T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ NÜKLEER TIP ANABİLİM DALI
KANSER TANISI ALMIŞ HASTALARDA KEMİK
METASTAZLARININ BELİRLENMESİNDE KEMİK
SİNTİGRAFİSİ İLE KEMİK SPESİFİK ALKALEN FOSFATAZ
VE TOTAL ALKALEN FOSFATAZ DÜZEYLERİNİN
KARŞILAŞTIRILMASI
Dr. SERDAR ALTINDAĞ TIPTA UZMANLIK TEZİ
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ NÜKLEER TIP ANABİLİM DALI
KANSER TANISI ALMIŞ HASTALARDA KEMİK
METASTAZLARININ BELİRLENMESİNDE KEMİK
SİNTİGRAFİSİ İLE KEMİK SPESİFİK ALKALEN FOSFATAZ
VE TOTAL ALKALEN FOSFATAZ DÜZEYLERİNİN
KARŞILAŞTIRILMASI
Dr. SERDAR ALTINDAĞ TIPTA UZMANLIK TEZİ
TEZ DANIŞMANI Yard. Doç. Dr. AYTEN GEZİCİ
ÖNSÖZ
Uzmanlık eğitimim ve tez hazırlanmam süresince tecrübeleri ve bilgilerinden yararlandığım tüm hocalarıma, asistanlık hayatım boyunca pek çok şeyi paylaştığımız tüm asistan arkadaşlarıma ve tüm Nükleer Tıp Anabilim Dalı çalışanlarına teşekkürlerimi sunarım.
Bugünlere gelmemde büyük emeği geçen annem ve babama ile her zaman yanımda olan eşim Pınar’a sabırlarından dolayı sonsuz saygı ve teşekkürlerimi sunarım.
…Ve son olarak da tez çalışmalarım sırasında dünyaya gelip hayatımıza renk katan ve neşe kaynağım biricik oğlum Ali Baran’a sevgilerle…
ÖZET:
Kanserli hastalarda kemik metastazlarının belirlenmesinde kemik sintigrafisi ile kemik spesifik alkalen fosfataz ve total alkalen fosfataz düzeylerinin karşılaştırılması
Giriş ve amaç: Hayatı tehdit eden bir sağlık sorunu olan kanserlerin takibinde metastazların erken tespiti önemlidir. Kanserlerin kemik metastazlarının belirlenmesinde kemik sintigrafisi önemli bilgiler veren ve öncelikle tercih edilen bir yöntemdir. Bu çalışmamızda kemik sintigrafisiyle iskelet sisteminde metastaz saptanan hastalarda, kemik spesifik alkalen fosfataz ve total alkalen fosfataz değerlerinin kemik sintigrafisi bulguları ile uyumunu göstermeyi amaçladık.
Materyal metod: Patolojik olarak kanser tanısı almış 92 hastaya rutin Tc-99m HDP ile kemik sintigrafisi çekildi. Hastaların kemik spesifik alkalen fosfataz ve total alkalen fosfataz değerleri çalışıldı.
Bulgular: Doksan iki hastanın 54’ünde kemik sintigrafisinde kemik metastazı tespit ettik, 92 hastanın 38’inde ise metastaz tespit etmedik. Sintigrafik olarak kemik metastazı saptadığımız hasta grubu ile kemik metastazı saptamadığımız hasta grubu arasında kemik spesifik alkalen fosfataz ve total alkalen fosfataz değerleri açısından anlamlı fark bulduk (p<0.001). Ancak kemik metastazı saptanan 54 hastanın 25’inde kemik spesifik alkalen fosfataz ve 54 hastanın 23’ünde de total alkalen fosfataz değerleri normal sınırlarda saptandı.
Sonuç: Biz çalışmamızda kanserli hastalarda kemik metastazlarının tespitinde total ALP ve kemik spesifik ALP değerlerinin özgüllüğünü yüksek olarak saptadık (%89.4 ve %92.1). Ancak kemik metastazlarının saptanmasında kemik spesifik alkalen fosfatazın kemik sintigrafisinin yerini alması beklenemez. Kemik sintigrafisi normal olan hastalarda bir sonraki görüntüleme zamanının tayininde kullanılabilir, ani yükselen kan değerleri sintigrafik çalışmanın erken programlanmasını sağlayabilir. ANAHTAR SÖZCÜKLER: Kemik sintigrafisi, kemik metabolizması, kemik metastazı, kemik alkalen fosfataz, kanser
ABSTRACT:
The comparison of bone scintigraphy to bone-specific alkaline phosphatase and total alkaline phosphatase levels determination of bone metastasis in patients with cancer
Aim: At the follow-up of a cancer which is a health problem with life-threatening, early detection of metastases is important. Bone scintigraphy in detecting bone metastases of cancers is providing important information and preferred method. In this study, in the patients with cancer we detected bone metastases with bone scintigraphy; we aimed to show the accordance of the bone specific alkaline phosphatase and total alkaline phosphatase values with bone scintigraphy findings. Material-Methods: Pathologically diagnosed 92 patients with cancer were taken routine bone scintigraphy with Tc-99m HDP. Patients were studied values of bone specific alkaline phosphatase and total alkaline phosphatase.
Findings: We have detected bone metastases 54 of ninety-two patients in bone scintigraphy, we did not detect metastases in 38 of 92 patients. We have found significant difference in values of bone specific alkaline phosphatase and total alkaline phosphatase between the group of patients detected bone metastasis and group of patients not detected bone metastases (p<0.001). However, in 25 of 54 patients detected bone metastases bone specific alkaline phosphatase and in 23 of 54 patients total alkaline phosphatase values were within normal limits.
Results: In our study, in determining of bone metastasis we found the specificity of total and bone specific ALP values were high in the patients with cancer (%89.4 and %92.1). However, in the detection of bone metastases bone specific alkaline phosphatase can not be expected to replace with bone scintigraphy. Bone scintigraphy in patients with normal findings is available viewing time for the next determination the sudden rise of blood values can provide an early programming of scintigraphic study.
KEYWORDS: Bone scintigraphy, bone metabolism, bone metastasis, bone specific alkaline phospatase, cancer
İÇİNDEKİLER Sayfa ÖNSÖZ……….…..i ÖZET………..………ii ABSTRACT………...……….………...iii TABLOLAR………...………v RESİMLER………...………...vi OLGU ÖRNEKLERİ………...………..vii 1. GİRİŞ ve AMAÇ ……….………...1 2. GENEL BİLGİLER………...3
2.1.İskelet sistemi embriyoloji, anatomi ve fizyolojisi…………..…...3
2.2.Kemik metastazlarının fizyopatolojisi………..……….3
2.3.Kemik metastazlarının sıklığı……….………...5
2.4.Kemik metastazlarında klinik bulgular…..………...…6
2.5.Kemik metastazlarında tanı yöntemleri.………7
2.5.1. Radyolojik görüntüleme yöntemleri.………...7
2.5.2. Sintigrafik görüntüleme yöntemleri..………10
2.5.3. Laboratuar bulguları………..………16
2.5.4. Biopsi………...………...………..20
2.6.Kemik metastazlarında tedavi………..………...20
3. GEREÇ VE YÖNTEM……….22
3.1.Hastalar………...22
3.2.Radyofarmasotik……….22
3.3.Kemik Sintigrafisi çalısması……….…..…22
3.4.Total ve Kemik Spesifik Alkalen Fosfataz ..……….….…23
3.5.İstatistiksel değerlendirme..…………...……….……...24
4.BULGULAR……….……25
5. TARTIŞMA VE SONUÇ………..………...32
TABLOLAR Sayfa No Tablo1. Primer tümör tanısına göre kemik metastazı insidans 6 Tablo 2. En sık kullanılan pozitron salıcısı radyonüklidler 14
Tablo 3. Kemik metabolik belirleyicileri 17
Tablo 4. Metastatik ve non-metastatik gruplarda kanserlerin dağılımı 23 Tablo 5. Metastatik ve non-metastatik gruplara ait tALP ve bALP değerleri 26
Tablo 6. Meme kanseri tanılı hastaların ortalama total alkalen fosfataz ve kemik spesifik alkalen fosfataz izoenzimi değerleri 27 Tablo 7. Akciğer kanseri tanılı hastaların ortalama total alkalen fosfataz ve kemik spesifik alkalen fosfataz izoenzimi değerleri 27 Tablo 8. Prostat kanseri tanılı hastaların ortalama total alkalen fosfataz ve kemik spesifik alkalen fosfataz izoenzimi değerleri 28
RESİMLER Sayfa No Resim 1. 51 yaşında Meme Ca tanılı hastanın direkt grafisinde
distal femurunda osteolitik kemik metastazı 8
Resim 2. 54 yaşında Prostat Ca tanılı hastanın lateral grafisinde
2.lumbal vertebrada sklerotik kemik metastazı 8 Resim 3. 44 yaşında Akciğer Ca tanılı hastanın aksiyal bilgisayarlı
tomografi görüntülerinde torakal vertebrada 2 odakta
osteolitik-sklerotik kemik metastazı 9
Resim 4. 43 yaşında Meme Ca tanılı hastanın aksiyal gadolinium-enhanced spin-echo T1 ağırlıklı kesitlerde 3.torakal vertebrada
yüzük şeklinde kemik metastazı 9
Resim 5. 66 yaşında akciğer Ca tanılı hastanın sagital spin echo T2 ağırlıklı magnetik resonans kesitlerinde 10.torakal ve 3.lumbal
vertebrada hipointens kemik metastazları 10
Resim 6. 60 yaşında Nazofarenks Ca tanılı hastanın kemik
sintigrafisinde tipik multipl kemik metastazları 12 Resim 7. İnflamatuar Meme Ca tanılı hastanın multipl kemik
metastazı izlenen PET/CT görüntüleri 15
Resim 8. Meme Ca tanılı hastanın 3.lumbal vertabrada BT saptanmayan(a), PET/CT(b) ve yağ baskılı T1 ağırlıklı axiyal
OLGU ÖRNEKLERİ Sayfa No Olgu 1. 62 yaşında Prostat Ca tanılı hastanın kemik sintigrafisinde
multipl kemik metastazı (tALP: 291, bALP: 79.5) 28 Olgu 2. 67 yaşında Prostat Ca tanılı hastanın kemik metastazı
izlenmeyen kemik sintigrafi görüntüsü (tALP: 118, bALP: 13.4) 29 Olgu 3. 61 yaşında Meme Ca tanılı hastanın kemik sintigrafisinde
multipl kemik metastazı (tALP: 77, bALP: 14.3) 29 Olgu 4. 35 yaşında Meme Ca tanılı hastanın kemik metastazı
izlenmeyen kemik sintigrafi görüntüsü (tALP: 56, bALP: 5.9) 30 Olgu 5. 49 yaşında Akciğer Ca tanılı hastanın kemik
sintigrafisinde multipl kemik metastazı (tALP: 132, bALP: 25.1) 30 Olgu 6. 61 yaşında Akciğer Ca tanılı hastanın kemik metastazı
izlenmeyen kemik sintigrafi görüntüsü (tALP: 61, bALP: 9.3) 31
Günümüzde kanser vakalarının ve kanserden ölüm oranlarının artmış olması nedeniyle erken tanı, tedavi ve takip hastanın prognozu açısından önem kazanmaktadır. Bunun yanı sıra tanısı konmuş ve takipli hastalarda rekürrensi ve/veya metastazlarının erkenden tespiti de önem taşımaktadır.
Kanserli hücreler çeşitli yollarla çevre dokulara, yakın-uzak organlara metastaz yapabilmekte ve iskelet metastaz yapması ayrı bir önem kazanmaktadır. Tümörlerin metastazlarını ve yaygınlığını saptamada çeşitli laboratuar ve görüntüleme yöntemleri kullanılmaktadır.
Metastatik kemik tümörleri, erişkinlerde görülen en sık kemik tümörüdür (1). Kemik sintigrafisi kemik metastazların saptanmasında major rol oynamaktadır. Tc-99m ile işaretlenmiş fosfatlı bileşikler ile yapılan tüm vücut kemik sintigrafisi metastatik kemik tutulumlarını saptamada çok sensitif bir metot olarak bilinen ve kemik metastazı yönünden yüksek insidansı olan kanserlerde (meme, prostat ve akciğer kanserleri) rutin olarak kullanılan bir yöntemdir (2-4). Bununla birlikte flare fenomeni nedeniyle tedaviye erken yanıtının değerlendirilememesi ve sensitivitesinin yüksek ancak spesifisitesinin düşük olması kemik sintigrafisinin kullanımında kısıtlamalar oluşturmaktadır (5). Kemik sintigrafisi yüksek sensitiviteye ve iyi bir spesifiteye sahip olup, % 70’lere varan pozitif belirleyici değere ve % 99.8 negatif belirleyici değerlere sahiptir (6). Ancak dozimetri ve maliyet-etkinlik asemptomatik hastaların takibinde, tekrarlanan kemik sintigrafilerinin kullanımını kısıtlayabilir (7,8).
Konvansiyonel radyolojinin sensitivitesi düşük olup genellikle kemik sintigrafisi ile kombine olarak kullanılmaktadır (9). Laboratuar testleri ise non-invazif, ucuz, kolay yapılabilir olup hasta tarafından rahat tolere edilirler.
Çeşitli kemik hastalıklarında kemik metabolizmasındaki yeni biyokimyasal parametrelerin klinik kullanımına ait giderek artan sayıda araştırmalar dikkati çekmektedir (10-13). Kemik remodeling faliyetlerinden doğrudan etkilenen kemik hücreleri ile dolaylı olarak etkilenen kemik matriksinden salınan metabolitler kemik metastazlarını değerlendirme araçları olarak önerilmektedir (14).
Alkalen fosfataz (ALP) birçok doku tarafından sentezlenmektedir. Karaciğer (LALP) ve kemik (bALP) orijinal alkalen fosfataz; serum alkalen fosfataz düzeyinin
aktiviteyi yansıtır ve serumda tayini kolaydır. Kemik metastazlarında artan osteoblastik aktivite sonucu serum total ALP (tALP) ve bALP izoenziminde artış beklenmektedir.
Çalışmamızda kemik sintigrafisinde kemik metastazı saptanan kanserli hastalarda; kemik spesifik ALP ve total ALP değerlerinin kemiğe metastazlarının belirlenmesindeki önemini ve sintigrafik bulgular ile uyumunu araştırmayı amaçladık.
2.1.İskelet Sistemi Embriyoloji, Anatomi ve Fizyolojisi
Destek dokusu (bağ dokuları, kıkırdak ve kemikler) ve kas dokusu (çizgili ve düz kaslar) türleri mezodermden farklılaşan mezenşim dokusu hücrelerinden gelişirler. İntrauterin hayatın 9-10. haftasında kıkırdak dokusundan yapılmış taslakların kemikleşmesi baslar. İskelet parçalarının kemikleşmesi olayı insanlar dünyaya geldikten sonra da devam eder, çok uzun sürer ve ancak 20-25 yaş arasında sona erer (15).
Vücudun çatısı birçok kemikle beraber bazı bölgelerdeki kıkırdaklardan yapılmıştır. Bu çatının kemik parçası iskeleti meydana getirir. İskelet sistemi aksiyel ve apendiküler kemiklerden oluşur. Kalvaryum, toraks, vertebralar ve pelvis aksiyel iskeleti, uzun kemikler ise apendiküler iskeleti oluşturur. Kemikler fonksiyonel olarak Trabeküler (spongioz) ve kortikal kemik iki ayrı histolojik yapı gösterirler. Trabeküler kemik aksiyel iskelette kortikal kemikler ise uzun kemiklerde bulunur.
Kemikte üç tip hücresel eleman vardır. Osteoblastlar yeni kemik oluşumunu sağlar ve kemik matriksinin (kollajen ve mukopolisakkaritler) sentezine aktif olarak katılır. Osteositler kemik yapımı ve yıkımında rol oynarlar. Osteoklastlar, kemik yıkımından sorumlu çok çekirdekli dev hücrelerdir. Organik matriksi eritebilen ve kalsiyum-fosfor salınımını sağlayan litik enzimler içerir. Devamlı bir yıkım ve yerine yeniden yapım faaliyeti içerisinde olan kemik, çok canlı ve aktif bir değişim içindedir. Söz konusu substitusyon sonucu kemik dokusu, özellikleri ve nitelikleri ile sürüp gider. Kemiğin kimyasal yapısı, organik ve inorganik olmak üzere iki kısımdan oluşur. İnorganik kısım (mineral yapı), hidroksiapatite çok benzeyen bir kalsiyum fosfat kompleksinden meydana gelir. Organik kısım şekilli elemanlar dışında kollajen, mukopolisakkarid ve glikoproteinlerden oluşur (16-18).
2.2.Kemik Metastazlarının Fizyopatolojisi
Metastaz habis tümörlerden ayrılan hücrelerin damarlar, vücut boşlukları ya da doku aralıkları ile uzaklara taşınmış olan ve buralarda primer odak ile fiziksel bağlantısı olmayan hücre topluluklarıdır (19).
Metastaz meydana gelebilmesi için aşağıdaki unsurlar gereklidir: 1-Tümör dokusu damarlanabilmeli.
3-Primer odaktan ayrılabilmek için tümör hücrelerinin adezyon yeteneği azalmış olmalı.
4-Tümörlerde invazyon yeteneği olmalı.
5-Tümör hücrelerinin kan veya lenf yoluyla embolus oluşturması ya da bir sıvı (beyin omurilik sıvısı) ile taşınabilmesi veya bir boşluğa düşmeleri (periton, plevra) ile yer değiştirebilmeleri.
6-Tümör hücrelerinin hümoral ve hücresel immün reaksiyon etkisinden kendilerini koruyabilmeleri.
7-Tümör hücreleri bulundukları damar içinde tutunabilmeli ve dokuya çıkabilmeli. 8-Bu yeni ortamda yaşayıp çoğalabilmeli.
Ayrıca primer tümörün çapı, diferansiyasyon derecesi, bulunduğu ortamın şartları ve organizmanın immün yeteneği metastaz oluşumunu etkileyebilecek diğer faktörlerdir (19).
Metastaz Yolları
1-Lenf yolu ile yayılma: Lenf yolu ile yayılma karsinomlarda daha sık görülür. 2-Kan yolu ile yayılma:
a)Ven yolu ile yayılma b)Arter yolu ile yayılma
Karsinomlar daha çok lenf yolu ile yayılır. Ancak tiroidin folliküler karsinomu ve böbrek karsinomu (hipernefrom) sıklıkla kan yolu ile yayılmaktadır.
Ayrıca çölemik yol ile yayılma sonucu seröz yüzeye çıkabilen tümör hücreleri oradan boşluğa dökülebilir ve Krukenberg tümöründe olduğu gibi, mide ya da bağırsak karsinomları overlerde implant metastazları oluşturabilir. Yine beyin-omurilik sıvısı yolu ile ependimomalarda olduğu gibi tümör hücreleri meninkslere ve spinal kanala taşınabilir. Böbrek pelvisi karsinomalarında olduğu gibi, epitelle döşeli yollarda (üreterler) implantasyon metastazları oluşabilir. Aspirasyon biopsilerinde, enjektörün dışarı çekilmesi esnasında transplantasyon metastazları meydana gelebilir (19).
Tümör hücreleri özellikle kanlanmanın yoğun olduğu akciğer, karaciğer ve kemik iliğine yayılır. Tümör hücreleri sinüzoid ve kemik iliği kavitesinden kurtulup endosteal kemik yüzeyine tutunup burada metastatik bir nidus oluşturmaktadır. Kemik metastazı sıklıkla önce medullada gelişir, kortikal hasar daha sonra olur (20-24).
Osteolitik kemik metastazlarında kemik hasarı, artmış osteoklast aktivitesine ve tümör hücrelerinin direkt etkisine bağlı olarak meydana gelmektedir. Osteoklast aktivite edici faktörler lokal ve sistemik faktörler olarak sınıflanabilir.
Osteoklast aktivite edici lokal faktörler:
1.Prostaglandin E1 ve E2; meme hücreleri tarafından üretilirler ve östrojenler-antiöstrojenler tarafından düzenlenirler.
2.Prokatepsin D; meme kanserli hücrelerden salgılanır ve lizozomal bir proteaz olan katepsin D’nin öncülüdür.
3.Vitamin D’ye benzeyen steroidler; meme kanseri olgularında kemik rezorbsiyonundan sorumlu tutulan faktörlerdir.
4.Tümör hücrelerinin ürettiği, bağışıklık sistemini aktive edici faktörler; bağışıklık sisteminin aktive olması ile osteoklastları stimüle edici tümör nekrozis faktör ve interlökin gibi sitokinlerin salgılanmasını sağlayarak indirekt olarak etki etmiş olurlar (23, 25-27).
Osteoklast aktivite edici sistemik faktörler:
1.Paratiroid hormonu ile ilişkili protein (PTH-rP); metastatik meme kanser hücrelerinden üretilirler ve osteoklastik kemik rezorbsiyonunu stimüle eder. Ayrıca böbrekte tübüler kalsiyum reabsorbsiyonunu stimüle ederek in vivo olarak hiperkalsemiye neden olur.
2.Transformin Growth Factör alpha (TGF-α); mitojenik bir polipeptid olup osteoklast formasyonunu ve osteoklastik kemik rezorbsiyonunu stimüle eder.
3. Transformin Growth Factör beta (TGF-β); osteoklastik kemik rezorbsiyonu olmakla birlikte inhibitör olarak da etki eder (23, 27, 28).
Tümör hücreleri ilik kavitesine yayıldıklarında genellikle osteoblastik aktiviteyi harekete geçirirler. Osteoblastik kemik metastazına en sık prostat kanserinde rastlanır. Diğer karsinomlarda da görülür. Prostat kanser hücreleri osteoblast stimülatör faktörler üreterek yeni kemik formasyonunu stimüle eder (23, 27, 28).
2.3.Kemik Metastazlarının Sıklığı
Metastatik kemik tümörleri, iskelet sisteminin en sık görülen neoplastik lezyonları olup, ileri evre kanserli olguların %65’inde kemik metastazı bulunmaktadır (29).
Uzak metastaz açısından akciğer ve karaciğerden sonra üçüncü sıklıkta kemik metastazları görülür. Kemik metastazları %80 aksiyel iskelet, %10 kalvaryum, %10 uzun kemiklerde görülür. Tümörlerin metastaz yaptığı kemikler sırasıyla; vertebra %45, pelvis+sakrum %20, femur ve kosta %15, kafatası ve humerus %9, skapula ve sternum %5, klavikula %4, tibia %2’dir (30-33) .
Tüm kemik metastazları değerlendirildiğinde; %80’den fazlasının meme, prostat, akciğer, böbrek ve tiroid kanserlerinden meydana geldiği görülmektedir. Tablo-1’de kemiğe metastaz yapma sıklıklarına göre primer tümörler gösterilmektedir (30, 33, 34).
Tablo1. Primer tümör tanısına göre kemik metastazı insidansı
Primer tümör bölgesi Kemik metastazı görülme sıklığı
Prostat 30% Meme 22% Böbrek 16% Tiroid 12% Akciğer 10% Testis 10% Malign Melanom 7% Nazofarenks 7% Mesane 5% Rektum 5% Serviks 4% Primeri bilinmeyen 30%
2.4.Kemik Metastazlarında Klinik Bulgular
İskelet metastazlarının en önemli belirtisi lokalize ağrıdır. Ağrının özelliği başlangıçta; hareketle ilişkisi olmayan, gelip geçici olmakla birlikte bazen süreğen, düzelmeyen ve gittikçe kötüleşen vasıftadır. Metastatik kemik tümörleri ile primer kemik tümörlerindeki ağrı paterni çoğunlukla birbirine benzer. Kemik metastazlarındaki ağrı, biyolojik ve mekanik olmak üzere iki nedene bağlı olabilir. Biyolojik ağrı oluşmasında; tümör hücreleri tarafından salınan lokal sitokinler ve substans-P, prostaglandin, bradikinin gibi kimyasal mediatörler ile tümör hücrelerinin normal kemik dokusu ile yer değiştirerek periostta gerilmeye neden olması rol oynar. Mekanik ağrı ise metastaz nedeniyle kemiğin normal yapısının bozulması sonucu
fiziksel egzersize bağlı olarak ortaya çıkan ağrıdır. Ancak bazı metastatik kemik lezyonlarında ağrı görülmeyebilir. Ağrıya ilaveten bazı klinik bulgular ortaya çıkabilir ki bunlar tutulum bölgesiyle ilgilidir (21, 23, 30, 35, 36).
Bunun dışında kemik metastazlarında hareket kısıtlılığı, patolojik kırıklar (sıklıkla femurda), parapleji, malign hiperkalsemi, kemik iliği yetmezliği ve depresyon gibi ciddi morbiditeye neden olabilecek komplikasyonlar gelişebilir (35, 37, 38).
2.5.Kemik Metastazlarında Tanı Yöntemleri
Tanı yöntemleri arasında; radyolojik görüntüleme yöntemleri ( konvansiyonel radyografi, bilgisayarlı tomografi, magnetik rezonans görüntüleme), sintigrafik görüntüleme yöntemleri (kemik sintigrafisi, pozitron emisyon tomografisi), laboratuar bulguları ve biyopsi yer alır.
2.5.1. Radyolojik görüntüleme yöntemleri
Kemik lezyonları radyolojik olarak osteolitik, osteosklerotik ve miks tip olmak üzere üç şekilde sınıflandırılır.
Osteolitik lezyonlar osteolizis sonucundaki kemik destrüksiyonunu yansıtırlar. Bu tip lezyonlara sıklıkla tiroid, böbrek, mesane, malign melanoma ve gastrointestinal sistem tümörlerinin kemik metastazlarında ve multipl myelomada rastlanmaktadır. Radyolojik olarak vertebralarda köşelenme, şekil bozukluğu ve kollaps seklinde bulgu verirler (39).
Osteosklerotik lezyonlarda kemik yapımı artışı vardır. En sık prostat kanserinde bu tip lezyonlar görülür. Bunun dışında mide, Nazofarenks, kolon (müsinöz karsinom), karsinoid tümörler ve medülloblastom’da da osteosklerotik kemik metastazları görülebilir (39).
Mikst tip lezyonlarda hem kemik yıkımı hem de kemik yapımı söz konusudur. Meme, akciğer, serviks, over ve testis tümörlerinde miks tip kemik metastazları görülür (39).
Diğer görüntüleme yöntemlerine göre kemik metastazlarını saptamada hassasiyeti daha düşük olmakla birlikte özellikle kemik korteksini değerlendirmeye çok uygun olup metastazlara bağlı patolojik fraktürleri değerlendirilebilir (39).
Resim 1.51 yaşında Meme Ca tanılı hastanın direkt grafisinde distal femurunda osteolitik kemik metastazı
Resim 2.54 yaşında Prostat Ca tanılı hastanın lateral grafisinde 2.lumbal vertebrada sklerotik kemik metastazı
b) Bilgisayarlı Tomografi:
Kemik sintigrafisinde pozitif olarak tanımlanan bir lezyon konvansiyonel radyografide görülmemişse ve klinik olarak metastaz düşünülüyorsa tanı için bilgisayarlı tomografi (BT) yapılması gerekir. BT’de kortikal kemik destrüksiyonu, kemik iliğine metastaz uzanımı, yumuşak doku invazyonu ve komşu nörovasküler yapıların tutuluşu konvansiyonel radyografiye göre daha iyi değerlendirilir. Ayrıca sakrum, vertebra, kraniovertebral bileşke gibi radyografide değerlendirilmesi zor
alanlarda da BT tercih edilebilir. BT’de osteoblastik metastazlar hiperdens, osteolitik metastazlar ise hipodens olarak görülür (28,40-42).
Resim 3. 44 yaşında Akciğer Ca tanılı hastanın aksiyal bilgisayarlı tomografi görüntülerinde torakal vertebrada 2 odakta osteolitik-sklerotik kemik metastazı
c) Magnetik Rezonans Görüntüleme (MRG):
Kemik sintigrafisinde pozitif olarak tanımlanan bir lezyonun değerlendirilmesinde konvansiyonel radyografi ve BT ile sonuç alınamamışsa MRG yapılır. MRG multiplanar (çok yönlü) görüntü imkanı vermesi ve yüksek rezolüsyonu nedeniyle lezyonların değerlendirilmesinde direk grafi ve BT’ye göre daha üstündür. Kortikal invazyonun saptanmasında BT daha iyi bir yöntem iken kemik iliği tutulumunu göstermede MRG daha üstündür. Yumuşak dokuyu daha iyi göstermesinden dolayı spinal kord basısı gibi bazı klinik bulgularda MRG tercih edilmelidir. MRG’de metastatik kemik lezyonları genellikle baskılanmış T1 imajlarda hipointens, T2 imajlarda hiperintes olarak görülür (23, 39-41, 43, 44).
Resim 4. 43 yaşında Meme Ca tanılı hastanın aksiyal gadolinium-enhanced spin-echo T1 ağırlıklı kesitlerde 3.torakal vertebrada yüzük şeklinde kemik metastazı
2.5.2. Sintigrafik görüntüleme yöntemleri a) Kemik sintigrafisi:
Kemik sintigrafisi radyoaktif izotopların kemiğe olan affinitesinin gösterilmesinden bu yana kullanılan, planar ve/veya tomografik görüntüleme yapılabilen çok sensitif bir yöntemdir. Aynı anda tüm vücut kemiklerinin metastaz yönünden non-invaziv bir şekilde taranmasına olanak sağlayan yegane görüntüleme yöntemidir. Radyofarmasötik olarak sıklıkla Teknesyum 99m ile bağlanmış fosfat bileşikleri (Tc99mMDP, Tc99mHMDP gibi) kullanılır. Bu radyofarmasötikler kemorezorpsiyon yoluyla kemikteki osteoblastlarca üretilen kalsiyum hidroksiapatit kristallerinin yapısındaki fosfor grupları tarafından tutulurlar. Kemiklerdeki artmış aktivite tutulumu öncelikle artmış osteoblastik aktiviteye ve artmış kan akımına veya ikisine birlikte bağlıdır (39, 42, 45).
Kemik sintigrafisi endikasyonları: 1) İskelet sistemi metastazlarının araştırılması 2) Primer kemik tümörlerinin evreleme ve takibi
3) Nedeni açıklanamayan kemik ağrılarının değerlendirilmesi
4) Stres fraktürleri de dahil olmak üzere, şüpheli fraktürlerin araştırılması 5) Kemik ve yumuşak doku enfeksiyonlarının değerlendirilmesi
6) Ortopedik protezlerde gevşeme ya da enfeksiyonun araştırılması 7) Kemik greftlerinin viabilitesinin değerlendirilmesi
8) Heterotopik ossifikasyonun cerrahi öncesi matürasyonunun araştırılması 9) Avasküler Nekrozun (AVN) tanısı ve metabolik aktivitesinin araştırılması 10) Metabolik kemik hastalıkları
11) Refleks Sempatik Distrofi’nin araştırılması 12) Fibröz Displazi’nin araştırılması
13) Paget hastalığının tanısı ve aktivasyonunun değerlendirilmesi
14)Direkt grafilerde saptanan anormal, nonspesifik kemik patolojilerinin değerlendirilmesi
15) Osteoid osteomanın araştırılması 16) Çocuk istismarı kuşkusu
Kemik metastazları trabeküler kemikteki lezyon 1.5 cm’e ulaşıncaya ve kemik minerallerinin %40-50’si kaybedilenceye kadar radyolojik olarak görüntülenemezler. Bundan dolayı sintigrafinin radyografiye diğer bir üstünlüğü de metabolik değişikleri anatomik değişiklikler başlamadan önce görüntüleyebilmesidir (46,47).
Kemik sintigrafisi kemikteki anormal lokalizasyonları göstermede son derece duyarlıdır, ancak spesifisitesi düşüktür. Kemik sintigrafisinde aktivite artışına yol açan benign lezyonlar; kıkırdak dokunun benign tümörleri, osteoid osteoma, paget hastalığı, fibröz displazi, fraktür, travma, osteoartrit, osteomyelit, yumuşak doku enflamasyonu ve daha önce geçirilmiş cerrahi müdahaledir. Artmış aktivite tutulumu gösterebilecek normal kemik alanları; kafa tabanı, kalsifiye tiroid kıkırdağı, kostokondral eklemler, paranazal sinüsler, sternum, skapula alt uçları ve sakroiliak eklemlerdir. Buna karşılık daha önce radyoterapi görmüş kemiklerde, çok indiferansiye hücreli tümörlerde veya çok çabuk büyüdüğü için osteoblastik reaksiyon vermeyen kemik metastazlarında yalancı negatif sonuçlar alınabilir. Olgularda kemik sintigrafisindeki yanlış pozitif/negatif sonuçları azaltmak için detaylı bir anamnez alınması, laboratuar ve diğer görüntüleme yöntemleriyle birlikte değerlendirilmesi gerekir (46, 47).
Sintigrafi tedaviye yanıtın değerlendirilmesi amacıyla kullanılırken tedavi sonrası ilk 6 ay içinde kemiklerdeki iyileşmeye bağlı olarak görülen osteoblastik aktivite artışına dikkat edilmesi gerekir. Bu dönemde sintigrafide lezyonların aktivite tutulumunda artış izlenir ve bu duruma alevlenme fenomeni (flare phenomen) denir (24, 28, 48, 49).
1- Lezyon bölgesindeki osteoblastik reaksiyona sekonder olarak fokal artmış aktivite tutulumu seklinde görülürler.
2- İleri derecede yaygın kemik metastazlarında superscan adı verilen, aksiyel iskelette düzenli olarak artmış aktivite tutulumu, zemin aktivitesinin çok düşük izlenmesi ve böbreklerin vizüalize olmaması ile karakterize bir tablo görülebilir. Bu duruma en sık prostat ve meme kanserleri metastazları ile hiperparatiroidizm gibi metabolik hastalıklarda rastlarız.
3- Metastazlar %3 oranında normal görünüm verebilir. Böyle durumlarda sintigrafi yalancı negatif sonuç verebilir.
4- Nadir olarak metastazlar %2 oranında fotopenik (soğuk alan) lezyonlar seklinde görülür. Bu durum; lezyon olan bölgedeki kan akımının azalması veya durması, kemik iliğinin tümör hücreleri tarafından invazyonu, reaktif osteoblastik cevabın çok az olması ve yaygın osteolizis sonucu meydana gelebilir (20, 24, 47-49).
Sintigrafideki radyasyon dozu X-ışınlı çalışmalardan daha düşüktür. Protezler, radyografik kontrast maddeler ve diğer atenüasyon kaynağı objeler normal yapıların görülmesini engelleyebilir. Ayrıca idrar bulaşması, enjeksiyon hataları, hasta hareketi, incelemeden hemen önce başka bir radyonüklid kullanılması ve enjeksiyondan sonra normal süreden daha erken görüntüleme yapılması da artefaktlara yol açabilir (50). Resim 6. 60 yaşında Nazofarenks Ca tanılı hastanın kemik sintigrafisinde tipik multipl kemik metastazları
PET, dokuların perfüzyonunu, metabolik aktivitesini ve canlılığını (viabilite) yansıtan tomografik görüntüler ve kantitatif parametrelerin kullanıldığı non-invaziv bir görüntüleme yöntemidir.
Onkolojide PET’in kullanım alanları şunlardır:
1. Primeri bilinmeyen kanserlerde primer tümör ve metastazlarının araştırılması, 2. Radyasyon nekrozu ile rezidü ve/veya nüks tümöral kitlenin ayrılması,
3. Cerrahi sonrası nükslerin belirlenmesi,
4. Hasta hakkında prognostik değerlendirmeler yapılması, 5. Tümörün progresyon/regresyonunun değerlendirilmesi, 6. Tedavi öncesi evreleme,
7. Tümörün tedaviye (kemoterapi, radyoterapi) yanıtının değerlendirilmesi, tedavi sonrası yeniden evreleme,
8. Akciğer nodüllerinin benign/malign ayırıcı tanısı, 9. Uygun biyopsi alanının belirlenmesi,
10. Radyoterapi uygulanacak alanın belirlenmesi.
PET diğer nükleer tıp yöntemlerinde olduğu gibi emisyon tekniğine dayalı bir görüntüleme yöntemi olup yapısal detaylardan ziyade fonksiyonel-metabolik aktivite hakkında bilgi verir. Bu yöntemde, insan vücuduna verilen pozitron yayıcı radyofarmösotiklerden yayılan özel gama ısınları saptanarak vücut içerisindeki dağılımları belirlenir ve üç farklı uzaysal düzlemde görüntüleme elde edilir. Vücut içerisinde radyofarmasötiklerden pozitron bozunması sonucu yayılan ve birbirine 180 derece zıt açı ile hareket eden 511 keV enerjili gama ısınları oluşur. Bu foton çiftleri PET tarama sistemlerindeki detektör halkaları içerisine yerleştirilmiş algılayıcı kristaller tarafından tespit edilir ve her bir foton çifti için sistem bilgisayarında x, y, z eksen koordinatları belirlenerek kaydedilir.
Günümüzdeki PET tarayıcılarında ise PET dedektörünün hemen önüne BT veya dedektörü yerleştirilerek entegre PET/BT veya PET/MR sistemleri (Hibrid Sistemler) elde edilmiştir. Hibrid sistemlerde aynı pozisyonda PET ve MR veya BT’den elde edilen hem yapısal hem de fonksiyonel görüntülerin üst üste getirilerek füzyon görüntülerin oluşturulmasıyla lezyon yerinin belirlenmesi kolaylaşmıştır (51,52). PET görüntülemede en sık kullanılan radyonüklidlerin fizik yarı ömürleri ve elde
Tablo 2. En sık kullanılan pozitron salıcısı radyonüklidler. Radyonüklid Fizik Yarı ömrü(dk) Üretim Yöntemi
Oksijen-15 2,07 Siklotron Azot-13 9,96 Siklotron Karbon-11 20,4 Siklotron Galyum-68 68.3 Jeneratör Flor-18 109.7 Siklotron Rubidyum-82 1,25 Jeneratör
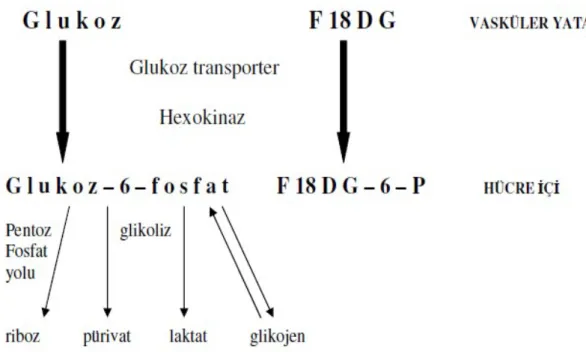
Rutin PET uygulamalarında, nispeten diğerlerine göre daha uzun yarılanma ömrüne sahip olduğu için nakledilmesi mümkün olan Flor-18 (18F)’li bileşikler kullanılmaktadır. F-18 ile işaretli fluoro -2-deoxy-D-glucose (FDG) onkolojik PET görüntülemesinde en çok kullanılan ajandır.
Şekil FDG’nin glikoza benzer şekilde hücre içine alınması
FDG tutulumu plazma glikoz düzeyinden etkilenmekte olup yüksek kan glikoz düzeylerinde tümör dokusundaki FDG tutulumu azalma göstermektedir. İnsülin FDG’nin kas hücrelerinde birikimini arttırarak tümör hücrelerindeki FDG birikimini azaltır. FDG ile yapılan onkolojik çalışmalarda 10-20 mCi FDG’nin i.v. enjeksiyonundan yaklaşık 60 dakika sonra PET görüntüleme yapılır. Genel olarak tüm vücut görüntüleme kafa tabanından femur proksimaline kadar olan aralıktan
yapılır ve yeni geliştirilmiş hibrid sistemlerde ortalama 20-30 dakika kadar sürmektedir (53-55).
PET’in en önemli özelliklerinden birisi de tutulum alanlarındaki aktivitenin sayısallaştırılabilmesidir. Maksimum standardize edilmiş uptake değeri (maxSUV) adı verilen semi kantitatif bir değer elde edilir. Bu değeri; plazma glikoz düzeyi, enjeksiyondan sonra geçen süre, vücut ağırlığı veya vücut yüzey ölçümü, belirlenen alanın büyüklüğü, tarayıcı sistemin rezolüsyonu, rekonstrüksiyon ve atenüasyon düzeltmenin tipi gibi faktörler etkiler. Eğer FDG tüm vücutta aynı konsantrasyonu gösterir ise SUV değeri olarak “1” elde edilecektir. Kan havuzundan daha yüksek uptake oranına sahip lezyonlar genellikle maligniteyi düşündürmektedir.
PET sistemleri rezolüsyon ve uzaysal çözünürlük bakımından gama kamera ve SPECT sistemlerine göre daha üstün olup daha doğru ve daha iyi görüntüleme imkanı sağlarlar (56).
FDG-PET Osteolitik kemik metastazlarının tespitinde kemik sintigrafisine göre daha spesifik ve sensitiftir. FDG-PET ile osteoblastik metastazların görüntüleme oranı 56%, kemik sintigrafisi ile 100%’dür.
Resim 7. İnflamatuar Meme Ca tanılı hastanın multipl kemik metastazı izlenen PET/CT görüntüleri
Resim 8. Meme Ca tanılı hastanın 3.lumbal vertebrada BT saptanmayan(a), PET/CT(b) ve yağ baskılı T1 ağırlıklı aksiyal MR(c) görüntülerinde saptanan kemik metastazı
2.5.3. Laboratuar bulguları:
İleri evre kanserli hastalarda, yaşam kalitesini önemli ölçüde etkileyen iskelet sistemi komplikasyonları ile seyreden kemik metastazları ortaya çıkar.
Kemik metastazlarının saptanmasında, biyokimyasal kemik metabolik belirleyicileri, güvenilebilir, non-invaziv ve göreceli ucuz olarak değerlendirilmektedir.
Kemik metabolik belirleyicileri; yapım belirleyicileri ve yıkım belirleyicileri olarak iki gruba ayrılmaktadır ve tablo 3’de sunulmuştur.
Kemik yapımı belirleyicileri; kemik yapımının arttığı kemik metastazlarında serumda yükselirler. Kemik yapımına ait tüm belirteçler serum veya plazmada ölçülürler.
Biyokimyasal belirleyicilerin dolaşımdaki düzeylerinin kemik döngüsünden başka biyolojik değişkenliklerden etkilenmesi ve teknik kısıtlanmalar en önemli dezavantajlarıdır. Bunlar 2 gruba ayrılır:
1- Kontrol edilemeyen faktörler: Yaş ve renal fonksiyon, cinsiyet, menopozal durum, etnik özellikler, yeni geçirilmiş kemik kırığı veya hastalığı, gebelik ve emzirme, ilaçlar (hormon tedavileri, bifosfonatlar, kortikosteroid, antikonvülzanlar, GnRH), karaciğer ve böbrek hastalıklarıdır.
2- Kontrol edilebilen faktörler: Sirkadien ritim, menstrüel siklus, mevsimsel değişiklik, egzersize bağlı etkiler, diyet ve referans aralıklardır.
Tablo 3: Kemik metabolik belirleyicileri A- KEMİK YAPIMI BELİRLEYİCİLERİ Serumda
- Total alkalen fosfataz (tALP)
- Kemiğe spesifik alkalen fosfataz (bALP) - Osteokalsin (Kemik gla proteini=BGP) - Prokollajen tip 1 propeptidleri (PICP, PINP) - Diğer kollajen olmayan kemik proteinleri B-KEMİK YIKIMI BELİRLEYİCİLERİ Kollajen yapıda olanlar
Serumda
- Serbest pridinolin ve deoksipridinolin (PYD, DPD) - Tip 1 kollajen karboksi- terminal telopeptid (ICTP)
- Tip 1 kollajen N ve C-telopeptid yıkım ürünleri (NTX-1, CTX-1) İdrarda
- Pridinolin ve deoksipridinolin (PYD, DPD)
- Tip 1 kollajen N ve C-telopeptid yıkım ürünleri (NTX-1, CTX-1) - Kalsiyum ve Hidroksiprolin ( Ca++, HYP)
- Hidroksilizin glikozidleri Kollajen yapıda olmayanlar Serumda
- Kemik siyaloprotein (BSP) İdrarda
- Osteokalsin yıkım ürünleri Osteoklast enzimleri Serumda
- Tartarat rezistan asit fosfataz (TRAP) - Katepsinler (Katepsin K, Katepsin L) 2.5.3.1.Kemik yapım belirleyicileri:
a)Total alkalen fosfataz ve Kemik spesifik alkalen fosfataz
Total alkalen fosfataz (tALP) metastatik kemik hastalığının tespitinde sıklıkla kullanılan geleneksel bir belirleyicidir fakat spesifik değildir. Hem kemik hem de karaciğer metastazlarında yükselebilir. Total alkalen fosfatazın karaciğer, kemik, ince barsak, böbrek ve plasentadan salınan izoformları vardır. Total alkalen fosfatazın yarısını kemik izoformu diğer yarısını da karaciğer izoformu oluşturmaktadır (57).
Kemik spesifik alkalen fosfataz (bALP), membrana bağlı bir osteoblast enzimidir ve osteoblastların spesifik ürünüdür.
Kemik spesifik alkalen fosfataz, osteoblast plazma zarında lokalize bir glikoproteindir. Normal bireylerde dolaşımdaki tALP’ın yaklaşık %50’sini kemik spesifik alkalen fosfataz oluşturmaktadır. Kemik spesifik alkalen fosfataz ölçümü kemik yapım ve yıkımını total alkalen fosfataz ölçümünden daha duyarlı olarak yansıtmaktadır (58).
Biyokimya laboratuarlarında serum kemik spesifik alkalen fosfataz düzeyleri radyoimmunoassay tekniği ile ölçülmektedir. Sağlıklı bireylerde normal değerler 3.7 µg/L ile 20.9 µg/L arasında ölçülür.
Serum kemik spesifik alkalen fosfataz, kemik formasyonunun dinamik parametreleriyle belirgin bir korelasyon göstermektedir (59).
b)Osteokalsin
Kemik g1a-proteini olarak da bilinir. Kemikteki kollajen olmayan matriks proteinlerinin çoğunu oluşturur (57). Osteokalsin osteoblastlarda üretilir ve kemik ekstrasellüler matriksine yerleşir. Osteokalsinin bir kısmı dolaşıma karışır ve radyoimmunoassay yöntemi ile ölçülebilir.
c)Prokollajen 1 ekstansiyon peptidleri (PICP, PINP)
Tip 1 kollajenin ekstrasellüler işlenmesi sırasında, kemik matriksinde fibril oluşumundan önce aminoterminal ve karboksiterminal propeptidleri ayrılır (57). Bu peptidler prokollajen 1 aminoterminal propeptid (PINP), prokollajen 1 karboksi terminal propeptid (PICP) olarak adlandırılırlar ve dolaşıma katılırlar (57). Kemik yapım belirleyicileri olarak ölçülebilirler.
2.5.3.2.Kemik yıkım belirleyicileri a)Kollajen pridinyum çapraz bağları
Kollajen yıkımının en spesifik ve en duyarlı göstergesi olan Pridinolin ve Deoksipridinolin matür kollajen yıkımı ile açığa çıkmakta ve yeni sentezlenen kollajenden kaynaklanmamakta ve başka ürünlere metabolize olmamaktadır. Hem idrarda hem de serumda yüksek basınçlı sıvı kromatografisi (HPLC) ile ölçülürler.
24 saatlik idrardaki kalsiyum atılımı ve sabah ilk idrardaki kalsiyum/kreatinin oranı kemik rezorpsiyonunun en önemli biyokimyasal belirleyicilerindendir. Sensitivitesi ve spesifisitesi düşüktür.
İnsanda kollajenin yarıya yakını kemikte bulunduğu için, idrarda artmış hidroksiprolin ekskresyonu dolaylı olarak artmış kemik yıkımını gösterir.
d)Tip 1 Kollajen Çapraz Bağlı Telopeptid
Tip 1 kollajen karboksi terminal çapraz bağlı telopeptid (ICTP), tip 1 kollajende yani büyük miktarı kemikte yer alır.
e) C-Terminal telopeptid (CTX)
Kemiğin osteoklastik bozulması sürecinde, Tip I kollajenin C telopeptidinden dağılan bir çeşit ürün dolaşıma salınır ve idrarla atılır. Bu dağılan ürünün bir fraksiyonu CrossLaps ELlSA ile ölçülür.
f) N-Terminal Telopeptid (NTX-1)
Tip 1 kollajenin çapraz bağlı N-telopeptidi (NTX-1), osteoklastlarca kemik kollajenin proteolitik yıkımı esnasında ortaya çıkar. NTX-1, Paget hastalığı, osteoporoz ve primer hiperparatiroidi gibi metabolik hastalıklarda ve kemik metastazlı prostat kanseri ve meme kanserinde de yükselmektedir.
g) Kemik Siyaloprotein (BSP)
Kemik ekstrasellüler matriksinin kollajen olmayan bir proteinidir. Osteoblastlar tarafından üretilir ve kemik yıkımı boyunca salınır. Kemik döngüsünün hızlandığı osteoporoz, hiperparatiroidizm, Paget hastalığı ve multipl myelomada artar. Ayrıca kemik metastazı olan meme, prostat ve tiroid kanserlerinde de arttığı gösterilmiştir (57).
h) İdrar hidroksilizin glikozidler
Hidroksiprolin gibi, hidroksilizinin de idrarla atılmasında artış olması kollajen ve kemik yıkımının potansiyel bir belirleyicisidir.
i)Plazma tartarat-rezistans asid fosfataz
Osteoklastik aktivite esnasında salınır ve kemik rezorpsiyon belirleyicisi olarak kullanılır (57). Asit fosfataz aktivitesi; kemik, prostat, dalak, eritrosit ve trombosit gibi birçok dokuda ve hücrede bulunur. Kemik izoenzimi sadece osteoklastlar tarafından üretilir. Bu bakımdan, kemik yıkımının iyi bir göstergesidir.
Paget hastalığı, osteomalazi, kemik metastazları, hipertroidizm gibi durumlarda kemik asid fosfataz düzeyi belirgin artar.
j) Katepsinler
Katepsin K bir sistein proteazdır ve osteoklastlardan salınır. Kemik yıkımında artmaktadır.
k) Matriks metalloproteinazları
Matriks metalloproteinazları (MMPs) osteoklast fonksiyonları için elzemdir. Kemik yıkım belirleyicisi olarak nitelendirilirler. Hem tümör hücrelerinden salınır ve hem de tümör invazyonu ve metastazına katkıda bulunurlar. Tümör aktivitesinin ölçümünde de yararlı olabilir. Meme kanserinin kemik metastazında ICTP ve TRACP-5b ile birlikte MMPs’ının başlıca belirleyici olduğu saptanmıştır.
2.5.4. Biyopsi:
Kemik metastazlarının kesin tanısı histopatolojik inceleme ile mümkündür. Kemik biyopsisi açık biyopsi veya çeşitli iğne aspirasyon yöntemleriyle yapılabilir. Özellikle primeri bilinmeyen soliter ya da multipl kemik metastazlarında ince iğne aspirasyon biyopsisi veya açık biyopsi ile kesin tanı ve tedavi yöntemleri belirlenmektedir.
2.6.Kemik Metastazlarında Tedavi
Kemik metastazlarında tedavi multidisipliner bir yaklaşım olup olgular, medikal onkolog, radyasyon onkologu, ortopedist, nükleer tıp uzmanı, radyolog ve patolog tarafından değerlendirilir. Genel olarak tedavinin amacı; semptomların ve komplikasyonların ortadan kaldırılması, organ fonksiyonunun düzeltilmesi ve korunması, iskelet stabilizasyonu ve lokal kontrolün sağlanmasıdır.
Kemik metastazlarında uygulanacak tedaviler sistemik ve lokal olmak üzere ikiye ayrılır.
1-Lokal tedaviler: Eksternal radyoterapi, cerrahi tedavi
2-Sistemik Tedaviler: Kemoterapi, hormonoterapi, immünoterapi, bifosfonatlar, analjezikler, radyoaktif izotoplar (35,39).
Nükleer tıp uzmanları tarafından uygulanan radyoaktif izotoplar ile tedavi yönteminde tümör hücrelerinin orta ve yüksek enerjili beta partikül radyasyonu etkisi kullanılarak tahrip edilmesi söz konusudur. Ağrı tedavisi için en çok kullanılan radyofarmasötikler sodyum fosfat (P 32), samaryum (Sm 153), stronsiyum klorid
(Sr 89) ve rhenium (Re 186)’dır. Bunlar daha çok osteoblastik kemik metastazlarında etkilidirler (60, 61).
3.GEREÇ VE YÖNTEM 3.1.Hastalar:
Bu çalışma için Dicle Üniversitesi Tıp Fakültesi Etik Kurulundan 18.03.2011/46 tarih ve sayı ile etik kurul onayı alındı. Çalışmaya, Dicle Üniversitesi Tıp Fakültesi Medikal Onkoloji ve Üroloji servisine başvurup Nükleer Tıp bölümümüze yönlendirilen patolojik olarak kesin tanısı konulan yeni tanılı veya takipli 43’ü erkek 49’u kadın toplam 92 kanser olgusu dahil edildi. 92 kanser olgusu kemik sintigrafisi bulgularına göre metastatik ve non-metastatik olmak üzere iki gruba ayrıldı. 92 kanser olgusu içerisinden hasta sayıları dikkate alınarak patolojik tanılara göre Meme kanseri, Akciğer kanseri ve Prostat kanseri tanılı hastalar kendi içinde kemik sintigrafisi bulgularına göre non-metastatik ve metastatik iki alt grup olmak üzere altı gruba ayrıldı.
Hastalara kemik metastazı taraması için rutin kemik sintigrafisi uygulandı. Kemik spesifik ALP ölçümü için hastalardan 3 ml kan alındı.
Çalışmaya dahil edilen tüm hastalarımıza çekilen kemik sintigrafisi ve kemik spesifik ALP laboratuar tetkikleri için hastalardan bireysel onamları alındı.
3.2.Radyofarmasötik:
Teknesyum-99m (Monrol, Türkiye) ile işaretli Hidroksimetilen difosfonat (Mallinckrodt TechneScan HDP, USA ) (Tc99m-HDP) kemik sintigrafisi ajanı olarak kullanıldı.
3.3.Kemik Sintigrafisi Çalışması:
Çalışmaya dahil edilen 92 hastaya rutin protokole uyarak Tc99m-HDP ile kemik sintigrafisi uyguladık. Sintigrafik görüntülemeler için Nükleer Tıp Anabilim Dalımızda bulunan tek dedektörlü (General Electric, Millenium Sequare, USA) gama kamera ile düşük enerjili genel amaçlı (LEGP) kolimatör kullandık.
Hastalara 18-20 mCi (erişkin doz) Tc99m-HDP intravenöz yolla enjekte edilken 3 saat sonra anterior-posterior pozisyonda 5.3 cm/dk hızda ilerleyecek şekilde tüm vücut ve lezyon bölgelerinden statik imajları aldık. Gerekli gördüğümüz durumlarda hastalarımızdan ek görüntüler aldık.
Sintigrafiler tez/proje yöneticisi nükleer tıp uzmanı tarafından farklı zamanlarda iki kez değerlendirildi.
Sintigrafi sonuçlarına göre hastalar iki gruba ayırdık:
Grup I: Sintigrafik olarak kemik metastazı tespit edilmeyen hastalar (non-metastatik grup)
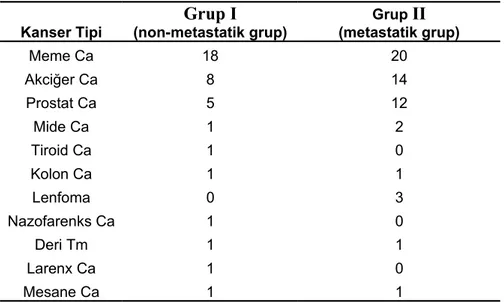
Grup II: Sintigrafik olarak kemik metastazı saptanan hastalar (metastatik grup) Grup I ve grup II’deki hastalara ait patolojik tanılı kanserlerin dağılımı tablo 4’te verilmiştir.
Tablo 4. Metastatik ve non-metastatik gruplarda kanserlerin dağılımı
Kanser Tipi (non-metastatik grup)Grup I
Grup II (metastatik grup) Meme Ca 18 20 Akciğer Ca 8 14 Prostat Ca 5 12 Mide Ca 1 2 Tiroid Ca 1 0 Kolon Ca 1 1 Lenfoma 0 3 Nazofarenks Ca 1 0 Deri Tm 1 1 Larenx Ca 1 0 Mesane Ca 1 1
3.4.Total ve Kemik Spesifik Alkalen Fosfataz: Hastalardan EDTA’lı tüplere 3 ml kan aldık.
Serum kemik spesifik alkalen fosfataz düzeyi tayini için kendi maddi imkanlarımız ile temin ettiğimiz Ostease IRMA kiti (Immunotech Company, Çek Cumhuriyeti) kullanılarak, Dicle Üniveristesi Nükleer Tıp Dalımızda bulunan RIA Laboratuarında radyoimmunoassay tekniği ile ölçümler yaptık.
Hasta serumları santrifüj makinesinde (Heraeus Labofuge 2000, Germany) 2500 rpm de 15 dakika santrifüj edildikten sonra çalışma zamanına kadar derin dondurucuda (Sanyo CRCFREE, Japan) -18 derecede sakladık. Çalışma öncesi hasta serumları oda sıcaklığında çözülmeye bıraktık.
1. aşamada antikor kaplı tüplere 100µl serum ve 100µl I-125 ile işaretlenmiş anti-kemik alkalen fosfataz antikoru konup 15 saniye nazikçe çalkaladık.
2.aşamada tüpler yaklaşık 19 saat 2-8 °C sıcaklıktaki su banyosunda beklettik. 3.aşamada (son aşama) tüm tüpler iki kez yıkama solüsyonu eklendikten sonra aspire edilip gama kounter cihazı (Bethold LB2111, Germany) ile bir dakikalık sayımlar aldık.
Total ALP ölçümü hastaların son 1 hafta içinde Abott Clinical Chemistry kiti kullanılarak yapılan testlerin sonuçları not ettik.
Referans aralıkları kit kataloglarına göre tALP için 50-140 U/L, bALP için 3.7-20.9 U/L olarak kabul ettik.
3.5.İstatistiksel Değerlendirme
Çalışmada elde edilen sayısal verilerin istatistiksel analizleri için Windows XP tabanında çalışan SPSS ( Statistical Package for Social Sciences) for Windows 15.0 paket programı kullanıldı.
Sayısal verilerin dağılımları Kolmogorov - Smirnov testi ile sınandı. p>0.05 değerleri bulunan veriler parametrik ve bunun altındaki değerler ise non parametrik dağılımlı değerler olarak kabul edildi.
Sayısal veriler arasındaki ilişkilerin incelenmesinde düzenli dağılım göstermeyen parametreler için Spearman’s korelasyon testi uygulandı.
İkili gruplar arasındaki farkın saptanmasında ise parametrik değerler için independent sample t test ve non parametrik değerler için Mann-Whitney U testi kullanıldı.
Elde edilen sonuçların anlamlılık düzeyi “p” değeri ile yorumlandı. p<0.05 değerleri istatistiksel olarak anlamlı olarak değerlendirildi.
4.BULGULAR
Non-metastatik grupta yaş ortalaması 56.13±15.7 (min-max 30-79) median yaş ise 57.5 yıl ve metastatik grupta yaş ortalaması 54±16.2 (min-max 14-85) median yaş ise 53 yıl idi. Her iki grup arasındaki fark istatistiksel olarak anlamlı fark bulmadık (p=0.51).
Non-metastatik grupta bulunan 38 hastanın 15’i (%39.5) erkek, 23’ü (%60.5) kadınlardan oluşmaktadır, metastatik grupta bulunan 54 hastanın 28’i (%51.8) erkek, 26’sı (%48.2) kadınlardan oluşmaktadır. Non-metastatik ve Metastatik gruplarının erkek-kadın sayısı aşağıdaki grafikte verilmiştir.
Grafik. Metastatik ve non-metastatik gruptaki kadın erkek sayıları
Çalışmaya katılan hastalarda hiperparatiroidi, rickets, osteomalasi, neoplastik kemik hastalıkları, myositis ossifikans, Paget hastalığı, safra kanallarının tıkanması, ilaçlara bağlı karaciğer hastalıkları ve hamilelik gibi alkalen fosfataz değerini artıran herhangi bir neden tespit etmedik.
Tüm olguların bulunduğu grupta kemik sintigrafisine göre kemik metastazı saptanmasında tALP değerinin spesifitesi %89.4, sensivitesi %53.7 ve pozitif belirleyici (prediktif) değeri %85.3; bALP değerinin spesifitesi %92.1, sensivitesi %57.4 ve pozitif belirleyici (prediktif) değeri %91.2 olarak hesapladık.
Meme kanserli hastaların bulunduğu grupta kemik sintigrafisine göre kemik metastazı saptanmasında tALP değerinin spesifitesi %94.4, sensivitesi %40 ve pozitif belirleyici (prediktif) değeri %85.7; bALP değerinin spesifitesi %100, sensivitesi %40 ve pozitif belirleyici(prediktif) değeri %100 olarak hesapladık.
Akciğer kanserli hastaların bulunduğu grupta kemik sintigrafisine göre kemik metastazı saptanmasında tALP değerinin spesifitesi %87.5, sensivitesi %42.8 ve pozitif belirleyici (prediktif) değeri %85.7; bALP değerinin spesifitesi %100, sensivitesi %57.1 ve pozitif belirleyici(prediktif) değeri %100 olarak hesapladık.
Prostat kanserli hastaların bulunduğu grupta kemik sintigrafisine göre kemik metastazı saptanmasında tALP değerinin spesifitesi %80, sensivitesi %91.6 ve pozitif belirleyici (prediktif) değeri %91.6; bALP değerinin spesifitesi %60, sensivitesi %91.6 ve pozitif belirleyici(prediktif) değeri %84.6 olarak hesapladık.
Tüm olgulardaki non-metastatik grup (Grup I) ile metastatik grup (Grup II)’ta tALP ve bALP değerleri arasında anlamlı fark bulduk (p<0.001). Grup I ve II’deki tALP ile bALP’nin ortalama±SD, medianları ve p değerleri tablo 5’te gösterilmiştir. Tablo 5. Metastatik ve non-metastatik gruplara ait tALP ve bALP değerleri
Non-metastatik grup (Grup I) Ortalama±SD
(Median) (n:38)
Metastatik grup (Grup I I ) Ortalama±SD (Median) (n:54) p Değeri tALP 101.1±107.3 U/L (69.5) 263.6±260.6 U/L (172.5) p<0.001 bALP 14±13 U/L (11.1) 41±41.2 U/L (24.6) p<0.001
Meme kanseri tanılı hastalardaki non-metastatik grup ile metastatik gruplardaki tALP (p<0.001) ve bALP (p<0.05) değerleri arasında anlamlı fark bulduk. Meme kanseri tanılı hastalardaki non-metastatik grup ile metastatik gruplardaki tALP ile bALP’nin ortalama±SD, medianları ve p değerleri tablo 6’da gösterilmiştir.
Tablo 6. Meme kanseri tanılı hastaların ortalama total alkalen fosfataz ve kemik spesifik alkalen fosfataz izoenzimi değerleri
Non-metastatik meme Ca’lı grup Ortalama±SD
(Median) (n:18)
Metastatik meme Ca’lı grup Ortalama±SD (Median) (n:20) p Değeri tALP 73.33±35.3 U/L (65) 211±226.9 U/L (114.5) p<0.001 bALP 10.97±4.94U/L (9.1) 28.88±28.75 U/L (17.3) p<0.05
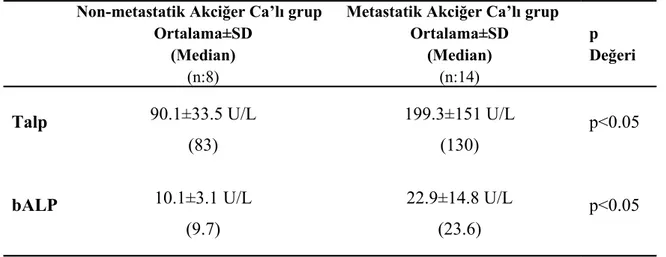
Akciğer kanseri tanılı hastalardaki non-metastatik grup ile metastatik gruplardaki tALP ve bALP değerleri arasında anlamlı fark bulduk (p<0.05). Akciğer kanseri tanılı hastalardaki non-metastatik grup ile metastatik gruplardaki tALP ile bALP’nin ortalama±SD, medianları ve p değerleri tablo 7’de gösterilmiştir.
Tablo 7. Akciğer kanseri tanılı hastaların ortalama total alkalen fosfataz ve kemik spesifik alkalen fosfataz izoenzimi değerleri
Non-metastatik Akciğer Ca’lı grup Ortalama±SD
(Median) (n:8)
Metastatik Akciğer Ca’lı grup Ortalama±SD (Median) (n:14) p Değeri Talp 90.1±33.5 U/L (83) 199.3±151 U/L (130) p<0.05 bALP 10.1±3.1 U/L (9.7) 22.9±14.8 U/L (23.6) p<0.05
Prostat kanseri tanılı hastalardaki non-metastatik grup ile metastatik gruplardaki tALP ve bALP değerleri arasında anlamlı fark bulduk (p<0.05). Prostat kanseri tanılı hastalardaki non-metastatik grup ile metastatik gruplardaki tALP ile bALP’nin ortalama±SD, medianları ve p değerleri tablo 8’de gösterilmiştir.
Tablo 8. Prostat kanseri tanılı hastaların ortalama total alkalen fosfataz ve kemik spesifik alkalen fosfataz izoenzimi değerleri
Non-metastatik Prostat Ca’lı grup Ortalama±SD
(Median) (n:5)
Metastatik Prostat Ca’lı grup Ortalama±SD (Median) (n:12) p Değeri tALP 128.2±91.6 U/L (96) 450.2±363.7 U/L (316) p<0.05 bALP 22±16.4 U/L (13.6) 78.7±52 U/L (78.6) p<0.05
Hastalarımıza ait örnekler olgu 1, olgu 2, olgu 3, olgu 4, olgu 5 ve olgu 6’da gösterilmiştir.
Olgu 1. 62 yaşında Prostat Ca tanılı hastanın kemik sintigrafisinde multipl kemik metastazı (tALP: 291, bALP: 79.5)
Olgu 2. 67 yaşında Prostat Ca tanılı hastanın kemik metastazı izlenmeyen kemik sintigrafi görüntüsü (tALP: 118, bALP: 13.4)
Olgu 3. 61 yaşında Meme Ca tanılı hastanın kemik sintigrafisi görüntüsünde multipl kemik metastazı (tALP: 77, bALP: 14.3)
Olgu 4. 35 yaşında Meme Ca tanılı hastanın kemik metastazı izlenmeyen kemik sintigrafi görüntüsü (tALP: 56, bALP: 5.9)
Olgu 5. 49 yaşında Akciğer Ca tanılı hastanın kemik sintigrafisi görüntüsünde multipl kemik metastazı (tALP: 132, bALP: 25.1)
Olgu 6. 61 yaşında Akciğer Ca tanılı hastanın kemik metastazı izlenmeyen kemik sintigrafi görüntüsü (tALP: 61, bALP: 9.3)
3. TARTIŞMA VE SONUÇ
Kemik metastazlarının belirlenmesinde nükleer tıp yöntemleri, radyolojik yöntemler ve labortuar metotları kullanılır. Kemik sintigrafisi kemik metastazlarının taranmsında hala gold standart olarak kullanılmasına rağmen akciğer kanserlerindeki gibi yalancı negatif görünüm ve kemiğin benign patolojileriden kırık ve artritlerde olduğu gibi yalancı pozitif görünümler vermektedir. Bu nedenlerle kemik metastazlarının saptanmasında kemik sintigrafisini daha duyarlı ve özgüllüğünü artırmak için araştırmacılar tarafından kemik metabolizmasını yansıtan metodların arayışıları sürmektedir.
Kanser hastalarında kemik yapım ve yıkım oranı kemik metastazlarının derecelendirilmesinde kullanıldığı için kemik metabolizmanın takibi önemlidir. Kemik metabolizmasının belirlenmesinde kemik dansitesi, kemik biopsisi ve spesifik biokimyasal markerler kullanılır (62). Kemik metabolizma belirteçlerinden alkalen fosfataz osteoblast fonksiyonunun serumdaki göstergesi olarak yaygın olarak kullanılmakla beraber hiperparatiroidi, rickets, osteomalasi, neoplastik kemik hastalıkları, myositis ossifikans, Paget hastalığı, safra kanallarının tıkanması, ilaçlara bağlı karaciğer hastalıkları ve hamilelik gibi artan alkalen fosfataz değerlerinden dolayı yeterli spesifisitesinin olmaması en önemli dezavantajıdır. Kemik metastazlarında artan osteoblastik aktivite beraberinde kemik spesifik ALP artışını da getirir (63,64). Kemik spesifik ALP kantitatif ölçümünün kemik metastazlarının ortaya konması, takip ve tedaviye cevabın değerlendirilmesinde kullanımına dair çalışmalar mevcuttur (65-73).
Birçok çalışmada kanser hastalarında kemik metastazlı hastalar ile kemik metastazı bulunmayan hastalar arasında total ALP ve kemik spesifik ALP değerleri anlamlı olarak yüksek bulunmuştur (1). Bizde çalımamızda metastaz saptanan hastalar ile saptanmayan hastalar arasında total ALP ve kemik spesifik ALP değerlerinde anlamlı fark bulduk (p<0.001).
Prostat kanserli 32 hastada Chen ve grubu bALP düzeyinin kemik metastazlarında tALP’a göre daha yüksek spesifiteye ve pozitif belirleyici değere sahip olduğunu rapor etmişlerdir (63). Ancak biz çalışmamızda prostat kanserli hastalarda total ALP ve kemik spesifik ALP arasında spesifite ve pozitif belirleyici değer arasında anlamlı fark bulamadık (p>0.05).
Zannito ve arkadaşları kemik, karaciğer ve lenf nodu metastazı olan 64 kanser olgusunun hepsinde total ALP’nin artarken, kemik izoenziminin sadece kemik metastazı olan hastalarda artmış olduğunu göstererek alkalen fosfataz kemik izoenzimin total enzimatik aktiviteden daha spesifik olduğunu rapor etmişlerdir (64). Bizim çalışmamızda ise total ALP normal olup kemik metastazı saptanan 6 hastada kemik spesifik ALP yüksek bulunmuştur. Ayrıca total ALP değeri yüksek olup kemik metastazı saptanmayan 2 hastada kemik spesifik ALP değeri normal sınırlardaydı.
Ramaswamy ve arkadaşları 62 meme kanserli ve 30 prostat kanserli hastayı kapsayan çalışmada total ve kemik spesifik ALP değerlerinin kemik metastazlı hastalarda anlamlı olarak yüksek bulmuşlardır (65). Biz de çalışmamızda aynı sonuca vardık.
Reale kemik alkalen fosfataz izoenziminin meme kanserli olgularda erken metastazların saptanmasında spesifisitesini %86.5 ve sensitivitesini %78.6 olarak bulmuş ve meme kanserli hastaların takibinde kullanımını önermiştir(66). Biz çalışmamızda meme kanserli hastaların kemik metastazlarının saptanmasında kemik spesifik ALP değerinin spesifitesini %100 sensivitesini %40 olarak hesapladık.
Jung ve grubu 117 prostat kanserli hastayı kapsayan çalışmalarında kemik metastazı saptamada total ALP değerinin spesifitesini %97 sensivitesini %45; kemik spesifik ALP değerinin spesifitesini %95 sensivitesini %66 olarak bulmuşlar (14). Biz çalışmamızda prostat kanserli hastalarda total ALP değerinin spesifitesini %80 sensivitesini %91.6; kemik spesifik ALP değerinin spesifitesini %60 sensivitesini %91.6 olarak hesapladık.
Çalışmamızda metastatik grupta serum alkalen fosfataz değerleri non-metastatik gruptan anlamlı olarak yüksektir. Elde ettiğimiz sonuçlara dayanarak total alkalen fosfataz ve kemik alkalen fosfataz izoenzimin metastatik ve non metastatik grupların ayrımında değerli olduğu sonucuna ulaştık ancak biz kemik metastazlarının tanısında kemik izoenziminin total alkalen fosfataza anlamlı üstünlüğünü gösteremedik. Bu, çalışma grubundaki hasta sayısının az olmasına ve hastaların tALP düzeyini artırabilecek başta karaciğer olmak üzere bilinen başka hastalıklarının olmasına bağlı olabilir. Ancak yine de total ALP düzeyinin yüksek bulunduğu
bALP’nin çalışılmasının daha ucuz ve kemiğe spesifik daha fazla bilgi vereceği sonucuna varabiliriz.
Öremek ve arkadaşları 64 kişilik çalışma grubunda kemik ALP, total ALP ve kemik sintigrafisini karşılaştırmış ve kemik izoenzim ALP’ın kemik sintigrafisi ile kombine olarak erken dönemde metastazların saptanmasında yararlı olduğunu bildirmişlerdir (67).
Ortapamuk ve arkadaşları yeni kanser tanısı almış 40 hastada kemik sintigrafisi ile ALP değerlerini karşılaştırdıkları çalışmada kemik metastazı saptanan tüm olgularda total ve kemik spesifik ALP değerini yüksek bulmuşlardır (68). Ancak bizim çalışmamızda kemik metastazı saptanan 25 hastada total ALP 23 hastada ise kemik spesifik ALP değeri normal ve düşük olarak bulduk.
Wada ve grubu 156 meme kanserli hasta ile yaptıkları çalışmada kemik metastazı saptanan hastalarda total ALP değerlerinde anlamlı fark bulamamışlar (69). Biz ise çalışmamızda meme kanserli hastalarda kemik metastazı saptanmasında total ALP değerlerinde anlamlı fark bulduk (p<0.001).
Garnero ve arkadaşları yaptıkları çalışmada 48 prostat kanserli hastanın kemik metastazının saptanmasında total ALP ve kemik spesifik ALP değerlerini anlamlı olarak yüksek bulmuşlar (70). Bizde çalışmamızda prostat kanserli hastalarda kemik metastazlılarda total ve kemik spesifik ALP değerlerini anlamlı olarak yüksek saptadık(p<0.05).
Aruga ve grubu 91 akciğer kanserli hasta üzerinde yaptığı çalışmada kemik metastazlı hastaların tespitinde total ALP değerinin spesifitesini %79.5 sensivitesini %55.6; kemik spesifik ALP değerinin spesifitesini %93.2 sensivitesini %44.4 olarak bulmuşlar (1). Biz çalışmamızda 22 akciğer kanserli hastada total ALP değerinin spesifitesini %87.5 sensivitesini %42.8; kemik spesifik ALP değerinin spesifitesini %100 sensivitesini %57.1 olarak hesapladık.
Bombardieri ve arkadaşları meme kanserli hastalarda neoplastik kemik lezyonlarının varlığının yanında, visseral metastazların ve postmenopozal durumun bu parametrelerin düzeyini etkilediğini göstermişlerdir, bALP’nın metastazın yüksek olasılıklı olduğu bu grupta kemik metastazlarının tanısında yeterli tanısal doğruluğa sahip olmadığını vurgulamışlardır (13).
Kanakis ve arkadaşları 24 meme kanserli hastayı kapsayan çalışmalarında kemik metastazlarının saptanması ve takibinde kemik spesifik ALP değerinin yararlı bir belirteç olduğu kanısına varmışlardır (62).
Erturan ve arkadaşları küçük hücreli dışı akciğer kanserli 125 hasta ile yapılan çalışmada artmış ALP değeri, kemik ağrısı ve hiperkalsemi gibi kemik metastazına özgü klinik faktörlerin yokluğunda bile kemik sintigrafisi yapılmasını önermişler (71). Bizim çalışmamızda kemik metastazı izlenen 14 akciğer hastasından 8’inde total ALP ve 6’sında ise kemik spesifik ALP’ı normal sınırlarda saptadık.
Wechsel ve grubu prostat kanserli hastalar üzerinde yaptıkları çalışmada kemik spesifik ALP fosfatazın lokal ve ilerlemiş vakaların ayrımında kullanılabileceğini vurgulamışlar (72). Bizde çalışmamızda prostat kanserli hastalarda evre değişikliğine sebep olduğu için kemik metastazlarını saptamada ve böylelikle lokal ve ilerlemiş vakaların ayrımında kemik spesifik ALP’ın yararlı olacağını düşündük.
Sonuç olarak; biz çalışmamızda kanserli hastalarda kemik metastazlarının tespitinde total ALP ve kemik spesifik ALP değerlerinin özgüllüğünü yüksek olarak saptadık. Ancak kemik metastazlarının saptanmasında duyarlı bir metot olarak karşımıza çıkan kemik spesifik alkalen fosfatazın kemik sintigrafisinin yerini alması beklenemez. Kemik sintigrafisi normal olan hastalarda bir daha ki görüntüleme zamanının tayininde yönlendirici bir parametre olarak kullanılabilir, ani yükselen kan değerleri sintigrafik çalışmanın öncelikli programlanmasını sağlayabilir olduğunu vurgulayabiliriz.
4. KAYNAKLAR
1. Aruga A, Koizumi M, Hotta R, Takahashi S, Ogata E. Usefulness of bone metabolic markers in the diagnosis and follow-up of bone metastasis from lung cancer. British J. of Cancer, 1997; 76(6): 760-4
2. Eubank WB, Mankoff DA. Evolving role of positron emission tomography in breast cancer imaging. Semin Nucl Med. 2005;35:84–99
3. Yeh SD, Imbriaco M, Larson SM, Garza D, Zhang JJ, Kalaigian H, et al. Detection of bony metastases of androgen-independent prostate cancer by PET-FDG. Nucl Med Biol. 1996;23:693–697
4. Gendreau V, Montravers F, Philippe C, Talbot JN. Reevaluation of the usefulness of systematic bone scanning in initial staging and follow-up of small cell lung carcinoma, taking into account the serum levels of neuron-specific enolase. Int. J. Biol Markers. 1997;12:148–153
5. Maffioli L, Florimonte L, Pagani L, Butti I, Roca I. Current role of bone scan with phosphonates in the follow-up of breast cancer. Eur J Nucl Med Mol Imaging. 2004;31(suppl 1):143–148
6. Crippa F, Seregni E, Agresti R et al. Bone scintigraphy in breast cancer: a ten year follow-up study. J Nucl Biol Med 1993;37: 57-61.
7. Loprinzi CL. It is now the age to define the appropriate follow-up of primary breast cancer patients. J Clin Oncol 1994;12: 881-3.
8. Rosselli TM, Palli D, Cariddi A et al. Intensive diagnostic follow-up after treatment of primary breast cancer. JAMA 1994;271:1593-7.
9. Rankin S, Rubens RD, Fogelman I et al.Bone metastases: diagnosis and treatment. Berlin Heidelberg New York: Springer: 1991; 63-81.
10. Hortobagyi GN, Libshitz HI, Seabold JE. Osseous metastases of breast cancer: clinical, biochemical, radiographic and stenographic evaluation of response to theraphy. Cancer 1984;53:577-82.
11. Coombes RC, Dady P, Oarsons C et al. Assessment of response of bone metastases to systemic treatment in patients with breast cancer. Cancer 1983;52:610-4.