PAMUK YAĞINDA DNA İZOLASYON YÖNTEMLERİNİN ETKİNLİĞİNİN KARŞILAŞTIRILMASI VE GENETİĞİ DEĞİŞTİRİLMİŞ ORGANİZMA ANALİZLERİNE
ETKİSİNİN DEĞERLENDİRİLMESİ Sibel Kaygusuz
Yüksek Lisans Tezi Biyomühendislik Anabilim Dalı
Dr. Öğr. Üyesi CerenBayraç Ağustos-2019
T.C.
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
PAMUK YAĞINDA DNA İZOLASYON YÖNTEMLERİNİN ETKİNLİĞİNİN KARŞILAŞTIRILMASI VE GENETİĞİ DEĞİŞTİRİLMİŞ ORGANİZMA
ANALİZLERİNE ETKİSİNİN DEĞERLENDİRİLMESİ
YÜKSEK LİSANS TEZİ Sibel KAYGUSUZ
Biyomühendislik Ana Bilim Dalı
Tez Danışmanı: Dr. Öğr. Üyesi Ceren BAYRAÇ
ii
TEZ BİLDİRİMİ
Yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
(İmza) Sibel Kaygusuz
i
ÖZET
Yüksek Lisans Tezi
PAMUK YAĞINDA DNA İZOLASYON YÖNTEMLERİNİN ETKİNLİĞİNİN KARŞILAŞTIRILMASI VE GENETİĞİ DEĞİŞTİRİLMİŞ ORGANİZMA
ANALİZLERİNE ETKİSİNİN DEĞERLENDİRİLMESİ Sibel Kaygusuz
Karamanoğlu Mehmetbey Üniversitesi Fen Bilimleri Enstitüsü
Biyomühendislik Ana Bilim Dalı Danışman: Dr. Öğr. Üyesi CerenBAYRAÇ
Ağustos, 2019, 59 sayfa
Gıdalarda genetiği değiştirilmiş organizma analizlerinin en önemli basamağı saf ve kırılmamış DNA elde edilmesidir. Bu çalışmada, gıda endüstrisinde kullanılan ticari olarak temin edilen pamuk yağı örneklerinden dört farklı yöntem ile DNA izolasyon çalışması gerçekleştirildi. Cetyl trimethylammonium bromide (CTAB)-hekzan-kloroform, CTAB-merkaptoetanol,CTAB ve kit yöntemiyle elde edilen DNA’ların konsantrasyon ve saflık değerleri spektrofotometri ile belirlendi. Bu yöntemlerle izole edilen DNA’ların polimeraz zincir reaksiyonunda (PZR) etkin bir şekilde amplifikasyona maruz kalıp kalmama durumları değerlendirildi. Bunun için pamuğa(Gossypium)özgü acyl taşıyıcı protein 1 kodlayan gen bölgesine (acp 1) göre tasarlanan primerler ve genetiği değiştirilmiş gene ait 35S promotor bölgesine göre tasarlanan primerler ile amplifikasyon reaksiyonu gerçekleştirildi. Sonuç olarak, CTAB temelli manuel yöntemlerle izolasyon işleminden sonra ortamdan uzaklaştırılamayan polisakkarit ve diğer moleküllerin amplifikasyonu engellediği sonucuna varıldı. Kit yöntemiyle yapılan izolasyonda ise yeterli miktarda DNA elde edilemediği ve bu nedenle amplifikasyonun başarılı şekilde yapılamadı değerlendirildi. DNA’ların etanol ile temizlenmesinden sonra daha saf hale geldiği spektral olarak belirlendi ve CTAB yöntemiyle izole edilen DNA’larda amplifikasyon reaksiyonu bazı örnekler için gerçekleştirildi.
ii
ABSTRACT
MsThesis
COMPARING THE EFFICIENCY OF DNA EXTRACTION METHODS FROM COTTON OILS AND EVALUATION OF THEIR EFFECTS ON THE
ANALYSES OF GENETICALLY MODIFIED ORGANISM SibelKaygusuz
Karamanoğlu Mehmetbey University Graduate School of Natural andAppliedSciences
Department of Bioengineering Supervisor: Assist. Dr. Ceren Bayraç
August, 2019, 59 pages
The most important step of genetically modified organism analysis in foods is obtaining pure and intact DNA. In this study, DNA isolation study was performed with four different methods from commercially available cotton oil samples used in food industry. The concentrations and purities of DNA samples isolated by cetyl trimethylammonium bromide (CTAB) -hexane-chloroform, CTAB-mercaptoethanol, CTAB and kit DNA were obtained by spectrophotometry. The DNAs isolated by these methods were evaluated whether they were effectively subjected to amplification in polymerase chain reaction (PCR).For this purpose, amplification reactions were performed with primers designed according to the gene region encoding acyl carrier protein 1 (acp1) specific to cotton (Gossypium spp) and primers designed according to the 35S promoter region of modified gene.As a result, it was concluded that polysaccharide and other molecules that might notbe removed after isolation by CTAB based manual methods prevented amplification. Also, it was evaluated that sufficient DNA could not be obtained from isolation by kit method and therefore amplification could not be performed successfully. It was determined that DNAs became more pure after ethanol precipitation and amplification reaction was performed succesfully for some samples of DNA isolated by CTAB method.
iii
ÖNSÖZ
Bu çalışmanın tüm süreçinde bana destek olan, pes etmememi sağlayan, tezimi incelik ve titizlilikle takıp eden Sayın Dr. Öğr. Üyesi Ceren BAYRAÇ ‘a sonsuz teşekkürleri bir borç bilip onsuz bu noktalara gelemiyeceğimi belirtmek isterim.
Bunun yanı sıra Saray Holding Ailesine ve ARGE Müdürüme bana yüksek lisans imkanları sağladıkları için teşekkür ederim. Ve değerli ailem İsmail KAYGUSUZ, Nagül KAYGUSUZ, Onur KAYGUSUZ, Halime AKTAŞ, Osman AKTAŞ ve Eda ERMUT ‘a benden bir gün olsun umudu kesmedikleri için, her koşulda yanımda oldukları için minnetlerimi sunuyorum ve teşekkür ederim.
(İmza) Sibel Kaygusuz Karaman-2019
iv İÇİNDEKİLER Sayfa ÖZET ... i ABSTRACT ...ii ÖNSÖZ ...iii İÇİNDEKİLER ... iv ŞEKİLLER DİZİNİ ... viii SİMGELER VE KISALTMALAR DİZİNİ ... ix 1. GİRİŞ ... 1
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI ... 2
2.1. Genetiği Değiştirilmiş Organizmalar ... 2
2.2. Genetiği Değiştirilmiş Bitkiler ve Üretim Amaçları ... 3
2.3. Bitkilerde Genetik Transformasyon Yöntemleri ... 5
2.3.1. Agrobacterium Yöntemi ... 5
2.3.2. Biyolistik Yöntem (Gen Tabancası) ... 6
2.3.3 Elektroporasyon Yöntemi ... 6
2.3.4 Ultrason yöntemleri ... 6
2.3.5. Mikroenjeksiyon Yöntemi ... 7
2.3.6. Silikon karbid fiberler Yöntemi ... 7
2.3.7. Cam boncuklarla çalkalama Yöntemi ... 7
2.3.8. PEG Yöntemi ... 8
2.3.9. Lazer Mikroışınlar Yöntemi ... 8
2.4.GDO’nun Dünyadaki Yeri ... 8
2.5. GDO Tespit Metodları... 10
2.5.1. Protein-Temelli Yöntemler ... 10
2.5.2. DNA-Temelli Yöntemler ... 10
2.6. Gıda Ürünlerinde GDO Tespiti ... 13
2.7. Gıda Örneklerinden DNA İzolasyonu ... 15
2.8. Pamuk Yağı ... 16
2.8.1 Dünya’da Pamuk ... 16
2.8.2. Türkiye‘de Pamuk Durumu... 17
v
3. MATERYAL VE METOT... 18
3.1. Çalışmada Kullanılan Materyaller ... 18
3.2. Çözeltilerin Hazırlanması ... 18
3.3. Pamuk Yağından DNA İzolasyonu ... 19
3.3.1. Pamuk Yağından CTAB-Hekzan-Kloroform Yöntemiyle DNA İzolasyon Protokolü (Protokol 1)... 19
3.3.2 Pamuk Yağından CTAB-Merkaptoetanol Yöntemiyle DNA İzolasyon Protokolü (Protokol 2)... 20
3.3.5. Etanol ile çöktürme işlemi ... 23
3.4. Saflık, Konsantrasyon ve Kalite Kontrolü ... 24
3.5 DNA Amplifikasyonu ... 24
3.5.1. Primerlerin Belirlenmesi ... 24
3.5.2. PZR Reaksiyon Bileşenlerinin Hazırlanması ... 25
3.5.3. Amplifikasyon protokolü ... 25
3.5.4. Jel Elektroforez ... 26
3.6. İstatistiksel Analiz ... 26
4. BULGULAR ... 27
4.1. Farklı yöntemlerle Pamuk Yağından DNA izolasyonu ve Kontrolü ... 27
4.1.1 CTAB-hekzan-kloroform yöntemiyle (Protokol 1) Pamuk yağından DNA izolasyon sonuçları ... 27
4.1.2 CTAB-merkaptoetanol yöntemiyle (Protokol 2) Pamuk yağından DNA izolasyon sonuçları ... 30
4.1.3CTAB yöntemiyle (Protokol 3) Pamuk yağından DNA izolasyon sonuçları .. 32
4.1.4 Kit Yöntemiyle Pamuk yağından DNA izolasyon sonuçları ... 35
4.2 Pamuk Yağında DNA İzolasyon Yöntemlerinin Etkinliğinin Değerlendirilmesi .... 37
4.3 Farklı Yöntemlerle İzole Edilen DNA’ların Genetiği Değiştirilmiş Organizma Analizlerine Etkinliğinin Değerlendirilmesi ... 39
5. TARTIŞMA VE SONUÇ ... 43
5.1 Farklı Yöntemlerle Pamuk Yağından DNA İzolasyonu Ve Kontrolü ... 43
5.2 Pamuk Yağında DNA İzolasyon Yöntemlerinin Etkinliğinin Değerlendirilmesi .... 50
5.3 Farklı Yöntemlerle İzole Edilen DNA’ların Genetiği Değiştirilmiş Organizma Analizlerine Etkinliğinin Değerlendirilmesi ………..50
vi
KAYNAKLAR ... 53 ÖZGEÇMİŞ ... 59
vii
ÇİZELGELER DİZİNİ
Çizelge Sayfa
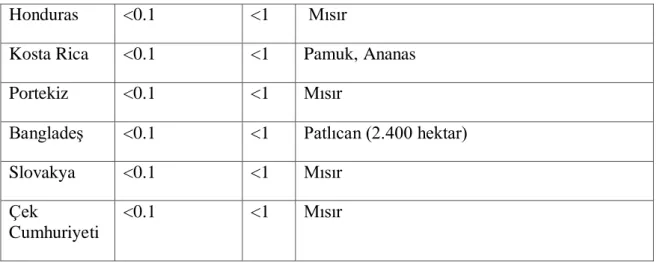
Çizelge 2-1 2017 yılında üretilen GD bitkilerin ülkelere göre dağılımı ... 5
Çizelge 3-1 Reagent plate E’de bulunan reaktif hazneleri ve reaktifler ... 23
Çizelge 3-2 Çalışmada kullanılan primerler ... 25
Çizelge 3-3 Çalışmada kullanılan PZR bileşenleri ... 25
Çizelge 3-4 acp1 primer setine ait amplifikasyon protokolü... 25
Çizelge 3-535S promotör primer setine ait amplifikasyon protokolü ... 25
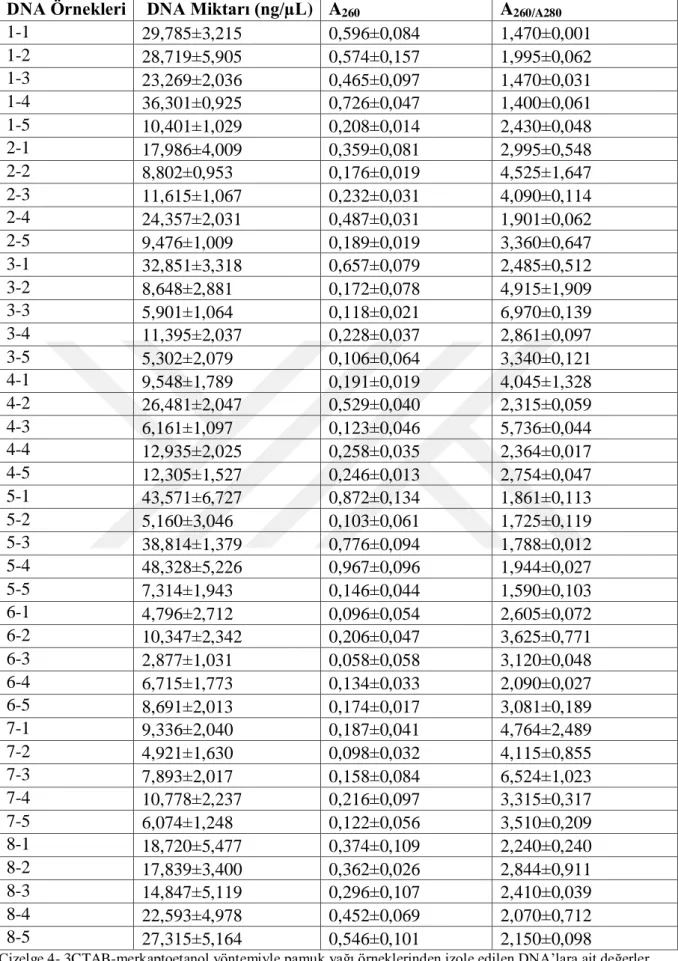
Çizelge 4-1 CTAB-hekzan-kloroform yöntemiyle 300 µL pamuk yağı örneklerinden izole edilen DNA’lara ait değerler ………..28
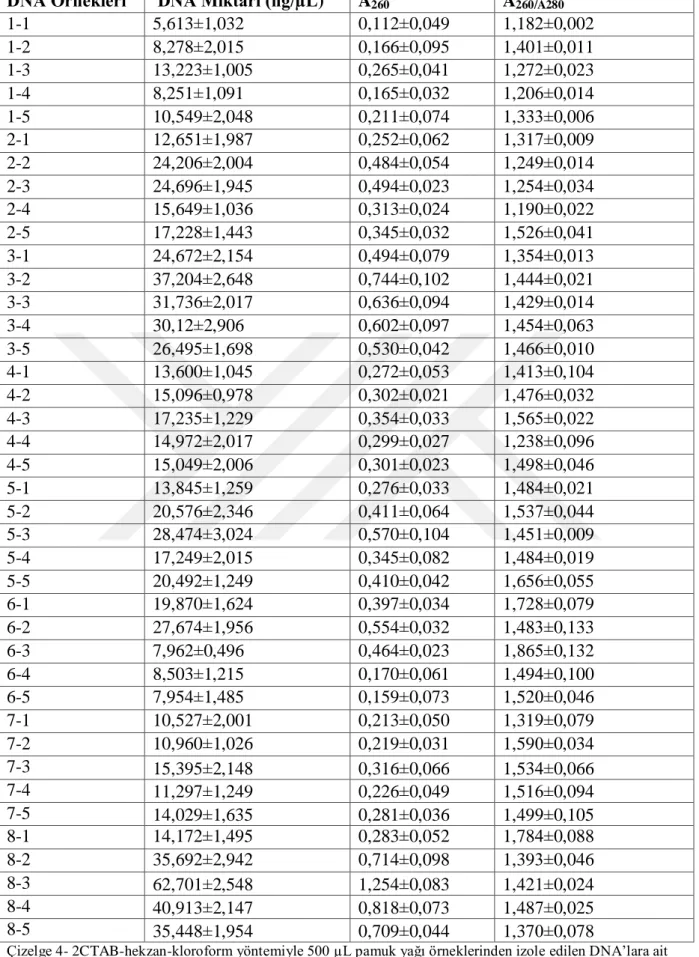
Çizelge 4-2 CTAB-hekzan-kloroform yöntemiyle 500 µL pamuk yağı örneklerinden izole edilen DNA’lara ait değerler ... 29
Çizelge 4-3 CTAB-merkaptoetanol yöntemiyle pamuk yağı örneklerinden izole edilen DNA’lara ait değerler... 31
Çizelge 4-4 CTAB yöntemiyle 300 µL pamuk yağı örneklerinden izole edilen DNA’lara ait değerler... 33
Çizelge 4-5 CTAB yöntemiyle 500 µL pamuk yağı örneklerinden izole edilen DNA’lara ait değerler... 34
Çizelge 4-6 Kit yöntemiyle pamuk yağı örneklerinden izole edilen DNA’lara ait değerler ... 36
Çizelge 4-7 Farklı Yöntemle Pamuk yağı örneklerinden beşer biyolojik tekrar ile izole edilen DNA’lara ait konsantrasyon, standart sapma ve varyasyon katsayıları ... 38
Çizelge 4-8 Pamuk yağı örneklerinden dört farklı yolla izole edilen DNA’ların etanol ile çöktürülmesinden sonra elde edilen DNA’ların konsantrasyon ve saflık değerleri. ... 41
Çizelge 5-1 Literatürde bulunan zeytinyağından DNA izolasyon çalışmalarına ait bilgiler ……….44
viii
ŞEKİLLER DİZİNİ
Şekil
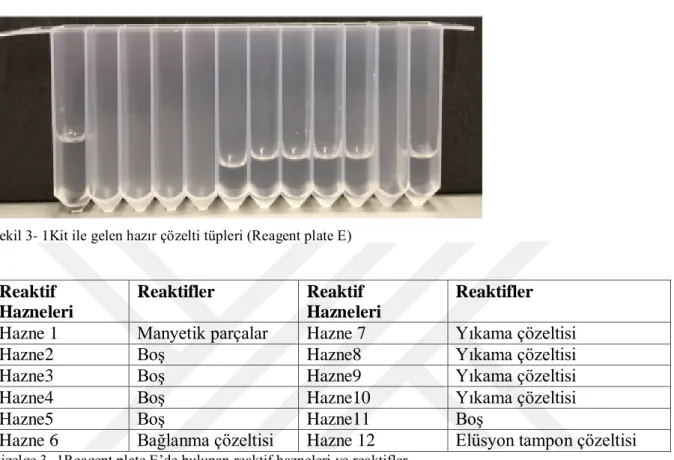
Şekil 3-1 Kit ile gelen hazır çözelti tüpleri (Reagent plate E) ... 23
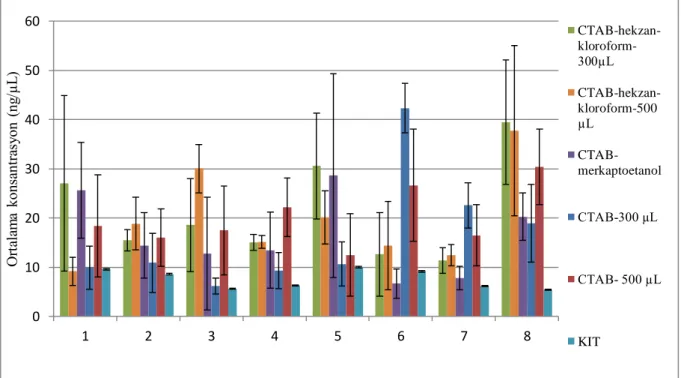
Şekil 4- 1Dört farklı yöntem ile sekiz farklı pamuk yağının beşer biyolojik tekrarından izole edilen DNA’ların ortalama konsantrasyon grafiği (CTAB-hekzan-klorofom yöntemi ve CTAB yöntemi için iki farklı başlangıç miktarı denendi, 300 ve 500 µL’ler bu yöntemlerdeki başlangıç pamuk yağı miktarlarını temsil etmektedir) .... 37 Şekil 4- 2Dört farklı yöntem ile izole edilne pamuk yağı örneklerinin acp 1gen
bölgesinin amplifikasyonuna ait PCR ürünlerinin jel görüntüsü (%4’lük agaroz jel) (A) hekzan-kloroform yöntemiyle elde edilen DNA’lara, (B) CTAB-merkaptoetanol yöntemiyle elde edilen DNA’lara, (C) CTAB yöntemiyle elde edilen DNA’lara, (D) Kit yöntemiyle elde edilen DNA’lara ait sonuçlar ... 40 Şekil 4- 3CTAB yöntemi (Protokol 3) ile izole edilen genomik DNA’ların etanol ile
temizlenmesinden sonra elde edilen agaroz jel görüntüsü (%1’lik jel görüntüsü) .. 41 Şekil 4- 4CTAB yöntemi (Protokol 3) ile izole edilen genomik DNA’ların
temizlenmesinden sonra acp 1gen bölgesinin amplifikasyonuna ait PCR ürünlerinin jel görüntüsü (%4’lük agaroz jel)(PZR ürünleri 2. kuyucuktan itibaren srasıyla yüklenmiştir, son kuyucuk negatif kontroldür). ... 41 Şekil 4- 5CTAB yöntemi (Protokol 3) ile izole edilen genomik DNA’ların
temizlenmesinden sonra 35S bölgesine özgü primerler ile amplifikasyonuna ait PCR ürünlerinin jel görüntüsü (%4’lük agaroz jel)(PZR ürünleri 2. kuyucuktan itibaren srasıyla yüklenmiştir, son iki kuyucuk pozitif ve negatif kontroldür). ... 42 Şekil 5-1 Pamuk (Gossypium hirsutum)’ın 15. kromozomunda bulunan acp 1 gen
ix SİMGELER VE KISALTMALAR DİZİNİ Simgeler Açıklama % Yüzde m/mKütle/Kütle gGram kg Kilogram °C Derece selsiyus rpm Dönüş/devir sayısı mM Milimolar µM Mikromolar g Gravite mL Mililitre µL Mikrolitre Kısaltmalar Açıklama
GDO Genetiği Değiştirilmiş Organizma
GD Genetiği Değiştirilmiş
ABD Amerika Birleşik Devletleri
DNA Deoksiribonükleik Asit
1
1. GİRİŞ
Gıdalarda genetiği değiştirilmiş organizma (GDO) analizlerinde yüksek saflıkta ve kalitede DNA elde edilmesi ilk ve önemli bir basamaktır. Kaliteli ve belirli bir konsantrasyonda DNA eldesi daha sonra izlenecek olan kalitatif ve kantitatif GDO taramasında doğru sonucun elde edilmesini doğrudan etkilemektedir. Bu nedenle farklı gıda numuneleri için farklı DNA izolasyon yöntemleri geliştirilmekte ve kullanışlılığı ölçülmektedir.
Doğrudan gıda olarak tüketime sunulan GD organizmalardan DNA izolasyonu, bitkilerden DNA izolasyonu için geliştirilmiş yöntemleri temel almaktadır. Bu yöntemlerde genel temel prensip; bitkisel hücrelerin hücre duvarlarının parçalanması, setil trimetil amonyum bromür (CTAB) ve sodyum dodesil sülfat (SDS) gibi deterjanlar kullanılarak hücre zarı parçalanması ve böylece hücre içerisinde DNA moleküllerinin serbest hale gelmesidir. DNA izolasyonundaki başarı ölçütleri işlemler sonrası elde edilen DNA’nın miktarı, DNA’nın kalitesi ve DNA’nın kullanışlılığıdır.
Doğrudan tüketime sunulan GD organizmalar dışında, GD organizmalardan üretilmiş işlenmiş ürünlerden DNA izolasyonu klasik yöntemlerden farklı yöntemlere gereksinim duymaktadır. Bunun sebebi; yüksek sıcaklık, öğütme gibi çeşitli işlemlere maruz kalan işlenmiş ürünlerde DNA moleküllerinin yapısal bozulmaya uğramasıyla elde edilen DNA konsantrasyonunun daha düşük olmasıdır.
İşlenmiş ürün olan pamuk yağı gıda sektöründe sürülebilir çikolata gibi birçok üründe kullanılmaktadır. Kullanılan pamuk yağının büyük bir oranda yurt dışından temin edilmesi ve Biyogüvenlik Kanunu (Biyogüvenlik Kanunu Kanun No 5977, 2010) kapsamında Biyogüvenlik Kurulunun şuana kadar gıdalarda GDO kullanımına izin vermemiş olması GDO tarama işlemlerinin uygulanmasını zorunlu kılmaktadır. Bu nedenle pamuk yağı numunelerinden DNA izolasyonu GDO analizlerinin doğru ve etkin sonuç vermesi adına önemli bir basamak olarak değerlendirilmektedir.
Bu tezin amacı farklı DNA izolasyon yöntemleri ile pamuk yağından elde edilen DNA moleküllerinin kalitesini ve miktarını değerlendirmek ve daha sonra uygulanacak GDO tarama yöntemlerindeki etkisini belirlemektir.
2
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI 2.1. Genetiği Değiştirilmiş Organizmalar
Moleküler biyoteknolojide meydana gelen hızlı gelişmeler 1960 yılında gıda üretiminde ilk gen teknolojisi ürünü ile sonuçlanmıştır. Moleküler biyoteknolojideki bu ilerleme 1973 yılında bakterilerde gen aktarımı ile başlayıp 1980’li yıllardan itibaren hızlı bir şekilde artmaya başlamıştır. Ticari olarak 1990’da ilk transgenik bitki üretimine başlanmıştır. Bunun üzerine 1996 yılından itibaren de rekombinant DNA teknolojisi ile elde edilmiş genetiği değiştirilmiş organizmalar dünya genelinde hızla yaygınlaşmaya başlamıştır.Genetiği değiştirilmiş organizmalar (GDO) tarımsal üretimler dışında sanayi, tıpve çevre ürünleri gibi birçok alanda da kullanılmaya başlamıştır(Demir, 2017).
Dünyada GDO ile ilgili önemli olan gelişmeleri aşağıdaki gibi sıralanmıştır;
-1980 yılında Amerika Birleşik Devletleri (ABD) Yüksek Mahkemesi genetik olarak değiştirilmiş mikroorganizmaların (GDM) patentleşebileceğine karar vermiştir. Verilen ilk patent petrol yiyen bakteri için verilmiştir.
-1982 yılında rekombinant DNA teknolojisini kullanarak Amerikan Gıda ve İlaç Dairesi (FDA) insülin hormonunu satışa sunmuştur. Buna bağlı olarak Avrupa’da rekornbinant DNA teknolojisi ile üretilmiş ilk hayvan aşısının kullanımı onaylanmıştır.
-1985 yılında tarım alanında böcek, bakteri ve virüslere karşı bitkilerin toprakta daha dirençli yetiştirilmesi için çalışmalara başlandı.
-1986 yılında ise ilk rekombinant aşı olan Hepatit B aşısı üretildi.
-1990 yılında ABD’de peynir üretimi için rekombinantkimozin kullanılmaya başlandı.
-1994 yılında ilk genetik mühendisliği ile geliştirilmiş domates Dünya Gıda Örgütü (FAO) tarafından resmi olarak kabul edilmiştir.
-1996 yılında genetik olarak değiştirilmiş bitkiler aynı zamanda ticari amaçla kullanılmak için ekilmeyede başlamıştır.
-1997 yılında koyun Dollyklonlandı.
-2000 yılında A vitaminlerine daha yüksek performansta dönüşen ‘Altın pirinç’ (provitamin A üreten pirinç) geliştirilmiştir.
-2000 yılından sonra GDO’lu ürünlerin kullanımnda hızlı bir artış gözlenmiştir. ABD, Almanya,Belçika gibi ülkelerde yapılan çalışmalar sonucunda, hayvan ve bitkilerin genetik transformasyonuna izin veren gelişmiş gen teknolojisi sağlık ve gıda endüstrisi, tarım gibi pek
3
çok alanda kullanılmaya başlanmıştır.Biyoteknolojik çalışmalar sonucu genetiği değiştirilmiş tarımsal ürün üretiminin çoğunluğu ABD, Brezilya, Arjantin, Hindistan, Kanada ve Çin’de
yapılmaktadır. Dünyada üretilen ve ticareti yapılan GDO’lu ürünlerin önemlibir kısmı bitkilerden elde edilir. Hayvanlar üzerinde de çeşitli çalışmalar yürütülmektedir.Fakat transgenik hayvanların hayvansal üretimde kullanılması henüz pek yaygın değildir (Anonim a, 2019).
2.2. Genetiği Değiştirilmiş Bitkiler ve Üretim Amaçları
GD Bitkiler; birinci nesil GD bitkiler, ikinci nesil GD bitkiler ve üçüncü nesil GD bitkiler olaraksınıflandırılmaktadır (Sancak, 2019).Birinci nesil GD bitkilerin üretim aşamaları sırasında bitkilere herbisit, böcek, hastalık ve çevresel stres koşullarına dayanıklılık gibi özelliklerinin kazandırıldığı bitkiler olarak belirtilirken,ikinci nesil GD bitkilerin araştırılması ve geliştirmesisırasında verim ve besleme kalitesinin artırıldığı bitkiler olarak üretilmişlerdir.Üçüncü nesil GD bitkiler ise insan tedavisinde kullanılan aşı, ilaç ve biyo-yakıt üretiminde kullanılan bitkilerdir.
4
Ülke Ekim Alanı
(Milyon Hektar)
% GD Bitkiler ve Toplam Üretime Oranları
ABD 75.0 40 Soya (%94), Mısır (%93), Pamuk (%96), Şeker Pancarı (%100), Kolza (%100), Papaya (%77), Yonca (%14.4), Elma, Eten, Kavun, Erik, Patates, Tütün, Domates, Buğday, Çeltik, Kabak, Hindiba
Brezilya 50.2 26 Soya (%97), Pamuk (%84), Mısır (%88.9), Şeker Kamışı
Arjantin 23.6 1 12 Soya (%100), Mısır (%97), Pamuk (%100) Kanada 13.1 7 Kolza (%95), Mısır (%92), Soya (%85), Şeker
Pancarı (%100), Yonca (%0.7), Patates
Hindistan 11.4 6 Pamuk (%93)
Paraguay 3.0 2 Soya (%96), Mısır (%42), Pamuk (%100)
Pakistan 3.0 2 Pamuk (%96)
Çin 2.8 1 Pamuk (%95), Papaya (%86)
Güney Afrika
2.7 1 Mısır (%85), Soya (%95), Pamuk (%100)
Bolivya 1.3 1 Soya (%100)
Uruguay 1.1 1 Soya (%98), Mısır (%100)
Avustralya 0.9 <1 Pamuk, Kolza Filipinler 0.6 <1 Mısır
Miyanmar 0.3 <1 Pamuk
Sudan 0.2 <1 Sudan 0.2<1 Pamuk
İspanya 0.1 <1 Mısır
Meksika 0.1 Pamuk, Soya
Kolombiya 0.1 <1 Pamuk, Mısır Vietnam <0.1 <1 Mısır,
5
Honduras <0.1 <1 Mısır
Kosta Rica <0.1 <1 Pamuk, Ananas Portekiz <0.1 <1 Mısır
Bangladeş <0.1 <1 Patlıcan (2.400 hektar) Slovakya <0.1 <1 Mısır
Çek
Cumhuriyeti
<0.1 <1 Mısır
Çizelge 2- 12017 yılında üretilen GD bitkilerin ülkelere göre dağılımı (ISAAA, 2017)
2.3. Bitkilerde Genetik Transformasyon Yöntemleri
Transgenik bitki üretiminde en zorlu noktalardan birisi de etkili transformasyon yöntemlerinin uygulanmasıdır. Kullanılacak olan en uygun transformasyon yönteminin seçilmesi ve geliştirilmesi, transgenik tarla bitkilerinin rejenerasyonu da hala aşılması gereken önemli bir zorluk olarak bilinmektedir (Altpeter ve ark., 2016).
2.3.1. Agrobacterium Yöntemi
Agrobacterium yöntemi Agrobacterium tumefaciens ve Agrobacterium rhizogenes gibi bakteriler aracılığıyla aktarılmak istenen genin hedef organizmaya taşınmasında ele alan bir yöntemdir (Zupan ve ark, 1997; Patnaik ve Khurana, 2001; Rakoczy-Trojanowska, 2002). Agrobacterium’un çeşitli türleri üzerinde ilk olarak 100 yıl kadar önce çalışmalar yapılmış ve bitkilerde bulunan taç gali hastalığının sebepleri araştırılmıştır. 1897 yılında A. tumefaciens asma bitkisine ait gallerden izole edilmiştir (Hwang ve ark., 2015). Bu bakteri sahip olduğu Ti plazmidi ile bitkilerde taç tümörüne sebep olurken, A. rhizogenes ise ri plazmidi ile bitkilerde saçak kök hastalığına sebep olmaktadır (Meyers ve ark., 2010; Barampuram ve Zhang, 2011). Agrobacterium yönteminin avantajları genom entegrasyonunun kesin olması, düşük kopya sayısıyla transgenlerin yerleştirilmesinin daha kolay olması, genin entegrasyonu, ifadesi ve kalıtımınınuzun süre boyunca kararlı olması, birçok dikotil bitki ve bazı monokotil bitkiler için etkili ve tekrarlanabilir protokollerine sahip olmasıdır. Agrobacterium yönteminin dezavantajları ise sürecin yavaş ilerlemesi ve bitkilerde bilinmeyen genetik ifadelere sebep olabilecek gereksiz vektörlerin aktarılabilir olmasıdır (Barampuram ve Zhang, 2011; Rivera ve ark., 2012; Rivera ve ark., 2014).
6
2.3.2. Biyolistik Yöntem (Gen Tabancası)
Biyolistik yöntemde partikül tabancasıyla, yaklaşık 1-2 μm oyuta sahip altın veya tungsten parçalarına yapıştırılmış DNA parçalarının itici kuvvet olarak helyum gazı ile bitki hücre ve dokularına atış yapılmaktadır (Demir, 2017). Biyolistik yöntemin en önemli avantajları kolay uygulanabilir olması, hücre duvarında herhangi bir işleme gerek duyulmadan yapılabilir olması, birçok hücre için uygun olmasıdır. Hücrenin fizyolojik özelliklerinden bağımsızlığı ve çoklu transgen aktarımının mümkün olması bu yöntemi daha kullanılır bi hale getirmektedir. Biyolistik yöntemin dezavantajlarından ön önemlisi ise pahalı olmasıdır. Aktarılmak istenen genin birden fazla kopyalsının aktarılmasına ait risk taşıması, transformasyon veriminin düşük olması, optimizasyon gerektirmesi, DNA ve hücrelerin hasar görebilir olması gibi bir çok dezavantajıda bulunmaktadır(Barampuram ve Zhang, 2011; Rivera ve ark., 2012; Rivera ve ark., 2014).
2.3.3 Elektroporasyon Yöntemi
Fromm ve arkadaşlarının araştırmalarına göre elektroporasyon yöntemi hücre membranında uygulanan elektirik alanı nedeniyle polarite değişimine sebep olunması ve bu sayade hücre membranında porların oluşumuna sebep olunması prensibine dayanır. Oluşan porlardan DNA’nın hücrelere girişini kolaylaştırılmış olunur (Fromm ve ark., 1985; Saulis ve ark., 1991). Bu yönteminin en önemli avantajları tüm bitki protoplast çeşitlerine uygulanabilir olmasıdır. Çeşitli hücre tiplerinde kullanılabilirliğinin kolay olması, hızlı olması ve ucuz olması büyük bir avantajdır.Elektroporasyon Yönteminde Avantajları olduğu gibi dezavantajlarıda vardır. Bunlar ise zahmetli protokollerinin olması, çoğunlukla protoplastlara uygulanması ve transformasyon veriminin düşük olmasıdır(Barampuram ve Zhang, 2011; Rivera ve ark., 2012; Rivera ve ark., 2014).
2.3.4 Ultrason yöntemleri
Bir diğer yöntem olan ultrasyon yöntemi bitki protoplastlarına ya da bitki hücrelerine hedef genlerin aktarılması için kullanılan bir yöntemdir (Joersbo ve Brunstedt, 1992; Trick ve Finer, 1997). Bu yöntem bitkiye uygulanan ultrasonik dalgalarla hücre zarının geçirgenliğinin değiştirlmesi prensibine dayanır. Böylece DNA’ya karşı daha geçirgen hale gelen hücre DNA’yı içeri alır (Miller ve ark., 2002; Liu ve ark., 2006). Ultrasyon yönteminin avantajları yüksek verime sahip olmasıdır. Yüksek bir maaliyete sahip değildir. Farklı hücre tiplerine de
7
uygulanabilir. Bu yöntemin en önemli dezavantajı ise hücre zarını parçalayarak hücrelere zarar vermesidir(Barampuram ve Zhang, 2011; Rivera ve ark., 2012; Rivera ve ark., 2014).
2.3.5. Mikroenjeksiyon Yöntemi
Mikroenjeksiyon yönteminde akraılmak istenen DNA mikro kapiler pipet yardımıyla bitkiye aktarılır (Crossway ve ark., 1986; Rao ve ark., 2009). Mikroenjeksiyon yönteminin deavantajlarından biri işlem için kullanılan pipetin maliyetli olmasıdır. Bu pipet DNA’nın hücre çekirdeğine girmesi için kullanılan özel bir pipetdir (Rao ve ark., 2009). Bu işleme maruz bırakılmış hücreler işlem sonrası doku kültürü sistemine aktarılarak bitki oluşturması sağlanır (Barampuram ve Zhang, 2011). Mikroenjeksiyon yöntemi en önemli avantajlarından birisitransformasyon verimininçok yüksek olmasıdır. Diğer bir avantajı ise plazmidlerin ve bütün kromozomların aktarılmasına çok iyi olanak sağlamasıdır. Bu yöntemin dezavantajları ise pahalı, çok zahmetli ve yavaş olmasıdır(Barampuram ve Zhang, 2011; Rivera ve ark., 2012; Rivera ve ark., 2014).
2.3.6. Silikon karbid fiberler Yöntemi
Silikon karbid fiberler yöntemi gen aktarımı için maliyeti düşük bir yöntemdir. Ucuz olmasına rağmen kompleks bir yöntemdir. Bu uygulama için çok fazla ekipman ve yeteneğe de gerek yoktur (Kaeppler ve ark., 1990; Hassan ve ark., 2016). Gen aktarımı yönteminde kullanılan silikon karbid elyaflar genellikle 10-80 mm uzunluğa ve 0.6 mm çapa sahip sert materyallerden üretilmektedir (Rakoczy-Trojanowska, 2002). Silikon karbid fiber yönteminin en iyi avantajları; kolay, hızlı, düşük maliyetli ve de farklı hücre tiplerine uygulanabilir olmasıdır. Silikon karbid fiber yönteminin dezavantajı ise verimin çok düşük olması, hücrelerin zarar görerek rejenerasyon yeteneklerininazalması ve fiberlerin solunmasının araştırmacılarazararlı olmasıdır (Barampuram ve Zhang, 2011; Rivera ve ark., 2012; Rivera ve ark., 2014).
2.3.7. Cam boncuklarla çalkalama Yöntemi
Cam boncuklarla çalkalama yönteminde gen aktarılmak istenen hücreler spesifik DNA’yı taşıyan cam boncuklarla beraber çalkalanır (Macar ve ark., 2017). Cam boncuklarla çalkalama yönteminin avantajları kolay, hızlı ve düşük maliyetli olmasnın yanı sıra, cihaz ve çözeltilere gerek duyulmadan uygulanmasıdır. Bu yönteme ait dezavantaj ise silikon karbid fiber
8
yönteminde olduğu gibihücrelere zarar vererek rejenerasyon yeteneklerini düşürmesidir (Barampuram ve Zhang, 2011; Rivera ve ark., 2012; Rivera ve ark., 2014).
2.3.8. PEG Yöntemi
Macar ve arkadaşlarına göre bu yöntem bitkilerde var olan bazı genlerin protein aracılığıyla susturulması prensibine dayanır (Macar ve ark., 2017). Geçici gen transformasyonunun avantajlarından en önemlisi diğer transformasyon yöntemlerine göre daha hızlı olmasıdır. (Baur ve ark., 2005). Bu nedenle polietilen glikol (PEG) aracılığıyla gerçekleştirilen protoplast transfeksiyonu en yaygın kullanılan yöntemlerden biridir (Baur ve ark., 2005;Tan ve ark., 2013; Wang ve ark., 2015). PEG yönteminin avantajlarından en önemlisikolay olması ve pahalı ekipmana ihtiyaç duyulmamasıdır. PEG yönteminin dezavantajları ise transformasyon veriminin düşük olması ve transformasyonda protoplastlar kullanılmasından dolayı gen aktarılmış olan protoplastların tam bir bitki oluşturmak üzere rejenerasyonundaki zorluklardır (Barampuram ve Zhang, 2011;Rivera ve ark., 2012; Rivera ve ark., 2014).
2.3.9. Lazer Mikroışınlar Yöntemi
Lazer mikroışınlar yöntemindegenetik materyaller hücrelerin içine lazer mikro ışınları kullanılarak sağlanır. Lazer mikro ışınlar yönteminin en önemli avantajlarından biriprotoplastın bitkiyi yeniden oluşturamayacak kadar kırılganlığının üstesinden gelebilmesidir. Ayrıca bu yöntem ile bitkiye ait çeşitli organellerde ve DNA moleküllerinin üzerinde bile çalışmalar yapılabilmektedir (Rivera ve ark., 2012).
2.4.GDO’nun Dünyadaki Yeri
Dünyada bazı bölgelerde tarım alanında kullanılan GDO’lu ürünler fazla iken bazı bölgelerde bu kullanım oldukça azdır. GDO’nun yaygın kullanılıdığı ülkeler genellikle Amerika ve Güneydoğu Asya kıtası iken, Avrupa ve Afrika kıtasında kullanım sınırlıdır (James, 2013). Transgenik organizma üretimi yapan ülke sayısı 2011 yılında 29 iken bunların 19 tanesi gelişmekte olan ülkelerdi. Bunun 10 adedi ise zaten gelişmiş ülkedir. GDO üretimi fazla olan ülkeler 1 milyon hektardan fazla alanda ürün yetiştirmiştir. Bir önceki yıl ile karşılaştırıldığında 2011 yılında %8’lik veya 1,3 milyon GDO üretiminde artış gözlenmiştir. İlave üreticilerle birlikte toplam 16,7 milyon üretici üretim yapmıştır (ISAAA, 2011). 2014 yılına bakıldığında ise 27 ülke ve 18 milyon üretici ile GDO üretim yapılan alan 181,5 milyon hektara ulaşmıştır (ISAAA, 2014).
9
GDO’lu ürün üretiminde önemli bir yere sahip olan ilk 5 ülke; Amerika Birleşik Devletleri, Hindistan, Çin Halk Cumhuriyeti, Brezilya ve Arjantin’dir. Örneğin, genetiği değiştirilmiş pamuk (Bt pamuk) üretimi 2011 yılında toplam pamuk ekim alanının % 88’dir (ISAAA, 2011). GD pamuk için Çin Halk Cumhuriyeti’ne bakıldığında toplam pamuk alanının % 71,5’ini kaplamaktadır (ISAAA, 2011).
GD pamuk ilk olarak 1996 yılında ABD’de piyasaya sürülmüştür. 2019 yılı itibariyle toplam 63 gen bölgesinde değişiklik yapılmaktadır. Bu genlerden 37 adedi piyasada mevcut olarak bulunmaktadır.25 adedi de ise aktif değildir. Bu genlerin kullanım amaçları ise şu şekidedir; Herbisit toleranslılığı, böcek dirençliliği veya herbisit toleransının aynı anda veya tek tek kullanılmasıdır.
Şu an Hindistan Dünya üzerinde en büyük pamuk üreticisi ünvanını almıştır. Bt pamuk sayesinde ülkede 2002-2008 yılları arasında ekonomik kazanım 5.1 milyar ABD doları olmuştur. Aynı zamanda genetiği değiştirilmiş pamuk insektisit kullanımını da yarı yarıya azalttığı görülmüştür. Üretimin artmasıyla Hindistan pamuk ithal eden ülkeden ihraç eden ülke konumuna geçmiştir. Hindistan dışında Güney Afrika, Burkina Faso ve Mısır Arap Cumhuriyeti de GD pamuk üretimi yapan ülkelerdir (ISAAA,2009).
2016 yılında Dünyada pamuk üretimi; 32 milyon hektardır. Genetiği değiştirilmiş pamuk üretimi ise 24 milyon hektar olmuştur. Bunun 11.6 milyon hektarınıHindistan, 3.6 milyon hektarıÇin, 3.4 milyon hektarıABD,2.9 milyon hektarı Pakistan, 2.5 milyon hektarıArjantin, Avustralya, Brezilya, Burkina Faso, Kolombiya, Kosta Rika, Meksika, Miyanmar, Paraguay, Güney Afrika ve Sudan.
Ülkemizde ise genetiği değiştirilmiş organizmalar ile hertürlü işlem (üretim, ihracat, ithalat ve ekim gibi) 2010 yılında yayınlanan 5977 nolu Biyogüvenlik Kanununu ve bu kanuna ait yöentmelik ile düzenlenmektedir (Biyogüvenlik Kanunu, Kanun No 5977, 2010). Ayrıca, 2014 yılında yapılan düzenlemeyle eşik değer belirlenmiş ve %0,9 değerin üzerinde GD içeren ürünlerin etiketlemesine karar verilmiştir (Gıda, Tarım ve Hayvancılık Bakanlığı Yönetmelik, 2014). Ülkemizde özellikle beyaz et ve sanayicilerinin talepleri doğrultusunda 2011 yılından itibaren Biyogüvenlik Kurulunun almış olduğu kararlarda bazı genetiği değiştirilmiş soya ve mısır çeşitlerinin sadece hayvan yemi olarak kullanımına izin verildiği durumlar görülmektedir (Türkiye Biyogüvenlik Bilgi Değişim Mekanizması, 2019).
10
2.5.GDO Tespit Metodları
Genetiği değiştirilmiş organizma analizleri DNA ve protein bazlı metotlar olmak üzere iki temelde toplanır (Ahmed, 2002). Protein temelli analizlerde ELISA ve bioassay yöntemleri aktarılan genin nihai ürünü olan protein tayini yapılmakta iken DNA temelli metotlarında doğrudan aktarılan genlerin tayini yapılmaktadır. Biktiye aktarılan genin her zaman ifade edilmemesi, bazı durumlarda çeşitli stres koşullarında ekspres edilmedi durumu nedeniyle DNA temelli GDO analizleri daha yaygın olarak kullanılmaktadır (Macar ve ark., 2017).
2.5.1. Protein-Temelli Yöntemler
Protein temelli yöntemler gen tarafından ifade edilen yeni ve özgün proteinlerin tespitini sağlamada kullanılan yöntemlerdir. Antikor ve antijenin ilişkisinden yola çıkarak özgün bağlanma prensibine dayanan immünolojik testlerin başında Enzim Bağlı Immunosorbent Testi (ELIZA,Enzyme-Linked Immunosorbent Assay (ELISA)) gelmektedir. Bu yöntem antikor ile bağlanması neticesinde oluşan renk değişiminin tespit edilmesidir. ELIZA testi genel düşük maliyetli olmakla birlikte, daha hızlı sonuç vermektedir. En büyük dezavantajlarından birisi sıcaklığın işlem sırasında protein yapısına geri döünüşü olmayan zarar verebilmesidir ve buna bağlı olarak işlenmiş gıdalar üzerinde iyi çalışamamasıdır. Ayrıca bir diğer dezanvantajı hali hazırda ticari kitlerin gün geçtikçe yeni üretilen ürünlere cevap verememesidir. Özgün antikor emdirilmiş kâğıt şeritlerin (lateral flow strip) kullanılması ise diğer bir yöntemdir. Temel prensip yine gen ürünü porteinin tespitidir (Ahmed, 2002).
2.5.2. DNA-Temelli Yöntemler
DNA-Temelli yöntemler transgenik dizi olarak aktarılan DNA’nın doğrudan tespitine dayalı yöntemlerdir. Bu yöntem daha protein temelli yöntemlerle karşılaştırıldığında hala en sık kullanılan yöntem olma özelliğine sahiptir. Genetik mühendisliği yöntemlerinin kullanımı ile üretilmiş gıda ürününün tespitinde kullanılan ilk resmi yöntemdir. Dışarıdan aktarılan DNA’nın kendine özgü primerler ile amplifikasyonunu temel almaktadır. Bu yöntem Almanya Federal Gıda ürünlerinin Resmi Yöntemler Koleksiyonunda 35. makale başlığı altında 1993’de yayınlanmış ve 1998 yılında basılmıştır (Anonim, 1998). Uzun yıllardan beri gıda üretiminde kullanıldıklarından çeşitli GB bitkiler için standart Polimeraz Zincir Reaksiyonu (PZR) temelli yöntemler geliştirilmiştir. Tespit çalışması yapılan laboratuvarlarda genellikle iki farklı durum ortaya çıkmıştır. Birincisi, numunenin genetik olarak işlenmiş
11
bileşenler içerip içermediği üzerine odaklanan sorulardır. İkincisi ise, örnekte tespit edilen bir genetik değişimin miktarının belirlenebileceği laboratuvar ihtiyacına yöneliktir. Her iki sorunun yanıtı ise hedef DNA’nın var ya da yok olası durumuna cevap veren ya da miktar belirleyebilen yömntemlerin varlığıdır. Bu aşamada DNA temelli analizlerde ilk basamak olan DNA izolasyonu oldukça önemlidir. Birinci durumda, GD vakalarının tamamında veya çoğunda ortak olan bölgeye bakılırken ikinci durumda, aktarılan nükleotit dizisinin tespit etmesidir. Miktar tayini ise Real-Time (RT-PZR, Gerçek zamanlı PZR) veya kinetik PZR ile elde edilmektedir (Holst-Jensen ve ark., 2003).
2.5.2.1. Kalitatif Sistemler
Genetiği değiştirilerek elde edilen ürünlerin ilk önce tanımlanması ve doğrulanması gerekmektedir. Bunun için ilk olarak bitki DNA’sına özgün dizinin PZR yöntemi ile çoğaltılması gerekmektedir. Gerçekleşen doğrulama testlerinden sonra aşağıda açıklanan 4 kategori ile sınıflandırılabilmektedir (Anklam ve ark., 2002; Holst-Jensen ve ark., 2003)
2.5.2.1.1. Tarama yöntemleri
Gıda ürünlerinde ilk önce GDO’ların varlığını belirlemek için gerçekleştirilen ve ilk adım olarak adlandırılan ve uygulanan tarama işlemlerinde kalitatif PZR yöntemleri kullanılmaktadır. DNA dizilerinde yeni özelliği kodlayan genlerin, seçicilik sağlayan genleri ve promotör veya terminatör bölgeleri tarama amacıyla PZR çalışmaları için hedef bölgelerdir. PZR yönteminde hedef dizilerden sıklıkla çalışılanlar; Cauliflowermosaic virüsünde bulunan ve çoğu GDO konstraktında güçlü yapısal transkripsiyon promotörü olarak kullanılan 35S promotör (P-35S) ve/veya Agrobacterium tumefaciens’deki NOS (nopalinsentaz) terminatörüdür (T-Nos). Bunların yanında, en yaygın olarak kullanılan klonlama vektörleri arasında pBR322 ve pUC19 gibi vektörler kullanılmaktadır (Holst-Jensen ve ark., 2003).
2.5.2.1.2. Gene özgü yöntemler
Bu yöntemde hedeflenen gen için PZR yöntemleri diğer yönteme göre daha özgündür. CaMV 35S promotör, nos terminatör veya nptII genlerinin taraması yeterli olmadığından GDO ürünlerin taranması için aktarılan gene özgü bölgelerin taranması gerekmektedir. Bu yöntemde uygun genlerin seçimi önemlidir. Normalde bu yöntemlerinin kullanımı sonucunda alınan pozitif sonuç değiştirilmiş DNA’yı vurgulamaktadır. Tarama sonuçlarının kullanımıyla
12
GDO’nun kendisinin tanımlanması mümkün olmadığından, aktarılan hedef DNA dizisi, ileri PZR çalışmalarında kullanılmaktadır (Anklam ve ark., 2002; Holst-Jensen, 2009).
2.5.2.1.3. Konstrakta özgü yöntemler
Konstrakta özgü yöntembirbirine komşu olan en az iki genetik elementin sınırını kapsayacak şekilde yeni dahil edilmiş DNA bölgesini kullanarak gerçekleşen bir yöntemdir. Bu işlemde ilgilenilen gen bölgesi ve promotör arasında olduğu gibi gen konstraktındaki bitişik elementler arasındaki kesişmeleri baz alınmaktadır. Pozitif bir sinyal yalnızca genetik değişiklik içeren materyalin varlığında ortaya çıkmaktadır. DNA’nın değişiklik kaynağının belirlenmesinde, gene özgü yöntemlerden çok daha başarılıdır. Fakat aynı gen konstraktının birden fazla GD numunesinde bulunma ihtimali devardır. Örneğin; MON 809 GD mısırda; pV-ZMBK07 ve pVZMGT10 transfer edilmişken, MON 832’de pVZMGT10 plazmidi bulunmaktadır (AgBios, 2008).
2.5.2.1.4. Vakaya özgü yöntemler
Vakaya özgü yöntemler ile GDO’ların anlamlı bir şekilde tanımlanabilmesi, primer seçimi bahsi geçen genetiği değiştirilmiş organizma için özgün olan hedef diziler için primerler belirlenmesine dayalıdır. Gerçekleşen transformasyon olayının en belirgin özelliği alıcı genom ile eklenen DNA arasındaki integrasyonlokusundaki bağlantılı olmasıdır. Bu bağlantı vakaya özgü yöntemleri oluşturmaktadır. Bütünleşmiş gen ve konak organizma genom DNA’sı arasındaki özgün birleşme dizilerini temel alan bir yöntemdir. PZR-temelli yöntemler arasında multipleks ve nested PZR teknikleri bulunmaktadır. Nested PZR; farklı primer setleri ile birden fazla amplifikasyona dayanmaktadır. Bu yöntem ayüksek hassasiyetle özgün olmayan amplifikasyonları azaltmaktadır.Bir farklı yöntem ise multipleks PZR olup tek bir reaksiyonda iki ya da daha fazla hedef dizinin çoğalmasına olanak sağlayan kullanışlı bir yöntemdir. Bu sayede GDO’ların oldukça hızlı, tekrarlanabilir ve ekonomik bir şekilde kısa sürede tespitini mümkün kılar. Multipleks PZR yöntemi ile birden fazla transgenik vaka kısa sürede belirlenebilmektedir. Bu yöntemin en basit örneği mısır ve soya bitkisinden elde edilen gıdalarda genetik değişikliğin tespiti için Cry1Ab ve EPSPS genlerinin birlikte analizine olanak sağlamaktadır. Bunun dışında aynı reaksiyonda sekiz faklı genetik değişiklik de çalışılabilmiştir (Dinon ve ark., 2010). Bu yöntemin kullanılabilirliğini yükseltmek için son zamanlarda hassaslığı ve tekrarlanabilirliği arttırmak amacıyla, RT PZR, mikroarray,
13
biyosensör gibi farklı bazı kalitatif ve/veya kantitatif yöntemler ile birlikte kullanılmaktadır (Shrestha ve ark., 2010).
2.5.2.2. Kantitatif Sistemler
Geçerliliği kabul görmüşkalitatif yöntemlerin kullanımı sonucunda eğer GDO’ya özgü DNA bulunamamış ise, gıda ürününün etiketlenmesine gerek yoktur. Fakat bir ürününiçerisinde GDO içerdiği gösterilmişse, bunu takip eden basamak kantifikasyonunun sağlanmasıdır. Kantifikasyon gıdalarda GDO’ların analizlerine ait en önemli konudur. Bunun sebebi ise gıdalardaki GDO’ların maksimum limitinin ülkemiz ve Avrupa Birliği’nde etiketleme için temeli olmasıdır (La Paz ve ark., 2007). Bu işlem sıklıkla RT-PZR kullanımı ile gerçekleştirilmektedir. Kantifikasyon sayesinde kalitatif ve kantitatif analizler yapılmakta, birden fazla örnek minimum kontaminasyon riskiyle güvenle çalışılabilmektedir. PZR ürün miktarlarının tayini için çeşitli formatlar uygulanmaktadır: (i) çift zincir DNA bağlanma boyası, SYBR Green I; (ii) hibridizasyon veya Florasan Rezonans Enerji Transfer(FluorescenceResonanceEnergy Transfer (FRET)) propları; (iii) hidroliz probları (TaqMan®); ve (iv) moleküler işaretleyiciler. Gıda ürünlerinin genetik değişikliğin yüksek kalitede belirlenmesi için genellikle florasansbağlantılı RT-PZR kullanılmaktadır. Gıdada doğrudan veya dolaylı olarak kullanılan numunelerde GDO kantifikasyonu alanında en yaygın olarak kullanılan yaklaşım raportör (reporter) ve baskılayıcı (quencher) boya bağlanmış oligonükleotitten oluşan florojenik bir prob kullanan Taqman® veya 5 -ekzonükleazlardır. 5 ucunda FAM (5’carboxyfluorescein- karboksifloresin) veya HEX/VIC, 3 ucunda TAMRA (6-karboksitetrametilrodamin) ile işaretlenen TaqManprobları genellikle kullanılmaktadır.
2.6.Gıda Ürünlerinde GDO Tespiti
Dünya çapında GDO kullanılarak elde edilen gıdaların kullanım alanlarında her geçen yıl olağanüstü bir artış gözlenmektedir. GDO’lu ürünlerin artışı aynı zamanda insanlığın güvenlik endişesini artmasına sebeb olmuştur. Buna bağlı olarak tüketiciler GDO kullanılarak elde edilen ürünler için ve bu ürünlerden elde edilen gıdaların dolaylı yollarla kullandıkları ürünlerin hakkında kendilerinin de bilgilendirilmesi hakkında bi öngörüde bulunmuşlardır. Günümüzde tüketicilerin bilinçli olması gıda güvenliğinde daha fazla gıda kalite kontrol ihtiyacını doğurmuştur. Avrupa Birliği komisyonun aldığı karara göre GDO kullanılarak elde edilen ve belirlenebilir miktarlarda DNA içeren gıda ürünlerinde içeriklerin etiketlenmesi
14
zorunlu hale getirilmiştir (miktar % 0.9 değerini aşarsa). Ülkemizde ise GDO 2010 yılında
yayınlanan 5977 no'lu Biyogüvenlik Kanununu ile düzenlenmektedir. GDO kullanılarak elde edilen gıdaların tespiti amacı ile gerçekleştirilen çalışmalarda; Referans Materyal ve Ölçüm Enstitüsü (IRMM, The Institute for Reference Materials and Measurements, Belçika) tarafından üretilmiş, farklı oranlarda genetik değişiklik içeren sertifikalı referans materyal (CRM, Certified Reference Material) pozitif ve negatif kontroller olarak kesinlikle kullanılmalıdır (Yoshimura ve ark., 2005).
GDO kullanılarak elde edilen gıda ürünlerinin doğrudan veya dolaylı olarak analizi için belirli basamaklar bulunmaktadır. Bunlar sırasıyla; analiz edilecek üründen belirlenen miktarda numune alınması, numunenin homojenize edilmesi, izolasyon ve saflaştırmanın yapılması, saflaştırılan DNA’nın analizi, pozitif sonuç alındığında kantitatif analizin yapılmasıdır. Analiz yöntemleri her gıda için çeşitlilik gösterse bile temelde protein ve DNA temelli test olmak üzere iki temel yöntem kullanılmaktadır. Bu yöntemler dışında spektrofotometrik teknikler, mikrodizi, biyoçip, biyosensör, genarrayleri, mikroarray gibi yöntemlerin gelişimi halen devam etmektedir (Querci ve ark., 2010). Günümüzde yeni nesil teknolojiler olarak adlandırılan bu yöntemlerle aynı anda bir değil binlerce genin ekspresyonu ölçülebilmektedir. Bunun dışında karşılaştırılabilmekte ve elde edilen sonuçlar çeşitli bilgisayar algoritmaları ile sınıflandırılabilmektedir. GDO’lu gıdaların belirlenmesinde biyoçiplerin kullanımına yönelik ilk çalışmalardan biri 2002 yılında Feriotto ve arkadaşları tarafından yayınlanmıştır. Roundup Ready soya bitkisinde hedef gen ve lektinin dizisini içeren biotinli tek zincir oligonükleotidler sensör çiplerin iki farklı kuyucuğuna immobilize edilmiştir (Feriotto ve ark., 2002).Oligonükleotid problar bu çipler üzerine eklenmiş ve oluşan reaksiyonlar sonucunda GDO içeren soya örnekleri, kısa bir sürede hızlı bir şekilde tespit edilebilmiştir. Kullanılan diğer bir yöntem ise Mikroarray teknolojisi temelli yöntemdir. Bu yöntemçiplerden esinlenerek geliştirilmiş olup tarama ve aynı zamanda tanımlama işlemini aynı anda yapabilmektedir. Temel olarak, araştırılmak istenilen numunede istenilen gen dizisinin tamamlayıcısının varlığının belirlenmesi temeline dayanmaktadır. Avrupa Birliği tarafından ticarileştirilmelerine izin verilen 9 farklı GDO’lu ürün eş zamanlı taranabilmesi amacıyla geliştirilen mikroarrayde, spesifik problarla, amplifiye edilmiş hedef dizilerin hibridizasyonu gerçekleştirilmiştir (Michelini ve ark., 2008). Son yıllardaise üzerinde oldukça fazla durulan manyetik boncuk esaslı yöntemle iki renkli Floresan Çapraz Korelasyon ilişkili Spektroskopi (Fluorescence Cross Correlation Spectroscopy (FCCS)) tekniğinin kullanımı GDO’nun hızlı tespiti için tanımlanmıştır. Başka bir yöntem olan Luminex xMAP teknolojisi yüz farklı renk
15
setine sahip floresan bilyelerin kullanımı esasına dayanmaktadır. Bu yöntem PZR ile çoğaltılan DNA’nın farklı renkteki bilyeler ile muamele edilmesi ve hibridizasyonunu içerir Fakat bu teknolojinin şimdilik sadece p35S ve epsps gibi sınırlı sayıda genetik değişimi belirleyebilmektedir. Yeni nesil teknolojilerde bir diğeri ise omiks yaklaşımları hedef alan ve GD metabolitlerin veya proteinlerin arandığı kütle spektroskopisi (MS) esaslı teknolojidir. Bu yöntemlerin DNA ve protein esaslı diğer geleneksel yöntemlerle kıyaslandıklarında yüksek teknoloji içeren pahalı cihaz sistemlerine ihtiyaç duyduklarından dolayı şuan için GDO analiz laboratuvar çalışmalarına henüz dâhil olamamaktadır (Garcia-Canas ve ark. 2008).
2.7. Gıda Örneklerinden DNA İzolasyonu
DNA izolasyonu; GDO organizmaların ve GD içeren gıda ürünlerinin analizlerinde ilk ve en önemli basamak olarak başrollerdedir. DNA izolasyonu, çapraz kontaminasyona izin vermeden tek parça ve yüksek verimde DNA elde etmek, daha sonra yapılacak olan analizlerin başarısında önemli bir yere sahiptir. Bu çalışmanın en önemli özelliklerinde biri, yüksek moleküler ağırlıklı DNA'nın, pamukyağından yüksek verimle elde edilmesidir. Bunun dışında önemli olan bir diğer faktör ise daha sonraki analizler için yüksek saflıkta ve verimde DNA sağlanması için etkili ve pahalı olmayan bir protokol oluşturmaktır. Bu uygulananın amacı, moleküler belirteçlerle PZR ile amplifiye edilebilen ve hedeflenen bir DNA'yı yüksek verimde ve pahalı olmayan bir yöntemle izole etmektir. Şuan gıda analizi yapan laboratuvarlarda ticari kitler, özellikle QIamp DNA kiti (Qiagen), Gene Elute Bitki Takımı (Sigma), Nucleospin Food ve Nucleospin kullanılarak pozitif sonuçlar elde edilmektedir. Ama bunun dışında bir takım olumsuzluklarda zaman zaman gözlenmektedir. Bu olumsuzluklar DNA bozunumu, düşük verim ve safsızlıkların varlığı gibi bir dizi problemdir. Dolayısıyla, sonuçların sonraki aşamalarda tekrarlanabilirliğini etkilediği birçok çalışma ortaya çıkmıştır (Agrimonti ve ark., 2011). İlk denemelerde klasik prosedürlerden bazıları kullanılmıştır ve piyasada kullanılan kitlerin tekrarlanabilirliğinin fazla olduğu kanısına varılmıştır (Doyle ve Doyle, 1987; Busconi ve ark., 2003; de la Torre ve ark., 2004; Testolin ve Lain, 2005; Muzzalupo ve ark., 2007; Spaniolas ve ark., 2008; Ben-Ayed ve ark., 2009; Costa ve ark., 2010;Giménez ve ark., 2010; Rabiei ve ark., 2010; Spaniolas ve ark., 2010). Fakat geri kazanılan DNA’da bozulmalar gözlenmiştir ve bu bozulmalar bir sonraki işlemlerin başarısını oldukça fazla etkilemektedir. Başka bir çalışmada ise kit yöntemlerinin dışında manuel bir yöntem olan CTAB yöntemi kullanılmıştır. Bu yöntemde diğerine göre daha yüksek verimde DNA elde edilmiştir (Giménez ve ark., 2010). CTAB-hekzan-kloroform protokolünde izole
16
edilen DNA ise yüksek molekül ağırlığına sahip parçalanmamış ve SSR analizine uygun DNA eldesini sağlamıştır. Bu çalışma sonucunda CTAB-heksan-kloroform protokolünün mevcut protokollere göre daha avantajlı olduğu kanısına varılmıştır.
2.8. Pamuk Yağı
Pamuk yağı pamuk tohumlarının sıkılmasıyla elde edilen ve kendine has tadı ve kokusu olan, bitkisel bir yağdır. Yağ içeriği % 30-40 arasında değişen tohumlardan elde edilir. Ülkemizde pamuk yağının kullanım alanı genellikle margarin hammaddesidir (Anonim b, 2019).
Pamuk, yağ üretimi yönünden soya fasulyesi, palm, kolza ve ayçiçeğinden sonra beşinci sırada bulunmasına rağmen protein kaynağı olarak önemli bir yere sahiptir. Soya fasulyesinden sonra ikinci sırada yer almaktadır. Pamuk yağı üreten ülkeler arasında başta Çin, Hindistan, Amerika ve Türkiye gelmektedir. Dünya pamuk yağı ithalatının % 45’ten fazlası Amerika tarafından karşılanmaktadır. Çin de dünya ithalatının % 5 - % 6’sını karşılayan önemli bir ithalatçıdır (Fidan ve ark., 2009).
2.8.1 Dünya’da Pamuk
İlk olarak 1996 yılında ABD’de piyasaya sürülen GD pamuk, 2017 yılı itibariyle toplam 59 gen bölgesinde değişiklik yapılmaktadır. Bu genlerden 38 tanesi piyasada mevcut olarak bulunmaktadır. Kullanım amaçları başlıca şu şekildedir; böcek dirençliliği, herbisit toleranslılığı veya herbisit toleransı ve böcek dirençliliğin aynı anda kullanılmasıdır. 2019 yılı itibariyle toplam 63 gen bölgesinde değişiklik yapılmıştır. Piyasada mevcut olarak bulunan 38 genin kullanım amaçları genellikle herbisit toleranslılığı böcek dirençliliği veya bitkinin dayanıklılığını arttırmaktadır. Uluslararası Pamuk Danışmanları Komitesi (International Cotton Advisory Committee, ICAC) tarafından belirtilen raporlara göre, dünyada pamuk üretimi 2017/18sezonunda 26.8 milyon tona iken, 2018/19 sezonunda çeşitli faktörler nedeniyle 26.3 milyon ton’a olacağı düşünülmektedir (Anonim a, 2019)
2018’da Dünyada pamuk üretimi; 5,9 milyon hektar iken genetiği değiştirilmiş pamuk üretimi 24 milyon hektar olarak gözlemlenmiştir. Üreten ülkelerin başında Hindistan (11.6 milyon hektar), Çin(3.6 milyon hektar), ABD (3.4 milyon hektar),Pakistan (2.9 milyon hektar), Arjantin, Avustralya, Brezilya, Burkina Faso, Kolombiya, Kosta Rika, Meksika, Miyanmar, Paraguay, Güney Afrika ve Sudan (2.5 milyon hektar) gelmektedir.
17
2.8.2. Türkiye‘de Pamuk Durumu
Türkiye pamuk ekim alanlarına bakıldığında 2016/17 sezonunda 416 bin hektar iken, 2017/18 sezonunda 502 bin hektardır. 2018/19 sezonuna bakıldığında 525 bin hektar ekim yapılmıştır (Anonim a, 2019). Biyogüvenlik kanun ve yönetmelikler uyarınca ülkemizde GDO ekimi ve üretimi yasak olduğundan GD pamuk üretimi bulunmamaktadır.
2.8.3. Pamuk Yağının Gıdalarda Kullanımı
Pamuk bitkisinin; pamuk yağı, pamuk lifi ve hayvan yemi elde etmek için yetiştirilen en önemli çeşitleri Gossypium hirsutum ve Gossypium herbaceum olmak üzere çeşitli pamuk fideleri yüzyıllardır üretilmektedir.
Pamuk yağı hafif bir tada ve açık bir renge sahiptir. Renk tonu işlenme şekline ve rafine sürecine bağlı olarak değişiklik göstermektedir. Pamuk yağının raf ömrüne uzun olduğundan ambalajlı gıdalarda yaygın olarak kullanılmaktadır. Ayrıca ısıya dayanıklı olması nedeniyle pastacılık sektöründe ve kızartma ürünlerde kullanımı görülmektedir.
18
3. MATERYAL VE METOT
3.1. Çalışmada Kullanılan Materyaller
Çalışma kapsamında kullanılan DNA izolasyon yöntemlerine ait kimyasallar Sigma-Aldrich (St Louis, MO, ABD) firmasından temin edildi. DNA izolasyon kiti innuPrep Food DNA Kit Analytikjena (Almanya) firmasından temin edildi.
Pamuk yağı örnekleri Adana yöresine ait çeşitli firmalardan temin edildi. Sekiz farklı pamuk yağına 1’den 8’e kadar numara verildi.
3.2. Çözeltilerin Hazırlanması
Pamuk yağından DNA izolasyonu için üç manual yöntem(protokol-1,protokol-2,protokol-3) ve bir kit yöntemi kullanıldı.
Cetyl trimethylammonium bromide (CTAB)-hekzan-kloroform yöntemiyle DNA izolasyon protokolü-1 için %2’lik CTAB çözeltisi, %0,5’lik CTAB tampon çözeltisi ve amonyum asetat çözeltisi aşağıda belirtilen şekilde hazırlandı.
%2 CTAB Çözeltisi
1g CTAB tartıldı ve 50 mL distile su içerisinde çözüldü. 10 M amonyum asetat çözeltisi
77,083g amonyum asetat tartıldı ve 100 mL distile su içerisinde çözüldü. % 0,5CTAB tampon çözeltisi;
1,2 g Tris base 8,18 g NaCl 5,84 g EDTA
0,5 g CTAB tartıldı ve 80 mL distile su içerisinde çözüldü ve çözeltinin pH’ı pH 8’e ayarlandı. Çözeltiye 1000µL polyvinylpyrrolidone ve 200 µL merkaptoetanol eklendi ve çözeltinin toplam hacmi 100 mL’ye ayarlandı.
CTAB-merkaptoetanol yöntemiyle DNA izolasyon protokolü-2 için CTAB presipitasyon çözeltisi ve CTAB ekstraksiyon tampon çözeltisi aşağıda belirtilen şekilde hazırlandı.
CTAB presipitasyon çözeltisi; 1 g CTAB
19 0,8 g Tris–HCl
0,3 g EDTA tartıldı ve 80 mL distile su içerisinde çözüldü. Çözeltinin pH’ı pH 8’e ayarlandı ve çözeltinin toplam hacmi 100 mL’ye ayarlandı.
CTAB ektraksiyon tampon çözeltisi; 0,5 g CTAB
1,57 g Tris–HCl 5,8 g EDTA
8,2 g NaCltartıldı ve 100mL distile su içerisinde çözüldü. Çözeltiye % 1 (h/h) b-merkaptoetanol eklendi.
CTABDNA izolasyon protokolü-3 için CTAB tampon çözeltisi, CTAB presipitasyon çözeltisi ve tuz çözeltisi aşağıda belirtilen şekilde hazırlandı.
CTAB tampon çözeltisi; 4 g CTAB 16,4 g NaCl 3,15 g Tris-HCl
1,5 g Na2EDTAtartıldı ve 100 mL distile su içerisinde çözüldü. Çözeltinin pH’ı pH 8’e ayarlandı ve çözeltinin toplam hacmi 200 mL’ye ayarlandı.
CTAB presipitasyon tampon çözeltisi; 1 g CTAB
0,5 g NaCltartıldı ve 100 mL distile su içerisinde çözüldü. Çözeltinin pH’ı pH 8’e ayarlandı ve çözeltinin toplam hacmi 200 mL’ye ayarlandı.
1,2M tuz çözeltisi;
7g NaCl tartıldı ve 100 mL distile su içerisinde çözüldü.
3.3. Pamuk Yağından DNA İzolasyonu
3.3.1. Pamuk Yağından CTAB-Hekzan-Kloroform Yöntemiyle DNA İzolasyon Protokolü (Protokol 1)
20
Bu protokol Raieta ve ark. (2015) tarafından yapılmış çalışmadan alındı.
1. 2 mL’lik tüp içerisine 300 µL önceden ısıtılmış %2’lik CTAB tampon çözeltisi, 300 µL hekzan ve 300 µL pamuk yağı eklendi ve tüp ters düz edilerek karıştırıldı.
2. Tüp 1 saat 20°C’de 14000 rpm’de santrifüjlendi.
3. Yağ fazı atıldı ve sulu faz 65°C’de 30 dakika inkübe edildi.
4. İnkübasyondan sonra sulu faz 15 dakika 20°C’de 14000 rpm’de santrifüjlendi. Sıvı faz ayrı bir tüpe alındı.
5. Pelet 200 µL 0,5% CTAB tampon çözeltisi ve 200 µL fenol içerisinde çözüldü. 6. Karışım 15 dakika 20°C’de 14000 rpm’de santrifüjlendi. Sıvı faz ayrı bir tüpe alındı. 7. Sıvı faza kloroform:izoamil alkol (24:1) eklendi ve 15 dakika 4°C’de 14000 rpm’de
santrifüjlendi.
8. Sıvı faza 2,5 katı kadar soğuk etanol, 0,1 katı kadar amonyum asetat çözeltisi ve 10 µg/mL glikojen eklendi ve tüp ters düz edilerek karıştırıldı.
9. Karışım bir gece -20°C’de inkübe edildi.
10. İnkübasyondan sonra karışım 15 dakika 20°C’de 14000 rpm’de santrifüjlendi. Sıvı faz ayrı bir tüpe alındı.
11. Pelet iki kere 500 µL %70’lik (h/h) etanol ile yıkandı. Santrifüjlendikten sonra kurutuldu.
1. Kuruyan pelet 50 µL steril saf su içerisinde çözüldü. DNA çözeltisi buzdolabında -20°C’de saklandı.
3.3.2 Pamuk Yağından CTAB-Merkaptoetanol Yöntemiyle DNA İzolasyonProtokolü(Protokol 2)
Bu protokol Busconi ve ark. (2003) tarafından yapılmış çalışmadan alındı.
1. 50-100 mL pamuk yağı örnekleri 4°C’de 14000 g’de 30 dakika yaklaşık 0,5 mL ıslak pelet elde edilene kadar santrifüjlendi.
2. Süpernatant atıldı ve ıslak pelet 2 mL’lik tüpe aktarıldı.
3. Tüp 4°C’de 14000 g’de 15 dakika tekrar santrifüjlendi ve yağlı süpernatant dikkatlice atıldı.Pelet sıvı nitrojen ile donduruldu.
4. Daha sonra tüp hemen önceden 65°C’de ısıtılmış su banyosuna daldırıldı. Bu dondur-çöz işlemi iki kere tekrar edildi.
21
6. Pelet eklenen tampon çözelti içerisinde vortekslemeden çözüldü ve 65°C’de 1.5 saat inkübe edildi. İnkübasyon süresi boyunca her 10 dk’da bir yavaşça karıştırıldı.
7. Tüpe 750 µLkloroform:oktanol (24:1 v:v) eklendi ve tüp ters düz edilerek oda sıcaklığında 5 dk karıştırıldı.
8. Tüp oda sıcaklığında 14000 g’de 10 dakika santrifüjlendi ve süpernatant temiz bir tüpe aktarıldı.
9. Tüpe tekrar 750 µLkloroform:oktanol (24:1 v:v) eklendi. Tüp ters düz edilerek oda sıcaklığında 5 dk karıştırıldı, 14000 g’de 10 dakika santrifüjlendi ve süpernatant temiz bir tüpe aktarıldı.
10. 75 µL suda çözülmüş %10’luk CTAB süpernatant üzerine eklendi ve 5 dk karıştırıldı. 11. Tüpe 1.5 hacim katı kadar CTAB presipitasyon çözeltisi eklendi ve 10 dk ters-düz
edilerek karıştırıldı.
12. Tüp oda sıcaklığında 14000 g’de 20 dakika santrifüjlendi ve süpernatant atıldı.
13. Pelet oda sıcaklığında 15-30 dk kurutuldu. Daha sonra 100 µL tuz çözeltisi eklenerek 37°C’de bir saat inkübe edildi.
14. Tüpe 750 µLkloroform:oktanol (24:1 v:v) eklendi ve tüp ters düz edilerek oda sıcaklığında 5 dk karıştırıldı.
15. Tüp oda sıcaklığında 14000 g’de 10 dakika santrifüjlendi ve süpernatant temiz bir tüpe aktarıldı.
16. Süpernatantın 2.5 hacim katı kadar soğuk saf etanol eklendi. Tüp ters-düz edilerek karıştırıldı.
17. Tüp 4°C’de 14000 g’de 15 dakika santrifüjlendi ve üst faz atıldı.
18. Pelet üzerine 1 mL %70’lik etanol eklendi ve tüp 4°C’de 14000 g’de 5 dakika santrifüjlendi.
19. Süpernatant atıldı ve pelet oda sıcaklığında birkaç dakika kurutuldu.
20. Pelet 30-50 µLsteril saf içinde çözüldü ve 65°C’de 10-30 dakika inkübe edildi.
21. Tüp 14000 g’de 5 dakika santrifüjlendi ve süpernatant temiz bir tüpe aktarıldı. Pelet atıldı. DNA çözeltisi buzdolabında -20°C’de saklandı.
3.3.3. Pamuk Yağında CTAB Yöntemiyle DNA İzolasyon Protokolü (Protokol 3) 1. Örnekten 300 mL steril 1,5’lik mikrosantrifüj tüpe aktarıldı.300 mL steril deiyonize su
eklendi ve ters düz ederek karıştırıldı.
2. 500 mL CTAB-tampon çözeltisi çözeltisieklendi ve karıştırıldı. 3. Karışım 16000x g’de 10 dakika santrifüjlendi.
22
4. Süpernatant 500mL kloroform içeren bir mikro santrifüj tüpüne eklendi,30 saniye karıştırıldı.
5. Faz ayrılına kadar 16000x g’de 5 dakika santrifüjlendi.Üst tabaka yeni bir mikro santrifüj tüpüne aktatırıldı.
6. 2 hacim CTAB presipitasyon çözeltisi eklendi ve pipet ilekarıştırıldı.60 dakika oda sıcaklığında inkübe edildi.
7. 16000 x g’de 10 dakika santrifülendi.Süpernatant atıldı.
8. Pelet 350 mL tuz çözeltisinde çözüldü. 350mL kloroform eklendi ve 30 saniye çalkalandı.
9. Faz ayrılana kadar 16000x g’de 10 dakika santrifüjlendi. 10. Üst tabaka yeni bir mikro santrifüj tüpüne aktarıldı. 11. 0,6 hacim izopropanol eklendi ve çalkalandı.
12. 16000x g’ de 10 dakika santrifüjlendi ve süpernatant atıldı. 13. Pelete 500 mL %70 ‘lik etonel eklendi ve dikkatlice karıştırıldı. 14. 16000x g’ de 10 dakika santrifüjlendi ve süpernatant atıldı.
15. Pelet kurutuldu ve 50 µL saf suda içerisinde çözüldü.DNA çözeltisi buzdolabında -20°C’de saklandı.
3.3.4.Pamuk Yağından DNA İzolasyonKitiile DNA İzolasyon Protokolü
Bu basamakta innuPrep Food DNA Kit (Analytikjena, Almanya) kullanıldı.InnuPure® C16 touch otomatik DNA izolasyon cihazı kullanılarak DNA izolasyonu yapıldı.Kit protokolüne göre uygulanan işlemler aşağıda belirtildi.
1. 200 mg gıda örneği tartılarak 2 mL’lik tüplere konuldu.
2. Üzerine 0,5 mL liziz çözelti (lysis solutuion CBV) ve 20 µL proteinaz K eklenerek karıştırıldı ve 65°C’de 1 saat inkübe edildi.
3. İnkübasyon sonrası tüpler 11.000 x g ‘de 10 dakika santrifüj edildi. Süpernatant temiz bir tüpe aktarıldı.
4. Kitle birlikte gelen ve Şekil 3-1’de gösterilen çözelti tüpleri Çizelge 3-1’de belirtildiği gibi hazırlandı.
5. 400 µL lisis çözeltisi içerisinde örnek üçüncü hazneye eklendi.
6. Çözelti tüpleri InnuPure C16 touch örnek tepsisine yerleştirildi ve cihaza yüklendi. 7. Cihaz yazılımından uygun protokol belirlendi ve başlatıldı.
23
8. Protokol tamamlandıktan sonra içerisinde DNA olması beklenen tüpler alındı ve kapakları kapatıldı.
9. Tüpler buzdolabında -20°C’de saklandı.
Şekil 3- 1Kit ile gelen hazır çözelti tüpleri (Reagent plate E)
Reaktif Hazneleri
Reaktifler Reaktif Hazneleri
Reaktifler Hazne 1 Manyetik parçalar Hazne 7 Yıkama çözeltisi
Hazne2 Boş Hazne8 Yıkama çözeltisi
Hazne3 Boş Hazne9 Yıkama çözeltisi
Hazne4 Boş Hazne10 Yıkama çözeltisi
Hazne5 Boş Hazne11 Boş
Hazne 6 Bağlanma çözeltisi Hazne 12 Elüsyon tampon çözeltisi
Çizelge 3- 1Reagent plate E’de bulunan reaktif hazneleri ve reaktifler
3.3.5. Etanol ile çöktürme işlemi
Pamuk yağından her bir yöntemle izole edilen DNA’lar birleştirildi ve etanol çöktürme işlemi ile çöktürüldü.Bu basamak için aşağıda sırasıyla belirtilen işlemler uygulandı.
1. Bir temiz tüp içerisinde toplanan DNA çözeltilerinin üzerine 2 katı kadar soğuk saf etanol eklendi ve -20°C’de bir gece bekletildi.
2. Bir gece bekletilen DNA çözeltileri 20 dakika 11.000 g’de santrifüjlendi ve süpernatant atıldı.
3. Pellete soğuk %70’lik etanol eklendi ve dikkatlice karıştırıldı. Çözelti 15 dakika 11.000g’de santifüjlendi ve süpernatant atıldı.
4. Pellet kurutuldu ve 50 µL saf suda içerisinde çözüldü.DNA çözeltisi buzdolabında -20°C’de saklandı.
24
3.4. Saflık, Konsantrasyon ve Kalite Kontrolü
İzolasyonu yapılan DNA örneklerinin saflığı ve konsantrasyonudüşük hacimli spektrofotometre ile değerlendirildi. Her örnek üçer kez spektrofotometre ile okunduktan sonra sonuçlar ortalama olarak belirtildi. Spektrofotometre ile
260 nm’de ölçüm yapılarak; DNA 280 nm ‘de ölçüm yapılarak; Protein
230 nm ’de ölçüm yapılarak; RNA’nın varlığı değerlendirildi.
260 nm dalga boyundaki absorbans değerinin 280 nm dalga boyundaki absorbans değerine oranı (A260/A280) DNA saflık derecesini değerlendirmek amacıyla belirlendi. Bu oranın; 1.80 olması en saf DNA eldesini,
1.70 – 2.10 olması saf DNA eldesini,
1.00 – 1.70 arasında olması protein kontaminasyonunu, 2.10 – 2.50 arasında olması RNA kontaminasyonunu belirtti. Çift Sarmal DNA (dsDNA) miktarı aşağıdaki formülle hesaplandı. dsDNA (µg/ml)=260 nm’dekiabsorbans x sulandırma kat sayısı x 50
Farklı yöntemlerle izole edilen DNA örneklerinin fragmentasyon durumlarını kontrol etmek amacıyla DNA örnekleri agaroz jel elektroforez tekniği ile incelendi. Bu basamakta, %1’lik agaroz jeli TBE tampon çözeltisinde hazırlandı ve içerisine etidyum bromür eklendi. DNA örnekleri 100 V altında 1 saat jelde yürütüldü ve Jel görüntüleme cihazında jellerin görüntüleri alındı.
3.5 DNA Amplifikasyonu
3.5.1. Primerlerin Belirlenmesi
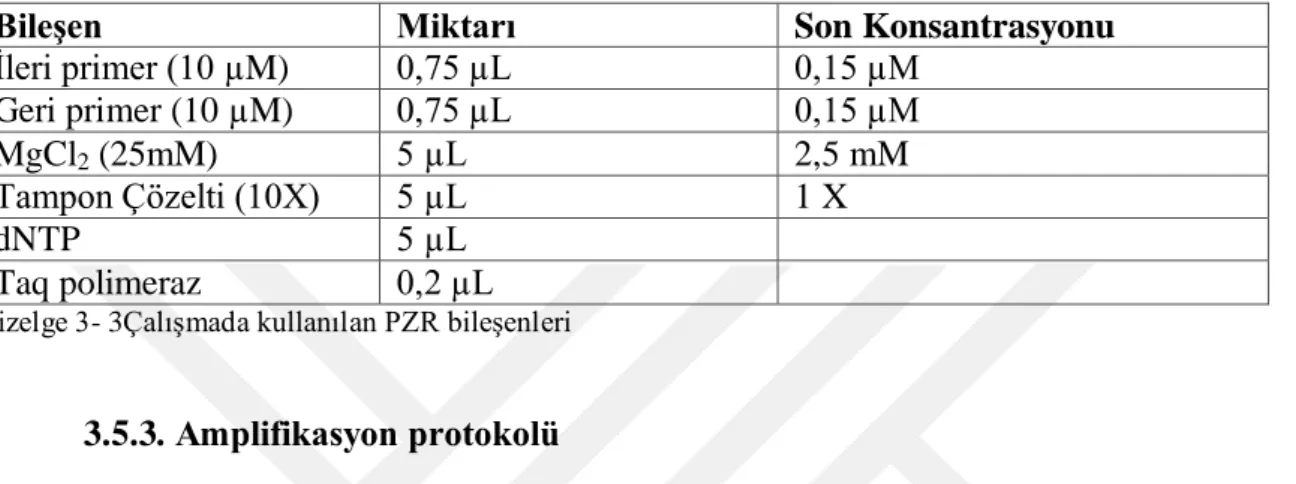
İzole edilen DNA örneklerinin amplifikasyonu için iki farklı primer seti belirlendi. Primerlere ait bilgiler Çizelge 3-2 ‘de belirtildi.
Primerler 5’-3’ dizileri Hedef Gen Bölgesi Kaynaklar acp1-F ATTGTGATGGGACTTGAGGAAGA Pamuk spesifik acyl
taşıyıcı protein 1 kodlayan gen bölgesi (Acp 1)
CRL-GMFF, 2008
acp1-R CTTGAACAGTTGTGATGGATTGTG
P35S-F CCACGTCTCAAAGCAAGTGG 35S promotör bölgesi Lipp ve ark., 2001
25 Çizelge 3- 2Çalışmada kullanılan primerler
3.5.2.PZRReaksiyon Bileşenlerinin Hazırlanması
Dört farklı primer seti için her örneğe ait reaksiyon bileşenleri Çizelge 3-3’debelirtildiği gibi hazırlandı. DNA örnekleri 50 µL’lik reaksiyon çözeltisinde 50 ng olacak şekilde çözeltiye eklendi ve geri kalan kısım su ile tamamlandı.
Bileşen Miktarı Son Konsantrasyonu
İleri primer (10 µM) 0,75 µL 0,15 µM Geri primer (10 µM) 0,75 µL 0,15 µM MgCl2 (25mM) 5 µL 2,5 mM Tampon Çözelti (10X) 5 µL 1 X dNTP 5 µL Taq polimeraz 0,2 µL
Çizelge 3- 3Çalışmada kullanılan PZR bileşenleri
3.5.3. Amplifikasyon protokolü
Pamuk spesifik acyl taşıyıcı protein 1 kodlayan gen bölgesi (Acp 1) için yapılan amplifikasyon çalışmalarında kullanılan PZR protokolü Çizelge 3-4’de verildi.
Program Sıcaklık Süre Döngü Sayısı
Isıtma 50 ºC 2 dakika 1
Ön denatürasyon 95 ºC 5 dakika 1
Denatürasyon 95 ºC 15 saniye 45
Primerlerin DNA’ya yapışma safhası
60 ºC 60 saniye
Uzama safhası 72 ºC 30 saniye
Soğuma 10 ºC - 1
Çizelge 3- 4acp1primer setine ait amplifikasyon protokolü
İzole edilen DNA’ların genetik modifiye bölge içerip içermediğinin kontrolü için seçilen 35S promotör bölgesi için yapılan amplifikasyon çalışmasında kullanılan PZR protokolü Çizelge 3-5’de verildi.
Program Sıcaklık Süre Döngü Sayısı
Ön denatürasyon 95 ºC 10 dakika 1
Denatürasyon 95 ºC 25 saniye 50
Primerlerin DNA’ya yapışma safhası
62ºC 30 saniye
Uzama safhası 72 ºC 45 saniye
Son uzama 72 ºC 7dakika 1
Soğuma 10 ºC - 1
26
3.5.4. Jel Elektroforezi
Amplifikasyon ürünlerinin kontrolü için %4 ‘lük agaroz jel hazırlandı ve 1X TBE tampon çözelti içerisinde 100V 45 dakika jelde yürütüldü. UV ışık altında Jel görüntüleme cihazı ile jellerin görüntüleri alındı.
3.6. İstatistiksel Analiz
Çalışmada tüm yağ örneklerinden her metot için beşer biyolojik tekrarla DNA izole edildi. Biyolojik tekrarların spektrofotometre ile konsantrasyon ve absorbans okumaları her biri için üçer kez yapıldı. Sonuçlar ortalama±standart sapma olarak verildi. Varyasyon katsayısı (CV) aşağıda belirtilen formülle hesaplandı.
𝑣𝑎𝑟𝑦𝑎𝑠𝑦𝑜𝑛 𝑘𝑎𝑡𝑠𝑎𝑦𝚤𝑠𝚤 (𝐶𝑉) = 𝑠
𝑥−. 100 Formülde verilen s standart sapmayı, x