T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
Prof. Dr. Fehmi AKÇİÇEK
MEMBRANÖZ GLOMERÜLONEFRİT TANILI
HASTALARDA PROGNOZU BELİRLEYEN FAKTÖRLERİN
KLİNİK VE PATOLOJİK YÖNDEN RETROSPEKTİF
OLARAK DEĞERLENDİRİLMESİ
UZMANLIK TEZİ
Dr. Hüseyin ÖZKÖK
TEZ DANIŞMANI
ÖNSÖZ
Ege Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı’nda sürdürdüğüm uzmanlık eğitimim süresince bilgi ve deneyimlerinden yararlandığım, her zaman desteğini esirgemeyen Anabilim Dalı Başkanı Sayın Prof. Dr. Fehmi Akçiçek’e,
Bu tezin hazırlanmasındaki yol göstericiliğinden, bilgi ve tecrübelerinden yararlandığım ve eğitimime sağladığı katkılardan dolayı tez danışmanım sayın Prof. Dr. Gülay Aşçı’ya ve Nefroloji Bilim Dalı Başkanı Prof. Dr. Hüseyin Töz’e,
Tezin hazırlanmasında büyük emeği ve katkıları bulunan Patoloji Anabilim Dalı’ndan sayın Prof. Dr. Sait Şen’e,
İç Hastalıkları eğitimim boyunca verdikleri destek ve eğitimime sağladıkları katkılar nedeniyle bütün İç Hastalıkları öğretim üyelerine, uzmanlarına, birlikte çalıştığım tüm asistan arkadaşlarıma, İç Hastalıkları ABD bünyesinde çalışan tüm hemşire ve personellere,
Özveri ve hoşgörüleri ile bugünlere gelmemi sağlayan, hayatımın her döneminde varlıklarından güç aldığım sevgili aileme sonsuz teşekkürü bir borç bilirim.
Dr. Hüseyin ÖZKÖK
İ
ÇİNDEKİLER
SİMGELER VE KISALTMALAR ...v TABLO DİZİNİ ...vi ŞEKİL DİZİNİ ... vii ÖZET... viii ABSTRACT ... ix 1- GİRİŞ ve AMAÇ ...1 2- GENEL BİLGİLER ...32.1. Membranöz Glomerülonefritin Tanımı ...3
2.2. Epidemiyoloji ...3
2.3. Patogenez ...4
2.3.1. Hayvan Modelleri...4
2.3.2. Nötral endopeptidaz (NEP) ...6
2.3.3. Fosfolipaz A2 reseptörü ...6
2.3.4. T hücrelerinin rolü...7
2.4. Histopatoloji ...7
2.5. Etiyoloji ...12
2.6. Klinik Özellikler...16
2.7. Doğal seyir ve Prognoz ...17
2.7.1. Cinsiyet...18
2.7.2. Yaş...18
2.7.3. Etnik Köken...19
2.7.4. Renal Fonksiyon...19
2.7.5. Proteinüri ...19
2.7.6. Diğer Üriner Belirteçler ...19
2.7.7. Remisyon...20
2.7.8. Histolojik Bulgular...20
2.8. MGN’de Risk Derecelendirmesi ...21
2.8.1. Düşük Risk ...21
2.8.2. Orta Risk ...21
2.9.1. Non-immünsüpresif Tedavi...23
2.9.2. İmmünsüpresif Tedavi...24
2.9.2.1. Kortikosteroidler ...25
2.9.2.2. Alkilleyici ajanlar ...25
2.9.2.3. Kalsinörin inhibitörleri: Siklosporin ve Takrolimus ...26
2.9.2.4. Mikofenolat mofetil (MMF)...27
2.9.2.5. Azatioprin...27
2.9.2.6. Ritüksimab ...27
2.9.2.7. İntravenöz İmmünglobulin (İVİG)...28
2.9.2.8. Sentetik Adrenokortikotropik Hormon (ACTH)...28
3- MATERYAL ve METOD ...29
3.1. Çalışma tasarımı ve Hastalar...29
3.2. İstatiksel Analiz Yöntemleri...30
4- BULGULAR...31
4. 1. Tanı Verilerinin Değerlendirilmesi ...31
4. 2. Böbrek Biyopsi Bulguları...35
4. 3. Tedavi seçimi ...40
5- TARTIŞMA ...44
SİMGELER VE KISALTMALAR
ACEİ : Anjiotensin Konverting Enzim İnhibitörüACTH : Adrenokortikotropik Hormon ARB : Anjiotensin II Reseptör Blokeri Ca++ : Kalsiyum
C3 : Kompleman 3
C4b : Kompleman 4b CMV : Sitomegalovirüs DM : Diyabetes Mellitus
FGS : Fokal Segmental Glomerüloskleroz GBM : Glomerüler Bazal Membran
GFH : Glomerüler Filtrasyon Hızı HDL : Yüksek Dansiteli Lipoprotein
HSCT : Hematopoetik Kök Hücre Transplantasyonu HT : Hipertansiyon IgG : İmmünglobulin G IgM : İmmünglobulin M IgA : İmmünglobulin A İVİG : İntravenöz İmmünglobulin KB : Kan basıncı LDL : Düşük Dansiteli Lipoprotein MGN : Membranöz Glomerülonefrit MMF : Mikofenolat mofetil
MAC : Membran Atak Kompleksi NEP : Nötral Endopeptidaz NS : Nefrotik Sendrom
NSAİİ : Non Steroidal Antiiinflamatuar İlaç PE : Pulmoner Emboli
PSA : Prostat Spesifik Antijen PLA2R : Fosfolipaz A2 Reseptörü RAP : Reseptör İlişkili Protein SLE : Sistemik Lupus Eritematozus Th : T helper
TABLO DİZİNİ
Tablo 1: Heymann nefritinin patogenezi ...5
Tablo 2: Sekonder MGN nedenleri...13
Tablo 3: Primer MGN’li hastalardaki prognostik faktörler ...20
Tablo 4: MGN’de risk derecelendirmesi ...22
Tablo 5: Primer MGN’de tedavi algoritmi ...28
Tablo 6: Hastaların bazal laboratuvar bulguları ...33
Tablo 7: Proteinüri miktarlarına göre gruplandırılan hastaların özellikleri ...35
Tablo 8: Glomerüler skleroz skorlarına göre guplandırılan hastaların özellikleri...39
Tablo 9: Tedavi gruplarının bazal özellikleri ...40
Tablo 10: İmmünsüpresif tedavi alan ve almayan hastaların bazal özelliklerinin karşılaştrılması...41
Tablo 11: 12. ay sonunda tam remisyonda izlenen hastaların remisyona girmeyen hastalarla karşılaştırılması ...42
Tablo 12: 12. ay sonunda tam veya kısmi remisyonda olan hastalarla remisyona girmeyen hastaların karşılaştırılması...43
Ş
EKİL DİZİNİ
Şekil 1: Normal glomerülün ışık mikroskopisinde görünümü...8
Şekil 2: MGN’nin ışık mikroskopisinde görünümü ...9
Şekil 3: MGN’nin ışık mikroskopisinde görünümü ...9
Şekil 4: Kapiller duvar boyunca yaygın, granüler IgG birikimi gösteren MGN’nin immünfloresan mikroskopisinde görünümü...10
Şekil 5: Normal glomerüler kapiller kulbun elektron mikroskopik görüntüsü...10
Şekil 6: MGN’nin elektron mikroskobisinde görünümü ...11
Şekil 7: Hastaların cinsiyete göre dağılımı ...31
Şekil 8: Hastaların yaşlarının dekatlara göre dağılımı...31
Şekil 9: DM’li hasta oranı...32
Şekil 10: Tanı anında PE’li hasta oranı ...32
Şekil 11: Biyopsi anında HT tanılı hasta oranı ...33
Şekil 12: Proteinüri miktarlarına göre gruplandırılmış hasta oranları ...34
Şekil 13: Glomerüler skleroz skor oranları...36
Şekil 14: İnterstisyel fibrozis skor oranları...36
Şekil 15: Tübüler atrofi skor oranları ...37
Şekil 16: Kronik vasküler değişiklik skor oranları ...37
Şekil 17: Arterioler hyalinozis skor oranları...38
Şekil 18: FGS skor oranları ...38
Şekil 19: Mezengial matriks artışı skor oranları ...39
Şekil 20: Biyopsi zamanında ACEİ veya ARB alan hastaların oranı...40
ÖZET
GİRİŞ VE AMAÇ: MGN, erişkinlerde görülen NS’nin yaygın görülen nedenlerindendir.
MGN kronik bir hastalık olup, spontan remisyon ve relapslar ile seyretmektedir. MGN tedavisinde tam bir görüş birliği olmasa da bazı risk gruplarında immünsüpresif tedavi yaklaşımları ön plandadır. Biz de bu çalışmada kliniğimizde tanı almış primer MGN tanılı olgular üzerinden hastalığın klinik ve patolojik özellikleriyle birlikte tedavi yaklaşımlarının remisyon üzerine etkilerini incelemeyi amaçladık.
MATERYAL VE METOD: Çalışmaya Ege Üniversitesi Tıp Fakültesi İç Hastalıkları
Nefroloji Bilim Dalı tarafından 2006-2012 yılları arasında böbrek biyopsisi ile primer MGN tanısı almış ve 12 ay süreli takibi olan 60 erişkin hasta dahil edildi. Hastaların tanı ve takiplerindeki klinik verileri dosyaları taranarak retrospektif olarak incelendi. Biyopsi örnekleri çeşitli patolojik kriterlere göre yeniden değerlendirildi. Elde edilen verilerle hastalığın klinik ve patolojik özellikleri arasındaki ilişkiler incelendi.
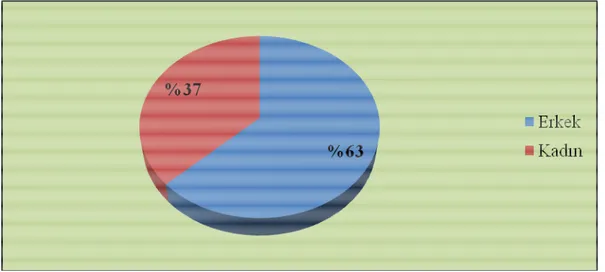
BULGULAR: Hastaların %63’ü (37) erkekti. Ortalama yaş 55.7±14.8 yıl olarak saptandı.
Hastalar proteinüri miktarlarına göre gruplandırıldığında, yüksek proteinürili (>8 gr/gün) vakalarda erkek cinsiyet hakimiyeti bulunmaktaydı. Gruplar arasında serum kreatinin düzeyleri ve HT oranları benzerdi. Hastaların %21.7’sine tek başına metilprednisolon, %28.3’üne metilprednisolon ile birlikte siklofosfamid tedavisi başlandı. Olguların %46.7’si ise ACEİ veya ARB ile takibe alındı. İmmünsüpresif tedavi alan gruplarda erkek dominansı ve nefrotik düzeyde proteinüri hakimdi. Proteinüri düzeyi (p=0.002) ve erkek cinsiyet (p=0.01) immünsüpresif tedavi verme açısından istatiksel olarak anlamlı bulundu. Hasta grubunun %29.6’sı 12.ay sonunda tam remisyona (<0.2 g/gün) girdi (İmmünsüpresif tedavi grubunun %31.7’si konservatif tedavi grubunun %23.1’i). 12. ay sonunda tam ve kısmi remisyon oranları immünsüpresif tedavi grubunda %87.8 iken, konservatif tedavi grubunda % 61.5 idi. Çoklu değişken analizinde tam-kismi remisyon için kadın cinsiyet (p=0.02) ve immunsüpresif tedavi almak (p=0.01); tam remisyon için biyopsi anındaki glomerüler skleroz oranı bağımsız belirleyiciydi (p=0.03).
SONUÇ: Primer MGN tanılı riskli gruplarda immünsüpresif tedavi ile tam-kismi remisyon
oranı konservatif tedaviden daha yüksektir. Erkek cinsiyet ve immünsüpresif tedavi almak remisyon için belirleyici bulunmuştur.
ABSTRACT
INTRODUCTION AND AIM: MGN is common cause of NS in adults. MGN is a chronic
disease, with spontaneous remission and relapses. Although there is no consensus for the treatment of MGN, immunosuppressive therapy approaches are forefront at some risk groups. In this study, we aimed to investigate the effects of clinical and pathological features of the disease through treatment approaches on remission with patients diagnosed as primary MGN at our department.
METHOD: 60 adult patients diagnosed by renal biopsy as primary MGN between 2006-2012
were included. Follow-up period was 12-month. Patients’ clinical data at the time of diagnosis and follow-up were retrospectively analyzed. Biopsy specimens were re-evaluated according to various pathological criteria. The relationship between clinical and pathological features of the disease was examined.
RESULTS: 63% (37) of the patients were male. Mean age was 55.7±14.8 years. When the
patients were grouped according to the amount of proteinuria, in high proteinuria (>8 g/day) group, there was male gender dominance. Serum creatinine levels and HT frequency were similar among groups. Treatment has been started 21.7% of the patients as methylprednisolone alone and 28.3% as cyclophosphamide combined with methylprednisolone. 46.7% of cases were followed with the ACEI or ARB. In groups that received immunosuppressive therapy there was dominance of male gender and nephrotic proteinuria. Levels of proteinuria (p=0.002) and male gender (p=0.01) were statistically significant variables for receiving immunosuppressive therapy. 29.6% of patients have been complete remission at the end of the 12th month (31.7% of immunosuppressive treatment group and 23.1% of the conservative therapy group). Complete and partial remission rates were 87.8% in the group treated with immunosuppressive therapy, and 61.5% in the conservative treatment group. In multivariate analysis, for complete-partial remission, female gender (p=0.02) and receiving immunosuppressive therapy (p=0.01); for complete remission, rate of glomerular sclerosis at the time of biopsy (p=0.03) were independent predictors.
CONCLUSION: In high-risk groups diagnosed as primary MGN, complete-partial remission
rate is higher in immunosuppressive therapy group than conservative treatment.Male gender and receiving immunosuppressive therapy has been found decisive for remission.
1.GİRİŞ VE AMAÇ
Membranöz glomerülonefrit (MGN) subepitelyal immünglobulin G (IgG) depolanması neticesinde oluşan glomerül bazal membran (GBM) kalınlaşması ile karakterize bir immün kompleks nefropatisidir [1].
Erişkinlerde görülen MGN’lerin yaklaşık %75’inde etiyoloji bilinmemektedir ve primer (idiopatik) olarak tanımlanır [2]. Yakın zamana kadar erişkinlerde görülen primer nefrotik sendromun (NS) en sık nedeni olarak primer MGN kabul edilirdi ve erişkin NS olgularının %22-33’lük kısmını oluştururdu [3, 4]. Ancak yeni yayınlanan çalışmalarda fokal segmental glomerülosklerozun Batı ülkelerinde artık daha çok öne çıkan bir NS nedeni olduğu bildirilmiştir [5, 6]. Pimer MGN NS ile ilişkili glomerülopatiler arasında Avrupa’da birinci sırada [7, 8], Kuzey Amerika’da ise fokal segmental glomerülosklerozdan sonra ikinci sırada yer alır [4, 5].
MGN enfeksiyonlar, tümörler, otoimmün hastalıklar, ilaç kullanımı ya da toksik ajanlara maruziyet gibi nedenler ile sekonder olarak da gelişebilmektedir. Sistemik lupus eritematozus (SLE), hepatit B antijenemisi ya da diğer kronik enfeksiyonlar, graft versus host hastalığı, orak hücreli anemi gibi hastalıklar ile çeşitli ilaç ve toksinler (terapötik olarak kullanılan altın tuzları, penisilamin, civa içeren ajanlar) diğer sekonder nedenleri oluşturur [2].
Primer MGN en sık 30-60 yaş arası erişkinlerde görülmekte olup, erkek hastalarda kadınlara göre iki kat daha fazla görülmektedir. MGN yaşlı ve çocuk hasta grubunda da izlenebilen bir patolojidir [2]. Hastaların %75’den fazlası NS kliniği ile hastaneye başvurmaktadır. Başvuru esnasında hastaların çoğunluğunun renal fonksiyonları bozulmamıştır ve normotansiftirler. Yaklaşık olarak yarısında mikroskobik hematüri saptanmaktadır, belirgin hematüri ve hipokomplemantemi görülmesi ise çok daha nadirdir [9].
MGN kronik bir hastalık olup, spontan remisyon ve relapslar ile seyretmektedir. MGN, Amerika Birleşik Devletleri ve Avrupa’da primer glomerülonefrit tiplerinin neden olduğu son dönem böbrek hastalığı tablosunda en sık görülen ikinci ya da üçüncü sebeptir [2].
Primer MGN’nin çoğu iyi seyirlidir, bazı hastalarda spontan remisyon olabilir ve renal fonksiyonları yıllarca stabil kalabilir [10]. Spontan remisyon hastaların yaklaşık üçte birinde görülürken, olguların %30-50’sinde ise relaps görülmektedir [11].
MGN’de tedavi yaklaşımları konusunda tartışmalar devam etmektedir. Bu nedenle, tedavi planı belirlenmeden önce, tedavi verilmemiş MGN’nin doğal seyrini ve prognozunu anlamak önemlidir [12-14].
MGN’nin progresyonunu değerlendirebilmek için birçok risk faktörü tanımlanmıştır. Hastalığın geç yaşta başlaması, erkek cinsiyet, nefrotik düzeyde proteinüri varlığı (özellikle protein ekskresyonu 8-10 g/gün’ü aşıyorsa ), başlangıçta yüksek serum kreatinin düzeyi ve renal biyopside tübülointerstisyel lezyonların fazla olması kötü prognoz göstergeleridir [15-21].
Bu çalışmada 2006-2012 yılları arasında Ege Üniversitesi Tıp Fakültesi Nefroloji Kliniği’ne başvuran MGN tanılı hastaların klinik özellikleri, renal fonksiyonları ve histopatolojik bulguları yönünden incelenmesi ve temel olarak klinik izlem ve patolojik veriler üzerinden prognoz tahmini ve tedavi yaklaşımı açısından yeni veriler elde edilmesi amaçlanmıştır.
2. GENEL BİLGİLER
2.1. Membranöz Glomerülonefritin Tanımı
MGN subepitelyal immünglobulin G (IgG) depolanması neticesinde oluşan GBM kalınlaşması ile karakterize bir immün kompleks nefropatisidir [1].
MGN tanısı böbrek biyopsisi ile konan histopatolojik bir tanıdır. MGN’ye nefritten ziyade nefropati demek daha doğru olur çünkü; glomerül veya interstisyumda herhangi bir inflamatuar yanıt nadiren vardır.
2.2. Epidemiyoloji
Erişkinlerde görülen MGN’lerin yaklaşık %75’inde etiyoloji bilinmemektedir ve primer olarak tanımlanır [2]. Yakın zamana kadar erişkinlerde görülen primer NS’nin en sık nedeni olarak primer MGN kabul edilirdi ve erişkin NS olgularının %22-33’lük kısmını oluştururdu [3, 4]. Ancak yeni yayınlanan çalışmalarda fokal segmental glomerülosklerozun Batı ülkelerinde artık daha çok öne çıkan bir NS nedeni olduğu bildirilmiştir [5, 6]. Primer MGN NS ile ilişkili glomerülopatiler arasında Avrupa’da birinci sırada [7, 8], Kuzey Amerika’da ise fokal segmental glomerülosklerozdan sonra ikinci sırada yer alır [4, 5].
1990 yılından bu yana böbrek biyopsi materyallerinde MGN görülme sıklığı %15-33’lere gerileme göstermiştir [4, 5, 22, 23]. Bu oranlar, siyahi ve Hispanik kökenli NS olgularında fokal segmental glomerülosklerozis izlenme sıklığının görece artmış saptanması nedeniyledir [4, 5, 22].
MGN her iki cinsiyette, bütün etnik ve ırksal gruplarda izlenmektedir. Primer MGN en sık 30-60 yaş arası erişkinlerde görülmekte olup, erkek hastalarda kadınlara göre iki kat daha fazla rastlanmaktadır. MGN yaşlı ve çocuk hasta grubunda da izlenebilen bir patolojidir [2]. Yaşlı hasta grubu biyopsi örneklerinin incelendiği daha güncel çalışmalarda, hastalığın yaşlılarda, zannedilenden daha sık olduğu saptanmıştır [24]. İtalyan bir grubun çalışmasında yaşlı popülasyondaki MGN insidansı milyonda 13.4 olarak saptanırken, genç erişkin popülasyonunda milyonda 4.2 olarak saptanmıştır [25]. Çocuk hastalarda MGN daha az sıklıkta izlenir, bunların çoğu hepatit B ya da daha az oranda otoimmün ya da tiroid hastalıklarıyla birliktelik gösterir [26].
2.3. Patogenez
Primer MGN antikor aracılı glomerüler bir hastalıktır. Morfolojik özellikleri dikkate alındığında MGN’nin patogenezinde podosit hasarının ve subepitelyal immün birikimlerin önemli bir rolü olduğu düşünülmektedir. İnsan MGN’sinin kesin patogenezi hala tam olarak açıklanamamıştır. Patogenezi açıklayan birkaç teori mevcuttur.
2.3.1. Hayvan Modelleri
MGN’ye yol açan patojenik mekanizmalar ilk olarak 1959 yılında oluşturulmuş Heymann nefritinin sıçan modelinde aydınlatılmıştır. Bu model hem klinik hem de histolojik evre bulguları olarak insandaki hastalığa oldukça benzerlik göstermektedir [27, 28]. Heymann nefriti aktif ve pasif model olarak iki farklı şekilde meydana getirilmektedir. Aktif Heymann nefritinde Freund adjuvanı ve proksimal tübülüs fırçamsı kenar materyalini ihtiva eden böbrek ekstrakları verilen farelerde proteinüri ve insan MGN’sine benzeyen bazal membran lezyonları oluşturulmaktadır. Pasif Heymann nefriti modelinde ise hastalık immünize edilmiş ve antikorlara sahip sıçanın böbreğinden hazırlanmış bir süspansiyonun, normal bir sıçana verilmesiyle oluşturulmuştur [29, 30].
Heymann nefritinde rolü olan antijeni tanımlamak amacıyla birçok deneme yapılmıştır. Yıllar süren yoğun araştırmalardan sonra hedef antijen tanımlanabilmiştir. Heymann nefritinin oluşmasından sorumlu antijenin gp330 veya megalin olarak olarak adlandırılan bir podosit membran glikoproteini olduğu anlaşılmıştır [31]. Megalin LDL reseptör gen ailesinin bir üyesi olup, plazminojen, plazminojen aktivatörü, ferritin ve Ca++ gibi çeşitli moleküllerin tutulumu ile ilişkili bir endositik reseptördür [30, 32]. Megalin proksimal tübülüs fırçamsı kenarındaki mikrovillusların bazalinde bulunan klatrin kaplı çukurlarda ve podosit ayaksı çıkıntılarının bazalinde bulunur. Burada megalin reseptör-ilişkili protein (RAP) olarak adlandırılan spesifik bir protein ile birlikte kompleks oluşturur. RAP, megalinin intrasellüler şaperonu olarak görev yapar, megalinin endoplazmik retikulumda katlanmasında ve hücre yüzeyine taşınmasında yardımcı olur [30, 32-34]. Heymann nefritinde, dolaşımdaki membranlar podosit ayaksı çıkıntılardaki megalin reseptörünü hedef alır. Megalin reseptörüne yönelik antikorlar bazal membranı geçip megalin-RAP kompleksine bağlanarak in situ immün kompleksler oluştururlar. Sonuç olarak ortaya çıkan immün kompleksler kompleman sistemini aktive ederek C5b-9 mebran atak kompleksinin (MAC) podositlerin membranından içeri girmesine neden olur [35-38]. Takip eden podosit hasarı iki
▪ Podositteki sinyal yollarının aktivasyonu ile aktin redistribüsyonu ve slit diyafram bütünlüğünün bozulması sonucunda proteinüri oluşumu [37-39].
▪ Hasarlanmış podositler tarafından tip 4 kollojen ve laminin aşırı üretimi sonucunda GBM genişlemesi [40-42].
Tablo 1: Heymann nefritinin patogenezi [43]
▪ İntrasellüler megalin
▪ RAP’ın yardımıyla megalin endoplazmik retikulumda katlanır ve podositlerin klatrin kaplı çukurlarına taşınır
▪ Megalin yabancı bir antijen olarak tanınır
▪ Dolaşımda yer alan antimegalin atikorları dokudaki hedef antijenleri ile bağlanır
▪ Subepitelyal bölgede immün kompleks formasyonu izlenir
▪ Kompleman kaskadı aktive edilir
▪ Terminal komponentler olan C5b-9 ile podositler uyarılır, inflamatuar mediatörler ve reaktif oksijen türevleri sentezlenir
▪ GBM hasarı ve proteinüri
GBM: glomerüler bazal membran RAP: reseptör ilişkili protein
Subepitelyal immün kompleks depolanması ve kompleman sisteminin lökosit infiltrasyonu, çeşitli sitokinler, araşidonik asit metabolitleri, adhezyon molekülleri ve büyüme faktörleri gibi mediatörlerin aktivasyonu ile hastalık süreci ortaya çıkar. Heymann nefriti deneysel modelleri, insan MGN’si ile birçok benzerlik göstermektedir. Ancak birçok soruya hala cevap bulunamamıştır. Patojenik antijenik hedef bilinmemektedir. Deneysel model ve insan MGN’si arasındaki histopatolojik ve klinik uyuma karşın insanlardaki MGN’lerde ne podositlerde ne de subepitelyal immün birikimlerin içerisinde megalin varlığı gösterilebilmiş değildir [44]. Ancak insan MGN’sinde ilişkisi saptanmış NEP ve PLA2R gibi başka antijenlere rastlanılmıştır.
2.3.2. Nötral endopeptidaz (NEP)
NEP insan MGN’sinde rolü kanıtlanmış olan ilk antijendir. 2002 yılında Debiec ve Ronco, nadir MGN formu olan alloimmün antenatal MGN’de sorumlu antijen olarak NEP’i tanımlamışlardır [45]. Buradan hareketle, 20 yıl öncesinde Heyamnn sıçan nefriti modelinde tanımlanmış olan megalin gibi, bir insan podosit antijeninin de nefritojenik antikorlar için hedef oluşturabileceği fikri ortaya ortaya atılmıştır.
NEP peptidlerin sindiriminde görevli olan membran ilişkili bir podosit antijenidir. Anti-NEP antikorlarının (NEP’i genetik olarak defektli, gebelik öncesi alloimmünize olan anneden) transplasental geçişi, fetüs/infantta subepitelyal immün depozitli (anti-NEP ve NEP) MGN’ye neden olmaktadır. Doğum sonrası maternal antikorların dolaşımdan temizlenmesiyle birlikte immün depozitler de kaybolmakta ve NS tablosu aylar içinde gerileme göstermektedir. Alloimmünize NEP defekti olan annelerdeki predominant IgG subtipi kompleman fiksasyonu göstermeyen IgG4 olsa da, annelerin bebeklerindeki proteinüri gelişimine kompleman fiksasyonu gösteren IgG1 anti-NEP’de katkı sağlar [46]. Bu bilgi ile birlikte, yeni başlamış MGN olgularının idrarlarında C5b-9’a rastlanılması [47, 48], Heymann nefriti modelinde elde edilen verilerin insandaki hastalık süreci ile paralellik gösterdiğini desteklemektedir.
2.3.3. Fosfolipaz A2 reseptörü (PLA2R)
M-tip PLA2R, glomerüler podositlerde yüksek oranda eksprese edilen transmembran bir resptör olup, insan primer MGN’de görevli bir antijen olarak tanımlanmıştır. 2009 yılında Beck ve arkadaşları erişkin primer MGN olgularında dolaşımda transmembran glikoprotein M-tip PLA2R’ye karşı gelişmiş olan antikorları saptamışlardır. PLA2R’ye karşı gelişmiş antikorlar olguların büyük çoğunluğunda saptanmış ve yine Heymann nefritinde ortaya atılmış modeli destekleyen bir mekanizmanın varlığına işaret etmiştir. Anti-PLA2R antikorları primer MGN açısından oldukça spesifik olup, sağlıklı bireylerde, NS’ye yol açan diğer hastalıklarda veya sekonder MGN olgularında bulunmamaktadır. Dolaşımdaki anti-PLA2R antikor düzeyi hastalığın klinik seyri ile paralellik göstermektedir. Anti-anti-PLA2R antikor düzeylerinde proteinürinin kısmi veya tam remisyonuyla düşüş izlenirken, NS’nin rekürrensi ile birlikte tekrar artış görülmektedir [49].
Primer MGN’ li hastalarda anti-PLA2 antikorlarının varlığı, Avrupa ve Çin’de yapılan beş ayrı çalışmada sırasıyla %57, %74, %75, %78 ve %82 oranlarında gösterilmiştir [50-54].
2.3.4. T hücrelerinin rolü
T helper (Th) hücreleri değişik immün mekanizmaları aktifleştirmekte ve glomerülonefrit patogenezinde rol oynamaktadır. MNG’de proteinüri oluşumunda da yer aldığı düşünülmektedir. Proliferatif ve kresentrik glomerülonefritlerde daha çok Th1 tipi görev alırken, MGN’de ve minimal lezyon hastalığında Th2 tip hücreler ön plana çıkmaktadır [55, 56].
Th2 tip hücre ve IL-4, IL-10 gibi artmış sitokinlerin ürünü olan IgG4’ün varlığı, Th2 hücrelerin rolünü desteklemektedir. Bu CD4, T hücre bağımlı humoral yanıt, Ig depozitlerin oluşumundan ve kompleman aktivasyonundan sorumludur [2].
Lupus nefriti modelinde gözlenen WSX-1 gen delesyonu (bu gen Th1 yanıtı tetikleyen bir integral sitokin reseptörünü kodlar), yanıtı Th2 yönüne çevirir ve tipik görülen diffüz proliferatif patern yerine membranöz patern oluşumuna yol açar [57]. Bu model Th2’nin MGN patogenezindeki rolünü destekler niteliktedir.
2.4. Histopatoloji
Her MGN olgusunda ışık mikroskobik bulguların yeterli belirleyiciliğe sahip olmaması ve diğer bazı glomerüler hastalıklarda da bazal membran kalınlaşmasının görülebilmesi, geçmişte MGN’nin patolojik tanısını koymada güçlüklere neden olmuştur. Ancak günümüzde elektron mikroskobisi ve immünolojik tekniklerin gelişmesi MGN’nin diğer NS nedenlerinden ayırıcı tanısının oldukça başarılı bir şekilde yapılmasını sağlamıştır [2]. MGN’nin ayırıcı histolojik özellikleri, ilk olarak Jones [58], Mellors ve Ortega [59] tarafından 60 yıl önce tarif edilmiştir.
MGN’de karakteristik değişiklikler glomerül kapiller duvarlarında izlenmektedir. Diğer kompartmanlarda da sekonder değişimlere rastlanabilir. Ancak bunlar hastalığın ileri dönemlerine kadar minör düzeydedir. Hastalığın erken dönemlerinde ışık mikroskobik bulgular net olarak tanıyı koydurmayabilir. Bu olgularda immünopatolojik incelemeler ve elektron mikroskobik bakı kolayca tanıya ulaşılmasını sağlar [2].
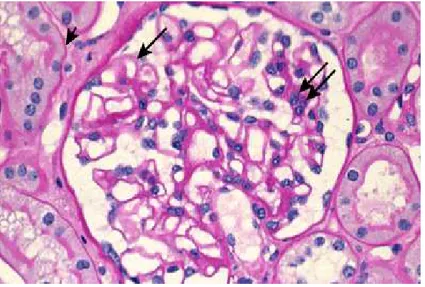
Şekil 1: Normal glomerülün ışık mikroskopisinde görünümü. Her bir kapiller yumakta sadece
1 veya 2 hücre vardır, kapiller lümen açıktır. Glomerüler kapiller duvarın kalınlığı (uzun ok), tübüler bazal membranla benzerdir (kısa ok). Mezengial hücreler ve mezengial matriks yumağın merkezinde ya da sap kısmındadır (oklar).
Courtesy of Helmut Rennke, MD.
Işık mikroskopisinde izlenen karakteristik histolojik lezyon tüm glomerül boyunca, belirgin hipersellülarite olmadan GBM’de izlenen diffüz kalınlaşmadır [60, 61]. MGN’de glomerül genişlemiştir ve hafif bir mezangial hipersellülarite tariflenmesine rağmen tipik olarak normosellülerdir. Glomerüler kapiller lümen açık olup endokapiller proliferasyon gözlenmez. Birçok vakada GBM’nin internal vaküolizasyonu belirgindir. MGN’nin erken döneminde glomerül tamamen normal olarak görülebilir. Hastalığın başlangıç evreleri minimal değişiklik hastalığı ile karıştırılabilir. İlerlemiş olgularda, immün depozitler arası GBM uzanması olan dikensi yapılar ise uygun boyama yöntemleri ile görülebilmektedir. Hastalık ilerledikçe glomerüler ve tübülointerstisyel alanlarda kronik sklerozan değişimler de meydana gelmektedir.
Şekil 2: MGN’nin ışık mikroskopisinde görünümü. Normal sellülariteli GBM’nin diffüz
kalınlaşması (uzun oklar) görülmektedir. Glomerüler kapiller duvarların kalınlığı komşu tübüler bazal membranlardan çok daha fazladır (kısa ok). Mezangial genişleme alanları bulunmaktadır (yıldız). İmmünfloresan mikroskobu ve elektron mikroskobu genellikle tanıyı doğrulamak için gereklidir.
Courtesy of Helmut Rennke, MD.
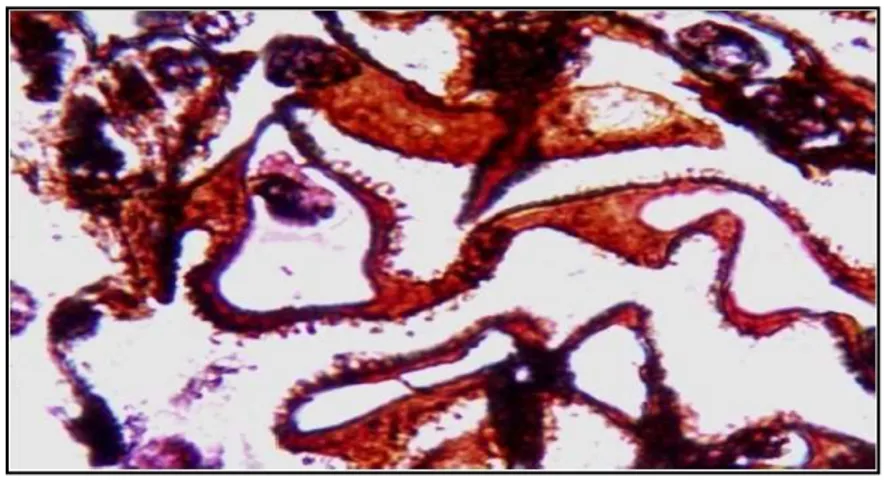
Işık mikroskobisinde en erken görülen değişiklik, GBM’de gümüş boyaları ile saptanabilen ‘’güve yeniği’’ görünümüdür [2].
Şekil 3: MGN. Gümüş boyaları ile lineer projeksiyonlar ya da ‘’dikensi (spikes)’’ yapıların
GBM’nin dış yüzeyinden protrude olduğu görülebilmektedir (Periodik asit methenamin gümüş, 100x) [2].
İmmünfloresan mikroskopide GBM boyunca, diffüz granüler IgG ve C3 birikimi görülmektedir. Boyamada rastlanan en önemli ve değişmeyen depozit IgG’dir. Diğer immünglobulinler ya da kompleman reaktanları da zaman zaman görülebilse de, bunlar daha silik boyanır ve sadece segmental olarak izlenir [62].
Şekil 4: Kapiller duvar boyunca yaygın, granüler IgG birikimi gösteren MGN’nin
immünfloresan mikroskopisinde görünümü.
Courtesy of Helmut Rennke, MD.
Elektron mikroskopide saptanan bulgular MGN tanısını kolaylaştırmıştır [63]. Elektron mikroskopisinde subepitelyal depolanmalar ve ayaksı oluşumların füzyonu görülür [64, 65].
Şekil 5: Normal glomerüler kapiller kulbun elektron mikroskopik görüntüsü. Endotelyal
hücreler fenestrasyonlar göstermektedir (Endo), GBM, epitelyal hücreler ve birbirine geçmiş ayakçıkları (ok). GBM incedir ve elektron yoğun depozitler yoktur. Kapiller lümende iki normal kan pulcuğu görünmektedir.
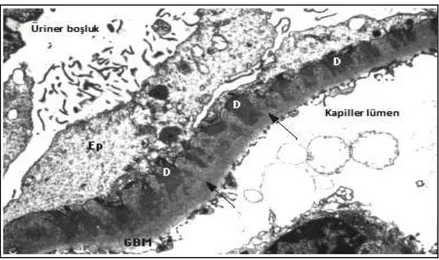
Primer MGN’de elektron mikroskobisinde gözlenen elektron dens depozitler özellikle subepitelyal ve intramembranöz lokalizasyondadır. Sekonder formlarda ise dolaşan immün komplekslerin varlığına işaret eden mezangial ve/veya subendotelyal depozitler ön plana çıkar [62, 66, 67].
Şekil 6: MGN’nin elektron mikroskobisinde görünümü. Evre 2 MGN görülmektedir. Elektron
dens depozitler (D), subepitelyal alanda GBM boyunca ve epitelyal hücrelerin (Ep) altında bulunmaktadır.
Courtesy of Helmut Rennke, MD
MGN’nin evrelemesine ilişkin değişik modeller kullanılmıştır. Günümüzde en çok kabul gören modifiye Ehrenreich ve Churg evrelemesidir. Bu sistemde MGN histopatolojik bulgular temelinde beş evreye ayrılmaktadır [43, 61, 68, 69].
Evre I : Bu evrede ışık mikroskopi bulguları genellikle normal sınırlardadır. GBM normal ya
da hafifçe kalınlaşmış olarak görülebilir. Minimal düzeyde dikensi yapılar (spikes) izlenebilir. Az sayıda küçük ve yassı subepitelyal elektron yoğun birikimler görülür.
Evre II : GBM’nin epitelyal yüzeyinde dikensi yapıları oluşturan ‘’spike’’ formasyonları
belirginleşmiştir. Elektron yoğun birikimler arasında uzanan bu oluşumlar yaygın olarak izlenir. İlerlemiş olgularda bu dikensi yapıların uçları genişlemeye ve çomaklaşmaya başlar. Elektron yoğun birikimlerin sayısı ve büyüklüğü artmıştır.
Evre III : Elektron yoğun birikimler GBM’nin etrafını kuşatmış ve onunla kaynaşmıştır. Bu
durum bazal membran ve kapiller duvarın düzensiz olarak kalınlaşması şeklinde izlenir. Biriken immün kompleks materyal GBM ve kapiller duvarın birbirinden ayrışmasına neden olur.
Evre IV : Bazal membran ile kaynaşmış birikimler elektron yoğun görünümünü kaybetmiştir.
GBM’ nin çok düzensiz kalınlaşmalar gösterdiği izlenir . Görünümü vakuollü bir yüzey
şeklindedir.
Evre V : İyileşme dönemini temsil eder. Subendotelyal birikimler iyice azalmış, bazal
membranın görünümü normale dönmeye başlamıştır. Bazal membran kısmen kalınlaşmış ve bazı bölgelerinde saydamlaşmıştır.
2.5. Etiyoloji
Erişkinlerde görülen MGN’lerin yaklaşık %75’inde etiyoloji bilinmemektedir ve primer olarak tanımlanır [2].
Primer MGN çeşitli sekonder nedenlerden ayırt edilmelidir. Çünkü altta yatan nedenin tedavi edilmesi ya da ortadan kaldırılması ile NS tablosunun gerileme gösterdiği izlenmiştir.
MGN enfeksiyonlar, tümörler, otoimmün hastalıklar, ilaç kullanımı ya da toksik ajanlara maruziyet gibi nedenler ile sekonder olarak da gelişebilmektedir. SLE, hepatit B antijenemisi ya da diğer kronik enfeksiyonlar, graft versus host hastalığı, orak hücreli anemi gibi hastalıklar ile çeşitli ilaç ve toksinler (terapötik olarak kullanılan altın tuzları, penisilamin, civa içeren ajanlar) diğer sekonder nedenleri oluşturur [2].
Hastanın öyküsünün detaylı bir şekilde alınması, daha önce kullandığı ilaçların incelenmesi ile fizik bakı ve laboratuvar testlerinden elde edilen bulgular sekonder nedenlerin ekartasyonu açısından büyük ölçüde yardımcı olmaktadır [70]. Ayrıca elektron mikroskopi ve immünfloresan bakıdaki bazı bulgular sekonder MGN tanısında yönlendirici olabilir.
Tablo 2: Sekonder MGN nedenleri [2]
MGN’de en sık enfeksiyonla ilişkili etkenler hepatit B ve hepatit C virüsleridir [71, 72]. HBcAg gibi hepatit B antijenleri subendotelyal immün kompleks depozitlerinin içinde tanımlanmıştır [73]. Hepatit B virüs enfeksiyonuna bağlı ortaya çıkan MGN, hipokomplemantemi ile ilişkisi olan MGN formlarındandır [74]. Hepatit B virüsü enfeksiyonuna sekonder MGN genellikle, endemik bölgelerde yaşayan ve aktif hepatit öyküsü bulunmayan asemptomatik taşıyıcı olan çocuklarda görülür [26, 74-77]. Hepatit B ilişkili MGN görülen çocuk hastalarda proteinüri çoğunlukla spontan gerilerken, erişkin hastaların
Enfeksiyonlar: • Hepatit B • Hepatit C • Streptokokkal enfeksiyonlar • Malarya • Şistozomiyazis • Sifiliz • Lepra • Tüberküloz • Sitomegalovirüs (CMV) İlaçlar: • Kaptopril • Klopidogrel • Civa • Penisilamin
• NSAİİ’ler (non-steroidal antiiflamatuar ilaç)
• Altın tuzları Otoimmun hastalıklar: • SLE • Romatoid artrit • Tiroidit • Sjögren hastalığı • Psöriazis • Sarkoidozis
• Miks bağ dokusu hastalığı
Neoplaziler:
• Mesane, meme, pankreas, prostat, mide ve akciğer karsinomları
• Hematolojik maligniteler: Lenfoma, Kronik Lenfositik Lösemi
Diğer:
• Orak hücreli anemi
• Diyabetes mellitus (DM)
• Post-transplant
çoğunda hastalık progresiftir [75]. Hepatit C virüs enfeksiyonu MGN’den çok membranoproliferatif glomerülonefrit ile ilişkilidir. MGN kronik hepatit C enfeksiyonu seyri sırasında da ortaya çıkabilmektedir [78].
MGN malarya, trypanozomiazis, lepra ya da endemik bölgelerdeki diğer başka enfeksiyonlarla birlikte de görülebilir [79]. Ayrıca konjenital ve sekonder sifilizin MGN ile ilişkili olduğu gösterilmiştir [80-85]. Günümüzde enfeksiyona sekonder MGN’nin gerçek insidansı bilinmemektedir, ancak tropik bölgelerde artmış olduğu tahmin edilmektedir [43].
Potansiyel olarak MGN gelişimine yol açabilecek ilaç sayısı gün geçtikçe artmaktadır. En iyi dökümante edilmiş ilaca bağlı MGN civa, altın ve penisilamine bağlı MGN’dir. Hastalıkla ilişkili diğer tedavi ajanlarından kaptopril ve NSAİİ’lerle daha az ilişki kurulmaktadır [86]. Ayrıca günümüzde romatoid artrit tedavisinde kullanılan busilamin ve etanersept, infliksimab, adalimumab gibi anti-TNF (tümör nekroz faktör) ajanları da MGN’ye neden olmaktadır [87-90]. Proteinüri tablosu genellikle ilaç tedavisinin ilk 6-12. ayları arasında görülmekle birlikte, 3-4 yıl sonrası gibi uzun dönemde de ortaya çıkabilir [91]. Proteinüri geliştikten sonra ilacın kesilmesi ile hemen hemen tüm olgularda proteinüri gerilemektedir [91, 92].
Amerika Birleşik Devletleri’nde, MGN’nin en sık sekonder nedeni membranöz lupus nefritidir ve Uluslararası Nefroloji-Renal Patolojiler Derneği tarafından sınıf V lupus nefriti olarak tanımlanır [2]. SLE gibi otoimmün hastalıkların seyri sırasında da MGN gelişebilmektedir [93]. Lupus nefriti olan hastaların %10-20’ sinde renal biyopside MGN saptanmaktadır [94]. SLE nadiren diğer klinik bulgular olmadan sadece nefrit varlığı ile ortaya çıkabilmektedir. Bu tip hastalarda başlangıçta belirgin bir primer MGN tablosu varken, SLE’nin serolojik ve diğer klinik bulguları görülmez. Renal biyopside ılımlı bir mezangial proliferasyon dışında MGN’ nin sekonder olduğunu düşündürtecek herhangi bir bulgu yoktur. SLE’nin ekstrarenal bulgularının gelişmesi ve anti-dsDNA antikoru düzeylerindeki artış 1-14 yıllık süre içerisinde gerçekleşir [95]. Primer MGN’yi membranöz lupus nefriti ve diğer sekonder MGN nedenlerinden ayırmada bazı histolojik bulgular yardımcı olmaktadır. Subendotelyal ve mezangial yerleşimli depozitlerin varlığı, buna eşlik eden subepitelyal depozitler ve immünfloresan boyamada IgG, IgA, IgM, C3, C1q varlığının gösterildiği ‘’full house’’ paterni membranöz lupus nefritini düşündürür [96]. Ayrıca glomerüler endotelde tübüloretiküler yapıların varlığı da lupus nefritine işaret etmekle birlikte bu bulgu, diğer
MGN görülen erişkin hastaların %5-20 kadarında, özellikle de 65 yaş üstü hastalarda, malignite varlığı bildirilmiştir. Bunların büyük kısmını prostat, akciğer malignitesi ya da gastrointestinal trakta ait solid tümörler oluştursa da, daha nadir olarak kronik lenfositik lösemi gibi hematolojik maligniteler de görülebilmektedir [98-103]. MGN’li hastalar arasındaki malignite görülme riski, genel popülasyona göre 2 ile 12 kat artış göstermektedir. Bu değişkenlik, seçilen popülasyonun özelliklerine ve tabi ki, yaş ve cinsiyet gibi parametrelere bağlıdır [102, 103]. Malignitenin MGN ile etiyolojik olarak ilişkili kabul edilmesi için, tümörün eksizyonu sonrası proteinürinin remisyona uğradığı gözlenmelidir. Öne sürülen bir mekanizmaya göre, glomerüldeki tümör antijen depozitleri antikor birikimi ve kompleman aktivasyonuna yol açarak, epitelyal ve GBM hasarına neden olmakta ve akabinde de proteinüri görülmektedir [104]. Olguların yaklaşık yarısında renal biyopsi anında neoplazi varlığı bilinirken, %40-50’lik kısmında proteinüri, altta yatan malignitenin klinik belirti ve bulgularından aylar, yıllar önce başlayabilmektedir [98]. Olguda yaş grubu nedeniyle ya da malignite açısından şüphelendirecek klinik bir bulgu varsa malignite taraması yapılmalıdır. Bu nedenle, 50 yaş ve üzeri hastalarda (ve diğer durumlarda endikasyon varsa) gaitada gizli kan bakılması ve kolonoskopi yapılması, 40 yaş ve üzeri olan kadın hastalarda mammografi çekilmesi, 50 yaş ve üzeri erkek hastalarda prostat spesifik antijen (PSA) bakılması ve akciğer kanseri açısından yüksek riskli hastalarda akciğer grafisi ve mümkünse bilgisayarlı tomografi çekilmesi önerilmektedir.
Diğer glomerüler hastalıklar gibi MGN de DM’li hastalarda görülebilir. Diyabetik nefropati tabloya eşlik edebilir ya da etmeyebilir [105, 106].
HSCT sonrası MGN oluşumu, kronik graft versus host hastalığının humoral bir belirtisi olabilir. MGN, HSCT sonrası görülen NS’nin en yaygın nedenidir ve primer MGN’de olduğu gibi erkekleri daha çok etkiler [107].
Renal transplantasyon sonrası MGN rekürrensi olabilse de, transplat alıcılarında daha çok de novo MGN oluşumu gözlenmiştir. Patogenezde minör histokompabilite antijenlerine karşı alloimmünizasyon oluşumu ya da özel eksprese edilen donör epitopalarının rol aldığı düşünülmektedir [108]. MGN rekürrens oranı renal allograftlarda %42 olup, yavaşça progrese olan proteinüri şeklinde görülür [109].
2.6. Klinik Özellikler
Primer MGN en sık 30-60 yaş arası erişkinlerde görülmekte olup, erkek hastalarda kadınlara göre iki kat daha fazla rastlanmaktadır. MGN yaşlı ve çocuk hasta grubunda da izlenebilen bir patolojidir [2].
Hastaların %75’den fazlası NS kliniği ile hastaneye başvurmaktadır. Başvuru esnasında hastaların çoğunluğunun renal fonksiyonları bozulmamıştır ve normotansiftirler. Yaklaşık olarak yarısında mikroskobik hematüri saptanmaktadır, belirgin hematüri ve hipokomplemantemi görülmesi ise çok daha nadirdir [9].
MGN olgularının çoğu tanı anında normotansiftir, ancak %10-20’lik kısmında tanı anında hipertansiyon (HT) saptanabilir. Hastaların %20’ den azı ilk tanı konduğu anda renal yetmezliktedir [2].
Altta yatan patoloji subepitelyal depozitlerin yavaş yavaş birikmesi ve podosit hasarı olduğu için, özellikle kilo alımı ve alt ekstrimite ödemi gibi NS bulguları, minimal lezyonlu ya da fokal segmental glomerülosklerozlu olgulara göre daha geç ortaya çıkmaktadır. Bu nedenle hastalığın tam olarak ne zaman ortaya çıktığı hasta ve klinisyen tarafından fark edilmeyebilir. Hastalığın belirtileri genellikle sinsi olup, birçok olguda ilk belirti yavaş oluşan ödemdir.
Proteinürinin derecesi değişkendir. Proteinüri subnefrotik düzeyden (<3.5 g/gün), günde 20 gramdan fazla olacak miktarlara kadar değişebilmektedir. MGN tanısı konmadan aylar öncesinden itibaren proteinüri tipik olarak vardır. Bu da hastalığın aşama aşama ilerlediğine işaret etmektedir. İdrar analizinde sık karşılaşılabilecek diğer anomaliler arasında oval lipid cisimcikleri, lipid damlacıkları ve yağ silendirleri sayılabilir. Mikroskopik hematüri %50’ye varan oranda görülebilir, ancak makroskopik hematürinin ve idrarda eritrosit silendirlerinin görülmesi nadirdir [61].
Hipoalbuminemi ve ağır hipelipidemi, NS tanısı almış hastaların çoğunda tanı anında mevcuttur. Bu durum subnefrotik proteinürili (<3.5 g/gün) hastalarda ise genellikle görülmemektedir.
Bu hastalık değişken bir klinik seyir izlemektedir. Bazı olgularda spontan remisyonlara rastlanmaktadır bunun yanı sıra son dönem böbrek yetersizliğine kadar giden
MGN tüm dünyada kronik böbrek hastalıklarının önde gelen nedenlerinden biridir. MGN, Amerika Birleşik Devletleri ve Avrupa’da primer glomerülonefrit tiplerinin neden olduğu son dönem böbrek hastalığı tablosunda en sık görülen ikinci ya da üçüncü sebeptir [2].
2.7. Doğal seyir ve Prognoz
Hastalığın başlangıcında MGN’li bir hastanın klinik seyrini tahmin etmek güçtür; çünkü hastalığın değişken ve dalgalı bir seyri vardır.
Primer MGN’nin çoğu iyi seyirlidir, bazı hastalarda spontan remisyon olabilir ve renal fonksiyonları yıllarca stabil kalabilir [10]. Spontan remisyon hastaların yaklaşık üçte birinde görülürken, olguların %30-50’sinde ise relaps görülmektedir [11].
Genel bir kural olarak tedavi edilmemiş MGN hastalarının 1/3’ü tedavisiz spontan remisyona girerken, 1/3’ünde renal fonksiyonlar korunur ancak proteinüri devam eder, kalan 1/3’lük kısmında ise son dönem böbrek yetmezliğine progresyon görülür.
NS eşlik eden ya da etmeyen primer MGN tedavisinde kullanılan ilaçların toksisite potansiyeli bulunmaktadır. Bu nedenle tedavi kararı verirken, başlangıçta NS bulguları olan ya da olmayan hastalarda, tedavisiz hastalığın ne şekilde seyrettiğini anlamak önemli bir basamağı oluşturmaktadır [10, 15, 110, 111]:
▪ Proteinüri 5 yıllık dönem içerisinde %5 ile %30 olguda spontan olarak tam remisyona girebilmektedir [15, 110, 111].
▪ 5 yıllık dönemde spontan kısmi remisyon (proteinüri ≤2 g/gün) %25 ile %40 olguda görülmektedir [15, 110, 111].
▪ Tedavi almamış olgularda son dönem böbrek yetmezliğine progresyon, 5 yılda yaklaşık %14’lük kısımda görülmüştür. Bu oran ilk 10 yılda %35 iken, 15. yılda %41’dir [10, 111].
MGN’de uzun dönemde olumsuz sonuçların görülme riskinin daha yüksek olduğu düşünülmektedir. MGN’nin son dönem böbrek yetmezliğine progrese olması haricinde, yaşamı tehdit edici diğer komplikasyonlara da yol açması olasıdır. Tedavi almamış hastalarda mortalite oranlarının %6-20 arasında değiştiği bildirilmiş olup yaş ortalaması 50’dir [110, 112, 113]. Geçmişte NS’li hastalarda en yaygın görülen ölüm nedenlerinden biri
enfeksiyonlar olsa da, günümüzde enfeksiyon nedeniyle görülen mortalite oranları, en azından gelişmiş ülkelerde, oldukça azalmıştır; ancak bu sebep tam olarak elimine edilememiştir. Günümüzde renal yetmezlik dışında nefrotik hastalarda görülen en sık ölüm nedenleri arasında kardiyovasküler ve trombotik komplikasyonlar yer almaktadır [43]. MGN’de derin ven trombozu ve renal ven trombozu sık görülür; hastaların yaklaşık %17’sinde pulmoner emboli (PE) gelişebilir [114]. Arteryel trombozlar da görülebilir. Trombotik komplikasyon riski yaşlı hasta grubunda daha yüksektir [115].
Hipoalbuminemi, hiperlipidemi, hiperkoagülobilite, HT ve renal yetmezlik gibi faktörler NS’li hastalarda morbidite ve mortalite ile yakından ilişklidir [43].
MGN’de tedavi yaklaşımları konusunda tartışmalar devam etmektedir. Bu nedenle, tedavi planı belirlenmeden önce, tedavi verilmemiş MGN’nin doğal seyrini ve prognozunu anlamak önemlidir [12-14]. MGN’nin progresyonunu değerlendirebilmek için çeşitli risk faktörleri belirlenmiştir.
2.7.1. Cinsiyet
Genel görüş, prognozun kadınlarda erkeklere göre daha iyi olduğu yönündedir. Bu görüş, daha önceleri tek merkezli olan bir çalışmadan yola çıkarak ortaya atılmış daha sonra ileri incelemelerle de desteklenmiştir. Kadın cinsiyetin spontan remisyon olasılığında artışla [116] ve daha yavaş progresyon hızı ile ilişkili olduğu saptanmıştır [117, 118]. Ayrıca kadınların erkeklere göre spesifik bir tedaviye yanıt verme olasılığı önemli derecede daha yüksektir [119].
2.7.2. Yaş
Yakın zamanda yayınlanmış çalışmalar incelendiğinde, NS’li çocukların yaklaşık 1/4’ünde (tedavi almamış ya da değişik immünsüpresif tedavileri almış olsa dahi) kronik böbrek yetmezliği geliştiği görülmüştür [120]. Çocuk hastalarda trombotik komplikasyonlar da sık olarak görülmektedir [121]. 60 yaş ve üzeri hastalarda başlangıçta serum kreatinin düzeyleri genellikle daha yüksektir ve genç erişkinler ile karşılaştırıldığında, renal yetmezlik gelişme riski daha fazladır [122-124].
2.7.3. Etnik Köken
Asya kökenli hastalarda uzun dönemdeki prognozun, diğer etnik kökenli hastalara göre daha iyi olduğu düşünülmektedir [16].
2.7.4. Renal Fonksiyon
Başlangıçta görülen artmış serum kreatinin düzeylerinin son dönem böbrek yetmezliğinin bir habercisi olduğu yönünde fikir birliği bulunmaktadır [19, 125, 126]. Düşük kreatinin klirensi [13] veya 1.5 mg/dL’den daha yüksek serum kreatinin düzeyi [16] son dönem böbrek yetmezliğine ilerlemenin önemli prediktörleri olarak kabul edilmektedir. Ancak şu da unutulmamalıdır ki, bazı ağır NS olgularında renal yetmezlik, şiddetli hipoalbuminemi ya da aşırı dozda diüretik kullanımına bağlı hipovolemi nedeniyle fonksiyonel ve geri dönüşümlü olabilmektedir.
2.7.5. Proteinüri
Proteinürinin derecesinin ve süresinin prognozu öngörmede değerli olduğu düşünülmektedir [20]. Cattran ve arkadaşları, primer MGN’de progresyon riskini öngörebilmek için bir model oluşturmuşlardır. Bu modele göre olgular proteinüri dereceleri ve 6 aylık izlemdeki klinik seyirlerine göre düşük, orta ve yüksek olarak risk gruplarına ayrılmıştır. 6 aylık izlem süresince serum kreatinin düzeyleri normal ve proteinürisi <4 g/gün saptanan olgular, progresif renal yetmezlik tablosu geliştirme açısından düşük riskli grupta yer almıştır. 6 aylık izlemde orta derecede proteinüri (4-8 g/gün) saptanmış ve serum kreatinin düzeyleri normal ya da normale yakın izlenen olgular ise orta derecede riskli gruba dahil edilmiştir. 6 ay süresince serum kreatinin düzeyleri anormal ya da giderek bozulma gösteren ve proteinüri düzeyi >8 g/gün saptanan olgular ise yüksek riskli grupta yer almıştır [127].
2.7.6. Diğer Üriner Belirteçler
IgG (UIgG) ve α1-mikroglobulin üriner ekskresyon yüksekliğinin tübülointerstisyel hasarın derecesi ile anlamlı ölçüde ilişkili olduğu ve atılmış toplam protein miktarından bağımsız olarak, hem remisyon hem de progresyon için anlamlı bir prediktif değer olduğu gösterilmiştir [128]. Β2-mikroglobulin (Ubeta2m) ve IgG’nin (UIgG) üriner ekskresyon düzeylerinin de, MGN hastalarında gelişebilecek renal yetmezlik açısından yararlı prediktörler oldukları gösterilmiştir [129].
2.7.7. Remisyon
Tam remisyonla birlikte uzun dönemde renal prognoz mükemmeldir ve 10 yıllık renal sağ kalım neredeyse %100’dür. Kısmi remisyonla birlikte bu rakam %90’lara geriler, remisyon görülmeyen olgularda %45’tir [13].
2.7.8. Histolojik Bulgular
Progesyon riski glomerüler skarlanma (segmental sklerozis) görülen olgularda artmıştır. Bu bulgu glomerüler hasarlanmanın derecesindense, tübülointerstisyel hastalığın
şiddeti ile daha yakın ilişki göstermektedir [16, 130, 131]. Bu durum çoğu glomerüler hastalık için geçerlidir.
Tübülointerstisyel lezyon, vasküler sklerozis ve fokal sklerozis yoğunluğunun azalmış renal sağkalımla birlikte olduğu gösterilmiştir [21]. Tübülointerstisyel hastalığın daha belirgin olması sıklıkla başlangıçta yaşın ileri, ortalama arteryel basıncın daha yüksek ve kreatinin klirensinin daha düşük olması ile ilişkilendirilmektedir. Bu nedenle, tübülointerstisyel hastalığın şiddeti bazal klinik değişkenlerden bağımsız bir prediktör olarak sayılmayabilir [21]. Prognoz değerlendirmesi yapılırken elektron mikroskobik bulgulardan da yararlanılabilir. Biyopsi örneklerinin elektron mikroskobik incelemesinde çeşitli evrelerde dens depozit ya da büyük dens depozit varlığı saptananların, kötü prognoza sahip oldukları gösterilmiştir [132].
Tablo 3: Primer MGN’li hastalardaki prognostik faktörler [43]
Faktör İyi prognoz Kötü prognoz
Cinsiyet Kadın Erkek
Yaş Genç İleri yaş
Renal fonksiyon Normal Bozulmuş
Proteinüri 6 ay boyunca <4 g/gün 6 ay boyunca >8 g/gün IgG üriner ekskresyonu <110 mg/g idrar kreatinini
<250 mg/24 saat
>110 mg/g idrar kreatinini >250 mg/24 saat
Üriner B2-mikroglobulin <0,5 µg/dk >0,5 µg/dk
NS remisyonu Evet, özellikle de tam ise Remisyon yok
2.8. MGN’de Risk Derecelendirmesi
MGN’de düşük-orta-yüksek şeklindeki risk derecelendirmesi, 24 saatlik idrar örneğinden ölçülen proteinürinin derecesi ve kreatinin klirensine göre yapılan tahmini glomerüler filtrasyon hızına (GFH) bakılarak oluşturulmaktadır [19, 20].
2.8.1 Düşük Risk
6 aylık izlem periyodu boyunca renal fonksiyonları normal ve 24 saatlik idrar örneklerinden ölçülen protein eksresyon düzeyi <4 g/gün olan asemptomatik hastalar, progresif hastalık açısından düşük risk altındadırlar. Bu hastalarda proteinüri nefrotik düzeye ulaşmadıkça immünsüpresif tedavinin başlanmaması önerilmektedir, çünkü hastalığın prognozu uzun dönemde mükemmeldir. Spontan, kısmi ya da tam remisyon sıklıkla görülmektedir [11, 15, 110, 111, 133]. Bu grupta yer alan hastalarda 5 yıldan sonra kronik böbrek yetmezliği riski %8’den azdır. Hastalık spesifik olmayan tedaviden yarar görürler [12, 127, 134].
2.8.2 Orta Risk
Proteinüri düzeyi 4-8 g/gün arasındadır ve 6 aydan fazla devam eder. 6 aylık takipte kreatinin klirensinin normal ya da normale yakın düzeylerde stabil olduğu görülür. %50 hastada 5 yıldan sonra kronik böbrek yetmezliği gelişir. Hastalara öncelikle hastalık spesifik olmayan tedavi başlanır. 6 ay içinde düzelme olmazsa spesifik tedavi başlanır [12, 127, 134].
2.8.3 Yüksek Risk
Proteinüri düzeyi 8 g/gün’ün üzerindedir ve 3 ay devam eder. Renal fonksiyonlar MGN nedeniyle normalin altında olabilir ya da renal fonksiyonlarda bozulma takip sırasında gözlenebilir. Bu hastaların %75’i, 5 yıldan sonra kronik böbrek yetmezliğine progresyon açısından risk altındadır. Hastalık spesifik olmayan tedavinin yanı sıra hastalık spesifik tedavi de başlanmalıdır [12, 127, 134].
Renal fonksiyonlarda bozulma nedeniyle yüksek risk grubuna dahil edilen hastaların MGN ile bağlantılı olabilecek ya da bağımsız diğer durumlar açısından da dikkatlice değerlendirilmesi gerekmektedir. Örneğin; uzun süredir HT’si olan ya da yaşlı hastalarda GFH’deki düşme MGN’den bağımsız olabilir [21]. Hastalardaki bozulmuş renal fonksiyonlar başka nedenlerle açıklanamıyor ya da hastalık izlem sırasında progresyon gösteriyorsa, tedaviye gecikmeden başlanmalıdır.
Tablo 4: MGN’de risk derecelendirmesi [93]
Risk
derecelendirmesi Proteinüri Kreatinin klirensi İzlem
5 yıldan sonra kronik böbrek yetmezliği gelişme riski
Önerilen tedavi
Düşük risk <4 g/gün Normal seyreder 6 ay 5 yıldan sonra
<%8 Hastalık spesifik olmayan tedavi Orta risk <4–8 g/gün Normal/normale yakın 6 ay %50 Hastalık spesifik olmayan tedavi, 6 ay içinde düzelme yoksa hastalık spesifik tedavi Yüksek risk >8 g/gün Normalin altında ya da izlem periyodunda azalan 3 ay %75 Hastalık spesifik olmayan + hastalık spesifik tedavi 2.9. Tedavi
Tedavi yaklaşımı planlanmadan önce, MGN’nin primer mi yoksa sekonder mi geliştiğinin ayrımı yapılmalıdır. Bu nedenle, tanı için yapılacak değerlendirmeler arasında etiyolojik faktörlerin geniş çaplı araştırılmasına da yer verilmelidir.
Sekonder MGN olgularında, neden olan ajanın kesilmesi (ör: pesilamin, altın tuzları ya da NSAİİ’ler) [135] ya da altta yatan hastalığın tedavisi ile NS tablosu genellikle düzelir.
Primer MGN tedavisinde amaç, renal fonksiyon kayıplarını ve NS nedeniyle oluşacak komplikasyonları (ör: hiperlipidemi, volüm yüklenmesi nedeniyle HT, trombofili gibi) önlemektir. Ancak bu sonuçlara ulaşmak için izlenmesi gereken tedavi planı konusu halen tartışmalıdır. Bugüne kadar uygulanan tedavilerde steroidler, immünsüpresif ilaçlar tek tek ya da kombine olarak kullanılmış, veya konservatif tedaviyle hastalar izlenmiş, ancak en etkin tedavinin hangisi olduğu konusunda görüş birliğine varılamamıştır [136-138].
2.9.1. Non-immünsüpresif Tedavi
Konservatif tedavi; ödem kontrolü, yüksek kan basıncı (KB) ve hipelipidemi tedavisi; renin anjiotensin sisteminin inhibisyonu yoluyla proteinürinin azaltılması ve diyetteki protein alımının düzenlenmesidir. Non-immünsüpresif tedavinin NS’li bütün hastalara verilmesi önerilmektedir.
MGN’nin tanımlanabilen nedenleri uygun testlerle dışlandıktan sonra, proteinüri derecesi tedavi yaklaşımını belirlemede yol gösterici olabilir. Non-nefrotik düzeyde proteinürisi olan hastalarda renal yetmezliğe progresyon görülmediğini destekleyen veriler bulunmaktadır [98, 110, 112, 139]. Bu hastalar NS’nin zararlı etkilerinden uzak durumdadırlar. Bu nedenle, bu tip hastalarda proteinüriyi düzeltmek amacıyla anjiotensin konverting enzim inhibitörü (ACEİ) ya da anjiotensin II reseptör blokeri (ARB) kullanımı temel yaklaşımı oluşturur. Kronik proteinürik böbrek hastalığı olan tüm hastalarda, ACEİ ya da ARB kullanımı önerilmektedir. Anjiotensin inhibisyonuyla intraglomerüler basınçta azalma görüleceğinden, hastalığın progresyon hızında belirgin bir yavaşlama gözlenir. ACEİ veya ARB grubu ilaçlar erken dönemde MGN olgularında protein eksresyonunu, KB ya da GFH’de değişikliğe yol açmadan, %35 oranında azaltabilir [140]. Proteinüride daha fazla düşüş elde etmek amacıyla ACEİ ile ARB’lerin kombinasyou denenebilir. Bu ajanlar kullanılırken sistemik KB, GFH ya da serum potasyum düzeylerinde değişikliğe yol açmadan, tolere edilebilen maksimal dozlara kadar titre edilebilir. Renal vasküler hastalık öyküsü ya da belirgin renal yetmezliği bulunan yaşlı hastalarda dikkatli olunmalıdır.
Ödemi olan hastalarda sodyum kısıtlaması yapılmalı ve diüretik ajanlar kullanılmalıdır [70]. Ödem tedavisi için düşük dereceli olgularda diyetle alınan tuz miktarının kısıtlanması ve düşük doz hidroklorotiyazid kullanımı yeterli olabilirken, daha ağır olgularda yüksek dozlarda loop diüretiklerinin kullanımı gerekebilmektedir. Yüksek doz loop diüretiği kullanımına rağmen yanıt alınamayan olgularda loop diüretiği ile hidroklorotiyazidlerin kombinasyonu denenebilir [43].
Hiperlipidemi, NS tanımının bir parçası olan ağır proteinüri tablosunu sıklıkla komplike eder. Total plazma kolesterol ve trigliserid düzeyleri tipik olarak yüksektir. NS’li hastalarda lipid düzeylerinin yüksek seyretmesi, zaten artmış olan koroner hastalık riskine katkıda bulunmaktadır. Artmış lipid düzeyi renal fonksiyonların da etkilenmesine sebep olabilir. Bu nedenle, uzun süreli üriner protein ekskresyon artışı yanında sekonder hiperlipidemi de saptanan olgularda, statin kullanımı önerilmektedir [141-143].
MGN dahil kronik proteinürik renal hastalığı olanlar için hedef KB ≤125/75 mmHg’dir. Bu hedefe ulaşılmasıyla, kronik proteinürik renal hastalığın progresyonu yavaşlayabilir ve kardiyovasküler açıdan bir korunma da sağlanabilir; çünkü kronik renal hastalıkların kardiyovasküler hastalık riskinde belirgin artışa neden olduğu bilinmektedir. MGN hastalarında hedef KB düzeyine ulaşmak için genellikle anjiotensin inhibisyonundan fazlasına ihtiyaç duyulur. Volüm yükünün azaltılması özel bir önem arz eder ve diüretik tedavisinin kullanılmasını gerektirir.
Diyette ılımlı bir protein kısıtlamasıyla (genellikle 0.8 g/kg/gün) proteinüride %15-25 oranında azalma görülebilir ve özellikle de protein ekskresyonu 2 ile 10 g/gün arasında olan hastalarda belirgin bir yan etkiye yol açmadan renal hastalığın progresyonu yavaşlatılabilir [64]. Ancak NS’li hastalara düşük proteinli diyet verilmesinin güvenli olup olmadığı belirsizdir.
NS’li hastalarda antikoagülan ilaç kullanımı tartışmalı bir konudur. NS hastaları derin ven trombozu, renal ven trombozu ve PE gibi tromboembolik komplikasyonlar açısından yüksek risk taşımaktadır. Bu riskin, özellikle de düşük albümin düzeyli ve tromboembolik hastalık öyküsü bulunan primer MGN olguları için daha da fazla olduğu düşünülmektedir. Yapılan analizlerde primer MGN hastalarında oral antikoagülan kullanımının, risklere oranla daha fazla yarar sağladığı gösterilmiştir [136]. Ancak antikoagülan tedavi başlamadan önce NS’nin ciddiyeti (serum albümin düzeyleri ile değerlendirilir), öyküde trombotik durum varlığı ve oral antikoagülanlarla oluşabilecek ciddi kanama olasılıkları gibi değişkenler göz önünde bulundurulmalıdır. Profilaktik antikoagülan tedavinin ideal olarak ne süreyle uygulanması bilinmemekle birlikte, NS devam ettiği sürece tedavinin sürdürülmesi gerektiği düşünülmektedir [144].
2.9.2 İmmünsüpresif Tedavi
Hafif ve orta şiddette hastalığı olanların birçoğunda spontan remisyon görülebilmesi ve immünsüpresif ajanların bilinen toksisiteleri nedeniyle, tedavi başlama kararı hastalığın progresif seyir izleme olasılığı temel alınarak verilmelidir [145]. Primer MGN’li hastalarda spontan remisyon oranlarının yüksek olması nedeniyle [10, 15], sadece şiddetli ya da progresif hastalığı olanlara immünsüpresif tedavi verilmesi önerilir.
2.9.2.1. Kortikosteroidler
Yıllar içerisinde MGN tedavisinde değişik ajanlar kullanılmıştır. İlk denemeler kortikosteroidler ile yapılmıştır. Kortikosteroidlerin tedavide tek başına kullanımının başarılı olmadığı görülmüştür [137, 146, 147]; ancak Japon hastaların bu konuda bir istisna oldukları düşünülmektedir [16]. Kortikosteroidlerin genellikle alkilleyiciler olmak üzere sitotoksik ajanlarla yapılan kombinasyonlarının MGN tedavisinde daha umut verici bir yaklaşım olduğu saptanmıştır [110].
2.9.2.2. Alkilleyici ajanlar
Progresyon açısından orta riskli olan hastalarda sitotoksik ilaçlarla ( siklofosfamid ya da klorambusil) kortikosteroidlerin kombinasyon tedavisinin önemli yarar sağladığı gösterilmiştir. Progresyon açısından orta riskli hastaları kapsayan randomize kontrollü prospektif çalışmalarda, siklofosfamid ya da klorambusil tedavisinin kortikosteroid ile kombine edilmesiyle, hem proteinüride remisyon sağlandığı hem de son dönem böbrek hastalığına progresyonun önlendiği kaydedilmiştir [110, 111, 148].
Siklofosfamid ve klorambusil temelli rejimlerin etkinlikleri hemen hemen aynıdır [148, 149]. Siklofosfamid ile toksiste oranlarının daha düşük olması nedeniyle, klorambusil rejimine göre daha çok tercih edilmektedir. Oral prednizon (günde 0.5 mg/kg) ya da metilprednizolon (günde 0.4 mg/kg) 1, 3, 5. aylarda ve oral siklofosfamid (günde 2-2.5 mg/kg) 2, 4, 6. aylarda kullanılmak üzere kombinasyon tedavisi yapılır [111, 148]. Glukukortikoid ile başlayan aylarda 3 günlük 1 g/gün’den intravenöz metilprednizolon verilip sonra oral doza geçilir.
Klorambusil ve kortikosteroid kombinasyon rejiminde; 3 gün boyunca 1 g metilprednizolonu takiben, 1 ay boyunca metilprednizolon (günde 0.4 mg/kg) tedavisine devam edilir, sonraki ay klorambusil (günde 0.2 mg/kg) şeklinde değiştirilerek, toplamda 6 ay süren tedavi uygulanır [110].
Alkilleyici ajanlarla yapılmış çalışmalarda 5 yıllık renal sağkalım %86-92 arasında değişmekteyken, remisyon oranları %65-85 arasında değişkenlik göstermekte ve 5 yıl sonrası relaps oranları %25 civarında seyretmektedir [70]. Sitotoksik temelli tedavi alıp relaps görülen olgularda kalsinörin inhibitörlerine geçilebilir ya da aynı sitotoksik tedavinin ikinci
kür uygulaması yapılabilir [148, 150, 151]. Tekrarlayan relaps olgularında iki kürden fazla sitotoksik tedavi verilmemektedir.
Uzun süreli kullanıldığında siklofosfamidin yan etkileri bu tedavinin yaygın kullanımı için en önemli engeldir. Yan etkiler şunlardır: infeksiyonlara eğilim, anemi, trombositopeni, bulantı, kusma, sterilite ve başta mesane kanseri olmak üzere uzun sürede malignitedir. Klorambusile bakıldığında esas sorun akut lösemi veya lenfomaya neden olma olasılığıdır. Siklofosfamid tedavisi, klorambusile göre yan etkilerinin daha az olmasından dolayı anlamlı derecede daha az oranda ilaç kesilmesine neden olmuştur [152].
2.9.2.3. Kalsinörin inhibitörleri: Siklosporin ve Takrolimus
Primer MGN’li hastalarda hem siklosporinin hem de takrolimusun tedavide etkili olduğu görülmüştür. Ancak kalsinörin inhibitörü temelli tedavi alan hasta grubundaki relaps oranlarının, sitotoksik tedavi alanlara göre daha yüksek olduğu gösterilmiştir [153-156].
MGN tedavisinde steroid-sitotoksik ajan tedavisine alternatif olabilecek en iyi ve en çok üstünde çalışılmış ajan siklosporindir. Siklosporin interlökin-2 üretimini baskılayarak etkisini göstermektedir ve 1980’lerden itibaren renal transplantasyonda etkili biçimde kullanılmaktadır. Glomerülonefrit tedavisinde ise 1986’lardan beri kullanılmaktadır [157]. Siklosporin genellikle 3.5-5 mg/kg/gün gibi düşük dozlarda kullanılır. Düşük doz prednizon (maksimum 10 mg/gün) ile kombine edilen siklosporinin protein remisyonunu indüklemede ve son dönem böbrek hastalığına progresyonu önlemede başarılı olduğu gösterilmiştir [127, 153, 154]. Siklosporin MGN’de protein ekskresyonunu genellikle %30-50 oranında azaltmaktadır ve %70 hastada tam ya da daha sık olarak kısmi remisyon görülmektedir [153]. Kısa dönemli siklosporin kullanımı sonrasında (4-6 ay) relaps sıklıkla izlenir, ancak tedavi süresi uzatılırsa (1-2 yıl) remisyonun daha kalıcı olacağı düşünülmektedir [158]. Yanıt alınan olgularda renal fonksiyonların da stabilize olduğu gözlenmiştir. Siklosporin ile tam remisyon oranlarının belirgin az, tedavinin kesilmesi sonrası relaps oranlarının yüksek, ilacın potansiyel nefrotoksik etkilerinin olması ve tedavi sürecinde HT, hiperkalemi gibi problemlerin görülmesi nedeniyle, sitotoksik ajan tedavisine göre ikinci seçenek bir ilaçtır. Renal fonksiyonları bozuk hastalarda siklosporin kullanımı önerilmemektedir.
Takrolimus ile siklosporinin etkinlikleri benzerdir. Siklosporin takrolimusa göre klinikte daha yaygın kullanılan bir ajandır. Takrolimus MGN’de proteinüriyi azaltmaktadır, ancak ‘’patolojiyi etkilemiyor olabilir’’. Bu tedaviyi alan hastalarda relaps oranlarının belirgin bir
şekilde yüksek olduğu gözlenmiştir [155, 160].
2.9.2.4. Mikofenolat mofetil (MMF)
MMF de novo pürin sentezini baskılayarak, T ve B hücre, düz kas hücresi ve fibroblast proliferasyonunu engellemekte ve bu mekanizma ile böbreği progresif hastalıklardan korumaktadır. MMF ile monoterapinin etkin olmadığı gösterilmiştir [161]. MMF’nin 2 g/gün dozunda ve korikosteroid ile kombine edilmesiyle sağlanan remisyonun, siklofosfamid ya da klorambusil tedavisiyle sağlanan remisyon kadar etkin olabileceği düşünülmektedir [162]. Ancak tedavinin sonlandırılmasını takip eden 2 yıl içerisinde hastaların çoğunda (%75) relaps görülmektedir ve renal hastalık son dönemi ile ilgili sağlanan yararlar açısından net bulgulara erişilememiştir. Bu nedenle MMF tedavisinin sadece, sitotoksik ajanları ya da kalsinörin inhibitörlerini kullanamayacak ya da bu rejimleri tolere edemeyen hasta gruplarında alternatif tedavi olarak kullanılması önerilmektedir.
2.9.2.5. Azatioprin
Renal fonksiyonlarında bozulma görülen yüksek riskli hasta grubunda, kortikosteroid ile kombine edilmiş azatioprin tedavisinin etkili olduğunu bildiren yayınlar mevcuttur. Bu tedavi protokolü ile hastaların bazılarında proteinüride gerileme sağlanmış ya da renal fonksiyonlarında düzelme görülmüştür [163, 164]. Bu verilere karşıt olarak, yapılan bazı çalışmalarda azatioprinin yararlı olmadığı gösterilmiştir [165, 166]. Sonuç olarak, MGN tedavisinde azatioprin ve kortikosteroid kombinasyonunun sınırlı bir yeri olabileceği söylenebilir.
2.9.2.6. Ritüksimab
Ritüksimab, B ve/veya plazma hücrelerinin azalmasına yol açan bir anti-CD20 monoklonal antikorudur. Son zamanlarda yayınlanmış çalışmalarda ritüksimabın da MGN tedavisinde kullanılabileceği ileri sürülmüştür [167]. Tedavide ritüksimabın kullanılmasıyla birlikte MGN’de remisyon insidanslarının arttığı gözlenmiştir. En iyi sonuçlar renal fonksiyonları normal olan ve orta derecede proteinüriye sahip kadın olgularda bildirilmiştir [168]. Orta derecede tübülointerstisyel fibrozisi olan hastalarda ise tedavinin etkin olmadığı

![Tablo 2: Sekonder MGN nedenleri [2]](https://thumb-eu.123doks.com/thumbv2/9libnet/3040897.2784/22.892.112.754.136.877/tablo-sekonder-mgn-nedenleri.webp)
![Tablo 3: Primer MGN’li hastalardaki prognostik faktörler [43]](https://thumb-eu.123doks.com/thumbv2/9libnet/3040897.2784/29.892.103.803.795.1087/tablo-primer-mgn-li-hastalardaki-prognostik-faktorler.webp)
![Tablo 4: MGN’de risk derecelendirmesi [93]](https://thumb-eu.123doks.com/thumbv2/9libnet/3040897.2784/31.892.100.799.152.592/tablo-mgn-de-risk-derecelendirmesi.webp)
![Tablo 5: Primer MGN’ de tedavi algoritmi [127]](https://thumb-eu.123doks.com/thumbv2/9libnet/3040897.2784/37.892.104.758.598.1096/tablo-primer-mgn-de-tedavi-algoritmi.webp)