T.C.
EGE ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ
HĠSTOLOJĠ VE EMBRĠYOLOJĠ ANABĠLĠM DALI
SIÇAN OVER DOKUSU VĠTRĠFĠKASYONUNDA PLATELETTEN ZENGĠN PLAZMA (PRP) EKLENMĠġ
DONDURMA SOLÜSYONUNUN ETKĠLERĠNĠN HĠSTOLOJĠK OLARAK ĠNCELENMESĠ
UZMANLIK TEZĠ Dr. AYLĠN GÖKHAN
DANIġMAN Prof. Dr. MERAL BAKA
ĠZMĠR 2018
T.C.
EGE ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ
HĠSTOLOJĠ VE EMBRĠYOLOJĠ ANABĠLĠM DALI
SIÇAN OVER DOKUSU VĠTRĠFĠKASYONUNDA PLATELETTEN ZENGĠN PLAZMA (PRP) EKLENMĠġ
DONDURMA SOLÜSYONUNUN ETKĠLERĠNĠN HĠSTOLOJĠK OLARAK ĠNCELENMESĠ
UZMANLIK TEZĠ Dr. AYLĠN GÖKHAN
DANIġMAN Prof. Dr. MERAL BAKA
ĠZMĠR 2018
TEġEKKÜR
2015 yılından beri asistanlığım boyunca bilgi ve deneyimlerini aktararak eğitimimi destekleyen, sabırlı ve hoĢgörülü tavrıyla her zaman motive eden, sevgili hocam, anabilim dalı baĢkanımız Prof. Dr. AyĢegül UYSAL‟a;
Bilim aĢkını yenilikçi tarzıyla aĢılayarak ihtisasım boyunca engin bilgi ve ileri görüĢlülüğüyle bana yön veren, sabırla ve her türlü motivasyonla eğitimimi destekleyen, her zaman saygıyla anacağım çok kıymetli hocam ve tez danıĢmanım Prof. Dr. Meral BAKA‟ya;
Kendilerinden çok değerli bilgiler öğrendiğim ve eğitimin yanında hayata dair bilgi ve becerilerini aktararak emek veren, asistanları olmaktan gurur duyduğum kıymetli hocalarım Prof. Dr. Hüseyin AKTUĞ, Prof. Dr. Gülperi ÖKTEM, Prof. Dr. Altuğ YAVAġOĞLU, Prof. Dr. Yiğit UYANIKGĠL, Doç. Dr. Özlem YILMAZ ve anabilim dalımızın değerli uzmanı Uzm. Dr. Fatih OLTULU‟ya;
Gerek ihtisas eğitimi gerek hayat hakkında tecrübelerini aktararak hem eğiten hem öğreten, düĢsem de ayağa kalkabileceğimi gösteren, sabırla emek, güven ve sevgi veren ayrıca tezimin her aĢamasında özveriyle yol gösteren Doç. Dr. Türker ÇAVUġOĞLU‟na;
Biyokimya çalıĢmalarına katkı sağlayan üniversitemizin çok değerli hocası Prof. Dr. Eser SÖZMEN‟e, istatistiksel verilerin analizinde destek veren üniversitemizin çok değerli hocası Doç Dr. Timur KÖSE‟ye; tezimde desteğini esirgemeyen Doç. Dr. Oytun ERBAġ‟a;
Deney ve laboratuvar çalıĢmalarında destek aldığım, güler yüzlülükleriyle her zaman yanımda olan Dr. Canberk TOMRUK ve Dr. Tuğba ġENKAYA‟ya ve tezimle ilgili deneysel çalıĢmalarda ve yazım aĢamasında yardım eden aynı zamanda eğlenceli arkadaĢlığını esirgemeyen AraĢ. Gör. Kubilay Doğan KILIÇ‟a;
Manevi desteklerinden dolayı Aylin BUHUR ve Cansın ġĠRĠN‟e; laboratuvar çalıĢmalarımdaki katkılarından dolayı laboratuvar sorumlusu teknisyenimiz Erdinç YILMAZ‟a; biyokimyasal analizdeki katkılarından dolayı Hikmet MEMMEDOV‟a;
Beraber çalıĢmaktan ve dostluklarından mutluluk duyduğum tüm asistan arkadaĢlarım ve bir aile olmamızı sağlayan anabilim dalımızın bütün çalıĢanlarına teĢekkür ederim.
Tüm fedakarlıklarıyla, sevgileriyle, maddi manevi her türlü destekleriyle yanımda olan, en zor zamanlarımda motivasyonlarıyla beni ayakta tutan, hayata dair verdikleri bilgilerle bana sürekli ıĢık tutan, bugünlere gelmemi sağlayan canımdan çok sevdiğim annem ve ayrıca doktorluk mesleğimde de bana daima örnek olan canım babam, canım abim ve biricik ailesine;
TanıĢtığım günden beri her yönüyle sevdiğim, her daim yanımda olan, sabırla beni destekleyen, öngörüsüyle güven veren aynı zamanda mesleki açıdan da destek olan, hayatımın anlamı sevgili eĢim Dr. Fahri GÖKHAN ve yardımlarını esirgemeyen öz ailem gibi benimsediğim ailesine ve hayatıma renk katan, varlıklarına Ģükrettiğim sevgi dolu miniklerim Gizem GÖKHAN ve Gamze GÖKHAN‟a yanımda oldukları için sonsuz teĢekkür ederim.
Dr. Aylin GÖKHAN ĠZMĠR, 2018
i ĠÇĠNDEKĠLER ÖZET ... v ABSTRACT ...vii TABLOLAR LİSTESİ ... ix ŞEKİLLER LİSTESİ ... x
KISALTMALAR LİSTESİ ... xii
1. GİRİŞ ... 1
2. GENEL BİLGİLER ... 3
2.1.KADIN GENİTAL SİSTEMİNE GENEL BAKIŞ ... 3
2.1.1.OVER ANATOMİSİ ... 4 2.1.2.OVER EMBRİYOLOJİSİ ... 5 2.1.3.OVER HİSTOLOJİSİ ... 7 2.1.4.FOLİKÜL GELİŞİMİ ... 8 2.1.5.OVULASYON ... 13 2.1.6.KORPUS LUTEUM... 14 2.1.7.KAPASİTASYON VE FERTİLİZASYON ... 16 2.1.8.FOLİKÜLER ATREZİ ... 19
2.2.SIÇAN OVER DOKUSU ... 22
2.2.1. SIÇAN OVER EMBRİYOLOJİSİ ... 23
2.2.2. SIÇAN OVER HİSTOLOJİSİ ... 24
2.3.KRİYOBİYOLOJİ ... 27 2.3.1. KRİYOPREZERVASYON VE KRİYOHASAR ... 27 2.3.2. KRİYOPROTEKTANLAR... 29 2.3.2.1.GLİSEROL ... 33 2.3.2.2.DİMETİL SÜLFOKSİT ... 33 2.3.2.3.ETİLEN GLİKOL ... 34 2.3.2.4.PROPİLEN GLİKOL ... 34 2.3.2.5.SÜKROZ ... 35 2.3.2.6.MAKROMOLEKÜLLER/POLİMERLER ... 36 2.3.3.TAŞIYICI SOLÜSYON ... 36 2.3.4.KRİYOPROTEKTAN TOKSİSİTESİ ... 37 2.3.5.KRİYOPREZERVASYON ... 38 2.3.5.1.YAVAŞ DONDURMA ... 40 2.3.5.2.VİTRİFİKASYON ... 40
ii
2.3.5.2.1.VİTRİFİKASYONDA ÖRNEK YÜKLEME EKİPMANLARI ... 43
2.3.5.2.1.1.AÇIK SİSTEM (OPEN DEVICE) EKİPMANLARI ... 43
2.3.5.2.1.2.KAPALI SİSTEM (CLOSED DEVICE) EKİPMANLARI ... 45
2.3.6. OOSİT KRİYOPREZERVASYONU ... 48
2.3.7. EMBRİYO KRİYOPREZERVASYONU ... 50
2.3.8. OVER DOKUSU KRİYOPREZERVASYONU ... 52
2.3.9. HAYVANLARDA OVER DOKUSUNUN KRİYOPREZERVASYONU ... 57
2.4.PLATELETLERİN FİZYOLOJİSİ ... 58
2.5.PLATELETTEN ZENGİN PLAZMA TARİHİ VE TANIMI ... 63
2.6.PLATELETTEN ZENGİN PLAZMA HAZIRLANMASI VE AKTİVASYONU ... 64
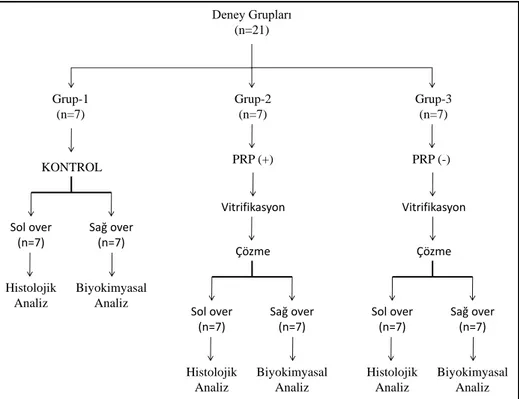
3.GEREÇ VE YÖNTEM... 65 3.1.DENEYSEL GEREÇLER ... 65 3.2.DENEYSEL YÖNTEM ... 68 3.2.1. DENEY TASARIMI ... 68 3.2.2. BİYOKİMYASAL ANALİZ ... 71 3.2.2.1.MDA ÖLÇÜMÜ ... 71 3.2.2.2.KATALAZ ÖLÇÜMÜ ... 71 3.2.2.3.MPO ÖLÇÜMÜ ... 71
3.2.3. PLATELETTEN ZENGİN PLAZMA HAZIRLANMASI ... 72
3.2.4. VİTRİFİKASYON VE ÇÖZME (WARMING) İŞLEMLERİNDE KULLANILAN SOLÜSYONLAR ... 73
3.2.4.1.BASE MEDIUM ... 73
3.2.4.2.DENGELEME SOLÜSYONU (EQUILIBRATION MEDIUM) ... 73
3.2.4.3.VİTRİFİKASYON SOLÜSYONLARI (VS-1/VS-2) ... 73
3.2.4.3.1.VS-1 ... 73
3.2.4.3.2.VS-2 ... 73
3.2.4.4.ÇÖZME SOLÜSYONLARI (WARMING SOLUTIONS) ... 74
3.2.4.4.1.WS-1 ... 74
3.2.4.4.2.WS-2 ... 74
3.2.4.4.3.WS-3 ... 74
3.2.5.VİTRİFİKASYON İŞLEMİ ... 75
3.2.6.ÇÖZME İŞLEMİ (WARMING) ... 75
3.3. MİKROSKOPİK GEREÇ VE YÖNTEM ... 77
3.3.1.TESPİT SOLÜSYONLARI ... 77
3.3.1.1.%4’LÜK PARAFORMALDEHİT TESPİT SOLÜSYONU ... 77
iii
3.3.2.IŞIK MİKROSKOBU YÖNTEMLERİ ... 78
3.3.2.1.DOKU TAKİBİ VE GÖMME ... 78
3.3.2.2.KESİT ALMA ... 78
3.3.2.3.HİSTOKİMYASAL BOYAMA ... 78
3.3.2.3.1.HEMATOKSİLEN EOSİN BOYAMA... 78
3.3.2.3.1.1.HE BOYAMA İÇİN HAZIRLANAN SOLÜSYONLAR ... 78
3.3.2.3.1.2.HE BOYAMA TEKNİĞİ ... 79
3.3.2.3.2.PERİYODİK ASİT SCHIFF BOYAMA ... 80
3.3.2.3.2.1.PAS BOYAMADA KULLANILAN SOLÜSYONLAR ... 80
3.3.2.3.2.2.PAS BOYAMA TEKNİĞİ ... 81
3.3.2.3.3.MALLORY TRİKROM BOYAMA ... 82
3.3.2.3.3.1.MALLORY TRİKROM BOYAMADA KULLANILAN SOLÜSYONLAR ... 82
3.3.2.3.3.2.MALLORY TRİKROM BOYAMA TEKNİĞİ ... 82
3.3.2.4.İMMÜNHİSTOKİMYASAL BOYAMA ... 83
3.3.2.5.TUNEL BOYAMA ... 84
3.3.2.6.İMMÜNFLORESAN BOYAMA ... 85
3.3.2.6.1.KASPAZ 3 İMMÜNFLORESAN BOYAMA ... 85
3.3.2.6.1.1.KASPAZ 3 İMMÜNFLORESAN BOYAMA TEKNİĞİ ... 85
3.3.2.6.2.TUNEL İMMÜNFLORESAN BOYAMA ... 86
3.3.2.6.2.1.TUNEL İMMÜNFLORESAN BOYAMA TEKNİĞİ ... 86
4. BULGULAR ... 87
4.1.BİYOKİMYASAL BULGULAR ... 87
4.2.MİKROSKOPİK BULGULAR ... 88
4.2.1.IŞIK MİKROSKOPİ BULGULARI ... 88
4.2.1.1.HİSTOKİMYASAL BULGULAR ... 88
4.2.1.1.1.GRUP 1 (KONTROL GRUBU) ... 88
4.2.1.1.2.GRUP 2 *PRP EKLENMİŞ GRUP; PRP(+) GRUP+ ... 89
4.2.1.1.3.GRUP 3 [PRP EKLENMEMİŞ GRUP; PRP(-) GRUP] ... 91
4.2.1.2.İMMÜNHİSTOKİMYASAL BULGULAR ... 93 4.2.1.2.1.KONNEKSİN 43 İMMÜNREAKTİVİTESİ ... 93 4.2.1.2.2.BAX İMMÜNREAKTİVİTESİ ... 94 4.2.1.2.3.BCL-2 İMMÜNREAKTİVİTESİ ... 95 4.2.1.2.4.KASPAZ 3 İMMÜNREAKTİVİTESİ ... 96 4.2.1.2.5.TUNEL İMMÜNREAKTİVİTESİ ... 97 4.2.1.3.İMMÜNFLORESAN BULGULAR ... 98
iv
4.2.1.3.1.KASPAZ 3 İMMÜNFLORESAN ... 98
4.2.1.3.2.TUNEL İMMÜNFLORESAN ... 100
4.3.İSTATİSTİKSEL BULGULAR... 102
4.3.1.İSTATİSTİKSEL ANALİZ YÖNTEMLERİ ... 102
4.3.2.İSTATİSTİKSEL ANALİZ SONUÇLARI ... 103
5. TARTIŞMA... 108
6. SONUÇ VE ÖNERİLER ... 125
7. KAYNAKLAR ... 126
v
ÖZET
Kanser veya kanser dıĢı nedenlerle gonadotoksik tedavi alacak özellikle prepubertal çağdaki hastalar ve fertilite arzusunu ertelemek isteyenlerde doğurganlığın korunabilmesi günümüz Ģartlarında mümkündür. GeliĢen tedavi protokolleri ile bazı kanserlerde kür sağlanmakta ancak alınan kemoterapötik ilaçlar ve/veya radyoterapi sonrası ovaryan disfonksiyon kaçınılmaz olmaktadır. Fertilitenin korunması için oosit ve embriyo kriyoprezervasyonu gibi yöntemler seçenekler arasında bulunmaktadır ancak bu iĢlemlerde önceden stimülasyon protokollerine ihtiyaç duyulmaktadır. Hızlıca kemoradyoterapi baĢlanması gereken hastalarda ovaryan stimülasyon iĢlemlerine vakit kalmamaktadır. Söz konusu durumlarda ovaryan kriyoprezervasyon alternatif bir tedavi seçeneği sunmaktadır.
Günümüzde over doku kriyoprezervasyonu sonucu sağlıklı gebelikler bildirilmiĢtir. Over doku kriyoprezervasyonu iĢleminin baĢarılı örnekleri literatürde mevcut olmakla birlikte hala deneysel çalıĢma olarak nitelendirilmekte ve prosedürlerin geliĢtirilmesine ihtiyaç duyulmaktadır. Kriyoprezervasyon ve kriyoprotektan ajanlardan kaynaklanan hücresel hasarın azaltılmasında çeĢitli maddeler denenmiĢ ve olumlu sonuçlar elde edilmiĢtir. Kriyohasarı azaltmak amacıyla plateletten zengin plazmanın kullanılabilirliği çalıĢmamıza konu olmuĢtur.
Plateletten zengin plazma (PRP), plateletlerin yoğunlaĢtırılmasıyla elde edilen bir kan ürünüdür. Ġçeriğindeki zengin büyüme faktörleri sayesinde rejeneratif tıpta oldukça fazla kullanım alanı bulmuĢtur. Besiyerlerine eklenen hücresel fonksiyonlarda destekleyici görev gören fetal sığır serumunun (FBS) alternatifi olarak PRP kullanılması ile hayvansal maddelerin veya enfeksiyöz patojenlerin geçiĢi elimine edilmektedir. Ayrıca PRP‟nin otolog kullanılması nedeniyle immün reaksiyon ihtimali azalmaktadır.
Kriyoprezervasyon tekniklerinin geliĢtirilmesi adına literatürde ilk defa sıçan bütün over doku kriyoprezervasyon iĢleminde vitrifikasyon solüsyonuna PRP eklenerek dokular dondurulmuĢtur. Dokular kontrol (Grup 1), vitrifikasyon solüsyonuna PRP eklenerek dondurulan PRP eklenmiĢ (Grup 2) ve vitrifikasyon solüsyonuna FBS eklenerek dondurulan PRP eklenmemiĢ (Grup3) olarak gruplandırıldı. Çözme sonrası dokular histokimyasal, immünhistokimyasal ve immünfloresan boyama yöntemleri ile boyanarak incelendi. Histokimyasal boyama yöntemi ile HE, PAS ve Mallory Trikrom boyamaları yapıldı. Ġmmünfloresan boyama yötemiyle kaspaz 3 ekspresyonuna ve TUNEL analizine bakıldı. Ġmmünhistokimyasal boyama yöntemiyle konneksin 43, Bax, Bcl-2 ve kaspaz 3 ekspresyonu incelendi ve TUNEL analizi yapıldı.
vi Sonuçta kontrol grubu ile karĢılaĢtırıldığında gerek Grup 2‟de gerekse Grup 3‟te vitrifikasyona bağlı dejenerasyonların olduğu görülmüĢtür. Ancak Grup 2‟de PRP‟yi aktive etmek için kullanılan CaCl2‟ün vitrifikasyonun zararlı etkilerini agreve ederek over dokusunda görülen dejenerasyonu arttırdığı ve PRP‟nin muhtemel olumlu etkilerini önlediği tespit edilmiĢtir. Her iki deney grubunda da primordiyal foliküllerin korunmuĢ olduğu ancak foliküler geliĢimin ileri aĢamasındaki foliküllerde dejenerasyonun artmıĢ olduğu dikkati çekti. Elde edilen bulgular ıĢığında sıçan over dokusu kriyoprezervasyonunun bütün over dokusu yerine kortikal parçalar halinde yapılması, PRP aktivasyonu için CaCl2 yerine baĢka metodların uygulanması, vitrifikasyon solusyonlarına CaCl2 eklenmemesi, PRP‟nin kriyoprezervasyondaki muhtemel yararlı etkilerinin gösterilmesi ve standardizasyonunun sağlanması için CaCl2 ile aktive edilmemiĢ PRP‟nin hem vitrifikasyon hem de yavaĢ dondurma yönteminde uygulanarak sonuçlarının analiz edilmesi gerektiği kanaatine vardık.
Anahtar kelimeler: Fertilitenin korunması, kriyoprezervasyon, over doku vitrifikasyonu, plateletten zengin plazma.
vii
ABSTRACT
It is possible to preserve fertility especially in the prepubertal age and those who want to postpone the desire for fertility in today's conditions. The cure is provided in some cancers with improved treatment protocols, but ovarian dysfunction is inevitable after chemotherapeutic drugs and/or radiotherapy. Methods such as oocyte and embryo cryopreservation to protect fertility are among the treatment options, but these require pre-stimulation protocols. There is no time for ovarian pre-stimulation procedures in patients who should undergo rapid chemoradiotherapy. Ovarian cryopreservation provides an alternative treatment option in these cases.
Today, healthy pregnancies have been reported due to ovarian tissue cryopreservation. Successful specimens of ovarian cryopreservation are still available in the literature but are still considered to be experimental studies and need to be developed. Several substances have been tried and positive results have been obtained for cryopreservation and reduction of cellular damage caused by cryoprotectant agents. The availability of platelet-rich plasma in order to reduce cryodamages has been the subject of our study.
Platelet-rich plasma (PRP) is a blood product obtained by condensation of platelets. It is frequently used in regenerative medicine because of its rich growth factors. The risk of animal substances or infectious pathogens transmission is eliminated by the use of PRP in the mediums as an alternative to fetal bovine serum (FBS) for supporting cellular functions. Moreover, the possibility of an immune reaction is reduced due to the autologous use of PRP.
In order to develop cryopreservation techniques, tissues were frozen by adding PRP to the vitrification solution in whole ovarian cryopreservation procedure. Tissues are grouped as control (Group 1), vitrification group treated with PRP added freezing solution (Group 2), and vitrification group treated with FBS added freezing solution (Group 3). After thawing, tissues were stained by histochemical, immunohistochemical and immunofluorescent staining methods. HE, PAS and Mallory Trichrome stainings were performed by histochemically. The expression of caspase 3 and TUNEL analysis were investigated by immunofluorescence staining methods. The expressions of connexin 43, Bax, Bcl-2 and caspase 3 were investigated by immunohistochemical staining methods and TUNEL analysis was also performed.
viii In conclusion, degenerations due to vitrification were observed both in Group 2 and Group 3 compared to the control group. However, CaCl2 used to activate PRP in Group 2 was found to aggregate the harmful effects of vitrification and increase the degeneration of ovarian tissue and prevent the possible positive effects of PRP. In both experimental groups, it was noted that the primordial follicles were preserved, but degeneration of the follicles at the advanced stages of follicular development was increased. In the light of the findings, it was concluded that the rat ovarian cryopreservation should be performed as cortical parts instead of whole ovarian tissue. We concluded that the results should be analyzed by applying both vitrification and slow freezing methods.
Keyword: Fertility preservation, cryopreservation, ovarian tissue vitrification, platelet rich plasma.
ix
TABLOLAR LĠSTESĠ
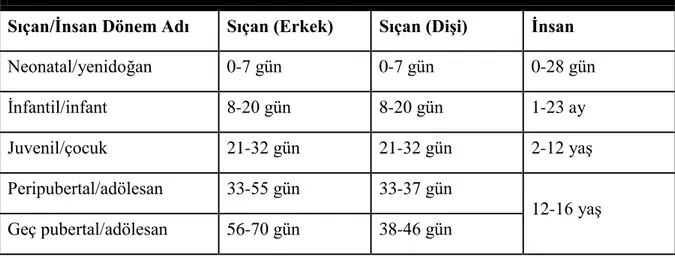
TABLO 1. SIÇAN VE İNSANDA DOĞUM SONRASI GELİŞİM DÖNEMLERİ ... 23
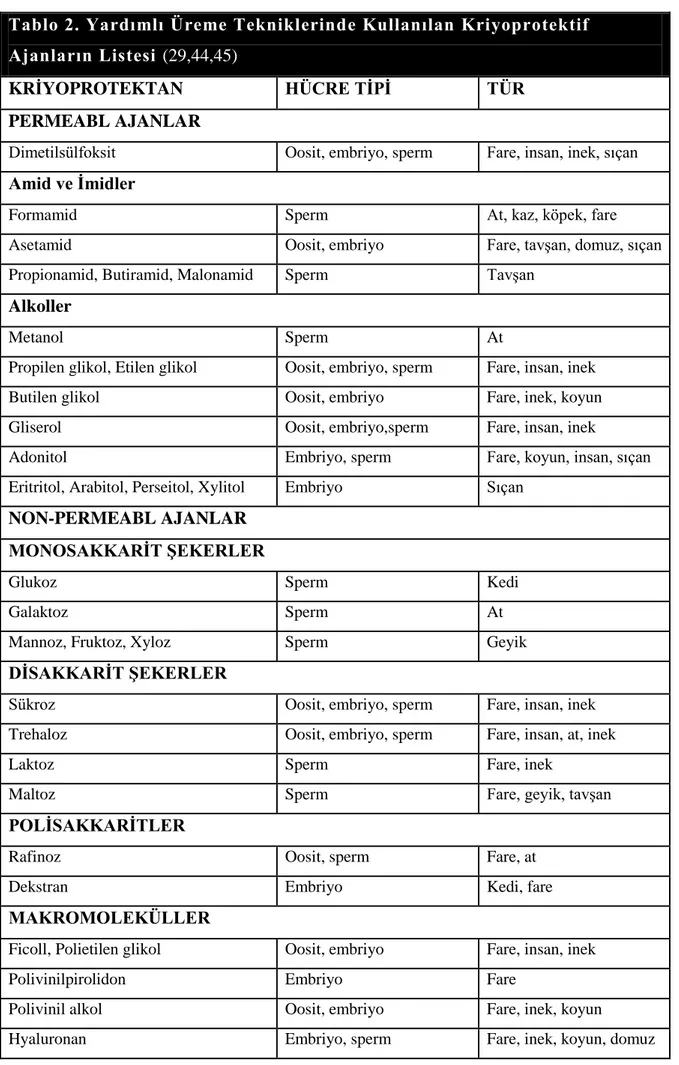
TABLO 2. YARDIMLI ÜREME TEKNİKLERİNDE KULLANILAN KRİYOPROTEKTİF AJANLARIN LİSTESİ ... 31
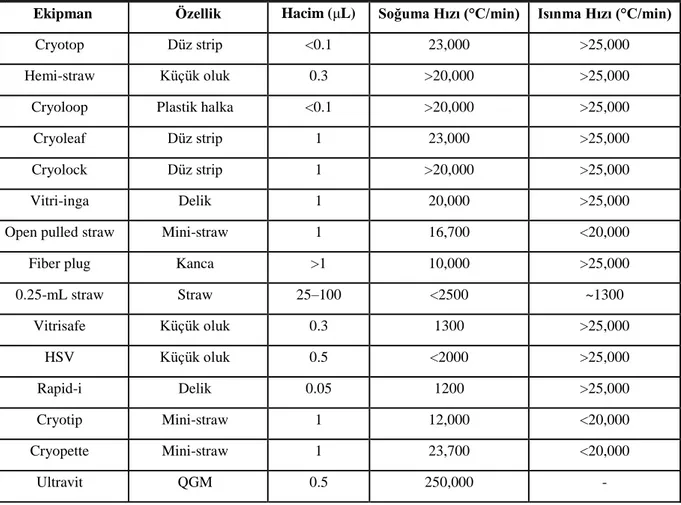
TABLO 3. VİTRİFİKASYONDA KULLANILAN AÇIK VE KAPALI SİSTEM EKİPMANLARININ GENEL ÖZELLİKLERİ ... 48
TABLO 4. GONADAL TOKSİSİTEYE GÖRE SİTOTOKSİK AJANLAR ... 52
TABLO 5. OVER KRİYOPREZERVASYONU YAPILABİLECEK BAZI HASTALIKLAR ... 53
TABLO 6. PRP’DE BULUNAN BAZI FAKTÖRLER VE FONKSIYONLARI... 59
TABLO 7. %4’LÜK PARAFORMALDEHİT TESPİT SOLÜSYONU HAZIRLANIŞI ... 77
TABLO 8. FOSFAT TAMPON SOLÜSYONU (PBS) HAZIRLANIŞI ... 77
TABLO 9. HE BOYAMA İÇİN ÖN HAZIRLIK ... 79
TABLO 10. PERİODİK ASİT SCHİFF (PAS) BOYAMA İÇİN ÖN HAZIRLIK ... 80
TABLO 11. MALLORY TRİKROM BOYAMADA KULLANILAN SOLÜSYONLAR ... 82
TABLO 12. SIÇAN OVER DOKU BIYOKIMYASAL ANALIZ DEĞERLERI ... 87
TABLO 13. SAĞLAM VE DEJENERE PRİMER FOLİKÜL SAYILARI ... 103
x
ġEKĠLLER LĠSTESĠ
ŞEKİL 1. KADIN GENİTAL SİSTEMİNE AİT BAZI YAPILARIN ŞEMATİK GÖRÜNÜMÜ ... 4
ŞEKİL 2. OVERİN ŞEMATİK GÖRÜNÜMÜ ... 7
ŞEKİL 3. OVER KESİTİ VE FOLİKÜLER EVRELERİN ŞEMATİK GÖRÜNÜMÜ ... 9
ŞEKİL 4. İNSAN KORPUS LUTEUMUNUN ŞEMATİK GÖRÜNÜMÜ ... 15
ŞEKİL 5. OVERDE ATRETİK FOLİKÜL ÖRNEKLERİ ... 21
ŞEKİL 6. SIÇAN OVER KESİTİNİN HİSTOLOJİK GÖRÜNÜMÜ ... 24
ŞEKİL 7. SIÇAN OVERİNE AİT HİSTOLOJİK KESİTLER ... 26
ŞEKİL 8. BAZI PERMEABL KRİYOPROTEKTANLARIN KİMYASAL YAPISI ... 35
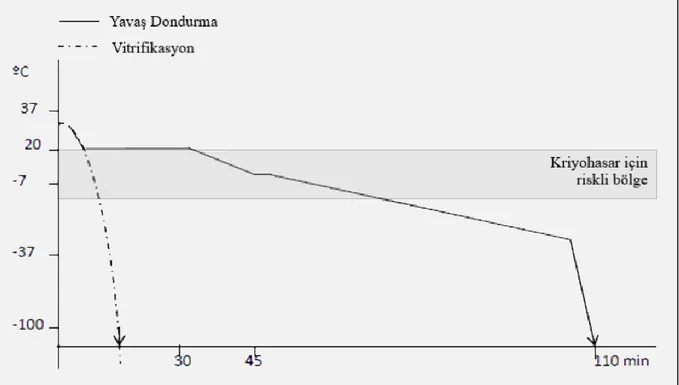
ŞEKİL 9. YAVAŞ DONDURMA VE VİTRİFİKASYON SIRASINDA SOĞUTMA HIZININ ŞEMATİK GÖSTERİLİŞİ. ... 42
ŞEKİL 10. AÇIK VE KAPALI SİSTEM ÖRNEK EKİPMANLARI ... 47
ŞEKİL 11. OVER DOKU KRİYOPREZERVASYONUNUN BAŞARISINI ETKİLEYEN HUSUSLAR ... 56
ŞEKİL 12. DENEY PLANININ ÖZETİ. ... 68
ŞEKİL 13. SIÇAN OVER DİSEKSİYONU. ... 69
ŞEKİL 14. BİYOKİMYASAL ANALİZ İÇİN AYRILAN OVER ÖRNEĞİ. ... 70
ŞEKİL 15. KONTROL GURUBU OVER FOTOĞRAFI. ... 70
ŞEKİL 16. İNTRAKARDİYAK PONKSİYON İŞLEMİ. ... 72
ŞEKİL 17. PRP ELDE ETMEK İÇİN YAPILAN SANTRİFÜJ İŞLEMLERİ.. ... 72
ŞEKİL 18. FİKSATİFTE KONTROL GRUBU VE BASE MEDİUMDA DENEY GRUBU OVER DOKUSU ... 74
ŞEKİL 19. VİTRİFİKASYON YÖNTEMİ İLE OVER DOKU KRİYOPREZERVASYONU. ... 75
ŞEKİL 20. WARMING İŞLEMİNİN BASAMAKLARI ... 76
ŞEKİL 21. SCHIFF REAKTİFİ VE PAS BOYASI. ... 80
ŞEKİL 22. G1, G2 VE G3 GRUPLARINA AİT HEMATOKSİLEN EOZİN BOYAMA ... 88
ŞEKİL 23. G1, G2 VE G3 GRUPLARINA AİT PAS BOYAMA ... 90
ŞEKİL 24. G1, G2 VE G3 GRUPLARINA AİT MALLORY TRİKROM BOYAMA ... 92
ŞEKİL 25. G1, G2 VE G3 GRUPLARINA AİT CX 43 İMMÜNHİSTOKİMYASAL BOYAMA ... 93
ŞEKİL 26. G1, G2 VE G3 GRUPLARINA AİT BAX İMMÜNHİSTOKİMYASAL BOYAMA ... 94
ŞEKİL 27. G1, G2 VE G3 GRUPLARINA AİT BCL-2 İMMÜNHİSTOKİMYASAL BOYAMA ... 95
ŞEKİL 28. G1, G2 VE G3 GRUPLARINA AİT C3 İMMÜNHİSTOKİMYASAL BOYAMA ... 96
ŞEKİL 29. G1, G2 VE G3 GRUPLARINA AİT TUNEL İMMÜNHİSTOKİMYASAL BOYAMA ... 97
ŞEKİL 30. G1, G2 VE G3 GRUPLARINA AİT C3 İMMÜNFLORESAN BOYAMA (X100) ... 98
ŞEKİL 31. G1, G2 VE G3 GRUPLARINA AİT C3 İMMÜNFLORESAN BOYAMA (X200) ... 99
ŞEKİL 32. G1, G2 VE G3 GRUPLARINA AİT C3 İMMÜNFLORESAN BOYAMA (X400) ... 99
ŞEKİL 33. G1, G2 VE G3 GRUPLARINA AİT TUNEL İMMÜNFLORESAN BOYAMA (X100) ... 100
ŞEKİL 34. G1, G2 VE G3 GRUPLARINA AİT TUNEL İMMÜNFLORESAN BOYAMA (X200) ... 101
ŞEKİL 35. G1, G2 VE G3 GRUPLARINA AİT TUNEL İMMÜNFLORESAN BOYAMA (X400) ... 101
ŞEKİL 36. PRİMER VE SEKONDER SAĞLAM FOLİKÜL ORANLARININ KONTROL (G1), PRP EKLENMİŞ (G2), PRP EKLENMEMİŞ (G3) GRUPLAR ARASINDA KARŞILAŞTIRILMASI ... 103
ŞEKİL 37. PRİMER VE SEKONDER DEJENERE FOLİKÜL ORANLARININ KONTROL (G1), PRP EKLENMİŞ (G2), PRP EKLENMEMİŞ (G3) GRUPLAR ARASINDA KARŞILAŞTIRILMASI ... 103
ŞEKİL 38. CX 43 İMMÜNHİSTOKİMYA EKSPRESYON YÜZDESİNİN KONTROL (G1), PRP EKLENMİŞ (G2), PRP EKLENMEMİŞ (G3) GRUPLAR ARASINDA KARŞILAŞTIRILMASI ... 104
ŞEKİL 39. BAX İMMÜNHİSTOKİMYA EKSPRESYON YÜZDESİNİN KONTROL (G1), PRP EKLENMİŞ (G2), PRP EKLENMEMİŞ (G3) GRUPLAR ARASINDA KARŞILAŞTIRILMASI ... 104
ŞEKİL 40. BCL-2 İMMÜNHİSTOKİMYA EKSPRESYON YÜZDESİNİN KONTROL (G1), PRP EKLENMİŞ (G2), PRP EKLENMEMİŞ (G3) GRUPLAR ARASINDA KARŞILAŞTIRILMASI ... 105
ŞEKİL 41. C3 İMMÜNHİSTOKİMYA EKSPRESYON YÜZDESİNİN KONTROL (G1), PRP EKLENMİŞ (G2), PRP EKLENMEMİŞ (G3) GRUPLAR ARASINDA KARŞILAŞTIRILMASI. ... 105
xi
ŞEKİL 42. TUNEL ANALİZİNDE EKSPRESYON YÜZDESİNİN KONTROL (G1), PRP EKLENMİŞ (G2), PRP EKLENMEMİŞ (G3) GRUPLAR ARASINDA KARŞILAŞTIRILMASI ... 106 ŞEKİL 43. C3 İMMÜNFLORESAN BOYANMA YÜZDESİNİN KONTROL (G1), PRP EKLENMİŞ (G2), PRP EKLENMEMİŞ
(G3) GRUPLAR ARASINDA KARŞILAŞTIRILMASI ... 106 ŞEKİL 44. TUNEL İMMÜNFLORESAN BOYANMA YÜZDESİNİN KONTROL (G1), PRP EKLENMİŞ (G2), PRP
xii
KISALTMALAR LĠSTESĠ
ACD-A: Asit sitrat dekstroz-A, acid-citrate-dextrose-A
AMH: Antimüllerian hormon (müllerian inhibe edici faktör; mullerian inhibiting factor, MIF) ASRM: Amerikan Üreme Tıbbı Derneği, American Society for Reproductive Medicine BM: Temel solüsyon, base medium
BMP: Kemik morfogenetik protein, bone morphogenetic protein DER: Düz endoplazmik retikulum
DMEM: Dulbecco's Modified Eagle Medium DMSO: Dimetil sülfoksit
EG: Etilen glikol
EGF: Epidermal büyüme hormonu, epidermal growth factor EM: Dengeleme solüsyonu, equilibration medium
ET: Embriyo transferi
FBS: Fetal sğır serumu, fetal bovine serum
FGF: Fibroblast büyüme faktörü, fibroblast growth factor FSH: Folikül stimüle edici hormon
G: Gliserol
GE: Germinal epitel, germinal epithelium GER: Granüllü endoplazmik retikulum GIFT: Gamet intrafallopian transfer
GnRH: Gonadotropin salgılatıcı hormon, gonadotropin-releasing hormone hCG: Ġnsan koryonik gonadotropin, human chorionic gonadotropin
HE: Hematoksilen eozin
HPO: Hipotalamik hipofizer ovaryan aksı
IGF: Ġnsülin benzeri büyüme hormonu, insulin-like growth factor IVI: In vitro inseminasyon
KL: Korpus luteum, korpora lutea
KP: Kriyoprezervasyon, cryopreservation KPA: Kriyoprotektan ajan, cryoprotective agent LH: Luteinizan hormon
MIF: Müllerian inhibe edici faktör, mullerian inhibiting factor (antimüllerian hormon, AMH) NAIP: Nöral apopitoz inhibitör protein, neural apoptosis inhibitor protein
NF-κβ: Nükleer faktör kappa B, nuclear factor kappa B OCS: Açık kanallar sistemi, open canalicular system OH: Hidroksil
OHSS: Ovaryan hiperstimülasyon sendromu, ovarian hyperstimulation syndrome OMI: Oosit matursayon inhibitörü, oocyte maturation inhibitor
OPS: Opened pulled straw
OSE: Over yüzey epiteli, ovarian surface epithelium PAS: Periyodik Asit Schiff
PDAF: Platelet kaynaklı anjiyogenezis faktörü, platelet derived angiogenesis factor
PDEGF: Platelet kaynaklı endotel büyüme faktörü, Platelet derived endothelial growth factor PDGF: Platelet kaynaklı büyüme faktörü, platelet derived growth factor
xiii PN: Pronükleer
PND: Postnatal gün, postnatal day POY: Prematür ovaryan yetmezlik PPP: Platelet poor plasma
PrOH: Propilen Glikol
PRP: Plateletten zengin plazma; Platelet rich plasma QMC: Quartz microcapillary
RANKL: Reseptör-aktivatör nükleer faktör kappa beta ligand, receptor-activator of nuclear factor kappa beta ligand
S: Sükroz
SCID: Ağır kombine immün yetmezlik, severe common immunodeficiency TDF: Testis belirleyici faktör, testis determining factor
TGF: Transforme edici büyüme faktörü, transforming growth factor
TIMPs: Doku metalloproteinaz inhibitörleri, tissue inhibitors of metalloproteinases VS: Vitrifikasyon solüsyonu, vitrification solution
vWF: von Willebrand faktör YÜT: Yardımlı üreme teknolojisi ZIFT: Zigot intrafallopian transfer ZP: Zona pellucida
1
1. GĠRĠġ
Dünya genelinde 48,5 milyon çiftin etkilendiği infertilitede kadın faktörü önemli derecede yer tutmaktadır (1). Anatomik bozukluklar, prematür ovaryan yetmezlik (POY), kanserler gibi primer ve sekonder infertiliteye neden olabilecek durumların tedavisinde çeĢitli yardımcı üreme teknikleri üzerinde araĢtırmalar gittikçe hız kazanmaktadır. Bu çalıĢmaların ıĢığında infertilite uygulama ve araĢtırma merkezlerinde in vitro inseminasyon (IVI), in vitro fertilizasyon (IVF), gamet intrafallopian transfer (GIFT), zigot intrafallopian transfer (ZIFT), oosit/embriyo/over dokusu dondurma (kriyoprezervasyon) gibi tedavi protokolleri hastalığın Ģiddetine göre uygulanabilmektedir.
1776 yılında Spallanzani‟nin çok düĢük sıcaklığın insan spermi üzerindeki dondurucu etkilerini gözlemlediği, ilk defa 1866 yılında Montegazza‟nın donmuĢ insan semeninden banka oluĢturma önerisini sunduğu, 1942 yılında Pincus‟un vitrifikasyon prensiplerini anlattığı, 1949 yılında Polge‟nin gliserolü kriyoprotektif ajan olarak kullandığı, 1972 yılında Whittingham‟ın -196oC‟de sakladığı fare ve tavĢan embriyolarının normal geliĢtiğini gösterdiği çalıĢmalar kriyoprezervasyonda önemli yere sahip araĢtırmalar olarak tarihe geçmiĢtir (2). Sonraki yıllarda da birçok canlı türünde çeĢitli kriyoprezervasyon yöntemleri baĢarılı Ģekilde denenmiĢtir (3).
Çoğunlukla üzerinde çalıĢılan oosit/embriyo kriyoprezervasyonu; Hodgkin Lenfoma, hematolojik maligniteler gibi acil kemo/radyoterapi verilmesi gereken veya OHSS gibi indüksiyon komplikasyonlarının istenmediği bazı durumlarda ovaryan rezervi hızlıca korumada yeterli gelmemektedir. Bu aĢamada over dokusunun dondurulması alternatif bir çözüm olmaktadır. Bu yöntemle prepubertal kanser olgularında kemoterapötiklerin gonadotoksik yan etkileri azaltılmıĢ olup, daha çok folikül elde edilebilmektedir. Günümüzde over doku kriyoprezervasyonu belirli merkezlerde denenmekle birlikte sağlıklı gebeliklerin elde edildiği çalıĢmalar mevcuttur (4–8).
Plateletten zengin plazma (platelet rich plasma; PRP), tam kanın satrifüj edilmesi ile elde edilen ve tam kandan daha yüksek yoğunlukta trobosit içeren plazma komponentidir (9). Otolog olması nedeniyle immünreaktif olmaması, içerdiği birçok büyüme faktörü sayesinde doğal iyileĢme sürecine büyük benzerlik göstermesi (10) gibi nedenlerle kültür ortamında ekzojen büyüme faktörleri yerine PRP kullanılmasını (11) araĢtıran çalıĢmalar mevcuttur. PRP içeriğindeki büyüme faktörleri birbirleri ve çevrelerindeki moleküller ile etkileĢime geçerek tek bir büyüme faktörü kullanımına göre daha avantajlı olmaktadırlar (12).
2 Biz bu çalıĢmamızda over kriyoprezervasyon yöntemlerinin geliĢtirilmesine katkı sağlamayı amaçlamaktayız. Ġçerdiği büyüme faktörleri sayesinde büyüme faktörü agonisti gibi davranan trombositlerin yoğunlaĢtırılarak vitrifikasyon solüsyonuna eklenmesinin, çözme sonrası doku viabilitesine olumlu katkı yapacağını düĢünmekteyiz. Fertilite isteği doğduğunda over doku nakli, in vitro maturasyon gibi teknikler de kullanılarak daha çok folikülün olgunlaĢmasına olanak sağlayacaktır.
3
2. GENEL BĠLGĠLER
2.1. KADIN GENĠTAL SĠSTEMĠNE GENEL BAKIġ
DiĢi üreme sistemi, pelvis yerleĢimli iç genital ve vulva olarak bilinen perinenin ön kısmında bulunan dıĢ genital yapılardan oluĢmaktadır. Ġç genital organlar overler, uterus tüpleri (fallop tüpleri, tuba uterina), uterus ve vajinadır (ġekil 1). Bunlar çoğunlukla pelvis boĢluğunda perine içinde bulunurlar. DıĢ genital organlar arasında mons pubis, labia majora ve minora, klitoris, vestibül ve vajina, himen ve eksternal üretral orifis açıklığı yer alır.
Cinsel olarak olgunlaĢmıĢ over, tuba ve uterus her bir adet döngüsü ve hamilelikte nörohormonal stimülasyonla yapısal ve fonksiyonel değiĢikliklere maruz kalır. Bu mekanizmalar ayrıca kadın üreme sisteminin erken geliĢimini de düzenlemektedir. Menstrüasyon olarak adlandırılan adet döngüsü 9-14 yaĢları arasında (menarĢın yaĢ ortalaması 12.7) ortaya çıkmakta ve üreme yaĢamının baĢlangıcını göstermektedir. Bu dönem boyunca, adet döngüsü 21-35 gün arasında değiĢir (13). 45-55 yaĢ arası [ortalama yaĢ 51(14)] folikül havuzu azaldıkça adet döngüsü seyrek hale gelir ve sonunda durur. Klimakteriyum denilen geçiĢ döneminden sonra son adetin görüldüğü menopozla menstruasyon kalıcı olarak sonlanır. Overler, üreme aktivitesini düzenleyen hormonların üretilmesi için üreme fonksiyonlarını ve onların endokrin fonksiyonlarını durdurur. Diğer organlar (örneğin vajina ve meme bezleri), özellikle sekretuar aktivite olmak üzere değiĢen derecelerde azalmıĢ iĢlev gösterir.
Overlerin birbiriyle iliĢkili iki iĢlevi vardır: gametogenez (gametlerin üretimi) ve steroidogenez (steroidlerin üretimi). Kadınlarda gamet üretimine oogenez; geliĢen gametlere oosit, matür gametlere ova denilmektedir.
Regülasyonda rol alan iki ana grup steroid hormon östrojen ve progestojenler overler tarafından salgılanır. Östrojenler iç ve dıĢ cinsel organların büyümesini ve olgunlaĢmasını teĢvik eder ve ergenlik döneminde geliĢen diĢi cinsiyet özelliklerinden sorumludur. Östrojenler ayrıca, adipoz doku birikimi, meme büyümesi ve stromal büyümeyi uyararak meme bezleri üzerinde etki eder. Progestojenler, endometriyumdaki sekretuar değiĢiklikleri regüle ederek hamilelik için uterus baĢta olmak üzere iç cinsel organları hazırlar. Progestojenler ayrıca lobüler proliferasyonu artırarak emzirme için meme bezini hazırlar. Her ikisi de fertilize olmuĢ oositin implantasyonu için uterusu hazırlayarak adet döngüsünde önemli bir rol oynar. Ġmplantasyon gerçekleĢmezse uterus endometriyumunda dejenerasyon takiben menstruasyon olur.
4
ġekil 1. Kadın genital sistemine ait bazı yapıların Ģematik görünümü (15).
1. Vajina 2. Serviks 3. Servikal kanal 4. Uterus 5. Over 6. Fallop tüpü 6a. Intramural kısım 6b. Istmus 6c. Ampulla 6d. Infindibulum 6e. Fimbria 7. Uterus duvarı 7a. Endometriyum 7b. Myometriyum 7c. Adventisya
i. Lateral servikal ligament ii. Broad ligament
iii. Ovaryan ligament
2.1.1. OVER ANATOMĠSĠ
Overler fossa ovarica denilen çukurcuklarda yerleĢmiĢ, nulliparlarda badem Ģekilli ve yaklaĢık 3 cm uzunluğunda, 1.5 cm geniĢliğinde ve 1 cm kalınlığında pembemsi beyaz yapılardır. Yapılan çalıĢmalar over hacminin 30 yaĢa kadar ortalama 6.6 cm3
olduğu, bu yaĢtan sonra hacmin giderek azaldığını, postmenopozal dönemde en küçük hacme sahip olduğunu göstermektedir (16).
Ergenlikten önce over yüzeyi pürüzsüzdür ancak reproduktif yaĢam boyunca tekrarlanan ovulasyonlardan dolayı giderek artan Ģekilde düzensiz hale gelir. Her bir over,
5 Broad Ligamentinin arka yüzeyine mezoovaryum denilen peritoneal bir katlantı ile bağlanır. Üst ucu veya tubal uç pelvik duvara over damarları ve sinirlerini taĢıyan Suspensatuar Ligament ile bağlıdır. Alt veya uterin kutup Ovaryan Ligament ile uterusa bağlanır. Bu ligament, geliĢmekte olan gonadı pelvis tabanına bağlayan embriyonik fibröz kord olan gubernakulumun artığıdır.
Overin mezoovaryuma yapıĢan ön kenarında hilus bulunur, overin damarları ve sinirleri buradan girer ve çıkarlar. Mezoovaryuma yapıĢan kenarında damar sinir paketinin girdiği bölge olan hilus bulunur. Kanlanması baĢlıca abdominal aortanın dalı olan A. Ovarica tarafından sağlanır. Bu arter pelviste Ligamentum Suspensorium Ovarii içinde seyreder. Kanlanmaya A. Uterina‟nın dalları da katkı sağlar ve A. Ovarica ile uterin arterin overi besleyen dalları arasında anastomoz vardır. Venler pleksus oluĢturarak ovaryan venlere drene olurlar. Foliküllerin teka tabakalarındaki lenfatik damar ağları, geliĢmekte olan ve atretik foliküller ile korpus luteumu çevreler.
Lenfatik damarlar, a. ovarica‟yı takip ederek lomber bölgede baĢlıca paraaortik lenf nodlarına drene olur. Overler otonomik overyan pleksus tarafından innerve edilir. Overin hem sempatik hem de parasempatik lifleri aldığı açık olmakla birlikte gerçek dağılımları hakkında çok az Ģey bilinir. Parasempatik ganglion hücre grupları medullada dağılmıĢtır. Foliküller ile iliĢkili sinir lifleri bazal laminaya penetre olmaz. Duyusal sinir uçları stromada dağılmıĢtır ve ovaryan pleksus yoluyla impulsları ileterek ilk lomber spinal sinirlerin dorsal kök gangliyonlarına ulaĢır. Bu nedenle, ovaryan ağrı, bu spinal sinirlerin kutanöz dağılımına yansır. Ovulasyon sırasında kadınların yaklaĢık % 45'inde midsiklus ağrısı görülür (“mittelschmerz”). Genellikle birkaç dakikadan 24 saate kadar sürebilen, az miktar kanamanın eĢlik ettiği, keskin alt abdominal ağrı olarak tanımlanır. Bu ağrının over ve ligamentlerindeki düz kas hücre kontraksiyonuna bağlı olduğu düĢünülmektedir. Bu kasılmalar, LH pikinin aracılık ettiği artmıĢ prostaglandin F2α seviyesine yanıt olarak oluĢur.
2.1.2. OVER EMBRĠYOLOJĠSĠ
GeliĢimin 5. haftasında mezonefrozun mediyalinde, çölom epiteli ve altındaki mezenĢimin çoğalmasıyla gonadal çıkıntı (gonadal sırt, gonadal kabarıklık; gonadal ridge) oluĢur. Bu haftaya kadar gonadal çıkıntıda germ hücreleri yoktur. Primordiyal germ hücreleri, ilk olarak yolk kesesine (yolk sak) yakın primitif endoderm hücreleri arasında belirir. Son bağırsak ve dorsal mezenter boyunca ameboid hareketlerle ilerleyerek, 5. haftanın baĢında primitif gonadlara ulaĢır; 6. haftada da gonadal çıkıntıyı iĢgal eder. Primordiyal hücre
6 göçünde aksaklık gonadların geliĢmemesiyle sonuçlanır. Göç esnasında, gonadal çıkıntının epitel hücreleri prolifere olarak altlarındaki mezenĢim içine gömülür ve primitif seks kordonları denilen düzensiz kordonları oluĢturur. 6. haftada primordiyal germ hücreleri mezenĢim içine girer ve primer seks kordonları ile birleĢir. Erkek ve diĢide gonadlardaki farklılaĢma 7. haftaya kadar baĢlamaz. Bu evredeki gonada farklanmamıĢ gonad denir (17). Hem erkek hem de diĢi embriyolarda bu kordonlar yüzey epiteline bağlıdır ve erkek/diĢi gonad ayrımı yapılamaz. Testis geliĢimi için Y kromozomu üzerindeki SRY geninden kodlanan testis belirleyici faktör (TDF) gereklidir. Buna ilaveten otozomal genlere de ihtiyaç vardır. Bunun etkisi ile primitif cinsiyet kordonları çoğalarak medullanın derinliklerine penetre olurlar ve testis veya medüller kordonları meydana getirir. Bu kordonlar daha sonra rete testisi yapacak olan ince hücre sıraları Ģeklinde hilusa doğru uzanır. Testis kordonlarının yüzey epiteliyle olan bağı sıkı bağ dokusu olan tunica albugineanın araya girmesiyle sona erer.
Testis geliĢimi için Y kromozomu üzerindeki SRY geninden kodlanan TDF‟ye ilaveten otozomal genlere de ihtiyaç vardır. Bu genlerin içinde en önemlisi SOX9 olup SRY tarafından aktiflenir. Over geliĢimi için önemli olan genler ise X kromozomu üzerindeki DAX1 ve SF1 olup Sertoli ve Leydig hücrelerinin geliĢmesini inhibe eder. Sertoli hücreleri tarafından salgılanan müllerian inhibe edici faktör (mullerian inhibiting factor; MIF veya antimullerian hormon, AMH) sayesinde diĢi duktal sistem (paramezonefrik kanallar veya müllerian sistem) regrese olur; mezonefrik kanallar (wollfian sistem) geliĢir. Mezonefrik kanalların virilizasyonu Leydig hücreleri tarafından salgılanan testosteron ile olurken, dıĢ genital kanalların virilizasyonu ise testosterondan dönüĢen dihidrotestosteron ile olur.
XY kromozomu taĢıyan embriyolarda gonadın meduller kordonları geliĢerek testis kordonlarına dönüĢür ancak XX cinsiyet kromozomuna sahip embriyolarda meduller kordonlar geriler, kortikal kordonlar geliĢir. DiĢi embriyolarda primitif cinsiyet kordonları düzensiz hücre kümelerine ayrılır. Bu hücre kümeleri bir süre sonra kaybolarak yerlerini vasküler bir stromaya (ovaryan medulla) bırakır. DiĢi gonadın yüzey epiteli erkeklerde olduğunun tersine çoğalmaya devam eder. 7. haftada alttaki mezenĢim içine gömülmesine rağmen, yüzeye yakın kalmaya devam eden kortikal kordonlar denilen ikinci nesil kordonlar geliĢir. Dördüncü ayda, bu kordonlar her biri bir veya daha fazla primitif germ hücresini çevreleyen izole hücre toplulukları haline gelir. Bu germ hücreleri zamanla oogoniyaya dönüĢürken, yüzey epitelinden aĢağıya göç eden ve germ hücrelerini çevreleyen epitel hücrelerinden de foliküler hücreler meydana gelir (17).
7
2.1.3. OVER HĠSTOLOJĠSĠ
Primitif gonadın kortikal bölgesinden geliĢen overler sağda ve solda olmak üzere pelvis boĢluğunun her iki yanında yer alan yaklaĢık 3 cm uzunlukta 1,5 cm geniĢlikte ve 1 cm kalınlıkta oosit üretimi gibi endokrin östrojen ve progesteron üretimi gibi ekzokrin fonksiyonlara sahip organlardır.
Over yüzeyi basit yassı-alçak küboidal epitel ile örtülüdür. Germinal epitel (germinal epithelium, GE) olarak bilinen bu hücresel katman, mezovaryumu örten mezotel ile süreklilik gösterir. Sıkı bağ dokusu tabakası tunika albuginea, germinal epitel ve alttaki korteks arasında uzanır.
Over sınırları net olmayan korteks ve medulladan oluĢur. Medulla veya medüller bölge overin orta kısmında yer alır ve bağ dokusu, elastik fibriller, interstisyel hücreler ile hilus boyunca overe ulaĢan kan damarları, lenf damarları ve sinirleri içerir. Korteks veya kortikal bölge medullayı çevreleyen periferik kısımdır. Korteks, hücresel olarak zengin bağ dokusuna gömülü over foliküllerini içerir (ġekil 2). Çevre stromada dağınık düz kas lifleri bulunur (18).
8 Her biri tek bir oosit içeren çeĢitli boyutlardaki over folikülleri korteksin stromasına dağılmıĢ durumdadır. Bir folikülün büyüklüğü oositin geliĢim durumunu gösterir. Yolk kesesinden göç ederek gelen germ hücreleri 9. haftada mitozla çoğalarak sayılarını arttırmaya baĢlar. En yüksek sayı 6-7 milyon ile 20. gebelik haftasında görülür. Bundan sonra mitoz görülmez. 11-12. haftalarda mayotik bölünme baĢlar ve primer oositler oluĢmaya baĢlar. Doğuma kadar oogoniaların hepsi primer oosite dönüĢmüĢ olur. Prenatal dönemde birinci mayoz bölünmeye giren oosit profazın diploten evresinde arreste uğrar ve puberteye kadar arrest devam eder. 20. gebelik haftasında 5 milyon kadar olan primer oosit sayısı, bütün yaĢam boyunca aynı zamanda atrezi de devam ettiği için doğumda 600-800 bin seviyesine iner. Reprodüktif yaĢam boyunca 400 adet matür oosit oluĢmaktadır.
2.1.4. FOLĠKÜL GELĠġĠMĠ
Genel olarak over folikülleri geliĢimlerine göre aĢağıdaki Ģekilde tanımlanabilir (19):
Primordial foliküller
Primer foliküller
Sekonder foliküller
Olgun, matür folikül veya Graaf folikül.
Foliküler geliĢim evrelerinde farklı ek aĢamalar da tanımlanmıĢtır (15,18,20).
Overlerde foliküller geliĢimin tüm aĢamalarında foliküller bulunur ancak primordial foliküller baskındır. Primordial foliküller ilk olarak fetal geliĢimin üçüncü ayında görülür. Primordial foliküllerin erken geliĢimi gonadotropin stimülasyonundan bağımsızdır. Olgun overde, tunika albuginea'nın hemen altındaki korteksin stromasında primordial foliküller bulunur (ġekil 3). Tek tabakalı skuamöz folikül hücreleri oositi çevreler. Folikül hücrelerinin dıĢ yüzeyi bir bazal lamina ile sınırlandırılmıĢtır. Bu aĢamada, oosit ve çevreleyen folikül hücreleri birbiriyle yakından iliĢkilidir. Foliküldeki oosit yaklaĢık 30 µm çapındadır ve çok iyi dağılmıĢ kromatin, bir veya daha fazla büyük nükleolus içeren geniĢ, eksantrik bir çekirdeğe sahiptir (18).
9
ġekil 3. Over kesiti ve foliküler evrelerin Ģematik görünümü (19).
Oositin sitoplazması, ooplazma olarak adlandırılır, bir Balbiani cisimciği içerir. Ultrastriktürel düzeyde, Balbiani cisimciği, Golgi membranı ve kesecikleri, endoplazmik retikulum, sentrioller, sayısız mitokondri ve lizozomların lokalize bir birikimi olarak ortaya çıkar. Ek olarak, insan oositleri, annulate lamella içerir ve küçük, dairesel mitokondri ile birlikte sitoplazma boyunca çok sayıda küçük veziküller içerir. Annulate lamella bir nükleer zarf yığınına benzemektedir. Yığının her bir tabakası, nükleer gözeneklere morfolojik olarak benzer olan por yapıları içerir.
10 Primordial folikül büyüyen bir folikül haline geldikçe oositte folikül hücrelerinde ve bitiĢik stromada değiĢiklikler meydana gelir. BaĢlangıçta oosit geniĢler ve çevresindeki yassı folikül hücreleri büyür ve kübik hale gelir. Bu aĢamada yani folikül hücreleri kübik hale geldiğinde folikül primer folikül olarak tanımlanır. Oosit büyüdükçe zona pellucida (ZP) denen bir hücre dıĢı kılıfı oluĢturacak olan belirli proteinleri salgılar. Bu zona pellucida oosit ve bitiĢik folikül hücreleri arasında görülür ve insanlarda ZP-1 (80 ila 120 kDa), ZP-2 (73 kDa) ve ZP-3 (59 ila 65 kDa) olarak adlandırılan üç sülfatlı asidik zona pellucida glikoprotein sınıfından oluĢur. Bu üçünden en önemlisi spermatozoa-bağlayıcı reseptör ve akrozom reaksiyonunun indükleyicisi olarak iĢlev gören ZP-3'dür. ZP-2'nin sekonder spermatozoa-bağlayıcı protein olarak iĢlev gördüğüne inanılmaktadır. ZP-1 henüz iĢlevsel olarak karakterize edilmemiĢtir. IĢık mikroskobunda zona pellucida asidofilik boyalarla ve PAS boyası ile homojen refraktil bir tabaka olarak net Ģekilde görülebilir. Tek bir kuboidal veya kolumnar folikül hücre tabakasıyla çevrili oosit ilk olarak 50-80 µm arasında bir çapa büyüdüğünde görülebilir.
Hızlı mitotik aktiviteleri sayesinde tek katlı folikül hücreleri, membrana granüloza (stratum granulozum) denilen oositi çevreleyen tabakalı epitel katmanı oluĢturur. Folikül hücreleri bu aĢamada granüloza hücreleri olarak tanımlanmaktadır. Bazal lamina, kubik hale gelen folikül hücrelerinin en dıĢ tabakası ile bağ dokusu stroması arasındaki konumunu korur.
Foliküler büyüme sırasında granüloza hücreleri arasında yaygın gap junction bağlantıları oluĢur. Bununla birlikte, testisteki Sertoli hücrelerinden farklı olarak granüloza hücrelerinin bazal katmanı sıkı bağlantılara (zonula occludens) sahip değildir bu da bir kan-folikül bariyerinin yokluğuna iĢaret etmektedir. Besinlerin ve bilgi taĢıyan küçük makromoleküllerin kandan foliküler sıvıya hareketi oosit ve folikülün normal geliĢimi için oldukça önemlidir.
Granüloza hücreleri çoğaldıkça folikülü ivedilikle çevreleyen stromal hücreler, teka folikülü denilen bazal laminanın hemen dıĢında konnektif bağ doku hücre katmanını oluĢturur. Teka folikülü ayrıca iki katmana ayrılır. Teka interna denilen iç katman kuboidal sekretuar hücrelerden oluĢan oldukça vaskülarize bir katmandır. Teka internanın tamamen farklılaĢmıĢ hücreleri steroid üreten hücre özelliklerine sahiptir. Teka interna hücreleri çok sayıda lüteinizan hormon (LH) reseptörüne sahiptir. LH uyarımına yanıt olarak, estrojenlerin öncüleri olan androjenleri sentezler ve salgılarlar. Sekretuar hücrelere ek olarak teka interna fibroblastlar, kollajen demetleri ve endokrin organlara özgü zengin bir küçük damar ağı içerir. Teka externa ise bağ dokusu hücrelerinin dıĢ tabakasıdır. Temel olarak düz kas hücreleri ve kollajen lif demetlerini içerir.
11 Teka katmanları arasındaki ve teka externa – çevre stroma arasındaki sınırlar belirgin değildir. Bununla birlikte granüloza tabakası ve teka interna arasındaki bazal lamina, bu tabakalar arasında belirgin bir sınır oluĢturur. Bu, internadaki zengin kılcal yatağı, foliküler büyüme döneminde avasküler olan granüloza katmanından ayırır.
Oosit olgunlaĢtıkça organellerin dağılımı değiĢir. Primordial oositin tek Balbiani gövdesinden türeyen çoklu, dağılmıĢ Golgi elemanları sitoplazmada dağılmıĢlardır. Serbest ribozomların sayısı, mitokondri, küçük veziküller ve multiveziküler cisimler ve granüllü endoplazmik retikulum (GER) miktarı artmaktadır. Bazen lipid damlacıkları ve lipokrom pigmentler görülebilir. Memeliler dahil olmak üzere birçok türün oositleri, kortikal granüller olarak bilinen özel salgı kesecikleri sergiler. Oolemmanın hemen altında bulunurlar. Granüller, ovum sperm tarafından aktive edildiğinde eksositozla salınan proteazlar içerir.
Oositden, oosit ile çevredeki granüloza hücreleri arasındaki perivitellin boĢluğuna çok sayıda düzensiz mikrovillus projeksiyonu olur. Aynı zamanda, granüloza hücrelerinden ince uzantılar geliĢir ve oosite doğru ilerler; oosit mikrovillusları ile karıĢır ve bazen oosit plazma zarına invajine olur. Plazma membranı ile temas etse de hücreler arasında sitoplazmik bağlantı oluĢmaz.
Birincil folikül baĢlangıçta, granüloza hücrelerinin çoğalması yoluyla, boyut olarak arttıkça kortikal stromada daha derine girer. Oosit ve foliküler büyüme için çeĢitli faktörler gereklidir: Folikül uyarıcı hormon (FSH), Büyüme faktörleri [örn: Epidermal büyüme faktörü (EGF), insülin benzeri büyüme faktörü I (IGF-I)], Kalsiyum iyonları (Ca+2).
Stratum granulozum, 6 ila 12 hücre tabakası kalınlığına ulaĢtığında, granüloza hücreleri arasında sıvı dolu boĢluklar görülür. Likör folikülleri olarak adlandırılan hiyalüronan açısından zengin sıvı granüloza hücreleri arasında birikmeye devam ettikçe, boĢluklar birleĢmeye baĢlar ve sonunda antrum adı verilen tek, hilal Ģeklinde bir oyuk oluĢturur. Folikül Ģimdi ikincil folikül veya antral follikül olarak tanımlanmaktadır. YaklaĢık 125 µm'lik bir çapa ulaĢan eksantrik olarak konumlanmıĢ oosit, daha fazla büyümeye göstermez. Bu büyümenin inhibisyonu, granüloza hücreleri tarafından antral sıvıya salgılanan, oosit matürayon inhibitörü (oocyte maturation inhibitor, OMI) adı verilen küçük 1-2 kDa‟luk peptid ile olur. Sekonder folikül ve OMI konsantrasyonu arasında doğrudan bir korelasyon gözlenir. Konsantrasyon, küçük foliküllerde en yüksek ve olgun foliküllerde en düĢüktür. Sıvı ilk ortaya çıktığında folikül 0.2 mm çapında erken sekonder foliküldür, büyümeye devam eder ve çapı 10 mm veya daha fazla olur.
Sekonder folikül büyüklüğü arttıkça, granüloza hücrelerinin çeĢitli katmanları ile kaplı antrum geniĢler. Stratum granulozum, oosit ile iliĢkili bölge haricinde nispeten homojen bir kalınlığa sahiptir. Burada granüloza hücreleri, antruma doğru uzanan kalınlaĢmıĢ kümülüs
12 ooforiusu oluĢturur. Oositi hemen çevreleyen ve ovulasyonda onunla birlikte atılan kümülüs ooforius hücreleri korona radiata olarak adlandırılır. Korona radiata, oosit mikrovillusu ile gap junction yoluyla iletiĢim kurmak için zona pellucida boyunca penetran mikrovillus gönderen kümülüs hücrelerinden oluĢur. Foliküler olgunlaĢma sırasında granüloza hücrelerinin yüzey mikrovillus sayısı artar ve serbest antral yüzey üzerinde artan sayıda LH reseptörü ile korelasyon gösterir. Granüloza hücreleri arasında hücre dıĢı, yoğun boyanan, Call-Exner cisimcikleri olarak adlandırılan PAS pozitif materyal görülebilir. Bu cisimler granüloza hücreleri tarafından salgılanır ve hiyalüronan ve proteoglikanlar içerir.
Graaf folikülü olarak da bilinen olgun folikül çapı 10 mm veya daha fazladır. GeniĢ boyutu nedeniyle, over korteksinin tam kalınlığına kadar uzanır ve over yüzeyinde bir ĢiĢkinliğe neden olur. Folikül maksimum boyutuna yaklaĢtıkça, granüloza hücrelerinin mitotik aktivitesi azalır. Stratum granulozum antrumun boyut olarak artmasıyla incelmiĢ gibi görünür. Granüloza hücreleri arasındaki boĢluklar geniĢlemeye devam ederken, oosit ve kümülüs hücreleri ovulasyon için hazırlanırken granüloza hücrelerinin geri kalanı yavaĢ yavaĢ gevĢetilir. Oositi hemen çevreleyen kümülüs hücreleri artık tek bir korona radiata hücresi tabakası oluĢturur. Bu hücreler ve gevĢek bağlı kümülüs hücreleri ovulasyonda oosit ile atılır.
Folikül olgunlaĢmasının bu döneminde, tekal tabakalar daha belirgin hale gelir. Lipid damlacıkları, teka interna hücrelerinin sitoplazmasında görünür ve hücreler, steroid üreten hücrelerle iliĢkili ultrastrüktürel özellikler gösterir.
Ġnsanlarda LH, teka interna hücrelerini androjen üretmek üzere uyarır. Aromataz eksikliği nedeniyle, teka interna hücreleri östrojen üretemez. Aksine, granüloza hücreleri aromataz aktivitesine sahiptir; bu nedenle, bazı androjenler daha fazla iĢlem için düz endoplazmik retikulum (DER)'a taĢınır. FSH'ye yanıt olarak, granüloza hücreleri, androjenlerin östrojenlere dönüĢmesini katalize eder, bu da granüloza hücrelerini çoğalmaya ve böylece folikülün boyutunu arttırmaya teĢvik eder. Foliküler ve sistemik kaynaklardan gelen artmıĢ östrojen seviyeleri, gonadotropinlerin gonadotropin salgılatıcı hormona (GnRH) karĢı artmıĢ duyarlılığı ile iliĢkilidir. FSH veya LH salınımındaki bir dalgalanma, ovulasyondan yaklaĢık 24 saat önce adenohipofizde indüklenir. LH dalgalanmasına yanıt olarak, granüloza hücreleri üzerindeki LH reseptörleri aĢağı regüle edilmiĢtir (duyarsızlaĢtırılmıĢtır) ve granüloza hücreleri artık LH'ye tepki olarak östrojen üretmemektedir. Bu dalgalanma tarafından tetiklenen, primer oositin ilk mayoz bölünmesi kaldığı yerden devam eder. Bu olay LH dalgalanmasından 12 ila 24 saat sonra ortaya çıkar ve sekonder oosit ve birinci polar cismin oluĢumu ile sonuçlanır. Hem granüloza hem de teka hücreleri luteinizasyona uğrar ve progesteron üretir.
13
2.1.5. OVULASYON
Ovulasyon, Graafian folikülünden sekonder oositin salındığı bir süreçtir. Herhangi bir adet döngüsünde ovulasyona uğrayacak folikül, döngünün ilk birkaç gününde primer folikül kohortundan seçilir. Ovulasyon sırasında oosit, germinal epitel de dahil olmak üzere tüm foliküler duvarı geçmektedir.
Menstrüel siklusun ortasındaki sekonder oosit salınımından (yani 28 günlük bir döngünün 14. gününde) hormonal değiĢiklikler ve enzimatik etkilerin bir kombinasyonu sorumludur. Bu faktörler Ģunları içerir; foliküler sıvının hacminde ve basıncında artıĢ; aktive edilmiĢ plazminojen ile foliküler duvarın enzimatik proteolizi; oosit-kümülüs kompleksi ve stratum granulozum arasındaki hormonal olarak yönlendirilmiĢ glikozaminoglikan birikimi; prostaglandinler tarafından tetiklenen teka eksterna tabakasındaki düz kas liflerinin kasılması.
Ovulasyondan hemen önce, kan akıĢı, over yüzeyinin ĢiĢkin folikül üzerinde yer alan küçük bir bölgesinde durur. Makula pellucida veya foliküler stigma olarak bilinen bu germinal epitel alanı yükselir ve daha sonra rüptüre olur. Korona radiata ve kümülüs ooforius hücreleri tarafından çevrelenen oosit rüptüre folikülden atılır. Ovulasyon sırasında, uterus tüpünün fimbriaları over yüzeyine yakın bir Ģekilde yerleĢtirilir ve oosit içeren kümülüs kütlesi daha sonra fimbriya tarafından uterus tüpünün abdominal ostiumuna sürüklenir. Kümülüs kütlesi fimbrialara sıkı sıkıya yapıĢır ve uterus tüpünü kaplayan siliyer hücreler tarafından aktif olarak taĢınır ve periton boĢluğuna geçiĢi engellenir. Son zamanlarda, over folikül geliĢimini izlemek için non-invaziv ultrason teknolojisi kullanılmaktadır. Transvajinal ultrason muayenesi geliĢmekte olan foliküllerin sayısı ve büyüklüğü hakkında detaylı bilgi sağlayabilir. Ovulasyondan sonra, sekonder oosit yaklaĢık 24 saat boyunca canlı kalır. Bu dönemde döllenme gerçekleĢmezse, sekonder oosit uterus tüpünden geçerken dejenerasyona uğrar.
Uterin tüpe giremeyen oositler genellikle periton boĢluğunda dejenere olurlar. Bununla birlikte bazen döllenebilir ve over, bağırsak yüzeyi veya rektouterin boĢlukğa (Douglas) implante olabilir. Bu ektopik implantasyonlar genellikle erken fetal evrelerin ötesine geliĢmez, ancak cerrahi olarak çıkarılması gerekebilir. Uterus boĢluğunun endometriumu dıĢında herhangi bir bölgede geliĢen ektopik gebelik, gebeliğin ilk yarısında anne ölümlerinin en sık nedenini oluĢturmaya devam etmektedir.
Normalde, sadece bir folikül her döngüde olgunlaĢmayı tamamlar ve sekonder oositini serbest bırakmak için rüptüre olur. Nadiren, oositler aynı döngü boyunca tam olgunluğa ulaĢan diğer foliküllerden salınarak çoklu zigotların ortaya çıkmasına yol açar. Örneğin, klomifen sitrat (Serophene) ya da insan menopozal gonadotropinler (human menopausal
14 gonadotropins) gibi ilaçlar büyük ölçüde over aktivitesini stimüle ederler ve çok sayıda folikülü aynı anda olgunlaĢmaya iterek çoklu doğumlar olasılığını arttırırlar.
Primordial folikül içindeki primer oosit, ilk mayoz bölünmesine embriyo zamanında baĢlar ancak bu süreç mayozun profazının diploten aĢamasında duraklatılır. Birinci mayozun profazı ovulasyondan hemen önceye kadar tamamlanmaz. Bu nedenle, primer oositler 12 ila 50 yıl boyunca birinci mayozun profazında bekler. Bu uzun süreli mayotik arrest, primer oositin olumsuz çevresel etkilere maruz kalmasına neden olur ve mayoz bölünmesindeki ayrılmama gibi hatalara katkıda bulunur. Bu tür hatalar kromozom 21 (Down sendromu) trizomisi gibi anomaliler ile sonuçlanır.
Birinci mayotik bölünme (redüksiyon bölünmesi) matür folikülde tamamlanır. Primer oositten geliĢen her hücre kromatini eĢit olarak alır, ancak bunlardan bir tanesi sitoplazmanın çoğunu alır ve sekonder folikül haline gelerek 150 µm çapa ulaĢır. Diğer hücre minimum miktarda sitoplazma alır ve birinci polar cisim adını alır (18).
Ġlk mayoz bölünme tamamlanır tamamlanmaz, sekonder oosit ikinci mayoz bölünmeye girer. Korona radiata hücreleri tarafından çevrelenmiĢ sekonder oosit, ovulasyon esnasında folikülü terk ederken ikinci mayoz bölünme (ekvatoryal bölünme) devam etmektedir. Bu bölünme metafazda tutulur ve ancak sekonder oosit bir spermatozoon tarafından fertilize edilirse tamamlanır. Döllenme gerçekleĢirse, sekonder oosit ikinci mayoz bölünmesini tamamlar ve 23 kromozomlu maternal pronükleus içeren matür ovumu oluĢturur. Bu aĢamada üretilen diğer hücre ikinci polar cisim adını alır. Ġnsanlarda, ilk polar cisim ovulasyonun ardından 20 saatten fazla kalır ve bölünmez bu nedenle döllenmiĢ oosit iki kutup cisim (diploid birinci polar cisim ve haploid ikinci polar cisim) varlığıyla fark edilebilir. Bazı memelilerde, ilk polar cisim bölünebilir ve mayozun nihai sonucu bir oosit ve üç haploid polar cisimden oluĢur. Daha fazla geliĢme yeteneğine sahip olmayan polar cisimler, apoptosise uğrar.
2.1.6. KORPUS LUTEUM
Ovulasyonda, kalan granüloza ve teka hücrelerinden oluĢan foliküler duvar çöker ve korpus luteum veya luteal bez haline dönüĢür. Ġlk olarak teka internadaki kılcal damarlardan foliküler lümene doğru olan kanama merkezi bir pıhtı içeren korpus hemorajikum oluĢumuna yol açar. Stromal bağ dokusu daha sonra eski foliküler kaviteyi iĢgal eder.
Granüloza ve teka interna katmanlarının hücreleri daha sonra luteinizasyon denilen süreçte granüloza lutein ve teka lutein halini alır. Bu luteal hücreler, boyut olarak artan ve
15 lipid damlacıkları ile dolan morfolojik değiĢikliklere uğrarlar. Hücrelerin sitoplazmasındaki lipit-çözünür pigment olan lipokrom taze preparatlarda sarı bir görünüme sahiptir. Ultrastrüktürel incelemeler, steroid salgılayan hücrelerle iliĢkili özellikleri yani bol DER ve tübüler cristae ile mitokondriyi ortaya koyar.
Ġki tip luteal hücre tanımlanmıĢtır (ġekil4):
Granüloza lutein (GL) hücreleri, granüloza hücrelerinden türetilmiĢ, merkezi olarak konumlandırılmıĢ hücrelerdir (yaklaĢık 30 µm çapında). Korpus luteumun yaklaĢık % 80'ini oluĢturur ve östrojen, progesteron ve inhibin sentezler. Daha sonra hipofiz bezinin ön lobundan FSH'nin üretimini ve sekresyonunu düzenler.
Teka lutein (TL) hücreleri daha küçüktür (yaklaĢık 15 µm), daha koyu boyanır ve teka interna katının hücrelerinden derive olan periferal yerleĢimli hücrelerdir. Korpus luteum hücrelerinin kalan % 20'sini temsil eder ve androjen ve progesteron sekrete ederler.
ġekil 4. Ġnsan korpus luteumunun Ģematik görünümü (18). (KL: Korpus luteum, GL: Granüloza lutein hücreleri, TL: Teka lutein hücreleri, ok: TL hücreleri)
16 Korpus luteum oluĢmaya baĢladıkça, teka internadan gelen kan ve lenfatik damarlar hızla granüloza katmanına doğru büyür. Korpus luteum içinde zengin bir vasküler ağ kurulur. Over korteksinde yer alan bu oldukça vaskülarize yapı progesteron ve östrojenleri salgılar. Bu hormonlar, fertilizasyonun meydana gelmesi durumunda geliĢmekte olan zigotun implantasyonuna hazırlanması için, uterus endometriyumunun büyümesini ve sekretuar aktivitesini uyarır.Döllenme ve implantasyon gerçekleĢmezse, korpus luteum sadece 14 gün aktif kalır. Ġnsan koryonik gonadotropin (hCG) ve diğer luteotropinlerin yokluğunda, progestojenlerin ve östrojenlerin salgılanma oranı azalır ve korpus luteum ovulasyondan yaklaĢık 10 ila 12 gün sonra dejenere olmaya baĢlar.
Korpus luteum, hamilelik veya menstrüasyondan sonra yavaĢ yavaĢ inversiyona uğrar ve bozulur. Hücreler lipit ile yüklenir, boyut küçülür ve otolize uğrar. Beyaz bir skar korpus albikans, önceki korpus luteumun dejeneratif hücreleri arasında hiyalin materyali birikiminden oluĢur. Korpus albicans, birkaç ay boyunca yavaĢ yavaĢ kaybolarak over korteksinde daha derine çöker.
2.1.7. KAPASĠTASYON VE FERTĠLĠZASYON
Epididimde olgunlaĢmasının ardından, spermatozoa diĢi üreme sistemi içinde aktive edilmelidir. Kapasitasyon olarak adlandırılan bu aktivasyon sürecinde, spermatozoonda yapısal ve fonksiyonel değiĢiklikler meydana gelir ve bunun sonucunda zona pellucida reseptörlerine bağlanma afinitesi artar. BaĢarılı bir kapasitans, flagellalarının Ģiddetli, kırbaç benzeri bir salınım modeli olarak ortaya çıkan spermatozoanın hiperaktivasyonu ile doğrulanır.
Kapasitans, spermatozoon ve plazma membranında çeĢitli biyokimyasal değiĢiklikler ve modifikasyonlar içerir:
Artan cAMP seviyesine yol açan adenil siklaz aktivitesi artıĢı;
ArtmıĢ tirosin fosforilasyon oranı (tirosin fosforilasyon ölçümü klinik olarak kapasitansın biyokimyasal bir göstergesi olarak kullanılır);
Ca+2 kanallarının aktivasyonu (artmıĢ hücre içi Ca+2 seviyeleri ile sonuçlanır);
Seminal sıvı glikokonjugatların spermatozoon baĢının yüzeyinden serbest bırakılması. Epididimdeki sperm olgunlaĢması sırasında eklenen bu yüzey glikozidleri (aynı zamanda dekapitasyon faktörleri olarak da adlandırılır) zona pellucida reseptörlerine bağlanmayı inhibe eder.
17 Plazma membranında kapasitasyonun predominant inhibitörü kolesterolün ayrılmasıyla gerçekleĢen kapsamlı modifikasyon ve fosfolipitlerin ve karbonhidrat parçalarının yeniden dağıtılması.
Genellikle, bir ejakülattaki milyonlarca spermatozoanın sadece yüzlerce kısmı, tipik olarak uterus tüpünün ampullası olan döllenme alanına ulaĢır. UlaĢtığında spermatozoa, korona radiata ile çevrelenmiĢ sekonder oosit ile karĢı karĢıya kalır. Spermatozoa, zona pellucidaya eriĢmek için korona radiata'ya nüfuz etmelidir. Birkaç spermatozoa zona pellucidaya nüfuz edebilmesine rağmen, sadece bir tanesi dölleme iĢlemini tamamlar. Spermatozoa zona pellucida reseptörlerine bağlanabildiğinde kapasitasyon tamamlanır. Zona-pellucida üzerindeki ZP-3 reseptörlerine bağlanma, akrozomdan salınan enzimlerin (esas olarak hiyalüronidazların) bir spermatozoonun zona pellucidaya nüfuz etmesini sağlayan akrozom reaksiyonunu tetikler. Penetrasyon ilerleyen hipermotil spermatozoonun önünde zona pellucida'nın sınırlı proteolizi ile gerçekleĢtirilir.
Zona pellucidaya nüfuz ettikten sonra spermatozoon, zona pellucida ve oosit plazma membranı (oolemma) arasındaki perivitellin boĢluğuna girer. Burada spermatozoon plazma zarı, oolemma ile birleĢir ve sperm baĢının çekirdeği nihayet oosit içine aktarılır. 23 paternal kromozom içeren erkek pronükleusu oluĢturur. Ġki pronükleusun hizalanmasından ve nükleer membranlarının çözülmesinden sonra, sonuçtaki zigot, 46 kromozomun diploid (2n) komponenti ile, bir mitotik bölünme veya ilk ayrılmaya uğrar. Bu iki hücreli evre embriyonik geliĢimin baĢlangıcını gösterir.
Bir ikincil oosit yaklaĢırken, bir spermatozoon hiperaktif hale gelir; daha hızlı yüzer ve kuyruk hareketleri daha güçlü hale gelir. Son çalıĢmalar, bu hiperaktivasyon reaksiyonunun, Ca+2'nin spermatozoa kuyruklarına ani bir akıĢından kaynaklandığını göstermektedir. Sperm kuyruğunun plazma membranı, CatSpers (spermin katyon kanalları) adı verilen çok sayıda transmembran Ca+2
kanal proteinini içerir. CatSper proteinleri sadece kuyruğun membranlarında eksprese edilir. Ca+2
akıĢı, kuyruğun daha aktif olmasına ve daha kuvvetli bir Ģekilde bükülmesine neden olur, bu da uterus tüpünün viskoz ortamından daha hızlı sperm hareketine neden olur. Zona pellucida'nın sınırlı proteolizi ile birlikte, hiperaktivasyon oositin fiziksel penetrasyonundan sorumludur. Sperm hiperaktivitesi, sekonder oositi fertilizasyondan koruyan fiziksel bariyerlerin kırılması için gereklidir. Bu nedenle, erkek fertilitesi için CatSpers aktivasyonu gereklidir.
Zona pellucidaya nüfuz ettikten sonra spermatozoon, zona pellucida ve oolemma arasındaki perivitellin boĢluğuna girer. Burada, oolemmaya dokunduktan sonra, spermatozoon plazma zarı oolemma ile birleĢir. Oosit impregnasyonu olarak adlandırılan bu süreç, sperm
18 çekirdeğinin (yüksek oranda konsantre DNA içeren), sentrozomun, mitokondri içeren orta parçanın ve kinosilyumun oositin sitoplazmasına dahil edilmesine izin verir. Kuyruk plazma zarı, oolemmanın bir uzantısı olarak kalır.
Spermatozoon, ikinci mayoz bölünmenin sonlandırılması için moleküler bir sinyal üretir. Bu bölünme, sekonder oositi olgun bir oosit haline dönüĢtürür ve ikinci polar cismin perivitellin boĢluğuna atılmasını tetikler.
Dahil edilen sperm baĢının çekirdeğinde yer alan erkek genetik materyal paketlenmemiĢtir ve 23 paternal kromozom içeren erkek pronükleus oluĢumunda görev alır. Hem diĢi hem de erkek pronükleusun nüklear zarları çözülür (kaynaĢma olmadan) ve kromozomlar kendilerini ortak mitotik iğ içinde hizalarlar. Elde edilen zigot, 46 kromozomun diploid (2n) komplementini içerir ve daha sonra ilk mitotik bölünme veya klivaja uğrar. Erkek sentrozom, kromozomları embriyonun ilk iki hücresine bölen mitotik iğcik hizalanması için gereklidir. Ġlk ve devamındaki mitotik iğcik oluĢumunda sadece babadan gelen sentrozomlar kullanılır. Dahil olan kinosilyum çözülür ve tüm sperm mitokondrisi oosit sitoplazmasından elimine edilir. Ġnsan hücrelerinde normalde tüm mitokondriler anne kaynaklıdır fakat tüm sentrozomlar babanın sperm hücresinden kaynaklanır.
Fertilize eden spermatozoon, ooplazmaya nüfuz ederken, diğer spermatozoaların sekonder oosite girmesini (polispermi) önlemek için en az üç postfüzyon reaksiyonu ortaya çıkar. Bu olaylar Ģunları içerir:
Polisperminin hızlı blokajı. Oolemmanın büyük ve uzun süreli (1 dakikaya kadar) depolarizasyonu polispermiye geçici bir elektrik bloğu oluĢturur.
Kortikal reaksiyon. Oolemmanın polaritesindeki değiĢiklikler daha sonra ooplazmik depolardan Ca+2'nin salınmasını tetikler. Ca+2, kortikal granüllerin yüzeye doğru hareket ederek oolemma ile birleĢtiği, ovumun yüzey alanında geçici bir artıĢ ve zarın yeniden düzenlenmesine yol açan bir kortikal reaksiyon dalgasını yaymaktadır. Kortikal granüllerin içeriği perivitellin boĢluğuna bırakılır.
Zona reaksiyonu. Kortikal granüllerin salınan enzimleri (proteazlar), sadece oosit plazma membranı glikoprotein reseptörlerini sperm bağlanması için bozmakla kalmaz, aynı zamanda zona pellucida'nın yüzeyindeki proteinleri çapraz bağlayarak perivitellin bariyerini de oluĢturur. Bu olay polispermiye son ve kalıcı bir blok oluĢturur.
Döllenme ve implantasyon meydana gelirse, korpus luteum, gebeliğin korpus luteumunu oluĢturmak için boyut olarak artar. Korpus luteumun varlığı ve iĢlevi, topluca luteotropinler olarak tanımlanan, parakrin ve endokrin sekresyonlarının bir kombinasyonuna bağlıdır.
19 Parakrin luteotropinler, over tarafından lokal olarak üretilir ve Ģunları içerir:
Östrojenler
IGF-I ve IGF-II
Endokrin luteotropinler hedef organlarından uzakta korpus luteumdan üretilir ve Ģunları içerir:
Korpus luteumdaki LH reseptörlerini uyaran ve dejenerasyonunu önleyen koryonik trofoblast tarafından salgılanan 37 kDa ağırlığında glikoprotein yapıda hCG;
Her ikisi de hipofiz bezi tarafından salgılanan LH ve prolaktin;
Pankreas tarafından üretilen insülin.
Korpus luteum tarafından kolesterolden üretilen yüksek düzeydeki progesteron, over foliküllerinin siklik geliĢimini bloke eder. Erken gebelikte, korpus luteum 2 ila 3 cm ölçülerek, overlerin çoğunu doldurur. Hamilelik boyunca devam etmesine rağmen, 8 haftalık hamilelikten sonra iĢlevi yavaĢ yavaĢ azalmaya baĢlar. Korpus luteumun aktif kalmasına rağmen, plasenta 6 haftalık gebeliğin ardından korpus luteumun iĢlevini üstlenmek için maternal ve fetal öncülerden yeterli miktarda östrojen ve progestojen üretir. hCG, serumda gebe kalmadan 6 gün sonra ve idrarda gebeliğin 10-14. günü kadar erken bir sürede saptanabilir. Ġdrarda hCG'nin spesifik antikorlarla saptanması, çoğu gebelik testinin temelini oluĢturur. Ek olarak, erken gebelikte hCG'nin dolaĢım seviyesindeki hızlı artıĢı bulantı ve kusmadan sorumludur. Bu semptomlar genellikle sabahın erken saatlerinde görülür ve sıklıkla gebeliğin ilk belirtileri arasındadır.
2.1.8. FOLĠKÜLER ATREZĠ
Belirtildiği gibi, embriyonik overde farklılaĢmaya baĢlayan over foliküllerinin çok azı, olgunlaĢmalarını tamamlarlar. Foliküllerin çoğu, over foliküler atrezisi adı verilen bir süreçte dejenere olur ve kaybolur. Atreziye granüloza hücrelerinin apoptosisi aracılık eder. Çok sayıda folikül, fetal geliĢimde, postnatal erken dönemde ve ergenlik döneminde atreziye maruz kalmaktadır. Ergenlikten sonra, folikül grupları her adet döngüsünde olgunlaĢmaya baĢlar ancak normalde sadece bir folikül olgunlaĢmasını tamamlar. Atrezinin artık, diğer foliküllerin programlanmıĢ ölümüyle geliĢmelerini sürdürmek için birkaç folikülü uyardığı bir mekanizma olduğu düĢünülmektedir. Böylece, olgunlaĢmasının herhangi bir aĢamasında bir folikül atreziye uğrayabilir. ĠĢlem, folikül olgunlaĢmaya doğru ilerledikçe daha karmaĢık hale gelir.