T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ GÖZ HASTALIKLARI ANABİLİM DALI
Başkan: Prof. Dr. Filiz AFRASHİ
YENİ TANI ALMIŞ NEOVASKÜLER TİP YAŞA BAĞLI MAKÜLA DEJENERESANSI OLGULARINDA
İNTRAVİTREAL AFLİBERCEPT TEDAVİSİ
Dr. Pelin Kıyat UZMANLIK TEZİ
Tez Danışmanı: Prof. Dr. Jale Menteş
ÖNSÖZ
Uzmanlık eğitimim ve tez çalışmam süresince bilgi ve tecrübelerinden faydalandığım; farklı bakış açıları kazanmamda büyük emeği olan; tezimin planlanması ve uygulanması sırasında bana desteğini hiçbir zaman esirgemeyen çok değerli tez hocam sayın Prof. Dr. Jale Menteş’e sonsuz teşekkürlerimi sunarım.
Eğitimim süresince bilgi ve deneyimlerini benimle paylaşan, mesleğimin inceliklerini öğreten ve cerrahi becerimin gelişmesinde bana büyük katkıları olan çok değerli hocalarım; anabilim dalı başkanımız Prof. Dr. Filiz Afrashi’ye, Prof. Dr. Ayşe Yağcı’ya, Prof. Dr. Cezmi Akkın`a, Prof. Dr. Halil Ateş’e, Prof. Dr. Önder Üretmen’e, Prof. Dr. Sait Eğrilmez’e, Doç. Dr. Melis Palamar Onay’a ve Doç. Dr. Suzan Güven Yılmaz’a çok teşekkür ederim.
Asistanlığım boyunca, desteklerini her zaman hissettiğim, yardımlarını hiçbir zaman esirgemeyen, sıcaklıkları ve samimiyetleri ile hatırlayacağım Uzm. Dr. Serhad Nalçacı’ya Uzm. Dr. Elif Demirkılınç Biler’e, Uzm. Dr. Özlem Barut Selver`e, Uzm. Dr. Cumali Değirmenci’ye sonsuz teşekkürlerimi sunarım.
Birlikte çalışmaktan büyük mutluluk duyduğum ve pek çok güzel anılar paylaştığım tüm asistan arkadaşlarıma; ameliyathane, poliklinik, servis ve birimlerde birlikte çalıştığımız samimiyetlerini ve yardımlarını hiçbir zaman unutmayacağım tüm hemşirelerimize, tüm teknisyen ve yardımcı sağlık personelimize ve klinik sekreterlerimize çok teşekkür ederim.
Son olarak, bu gün bulunduğum noktaya gelmemde en büyük role sahip olan, sonsuz desteğini her zaman gösteren sevgili annem ve aileme teşekkürlerimi ve sevgilerimi sunarım.
Dr. Pelin Kıyat
İÇİNDEKİLER ÖNSÖZ……….………..…………II İÇİNDEKİLER………..………..……….…………III KISALTMALAR………...……….………...…………IV GİRİŞ ……….……….1 GENEL BİLGİLER ……….………...………..2
YAŞA BAĞLI MAKULA DEJENERASYONU………...……..2
EPİDEMİYOLOJİ ………... 3 RİSK FAKTÖRLERİ………....3 PATOGENEZ………..…………..7 YBMD EVRELERİ………..………....10 KLİNİK BULGULAR………..………...………….12 TANI ………..………...15 NVYBMD TEDAVİSİ………..……….………….19 ANTİ-VEGF TEDAVİ ………..……….……….20
POLİPOİDAL KOROİDAL VASKÜLOPATİ………..………..……….30
RETİNAL ANJİOMATÖZ PROLİFERASYON…………..……….…………..33
GEREÇ-YÖNTEM………...34 BULGULAR……….37 TARTIŞMA……….…48 SONUÇ……….…60 ÖZET………...63 REFERANSLAR…...65 III
KISALTMALAR
ADVA: Anormal dallanmış vasküler ağ CFH:Kompleman faktör H
EİDGK: En iyi düzeltilmiş görme keskinliği FA: Floressein anjiografi
FAZ: Foveal avasküler zon FDT: Fotodinamik tedavi
FDA: Amerikan Gıda ve İlaç Dairesi (U.S Food and Drug Administration) FVPED: Fibrovasküler PED
GİB:Göz içi basıncı ILM: İç limitan membran İR Sıvı: İntraretinal sıvı
İSYA: İndosiyanin yeşili anjiografisi İV A: İntravitreal aflibercept
İV R: İntravitreal ranibizumab İV B: İntravitreal bevacizumab KMÖ: Kistoid maküla ödemi
logMAR: Logarithm of the minimum angle of resolution MAC: Membran atak kompleks
MMPs: Matriks metalloproteinazlar Nv: Neovaskülarizasyon
NvYBMD: Neovasküler tip yaşa bağlı maküla dejeneresansı OKT: Optik koherens tomografi
PAİ-1: Plazminojen aktivatör inhibitörü-1 PED: Retina pigment epitel dekolmanı PKV: Polipoidal koroidal vaskülopati PlGF: Plasental büyüme faktörü PRN: Pro re nata (gerektiğinde tedavi) RAP: Retinal anjiomatöz proliferasyon RPE: Retina pigment epiteli
SD-OKT: Spektral Domain-Optik Koherens Tomografi SPSS: Statistical Package for Social Science
SR Sıvı: Subretinal sıvı
TIMPs: Metalloproteinaz doku inhibitörleri VEGF: Vasküler endotelial büyüme faktörü
GİRİŞ
Yaşa bağlı makula dejeneresansı (YBMD), gelişmiş ülkelerde ileri yaş grubunda geri dönüşümsüz görme kaybının önde gelen nedenlerinden birisidir. Kuru (non-neovasküler) ve yaş (neovasküler) olmak üzere iki ayrı formu mevcut olup, neovasküler YBMD (nvYBMD)’de hemoraji ya da eksudatif değişikliklere bağlı olarak ani görme kaybı gelişebilir (1). NvYBMD’nin temel bulgusu neovaskülarizasyon (nv) olup özellikle santral görmenin kaybı hastalarda fiziksel, emosyonel ve sosyal sorunları beraberinde getirmektedir (2,3).
NvYBMD tedavisinde bir dekad öncesine kadar tedavi ile tatmin edici sonuçlar alınamazken vasküler endotelial büyüme faktörünün (VEGF) nvYBMD’de yeni damar oluşumundan sorumlu temel faktör olduğunun ortaya konması ile anti-VEGF ajanlar geliştirilmiştir. Anti-VEGF ajanların kullanıma girmesi devrim niteliğinde olup günümüzde nvYBMD’de standart tedavi olarak kullanılmaktadırlar.
Kullanıma giren anti-VEGF ajanların en yenisi aflibercepttir, diğer anti-VEGF ajanlara göre VEGF afinitesi daha fazladır ve tüm VEGF alt gruplarına ek olarak patogenezde rol aldığı kanıtlanmış olan plasental büyüme faktörünü (PlGF) de inhibe etmektedir (4). Aflibercept diğer anti-VEGF ajanlardan daha uzun bir yarılanma ömrüne sahiptir ve bu özelliği diğer ajanlara kıyasla daha az enjeksiyon ile etkin tedavinin yapılabilmesini sağlamıştır. VIEW 1 ve 2 (VEGF Trap-Eye: Investigation of Efficacy and Safety in Wet Age-Related Macular Degeneration) çalışmaları bir ay ara ile yapılan 3 ardışık intravitreal aflibercept enjeksiyonu ardından iki ayda bir devam edilen enjeksiyonlar ile elde edilen sonuçların, ranibizumabın aylık uygulanması ile alınan sonuçlardan 52. haftada ve 96. haftada yapılan değerlendirmeler sonucu daha başarısız olmadığını bildirmiştir (5,6).
Anti-VEGF tedavi ile nvYBMD tedavisinde büyük oranda başarı sağlanabilmektedir, ancak olguların tamamında tedaviye istenilen yanıt alınamamaktadır. Tanı sırasında saptanan bazı anatomik bulgular, polipoidal koroidal vaskülopati (PKV) ya da retinal anjiomatöz proliferasyon (RAP) gibi diğer neovasküler oluşumların varlığı tedavi yanıtını etkileyebilmekte ve tedavi başarısı üzerine etkili olabilmektedir. Geniş kapsamlı randomize klinik çalışmalar planlanırken hastaların çalışmaya dahil edilme kriterleri çok katı iken, bizim çalışmamız gibi gerçek yaşam verilerini içeren çalışmalarda farklı görme keskinliklerine sahip, farklı anatomik
özelliklere sahip nvYBMD olguları çalışmaya dahil edilmektedir ve olgulardaki başlangıç özellikleri tedavi yanıtını etkileyebilmektedir.
Çalışmamızın amacı yeni tanı almış ve daha önce herhangi bir tedavi uygulanmamış nvYBMD’li olgularda intravitreal aflibercept tedavisi ile alınan anatomik ve fonksiyonel sonuçları prospektif olarak değerlendirmektir. Çalışmamızda ayrıca intravitreal aflibercept tedavisi ile alınan anatomik yanıtları etkileyen başlangıç faktörleri analiz edilmiş ve tanı sırasında saptanan PKV ya da RAP gibi diğer neovasküler anomalilerin intravitreal aflibercept tedavisi ile alınan anatomik yanıtlar üzerindeki etkisi incelenmiştir.
GENEL BİLGİLER
YAŞA BAĞLI MAKULA DEJENERASYONU
Yaşa bağlı maküla dejeneresansı (YBMD), 1885’te Otto Haab tarafından 50 yaş üzerindeki olgularda makülada izlenen pigmentli veya atrofik değişimler ile santral görme keskinliğinde progresif azalma olarak tanımlanmıştır (7). Gass ise 1967 yılında, drusen, atrofik maküla dejeneresansı ve eksudatif maküla dejeneresansının aynı hastalığın varyasyonları olduğunu belirtmiştir (8,9).
Günümüzde YBMD, nörodejenerasyon ile seyreden maküler bir hastalık olarak düşünülmekte ve makülada koriokapillaris, Bruch membranı, retina pigment epiteli (RPE), fotoreseptör tabakalarının etkilendiği progresif bir dejenerasyon olarak tanımlanmaktadır (10). YBMD, gelişmiş ülkelerde 65 yaş ve üzeri popülasyonda geri dönüşümsüz görme kaybının en başta gelen nedenidir (11). Dünya nüfusunun ve yaşam süresinin artması yaşlı popülasyonunun da artmasına neden olmakta, buna paralel olarak da YBMD insidansı artış göstermektedir. YBMD, dünyada katarakt ve glokomdan sonra körlüğe neden olan 3. sıklıktaki hastalık olarak kabul edilmektedir (12).
YBMD; kuru tip (non-eksudatif, atrofik) ve yaş tip (eksudatif, neovasküler) olmak üzere ikiye ayrılır. YBMD olgularının, %85-90’ını kuru tip, %10-15’ini yaş tip oluşturmaktadır (13). Kuru tip YBMD, YBMD’e bağlı ciddi görme kayıplarının %10’undan sorumludur. Görme keskinliği, fotoreseptörlerin, RPE’nin ve koriokapillarisin progresif atrofisi nedeni ile azalır. YBMD’de çoğu zaman bilateral ve asimetrik tutulum izlenir (14). NvYBMD’de görme kaybı
çoğunlukla nv gelişimine sekonder izlenen bulgular nedeniyle görülür. Nv, Bruch membranındaki defektlerden retina içine uzanarak, sıvı ve lipid birikimine ve kanamaya neden olur. NvYBMD tedavi edilmezse atrofi ya da fibröz skar dokusunun gelişimi ve görme keskinliğinde kalıcı kayıp ile sonuçlanır (1).
EPİDEMİYOLOJİ
Toplum bazlı çalışmalarda YBMD prevalansı değişiklik göstermektedir. Bu değişikliklerin nedeni YBMD sınıflamasının farklı yapılması ve çalışmalardaki popülasyonun yaş, cinsiyet ya da genetik mutasyonlar gibi çeşitli demografik faktörler açısından farklılık göstermesine dayanmaktadır.
Beaver Dam, Blue Mountain ve Rotterdam çalışmalarında ortak değerlendirme yöntemi olarak stereoskopik renkli maküla fotoğrafları temel alınmış ve Wisconsin Age-Related Maculopathy Grading System (WARMGS)’e göre lezyon evrelendirilmiş ve YBMD prevalansı belirtilmiştir (15,16). Beaver Dam çalışmasında YBMD prevalansı % 1.7 olarak belirtilirken, bu oran Rotterdam çalışmasında % 1.2, Blue Mountain çalışmasında % 1.4’tür. Her üç çalışmada da YBMD prevalansı yaşla birlikte artmaktadır.
NvYBMD tanısı alan birçok hastada, tanının PKV olabileceği de düşünülmelidir. PKV, Sarı ırkta nvYBMD tanısı alan olguların %23.9-54.7’sini oluştururken beyaz ırkta bu oran %4-9.8 arasında olarak değişmektedir (1). Menteş ve ark. ise çalışmalarında intravitreal ranibizumab tedavisine cevapsız nv-YBMD olgularında PKV sıklığının %54.8 olduğunu bildirmişlerdir (17). YBMD tanısı alan olgularda düşünülmesi gereken bir diğer patoloji ise RAP olup nvYBMD olgularının %12-15’ini oluşturduğu düşünülmektedir (18).
RİSK FAKTÖRLERİ Yaş
İleri yaş her evre YBMD için en önemli bağımsız risk faktörü olup ilerleyen yaşla birlikte prevalans, insidans ve progresyon da artmaktadır (19). ‘Waterman’ çalışma grubu prevalans ve insidansın 60 yaş üzerinde her 10 yılda 2 kat arttığını bildirmiştir (20).
Kopenhag Göz Kliniği tarafından yapılan bir çalışmada ise YBMDprevalansı 60-64 yaş arasında % 2.3 iken 75-80 yaş arasında % 27.3 olarak saptanmıştır (21).
Cinsiyet
Cinsiyet konusunda farklı çalışmalarda farklı sonuçlar bildirilmiştir. Birçok çalışmada YBMD sıklığı açısından kadın ve erkek cinsiyet arasında fark olmadığı gösterilmesine rağmen Beaver Dam Göz Çalışması’nda 75 yaş üstü popülasyonda erken YBMD insidansı kadınlarda iki kat fazla saptanmıştır. 1988-1994 National Health and Nutrition Examination Survey (NHANES)’de YBMD prevalansının kadınlarda erkeklerden daha yüksek olduğu bildirilmiştir (22); ancak 2005-2008 NHANES çalışmasında cinsiyet açısından bir fark izlenmemiştir (23). Çalışmalar arası farklılıkların nedeni bazı çalışmalarda 75 yaş üstü popülasyonda kadın oranının daha fazla olması olabilir (24,25). Postmenapozal dönemde kadınlarda östrojen hormonunun koruyucu etkisinin ortadan kalkması ile YBMD gelişiminde artış izlendiği de düşünülmektedir (26).
Irk/Etnik Köken
YBMD prevalansı farklı etnik gruplarda değişmektedir. Kuru ya da nvYBMD’nin beyaz ırkta daha yaygın olduğu bildirilmiştir ve YBMD en sık Kafkas ırkında görülmektedir (27). Hücresel yaşlanmanın bir belirteci olan lipofuskin oluşumuna karşı, melaninin koruyucu olması; melaninin daha az bulunduğu beyaz ırkta YBMD’nin daha sık görülmesine neden oluyor olabilir (28).
Sigara
Sigara; modifiye edilebilir risk faktörleri arasında en iyi bilinenidir. The Age-Related Eye Disease Study (AREDS) sonuçlarına göre sigara içenlerde YBMD riski iki katına çıkmaktadır (29). Sigara içenlerde içmeyen gruba göre YBMD gelişme riski en az 5 yıl daha erkene çekilmektedir. Sigaranın dış retina katlarındaki antioksidan seviyesini azalttığı ve retinayı oksidatif hasara duyarlı hale getirdiği düşünülmektedir. Sigara ayrıca trombosit agregasyonunu, lipid peroksidasyonunu artırır ve serum antioksidan düzeylerini düşürürür.
Bunlara ek olarak vazokonstriktör etkisiyle koroid kan akımında azalmaya neden olarak YBMD gelişimine katkıda bulunur (30).
Antioksidan, Vitamin ve Mineraller
C ve E vitaminlerinin, lutein ve zeaksantin gibi antioksidanların ve çinkonun YBMD patogenezindeki rollerinden dolayı eksikliklerinin YBMD ile ilişkili olabileceği düşünülmektedir.
Alkol
Alkol ve YBMD gelişme riski ile ilgili çalışmalarda ortak bir sonuca varılamamıştır (31).
Kardiyovasküler hastalık
Koroidal vasküler yapıdaki aterosklerozun YBMD gelişimi için risk faktörü olduğu bilinmektedir (32). Anjiografik olarak bozulmuş koroidal kan akımının erken YBMD için uyarıcı nitelikte bir bulgu olduğu düşünülmektedir (33).
Hipertansiyon; epidemiyolojik çalışmalarda en sık görülen komorbid sistemik hastalıktır (34). Ateroskleroz ve dislipidemi de YBMD hastalarında sık görülen komorbid bozukluklardır (35,36).
YBMD hastalarının kardiyovasküler problemlerinin tedavisi önemle tavsiye edilmektedir; çünkü hem kardiyovasküler hastalıkların hem de YBMD’nin patogenezinde enflamasyon, lipid metabolizması bozuklukları ve oksidatif hasar bulunmakta ve bu hastalıklar ortak bir patofizyolojik mekanizma ile ortaya çıkmaktadırlar (37).
Obezite
Obezite ile YBMD arasında ilişki olduğunu bildiren çalışmalar bulunmakta, artan vücut kitle indeksi ile gelişen oksidatif stres ve enflamasyon artışının YBMD riskini arttırdığı düşünülmektedir (25).
Yüksek serum C-reaktif protein, homosistein ve fibrinojen düzeyleri
Bu faktörlerin YBMD riski üzerindeki etkiler hakkında yapılan çalışmalar çelişkilidir (14).
Genetik Faktörler
YBMD gelişimi üzerine genetik faktörlerin etkisi ile ilgili kanıtlar giderek artmaktadır. İkiz çalışmalarında YBMD gelişiminde genetik faktörlerin % 46-71 oranında etkili olduğu bildirilmiştir (28).
Yapılan çalışmalarda Kromozom 1q31’deki mutasyonların, 10q26’daki kompleman faktör H (CFH) proteininin sentezinden sorumlu gende 402. pozisyonunda tirozinin (Y) yerine histidinin (H) geçmesiyle oluşan CFH Y402H polimorfizminin YBMD riskini arttırdığı düşünülmektedir. Yapılan çalışmalarda CFH Y402H polimorfizmi ile kuru tip YBMD’dense özellikle nvYBMD’nin ilişkili olduğu saptanmıştır (38). İlgili kromozom sahalarından sentezlenen proteinlerin görevlerine bakıldığında; immünite, enflamasyon ve oksidatif stres kontrolünde görevli proteinler olup; bu proteinlerin sentezindeki mutasyonların YBMD patogenezinde rol oynadığını düşünülmektedir (39).
Sosyoekonomik durum
Sosyoekonomik olarak yüksek seviyenin yaşam tarzı, diyet seçimi ve fiziksel aktivite tercihlerinin YBMD görülme riskini azalttığı düşünülmektedir (40).
Güneş ışığı
Güneş ışınları, risk faktörü olarak değerlendirilmekle birlikte çalışmalarda YBMD ile ilişkisi kanıtlanamamıştır. İstisnai olarak Beaver Dam çalışmasında, UV ışınlarının YBMD riskini arttırdığı belirtilmiştir (41).
İlaçlar
Statinlerin YBMD hasta grubunda nv oluşma riskini azalttığı bildirilmiştir. Statinlerin, kan lipid seviyelerini düzenleyici etkileri, anti-enflamatuar ve antioksidan etkileri nedeniyle YBMD gelişim riskini azalttığı düşünülmektedir (42).
Klein ve ark. çalışmasında ise antihipertansif ya da vazodilatatör ajan kullanımı ile YBMD insidansı arasında ilişki değerlendirilmiş ve vazodilatatör ajanlardan oral nitrogliserinin
erken YBMD riskinde artışa neden olduğu, antihipertansif ajanlardan ise oral beta bloker kullanımının eksudatif tip YBMD insidansında artışa neden olduğu bildirilmiştir. Antihipertansif kullanımının YBMD gelişim riski üzerine etkilerinin değerlendirildiği benzer çalışmalar da (43) beta blokerlerin YBMD insidansını artırdığını bildirmişlerdir. In vitro çalışmalar antihipertansif ajanların özellikle de beta blokerlerin kültüre edilmiş RPE hücrelerinde lipofuskin benzeri pigment gelişimini indüklediğini ve bu sayede YBMD insidansını artırabileceğini göstermiştir (44).
Oküler Risk Faktörleri
YBMD ile katarakt ilişkisine bakıldığında, kataraktın UV geçişini önleyerek koruyucu olduğunu savunan çalışmaların (45) yanı sıra, kataraktın YBMD için herhangi bir koruyucu etkisi olmadığını bildiren yayınlar da mevcuttur (46). Katarakt cerrahisi sonrası UV’den koruyucu etkinin ortadan kalkması ve cerrahi enflamasyonun tetikleyici etkisi nedeni ile YBMD progresyonu olabileceği bildirilmiş ise de sonraki çalışmalarda bu ilişki kanıtlanmamıştır (47-49). Bir gözünde nvYBMD gelişen bir hastanın diğer gözünde de nv gelişme ihtimalinin arttığı da çalışmalarda bildirilmiştir (50,51).
Sonuç olarak YBMD etyopatogenezinde en önemli faktörler ileri yaş, genetik yatkınlık ve sigara kullanımı olup yüksek riskli gruplarda modifiye edilebilir risk faktörlerinden kaçınılması ve YBMD gelişimi açısından yakın takip önerilebilir.
PATOGENEZ
YBMD patogenezinde kronik oksidatif hasar, lipofuskin birikimi, kronik enflamasyon, anjiogenezis ve apoptozisin rolü olduğu düşünülmektedir. RPE hücrelerinde lipofuskin birikimi ile karakterize olan yaşlanma ile koroidal iskemi YBMD gelişiminden sorumlu temel faktörler olarak düşünülmektedir (52).
RPE, fotoreseptörlerin fonksiyonlarının devamını sağlayan ve büyük önem arz eden birçok metabolik yolda görev almaktadır. Bunların başında dış kan-retina bariyerinin bütünlüğünün ve A vitamini bağımlı görsel siklusun devamlılığının sağlanması, yaşlanan fotoreseptör dış segmentlerinin apikal kısımlarının fagositozu yer almaktadır (53). RPE hücreleri replike olamadıkları için yaş ile birlikte RPE’de değişiklikler görülmeye başlar. Yaşlanma ile RPE hücrelerinin yoğunluğu azalır ve fagositoz kapasiteleri düşer. Fotoreseptör dış segmentine ait sindirilemeyen atıklar RPE hücresinde lipofuskin olarak birikir. Fotoreseptör
dış segmentlerinde ışık etkisi ve oksijen metabolizması nedeniyle başlayan serbest radikal reaksiyonlarının sonucu olarak bazı moleküller hasarlanır ve anormal olarak birikmeye başlar (54,55). Dış segmentlerin fagositozu sonrası RPE’deki lizozomal enzimler bu anormal molekülleri tanıyamadığı için bu anormal moleküller lipofuskin olarak birikir. Lipofuskinin birikimi ile RPE hücresinde sitoplazma hacmi azalır ve organellere yer kalmaz. RPE fonksiyonlarında bozukluklar ortaya çıkarak fotoreseptörlerin yenilenme sürecinde aksamalar oluşur. Anormal molekül birikimi nedeni ile şişen RPE hücreleri otofajiye uğrar ve yerlerini komşu RPE hücreleri doldurur. Dolayısı ile daha kısa ve daha geniş yüzeyli hücreler ortaya çıkar (56,57) Yaşlanma ile RPE hücrelerinde kayıp başlar. RPE yoğunluğundaki azalma foveada yılda %0.3 kadardır (58). Buna rağmen her bir RPE hücresinin ilişkide bulunduğu fotoreseptör sayısı değişmediği için RPE kaybı, fotoreseptör hücrelerinde de paralel bir kayıp ile sonuçlanır (59).
Bruch membranı kendini yenileyebilmekte, bu yenilenme matriks metalloproteinazlar (MMPs) ve metalloproteinaz doku inhibitörleri (TIMPs) dengesi ile olmaktadır. Bruch membranında yaşlanma ile kalınlaşma meydana gelir. Kalınlaşma temel olarak tip 1 kollajen liflerin artışı kaynaklıdır. Kalınlaşmanın diğer bir nedeni de RPE bazal membranından geçen koroid kaynaklı debrislerin birikmesidir. Fotoreseptör dış segmentlerindeki peroksidize lipitlerin Bruch membranında ilerleyen yaşla artışı da önemli olup Bruch membranında lipid birikimi en çok makülada olur. Fotoreseptör yoğunluğunun ve dış segment peroksidasyonunun dolayısıyla metabolik aktivitenin en yoğun olarak makülada bulunması bu durumun nedeni olabilir (53). Bruch membranında kalınlaşma ile sıvı geçirgenliğine karşı direnç gelişir, membranın rijiditesi artar, normal şartlarda membrandan geçebilen protein molekülleri içeride kalır. Ayrıca kalınlaşmaya bağlı oksijen transport mesafesi artar ve bu durum dış retinal katların oksijensiz kalması ile sonuçlanır (60-62).
Yaşlanma ile koroid kan akımında, koriokapillaris yoğunluğunda ve lümen çapında azalma olduğu gösterilmiştir. Ayrıca, koroid damarları RPE tarafından salınan büyüme faktörleri ile de regüle olmaktadır. YBMD patogenezinde hem RPE dejenerasyonu hem Bruch membranı kalınlaşması ile bu faktörlerin koriokapillarise ulaşımı azalmaktadır. Dolayısı ile RPE dejenerasyonu ile koroidal perfüzyon bozulmaktadır. Ancak koroidal perfüzyonun RPE dejenerasyonuna yol açtığı da ileri süren araştırmacılar da bulunmaktadır. Koriokapillarisin temasta olduğu Bruch membranının arka yüzünde, koriokapillaris atrofisine sekonder değişimler izlenmiştir. Histopatolojik olarak Bruch membranının arka yüzeyinde makrofajlar, fibroblastlar ve az sayıda lenfositlerin bulunduğu gösterilmiştir. Dejenere RPE hücrelerinin kaynağını oluşturduğu Bruch membranındaki artıklara cevap olarak gelişen düşük seviyeli
kronik enflamasyon, etkisini Bruch membranı çatlaklarına uyan alanlardaki koroidde de gösterir ve bu durum nv gelişimi ile sonuçlanabilir.
YBMD patogenezinde değişiklikler, temel olarak RPE içinde lipofuskinin ve sub-RPE alanda ise lipit ve diğer atıkların birikimi ile başlar (63,64). Atıklar kronik enflamasyonu uyarır. Kronik enflamasyon ise kompleman aracılı yolağın aktivasyonu ve makrofaj infiltrasyonu ile sonuçlanır. Sonuçta RPE bazal membranında Membran atak kompleks (MAC) oluşur (65,66). MAC, RPE’de hem fonksiyon bozukluğuna hem ölüme neden olur ayrıca dış retinal atrofiye yol açar. Kompleman yolunun aktive olması ile oluşan C5a’nın proanjiogenik etkileri, nv gelişimine katkıda bulunur (67,68).
NvYBMD’nin en önemli bulgusu nv’dir. Yeni damarlar, sub-RPE, subretinal ya da intraretinal alanda gelişebilirler. Neovasküler lezyonlar çoğunlukla sıvı sızdırırlar, kanarlar ve fibrovasküler dokuya dönüşebilirler. Nv, tedavi edilmezse makülayı içeren diskiform skar oluşumu ile sonuçlanır. Erken dönemde görme azlığı sıvı sızıntısına ya da hemorajiye bağlı ve nispeten geri dönüşümlü olsa da, fibröz skar gelişmesi ile görme kaybı kalıcı hale gelir.
Nv’nin gelişimi makülada dış nükleer tabakada ve RPE’de anjiogenik büyüme faktörlerinin artması ile ilişkilidir (69). YBMD’de nv yakınındaki koroidde iskemi alanları görülmüş olup, buna cevap olarak RPE hücreleri nv gelişimine yol açan birçok madde üretmektedir (70). Nv patogenezinde temel olarak VEGF üzerinde durulmaktadır. VEGF, anjiogenezi düzenleyen anahtar molekül olup fonksiyonunun engellenmesi ile nv gerilemesi sağlanabilir. NvYBMD’de yeni damar oluşumu anjiogenez ile olmaktadır yani daha önceden var olan damarlardan yeni damarların oluşu söz konusudur. Anjiogenezisin başlangıcında kapiller endotel hücreleri arasında boşluklar oluşur ve endotel hücrelerinde pencereler meydana gelir, böylece kapillerler plazma proteinlerine ve fibrinojene geçirgen hale gelirler (71). Bazal membranın yıkılması ve hücre migrasyonu sonrasında ekstraselüler matriksin yeniden şekillendirilebilmesi için MMPs salgılanır. Fibrinojenin pıhtılaşması fibrin oluşumuna neden olmakta ve yeni büyüyen damarlara destek matriks olarak görev yapmaktadır. Sonrasında vasküler yatak içinde endotelyal hücreler prolifere olur ve lümen formasyonu oluşur. İnce duvarlı, perisitten fakir gelişen kapillerlerin gelişimi ile yeni damar oluşumu tamamlanmış olur (72).
Nv gelişiminde rol alan anjiogenetik faktörlerin en önemlisi VEGF’tir. İnsan vücudunda VEGF’in A, B, C, D, E ve PlGF adında 6 izoformu bulunmaktadır. VEGF izoformları arasında en büyük öneme sahip olanı VEGF-A olup, 121, 165, 189 ve 206 aminoasid içeren 4 formu bulunmaktadır (73). VEGF-165 insan gözündeki neovaskülarizasyonda rol oynayan temel izoformdur. VEGF-121 sistemik dolaşımda en az 14 gün kalabilirken VEGF-165’in yarı ömrü
çok daha kısadır bu da VEGF-165’i hedef alan bir ajan olan pegaptanibin, tüm izoformlara etkili olan diğer anti-VEGF ajanlara göre daha zayıf kalan etkisini açıklamaktadır. VEGF reseptörleri endotel hücre yüzeyinde yer alır ve VEGFR-1, VEGFR-2, VEGFR-3 olmak üzere üç farklı tirozin kinaz reseptörüne bağlanır. VEGF A sadece VEGFR-1 ve VEGFR-2’ye bağlanır. Bunlardan VEGFR-2, VEGF’in anjiogenik, mitojenik ve damar geçirgenliğini artırıcı özelliklerinden sorumlu iken; VEGFR-1 ise VEGF’in çalışmasında düzenleyici rol üstlenir.
Retinada VEGF upregülasyonu, kronik enflamasyon ve çeşitli büyüme faktörleri salınımı ile gerçekleşse de korioretinal dokuda VEGF düzenleyicisi temel olarak hipoksidir (74). Oksijen konsantrasyonunun düşük olması VEGF sentezini artırır. Oluşan reaktif oksijen molekülleri de RPE’yi uyararak VEGF sentezini artırır. Hipoksik RPE hücrelerinin nv patogenezinde yer aldığı bilinen PlGF ürettikleri gösterilmiştir (75). VEGF, endotel proliferasyonunu, damarlarda fenestrasyonu dolayısı ile geçirgenliği artırır (76).
Nv’nin sızdırması ya da kanaması sonucu seröz ya da hemorajik PED gelişebilir (77,78). Nv dokudan kanama diskiform skar oluşumuna yol açabilir (79). Eksudatif formun son evresi olan diskiform skar bir gözde varsa diğer gözde de eksudatif bir lezyon gelişme riski % 12-34’tür (80). Diskiform skarlarda etrafı makrofajlarla çevrili neovasküler kanallar, fibroselüler doku, RPE atrofisi ve fotoreseptör kaybı gösterilmiştir (81,82).
YBMD EVRELERİ
YBMD’ye yönelik farklı sınıflandırmalar kullanılmaktadır. Genellikle anormal neovaskülarizasyonun varlığı veya yokluğuna göre YBMD neovasküler ya da non-neovasküler olarak sınıflandırılır. YBMD görme keskinliğindeki azalma miktarına göre de erken veya geç olarak sınıflandırılabilmektedir (83).2000 yılında yayınlanan AREDS çalışma grubu YBMD sınıflamasını aşağıdaki gibi düzenlemiştir (30). (Tablo-1)AREDS’e göre 5 yıllık süreçte en az bir gözde ileri YBMD gelişme riski kategori 2’de %1.3, kategori 3’te %18.3 ve kategori 4’te %43.9 olarak saptanmıştır (84).
İleri YBMD’nin risk faktörlerinin daha net olarak tanımlanması amacı ile AREDS verilerinin tekrar değerlendirilmesi ve analizi ile Ferris ve ark. (85) tarafından yeni bir sınıflama sistemi oluşturulmuştur (Tablo 2). Bu sınıflamada vurgulanan temel noktalar: Küçük drusen (<63 µm çaplı) önemsiz derecede düşük ileri YBMD riski taşımaktadır. Küçük drusen varlığı, büyük drusen ve pigmenter değişikliklerin gelişimi için şart değildir. Foveadan 2 optik disk çapı kadar uzaklıktaki mesafe içinde yer alan, en az birkaç orta boy drusenle (63 µm-125 µm) birlikte olan, bilinen bir retinal hastalık veya başka bir anomali ile ilişkisi olmayan pigmenter
değişiklikler artmış ileri YBMD riski ile ilişkilidirler. Bu olgular, büyük drusen (>125 µm) bulunmasa da erken YBMD olarak kabul edilmelidirler (85).
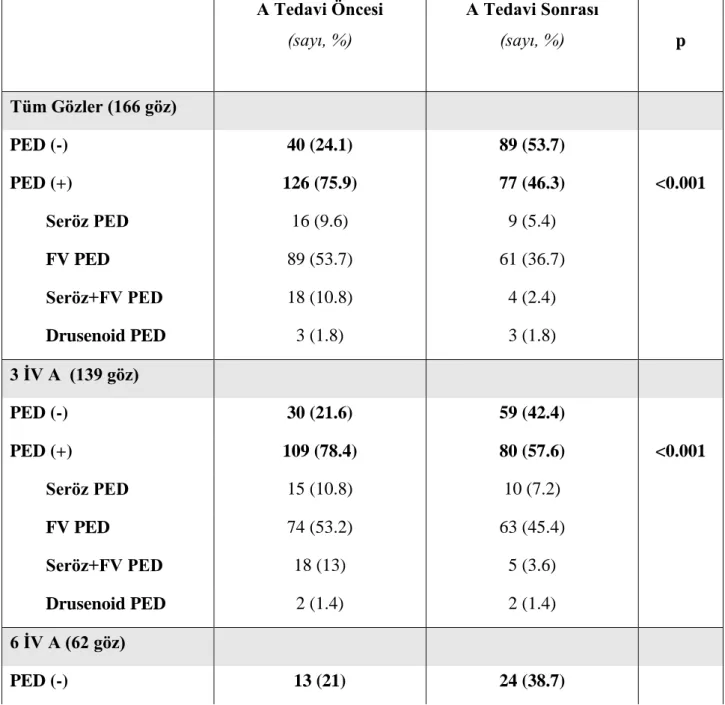
Tablo 1: Yaşa Bağlı Maküla Dejenerasyonu Bulgularının AREDS Sınıflaması Kategori 1 Drusen yok ya da birkaç adet küçük drusen (<63 µm ) mevcut
Kategori 2 Aşağıdaki bulgulardan en az birisinin olması: Çok sayıda küçük drusen
Birkaç adet (20’den az) orta boy drusen (63-124 µm) RPE anormallikleri
Kategori 3 Aşağıdaki bulgulardan en az birisinin olması:
Çok sayıda orta boy drusen ve en az bir büyük drusen (≥125 µm)
Foveayı içermeyen coğrafik atrofi
Kategori 4 Aşağıdaki bulgulardan en az birisinin olması: Foveayı içine alan coğrafik atrofi
Nv, drusenoid olmayan PED veya subfoveal drusen gibi erken evre YBMD lezyonlarına bağlı olarak görme keskinliğinin 20/32’den az olması.
Tablo 2: Yaşa Bağlı Maküla Dejenerasyonunun Klinik Sınıflaması (Ferris ve ark.)
(Lezyonlar en az bir gözde, fovea merkezinden 2 optik disk çapı kadar mesafede olmalıdır)
Belirgin yaşlanma bulgusu yok Drusen yok ve
YBMD’e bağlı pigmenter değişiklik yok * Normal yaşlanma bulguları Küçük drusen var (<63 µm çaplı) ve
YBMD’e bağlı pigmenter değişiklik yok * Erken YBMD Orta boy drusen var (63 µm > ve ≤125 µm
çaplı)
YBMD’e bağlı pigmenter değişiklik yok * Orta Düzey YBMD Büyük drusen var (>125 µm çaplı) ve/ veya
YBMD’e bağlı herhangi bir pigmenter değişiklik var *
İleri YBMD Nv YBMD var ve/veya Coğrafik atrofi var
*YBMD’ye bağlı pigmenter değişiklik: Başka bir hastalıkla ilişkisi olmayan hipo/hiperpigmentasyonlar
nvYBMD
KLİNİK BULGULAR
Kuru tip YBMD, nvYBMD’ye göre daha sık görülmektedir; bütün YBMD olgularının % 90’ını oluşturmaktadır (39). Klinik bulgular arasında drusen, eksuda, hemoraji, RPE değişiklikleri, atrofi ve skar dokusu görülür.
NvYBMD, YBMD olgularının yaklaşık %10’unda görülmekle birlikte YBMD ile ilişkili ciddi görme kayıplarının %90’ından sorumludur. NvYBMD’li hastaların şikayetleri arasında metamorfopsi, santral veya parasantral skotom, ani görme azalması görülebilir. Ancak
her hasta semptomatik olmayabilir (86). Bu nedenle asemptomatik olsa bile 50 yaş üzerinde büyük, yumuşak, konfluent druseni olan ve nv için risk faktörleri bulunan hastalar periyodik olarak muayene edilmelidir.
NvYBMD geliştiğinde hastalar genellikle yeni ve ani gelişen görme azlığı ile başvururlar. Hastalar tipik olarak santral görmenin aniden kötüleşmesi ile birlikte düz çizgileri çarpık görme (metamorfopsi), santral görme alanında siyah bir alan (pozitif skotom) semptomlarını tarif ederler. NvYBMD varlığında klinik muayene ve görüntüleme yöntemleri ile elde edilen görüntülerde posterior polde, intraretinal ve/veya subretinal sıvı ve hemoraji, PED veya gri-yeşil kabarıklık şeklinde nv görülebilir ve tedavi edilmezse subretinal fibrozis veya atrofi ile sonuçlanabilir (1). NvYBMD’de, tedavi edilmediği takdirde son dönem bulgu diskiform skar oluşumudur (79).
Nv, Floressein Anjiografi (FA)’deki boyanma şekline göre klasik (pür, dominant, minimal) veya okkült olarak sınıflandırılır.
Klasik nv: Koroid fazında floresans verir; erken fazda parlak, sınırları belirgin, geç fazda sızıntı gösteren ve sınırları belirsizleşen hiperfloresans ile karakterizedir. Nv ağ, dantel veya tekerlek şeklinde izlenebilir.
Okkült nv: FA’da fibrovasküler PED veya kaynağı belirsiz geç sızıntı paternlerinden birisi izlenir. Fibrovasküler PED, FA’nın ilk 30-60 saniyesinde çok sayıda granüler tarzda hiperfloresans olarak görülür, floresans giderek artar, geç dönemde sızıntı görülür. Kaynağı belirsiz geç sızıntıda ise FA’nın geç fazında RPE düzeyinde sınırları belirsiz, benekli hiperfloresans görülür. Hiperfloresans 2-5 dk sonra belirginleşir. Sızıntının kaynağı olabilecek bir odak tanımlanamaz.
Klasik lezyonlarda daha hızlı progresyon izlenirken, laser tedavisi ve fotodinamik tedaviye (FDT) okkült lezyonlardan daha iyi yanıt verdikleri bilinmektedir fakat günümüzde öncelikli tedavi yöntemi olarak anti-VEGF ilaçlar kullanıldığından, bu sınıflama tedaviye yanıtı değerlendirmede eski önemini yitirmiştir (1).
Klasik nv yerleşimi yönünden foveal avasküler zon (FAZ) merkezinden uzaklığına göre 3 gruba ayrılır:
Subfoveal: FAZ merkezinin altında
Jukstafoveal: FAZ merkezinden uzaklığı 1-199 μ
Klasik nv içerdiği klasik komponentin miktarına göre de FA’da pür klasik, dominant klasik ve minimal klasik lezyon olarak da sınıflandırılabilir. Dominant klasik nv’de; lezyonun % 50’den fazlası klasik komponentten oluşur. Minimal klasik nv’de; lezyonun %50’sinden daha az bir kısmını klasik komponent oluşturmaktadır.
Nv’ler, OKT ile muayenede ilk orjin aldıkları anatomik lokalizasyonlarına göre 3 farklı tipe ayrılırlar. Tip 1 nv, sub-RPE alandan, tip 2 nv subretinal alandan, Tip 3 nv (RAP)
ise retina içerisinden orijin alır (87).
Pigment Epitel Dekolmanı
RPE ile Bruch membranı arasındaki yapışıklığın devamlılığını sağlayan mekanizma tam olarak açıklığa kavuşmamıştır. Normal şartlarda vitreustan koroide doğru akım mevcut olup bu akım hidrostatik ve osmotik kuvvetler arasındaki denge sayesinde oluşmaktadır. RPE’nin bazal membranı Bruch membranına laminin, proteoglikan, tip 4 ve 5 kollajen içeren hemidesmosomlar ile tutunmaktadır (88). PED, Bruch mebranın iç kollajenöz tabakası ile RPE‘nin bazal membranı arasında gelişir (89). Retina ve koroid damarlarının endotelinde hasara neden olan dejeneratif değişimler dış kan bariyerini bozar ve RPE altında sıvı birikimine yol açarak PED gelişmesine neden olur (90). PED, çoğunlukla YBMD ile ilişkilidir. YBMD ile ilişkili PED’in patogenezinde yaşla birlikte Bruch membranında oluşan dejeneratif değişiklikler ve nv yer almaktadır (91). Green ve ark. (92) yaş ile Bruch membranının kalınlığında artış saptamışlardır. Pauleikhoff ve ark. (93) ise ilerleyen yaş ile birlikte fotoreseptörlerin dış segment artıklarının salınımı ile oluşan nötral yağların muhtemelen dokunun doğal yapısını bozduğunu göstermiştir. YBMD’de drusene sekonder artmış hidrofobiklik ve vitreustan koroide doğru sıvı çıkışında azalma, RPE altında sıvı birikmesine neden olur ve seröz PED gelişir (94). YBMD’nin diğer özelliği de PED ile ilişkili nv’dir. Gass (95) tarafından öne sürülen teoriye göre sub-RPE boşlukta ve Bruch membranı içinde sızdıran yeni damarların oluşumu, her zaman klinik olarak tespit edilemeyen hidrostatik basınç yükselmesi sonrasında seröz ve hemorajik PED’lerin oluşumuna neden olabilmektedir. Bazı çalışmalar ise lokal enflamatuar mediatörlerin Bruch membranı ve RPE hücrelerinin anatomik yapısına zarar verdiğini ve geçirgenliği değiştirdiğini savunmaktadır (96). Marshall ve ark. (88) ise PED’in Bruch membranınında bulunan tip 4 kollajenin yapısını bozduğunu, buna sekonder Bruch membranının bariyer fonksiyonunun bozulmasının nv gelişmine neden olduğunu savunmuşlardır.
YBMD’de PED, RPE altındaki materyalin özelliğine göre hemorajik, seröz, drusenoid ya da fibrovasküler olmak üzere sınıflandırılabilir. Hemorajik PED, nv’nin RPE altındaki boşluğa kanamasıyla gelişir. Hemoraji çok masif olduğunda hemorajik retina dekolmanına neden olabilir ve vitreus hemorajisi ile sonuçlanabilir. Seröz PED, RPE ve retinanın keskin kenarlı, yuvarlak elevasyonu olup genelde bir disk çapı veya daha büyük çapta olabilir. Erken dönemde seröz sıvı yalnız RPE altında kalır, zamanla sıvı retina altına sızarsa seröz retina dekolmanına yol açabilir. Zamanla seröz dekolman kaybolabilir, drusene benzer sarı-beyaz birikintiler ile RPE atrofisi kalır. Drusenoid PED çok sayıda drusenin birleşmesinden oluştuğu için ondülasyon gösteren kenarlara sahiptir (97). Bruch membranının ekstraselüler matriksinde ve RPE’nin bazal membranında lipit birikimi sonucu oluşan drusenden ibarettir (91). Patogenezinde lipid birikimine bağlı hidrofobik bariyer oluşması ve sıvı birikmesi sonucu PED geliştiği düşünülmektedir (98).
YBMD ile ilişkili PED tiplerinin klinik ve prognostik açıdan birçok farklı yönleri olmakla birlikte PED’ler sıklıkla asemptomatik olarak ortaya çıkarlar. Hastalarda görmede bulanıklık, metamorfopsi ve mikropsi şikayetleri oluşabilir. Yeni gelişen hipermetropide PED gelişiminden şüphelenilmelidir. Klinik muayenede fundus bakısında tek veya multipl elevasyon olarak görülür, boyutu değişkendir. PED ile birlikte pigment bandı izlenebilir ve kronik hastalığın göstergesi olup, melanin ve lipofuskinden oluşur (99). PED’lerde radial korio-retinal katlantıların olması PED altında olası bir nv varlığının göstergesidir (99). Katlantılar fibrovasküler dokunun kontraksiyonu nedeniyle görülmektedir. RPE yırtığı PED’lerin bir komplikasyonu olarak izlenebilir. Kendiliğinden veya tedavi sonrasında gelişebilir.
TANI
Nv tanısı için temel tanı yöntemi FA’dır. PKV gibi koroidal patolojilerin tanınması için ise indosiyanin yeşili anjiografisi (İSYA) kullanılır. OKT ise invaziv olmayan bir görüntüleme yöntemi olup YBMD’nin erken tanısı, tedavi kararı verilmesi ve tedaviye yanıtın değerlendirilmesinde non invaziv, tekrarlanabilir, hızlı ve zararsız olması nedeniyle günümüzde en sık tercih görüntüleme yöntemi olmuştur (1).
Floressein Anjiografi
FA, YBMD tanısında, takibinde ve tedavi kararında yararlı invaziv bir görüntüleme yöntemidir. FA çekiminde intravenöz verilen boya maddesinin (sodyum floressein), ışığın bir
dalga boyunu absorbe etmesi, sonrasında farklı bir dalga boyunun eksitasyonu özelliğinden faydalanılır. FA esnasında uyarıcı ve engelleyici filtreler içeren fundus kamera sistemleri ve tarayıcı laser oftalmoskoplar kullanılır. Bu amaçla 5 ml % 10’luk sodyum floressein intravenöz olarak enjekte edilir (100). Sodyum floressein 376 dalton molekül ağırlıklı bir hidrokarbon olup kanda %80 oranında proteinlere, özellikle albümine bağlanır. Serbest kalan %20’lik kısım retina ve koroid dolaşımına geçerek floresansa neden olur. Vücuttan eliminasyonu 24-36 saatte karaciğer ve böbrek yoluyla gerçekleşmektedir. FA; floreseinin intravenöz enjeksiyonu sonrası retina ve koroid sirkülasyonuna geçişinin seri görüntüler aracılığı ile yorumlanmasıdır. YBMD’de FA paternleri hiper ve hipofloresans olarak sınıflanır (101). Hiperfloresan lezyonlar arasında RPE atrofisi, RPE yırtığı, nv, seröz PED, subretinal fibrozis ve laser skarları sayılabilir. Hipofloresan lezyonlar arasında ise floresseinin blokajına neden olan kanama, lipid ya da pigment proliferasyonu bulunmaktadır.
Drusen içeriğine göre hiper ya da hipofloresan olabilir. Hiperfloresan drusenin düşük lipid içeriği nedeniyle hidrofilik olduğu ve nv gelişimi için daha riskli olduğu düşünülmektedir. Hipofloresan drusen ise yüksek lipid içeriği nedeniyle hidrofobiktir. Floressein de hidrofilik bir boya olduğu için daha az boyanır (14).
Nv retinal doku içine boya sızıntısı nedeni ile hiperfloresans verir. Sızıntı yerine (subfoveal, jukstafoveal ve ekstrafoveal) ve tipine göre (klasik, okkült) sınıflara ayrılır. Klasik nv, RPE’yi penetre etmiş ve RPE üzerindeki bir lezyonu ifade ederken okkült nv, RPE altındaki bir lezyonun göstergesidir (1).
İndosiyanin Yeşili Anjiografi
İlk olarak 1972’de Flower ve Hochheimer koroid dolaşımının değerlendirilmesinde İSYA’nın önemini belirtmişlerdir (102). İSYA da FA gibi retina ve koroid sirkülasyonunun değerlendirilmesinde kullanılır. FA retina sirkülasyonunun değerlendirilmesinde başarılı bir yöntem olmakla birlikte RPE’nin blokajı nedeni ile koroid dolaşımının detaylı değerlendirilmesinde yetersiz kalabilir. İSYA’da kullanılan bir trikarbosiyanin boyası olan indosiyaninin emisyon ve absorpsiyon piklerinin infrarede yakın aralıkta olması, % 98 oranında
serum proteinlerine bağlanarak koriokapillaristen çok yavaş geçmesi ve bu nedenle floresseine
göre normal ve anormal koroid damarlarında daha uzun süre kalması; retinanın derin katlarının
FA’dan daha yararlı olmasını sağlamaktadır (103). Ayrıca koroid kaynaklı neovasküler lezyonlar olan PKV, en iyi İSYA ile görüntülenebilmektedir (1).
Drusenin içeriğindeki fosfolipidlere indosiyaninin bağlanması ile İSYA’da sert drusen, geç evrede devam eden hiperfloresan odaklar olarak izlenmektedir (104). Yumuşak drusen ise hipofloresan olarak izlenir (105).
NvYBMD’de İSYA özellikle FA ile tam olarak saptanamayan okkült nv’lerin değerlendirilmesinde ve YBMD ile PKV ayırıcı tanısında faydalıdır. Klasik nv’lerde ise İSYA’da sızıntı daha az olmakla beraber FA’ya benzer görünüm izlenmektedir. İSYA’da klasik
nv, FA’da olduğu gibi erken evrede keskin sınırlı dantel şeklinde izlenebilir.
Optik Koherens Tomografi
OKT, retinanın non-invaziv ve non-kontakt görüntülenmesini sağlayan hızlı, güvenilir ve tekrarlanabilir bir görüntüleme yöntemidir. Bu özelliklerinden dolayı, günümüzde, retina hastalıklarının tanı ve takibinde olmazsa olmaz bir görüntüleme yöntemi haline gelmiştir. OKT retinanın yüksek çözünürlüklü kesitsel görüntülerinin alınmasını sağlar. Retinanın ayrıntılı morfolojik bilgisini sağlar ayrıca retina kalınlık ölçümü gibi kantitatif incelemelere de imkan tanır. OKT, nv’nin kesitsel olarak görüntülenmesine izin verir. Ancak lezyondaki neovasküler komponenti, hemoraji veya fibröz dokudan net olarak ayıramaz (106).
OKT’de, kızılötesine yakın dalgalar ve interferometrik analiz yöntemi kullanılır. Farklı ışık dalga boyları kullanılarak, gönderilen ve yansıyan ışık dalgaları arasındaki gecikmenin referans değerlerle karşılaştırılmasıyla yani farklı retina katlarından yansıyan ışınların birbirlerine göre gecikmesi analiz edilerek görüntüler elde edilir. Dokunun derin katlarından yansıyan ışık, yüzeyden yansıyana göre daha uzun bir gecikme süresi gösterecektir.
Son yıllarda görüntüleme yöntemlerinde ve cihazlardaki teknolojinin hızlı gelişimi OKT’de de yaşanmaktadır. İlk ortaya çıkan OKT cihazları time-domain iken, günümüzde
yaygın olarak spektral domain OKT’ler kullanılmaktadır. SD-OKT ile retinal yapıların yüksek
çözünürlükte, yaklaşık 2-3μm kalınlığında kesitsel görüntüleri elde edilebilmektedir. Son yıllarda Swept Source-OKT ve High Speed, Ultra-high Resolution (hsUHR)-OKT de kullanıma girmiştir.
Temel olarak OKT görüntüleri siyah ve beyaz renkte olup dokuların ışığı yansıtma özelliğine göre bilgisayar programları aracılığı ile renklendirilmektedir. Işığı güçlü yansıtan tabakalar OKT’de kırmızı renkte görülürken, ışığı yansıtma gücü zayıf olan tabakalar mavi-siyah olarak görülmektedir. Sinir lifi tabakası, kırmızı olarak görülürken; ganglion hücre
tabakası, iç nükleer tabaka ve dış nükleer tabakanın yansıtıcılıkları düşüktür. İç pleksiform tabaka orta derecede yansıtıcılık gösterirken, dış pleksiform tabaka yansıtıcılığı yüksektir. RPE önündeki yüksek yansıtıcılık alanı, fotoreseptör iç ve dış segmentleri arasındaki sınırdır. RPE ve koriokapillaris de yüksek yansıtıcılığa sahiptir. Bruch membranı ise OKT kesitlerinde ayrı olarak reflektans vermez.
OKT ile drusen, nv, PED, RPE yırtığı, subretinal sıvı, kistoid maküla ödemi, diskiform skar ve atrofi tanınabilir, intraretinal – subretinal sıvı takibi yapılabilir. Drusen, OKT’de RPE altındaki yüksek yansıtıcılıktaki bantta düzensizlik, lokalize kalınlaşma ve küçük elevasyonlar şeklinde görülür (37).
OKT görüntülerinde PED’ler dört grupta incelenebilir:
Seröz PED: Retina ve RPE’de geniş tabanlı bir elevasyon olarak görülür. PED altındaki boşluk
hiporeflektandır ve siyah olarak görülür (107). Sınırlayan RPE bandı ise hiperreflektiftir. PED, subretinal sıvı ile beraberse PED kenarlarında, subretinal hiporeflektan boşluklar görülür.
Fibrovasküler PED: OKT’de sınırları düzensiz, retina-RPE elevasyonuna neden olur. PED
altındaki boşluk, fibrovasküler proliferasyon nedeniyle orta yansıtıcılıktadır ve mavi- kırmızı renklerde alacalı görülür (107).
Hemorajik PED: PED altındaki boşluğun RPE’ye yakın bölgesi hemoraji nedeniyle
orta-yüksek derecede yansıtıcılık özelliği gösterir. Altında ise seröz PED’lerde olduğu gibi düşük yansıtıcılıkta bir boşluk bulunur (107).
Drusenoid PED: PED’ler düzgün sınırlı, çok sayıda yumuşak drusenin birleşmesinden
oluştuğu için ondülasyon gösterirler (108).
OKT’nin klinik kullanımdaki en büyük katkısı bir YBMD olgusunun noneksudatif yada eksudatif (nv YBMD) olup olmadığının belirlenmesidir. İlaveten bir nvYBMD olgusunun aktif yada inaktif dönemde olup olmadığını da OKT bulgularına bakarak değerlendirmek mümkündür.
OKT bulgularına bakarak bir lezyonun aktif olup olmadığını değerlendirmeye yarayan parametreler arasında intraretinal ve subretinal sıvı birikimleri, kistoid değişimler, intraretinal ve subretinal hemorajiler, fibrozis ve PED bulunmaktadır. Sıvı birikimleri ve hemorajiler lezyonun aktif olduğuna işaret ederken, fibrozis çoğunlukla aktivitenin düşük olduğunu gösterir (109). OKT ile intraretinal sıvı, subretinal sıvı, intraretinal kistler ve PED’ler tedavi etkinliğinin
takibi için de incelenebilir (37). OKT, nv tanısında sınırlı değere sahipken nv tedavisinde kantitatif değerlendirme sağladığı için tedaviye yanıtın monitörizasyonunda büyük öneme sahiptir (107). Diskiform skar ise OKT’de RPE-koriokapillaris hattını temsil eden hiperreflektan bantın kalınlaşması ve daha hiperreflektif görünmesi ile kendini gösterir.
TEDAVİ
NvYBMD TEDAVİSİ
NvYBMD tedavisinde çalışmalarla etkinliği kanıtlanmış yöntemler; FDT, konvansiyonel laser tedavisi ve anti-VEGF ajanlarla tedavidir. VEGF’i inhibe eden anti-VEGF ajanlar günümüzde nvYBMD tedavisinin temelini oluşturmakta (110,111) ve anti-VEGF tedavinin kullanıma girmesinden sonra YBMD’ye bağlı görme kayıplarının azaldığı yapılan çalışmalarla kanıtlanmaktadır (112). NvYBMD tedavisinde yeni yaklaşımlar arasında düşük doz radyoterapi uygulanması (113), anti-VEGF etkiyi sağlayan yavaş salınımlı farmasötik formlar, VEGF sonrası yolaklarda inhibitör etkiye sahip ajanların kullanımı (114) sayılabilir.
Laser Fotokoagulasyon
Laser fotokoagulasyon, sadece sınırları iyi belirlenmiş, ekstrafoveal ya da jukstafoveal lezyonlar üzerine uygulanabilir (115,116). Tedavinin temel amacı, tüm neovasküler lezyonu koagülasyon nekrozu yaratarak kapatmaktır. Laser fotokoagülasyonun sadece sınırları belirgin nv’de uygulanabilmesi, lasere bağlı görme kaybı gelişebilmesi, nüks oranının yüksek olması nedeniyle günümüzde kullanımı sınırlıdır (117).
Fotodinamik tedavi
FDT, toksik olmayan fotosentisizan bir maddenin intravenöz infüzyonla verilip, hasarlı bölgede birikmesi ve uygun dalga boyunda laser ile aktive edilmesi sonrasında hedef dokuda oluşan fotokimyasal değişikliklerin tedavi edici amaçlı kullanılmasıdır. Etkisini spesifik olarak nv’yi hedef alarak gösterse de küçük ve orta çaplı koroidal damarlarda da oklüzyona yol açabilmekte, VEGF gibi anjiogenik faktörlerin salınımını arttırabilmekte ve bu durum rekürrens oranlarını olumsuz yönde etkileyebilmektedir. Günümüzde anti-VEGF ajanların güvenli ve etkin bir şekilde kullanıma girmesiyle beraber FDT’nin nvYBMD tedavisinde kullanımı oldukça sınırlanmış olmasına rağmen özellikle PKV gibi koroid kaynaklı patolojilerin tedavisinde halen tercih edilmektedir.
Anti-VEGF Tedavi
NvYBMD tedavisinde en önemli gelişme VEGF inhibisyonu sağlayan ajanların kullanıma girmesi olmuştur. NvYBMD patogenezinde VEGF-A, PIGF ve diğer VEGF alt grupları retinada nv gelişiminde temel rolü oynamaktadır. Nv gelişminde VEGF’in rolünün anlaşılmasıyla, intravitreal anti-VEGF ajanlar araştırılmaya başlanmış ve günümüzde intravitreal anti-VEGF enjeksiyon tedavisi standart hale gelmiştir (118,119).
Bugüne kadar pegaptanib, ranibizumab ve aflibercept olmak üzere FDA onaylı üç ayrı anti-VEGF ajan klinik kullanıma girmiştir. Pegaptanib (Macugen; Valeant Ophthalmics, Bridgewater, NJ, USA) VEGF165’e bağlanan, nvYBMD tedavisinde kullanım onayı alan ilk anti-VEGF ajandır. Ranibizumab (Lucentis; Genentech, South San Francisco, California, CA, USA) tüm VEGF-A izoformlarını inhibe eden bir diğer ajan olup 2006 yılında kullanıma girmiştir. Aflibercept (Eylea; Regeneron, Tarrytown, New York, NY, USA); en yeni anti-VEGF ajandır ve tüm VEGF-A izoformlarını ayrıca VEGF-B’yi ve PIGF inhibe eder (120). Bevacizumab (Avastin; Genentech, South San Francisco, California, CA, USA); kolorektal kanser, küçük hücre dışı akciğer kanseri, renal hücreli karsinomda sistemik olarak uygulanan bir kemoterapötik ajan olup off-label olarak çeşitli retinal hastalıkların tedavisinde maliyet-etkin bir tedavi yöntemi olarak kullanılmaktadır (37). Platelet Kaynaklı Büyüme Faktör (PDGF) inhibisyonu üzerinde çalışmalar devam etmekte olup PDGF; nv’deki anjiogenik endotel hücrelerine, endotel hücrelerinin yaşamlarını sürdürebilmelerine yardımcı olan perisitlerin tutunmasını sağlayan bir büyüme faktörüdür (37).
Anti-VEGF ajanların etki süreleri 4-6 haftadır. Bu nedenle nv’ ye ait aktivasyon bulguları tamamen kaybolana kadar gözler belirli rejimler (aralıklar) ile tedavi edilirler. Tekrar tedavi kararı vermede önemli rol oynayan nvYBMD’ ye ait aktivasyon bulguları şunlardır:
Klinik Muayenede; - Yeni Hemoraji OKT’ de;
- Subretinal sıvı
- Sub RPE sıvı (= PED) varlığı - Kistoid maküler ödem varlığı
- İntraretinal sıvı varlığında artış olması (sıvı varlığı değil!) FA’ da;
- Persistan sızıntı - Yeni sızıntı
Geniş popülasyona sahip, randomize klinik çalışmalarda en az doz, en az vizit, etkin tedavi planlaması, nükslerin engellenmesi veya erken tedavi sağlayacak protokoller araştırılmıştır. Tedavi protokolleri başlıca üç grup altında toplanabilir:
Aylık tedavi protokolü: Düzenli olarak her ay enjeksiyon yapılır. ‘Fiks protokol’ EİDGK’nı
arttırmada ve devamlılığını sağlamada yüksek potansiyele sahip olsa da yüksek maliyet ve ekonomik yük nedeni ile kullanımı sınırlıdır. Ayrıca çoğu nvYBMD hastasının yaşlı olduğu ve her ay vizit ve enjeksiyon imkanının kısıtlı olduğu göz önüne alınırsa fiks protokolün gerçek hayatta uygulanabilirliği oldukça sınırlı kalacaktır. Ek olarak, her ay enjeksiyon yapılmasının hem lokal (endoftalmi, göz içi basınç artışı vs) hem de sistemik (kardiyovasküler riskler) yan etki potansiyeli nedeniyle bu protokolün kullanımı kısıtlıdır.
Düzenli kontrol ve gerektiğinde tedavi (PRN) (Pro Re Nata, Tedavi et ve gözle): Potansiyel
EİDGK artışı sağlamak ve gereksiz enjeksiyondan kaçınmak amacı ile tercih edilen bir protokol olup, aylık vizitleri içermektedir. Tedavi planlaması OKT rehberliğinde yapılmaktadır. 3 aylık ardışık enjeksiyondan sonra OKT’de aktivasyon mevcut ise yeniden tedavi yapılır. Lezyon aktif değil ise düzenli (aylık) aralıklarla takip önerilir. Bu protokolde her ne kadar aylık enjeksiyon gerekmese de, aylık vizit gerekmesi olguların aylık vizitlerin atlanabildiği ‘gerçek hayat’ görme keskinliği sonuçlarının, aylık vizitlerin düzenli olarak yapıldığı klinik çalışmalardan daha zayıf olması ile sonuçlanıyor olabilir.
Tedavi et ve uzat protokolü (Treat and extend): Tüm hastalara lezyon inaktif oluncaya kadar
aylık tedavi uygulanır, OKT rehberliğinde kontroller yapılır. Hastalık stabilize olduğunda, her vizitte vizit aralıkları açılarak tedavi uygulanır. Vizitte aktivasyon yoksa tedavi yapılıp vizit-tedavi aralığı iki hafta uzatılır. Her vizitte lezyon kuru da olsa mutlaka vizit-tedavi yapılır ve ara en fazla üç ay olacak şekilde uzatılır. Nüks varsa tedavi yapılıp ara tekrar kısaltılır. Temel amaç ekonomik yükü arttırmadan maksimum anatomik ve görsel sonuçların sağlanmasıdır. Özellikle aflibercept enjeksiyonu sonrası intraoküler VEGF supresyonunun, yaklaşık olarak 70.5 gün devam ettiği düşünüldüğünde, daha uzun intervaller, inravitreal tedavi aflibercept tedavisi için uygun bir protokol olabilir.
İntravitreal Kullanılan Anti-VEGF Ajanlar Pegaptanib
Kullanıma ilk giren anti-VEGF ajan olan pegaptanib (Macugen; OSI Eyetech Pharmaceuticals, New York, NY), 2001 yılında FDA onayıyla nvYBMD’de kullanılmaya başlanmıştır. Pegaptanib sodyum, sadece VEGF-165’e bağlanabilme özelliği bulunan bir aptamerdir. Klinik pratikte çok kısa süreli kullanım şansı bulan bu ajan tedavide yetersiz olması nedeni ile yerini hızla daha sonra geliştirilen ranibizumab, aflibercept gibi daha güçlü anti-VEGF ajanlara bırakmıştır (121).
Ranibizumab
Ranibizumab (Lucentis; Genentech, Inc. South San Francisco, CA) rekombinant monoklonal antikor teknolojisi ile üretilen, insan anti-VEGF antikorunun kappa izotipinin fragmanıdır. NvYBMD tedavisinde kullanımı için 2006 yılında FDA, 2007 yılında ise Avrupa İlaç Ajansı (EMA) onayını almıştır. Mart 2008’de Türkiye’de onay almıştır. Tüm VEGF-A izoformlarının nonselektif ve potent inhibitörüdür. VEGF-A, ranibizumab tarafından bloke edildiğinde, endotel duvarında yer alan hedef reseptörleri VEGFR-1 ve 2’ye tutunamaz, endotel proliferasyonu ve dolayısı ile anjiogenez engellenir ve nv’nin gerilemesi sağlanır (122).
Ranibizumabın güvenlik ve etkinliğini değerlendirmek amacıyla yapılan pek çok çalışma vardır. Çok merkezli, randomize, kontrollü ve prospektif iki büyük çalışma mevcut olup bunlar; MARINA (Minimally Classic/Occult Trial of Anti-VEGF Antibody Ranibizumab in the Treatment of Neovascular Age-Related Macular Degeneration) ve ANCHOR (Anti-VEGF Antibody for the Treatment of Predominantly Classic Choroidal Neovascularization in AMD) çalışmalarıdır.
MARINA: İki yıl takip süresine sahip randomize, kontrollü bir çalışmadır, minimal klasik ve okkült nv’li hastalar üzerinde yapılmıştır. 716 hasta yaklaşık eşit sayılarda üçe bölünerek 0.3 mg, 0.5 mg ranibizumab ve sham grupları olarak 24 aylık enjeksiyon tedavisine alınmış, 12. ve 24. ayda tedavi sonuçları değerlendirilmiştir. 12. ay sonunda EİDGK’da artış veya 15 harften daha az görme kaybı mevcut olan olgu oranları, 0.3 mg, 0.5 mg ve sham gruplarında sırası ile %94,5, %94,6, %62,2 olarak saptanmış olup 15 harften daha fazla görme kazancı da yine sırası ile %24,8, %33,8 ve %5,0 olarak izlenmiştir. 24. ay sonunda da sonuçlar benzer olup, EİDGK’da artış veya 15 harften az kayıp oranı sırası ile %92, %90 ve %52.9 olarak
saptanmıştır. Minimal klasik ve okkült nv’de 24 ay takip süresi ile aylık ranibizumab enjeksiyonu ile EİDGK, kontrol grubuna göre daha iyi olmaktadır. Güvenlik açısından önemli bir sorun izlenmemektedir (123).
ANCHOR: İki yıl takip süresine sahip, kontrollü bir çalışma olup hastalar dominant klasik nv’ye sahip olgulardır. Çalışmaya dahil edilen 423 hasta yaklaşık olarak eşit paylaştırılmış, ilk gruba FA baz alınarak 3 ay aralıklı FDT uygulanmış, diğer iki gruba 0.3 mg ve 0.5 mg aylık ranibizumab enjeksiyonu yapılmıştır. EİDGK’da artış veya 15 harften az kayıplar, sırası ile %65.7, %89.9 ve %90.0 olarak belirlenmiş, 15 harften fazla kazanç sağlayanlar ise, yine sırası ile %6.3, %34 ve %41 olmuştur. Sonuç olarak intravitreal aylık ranibizumab ile dominant klasik nv’li YBMD olgularında FDT’ye göre anlamlı bir görme kazancı ya da stabilizasyonu sağlamıştır (124,125).
PIER (Phase IIIb, multicenter, randomized, double-masked, sham injection controlled study of efficacy and safety of Ranibizumab in Subjects with subfoveal CNV with or without classic CNV secondary to AMD): Subfoveal nv’li YBMD olgularında, ilk üç ay, aylık yükleme dozu uygulandıktan sonra, her üç ayda bir intravitreal ranibizumab uygulaması ile elde edilen sonuçlar araştırılmıştır. 184 olgu yaklaşık üç eşit grup halinde sham, 0.3 mg ve 0.5 mg ranibizumab grubu olarak ayrılmıştır. 12. ay sonunda, görme kaybı gruplarda sırası ile 16.3, 1.6 ve 0.2 harf olarak saptanmış olup, ikinci yılda da 21.4, 2.2 ve 2.3 harf olarak izlenmiştir. İntravitreal ranibizumab grupları ile sham grubu arasında anlamlı fark saptanmıştır. İlk üç aylık yükleme dozu sonrasında, dozların azaltılması ile harf kazancının tüm gruplarda belirgin bir şekilde düştüğü gözlenmiş ve aylık uygulamanın, 3 aylık uygulamadan belirgin olarak daha üstün olduğu bildirilmiştir (126).
PRONTO (Prospective Optical Coherence Tomography Imaging of Patients with Neovascular AMD Treated with intra-ocular Ranibizumab): Üç aylık aralarla yapılan intravitreal ranibizumab tedavisinin, aylık enjeksiyona göre daha başarısız olması üzerine farklı tedavi rejimleri ile elde edilecek sonuçlar araştırılmıştır. 2 yıl takip süresine sahip prospektif, tek merkezli, nonrandomize bir çalışmadır. Subfoveal nv bulunan ve OKT kalınlığı en az 300 mikron olan 40 hasta çalışmaya dahil edilmiş ve ilk üç ayda 0.5 mg yükleme dozu aylık olarak yapılmıştır. Sonrasında tekrar tedavi kriterlerine uyan olgularda enjeksiyon tekrarı yapılmıştır. Tekrar tedavi kriterleri, OKT’de sıvı varlığı ile eşlik eden 5 harf kaybı, OKT’de 100 mikrondan fazla santral retinal kalınlık artışı, yeni kanama gelişimi, bir önceki enjeksiyonun üzerinden bir ay geçmiş olmasına rağmen OKT ile tespit edilen maküladaki sıvı miktarında değişim olmaması olarak belirlenmiştir. 12 ayın sonunda bu kriterlere uyularak yapılan enjeksiyonlar sonunda
ortalama enjeksiyon sayısı 5.6 olarak saptanmış ve EİDGK’da artış 9.3 harf olarak bildirilmiştir (127). Sonuç olarak, MARINA çalışmasında 24 ay sonunda başlangıç görmeye göre artış 0.5 mg aylık enjeksiyon grubunda 6.6 harf olarak izlenirken PRONTO çalışmasında 24. ay sonucunda ortalama 9.9 intravtreal enjeksiyon ile 11.1 harf kazancı bildirilmesi, gerektiğinde tedavi rejiminin gündeme gelmesine neden olmuştur.
SUSTAIN: Esnek gerektiğinde tedavi rejimini ile uygulamaların sonuçlarını değerlendirmek amacıyla düzenlenmiştir. Avrupa ve Avustralya’da çok merkezli olarak düzenlenen faz-III, tek gruplu bir çalışmadır. 513 adet naive nvYBMD olgusu çalışmaya dahil edilmiş olup, ilk 2 ayda üç enjeksiyonla yükleme yapılmış ve daha sonra gerektiğinde tedavi protokolüne geçilmiştir. Kontrolde en az 5 harf kaybı veya 100 mikron ve daha fazla santral foveal kalınlık artışı izlendiğinde enjeksiyon tekrarı kararı alınmıştır. 12 ay sonunda ortalama 5.6 enjeksiyon sayısı ile EİDGK’da başlangıca göre 3.6 harf kazancı sağlanmıştır. Submakuler nv’li olgularda, aylık ranibizumab uygulaması ile kıyaslandığında, SUSTAIN çalışmasında uygulandığı gibi 3 yükleme sonrasında esnek gerektiğinde tedavi uygulaması ile enjeksiyon sayısı 12’den 5.6’ya düşürülebilmiş ancak görme artışı da 3.6 harf ile sınırlı kalmıştır (128).
Sonuç olarak ranibizumab, aylık olarak 0.3-0.5 mg yapılması halinde nvYBMD’de, özellikle erken evrede tedaviye alınmış olgularda %90’lara varan sıklıkla başlangıçtaki görme seviyesinin stabilizasyonunu sağlayabilen ve olguların yaklaşık üçte birinde ortalama 15 harfe kadar görme artışı sağlayabilen bir ajandır (129). Önerilen intravitreal kullanım dozu aylık enjeksiyon şeklinde olsa da tedavinin yüksek maliyeti ve takip sıklığının yarattığı zorluklar klinisyenleri farklı tedavi stratejilerine yönlendirmiştir (130). Mitchell ve ark. (131) ANCHOR, MARINA, PIER, SUSTAIN çalışmalarının verilerini değerlenmişler ve en iyi sonucun tedavinin başlangıç olarak ardışık üç kez aylık enjeksiyon yapılmasının ardından aktivasyon bulguları devam ettiği sürece aylık enjeksiyonların uygulanması olduğunu bildirmişlerdir (131,132).
İntravitreal ranibizumab tedavisinin yan etkileri ile ilgili çalışmalarda ranibizumab enjeksiyonu sonrası ölümcül olmayan tromboembolik olay riskinin kontrol grubuna göre artmış olduğu izlenmiştir (133).
Aflibercept
VEGF-A anjiogenezden sorumlu temel VEGF olup, izoformları arasında özellikle VEGF-165 anjiogenezde kritik rol oyanamaktadır. VEGF’in bağlandığı üç tip reseptör bulunmaktadır. VEGFR-1, 2 ve 3. Bu reseptörler arasında VEGFR-1, VEGF’e en yüksek afiniteyi gösterirken, VEGFR-2 anjiogenezde anahtar rol oynamaktadır. İnsan VEGFR-1’in 2. Ig parçası ile, VEGFR-2’nin 3. Ig parçasının, insan IgG1’in Fc parçası ile füzyonu sonucu aflibercept molekülü elde edilmiştir. İki reseptör parçasının rekombinant teknoloji ile füzyonu sonucu, 115 K Daltonluk çözünebilir bir füzyon proteini elde edilmiş olup, VEGF-A’nın tüm izoformlarına kendi reseptöründen daha yüksek afinite ile bağlanması sağlanmıştır (134,135). Bevazicumab ve ranibizumabdan farklı olarak damar permeabilitesinde önemli bir rol oynamakta olan ve nv patogenezinde rol aldığı bilinen PlGF 1 ve 2’yi de bağlamaktadır. Ayrıca aflibercept tüm VEGF ailesine de bağlanabilmektedir. (VEGF-A,B,C ve D) Aflibercept VEGF dimerlerini 1:1 oranında iki koldan bağlar ve etkisini multimerik kompleksler oluşturmadan gösterir. Böylelikle VEGF dimeri açıkta kalmaz ve başka aflibercept veya VEGF molekülleriyle etkileşim gerçekleşemez (136). Bevacizumabın da iki bağlayıcı kolu bulunmakta ve VEGF’i 1:2 oranında bağlayarak uzun multimerik kompleksler oluşturmaktadır. Ranibizumabın ise tek bağlayıcı kolu mevcut olup, VEGF’i 1:1 oranında bağlayabilir. Aflibercept insan aminoasit sekanslarından oluştuğu için düşük bir antijenik potansiyel içermektedir (137).
Aflibercept (VEGF Trap-Eye; Eylea; Bayer/Regeneron Pharmaceuticals, Inc, Tarrytown, NY) intravitreal olarak 2 mg dozunda uygulandığında, çok yavaş bir şekilde sistemik sirkülasyona geçmekte olup serbest maksimum plazma konstantrasyonu, ortalama 0.02 mikrogram/ml (0-0.054 mikrogram/ml) olarak saptanmaktadır. Bu değer yaklaşık 1-3 gün arasında sürmekte ve 2 haftada plazmadaki aflibercept konsantrasyonu tespit edilemez değerlere düşmektedir. Önemli olan bir diğer nokta da hayvan çalışmalarında gösterildiği üzere, maksimum plazma konsantrasyonu, sistemik VEGF’in %50’sinin inhibe edilmesi için gereken miktarın 50 ila 500 kat daha azıdır. Yine bir çalışmada, 2 mg intravitreal aflibercept enjeksiyonundan sonra ortalama maksimum plazma konsantrasyonu, sistemik VEGF’in %50’sini inhibe etmek için gereken miktarın 100 kat azı olarak saptanmıştır. Bu bilgiler ışığında intravitreal aflibercept ile sistemik yan etkilerin görülme ihtimalinin oldukça az olduğu yorumu yapılabilir (138). Hayvan çalışmaları üzerinden elde edilen veriler matematiksel olarak analiz edildiğinde, enjeksiyondan sonra VEGF bağlama etkinliği afliberceptte yaklaşık 79 gün iken ranibizumabda 30 gün olarak saptanmıştır. Bu durum afliberceptin daha uzun etki süresi anlamına gelmekte olup daha uzun intervaller ile enjeksiyon olanağı sağlamaktadır (139).
The Clinical Evaluation of Anti-Angiogenesis in the Retina Intravitreal Trial çalışması, 0.05, 0.15, 0.5, 1, 2, and 4 mg aflibercept dozlarının nvYBMD olgularında kullanımı ile elde edilen sonuçları değerlendiren bir Faz 1 çalışması olup, altı haftalık süreç sonunda EİDGK’da 4.4 harf kazanç izlenmiştir (140). The Clinical Evaluation of Anti-Angiogenesis in the Retina Intravitreal Trial 2 çalışması ise, nvYBMD hastalarında tekrarlayan dozlarda afliberceptin güvenilirlik ve etkinliğini araştıran bir Faz 2 çalışması olup hastalar her 4 haftada bir 0.5 ve 2 mg alan hasta grupları ile 12 haftada bir 0.5, 2 ve 4 mg alan hasta grupları olmak üzere 5 grup olarak randomize edilmişlerdir. Çalışmanın 8. haftasında tek doz 2 mg alan gruptaki görme artışı ile 2 kez aylık 2 mg doz alanlardaki görme artışı birbirine çok yakın izlenmiş (136) ve bu bulguya dayanarak Faz 3 çalışmaları olan VIEW-1 ve VIEW-2 planlanmıştır. VIEW-1 ve VIEW-2 çalışmaları, çok uluslu, randomize, kontrollü klinik çalışmalar olup, nvYBMD tedavisinde ranibizumab ve afliberceptin etkinlik ve güvenilirliğinin karşılaştırılması amaçlanmıştır. VIEW-1 çalışması Kanada ve ABD’de 1217 hasta üzerinde yapılmış olup, VIEW-2 çalışması ise Avrupa, Asya, Japonya ve Latin Amerika’da 1240 hasta ile gerçekleştirilmiştir. Her iki çalışma da randomize hastalarda 3 tedavi rejimini incelemiştir: 0.5 mg afliberceptin aylık uygulanması, 2 mg afliberceptin aylık uygulanması, 3 doz aylık uygulamadan sonra 2 ayda bir 2 mg aflibercept uygulaması. Tüm gruplar, etkinlik ve güvenlik açısından 4. bir kol olarak 0.5 mg ranibizumab aylık enjeksiyon grubu ile karşılaştırılmıştır. İlk karşılaştırma, EİDGK’da stabilizasyon üzerine iken (15 harften daha az kayıp), ikinci karşılaştırma EİDGK’da artış üzerinedir. Hem VIEW-1 hem de VIEW-2 çalışmaları ikinci yılda da devam etmiş olup, her iki çalışmada da modifiye PRN stratejisi benimsenmiştir. Olgular aylık olarak değerlendirilmiş ve ilk yıl dozları ile aynı olacak şekilde ‘gerektiğinde tedavi’ uygulanmıştır. Fakat tüm olgularda en fazla 3 aylık enjeksiyonsuz dönem bulunmaktadır.
1. yıl sonunda EİDGK’da stabilizasyon saptanan olguların oranı (15 harften daha az kayıp) 2 mg aflibercept alan gruplarda (aylık ya da 3 yükleme dozundan sonra 2 ayda bir) yaklaşık %95 iken, aynı sonuç 0.5 mg ranibizumab aylık enjeksiyon grubunda da elde edilmiştir ( VIEW 1 çalışmasında 4 haftada bir 2 mg grubu %95.1, 4 haftada bir 0.5 mg grubu %95.9 ve 8 haftada bir 2 mg grubu %95.1; VIEW 2 çalışmasında sırasıyla %95.6, %96.3 ve %95.6 iken aylık ranibizumab iki çalışmada da %94.4 etkinliktedir) (141). EİDGK’da artış açısından yapılan değerlendirmelerde ise, aylık uygulamalarda aflibercept enjeksiyonu ile VIEW-1 ve VIEW-2’de sırası ile 10.9 harf ve 7.6 harf kazancı mevcutken, aylık ranibizumab uygulaması ile VIEW-1’de 8.1 harf, VIEW-2’de ise 9.4 harf kazancı elde edilmiştir. VIEW-1’de 2 mg afliberceptin aylık uygulaması ile ranibizumaba göre istatistiksel anlamlı olarak daha yüksek