T.C.
DOKUZ EYLÜL ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
MEME KANSERLİ OLGULARDA BEYİN METASTAZI
GELİŞİMİNİ ÖNGÖREN FAKTÖRLER
TIPTA UZMANLIK TEZİ
Dr. Adem DAYAN
TEZ DANIŞMANI
Prof. Dr. Uğur YILMAZ
1. TEŞEKKÜR
Tezimin hazırlanmasının her aşamasında bana yardımcı olan Hocam Prof. Dr. Uğur YILMAZ’a ve başta Uzm.Dr. Doğan KOCA olmak üzere tüm Onkoloji Bilim Dalı çalışanlarına,
Sayın Prof.Dr.İlkay ŞİMŞEK nezdinde İç Hastalıkları uzmanlık öğrenciliğim sırasında beni yetiştiren tüm hocalarıma ve iyi ve kötü günlerimde her zaman yanımda olan çalısma arkadaslarıma,
Tezimin istatiksel değerlendirmeleri konusundaki yardımlarını esirgemeyen Doç Dr. Hülya ELLİDOKUZ’a,
En temel veri kaynaklarımdan biri olan Radyasyon Onkolojisi Bilim Dalı arşivinden yararlanmama izin veren Sayın Prof Dr. Rıza ÇETİNGÖZ ve bu hastaların tedavisinde en önemli rolü oynayan Radyasyon Onkolojisi Anabilim Dalı çalışanlarına,
İç Hastalıkları uzmanlık öğrenciliği süreci boyunca beni hep destekleyen ve her zaman yanımda olan sevgili eşim ve beni bugünlere getiren aileme destekleri için teşekkür ederim.
2. İÇİNDEKİLER 1. TEŞEKKÜR 2. İÇİNDEKİLER I 3. KISALTMALAR II 4.
TABLO ve ŞEKİL LİSTESİ
III 5. ÖZET 1 6. SUMMARY 2 7. GİRİŞ ve AMAÇ 3 8. GENEL BİLGİLER 4 8.1.Meme Kanseri 4
8.2 Meme Kanserinde Prognostik Faktörler 8 8.3 Meme Kanserli Hastalarda Beyin Metastazı 13 9. MATERYAL VE METOD 18 10. BULGULAR 19 11. TARTIŞMA 29 12. SONUÇ 33 13. KAYNAKLAR 34 14. ÖZGEÇMİŞ 39
3. KISALTMALAR
ASCO : American Society of Clinical Oncology BOS : Beyin omurilik sıvısı
BRCA : Meme kanseri (Breast cancer)
CMF : Siklofosfamid-Metotreksat-Flurourasil DCIS : Duktal karsinoma in situ
DFS : Disease Free Survival (Hastalıksız sağkalım) EC : Epirubicin-Siklofosfamid
EGFR : Epidermal Büyüme Faktör Reseptörü ER : Östrojen reseptörü
FEC : Flurourasil-Epirubusin-Siklofosfamid FISH : Fluorescence in situ hibridizasyon
HER-2 : Human Epidermal Büyüme Faktör Reseptörü-2 HRT : Hormon replasman tedavisi
HT : Hormonoterapi
İDK : İnvaziv duktal karsinom İHK : İmmunohistokimya İLK : İnvaziv lobuler karsinom KT : Kemoterapi
LN : Lenf nodu
MKC : Meme koruyucu cerrahi MRM : Modifiye radikal mastektomi PAI : Plazminojen aktivatör inhibitör PR : Progesteron reseptörü
RTOG : Radyoterapi Onkoloji Grubu OS : Overall Survival (Genel sağkalım) SSS : Santral sinir sistemi
uPA : Ürokinaz plazminojen aktivatör VKİ : Vücut kitle indeksi
4. TABLO LİSTESİ
TABLO NO SAYFA NO
Tablo 1. Hasta ve kontrol gruplarının genel özellikleri ... 19
Tablo 2. Hasta ve kontrol gruplarının sağkalım verileri ... 21
Tablo 3. Tümöre ait histopatolojik özellikler... 22
Tablo 4. Hastaların evrelerine ait özellikleri... 23
Tablo 5. Hasta ve kontrol gruplarında uygulanan tanı ve tedavi yöntemleri ... 24
Tablo 6. Hormon reseptör durumu ... 25
Tablo 7. Metastaz özellikleri ve tutulan organlar... 26
Tablo 8. Metastatik meme kanserinde kullanılan kemoterapötikler... 27
Tablo 9.Tek değişkenli ve çok değişkenli analizler... 28
ŞEKİL LİSTESİ Şekil No Sayfa No Şekil 1. Hasta ve kontrol gruplarının genel sağkalım verileri... 20
5. ÖZET
Meme kanseri hastalığı olan ve meme kanserine bağlı tanı anında veya takipleri sırasında beyin metastazı tespit edilen toplam 63 kadın hastanın verileri geriye dönük olarak incelendi. Kontrol grubu olarak bu hastalardan sonra polikliniğe başvurmuş aynı sayıda, tanı anında veya izlemde metastaz gelişmiş olan ancak beyin metastazı olmayan meme kanserli kadın hastalar alındı.
Beyin metastazı olan hasta grubunda hastaların ortanca yaşları 49 yıl, kontrol grubunda 50 yıldı. Hasta grubunda vakaların ortanca vücut kitle indeks (VKI)’leri 27 kg/m², kontrol grubunda 27 kg/m² idi. Hasta grubunda vakaların 28 (%44,4)’i postmenapozal dönemde iken kontrol grubunda 36 (%57,1)’sı postmenapozal dönemdeydi.
Hasta grubunda ortalama takip süresi 51 ay, kontrol grubunda 58,52 aydı. Hasta grubunda ilk metastazdan sonra ortanca sağkalım 22,6 ay, kontrol grubunda 39,0 aydı. Hasta grubunda 5 yıllık yaşam oranı %12 iken kontrol grubunda %31 idi. Hasta grubunda vakaların %80,9’u (n=51) ölmüştü, kontrol grubunda hastaların %34,9 (n=22)’u ölmüştü. Hasta grubunda ilk metastazdan beyin metastazına kadar geçen ortanca süre 8,5 ay, beyin metastazı tespit edildikten sonra ortanca yaşam süresi 6,9 aydı.
Vakaların tek değişkenli analizleri incelendiğinde hasta grubunda vakalarda daha çok vasküler invazyon görülmesi, daha fazla Human Epidermal Büyüme Faktör Reseptörü-2 (HER-2) pozitifliği kontrol grubunda ise tümörde histolojik olarak invaziv lobüler karsinom (İLK) komponenetinin daha fazla görülmesi, ER (östrojen reseptörü) pozitifliğinin daha fazla görülmesi, kemik ve karaciğer metastazının daha fazla görülmesi, ilk metastazdan sonra kemoterapi (KT) verilme oranının istatiksel olarak anlamlı olduğu görüldü.
Grupların çok değişkenli analizinde ise hasta grubunda HER-2 pozitifliğinin daha fazla olması, kontrol grubunda ise hastaların kemik metastazının bulunması ve saptanan metastaz sonrası daha fazla KT almalarının istatiksel olarak anlamlı olduğu saptandı.
6. SUMMARY
Data of 63 female patients with breast cancer and brain metastasis were retrospectively analyzed. As control group, same numbers of female patients who have applied to the outpatient clinic with application numbers following the previous ones and who were also diagnosed with metastatic breast cancer without brain metastasis were taken into consideration.
Median age for the patient group with brain metastasis was 49 years and for the control group patients, it was 50 years. While average Body Mass Index (BMI) for the patient group was 27 kg/m²; it was 27 kg/m² for the control group. 28 of the cases (44,4%) in the patient group were at post menopausal stage while 36 of the control group (57,1%) were in the post menopausal stage.
Mean follow-up period for the patient group was 51 months while it was 58,52 months for the control group. The median survival from the first metatasis diagnosis was 22,6 months for the patient group, while it was 39,0 months for the control group. 5 years survival rate for the patient group was %12, while it was % 31 for the control group. %80,9 (n=51) of the cases in patient group have died. % 34,92 (n= 22) of the patients in control group have died. Median period from first diagnose until the development of brain metastasis was 8,5 months in the patient group. Average survival period after detection of brain metastasis was 6,9 months for the patient group.
Univariate analysis showed that the following were found significant: Majority of the cases in patient group were higher vascular involvement in patient group, ER being more negative at the patient group, HER-2 level being more positive in patient group in comparison to control group, while ER being more positive , bone and liver metastasis were seen more much in control group, the component of invasive lobular carcinoma in histology was higher in the control group and rate of given chemotherapy after metastasis was higher in the control group in comparison to patient group.
In multivariate analyses detection of HER-2 level being more positive in patient group versus control group and having more much bone metastasis and chemotherapy requirement after the metastasis were found significant.
7. GİRİŞ VE AMAÇ
Meme kanseri, tüm kanserler arasında akciğer kanserinden sonra ikinci sıklıkta görülen ve kadınlarda en sık görülen kanserdir. A.B.D.’de 2009 verilerine bakıldığında meme kanserinin yıllık insidansının 190 bin olduğu görülmektedir. Yine A.B.D. verilerine göre yıllık kanser insidansı 1,5 milyon civarında iken yıllık ölüm rakamlarının 500 bin civarında olduğu açıklanmıştır. Meme kanserine bağlı ölümler ise, tüm kanserler içinde üçüncü sırada yer almaktadır ve sayı olarak geçen yıl 40 bin civarında olduğu açıklanmıştır (2).
Meme kanseri akciğer kanserinden sonra beyne en sık metastaz yapan ikinci kanserdir. Meme kanserli hastalarda beyin metastazı insidansı ortalama %10-16 arasındadır. Ancak yapılan otopsi çalışmalarında %30’lara varan oranlarda metastaz saptanabilmektedir. Meme kanseri tanısından semptomatik beyin metastazı gelişimine kadar geçen süre yaklaşık olarak 2-3 yıldır. Vakaların çoğunda beyin metastazı sıklıkla akciğer, karaciğer ve/veya kemik metastazını takiben ortaya çıkmaktadır. Nadiren beyin metastazının varlığı primer meme kanserinin tanısından önce saptanabilir. Meme kanserli hastalarda santral sinir sisteminin tutulumu, beyin parankiminin veya leptomeninkslerin tutulumu şeklinde olur. Meme kanseri leptomeningeal tutuluma en sık yol açan solid tümördür (40).
Kadınlarda en sık görülen kanser olan meme kanserinde beyin metastazı gelişiminin oldukça hızlı şekilde hastanın genel durumunu bozması ve ciddi morbidite ve mortaliteye yol açması nedeniyle erken tanısı oldukça önemlidir. Günümüzde meme kanserinde beyin metastazının gelişimi ile ilgili veriler oldukça yetersiz olup henüz kabul görmüş bir risk sınıflaması ve küçük hücreli akciğer kanserindekine benzer proflaktik tedavii yaklaşımları bulunmamaktadır. Küçük hücreli akciğer kanserinde tedaviler sonrası uygulanan tüm beyin ışınlaması benzeri koruyucu önlemlerle beyin metastazlarının ve nükslerinin belli ölçüde de olsa önlenebilmesi mümkündür. Bizim çalışmamızda da öncelikle beyin metastazı gelişmiş olan meme kanserli hastalarda ayırt edici özellikleri inceleyip bunların varlığının ne kadar risk artışına yol açtığını saptamayı, bu konuda hastanemizdeki verileri ortaya koymak ve beyin metastazları ile ilgili prediktif faktörleri tanımlamaya yönelik prospektif çalışmalar için yol gösterici sonuçlar elde etmeyi amaçladık. Bu çalışmayla aynı zamanda beyin metastazı gelişmeden önce verilen tedavilerin beyin metastazı gelişime etkileri ve beyin metastazı geliştikten sonra verilen tedavilerin hastaların
8.GENEL BİLGİLER
8.1 Meme Kanseri
Meme kanseri, tüm kanserler arasında akciğer kanserinden sonra ikinci sıklıkta görülen kanser iken kadınlarda en sık görülen kanseri oluşturmaktadır. A.B.D.’de 2009 verilerine bakıldığında meme kanserinin yıllık insidansının 190 bin olduğu görülmektedir. Yine A.B.D. verilerine göre yıllık kanser insidansı 1,5 milyon civarında iken yıllık ölüm rakamlarının 500 bin civarında olduğu açıklanmıştır. Meme kanserine bağlı ölümler, tüm kanser ölümleri arasında üçüncü sırada yer almaktadır. Yaşam boyu kadınlarda meme kanseri görülme riski ortalama olarak %12 ve bu nedenle ölüm riski ortalama %5’tir (1). Ülkemizde Sağlık Bakanlığı Kanser Dairesi’nin açıkladığı verilere göre meme kanserinin 2005 yılı insidansı 35/100 bin olarak açıklanmış ve meme kanserinin kadınlarda en sık görülen kanser olduğu belirtilmiştir (2). Türkiye ile ilgili bu tahmin rakamları kanımızca gerçek rakamların oldukça altındadır.
Memeler, her iki kenarda sternum ve midaksiller çizgi ile üstten ikinci kot ile alttan altıncı kotlar arasında bulunan, deri, subkutan doku, epitelyal ve stromal doku içeren meme dokusundan oluşmaktadır. Memenin %10-15’ni epitelyal doku oluştururken geriye kalanını stroma oluşturur. Her bir meme 15-20 lobdan oluşan, fibröz bağ dokunun desteklediği glandüler yapılar içermektedir. Meme dokusunun kanlanmasını internal mammarial, internal ve lateral torasik arterler sağlarken, venöz dönüşünü internal torasik, aksiller ve interkostal venler sağlar. Lenfatik drenajı ise süperfisiyel ve derin lenfatik pleksus yoluyla %95 oranında aksiller lenf nodlarına olmaktadır. Meme dokusunun innervasyonunu ise 4. 5. ve 6. interkostal sinirler sağlamaktadır (3).
Meme kanserinde en iyi tanımlanmış olan risk faktörlerinin başında yaş gelmektedir. Meme kanseri insidansı 30 yaşına kadar oldukça düşükken ( < 25/100.000), sonrasında 80 yaşına kadar lineer bir artış gösterir ve 80 yaşında 500/100.000’lere kadar çıkar. 65 yaşın üstündeki kadınlarda, 65 yaşın altındaki kadınlarla kıyaslandığında meme kanseri için görece risk 5,8 kat daha fazladır (4). Türkiye’de de yine benzer sonuçlar bildirilmiş ve meme kanserli vakaların sadece %5’nin 35 yaş altında görüldüğü belirtilmiştir (5).
Meme kanseri, vakaların sadece %1-2’lik kısmında kalıtımsaldır ve bu kişilerde yaşam boyu meme kanseri gelişme riski %85 civarındadır. Aile öyküsünde
iki veya daha fazla birinci derece (anne-baba, kardeş veya çocuk) veya ikinci derece (büyükanne, büyükbaba, teyze, yeğen) akrabada meme veya over kanseri varsa, yakın akrabada premenapozal meme kanseri öyküsü varsa, ailede meme ve over kanseri birlikte tespit edilmişse, ailede erkekte meme kanseri öyküsü varsa, ailede meme kanserine yatkınlık yaratan genler (BRCA-1 ve BRCA-2 ) pozitif ise altta yatan bir genetik sorunun varlığı düşünülmelidir (6,7).
Kalıtımsal meme kanseri vakalarının yaklaşık %40’ında BRCA-1 veya BRCA-2 genleri pozitif olarak saptanır. BRCA-1 mutasyonunda meme kanseri için 70 yaşına kadar kümülatif risk %55-85 arasındadır. Bu hastalarda over kanseri için risk %16-60 arasındadır. BRCA-1 gen mutasyonu erkeklerde de meme kanseri gelişim riskini arttırmaktadır. BRCA-2 gen mutasyonu yine artmış meme ve over kanseri riski taşımaktadır (6,8).
Meme kanserindeki risk faktörlerini erken menarş, geç menapoz, nulliparite, HRT kullanımı, alkol kullanımı, postmenapozal obezite, birinci derece akrabada meme kanseri hikayesi, ilk doğum yaşının 35’in üzerinde olması, atipisiz benign proliferatif hastalık hikayesi, mamografik meme yoğunluğunun fazla olması, 40 yaşından önce radyasyon maruziyeti, BRCA-1 ve veya BRCA-2 mutasyonu, in situ lobular karsinom ve atipik hiperplazi olarak sıralayabiliriz (8).
Meme kanserinin hormona bağımlı bir kanser olduğu bilinmektedir. Endojen östrojen ile artmış maruziyetin meme kanseri gelişiminde önemli bir risk faktörü olduğu epidemiyolojik araştırmalarla gösterilmiştir. Yumurtalıkları fonksiyon görmeyen ve hiç östrojen replasman tedavisi almamış kişilerde meme kanseri gelişmez. Bu nedenle uzun süre kesintisiz olarak düzenli menstruel siklusları olan kadınlarda risk artmıştır. Bu bağlamda yapılan bir çok çalışmada erken menarş yaşı, geç menapoz yaşı ile birlikte düzenli adet gören kadınlarda artmış risk saptanmıştır. Menarş yaşı 12’nin altındaki kadınlarda 15’in üzerinde olanlara göre görece risk 1,3 kat artmıştır. Benzer şekilde 45 yaşından önce menapoza girenlerde 55 yaşından sonra menapoza girenlere göre risk yarı yarıya azalmıştır. İlk gebelik yaşı 30’un üzerinde olan veya nulliparitesi olan kadınlarda, ilk gebelik yaşı 20 yaşın altında olan göre görece risk 1,7-1,9 kat arasında saptanmıştır. (5,8).
Oral kontraseptif kullanımı ile meme kanseri arasındaki ilişki de araştırılmış
ve sonuç alarak ilk nesil oral kontraseptif kullanımı ile meme kanseri riskinde minimal artış olduğu, ancak günümüzde kullanılan oral kontraseptiflerin daha güvenilir olduğu
Menapozdan sonra hormon replasman tedavisi ile meme kanseri riskinde artış olduğu birçok çalışmada gösterilmiştir. Risk sıklıkla 5 yıldan fazla hormon replasman tedavisi alanlarda belirgindir ve kullanım süresi arttıkça risk artmaktadır. Tedavi bırakıldıktan sonra ise risk azalmaya başlamaktadır. Kombine hormon replasman tedavisi kullananlarda risk tek başına östrojen replasman tedavisi alanlara göre daha fazladır. En az 5 yıl boyunca östrojen ve progesteron içeren hormon replasman tedavisi alan kadınlarda almayanlara göre meme kanseri için görece risk 1,3 kat artmıştır (5,8).
Mamografik meme yoğunluğundaki artışa paralel olarak meme kanseri görülme riskinin de arttığı görülmüştür. Bu risk artışının yaş, menapoz durumu ve etnik yapıdan bağımsız olduğu görülmüştür. Postmenapozal kadınlarda mamografik meme yoğunluğu oranı tamoksifen ve raloksifen tedavisiyle azalmakta, premenapozal kadınlarda ise GnRH analogları ile azalmaktadır. Buna paralel olarak da meme kanseri insidansının azaldığı görülmüştür (10).
Memenin proliferasyonsuz benign lezyonlarıyla (apokrin metaplazi, kist, periduktal mastit, fibrosis, fibroadenom, skuamöz metaplazi) meme kanseri arasında hiçbir ilişki bulunmamaktadır. Bununla birlikte memenin atipik proliferasyonlu olmayan lezyonlarında (sklerozan adenozis, apokrin adenozis, papilloma, atipisiz hiperplazi) 1,5-2 kat, atipik proliferasyonlu lezyonlarında ise 4-5 kat artmış meme kanseri riski tanımlanmıştır (11).
Meme dokusuna özellikle 15-30 yaşları arasında iyonize radyasyon maruziyeti tehlikeli olup, 40 yaşından sonraki maruziyette risk arttırmadığından bu yaştan sonra tarama amaçlı çekilen mamografiler meme kanseri riskini arttırmamaktadır. Özellikle Hodgkin lenfomalı mantle bölge ışınlaması yapılmış olan kadınlarda RT’den 15-30 yıl sonra meme kanseri riski önemli derecede artmaktadır. Hastalar tedaviden 10 yıl sonra ya da 35 yaşından itibaren mamografilerle takip edilmelidir (12).
Meme kanseri riski oluşturan başka bir faktör olarak alkol tüketimi gösterilmiştir. Burada tüketilen alkol miktarı arttıkça riskin daha da arttığı saptanılmıştır. Alkolün DNA tamirinde bozukluğa veya koruyucu besinlerin alımında azalmaya neden olarak meme kanseri riskini arttırmaktadır. Günde 1 duble veya daha az (yaklaşık 12 gr ) alkol tüketimi meme kanseri gelişiminde anlamlı bir risk artışına yol açmazken, günde 2 duble ve üzeri alkol alanlarada almayanlara göre meme kanseri için görece risk 1,2 kat artmıştır (5). Postmenapozal obezite, fiziksel
aktivitede yetersizlik, karbonhidrattan zengin beslenme, sigara kullanımı, vitamin B12 ve folat eksikliğinin de meme kanseri gelişiminde etkili diğer risk faktörleridirler.(8).
2009 yılındaki American Cancer Society önerilerine göre kadınlarda meme kanseri taramasının 20-39 yaş arası 3 yılda bir, 40 yaşından itibaren her yıl düzenli olarak meme muayenesi yaptırması şeklindedir. Meme muayenesinin yanında diğer sağlık taramalarının ve aile hikayesinin alınması da önerilmiştir. Bununla birlikte aylık kendi kendine meme muayenesi öğretilmesi ve bu muayenenin kontrol edilmesi önerilmektedir. Mammografi ile tarama 40 yaşından itibaren yıllık önerilmektedir. Burada erken tanının meme kanserinden ölüm riskini azalttığı, erken evrede teşhis ile daha az agresif cerrahi tedavi, daha az agresif adjuvan tedavi ve daha geniş tedavi seçenekleri sağladığı görülmüştür. BRCA mutasyonu olan, öncesinde RT almış olan veya yüksek riskli kadınlarda ise meme kanseri taramasında 30 yaşından itibaren mamografi veya meme MR yapılması önerilmektedir (13).
Mamografi her iki memenin iki yönlü (mediolateral oblik ve kraniokaudal) X ışını incelemesidir. Mamografi kadınlarda meme kanserinin taramasında ve tanısında kullanılan oldukça duyarlı ve maliyet-etkin bir yöntemdir. Erkeklerde meme kanseri insidansı çok düşük olduğundan mamografi tarama amaçlı değil tanı amaçlı kullanılmaktadır. Meme kanserinin tanısında mamografinin duyarlılığı %70 ve özgüllüğü %92 civarındadır (14).
Meme kanserinin mamografide elde edilen en değerli bulgusu spiküle konturlu, yüksek yoğunluklu kitlelerdir. Malign lezyonları benign lezyonlardan ayırmada kesin mamografik kriterler yoktur. Mammografi meme kanserini ekarte etmek amacıyla kullanılmaz. Mamografide %10-30 yanlış negatiflik söz konusu olduğundan tüm palpabl lezyonlara biopsi yapılmalıdır (10).
Meme kanserinin patolojik sınıflandırmasında en sık kullanılan sınıflandırma sistemi Dünya Sağlık Örgütü sınıflamasıdır. Buna göre meme kanseri in situ ve invaziv meme kanseri olarak ikiye ayrılmaktadır. İn situ karsinomlar, in situ duktal ve in situ lobuler olmak üzere ikiye ayrılırlar. İnvaziv karsinomları sırasıyla invaziv duktal karsinom ( %70-80), invaziv lobuler karsinom (%5-10), tubuler karsinom (%2), medüller karsinom (%1-5), musinöz =kolloid karsinom (%1-2), invaziv papiller karsinom (%1), invaziv kribriform karsinom, invaziv mikropapiller, apokrin karsinom, adenoid kistik karsinom, metaplastik karsinom, nöroendokrin karsinom ve inflamatuar karsinomdan oluşmaktadır (8).
Meme kanserinin tedavisinde cerrahi, radyoterapi, kemoterapi, immünoterapi ve hormonoterapiden oluşan sistemik tedaviler uygulanmaktadır. Meme kanseri tedavisindeki küratif tedavi cerrahi tedavi olup, basit mastektomi ve meme koruyucu cerrahi en sık kullanılan cerrahi tedavi yöntemleridir. Erken evre meme kanserinde MKC ile birlikte RT verilmesi sonrası toplam sağ kalımın mastektomiyle eşdeğer olduğu bilinmektedir. DCİS’da ve erken evre invaziv meme kanserinde MKC sonrası ve lokal ileri evre meme kanserinde ise mastektomi sonrası RT verilmesi standart hale gelmiştir. Mastektomi uygulanan T3, 4’ten fazla LN tutulumu olan veya deri-fasya tutulumu olan hastalara da potmastektomi RT standart yaklaşım haline gelmiştir (15).
Meme kanserinde günlük pratikte cerrahi sonrası adjuvan kullanılan sistemik tedavi modaliteleri bulunmaktadır. Bunlar tamoksifen, aromataz inhibitörleri veya over supresyonu gibi endokrin tedaviler, transtuzumab gibi anti-HER-2 tedaviler ve kemoterapilerdir. Hormonoterapi meme kanserinin tedavisinde tüm evrelerde, ancak sadece ER pozitif ve/veya PR pozitif olan hastalarda primer tedaviden sonra rutin olarak uygulanan bir tedavi yöntemidir. (7,15)
8.2 Meme Kanserinde Prognostik Faktörler
Memenin başlıca lenfatik drenajı aksiler lenf nodlarına olurken bir diğer lenfatik drenaj bölgesi internal mammarian lenf nodlarıdır. Aksiler lenf nodu tutulumu olmadan internal mammarian lenf nodlarında tutulum olması nadir görülen bir durumdur. Lenf nodu tutulumunun durumu uzun vadeli yaşam beklentisinin önemli bir göstergesidir. Lenf nodu tutulumu pozitif olan hastalardaki mortalite oranı negatif olanlara göre 4-8 kat daha fazladır. Tutulan lenf nodu sayısı arttıkça prognoz daha kötüye gitmektedir. 10 yada daha fazla lenf nodu tutulumu olan meme kanserli hastalardaki 10 yıllık mortalite oranı 1-3 arasında lenf nodu tutulumu olanlara göre %70 daha fazladır (16,17).
Tümör boyutu yine önemli prognostik faktörlerden biridir. Sağkalım verilerine bakıldığında, tümör boyutu 2-5 cm arasında olan vakalarda 10 yıllık Sağkalım %66 iken 1 cm’den küçük tümörü olanlarda %79 olarak belirtilmiştir. Ayrıca tümör boyutu arttıkça lenf nodu tutulum olasılığı da paralel olarak artmakta ve prognoz kötüleşmektedir (18).
ER, PR varlığı prognostik açıdan oldukça zayıf bir parametredir. ER ve PR meme kanserinin hormonoterapiye yanıtını değerlendirmede oldukça güçlü
parametrelerdir. Adjuvan hormonoterapi almamış olan hastalarda ER ve PR varlığının nüks ve prognoz açısından ER, PR negatif olan hastalara göre erken dönemde daha iyi sonuçlara sahip olmasına rağmen uzun dönem sonuçlarına bakıldığında bu açıdan aralarında anlamlı bir fark bulunmamaktadır. Ancak ER, PR pozitif hormonoterapi verilen hastalarda nüks ve sağkalım açısından oldukça anlamlı bir yarar sağlanmaktadır. ER, PR negatif olan hastalara hormonoterapi verilmesi durumunda bu yarar sağlanamamaktadır. Primer meme kanserinde ve metastatik lezyonların tamamında ER ve PR bakılması mutlak önerilmektedir. (19).
Meme kanserinde prognostik açıdan histolojik tipler çok iyi, iyi, kötü ve çok kötü olmak üzere 4 kategoride incelenebilir. En iyi prognoza sahip olan tipler; kribriform, tubuler, tubulo-lobuler ve musinöz tiptir. Bu tiplerde 10 yıllık yaşam beklentisi %80’nin üzerindedir. Mikst tubuler, mikst duktal, atipik medullar ve alveolar lobuler karsinom iyi prognoza sahip histolojik tiplerdir. Bu tiplerde 10 yıllık yaşam beklentisi %60-80’dir. İnvaziv papiller, klasik lobuler ve medüller karsinomda prognoz daha kötüdür. Son olarak duktal, solid lobular, mikst duktal ve lobuler karsinomda 10 yıllık yaşam beklentisi ise %50’nin altındadır. İnflamatuar mem kanserinde ise 10 yıllık yaşam beklentisi yaklaşık olarak %30’dur (20).
Tümörün patolojik özelliklerinin de prognostik önemi vardır. Bunlardan biri olan tümör grade değerlendirilmesinde Scarff-Bloom- Richardson sınıflaması kullanılmakta olup, bu sınıflamada tubül oluşumu, nükleer diferansiyasyon ve mitoz birlikte değerlendirilir. Yapılan çok sayıda çalışmada daha yüksek gradeli meme kanserli vakalarda uzun dönem mortalite oranının daha yüksek olduğu saptanmıştır. Tümör grade özellikle lenf nodu negatif veya tümör boyutu arada olan meme kanseri vakalarında prognozun belirlenmesinde değerlidir (20).
Meme kanseri gibi bazı tümörlerde çeşitli proto-onkogenlerin aktivasyonunun tümör patogenezinde rolü olduğu gösterilmiş. Bu genetik değişiklikler tümörün biyolojik agresifliğinin belirlenmesinde ve buna bağlı olarak klinik sonuçların tahmin edilmesinde önemlidir. C-erb-B2 (HER-2/neu) 17. kromozomda yer alan ve intrasellüler tirozin kinaz aktivitesi olan bir transmembran proteini kodlayan bir onkogen olup varlığı meme kanserinin daha agresif davranışlı olacağının bir göstergesidir. Tüm meme kanserlerinin yaklaşık %15-30’unda HER-2/neu onkogen aşırı ekspresyonu vardır. HER2/neu reseptörü epitelyal hücre büyümesi ve diferansiyasyonunu kontrol eden sinyal iletim yolağının aktivasyonunda rol oynayan
tirozin kinaz reseptörlerinin epidermal growth faktör reseptörü ailesindendir. Bu reseptör normalde epitelyum hücrelerinde düşük seviyelerde eksprese edilir (21).
HER-2 tayini meme kanserli hastaların klinik değerlendirmesinde çok önemli bir test olup HER-2’nin doğru tayini bir çok klinik yaklaşımın doğru planlanması için gereklidir. HER-2 onkogeninin tayini, hastaların prognozunun değerlendirilmesi, hastaların hormonoterapilerinin planlanmasında, kemoterapilerinin planlanmasında ve HER-2 bazlı hedef tedavilerden fayda sağlanıp sağlanmayacağının öngörülmesinde yararlıdır. HER-2 onkogeninin aşırı ekspresyonunun tayini yüksek histolojik grade, azalmış yaşam süresi, artmış tümör nüksü, metotreksat bazlı rejimlere ve tamoksifene düşük yanıt ile, antrasiklin ve taksan bazlı rejimlere yüksek yanıtla ilişkilidir. Daha da önemlisi bir monoklonal antikor olan transtuzumab ve lapatinib tedavisine yanıtı tahmin etmede değerlidir.HER-2 (+) meme kanserli hastalarda aromataz inhibitörlerinin adjuvan hormonoterapide tamoksifenden daha iyi olduğu gösterilmiştir (21).
HER-2 onkogen varlığının değerlendirilmesinde çeşitli yöntemler olmasına rağmen en sık kullanılan yöntemler immunohistokimyasal yöntem ile fluorescence
in-situ hibridization yöntemleridir (FISH). İmmunhistokimyasal yöntemle patolojik
preparattaki membran boyanması 0-3 arasında puanla skorlanır. Bu yöntem FİSH yöntemine göre oldukça ucuzdur. İmmunohistokimyasal yöntemle HER-2 2+ saptanan vakalarda HER 2 onkogen varlığının FISH yöntemiyle değerlendirilmesi gereklidir. FISH testi HER-2 neu onkogeninin değerlendirilmesinde FDA tarafından altın standart metod olarak kabul edilmiştir (22)
Kötü prognostik faktörler arasında olan bir başka parametre de tümörün mitoz sayısının fazla olmasıdır. Bu nedenle tümörün proliferasyon hızı ve artmış DNA sentezi kötü prognostik göstergelerdir. Tümörün proliferasyon hızı hücre siklusunun DNA sentez fazı olan S fazındaki hücrelerin oranının saptanmasıyla belirlenebilir. Bu amaçla timidin işaretleme indeksi ve flowsitometrik olarak S faz fraksiyonunun ölçüm testleri kullanılmaktadır (23).
Meme kanserinde ortalama S faz fraksiyon oranı %5’tir. Bu yöntemle saptanan S faz fraksiyonu prognozla koreledir. Yüksek S faz fraksiyonu sıklıkla kötü histolojik diferansiyasyon, ER negatifliği, lenf nodu pozitifliği, büyük tm boyutları ve anöploidi ile ilişkili olup özellikle lenf nodu negatif hastalarda bu özellikler daha belirgindir Günümüzde S faz fraksiyonunun belirlenmesinde kullanılan standart bir
yöntem olmadığından rutin olarak S faz fraksiyonunun flowsitometrik olarak bakılması önerilmemektedir
Timidin işaretleme indeksi de sentez fazındaki DNA’ya işaretlenen timidin miktarının ölçümü yapılır. Bu yöntemle elde edilen S fazı fraksiyonu da prognozla ilişkilidir. Ancak uygulanması zor ve henüz standardize edilmemiş olduğundan klinikte rutin kullanımı önerilmemektedir (23).
DNA analizi, tümör dokusunun ploidi durumu hakkında da bilgi verir. Normal insan hücreleri 46 kromozom içerirler ve diploid olarak tanımlanırlar. Kromozom sayısı 46'dan farklı olan hücreler sitogenetik olarak anöploiddirler. DNA analizi, sitogenitik inceleme ile iyi bir korelasyon göstermekle birlikte hücre DNA içeriğinin ölçülmesi kromozom sayısındaki ± 2 değişiklikleri ayırdetmekte yetersizdir. Bu nedenle DNA analizinde diploid olarak tanımlanan tümörler 46+2 kromozom içeren hücreleri kapsamaktadırlar. Meme kanseri olgularının pek çoğunda anöploidi saptanmıştır. Anöploidi tek başına ve özellikle de S-faz fraksiyonu ile birlikte değerlendirildiğinde prognozu olumsuz yönde etkilemektedir (12,24).
Kİ-67, sadece prolifere olan hücrelerde ve nükleusta bulunan bir antijene karşı geliştirilmiş olan bir monoklonal antikordur. İmmunohistokimyasal boyanma yöntemleriyle tayin edilir. Ki-67 seviyesindeki yükseklik tümörün agresifliğinin bir göstergesi olup, yüksekliği kötü prognoz göstergelerinden biridir. (24)
P53, 17.kromozomda yer alır ve normal apoptpzis için gereklidir ve tümör
baskılayıcı gen olarak çalışır. P53 mutasyonları insan kanserlerinde her zaman mevcuttur. İnsan meme kanserlerinin %20-50 sinde (%50 metastatik, %25 invaziv, %13 intraduktal ve %20 komedo DKİS) P53 geninde mutasyon veya P53 protein birikimi görülür. Bu durum herediter meme kanserlerinde sporadik olanlara göre daha sık görülür. İmmunohistokimyasal çalışmaların sonuçları; P53 birikiminin yüksek tümör grade’i, yüksek proliferatif hız ve ER,PR negatifliği gibi pek çok olumsuz prognostik faktörle ilişkili olduğu yönündedir. Hasta takipli pek çok çalışmada P53’ün LN + ve – olan hasta gruplarının her ikisinde de hastalıksız sağkalım ve genel sağkalım üzerinde azalmaya yol açan bağımsız bir faktör olduğu gösterilmiştir. ASCO tarafından da P53’ün kötü prognozla ilişkili olduğu belirtilmekte , ancak rutin klinik pratikte kullanımıyla ilgili bir mutabakat bulunmamaktadır. (21)
Katepsin D lizozomal proteolitik bir enzimdir. Protein katabolizmasında ve dokunun yeniden şekillenmesinde görevli olan bu enzimle ilgili yapılan çalışmalarda
prognozun belirlenmesinde çok değerli bir belirteç olmadığı düşünülmekte ve ASCO tarafından da rutin kullanımı önerilmemektedir (21,25).
Ürokinaz plazminojen aktivatörü (uPA) kanser invazyonu ve metastazında
önemli rol oynayan bir serin proteazdır. uPA reseptörüne bağlandığında plasminojeni plasmine çevirir ve tümör invazyonu sırasında hücre dışı matriksin parçalanmasını sağlar. uPA’nın spesifik inhibitörü olan PAI-1 (Plazminojen aktivatör inhibitörü) tümör dokusu ve plasmada yüksektir. Yapılan bir çok çalışmada özellikle LN negatif meme kanserli hastalarda prognozun değerlendirilmesinde uPA ve PAI-1 tayini oldukça önemlidir. uPA ve PAI-1 tüm meme kanserli hastalarda lenf nodundan sonra hastalıksız ve genel sağkalımın öngörülmesinde en güçlü parametre olduğu gösterilmiştir. ASCO tarafından yeni tanı almış özellikle küçük, LN negatif tümörü olan meme kanserli hastaların prognozunun değerlendirilmesinde ve KT açısından yarar görecek hastaların belirlenmesinde uPA ve PAI-1 tayinin klinik kullanımı önerilmektedir (21,26).
Siklin E, hücre siklusunun düzenlenmesinden görevli olan ve geç G1 fazında eksprese edilen bir proteindir. Siklinler siklin bağımlı kinazların düzenlenmesinden sorumludur. P21 ve P27 siklin/siklin bağımlı kinaz kompleksini inhibe eden proteinlerdir. Siklin E düzeyinin bir çok kanserde arttığı gözlenmiştir. Meme kanserinde yüksek siklin E düzeylerinin ileri evre hastalık, kötü histolojik diferansiyasyon ve steroid reseptörlerinin eksikliğiyle ilişkili olduğu bildirilmiştir. En son yapılan retrospektif bir çalışmada da immunohistokimyasal olarak ölçülen yüksek siklin E düzeylerinin özellikle lenf nodu negatif hastalarda kötü prognozla ilşkili olduğu gösterilmiştir ASCO tarafından da Siklin E ve P27’nin rutin klinik pratikte ölçülmesi önerilmektedir. (21,27).
Kemik iliginde sıklıkla tek tek veya gruplar halinde bulunan tümör hücreleri, kemik iligi mikrometastazları olarak tanımlanmaktadır. Bu hücreler klasik görüntüleme yöntemleri ile tespit edilememektedir. Tümör gelisiminin olasılıkla erken döneminde meydana gelen mikrometastatik yayılım; kan, lenf nodları veya kemik iligine olabilmekte; kemik iligi primer tümörden köken alan mikrometastatik hücrelerin en sık yayıldıgı organ olarak kabul edilmektedir. Bu hücreler yıllarca iskelet metastazı veya tekrar dolasıma geçerek uzak metastaz gelistirmeden G0 fazında kalmaktadır (28).
Lenf nodu tutulumu (evre N0) veya uzak metastazın klinik ve histopatolojik bulgusu olmayan (evre M0) epitelyal tümörlerde (meme, prostat, kolon ve akciger
karsinomları gibi) kemik iligi mikrometastazı oranı % 20-40 arasında degismektedir. Tek merkezli, önemli sayıda hastayı kapsayan ve yeterli izlem süresi olan çalısmaların çogunda, kemik iligi mikrometastazı varlıgı ile kötü prognoz arasındaki iliksi gösterilmistir (29).
Yapılan bir çok çalışmayla tanı anında obezitesi olan ya da tanıdan sonra kilo değişimi olan meme kanserli hastalarda bunun kötü bir prognostik faktör olduğu gösterilmiştir (30) .
Tümör gelişimi ve metastazı yeni kan damarlarının gelişimine bağlıdır.
Tümör hücreleri tarafından indüklenen çok sayıda anjiogenez molekülü tanımlanmışır. Ancak bu anjiogenez moleküllerinin meme kanserinin prognozunu değerlendirmedeki rolü üzerinde henüz tam bir mutabakat sağlanamamıştır (31) . Yaşın da birçok çalışmada diğer faktörler elimine edildikten sonra tek başına prognozun belirlenmesinde önemli bir prognostik faktör olduğu ve 35 yaşın altındaki kadınlarda meme kanserinin prognozunun daha kötü olduğu bilinmektedir (32).
8.3 Meme kanserli hastalarda beyin metastazı
Metastatik beyin kanserleri erişkinlerde oldukça sık görülmekte olup ABD’de her yıl 200 binin üzerinde vaka bildirilmektedir. Günümüzde kanser tanısı alan hastaların ortalama %8-10’unda beyin metastazı gelişmektedir. Beyin metastazına sık yol açan üç kanser bulunmaktadır. Bunlar sırasıyla akciğer kanseri (%40-50), meme kanseri (%15-25) ve malign melanomdur (%5-20). Bunlar içersinde malign melanom %50’ye varan metastazı oranı ile santral sinir sistemini tutmaya en eğilimli kanserdir (33).
Meme kanseri, akciğer kanserinden sonra beyine en sık metastaz yapan ikinci kanserdir. Meme kanserli hastalarda beyin metastazı insidansı ortalama %10-16 arasındadır. Ancak yapılan otopsi çalışmalarında %30’lara varan oranlarda metastaz saptanabilmektedir. Meme kanserinin tanısıyla semptomatik beyin metastazı gelişimine kadar ki geçen süre yaklaşık olarak 2-3 yıldır. Vakaların çoğunda beyin metastazı sıklıkla akciğer, karaciğer ve/veya kemik metastazını takiben ortaya çıkmaktadır. Nadiren beyin metastazının varlığı primer meme kanserinin tanısından önce saptanabilir. Beyin metastazı tipik olarak vasküler invazyonu takiben hematolojik yayılım sonucu gelişir. Supratentorial bölgede infratentoryal bölgeden ve burada da vasküler geçiş bölgelerinde ve gri-beyaz cevher birleşim alanlarında daha
parankiminin veya leptomeninkslerin tutulumu şeklinde olur. Meme kanseri leptomeningeal tutuluma en sık yol açan solid tümördür. Yapılan retrospektive bir çalışmada santral sinir sisteminde tutulum olan meme kanserli hastaların %78’inde multipl intraserebral, %14’ünde soliter intraserebral ve %8’inde leptomeningeal tutulum olduğu saptanmıştır (34). Meme kanserinde santral sinir sistemininde metastaz gelişiminde rol oynayan çeşitli risk faktörleri bildirilmiştir. Genç yaş bağımsız bir risk faktörü olarak görünmekte ve beyin metastazı olanlarda olmayanlara göre ortalama yaş 5 yıl daha azdır. Çeşitli grupların yaptıkları çalışmada hormon reseptör durumu ile beyin metastazı insidansı arasında ilişki saptanmıştır. Birçok çalışmada ER negatif hastaların %4-10’unda izlemde beyin metastazı geliştiği saptanmış. ER pozitif hastalarda ise hormonoterapi alınmasıyla riskin bu kadar yüksek olmadığı görülmüştür. HER-2 aşırı ekspresyonuyla beyin metastazı arasındaki ilişkiden özellikle bahsetmek gereklidir. Çünkü HER-2 aşırı ekspresyonu meme kanserli vakaların %25-30’unda görülmekte ve varlığı meme kanserinde nüks açısından oldukça güçlü bir öngördürücü faktördür. HER-2 pozitif meme kanserli hastaların %0,5-4,3’ünde ilk metastaz alanı santral sinir sistemidir (35).
Adjuvan KT alınmasıyla SSS metastazı gelişmesi arasındaki ilişki sistematik çalışmalarla araştırılmamış olmasına karşın bu konuda yapılan çalışmalarda adjuvan KT almış olan hastalarda ilk nüksün beyin metastazı olarak gelişme riskinin adjuvan KT almamış olanlardan 2 kat daha fazla olduğu görülmüştür. Bununla birlikte adjuvan KT almanın beyin metastazı gelişimi riskini arttıdığı kararına varılamaz (35).
Lenf nodu durumu (>3 adet), yüksek tümör grade (grade 3), tümör boyutunun 2 cm’den fazla olması beyin metastazı gelişiminde kabul edilen diğer risk faktörleridir. İlk nüks alanının akciğer olması, P53 pozitifliği, düşük bcl-2 ekspresyonu, yüksek EGFR ekspresyonu daha az yaygın çalışmalarda SSS metastazı ile ilişkisi olduğu gösterilmiş olan risk faktörleridirler (36).
Parankimal beyin metastazının en sık görülen klinik belirtileri; baş ağrısı, mental durum değişiklikleri ve bilişsel değişikliklerdir. Başağrısı %24-48, mental durum ve bilişsel değişiklikler ise vakaların %24-34’ünde görülür. Motor defisit, nöbet, bulantı-kusma ve ataksi gibi bulgular ise metastatik lezyonun yerleşim yerine ve oluşturmuş olduğu serebral ödeme bağlı gelişen belirtilerdir. Leptomeningeal metastaz ise tipik olarak kranial nöropati veya başağrısı gibi lokalize edilemeyen semptomlarla ortaya çıkar (35,37).
Kontrastlı BT veya gadoliniumlu MR ile yapılan görüntüleme, beyin metastazının değerlendirmesinde standat tanısal yaklaşımlardır. Gadoliniumlu MR beyin parankimi ve leptomeningeal hastalığı değerlendirmede BT’den daha sensitiv olduğundan nispeten daha fazla tercih edilmektedir. Leptomeningeal hastalıkta MR bazlı görüntülemelerle vakaların %76’sında tanı konulabilmekte iken BT ile vakaların 2/3’ünde leptomeningeal tutulum atlanmaktadır. BOS sitolojisi de leptomeningeal tutulumda oldukça yararlı olup %80’lere varan duyarlılık ve %100 özgüllüğü ile oldukça değerli ancak invaziv bir tanı yöntemidir. Bu işlem öncesi yapılacak olan beyin görüntülemesi ve/veya fundoskopik görüntüleme ile kafa içi basınç artışı ekarte edilmelidir (35,37).
Beyin metastazı saptanan meme kanserli hastalarda tanıdan sonraki 1 yıllık sağkalım oranı yaklaşık olarak %20’dir. Ortalama sağkalım süresi ise 3-6 aydır (32). RTOG (Radiation Therapy Oncology Group) tarafından 1200 beyin metastazı olan hasta üzerinde yapılan değerledirme sonrasında beyin metastazı olan hastalardaki prognostik faktörler belirlenmiştir. Buna göre 65 yaşın altında olmak, Karnofsky performans skorunun 70’in üzerinde olması, beraberinde ekstrakranial metastazın olmaması en önemli olumlu prognostik faktörlerdir. Diğer yapılan çalışmalarda da primer tümörün meme kanseri olması, primer tümörün kontrol altında olması, beyin metastazının soliter olması, uzun hastalıksız sağkalım varlığı ve kortikosteroid tedavisine yanıt saptanan diğer olumlu prognostik faktörlerdir (35).
Meme kanserli hastalarda beyin metastazının tedavisinde kullanılan ilaçlardan kortikosteroidler, peritümöral ödemi azaltmak ve semptomatik rahatlamayı sağlamak amacıyla kullanılır. Kortkikosteroidler arteriel tonusu düzenleyerek ve kapiller geçirgenliği azaltarak peritümöral ödemi azaltır ve bu etkisi saatler içinde ortaya çıkar. Başlangıç dozu genellikle 6 saatte bir 4 mg deksametazondur. Beyin metastazı olan hastalarda, multipl lezyonları olanlarda daha fazla olmak üzere %15-20 oranında fokal ya da generalize nöbetler ortaya çıkar. Bu hastalarda antirpileptiklerin başlanması önerilmektedir (35,37).
Multipl beyin metastazı olan hastalarda tüm beyin ışınlaması standart tedavi yaklaşımı olmuştur. Radyoterapinin, tek başına verilen kortikosteroidlerle karşılaştırıldığı birçok çalışmada tüm beyin ışınlamasının hem sağkalım hem de yaşam kalitesi açısından daha faydalı olduğu görülmüştür. RTOG tarafından yapılan çalışmada tüm beyin ışınlamasında kullanılan farklı yaklaşımlar arasında toplam
metastazı olan meme kanserli hastalarda tüm beyin ışınlamasıyla birlikte sterotaktik radyocerrahi uygulanması tek başına tüm beyin ışınlaması yapılmasına göre daha avantajlıdır (35,37).
Yapılan çeşitli çalışmalarla uygun hastalarda cerrahi rezeksiyon ve ardından yapılan tüm beyin ışınlaması ile tek başına beyin ışınlaması yapılmasına göre daha iyi sonuçlar elde edilmiştir. Ancak cerrahi rezeksiyonun faydalı olabilmesi için intraserebral tek ya da az sayıda metastatik lezyonun olması, hastanın genel durumunun uygun olması ve minimal ekstrakranial hastalığının bulunması gereklidir. Multipl lezyonları olan hastalarda cerrahi rezeksiyon tartışmalı bir konudur (35).
Sistemik kemoterapinin beyin metastazlı meme kanserinde sınırlı etkisinin en önemli nedeni kan-beyin bariyeri nedeniyle beyine kemoterapötik ilaçların zayıf geçişleridir. Kan-beyin bariyeri astrosit, perisit ve endotel hücrelerinden oluşmaktadır. Endotel hücreleri arasındaki tight junction adı verilen sıkı bağlantılar bu sınırlı geçişten sorumlu mekanizmalardan biridir. Sağlam bir kan-beyin bariyeri küçük ve lipidde çözünebilenler hariç kemoterapötiklerin SSS’ne geçişine engel olur. Buna ek olarak endotel hücrelerinden salgılanan P- glikoproteinde kemoterapötiklerin kan-beyin bariyerinden geçişini engeleyen diğer bir faktördür. Yapılan çalışmalarla meme kanseri tedavisinde etkili olan doksorubusin, siklofosfamid, fluorourasil, paklitaksel, dosetaksel ve vinorelbin gibi kemoterapötik ajanların fizyolojik şartlarda SSS’ne oldukça zayıf penetre oldukları gösterilmiştir. Bu nedenle beyin metastazlarının tedavisinde kemoterapötikler sınırlı şekilde kullanılmışlardır (35).
Temozolomid, tamoksifen, idarubusin, lipozomal doksorubusin, metotreksat kan-beyin bariyerinden ciddi derecede geçen kemoterapötiklerdir. Bunlardan temozolomidin BOS’daki konsantrasyonu serumdakinin %33’ü iken, bu değer tamoksifen için serumdakinin 48 katına kadar ulaşmaktadır. Cisplatin ve carboplatin ise sınırlı şekilde kan-beyin bariyerine geçebilmekte ve BOS’daki konsantrasyonları serumdakinin %2-3’ü kadar olmaktadır. Etoposide, fulvestrant ve transtuzumab kan-beyin bariyerinden geçemeyen diğer ilaçlardır. Bununla birlikte kan-beyin metastazında kan-beyin bariyeri sıklıkla hasarlıdır. Bu nedenle fizyolojik koşullarda kan-beyin bariyerinden geçemediği halde beyin metastazında buranın hasarlanması sonrası geçebilen ve tedavide kullanılmış olan ajanlarda vardır (35).
Bundan dolayı özellikle meme kanserindeki beyin metastazının tedavisinde kullanılmış olan ve etkili olduğu bildirilmiş olan tedavi şemaları şunlardır. Siklofosfamid + fluorourasil + prednizon, siklofosfamid + fluorourasil +
doksorubusin, siklofosfamid + fluorourasil + Metotreksat, temozolamid, kapesitabin, cisplatin + etoposide, tamoksifen, anastrazol, letrozol. Bu rejimlerle %50’leri aşan yanıt oranları ve 7 aya varan sağkalım oranları sağlanmıştır (35).
Proflaktik kranial ışınlama tanı anında beyin metastazı görülme riski düşük olan, ancak beyinde nüks açısından yüksek risk taşıyan hastalarda uygulanan bir tedavi yaklaşımdır. Küçük hücreli akciğer kanserinde tanıdan sonraki 2 yıl içersinde beyinde metastaz gelişimi açısından tahmini risk %50’nin üzerindedir. Küçük hücreli akciğer kanseri olan hastalarda bu açıdan yapılan birçok çalışmanın sonucunda proflaktik kranial ışınlama sonrası beyinde nüks riskinin %50 azaldığı ve hastaların %16-18’inde toplam sağkalım süresinin arttığı gösterilmiştir. Proflaktik kranial ışınlama sonrası kişinin bilişsel fonksiyonlarındaki değişimin araştırıldığı çalışmalar sonucunda bu hastalarda önemli bir değişimin olmadığı saptanmıştır (33).
9. MATERYAL VE METOD
Ocak 1995 tarihi ile Nisan 2010 tarihleri arasında Dokuz Eylül Üniversitesi Tıp Fakültesi İç Hastalıkları Anabilim Dalı Tıbbi Onkoloji Bilim Dalı’nda tedavi ve takip edilen tanı anında veya takiplerinde beyin metastazı görülen meme kanserli vakalar incelendi. Hasta dosyaları geriye dönük olarak incelenerek hastalara ait veriler (yaş, VKİ, menapoz durumu ), tümöre ait veriler (Evre, ER, PR ve HER-2 durumu, grade, histolojik tip, duktal karsinoma in situ odağı varlığı, lenfovasküler invazyon varlığı), hastalığın tedavisine ilişkin bilgiler (neoadjuvan ve adjuvan olarak aldığı kemoterapiler, adjuvan olarak aldığı radyoterapi ve hormonoterapi), metastaz gelişimi ve prognoz ile ilgili bilgiler elde edildi.
Kontrol grubu olarak da tanıda ya da takibinde metastaz saptanmış meme kanseri olan hastalardan yukarıda sözü edilen her bir hastanın hemen ardından başvurmuş olanlar alınarak dosyalardan aynı veriler kaydedildi. Dolayısıyla kontrol grubuna aynı sayıda hasta alındı.
Tanı konulduktan ya da ilk metastazdan ölüme kadar olan süre sağkalım analizlerinde değerlendirildi.
Verilerin istatistiksel analizi Statistical Package for Social Scienses for Windows (SPSS) Version 15.0 bilgisayar programı kullanılarak yapıldı. İki grubun
ortalaması analizinde t testi, bağımsız grup oranlarının karşılaştırılmasında
Chi-Square testi, prediktörler veya bağımsız değişkenlerle bağımlı değişkenler arasındaki
analizde Logistic Regression Testi, DFS ve OS analizleri Kaplan-Meier Metodu ile ve iki sağkalım eğrisinin karşılaştırılmasında Log rank testi kullanıldı. İstatistiki anlamlılık düzeyi p<0.05 kabul edildi.
10. BULGULAR
Meme kanseri hastalığı olan ve meme kanserine bağlı tanı anında veya takipleri sırasında beyin metastazı tespit edilen toplam 63 kadın hastanın verileri geriye dönük olarak incelendi. Kontrol grubu olarak bu hastalardan sonra polikliniğe başvurmuş aynı sayıda, tanı anında veya izlemde metastaz gelişmiş olan ancak beyin metastazı olmayan 63 meme kanserli kadın hasta alındı.
Beyin metastazı olan hasta grubundaki hastalarla kontrol grubundaki hastaların ortanca ve ortalama yaşları arasında anlamlı bir farklılık saptanmadı. Hasta ve kontrol grubundaki vakaların ortanca vücut kitle indeks (VKI)’leri benzer olarak saptandı. Hasta grubundaki vakaları çoğunlukta postmenapozal dönemde iken kontrol grubundaki hastalar ise çoğunlukla premenapozal dönemdeydi. Hasta ve kontrol grupları arasındaki bu farklılık istatiksel olarak anlamlı saptanmadı (Tablo 1).
Tablo 1. Hasta ve kontrol gruplarının genel özellikleri
Özellikler Hasta grubu Kontrol grubu
Hasta sayısı n(%) 63 (100) 63 (100)
Adet durumu n(%) Premenopozal 36 (57,2) 28 (44,4) Postmenopozal 27 (42,8) 35 (55,6)
Ortanca yaş (yıl) 49 50
Ortanca VKİ * 27 27
* kilogram/metrekare
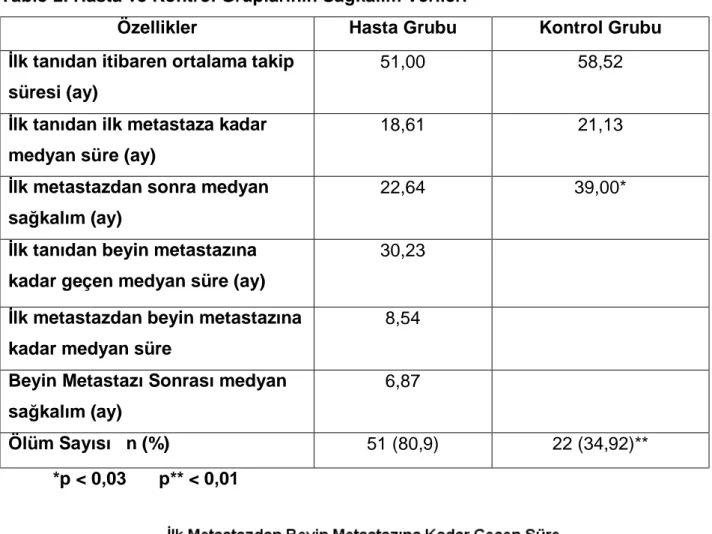
Hasta grubunda ortanca takip süresi ve tanıdan ilk metastaza kadar geçen süre daha düşük bulunurken fark anlamlı bulunmadı. İlk metastazdan sonra sağkalım ise hasta grubunda anlamlı olarak daha düşük bulundu (p<0,03). Kontrol grubunda 12-24-60 aylık sağkalım oranları sırasıyla % 85,8, % 77,4 ve % 31,1 olarak saptanırken hasta grubunda ise % 75,3, % 47,8 ve % 12,2 olarak saptandı (Şekil 1)
Şekil.1 Hasta ve kontrol gruplarının genel Sağkalım verileri
Hasta grubundaki vakalarla kontrol grubundaki vakalar arasında ölüm oranları açısından da oldukça anlamlı farklılık saptandı. (p<0,01) (Tablo 2). Hasta grubundaki vakaların 22 (% 34,9) tanesinde beyin metastazı ilk uzak metastaz saptandığı anda saptandı. İlk metastazdan beyin metastazı saptanmasına kadar geçen medyan süre 8,54 ay olarak bulundu. Medyan süre yıldan daha kısa olsa hastaların küçük bir bölümündede 109 aya varacak şekilde 5 yılın üzerine çıktığı görüldü (Şekil 2).
Tablo 2. Hasta ve Kontrol Gruplarının Sağkalım Verileri
Özellikler Hasta Grubu Kontrol Grubu İlk tanıdan itibaren ortalama takip
süresi (ay)
51,00 58,52
İlk tanıdan ilk metastaza kadar medyan süre (ay)
18,61 21,13
İlk metastazdan sonra medyan sağkalım (ay)
22,64 39,00*
İlk tanıdan beyin metastazına kadar geçen medyan süre (ay)
30,23
İlk metastazdan beyin metastazına kadar medyan süre
8,54
Beyin Metastazı Sonrası medyan sağkalım (ay)
6,87
Ölüm Sayısı n (%) 51 (80,9) 22 (34,92)**
*p < 0,03 p** < 0,01
Hasta grubunda vakaların çoğunda invaziv duktal karsinom kontrol grubundaki hastalarda ise invaziv lobuler karsinom saptandı. Gruplar arasında lobular komponentin varlığı açısından istatiksel olarak anlamlı farklılık saptandı (p < 0,05) Hasta grubunda ve kontrol grupları arasında DCİS odağı mevcudiyeti açısından anlamlı farklılık saptanmadı (Tablo 3).
Hasta ve kontrol grupları arasında tümör derecesindeki farklılığın istatiksel olarak anlamlı olmadığı saptandı. Lenfatik invazyon her 2 grupta da vakaların yarısından çoğunda pozitif olarak saptandı ve aralarında anlamlı bir istatiksel farklılığın olmadığı saptandı. Bunun yanında vasküler invazyonun hasta grubunda kontrol grubuna göre istatiksel olarak anlamlı bir oranda daha fazla pozitif olduğu saptandı (p < 0,005). Hasta grubunda P53 bakılan hastalarda çok daha fazla pozitiflik oranı görülmesine rağmen hasta ve kontrol grubundaki hastaların çoğunda P53 bakılmamış olması nedeniyle istatiksel değerlendirmeye alınmadı. Hasta grubunda bilateral meme kanseri görülme oranı kontrol grubunun 2 katı olmasına rağmen istatiksel değerlendirme için yeterli vaka mevcut olmadığından istatiksel olarak anlamlılık değerlendirilmedi (Tablo 3).
Tablo 3. Tümöre ait histopatolojik özellikler
Özellikler Hasta grubu/ n (%) Kontrol grubu/ n (%)
İDK* 39 (61,9) 33 (52,3)
İLK** 9 (14,3) 20 (31,7)
Mixt tip (İDK+İLK) 10 (15,8) 9 (14,3)
Diğer 5 (7,9) 1 (1,6)
Lobular komponent 19 (30,1) 29 (46,1)&
DCİS*** Odağı 14 (22,2) 18 (28,5)
Düşük grade 32 (50,8) 41 (65,1)
Yüksek grade 31 (49,2) 22 (34,9)
Vasküler invazyon 22 (34,9) 12 (19,1)&&
Lenfatik invazyon 23 (36,5) 9 (14,3)
P53 mutasyonu 6 (9,5) 0 (0)
Bilateral meme kanseri 4 (6,4) 2 (3,2)
* İnvaziv duktal karsinom ** İnvaziv lobüler karsinom ***Duktal karsinoma in situ & p < 0,05 && p < 0,005
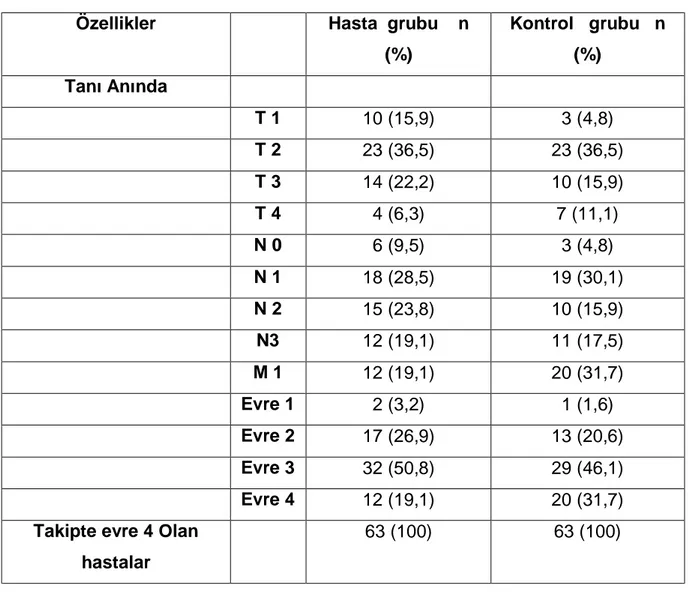
Hasta grubunda ve kontrol grubunda tümör boyutları, lenf noslarının varlığı ve tutulan lenf nodları sayısı açısından istatiksel anlamlı bir farklılık saptanmadı. Tanı anında metastatik meme kanseri olanlar ilginç olarak kontrol metastatik meme kanseri olan grupta daha fazla olarak saptandı. Ancak bu farklılığın istatiksel olarak anlamlı olmadığı görüldü. Benzer şekilde hasta ve kontrol grubunun evreleri açısından yapılan karşılaştırmalarında da istatiksel bir farklılık saptanmadı (Tablo 4).
Tablo 4. Hastaların evrelerine ait özellikleri
Özellikler Hasta grubu n (%) Kontrol grubu n (%) Tanı Anında T 1 10 (15,9) 3 (4,8) T 2 23 (36,5) 23 (36,5) T 3 14 (22,2) 10 (15,9) T 4 4 (6,3) 7 (11,1) N 0 6 (9,5) 3 (4,8) N 1 18 (28,5) 19 (30,1) N 2 15 (23,8) 10 (15,9) N3 12 (19,1) 11 (17,5) M 1 12 (19,1) 20 (31,7) Evre 1 2 (3,2) 1 (1,6) Evre 2 17 (26,9) 13 (20,6) Evre 3 32 (50,8) 29 (46,1) Evre 4 12 (19,1) 20 (31,7)
Takipte evre 4 Olan hastalar
63 (100) 63 (100)
Her iki grupta neoadjuvan kemoterapi alma ve yapılan cerrahinin tipi arasında anlamlı bir farklılık saptanmadı. Hasta grubunda hastalara FEC (% 23), dosetaksel (% 8) veya FEC+dosetaksel (%69) kemoterapisi verilmişken, kontrol grubuna ise FEC (% 42), FEC+dosetaksel (%42), epirubusin+dosetaksel (% 8) ve CMF (%8) kemoterapileri verilmişti (Tablo 5).
Her iki grup arasında adjuvan kemoterapi açısından farklılık saptanmadı. Primer tedavide antrasiklin ya da taksan kullanımı açısından yapılan karşılaştırmada da istatiksel anlamlı farklılık saptanmadı (Tablo 5).
Her iki grupta adjuvan radyoterapi ve adjuvan hormonoterapi açısından anlamlı bir farklılık saptanmadı. Ancak adjuvan hormonoterapi süreleri açısından değerlendirildiğinde hasta grubunda ortanca HT kullanma süresi 23,5 ay iken kontrol grubunda ortanca HT kullanma süresi 43,5 ay olarak bulundu. Her iki grupta da hastaların tamamına yakınının tamoksifen veya aromataz inhibörleri aldığı görüldü (Tablo 5).
Tablo 5. Hasta ve kontrol gruplarında uygulanan tanı ve tedavi yöntemleri Özellikler Hasta grubu n (%) Kontrol grubu n (%) Neoadjuvan kemoterapi 13 (20,6) 12 (19,0)
MRM* 29 (46,0) 27 (42,9)
MKC** 25 (39,6) 24 (38,1)
İn-op 9 (14,3) 12 (19,0)
Adjuvan kemoterapi 40 (63,5) 35 (55,6)
Primer tedavide antrasiklin 44 (69,8) 34 (54,0)
Primer tedavide taksan 13 (20,6) 10 (15,9)
Adjuvan radyoterapi 33 (52,4) 42 (66,7)
Adjuvan hormonoterapi 29 (%46,0) 22 (%34,9)
• Modifiye Radikal Mastektomi, **
• Meme Koruyucu Cerrahi
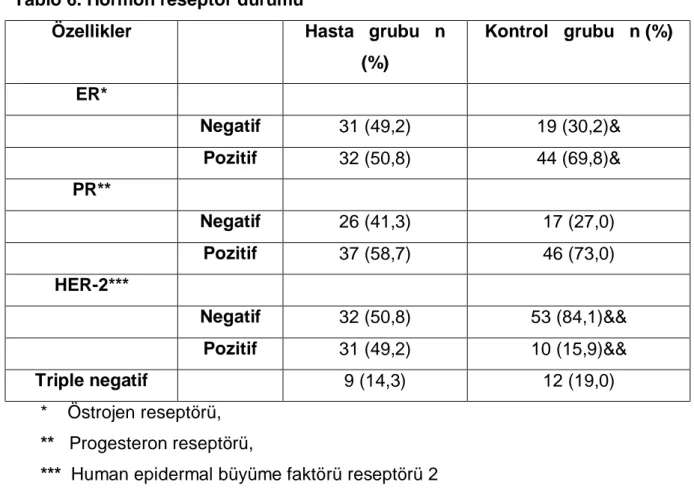
Kontrol grubunda ER pozitifliği hasta grubuna göre istatiksel olarak da anlamlı saptandı (p < 0,03). Bunun yanında PR pozitifliği açısından gruplar arasından istatiksel anlamlı bir farklılık saptanmadı. HER-2 varlığı açısından yapılan karşılaştırmada ise hasta grubunda istatiksel olarak da anlamlı bir şekilde yüksek HER-2 pozitifliği saptandı (p < 0,001).Triple negatiflik açısından ise gruplar arasında anlamlı bir farklılık saptanmadı (Tablo 6).
Tablo 6. Hormon reseptör durumu
Özellikler Hasta grubu n (%) Kontrol grubu n (%) ER* Negatif 31 (49,2) 19 (30,2)& Pozitif 32 (50,8) 44 (69,8)& PR** Negatif 26 (41,3) 17 (27,0) Pozitif 37 (58,7) 46 (73,0) HER-2*** Negatif 32 (50,8) 53 (84,1)&& Pozitif 31 (49,2) 10 (15,9)&& Triple negatif 9 (14,3) 12 (19,0) * Östrojen reseptörü, ** Progesteron reseptörü,
*** Human epidermal büyüme faktörü reseptörü 2
& p < 0,03 && p < 0,001
Hasta grubunda vakaların 41 (%65,1)’inde beyin metastazı saptandığında diğer organ metastazları da mevcuttu. Vakaların beyin metastazı tanısı sırasında 30 (% 47,6)’unda kemik, 25 (% 39,7)’inde Akciğer ve 16 (% 25,4)’sında karaciğer metastazı saptandı. Bazı hastalarda beyin metastazı sırasında birden fazla odakta metastaz mevcuttu. Beyin metastazı olan hasta grubundaki vakaların yarısından çoğunda multipl beyin metastazı saptandı. (Tablo 7).
Hasta grubu ve kontrol grubu kemik, karaciğer ve akciğer metastazları açısından karşılaştırıldı. Kontrol grubunda kemik metastazlarının varlığı istatiksel olarak da anlamlı şekilde hasta grubuna göre yüksek saptandı. (p < 0,002) Akciğer metastazı hasta grubunda daha sık görülmesine karşın bu farklılığın istatiksel olarak anlamlı olmadığı gösterildi. Karaciğer metastazı varlığı da kemik metastazı gibi kontrol grubunda istatiksel olarak anlamlı bir şekilde daha yüksek saptandı (p < 0,02) (Tablo 7).
Beyin metastazı olan hastalara uygun dozda steroid tedavisi verilmiş olup bunlardan 50 (%79,4)’sine beyin metastazı tespit edildikten sonra beyine yalnız RT verilirken bu hastalardan 3 (%4,8)’üne beyin metastazı tespit edildikten sonra opere edilip ardından beyine radyoterapi verilmişti.
Tablo 7. Metastaz özellikleri ve tutulan organlar
Özellikler Hasta grubu n(%) Kontrol grubu n(%) Metastatik hasta 63 (100) 63 (15,3) Beyin 63 (100) 0 (00) Soliter 26 (41,3) Multipl 37 (58,7) Kemik 30 (47,6) 47 (74,6) Akciğer 25 (39,7) 18 (28,6) Karaciğer 16 (25,4) 29 (46,0)&
Kontrol grubunda metastaz saptandıktan sonra ve hasta grubunda beyin metastazı ortaya çıkmadan önce saptanan ilk metastazdan beyin metastazı gelişene kadar ki dönemde KT alıp almadıkları ve hangi KT’leri aldıkları karşılaştırıldı. Kontrol grubundaki hastaların hasta grubundakilerden istatiksel olarak da anlamlı bir şekilde daha yüksek oranda KT aldıkları saptandı (p 0,001) (Tablo 8).
Gruplar aldıkları KT açısından da değerlendirildiklerinde kontrol grubunun istatiksel olarak anlamlı şekilde epirubicin (0,016), siklofosfamid (p 0,048), flurourasil (p 0,025), dosetaksel (p 0,001), paklitaksel (0,048), kapesitabin (0,004) KT’lerini daha fazla aldıkları saptandı (Tablo 8).
Tablo 8. Metastatik meme kanserinde kullanılan kemoterapötikler
Özellikler Hasta grubu n(%) Kontrol grubu n(%) İlk metastaz sonrası kemoterapi alan hastalar 29 (46,0) 55 (87,3) Epirubicin alanlar 11 (17,5) 23 (36,5) Siklofosfamid alanlar 2 (3,2) 8 (12,7) Flurourasil alanlar 5 (7,9) 14 (22,2) Dosetaksel alanlar 22 (34,9) 43 (68,3) Paklitaksel alanlar 2 (3,2) 8 (12,7) Vinorelbine alanlar 13 (20,6) 17 (27,0) Gemsitabin alanlar 7 (11,1) 15 (23,8) Cisplatin alanlar 6 (9,5) 11 (17,5) Carboplatin alanlar 0 3 (4,8) Kapesitabin alanlar 6 (9,5) 19 (30,2) Transtuzumab alanlar 17 (27,0) 10 (15,9) Lapatinib alanlar 2 (3,2) 1 (1,6)
Vakaların tek değişkenli analizleri incelendiğinde hasta grubunda vakalarda daha çok vasküler invazyon görülmesi, daha fazla HER-2 pozitifliği kontrol grubunda ise tümörde histolojik olarak İLK komponenetinin daha fazla görülmesi, ER pozitifliğinin daha fazla görülmesi, kemik ve karaciğer metastazının daha fazla görülmesi, ilk metastazdan sonra KT verilme oranının ve buna bağlı olarak FEC, dosetaksel, paklitaksel ve kapesitabin KT’lerinin fazla verilmesinin istatiksel olarak anlamlı olduğu görüldü. (Tablo 9).
Grubların çok değişkenli analizinde ise hasta grubunda HER-2 pozitifliğinin fazla olması, kontrol grubunda ise kemik metastazının ve ilk metastaz sonrası daha fazla KT verilmesinin istatiksel olarak anlamlı olduğu saptandı (Tablo 9)
Tablo 9. Tek değişkenli ve çok değişkenli analizler
Özellikler Tek değişkenli (p) Çok değişkenli (p) İnvaziv lobuler karsinom varlığı 0,043
Vasküler İnvazyon 0,005
ERª 0,029
HER-2ªª 0,001 0,001
Kemik metastazı 0,002 0,035
Karaciğer metastazı 0,016
İlk metastaz sonrası kemoterapi alan hastalar 0,001 0,001 Epirubicin 0,016 Siklofosfamid 0,048 Flurourasil 0,025 Dosetaksel 0,001 Paklitaksel 0,048 Kapesitabin 0,004
ª Östrojen reseptörü, ªª Human epidermal büyüme faktörü reseptörü 2, p<0.05
11. TARTIŞMA
Sık görülen kanserlerin başında gelen ve metastaz görülmesi halinde tam iyileşme şansının olmadığı meme kanserinde diğer organlarla beraber veya sadece beyin metastazı gelişimi, hem tedavi hem de sağkalım açısından önemli bir problemdir. Biz bu çalışmamızda beyin metastazı görülen meme kanserli hastaların genel özelliklerini, prognostik-prediktif faktörleri ve sağkalım verilerini beyin metastazı olmayan metastatik meme kanserli hastalarla karşılaştırarak ortaya koymaya çalıştık.
Çalışmamızda tümöre ait bazı özelliklerin hastada beyin metastazı gelişimini etkilediği saptadık. Tümörün vasküler invazyona sahip olması, ER’nin negatif olması ve HER-2’nin pozitif olması durumlarında beyin metastazlarının daha sık görüldüğünü saptadık. Bununla birlikte histolojik olarak tümörü invaziv lobuler karsinom komponenti içeren, metastaz yerleri olarak karaciğer ve/veya kemik metastazı olan ve metastaz saptandıktan sonra kemoterapi alan hastalarda beyin metastazının daha az görüldüğünü saptadık.
Çalışmamızın geriye dönük bir çalışma olmasının en önemli kısıtlayıcı faktör olduğunu düşünmekteyiz. Fakat bununla birlikte iyi deneyim ve yeterli donanıma sahip olan merkezimizde takip edilen hastalarımızın verilerinin doğru ve düzgün olması nedeniyle yaptığımız bu geriye dönük çalışmanın da bu konuda fikir sahibi olunması açısından değerli bilgiler verebileceğini düşünmekteyiz.
Xavier ve arkadaşları tarafından geriye dönük olarak yapılan bir çalışmada invaziv lobuler karsinom komponenti bulunan hastalar invaziv lobuler karsinom komponenti bulunmayan hastaların verileriyle kıyaslanmıştır. Yapılan değerlendirme sonrası invaziv lobuler karsinom komponenti bulunanlarda tümörün daha erken evrede olduğu, ER pozitifliğinin daha fazla olduğu, daha düşük grade sahibi oldukları buna karşın gruplar arasında beyin metastazı gelişimi açısından istatiksel olarak anlamlı bir fark olmadığı saptanmıştır (38). Arpino ve arkadaşlarının invazive lobuler karsinomlu ve invaziv duktal karsinomlu erken evre meme kanseri hastalarını değerlendirdikleri bir çalışmada ise invaziv lobuler karsinomu olan hastalarda tümörün daha erken evrede olduğu, ER pozitifliğinin ve HER-2 negatifliğinin daha fazla olduğu ve beyin metastazı gelişim riskinin ise daha az olduğu istatiksel olarak gösterilmiştir (p < 0,04) (39).
Bizim çalışmamızda da beyin metastazı olmayan metastatik meme kanserli hastalarda patolojik tanıda invaziv lobuler karsinom komponenti tek değişkenli
Santral sinir sisteminin iyi izole olması nedeniyle buradan kaynaklanan tümörlerin diğer organlara metastazı nadir olup, bununla birlikte burada gelişen tümörlerin tedavisi de bir o kadar zor olmaktadır. Bu nedenle beyin tümörleri veya beyine metastaz yapmış tümörlerde prognoz kötü seyretmektedir. Santral sinir sisteminde lenfatik sistemin yokluğu da bir başka önemli faktördür. Diğer tümörlerde olduğu gibi meme kanserinde de birçok çalışmada beyin metastazının tipik olarak vasküler invazyon sonrası ortaya çıktığı gösterilmiştir (34). Dawood ve arkadaşları beyin tutulumu olan meme kanserli hastaları incelediler ve kan damar tutulumu olan hastalarda beyin metastazının daha fazla geliştiğini saptadılar (p < 0,05) (40). Carey ve arkadaşları yine meme kanserli hastalarda beyin tutulumu açısından tümörün kan damarı tutulumuna sahip olmasının beyin tutulumu riskini arttırdığını saptadılar (p 0,0001) (41). Graesslin ve arkadaşları meme kanserli hastalarda beyin metastazının gelişiminde tümörün kan damarı tutulumuna sahip olmasının bağımsız bir risk faktörü olmadığını belirttiler (42). Gonzalez ve arkadaşları da meme kanserli hastalarda beyin tutulumu gelişimi ile tümörün kan damarı tutulumuna sahip olması arasında anlamlı bir ilişki saptamadılar (43).
Biz de kendi çalışmamızda beyin metastazı olan meme kanserli hastalarda kan damarları tutulumunun istatiksel olarak daha fazla olduğunu hasta grubunda meme tümör patolojilerinde kan damarı tutulumunun olmasının hem tek değişkenli analizlerde hem de çok değişkenli analizlerde anlamlı olarak daha fazla olduğunu bulduk (p < 0,005).
Meme kanserininde önemli öngördürücü faktörlerden biri de ER durumu olup bu konuda yapılmış olan birçok çalışmada ER’nin negatif olması durumunda visseral organ metastazlarının ER pozitif hastalara göre %50 daha fazla olduğu, buna karşın ER pozitif hastalarda kemik metastazının ER negatif hastalara göre 3 kat daha fazla olduğu gösterilmiştir. (44). Bu konuda, Souglakos ve arkadaşları ER durumu ile beyin metastazı gelişme riski açısından meme kanserli hastaları incelediler ve ER’nin pozitif veya negatif olmasının beyin metastazı açısından anlamlı olmadığını saptadılar (45). Pestalozzi ve arkadaşları, Hicks ve arkadaşları, Slimane ve arkadaşları beyin metastazı görülen meme kanserli hastaların daha çok ER negatif olan hastalar olduğunu saptadılar (45,47,48). Yee-Lu ve arkadaşları uzak metastaz gelişen meme kanserli hastalarda beyin metastazı görülen grupta ER negatifliğinin anlamlı olarak daha fazla olduğunu saptadılar (49). Graesslin ve arkadaşları meme kanserli hastalarda ER negatifliğinin beyin metastazı gelişimi açısından bağımsız bir