TC
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ENFEKSİYON HASTALIKLARI VE KLİNİK MİKROBİYOLOJİ ANABİLİM DALI
BÖBREK NAKİLLİ VE HEMODİYALİZ UYGULANAN KRONİK BÖBREK YETMEZLİKLİ HASTALARDA STRONGİLOİDOZ SIKLIĞININ SEROLOJİK VE
MOLEKÜLER YÖNTEMLERLE ARAŞTIRILMASI
UZMANLIK TEZİ Dr. Esra ERDEM KIVRAK
TEZ YÖNETİCİSİ
Doç. Dr. Meltem IŞIKGÖZ TAŞBAKAN
İZMİR 2014
i TC
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ENFEKSİYON HASTALIKLARI VE KLİNİK MİKROBİYOLOJİ ANABİLİM DALI
BÖBREK NAKİLLİ VE HEMODİYALİZ UYGULANAN KRONİK BÖBREK YETMEZLİKLİ HASTALARDA STRONGİLOİDOZ SIKLIĞININ SEROLOJİK VE
MOLEKÜLER YÖNTEMLERLE ARAŞTIRILMASI
UZMANLIK TEZİ Dr. Esra ERDEM KIVRAK
TEZ YÖNETİCİSİ
Doç. Dr. Meltem IŞIKGÖZ TAŞBAKAN
İZMİR 2014
ii TEŞEKKÜR
Asistanlık sürecim boyunca desteğini hep hissetiğim, bilgi ve deneyimlerinden faydalandığım sevgili tez hocam Doç. Dr. Meltem Işıkgöz Taşbakan’a, tezim süresince yardımlarını esirgemeyen Doç. Dr. Ayşe Caner’e, Doç. Dr. Mert Döşkaya’ya, uzmanlık eğitimimde emeği geçen Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Anabilim Dalı’ndaki tüm değerli hocalarıma, bu zorlu yolculukta ve hayatımın her döneminde uzakta olsalar da sevgi ve desteklerini hep yanımda hissettiğim canım aileme, her zaman yanımda olduğunu ve olacağını bildiğim sevgili eşim Mücahit Kıvrak’a teşekkürü bir borç bilirim.
iii
İÇİNDEKİLER
ÖZET IV
ABSTRACT VI
TABLOLAR, ŞEKİLLER, RESİMLER, EKLER DİZİNİ VIII
GİRİŞ VE AMAÇ 1
GENEL BİLGİLER 3
Nematodların Yapısal Özellikleri 4
Strongiloidoz 8
Epidemiyoloji 9
Strongyloides stercoralis ve Özellikleri 10
Yaşam Döngüsü 13
Bulaş Yolları 16
Klinik Belirtiler 16
Hiperenfeksiyon Sendromu ve Dissemine Strongiloidoz 19
Tanı 20 Tedavi ve Korunma 28 GEREÇ VE YÖNTEM 30 BULGULAR 41 TARTIŞMA 45 SONUÇ ve ÖNERİLER 58 EKLER 59 KAYNAKLAR 67
iv ÖZET
Strongiloidoz, tropik ve subtropik bölgelerde endemik olarak görülen ve çoğunlukla Strongyloides stercoralis (S. stercoralis)’in neden olduğu intestinal bir paraziter
enfeksiyondur. Bu parazit bağışıklığı baskılanmış kişilerde hiperenfeksiyon sendromu, dissemine strongiloidoz gibi tablolara yol açarak yaşamı tehdit eden enfeksiyonlara neden olabilmektedir. Strongiloidozda tanı genellikle gecikmekte ve ağır strongiloidoz olgularında %80’e varan oranlarda mortalite görülebilmektedir. Bu nedenle endemik bölgelerden gelen, HIV pozitif ya da çeşitli nedenlerle (organ nakli, kemoterapi, immünoterapi gibi )
immünsüpresyon öncesi dönemde olan kişilerin dışkı larva kültürü ve serolojik yöntemlerle taranması önerilmektedir. Çalışmamızda; böbrek nakli yapılmış hastalar ile hemodiyaliz uygulanan kronik böbrek yetmezlikli hastalarda strongiloidoz sıklığının belirlenmesi amaçlanmıştır. Ege Üniversitesi Tıp Fakültesi Hastanesi Organ Nakli Polikliniği’ne
01.04.2013 – 31.12.2013 tarihleri arasında başvuran böbrek nakli yapılmış hastalar ile diyaliz merkezinde hemodiyaliz uygulanan kronik böbrek yetmezlikli hastalar olmak üzere toplam 108 hasta çalışmaya dâhil edilmiştir. Hastaların 28’i (%25,9) hemodiyaliz uygulanan kronik böbrek yetmezlikli hasta, 80’i (%74,1) de böbrek nakli uygulanan hastadır. Toplam 108 serum örneğine anti-S. stercoralis IgG antikor varlığının araştırılması için enzyme-linked
immünosorbent testi (ELISA) uygulanmıştır. ELISA testinde kullanılacak pozitif ve negatif kotrollerin belirlenmesi için ticari kit ( DRG® Diagnostics Strongyloides IgG ELISA EIA-4208; Almanya ) kullanılmıştır. Dışkı örneklerinde ‘‘real time’’ polimeraz zincir reaksiyonu (PZR ) ile. S.stercoralis 18S rRNA geninde (GENBANK No: AF279916) bulunan 101 bp’lik kısım primer ve hidroliz probları kullanılarak araştırılmıştır. Böbrek nakli uygulanmış bir hastada serumda ELISA ile S. stercoralis antikorları pozitif saptanmıştır. Aynı hastanın dışkısında ‘‘real time’’ PZR testi ile S. stercoralis pozitifliği saptanmıştır.
v
Sonuç olarak; hastanemizin de bulunduğu Ege Bölgesi’nin S. stercoralis açısından riskli bir bölge olmadığını fakat bağışıklığı baskılanmış hastalarda ölümcül seyredebilmesi nedeniyle strongiloidozun akla getirilmesi gerektiğini söyleyebiliriz. Çalışmamız, ülkemizde böbrek nakli sonrası kan ve dışkı örneklerinde S. stercoralis’in araştırıldığı ilk çalışmadır. Anahtar kelimeler: strongiloidoz, böbrek nakli, kronik böbrek yetmezliği, polimeraz zincir reaksiyonu (PZR), enzim-linked immünosorbent testi (ELISA)
vi ABSTRACT
Strongyloidiasis is an intestinal infestation especially endemic in the tropical and subtropical regions, it is mostly caused by Strongyloides stercoralis (S. stercoralis). This parasite can cause life-threatining infections such as hyperinfection syndrome, disseminated strongyloidiasis in immunosuppressed patients. Diagnosis of strongyloidiasis is usually delayed and the mortality rate may be up to 80 % among severe cases. Thus, screening of patients from endemic areas or HIV (+) patients or patients before immunosuppression (for some reasons such as organ transplantation, chemotherapy and immunotherapy) is
recommended with stool larvae cultures as well as with serologic tests. The aim of this study was to find out the prevalence of strongyloidiasis in renal transplanted patients and patients on chronic hemodialysis. . A total of 108 patients who presented to the Outpatient Clinic of the Organ Transplantation Unit at the Ege University Faculty of Medicine between 01.04.2013 – 31.12.2014 were included in the study. Twenty eight patients (25,9%) were undergoing dialysis with chronic renal failure and 80 patients (74,1%) had received renal transplants. Enzyme-linked immunosorbent assay (ELISA) test was used to investigate anti-S. stercoralis IgG antibodies in the serum samples of the study population. To detect positive and negative controls, a commercial kit (DRG® Diagnostics Strongyloides IgG ELISA EIA-4208;
Germany) was used. In stool samples, a specific 101 bp part of S. stercoralis 18 rRNA gene (GENBANK No: AF279916) was investigated by real time PCR primers and hydrolysis probes. ELISA was positive for anti-S. stercoralis antibodies in one renal transplant patient and the stool PCR also tested positive in the same patient.
In conclusion, the Aegean region where the Ege Universtiy hospital is located is a low risk area for S. stercoralis. However, due to the high mortality rate of strongyloidiasis among immunosuppressed patients, it should always be considered in such patients. To our
vii
knowledge, this is the first study, which investigates S. stercoralis in the serum and stool samples of patients who underwent renal transplantation in Turkey.
Key words: strongyloidiasis, renal transplantation, chronic renal failure, polymerase chain reaction (PCR), enzyme-linked immunosorbent assay (ELISA)
viii ŞEKİLLER DİZİNİ
Şekil No Şekil Adı Sayfa
Şekil 1 Strongyloides stercoralis’in morfolojisi 12
Şekil 2 Strongyloides stercoralis’in yaşam döngüsü 15
TABLOLAR DİZİNİ
Tablo No Tablo Adı Sayfa
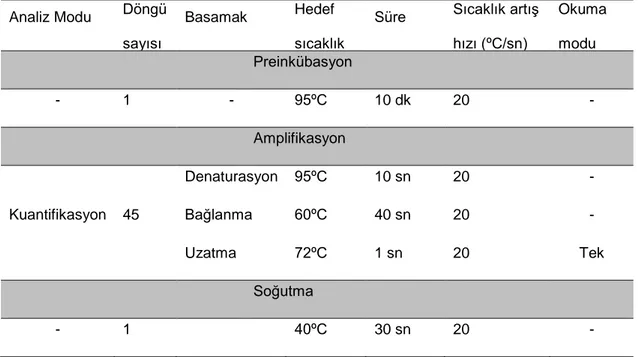
Tablo 1 ‘‘Real time’’ PZR aşamasında her bir örnek için kullanılan reaksiyon karışımı 38 Tablo 2 ‘‘Real time’’ PZR testinde her bir örnek için kullanılan protokol 39
RESİMLER DİZİNİ
Resim No Resim Adı Sayfa
Resim 1 ELISA ile pozitif saptanan hasta serumu (durdurma solüsyonu konulmadan önce) 43 Resim 2 ELISA ile pozitif saptanan hasta serumu (durdurma solüsyonu konulduktan sonra) 44 Resim 3 ‘‘Real Time’’ PZR testi ile pozitif saptanan hasta örneğine ait amplifikasyon eğrileri 44
EKLER DİZİNİ
Ek No Ek Adı Sayfa
Ek 1 Bilgilendirilmiş Gönüllü Olur Formu 59
1 1. GİRİŞ VE AMAÇ
Strongiloidoz genellikle intestinal bir nematod olan Strongyloides spp.'nin iki türünden birinin neden olduğu parazitik bir hastalıktır. Fırsatçı enfeksiyon etkeni bir nematod olup, bağışıklığı baskılanmış kişilerde daha sık görülmekte ve ölümcül seyirli olabilmektedir. Strongyloides stercoralis enfeksiyonu insanlarda strongiloidozun en sık nedeni iken, Strongyloides fuelleborni (S. fuelleborni) enfeksiyonları nadir görülmektedir (1,2). S. stercoralis hem tropikal (Sahra altı Afrika, Güneydoğu Asya, Latin Amerika) hem de ılıman bölgelerde (Amerika'nın güneydoğu bölgeleri, bazı Avrupa ülkeleri) endemik olan, topraktan bulaşan intestinal bir nematodtur (3). S. stercoralis'in neden olduğu ciddi strongiloidoz, endemik ülkelere seyahat eden hastalarda, temastan 30 yıl sonra dahi ortaya çıkabilmekte ve yaşamı tehdit edebilmektedir. Ülkemizde yapılan seroprevalans çalışmalarında S. stercoralis sıklığı %0,3-%0,9 arasında bildirilmiştir (4,5). Enfeksiyon, başlıca filariform larvaların deri yoluyla vücuda girmesiyle başlar. İnsan cildi ile kontamine toprağın temasını takiben filariform larva cilde penetre olmakta ve barsaklara yerleşmeden önce akciğerlerden geçmektedir (6). İmmunkompetan konaklarda, S. stercoralis enfeksiyonu kutanöz, pulmoner ve gastrointestinal semptomlara neden olabilmekte ve pek çok olgu da asemptomatik seyretmektedir. Bununla birlikte; otoenfeksiyonlar sonucu gelişen hiperenfeksiyon sendromu (barsakların veya akciğerlerin filariform larva tarafından masif invazyonu) veya hastalığın dissemine formuna neden olan ekstra intestinal doku ve organlara larvaların yayılımı ile de ortaya çıkabilmektedir (6).
Larvanın göçü döneminde pnömoni, diyare, huzursuzluk erken belirtilerdir. Daha sonra ince barsak mukozasında ülserasyon, kanlı ishal ve malabsorbsiyon gelişmektedir. Bağışıklığı baskılanmış kişilerde ve immünsüpresif tedavi alan
2
hastalarda defektif T hücre fonksiyonuna neden olarak, konağın savunma mekanizmalarını zayıflatır ve morbidite ve mortaliteyi artırır (7). Kortikosteroit tedavisi ile strongiloidoz arasındaki ilişki yaygın olarak bildirilmiştir. Kortikosteroit tedavisi S. stercoralis ile enfekte olma riskini 2-3 kat arttırırken, kortikosteroitin tetiklediği immünsupresyon asemptomatik hastalarda hastalığın ciddi formlarına ilerlemesine neden olabilir (2,8,9). Kortikosteroitlerin, eozinofiller gibi S. stercoralis'e karşı immün cevapta başlıca rol oynayan mediyatörler üzerindeki baskılayıcı etkileri nedeniyle parazitik enfeksiyonlara karşı duyarlılığı arttırdıkları düşünülmektedir (10,11). Aynı zamanda kortikosteroitlerin S. stercoralis'in yayılımını hızlandırarak parazitler üzerinde doğrudan bir etkiye sahip olabildikleri de düşünülmektedir (12). Organ ve kemik iliği nakli sonrasında bildirilen S. stercoralis enfeksiyonu olguları literatürde bulunmaktadır. Bu hastaların özellikle nakil sonrası üç ay süresince yüksek risk altında olduğu bildirilmektedir. Bu hastaların enfeksiyonu daha önce aldığı ve ince barsaklarda yerleşen S. stercoralis larvalarının immün yetmezliğe bağlı otoinfeksiyon nedeniyle sistemik olarak yayıldığı bildirilmiştir (13,14).Klasik olarak çoklaştırma yöntemleri kullanılarak yapılan dışkı incelemesinde filariform larvaların görülmesiyle tanı konulmaktadır. Ayrıca duedonum sıvısında ve balgamda larvalar bulunabilmektedir. Bu tanı yöntemleri çoğu kez yeterli olmamaktadır. Tanıda dışkı kültürü, serolojik ve moleküler yöntemler de mevcuttur. Serolojik ve moleküler yöntemlerle yapılan daha fazla çalışmaya ihtiyaç duyulmaktadır (2). Özellikle endemik olmayan bölgelerde akla getirilmemesi nedeniyle hastalık gözden kaçabilmektedir.
Ülkemizde böbrek nakli yapılmış hastalar ile hemodiyaliz uygulanan kronik böbrek yetmezlikli hastalarda strongiloidoz açısından yapılan herhangi bir çalışma ve veri bulunmamaktadır. Bu çalışmayla; hastanemizde izlenen böbrek nakli yapılmış
3
hastalar ile hemodiyaliz uygulanan kronik böbrek yetmezlikli hastalarda strongiloidoz sıklığının araştırılması, bulunan prevalansa göre böbrek nakli öncesinde ve hemodiyaliz hastalarında strongiloidoz taramasının önerilmesi ve erken tanı ile ölümcül komplikasyonları olan bu hastalığın tedavisinin sağlanması amaçlanmıştır.
2. GENEL BİLGİLER
Barsak helmintlerinin çoğu hafif veya orta dereceli gastroenterit ile ilişkili olabilmektedir. Bu helmintlerden ülkemizde en sık nematodlar ile karşılaşılmaktadır (2,15). Çengelli solucanlar ve S. stercoralis diğer nematodlara göre daha sık klinik bulgu vermektedirler (16). Strongiloidoz; S. stercoralis başta olmak üzere Strongyloides türlerinin yol açtığı, erişkin şeklinin insan ince barsak çeperinde, larvalarının ise çeşitli organlarda yerleşmesi ile ortaya çıkan bir nematod enfeksiyonudur (17). Strongyloides cinsi parazitler, nematod sınıfı, Strongyloidoidea üst ailesi ve Strongyloididae ailesinde yer almaktadır (18).
Helmintler (solucanlar) ; dokular ve organlar oluşturmak üzere özelleşmiş hücreleri olan, bilateral simetrili, kasları çizgisiz, eklemli, eklentiler bulunmayan ve hayvanların Annelida, Nematoda, Nematomorpha, Acanthocephala ve Plathelminthes şubelerinde bulunan canlılardır.
Nematodlar (yuvarlak ya da ipsi solucanlar) iki yandan simetrili, omurgasız hayvanlardır. Vücutları iki uca doğru incelmiş silindir şeklinde ve tek parçalıdır. Sindirim boruları tam olan bu canlıların vücut boşlukları vardır fakat mezotelyum ile örtülü olmaması nedeniyle gerçek bir vücut boşluğu (sölom) değildir. Vücudun dışını sert bir tabaka örtmüştür; bu tabakaya kütikül denir. Bunların eklemli bacakları veya uzayıp kısalabilen hortumları yoktur. Evrimlerinin hiçbir döneminde titrek kirpikçikleri bulunmayan bu hayvanların erkek ve dişileri ayrılmıştır. Yumurtaların
4
kabukları kapaksızdır ve yumurtada gelişen embriyonda kirpik ve çengel bulunmaz (16,17).
2.1. Nematodların Yapısal Özellikleri
Nematodların boyları çok değişkendir; birkaç milimetreden, bir veya birkaç metreye kadar farklı boylarda olabilirler. Genellikle erkekler dişilerden daha küçüktürler. Sindirim sistemleri ağızla başlar, anüsle sonlanır. Ağız ön uçta, anüs arka uca yakındır. Anüsten sonraki vücut kısmına kuyruk denir. Erkeklerin arka ucu spiral çengel şeklinde kıvrılmış ya da çan şeklinde genişlemiştir. Nematodların vücutlarının üzeri renksiz ve ölü bir tabaka olan kütikülle örtülüdür. Kütikül genellikle enine çizgilidir. Vücudun yanlarında kanat biçiminde genişleyebilir ve bu kanatlar boyunda ve kuyrukta ya da bütün vücut boyunca uzanır (16).
Kütikülün altında hipodermis vardır ve kütikül; canlı olan bu tabaka tarafından salgılanır. Bu tabaka incedir fakat yer yer kalınlaşabilir ve altındaki kas tabakasından geçerek vücut boşluğuna uzanır. Bu bölgelere kiriş denir. En belirginleri yan kirişlerdir. Orta karın veya orta sırt kirişleri daha siliktir. Kirişlerin sayısı, dizilişi, simetrisi, görünüşü ve içlerindeki çekirdek sayısı nematodlar arası ayırımı sağlar (16).
Hipodermisin altında kas tabakası bulunur. Kas hücreleri nematod boyunca dizilmişlerdir. Her kas hücresinde bir temel zar, bu zara bağlı kasılabilen kas telleri ve çekirdeği çeviren bir sarkoplazma bulunur. Kasılabilen teller yan duvarlara uzanabilir, bu gibi hücreler enli ve basıktırlar (16).
2.1.1. Nematodların Sindirim Sistemi
Sindirim sistemi nematod boyunca uzanan bir borudur. Ağızdan başlar, anüs ile sonlanır. Ağız deliği, ağız kapsülü, yutak, yemek borusu, barsak ve rektumdan
5
oluşmuştur. Ağız çoğunlukla ön uçta bulunur. Ağız dudaklarla çevrilebilir; ağız yanında papiller bulunur.
Bazı nematodlarda ağızdan sonra hemen yemek borusu başlar. Bazılarında ise ağız ile yemek borusu bir boşlukla ayrılmıştır, buna ağız boşluğu, yutak, yutak boşluğu ya da vestibül denir. Ağız boşluğu vücudun dışını örten ve her gömlek değiştirmede değişen kütikülle örtülüdür; bazı nematodlarda burada dişler bulunabilir. Bazen ise burası kalın bir kütikülle döşenmiştir, bu tarzdaki ağız boşluklarına ağız kapsülü denir (16).
Orta barsak; yemek borusundan bir boğumla ayrılır, geniştir. Düz veya dalgalı, bazen tespih biçiminde olabilir. Solucanın dış çeperine telimsi bir takım kordonla bağlıdır. Son barsak veya rektum kısa ve dar bir borudur, anüsle sona erer. Anüs karın yüzeyindedir, arka yüze yakın ya da arka uçtadır (16).
2.1.2. Nematodlarda Boşaltım Sistemi
Yan alanlarda bulunan kanallardan oluşur. Her alanda iki veya üç tanedir. İçlerinde saydam bir sıvı bulunur. Hepsi özefagus hizasında birleşir ve karın yüzeyine ortak bir delikle açılır (16).
2.1.3. Nematodlarda Sinir Sistemi
Yemek borusunu saran sinir halkasından önce altı sinir çıkar. Bunlardan ikisi yan alanlar içinde, dördü orta ve yan çizgiler arasındaki aralıkta uzanır ve ağız papillalarına varırlar. Arka sinirler sırt ve karında orta çizgi boyunca vücudun arkasına uzanırlar. Anüs bölgesinde de birkaç gangliyon vardır (16).
2.1.4. Nematodların Duyu Organları
Dudak, boyun ve erkeklerde genital papillalar; duyu organları olarak tanımlanırlar. Dudak ve boyun papillalarında ince sinir lifleri sonlanır ve bunlar kütikülü delerler. Boyun papillalarına ‘deirid’ denir. Bunlar boyun halkasına yakın
6
bir çift yan duyu organından oluşmuştur. Genital papillalar kütikülün altında şişkin birer organdan meydana gelmişlerdir.
Amfidler; duyu organı veya reseptör organı olarak kabul edilen, baş hizasında, yanlarda bulunan iki ufak cisimden oluşmuştur. Dışarıdan delik tarzında dairesel, helezon ve çeşitli şekillerde görülürler.
Bazı nematodların kuyruk ucunda ‘fasmid’ denen oluşumlar vardır ve bunlar erkeklerdeki genital papillalarla karıştırılmamalıdır. Fasmidler anüsün arkasında bulunan bir çift deliktir. Kabarık olabilirler, iç tarafa duyu kesesine giden çift borucukla bağlıdırlar (16).
2.1.5. Nematodlarda Üreme Sistemi
Erkek ve dişisi ayrılmıştır. Sahip oldukları sistemler içerisinde en gelişmiş olan sistemdir. Yaşamlarında erişkin, yumurta, dört larval dönem ve erişkin dönem olmak üzere 4 evre görülmektedir. Her larva evresinde eski kütikül atılarak bir sonraki evreye geçilir, hipodermis tarafından yeni kütikül salgılanır. Larva bu sırada büyümesini gerçekleştirir. Bu durum gömlek değiştirme olarak adlandırılır. L1, L2, L3 ve L4 olarak belirtilen larval evrelerden genellikle L3; parazitin erişkin dönemini içeren son konak için bulaştırıcı yani enfektif dönemdir (16).
İnsan vücudunda nematodların bazıları sadece erişkin dönemde, bir kısmı sadece larval dönemde, bir kısmı da hem erişkin hem larval dönemde bulunmaktadır (17).
2.1.5.1. Erkek Üreme Sistemi
Bazı basit nematod türleri hariç genellikle tek borudan oluşmuştur. Bu boru az çok kıvrımlar çizer ve üç farklı bölge gösterir; başlangıç kısmı ince ve uzundur, buna testis denir. Bundan sonraki kısım deferens kanaldır, bu kanal sonuna doğru genişleyerek meni kesesini yapar. Üçüncü kısım atar kanaldan ibarettir, atar kanal
7
rektumla beraber dışkılığa açılır. Spermatozoidler konik veya toparlaktırlar, amiboid hareket gösterirler. Bazı türlerde uzun kuyruklu spermatozoidler bulunabilir. Genellikle sert çiftleşme organları vardır. Bunlara spikül denir. Nematodların birçoğunda iki tane spikül vardır. Spiküllerin yanında kitinden yapılmış ufak bir organ daha bulunabilir, buna ‘gubernakulum’ denir (16).
2.1.5.2. Dişi Üreme Sistemi
Bu sistem çoğunlukla çifttir; iki yumurtalık, iki ovidükt, iki dölyatağı vardır. Bunlar bir tek vaginada birleşirler ve bu da vulvada sona erer. Yumurtalık uzun bir borudan ibarettir, bunu ovidükt ve dölyatağı takip eder, dölyatağı ile vagina arasında ovejektör bulunur (16).
2.1.6. Yaşayış
Nematodlar denizlerde, tuzlu sularda, karalarda, nemli yerlerde serbest olarak yaşarlar. Bitki, hayvan ve insanların paraziti olanlar vardır. İnsan paraziti olan nematodların erişkin şekilleri canlıların birçok organında (sindirim, solunum, dolaşım sistemi gibi) bulunabilirler. Parazit nematodlar konaklarının gıdaları ve sıvıları yardımıyla yaşarlar. Ömürleri türlere göre değişir (16).
2.1.7. Konak ve Evrim
Nematodlarda karşılıklı salınan feromonlarla erkek ve dişiler birbirini bulurlar. Çiftleştikten sonra yumurta hücresi döllenir ve etrafı bir vitellüs ile kaplanır. Yumurta hücresi ikiye bölünerek embriyo gelişir. Genç embriyo fasulyeye benzer, karın yüzü çukur tarafıdır. Embriyo büyüdükçe sırt tarafı daha konveks, karın tarafı daha çukur olur. Baş belirir ve kuyruk incelir. Embriyo daha büyüyünce kendi etrafında kıvrılarak ‘8‘ şeklini alır. Bu gelişim türe göre ya uterusta ya yumurtladıktan sonra dışarıda, ya da bir kısmı uterusta bir kısmı dışarıda olur.
8
Embriyo birkaç defa gömlek değiştirip larva dönemlerinden geçerek erişkin hale gelir. Birçok parazit nematodta evrimin bitirilmesi için tek bir konak yeterlidir (16). 2.2. Strongiloidoz
Strongyloides türlerince oluşturulan, genellikle asemptomatik ya da hafif seyirli olan fakat bağışıklığı baskılanmış kişilerde şiddetli seyredebilen hatta ölümcül olabilen bir hastalıktır (20,21). Strongyloides’in pek çok türü hayvanları enfekte etmesine karşın, insanda enfeksiyon yapan temelde iki farklı türü bulunmaktadır. Bunlardan S. stercoralis en yaygın olarak görülen türüdür. Bundan anatomik olarak farklılıklar gösteren diğer türü olan S. fuelleborni’ye ise sporadik olarak rastlanmaktadır(2, 22).S. fuelleborni’nin alttürü olan S. fuelleborni kelly’i ile serbest yaşayan erişkin parazitlerin morfolojik olarak farklı olduğu gösterilmiştir. Bu alt türe Papua Yeni Gine’nin bir bölgesinde rastlanmıştır (22,23). Genellikle üç hafta ile bir yaş arası çocuklarda “swollen belly syndrome (şişmiş karın sendromu)” olarak adlandırılan ve tedavi edilmez ise fatal seyreden enfeksiyona yol açar (24). Strongyloides fuelleborni larvalarının morfolojik olarak S. stercoralis larvalarından farklı oldukları ve dışkıda S. fuelleborni larvalarının görülmediği, sadece yumurtalarının görülebildiği bildirilmiştir(20).
Strongyloides stercoralis, dünya çapında tahmini olarak 30-100 milyon insanı enfekte eden bir barsak nematodudur (25). Hastalık ilk olarak 1876 yılında Vietnam’da görevli, ciddi diyaresi olan Fransız askerlerin dışkısında rapor edilmiştir ve yıllarca ‘Cochin-China diaresi’ olarak tanımlanmıştır. Bu parazitin karmaşık yaşam döngüsünün tanımlanması parazitin bulunmasından 50 yıl sonra olmuştur (26). Bu parazitin yurdumuzda varlığı ise ilk kez Dr. Reşat Rıza tarafından Balkan Savaşları sırasında Makedonya’da manastırdaki askerler arasında tespit edilmiştir (16). Hijyenik koşulların az olduğu, sıcak ve nemli bölgelerde daha sık
9
görülmektedir (27). Genellikle subtropik ve tropik ülkelerde oluşmasına rağmen uygun koşulların bulunduğu ılıman ülkelerde de görülebilir (25). Ayrıca, strongiloidoza göç ve seyahate bağlı olarak endemik olmayan ülkelerde de rastlanmaktadır. Enfeksiyon seyahat edenlerden çok göçmenlerde daha sık görülmektedir (28). Başlıca risk faktörleri İnsan T-Hücre Lenfositotropik virüsü tip 1 (HTLV-1) enfeksiyonu, malnütrisyon, kronik obstrüktif akciğer hastalığı, diabetes mellitus, kronik böbrek yetmezliği ve emzirmedir (29,30).
Parazitin konak içinde çoğalma yeteneğine bağlı olarak, büyük çoğunluğu hastalarda asemptomatik olarak bulunur. Bağışıklığı yetersiz hastalarda ise asemptomatik formdan larvanın yayılması sonucunda oluşan hiperenfeksiyon veya dissemine enfeksiyona kadar değişen birçok klinik tablo görülebilir (2,30,31). Parazit sayısının genelde düşük olması ve larva atılımının düzensiz olması nedeniyle tanı koymak oldukça güçtür(20,32).
2.3. Epidemiyoloji
Tüm dünyada başlıca tropikal ve subtropikal iklimler olmak üzere ılıman iklimlerde de görülmektedir. Gelişmekte olan ülkelerde oldukça yaygın olup Sahra altı Afrika, Latin Amerika, Güneydoğu Asya, Güneydoğu Amerika ülkelerinde endemik olarak karşımıza çıkabilir. Yağışlı, toprağı humuslu, 20°C’nin üstündeki sıcaklıkta ve uzun süre nemli olan yerlerde görülmektedir. En çok kerpiç tuğla ve kiremit yapımı olan yerlerde, maden ocaklarında, sulu tarım yapılan yerlerde, derelerde ve bataklık kıyılarında çıplak ayakla çalışan insanların enfekte olduğu bildirilmiştir (18,22,33).
Tropikal ve subtropikal ülkelerde S. stercoralis enfeksiyonu, çalışmalarda kullanılan yöntemlerin duyarlılığına göre değişmekle birlikte %10-50 arasındadır. Schar ve arkadaşlarının yaptığı bir derlemede toplum kökenli verilerde prevalans
10
oranları Afrika Kuzey Gana’da %11.6, Nijerya’da %48.1, Güney Afrika’da %27.5, Tayland’da %23.7, Japonya’da %18.7, İspanya’da %14.8, Çin’de %14, Brezilyada %13, Meksika’da %1.6, Türkiye’de %0.6 olarak bildirilmiştir (33).
Enfeksiyon yetişkinlerde çocuklara, erkeklerde kızlara, beyaz ırkta siyah ırka göre daha sık görülmektedir. Tayland’daki yetişkin gönüllülerde prevalans %9,7 ve okul çocuklarında %2 olarak bildirilmiştir(33).
Strongyloides stercoralis enfeksiyonları için HIV-AIDS hastaları, HTLV-1 hastaları, alkolikler, diyareli hastalar, steroit kullanan bağışıklığı baskılanmış hastalar yüksek risk grubundadır. Sosyoekomik düzeyin düşük olması, mental gerilik ve kötü hijyen koşulları risk faktörleri arasındadır.
Ülkemizde S. stercoralis, başta bağışıklığı baskılanmış kişilerde olmak üzere, sporadik olgular şeklinde bildirilmektedir. En yaygın olarak Akdeniz ve Karadeniz bölgelerinde olmak üzere Marmara, İç Anadolu ve Doğu Anadolu bölgelerinde rastlanmıştır (22). Ülkemizde S. stercoralis prevalansı %0,2 ile %4,4 arasında değişmektedir. Bu oranlar sırasıyla Adana ve Samsun illerimizde saptanmıştır (34,35).
2.4. Strongyloides stercoralis ve özellikleri 2.4.1. Morfoloji
Strongyloides stercoralis’in doğada serbest yaşayan ve parazitik şekilleri mevcut olup, bu şekiller morfolojik olarak farklıdırlar. Parazitik olanlar yaklaşık 2x0,05 mm, serbest yaşayanlar ise yaklaşık 1x0,05 mm kadardır ve serbest yaşayan dişiler, erkeklerden daha büyüktür. S. stercoralis’in sadece dişileri parazitiktir ve dişiler partogenik olarak üremektedir yani üremek için erkek cinsiyete gerek duymazlar. Serbest yaşayanların erkek ve dişileri mevcuttur. Serbest yaşayan dişiler, parazitik dişilerden daha kısa fakat daha geniştir. Serbest yaşayan erkekler, 0,7x0,04
11
mm boyutlarında, arka uçları kıvrık ve uç kısımda iki eşit uzunlukta spikül bulunmaktadır. Parazitik dişilerde filariform, serbest yaşayan erişkinlerde rabditiform özefagus bulunmaktadır. Partogenik olarak oluşan yumurtalar 50-58x30-34 µm boyutlarında olup saydam kabuklu, oval, ince çeperlidir. Genellikle barsakta açılırlar ve içlerinden rabditiform larva çıkmaktadır. Konağın dışkı örneklerinde S. stercoralis’in sadece bu larval dönemi görülmektedir. Serbest yaşayan dişilerin yumurtaları oval yaklaşık 45x70 µm boyutlarındadır. Bu yumurtalar bazen yumurtlanmadan önce açıldıkları için parazit vivipar özellik taşımaktadır. Rabditiform larvalar 300-380 µm, filariform larvalar 490-630 µm uzunluktadır. Strongyloides’lerin bukkal kaviteleri kısa olup özefagusları vücut uzunluğunun 1/3’ü kadardır. Enfektif larvalarının kuyruk kısımlarındaki çatallanma; diğer nematodlarla kontamine olabilecek dışkı örneklerinin ayırımında, Strongyloides için önemli bir tanısal özelliktir. Parazitin dişileri çift overlidir. Vulva; parazitik formda vücut uzunluğunun 2/3’lük kısmında, serbest şekillerde ise orta bölümde yer almaktadır. Tür ayırımında etkenin ağız yapısı, overlerin yerleşimi, konak dışkısında parazitin geçtiği evre (yumurta, larva veya her ikisi) ve perivulval lateral kütikülün morfolojisi gibi özellikler gözönünde bulundurulmaktadır (22,36-38).
12
Şekil 1: Strongyloides stercoralis Morfolojisi. A. Parazitik dişi B. Serbest yaşayan dişi C. Serbest yaşayan erkek D. Rabditiform larva E. Filariform larva F. Olgun larva içeren yumurta a: anüs, c: kloaka, e: özefagus, e.b: özefagiyal bulb, e.c: ekskratuvar hücre, ej.d: ejekulatuvar duktus, e.p: ekskratuvar por, g: genital rudiment, i: barsak, m: ağız, n.r: sinir halkası, ov.a: anterior ovum, ov.p: posterior ovum, pr.a.p: preanal papilla, po.a.p: postanal papilla, r: rektum, s: spikül, s.v: seminal vezikül, t: testis, u: uterus, v: vulva (22).
13 2.5. Yaşam Döngüsü
Strongyloides stercoralis’in yaşam döngüsü diğer helmintlerden oldukça farklı ve karmaşık özellikler göstermektedir. Yaşamında serbest ve parazitik nesiller bulunur fakat bu iki farklı yaşam tam olarak birbirini izlememektedir. Bir türün gelişimde ya parazitik döngü, ya serbest yaşam döngüsü ya da iki döngü birlikte görülmektedir.
2.5.1. Parazitik Döngü
Toprakta bulunan filariform (strongyloid, enfektif) yani üçüncü dönem larvalar (L3) deri yoluyla vücuda girmekte ve kan veya lenf dolaşımıyla portal dolaşıma, sağ kalbe oradan da akciğerlere gitmektedirler. Nadiren oral yolla alınırlar. Oral yolla alınan larva ağız ve özefagus mukozasından girerek sistemik dolaşıma katılır. Buradan sonraki yol deri yolu gibidir. Akciğerlerde bir süre kalan larvalar gömlek değiştirerek gelişmektedirler. Bu larvalar akciğerlerde pulmoner kapillerlerden alveolar boşluklara ve buradan trakeaya varmaktadırlar. Trakeadan sonra glottis ve farinkse, buradan da yutularak duedonum ve üst jejunuma ulaşmaktadırlar. İnce barsak mukozasına yerleşen L4 larvalar burada hızla büyüyerek iki gömlek değiştirmekte ve 17 günde erişkin dişiyi oluşturmaktadırlar. Parazitik dişiler, duodenum ve jejunumun Lieberkühn kriptlerinin enterositleri arasındaki tünellerde yerleşip olgunlaşarak partogenezle yumurta üretmektedirler. Yumurta üretimi enfeksiyonun ilk üçüncü ve sekizinci haftalarında en yüksek seviyelerine ulaşmaktadır. Bu yumurtalardan enfektif olmayan, rabditiform larvalar (L1 larvalar) serbestleşmektedir. Rabditiform larvalar iki farklı evrim geçirebilmektedirler. Bu larvalar ya konak dışkısıyla atılarak serbest yaşayan erişkinlere dönüşmekte (heterogonik döngü) ya da iki kez gömlek değiştirerek (homogonik döngü) otoenfeksiyonlara neden olan enfektif filariform larvalara dönüşmektedirler.
14
Homogonik döngüde, L1 larvalar hızla enfektif larva haline dönmektedir. Bu olay 27°C’de yaklaşık 12-24 saat gibi kısa bir sürede gerçekleşmektedir (19,20,22,32,40). 2.5.2. Serbest Yaşam Döngüsü
Dışkıyla atılan rabditiform larvalar dört kez gömlek değiştirerek serbest yaşayan erişkinlere (erkek ya da dişi) dönüşmektedir. Parazitin doğada serbest gelişiminde ideal ısı 20-30°C’dir ve bu ısıda L4 larvalar 24 saatte erişkin hale gelmektedir. Larvanın geliştiği toprağın yapısı, pH’sı ve sıcaklığı larvanın hangi yönde gelişeceğinde rol oynamaktadır. Serbest yaşayan erkek ve dişi uygun koşullarda toprakta çiftleşmektedir. Dişinin yumurtladığı döllenmiş yumurtadan rabditiform larvalar (L1) çıkmakta ve toprakta evrimini tamamlamaktadır. Bazen dişi yumurtlamadan önce, yumurta dişinin vücudunda açılarak larvalar dışarı çıkmaktadır. Sonuçta; ya üç gömlek değiştirerek enfektif, filariform larva şekline dönüşmekte ya da tekrar serbest yaşayan erişkin şekillere dönüşmektedir. İdeal sıcaklıkta gelişme heterogonik ağırlıktayken, ısının artması veya azalması durumunda gelişim homogonik yöne kaymaktadır. (19,21,22,39,40).
15
16 2.6. Bulaş Yolları
Strongiloidozda bulaş en sık toprakta bulunan enfektif larvaların (filariform, strongyloid, L3) özellikle çıplak ayakla gezenlerde ayak derisinden vücuda girmesi ile oluşmaktadır. Ayrıca enfekte olmuş kişide otoenfeksiyon meydana gelebilmektedir. Otoenfeksiyonda barsak içerisinde (internal otoenfeksiyon) ya da perianal bölgedeki dışkıda (eksternal otoenfeksiyon) bulunan enfektif olmayan rabditiform larvaların, enfektif olan strongyloid şekle dönmesi ve takiben bölgedeki mukoza ya da deriden tekrar kan damarlarına ulaşması ile oluşmaktadır. Eksternal otoenfeksiyon, özellikle kronik konstipasyon gibi durumlarda dışkının dolasıyla rabditiform larvaların barsaklarda uzun süre boyunca kalması sonucunda enfektif larvalara dönüşmesi ile oluşmaktadır. Eksternal otoenfeksiyon durumunda dışkıda bulunan bu enfektif larvaların fekal oral alım sonucu ağız mukozasından vücuda girmesi de mümkün görülmektedir (22,40-42).
2.7. Klinik Belirtiler
Strongyloides stercoralis immünkompetan ve bağışıklığı baskılanmış kişilerde farklı klinik tablolara yol açabilmektedir (43,44).
Akut strongiloidozun klinik belirtileri; deriden ince bağırsağa uzanan larvanın göç yolu ile ilişkilendirilebilir. Enfekte bireylerde larvanın deriye girişi sonrası ciltte gelişen irritasyonun ardından trakeal irritasyon ya da kuru öksürük, sonuçta ishal, kabızlık, karın ağrısı, bulantı gibi gastrointestinal semptomlar gelişebilmektedir. Gastrointestinal semptomlar enfeksiyondan yaklaşık iki hafta sonra başlamakta ve 3-4 hafta sonra da dışkıda larvalar saptanabilmektedir (3-43-4).
Kronik strongiloidoz, immünkompetan kişilerde sıklıkla asemptomatik enfeksiyonlara neden olmaktadır. Enfekte kişilerin %75’inde periferik eozinofili veya yüksek IgE düzeyleri olabilir; bu nedenle, strongiloidoz, endemik bölgelere
17
seyahat edenler veya göçmenlerde dirençli eozinofili durumlarında ayırıcı tanıda düşünülmelidir (45-48). S. stercoralis enfeksiyonu immünkompetan kişilerde genellikle asemptomatik ya da akciğer, gastrointestinal sistem (GİS) ve cildin hafif bulguları ile seyretmektedir. Fakat bağışıklığı baskılanmış olgularda dissemine enfeksiyona neden olarak hayatı tehdit edici hiperenfeksiyon sendromuna yol açabilmektedir(49).
2.7.1. Derideki Dönem
Larvalar deriye girerken genellikle hiçbir bulgu vermemektedir. Bazı olgularda mekanik-travmatik ve toksik-allerjik etkiyle kızarıklık, kaşıntı, şişkinlik gibi ciddi olmayan deri reaksiyonları görülebilmektedir. Lezyonun şiddeti, penetre olan larva sayısı ile ilişkili olabilmektedir. Larvanın girdiği bölgede küçük eritematöz papül, şiddetli kaşıntı, ürtiker ve peteşi oluşabilir ve sonrasında çizgisel ürtiker, enflamasyon oluşur ve buna ‘larva currens’ denir. Lezyonlar tipik olarak çok hızlı olup, bazı vakalarda 10 cm/saat hıza varabilmektedirler ve genellikle 12-18 saatte kaybolmaktadırlar. Tekrarlayan enfeksiyonlar ile oluşan allerjik cevap, parazitin yaşam döngüsünü tamamlamasını engellemekte ve larvaların deri göçü sınırlanabilmektedir(22,40,50).
2.7.2. Akciğer Dönemi
Klinik tablo parazitin sayısına göre değişmektedir. Fazla sayıda parazitin varlığı ateşin yüksek seyretmesine neden olabilmektedir. Larvaların akciğerlerden geçişleri sırasında kanamalara bağlı hemoptizi, öksürük, göğüs bölgesinde yanma görülebilmektedir. Eozinofilden zengin lökosit infiltrasyonu ve larvaların mukozaya invazyonundan kaynaklanan ödeme neden olabilir (41).
Strongyloides stercoralis’in pulmoner belirtileri değişkendir. Eozinofilinin eşlik ettiği pulmoner infiltratlar (Loeffler sendromu), pulmoner infiltrasyon olmadan
18
ortaya çıkan astım kliniği, alveolar hemorajinin neden olduğu hemoptizi ve özellikle kortikosteroit kullanan ve bağışıklığı baskılanmış hastalarda ortaya çıkan hiperenfeksiyon sendromu şeklinde görülebilmektedir (51). Loeffler sendromu, S. stercoralis, Ascaris lumbricoides, Toxocara canis gibi paraziter etkenler, aspergillus gibi mantarlar, penisilin, paraaminosalisilik asit ve hidralazin gibi ilaçlar ile oluşabilmektedir (52).
2.7.3. Barsak Dönemi
Barsakta yerleşen erişkinlerin neden olduğu klinik tablo genellikle belirsiz semptom ya da hafif diyareler şeklinde görülmektedir (22). Erişkin dişi parazitler GİS’de olgunluğa ulaştığı zaman, abdominal belirti ve bulgular görülebilmektedir. Yapılan kontrollü bir çalışmada S. stercoralis ile enfekte bireylerde hazımsızlık, kramp tarzında karın ağrısı, malabsorbsiyona neden olan ishal ve kilo kaybı anlamlı olarak daha sık saptanmıştır (26).
Gastrointestinal strongiloidoz ile ilişkili radyolojik bulgular düzensiz mukozal kıvrımlar ile seyreden duedonal ödem, ülserler ve daralmalar şeklinde görülmektedir. Eozinofili, spesifik ve non-spesifik Ig E düzeylerinin yükselmesi sık görülen laboratuvar bulgularıdır(53).
Hastalığın hafif seyrettiği durumlarda bulantı, kusma, epigastriumda ağrı görülmektedir. İshal, nadiren kabızlık olabilmektedir. İshal günde 5-6 kez tenezm ile birlikte ve ağrılı olmaktadır. Dışkı az miktarda, bazen mukuslu, nadiren kanlı olabilmekte, dışkı incelemesinde lökositler görülebilmektedir (41).
Artan larval yük sonucunda intestinal obstrüksiyon, ileus, hemodinamik olarak anlamlı gastrointestinal kanama ve kronik intestinal belirtilerin kötüleşmesi gibi komplikasyonlar meydana gelebilmektedir (44,54,55).
19
2.8.Hiperenfeksiyon Sendromu ve Dissemine Strongiloidoz
Bu iki tablo genellikle bağışıklığı baskılanmış, kronik strongiloidozlu hastalarda otoenfeksiyon sonucu barsak içinde (nedeni bilinmeyen bir tetik mekanizması ile) filariform larvalara dönüşen rabditiform larvaların sayısının aşırı artmasına bağlı olarak barsak ya da barsak dışına larva göçü sonucu ortaya çıkmaktadır. Hiperenfeksiyon sendromu (komplike olmayan strongiloidoz) artan larvaların başta akciğerler olmak üzere barsak dışında görülmesi iken, dissemine strongiloidoz (komplike strongiloidoz) tablosu ise larvaların beyin gibi ektopik bölgelerde (karaciğer, kalp, pankreas, böbrek gibi) de görülmesi olarak tanımlanmaktadır (22,26).
Hiperenfeksiyona zemin hazırlayan bazı risk faktörleri mevcuttur. Bunlar arasında; uzun süreli steroit kullanımı, lenfoma, lösemi ve lepromatöz lepra tedavisi alan hastalar, başta böbrek ve kemik iliği olmak üzere transplantasyon yapılan hastalar, HTLV-1 ve HIV enfeksiyonları, hipogamaglobulinemi, malnutrisyon, diyabet ve kronik böbrek yetmezliği gibi durumlar sayılabilir (18,44). Hiperenfeksiyon sendromlu hastalarda genellikle ateş yüksekliği, gastrointestinal semptomlar, dispne, ‘‘wheezing’’, hemoptizi, öksürük ve kilo kaybı olabilmektedir. Bu hastalarda eozinofili görülmeyebilir (22). Hiperenfeksiyon sendromu ve dissemine strongiloidoz tablolarında mukozanın tamamen hasarlandığı, ülserasyonların ve paralitik ileusun oluştuğu gözlenmektedir. Hareket eden larvaların barsak florasını bozması sonucu bakteriyel ve fungal enfeksiyonlar oluşabilmektedir. Enfektif larvaların dış yüzeyini kaplayan enterik bakterilerin larvalarla taşınması sonucu sepsis, pnömoni, menenjit ve akciğerler de dâhil vücudun birçok yerinde yaygın bakteriyel ve fungal enfeksiyonlar meydana gelebilmektedir. Masif sekonder
20
bakteriyel enfeksiyonlar, hiperenfeksiyon sendromlu hastalarda genellikle ölümle sonuçlanmaktadır (2,26,56).
2.9 Tanı
Strongiloidozun kesin tanısı genellikle dışkıda larvaların saptanması ile olur. Ancak komplike olmayan strongiloidoz olgularının çoğunda, parazit yükü genellikle çok düşük ve larva atılımı minimal düzeyde olmaktadır (2,12,26,49,56,57).
2.9.1. Eozinofili
Diğer kronik barsak paraziti enfeksiyonlarıyla karşılaştırıldığında S. stercoralis enfeksiyonunda eozinofili daha sıklıkla görülmektedir. Erişkin dişi parazitlerin barsak lümeninde değil submukozada yaşaması sebebiyle eozinofilik tepkinin daha yüksek olmasının bunun nedeni olabileceği düşünülmektedir. Bu durumda eozinofili, özellikle asemptomatik bireylerde kronik strongiloidoz taramasında potansiyel bir gösterge olarak düşünülebilir. Ayrıca, kronik strongiloidozda eozinofili aralıklarla meydana gelebilmektedir (58,59).
2.9.2. Dışkı İncelemeleri
Olguların üçte ikisinden fazlasında, gram dışkıda ≤25 larva bulunmaktadır. Gram dışkıdaki larva sayısı 25’ten az ise tanı yanıltıcıdır veya çoğunlukla gözden kaçmaktadır (2,56). Tek bir dışkı incelemesiyle, olguların %70 kadarında larvaların saptanamadığı gösterilmiştir. Tekrarlayan dışkı incelemeleriyle parazit yakalama şansı artmaktadır. Bazı çalışmalarda, üç dışkı incelemesi ile tanısal duyarlılığın %50’ye kadar arttığı bildirilmiştir. Yedi seri dışkı incelemesiyle parazite rastlama olasılığı %100’e yaklaşmaktadır (60,61).
Dışkı örneklerinde larva ayırt etmek için bir takım yöntemler kullanılmaktadır. Bunlar; dışkının salin–lugol iyot boyasıyla direkt bakısı, Baermann konsantrasyon yöntemi, formalin-etil asetat konsantrasyon yöntemi, Harada-Mori
21
filtre kağıdı ile kültür yöntemi ve agar plakta kültür (APC) yöntemi olarak sayılabilir (40,43,62). Bu yöntemler basit dışkı bakısından çok daha duyarlı olmalarına karşın klinik parazitoloji laboratuvarlarında nadiren standart olarak uygulanmaktadırlar (63).
Baermann yöntemi ilk olarak 1917 yılında tanımlanmış olup, ucuz ve basit bir tekniktir. Dışkı, huni içerisine yerleştirilmiş bir süzgeç üzerinde uzanan kalın bir kumaş üzerine konulur, huni klemplenmiş tüpe bağlanır ve ılık suyla doldurulur. Bir saatlik enkübasyondan sonra larvalar sürünerek fekal süspansiyondan dışarı çıkar ve suya hareket ederler. Buradan santrifüjle toplanabilirler (58).
Harada-Mori tekniği, Strongyloides larvalarının konsantre hale getirilmesi için, bu larvaların sudaki tropizmlerini kullanan filtre kağıdı kültür yöntemidir. Özetle, taze dışkılar suyla ıslatılmış filtre kağıdının üzerine konur ve 10 gün boyunca 30°C enkübe edilir. Su sedimenti her gün canlı larvaların aranması için taranır (58).
Agar plakta kültür yönteminde, dışkı örneği bir besleyici agar plak ( %1,5 agar, %1 pepton, %0,5 NaCl ) üzerine yerleştirilir ve en az iki gün oda ısında enkübe edildikten sonra direkt mikroskopta hareketli larvalar görülebilmektedir ya da agarın üst yüzeyinde larvalar bakteri taşırlarken karakteristik izler oluşturmaktadır (2,22).
Bin üçyüzden fazla dışkı örneğinin incelendiği bir çalışmada, dört farklı yöntem (direkt dışkı bakısı, formalin-etil asetat konsantrasyon yöntemi, Harada-Mori yöntemi ve agar plak kültür yöntemi) karşılaştırılmış ve APC yönteminin sensitivitesinin %96 olduğu saptanmıştır (64). Bir başka çalışmada APC yönteminin, direkt dışkı bakısından 4,4 kat daha üstün olduğu bulunmuştur (65). Bu yöntem diğer yöntemlere göre hassas olmakla birlikte zahmetli, zaman alıcı, pahalı ve karmaşık bir yöntemdir (2).
22
Larvalar aynı zamanda tükrük, duodenal aspirat, gastrik biyopsi, servikal sürüntü veya beyin omurilik sıvısı (BOS) gibi örneklerde de bulunabilmektedir (41).
Bazı çalışmalarda duodenal aspirat incelemesinin çok hassas olduğunun belirtilmesine rağmen, bu invaziv yöntem sadece hiperenfeksiyon sendromundan şüphelenilen ve hızlı tanı konulması gereken bağışıklığı yetersiz çocuklar için önerilmektedir (56,66). Duodenal materyallerin örneklenmesi için kullanılan string kapsül testinin (enterotest) S. stercoralis'in tanısı için uygun bir yöntem olduğu gösterilmiştir. Kaplanmış jelatin kapsül içine sarılmış bir naylon iplik konulur ve bu kapsül yutturulur. Kapsül mide ve duodenuma gider ve sonra safra ile boyanmış duodenal mukus ile geri çekilir. Goka ve arkadaşları tarafından, gastrointestinal semptomları olan bir grup hastada dışkı bakısı ve string kapsül testi ile elde edilmiş duodenal sıvı incelemesi karşılaştırılmıştır ve duodenal sıvı incelemesinin duyarlılığı daha yüksek saptanmıştır (67).
Dissemine enfeksiyonlarda parazit yükünün fazla olması nedeniyle hiperenfeksiyon sendromlu hastalarda S. stercoralis larvalarının saptanması daha kolaydır. Dissemine strongiloidozda, balgam, bronkoalveolar lavaj (BAL) sıvısı, bronşiyal yıkama ve fırçalamalar, akciğer biyopsileri veya plevra sıvı örneklerinde Gram, Papanicolaou veya asit dirençli (Auramine O ve Kinyoun) boya yöntemleri kullanılarak boyanmış olan larvalara rastlanabilmektedir (2).
2.9.3. Endoskopi
Strongiloidoz GİS’in herhangi bir bölümünü tutabilir. En sık görülen endoskopik oluşumlar ülserasyon, kanama, mukozal ödem, kalın duodenal kıvrımlar veya mukozada kahverengi renk değişikliğidir. Kolonda larvaların kendilerini kolonik mukozaya gömdüklerini gösteren püstül benzeri lezyonların olduğu
23
bildirilmiştir. Kolonik mukozadaki diğer bulgular haustranın kaybı, dar aftoid ülserasyonlar, sarımsı beyaz nodüller, eritrem veya ülserasyonlardır (58,68).
2.9.4. Tanısal Radyoloji
Patognomonik radyolojik bulgu bulunmamaktadır. Bulgular çok geniş bir spektrumda tanımlanmıştır. Gastrointestinal sistemin normal görünümünden, ince barsak mukozası ödemine ve ciddi dilatasyona ya da hiperenfeksiyon sendromlu hastada parezi veya striktür gelişmiş ince barsak mukozasının kalın görüntüsüne kadar değişen birçok belirti bildirilmiştir. Ağır enfeksiyonlu olgularda baryumla yapılan incelemelerde duodenal dilatasyon veya darlık da tanımlanmıştır (58,69-71).
Akciğer tutulumunda; intersitisyel ya da alveolar, diffüz ya da fokal, bilateral ya da tek taraflı gibi farklı görünümde pulmoner infiltrasyonlar saptanabilir. Nadiren kavitasyon veya abse formasyonları bildirilmiştir (2).
2.9.5. İntradermal Deri Testleri
Farklı somatik ve boşaltım/salgı antijenlerine karşı derideki ani hipersensitivite reaksiyonunun strongiloidoz tanısı için uygun bir test olduğu rapor edilmiştir. Fakat diğer nematod enfeksiyonlarıyla çapraz reaksiyon göstermesi ve tedaviden sonra pozitif deri testi reaksiyonun görülmesi nedeniyle rutin tanı için uygun bir test değildir (58,72,73).
Ancak, bağışıklığı baskılanmış kişilerde özellikle HTLV-1 ile enfekte olan hastalarda testin duyarlılığı düşüktür (74).
2.9.6. Seroloji
Tanı için birden fazla dışkı örneği incelemesi gerekmektedir. Tek dışkı incelemesiyle larvaların saptanamaması, enfeksiyon varlığını dışlayamaz. Bu nedenle, S. stercoralis için son derece özgül ve etkin, hatta birden fazla helmint enfeksiyonunda kullanılabilme potansiyeline sahip serolojik tanı testine büyük
24
ihtiyaç vardır. Ayrıca strongiloidoz açısından riskli kişilerde immünsüpresyonun başlangıcından önce ya da kortikosteroit verilmeden önce, kronik latent enfeksiyonun gösterilmesi amacıyla serolojik testlerin önemi büyüktür. Bu nedenle duyarlılığı ve özgüllüğü yüksek serolojik testlerin uygulanması gerekmektedir (2,26,56).
Seroimmünolojik testler arasında, larva ekstraktlarını içeren deri testi, tespit edilmiş larva ile indirekt floresan testi (IFAT), spesifik IgE radioallerjosorbent test ve jelatin partikül aglütinasyon testi gibi testler mevcuttur ve bu testlerin başarısı sınırlıdır (2).
İndirekt immünofluoresans mikroskopisi (IFAT) temeline dayanan partikül aglütinasyon testi, parazitolojik testlerden daha yüksek duyarlılıkla kullanılır olmuştur. Son yıllarda Boscolo ve arkadaşları, doğru tanı koyma kapasitesi yüksek ve antikor titre eşiği ≥1:20 (%97 duyarlılık ve %98 özgüllük) olan, larvaların hepsini kullanan bir IFAT testini geliştirmiştir. Bu tekniğin temel dezavantajı, en uygun floresansın canlı parazitler kullanıldığında saptanması nedeniyle, canlı enfektif larvaların kullanımını gerektirmesidir. Bu nedenle testin iyi bir performans göstermesi için çok miktarda larva bulunması gerekmektedir. Bunun üstesinden gelmek için jelatin partikül aglütinasyon testi geliştirilmiştir ve bu testin %81 duyarlılık ve %74 özgüllüğe sahip olduğunu bildirilmiştir.
İmmünoblot analizinin S. stercoralis ve S. ratti’nin (S. ratti, farelerin GİS parazitidir ve insan paraziti olan S. stercoralis’in laboratuvar analoğudur) immünodominant antijenine özellikle 41-kDa veya 26-kDa larval bileşenine karşı oluşan IgG antikorlarının değerlendirilmesinde duyarlılığı yüksek bulunmuştur.
Strongiloidoz tanısı amacıyla birçok enzyme-linked immünosorbent testi (ELISA) geliştirilmiştir. Filariform larvaların basit antijenik ekstraktlarından bazıları
25
S. stercoralis’ten ve diğerleri S. venezuelensis veya S. ratti’den elde edilip, bunlardan birçok ‘‘in-house’’ ELISA yapılmıştır. Günümüzde Bordier-ELISA ve IVD-ELISA olmak üzere iki ticari kit bulunmaktadır. Bu testlerin duyarlılığının %73-100 arasında olduğu gösterilmiştir. Ancak, bağışıklığı baskılanmış hastalarda ELISA’nın duyarlılığı oldukça düşüktür. Bu durum, bağışıklığı baskılanmış kişilerde antikor üretiminin az olmasıyla açıklanmaktadır (58,75,76).
İranlı araştırmacılar S. stercoralis tanısında ELISA ve IFAT yöntemlerini karşılaştırmış ve ELISA’nın (%93,5) , IFAT’a (%87) göre daha duyarlı olduğunu belirtmişlerdir. Diğer nematod türleriyle çapraz reaksiyonlar bu testlerin temel dezavantajlarındandır. Bu durum özellikle göçmenlerdeki sonuçların değerlendirilmesinde önemlidir. Çünkü göçmenler yıllarca diğer helmint enfeksiyonlarına maruz kalabilir ve bu kişilerin, seyahat edenlerle karşılaştırıldığında diğer nematod enfeksiyonlarına sahip olma riski daha yüksektir (58,77,78).
Bazı araştırmacılar, belirli nematod ekstraktıyla serumun önceden enkübe edilmelerini sağlayarak ELISA’yı modifiye etmişlerdir. Filaryal parazitler veya Necator americanus ile enfekte bireylerde, Onchocerca gutturosa’nın ekstraktıyla serum absorbsiyonunun, indirekt ELISA’da elde edilen yanlış pozitiflik oranını yarıdan fazla azalttığı gösterilmiştir. ELISA’nın özgüllüğünü ve duyarlılığını artırabilmek için, serum örneğinin O. gutturosa’nın fosfat tamponlu salin çözünür ekstraktıyla enkübe edilmesi önerilmektedir (58,79). ELISA ve diğer serolojik testlerin S. stercoralis tanısındaki performansını daha iyi değerlendirmek için ELISA’nın, endemik ülkelerdeki popülasyonlar üzerinde test edilmesi gerekmektedir. Endemik yerlerde diğer nematod enfeksiyonlarıyla çapraz reaksiyon nedeniyle duyarlılık ve bunun sonuncunda pozitif prediktif değer düşebilmektedir. Örneğin, yapılan bir çalışmada, kancalı kurt enfeksiyonu olduğu bilinen kişilerin
26
%77'sinde ELISA ile S. stercoralis pozitif saptanmıştır (58,80). S. stercoralis enfeksiyonunun tanısı için altın standart bir testin olmaması zorluk yaratmaktadır. Kanada'dan yeni gelen Asyalı mülteciler üzerinde yapılan bir çalışmada, dışkı incelemesi altın standart olarak kullandığında serolojik testin %95 duyarlılıkta ve %29 özgüllükte olduğu gösterilmiştir (81). Strongiloidoz tanısında ELISA’nın değerlendirilmesindeki diğer bir problem, antijenlerin çoğunlukla iyi tanımlanmaması ve laboratuvar protokollerinin çok değişken olmasıdır. Larvanın basit antijenik ekstraktlarına dayanan ELISA testlerinin kullanımının diğer bir dezavantajı da, testte kullanılması amacıyla antijen üretimi için çok fazla sayıda larva gerekmesidir. IFAT’da olduğu gibi basit antijen temelli ELISA’lar geniş çapta kullanım için uygun değildir(58).
Strongiloidozun serolojik tanısını geliştirme çalışmalarında Stronygloides spp’nin yüzeyindeki veya salgı ürünleri içindeki bazı proteinler saptanmıştır. Ayrıca, iki S. stercoralis’in iki rekombinant antijeni 5a ve 12 karakterize edilmiştir ve bu antijenlerin filaryazis veya barsak nematod enfeksiyonlarına sahip hastalardan alınan serumlarla çapraz reaksiyon göstermediği kanıtlanmıştır (2,58).
Son yıllarda, Ravi ve arkadaşları tarafından geliştirilen rekombinant Strongyloides antijeni (NIE) kullanarak lüsiferaz immünopresipitasyon sistemi (LIPS) üzerine dayanan bir test geliştirilmiştir. Bu test NIE-ELISA testine göre %97 duyarlılık ve %100 özgüllük göstermiştir. Ayrıca, filarya ile enfekte hastaların serumlarıyla herhangi bir çapraz reaksiyon göstermemiştir. Tedavi sonrası izlemde pozitiften negatife dönen sonuçlara bakıldığında, her iki testte de antikor cevabı düşmesine rağmen; NIE-LIPS (%58) testi NIE-ELISA (%17) testiyle karşılaştırıldığında antikor cevabındaki düşüş daha sık saptanmıştır. Bu testin önemli bir avantajı geniş çapta saflaştırılıp üretilebilen rekombinant bir antijenin
27
kullanımıdır. Ham antijen hazırlığı genelde zaman alıcıdır ve enfekte insanlardan veya deney hayvanlarından alınan dışkıların toplanmasına bağlı olarak değişir (58,82).
2.9.7. Koproantijen Saptanması
Hayvan modellerinin dışkı örneklerinde S. stercoralis’in koproantijenini saptamak için ELISA kullanılmaktadır. El-Badry ve arkadaşları tarafından nematodlar (Capillaria philipinensis) veya trematodlar (Schistosoma mansoni ve Fasciola gigantica) ile çapraz reaksiyon göstermeyen, enfekte hastalardan S. stercoralis koproantijenini yakalayabilen ELISA testi geliştirilmiştir. Ancak strongiloidoz tanısındaki etkinliğinin anlaşılması için daha fazla çalışmaya gerek duyulmaktadır (58,83).
2.9.8. Moleküler Tanı
Strongyloides stercoralis saptanması için birçok real-time PZR çalışması yapılmıştır. Genellikle %100 özgüllük gösteren bu testler, 18S rRNA, sitokrom c oksidaz alt birimi I geni veya 28S RNA gen sekanslarını hedef almaktadırlar. Strongyloides spp.’nin 18S rDNA’sındaki birçok hiper-değişken bölgenin, türe özgül tanı için bir gösterge olabileceği düşünülmektedir. Bir çalışmada, APC ile karşılaştırıldığında ‘‘nested’’ PZR’nin %100 duyarlılığa sahip olduğu gösterilmiştir. Bununla birlikte, bir çalışmada, testin duyarlılığı Baermann veya APC yöntemlerine göre daha yüksek saptanmamıştır. PZR için kullanılan dışkı miktarının, APC ya da Baermann yöntemi için gerekli olandan 40 kat daha düşük olduğu belirtilmiştir. Aynı zamanda parazite özgül DNA miktarının enfeksiyon yoğunluğuyla ve konağın bağışık yanıtıyla ilişkili olabileceği akılda bulundurulmalıdır. Bu nenenle düşük larval değerlere sahip asemptomatik hastalarda bu testin duyarlılığı, dışkı örnekleri ile tekrar test edilmediği takdirde yüksek değildir (58,84,85).
28 2.10. Tedavi
Strongiloidoz, tedavisi zor olan bir enfeksiyondur. Birçok helmint enfeksiyonunda klinik hastalığa neden olan parazit yükünün belli bir seviyenin altına inmesi yeterli tedavi olarak kabul edilirken strongiloidozda, ciddi hastalık tehlikesini ortadan kaldırmak için parazitin tamamen eradikasyonu gerekmektedir. Bu nedenle kimyasal maddelere karşı nispeten dirençli olan otoenfektif L3 larvaların, etkili bir anthelmintik ile öldürülmesi gerekmektedir (26,56 ).
Tiyabendazol, gastrointestinal yan etkilerine ve yüksek nüks oranına rağmen, strongiloidoz tedavisinde tercih edilmektedir (26,86). En az üç gün boyunca ve günde iki kez 25 mg/kg dozunda kullanılmaktadır. Hiperenfeksiyon sendromunda ise 5-7 gün kullanılması önerilmektedir. Bu dozda S. stercoralis’i %90 olarak eradike edebilmektedir. Ancak bu tedavi ile parazitin eradike edilemediğine ilişkin yayınlar da bulunmaktadır (22).
Son çalışmalarda, ivermektin’in hem komplike olmayan hem de dissemine strongloidosis tedavisinde en etkili ilaç olduğu gösterilmiştir (87). İyileşme oranı tiyabendazole göre daha yüksektir (56). Bu ilaç Dünya Sağlık Örgütü'nün strongiloidoz tedavisi için gerekli ilaçlar listesindedir (2). İki hafta süreyle 100-200 µg/kg/gün kullanılması önerilmektedir. İmmunsüpresif tedavi alan, AIDS’li hastalarda tedavi başarısızlığını önlemek için ivermektin tedavisi uzun süreli verilmelidir (22).
Mebendazol dört gün boyunca, günde iki kez 100 mg olarak verilebilmektedir. Tiyabendazol ile karşılaştırıdığında bu ilacın etkinliği daha az olmasına rağmen, daha iyi tolere edildiği bildirilmiştir (20,43,61).
Albendazol, günlük 400 mg üç gün süresince verilip; iki hafta sonra tekrar üç günlük kür şeklinde uygulandığında başarı oranının yaklaşık %62 olduğu
29
bildirilmiştir. Hiperenfeksiyon sendromunda ise, albendazolün 15 gün boyunca 400 mg/gün şeklinde verilmesi önerilmektedir (22,41).
Ülkemizde tedavi seçeneği olarak albendazol ve mebendazol bulunmaktadır. 2.11. Korunma
Tüm paraziter enfeksiyonlarda olduğu gibi genel önlemler çok önemlidir. Bunları sırasıyla belirtecek olursak:
1. İnsan dışkısı sağlığa uygun bir şekilde bertaraf edilmelidir.
2. Kişilerin toprak ile temasının önlenmesi amacıyla çıplak ayakla dolaşılmaması, çizme ve eldiven giyilmesi sağlanmalıdır.
3. Hastalığın yaygın olduğu bölgelerde halkın eğitimi ve bilgilendirilmesi sağlanmalıdır.
4. Eksternal otoenfeksiyonun önlenmesi amacıyla enfekte kişilere perianal bölgenin temiz tutulması gerektiği anlatılmalıdır.
5. Kişiler taze sebze ve meyvelerin yıkanarak yenmesi konusunda bilgilendirilmelidir.
6. Enfekte kişiler tedavi edilmelidir.
7. Özellikle kortikosteroit kullanan, HTLV-1 ile enfekte hastalar başta olmak üzere tüm bağışıklığı baskılanmış hastalar kronik strongiloidoz açısından araştırılmalı ve kronik strongiloidoz enfeksiyonu saptandığında tedavileri ya da profilaksileri sağlanmalıdır (19,22).
30 3. GEREÇ VE YÖNTEM
Bu çalışma için,
1. Yerli ve yabancı literatür taranarak veri toplanmıştır.
2. Ege Üniversitesi Tıp Fakültesi Parazitoloji AD ile görüşülerek çalışmanın alt yapısı planlanmıştır.
3. Ege Üniversitesi Tıp Fakültesi Araştırma Etik Kurulu’ndan 26.02.2013 tarih ve 13-2/15 karar no’lu onay alınmıştır.
4. Ege Üniversitesi Bilimsel Araştırma Projeleri Şube Müdürlüğü’ne çalışmaya mali destek sağlanması amacıyla başvurulmuş ve çalışma 2013-TIP-022 no’lu proje ile desteklenmiştir.
5. Etik kurul başvurusu sırasında ayrıntılı olarak hazırlanmış olan
“bilgilendirilmiş gönüllü olur formu”, hasta ve hasta yakını bilgilendirildikten sonra, hastalar ya da birinci derece yakınları tarafından doldurulmuştur (Ek-1).
6. Çalışmaya alınan her hasta için tarafımızca, demografik özellikleri, klinik ve laboratuvar bulguları gibi bilgilerin yer aldığı ve takiplerinin yapıldığı “olgu rapor formu” doldurulmuştur (Ek-2).
7. Hastalardan kan ve dışkı örnekleri toplanmıştır.
8. Alınan örnekler çalışma gününe dek -20°C saklanmıştır.
9. Ege Üniversitesi Bilimsel Araştırma Projeleri Şube Müdürlüğü’ne başvurularak tez çalışmasında kullanılacak tüm malzemelerin rektörlük projesi kapsamında satın alma işlemleri yapılmıştır.
10. Serum örneklerinde ELISA ile S. stercoralis’e karşı antikor arama ve dışkı örneklerinde S. stercoralis nükleik asit arama testleri yapılmıştır.
31
11. Proje hakkında Ege Üniversitesi Bilimsel Araştırma Projeleri Şube Müdürlüğü’ne düzenli olarak rapor verilmiştir.
3.1. Hasta Popülasyonu
01 Nisan 2013–31 Aralık 2013 tarihleri arasında Ege Üniversitesi Tıp Fakültesi Hastanesi İç Hastalıkları nefroloji-organ nakli polikliniğine başvuran böbrek nakli yapılmış hastalar veya diyaliz merkezinde hemodiyaliz uygulanan hastalar çalışmaya alınmıştır.
3.1.1. Çalışmaya Alınma Ölçütleri:
-Çalışmaya katılmayı kabul etme (Hasta bilgilendirme ve onam formunun imzalanması)
-18 yaş ve üstünde olma
-Böbrek nakli yapılmış olması ya da kronik böbrek yetmezliği nedeniyle hemodiyaliz uygulanması
3.1.2. Çalışmaya Alınmama Ölçütleri: -Çalışmaya katılmayı kabul etmeme -18 yaşın altında olma
-Periton diyalizi uygulanan hastalar 3.2. Olgu Rapor Formu
Uygun kriterleri karşılayan hastaların cinsiyet, yaş, meslek, doğum yeri ve yaşadığı yer, böbrek nakli ya da hemodiyalize başlama tarihi, ek hastalıkları olup olmadığı, mevcutsa bu hastalıkların neler olduğu, klinik bulguları (ateş yüksekliği, ishal, öksürük, balgam), S. stercoralis bulaşı açısından risk faktörleri (çıplak ayakla toprağa basma, bahçe işleri ile uğraşma ve ılıman bölgeye seyahat) , laboratuvar (lökosit sayısı ve eozinofili) ve immünsüpresif tedavi bilgilerini içeren hasta takip formları doldurulmuştur (Ek-2).
32 3.3. Örneklerin Alınması ve Saklanması
1) Her hastadan kontrole geldiği bir dönemde rutin tetkiklerine ek olarak bir tüp steril düz kan (Greiner bio-one; Z Serum Clot Activatör-9 ml) ve steril kaba dışkı örneği alınmıştır.
2) Örnek alındıktan sonra en geç 4 saat içinde Ege Üniversitesi Tıp Fakültesi Parazitoloji moleküler laboratuvarına gönderildi. Bu süre içerisinde +4 ºC‘lik buzdolabında saklanmıştır.
3) Örnekler sorumlu araştırıcı ve yardımcı araştırıcılar tarafından bizzat teslim alınıp laboratuvara getirilmiştir.
4) Örnekler çalışılana dek, Enfeksiyon Hastalıkları Kliniği’nde veya Parazitoloji Anabilim Dalı’nda bulunan -20 ºC’lik derin dondurucularda saklanmıştır. 5) Testlerde kullanılacak sarf malzemelerinin ve kitlerin tümü malzemeye uygun
soğutucularda saklanmıştır.
6) Hastalara ait örneklerle ilgili hasta kayıtları bilgisayar ve dosya sistemi ile kayıt altına alınmıştır.
7) Çalışmada Ege Üniversitesi Tıp Fakültesi Parazitoloji Moleküler Laboratuvarı’nda bulunan alet ve cihazlar kullanılmıştır.
3.4. Strongyloides stercoralis’in Serolojik Yöntemle Araştırılması
Yüz sekiz hastadan toplanan toplam 108 serum örneğinde anti-S. stercoralis IgG antikorlarının varlığının araştırılması için ELISA testi uygulanmıştır. ELISA testinde kullanılacak pozitif ve negatif kotrollerin belirlenmesi için ticari kit ( DRG® Diagnostics Strongyloides IgG ELISA EIA-4208; Almanya ) kullanılmıştır. ELISA testi sırasında kullanılan cihazlar, solüsyonlar ve sarf malzemeleri aşağıda
33 3.4.1. Cihazlar
• Mikrosantrifüj: Beckman Coulter Microfuge 18, Amerika Birleşik Devletleri (ABD)
• Masaüstü santrifüj: Hettich Universal 16A, Almanya • Enkübatör: Incucell 55, Almanya
• ELISA plak okuyucusu: Bio-Tek ELx808, ABD 3.4.2. Malzemeler ve Solüsyonlar
Strongyloides IgG ELISA (DRG) kit içeriği aşağıda listelenmiştir.
Test stripleri: Strongyloides stercoralis antijeni ile kaplı 96 mikroçukur içermektedir.
Enzim konjugatı: peroksidaz içeren protein A konjugatı (11ml) Pozitif kontrol: dilue pozitif tavşan kanı (1 ml)
Negatif kontrol: dilue negatif insan kanı (1 ml) Kromojen: tetrametilbenzidin (TMB) kromojeni
Yıkama tamponu (20X): konsantre tampon ve surfaktan (25 ml) Dilüsyon tamponu: Tamponlanmış protein solüsyonu (30 ml) Durdurma solüsyonu: 0,73 M fosforik asit (11 ml)
3.4.3. Malzemeler ve Solüsyonların Hazırlanması:
Üretici firmanın protokolüne göre 25 ml yıkama tamponu (20X) üzerine 475 ml distile su ilave edilerek hazırlanmıştır.
3.4.4. Strongyloides IgG-ELISA Testinin Uygulanması
Serumda S. stercoralis IgG antikorları ELISA tekniği ile araştırılmıştır. Kullanılacak tampon solüsyonlar Strongyloides IgG ELISA kiti protokolüne göre hazırlanmıştır. Hasta serumları sulandırım kabında sulandırma solüsyonu ile 1/64 olacak şekilde dilüe edilmiştir. Pozitif ve negatif kontrol serumları sulandırılmadan
34
direkt kullanılmıştır. Tüm örnekler için çift çukur çalışılmıştır. Strongyloides antijeni ile kaplı olan ELISA plakları üzerine dilüe edilmiş serum örnekleri 100 μl olarak ilave edilmiş ve 10 dk enkübasyon yapılmıştır. ELISA plakları yıkama solüsyonu ile 3 kere yıkandıktan sonra plak çukurları tamamen boşaltılıp her çukura 2 damla konjuge aktarılmıştır. Oda ısısında 5 dk enkübasyon yapılmıştır. Enkübasyon sonrası plaktaki içerikler dökülmüş, çok katlı gazlı bez üzerine vurularak tamamen
boşaltılmış ve tekrar her çukur 3 kez yıkanmıştır. Plaklar yıkandıktan sonra çukurlara substrat peroksidaz (TMB) dan 2 damla ilave edilmiş ve oda ısısında plak
çukurundaki karışım maviye dönene kadar 5 dk enkübe edilmiştir. En son olarak üzerine durdurma solüsyonu eklenerek ELISA plak okuyucuda 450 nm dalga boyunda okutulmuştur.
3.4.5. Strongyloides IgG-ELISA Testinin Kontrolü ve Yorumlanması
Test içinde negatif kontrol: 0,0 ile 0,2 OD ünit arasında, pozitif kontrol 0,5 OD ünit ve üzerinde değerleri vermesi gerekmektedir. Serum örneklerimizden 0,2 OD ünit değerinden yüksek olanlar pozitif, düşük olanlar ise negatif olarak değerlendirilmiştir.
3.5. Strongyloides stercoralis’e ait DNA’nın PZR Yöntemi ile Araştırılması 3.5.1 DNA Ekstraksiyonu
Yüz sekiz hastadan toplanan toplam 108 dışkı örneğine, öncelikle PZR sırasında kullanılmak üzere genomik DNA’nın elde edilmesi amacı ile DNA ekstraksiyonu uygulanmıştır. Hastalardan alınan dışkı örneklerinin genomik
DNA’larının elde edilmesi amacı ile DNA ekstraksiyonları QIAamp DNA stool mini kit (Qiagen, ABD) üreticisi firmanın protokolu kullanılarak yapılmıştır.
Kit içerisinde inhibitEX tablet, dışkı eritme tamponu (ASL tampon), eritme tamponu (AL tampon), proteinaz K, yıkama tamponu 1 (AW1), yıkama tamponu 2