T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
BÖLGEMİZDE GENÇ TROMBOZLU VAKALARDA FAKTÖR XII
C46T GEN POLİMORFİZİMİNİN PREVELANSI VE TROMBOZ
İLE İLİŞKİSİ
UZMANLIK TEZİ
Dr. Sedat ÇETİN
TEZ DANIŞMANI
Prof. Dr. M.Orhan AYYILDIZ
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
BÖLGEMİZDE GENÇ TROMBOZLU VAKALARDA FAKTÖR XII
C46T GEN POLİMORFİZİMİNİN PREVELANSI VE TROMBOZ
İLE İLİŞKİSİ
UZMANLIK TEZİ
Dr. Sedat ÇETİN
TEZ DANIŞMANI
Prof. Dr. M.Orhan AYYILDIZ
TEŞEKKÜR
Bilimsel düşünme ve çalışmayı bizlere öğreten, engin bilgi ve birikimlerini bizimle paylaşan, bugünlere gelmemizde büyük emeği olan, hekimliği bizlere öğreten değerli hocamız Prof. Dr. Ekrem MÜFTÜOĞLU’ na başta olmak üzere, İç Hastalıkları A.B.D. Başkanımız Prof. Dr. M. Emin YILMAZ’a yetişmemde büyük emekleri olan bütün değerli öğretim üyeleri; Prof. Dr. Orhan AYYILDIZ, Prof. Dr. Vedat GÖRAL’a, Prof. Dr. Abdurrahman IŞIKDOĞAN, Prof. Dr. Kendal YALÇIN, Prof. Dr. Alpaslan TUZCU, Prof.Dr. Muhsin KAYA, Prof. Dr. Ali Kemal KADİROĞLU, Doç. Dr.Ebubekir ŞENATEŞ, Yrd. Doç. Dr. M.Ali KAPLAN, Yrd. Doç.Dr. Ali İnal, Yrd. Doç.Dr. Mehmet KÜÇÜKÖNER, Yrd.Doç. Dr. Yaşar YILDIRIM Yrd. Doç.Dr. Zülfikar YILMAZ, Yrd. Doç. Dr.Sinan DAL, Uz. Dr. Faruk KILINÇ, Uz. Dr.Nazım EKİN, Uz. Dr.Zuhat URAKÇI’ya teşekkürlerimi sunuyorum.
Tezimin her aşamasında yardımlarını esirgemeyen sayın Prof. Dr.Orhan Ayyıldız, Hematoloji Labaratuarı çalışanları ve Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.B.D. , Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D , Göğüs Hastalıkları ve Tüberküloz A.B.D., Radyoloji A.B.D. başkanlarına ve değerli öğretim üyelerine,
Birlikte çalışmaktan her zaman büyük mutluluk ve onur duyduğum tüm asistan arkadaşlarıma ve İç Hastalıkları A.B.D. çalışanlarına,
Asistanlık süresi boyunca desteklerini esirgemeyen sevgili aileme ve sevgili dostlarıma teşekkürlerimi sunuyorum.
İÇİNDEKİLER Bölüm Sayfa No TEŞEKKÜR 2
İÇİNDEKİLER 3
SİMGELER KISALTMALAR 5 ŞEKİLLER VE TABLOLAR 7 1. ÖZET 9 2. ABSTRACT 10 3. GİRİŞ VE AMAÇ 4. GENEL BİLGİLER 13 4.1.HEMOSTAZ 13 4.1.1.PRİMER HEMOSTAZ 14 4.1.1.1.Vasküler Endotel 17 4.1.1.2.Trombositler 19 4.1.2SEKONDER HEMOSTAZ 22 4.1.2.1.Koagülasyon sistemi 22
4.1.2.1.1. Pıhtılaşma Faktörlerinin Sınıflandırılması 23
4.1.2.1.2. K vitaminine bağımlı faktörler 25
4.1.2.1.3. Trombine Duyarlı Faktörler 30
4.1.2.1.4. Kontakt Faktörleri 33
4.1.2.1.5. Fosfolipidler ve Kalsiyum İyonları 35
4.1.2.1.6. Koagülasyon İnhibitörleri (Antikoagülan Proteinler) 35
4.1.2.2. Pıhtılaşma Sistemi Aktivasyonu 37
4.1.2.3. Koagülasyon Kaskadı (Klasik Anlayış) 40
4.1.2.4. Pıhtı İnhibisyonu Ve Erimesi 41
4.2. TROMBOZ VE TROMBOFİLİ 43
4.2.1. Kalıtsal trombofili taraması yapılması gereken durumlar 46
4.3.2. Kalıtsal trombofili taraması yapılması önerilmeyen durumlar 46
4.3.3. Kalıtsal trombofilinin klinik önemi 46
4.3.5. Kalıtsal Tromboz Nedenleri 48
4.3.5.1. Antitrombin III Eksikliği 50
4.3.5.2. Protein C Eksikliği 52
4.3.5.4. Aktif Protein C (APC) Direnci ve Faktör V Leiden Mutasyon 53
4.3.5.5. Protrombin G20210A Mutasyonu 55
4.3.5.6. Hiperhomosisteinemi 56
4.3.5.7. Faktör VIII Yüksekliği 57
4.3.5.8. Fibrinojen Gen Mutasyonu 58
4.3.5.9. Plazminojen Aktivatör İnhibitör 1(PAI–1) Gen Poliformizmi 58
5. MATERYAL VE METOD 62
6. BULGULAR 64
7. TARTIŞMA VE SONUÇ 68
SİMGELER VE KISALTMALAR
µm: Mikrometre
ADP: Adenozin Difosfat
AMI: Akut Miyokard Enfarktüsü APC: Aktive Protein C
APCR: Aktive Protein C Rezistansı AT-III : Antitrombin III
ATP: Adenozin Trifosfat Ca++: Kalsiyum
DVT: Derin Ven Trombozu EGF: Epidermal Growth Factor GIa: Gama Karboksi Glutamik Asit
HMWK: Yüksek Molekül Ağırlıklı Kininojen (High Moleküler Weight Kininojen, Fitzgerald Faktörü )
İS: Serebral Enfarkt (İskemik Strok) KAH: Koroner Arter Hastalığı MI: Miyokard Enfarktüsü
MTHFR: Metilentetrahidrofolat Redüktaz ng: nanogram
NO: Azot Oksit
PAI–1: Plazminojen Aktivatör İnhibitörü–1 PC: Protein C
PIVKA: K vitamini yokluğunda oluşan proteinler (Proteins Induced By Vitamin K Absence) PK: Prekallikrein (Fletcher faktörü)
PS: Protein S
PTE: Pulmoner Tromboemboli PVT:Portal Ven Trombozu
PTGM: Protrombin G20210A Mutasyonu
RES: Retikülo Endotelyal Sistem
TAT kompleksi: Trombin- Antitrombin III kompleksi TF: Doku Faktörü (Tissue factor)
TFPI: Doku Faktör Yolu İnhibitörü (Tissue Factor Pathway Inhibitör) t-PA: Doku Plazminojen Aktivatörü
TXA2: Tromboksan A2 VTE: Venöz Tromboemboli vWF: Von Willebrand Faktörü
ŞEKİLLER
Şekil 1: Hemostaz
Şekil 2: ProteinC Mekanizması
Şekil 3: Koagulasyon sisteminin aktivasyonu (Klasik anlayış) Şekil 4: Yeni anlayışa göre koagülasyon kaskadı
TABLOLAR
Tablo 1: Kan koagülasyon proteinlerinin adlandırılması ve özellikleri Tablo 2: Pıhtılaşma işlevi
Tablo 3: Kalıtsal trombofili görülme sıklığı ve trombozla ilişkisi Tablo 4: Nadir rastlanan primer trombofili nedenleri
Tablo 5: Sekonder trombofili nedenleri
Tablo 6: Protein C ve protein S eksikliği tipleri, şekillerive klinik tipleri Tablo 7: Çalışmaya alınan hasta ve kontrol grubunun demografik
özellikleri
Tablo 8: Çalışmaya alınan hastaların tanılara göre dağılımı Tablo 9: Çalışma ve kontrol grubu hastalarında faktör XII
polimorfizimi dağılımı
Tablo 10: Çalışmaya alınan hastaların Faktör XII gen
polymorfizimine göre tanılarının dağılımı
Tablo 11: Faktör XII gen polimorfiziminin tromboz tipine göre dağılımı Tablo 12: Çalışmaya alınan hastaların cinsiyetlerine göre
FXII gen polimorfizimleri
Tablo 13: Çalışmaya alınan trombozlu hastaların cinsiyete göre FXII gen polimorfizminin
dağılımı
Tablo 14: DVT tanılı kadın hastalar ile kontrol grubundaki kadınların
FXII gen polimorfizimlerinin karşılaştırılması
Tablo 15: Çalışmaya alınan hastaların demografik özellikleri ve sonuçlarının özeti
ÖZET
Giriş: Prokoagülan ve antikoagülan dengenin edinsel veya kalıtsal bir faktör etkisiyle
bozulması ile ortaya çıkan tromboz, yerleşim yerine göre semptomlar verir. Trombozlar, önemli mortalite ve morbidite nedenidir. Herediter trombofililer erken yaşta, anormal yerleşimli veya sık tekrarlayan tromboz ataklarına neden olabilirler. Tromboz etyolijisinde APC direnci, protein C ve S eksiklikleri, faktör V leiden mutasyonu ve protrombin gen mutasyonu ilk tanımlanan herediter trombofili nedenleri olsa da, yapılan çalışmalarda yeni mutasyonlarda bulunmaktadır. Trombozdaki etyolojisi tam açıklanamayan ve etkinliği hakkında görüş birliği olamayan bir faktör de FXII C46T gen polimorfizimidir.
Amaç: Bölgemizde genç trombozlu vaklarda FXII C46T gen polimorfizmin prevelansı ve
trombozla ilişkisini araştırmak.
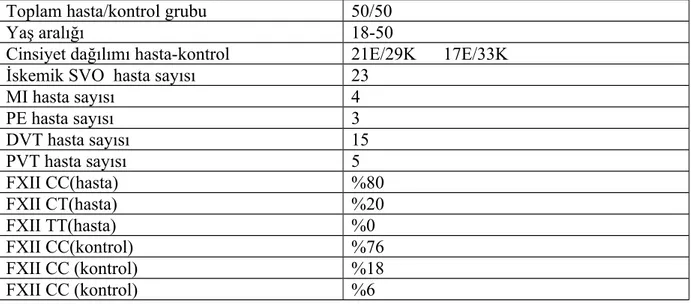
Hastalar ve yöntem: Çalışmaya 50 yaş ve altı 50 hasta (21E/29K) tromboz öyküsü(derin ven
trombozu,portal ven trombozu,iskemik stroke,.myokard infarktüsü,pulmoner emboli) olan ve daha önce FXII C46T gen polimorfizmi çalışılmış olan hastalar alındı.50 kontrol grubu tromboz öyküsü olmayan, sağlıklı birey alındı. Hastalarda ve kontrol grubunda PCR yöntemiyle bakılmış FXII C46T gen polimorfimizmi sonuçları değerlendirildi.
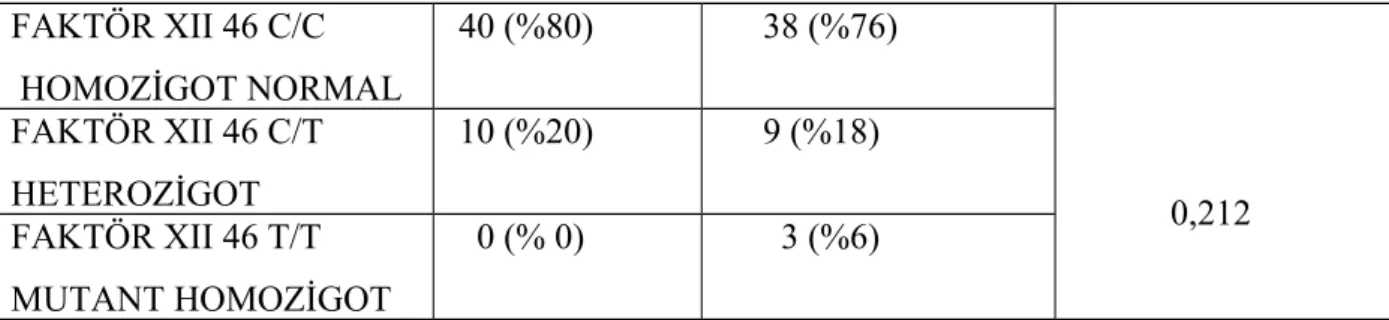
Bulgular : Hasta ve sağlıklı grubun polimorfizim prevelansları Ki-Kare testi ile karşılaştırıldı
ve istatistiksel olarak anlamlı sonuç bulunamadı.(Sonuçlar sırasıyla hasta ve kontrol grubunda C/C:% 80 ve % 76 C/T: % 20 ve % 18 T/T:% 0 ve % 6 p:0.212) AMI da CC:%50 CT:%50 TT:%0 p:0.295 ,SVO da CC:%69.5 CT:%30.5 TT:%0 p:0.275,PE de CC:%100 CT:%0 TT:%0 p: 0.659, PVT de CC:%100 CT:%0 TT:%0 p:0.467, DVT de CC:%93.4 CT:%6.6 TT:%0 p:0.317.Tromboz tipine göre çıkan sonuç:arteryel tipte CC: %50 CT:%50 TT:%0 Venöz tipte CC:%83.4 CT:%16.6 TT:50 p:0.174.
Sonuç: Çalışmanın sonucunda trombozlu hastalarda FXII gen polimorfizmi arasında
istatistiki olarak anlamlı sonuç bulunamamıştır.Vaka sayılarının az olması nedeniyle ilerde daha fazla hasta gruplarıyla yapılacak çalışmalara ihtiyaç vardır.
ABSTRACT
Introduction: Thrombosis, which is identified as the disequilibrium between procoagulan
and anticoagulan systems by a factor such hereditary or acquired, rises symptoms by its localisation, and is one of the most important causes of morbidity and mortality. Hereditary thrombophilias may be manifested by recurrent thrombotic attacks in abnormal localisation in early ages. As it is well known that APC resistance, protein C and protein S deficiencies, factor V leiden mutations and prothrombine gene mutations are the former identified causes of thrombosis, in recent studies, new mutations were recognized. The FXII C46 gene
polmymorphism is one of these mutations that no clear consensus has been clarified the role of it in the pathogenesis and etiology of thrombosis.
Purpose:In our study, we aim to evaluate the prevalence of FXII C46T gene polymorphism
and its association with thrombosis in patients presented with thrombosis at early ages. 50 patients (21M/29 F) under 50 years of age with history of thrombosis(Portal vein
thrombosis, pulmoner emboli, myocard infarction, ischemic stroke, deep venous thrombosis) and previously studied FXII C46T gen polmorphisms. 50 controls which has no history of thrombosis and healthy were included. The prevalence of FXII C46T gene polymorphism was studied by PCR in both groups.
Results:The prevalences of gene polymorphism among patients and control group were
compared with chi-square test and no statistically significant results were seen between each groups.(C/C: 80% vs 76%; C/T: 20% vs 18% ; T/T : 0% vs 6% p value: 0,212) AMI CC:%50 CT:%50 TT:%0 p:0.295 , in SVO CC:%69.5 CT:%30.5 TT:%0 p:0.275,in PE CC:%100 CT:%0 TT:%0 p: 0.659, in PVT CC:%100 CT:%0 TT:%0 p:0.467, in DVT CC:%93.4 CT:%6.6 TT:%0 p:0.317.Result of thrombosis type in arterial type CC: %50 CT:%50 TT: %0 Venous type CC:%83.4 CT:%16.6 TT:50 p:0.174.
Conclusion:In our study, no statistically significant association between FXII gene
polymorphism and thrombosis were found. It needs to be further evaluated in large trials.
Keywords:FXII, thrombophilia, thrombosis
1.GİRİŞ VE AMAÇ
Normal kan akışı; koagülan, antikoagülan ve fibrinolitik sistemler arasındaki hassas dengenin korunması ile sağlanmaktadır. Bu hemostatik denge, hem kanamayı hem de uygun olmayan pıhtı oluşumunu önlemektedir. Koagülasyon bozuklukları tromboembolik hastalıklara yol açmaktadır.
Trombofili (Thrombo-philia: trombozu sevme) tromboza eğilim yaratan tabloları tanımlamakta kullanılan bir terimdir. Tromboz gelişimi multifaktöriyeldir . Çok sayıda edinsel ve kalıtsal faktör değişik mekanizmalarla tromboz oluşumuna neden olduğu bilinmektedir . Arteriyel ve venöz sistemde tromboz formasyonunun farklı olması, bu iki sistemde farklı etyolojilerin rol oynadığını düşündürmektedir (arteryel platelet bakımından, venöz ise fibrin bakımından zengindir). Arteriyel sistemde endotel hasarı ve trombositlerin fonksiyonel bozukluklarının önemli rol oynadığı, venöz sistemde ise daha çok staz ve pıhtılaşma sistemine ait bozuklukların (pıhtılaşma sistemini kontrol eden doğal inhibitör mekanizma bozukluklarının ) tromboz gelişimine neden olduğu bilinmektedir .
Venöz tromboz; venöz sistem içinde fizyolojik gereksinim olmadan pıhtı oluşmasıdır. Çoğunlukla alt extremitelerin derin venlerinde oluşan trombuslar o ekstremitede lokal yakınmalara ve/veya bazen kopup pulmoner arter ve dallarını tıkayarak pulmoner tromboemboliye (PTE) neden olabilir. PTE’ si olan hastaların %70’inde alt ekstremitede çoğulukla asemptomatik venöz trombus tespit edilmiştir .
Tromboz toplumda sık görülen hastalık olup, insan hayatında önemli mortalite ve morbidite nedenlerinden biridir. Erişkinlerde insidansı yaklaşık %1 iken, çocuklarda bu oran yılda 1/100.000 olarak belirtilmiştir . Herediter trombofili denilince akla tromboza eğilimi olan bireyler gelmektedir . Tromboz etyolojisi karmaşık olup genelde birden fazla faktör içerir. Genellikle herediter ve edinsel risk faktörlerinin etkileşimi sonucu ortaya ortaya çıkar . Edinsel faktörler; cerrahi müdahale, obezite, cinsiyet, uzun süre hareketsiz kalmak,
maligniteler, travma, nefrotik sendrom, myeloproliferatif hastalıklar, PNH, konjestif kalp yetmezliği, östrojen kullanımı, hamilelik ve lohusalık gibi doğrudan risk faktörleriyle bağlantılı ve yaşla artan bir insidans gösterir .
Yakın geçmişte tomboemboli ile başvuran hastaların bazılarında altta yatan nedenler saptanamamaktaydı. 1993 yılı öncesinde herediter nedenler trombozlu olguların %10-15’inde bulunabilmekte ve ATIII, Protein C, Protein S eksikliği ile sınırlı kalmaktaydı . Son yıllarda aktive protein C rezistansı (1993), faktör V Leiden mutasyonu (1994),
hiperhomosisteinemi (1994), protrombin G20210A mutasyonu (1995), fibrinojen defektleri, plazminojen aktivatör inhibitörü–1 gen polimorfizmi, faktör 13 gen mutasyonu, plazminojen eksikliği, faktör 12 gen mutasyonu, trombomodulin gen mutasyonları, plazma proteinlerindeki anormalliklerin tespiti etyolojisi %40-60 aydınlatılmıştır . Herediter trombofili nedenlerini genetik olarak taşıyan bireylerde tromboz riski artmakla birlikte yaşam boyu hiç trombotik atak geçirmemeleride mümkündür. Veya bu kişilerde tekrarlayan trombotik ataklar arasında uzun süren asemptomatik dönemler olabilmektedir. Bu durum, tek başına kalıtsal nedenlerin yeterli olmadığını, tromboz gelişiminde bazı edinsel faktörlerin katkısı olduğunu göstermektedir . Kalıtsal trombofili tanısı için yapılacak testler oldukça zahmetlidir, pahalıdır ve uygun testler kullanılmazsa yanıltıcı sonuçlar elde edilebileceğinden titizlikle seçilmelidir .
Faktör XII ( Hageman faktör ) plazmada bulunan 80.000 kDa ağırlığında, koagulasyon kaskadındaki diğer faktörler gibi serin proteaz üyesidir. Faktör XII koagulasyonun başlaması, fibrinoliziste, kompleman sistemin aktivasyonunda, bradikinin oluşumunda rol alır.(22) Son zamanlarda ödem oluşumunda da rol aldığı gösterilmiştir(23).Koagulasyonda intrinsik yolu başlatır. Aktive Faktör XII Faktör XI aktifler. Faktör XII eksikliği kanama semptomlarına yol açmaz. Genelde sağlıklı bireylerin kontrol amaçlı, preoperatif değerlendirme için bakılan Aptt uzama saptandıktan sonra tespit edilir. Faktör XII N-terminl ağır zincir ve C- terminal ağır zincirden oluşur.NH2-terminal parçası negatif yüklü alanları bağlar. 2 fibronectin-type domains(FT-I, FT-II) 2 EGF benzeri ve proteinden zengin alanlar içerir. COOH-terminal parçası enzimatik aktiviteye sahiptir.(24) Faktör XII geni 5. kromozomun uzun kolunda (5q33) lokalizedir. 14 exon ve 13 introndan oluşur. Faktör XII geni 19 aa sinyal peptid ve 596 aa matur proteini kodlar. (25)
TT homozigot formunda CC homozigot formuna göre Faktör XII düzeyleri daha düşük saptanmış. Çalışmamızda Güneydoğu Anadolu bölgesindeki trombozlu vakalarda faktör XII C46T polimorfiziminin prevelansı ve tromboz ile ilişkisini araştırdık.
2.GENEL BİLGİLER
Kan, organizmada gerçekte kapalı bir kanallar sistemi içinde dolaşan bir dokudur. Dolaşım kanı, plazma adı verilen sıvı bir ortam içinde süspansiyon halinde bulunan şekilli elemanlardan meydana gelmiştir. Metabolizma, gaz transportu, hormonlar yoluyla hücresel iletişim ve immün savunma dahil pek çok fizyolojik olayda kilit rol oynar. Ortalama bir kişinin kilogram basına yaklaşık 70 ml (70ml/kg) kanı vardır . Kan pH’ı ortalama 7,4 ve dansitesi 1,035–1,075 g/cm3 arasındadır. Kan hacminin neredeyse %50-60’ı sıvı, geri kalanı ise hücrelerden oluşmaktadır. Arteriyel kanın rengi, venöz kan renginden daha açıktır. Kan, protein içeriği ve şekilli elemanları nedeniyle visközdür. Viskozitesi suyunkinin 5 katı kadardır. Plazma adı verilen sıvı bileşenin yaklasık %90’ı su; geri kalan %10’luk kısmı ise glukoz, aminoasitler ve diger metabolitler, iyonlar, çeşitli protein ve hormonlar tarafından oluşturulur. Serum; plazmanın, koagülasyon faktörleri ve fibrinojenin uzaklaştırılmasından sonra geriye kalan kısmıdır. Kan, görev aldığı fizyolojik olayları yerine getirebilmek sıvı halini sürdürmek zorundadır. Damar sisteminde non koagüle kalıp akışkan olmasına katkıda bulunan etkenler; damar sisteminin kasılabilir olması, göğüs boşluğundaki negatif basınç (emici güç), kalbin pompalama gücü ve venöz damarlarda kanın geri dönmesini engelleyen kapakçıklar olarak sayılabilir. Kan damarları ( arter, ven ve kapillerlerde ) histolojik katmanlar
ve içerikleri açısından farklılıklar gösterir. Elastin; damarın esnekliğini, bedenin hareketleri ve kalbin pompalama kuvvetiyle uyumu sağlar, düz kaslar uyarıya göre kasılırlar (vazokonstriksiyon). Damar kollajeni başlıca tip I ve tip III’den oluşur. Tip III kollajen trombositin yapışmasını en iyi şekilde sağlar ve aynı zamanda damarın bütünlüğünü korur. Bunun eksikliğinde (örneğin Ehlers- Danlos sendromu tip IV) büyük bir arterin yırtılması sonucunda ani ölüm sık görülür. Bunun yanı sıra damarın iç yüzeyinde, endotel hücrelerinin oluşturduğu kaygan yüzey de kanın sıvı halde akmasında önemli bir etkendir .
2.1.HEMOSTAZ
Hemostaz, kanın dolaşımda sıvı halde kalmasını sağlayıp sağlıklı bir şekilde akmasına neden olan mekanizmadır. Bu mekanizma kan damarlarında herhangi bir travma sonucu oluşan kanamayı durdurması ve daha sonra aynı damarın fonksiyonunu devam ettirmesi için damarın pıhtıdan temizlenmesi durumlarını da içerir . Koagülasyon hemostazın bir fazıdır. Yaralanmayı takiben vasküler endotel, dolaşan trombositler ve koagülasyon faktörleri arasındaki etkileşimler ile koagülasyonu sağlanır.
Damarın zedelenmesi sonucu oluşabilecek kan kaybını önleyen hemostaz sisteminin iki önemli özelliği vardır. İlki; yüzey bağımlılığı yani hasarlanmış bölgede açığa çıkan fosfolipidler aracılığı ile hemostazın başlaması, olayın belli bir bölgede sınırlı kalmasını sağlar. Trombosit yüzeyindeki fosfolipidler koagülasyon için primer pıhtılaşma alanı oluşturur. İkinci özelliği ise çok sayıda negatif geri besleme yolları (feedback loop) bulunmasıdır. Hemostazda görev alan her sistem, karşıt işlev gören bir inhibitör sistemle dengelenmiştir. Hatta çoğu kez bir sistem uyarıldığında karşıt sistemini kendi devreye sokar; bu sayede her sistem, karşıt sistemi ile eş zamanlı faaliyete geçmiş olur. Dolayısıyla kanın pıhtılaşması (hemostaz) ve pıhtının erimesi (fibrinoliz) süreçleri birbiri ile yakından ilişkilidir ve sürekli bir etkileşim halindedir . (Şekil 1)
Damarlara bir hasar meydana geldiğinde üç olay peşpeşe meydana gelir ;
1- Damarda, başlangıç zararının ardından büyük ölçüde refleks nörojen mekanizmalara bağlı olan ve endotelin (güçlü vazokonstriktör) gibi faktörlerin lokal salınımı ile artan kısa süreli vazokonstriksiyon olur (vasküler faz).
2- Endotel zararı aynı zamanda, yüksek trombojenik etkiye sahip olan subendatelyal hücre dışı matriksi (ECM) de açığa çıkarır. Bu da trombositlerin yapışmasına, aktive olmasına yani şekil değişikliğine uğraması ve salgı granüllerinin serbestleşmesine olanak sağlar.
Serbestleşen bu maddeler daha fazla trombositleri bir araya toplayarak (agregasyon) hemostatik tıkacı oluşturur (Trombosit fazı). Bu primer hemostaz işlemidir.
3- Zarar bölgesinden açığa çıkan doku faktörü, trombositlerden salınan faktörlerle birlikte etki ederek pıhtılaşma sistemini uyarır. Sonuçta fibrin birikimi olur. Pıhtılaşma zincirinde aktive olan trombin de daha fazla trombositin toplanmasına ve granüllerin serbestleşmesine yol açar (Plazma fazı). Sekonder hemostaz denilen bu dönem, başlangıçtaki trombosit tıkacının oluşmasından daha uzun sürer.
Kısaca damar hasarının olduğu bölgede trombositlerin tıkaç oluşturmasına primer hemostaz, bunu takiben koagülasyon sisteminin aktif hale gelerek fibrin pıhtısını oluşturmasına sekonder hemostaz adı verilir.
2.1.1.PRİMER HEMOSTAZ
Primer hemostaz sisteminin başlıca bileşenleri vasküler endotel ve trombositlerdir. Primer hemostaz, trombositlerin ve vasküler endotelin aktivasyunu ile gerçekleşir. Trombositlerin hasarlı bölgeye gelerek, yapışma (adezyon), granül içeriklerini ortama salgılama (sekresyon) ve kümeleşme (agregasyon) fonksiyonlarını yerine getirirler .
2.1.1.1.Vasküler Endotel
Kan damarlarının duvarı, endotel hücrelerinin ince bir tabakasından oluşmuştur. 10–15 µm genişliğinde, 20–25 µm uzunluğunda olan endotel hücreleri; uzamış nükleusları ile kan damarlarının iç yüzeyinin uzun ekseni boyunca sıralanarak tek katlı bir tabaka oluşturan poligonal hücrelerdir. Damar duvarının içini kaplayan sağlam endotel tabakası pıhtı oluşumunun engellenmesinde önemli bir rol oynarlar. Bu yapı; öncellikle trombositler ile yüksek trombojenik özellik gösteren subendotelial bağ dokusu arasında bir bariyer görevi görürler. Pek çok biyolojik aktiviteye sahip olan damar endoteli, vücudun değişik dokuları ile kan arasında seçici bir geçirgenlik işlevini de üstlenir. Normal koşullarda sağlam endotel yüzeyi ve kanın sürkülasyonu, koagülasyon sisteminin ve trombositlerin kendiliğinden aktive olmalarını engeller. Fakat travma ve bazı damar hastalıklarında bu yüzeyin bozulmasıyla birlikte koagülasyon sistemi ve trombositleri aktive eden değişiklikler gözlenmektedir .
Endotel hücrelerinin metabolik olarak etkileri ile kan akımında, trombosit agregasyonunda ve pıhtılaşma yolunun düzenlenmesinde rol oynarlar. Sağlam endotel hücreleri, sentezlediği veya saldığı ya da yüzeylerinde belirlediği faktörler aracılığı ile hemostaz üzerine güçlü bir inhibitör etki gösterir. Bu faktörlerden prostaglandin I2 (prostasiklin) ve azot oksitin (NO) güçlü bir vazodilatatör etkisi vardır. Bu sayede kan akımı yavaşlatılır. Bu iki madde de trombosit içi siklik adenozin monofosfat ve siklik guanozin monofosfat düzeylerini artırarak trombositlerin ve lökositlerin agregasyonunu inhibe ederler .
Vasküler endotel hücrelerinin dış membranının antitrombotik özellikleri mevcuttur. Glikokaliks; 50–60 angstrom kalınlığında proteoglikan tabaka olup; heparan sülfat, dermatan sülfat ve heparin içerdiğinden dolayı damar endotelinin kana bakan yüzeyinde kaygan bir zemin oluşturur . Heparan sülfat, doğal bir antikoagülan olan Antitrombin III (AT-III) plazma proteinini üretir . AT-III antikoagülan etkisini fibrinojeni fibrine dönüştürmekten sorumlu enzim olan trombin ve Faktör XIIa, FXIa, FXa, FIXa gibi bazı pıhtılaşma faktörlerini inhibe ederek gösterir .
Endotel hücreleri elektrik olarak negatif yüklüdür ve negatif yüklü trombositleri uzaklaştırırlar (nontrombojenik etki ). Bu fiziksel etkinin dışında, endotel hücrelerinin yüzeyinde bulunan trombomodulin ve heparan sülfatın trombini inhibe edici etkileriyle, fibrin pıhtısının damar içi yayılması sınırlanır . Trombomodulin membran reseptörüdür ve trombinle etkileşerek kuvvetli bir pıhtılaşma inhibitörü olan protein C’nin aktivasyonunu hızlandırır. Aktif protein C; FV ve FVIII’i inaktive ederek plazminojen aktivatörlerinin konsantrasyonunu arttırır. Böylece trombozu kontrol altına alır .
Endotel hücre yüzeyinin zedelenmesi güçlü bir kas kontraksiyonuna ve damar spazmına yol açar. Bu durum kan kaybını durdurmaya yönelik etkili bir reflekstir ve trombüs oluşumuna zemin hazırlar. Zarar görmüş endotel hücreleri trombosit adezyonunu, aktivasyonu ve agregasyonunu uyarabilme özelliğine sahiptir. Endotel hücreleri damar bütünlüğünün bozulduğu bölgelerde trombosit adezyonunun önemli bir kofaktörü olarak görev yapan Von Willebrand Faktörünün de (vWF) başlıca kaynağıdır. Ayrıca zedelenen yüzeyden subendotelyal doku ile trombositlerin etkileşiminde önemli olan kollajen tip IV gibi moleküller salınabilir .
vWF büyük bir glikoprotein olup, endotel hücreleri ve megakaryositlerden sentezlenir. Prokoagülan özelliği vardır. Salınımını uyaran başlıca etkenler; trombin, IL-1 ve bazı hormonlardır (adrenalin, vazopressin ve insülin). Şiddetli eksersiz ve damar tıkanması da etkili uyarıcılardır. Ayrıca kan damarlarını ve karaciğeri etkileyen birçok hastalıkta da kanda vWF düzeyleri artar. vWF, trombositlerin alfa granüllerinde depolanmıştır ve aktivasyonu halinde plazmaya salınır. Plazmada vWF ve FVIII birlikte bulunurlar. Bu şekilde FVIII, aktive protein C (APC), trombin ve diğer plazma proteazları tarafından yapılan hızlı proteolizden korunur. Aktif trombositlerin membranı üzerinde özgün bir reseptörle
etkileşerek, bunların subendotel bileşenlerine ve kollajene adezyonunu kolaylaştıran vWF hemostazda kritik rol oynar .
Trombospondin ve fibronektin, trombosit adezyonu ve agregasyonunda rolü olan adezif proteinlerdir. Laminin ve vitronektin subendotelyal tabakada bulunurlar, trombosit damar etkileşiminde küçük bir rol alırlar. Aktive olmuş trombositlerden salınan ADP ve tromboksan, çevredeki diğer trombositleri de aktive ederek trombosit tıkacının büyümesini sağlar. Ayrıca subendoteldeki kollajen liflerinin aktive ettiği FXII, trombosit yüzeyinde aktive olan FXI ve haraplanmış endotel hücrelerinden salınan bir doku faktörü; koagülasyon mekanizmasını başlatır.
Endotel hücrelerinden sentezlenen protein S’ de APC’nin antikoagülan aktivitesinde kofaktör olarak görev alır . Ayrıca APC, damar endotelini uyararak “Doku plazminojen aktivatörünün (t-PA)” salgılanmasını sağlar. T-PA, plazminojenin plazmine dönüşmesinde önemli bir maddedir. Plazmin ise fibrinin parçalanmasından sorumlu olan proteolitik bir enzimdir. Plazminojenin plazmine dönüşümünde gerekli olan diğer bir aktivatör ise, endotel hücreleri ve böbrek hücrelerinde sentezlenen ürokinazdır. T-PA’nın inaktivasyonu ise, yine endotel hücrelerinde sentezlenen ve ürokinazı da nötralize eden plazminojen aktivatör inhibitörü–1 (PAI–1) tarafından gerçekleştirilir .
Trombositler hemostazın sürdürülmesinde ana elementlerdir. Dolaşımda bulunan normal trombositler uzun ekseni 2-4 µm ve hacmi 5-12 fL olan uzunca bir diske benzer. Kemik iliği veya diğer hematopoietik yerlerde megakaryositlerin stoplazmasının parçalanması ile oluşur. Çekirdekleri olmamasına rağmen, sitoplazmalarında aerobik metabolizmayı sağlayan mitokondriler, anaerobik glikoliz için glikojen depoları ve içerikleri pıhtılaşma açısından önem taşıyan spesifik granüller bulunur. Kandaki normal sayıları 150.000– 350.000/mm3 ‘tür .
Trombosit membranı glikokaliksle kaplı, çift katlı lipid tabakasından oluşur. İki bakımdan trombosit plazma zarı önemlidir. İlki, bir çok spesifik glikoprotein reseptörlerini bulundurur ve bunlar aracılığıyla agregasyon yapıcı etkenlerle, inhibitörlerle, pıhtılaşma faktörleri ile diğer trombositlerle ve damar duvarı ile etkileşir. İkincisi ise plazma zarının fosfolipidleri içermesidir. Bu fosfolipidler prostaglandin sentezi, hücre içi kalsiyum hareketi ve prokoagülan aktivitenin trombositin dış yüzeyinde oluşması ve yerleşmesi bakımından önemlidir .
Trombosit membranına yakın bölgelerde kanallar sistemi, endoplazmik retikulum artıkları, daha iç bölgede farklı yoğunlukta granüller bulunur. Mitokondriden zengin hücreler olup, endoplazmik retikulum ve golgi aygıtında çesitli enzimlerin sentezini gerçekleştirip bol miktarda kalsiyum (Ca++) depo ederler. Sitoplâzmalarında bulunan trombastenin, aktin, miyozin gibi kasılabilir proteinler sayesinde şekil değiştirebilir, kasılabilir, salgı yapabilir ve bir yere veya başka bir trombosite bağlanabilirler.
Trombosit hacminin neredeyse %20’si granüllerden oluşurken, içindeki proteinlerin %25’ini trombosit kontraksiyonu için gereken aktin ve myozin oluşturur. Trombositlerde; lizozimler, α-granüller ve yoğun cisimcikler olmak üzere üç tip salgı granülü bulunur. Lizozimlerde asit hidrolazlar; α-granüllerde ise heparini nötralize eden trombosit faktör 4 (PF4), beta-tromboglobulin (β-TG), trombospondin, fibrinojen, fibronektin, PAİ–1, α2-antiplazmin, FV, FVIII, vWF ve çeşitli büyüme faktörleri gibi trombositlere özgü proteinler bulunur. Başlıca büyüme faktörleri; trombosit kökenli büyüme faktörü (PDGF), transforme edici büyüme faktörü-beta (TGF-β) ve endotel hücresi büyüme faktörüdür (ECGF). Yoğun cisimcikler ise, trombositlerin metabolizmasıyla ilişkili ADP, adenozin trifosfat (ATP ), 5- hidroksitriptamin (5-HT), pirofosfat ve Ca++ iyonları bulunur. Ayrıca yoğun cisimciklerde ADP ve ATP nükleotid öncü depolarına sahiptirler. Bu nükleotid öncüleri, gerekli enerjinin oluşumu ve membran aktivitesini sağlarlar .
Dolaşımdaki trombositler, damarın endotel örtüsünde herhangi bir hasar olmadıkça, endotele ve birbirlerine yapışmadan hareket ederler. Normalde insan trombositi kanda yaklaşık 9–10 gün dolaşır ve sonra “Retikülo Endotelyal Sistem (RES)” tarafından parçalanır.
Travmadan sonraki kısa sürede zedelenen damarda oluşan vazokonstrüksiyon o damarda akımının yavaşlamasına neden olur. Vasküler sistemin antikoagülan ve prokoagülan özelliği olduğu bilinmektedir. Endotel; prostasiklin (trombosit adezyon ve agregasyonuna engel olarak), trombomodulin (Trombin, trombomodulin ile birleşerek Protein C’nin aktivasyonu ve APC; FV ve FVIII’in inaktivasyonuna neden olarak) ve t-PA sentez ederek antikoagülan özelliğe sahip iken, diğer taraftan vWF sentezi ile trombosit adezyonunu arttırdığı gibi, doku faktörü sentezi ile koagülasyon mekanizmasının aktivasyonuna ve PAI-1 sentezi ile fibrinoliz inhibisyonuna neden olabilecektir.
Trombositlerin hemostazdaki rolleri şu şekilde özelenebilir: Trombosit adezyonu (yapışması), trombosit şekil değişikliği, trombosit salınım reaksiyonu, trombosit agregasyonu, trombosit prokoagülan aktiviteleridir.
Dolaşımdaki trombositler hücre temelli bir hemostaz (Primer hemostaz) ortamı sağlarlar. Dolaşımdaki trombositler hasar görmüş bir damardaki subendotelial dokuya temas ettikleri zaman, integrin reseptörü GPIa/IIa ve GPVI aracılığıyla açığa çıkmış olan kollajene ve ikinci bir reseptör GPIb/IX-V (önceki adıyla GPIb–IX, CD sisteminde CD 42 olarak adlandırılır) aracılığı ile kollajene bağlı vWF’a tutunurlar. Trombositler vWF’ye bağlandıktan sonra, hasar görmüş yüzey üzerinde yuvarlanmaya, kaymaya başlarlar ve psödopod uzantıları geliştirerek biçim değiştirirler. Bu durum trombositlerin birbirlerinin çok yakınında kalmasına yardım eder. Onların birbirlerine tutunmasını ve aktivasyonunu artırır. GPIb/IX-V’nin vWF’e bağlanması GPIIb/IIIa reseptöründe(CD sisteminde adı CD 41/ CD 61 olarak belirlenmiştir) de bir yapı değişikliğine neden olur, bu da vWF’ye daha sağlam tutunulması ile sonuçlanır .
Trombositler trombin tarafından da aktive edilirler. Trombosit GPIb’si membranla ilişkili reseptörler aracılığı ile bu reaksiyonun kofaktörü olarak görev yapar. Böylece, büyümekte olan trombosit tıkacına daha fazla trombosit toplanmasına yardım eder. Kollajen ise trombosit adezyonu ve agregasyonunu sağlar. Kollajen; GPIa/IIa reseptörü aracılığıyla trombositleri bir bölgeye toplarken, GPVI reseptörü aracılığıyla ikinci bir bölgedeki trombositleri aktifleştirir. GPVI’ nin kollajene bağlanması, intraselüler kinaz ailesi protein sinyallerinin oluşumuna yol açar. GPIIb/IIIa, GPIb/IX-V ve GPIa/IIa eksikliği olan hastalarda önemli bir hemostaz bozukluğunun olması, bu adezyon ve aktivasyon reseptörlerinin klinik önemini gösterir.
Trombosit adezyonu kan akım hızı ile ilişkilerdir. Yavaş kan akım hızlarında trombositlerin fibrinojene bağlanması için GPIb/IIIa reseptörü yeterli iken, hızlı kan akım hızlarında ise adezyon ve agregasyona esas olarak GPIb/IX-V aracılık eder .
Aktive olmuş ve yapışmış trombosit granüllerinden bazı maddeler salgılanır. Bunlar: tromboksan A2 (TXA2), heparinaz, FVa, vWF, trombospondin, fibronektin, fibrinojen ve ADP’dir. Bu salınım fosfatidil inozitol döngüsü ve prostaglandin oluşumu ile birlikte gerçekleşir. Trombosit aktivasyonu ve sekresyonu siklik nükleotid düzeyindeki değişikliklerle, Ca++’ un hücre içine girmesiyle, membran fosfolipidlerinin hidrolizi ve hücre içinde önemli bazı proteinlerin fosforilasyonu ile düzenlenir. Trombosit membranında yer alan iki enzim olan fosfolipaz C ve fosfolipaz A2, trombositlere bağlanan agonistlerle (adrenalin, kollajen, trombin) aktive olur. Bu enzimler araşidonik asitten iki önemli membran fosfolipidinin salınmasını katalize ederler. Bunlar fosfotidilinozitol ve fosfatidilkolindir. Fosfolipaz C’nin fosfatidilinozitole etkisi sonucu oluşan inozitol trifosfat Ca++ depolama organelleri üzerindeki reseptörlerle etkileşir, iyonize Ca++’u harekete geçirir ve sitoplasmadaki yoğunluğunu artırır. Trombosit aktivasyonunda rol alan birçok süreç Ca++’ a bağımlıdır. Prostaglandin metabolizması ile ilgili olarak, araşidonik asitten siklooksijenaz enzimi etkisiyle TXA2 oluşur. Bu maddenin plazmada yarı ömrü 2 dakikadır ve etkisiz bir şekle (TXB2) dönüşür. TXA2 güçlü bir vazokonstriktördür ve yoğun granüllerden Ca++ harekete geçirerek salınım reaksiyonunu stimüle eder .
Travmayı takiben (endotel hasarı); trombosit adezyon, aktivasyon ve agregasyon olayı başlar. Oluşan trombosit ya da hemostatik tıkacın kanamanın mekanik olarak durmasını sağlar ve koagülasyon faktörlerinin fibrin oluşturmak için etkileşeceği yüzeye destek verir. Damardaki küçik hasarlanmalar da ise, trombosit tıkacı tek başına kan kaybını tamamen durdurabilir; geniş ise trombosit tıkacına ek olarak kan pıhtısı da gereklidir .
Trombosit tıkacının oluşması ile sekonder hemostaz bileşenleri olan koagülasyon sistemi ve fibrinolitik sistemler devreye girer .
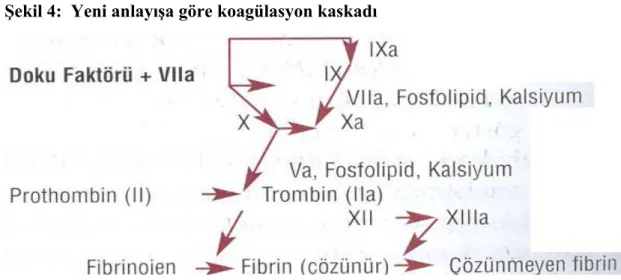
Sekonder hemoztaz sisteminin başlıca bileşenleri koagülasyon ve fibrinolitik sistemlerdir. Koagülasyonda sıvı halde akışkan kanın katılaşıp akamaz hale gelmesi ile oluşur. Bu olaylar değişik plazma proteinleri ile düzenlenir. 1964 yılında öne sürülen kaskad hipotezine göre Faktör XII aktivasyonu ile başlayan kontakt (intrensek) yol ve subendotelyal bölgeden açığa çıkan TF ile başlayan doku faktörü (ekstrensek) yolundaki reaksiyon dizileri sonucunda iki yolun son ürünleri Faktör X’un aktivasyonunu sağlar ve bundan sonra ortak olarak devam eden yol, trombin ve fibrin oluşumu ile biter.
2.1.2.1.Koagülasyon sistemi
Koagülasyon faktörlerinin sırayla aktivasyonu sonucu fibrinojenin fibrine, takiben fibrin polimerizasyonu ile fibrin tıkacının oluşması olayına koagülasyon kaskadı denilmektedir . Pıhtılaşma mekanizmaları 1964 yılında iki farklı araştırma grubu tarafından ortaya atılan kaskad hipotezi ile tanımlanmıştır. Pıhtılaşma faktörleri merkezde protein bir kor ve çevresinde sialik asit rezidüleri içeren yan zincirlerden oluşmuş glikoproteinlerdir. Koagülasyon faktörlerinin çoğunluğu serin proteaz yapısında ve dolaşımda inaktif öncüller (zimojenler) olarak dolaşırlar. Proteazlar tarafından parçalanarak aktif hale getirirler. Aktifleştikleri zaman FXII, FXI, FIX, FX ve protrombin (serin proteazlar) proteolitik enzim özelliği kazanırken FVIII ve FV bu proteoliz reaksiyonlarından bazılarını katalize eden kofaktörlere dönüşürler. Sonuçta bir faktör aktifleşmeden önce bir reaksiyonda substrat iken, aktifleştikten sonra başka bir reaksiyonun enzimi haline gelir. Her aktif enzim bir sonraki faktörün birden çok molekülünü aktifleştirdiğinden; aktive olmuş faktör moleküllerinin sayısı bir anda geometrik olarak artar. Koagülasyon proteinleri de kaskadın sonunda bir çığ etkisi yaratacak kadar çoğalmış olurlar. Koagülasyon sisteminde birbirini aktifleyen proteinler olduğu gibi inhibe eden proteinlerde mevcuttur. Böylelikle kanın akışkanlığı sağlanmış olur.
Pıhtılaşma faktörleri romen rakamları ile numaralandırılmıştır. Faktörlerin numaraları bulunuş sıralarına göre verilmiştir. Romen rakamları ile numaralandırılmamış başka koagülasyon proteinleri de vardır: yüksek molekül ağırlıklı kininojen (high – moleküler – weight kininojen, HMWK, Fitzgerald faktörü) ve prekallikrein (PK, Fletcher faktörü). FV ve VIII enzim değil kofaktördür. FVIIIa, FIXa’ nın FX’ u aktive edebilmesi için gereklidir. FVa ise FXa’ nın protrombini trombine çevirmesi için gerekli kofaktördür. FV ve FVIII’ i, FVa ve
FVIIIa şekline, trombin çevirir . Daha önce FVI olarak numaralandırılan faktör, FV’ in aktif şekli olduğundan listeden çıkarılmıştır.
Dolaşımda normalde bulunmayan tek faktör doku faktörüdür (Tissue factor, TF). Aktifleşmesi gerekmez, endotel hasarını takiben subendotelyal dokulardan çıktığı anda aktiftir. TF’ de FVIIa ve FVa gibi proteolitik enzim değil enzim kofaktörüdür. FIII bir doku faktörüdür ve plazmada bulunmaz. FIV, Ca++ iyonudur. Diğer faktörler protein yapısındadır (Tablo 1).
Koagülasyon proteinlerinin çoğunun, koagülasyonun fizyolojik inhibitörlerinin birkaçının ve fibrinolitik sistemin ana komponentlerinin sentez yeri karaciğer parankim hücreleridir. Aynı zamanda karaciğer, aktive pıhtılaşlma faktörlerini ve plazminojen aktivatörlerini sistemik dolaşımdan temizleyerek hem hemostazı hem de fibrinolizi düzenler . FVIII kompleks bir moleküldür, yalnız pıhtılaşma aktivitesi gösteren ve FVIII: koagülan protein (VIII: C) olarak adlandırılan parçası karaciğerde yapıldığı, diğer parçasını olusturan ve multimerik yapıda bir glikoprotein olan vWF’ nün ise başlıca endotel hücrelerinde ayrıca megakaryositlerde sentez edildiği gösterilmistir. vWf multimerleri FVIII’ in stabilizasyonunu ve dolaşımda taşınmasını sağlar ve trombositlerin endotel altı dokuya adezyonuna yardım eder. FII, FVII, FIX, FX karaciğerde sentezleri sırasında K vitaminine kofaktör olarak ihtiyaç gösteren proteinlerdir. Bu proteinlerdeki glutamik asit rezidülerinin karboksilasyonunu ( Epoksit redüktaz enzimi aracılığı ile) K vitamini sağlar. Böylece bu faktörler Ca++ aracılığıyla fosfolipid yüzeylere tutunabilme yeteneği kazanırlar .
Plazmatik faktörler dısında pıhtılaşma reaksiyonları için gerekli fosfolipid yüzeyleri intrensek pıhtılaşma yolunda trombosit faktör 3, ekstrensek pıhtılaşma yolunda ise doku faktörü III (TFIII) tarafından sağlanır. TF, hücre membranlarının hemen tamamında bulunan glikoprotein-fosfolipid kompleksidir. Plazmayla temas eden kan hücrelerinin ve endotelin yüzeyinde bulunmaz. Monosit ve endotel hücrelerinin inflamatuar sitokinlerle uyarılması bu hücrelerde TF’ nin indüklenmesine yol açar (Tablo 2).
Tablo 1: Kan koagülasyon proteinlerinin adlandırılması ve özellikleri (35)
Faktör Sinonim Sentez Yeri MolekülAğırlığı ÖmürYarı FonksiyonelAktivite
I Fibrinojen Karaciğer 340.000 3-4 gün Substrat
II Protrombin Karaciğer 72.000 60 saat Serin proteaz
III Tromboplastin
IV Ca++
V Labil faktör Karaciğer 330.000 12-16 saat Kofaktör VII Prıkonvertin Karaciğer 48.000 6-8 saat Serin proteaz
VIII ( C ) FVIII koagülantı 280.000 12 saat Kofaktör
VIII (Ag) VWF Megakaryositendotel 800.000 12 saat Kofaktör IX Christmas faktör Karaciğer 54.000 24 saat Serin proteaz
X Stuart-Powerfaktör Karaciğer 59.000 48-72 saat Serin proteaz
XI tromboplastinPlazma Karaciğer 160.000 48-84 saat Serin proteaz XII Hageman Faktör Karaciğer 80.000 48-92 saat Serin proteaz
XIII
Fibrin stabilize
edici faktör Karaciğer 320.000 3-5 gün Transamidaz Prekallikrein Fletcher faktör Karaciğer 85.000 Serin proteaz
HMWK Fitzgerald faktör Karaciğer 110.000 5-6 gün Kofaktör
Tablo 2: Pıhtılaşma işlevi
Pıhtılaşma başlatıcılar: Protrombotik Prokoagülanlar ve platelet aktivatörleri- TF, PAI_!, vWF,Fibrinojen, Kollajen, IL_1, Adezyon molekülleri, Trombin, Serotonin, Epinefrin, Vazopressin, İmmunkompleksler, TXA2, PAF, FXIIa, plazmin
Pıhtılaşmayı sağlayıcılar (Faktörler): Protrombin, FIX, FX, FXI, FXII, FV, Ca++, fosfolipidler, fibrinojen
Pıhtılaşmayı önleyiciler:
Doğal prokoagülanlar
Protein C ( K vitaminine bağımlı) (Karaciğerde) Protein S ( K vitaminine bağımlı) (Karaciğerde) Antitrombin III (Karaciğerde)
TFPI ( Tissue factor pathway inhibitor)(Endotel’de) α2-Makroglobin
Heparin Kofaktör II
Trombomodulin (Endotel’de)
Platellet aktivasyon inhibitörlrti: NO, PGE2, PGI2, ADPase, ATP Difosfohidrolaz
Fibrinlitik sistem: Plazminojen, Plazmin, t-PA, Ürokinaz
2.1.2.1.1. Pıhtılaşma Faktörlerinin Sınıflandırılması A- K vitaminine bağımlı faktörler.
1. Faktör II (Protrombin) 2. Faktör VII 3. Faktör IX 4. Faktör X 5. Protein C 6. Protein S
B-Trombine duyarlı faktörler:
1. Faktör I (fibrinojen) 2. Faktör V 3. Faktör VIII 4. Faktör XIII C-Kontakt faktörleri 1. Faktör XII 2. Faktör XI 3. HMWK 4. Prekallikrein
D-Fosfolipidler ve kalsiyum iyonları E-Koagülasyon inhibitörleri
2.1.2.1.2. K vitaminine bağımlı faktörler
K vitaminine bağımlı plazma proteinleri: Protrombin (FII), FVII, FIX, FX, Protein C ve Protein S karaciğerde sentezlenir. Bunlar Gama karboksi glutamik asit (GIa) kalıntılarını ihtiva ederler ve böylece diğer proteinlerden ayrılırlar. Molekülün amino terminal bölgesinde yer alan ve sayıları 10–14 arasında değişen GIa kalıntıları, glutamik asitlerin karboksilasyonu ile meydana gelir. K vitamini bu reaksiyonda görev alır.
K vitaminine bağımlı pıhtılaşma faktörlerindeki Gla kalıntıları sayesinde Ca++’ a bağımlı bir mekanizma ile fosfolipitlere bağlanma özelliği kazanırlar. Fizyolojik aktivitelerini göstermeleri için mutlaka bu posttranslasyonel modifikasyona ihtiyaçları vardır .
Bu faktörler karaciğerde sentez edildikten sonra, K vitamini tarafından aktive edilene kadar biyolojik etkinlikleri yoktur.
Glutamik asidin karboksilasyonunda K vitamininin kofaktör olarak rolü vardır. Bu reaksiyon koagülasyon aktivitesi için gerekli Ca++ bağlantı yerlerini sağlar. Koagülasyon faktörlerinin prekürsörleri PIVKA (proteins induced by vitamin K absence – K vitamini yokluğunda oluşan proteinler) olarak adlandırılır. K vitamini eksikliğinde plazmada PIVKA düzeyleri artar . Her K vitaminine bağımlı pıhtılaşma faktörü için bir PIVKA tanımlamak mümkündür. Kumarin gibi oral antikoagülanlardan sonra K vitamini inhibisyonu veya yokluğu durumunda da PIVKA düzeylerinde artış olur.
K vitaminine bağlı proteinlerin çoğu bir serin proteazdır. Koagülasyon sistemindeki K vitaminine bağımlı serin proteazların katalitik olmayan kısmı 3 farklı bölge ihtiva eder. Bunlar GIa bölgesi, EGF (Epidermal Growth Factor) bölgesi, kringle (ilmik) bölgesidir. GIa bölgesinde gama karboksiglutamik asit taşınır. Molekülün NH2 terminal ucunda yer almıştır ve metal iyonlarını bağlama özelliğine sahiptir. EGF bölgesi, epidermal büyüme faktörüne çok benzediği için bu ismi almıştır. Kringle bölgesi ise katlanmış bir yapıda olup, belirli proteinleri bağlamakla görevli olduğu düşünülmektedir (82).
K vitaminine bağlı plazma proteinleri; 1. Faktör II (Protrombin) :
Protrombin 72.000 Dalton molekül ağırlıklı, yarı ömrü invivo olarak 79 – 96 saat arasında değişen ve plazma konsantrasyonu en yüksek olan K vitaminine bağımlı bir proteindir. Yapısal olarak başlıca iki bölgeye ayrılabilir; ilki 274 aminoasitten meydana gelen ve iki oligosakkarit tasıyan “pro” kısmı, diğeri ise 304 aminoasitten oluşan ve tek bir oligosakkarit zinciri taşıyan “trombine dönüşen kısım – pretrombin 2’dir . Pro kısmında yapısal olarak birbirine benzeyen, fakat fonksiyonel olarak farklı iki bölge vardır: 1–156. aminoasitler arasındaki bölge; protrombin fragman 1 ve 157 – 274. aminoasitler arasındaki bölge; protrombin fragman 2 olarak adlandırılır. Bu iki bölge üçlü disülfit bağları taşır ve ilmik bölgesi adını alır. Her biri ilmiğe benzediği için, bu şekilde adlandırılmıştır.
İki bölgenin tersiyer yapıları birbirine çok benzerken primer yapılarındaki aminoasit dizileri çok farklıdır . Fragman 1’in aminotermal ucundaki 40 aminoasitlik dizisinde oluşan bölge 10 adet GIa ihtiva eder ve bunların 6 tanesi diğer K vitaminine bağımlı proteinlerde olduğu gibi çift yerleşim gösterir. Bu bölge GIa bölgesi olarak adlandırılır. Trombine dönüsen kısım (Pretrombin 2)’da 2 bölgeden meydana gelir: A ve B bölgesi.
Trombinin aktif bölgesi B zincirindedir. Trombin bir disülfit köprüsü taşır ve çift zincirlidir ve proteolitik aktiviteye sahiptir. Protrombinin fizyolojik aktivasyonu FXa ve FVa tarafından aktive edilir .
Normal protrombindeki GIa kalıntılarına hiç sahip olmayan veya daha az sayıda sahip olan anormal protrombin molekülüne, PIVKA II denir. GIa, gama pozisyonunda karboksillenip, GIa şekline dönemeyen protrombin molekülü, normal protrombine benzer immünolojik özelliğe sahiptir ama fizyolojik şartlarda fonksiyonel değildir. Böyle bir proteinin varlığı ilk defa 1963 yılında Hemker tarafından oral antikoagülan tedavisindeki kişilerin plazmasında tespit edildi .
Protrombin fizyolojik şartlar dışında bazı yılan zehirleri tarafından da aktifleştirilebilir. Bunlardan biri olan echis carinatus, hem normal protrombini hemde anormali aktifleştirebilir. Staphylococcus aureus’un sekrete ettiği stafilokoagülaz adı verilen bir protein de hem normal hem de anormal protrombinle kompleks teşkil ederek trombine benzeyen bir aktivite oluşturur .
PIVKA II, Ca++ bağlayamadığı için Ca++ iyonları varlığında gerçekleştirilen elektroforezde katoda daha hızlı göç eder. Bu özelliğinden faydalanarak “cross” immunoelektroforezle varlığı gösterilebilir .
2. Faktör VII :
FVII, TF aracılığıyla pıhtılaşmayı başlatan ve molekül ağırlığı 45.000 – 54.000 D olan bir glikoproteindir. FVIIa, koagülasyon kaskadında FIX ve FX’ u aktifleştirir. Yarılanma ömrü 2-6 saattir. Aktive olduğunda FVII, birbirine disülfit köprüsü ile bağlı çift zincirli bir yapı kazanır, bir aktivasyon peptidi ayrılmaz. Bu yapıda molekül ağırlığı 29500 D olan ağır zincir aktif bölgeyi içerir. Amino terminal bölgesinde meydana gelen, 2900 D molekül ağırlığı olan hafif zincir ise K vitaminine bağımlı degişikliklere sahiptir .
3. Faktör IX :
FIX, glikoprotein olup molekül ağırlığı 55000 D’ dur. Yarılanma ömrü 20-30 saattir. Molekül yapısı diğer K vitaminine bağımlı pıhtılaşma faktörlerine çok benzediği için saflaştırılması güçtür. İlk kez 1950 yılında Aggler ve arkadasları tarafından kısmi olarak saflaştırılmıştır. Sadece FXIa ile değil, TF ve FVIIa tarafındanda aktive edilebilir. Fakat reaksiyon hızı, aynı faktörlerin FX’ u aktive etmelerine göre 6–7 defa daha yavaş olup aktivasyonun fizyolojik önemi bilinmemektedir .
FX, hem intrensek hem de ekstrensek yolun ortak substratıdır. Molekül ağırlığı 55000 D’ dur. Plazma yarılanma ömrü ise 20-40 saattir. Bu faktör diğer K vitaminine bağımlı faktörlerin aksine inaktif şeklinde de çift zincirlidir. FX, FIXa, FVIIIa, Ca++ ve fosfolipid varlığında aktifleşir .
5. Protein C :
K vitamine bağımlı bir protein olan protein C (PC), pıhtılaşma sisteminin önemli bir inhibitörüdür ilk kez 1960/1961’de Seeger’in laboratuvarında Mammen, Ulutin ve Seeger tarafından, bir laboratuvar çalısması esnasında izole edilmiş ve “Autoprotrombin II-antikoagülan” olarak adlandırılmıştır. 1976’da ise Stenflo; plazmadan, vitamin K’ya bağımlı yeni bir faktör izole etti ve “protein C” adını verdi. Bu iki molekül karşılaştılrıldığında aynı madde olduğu gösterildi. Bugün, Autoprotrombin II-A yerine Protein C terimi tercih edilmektedir . Karaciğerde sentezlenir, molekül ağırlığı 62 000 D kadardır . Plazmada yarı ömrü 8–10 saattir. Protein C dolaşımda zimo halde bulunur, aktive olmadıkça antikoagülan etki göstermez . (Şekil 2)
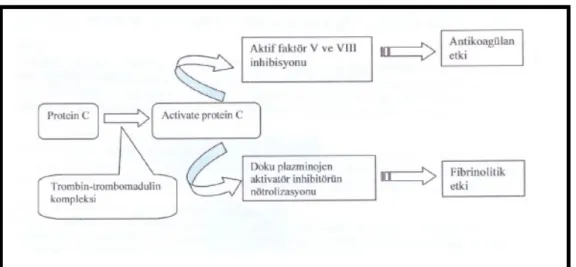
Koagülasyon sisteminin kontrolü doğal antikoagülan sistemler tarafından sağlanır. Bunlardan biri Protein C’ dir ( diğerleri heparin-antitrombin III ve doku faktör inhitöleridir ). Diğer mekanizmalar proteaz kompanentlerin inhibisyonunu sağlarken, PC nonproteolitik mekanizmalardan FVa ve FVIIa’ nın inhibisyonunu sağlamaktadır. Koagülasyon reaksiyonlarında ortaya çıkan trombin damar endotel hücrelerinin yüzeyindeki trombomoduline, büyük damarlardaki endotelial hücrelerde bulunan endotelial PC reseptörü (EPCR) ise PC’ye bağlanır . Trombin-trombomodulin kompleksi PC’ yi katalitik olarak aktive edebilme özelliğindedir. Trombin-trombomodulin kompleksi ile EPCR’ye bağlı PC’ yi serbest PC’ye göre daha etkin olarak aktive edebilme özelliğindedir. Aktive olan PC’nin bir kısmı EPCR’den ayrılarak hızla mikrosirkulasyona geçer. EPCR’ye bağlı olarak kalan PC antikoagulant aktivitesini kaybetmiş olarak bulunur. EPCR’ye bağlı olarak kalan PC FVa’ yı inaktive etme özelliğine sahip değildir. APC endotelial hücre yüzeyindeki protein S (PS) ile devamlı etkileşim halindedir. Bu etkileşim APC’nin trombosit ve diğer endotelial hücre yüzeyine bağlanmasını kolaylaştırır. Hücre yüzeyine bağlı olarak bulunan APC, FVa ve FVIIIa inaktive edebilme özelliğindedir . APC ile Faktör Va’da ilk olarak Arg506 parçalanmaya başlar bunu Arg306 ve Arg679 bölgeleri izler.
APC’ nin ayrıca profibrinolitik özelliği de vardır. APC’nin antienflamatuar etkisi ise mekanizması tam anlaşılmamış bir yoldan PAI–1’ i etkisizleşyirmesine bağlıdır. Normalde plazma APC düzeyleri çok düşüktür, ancak trombojenik stimulus ile artar. Dolaşımdaki
aktivitesinin yarı ömrü 15 – 20 dakika kadardır. APC primer olarak PC inhibitörü (PAI – 3) ve daha az miktarda α1 Proteinaz inhibitör ve α2 makroglobulin ile inhibe edilir .
1993’de Dahlback tarafından APC resistansı (APCR) tanımlanmıştır. APCR invitro test temelinde plazmada anormal olarak azalmış antikoagulant cevabı tanımlamaktadır. Dahlbäck, derin ven trombozlu ailelerde, aktive parsiyel trompalstinle eşde edilen cevabın bozukluğu sonrası APCR’ nin varlığını yayınlamıştır. Yaptığı çalışmada DVT’ u vakalarının %20’sinde ve ailesel venöz tromboz vakaların %50’sinde APCR’ nı saptamıştır. Kısa bir süre sonra yapılan çalışmalarda buna sebep olan bozukluğun FV’ teki noktasal mutasyondan kaynaklandığı saptanmıştır .
Kalıtsal koagülasyon defektleri içinde en sık sebep faktör V leiden (FVL) mutasyonudur. PC geni kromozom 2q14-21’de bulunmakta olup, 11 kb uzunluğunda, 9 ekzon ve 8 introndan oluşmaktadır .
Şekil 2: ProteinC Mekanizması
6. Protein S:
1977’de Di Scipio ve arkadaşları tarafından tanımlanmıstır. K vitaminine bağımlı bir protein olup molekül ağırlıgı 70 000 D’dur. PS geni kromozom 3p11.1–11,2’de bulunmakta olup, 80 kb uzunlugunda, 15 ekzon ve 14 introndan oluşmaktadır . Normal bireylerde plazma konsantrasyonu 25µg/ml’dir. Plazmada %40’ı serbest, %60’ı C4b-bağlayıcı protein (C4b-BP) ile dolaşan PS; APC’nin FVa ve FVIIIa’yı inaktivasyonunda nonenzimatik kofaktördür . Bağlı şekil C4b bağlayıcı proteinle kompleks halindedir ve fizyolojik olarak aktif değildir. PS geni, 3. kromozomun p11.1-p11.2 bölgesine lokalize olmuştur. Bu gen üzerinde çoğu nokta mutasyonu olmak üzere, 13’ten fazla mutasyon tespit edilmiştir . PS bir proteaz değildir. NH2
terminal ucunda 11 GIa ihtiva eder . PC’nin FVa ve FVIIIa’yı inaktive ettiği reaksiyonların kofaktörüdür. PS, normalde plazmada ve trombositlerin α granüllerinde bulunur . Protein S, APC’nin FVIIIa ve FVa üzerindeki etkisini arttırır. Hepatositlerde, endotel hücrelerinde testis leyding hücrelerinde, megakaryositlerde ve nöral tümör hücrelerinde yapılır. Plazma yarı ömrü 42 saattir. Plazmada PS’nin %40’ı 1:1 oranında C4b-bağlayan proteine (C4b- BP) bağlı olarak bulunur. C4b- BP bir akut faz reaktanı olup, klasik kompleman yolunda negatif regülatördür. PS’ nin %60’ ı serbest halde bulunur ve aktif olan kısmıdır. PS’ nin kendisi de tenaz ve trombinaz komplekslerini inhibe edebilir, bu reaksiyon APC’ den bağımsızdır. Plazma PS düzeyini hem C4b-BP düzeyi hem de PS molekülünü birkaç yerinden parçalayan trombin düzeyi belirler .
PS trombin tarafından parçalanınca; proteinin Ca++ bağlama özellikleri değişir, fosfolipid bağlayamaz ve PC’ nin kofaktörü olarak görev yapamaz . PC ve PS doğal antikoagülan sisteminin merkezinde yer alır. Bu sistem pıhtılaşmayı önlemekle kalmaz, aynı zamanda fibrinolizi artırır. Trombin; endotel yüzeyinde trombomodülünün varlığında, prokoagülan aktivitesinin nötralize edildiği ve PC’ yi aktifleştirme yeteneğinin arttığı bir kompleks olusturur. Bir kofaktör olan PS ile birlikte APC, FV ve FVIII’i inaktive ederek trombin oluşumunu engeller. APC aynı zamanda fibrinolizi de uyarır. Bunu kısmen tPA’ nın önemli bir inhibitörünü nötralize etmek suretiyle yapar . Kısmi PC eksikliği olan heterozigot olgularda genellikle adolesan çağda veya genç erişkin dönemde tromboembolik fenomen ortaya çıkarmaktadır . PS eksikliği de hetorozigotlarda tromboemboliye yol açar. PC veya PS eksiklikleri DVT için önemli bir risk faktörüdür .
2.1.2.1.3. Trombine Duyarlı Faktörler 1. Faktör I (Fibrinojen) :
Fibrinojen, molekül ağırlığı 340.000dalton olan ve plazmada yüksek konsantrasyonda bulunan bir pıhtılaşma faktörüdür. Yarılanma ömrü 100 saat dolayındadır . Fibrinojen yapısal olarak disulfid köprüleri ile kovalent bağlarla bir arada tutulan büyük bir moleküldür. Simetrik yarı moleküllerin her biri üç değisik polipeptid zincirini (α , β ve γ zincirleri ) içeren bir küme olusturur. İki yarı molekül merkezi amino terminal bölgede anti paralel bir tarzda zincirler arası üç disulfid köprü ile birbirine bağlanır. Bunlardan ikisi γ zincirleri diğeri ise α zinciri arasındadır. β ve γ zincirleri asparjin bağlı kompleks oligosakkaritler tasırlar. Bu zincirlerin üçü de karaciğerde sentezlenir. İlişkili olan genlerin üçü aynı kromozom üzerinde bulunur.
Disulfid bağları tarafından 6 adet zincirin amino terminal bölgeleri birbirleri ile yakın konumda tutulurken, buna karsılık karboksi terminal bölgeleri asimetrik olarak uzanmıs bir molekül yapısının gelismesine yol açmaktadır. Zincirlerin amino terminal uçlarındaki fibrinopeptid A ve fibrinopeptid B bölümleri, tirozin sülfatın yanı sıra aspartat ve glutamat kalıntılarının varlığı nedeniyle aşırı negatif yükler taşır. Bu negatif yükler; plazmada fibrinojenin çözünürlülüğüne katkıda bulunur. Elektrostatik olarak birbirlerini uzaklaştırmalarına neden olan fibrinojen molekülleri agregasyonu engellemeye yardımcı olur . Fibrinojen, trombin ve plazmin tarafından parçalanır. Trombin fibrinojenden fibrinopeptid A ve B olusumunu indükler (36).
2. Faktör V:
FV, molekül ağırlığı yaklaşık 330.000 Da olan tek zincirli bir glikoproteindir. İnvivo yarı ömrü 12–15 saat arasındadır. Yapısında A1, A2 ve B olmak üzere 3 önemli alt birimi vardır. Bunlar içerisinde koagülasyondaki aktiviteden sorumlu olan B alt birimdir. B alt birimi ağır (150.000Da) ve hafif (4.000 Da) zincirlerden oluşmaktadır. Plazmadaki konsantrasyonu 4–10 ng/ml olup % 80’ni serbest halde bulunurken % 20’si trombositlerde bulunmaktadır. Trombositlerdeki FV seviyesi ve fonksiyonu hem normal hem de anormal hemostazda önemli rol oynamaktadır. Megakaryositler ve lökositler tarafından üretilen FV endotel hücreleri, trombositler ve monositlerin yüzeylerinde de bulunmaktadır.
FV kan koagülasyon proteinlerinden en önemlilerinden biridir. Trombin tarafından aktiflenir ve oluşan aktif FV (FVa) N-terminal kısmı 105 kDa, C terminal kısmı ise 74kDa olan heterodimerik bir yapıdadır. Her iki alt birim Ca++ iyonuyla nonkovalent olarak bir arada tutulur. Kendisi APC’nin kofaktörü olarak fonksiyon görür. APC, FVa ve FVIIIa’yı inaktive ederek kanın pıtılaşmasını engelleyen bir serin proteaz enzimidir .
FV, FXa için kofaktördür. Fosfolipid ve Ca++ ile birlikte FII’ nin aktivasyonundan sorumludur. FX’ un trombosit membranı üzerinde toplanmasını kolaylaştırır .
3. Faktör VIII:
FVIII molekül ağırlığı 1 milyon daltondan fazla glikoproteindir. Bu faktörün karbonhidrat kısmı onun koagülan aktivitesinden ziyade trombosit bağlayıcı özellikleri için önemlidir. FVIII’ in yapısında koagülan aktiviteye sahip düşük bir moleküler fraksiyon (FVIIIC) ve vWF aktivitesi gösteren yüksek bir moleküler fraksiyondan yapılıdır (FVIII: vWF). Bu iki birim birbirine nonkovalent bağlarla tutturulur. FVIII’ in “koagülan aktivite fraksiyonu” (FVIIIC) trombin ile önce aktive edilir, sonra da inaktive edilir. FVIIIC aynı sekilde plazmin tarafından da inaktive edilir. VWF trombositlerin kollajene bağlanmasında köprü görevi yapar ve FVIII’in plazmada taşınmasını sağlar .
4. Faktör XIII:
Koagülasyon faktörü olan Faktör XIII’ün varlığı ile ilgili çalışmalar 70 yıl önce Barkan ve arkadaşlarının Ca++ varlığında fibrin pıhtılarının zayıf bazda çözünmez hale gelmesini tespit ile başladı . Yaklaşık 20 yıl sonra Robbins fibrinojenden arındırılmış ve en son Ca++ ile etkileştirilmiş pıhtının zayıf asit ve bazda çözünmemesi için bir faktör gerektiğini tespit etmiş . Laki ve Lorand ise üre solüsyonundaki çözülmeyen fibrin pıhtısının oluşumuna katkıda bulunan bu faktöre “fibrin stabilize edici faktör” demişlerdir . 1963 yılında ise uluslararası komiteler tarafından bu faktöre “Faktör XIII” ismi verildi .
FXIII; koagülasyonun son aşamasında aktif hale gelen bir protransglutaminazdır (pro-TG). Çözülmeyen bir yüzey üzerinde çalışır. FXIII, Ca++ varlığında trombin tarafından aktive edilir. Bundan başka yılan zehirleri, tripsin ve papain gibi proteazlar FXIII’ü aktive edilebilir. Bu reaksiyonlar B zincir çiftinin yıkılmasını içerir. B zincir çift enzimatik olarak aktif kısımdır. FXIIIa, bir fibrin monomer zincirinin glutamin bölgesi ile ikinci bir fibrin zincirinin lizin bölgesi arasında peptid baglarının olusumunu sağlar. Böylece fibrin enine bağlanır ve stabilize edilir .
Potansiyel olarak aktif alt birimleri trombositler, monositler, monosit kökenli makrofajlar, dendritik hücreler, kondrositler, osteoblastlar ve osteositler stoplazmasında mevcuttur. FXIII hemostaza yaptığı katkıların yanı sıra birden çok hücre içi/disi işlevleri vardır. Örneğin gebelik koruması, yara iyileşmesi sürecine olan katkısı ve proanjiyogenik fonksiyonlari vardir . FXIII’ün damar geçirgenliğini inhibe etmesi, kardiyoprotektif özelliği ve kıkırdak ve kemik gelişiminde rolü açısından daha detaylı araştırma yapılması gerekmektedır . Faktör 13 fibrin molekülleri arasındaki reaksiyon dışında fibronektin, vitronektin, kollagen ve lipoprotein arasındaki bağlantıları da katalize edebilir .
FXIII plazma içerisinde tetramerik şeklinde (FXIII-A2B2) dolaşan bir pro-TG dir. FXIII, iki potansiyel olarak aktif, katalitik A alt birimleri (FXIII-A) ve iki taşıyıcı / inhibitor B alt birimlerinden (FXIII-B) oluşmaktadır. FXIII-B % 50 plazma da serbest nonkompleks formunda mevcuttur. FXIII-A dimeri (FXIII-A2), aynı zamanda, özellikle, trombosit ve monositler / makrofajlar gibi hücrelerinin stoplazması içinde mevcuttur.
FXIII-A metionin bir başlatıcı dahil olmak üzere 732 aminoasitten oluşur; moleküler kütle 83 kDa miktarındadır . Tek bir trombositin ortalama tahmini FXIII-A içeriği olan 60+/-10 fg, toplam trombosit proteinleri miktarinin % 3'üne tekabül etmektedir . FXIII-A
konsantrasyonu plazma ile karşılaştırıldığında trombosit stoplazmasında 150 kat daha yüksektir. FXIII-A trombositlerin preküsör hücresi olan megakaryositlerde de yer almaktadır .
FXIII-B 641 aminoasidinden oluşan ve %8,5'i karbonhidratlı içeren bir glikoproteindir; moleküler kütlesi 80 kDa dir. FXIII-B iç disülfit bağlarından oluşan tipik bir mozaik proteindir.
FXIII plazmada sadece yeni oluşmuş fibrin yüzeyi üzerinde aktif hale gelir, ve kesilmiş aktif dimer tabaka ile bağlantılı kalır; FXIII fibrin pıhtısının fibrinolitik sistem tarafından bozulmadan korunmasında önmeli bir rolü vardir. Ayrıca fibrinoliz süreci başladığında trombin yapışacak FXIII’ ü serumda bulamaz .
FXIII’ün fibrinolize karşı koruyucu etkisi akış altında oluşmuş pıhtılarda gösterilmistir . FXIII pıhtılaşma sisteminin önemli bir bileşenidir; eksikliğinde ciddi kanama bozukluğuna neden olur. FXIII’ün hemostazdaki ana işlevi yeni oluşan fibrin stabilizasyonu sağlamaktır. FXIII; fibrinin γ-zincirleri, dimerlere ve yüksek moleküler ağırlıklı polimerlere çapraz bağlayarak, fibrin pıhtısının rijiditesini ve kuvvetini artarir. Böylece dolaşımın gerilmesine karşı fibrini korur. FXIII, oluşan fibrinlerin fibrinolitik sistemi tarafından hemen ortadan kaldırılmasına karsi korur. Bunu, ana plazmin inhibitörü olan α2 plazmonijenin fibrin iplikçiklerine kovalent olarak çapraz bağlanması sonucunda, plazminojenin fibrine çapraz bağlanması azalır, bununla ilişkili olarak plazminin fibrine çapraz bağlanması ve lizisi azaltılır.
Fibrin jel oluşumu, makrofaj invazyonu, fibroblast migrasyonu/proliferasyonu, ekstraselüler matriks ve yara iyileşmesinde anjiyogenez için önemli olaylardır. FXIII hücre dışı matriks proteinleri çapraz bağlayarak, fibroblastlar ve makrofajlara etki ederek ve anjiyogenezin karmaşık mekanizmasına olumlu etki gosterir. Fibrinojen, FVII, FVIII, FIX ve FX düzeyleri gebelik sırasında dereceli olarak artmaktadır. Benzer bir durum FXIII-B içinde soylenebilir .
FXIII kardiak etkisini, extraselüler matriks bileşenlerinin sentezi arttırarak ve iskemik doku hasarı durumda, mikrodamar anjiyojenezi arttırarak ve inflamatuar hücre akımı module ederek gösterir .
2.1.2.1.4. Kontakt Faktörleri
FXII, FXI, HMWK ve kallikreindir. Kontakt faktörler bazal membranlar, fosfolipitler, kollajen ve trombositler gibi negatif elektirik yüklü yüzeylere intrensek pıhtılaşma sisteminin ilk aktivasyon fazı sırasında bağlanır. Bu faktörler sadece pıhtılaşma işlemi aktivasyonu sırasında değil, fibrinoliz, kinin ve kompleman sisteminin aktivasyonunda da rol alırlar. Kontakt faktörleri eksik olan hastaların hemorojik eğilimi saptamazken FXI’ de bu durum gözlenebilir.
İnvitro olarak koagülasyonu başlatan olaylar in vivo olarak hemostazı baslatan olaylarla farklı olabilir. İntrensek yolun baslangıç adımlarıyla ilgili üç protein FXII, PK (prekallikrein) ve HMWK’den herhangi birinin yokluğu trombinin yavaş üretilmesine yol açar ve in vitro pıhtılaşma zamanı ile kısmi tromboplastin zamanını (PTT) uzatır. Bununla beraber bu üç proteindeki bir yetmezlik, hemostazda herhangi bir defekte yol açmaz. Bununla birlikte, FXI yetmezliği sıklıkla hemostatik yetmezlikle sonuçlanır. Bu klinik gözlemler in vivo olarak damar yaralanmasına yanıtın, üç temas proteinini atlayan ve direk olarak FXI’i aktive eden bir reaksiyonu içerdiğini gösterir. Trombositler FXI’ in aktivasyonunda FXII’ den bağımsız bir reaksiyonla yer alabilir .
1. Faktör XI:
FXI, molekül ağırlığı 160.000 D olan bir glikoproteindir. Disülfit köprüleriyle iki eş polipeptid zinciri birbirine bağlıdır. FXI, FXIIa tarafından aktiflendiğinde her zincirin bölünür ve bu bölünmüş üarçalarda disülfit köprüleriyle bağlanırlar. Aktif merkez hafif zincir içinde bulunur. FXI proteini in vitro olarak stabildir, plazma ve serumda mevcuttur. 10–20 saat arası biyolojik yarı ömrü vardır .
2. Faktör XII:
FXII, molekül ağırlığı 80.000 D olan bir glikoproteindir. Biyolojik yarı ömrü 50–70 saat arasındadır. Molekülün yıkılınca 28.000 D ağırlığında enzimatik olarak aktif bir parça olusur (αXII a). Bu parça yabancı yüzey bulunmasa bile aktiftir. βXII a ise etkili bir prekallikrein aktivatörü olduğu halde koagülasyon aktivitesi zayıftır . Faktör XII koagulasyonun başlaması, fibrinoliziste, kompleman sistemin aktivasyonunda, bradikinin oluşumunda rol alır. Son zamanlarda ödem oluşumunda da rol aldığı gösterilmiştir.Koagulasyonda intrinsik yolu başlatır. Aktive Faktör XII Faktör XI aktifler. Faktör XII eksikliği kanama semptomlarına yol açmaz. Genelde sağlıklı bireylerin kontrol amaçlı, preoperatif değerlendirme için bakılan Aptt uzama saptandıktan sonra tespit edilir. Faktör XII N-terminl ağır zincir ve C- terminal ağır zincirden oluşur.NH2-terminal parçası negatif yüklü alanları bağlar. 2 fibronectin-type domains(FT-I, FT-II) 2 EGF benzeri ve proteinden zengin alanlar içerir. COOH-terminal parçası enzimatik aktiviteye sahiptir. Faktör XII geni 5. kromozomun uzun kolunda (5q33) lokalizedir. 14 exon ve 13 introndan oluşur. Faktör XII geni 19 aa sinyal peptid ve 596 aa matur proteini kodlar.