T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ GENETİK ANABİLİM DALI
Akciğer Kanserli Hastalarda Periferik Kandan ctDNA’nın Metilasyon
Değişikliklerinin Dijital PCR ile İncelenmesi
DR. ZEHRA CENGİSİZ
DANIŞMAN
DOÇ. DR. ASUDE DURMAZ
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ GENETİK ANABİLİM DALI
Akciğer Kanserli Hastalarda Periferik Kandan ctDNA’nın Metilasyon
Değişikliklerinin Dijital PCR ile İncelenmesi
DR. ZEHRA CENGİSİZ
DANIŞMAN
DOÇ. DR. ASUDE DURMAZ
ÖNSÖZ
Uzmanlık eğitimim süresince ve bu çalışmanın yapılmasında kıymetli bilgi ve deneyimlerini benimle paylaşan, güler yüzü ve samimiyetiyle her zaman desteğini hissettiğim, aklıma takılan her konuda hiç çekinmeden danışabildiğim, değerli emeklerinin meslek hayatımda her zaman faydalı olacağını düşündüğüm, birlikte çalışmaktan onur duyduğum değerli tez hocam Doç. Dr. Asude Durmaz’a,
Uzmanlık eğitimim süresince her zaman beni desteklediklerini hissettiğim, bilgi ve deneyimlerimden yararlandığım kıymetli hocalarım Prof. Dr. Ferda Özkınay, Prof. Dr. Özgür Çoğulu, Prof. Dr. Haluk Akın, Prof. Dr. Hüseyin Onay, Doç. Dr. Emin Karaca, Doç. Dr. Burak Durmaz, Doç. Dr. Ayça Aykut ve Doç. Dr. Tahir Atik’e,
Tezime yaptıkları katkılar nedeniyle, Ege Üniversitesi Tıp Fakültesi Göğüs Hastalıkları A.D’dan Prof.Dr. Tuncay Göksel’e, Uzm.Dr. Haydar Soydaner Karakuş’a, Ege Üniversitesi Tıbbi Patoloji A.D.’dan Prof.Dr. Ali Veral’e, Ege Üniversitesi Tıp Fakültesi Biyoistatistik ve Tıbbi Bilişim A.D.’dan biyoistatistik uzmanı Su Özgür’e, Ege Üniversitesi Tıbbi Genetik A.D. çalışanlarından biyolog Vasif Aliyev’e,
Bu süreçte destek ve tecrübelerini her zaman hissettiğim, Uzm. Dr. Erhan Parıltay, Uzm. Dr. Aslı Ece Solmaz, Uzm. Dr. Esra Işık, Uzm.Dr. Durdugül Ayyıldız Emecen, Uzm.Dr. Enise Avcı’ya,
Uzmanlık eğitimim süresince birlikte çalışmaktan ve bu yolda birlikte yürümekten keyif aldığım hekim arkadaşlarım Uzm.Dr. Hasan Taşlıdere, Uzm.Dr. Ayşenur Kavaslıoğlu, Uzm.Dr. Hilmi Bolat, Uzm.Dr. Emine İpek Ceylan, Uzm.Dr.Elif Uzay, Dr. Tuba Sözen Türk, Dr. Semih Aşıkovalı, Dr. Gizem Kök, Dr. Duygu Arıcan, Dr. Mert Pekerbaş, Dr. Burak Aşçıoğlu ve Dr. Vedat Sivri’ye,
Uzmanlık eğitimim süresince tecrübelerini benimle paylaşan ve Ege Üniversitesi Tıbbi Genetik A.D’da teknisyen, biyolog, sekreter ve personel olarak görev yapan tüm çalışma arkadaşlarıma,
Çalışmamızı destekledikleri için Ege Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü’ne,
Her zaman koşulsuz sevgi ve desteklerini arkamda hissettiğim canım aileme ve bu çalışma süresince desteğini yakından hissettiğim kardeşim Burhan Osman Karademir’e,
En içten teşekkür, sevgi ve saygılarımı sunarım.
Dr. Zehra Cengisiz İzmir, 2020
İÇİNDEKİLER ÖNSÖZ
İÇİNDEKİLER ... I TABLOLAR LİSTESİ ... III ŞEKİLLER LİSTESİ ... IV KISALTMA LİSTESİ ... V ÖZET ... VI ABSTRACT ... VII 1. GİRİŞ ve AMAÇ ... 1 2. GENEL BİLGİLER ... 4
2.1 Kanser ve Kişiselleştirilmiş Hassas Tıp ... 4
2.2. Akciğer Kanseri ... 4
2.2.1 Akciğer Kanserinin Epidemiyolojisi ... 4
2.2.2 Akciğer Kanserinin Etyolojisi ... 6
2.2.3 Akciğer Kanserinin Klinik Belirtileri ... 7
2.2.4 Akciğer Kanserinin Tanısı ... 8
2.3 Küçük Hücre Dışı Akciğer Kanseri (KHDAK) ... 8
2.3.1 KHDAK Evrelemesi ... 9
2.3.2 KHDAK Genetiği ... 10
2.3.3 KHDAK’nin Erken Tanısında Metilasyon Biyomarkerlarının Önemi ... 18
2.4 De Novo Metilasyonunun Kanser Başlangıcındaki ve İlerlemesindeki Rolü .... 19
2.5 Cell-Free DNA’nın (cfDNA) Biyolojik Temeli ... 20
2.5.1 Metillenmiş ctDNA’nın Akciğer Kanseri Tarama ve Tanısında Biyomarker Olarak Kullanılması……….21
2.6 DNA Metilasyonu Analiz Yöntemleri………23
2.6.1 Metilasyon Spesifik PCR ... 25
2.6.2 Dijital PCR………26
2.6.2.1 Droplet Dijital PCR………...28
3. GEREÇ VE YÖNTEM ... 32
3.1 Olgu ve Kontrol grubunun Seçilmesi ... 32
3.2 Moleküler Çalışmalar... 33
3.2.1 cfDNA izolasyonu ... 33
3.2.2 cfDNA konsantrasyonu ölçümü ... 35
3.2.3 Tümör dokusundan DNA izolasyonu ... 35
3.2.4.1 Hedef CpG Bölgelerinin Seçilmesi ... 36
3.2.4.2 Primer Tasarımları... 38
3.2.4.3 Bisülfit Dönüşümü ... 41
3.2.4.4 PCR ... 42
3.2.4.5 Sanger Dizileme ... 43
3.2.5 Hedef Gen CpG Bölgelerinin ddPCR ile Metilasyon Analizi ... 45
3.3 İstatiksel Analiz ... 47
4. BULGULAR ... 48
4.1 Çalışma Grubunun Demografik ve Patolojik Verileri ... 48
4.2 Hastaların Aile Ağaçları ... 49
4.3 DNA Konsantrasyonları ve Sekans Analizi ... 54
4.4 ddPCR ve İstatiksel Analiz Sonuçları ... 58
5. TARTIŞMA ... 65
6. SONUÇ ... 72
7. KAYNAKLAR ... 73
8. EKLER ... 83
8.1 Etik Kurul Onay Belgesi ………83
8.2 Gönüllü Onam Formu……….86
8.3 Veri Toplama Formu………...89
TABLOLAR LİSTESİ
Tablo 1. Gen promotorunda hedeflenen CpG bölgelerinin dizileri ... 37
Tablo 2. Hedef bölgelerin bisülfit dönüşümü sonrası dizileri... 39
Tablo 3. Hedef gen bölgelerinin bisülfit dönüşümü sonrası dizi analizi için PCR ile çoğaltılmasında kullanılan primer dizileri ... 40
Tablo 4. Hedef gen bölgelerinin ddPCR ile metilasyon miktar analizinde kullanılan metilasyon spesifik primer dizileri ... 41
Tablo 5. Bisülfit Dönüşümünde Termal Döngü Koşulları... 42
Tablo 6. PCR Karışımının İçeriği ... 43
Tablo 7. Termal döngü koşulları ... 43
Tablo 8. Dizin Reaksiyonu Karışım İçeriği ... 44
Tablo 9. Dizin Reaksiyonu Termal Döngü Koşulları ... 44
Tablo 10. Hedef genlerin CpG bölgelerinin çoğaltıldığı termal döngü koşulları ... 46
Tablo 11. Grupların demografik ve patolojik verileri ... 48
Tablo 12. Örneklerin DNA konsantrasyonları ... 54
Tablo 13. cfDNA konsantrasyonları ile metilasyon değerleri arasındaki korelasyon ... 55
Tablo 14. 3 gruba ait metilasyon değerlerinin ortalamaları ... 55
Tablo 15. Doku ve kan örneklerine ait metilasyon değerleri ... 57
Tablo 16. Hasta ve kontrol grubunun metilasyon değerleri…..………60
Tablo 17. Hasta ve kontrol grubu karşılaştırmalı metilasyon değerleri ... 61
Tablo 18. Cinsiyetler arası metilasyon değerlerinin karşılaştırılması ... 63
Tablo 19. Genler arası korelasyonların değerlendirilmesi ... 63
Tablo 20. ROC analizi ile ölçümlerin değerlendirilmesi ... 64
Tablo 21. Hastaların DAPK1 metilasyon ölçüm değerleri... 64
ŞEKİLLER LİSTESİ
Şekil 1. 2018'de her iki cinsiyet, erkekler ve kadınlar için en sık görülen 10 kanserin insidans
ve mortalite dağılımı ... 5
Şekil 2. Akciğer adenokarsinomu ve squmöz hücreli karsinomunda onkojenik yolaklardaki genetik değişiklikler ... 12
Şekil 3. Akciğer kanserindeki moleküler değişiklikler ... 13
Şekil 4. KHDAK’de kanser özelliklerinin kazanılmasını destekleyen epigenetik değişimler.17 Şekil 5. DNA metilasyonu ... 19
Şekil 6. CpG adalarındaki metilasyon ... 20
Şekil 7. DNA metilasyon yöntemleri………...23
Şekil 8. Bisülfit dönüşümü sonrası DNA metilasyonu ………... 24
Şekil 9. Metilasyon sekanslama sonuçlarının yorumlanması………... 25
Şekil 10. dPCR çalışmalarının sonuçlarından örnekler ... 27
Şekil 11. dPCR çalışma prensibi ... 29
Şekil 12. ddPCR iş akış şeması ... 31
Şekil 13. BioRad QX200 Droplet Digital PCR Sistemi ile ddPCR uygulanması ... 46
Şekil 14. Hasta 1’in aile ağacı ... 49
Şekil 15. Hasta 2’nin aile ağacı ... 49
Şekil 16. Hasta 3’ün aile ağacı ... 50
Şekil 17. Hasta 4’ün aile ağacı ... 50
Şekil 18. Hasta 5’in aile ağacı ... 51
Şekil 19. Hasta 6’nın aile ağacı ... 51
Şekil 20. Hasta 7’nin aile ağacı………...52
Şekil 21. Hasta 8’in aile ağacı ... 52
Şekil 22. Hasta 9’un aile ağacı ... 53
Şekil 23. Hasta 10’un aile ağacı ... 53
Şekil 24. Kontrol (cfDNA), hasta (cfDNA) ve doku metilasyon değerlerinin ortalamalarının karşılaştırılması ... 56
Şekil 25. Üç hastanın cfDNA ve tümör dokulardan elde edilen DNA’larının metilasyon değerleri karşılaştırmalı grafiği……… ... 57
Şekil 26. 6 numaralı hasta örneğine ait p16 geninin sekans görüntüsü ... 58
Şekil 27. ddPCR çalışma görüntüleri ... 59
Şekil 28. 6 gene ait hasta ve kontrol grubunun metilasyon değerlerinin karşılaştırmalı kutu grafikleri ... 62
KISALTMA LİSTESİ
ctDNA: circulating tumor DNA cfDNA: cell-free DNA
ddPCR: droplet dijital PCR dPCR: dijital PCR
DDBT: düşük doz bilgisayarlı tomografi KHDAK: küçük hücre dışı akciğer kanseri TSG: tümör süpressör gen
qPCR: kantitatif polimeraz zincir reaksiyonu qMSP: kantitatif metilasyon spesifik PCR DSÖ: Dünya Sağlık Örgütü
TNM: tümör, lenf nodu, metastaz TKI: tirozin kinaz inhibitörleri DNMT: DNA metil transferaz HDAC: histon deasetilaz
EMT: epitelyal mezankimal transisyon miRNA: mikro RNA
lncRNA: uzun kodlamayan RNA CGI: CpG adaları
PCR: polimeraz zincir reaksiyonu
cdPCR: chamber based dPCR-odacık bazlı dijital PCR PK: proteinaz K
HPEA-FT: high pure extension assembly unit- kapaklı filtreli tüp CT: kollektör tüp
FFPE: formalin fixed paraffin embedded- formalinle sabitlenmiş parafine gömülü F: forward-ileri
R: reverse-geri
dNTP: deoksinükleotid trifosfat ddNTP: dideoksinükleotid trifosfat kDa: kilodalton
ÖZET
Akciğer Kanserli Hastalarda Periferik Kandan ctDNA’nın Metilasyon Değişikliklerinin Dijital PCR İle İncelenmesi
Amaç: Akciğer kanseri, dünya genelinde en sık görülen ve her iki cinsiyette de en sık ölüme sebep olan malignitelerden biridir. En sık sebebi sigara dumanı olan akciğer kanserinin erken tanısında, sigara içenlerde düşük doz bilgisayarlı tomografi ile tarama önerilmiştir. Bu taramanın yanlış tanı, maliyet, zaman kaybı gibi dezavantajları nedeniyle akciğer kanserinin erken tanısında non invaziv, sensitif biyomarkerların kullanılmasına ihtiyaç duyulmuştur. Bu çalışmada, ileri evre-küçük hücre dışı (non-small cell) akciğer kanseri tanısı konulmuş hastaların plazmasından elde edilen cfDNA’da (cell-free DNA) literatür taraması ile belirlenmiş akciğer kanseri ile ilişkisi bilinen 6 gene ait (RASSF1A, p16, SHOX2, RARβ2, APC, DAPK1) droplet dijital PCR (ddPCR) ölçümü ile saptanan metilasyon değişikliklerinin sağlıklı kişilerdeki değerleri ile karşılaştırarak değerlendirilmesi amaçlanmıştır.
Gereç ve Yöntem: Çalışmaya alınan 10 hasta ve 10 kontrolün periferik kan plazma örneklerinden cfDNA elde edildi. Literatür taraması ile 6 hedef gen promotor bölgesi belirlendi. cfDNA’da hedef gen bölgelerinin bisülfit dönüşümü sonrasında ddPCR ile metilasyon analizi yapıldı. Çıkan sonuçlar istatistiksel olarak analiz edildi.
Bulgular: Çalışmada DAPK1 geninin promotor bölgesindeki metilasyon seviyelerinde, hasta ve kontrol grubu arasında anlamlı farklılık saptanmıştır (p<0,05). Çalışmaya alınan 10 hastanın 8’inde DAPK1 geninde anlamlı metilasyon yüksekliği saptanmıştır. DAPK1 genindeki hipermetilasyon literatür ile uyumlu bulunmuştur.
Sonuç: Çalışmamız ddPCR ile akciğer kanserinde cfDNA’dan metilasyon analizi yapan ülkemizdeki öncü çalışmalardan biri olmuştur. Küçük hücre dışı akciğer kanserinde DAPK1 geninde hipermetilasyon saptanması ile literatüre katkıda bulunmuştur. Çalışmamız, bu alanda daha fazla sayıda hastalarla yapılacak sonraki çalışmalar için ön çalışma niteliğindedir.
ABSTRACT
Investigation of Methylation Changes of ctDNA From Peripheral Blood in Patients With Lung Cancer by Digital PCR
Objective: Lung cancer is one of the most common malignancies worldwide and the most common cause of death in both sexes. The most common cause of lung cancer is cigarette smoke. In the early diagnosis of lung cancer in smokers, screening with low-dose computed tomography has been proposed. Due to the disadvantages of this screening such as misdiagnosis, cost and time loss; non-invasive and sensitive biomarkers were needed for early diagnosis of lung cancer. In this study, it was aimed to evaluate the methylation changes detected by droplet digital PCR (ddPCR) measurement of 6 genes (RASSF1A, p16, SHOX2, RARβ2, APC, DAPK1) known to be associated with lung cancer determined by the literature scan in cfDNA (cell-free DNA) obtained from the plasma of patients diagnosed with advanced-non-small cell lung cancer.
Materials and Methods: cfDNA was obtained from peripheral blood plasma samples of 10 patients and 10 controls included in the study. With the literature review, 6 target gene promoter regions were determined. After bisulfite transformation of target gene regions in cfDNA, methylation analysis was performed with ddPCR. The results were analyzed statistically.
Results: In the study, a significant difference was found between the patient and control groups in the methylation levels of the DAPK1 gene in the promoter region (p <0,05). In 8 of 10 patients included in the study, significant methylation height in the DAPK1 gene was detected. Hypermethylation in the DAPK1 gene has been found to be compatible with the literature.
Conclusion: Our study has been one of the leading studies in our country that perform methylation analysis from cfDNA in lung cancer with ddPCR. It contributed to the literature with the detection of hypermethylation in the DAPK1 gene in non-small cell lung cancer. Our study is a preliminary study for further studies in this field with more patients.
1. GİRİŞ ve AMAÇ
Akciğer kanseri, dünya genelinde en sık görülen ve her iki cinsiyette de en sık ölüme sebep olan malignitelerden biridir. Türkiye’de en son 2014’de yapılan kanser araştırması istatistik verilerine göre erkeklerde birinci, kadınlarda beşinci sıklıkta görülmektedir. Akciğer kanserinin erken tanı ve güncel tedavi protokollerine rağmen 5 yıllık sağ kalım oranı %20-30’dur. Akciğer kanserinde, ileri evrede tedavi başarısının düşük olması nedeniyle erken tanının önemi büyüktür. Ancak başlangıç semptomlarının non-spesifik olması ve şikayetlerin hastalar tarafından önemsenmemesi nedeniyle hekime başvuruda ve tanıda gecikme yaşanmaktadır (1). Akciğer kanserinin en sık sebebi sigara dumanıdır. 2011 yılında ABD’de yapılan “Ulusal Kanser Tarama” çalışmasında; 55-74 yaş arası sağlıklı, en az 30 paket-yıl sigara içen/ içmiş veya 15 yıldan az süredir içmeyen kişilerde akciğer kanseri taraması için düşük doz bilgisayarlı tomografi (DDBT) yapılması önerilmiştir. Bu taramadan sonra erken tanı oranın artması ile birlikte akciğer kanserine bağlı mortalitenin %20 oranında azaldığı görülmüştür. Ancak DDBT ile yapılan taramanın, etkili olabilmesi için tam akredite olmuş merkezlere ihtiyaç duyulması, gereksiz fazla tanı konulması, bu tanıların doğrulanması amacı ile tekrarlayan invaziv girişimlerde bulunulması, bu nedenle aşırı mali yük getirmesi ve kişilerin radyasyona maruz kalması gibi bazı dezavantajları vardır. Bu durumlar, akciğer kanseri tanısında sensitif ve güvenilir non-invaziv klinik yaklaşımların önemini ortaya koymaktadır (2). Akciğer kanserindeki genetik değişiklikler temel olarak kalıcı genetik mutasyonlar ile dinamik epigenetik değişiklikler arasındaki etkileşimle açıklanabilir. Somatik genetik mutasyonların kanser gelişiminde önemli bir rol oynamasına rağmen, epigenetik değişikliklerin daha fazla değişken rol oynadığı bilinmektedir. Çünkü bu değişiklikler ya tümör supressör genlerin (TSG) ekspresyonunu baskılamakta ya da onkogen ekspresyonunu aktive etmektedirler. Ayrıca epigenetik değişiklikler, akciğer kanserinin erken teşhisi için biyolojik marker olarak kullanılabilir. Son on yılda, kanserin erken tanısı ve terapötik etkinlik amacıyla biyomarkerlar giderek daha çok uygulama alanı bulmaktadırlar (3).
Epigenetik değişiklikler, doğrudan DNA dizisini değiştirmeden gen ifadesinde meydana gelen kalıtsal değişiklikler olarak tanımlanabilir. Onkogenezde gözlenen epigenetik değişiklikler anormal DNA metilasyon paternleri, histon modifikasyonları ve kodlama yapmayan RNA'ların regülasyonunu içerir. DNA metilasyonu, üzerinde en çok çalışılan epigenetik değişikliktir ve gen ekspresyonunu baskılayıp genomik stabiliteyi sağladığı bilinmektedir. Hem gen promotorlarındaki hem de tüm genomdaki DNA metilasyonu kanserin ortaya çıkmasında ve ilerlemesinde oldukça önemli bir rol oynamaktadır. Bu nedenle, DNA
metilasyon değişikliklerini gözlemlemek, akciğer kanserinin erken tanısı veya tümörün progresyonunda kullanılabilecek potansiyel biyomarkerları belirlememizi sağlamaktadır (4).
Anormal DNA metilasyonu, onkogenezin başlamasına ve ilerlemesine önemli derecede katkıda bulunur. CpG dinükleotitleri, birçok genin, özellikle TSG'lerin promotor bölgesinde bulunmaktadır. Promotor bölgedeki DNA metilasyonu sıklıkla “gen susturma” ile ilişkilidir. Anormal promotor metilasyonu, hücre döngüsü kontrolü, DNA onarımı, hücre adezyonu, sinyal iletimi, apoptoz ve hücre farklılaşmasında yer alan genleri etkilemektedir (5).
Serbest tümör DNA’sı (circulating tumor DNA-ctDNA), tümör hücrelerinin nekrozu, apoptozu gibi nedenlerden dolayı dolaşıma katılan, vücutta plazma, serum, idrar veya tükürük gibi farklı biyoakışkan örneklerinin saflaştırılması ile elde edilen, ortalama 180 baz çifti uzunluğundaki fragmanlardan oluşan, hücreden bağımsız, çıplak, çift sarmal yapıdaki DNA’dır. Tümör hücrelerinin invaziv yapısı nedeniyle, klinikte biyopsi her zaman yapılamayabilir. Ayrıca tümörün solid ve heterojen doğası nedeniyle hatalı tanı konabilir. Non-invaziv biyomarker olarak ctDNA, tümör dokusuna ait tüm genetik değişiklikleri içermesi, tümör heterojenitesini, yükünü ve progresyonunu göstermesi nedeni ile doku biyopsisinden daha avantajlıdır. ctDNA’daki epigenetik değişiklikler, akciğer kanserinde karsinogenezdeki erken olaylar olup erken tanı açısından potansiyel biyomarkerlar olarak kullanılabileceği daha önce yapılmış çalışmalarda da gösterilmiştir (6, 7).
Bu amaçla çalışmalarda, konvansiyonel kantitatif polimeraz zincir reaksiyonu (qPCR) tabanlı platformlar, özellikle metilasyona özgü PCR (qMSP), ctDNA’daki akciğer kanserinde etkili genlerin metilasyonunu saptamak için kullanılmıştır. qMSP'nin klinik ortamlarda kullanımını sınırlayan bazı dezavantajları vardır. qMSP, veri normalizasyonu için dahili kontroller gerektirmektedir. Ayrıca ctDNA gibi düşük konsantrasyondaki nükleik asitlerde genetik veya epigenetik değişiklikleri analiz etme konusundaki duyarlılığı zayıftır.
Droplet dijital PCR (ddPCR), nükleik asitlerin kantitatif olarak doğrudan ölçülmesi için kullanılan bir yöntemdir. Bu yöntem çok sayıda mikro-reaksiyonun sonucuna dayanmaktadır ve dahili kontrol gerektirmez. Yapılan çalışmalar, ddPCR'nin düşük yoğunluklu nükleik asitleri ölçebildiğini ve konvansiyonel PCR'ye göre daha yüksek hassasiyete ve doğruluğa sahip olduğunu göstermiştir (5, 8).
Bu çalışmanın amacı, ileri evre-küçük hücre dışı (non-small cell) akciğer kanseri tanısı konulmuş hastaların plazmasından elde edilen ctDNA’daki literatür taraması ile belirlenmiş akciğer kanseri ile ilişkisi bilinen 6 gene ait (RASSF1A, p16, SHOX2, RARβ2, APC, DAPK1)
(9–12) ddPCR ölçümü ile saptanan metilasyon değişikliklerini sağlıklı kişilerdeki değerleri ile karşılaştırarak değerlendirmektir.
2. GENEL BİLGİLER
2.1 Kanser ve Kişiselleştirilmiş Hassas Tıp
Kanser, anormal hücrelerin kontrolsüz büyümesi ve yayılması ile tanımlanan, dünya çapında halk sağlığı sorunu olan bir hastalık grubudur. Dünya Sağlık Örgütü'nün (DSÖ) 2018 yılı verilerinde kanserin 9,6 milyon ölümden sorumlu olduğu (her 6 ölümden biri) belirtilmiştir (13). Amerikan Kanser Topluluğu’nun kanser istatistik verileri de sadece ABD'de 2019’da 1.762.450 yeni kanser vakasına tanı konulduğunu ve 606.880 kansere bağlı ölüm gerçekleştiğini göstermektedir. Aynı kuruluş yaklaşık 15,5 milyon ABD vatandaşının kanser tedavisi görmekte olduğunu söylemektedir (14). Yine DSÖ kanser istatistik verilerine göre 2018’de Türkiye’de 210.537 yeni kanser tanısı konulmuş ve 116.710 kanser nedenli ölüm gerçekleşmiştir. Ülkemizde kanserin 5 yıllık prevelansı 470.851 olarak bildirilmiştir (15).
Kanserin yönetiminde birincil hedef, kanseri tedavi etmek ve yaşam süresini uzatmaktır. Vakaların erken tespiti ve tedavisi mümkün olursa kanser mortalitesi ve tedavi maliyetleri azaltılabilir (13). Kanserin heterojenitesi nedeniyle, güçlü sağlık sistemleri ve hizmetleri olan ülkelerde bile birçok kanser vakasının ileri evrede tanısı konmakta ve kemoterapi, radyasyon gibi standart tedaviler hasta popülasyonunun sadece sınırlı bir kısmında etkili olmaktadır. Heterojenite; tümörler arasındaki genetik ve moleküler farklılıklardan kaynaklanmaktadır ve bu alandaki çalışmalar kişiselleştirilmiş hassas tıp alanına katkıda bulunmaktadır (16).
2.2 Akciğer Kanseri
Akciğer kanseri/karsinomu, trakea, bronşlar veya alveollerdeki akciğer dokularında kontrolsüz hücre büyümesi ile tanımlanan malign bir akciğer tümörüdür (17, 18).
2.2.1 Akciğer Kanserinin Epidemiyolojisi
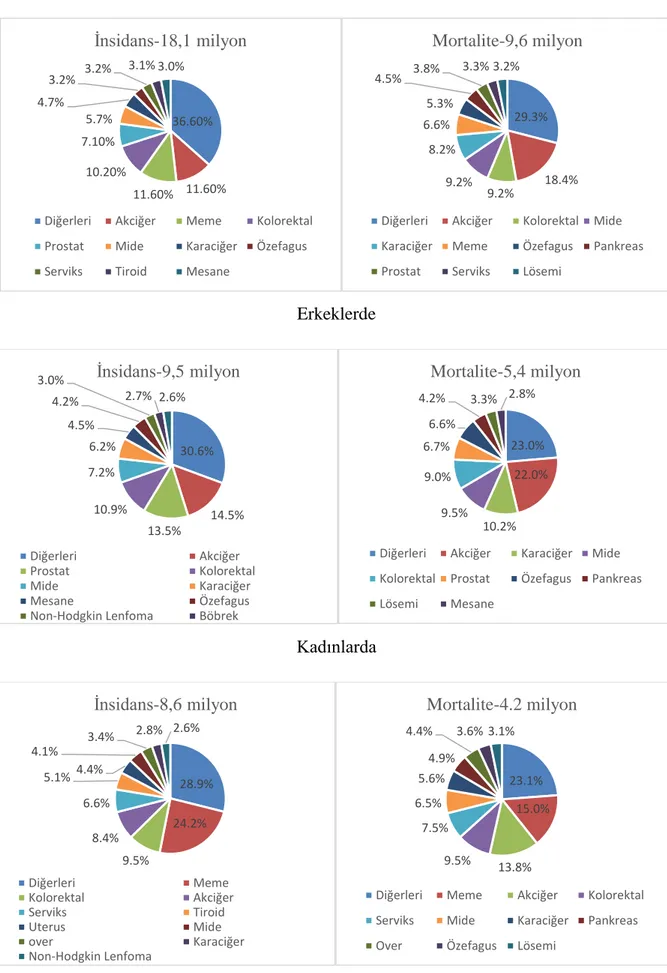
Global kanser istatistiklerine göre 2018’de küresel olarak 2.093.876 yeni akciğer kanseri vakası tespit edilmiş ve 1.761.007 akciğer kanserine bağlı ölüm meydana gelmiştir. Aynı yıl, her iki cinsiyet göz önüne alındığında, en sık teşhis edilen kanser (toplam kanser vakalarının %11,6'sı) türü ve kanser ölümlerinin önde gelen nedeni (toplam kanser nedenli ölümlerin %18,4'ü) akciğer kanseri olmuştur. Cinsiyetlere göre değerlendirildiğinde akciğer kanseri, erkeklerde en yüksek insidans ve en sık mortalite sebebiyken, kadınlarda meme ve kolorektal kanserlerden sonra en yüksek insidans ve meme kanserinden sonra en yüksek mortalite sebebidir. Dünya genelinde yaşa göre standardize edilmiş insidans erkeklerde 100.000’de 31,5, kadınlarda 100.000’de 14,6 olarak belirtilmiştir (19) (Şekil 1).
Her iki cinste
Erkeklerde
Kadınlarda
Şekil 1. 2018'de her iki cinsiyet, erkekler ve kadınlar için en sık görülen 10 kanserin insidans ve mortalite dağılımı (19) 36.60% 11.60% 11.60% 10.20% 7.10% 5.7% 4.7% 3.2% 3.2% 3.1% 3.0% İnsidans-18,1 milyon
Diğerleri Akciğer Meme Kolorektal Prostat Mide Karaciğer Ö zefagus Serviks Tiroid Mesane
29.3% 18.4% 9.2% 9.2% 8.2% 6.6% 5.3% 4.5% 3.8% 3.3% 3.2% Mortalite-9,6 milyon
Diğerleri Akciğer Kolorektal Mide Karaciğer Meme Ö zefagus Pankreas Prostat Serviks Lösemi
30.6% 14.5% 13.5% 10.9% 7.2% 6.2% 4.5% 4.2% 3.0% 2.7% 2.6% İnsidans-9,5 milyon Diğerleri Akciğer Prostat Kolorektal Mide Karaciğer Mesane Ö zefagus
Non-Hodgkin Lenfoma Böbrek
23.0% 22.0% 10.2% 9.5% 9.0% 6.7% 6.6% 4.2% 3.3% 2.8% Mortalite-5,4 milyon
Diğerleri Akciğer Karaciğer Mide Kolorektal Prostat Ö zefagus Pankreas Lösemi Mesane 28.9% 24.2% 9.5% 8.4% 6.6% 5.1%4.4% 4.1% 3.4% 2.8% 2.6% İnsidans-8,6 milyon Diğerleri Meme Kolorektal Akciğer Serviks Tiroid Uterus Mide over Karaciğer Non-Hodgkin Lenfoma 23.1% 15.0% 13.8% 9.5% 7.5% 6.5% 5.6% 4.9% 4.4% 3.6% 3.1% Mortalite-4.2 milyon
Diğerleri Meme Akciğer Kolorektal Serviks Mide Karaciğer Pankreas Over Ö zefagus Lösemi
Akciğer kanseri için tanıdan sonra beklenen ortalama yaşam ömrü 12 aydır ve 5 yıllık sağ kalım oranı %19 olarak bildirilmiştir. Türkiye Sağlık Bakanlığı 2017 sağlık istatistiklerine göre, erkeklerde en sık görülen kanser, akciğer kanseridir. Aynı yıl akciğer kanseri için ülkemizde erkeklerde yaşa göre standardize edilmiş insidans hızı 100,000’de 52,5 olarak tespit edilmiştir. Akciğer kanseri, kadınlarda en sık görülen beşinci kanser olarak tanımlanmıştır ve kadınlarda yaşa göre standardize edilmiş insidans hızı 100.000’de 9 olarak belirlenmiştir. Ülkemizde de dünyadaki gibi akciğer kanseri sıklığı son yıllarda artmıştır ve her iki cins için de önemli bir halk sağlığı sorunu olarak karşımıza çıkmaktadır (20).
2.2.2 Akciğer Kanserinin Etyolojisi
Kanser, DNA'da meydana gelen genetik hasar veya epigenetik değişikliklerin ardından gelişmektedir. Bu değişiklikler, hücre çoğalması, apoptoz ve DNA onarımı dahil olmak üzere hücrenin normal işlevlerini etkiler. Daha fazla hasar biriktikçe kanser riski artar.
Sigara kullanımı, akciğer kanserine en çok katkıda bulunan etmendir ve tüm akciğer kanseri vakalarının %85’inin sebebini oluşturmaktadır. Sigara dumanı, gaz ve parçacık bileşiklerinden oluşan karmaşık bir aerosoldür. Duman, ana duman ve yan duman bileşenlerinden oluşur. Ana duman, havanın sigaradan solunmasıyla üretilir ve sigara içen için birincil duman maruziyet kaynağıdır. Yan duman, her bir puf arasında sigaranın yanmasıyla üretilir ve çevresel tütün dumanının ana kaynağıdır. Tütün bağımlılığının birincil belirleyicisi nikotindir. Nikotin ve su haricindeki toplam sigara dumanı maddesi katrandır. Katran maruziyeti akciğer kanseri riskinin önemli bir sebebidir.
Uluslararası Kanser Araştırma Ajansı; sigara dumanının, benzo [α] piren, NNK, 1,3-bütadien ve radyoaktif bir polonyum izotopu olan polonyum-210 dahil olmak üzere, bilinen 55 kadar kanserojen içerdiğini belirtmektedir. Bu kanserojenlerin aktivasyonları, DNA metilasyonlarına, DNA’da sekans değişikliklerine, DNA segmentlerinde amplifikasyon veya delesyona, kromozom delesyonları veya duplikasyonlarına yol açar. NNK gibi tütün kanserojenleri, DNA'ya kovalent olarak bağlanarak DNA eklentileri oluşturur. DNA tamir mekanizmalarının bu DNA eklentilerini çıkaramaması, kalıcı mutasyonlara sebep olur. Bunun sonucunda, kontrolsüz hücre proliferasyonu ve tümör oluşumuna yol açan kritik onkogenler ile TSG’lerin modülasyonunu içeren bir dizi sinyal yolu aktivasyonu meydana gelir. NNK, K-ras onkogenlerinin aktivasyonu ile sonuçlanan DNA mutasyonları ile ilişkilidir. K-ras onkogen aktivasyonu, insan akciğer adenokarsinomlarının % 24'ünde tespit edilmiştir ve daha önce sigara içenlerde de akciğer adenokarsinomunda bulunmaktadır. Mutasyonlar tütün içiminin kesilmesi ile de geri dönmemektedir (21). Bu durum, sigara içmeyi bıraktıktan yıllar sonra bile
sigara içenlerde akciğer kanseri riskindeki sürekli yükselmeyi açıklayabilir. Ek olarak, tütün dumanının spesifik bir kimyasal bileşeni olan benzo [a] piren metaboliti, primer akciğer kanseri vakalarının yaklaşık % 60'ında TP53 gibi çeşitli TSG lokuslarına zarar vermektedir (21). Ayrıca tütün dumanında bulunan ilgili polisiklik aromatik hidrokarbonlar, diğer akciğer kanseri mutasyonel hotspotlarını da hedeflemektedir. Sigara içmeyenlere kıyasla sigara içenlerde göreceli akciğer kanseri riski artışı 10-30 kat arasında değişmektedir. Risk derecesi günlük içilen sigara ve paket sayısına, sigara kullanım yılı sayısına bağlıdır. Puro ve pipo tütünü içiminin de akciğer kanseri gelişme riskini arttırdığı saptanmıştır (18).
Pasif sigara içimi -başka bir kişinin sigara içmesinden kaynaklı yan akım dumanının solunması- sigara içmeyenlerde akciğer kanserinin bir nedenidir. Pasif olarak sigara içen kişi, sigara içen biriyle yaşayan veya çalışan biri olarak tanımlanabilir. ABD, Avrupa ve İngiltere'de yapılan çalışmalar, pasif olarak sürekli sigara dumanına maruz kalan kişilerde kanser riskinin önemli oranlarda arttığını göstermiştir. Araştırmalar, yan akım dumanının, doğrudan sigara dumanından daha tehlikeli olduğunu göstermektedir. 2004 yılında yapılan bir araştırma dünya genelinde, çoğu kadınlarda olmak üzere 600.000'den fazla ölümün pasif sigara içimine atfedilebileceğini göstermektedir (18, 21, 22).
Akciğer kanserine sebep olan diğer risk faktörleri arasında radon gazı maruziyeti, kronik obstruktif akciğer hastalığı, kronik enfeksiyonlar, odun-kömür gibi evsel biyokütle yakıtlarının dumanına maruziyet, çevresel hava kirliliği, asbest-berilyum-kadmiyum gibi mesleki karsinojenlerin maruziyeti, meyve-sebze ve lif yönünden fakir beslenme ile genetik faktörler yer almaktadır (22). Akciğer kanserinin yaklaşık %8'i kalıtsal faktörlerden kaynaklanmaktadır ve akciğer kanseri olan kişilerin akrabalarında risk toplum riskinin yaklaşık iki katı olarak bildirilmektedir. Bunun da muhtemelen kromozom 5, 6 ve 15 üzerindeki gen polimorfizmlerinin akciğer kanseri riski ile ilişkisinden kaynaklandığı düşünülmektedir (18). 2.2.3 Akciğer Kanserinin Klinik Belirtileri
Akciğer kanserine işaret edebilecek klinik belirtiler arasında solunum sistemi belirtilerinden öksürük (kanlı olabilir), hırıltılı ses veya nefes darlığı; sistemik belirtilerden kilo kaybı, halsizlik, ateş veya tırnaklarda çomaklaşma gibi bulgular bulunmaktadır. Tümör kitlesinin basısına bağlı olarak göğüs ağrısı, kemik ağrısı, superior vena kava tıkanıklığı veya yutma güçlüğü gibi bulgular da görülebilmektedir. Kanser, solunum yollarında büyürse; hava akışını engelleyerek solunum güçlüklerine neden olmaktadır. Tıkanıklık, tıkanıklığın arkasındaki salgıların birikmesine ve pnömoni yatkınlığına yol açmaktadır. Tümörün tipine bağlı olarak sistemik paraneoplastik olaylar, başlangıçta akciğer kanserine işaret edebilir. Bu
olaylar, hiperkalsemi, uygunsuz antidiüretik hormon sendromu, ektopik ACTH üretimi veya Lambert Eaton myastenia sendromudur (otoantikorlara bağlı kas zayıflığı). Akciğerin apikal tümörleri Pancoast tümörleri olarak bilinmektedir. Sempatik sinir sistemini lokal olarak istila edip Horner sendromuna (ptozis, myozis, enoftalmi yüzde anhidroz) sebep olarak bronşiyal pleksusa zarar vermektedir (18, 23).
Akciğer kanseri semptomlarının çoğu (iştahsızlık, kilo kaybı, ateş, yorgunluk) spesifik değildir. Birçok insanda, akciğer kanseri sırasında semptomlar geliştiğinde tümör, akciğerden diğer organlara metastaz yaparak yayılmıştır. Metastatik hastalığın varlığını gösteren semptomlar arasında kilo kaybı, kemik ağrısı ve nörolojik semptomlar (baş ağrısı, bayılma, konvülsiyonlar veya kas zayıflığı) bulunur. Yaygın metastaz alanları arasında beyin, kemik, adrenal bezler, karşı akciğer, karaciğer, perikard ve böbrekler bulunur. Vakaların yaklaşık %10'unda ise tanı anında semptomlar yoktur; rutin göğüs radyografisinde tesadüfen tanı konulmaktadır (18).
2.2.4 Akciğer Kanserinin Tanısı
Bir kişi akciğer kanserine işaret edebilecek semptomlar bildirirse, göğüs radyografisi ilk araştırma adımlarından biridir. Radyografide; bariz bir kitle, mediastenin genişlemesi (lenf düğümlerine yayılımı düşündürür), atelektazi, konsolidasyon veya plevral efüzyon ortaya çıkabilir. BT görüntüleme tipik olarak hastalığın türü ve kapsamı hakkında daha fazla bilgi sağlamak için kullanılır. Bronkoskopi veya BT eşliğinde biyopsi, sıklıkla tümörü histopatolojik olarak örneklemek için kullanılır. Akciğer kanseri, göğüs radyografisinde genellikle soliter bir akciğer nodülü olarak görülür. Metastatik kanser, hamartomlar ve tüberküloz, histoplazmoz ve koksidioidomikoz gibi bulaşıcı granülomlar dahil olmak üzere birçok başka hastalık da bu görünümü verebilmektedir. Akciğer kanseri aynı zamanda bir akciğer radyografisinde soliter pulmoner nodül veya herhangi bir nedenden dolayı yapılan BT taramasında tesadüfi bir bulgu şeklinde saptanabilmektedir. Akciğer kanserinin kesin tanısı, şüpheli dokuların klinik ve radyolojik özellikleri bağlamında histolojik incelemesine dayanır (23).
2.3 Küçük Hücre Dışı Akciğer Kanseri (KHDAK)
İki ana akciğer kanseri formu vardır: KHDAK (hastaların %85'i) ve küçük hücreli akciğer kanseri (%15). DSÖ, KHDAK'yı üç ana tipte sınıflandırmıştır: adenokarsinom, skuamöz hücreli karsinom ve büyük hücreli karsinom. Ayrıca klinik alt tiplerin çeşitli varyantları ve kombinasyonları da mevcuttur.
Adenokarsinom en yaygın KHDAK tipidir ve akciğer kanserlerinin yaklaşık %40'ını oluşturur. Adenokarsinom, daha küçük hava yolu epitelinde bulunan alveolar hücrelerden kaynaklanır ve TTF-1, napsin A gibi immünohistokimyasal markerları eksprese etme eğilimindedir. Adenokarsinomun DSÖ sınıflandırması, kanserin erken evrelerini in-situ adenokarsinom (pre-invaziv lezyon), invazyonun boyutuna göre minimal invaziv adenokarsinom veya invaziv adenokarsinom olarak kabul etmektedir. In–situ adenokarsinom, çapı 3 cm'den küçük ve lepidik patern içeren adenokarsinom olarak tanımlanır. Minimal invaziv adenokarsinom, çapı 3 cm'den fazla olan adenokarsinom olarak tanımlanır; fakat invazyon 5 mm’i geçtiğinde lenfovasküler invazyon, perinöral invazyon veya tümörde nekroz varlığı invaziv adenokarsinom olarak kabul edilir. Histopatolojisine göre asiner, papiller, bronkoalveolar ve mukus salgılayan olarak dört alt tipi bulunur. Evre I kanser dışında prognozu skuamöz hücreli karsinomdan daha kötüdür (24).
Skuamöz hücreli karsinomlar akciğer kanserlerinin %25 ila %30'unu oluşturur; hava yolu epitelinde bulunan hücrelerden ortaya çıkma eğilimindedirler. Genellikle CK5, CK6, p40 ve desmoglein-3 gibi immünohistokimyasal markerları içerirler.
Büyük hücreli kanserler, tüm akciğer kanserlerinin yaklaşık % 5 ila % 10'unu oluşturur. Güncel immünofenotipleme teknikleri nedeniyle az diferansiye skuamöz hücreli karsinomların ve adenokarsinomların sınıflandırılması daha iyi yapıldığından insidansı azalmaktadır. Bu tümörlerin tipik olarak diferansiyasyonu azdır ve bol sitoplazmaya sahip büyük hücrelerden ve büyük nükleollerden oluşmaktadırlar (24, 25).
2.3.1 KHDAK Evrelemesi
Akciğer kanseri evrelemesi, kanserin tümör orjininden yayılma derecesinin bir değerlendirmesidir. Akciğer kanserinin prognozunu ve potansiyel tedavisini etkileyen faktörlerden biridir. KHDAK evrelemesinde TNM (Tümör, lenf nodu, metastaz) değerlendirmesi kullanılır. Bu değerlendirme, primer tümörün büyüklüğüne, lenf nodu tutulumuna ve uzak metastaza bağlıdır. TNM tanımlayıcıları kullanarak, 0, IA, IB, IIA, IIB, IIIA, III B ve IV'e kadar bir evre grubu belirlenir. Bu evreleme tedavi seçimine ve prognoz tahminine yardımcı olmaktadır. Cerrahi öncesi görüntüleme çalışmalarına (BT ve PET taramaları gibi) ve biyopsi sonuçlarına dayanarak klinik evreleme yapılır. Cerrahi evreleme operasyon sırasında veya sonrasında değerlendirilir ve torasik lenf nodlarının cerrahi örneklemesini içeren cerrahi ve klinik bulguların kombine sonuçlarına dayanır (18, 26).
2.3.2 KHDAK Genetiği
İnsan kanserleri genetik ve epigenetik değişikliklerin dokuda birikimiyle gelişmektedir. Her iki değişikliğin de sadece kanser hücrelerinde değil, kanser gelişmeden çok önce normal hücrelerde de mevcut olduğu bilinmektedir. Bu değişikliklerin birikimi kanser riski ile ilişkilidir. Genetik değişikliklere yol açan nedenler; yaşlanma, mutajenik kimyasallar, radyasyon, ultraviyole ışık (UV), oksijen radikalleri ve diğer faktörlerden oluşur. Yaşlanmanın başlıca kanser riski faktörü olduğu bilinmektedir ve doku türlerine bağlı olan toplam kök hücre bölünmesi sayısı, kanser riski ile büyük ölçüde ilişkilidir. Aslında somatik mutasyonların önemli bir kısmı, kök hücrelerin yüksek bir bölünme oranına sahip olduğu, bireyin yaşamının erken döneminde birikir. Yaşlanmaya ek olarak, mutajenik faktörlere maruz kalma, insan dokularında kanser gelişmesine yol açan somatik mutasyonlara neden olur. Ayrıca, fizyolojik koşullarda bile sürekli üretilen ve enflamatuar koşullarda artan oksijen radikallerinin de somatik mutasyonları arttırdığına inanılmaktadır.Epigenetik değişikliklerin çeşitli çevresel uyaranlara maruziyet ile indüklendiği görülmektedir. Yaşlanmanın; somatik hücre replikasyonlarının bir fonksiyonu olarak, artmış anormal DNA metilasyon seviyeleri ile ilişkili olduğu gösterilmiştir. Çeşitli faktörler tarafından tetiklenen kronik enflamasyonun da anormal DNA metilasyonunun indüklenmesine neden olduğu gösterilmiştir. Kanseri tetikleyen in vivo ve in vitro durumlara sürekli maruz kalmak; “mutasyon imzası” olarak adlandırılan, her kanserde o dokuya ve kişiye spesfik mutasyonların kombinasyonuna yol açmaktadır. Bu mutasyon imzaları kanser hücrelerinin klonal genişlemesi sonucu oluşan tümör dokularında driver (sürücü) ve passenger (yolcu) mutasyonlardan oluşmaktadır. Sürücü ve yolcu mutasyonların birleşimi hem tümör oluşumunda hem de tümöre özgü tedaviyi belirlemede önemli bir nokta oluşturmaktadır. "Sürücü" terimi, hücrenin çoğalmasını arttıran ve kanser gelişimine neden olan somatik mutasyonları ifade ederken, "yolcu" hücre klonlarında bulunan ve çoğalma avantajı sağlamayan mutasyonları ifade etmektedir (28).
Akciğer kanseri, moleküler olarak heterojen bir hastalıktır. Biyolojisini anlamak, erken tanı ve etkili tedavilerin geliştirilmesi için çok önemlidir. Çoğu maligniteye benzer şekilde, KHDAK, farklı moleküler genetik özelliklere sahip olması nedeniyle hücre içi heterojeniteye yol açan hücre veya klonların alt popülasyonlarından oluşur (Şekil 2). Akciğer kanserinde, hastalar arası, tümör içi ve tümörler arası değişkenlik olmak üzere farklı seviyelerde moleküler heterojenlik tanımlanmıştır. Aynı histolojik alt tipte olan hastalar arasındaki moleküler heterojenite, her bir hasta için sıklıkla farklı tedavi cevabına neden olmaktadır. Ayrıca, primer akciğer tümörü ve metastatik lezyonlar arasında yüksek derecede genetik çeşitlilik, akciğer kanseri hastalarının tanı ve tedavisinde önemli bir rol oynamaktadır. Akciğer kanserinde
heterojenite; genetik, epigenetik ve genetik olmayan mekanizmalarla ilgili birkaç farklı kaynağa bağlanabilir (Şekil 3). Akciğer tümörleri, anöploidi, kromozomal delesyonlar ve duplikasyonlar, gen yeniden düzenlemeleri, kopya sayısı kazanımı, gen amplifikasyonlarını içeren geniş genomik anormallikler ile birlikte tanımlanmıştır (29).
Şekil 2. Akciğer adenokarsinomu ve skumöz hücreli karsinomunda onkojenik yolaklardaki genetik değişiklikler Diyagramda KHDAK’de tirozin kinaz reseptör sinyal yolağı, mTOR sinyal yolağı, oksidatif stres yanıtı ve proliferasyon yolaklarındaki değişikliklerin oranları gösterilmektedir. Değişikliklerin sıklığı, somatik mutasyonların, homozigot delesyonların, fokal amplifikasyonların ve gen ekspresyonunun önemli ölçüde farklı genler ile regülasyonuna (örneğin, AKT3, FGFR1, PTEN gibi) dayanmaktadır. Adenokarsinomdaki en yaygın mutasyona uğramış genler arasında KRAS ve EGFR ile TSG’lerden TP53, KEAP1, STK11 ve NF1 yer almaktadır. EGFR'yi aktive eden mutasyonların sıklığı etnik kökene göre büyük ölçüde değişmektedir. Skuamöz hücreli karsinomda yaygın mutasyona uğramış genler arasında TP53 (%90) ve CDKN2A gibi TSG’ler bulunmaktadır. P16INK4A ve P14ARF proteinlerini kodlayan CDKN2A, skuamöz hücreli akciğer kanserlerinin %70’inden fazlasında; metilasyon (%21), inaktive edici bir mutasyon (%18), ekzon atlama (%4) veya homozigot delesyon (%29) ile inaktive edilmiştir (30).
Şekil 3. Akciğer kanserindeki moleküler değişiklikler (31)
Büyüme Faktörü Reseptörleri
EGFR, ErbB ailesinin üyesi olan bir tirozin kinaz reseptörüdür ve birçok epitel kanseri tipinde anormal olarak aktive edilir. EGFR mutasyonları, akciğer adenokarsinomlarının yaklaşık % 20-30'unda görülür; fakat skuamöz hücreli karsinomlarda çok nadir görülür. EGFR mutasyonları kadınlarda, sigara içmeyen hastalarda ve Asya popülasyonunda daha yaygındır. EGFR genindeki bazı mutasyonlara sahip tümörlerin tirozin kinaz inhibitörlerine (TKI) yanıt oranı yaklaşık %70'tir. TKI'leri, yani erlotinib, gefitinib ve afatinib, EGFR mutant adenokarsinomlarının tedavisi için kullanılmaktadır (30). EGFR geninde ekzon 20'deki mutasyonlar nadirdir ve EGFR inhibitörlerine karşı direnç oluşturdukları düşünülmektedir. Ekzon 20’deki p.T790M (T790M) mutasyonu 1. kuşak TKI’lerine karşı direncin %60’ından, 2. kuşak TKI’lerine karşı direncin %73’ünden sorumludur. Bu nedenle, T790M mutasyonunu seçici olarak inhibe eden ve 3. Kuşak TKI olarak kabul edilen osimertinib tedavide kullanılmaya başlanmıştır (32).
FGFR tirozin kinaz ailesi; FGFR-1, FGFR‑2, FGFR‑3 ve FGFR‑4 olmak üzere dört kinazdan oluşur. Bu genler tümör patogenezinde önemli bir role sahiptir ve amplifikasyon, nokta mutasyonu veya translokasyon ile regülasyonları bozulur. FGFR1'in, FGF2 ve FGF9 ligandları, insan akciğer kanserlerinde eksprese olurlar. FGFR1 amplifikasyonunun insidansı skuamöz hücreli karsinomda %21’dir. Düşük sağkalım oranı ve sigara öyküsü ile ilişkilidir (31).
Büyüme faktörü reseptörleri EGFR FGFR-1 MET Translokasyonlar ALK ROS-1 RET Onkogen Aktivasyonu K-RAS B-RAF DDR2 PIK3CA TSG'lerin inaktivasyonu TP53 LKB-1 PTEN Epigenetik Değişiklikler DNA metilasyonu Histon Deasetilaz miRNA
MET protoonkogeninin amplifikasyonu KHDAK'lerin %5-10'unda görülür. Yüksek gen kopya sayıları skuamöz hücreli karsinomda adenokarsinomdan daha yaygındır. Artmış MET proteini ekspresyonunun kötü prognoz ile ilişkili olduğu gösterilmiştir (30).
Translokasyonlar
Kromozom 2 üzerinde bulunan ALK'nin bir kısmı ters çevrilerek, EML4 geninin bir kısmı ile birleşmiştir. Bu yeni ALK füzyon proteini, RAS / RAF / MEK, PI3K / AKT / mTOR ve JAK / STAT sinyal yollarını aktive etmek için bir ligand gerektirmeden sitoplazmada etkinleştirilebilmektedir. ALK ‑ EML4 füzyonu, çoğunlukla genç, sigara içmeyen ve ileri evre kliniği olan KHDAK'ların %4-7'sinde görülür. Krizotinib ALK inhibitörüdür ve 2011’de FDA tarafından tedavide kullanımı onaylanmıştır (29).
Adenokarsinom hastalarının %1-2'sinde ROS1 protoonkogeninin translokasyonları gözlenir. Akciğer adenokarsinomlarında, ROS1 geni birkaç farklı genle birleşebilir ancak en yaygın olanı CD74 ‑ ROS1 füzyonudur. ROS1 füzyonu genç hastalarda, kadınlarda ve sigara içmeyenlerde daha sık görülür. Krizotinib ROS1 proteinini de inhibe etmektedir (29).
RET protoonkogeninin translokasyonu, bir dizi füzyon proteini ile sonuçlanmaktadır. Adenokarsinomların yaklaşık % 1-2'sinde RET geninin 6 farklı gen ile füzyonu tanımlanmıştır. Bu onkogen füzyonları büyük oranda sigara içmeyenlerde görülmektedir (31).
Onkogen Aktivasyonu
KRAS, RAS proto-onkogen ailesinin bir üyesidir; hücre proliferasyonunu, farklılaşmasını ve hayatta kalmasını düzenleyen sinyal yollarında kritik fonksiyonlara sahip olan G proteinini kodlar. KRAS mutasyonları adenokarsinomda en sık görülen onkojenik değişikliktir; %25-40 oranında görülür. Bununla birlikte, skuamöz hücreli karsinom veya küçük hücreli kanserde çok nadir görülür. KRAS mutasyonları kötü prognoz ile ilişkilidir. KRAS mutasyonları arasında en sık G12C, G12V, G12D ve G12A mutasyonları yer almaktadır ve bu mutasyonlar batı toplumlarında, erkeklerde ve sigara içenlerde daha sık görülür. Sigara içenler arasında en sık görülen mutasyon G12C (%41) iken, sigara içmeyenler arasında en sık görülen mutasyon G12D'dir (%56) (31, 32).
BRAF, hücre çoğalmasını ve hayatta kalmasını düzenleyen MAPK sinyal iletim yolunu aktive eder. BRAF mutasyonları tüm insan kanserlerinin %8'inde görülür. En yaygın görüldüğü kanserler; hairy-cell lösemi (%100), melanom (%50), papiller tiroid karsinomu (%45), kolorektal kanser (%10), over ve akciğer kanserleridir (%3). BRAF geninin ekzon 15'indeki V600E mutasyonu, melanomda en sık görülen karsinojenik prekürsör mutasyonudur (%90).
Akciğerin kanserlerinin yaklaşık yarısı V600E mutasyonunu içerirken, diğer yarısı L596R ve G468A mutasyonları gibi mutasyonları içerir. BRAF V600E mutasyonu taşıyan melanomlu hastaların tedavisinde vemurafenib ve dabrafenib kullanımı onaylanmıştır. KHDAK'deki aktivitelerine ilişkin çalışmalar devam etmektedir (31).
Discoidin domain reseptörü‑2 (DDR2), akciğerdeki hücre dışı matrisin önemli bir bileşeni olan kollajeni bağlayan, hücre zarına bağlı bir tirozin kinaz reseptörüdür. DDR2'nin SHC, SRC, JAK, Erk1/2 ve PI3K gibi önemli sinyal yolak bileşenlerini aktive ettiği gösterilmiştir. DDR2 birçok kanser türü ile ilişkilidir. Proliferasyon ve metastazın yönlendirilmesinde rol oynadığı gösterilmiştir. Skuamöz hücreli akciğer kanserinin %3-4'ünde DDR2 mutasyonları görülür. Tedavide potansiyel yeni bir hedef olabileceği tahmin edilmektedir (31).
PIK3CA mutasyonları KHDAK'lerin yaklaşık %1-3'ünde bulunur. Genellikle diğer onkojenik mutasyonlarla, özellikle EGFR, KRAS ve ALK ile birlikte bulunurlar. PIK3CA amplifikasyonları skuamöz hücreli karsinomlarda (%33) adenokarsinomdan (%6) daha yaygındır. Çeşitli PI3K inhibitörleri klinik gelişme aşamasındadır (29).
TSG’lerin İnaktivasyonu
TP53, kromozom 17'nin kısa kolunda bulunur. Hücre döngüsünün, DNA onarımının ve apoptozun kontrolünde rol oynayan bir TSG’dir. TP53 genindeki mutasyonlar, insan kanserlerinde yüksek sıklıkta görülen en yaygın genetik değişiklikler arasındadır. TP53 gen mutasyonlarının yaklaşık %80'i missense mutasyonlardır. TP53'ün inaktivasyonu, küçük hücreli karsinomların %90'ında ve KHDAK'lerin yaklaşık %65'inde görülür. TP53 mutasyonlarının spektrumu sigara içenler ve içmeyenler arasında farklılık gösterir. Anormal TP53'ün akciğer KHDAK'da kötü bir prognostik faktör olduğu bulunmuştur. Ayrıca, TP53'teki genetik değişiklikler tedavi direnci ile ilişkilidir (30,31).
LKB-1, serin/treonin kinazı (STK11) kodlar ve mTOR inhibisyonu yoluyla hücre döngüsü, hücre polaritesi ve enerji metabolizması gibi biyolojik süreçleri düzenler. LKB‑1'in bialelik inaktivasyonu, KHDAK’de TP53 ve KRAS’dan sonra üçüncü en yaygın genetik bozukluktur (%30). İnaktive edici mutasyonlar adenokarsinomlarda skuamöz hücreli kanserlerden daha yaygındır; erkeklerde, sigara içenler arasında ve az diferansiye adenokarsinomlarda daha sık görülürler (29).
PTEN inaktivasyonu, AKT/protein kinazın liganddan bağımsız sınırsız aktivasyonuna neden olur. PTEN mutasyonları KHDAK'nin yaklaşık %5'inde görülür. Skuamöz hücreli
karsinomda adenokarsinomdan daha yaygındır ve sigara öyküsü ile ilişkilidir. PTEN ekspresyon seviyelerinin, KHDAK'nın yaklaşık %75'inde azaldığı gösterilmiştir (31).
Epigenetik Değişiklikler
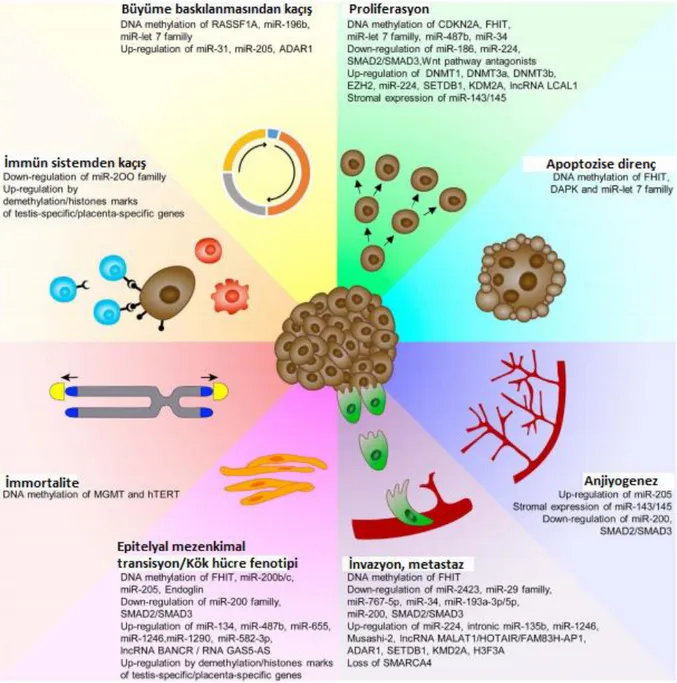
DNA metilasyonu en önemli epigenetik değişikliklerden biridir; DNA metiltransferaz (DNMT) enzimleri tarafından katalize edilir ve metile CpG'yi bağlayan proteinlerin yardımıyla gerçekleşir (MBD1, MBD2, MeCP2 vb.). Tümör baskılayıcı genlerin promotor hipermetilasyonu yoluyla inaktivasyonu, akciğer kanserinin erken evrelerinde görülür ve bu genlerin çoğunun prognozla ilişkili olduğu bilinmektedir. Akciğer kanserinde promotor metilasyonu bağlamında en yaygın olarak incelenen genler arasında P16INK4A, RASSF1A, APC, RARβ2, CDH1, CDH13, DAPK1, FHIT ve MGMT yer almaktadır. Çalışmalar, akciğer kanseri hastalarında DNMT1 ve DNMT3b enzimleri ve MBD2'nin seviyelerinin arttığını bulmuştur. Bunların, TSG’lerin hipermetilasyonu yoluyla akciğer kanserinin gelişmesine katkıda bulunduğu düşünülmektedir. DNA hasarı, DNA rekombinasyonu ve onarımında rol oynayan artmış TRDMT1 geninin, DNA metilasyonunu ve akciğer kanseri gelişimini etkileyebileceği ifade edilmektedir. Kanser gelişiminin başka bir mekanizması genomik hipometilasyondur. Akciğer adenokarsinomunda global hipometilasyon, ileri evrelerde görülmektedir. KHDAK'de hipometilasyonun inaktif onkogenleri aktive edebildiği ve kanser oluşumuna yol açan genomik instabiliteye neden olabileceği bildirilmektedir. Yapılan çalışmalarda akciğer kanserinde metilasyon değişikliklerinin; hücre farklılaşması, epitelyal mezankimal transisyon ve hücre döngüsü regülasyonunda rol oynadığı belirlenmiştir. Akciğer kanserinde nükleer elementler, LTR elementleri, segmental kopyalar ve subtelomerik bölgelerde hipermetilasyon olduğu gösterilmiştir. Şekil 4’te belirtildiği gibi akciğer kanserinin tümöral ilerlemesinde ve metastazında çoklu epigenetik mekanizmalar yer almaktadır (34).
Şekil 4.KHDAK’de kanser özelliklerinin kazanılmasını destekleyen epigenetik değişimler (34)
Histon deasetilazlar (HDAC), histon kuyruğundaki asetil gruplarının çıkarılmasını katalize ederek histonları inaktive ederler. Akciğer kanserinde HDAC’ların aşırı eksprese edildiği gösterilmiştir. Çeşitli global histon modifikasyonları akciğer kanserinde sağkalım ile ilişkilendirilmiştir. HDAC baskılayıcı kompleksin bir bileşeni olan SIN3A mRNA'sının KHDAK'de azaldığı gösterilmiştir (31).
Mikro RNA'lar (miRNA'lar), translasyona uğramayan miRNA genleri tarafından kodlanan küçük RNA molekülleridir. miRNA'lar yüzlerce mRNA hedefini negatif olarak regüle edebilir. Birçok çalışma akciğer kanseri ve miRNA ekspresyonu arasında bir ilişki olduğunu bildirmiştir, en çok çalışılanlar 21 ve 155'dir. Yapılan bir meta-analizde, yüksek
miR-21 ekspresyonu KHDAK'de düşük sağkalım ile ilişkilendirilmiştir. Histolojiye özgü miRNA ekspresyon paternleri de gösterilmiştir. Örneğin, 205'in skuamöz hücreli karsinoma, miR-124a'nın adenokarsinoma spesifik olduğu bildirilmiştir (31, 33).
Epigenetik bozulma ile KHDAK’de, malignitenin ilerlemesinde epitelyal mezankimal transisyon (EMT) da önemli bir rol oynamaktadır.EMT; invazyon, migrasyon, metastaz ve ilaç direncinin önemli bir unsuru olarak kabul edilmektedir. Çok sayıda miRNA'nın aktivitesi, KHDAK'de EMT'nin artmasını veya inhibisyonunu düzenler. Bunlar arasında miR-200, ZEB1, GATA3, ubikitine spesifik peptidaz 25, Flh, VEGFR1, BMP4, Foxf2, PD-L1 yer almaktadır.
Metastaz ilişkili akciğer adenokarsinom transkripti 1 (MALAT1) KHDAK'de metastaz ve kötü prognoz için prediktif biyomarker olarak tanımlanan ilk lncRNA’dır (uzun kodlayıcı olmayan RNA). MALAT1, metastaza bağlı genlerin ekspresyonunu indükleyerek migrasyon ve hücre büyüme özelliklerini destekler. BRAF ile aktive edilen lncRNA'nın (BANCR) ve RNA GAS5-AS'nin downregülasyonu, kötü prognoz ve ileri evre KHDAK ile ilişkilidir, ayrıca EMT'yi etkileyerek metastaza katkıda bulunur (34).
2.3.3 KHDAK’nin Erken Tanısında Metilasyon Biyomarkerlarının Önemi
Akciğer kanserinde, erken evrede teşhis edilen hastalar hayatta kalmak için en iyi şansa sahiptir. Fakat, akciğer kanseri vakalarının %80'inden fazlasını oluşturan KHDAK’lı hastaların sadece üçte birine lokalize, potansiyel olarak tedavi edilebilir hastalık teşhisi konmaktadır. DDBT kullanılarak yapılan taramanın akciğer kanserinin erken saptanmasına katkı sağladığı görülmüştür. Evre 1'de teşhis edilen vakaların %60'ı iyileştiğinden, göğüs radyografisine kıyasla DDBT’nin kanser mortalitesini %20 azalttığı gösterilmiştir. Çok ümit verici olmakla birlikte, DDBT taraması, daha ileri, invaziv test gerektiren ancak akciğer kanseri teşhisi ile sonuçlanmayan çok sayıda belirtisiz nodülü de tanımlar ve uygulanması maliyetli bir tarama yöntemidir.
KHDAK; klinik semptomların kapsamlı değerlendirilmesi, tıbbi görüntüleme, serum tümör biyomarker düzeylerinin değerlendirilmesi ve sitolojik inceleme ile teşhis edilir. Akciğer kanserinin gelişmesini açıklayan en önemli hipotez; tümör gelişiminde genetik ve epigenetik anormalliklerin kademeli birikimidir. Birçok çalışma, CEA, PRO-GRP, NSE, SCC-AG, CYFRA21-1 ve CA199 dahil olmak üzere birçok tümör markerının kombine olarak değerlendirilmesinin, tekli ölçümlerden daha etkili olduğunu göstermektedir. Yapılan çalışmalarda, epigenetik değişikliklerin KHDAK ile anlamlı şekilde ilişkili olduğu gösterilmiştir. Ayrıca anormal metilasyonlu genlerin; kanser tanısı, tedavi yanıtı, prognozla ilişkili olduğu ve birçok kanser tipinin erken tümöral evrede anormal DNA metilasyonunun
mevcut olduğu da daha önce yapılan çalışmalarda bulunmuştur. Ek olarak, plazma, idrar, semen ve dışkı gibi farklı tipte numunelerde anormal olarak metillenmiş DNA bulunmuş ve bu DNA metilasyonunun, KHDAK'nin erken teşhisini kolaylaştırabilen, non-invaziv bir biyolojik tanı belirteçi olma potansiyeline sahip olduğu gösterilmiştir (9).
2.4 De Novo Metilasyonunun Kanser Başlangıcındaki ve İlerlemesindeki Rolü
DNA metilasyonu, CpG dinükleotitleri içindeki sitozin halkasının beşinci karbonuna metil grubu eklenmesiyle meydana gelir. Bu reaksiyon, üç ana DNMT ile katalize edilir. CpG bölgeleri genom boyunca yer almaktadır, ancak dağılımları eşit değildir ve metilasyonları bimodaldir. Genomun büyük çoğunluğu az miktarda CpG içermektedir (100 bp başına 1 CpG'den az) ve bunların çoğu normal hücrelerde metillenmiş haldedir. Buna karşılık, genomun yaklaşık %2'si, CpG adaları (CGI'lar) olarak adlandırılan bölgelerde yüksek CpG yoğunluğu (10 bp başına ~ 1 CpG) içermektedir. CGI'lar, gen promotorlarının %50-60'ında transkripsiyon başlangıç bölgelerinde (TBB) bulunur ve normal gelişim sırasında veya yetişkin hücrelerinde genellikle metillenmez (Şekil 5, 6).
Şekil 5. DNA metilasyonu. DNMT’ler metil gruplarını SAM (S-adenosilmetionin) 'den SAH'ye (S-adenosilhomosistein) transfer eder; böylece 5-metilsitozin oluşur (35).
Şekil 6. CpG adalarındaki metilasyon (36)
DNA metilasyonunun fonksiyonu, hedef CpG bölgelerinin lokalizasyonuna göre değişir. TBB'de gerçekleştiğinde, DNA metilasyonu genellikle transkripsiyon başlangıcının inhibisyonu ile ilişkili inhibitör bir markerdır. Paradoksal olarak, gen gövdesindeki CpG bölgelerinin metilasyonu, transkripsiyonun uzamasını uyarmaktadır. Son çalışmalar, ekzon-intron bileşkelerinde meydana geldiğinde gen uç birleştirmesinin (splicing) düzenlenmesinde DNA metilasyonunun yeni bir rolü olduğunu göstermektedir (37). İntragenik DNA metilasyonu ayrıca alternatif promotorları susturup retrotranspozon elementlerin ekspresyonunu baskıladığında, transkripsiyon devamlılığını sağlayarak genom stabilitesini korur.
Yaşlanma, kronik enflamasyon, sigara içme, karsinojenlerin maruziyeti gibi akciğer kanseri ile ilişkili çeşitli faktörlerin epigenomu değiştirdiği gösterilmiştir. Anormal metilasyon paternleri, akciğer kanseri de dahil olmak üzere birçok kanserin ayırt edici özelliklerindendir. Metilasyon değişiklikleri erken karsinogenez sırasında ortaya çıkar ve tümörün ilerlemesini kolaylaştırır. Kanser genomu, TSG’ler ve kanseri durduran diğer genlerin kalıcı olarak susturulması ile ilişkili CGI'lardaki yoğun metilasyon haricinde, global olarak hipometile edilir. KHDAK'de bu CGI hipermetilasyonu; sigara kullanımı, histolojik alt tip, kanserin ilerlemesi, klinik olarak anlamlı moleküler alt tipler ve hasta prognozu ile ilişkili bulunmuştur (37). 2.5 Cell-free DNA’nın (cfDNA) Biyolojik Temeli
cfDNA, sağlıklı kişilerde hematopoetik hücrelerin ana kaynağı olduğu, farklı dokulardan kaynaklanan nükleik asitlerin bir karışımıdır. cfDNA'nın konsantrasyonu bireyler arasında büyük ölçüde değişir, ancak genellikle plazmada 10 ng'den daha düşük konsantrasyonda
bulunur. Yüksek cfDNA seviyesi doku travması, iltihaplanma veya kanser gibi hastalıkların sonucu olarak tespit edilir. Kanserde ise, dolaşımdaki tümör DNA'sı (ctDNA), <%0.05 ila %90 arasında değişen oranda, cfDNA'nın önemli bir kısmını temsil eder. En önemlisi tümör hacmi, lokalizasyonu ve vaskülarizasyonu olmak üzere hastanın kemoterapilere verdiği yanıt, ayrıca hepatik ve renal klirens gibi birçok faktör ctDNA'nın konsantrasyonunu etkiler. ctDNA çoğunlukla primer tümör ve metastatik lezyonların apoptoz ve nekrozundan kaynaklanmaktadır. ctDNA, bu işlemler sırasında nükleaz enziminin parçalamasıyla ortaya çıkan kısa fragmanlardan (180–200 bp) oluşur. Yakın zamanda yapılan çalışmalar, dolaşımdaki tümör hücreleri ve tümör hücreleri tarafından kana salınan eksozomlar gibi alternatif ctDNA kaynaklarını da bildirmiştir.
Birçok çalışma, kan örneğinden elde edilen ctDNA ve karşılık gelen tümör dokusu DNA'sı arasında uyumlu genetik ve epigenetik değişiklikleri göstermiştir. ctDNA potansiyel olarak primer ve metastatik kanserlerde intra ve intertümör moleküler heterojeniteyi yansıtır. Mutasyonlar, kopya sayısı değişimleri, kromozomal düzenlenmeler ve bu çalışmanın kapsamı olan anormal metilasyon kalıpları dahil olmak üzere ctDNA incelenerek tümöre özgü değişiklikler tespit edilebilir (38).
2.5.1 Metillenmiş ctDNA’nın Akciğer Kanseri Tarama ve Tanısında Biyomarker Olarak Kullanılması
DNA sekanslarının global hipometilasyonu ve CGI'larda fokal hipermetilasyon, karsinogenezin erken aşamalarında hali hazırda gözlendiğinden, metilasyon, kanserin erken teşhisi için cazip bir yaklaşım oluşturmaktadır. Literatüre bakıldığında, daha önce ctDNA’larda yapılmış farklı çalışmalarda; hem çalışmamızdaki RASSF1A, p16, SHOX2, RARβ2, APC, DAPK1 genlerinin, hem de farklı genlerin promotor bölgelerinin kontrollerle karşılaştırıldığında farklı olarak metillendiği bulunmuştur (9–12).
RASSF1A geni, 3. kromozomun p21.3 bölgesinde yer almaktadır. RASSF1A dahil sekiz homolog proteini kodlar. Tübülin ile etkileşime giren RASSF1A proteini, hücre döngüsü kontrolü, apoptoz ve mikrotübül stabilizasyonunun düzenlenmesinde kritik rol oynar. CpG adalarında promotor bölgedeki hipermetilasyonunun akciğer kanseri dahil birden fazla kanseri indüklediği bildirilmiştir. RASSF1A’nın akciğer kanserindeki hipermetilasyonu plazmada ve bronş lavajında tespit edilmiştir (39).
p16 (ayrıca sikline bağlı kinaz inhibitörü 2A, CDKN2A olarak da adlandırılır) geni 9. kromozomun p21 bölgesinde yer alır. Sikline bağlı bir kinaz inhibitörünü kodlar ve G1 sikline bağlı kinaz E'nin (CDKE) etkisizleştirilmesi yoluyla hücre döngüsünü düzenler. p16
promotorundaki hipermetilasyon, gen transkripsiyonunu baskılayarak hücre döngüsü ilerlemesinin inhibisyon kaybıyla sonuçlanır. Literatürde, bu epigenetik değişiklik; akciğer kanserinde plazma, doku, bronş lavajı, ekshalasyon kondensatında saptanmış ve çeşitli malignitelerde bildirilmiştir (39).
SHOX2 geni 3. kromozomun q25.32 bölgesinde bulunur. Kalp, iskelet ve beyin gelişiminde önemli rol oynayan bir transkripsiyon faktörünü kodlar. Bu gendeki metilasyon değişiklikleri; akciğer kanseri, baş ve boyun skuamöz epitel hücreli karsinomu, kolorektal kanserler, over kanseri gibi diğer kanser türlerinde hem plazmada hem de dokularda farklı çalışmalarda bildirilmiştir (39).
RARβ2 geni 3. kromozomun p24.2 bölgesinde bulunur, normal hücre büyümesi ve farklılaşması için gerekli olan A vitamini nükleer reseptörünün kodlayıcı genidir. Daha önceki çalışmalarda, KHDAK tümör dokularında RARβ2 promotor hipermetilasyon sıklığı %45-60 sıklığında bulunmuştur. RARβ2 'nin erken akciğer kanseri tespiti için duyarlı bir belirteç olduğu ileri sürülmüştür, çünkü sadece akciğer adenokarsinomunda (%83) değil, aynı zamanda hem düşük dereceli hem de yüksek dereceli (sırasıyla %55 ve %78) atipik adenomatöz hiperplazide yüksek oranlarda metillenmiş olarak bulunmuştur (40).
APC geni, kromozom 5q21’de yer almaktadır ve hem otozomal dominant kalıtılan ailesel adenomatöz polipozis koli sendromunda hem de sporadik kolorektal kanser gelişiminde önemli bir rol oynamaktadır.Çoğunlukla genin kodlayıcı bölge mutasyonları, transkripsiyonel aktivatör olarak işlev gören β-kateninde bozulmaya yol açar ve böylece hücre büyüme kontrolünün kaybına neden olur. Fakat APC geninin hotspot bölgesinde inaktive edici nokta mutasyonları akciğer kanserinde tespit edilmemiştir. Bu nedenle, kolorektal ve diğer gastrointestinal kanserlerin bir alt grubunda gösterildiği gibi, promotor metilasyonu ile inaktivasyon, akciğer kanserinde APC gen fonksiyonunun bozulmasını düşündürmektedir. Yapılan çalışmalar bu düşünceyi desteklemiştir (38, 40).
DAPK1 (DAPK) geni 9q21.33 bölgesinde yer almaktadır ve hücre ölüm yolaklarında yer alan "Death-Associated Protein" genleri grubundandır. DAPK1 geni, kalsiyum kalmodülin yolağını düzenleyen serin/treonin kinazı kodlamaktadır. Yapılan araştırmalarda DAPK1'in apoptotik ve otofajik hücre ölümünde, tümör progresyonunun ve metastazlarının supresyonunda önemli bir rol oynadığı gösterilmiştir. Birçok çalışma, promotor hipermetilasyonu ile DAPK1 kaybının KHDAK gelişimi ve ilerlemesi ile ilişkili olduğunu desteklemiştir (42).
2.6 DNA Metilasyonu Analiz Yöntemleri
Gelişen epigenetik alanında, DNA örneklerinin metilasyon durumunu belirlemek için çeşitli yöntemler mevcuttur. Yöntemler amacına uygun olarak ikiye ayrılır. Bunlar bilinmeyen epigenetik değişikliklerin saptanması ve ilgili düzenleyici bölgeler/genler içindeki DNA metilasyonunun değerlendirilmesidir (Şekil 7) (43).
Şekil 7. DNA metilasyon yöntemleri (43) HPLC-UV: High Performance Liquid Chromatography-Ultraviolet ELISA: Enzyme-Linked Immunosorbent Assay LINE: Long Interspersed Nuclear Elements RFLP: Restriction Fragment Length Polymorphism AFLP: Amplified Fragment Length Polymorphism LUMA: Luminometric Methylation Assay MSCC: Methyl-Sensitive Cut Counting HRM: High Resolution Melting
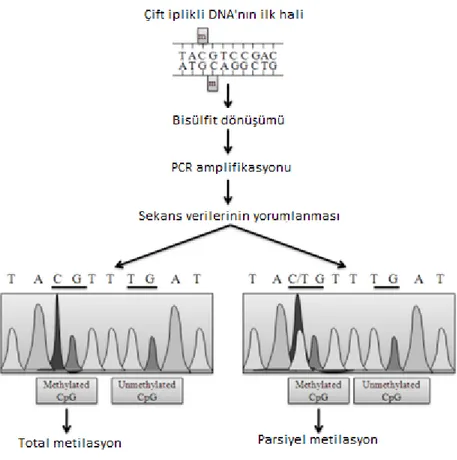
Bisülfit dizileme tekniği, DNA metilasyon çalışmalarında “altın standart” yöntemdir. Mevcut DNA sekanslama teknolojileri, metilsitozini sitozinden ayırt edememektedir. DNA'nın sodyum bisülfit ile muamelesi, metillenmemiş sitozini üç aşamada urasile dönüştürür:
Hedef bölge biliniyor mu? Hayır Tüm genom metilasyon profillemesi -HPLC-UV -Kütle spektrometresi -ELISA -LINE-1 PCR'ı ve Pyrosequencing -RFLP,AFLP -LUMA Farklı metillenmiş bölgeleri belirleme -Bisülfit Sekanslama -Mikroarray/ Bead array -MSCC Evet Bisülfit Dönüşümü -PCR ve sekanslama -Metilasyon spesifik PCR -HRM -COLD-PCR -Bead array -Pyrosequencing Digestion based analiz sonrası PCR/qPCR
sülfonasyon, hidrolitik deaminasyon ve desülfonasyon. Urasile dönüştürülmüş sitozinler, PCR amplifıkasyonu sonrasında Sanger sekanslamada timin olarak okunur. 5 mC, bu dönüşüme dirençlidir ve bu nedenle sitozin olarak okunur (Şekil 8). Böylece aynı DNA numunesinin bisülfit öncesi ve sonrası Sanger sekansının karşılaştırılması, metillenmiş sitozinlerin saptanmasını sağlar. Sekanslamada hem C hem de T pikleri ortaya çıkarsa, bu parsiyel metilasyonun veya potansiyel olarak eksik bisülfit dönüşümünün meydana geldiğini gösterir (Şekil 9). Bu yaklaşım, yeni nesil dizileme teknolojisi ile global DNA metilasyon analizinde de kullanılabilir (43, 44).
Şekil 9. Metilasyon sekanslama sonuçlarının yorumlanması (45)
2.6.1 Metilasyon Spesifik PCR
Metilasyona spesifik kantitatif PCR (qPCR), gene özgü metilasyon analizi için klasik bir yöntemdir. Bu yöntem aynı bölgeye spesifik, metillenmiş ve metile edilmemiş DNA dizilerini hedeflemek için tasarlanmış iki primer çiftini kullanır. Her numune için iki qPCR reaksiyonu gerçekleştirilir ve rölatif metilasyon, Ct değerlerinin farkına göre hesaplanır. Tek bir primer çifti farklı şekilde iki probla etiketlenmiştir. Bir prob bisülfit dönüşümünü takiben hedef bölgeye hibridize olurken, diğeri bisülfit dönüşümüne karşı korunan metile sitozine hibridize olur. Hedef bölge içindeki korunan ve dönüştürülen sitozinin oranı qPCR ile belirlenir. Yoğun CpG bölgelerinde lokusa özgü metilasyonu ölçememesi, yöntemi sınırlayan faktörlerden biridir. Prob bağlanma bölgesi birden fazla CpG'ye sahipse, analizin okunması, bu bölgenin sadece yarı kantitatif bir şekilde hipo/hipermetillenmiş olup olmadığını gösterecektir. Her bir CpG'yi spesifik olarak belirlemek için aynı bölgeye özgü birden fazla primer oluşturulabilir ancak bu maliyeti çok arttırmaktadır. Ayrıca metilasyon analizinde standart bir eğri oluşturmak için metillenmiş ve metillenmemiş kontrol DNA'sına ihtiyaç duymaktadır (43, 45).
2.6.2 Dijital PCR
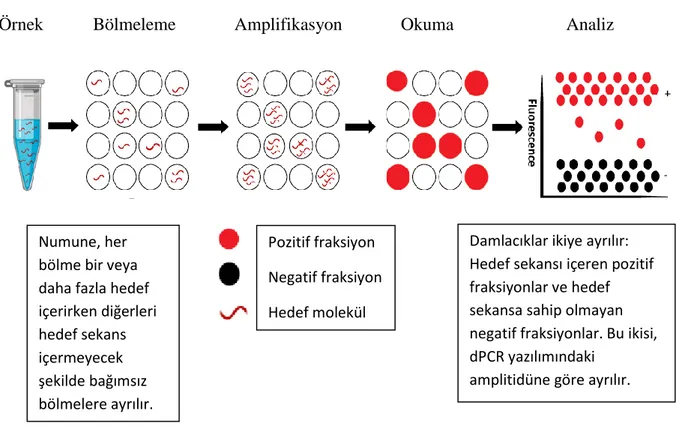
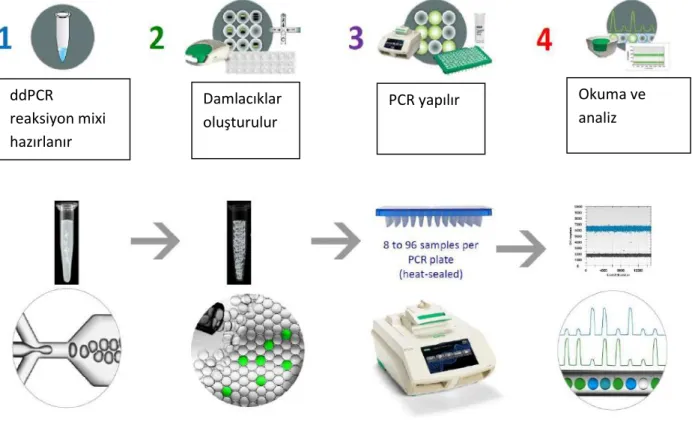
Polimeraz zincir reaksiyonu (PCR), ilgilenilen spesifik bir geni çoğaltmak için yaygın olarak kullanılan moleküler bir tanı tekniğidir. PCR'ın moleküler uygulamalarındaki bazı zorluklar ve kullanım alanlarının daha da genişletilerek farklılaştırmak istenmesi, dijital PCR (dPCR) sistemlerinin geliştirilmesine yol açmıştır. qPCR'ye göre birçok avantaja sahip olan dPCR, hedef nükleik asit dizilerini kesin olarak standart bir eğriye ihtiyaç duymadan ölçmeye olanak sağlar. dPCR ilk olarak 1999'da kanser teşhisi için bir araç olarak geliştirilmiştir. dPCR yöntemi de aslında PCR'ye dayanır, ancak qPCR'den ana farkı, reaksiyon hacminin çok küçük bir hacme (6 nanolitreden birkaç pikolitreye kadar) çok sayıda küçük bölme ile (500 ila binlerce) bölünmesidir. dPCR işleminden sonra, her bölme pozitif veya negatif olarak (ikili veya dijital okuma ile) puanlanır. Bir örnekteki hedef DNA'nın mutlak miktarı belirlenerek sonuçların istatistiksel analizi yapılır.
dPCR'de, hedef DNA kalıplarının bölmeler boyunca dağılımının bir Poisson grafiğini izlediği varsayılmaktadır. Toplam pozitif ve negatif bölme sayısını sayılarak ve Poisson istatistiği kullanılarak, orijinal örnekteki mutlak DNA kopya sayısı hesaplanabilmektedir (Şekil 10). Poisson (veya binom) dağılımına dayalı hedeflerin sayısının hesaplanması aşağıdaki varsayımlar dizisine dayanmaktadır;
-Hedef moleküller, analiz altındaki toplam bölme sayısına rastgele dağıtılır,
-Hedef molekülün varlığında bölme pozitif, yokluğunda negatif olarak sınıflandırılır,
-Tüm bölmeler aynı hacme sahiptir,
-Mutlak ölçüm için bölmelerin hacmi tam olarak bilinmedir.
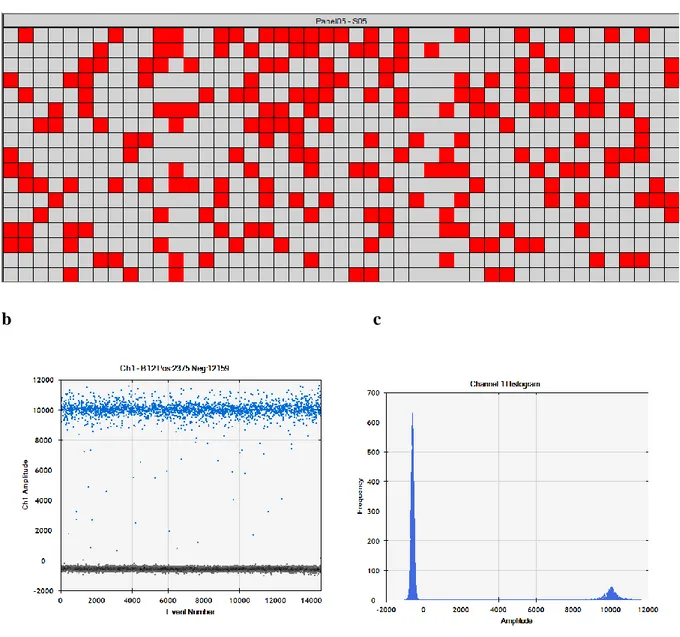
a
b c
Şekil 10. dPCR çalışmalarının sonuçlarından örnekler a 765 bölmeli bir plate ve 208'i pozitif olan (hedef molekülü içeren) bölmeler gösterilmektedir. b, c Bio-Rad QX200 platformundaki (dPCR) görsel çıktının örnekleri gösterilmektedir. Reaksiyon, 20.000 damlacık içerir ve pozitif damlacıklar, negatif damlacıklardan daha yüksek bir floresansa sahiptir (gösterilen örneklerde, 2.375 pozitif olan toplam 14.534 damlacık vardır).


![Tablo 3. Hedef gen bölgelerinin bisülfit dönüşümü sonrası dizi analizi için PCR ile çoğaltılmasında kullanılan primer dizileri [F:Forward (İleri), R:Reverse (Geri), Y:C/T, R:A/G]](https://thumb-eu.123doks.com/thumbv2/9libnet/3031431.2470/51.892.122.838.215.535/bolgelerinin-sonrasi-cogaltilmasinda-kullanilan-dizileri-forward-ileri-reverse.webp)