T.C DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
MALİGN MEZOTELYOMAYA BAĞLI PLEVRAL
EFÜZYON AYIRICI TANISINDA SIVI/SERUM
VASKÜLER ENDOTELYAL GROWTH FAKTÖR
(VEGF) ORANININ YERİ
UZMANLIK TEZİ
Dr. Yakup DÜZKÖPRÜ
İÇ HASTALIKLARI ANABİLİM DALI
TEZ DANIŞMANI
Doç. Dr. M. Ali KAPLAN
T.C DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
MALİGN MEZOTELYOMAYA BAĞLI PLEVRAL
EFÜZYON AYIRICI TANISINDA SIVI/SERUM
VASKÜLER ENDOTELYAL GROWTH FAKTÖR
(VEGF) ORANININ YERİ
UZMANLIK TEZİ
Dr. Yakup DÜZKÖPRÜ
İÇ HASTALIKLARI ANABİLİM DALI
TEZ DANIŞMANI
Doç. Dr. M. Ali KAPLAN
ÖNSÖZ
Bilimsel düşünme ve çalışmayı bizlere öğreten, engin bilgi ve birikimlerini bizimle paylaşan; bugünlere gelmemizde büyük emeği olan, hekimliği bizlere öğreten değerli hocamız Prof. Dr. Ekrem MÜFTÜOĞLU’na başta olmak üzere, İç Hastalıkları A.B.D. Başkanımız Prof. Dr. M.Emin YILMAZ’a yetişmemde büyük emekleri olan bütün değerli öğretim üyeleri; Prof. Dr. Orhan AYYILDIZ, Prof. Dr. Abdurrahman IŞIKDOĞAN, Prof. Dr. Alpaslan Kemal TUZCU, Prof. Dr. Muhsin KAYA, Prof. Dr. Ali kemal KADİROĞLU, Doç. Dr. Mehmet KÜÇÜKÖNER, Doç. Dr. Zülfükar YILMAZ, Yrd. Doç. Dr. Faruk KILINÇ, Yrd. Doç. Dr. Yaşar YILDIRIM, Yrd. Doç. Dr. M. Sinan DAL, Yrd. Doç. Dr. Zuhat URAKÇI, Uzm. Dr. Abdullah KARAKUŞ ve Uzm. Dr. Nazım EKİN’e teşekkürlerimi sunarım.
Tezimi oluşturmamda büyük emeği geçen tez danışmanım İç Hastalıkları öğretim üyelerinden Doç. Dr Muhammet Ali KAPLAN hocama teşekkürlerimi sunarım.
Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.B.D., Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D., Göğüs Hastalıkları ve Tüberküloz A.B.D. ve Radyoloji A.B.D. başkanlarına ve değerli öğretim üyelerine,
Birlikte çalışmaktan büyük mutluluk ve onur duyduğum asistan arkadaşlarıma ve İç Hastalıkları A.B.D. çalışanlarına teşekkürlerimi sunarım.
Ayrıca bu günlere gelmemde büyük pay sahibi olan ve desteklerini hiçbir zaman benden esirgemeyen anneme, babama, kardeşlerime ve her zaman en büyük destekçim olan hayat arkadaşım, değerli eşime ve gözümün nuru biricik kızıma teşekkürlerimi sunarım.
Dr. Yakup DÜZKÖPRÜ Diyarbakır-2015
ÖZET
GİRİŞ: Malign sıvıların ayırıcı tanısında çok sayıda parametre çalışılmış olup VEGF
bunlardan bir tanesidir. Bu araştırmanın amacı mezotelyoma ayırıcı tanısında sıvı ve serum VEGF düzeyleriyle sıvı/serum VEGF oranının ayırıcı tanıdaki yerini araştırmaktır.
MATERYAL VE METOD: Çalışmaya 2011-2015 yılları arasında hastanemize
başvuran plevral efüzyonu olan 18 yaş üstü hastalar dâhil edildi. Hastalar mezotelyoma(grup 1), mezotelyoma dışı malign(grup 2) ve benign(grup 3) olmak üzere 3 gruba ayrıldı. Mezotelyoma ve mezotelyoma dışı malign hastalar sıvı/serum VEGF oranı değerlendirilirken malign grup olarak değerlendirildi. Her üç grupta sıvı ve serum VEGF düzeyleri çalışıldı ve sıvı/serum VEGF oranlarına bakıldı.
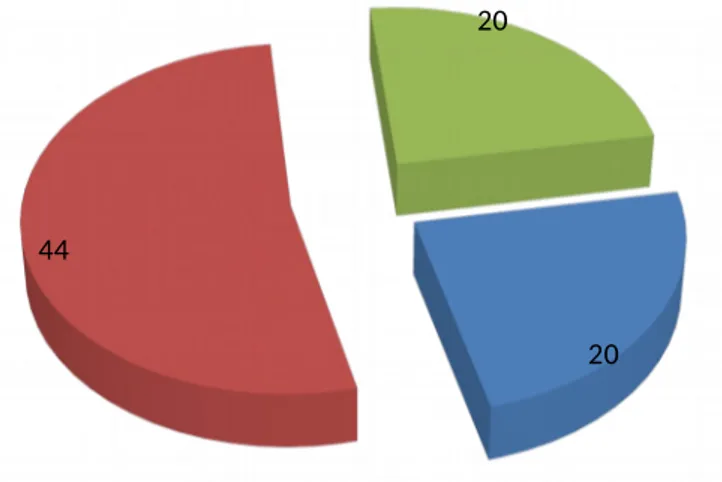
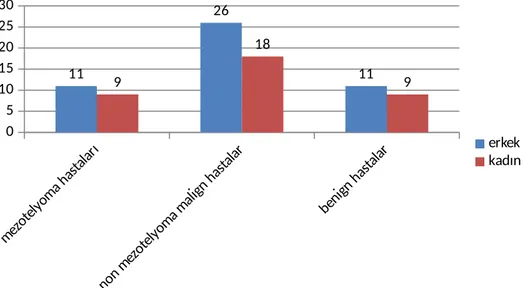
BULGULAR: 20 mezotelyoma, 44 mezotelyoma dışı malign ve 20 benign olmak
üzere toplam 84 hasta çalışmaya alındı. Serum VEGF düzeyleri açısından gruplar arasında istatistikî olarak anlamlı fark bulunmazken (grup 1: 437±324 pg/ml, grup 2: 354±223 pg/ml, grup 3: 373±217 pg/ml, p:0.836) sıvı VEGF düzeyleri açısından gruplar arasındaki fark istatistiksel olarak anlamlı bulundu (grup1: 3359±700 pg/ml, grup 2: 2175±435 pg/ml, grup 3: 1092±435 pg/ml, p:0.041). Malign ve benign gruplar arasındaki Sıvı/serum VEGF oranının farkı istatistiksel anlamlılık sınırındaydı(malign grupta: 8.83±1.29, benign grupta: 4.57±1.07, p:0.059). Mezotelyoma ile benign grup arasında sıvı/serum VEGF oranı istatistiksel olarak anlamlı düzeyde farklı bulundu(1. Grup: 12.11±1.68, 3. Grup: 4.57±1.07, p:0.044). ROC analizi ile sıvı/serum VEGF oranına ait cut off değeri % 76 sensitivite ve % 50 spesifite ile 0,85 olarak belirlendi. Bu Cut off değere göre hastalar kategorize edildiğinde malign ve benign grup arasındaki fark iatatistiksel olarak anlamlıydı (malign grupta cut off değerin üstündeki hasta oranı %75,9, benign grupta cut off değerin üstündeki hasta oranı %50, p:0.032). Mezotelyoma ile benign grup arasındaki fark istatistiksel anlamlılık sınırındayken (1. Grupta cut off değerin üstündeki hasta oranı %77,8, 3. grupta cut off değerin üstündeki hasta oranı %50, p:0.076) mezotelyoma ile mezotelyoma dışı malign grup arasındaki fark ise istatistiksel olarak anlamlı bulunmadı (1. Grupta cut off değerin üstündeki hasta oranı %77,8, 2. Grupta cut off değerin üstündeki hasta oranı % 75, p:0.822).
SONUÇ: Malign sıvıların ayırıcı tanısında sıvı VEGF katkı sunabilecek bir
parametredir. Sıvı/serum VEGF oranı da daha geniş çalışmalarla desteklenmek kaydıyla aynı şekilde ayırıcı tanıya katkı sunabilir. Ancak her iki parametre de diğer parametrelerle desteklenmelidir.
ABSTRACT
Introduction: VEGF is one of the parameters that has been studied in differential
diagnosis of malign fluids. This study is aimed to evaluate applicability of serum, fluid VEGF level and fluid to serum VEGF ratio in the diagnosis of mesothelioma.
Materials and Methods: The patients with pleural effusion over age of 18, between
period of 2011 and 2015 were included in the study. They were seperated into three group: 1 mesothelioma patients, group 2 other malignancies and group 3 benign etiologies. Group 1 and 2 were accepted as malign group. For evaluate fluid/serum VEGF ratio In all groups, fluid, serum VEGF levels and ratio of fluid/serum VEGF level were studied.
Results: 20 cases with mesothelioma, 44 cases with other malignancies and 20 cases
with benign etiologies were included in this study. No statistically significant difference were found between serum VEGF levels of all groups, (group 1: 437±324 pg/ml, group 2: 354±223 pg/ml, group 3: 373±217 pg/ml, p:0.836), while fluid VEGF levels showed statistically significant difference. (group1: 3359±700 pg/ml, group 2: 2175±435 pg/ml, group 3: 1092±435 pg/ml, p:0.041). Ratio of fluid to serum VEGF levels showed no statistical difference between malign ( group 1 and group 2) and benign (group 3) groups. (malign group: 8.83±1.29, benign group: 4.57±1.07, p:0.059), but showed statistically significant difference between mesothelioma and benign groups. (Group 1: 12.11±1.68, Grup 3: 4.57±1.07, p:0.044). The cut off value of ratio of fluid to serum VEGF level was found 0,85 (sensitivity 76%; specificity 50%, roc analysis). According to this cut of value, when patiens were categorized as over 0.85 and lower 0.85, statistically significant difference between malign and benign groups were found. ( for malign group %75,9, benign group %50, p:0.032). Between mesothelioma and benign groups, the difference were within the statistical range( group1 : %77,8, group3 %50, p:0.076), in contrast the difference between mesothelioma and other malignancies showed no significance. (group1 %77,8, group2 % 75, p:0.822)
Conclusion: VEGF can be an applicable parameter in the differential diagnosis of
malign fluids. Further studies need to be done to support the applicability of fluid/serum VEGF ratio as a promising parameter for differantial diagnosis of the malign fluids. However these parameters should be evaluate with others parameters that using for differantial diagnosis malign fluids.
İÇİNDEKİLER
ÖNSÖZ...i
ÖZET...ii
ABSTRACT...iv
TABLO VE ŞEKİL LİSTESİ...viii
KISALTMALAR...ix
1.GİRİŞ VE AMAÇ...1
2. GENEL BİLGİLER...3
2.1. PLEVRA...3
2.1.1. Plevranın anatomi ve histolojisi...3
2.1.2. Plevranın fizyolojisi...4
2.1.3. Plevral sıvı oluşumu...4
2.1.3.1. Plevral kapillerler ve sıvı oluşumundaki rolleri...4
2.1.3.2. Akciğer interstisyumu ve plevral sıvı oluşumundaki rolü...5
2.1.3.3. İntratorasik lenfatiklerin ve kan damarlarının sıvı oluşumundaki rolleri...6
2.1.3.4. Periton boşluğunun sıvı oluşumundaki rolü...6
2.1.4. Plevral sıvının emilimi...6
2.1.5. Plevral efüzyon patogenezi...6
2.1.6. Plevral efüzyonda tanısal yaklaşım...8
2.1.6.1. Klinik özellikler...8
2.1.6.2. Radyolojik degerlendirme...9
2.1.6.3. Torasentez...10
2.1.6.4. Plevral sıvının değerlendirilmesi...11
2.1.6.5. Torasentezle tanı konulamayan olgularda tanı yaklaşımı...17
2.2. MEZOTELYOMA...19
2.2.1.Tanım...19
2.2.4.Etyoloji...20
2.2.5. Patogenez...21
2.2.6 Klinik Belirti ve Bulgular...22
2.2.7.Fizik muayene bulguları...23
2.2.8.Görüntüleme...24
2.2.8.1.Akciğer Grafisi...24
2.2.8.2.Toraks Bilgisayarlı Tomografisi...24
2.2.8.3.Manyetik rezonans görüntüleme (MR)...24
2.2.8.4.Pozitron emisyon tomografi (PET)...25
2.2.9. Serum ve Plevral Sıvı Laboratuar Bulguları...25
2.2.10. Tanı...26
2.3 VASKÜLER ENDOTELYAL GROWTH FAKTÖR (VEGF)...28
3.MATERYAL VE METOD...32
4.BULGULAR...34
4.1. GENEL ÖZELLİKLER...35
4.2.SIVI ANALİZİ...36
4.3.SERUM ANALİZİ...38
4.4.SIVI/SERUM VEGF ORANI...39
5.TARTIŞMA...41
5.1.MALİGN EFÜZYON VE BENİGN EFÜZYON AYRIMINDA VEGF’İN YERİ...43
5.2.MEZOTELYOMAYA BAĞLI EFÜZYONLARIN VE BENİGN EFÜZYONLARIN AYRIMINDA VEGF’İN YERİ ...44
5.3.MEZOTELYOMAYA BAĞLI EFÜZYONLA DİĞER MALİGN EFÜZYONLARIN AYRIMINDA VEGF’İN YERİ ...45
5.4.VEGF SIVI/SERUM ORANININ AYIRICI TANIDAKİ YERİ...46
SONUÇLAR...48
TABLO VE ŞEKİL LİSTESİ
Tablo 1. Plevral efüzyonların nedenleriTablo 2.Torasentezin rölatif kontrendikasyonları
Tablo 3. Plevral sıvının hücresel özellikleri
Tablo 4. Light kriterleri
Tablo 5. Transüdatif efüzyon nedenleri
Tablo 6. Eksüdatif efüzyon nedenleri
Tablo 7. Transüda-eksüda ayırımında kullanılan diger parametreler
Tablo 8. Asbest ile ilişkili bazı hastalıklar
Tablo 9. Vasküler Endotelyal Büyüme Faktörü (VEGF) Reseptörleri
Ve Biyolojik Etkileri
Tablo 10. Gruplar içindeki tanı dağılımı
Tablo 11. Hastaların tanı gruplarına göre yaş ve cinsiyet dağılımı
Tablo 12. Tüm parametrelerin sıvı analiz sonuçları ve gruplara göre dağılımı Tablo 13. Tüm parametrelerin serum analiz sonuçları ve gruplara göre dağılımı
ŞEKİL LİSTESİ
Şekil 1: VEGF ve VEGFR sistemi
Şekil 2: Grupların tüm hastalar içindeki dağılımı
KISALTMALAR
ABD : Amerika Birleşik Devletleri
ABY : Akut böbrek yetmezliği
ANA : Antinükleer antikor
ARDS : Akut respiratuar distres sendromu
BT : Bilgisayarlı tomografi
CEA : Karsinoembriyonik antijen
DNA : Deoksiribonükleik asit
FDG : 2-Floro-2-deoksi-d-glukoz
Flk : Fetal Liver Kinase
Flt : Fms-like Ttyrosine Kinase
FRC : Fonksiyonel rezidüel kapasite
HA : Hyaluronic acid
KNT : Karbon nanotüb
KPİB : Kapalı Plevral İğne Biyopsisi
LE : Lupus eritematozus
MM : Malign mezotelyoma
MPE :Malign plevral efüzyon
MPF : Megakaryocyte potentiating factor
MPM : Malign plevral mezotelyoma
OPN : Osteopontin
PA : Posteroanterior
PET : Pozitron emisyon tomografi
PIGF : Plesental Growth Faktör
PGI2 : Prostoglandin I2
PP : Plevral plak
PT : Protrombin zamanı
PTT : Parsiyel tromboplastin zamanı
RF : Romatoid faktör
SMRP : Soluble mesothelin-related peptides
SUV : Standardized uptake value
SV -40 : Simian virüs-40
TTF-1 : Tiroid transkripsiyon faktör
USG : Ultrasonografi
VCSS : Vena cava superior sendromu
VEGF : Vasküler endotelyal growth faktör
VEGF-R : Vasküler Endotelyal Growth Faktör Reseptörü
sVEGF : Slouble Vasküler Endotelyal Growth Faktör
1.GİRİŞ VE AMAÇ
Efüzyonlar malign ve benign birçok hastalığın seyrinde ortaya çıkar ve hastaneye başvuruların önemli bir kısmını oluşturur. Toplumda yeni ortaya çıkan plevral efüzyonun görülme sıklığı 4/1000’dir (1). Efüzyonlar malign ve benign birçok hastalıkta görülebildiği için etiyolojiyi ve tanıyı hızlı bir şekilde belirlemek büyük önem arz etmektedir. Günümüzde kullanılan parametreler zaman zaman yetersiz kalmakta ve tüm girişimlere rağmen vakaların %10-15 inde kesin tanı konulamamaktadır (2). Bu nedenle kullanılabilecek yeni parametrelerin arayışı devam etmekte olup VEGF bunlardan biridir.
Malign mezotelyoma(MM) en sık plevra olmak üzere serozal yüzeylerdeki mezotelyal hücrelerden köken alır (3). Vakaların ortalama % 80’inde asbest maruziyeti olup genellikle ilk olarak dispne ve göğüs ağrısıyla beraber plevral efüzyonla hastaneye başvururlar (4). Sito-histopatolojik yöntemler malign efüzyonların tanısında kesin tanı yöntemleri olmasına rağmen alınan materyalin yetersiz oluşu ve diğer nedenlerden dolayı tanı koymada sıkıntılar yaşanmaktadır. Tanıya ulaşmak için birçok çalışmada efüzyonlarda diğer biyokimyasal parametrelerle beraber tümör markerleri de çalışılmış olup yeterli ölçüde spesifik olmadığı anlaşılmıştır. Özellikle mezotelyoma ve akciğer adenokanser ayırıcı tanısında ciddi zorluklar yaşanmaktadır (5).
VEGF, plevral effüzyon gelişiminde kritik bir role sahip olan trombosit kaynaklı büyüme faktör ailesinin bir üyesidir. Endotel hücreleri için bilinen en spesifik mitojenik faktör olup permeabiliteyi artırıcı ve anjiojenik özelikleri vardır. Vücutta hem fizyolojik süreçte, hem inflamatuar hadiselerde hem tümör gelişiminde ve yayılımında rol almaktadır (6). Yapılan çalışmalarda özellikle malign kaynaklı plevral sıvılarda düzeyi yüksek bulunan VEGF’in diğer parametrelerle beraber ayırıcı tanıya yardımcı olabileceği bildirilmiştir. 2008 yılında D.Ü.T.F’de Dr. Taylan POYRAZ’ın yaptığı çalışmada mezotelyomada sıvı/serum VEGF oranı 1’in altındayken diğer malign ve benign hasta gruplarında 1’in üstünde olduğu bildirilmiştir (7).
Biz de daha geniş bir hasta grubunda çalışarak MM ile beraber MM dışı malign hasta grubu ve diğer bir grup olarak da benign hastaların da dahil edildiği daha geniş bir çalışmayla hem sıvı hem serum örneklerinde VEGF çalışarak sıvı/serum VEGF oranının ayırıcı tanıdaki yararını araştırmak istedik.
2. GENEL BİLGİLER
2.1. PLEVRA2.1.1. Plevranın anatomi ve histolojisi
Plevra, göğüs kafesi, mediyasten ve akciğer parenkimini örten seröz bir zardır. Pariyetal ve visseral yapraklar olarak ikiye ayrılır. İçte bulunan visseral yaprak akciğerlerin yüzeyi ile akciğeri oluşturan loblar arasındaki fissürleri örterken, dışta bulunan pariyetal yaprak tüm toraks boşluğunun iç yüzeyini örter. Yapraklar hilusta birleşirler. Yüzeyleri normalde birbirleri ile yapışmayacak şekilde temas halinde olan bu iki yaprak arasında solunum esnasında akciğerlerin göğüs boşluğu içindeki hareketlerini kolaylaştırmak için az miktarda sıvı bulunur. Sıvının bulundugu potansiyel aralığa plevral kavite denir.
Plevral boşluktaki sıvı yaklaşık olarak 0,1-0,2 mL/kg olup berrak ve renksiz görünümdedir, sıvıda 1,5 gr/dL’den daha az protein, çoğu monosit, az miktarda lenfosit, makrofaj, mezotel hücresi ve polimorfonükleer lökosit olmak üzere yaklaşık 1500 hücre/μL mevcut olup, eritrosit yoktur (8).
Hem visseral hem de pariyetal plevra tek sıra mezotel hücreleri, bazal membran, kolajen ve elastik doku tabakalarının yanı sıra mikrodamarlar ve lenfatiklerden olusur (15-17). Pariyetal ve visseral tabakayı döşeyen mezotel hücreleri tek sıralı yassı hücrelerdir. 6-12 μm çapındadırlar ve mikrovilluslar içerirler. Mikrovilluslar düzensiz dağılmıstır, visseral plevranın inferior ve pariyetal plevranın anterior ve inferior mediyastinal kısımlarında daha fazla bulunurlar. Mikrovillusların fonksiyonları tam olarak bilinmemekle birlikte plevra sıvısını emdiği ve visseral plevranın dayanma kapasitesini artırdığı, ayrıca hiyaluronik asitten zengin glikoprotein ağı oluşturma görevleri olduğu zannedilmektedir.
Mezotel hücreleri aktif hücrelerdir, stimuluslara cevap verirler. Biyokimyasal olarak tip I, II ve IV kollajen, elastin, fibronektin ve laminin üretirler. Fibroblast ve
epitel hücrelerinin intermediyer filamentlerini eksprese ederler, ayrıca büyüme faktörleri üretirler (9).
2.1.2. Plevranın fizyolojisi
Plevral boslukta fonksiyonel rezidüel kapasite (FRC) düzeyinde akciğerlerin elastik rekoil (geri çekim) gücüne karsı koyarak alveollerin sürekli açık kalmasını sağlayan negatif bir basınç vardır (10).
Plevral sıvı olusumunda, sıvının geçtigi membran yüzeyine uygulanan hidrostatik ve onkotik basınçlar, sıvının geçtiği membranın kalınlığı ve sıvının kaynağını olusturan vasküler sistemin plevral membrana uzaklıgı rol oynar (9).
Normal koşullarda plevral sistemik damarlardan plevra bosluğuna ortalama 0,6 mL/saat hızla filtre edilen düşük protein içerikli plevral sıvı aynı hızla plevral lenfatiklerden emilir. Sağlıklı bir bireyde plevral sıvının oluşumu ya da emilimi arasında gelişebilecek bozukluklar plevral alanda sıvı birikimine neden olur (11).
2.1.3. Plevral sıvı oluşumu
2.1.3.1. Plevral kapillerler ve sıvı oluşumundaki rolleri
Plevral kapillerler ile plevral bosluk arasındaki sıvı hareketinin, Starling’in transkapiller değişim yasasına bağlı oldugu düşünülmektedir.
Starling denklemi plevraya uygulanırsa asağıdaki denklem ortaya çıkar: Qf= Lp A [(Pcap – Ppl) – σd (πcap –πpl)]
Qf: Sıvı (su) hareketi
Lp: Membran filtrasyon katsayısı (hidrolik su iletkenlik katsayısı) A: Membran yüzey alanı
Ppl: Plevra hidrostatik basıncı
σd: Membranın solüt süzme katsayısı πcap: Kapiller onkotik basınç
πpl: Plevra onkotik basıncı
σd degeri sıfır ile bir arasında değişmektedir. Bu değer sıfır olduğunda protein partikülleri membran porlarından rahatlıkla geçebilecek kadar küçük olup, albumin gibi büyük moleküllerin geçişi o kadar fazla olmaktadır. Tersine σd=1 oldugunda protein geçişi olmamaktdır. 0<σd>1 ise protein geçişinde kısmi bir kısıtlanma var demektir (11,12).
Pariyetal plevrada hidrostatik basınç 30 cm H2O iken plevral basınç -5 cm H2O dur, böylece net hidrostatik basınç farkı: [30-(-5)]=35 cm H2O’dur ve bu basınç farkı kapillerlerden plevral boşluğa sıvının hareketini sağlar. Normalde az miktarda olan plevra sıvısı az miktarda protein içeriğine sahiptir ve 5 cm H2O’luk bir onkotik basıncı vardır. Plazma onkotik basıncı 34 cm H2O olup, net onkotik basınç farkı 34-5= 29 cm H2O olur. Sonuç olarak net fark 35-29=6 cm H2O olup, sıvı pariyetal plevra kapillerlerinden plevral boşluğa bu basınçla geçmektedir (9, 11, 12).
2.1.3.2. Akciğer interstisyumu ve plevral sıvı oluşumundaki rolü
Plevral boşluktaki sıvının çoğunun akciğer interstisyumundan kaynaklandığı gösterilmiştir (12). Hidrostatik basınç ve permeabilite artısına bağlı gelişen akciğer ödemi ile ilgili yapılan deneysel çalışmalarda, ekstravasküler akciğer sıvısı kritik bir seviyeye ulaştığında plevral sıvının geliştiği gözlenmiştir (13). İnterstisyel sıvı seviyesinin artışı, subplevral interstisyel basınçta artışa yol açar. Visseral plevra kalın olmasına rağmen bariyerin zayıf olması nedeniyle, subplevral interstisyel basınç artınca sıvı visseral plevrayı geçer ve plevra boşluğuna girer (12).
2.1.3.3. İntratorasik lenfatiklerin ve kan damarlarının sıvı oluşumundaki rolleri
Torasik kanal hasarında lenf sıvısı plevral boşlukta birikerek şilotoraksa neden olur. Travma veya hastalığa baglı toraks içi büyük damar hasarlarında da plevral boslukta kan birikerek hemotoraksa neden olur (12).
2.1.3.4. Periton boşluğunun sıvı oluşumundaki rolü
Periton boşluğunda serbest sıvı varlığında diyafragmatik porlar aracılığıyla sıvı akışı periton bosluğundan plevral boşluğa doğru olur, çünkü plevradaki basınç daha düşüktür (13).
2.1.4. Plevral sıvının emilimi
Pariyetal plevradaki stomatalar aracılıgı ile plevra boslugu pariyetal plevradaki lenfatik damarlarla irtibat halindedir. Proteinler, hücreler ve diğer maddeler pariyetal plevradaki lenfatiklerle plevral bosluktan temizlenir (12).
Plevra lenfatikleri, plevra sıvısı hacim artışına bağlı olarak akım hızlarını 20 kata kadar arttırabilmektedir (15). Kısmen lenfatik damarların düz kaslarının miyojenik ritmik kontraksiyonları ve kısmen de solunum hareketleri ile ilgili doku basıncı değisikliklerine bağlı olarak lenfatik aktivite pulsatil bir karakter gösterir (16). Sıvının plevra boşluğunun aşağı kısımlarında emilimi daha fazladır (11).
2.1.5. Plevral efüzyon patogenezi
Plevral sıvı oluşumu, emilim hızını geçtiğinde plevra sıvısı birikmeye baslar (12). Plevral sıvı hacim ve içeriği çok stabildir, ancak sıvı ve solut homeostazında büyük değişiklikler olduğunda bu durum ortaya çıkar (11). Plevral sıvı oluşumunun artmasına ya da emiliminin azalmasına yol açan durumlar Tablo 1 de gösterilmistir.
Tablo 1. Plevral efüzyonların nedenleri (15)
1.Plevral sıvı olusumunun artması II. Plevral sıvı emiliminin azalması
A. İnterstisyel sıvı oluşumunun
artması
1. Sol ventrikül yetersizliği 2. Pnömoni
3. Pulmoner emboli
A. A. Pariyetal plevradaki lenfatik drenajın obstruksiyonu
B. Plevrada intravasküler basınç
artması
1. Sağ veya sol ventrikül yetersizliği 2. Vena kava süperior sendromu (VCSS)
B. Sistemik vasküler basınç artışı
1.VCSS
2.Sağ kalp yetersizliği
C. Plevrada kapiller permeabilite
artması
1. Plevral inflamasyon
2. Vasküler endotelyal büyüme faktörü artısı (VEGF)
C. Plevradaki aquaporin sistem
hasarı
D. Plevral sıvı protein seviyesinin
artışı
E. Plevral basınç azalması
1. Atelektazi
2. Akciger elastik geri çekim gücü Artısı
F. Periton boşluğunda sıvı artışı
1. Asit veya periton diyalizi
G. Duktus torasikus hasarı
H. Toraks içindeki kan damarlarının
hasarı
Plevral sıvı artışının en sık görülen sebebi akciğer interstisyumunda sıvı artışıdır, konjestif kalp yetersizliği, akut solunum sıkıntısı sendromu (ARDS) ve parapnömonik efüzyonda bu mekanizma ile sıvı birikir (13). Kalp yetersizliklerinde, VCSS ve
perikardiyal efüzyonda olduğu gibi hidrostatik basınç farkı artarsa Starling denklemine göre sıvı oluşum hızı artar.
Plevral permeabilitedeki genel artış membran filtrasyon katsayısında artış olarak yansır. Vasküler endotelyal büyüme faktörü seviyesindeki artışın da kapiller permeabiliteyi artırabileceği ve plevral sıvı birikimine neden olabileceği düşünülmektedir (17, 18). Onkotik basınç farkındaki azalma, atelektazi gibi nedenlerle plevral basınçtaki azalma, porlar aracılığıyla peritondaki sıvının geçişi gibi durumlarda da plevral sıvı oluşabilir (12, 14).
Yine plevral sıvının absorpsiyonunun azaldığı durumlarda plevral efüzyon gelişir ki, bunun en sık sebebi pariyetal plevradaki lenfatiklerin obstruksiyonudur, normal koşullarda artan sıvı miktarı karşısında lenfatikler akım hızını 700 mL/gün’e kadar çıkarabilirler (11). Lenfatikler sistemik venöz sisteme drene olduklarından, santral venlerde oluşacak basınç artışlarında akım da azalacak böylece plevral efüzyon gelişecektir (19).
2.1.6. Plevral efüzyonda tanısal yaklaşım
2.1.6.1. Klinik özellikler
Plevral efüzyon akciğer hastalıkları ya da sistemik hastalıklara bağlı olarak ortaya çıkabilir. Plevral efüzyonu olan olgularda öykü, belirti ve bulgular plevral efüzyona neden olan patolojiye ve sıvının miktarına bağlıdır. Bir çok hastada efüzyonla ilgili bir semptom bulunmaz. Semptomlar plevranın inflamasyonu, akciğer mekaniğinin bozulması, gaz değişiminin etkilenmesi ya da nadiren kardiyak outputun azalmasına bağlıdır. Plöretik göğüs ağrısı pariyetal plevranın inflamasyonunu gösterir, ağrı genellikle iyi lokalizedir, inflame olan bölgeyle uyumludur (12). Plevral inflamasyon ve akciğer kompresyonu nedeniyle kuru öksürük, büyük hacimli efüzyonlarda akciger volümlerinin azalmasına bağlı olarak dispne ortaya çıkabilir, dispnenin ciddiyeti efüzyon miktarı ile korele değildir, diyafragma fonksiyonunun bozulmasına bağlıdır (20). Etyolojiye bağlı olarak başka semptomlar da bulunabilir.
Fizik muayenede sıvı miktarı ile ilişkili olarak patolojik bulgular saptanabilir. Sıvı miktarı 300 cc’den az ise bulgu saptanmaz. Palpasyonda efüzyon olan tarafın solunuma katılımının az olduğu saptanır, vibrasyon torasik azalır veya kaybolur. Perküsyonla sıvının oldugu yerde matite alınır, oskültasyonda solunum sesleri azalır veya hiç duyulmaz, Sıvının üst kısmında ise sıvının basısı nedeni ile atelektatik (relaksasyon atelektazisi) akciğerden, seslerin artmış iletimine bağlı olarak, bronşial solunum sesi duyulabilir (12, 21).
2.1.6.2. Radyolojik degerlendirme
Plevra sıvılarının radyolojik görünümü, hastanın pozisyonuna, sıvının serbest ya da loküle olmasına ve miktarına göre değişir. İlk başvurulan yöntem posteroanterior (PA) ve lateral gögüs radyografisidir. Özellikle az miktarda plevral sıvısı olan vakaların tanısında lateral dekübitus pozisyonunda alınan grafiler, PA ve lateral grafilerden daha duyarlıdır (22, 23).
Subpulmoner plevral boşluktaki sıvı belli bir miktara ulaşınca önce posterior, daha sonra lateral kostofrenik sinüsü kapatır (24). PA radyografilerde plevral boşlukta sıvı birikmesine baglı ilk bulgu kostofrenik sinüslerde küntleşmedir. Lateral kostofrenik sinüste küntleşmenin görülebilmesi için en az 175 mL sıvının birikmesi gerekir (23). Plevra sıvısı interlober fissürlere uzanabilir, fissür içinde loküle ya da serbest olmasına göre değişik radyolojik bulgular verir (24).
Plevra sıvısı az miktarda ise radyolojik tanısı zor olur. Bu durumda en duyarlı göğüs radyografisi lateral dekübitus’dur. 5-10 mL gibi çok az miktardaki sıvıları bile gösterebilir (25).
Ultrasonografi (USG)
X ısını içermeyen, noninvaziv, kolaylıkla uygulanabilen bir yöntemdir, tek dezavantajı tanıdaki duyarlılığın yapan kisinin deneyimine bağlı olmasıdır. Temel olarak plevral boşlukta serbest veya loküle sıvı varlığının gösterilmesinde, sıvı ile
kalınlaşmanın ayırt edilmesinde, tanı amaçlı torasentezlerin ve plevral biyopsilerin yapılabileceği en uygun yerin saptanmasında kullanılır (26).
Bilgisayarlı tomografi (BT)
Bilgisayarlı tomografi günümüzde kullanılan, plevral boşluğu değerlendiren en iyi yöntemdir (1). Konvansiyonel göğüs radyografisi ve ultrasonografiye göre plevral sıvıyı plevral kalınlaşmadan ayırmada ve plevral duvarı tutan fokal kitleleri saptamada üstündür. Ampiyem ile periferik akciğer apsesi ayırımında ve peritoneal sıvı koleksiyonunu, plevral efüzyondan ayırmada da yararlıdır (9).
Malign-benign plevra sıvılarının ayırımında da BT’nin katkısı mevcuttur, pariyetal plevranın 1 cm’den kalın olması, akciğer parankiminde kitle, nodüller, mediyastende lenf nodları gibi bulguların saptanması, göğüs duvarı veya mediyastende invazyon görülmesi, sıvının öncelikle malign karakterli oldugunu düşündürür (27).
Manyetik rezonans görüntüleme (MR)
Güvenli ve hassas bir görüntüleme yöntemi olmasına rağmen, plevral efüzyonu göstermede BT ve USG’ye üstün değildir. MR incelemesi, plevra tümörlerinde, özellikle malign mezotelyomada göğüs duvarı diyafragma gibi komşu dokulara tümörün lokal yayılımının değerlendirilmesinde de tercih edilir. Plevranın fibröz tümörlerinde de spesifik tanı koyulabilir (28).
2.1.6.3. Torasentez
Radyolojik olarak plevral sıvının saptanması anormal bir bulgudur. Bilateral ve büyük olasılıkla transüdayı düşündüren olgular dışında, ultrasonografi ve lateral dekübitus grafide 10 mm’den fazla kalınlıkta sıvı saptanan her olguda tanısal amaçlı torasentez yapılmalıdır (12, 29). Alınan plevral sıvının makroskopik, mikroskobik ve biyokimyasal olarak degerlendirilmesi gerekir. Tam bir analiz için 50-100 mL sıvı
yeterli olur (30). Torasentezin mutlak kontrendikasyonu yoktur (8). Rölatif kontrendikasyonlar Tablo 2’de görülmektedir.
Tablo 2. Torasentezin rölatif kontrendikasyonları (31)
1. Kanama diatezi (Protrombin zamanı (PT) ve parsiyel tromboplastin zamanı (PTT) normalin iki katını asmamıssa, trombosit sayısı da 25000/mm3’den yüksekse acil ve zorunlu hallerde torasentez yapılabilir.)
2. Sistemik antikoagülan tedavi 3. Üremi
4. Hasta ile kooperasyon kurulamaması
5. Torasentez yapılacak cilt alanında infeksiyon olması
Torasentez düşük riskli bir yöntemdir. Komplikasyonları, pnömotoraks, hemotoraks, re-ekspansiyon pulmoner ödem, hava embolisi, plevrada infeksiyon, iğnenin giriş yolu üzerinde tümör implantasyonu olarak sıralanabilir. Prospektif bir seride komplikasyon oranı %11 olarak bildirilmiştir (32).
Komplikasyonlar için risk faktörleri arasında, işlemi yapan hekimin deneyimsizliği, küçük ya da loküle efüzyonlar, kalın göğüs duvarı, hastanın işbirliği yapmaması sayılabilir (33).
2.1.6.4. Plevral sıvının değerlendirilmesi
Makroskopik degerlendirme
Plevral sıvının tanısal değerlendirilmesinde sıvının görünümünün tanımlanması gereklidir (34). Plevral sıvıların rengi, kokusu, karakteri tanıya yardımcı olabilir. Transüdaların tamamına yakını ve eksüdaların önemli bir kısmı berrak, saman sarısı renginde, visköz olmayan kokusuz sıvılardır. Bulanık sıvılarda genellikle hücre ya da
lipit içeriği artmıştır. Santrifüj edilen sıvı halen bulanıksa lipit içeriği artmış demektir (8, 35). Sıvının rengi çikolata gibi ise plevraya açılmıs karaciğer amebiyazisi düşünülür. Hemorajik sıvılarda renk kırmızıdır, beklemiş ise kahverengi olabilir. Plevra sıvısının hematokriti kan hemotokritinin %50’sinden fazla ise hemotoraks olarak değerlendirilir. Hemorajik sıvıya neden olan durumlar sıklıkla, travma, malignite ve pulmoner embolidir (8). Sıvıdaki hemotokrit degeri %1’den az ise anlamlı değildir (36). Sarı-yesil renkli sıvılar romatoid plöreziyi düsündürürken, siyah renkli sıvılar aspergilloza bağlı olabilir. Berrak ya da kanlı visköz sıvılar mezotelyomayı düşündürür, artmış viskozite hyalüronik asite bağlıdır (12). Ampiyemlerde de sıvının viskozitesi artar, püy görünümü olabilir. Anaerob mikroorganizmalara bağlı kötü koku saptanabilir, idrar kokusu varsa akla ürinotoraks gelmelidir. Plevral sıvıda yemek partiküllerinin saptanması özofagus rüptürünü düşündürür (8,12).
Plevral sıvı mikroskopisi
Normalde plevral sıvı hücre miktarı 1000/mm³’ün altındadır ve mezotel hücre hâkimiyeti vardır. Mezotel hücrelerinden sonra ise sıklıkla monositler ve lenfositler bulunur, polimorf nüveli lökosit miktarı ise genellikle düşüktür (30).
Plevra sıvısı eritrosit miktarı 5000-10000/mm³ olduğunda kırmızı renk alırken 100000/mm³’den fazla eritrosit olduğunda sıvı belirgin hemorajik olur. Klasik olarak lökosit miktarı manuel olarak ölçülmesine karsın, son zamanlarda otomatik sayım cihazlarıyla da dogru sonuçlar alınabildiği gösterilmiştir (37). Transüda niteliğindeki sıvılarda 1000/mm3’ün altında iken, parapnömonik efüzyonlarda 10000 mm3’ün üzerindedir (38).
Transüdalarda baskın hücreler mezotel hücreleridir, eksüda karakterinde bir sıvıda %5’den fazla bulunması tüberkülozu ekarte ettirir (39). Akut pankreatit, pulmoner emboli, subfrenik abse ve parapnömonik efüzyonlarda ve transüdaların %10 kadarında polimorf nüveli lökosit hakimiyeti vardır (12).
Tüberküloz ve malign efüzyonlarda lökosit sayısı 500-2500/mm³ arasındadır ve lenfosit oranı %90’ın üzerindedir. Koroner arter by-pass cerrahisi sonrasında gelişen
durumlarda etyoloji saptanamayabilir. En sık rastlanan eozinofili nedeni plevral boşlukta kan ve hava bulunmasıdır (32). Benign asbestoz ve iyileşen plevral infeksiyonlarda da eozinofili görülebilir (12).
Plevral sıvıda bazofili (>%10) nadir rastlanan bir durumdur (8), karşılaşıldığında lösemilere bağlı tutulum akla gelmelidir (41). Plevral sıvının hücresel özellikleri Tablo 3’de görülmektedir.
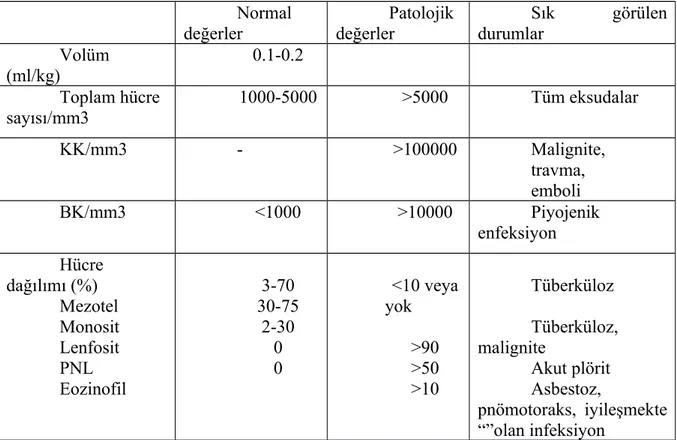
Tablo 3. Plevral sıvının hücresel özellikleri (30,37,42)
(İnsan ve hayvanlarda yapılan çalışmalardan derlenmistir) Normal değerler Patolojik değerler Sık görülen durumlar Volüm (ml/kg) 0.1-0.2 Toplam hücre sayısı/mm3 1000-5000 >5000 Tüm eksudalar KK/mm3 - >100000 Malignite, travma, emboli BK/mm3 <1000 >10000 Piyojenik enfeksiyon Hücre dağılımı (%) Mezotel Monosit Lenfosit PNL Eozinofil 3-70 30-75 2-30 0 0 <10 veya yok >90 >50 >10 Tüberküloz Tüberküloz, malignite Akut plörit Asbestoz, pnömotoraks, iyileşmekte “”olan infeksiyon Biyokimyasal degerlendirme
Plevral efüzyonu olan bir hastada torasentez ile alınan sıvının değerlendirilmesinde ilk adım, transüda-eksüda ayırımının yapılmasıdır. Plevral
sıvılarda transüda-eksüda ayırımının yapılması önemlidir ve bunun için birçok test ve kriter ileri sürülmüş olmakla birlikte bu gün için altın standart Light kriterleridir (43). Aşağıdaki kriterlerden birinin bulunması sıvının eksüda karakterinde olduğunu gösterir, transüdalarda bu kriterlerden hiçbirisi bulunmaz. Light kriterleri Tablo 4’de görülmektedir.
Tablo 4. Light Kriterleri (37)
• Plevral sıvı/serum protein > 0.5 • Plevral sıvı/serum LDH > 0.6
• Plevral sıvı LDH > 2/3 serum normalinin üst sınırı
Klinik olarak transüda düşünülen ancak Light kriterlerine göre eksüda saptanan olgularda, serum-plevral sıvı protein veya albumin farkına bakılması önerilmektedir. Eğer serum-sıvı protein farkı 3.1 g/dL’den, albumin farkı ise 1,2 g/dL’den büyükse, bu sıvı büyük olasılıkla transüdadır, protein farkı ek tetkik gerektirmediğinden daha pratiktir (44). Transüda vasfında plevral efüzyona sebep olan durumlar Tablo 5’te, eksüda vasfında plevral efüzyona sebep olan durumlar Tablo 6’da görülmektedir.
Plevral sıvının mikrobiyolojik değerlendirilmesi
Eksüda karakterindeki plevral sıvılarda ayırıcı tanı açısından mikrobiyolojik incelemeler yapılmalıdır. Plevra sıvısı normalde steril oldugundan santrifüj edilen sıvıda gram boyama, asid-fast ve fungal boyalarla bakteri, mantar saptanması veya aerobik, anarerobik, tüberküloz veya fungal kültürlerde mikroorganizmaların üretilmesi plevral infeksiyonun göstergesidir. Ülkemizde yapılan bir çalışmada tüberküloz plörezide, sıvıda aside rezistan bakteri % 2-10 pozitifken, kültür pozitifliği %12,5 bulunmuştur (45).
İmmunolojik testler
Plevral sıvıda romatoid faktör (RF) titresinin, 1:320 ve serum titresine eşit ya da daha büyük olması büyük olasılıkla romatoid artrite bağlı sıvıyı gösterir (12). Plevral sıvı antinükleer antikor (ANA) titresinin, 1:160’dan ya da plevra sıvı/serum ANA oranının 1’den büyük olması lupusa bağlı plevral efüzyonu düsündürürken, plevra sıvısında LE hücresinin bulunması lupus için tanı koydurucudur (46).
Tablo 5. Transüdatif efüzyon nedenleri (2)
Konjestif kalp yetmezliği Hipoalbüminemi
Siroz Atelektazi
Nefrotik sendrom Sarkoidoz
Glomerülonefrit Pulmoner emboli
Böbrek yetmezliği Vena kava süperior
sendromu
Periton diyalizi Meigs sendromu
Ürinotoraks Konstriktif perikardit
Miksödem Plevraya serebrospinal sıvı
sızması
Plevral sıvının sitolojik değerlendirilmesi
Malign efüzyonlu hastalarda oldukça hızlı, etkin, ucuz ve noninvaziv bir yöntemdir. Sitoloji ile malign plörezi tanısının farklı serilerde %40-87 arasında koyulabildiği bildirilmiştir (12). Sitoloji ile adenokarsinom tanısı koyulması kolay iken squamoz kanserde, Hodgkin hastalığında ve sarkomlarda bu yolla tanı daha zordur. İncelemenin üç kez tekrar edilmesi tanı olasılığını artırır (8, 12, 36, 47).
Neoplastik hastalıklar
Metastatik hastalıklar (akciger, meme vb) Mezotelyoma Lenfoma İnfeksiyöz hastalıklar Bakteriyel infeksiyonlar Tüberküloz Fungal infeksiyonlar (aspergillozis, blastomikozis, koksidioidomikozis, kriptokokkozis, histoplazmozis) Paraziter infeksiyonlar
(kist hidatik, amebiyazis, askariyazis, paragonimiyazis)
Viral infeksiyonlar
Diger (aktinomikozis, nokardiyozis)
Pulmoner emboli
Kardiyovasküler hastalıklar
Koroner arter by-pass cerrahisi Postkardiyak injuri sendromu Perikardiyal hastalık
Gastrointestinal hastalıklar
Pankreas hastalıkları
(pankreatit, pankreas psödokisti) Subfrenik apse İntrahepatik apse İntrasplenik apse Özofagus perforasyonu Abdominal cerrahi Diyafram hernisi
Endoskopik varis sklerozu Karaciger transplantasyonu
Kolajen vasküler hastalıklar
Romatoid plörezi
Sistemik lupus eritematozus İlaca baglı lupus
İmmünoblastik lenfadenopati Sjögren sendromu
Ailevi Akdeniz atesi Churg-Strauss sendromu Wegener granülomatozu
Kadın hastalıkları ve dogum
Overin hiperstimülasyon sendromu Fetal plevral efüzyon
Postpartum plevral efüzyon Meigs sendromu
Endometriozis
Lenfatik sistem hastalıkları
Silotoraks
Sarı tırnak sendromu Lenfanjiyomiyomatozis
İlaçlara baglı plevra hastalıkları Nitrofurantoin Dantrolen Metiserjit Ergot alkaloidleri Amiodaron İnterlökin-2 Prokarbazin Metotreksat Klozapin Mitomisin Bleomisin Bromokriptin Diger hastalıklar
Asbeste maruz kalma Akciger transplantasyonu Kemik iligi transplantasyonu Sarkoidoz
Üremi
Tuzak akciger
Radyasyona maruz kalma Suda bogulma Amiloidoz Torakotomi Elektrik yanıkları Ekstramedüller hematopoez Mediastinal kist rüptürü ARDS Whipple hastalıgı Sifiliz
İyatrojenik plevral efüzyonlar
Hemotoraks
İdiyopatik plevral efüzyonlar
2.1.6.5. Torasentezle tanı konulamayan olgularda tanı yaklaşımı
patolojiler ve pulmoner infiltratların bu sekilde daha iyi degerlendirilmesi mümkün olacaktır. Eger buradan da bir sonuca gidilememişse yapılacak olan şey, ya hastayı izlemek, ya da kapalı plevra biyopsisi, torakoskopi gibi invaziv işlemlere yönlendirmektir. Plevral efüzyonlarda %15 olguda etyoloji bulunamadığı unutulmamalıdır.
Transuda exuda ayırımında kullanılan diğer parametreler de yine aşağıdaki tablo7’de özetlenmiştir.
Tablo 7. Transüda-eksüda ayırımında kullanılan diger parametreler (2) Parametre Dansite Protein PS / S protein Albumin farkı LDH PS / S LDH Kolesterol PS / S Kolesterol HDL / LDL PS / S blirubin Alkalen fosfataz Transüda < 1016 <3 gr/dL <0,5 >1,2 <200 _U < 0,6 <60 mg/dL <0,3 > 0,6 <0,6 <75 _U/dL Eksüda >1016 >3 gr/dL >0,5 <1,2 >200 _U >0,6 >60 mg/dL >0,3 <0,6 >0,6 >75 _U/dL PS: Plevra sıvısı PS/S: Plevra sıvısı / Serum
Albumin Farkı: Serum ve plevra sıvısı albumin farkı
Kapalı plevra biyopsisi
Son dört dekaddan beri özellikle tüberküloz plörezi tanısında en çok kullanılan yöntemdir. Plevral biyopsi malign efüzyon tanısında sıvı sitolojisi kadar duyarlı
değildir. Sitoloji negatif olguların çok azında biyopsi ile tanı koyulabilir (12). Kapalı plevra biyopsisi sitoloji negatif olan ve malignite düsünülen olgularda torakoskopinin yapılamadığı durumlarda yapılmalıdır. Yine de tek başına kapalı plevra biyopsisinin %20 olguda tanı koydurucu olduğu da unutulmamalıdır (48).
Bronkoskopi
Düzelme izlenmeyen ve tanı konulamayan olgularda, masif plevral efüzyon, akciger grafisi veya tomografide infiltrasyon, hemoptizi veya mediyastenin sıvının oldugu tarafa çekilmesi durumlarından birisi varsa faydalı olabilir (49).
Torakoskopi
Daha noninvaziv yöntemlerle tanı koyulamayan olgularda yapılmalıdır. Plevrayı tutan malignite, spesifik infeksiyon gibi durumlarda tanı için en duyarlı yöntemdir. Bir diger avantajı da malign efüzyonda aynı seansda plörodezis uygulanabilmesidir. Malign hastalarda torakoskopi ile tanı koyulması %90’dan daha fazla oranda olasıdır. Bunun yanında özellikle mezotelyoma tanısında en iyi yöntemdir (12).
Torakotomi (Açık plevra biyopsisi)
Esas endikasyonu diğer yöntemlerle tanı konulamamış progresif plevral efüzyonlardır. Bu olgularda en sık neden mezotelyomadır. Açık plevra biyopsisi ile de tanı konulamayabilir. Tüm girişimlere rağmen plevral efüzyonu olan olguların %10-15’ine tanı konulamamaktadır (2).
2.2. MEZOTELYOMA
Malign mezotelyoma (MM) en sık plevra olmak üzere peritoneal, perikardial, tunica vajinalis testisin serozal yüzeylerindeki mezotelyal hücrelerden köken alan agresif seyirli bir tümördür (3).
2.2.2.Tarihçe
Mezotelyoma terimi 1924 yılında, plevranın primer tümörü olarak 33 yaşında bir tekstil işçisinde tanımlanmıştır (50). 1960 yılında Wagner ve arkadaşlarının, Güney Afrika da asbest madeni işçileri üzerinde yaptıkları çalışma sonucu, asbestin mezotelyoma etyolojisinde yer aldığı saptanmıştır. Mesleksel asbest maruziyetine bağlı olarak erkeklerde daha sık görülmektedir (51, 52, 53).
Asbest, doğal bir fibroz silikat olduğu için yeryüzünün birçok yerinde toprak örtüsünde bulunur. Böylece, “aktoprak” veya ülkemizin bazı yerlerinde “çorak” olarak adlandırılan bu toprak, ısı ve su yalıtımı amacıyla evlerin çatısında örtü, duvarlarında sıva-badana amacıyla sık olarak kullanılmıştır (54,55). Kapadokya bolgesinde üç köyde (Tuzköy, Karain, Sarıhıdır), asbest dışında erionit isimli bir mineralin de malign mezotelyoma epidemisine yol açtığı saptanmıştır. Asbest kimyasal içeriği ve mineralojik özellikleri nedeniyle amfibol ve serpentin olmak üzere iki gruba ayrılmaktadır. Amfibol ailesi amozit (kahverengi asbest), krokidolit (mavi asbest), tremolit, antofilit ve aktinolitten oluşmaktadır. Kırsal alanda, aktoprağın kontamine olduğu asbest lifleri esas olarak tremolite veya aktinolit’ dir (54,55).
2.2.3.Epidemiyoloji
Asbest minerali binlerce yıldır insanlar tarafından bilinmekte ve kullanılmaktadır (56). Malign Plevral Mezotelyoma (MPM) tanılı hastaların yaklaşık % 60-90 (ortalama % 80)’ ında asbest temasına ait öykü mevcuttur (4, 57). MPM normal populasyon için oldukça nadir bir tümör olup görülme sıklığı, bir yıl için milyonda 1 ile 2,2 arasında bildirilmektedir (58,59). Amerika Birleşik Devletleri (ABD)' nde yılda 2200, Avrupa' da yılda 9000 civarında olgu saptanmaktadır (60,61). Avusturalya,
Fransa ve İngiltere’ de ise malign mezotelyoma insidansının daha yüksek olduğu ve bu oranın artmaya devam ettiği bilinmektedir (62). Asbest doğada yaygın olarak bulunan bir mineraldir. Bazı bölgelerde toprak üstünde diğer minerallerle beraber bulunur.
Dünyada kullanılmakta olan asbestin % 90’ ı krizotildir (63). Her yıl yaklaşık 125 milyon insan asbeste maruz kaldıkları bir ortamda çalışmakta ve bunların en az 90.000’ i akciğer kanseri, mezotelyoma ve asbestozis nedeni ile ölmektedir (64). Kırsal alanda aktoprağın kontamine olduğu asbest lifleri tremolit veya aktinolittir (65). Türkiye’ de asbeste en yoğun temas bölgeleri Eskişehir, Kütahya, Bilecik, Yozgat, Sivas ve Diyarbakır' ın bazı köyleridir (66,67). Türkiye’ de insidans ile ilgili yeterli veri olmadığından kesin bir bilgi vermek mümkün değildir. Ancak yapılan çalışmalarda, insidansın milyonda 43 ile 50 arasında olduğu, Kapadokya’daki erionit köylerinde ise milyonda 996’ya çıktığı belirtilmektedir (68).
2.2.4.Etyoloji
Malign mezotelyoma tanısı alan hastaların yaklaşık % 70- 80’ inde asbest temas öyküsü mevcuttur (69). MPM latent periyodu mesleksel temasta ortalama 30- 40 yıl olup çevresel temaslarda bu süre değişkenlik gösterir. Asbest ve eriyonit MPM etyolojisinde bilinen, her ikisi de mineral lif olan iki önemli nedendir. Asbest özgül bir molekül olmayıp lifsi yapıda doğal fibröz bir silikattır. Amfibol ve serpentine olmak üzere iki gruba ayrılır (70). İlk gruptaki asbest tipleri olan tremolit, actinolit, amosit, krokidolit ve antofillit lifleri, serpentine grubunda yer alan krizotil tip asbest liflerine göre daha sert, daha uzun ve biyolojik yıkıma daha dayanıklıdır (71). Amfibol tip liflerin biyolojik ortamdan atılım yarı ömrü 7 yıldır (72). Hem fiziksel yapı özelliği hem de atılım süresi nedeniyle amfibol tip asbest liflerinin daha riskli olduğu öne sürülmektedir. Krizotil ile mezotelyoma arasındaki ilişki net değildir. Asbest lifleri için karsinojeniteyi belirleyen, kimyasal yapıdan çok fiziksel yapı olarak düşünülmektedir. Boy: en oranı 3/1’ den fazla olan liflerin karsinojenik olduğu gösterilmiştir. Ve bu oran arttıkça karsinojenite artmaktadır. Yani ince-uzun lifler daha güçlü karsinojenik etki gösterir (71). Eriyonit lifleri fibröz bir yapı özelliğine sahip olup asbest liflerine göre çok daha güçlü karsinojendir. Bazı MPM olgu serilerinde, mineral lif teması olmayan olgu oranının % 30' a ulaşması, ayrıca çocukluk çağında da mezotelyoma saptanması,
virüs- 40 (SV-40)’ ın karsinojenik etkisinin ve bazı kanserlerle olan ilişkisinin saptanmasını takiben yapılan kapsamlı çalışmalarda, bazı insan mezotelyoma hücrelerinde SV-40 benzeri genetik diziler gösterilmiştir. Radyoterapi uygulanmış olgularda radyoterapi sahasında ya da komşu alanlarda 7 ile 36 yıl sonra MPM gelişimi bildirilmiştir (52). MPM‟ nin bazı ailelerde ve tek yumurta ikizlerinde daha sık saptanması mezotelyoma gelişiminde genetik yatkınlığın rolü olabileceğini düşündürmektedir (74). Son yıllarda bircok araştırmaya konu olan ve adı sıkca duyulan karbon nanotübler (KNT) ise yeni bir tür teknolojik kristalin karbon olup yapılan calışmalarda KNT’ lerin normal insan mezotel hücre dizileri, MM hücre dizileri ve TSV40-transforme edilmiş mezotel hücrelerine sitotoksik olduğu rapor edilmiştir. .
2.2.5. Patogenez
Asbest liflerinin paryetal plevraya iki yolla ulaşabileceği düşünülmektedir. Birincisi asbest lifleri inhale edildikten sonra aerodinamik yapılarının yardımıyla bronşiyal alanda ilerleyerek kolaylıkla akciğer periferine ulaşabilirler. Daha sonra distal endotelyumdan intersitisyel alana girerek visseral plevraya ve komşuluk yolu ile paryetal plevraya erişirler. İkinci yol ise lenfatik dolaşıma katılan liflerin retrograd yol ile paryetal plevraya ulaşmasıdır (75). Lifler bulundukları yerlerde makrofajlar tarafından fagosite edilmeye çalışılırlar, ancak fiziksel yapıları nedeniyle fagositoz tam mümkün olmaz. Asbest nedeniyle ortama enzimler, sitokinler ve superoksid radikalleri çıkar, böylece asbest lifleri hem mutajenik hem de fibrojenik aktiviteyi başlatabilirler (76,77).
Mezotel hücreleri asbest ile etkilenmeye, diğer sistem hücrelerine göre daha fazla duyarlıdır (75,78). Plevrada asbest liflerinin yüzeyinde üretilen serbest radikallerin mutajenik özelikleri, liflerden zarar görmüş hücrelerden salınan oksijen radikalleri ve hedef hücrelerde liflerin direkt fiziksel etkileriyle Deoksiribonükleik asit (DNA) kırıkları, genetik değişiklikler ve hücre proliferasyonunu uyararak mezotelyal hücrelerde karsinojenik etkiler oluşturduğu kabul edilmektedir (79). Bu fiberler sonunda plevral plak, fibrosiz veya MM’ ya neden olurlar. Malign mezotelyomada plevral sıvının oluşum patolojisi ise tümörün lokal ve sistemik etkileri, tedavi komplikasyonları, plevranın doğrudan malign hücrelerle invazyonuna bağlıdır (80). Plevral plak (PP), plevral fibrozis ve malign plevral mezotelyoma (MPM) gibi plevra
hastalıklarında akciğerdeki lif sayısı asbestozise göre daha düşüktür (81). MPM’ de tümör, paryetal plevradan kaynaklanan küçük mikroskobik nodüller şeklinde, genellikle tek taraflı ve hemitoraksın alt yarısından başlar. Tümör hücrelerinden yoğun bir şekilde malign hücreler yer çekimi etkisiyle özellikle diafragmatik plevral yüzey olmak uzere alt plevral yüzeylere dökülüp ekim (implantasyon metastazı) yoluyla yeni tümöral alanlar oluşturur. MPM lenfojen ve hematojen yayılım da yapabilir ancak genel olarak yayılım şekli lokaldir. Böylece hastaların çoğunda görülen akciğerler ve komşu yapıları çepeçevre zırh gibi saran geniş yüzeyli bir tümöral kitle ortaya çıkar. Çoğunlukla lokal olarak yayılan tümörün komşu organ ve yapıları etkilemesi ölüme neden olur (82,83). Tanı döneminde ve erken evrede lenfojen-hematojen metastazlar nadirdir, ancak hastalığın terminal döneminde hastaların en az yarısında metastaz gelisir.
MPM 1999 World Health Organization / International Association for the Study of Lung Cancer (WHO/IASLC) sınıflandırması ile epiteloid (epitelyal), sarkomatoid (sarkomatöz) ve bifazik (miks) mezotelyoma olarak üçe ayrılmıştır (84). Serilerde hastaların büyük çoğunluğunu (yaklaşık % 50) epitelyal tip oluştururken, ikinci sırayı bifazik tip alır. Bifazik tip sıklık olarak ikinci sıradadır yaklasık % 30 civarında bir oranla görülür. Sarkomatöz tipin görülme oranı ise % 10- 20 arasındadır (59,82,85,86).
2.2.6 Klinik Belirti ve Bulgular
Malign mezotelyoma, doğumundan itibaren asbest veya erionit içeren ortamlarda yaşayanlarda 20-30’ lu yaşlarda klinik belirti ve bulgu vermeye başlar. Semptomların süresi 2 haftadan 2 yıla kadar uzayabilmekle birlikte olguların %25‟ inde semptom süresi 6 aydır. Ortalama tanı süresi ise 2-3 aydır. Genellikle ilk olarak dispne ve göğüs ağrısı şikâyetleri ile doktora başvururlar. Olguların yaklaşık % 60’ ı non plöretik göğüs ağrısından yakınırken dispne olguların % 50-70’ inde mevcuttur (87). Bu şikâyetlere ek olarak ateş, terleme, halsizlik, kilo kaybı gibi sistemik semptomlar görülebilir. MPM‟ da metastaz nadir olmakla birlikte hastalık ilerledikçe metastaz oranı artar. En sık metastaz hiler, mediastinal, supraklaviküler lenf ve internal mammariyan lenf nodlarına olur. İleri olgularda kemik, karaciğer ve akciğer içinde multinodüler,
milier yayımlar da görülebilir. Aşağıda asbest ile ilişkili bazı hastalıklar tablo şeklinde belirtilmiştir (Tablo 8).
Tablo 8. Asbest ile ilişkili bazı hastalıklar (4,55,56,57).
1-)Asbestozis (interstisyel akciğer fibrozisi)
2-)Plevral reaksiyonlar a-)Plevral plaklar b-)Plevral kalınlaĢma c-)Benign asbest plörezisi
3-)Parankimal akciğer hastalıkları a-)Rounded atelektazi b-)Transpulmoner bandlar
c-)Diğer benign pulmoner nodüller
4-)İmmunolojik değişiklikler
5-)Neoplastik hastalıklar
a-)Malign mezotelyoma
b-)Ekstrapulmoner karsinomlar -GİS karsinomları
-Diğer organ karsinomları c-)Akciğer karsinomu
2.2.7.Fizik muayene bulguları
Tümörün kendine has davranış biçimine bağlı olarak “ hareketleri kısıtlanmış bir hemitoraks” ve o tarafta “plevral sıvı / plevral kalınlaşma muayene bulguları (vibrasyon torasik kaybı, matite, seslerin alınamaması)” hemen her hastada saptanan temel bir özellik olup sık görülen fizik muayene bulgularıdır. Tümörün yerleşimi hastaların % 95 -97’ sinde tek taraflı olup %65 sağ taraftadır. Öte yandan, tümörün plevral yüzeyler boyunca çepeçevre yayılımı olguların yaklaşık %40-50’ sinde tutulan hemitoraksta kostaların birbirine yaklaşması ve omuzun çökmesi ile “tek taraflı çökük hemitoraks” saptanır. Toraks içinde tümörün kendine has davranı biçimi nedeniyle, nadir de olsa cilt
altında nodüler patolojilerin palpasyonu, vena kava superior sendromu, kord bası bulguları, Horner Sendromu tanımlanmıştır (59, 86, 88, 89).
2.2.8.Görüntüleme
2.2.8.1.Akciğer Grafisi
MPM’ li hastalarda, genellikle plevral sıvının alttaki yapıları örtmesi nedeniyle, iki boyutlu görüntü veren standart akciğer grafilerinde yalnızca “plevral sıvı” veya “plevral kalınlaşma” bulgusu saptanır. Ancak sıvının az olduğu veya olmadığı olgularda “nodüler veya düzensiz bir plevral kalınlaşma” bulgusu açıkça gözlenebilir. Mediastinal plevranın tutulduğu olgularda mediastinal yüzde düzensizlik izlenmektedir (59).
2.2.8.2.Toraks Bilgisayarlı Tomografisi
Bilgisayarlı Tomografi (BT), MPM şüphesi olan her olguda artık rutin kullanılan radyolojik bir yöntemdir. Olguların %92' sinde plevral kalınlaşma, %74' ünde effüzyon, % 20-50' sinde plevral kalsifikasyonlar bulunur. Ayrıca asbest maruziyetini gösteren kontrlateral plevral plaklar, fibrotik kalınlaşmalar ve kalsifikasyonlara da rastlanır. Toraks BT bulgularındaki bazı özellikler tanıyı destekler. Bunlar sırasıyla: 1. Plevradaki tutulumun çepeçevre olması (tüm plevral yüzeylerin tutulumu), 2. Mediastinal plevral tutulum, 3. Plevradaki kalınlaşmanın 1 cm’ den daha fazla olması diğer nedenlerle ortaya çıkan plevral kalınlaşmalardan ayırımında yararlıdır (90, 91).
2.2.8.3.Manyetik rezonans görüntüleme (MR)
MPM hastalarında rutin taramada kullanılmaz. Ancak Toraks BT’ nin yetersiz kaldığı göğüs duvarı, diyafram ve lenf nodu tutulumlarını belirlemede kullanılması önerilmektedir (92).
2-Floro-2-deoksi-d-glukoz (FDG) ile yapılan pozitron emisyon tomografisi (PET), malign lezyonları benign lezyonlardan ayırmada yardımcıdır. İşaretlenmiş glukozun tüketildiği yerlerde bu aktivitenin görüntülenmesine dayanır. PET’ deki standart uptake değer (SUV: standardized uptake value) sağkalım ile ters orantılı bulunmuştur (93). Anatomik ve metabolik görüntünün birleştirilmesiyle oluşan PET-BT’ nin dezavantajı ise yüksek maliyet ve yanlış pozitif sonuç vermesidir (94).
2.2.9. Serum ve Plevral Sıvı Laboratuar Bulguları
MPM için özgün kabul edilebilecek bir laboratuvar tetkiki henüz yoktur. Hastaların çoğunda sedimantasyon hızı yüksek bulunurken, bazı hastalarda kronik hastalık veya demir eksikliği anemisi, nadiren de coombs pozitif hemolitik anemi saptanabilir. Birkaç seride, hastaların bir kısmında trombosit sayısında artış gözlemlenmiştir ancak hiçbiri MPM ye özgün değildir. Bu bulgular diğer malign hastalıklarda da saptanabilen bulgulardır (59,86, 95, 96). MPM olgularının büyük çoğunluğunda plevral sıvı izlenmekle birlikte, plevral sıvı örneklerinde MPM için özgün ve/veya duyarlılığı yüksek parametreler tanımlanamamıştır. Plevral sıvı görünümü yaklaşık % 50 olguda hemorajiktir ve eksüda vasfında olup lenfosit oranı yüksektir. Yer yer kümeler halinde toplanmış, mitoz ve atipi kriterleri gösteren mezotelyal hücrelerin (cell ball) görülmesi malign tümöral gelişim lehine değerli bir bulgudur. MM nın metastatik malign plevral hastalıktan, benign plevral hastalıktan ve benign asbest plöreziden ayırımında etkili olabilecek serum tümör belirteçleri belirlenmesine yönelik oldukça kapsamlı çalışmalar yapılmıştır. Bu çalışmalarda hyalüronik asit (HA), osteopontin (OPN), mesothelin-diğer tanımlamayla serum soluble mesothelin related peptide (SMRP), vasküler endotelyal growth faktör(VEGF) ve megakaryocyte potentiating factor (MPF) söz konusu amaçlara yönelik umut verici belirteçler olarak rapor edilmiştir (97,98).
2008 yılında D.Ü.T.F de Dr. Taylan BOYRAZ’ın yaptığı 25 malign ve 25 benign hastanın alındığı bir çalışmada bu hastalardan alınan plevral sıvıda ve serum da VEGF düzeyleri ölçülmüş olup mezotelyoma hariç diğer bütün gruplarda sıvı/serum VEGF düzeyi>1 iken MM da sıvı/serum VEGF düzeyi <1 ölçülmüş (7). Biz de bu
çalışmada bu verilere dayanarak MM, diğer malign hastalıklar ve non-malign hastalıklarda gelişen sıvılarda ve bu hastalardan alınan serum örneklerinde VEGF çalışıp sıvı/serum VEGF oranının mezotelyoma ayırıcı tanısındaki yerini araştırmayı amaçladık.
2.2.10. Tanı
MPM’lı hastaların ilk değerlendirilmesinde kullanılan (fizik muayene, labaratuar çalışmaları ile radyografik yöntemler) yöntemler tanı için spesifik değildir. Nitekim konuyla ilgili çoğu çalışmada, tam bir MPM tanısı için doku histopatolojik incelemelerinin yanı sıra anamnez, fizik muayene, radyoloji ve diğer laboratuar bulgularının da önemli olduğu, bunların bir bütünlük içerisinde ele alınarak bir arada değerlendirilmesi gerektiği tavsiye edilmektedir (59,85,99).
Her malignitede olduğu gibi MPM’da da tanı histopatolojik incelemeyle olur. Patolojik tanı için plevral sıvı, perkütan iğne biyopsisi, ultrason veya BT eşliğinde biyopsi, torakoskopik biyopsi ya da torakotomi ile açık biyopsi ile alınan örneklerin incelenmesi ile yapılır. Plevral sıvının sitolojik incelemesinde olguların % 33’ ünde malign sitoloji görülebilir. Kapalı Plevral İğne Biyopsisi (KPİB) plevral patolojilerin tanısında yaygın olarak kullanılan bir yöntemdir. Kapalı iğne biyopsisi ile olguların % 30-50'inde malign hastalık tanısı konulabilmektedir (74). BT ya da USG eşliğinde "trucut" biyopsi tanıda yardımcı olur. Teknik olarak mümkün olduğunda torakoskopi ile. %70-80, torakotomi· ile %100 oranında tanıya gidilebilir (100). KPİB için kontrendikasyonların göreceli olması, komplikasyon oranının düşüklüğü hastaneye yatışı gerektirmemesi, tekrar edilebilme kolaylığı ile oldukça ekonomik oluşu bu yöntemin avantajlarıdır. Ancak alınan örnek küçüklüğü ve işlemin kör yapılması da en önemli ve belirleyici dezavantajlarıdır (92). MPM’da tümör dokusu bazen çok geniş bir pleomorfizme sahip olabilir, bu gibi durumlarda tanıda ciddi güçlük çekilebilmekte; epitelyal tipin “plevranın metastatik adenoakanser” inden, sarkomatöz tipin de “sarkoma” lardan veya “uzun süreli benign fibröz plevral kalınlaşma/reaktif mezotelyal proliferasyon’ dan ayırımında güçlük çekilebilmektedir. Alınan örneğin küçük olması veya lezyon üzerinden tam alınamaması bu güçlüğü iyice arttırır
(85,86,99,101,102,103). Torakoskopi, plevral patolojilerin tanısında etkinliğinin oldukça yüksek, MPM tanısında duyarlılığın % 80 civarında olduğu kabul edilmektedir (86,99,102). Torakoskopinin en önemli avantajı da plevral yüzeylerin, patolojik değişikliklerinin görülebilmesine imkân vermesidir. Torakoskopi aracılığıyla söz konusu bu lezyonlardan görerek, yeterli büyüklükte ve çok sayıda doku örneği alınabilir (104). Torakoskopi’nin diğer avantajları plevral aralıkta tümörün yayılımını değerlendirmeye imkan vermesi, yani evrelemedeki etkinliği (105) ve işlem sırasında plörodez yapılmasına, bir tedavi girişimine de imkan vermesidir. Torakoskopinin bazı dezavantajları da vardır; komplikasyon oranı KPİB’ye göre daha yüksektir, plevral sıvısı olmayan veya plevral yapışıklıkları çok olan hastalarda kullanılamaz. Diğer bir olumsuzluğu, torakoskopi serilerinde işlem yerinden tümöral yayım oranı (% 30) ile daha yüksek oranda bildirilmektedir (88,98). Torakotomi’ de patolojik değişiklikler rahat görülebilir, görülemeyen intratorasik bölgeler palpe edilebilir, lezyonlu yerlerden çok sayıda doku örneği alınabilir, dolayısıyla kesin tanı oranının % 90 ila 100 arasında olduğu bildirilmektedir. Tanı değerinin yanı sıra evrelemeye de tam olarak imkan verebilmektedir (101,106,107). Ancak, komplikasyon oranının diğer yöntemlere göre belirgin olarak daha yüksek olması, hastanede kalma süresinin uzunluğu ve ekonomik maliyetinin yüksek olması olumsuz yönleridir. Bu olumsuzlukları çoğu hastanın sadece tanı amacıyla yükleniyor olması da, MPM takibi yapan klinikler tarafından dikkate alınması gereken önemli bir husus olmalıdır.
Patolojik ve immünohistokimyasal değerlendirmede ayırıcı tanıda çok önemlidir. Epitelyal tip MPM, en çok metastatik adenokarsinomlar ile karışır. Epitelyal mezotelyomalar intraselüler müsin veya CEA ile nadiren pozitif boyanır (5). Sitokeratin 5/6 ise epiteloid mezotelyomada ve akciğerin skuamöz karsinomunda % 100 oranında ekspresyon gösterir. Adenokarsinom’da boyanma oranı ise % 0’dır. Bu nedenle kalretinin ile birlikte ikinci değerli mezotel markerdır (108). Kalretinin, MPM tanısında en yüksek duyarlılık ve özgüllüğe sahiptir (109,110). Epiteloid mezotelyomada %100 boyanmasına karşın, sarkomatoid mezotelyomada spindle hücrelerde % 39 oranında boyanır; sitoplazmik ve nükleer boyanır, ancak nükleer boyanma diagnostik olanıdır (5). MPM ile adenokarsinom ayırımında kullanılan ve adenokarsinom işaretleyici olan CEA (karsinoembriyonik antijen), günümüzde hala en değerli markerdır. Fokal ve zayıf boyanma gözlenebilse bile hiçbir mezotelyoma kuvvetli ve difüz CEA boyanması
göstermez. Özellikle TTF-1, akciğer kökenli adenokarsinomları % 85 oranında boyayarak oldukça faydalı olmaktadır. Özetle; calretinin ve cytokeratin5/6 MPM’ da, CEA ve TTF-1 adenokarsinomda pozitiftir. Heterolog elemanlı sarkomatoid mezotelyomaların tanısında aktin desmin gibi kas belirteçleri çalışılabilir. Ancak keratinin negatif olduğu durumlarda bile eğer tümör plöral kökenli yani difüz plöral gelişen tarzda ise hangi tip sarkomatöz görünüm söz konusu olursa olsun (osteosarkom, kondrosarkom, malign fibröz histiositom gibi) tanı MPM olarak verilmelidir (111).
2.3 VASKÜLER ENDOTELYAL GROWTH FAKTÖR (VEGF)
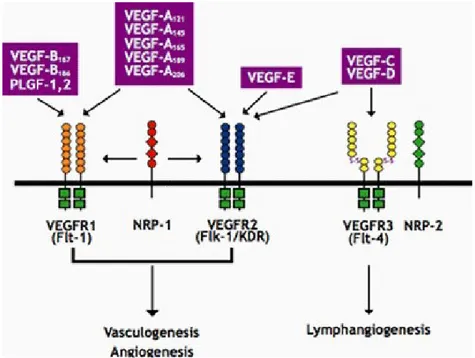
VEGF, trombosit kaynaklı büyüme faktör ailesinin bir üyesidir, endotel hücreleri için bilinen en spesifik mitojenik faktördür. Homodimerik bir protein olup kromozom 6p21.3’te kodlanmaktadır(112). Var olan 5 izoformu da (VEGF121,VEGF145, VEGF165, VEGF189, VEGF206) mRNA’nın alternatif splicing’iyle üretilirler(113). Vaskülogenezis ve anjiogenezde önemli rol oynarlar. Vucutta hem fizyolojik olaylarda hemde tümör büyümesi ve yayılması da dahil olmak üzere birçok hastalığın etyolojisinde rol almaktadır. VEGF endotel hücre yüzeyinde bulunan reseptörlere bağlanarak hücreyi etkiler. Bilinen reseptörler VEGFR 1 (Flt 1), VEGFR 2 (KDR-flk 2), VEGFR 3 (flt 4), nörofilin 1 ve 2 dir.
VEGFR 1 hücre hücre veya hücre matriks etkileşimlerini kontrol eder ve doku mimarisinin belirlenmesinden sorumludur. VEGFR 2 migrasyon ve endotel hücrelerinde proliferasyona neden olur (111). VEGFR -3 embiryojenezis sırasında vasküler ve lenfatik endotel hücrelerinden eksprese olurken daha sonra lenfatik endotelle sınırlı kalır. VEGF ailesi; VEGF-A (human vegf), VEGF-B, VEGF-C, VEGFD, VEGF-E Plesental büyüme faktörü(PIGF) ve yılan zehiri (svVEGF, VEGF-F) den oluşur. Başta VEGF-A vucutta oluşan birçok fizyolojik olayda (Vaskülogenezis, anjiogenezde veya kemotaksis) veya patolojik olayda (kanser, neovasküler hastalıklar veya kronik inflamatuar hastalıklarda) rol alır.
Takahashi ve arkadaşlarının yaptığı bir çalışmada yılan zehirinde VEGF ün moleküler yapısına çok benzeyen bir molekül tespit etmişlerdir, buna s-VEGF
(VEGF-F) adını vermişlerdir. VEGF-A dan 10 kat daha az artmasına rağmen, vasküler geçirgenliği aşırı derecede artırdığını bildirmişlerdir (114). Bu reseptör VEGFR-1 in kompetatif inhibitörü olarak görev yapmaktadır. Dolaşımdaki VEGF, bu reseptöre bağlanarak VEGF- 1 e bağlanamamakta, inaktive olup fonksiyonununu yapamamaktadır (115).
VEGF, Vaskülogenezis ve anjiogenezde önemli rol oynar. Anjiojenik etkilerine ek olarak endoteliyal hücrelerin migrasyon aktivitesini uyarmaktadır. Bu faktörün geri çekilmesi halinde vaskülarizasyonun gerilediği gözlemlenmiştir (6). Ayrıca VEGF’in kanser kök hücreleri için kemotaktik bir faktör olabileceği de söylenmiştir. Vucutta hem fizyolojik olaylarda hemde tümör büyümesi ve yayılması da dâhil olmak üzere birçok hastalığın etyolojisinde rol almaktadır. Anjiogeneziste yalnızca tümörün büyümesinde gerekli olmadığının ayn zamanda premalign tümörün kansere ilerlemesinde, kanser hücrelerinin dolaşıma geçmesinde, uykuda kalmasında, mikrometastazların açık metastazik lezyonlara dönüşmesinde de etkili olduğu anlaşılmıştır, yani angiyogenesiz kanserin çok erken evrelerinden uzak metastaz olan son dönemlerine kadar her evrede rol alır (116,117).
Tümör hücre tiplerinin çoğu birçok VEGF isoformlarını eş zamanlı salgılar ancak bunlar arasında en baskın olan VEGF 121 ve 165 tir (117).
VEGF ayn zamanda nitrik oksit salınımını ve NO aracılı vazodilatasyonu uyararak hipotansif etki yaratır. Ayrıca von-Willebrand faktörün salgılanmasını artıran PG-I2 üretiminide uyarmaktadır. VEGF’in biyolojik etkilerinin ortaya çıkması ağırlıklı olarak vasküler endotel hücrelerinde eksprese olan VEGF 2 reseptörüne bağlanmasıyla ilgilidir. Bu reseptör tirozin kinaz aktivitesine sahip bir yapıya sahiptir (118,119,120).
VEGF 2 ayn zamanda VEGF-C, VEGF-D ve VEGF-E reseptörüdür. Aslında VEGF, VEGF-1 e VEGF 2 den daha yüksek bir affiniteyle bağlanır. Ancak VEGF 1 in tirozin kinaz aktivitesi zayıftır. Buda VEGF nin mitojenik ve kemotaktik aktivitelerini yanlızca VEGF -2 yi eksprese eden hücrelerde gösterebileceğini düşündürmektedir. (118,119,120). VEGF reseptörleri ve biyolojik etkileri tablo 9’da verilmiştir.