AYDIN ĐLĐNDE ZEYTĐN DAL KANSERĐ
(Pseudomonas savastanoi pv. savastanoi)’ĐN
YAYGINLIĞININ BELĐRLENMESĐ VE PCR ĐLE TANISI
DURMUŞ SERVĐ YÜKSEK LĐSANS TEZĐ BĐTKĐ KORUMA ANABĐLĐM DALI
AYDIN ĐLĐNDE ZEYTĐN DAL KANSERĐ (Pseudomonas savastanoi pv. savastanoi)’ĐN
YAYGINLIĞININ BELĐRLENMESĐ VE PCR ĐLE TANISI
DURMUŞ SERVĐ YÜKSEK LĐSANS TEZĐ BĐTKĐ KORUMA ANABĐLĐM DALI
DANIŞMAN
Yrd. Doç. Dr. KUBĐLAY KURTULUŞ BAŞTAŞ
ÖZET Yüksek Lisans Tezi
AYDIN ĐLĐNDE ZEYTĐN DAL KANSERĐ HASTALIĞININ (Pseudomonas savastanoi pv. savastanoi)
YAYGINLIĞININ BELĐRLENMESĐ VE PCR ĐLE TANISI Durmuş SERVĐ
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Bitki Koruma Anabilim Dalı
Danışman: Yrd. Doç Dr. Kubilay Kurtuluş BAŞTAŞ 2009, 88
Jüri: Prof. Dr. Ahmet GÜNCAN
Prof. Dr. Özdemir ALAOĞLU
Yrd. Doç Dr. Kubilay Kurtuluş BAŞTAŞ
Pseudomonas savastanoi pv. savastanoi ’nin neden olduğu zeytin dal kanseri hastalığı zeytin ağaçlarında önemli kayıplar oluşturmaktadır. 2006 ve 2007 yıllarında, Aydın Đlindeki dokuz ilçede (Söke, Koçarlı, Çine, Karpuzlu, Nazilli, Karacasu, Bozdoğan, Buharkent, Kuyucak) yapılan surveylerde, 189 adet dal örneği toplanılmıştır. Etmenin izolasyonu ve tanılanmasında başlıca PVF1 ve King B besi yerlerinde gelişim, NSA’ da levan oluşumu, 370C’ de gelişim, oksidaz testi, esculin hidrolizi, pektolitik aktivite testi, arginine dehidrolaz testi, jelatinin hidrolizi, tütün yaprağında aşırı duyarlılık reaksiyonu, nitrat redüksiyonu, üreaz aktivitesi, erythritol, mannitol, sorbitol ve sakkaroz kullanımı, D- arabinoz, nitrat indirgenmesi, IAA üretimi, yumurta sarısı testi testleri kullanılmıştır. Patojenin moleküler tanısında, PCR tekniği ile iaal ve hrc gen bölgeleri çoğaltılmıştır. Patojenisite testleri zeytin ve zakkum fidanlarının sürgünlerinde gerçekleştirilmiş, altı izolat hariç, P. s. pv. savastanoi izolatlarının tümünün ur oluşturma kabiliyetinde oldukları gözlenmiştir. Surveyler sonucunda elde edilen 125 bakteriyel izolattan 85’i, biyokimyasal ve moleküler yöntemlerle P. s. pv. savastanoi olarak tanılanmış ve il genelinde etmenin yaygınlık oranı %44,9 olarak belirlenmiştir.
Anahtar Kelimeler; zeytin, dal kanseri, Pseudomonas savastanoi pv. savastanoi, PCR
ABSTRACT M.S. Thesis
THE DETERMINATION of PREVALANCE and IDENTIFICATION by PCR TECNIQUES
of OLIVE KNOT DISEASE (Pseudomonas savastanoi pv. savastanoi) in AYDIN PROVINCE
Durmuş SERVĐ
Selçuk University Graduate School of Natural and Applied Sciences Department of Plant Protect
Supervisor : Assistant. Prof . Dr. Kubilay Kurtuluş BAŞTAŞ 2009, 88
Jury: Prof. Dr. Ahmet GÜNCAN
Prof. Dr. Özdemir ALAOĞLU
Assitant. Prof. Dr. Kubilay Kurtuluş BAŞTAŞ
Olive knot disease caused by Pseudomonas savastanoi pv. savastanoi cause important losses on olive trees. It was collected 189 number branch samples in surveys from nine district of Aydın Province (Söke, Koçarlı, Çine, Karpuzlu, Nazilli, Karacasu, Bozdoğan, Buharkent, Kuyucak) in 2006 and 2007. in isolation and identification of agent was used mainly growth on PVF1 and King’s B mediums, levan production on NSA, growth at 370C, oxsidase, aesculin hydrolisis, pectolytic activity, arginine dihidrolase, gelatin hydrolisis, hypersensitive reaction on tobacco, nitrat reduction, urease activity, using of erythritol, mannitol, sorbitol and sucrose, D- arabinose, nitrate reduction, production of IAA, egg yolk test. in the molecular identification of the pathogen, iaal and hrc gene regions were amplified by PCR techniques. Pathogenicity tests were conducted on shoots of olive and oleander seedlings and except six isolates, it was observed abilities gall forming all of the P. s. pv. savastanoi isolates. It was identified 85 isolates as P. s. pv. savastanoi by biochemical and molecular methods from obtaining bacterial 125 isolates in the result of surveys and determined prevalence of pathogen as %44,9 in general of the province.
TEŞEKKÜR
Araştırma konum seçiminde ve çalışmalarım sırasında büyük katkı ve yardımlarını gördüğüm saygı değer değerli danışman hocam Sayın Yrd. Doç.Dr. K.Kubilay BAŞTAŞ’a zeytin dal kanseri Pseudomonas savastanoi pv. savastanoi materyallerimin moleküler tanılaması konusunda labrotuvarlarını kullanmama izin veren Selçuk üniversitesi Tarla Bitkileri Biyoteknoloji bölümü öğretim üyeleri ve asistanlarına, çalışmam esnasında kullandığım Pseudomonas savastanoi pv. savastanoi izolatlarını temin ettiğim Aydın Adnan Menderes Üniversitesi Ziraat fakültesi öğretim üyesi Prof.Dr. Kemal BENLĐOĞULU’ na teşekkür ederim.
ĐÇĐNDEKĐLER Sayfa No ÖZET... I ABSTRACT ... II TEŞEKKÜR ... IV ĐÇĐNDEKĐLER ... V ŞEKĐLLER LĐSTESĐ ... IX ÇĐZELGELER LĐSTESĐ ... XI 1.GĐRĐŞ ... 1 2.LĐTERATÜR ÖZETĐ ... 4 3. MATERYAL VE METOT ... 14 3.1.Materyal ... 14 3.1.1.Bitki materyali ... 14 3.1.2. Referans kültürler ... 14 3.1.3. Örnekleme metodu ... 14
3.1.4.Çalışmada kullanılan laboratuar alet ve ekipmanları ... 15
3.2.Metot ... 15
3.2.1. Hastalıklı bitki materyalinin elde edilmesi ... 15
3.2.2. Örnekleme metodu……… 15
3.3. Patojenin izolasyonu ... 17
3.4. Patojenin Tanısı ... 17
3.4.1.Patojenin tanısı ile ilgili olarak aşağıdaki testler yapılmıştır………17
3.4.1.1. Yarı seçici besi ortamı PVFl'in kullanımı……… 17
3.4.1.2.King's B besi ortamının kullanımı……… 18
3.4.1.3.Nütrient sakkaroz agar ortamının kullanımı……… 18
3.4.1.4. Biyokimyasal testler……… 19
3.4.1.5. Gram reaksiyon testi……… 24
3.4.1.7. Oksidaz testi……… 25
3.4.1.8.Patates testi………25
3.4.1.9.Arjinin dihidrolaz testi (Arginine Dehydrolase Testi)………. 26
3.4.1.10.Karbon kaynaklarının kullanımı……… 26
3.4.1.11.Jelatinin hidrolizi……… 27
3.4.1.12.Esculin hidrolizi……… 28
3.4.1.13.Floresan pigment üretimi……… 28
3.4.1.14. Üreaz testi……… 29
3.4.2. Tütünde hipersensitif reaksiyon testi……… 29
3.4.3. Patojenisite testleri……… 30
3.4.4. Moleküler tanı ve dna izolasyonu……… 30
3.4.4.1. Pseudomonas savastanoi pv. savastanoi’ nın DNA amplifikasyonu için spesifik primerlerin kullanımı……… 31
3.4.4.1.1. ĐAAL geni için spesifik primer kullanımı……… 31
3.4.4.1.2. HRC gen bölgesi için spesifik primer……… 32
3.4.5. Patojenin moleküler tanısı……… 32
3.4.6. PCR yöntemi……… 33
3.4.6.1. iaal geni PCR protokolü……… 33
3.4.6.2. hrc geni PCR protokolü……… 33
3.4.7. Agaroz jelin ve elektroforez tampon solüsyonunun hazırlanması……… 34
3.4.8. Amplifiye edilen bakteriyel DNA örneklerinin elektroforez sisteminde yürütülmesi……… 34
3.4.9.Agaroz jelin görüntülenmesi ve sonuçların incelenmesi……… 34
4. ARAŞTIRMA BULGULARI……… 36
4.1. Örnekleme Sonuçları……… 36
4.2 Patojenin izolasyonu………..………. 36
4.3. Patojenin tanısı……… 40
4.3.1.Patojenin tanısı ile ilgili olarak aşağıdaki testler yapılmıştır………… 40
4.3.1.2. Yarı seçici besi ortamı PVFl'in kullanımı……… 40
4.3.1.3.King's B besi ortamının kullanımı……… 40
4.3.1.4. Nütrient sakkaroz agar ortamının kullanımı……… 41
4.3.1.5. Biyokimyasal test sonuçları……… 42
4.3.1.6. Gram reaksiyon testi……… 42
4.3.1.7. Levan oluşumu……… 42
4.3.1.8.Oksidaz testi……… 43
4.3.1.9. Patates testi……… 43
4.3.1.10. Arginine dihydrolase testi………...44
4.3.1.11. Karbon kaynaklarının kullanımı……… 44
4.3.1.12.Jelatinin hidrolizi……… 45
4.3.1.14. Esculin hidrolizi……… 45
4.3.1.14. Üreaz testi……… 46
4.3.1.15. Tütünde hipersensitif reaksiyon testi……… 47
4.4. Patojenisite testi……… 48
4.5. Patojenin moleküler tanısı……… 64
4.5.1. PCR yöntemi……… 64
4.5.1.2 iaaL geninin amplifikasyonu……… 64
4.5.2 Hrc gen amplifikasyonu……… 67
5.TARTIŞMA……… ..73
7. KAYNAKLAR……… 82 ÖZGEÇMĐŞ………..89
ŞEKĐLLER LĐSTESĐ
Sayfa No
Şekil 3.2. Aydın ili ve ilçelerinden toplanan örneklerin yerleri……… 16
Şekil 4.2.1. Aydın ili Karacasu ilçesindeki yamalak Sarısı çeşidinde görülen zeytin dal kanseriPseudomonas savastanoi pv .savastanoi…37 Şekil 4.2.2. Aydın ili Karacasu ilçesindeki yamalak sarısı çeşidinde görülen zeytin dal kanseri pseudomonas savastanoi pv. savastanoi…38 Şekil 4.2.3. Aydın ili Buharkent ilçesi yabani zetindeki zeytin dal kanseri Pseudomonas savastanoi pv .savastaoi……….38
Şekil 4.2.4. Aydın ili bozdoğan ilçesinde hiçbir hastalık belirtisi görülmeyen gemlik çeşidi …….……….. 39
Şekil 4.2.5. Ziraat fakültesi labrotuvarına getirilen zeytin dal kanseri örneği Pseudomonas savastanoi pv. savastanoi……… 39
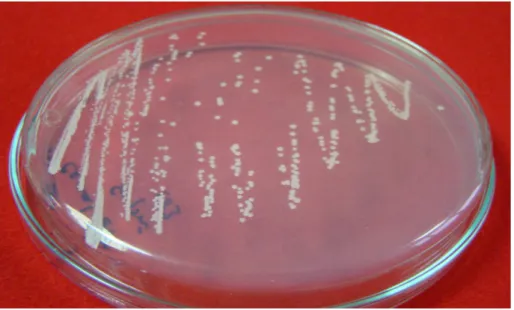
Şekil 4.4.1.3. Pseudomonas savastanoi pv. savastanoi izolatının king B Besiyerinde görünümü………... 41
Şekil 4.3.1.4. Pseudomonas savastanoi pv. savastanoi Đzolatlarının sna besiyerinde görünümü……… 42
Şekil 4.3.1.8. Oksidaz testi testi a)kontrol b) negatif……… 43
Şekil 4.3.1.11. Sorbitol testi a)kontrol b),c) pozitif d),e),f) negatif……… 44
Şekil 4.3.1.13.Jelatinin sıvılaşması testi a) pozitif b)negatif c)negatif d) negatif e)kontrol……… 45
Şekil 4.3.1.13. Esculin testi a)pozitif b),c),d) negatif……… 46
Şekil 4.3.1.14. Üreaz testi a,b,d negatif c, pozitif e, kontrol……… 47
Şekil 4.3.1.15. Tütünde hipersensitif reaksiyon……… 48
Şekil 4.4.1. Pseudomonas savastanoi pv. savastanoi KUPSS8’in gemlik çeşidinde gösterdiği urlar……… 49
Şekil 4.4.2. Pseudomonas savastanoi pv. savastanoi KUPSS11’ün zakkumda gösterdiği urlar……… 49
Şekil 4.5.1.3. Pseudomonas savastanoi pv. savastanoi iaal primerleri
kullanılarak yapılan PCR sonuçları……… 65 Şekil 4.5.1.4. Pseudomonas savastanoi pv. savastanoi iaal primerleri
kullanılarak yapılan PCR sonuçları……… 66 Şekil 4.5.1.5. Pseudomonas savastanoi pv. savastanoi iaal primerleri
kullanılarak yapılan PCR sonuçları……… 67 Şekil 4.5.2.1. Pseudomonas savastanoi pv. savastanoi Hrc primerleri
ÇĐZELGELER LĐSTESĐ
Sayfa No Çizelge 1. Türkiyede toplam zeytin üretimi ve zeytin ağacı sayısı……… 2 Çizelge 2. Zeytin’in Aydın ili ve ilçelerine göre dağılımı……… 15 Çizelge 3. Pseudomonas Türlerinin Tanılanmasında Kullanılan
Biyokimyasal Testler……… 20 Çizelge 4. Pseudomonas syringae’nin Patovarlarının Genel Tanılanmasında Kullanılan Testler……… 22 Çizelge 5.1. Pseudomonas savastanoi pv. savastanoi Bozdoğan ilçesi
izolatları Lopat testi sonuçları……… 50 Çizelge 5.2. . Pseudomonas savastanoi pv. savastanoi Buharkent ilçesi
izolatları Lopat testi sonuçları……… 50 Çizelge 5.3. Pseudomonas savastanoi pv. savastanoi Söke ilçesi
izolatları Lopat testi sonuçları……… 51 Çizelge 5.4. Pseudomonas savastanoi pv. savastanoi Çine ilçesi
izolatları Lopat testi sonuçları……… 51 Çizelge 5.5. Pseudomonas savastanoi pv. savastanoi Koçarlı ilçesi
izolatları Lopat testi sonuçları……… 52 Çizelge 5.6. Pseudomonas savastanoi pv. savastanoi Karacasu ilçesi
izolatları Lopat testi sonuçları……… 52 Çizelge 5.6. Pseudomonas savastanoi pv. savastanoi Karacasu ilçesi
izolatları Lopat testi sonuçları (devamı)……… 53
Çizelge 5.7. Pseudomonas savastanoi pv. savastanoi Nazilli ilçesi
izolatları Lopat testi sonuçları……… 53 Çizelge 5.8. Pseudomonas savastanoi pv. savastanoi Kuyucak ilçesi
izolatları Lopat testi sonuçları……… 54 Çizelge 6.1. Pseudomonas savastanoi pv. savastanoi Bozdoğan ilçesi
izolatları biyokimyasal test sonuçları……… 55 Çizelge 6.2. Pseudomonas savastanoi pv. savastanoi Buharkent ilçesi
izolatları biyokimyasal test sonuçları……… 56 Çizelge 6.3. Pseudomonas savastanoi pv. savastanoi Söke ilçesi
izolatları biyokimyasal test sonuçları……… 57 Çizelge 6.4. Pseudomonas savastanoi pv. savastanoi Çine ilçesi
izolatları biyokimyasal test sonuçları……… 58 Çizelge 6.5. Pseudomonas savastanoi pv. Savastanoi
Koçarlı ilçesi izolatları biyokimyasal test sonuçları……… 59 Çizelge 6.6. Pseudomonas savastanoi pv. savastanoi Karacasu ilçesi
izolatları biyokimyasal test sonuçları……… 60 Çizelge 6.6. Pseudomonas savastanoi pv. savastanoi Karacasu ilçesi
izolatları biyokimyasal test sonuçları (devamı)……… 61 Çizelge 6.7. Pseudomonas savastanoi pv. savastanoi Nazilli ilçesi
izolatları biyokimyasal test sonuçları……… 62 Çizelge 6.8. Pseudomonas savastanoi pv. savastanoi Kuyucak ilçesi
izolatları biyokimyasal test sonuçları……… 63 Çizelge 7.1. Pseudomonas savastanoi pv. savastanoi Bozdoğan ilçesi
izolatlarının PCR’da kullanılan primerlere verdikleri sonuçlar………… 70
Çizelge 7.2. Pseudomonas savastanoi pv. savastanoi Buharkent ilçesi
izolatlarının PCR’da kullanılan primerlere verdikleri sonuçlar…… 70 Çizelge 7.3. Pseudomonas savastanoi pv. savastanoi Söke ilçesi
izolatlarının PCR’da kullanılan primerlere verdikleri sonuçlar…… 70 Çizelge 7.4. Pseudomonas savastanoi pv. savastanoi Çine ilçesi
izolatlarının PCR’da kullanılan primerlere verdikleri sonuçlar……70 Çizelge 7.5. Pseudomonas savastanoi pv. savastanoi Koçarlı ilçesi
Çizelge 7.6. Pseudomonas savastanoi pv. savastanoi Karacasu ilçesi
izolatlarının PCR’da kullanılan primerlere verdikleri sonuçlar………71 Çizelge 7.6. Pseudomonas savastanoi pv. savastanoi Karacasu ilçesi
izolatlarının PCR’da kullanılan primerlere verdikleri sonuçlar (devamı)72 Çizelge 7.7. Pseudomonas savastanoi pv. savastanoi Nazilli ilçesi
izolatlarının PCR’da kullanılan primerlere verdikleri sonuçlar……… 72 Çizelge 7.8. Pseudomonas savastanoi pv. savastanoi Kuyucak ilçesi
izolatlarının PCR’da kullanılan primerlere verdikleri sonuçlar……… 72
1.GĐRĐŞ
Tarihi, günümüzden 8000 yıl öncesine dayanan zeytinin anavatanı’nın yukarı Mezopotamya (Güneydoğu Anadolu Bölgesi) olduğu ve çevresine buradan yayıldığı kabul edilmektedir. Zeytinden elde edilen zeytinyağının vücut için gerekli ancak sentez edilemeyen temel yağ asitleri ile sadece yağda eriyebilen E vitamininin kaynağını oluşturması ve yüksek kalori değeri (16 ml zeytinyağı/120 kalori içermektedir) yanı sıra, meyve suyu gibi natürel tüketilebilen tek yağ olma özelliği ve kendine has renk, koku, tat ve aromasıyla insan beslenmesinde çok önemli bir konuma sahiptir. Zeytinyağının başta kalp-damar hastalıkları olmak üzere sindirim sistemi, kemik yapısı, beyin ve sinir dokuları üzerinde çok önemli fonksiyonları bulunmaktadır. Kan hücrelerinin kümeleşmesinde rol oynayan faktörlere karşı etki göstererek kan damarlarında pıhtılaşma riskini azaltır. Zeytinyağı sıcak ve soğuk tüketildiğinde mide asitlerini azaltarak gastrit veya düodenal ülserlere karşı koruyucu bir rol oynamaktadır. Zeytinyağı safra salgısını canlandırıcı, safra kompozisyonunu düzenleyici ve safra kesesinin boşalmasını sağlayıcı özellikler nedeni ile safra taşı riskini azaltmaktadır. Tüm yağlar arasında en dengeli kimyasal pozisyona sahip olduğundan kemik mineralizasyonunun iyileşmesini sağlar ve normal kemik gelişimine yardımcı olur. Ayrıca yeni doğmuş bebeklerde 6/1 oranında gerekli olan linoleik-linoleik asit oranı zeytinyağında optimum seviyede olduğundan, bebek bekleyen ve emziren annelerin beslenmesinde en uygun yağdır. Zeytinyağı aynı zamanda dokuların yaşlanmasını önlemekte ve yaşlanmanın beyin fonksiyonları üzerindeki yıpratıcı etkisini azaltmaktadır (Denk, 2004).
Yaklaşık 500.000 ailenin geçimini zeytincilikten sağladığı dünyada 35 ülkede yaklaşık 10 milyon hektar alanda 900 milyon zeytin ağacı bulunmaktadır. 2004–2005 yılları ortalaması itibariyle 16 milyon ton olan dünya dane zeytin üretiminin altı tipik Akdeniz ülkesinde [Đspanya (%28,61) Đtalya (%25,88), Yunanistan (%15,02), Türkiye (%7,69), Suriye (%4,93) ve Tunus (%3,92)] yoğunlaştığı görülmektedir. Türkiye var-yok yılları ortalaması olarak 1.262.500 tonluk üretim hacmi ile dünyada 4. sırada yer almaktadır (Öztürk, 2006). Yurdumuzda 2006 yılı itibariyle yaklaşık 700 bin hektar
alanda 129 milyon ağaç varlığı ile toplam tane zeytin üretimi 1.766.749 ton seviyelerine gelmiştir (Anonim, 2007a).
Uluslararası Zeytinyağı Konseyi’nin verilerine göre, 2003-2007 yıllarında ortalama olarak 226.250 ton sofralık zeytin üretimi ile Đspanya’nın ardından dünyada 2. sırada olan Türkiye, zeytinyağı üretiminde ise 125.500 ton ile dünya zeytinyağı üretiminin % 4,2 ni karşılamakta ve ancak 6. sırada bulunmaktadır (Anonim, 2007b).
Ülkemizde 1995-2007 yıllar arasında zeytin ağacı sayısı ve elde edilen verim genel olarak artış göstermiştir (Çizelge 1).
Çizelge 1. Türkiyede toplam zeytin üretimi ve zeytin ağacı sayısı (1995-2007)
Zeytin üretimi
Yıllar
Ağaç sayısı (bin) Üretim (ton)
Meyve vermeyen
Meyve
veren Toplam Yağlık Sofralık Toplam
1995 6 144 81 437 87 581 309 000 206 000 515 000 1996 6 540 83 200 89 740 1 365 000 435 000 1 800 000 1997 9 950 85 780 95 730 310 000 200 000 510 000 1998 7 600 85 850 93 450 1 220 000 430 000 1 650 000 1999 8 370 87 130 95 500 350 000 250 000 600 000 2000 8 570 89 200 97 770 1 310 000 490 000 1 800 000 2001 9 000 90 000 99 000 365 000 235 000 600 000 2002 9 900 91 700 101 600 1 350 000 450 000 1 800 000 2003 10 500 92 250 102 750 500 000 350 000 850 000 2004 12 150 94 950 107 100 1 200 000 400 000 1 600 000 2005 16 555 96 625 113 180 800 000 400 000 1 200 000 2006 31 492 97 773 129 265 1 211 000 555 749 1 766 749 2007 40 110 104 219 144 329 620 469 455 385 1 075 854
Ülkemiz de zeytin, Ege ve Marmara Bölgeleri başta olmak üzere Akdeniz, Güneydoğu Anadolu ve Karadeniz Bölgelerimizde toplam 35 ilde yetiştiriciliği yapılan
bir üründür (Anonim, 1997). 1990 yılı itibariyle ülkemizde 324 bin civarında işletmede zeytin üretilmekte ve bu işletmelerin en büyük kısmının (%7) Ege Bölgesi'nde bulunduğu anlaşılmaktadır, işletmelerin önemli bir kısmının (%40) 2 ha' dan küçük olduğu ve son tarım sayımı sonuçlarına göre işletmelerin giderek daha da küçüldükleri anlaşılmaktadır (Anonim, 1997).
Dünya'da üretilen sofralık zeytinin %42,9’u yeşil, %30,6’sı siyah, %26,5’inin rengi dönük olarak işlenmektedir; Dünya yeşil sofralık zeytin üretiminde Đspanya'nın, siyah sofralık zeytin üretiminde ise Türkiye'nin lider olduğunu bildirmektedir (Anonim, 2007).
Dünya sofralık zeytin pazarına Đspanya ve Yunanistan'ın hakim olduğu ifade edilebilir. Dünyada ve ülkemizde zeytin üretimi yapılan alanlarda en önemli ve tahripkar bakteriyel hastalık zeytin dal kanseridir. Hastalığa sebep olan etmen Pseudomonas savastanoi pv. savastanoi ülkemiz zeytin yetiştirilen hemen tüm bölgelerde görülmektedir (Tunalıoğlu, 2003).
Bu çalışmada Aydın ilindeki zeytinlerde önemli sorun olan zeytin dal kanseri hastalığının, biyokimyasal ve moleküler olarak tanısının yapılarak öneminin ortaya konulması amaçlanmıştır. Yürütülen çalışma, il geneli için hastalıkla bulaşıklığın belirlenmesi ve hastalıkla mücadele olanaklarının düşünülmesi açısından önem taşımaktadır.
2. LĐTERATÜR ÖZETĐ
Zeytin, çok seçici olmamakla birlikte kalkerli-kumlu, besin maddelerince zengin, pH’sı 6–8 seviyesinde olan topraklardan hoşlanmaktadır. Taban suyu 1m.’den yakın olmamalıdır. Bu seviyeye yakın topraklarla mutlaka drenaj uygulanmalıdır. Zeytin, 40ºC ile -7 ºC arasındaki sıcaklıklarla dayanabilse de iyi bir büyüme ve meyve oluşumu için sıcaklığın 15–25 ºC’lerde olması istenmektedir. Zeytin’in soğuklama ihtiyacı 600 ila 1000 saat arasında değişmektedir. Ayrıca zeytinin iyi bir gelişme gösterip, normal göz gelişimi için yeterli bir sıcaklık toplamına ihtiyacı vardır. Zeytinin yıllık yağış isteği 650–800 mm’ dir. Yaz aylarından, mevsim yağışlarına kadar yapılan sulamalar zeytin irileşmesini ve yağ oluşumunun artmasını sağlamaktadır. Ayrıca bu oluşmalar ertesi yıl meyve verecek sürgünlerin gelişimini ve meyve gözlerinin oluşumunu hızlandırmaktadır. Nemli havalarda, ağaç yapraklarından gerçekleşen terleme azalır. Bu sayede sıcağın, bitkiye etkisi de azalmış olur. Ancak aşırı nem bazı hastalıklara uygun ortamı hazırlamaktadır. Çiçek zamanı yüksek nem ise döllenmeyi kısıtlamaktadır. Mayıs ayı ve haziran başında esen rüzgârlar döllenmeye yardımcı olurken, kış sonlarında esen rüzgârlar toprak neminin azalmasına yol açar. Zeytin ağacı ışığı çok sevdiğinden özellikle geçit bölgelerde güney yönleri tercih edilmelidir. Sisli dağ etekleri ve vadiler zeytin için uygun değildir. 800 m’ den yüksek yerlerde zeytin yetiştirilmemektedir (Anonim, 2008).
Zeytinin önemli ekonomik kayıplara sebep olan tahripkar hastalık ve zararlılar bulunmaktadır. Bunlar içersinde; zeytin dal kanseri (Pseudomanas savastanoi pv. savastanoi) zeytinlerde halkalı leke hastalığı (Spilocaea oleaginea) Armillaria kök çürüklüğü (Armillaria mellea) zeytin solgunluğu (Verticillium dahliae) zeytin güvesi (Prays oleae) zeytin kara koşnili (Saissetia oleae) zeytin kabuklu biti (Parlatoria oleae) zeytin pamuklu biti (Euphyllura olivina) zeytin sineği (Bactrocerra oleae) ilk sıraları almaktadırlar (Anonim, 2008).i
Dünyada yapılan survey çalışmaları Pseudomonas savastanoi pv. savastanoi’nin Đspanya (Alonso ve ark., 1988), Fas (Benjama ve ark., 1993), Ürdün (Theabsim, 1991), Tunus (Boulila, 1994), ABD-Kaliforniya (Teviotdale, 1994), Portekiz (Fermandes, 1994)’de mevcut olduğunu göstermiştir. Yunanistan da yapılan çalışmalarda Pseudomonas savastanoi pv. savastanoi’nin zakkum (Nerium oleander) ve yasemin (Jasminum spp.)’de doğal enfeksiyonlara neden olduğu belirtilmiştir. (Panagopolus,1993). Hastalığın ABD fidanlıklarında önemli kayıplara neden olduğu, (Azad ve ark., 1995), Portekiz’de verim kayıplarına neden olduğu belirtilmektedir (Marcelo ve ark., 1999) 2003 yılında Avustralya’nın 10 km güneyinde yapılan bir çalışmada, öncelikle 2 yaşındaki zeytinliklerde Pseudomonas savastanoi pv. savastanoi belirlenmiş ve bunu takip eden yıllarda 2 ile 5 yasındaki ağaçlardada 4 farklı bitkide aynı simmptomlar oluştuğu gözlenmiştir ( Hall, 2004).
Türkiye’de 1939 yılında meydana gelen dolu yağışı sonucunda zeytin dal kanser hastalığının şiddetli bir şekilde görüldüğü rapor edilmiştir (Đyriboz, 1941). Karaca (1977), hastalığın Karadeniz, Marmara, Ege, Akdeniz ve Güney Doğu Anadolu’da görüldüğü ancak Anadolu’nun Ege ve Akdeniz bölgelerinde daha şiddetli olduğunu bildirmişlerdir. Son yıllarda batı Akdeniz’in Antalya, Aksu, Döşemealtı, Serik, Manavgat, Kaş ve Kale ilçe ve köylerinde Pseudomonas savastanoi pv. savastanoi’nin yaygınlığı belirlenmiştir (Basım ve ark., 2000; Ersoy,2002). Ege bölgesinin Aydın ve Muğla ili ve ilçerinde’de yaygınlığı belirlenmiştir (Tatlı ve Benlioğlu, 2004)
P. s. pv.savastanoi’ nin neden olduğu urlar endemik bir hastalıktır. Hastalık oldukça şiddetli görülebilir ve bununla beraber zeytin ağaçlarında ölüme veya şiddetli yaprak dökümlerine neden olabilmektedir. Bu oldukça sıklıkla görülebilir bir durumdur. Bununla beraber yapılan araştırmalarda, ağaçta ürün kaybı, alınan üründe kalite düşüklüğü ve hatta çiçek dökümü görüldüğü saptanmıştır (Varvaro ve Surico, 1984).
Đtalya güneydoğusunda oldukça yoğun zeytin yetiştiriciliği yapılmaktadır. Kambiyum tabakası aktif ve patojenin popülasyonları çok yüksek olduğunda hastalığın etkisi ve şiddeti özellikle ilkbahar mevsimi süresince dondan zarar gören bitkilerde artmaktadır. P. s. savastanoi gerçekte, zeytin yapraklarında aktif değildir. Yapılan çalışmalarda P. s. savastanoi nin simptomsuz yapraklar üzerindeki sayısının tek bir bitki üzerindeki hastalığın şiddetiyle ilgili olmadığı tespit edilmiştir. Ancak bu sayı ilkbahar ve sonbahar mevsimlerinde, kış ve yaz mevsimlerine oranla daha fazladır. Bu sonuçlara bakıldığında P. s. savastanoi nin zeytin yapraklarındaki populasyonlarının bu mevsimler süresince önemli miktarda kolayca inokulum kaynağı olabileceğini desteklemektedir (Varvaro ve Surico, 1984).
Varvaro ve Ferulli (1983), yaptığı bir çalışmada patojenin zeytin bitkisinin tüm toprak üstü aksamlarında yayıldığı ve çoğaldığı gösterilmiştir. Yapraklara spreyleme yöntemiyle yapılan inokulasyondan sonra, bakteriyel populasyonun oldukça az bir miktarında 3-5 gün içerisinde ölüm görülmüştür. Đnokulasyondan 30 gün sonra yapraklardaki populasyon yaklaşık olarak 103 cfu/ml olarak tespit edilmiştir.
Zeytinliklerde maddi olarak önemli kayıplara neden olan bakteriyel hastalıkların başında gelen zeytin dal kanseri hastalığı Pseııdomonas savastanoi pv. savastanoi bakterisi isimli bakteriyel patojen tarafından oluşturulmaktadır. Bakteriyel dal kanseri hastalığı başta zeytin (Olea europea L.) olmak üzere zakkum {Nerium oleaııder L), dişbudak {Fraxinus excelsior L), ligstrum (Ligstrum japonicum Thunb) ve yasemin (Jasminum officinalis L) görülmektedir (Wilson, 1965).
Zeytin bitkilerinde doğal açıklıklardan ve özellikle soğuk, dolu vs. yoluyla açılan yaralardan kolaylıkla girerek bitkilerin dal ve gövde kısımlarında hatta yapraklarında da görülebilen ur şeklindeki odunsu yapılar oluşturmaktadır. Enfeksiyon kambiyum aktivitesine gerek duyar ve enfeksiyon üç aşamada oluşur. Bu aşamalar; 1) bitki dokularının bakteri ile kolonizasyonu ve yumuşak boşlukların oluşumu, 2) enjekteli
boşlukların etrafında bitki hücrelerinin çoğalması, 3) ksilem ve muhtemelen floem hücrelerini farklılaşması şeklindedir ( Wilson, 1965).
Bu yapılar bitkinin besin maddesi ve su alımını engellemekte ve dolayısıyla bitki giderek canlılığını kaybetmekte ve en sonunda da bitki tamamen kurumaktadır. Bu kurumalar yapraklarda, oluşan urlar nedeniyle yaprağın ucuna öz su akışını engelleyerek solma kuruma ve vakitsiz yaprak dökümüne neden olmaktadır (Gardan ve ark., 1992).
Pseudomonas savastanoi pv. savastanoi, bitkinin gövde ve dallarında hastalık belirtisi oluşturur. Ur görünümleri dalların dışında kök boğazında, yapraklarda ve meyvelerde az da olsa görülür. Ur ve siğiller önce yeşil renklidir, sonra grileşir. Urların üzeri başlangıçta düz süngerimsi iken sonra pürüzlenir, zamanla odunlaşır ve sertleşerek siyah rengini alır. Nemli ilkbahar aylarında urlardan akışkan bir madde yayılır. Bu salgı içerisinde bol miktarda bakteri vardır. Bitkiler genç dönemde hastalandığında yaşlı bitkilere nazaran daha fazla etkilenmekte ve kurumalar ortaya çıkmaktadır Bunun yanında yaşlı dallarda hastalık şiddetine bağlı olarak bitki gelişiminde gerileme ve verimde azalma meydana gelmektedir. Eğer hastalık için uygun koşullar ortaya çıkarsa, zarar çok daha fazla olur ve hastalık nedeniyle bitkinin besin ve su alımı engellendiğinden zamanla bitki zayıf düşmekte ve sonunda kurumalar meydana gelmektedir (Gardan ve ark., 1992).
Bakteri, kışı bulaşık ağaçlardaki taze urlar içerisinde geçirir. Hastalık etmeni urlar içerisinde yıl boyunca çoğalır. Islaklık ve nem olmadığı zaman enfeksiyon az görülür. Nemli ilkbahar aylarında urlardan akışkan bir madde yayılır. Bu salgı içerisinde bol miktarda bakteri vardır. Đlkbaharda bu akıntılara dokunan kuşlar, böcekler ve budama makasları bakteriyi diğer ağaçlara taşır. Siyah renge dönen urlar canlılığını yitirdiğinden hastalığı bulaştırma yetenekleri yoktur. Bakteri doğal açıklıklardan girip enfeksiyon yapamaz. Bitki dokusuna girebilmesi için dokuların yaralamaları gerekir. Sırıkla hasatta filizlerde ve dallarda meydana gelen yaralar, dolu yaraları, don çatlakları, budama ve aşı yaraları, yaprak dökümü ile meydana gelen yaralar, böcek zararı
(özellikle zeytin sineği, Dacus olea) ve rüzgâr esnasında dalların birbirine sürtmesi sonucu açılan yaralar bakterinin bitkiye giriş kapılarıdır. Hastalık etmeni, stoma gibi bitkinin doğal açıklıklarından giremez. Bakteri budama aletleri ve diğer ekipmanlarla da taşınabilir. Sıcaklık, hastalığın gelişmesinde ölçü değildir. Hastalık etmeninin gelişmesi için optimum sıcaklık derecesi 22-24°C; maksimum 32°C ve minimum 5-l0°C'dır (Saygılı ve ark., 2008).
Pseudomonas savastanoi pv. savastanoi morfolojik olarak düz çubuk şeklinde, bir veya iki kamçılı, gram negatif özellikte bakteridir. Yaklaşık olarak boyu 0.5-1 µm-1.5-4µm arasındadır (Palleroni, 1989). Bakteri ilk olarak zeytin (Olea europea L.) bitkisinden Smith tarafından izole edilmiş ve Bacterium savastanoi olarak isimlendirilmiştir. Daha sonra 1932 yılında dişbudak (Fraxinus excelsior) bitkisinden Brown tarafından izole edilmiş ve Bacterium savastanoi var. fraxini olarak tanımlanmış ve en son 1943 'te Dawson tarafından Pseudomonas savastanoi subsp. fraxini olarak yeniden isimlendirilmiştir (Janse, 1982). Zakkum (Nerium oleander) bitkisinde bu hastalık etmeninin ilk kez tanılanması Ferraris tarafından 1926' da Pseudomonas tonelliana olarak yapılmış ancak 1928' de Smith tarafından daha kesin bir tanılama yapılarak Pseudomonas savastanoi subsp. nerii olarak isimlendirilmiştir. Daha sonraki yıllarda Sisto ve ark., (1999) nın bildirdiklerine göre Gardan ve ark., 1992 yılında yaptıkları bir taksonomik çalışmayla bakteriyi Pseudomonas savastanoi pv. savastanoi olarak adlandırmışlardır.
Zeytin ve zakkumdaki ur oluşumunun enfekteli dokularda yüksek konsantrasyonlarda patojenik bakteri tarafından oluşturulan indole-3-acetic acid (IAA) ve sitokinin üretimi ile ilişkili olduğu belirlenmiştir (Smidt ve Kosuge, 1978; Comai ve ark., 1982; Surico ve ark., 1985, Surico ve Iacobellis, 1992; Iacobellis ve ark., 1994).
Yapılan sınıflandırma çalışmalarında, 40' dan fazla biyokimyasal ve fizyolojik özellik strainler üzerinde denenmiş ve yapılan çalışmalarda bütün Pseudomonas savastanoi pv. savastanoi strainlerinin yaklaşık olarak aynı karakteristiğe sahip olduğu,
önemli farklılıkların ise levan oluşumunda, IAA ve sitokinin benzeri bileşiklerin üretiminde görüldüğü tespit edilmiştir. Bu bahsedilen iki madde dişbudaktan elde edilen izolatlar tarafından üretilmemekte ya da çok az miktarda üretilmekteyken bu maddeler diğer konukçulardan elde edilen izolatlar tarafından daha fazla üretilmektedir. Yapılan testler sonucunda farklı konukçulardan elde edilen Pseudomonas savastanoi pv. savastanoi izolatları morfolojik, biyokimyasal ve serolojik olarak ayırt edilememiştir. Dişbudak ve diğer konukçu bitkiler arasındaki ayırım patojenisiteyle ilgili olan IAA ve sitokinin maddelerinin üretimiyle yapılmaktadır. Bununla birlikte farklı konukçu bitkilerden elde edilen izolatlar farklı patojenisite ve farklı konukçu bitki dizilişi göstermektedirler. Aynı zamanda dişbudaktan elde edilen izolatlar patojenisite testleri ile diğer konukçulardan elde edilen izolatlardan rahatlıkla ayırt edilebilmektedir. Bunun yanında konukçu spesifikliğine bir başka örnek olarak zakkum izolatlarının, zeytin bitkisinde ur oluşturabilmelerine rağmen, zeytin izolatlarının diğer konukçu bitkiler hariç zakkumda ur oluşturmadığı görülmüştür (Surico ve Iacobellis, 1992).
PVF1 ortamı genel olarak, bitki materyalleri örneklendiğinde yapraklarla bağlantılı saprofittik bakterilerin gelişimini %90 ve daha fazla engellemektedir. Zeytin ve zakkum bitkilerinden P. s. savastanoi' nin izolasyonunda PVF1 ortamının kullanımıyla bakteri hemen hemen saf kültür olarak elde edilebilir. Normal olarak, P. s. pv. savastanoi genç dokulardan izolasyonu, taze enfekteli bölgeler ele alındığında ve distile su ya da fosfat buffer içerisinde süspansiyon haline getirilerek küçük parçalarının petri kaplarına yayılmasıyla sağlanır. Diğer taraftan yaşlı çatlaklardaki gallerden P. s. pv. savastanoi nin izolasyonu, çok sayıda farklı özellikte teşhis edilmemiş sarı pigmentli bakt e ri l eri n varlığından ve hastalıklı dokulardaki canlı popülâsyonunun azlığından genelde çok zordur (Basım ve Ersoy, 2002).
Azad ve Cooksey (1995), zakkum izolatlarından elde edilen P. s. pv. savastanoi izolatlarının teşhisi için "oleander knot agar" olarak adlandırdıkları OKA yarı seçici ortamını dizayn etmişlerdir. 38 farklı coğrafik bölgeden
toplanmış P. s. pv.savastanoi izolatları OKA' da geliştirilmiş ve ortalama olarak %43.6 oranında bir başarı sağlanmıştır. OKA ortamı diğer ortamlarla karşılaştırıldığında saprofittik bakterilerin gelişimini %89–96,7 oranında engellendiği tespit edilmiştir. Diğer test edilen bitki patojeni bakterilerin %44' ünün bu ortamda gelişme gösteremediği belirlenmiştir. %13 ise az gelişme göstermiştir.
Farklı zeytinliklerden toplanan hastalıklı bitki materyallerinin izolasyonunda, dallar üzerinde oluşmuş urlar hastalandırdıkları dal parçalarından ayrılmıştır. Öncelikle grimsi yeşil tondaki urlar dikkate alınarak eğer alınan urların üst yapısı odunsuysa öncelikle bu odunsu dokunun üst sert tabakası kazınmıştır. Üst yüzeydeki sert tabaka kazınan urlar %96' lık alkole batırılarak kısa süre ile ateşten geçirilmiş ve birkaç damla fosfat buffer ile steril porselen bir havan içinde iyice ezilerek 2–3 saat bekletilmiştir. Eğer doku yumuşaksa ur dokusunun yüzeyi alkolle silinerek ve yine birkaç damla steril fosfat buffer eklenerek porselen havan içinde ezilmiş ve 2–3 saat bekletilmiştir (Lelliot ve Stead, 1987).
Tatlı ve Benlioğlu (2004), yaptıkları izolasyon çalışmalarında urlu bölge ile sağlıklı ve hastalıklı bölgeden yaklaşık olarak 0.5–1 cm büyüklüğünde parçalar kesilerek %70'lik etil alkol ile 1–2 dakika arınık edilmiştir. Daha sonra steril damıtık su ile durulanmış ve steril kurutma kâğıtları ile kurulanmıştır. Bu parçalar 1-2 ml steril damıtık su içinde havanda ezilmiş ve elde edilen süspansiyonlardan bir öze dolusu alınarak çizgi ekim yöntemi ile besi yerlerine ekim yapılmıştır. Bu amaçla Surico ve ark., (1989)'da belirtilen yönteme göre hazırlanan yarı seçici besi yeri PVF-1 kullanılmıştır. Đnokule edilen besi yerleri 24-48 saat inkube edilmiş ve besi yerinde pozitif kontrol (Psv 19 ve Psvz-1) izolatlarıyla benzerlik gösteren yavaş gelişen, yaklaşık 6 gün içinde düzgün, 2-3mm çapta, grimsi-beyaz, kenar kısmı ile birlikte hafifçe kabarık ve UV ışık altında soluk mavi floresans gösteren koloniler Nutrient Agar (NA) besi yerine saflaştırılmıştır. Elde edilen izolatlar patojenisite ve diğer test çalışmalarında kullanılmak üzere içinde %15 glycerol ve Nutrient Broth içeren tüplerde -80°C'de stoklanmıştır.
Havan içerisinde ezilen bitki materyalinden elde edilen sıvıda bir öze yardımı ile alınarak besi ortamına tek koloni çizim tekniği ile ekim yapılmışlar. 27°C de 6 gün bekletilen SNA besi ortamda gelişen bakteri kolonilerinin pürüzsüz, küçük (2-3 mm), grimsi beyaz, hafif yükselti şeklinde, kenarları sınırlanmış olan koloniler Pseudomonas savastanoi pv. savastanoi olarak değerlendirilmişleridir. Ayrıca bu ortamda gelişen bakteri kolonileri 3-5 gün sonunda King's B besi ortamına çizilmiş ve bakteri yeşilimsi pigment oluşturarak ve UV ışığı altında floresan ışık vermiştir (Surico ve Lavermicocca, 1989; Krieg ve Holt, 1984).
Pseudomonas savastanoi pv. savastanoi’nin biyokimyasal testleri öncelikle levan,oksidaz,patateste yumuşak çürüklük,arjinin dihidrolaz ve tütünde aşırı duyarlılık testlerini kapsayan LOPAT testleri yapılmaktadır. Ayrıca 370C de gelişim, jelatin hidrolizi,eskulin,nitrat redüksiyon testi,,indol oluşumu,karbon kaynaklarından yararlanma testleri uygulanmaktadır (Lelliot ve ark., 1966).
Scortichini (2004), yaptığı patojeniste testlerinde Frantoio çeşidi zeytinler üzerinde 2.107 cfu/ml yoğunlukta Pseudomonas savastanoi pv. savastanoi ‘ yi gövde inoklasyonunda kullanmış simptom gelişimi aşılamadan 2 ay sonrasına kadar takip edilmiştir.
Patojenin etkisi değerlendirilirken virulensliği, bitkinin yaşı ve tümöre neden oluşu göz önüne alınmaktadır. Pek çok Pseudomonas savastanoi pv. savastanoi streynleri zeytin bitkilerinde yüksek virulent olarak değerlendirilmiştir ancak çeşitler ve strainler arasında interaksiyon olduğu bulunmuştur. Belirlenmiş olan çeşitlerdeki hastalık şiddeti büyük ölçüde patojenin yara kısmındaki etkisine bağlıdır. Đkincil tümörler, bir inokulasyonun ardından inokule edilmeyen yaralarda oluştuğu düşünülmektedir. Ayrıca hiçbir çeşidin hastalığa dayanıklı olmadığını belirlenmiştir (Panyalver, 2005).
Son yıllarda özellikle 1980’li yılların başından itibaren nükleik asit karakterizasyonu, moleküler klonlama, sekans analizi, rekombinant teknolojisi ve genetik materyaller üzerindeki çalışmalar, nükleik asit tabanlı problardan yararlanma olanakları giderek artmıştır. Ayrıca prokaryotik ve ökaryotiklerin genomlarındaki modifikasyonlar, restriksiyon analizleri ve sistemleri üzerinde de son zamanlarda yoğun çalışmalar yapılamaktadır. 1985 yılında Saiki ve arkadaşları tarafından DNA veya RNA baz sıralarının sayısal olarak artırılması (amplifikasyon) teknolojisine dayanan dolayısıyla mevcut yöntemlerle analiz edilebilmelerini sağlayan Polimeraz Zincir Reaksiyonu’nu geliştirmişlerdir. PCR’ın geliştirilmesi, moleküler teknolojinin ve aynı zamanda kullanım alanının da genişlemesine yol açmıştır. PCR son yıllarda enfeksiyöz etmenlerin teşhisinde, epidemiyolojide, genetik defektlerin saptanmasında ve diğer alanlarda geniş bir uygulama ortamı bulmuştur. PCR, izole edilen veya patolojik materyallerde bulunan hedef genetik materyallerin (DNA veya RNA) spesifik kısa zincirli oligonükleotit primerler yardımı ile enzimatik olarak sayısal çoğaltılması (amplifikasyon)’dır. Bu hedef genetik materyal çok az sayıda ve hatta birçok veya sayısız diğer veya ilgisiz DNA’lar arasında olsa bile çoğaltılabilir ve homojen bir DNA materyali haline getirebilir ve kolayca identifiye edilebilir. PCR solüsyonu, aranan hedef DNA sekansları, iki tür spesifik oligonükleotid primerleri (15–30 bazlık tek iplikçikli), DNA polimeraz enzimi (ençok kullanılan Taq polimeraz) ve dört tür dNTP (dATP, dCTP, dGTP, dTTP) şeklinde hazırlandıktan sonra hedef DNA nın denatürasyonu, primerlerin bağlanması, polimerizasyon, amplifiye edilmiş ürünlerin saptanması aşamaları ile tanıya gidilmektedir (Arda, 1994).
Smith ve arkadaşları (1995), tarafından tanımlanan yöntemde tek bir koloniden 48 saat boyunca NA besi yerinde büyütülmüş hücrelerden bir bölümü alınarak steril salinle karıştırılıp 2 dakika boyunca 12000 g’de sentrifüj edilmiştir. çökelti atıldıktan sonra pellet 1-2 x 108 CFU ml. karşılık gelen bir optik yoğunlukta steril salinde çözülmüştür. Süspansiyon kaynayan suda 10 dakika ısıtılıp -20oC’de depo edilmiştir. Tekrarlı PCR (rep-PCR) yöntemi Louws ve ark. (1994) tarafından kullanılmıştır. Farklı bölgelerde yetiştirilmiş farklı Đtalyan zeytin kültürlerinden elde edilmiş P.s. pv.
savastanoi izolelerinin DNA parmak izleri ERIC, BOX ve REP primer setleriyle tekrarlı PCR yapılarak belirlenmeye çalışılmış ve tekrarlanabilen genomik PCR profilleri 100-1500 baz dizisi arasında değişen bantlardan ibaretti. REP primerleri kullanılarak 40 tekrarlanabilir ve kolayca seçilebilir bantlar tespit edilmiştir. En fazla ayrık bant sonucu veren REP primerleri, ERIC ve BOX primerlerinden elde edilmiştir (Ercolani, 1978).
Kullanılan bu tanılama yöntemlerinden daha kolay ve daha kısa zamanda kesin tanıya ulaşabilmek amacı ile yapılan çalışmalar sonucunda hem kısa sürede bakterinin teşhisi yapılabilmekte hem de bakteri moleküler düzeyde tanımlanabilmektedir. iaaL gen bölgesine ait spesifik olarak dizayn edilen primerler IAALF 5'-GGC ACC AGC GGC ATC AA-3' ve IAALR 5'-CGC CCT CGC AAC TGC CAT AC-3’ ile PCR tekniği kullanılarak amplifikasyonu sağlanmıştır (Penyalver, 2000).
Pseudomonas savastanoi pv. savastanoi nin PCR tanısında, spesifik hrcC2F 5’-GACCGGCTTGGTCAGGAAT-3’ ve hrcC2R 5’-CGGCTTTTCCCGGATTTCT-3’ oligonükleotid primerleri kullanılarak 593 bp’ lik DNA fragmentinin amplifikasyonu sağlanmıştır (Sisto, 2004).
3. MATERYAL ve METOT
3.1.Materyal
3.1.1.Bitki materyali
Çalışmamızın ana materyalini Aydın yöresindeki zeytin dikiliş alanlarındaki ilçelerden toplanan hasta ve sağlıklı görünüme sahip zeytin dalları oluşturmuştur.
3.1.2. Referans P. s. pv. savastanoi kültürleri
Denemelerde kullanılan orijinal P. s. pv. savastanoi kültürlerinden PSS112 ve PSS116 Prof. Dr. Kemal BENLĐOĞLU (Adnan menderes Üniversitesi)’den elde edilmiştir.
3.2.Metot
3.2.1. Hastalıklı bitki materyalinin elde edilmesi
Aydın ilinde yoğun olarak zeytin yetiştiriciliği yapılan ilçelerde ( Söke, Koçarlı, Çine, Karpuzlu, Nazilli, Karacasu, Bozdoğan, Buharkent, Kuyucak ) ve bunlara bağlı köylerde surveyler yapılarak elde edilen hastalıklı zeytin ağacı dalları 2006–2007 tarihlerinde toplanarak Selçuk Üniversitesi Ziraat Fakültesi Bitki Koruma laboratuarına getirilmiştir. 2006 yılı Aydın ili zeytin ağacı sayısı ve üretimi çizelge 2’ de verilmiştir. Örnek toplanan ilçelerin bölgesel görünümü şekil 3.2’ de verilmiştir.
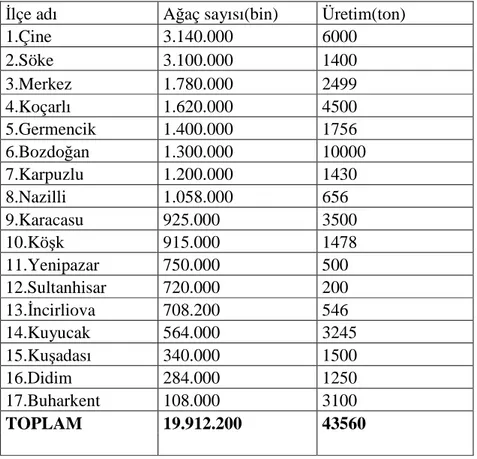
Çizelge 2. Zeytin’in Ağaç sayısı ve Üretiminin Aydın ili ve ilçelerine göre dağılımı (Anonim, 2006)
Đlçe adı Ağaç sayısı(bin) Üretim(ton)
1.Çine 3.140.000 6000 2.Söke 3.100.000 1400 3.Merkez 1.780.000 2499 4.Koçarlı 1.620.000 4500 5.Germencik 1.400.000 1756 6.Bozdoğan 1.300.000 10000 7.Karpuzlu 1.200.000 1430 8.Nazilli 1.058.000 656 9.Karacasu 925.000 3500 10.Köşk 915.000 1478 11.Yenipazar 750.000 500 12.Sultanhisar 720.000 200 13.Đncirliova 708.200 546 14.Kuyucak 564.000 3245 15.Kuşadası 340.000 1500 16.Didim 284.000 1250 17.Buharkent 108.000 3100 TOPLAM 19.912.200 43560 3.2.2. Örnekleme metodu
Aydın ili ve ilçelerinde zeytin yetiştiriciliği yapılan ve ili temsil edecek şekilde belirlenen zeytin örnekleri alınmıştır. Örnekleme;
Đlçe Toplam Zeytin Ağacı Sayısı ÖrnekSayısı 1.Çine 3.140.000 35 2.Söke 3.100.000 35 3.Koçarlı 1.620.000 15 4.Bozdoğan 1.300.000 9 5.Nazilli 1.058.000 30 6.Buharkent 108.000 15 7.Karacasu 925.000 35 8.Kuyucak 564.000 15 Toplam 11.851.000 189 Toplanan ilçeler
3.3 Patojenin izolasyonu
Farklı zeytinliklerden toplanan hastalıklı bitki materyallerinin izolasyonunda, dallar üzerinde oluşmuş urlar hastalıklı dal parçalarından ayrılmıştır. Öncelikle grimsi yeşil tondaki urlar dikkate alınarak eğer alınan urların üst yapısı odunsuysa öncelikle bu odunsu dokunun üst sert tabakası kazınmıştır. Üst yüzeydeki sert tabaka urlar %96' lık alkole batırılarak kısa süre ile ateşten geçirilmiş ve birkaç damla fosfat buffer (0,05M) (Na2HPO4, 4,26 gr, K2HPO4, 2,72 gr; 1000 ml. saf steril su) steril porselen bir havan içinde iyice ezilerek 2-3 saat bekletilmiştir. Eğer doku yumuşaksa ur dokusunun yüzeyi alkolle silinerek ve yine birkaç damla steril fosfat buffer (Na2HPO4, 4,26 gr, K2HPO4, 2,72 gr; 1000 ml. saf steril su) eklenerek porselen içinde ezilmiş ve 2-3 saat bekletilmiştir (Lelliot ve Stead, 1987).
3.4. Patojenin Tanısı
3.4.1.Patojenin tanısı ile ilgili olarak aşağıdaki testler yapılmıştır
3.4.1.1. Yarı seçici besi ortamı PVFl'in kullanımı
Havan içerisinde ezilen bitki materyalinden elde edilen sıvı bir öze yardımı ile alınarak besi ortamına tek koloni çizim tekniği ile aşılanmıştır. 27°C de 6 gün bekletilen ortamda gelişen bakteri kolonilerinin pürüzsüz, nispeten küçük (2-3 mm), grimsi beyaz, hafif yükselti şeklinde, kenarları sınırlanmış olan koloniler Psendomonas savastanoi pv. savastanoi olarak değerlendirilmiştir. Ayrıca bu ortamda gelişen bakteri kolonileri 3-5 gün sonunda King's B besi ortamında olduğu gibi UV ışığı altında floresan ışık vermişlerdir (Surico ve Lavermicocca, 1989).
3.4.1.2.King B besi ortamının kullanımı gr/L • Proteose peptone 20,0 • K2HPO4.3H2O 1,5 • MgSO4.7H2O 1,5 • Agar 15,0 • Glyserol 10 • Destile su 1 pH=7.2 (King ve ark., 1954)
Tek koloni yöntemiyle besi ortamına çizilen bakteri kolonileri 25°C de 2 gün bekledikten sonra 365 nm' ye ayarlı UV lamba altında kontrol edilen besi ortamlarında fluoresan pigment veren pozitif koloniler gözlenmiştir (Krieg ve Holt, 1984).
3.4.1.3.Nütrient sakkaroz agar ortamının kullanımı
Nütrient Agar (NA)
gr/L • Beef extrakt 1 • Yeast ektrakt 2 • Bakteriyolojik pepton 5 • NaCl 5 • Agar 15 pH=7,2
Tek. koloni yöntemi ile çizilen bakteriler 27°C de 48-72 saat içerisinde geliştikten sonra, tam daire ya da düzgün olmayan daire biçiminde pürüzsüz, 3-5 mm
çapında, solgun san rengine yalan gri veya grimsi beyaz renginde hafifçe yükselti şeklinde, kenarları tamamen ya da düzensiz olarak sınırlanmış koloniler gözlenmiştir (Surico ve Lavermicocca, 1989).
3.4.1.4. Biyokimyasal testler
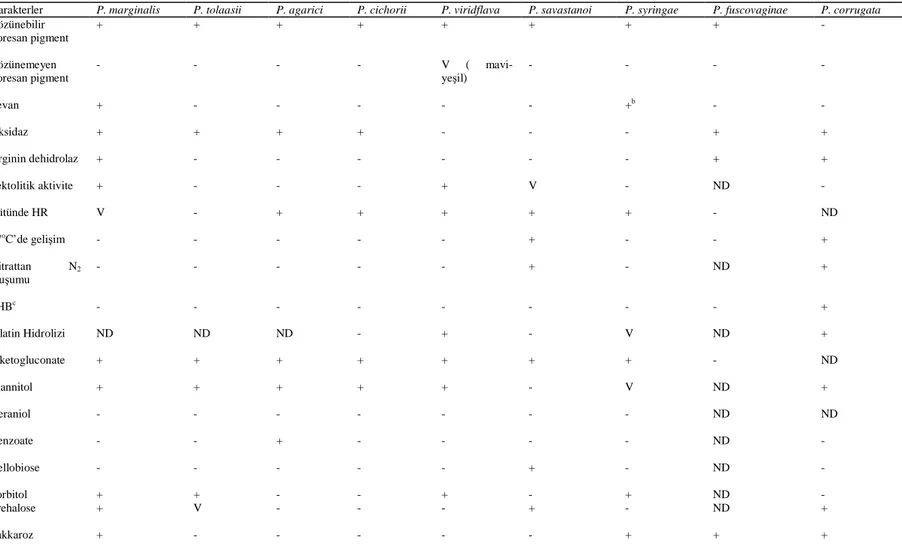
Pseudomonas savastani pv. savastanoi için levan oluşumu, oksidaz reaksiyonu (Kovacs, 1956), pektolitik aktivite testi (Kovacs, 1956), arginine dihiydrolase testi (Thornley, 1960), karbon kaynaklarının kullanımı, King B besi yerinde gelişim, arbutin hidrolizi, jelatin hidrolizi, nitrat indirgenmesi, L(+) Arginine dehidrolaz aktivitesi, H2S üretimi, tütün yaprağında aşırı duyarlılık reaksiyonu (Klement, 1963; Klement ve ark., 1990; Lelliott ve Stead, 1987; Mohan ve ark., 1987) yapılarak elde edilen fitopatojen bakterilerin biyokimyasal özellikleri belirlenmiştir (Schaad (2001) (çizelge 3;çizelge 4)) Her bir test aynı şartlarda 3 kez tekrarlanmıştır.
Çizelge 3. Pseudomonas Türlerinin Tanılanmasında Kullanılan Biyokimyasal Testler (Schaad, 2001)
Karakterler P. marginalis P. tolaasii P. agarici P. cichorii P. viridflava P. savastanoi P. syringae P. fuscovaginae P. corrugata
Çözünebilir floresan pigment + + + + + + + + - Çözünemeyen floresan pigment - - - - V ( mavi-yeşil) - - - - Levan + - - - +b - - Oksidaz + + + + - - - + + Arginin dehidrolaz + - - - + + Pektolitik aktivite + - - - + V - ND - Tütünde HR V - + + + + + - ND 37oC’de gelişim - - - - - + - - + Nitrattan N2 oluşumu - - - + - ND + PHBc - - - - - - - - + Jelatin Hidrolizi ND ND ND - + - V ND + 2-ketogluconate + + + + + + + - ND Mannitol + + + + + - V ND + Geraniol - - - ND ND Benzoate - - + - - - - ND - Cellobiose - - - + - ND - Sorbitol + + - - + - + ND - Trehalose + V - - - + - ND + Sakkaroz + - - - + + +
Çizelge 3. (Devam) Meso-tartarate V + - + + - + ND ND D(-)-tartarate V - - - + - - ND V D-arabinose - - - ND + I-rhamnose V ND - - - ND - D-aspartate - ND ND + - - - ND ND Buz çekirdeği oluşturma - + + - - - + - - IAA üretimi - - - + - - -
+ : %80 veya daha fazla izolat pozitif; - : %80 veya fazla izolat negatif; V : %21-79 izolat pozitif; ND : belirlenmemiş,
a : Sands ve ark, 1970; Hildebrand ve ark, 1988; Holt ve ark, 1994; ve Yound ve Triggs, 1994’den sonra modifiye edilmiştir. b : Delphinii, populans ve passiflorae patovarları negatif
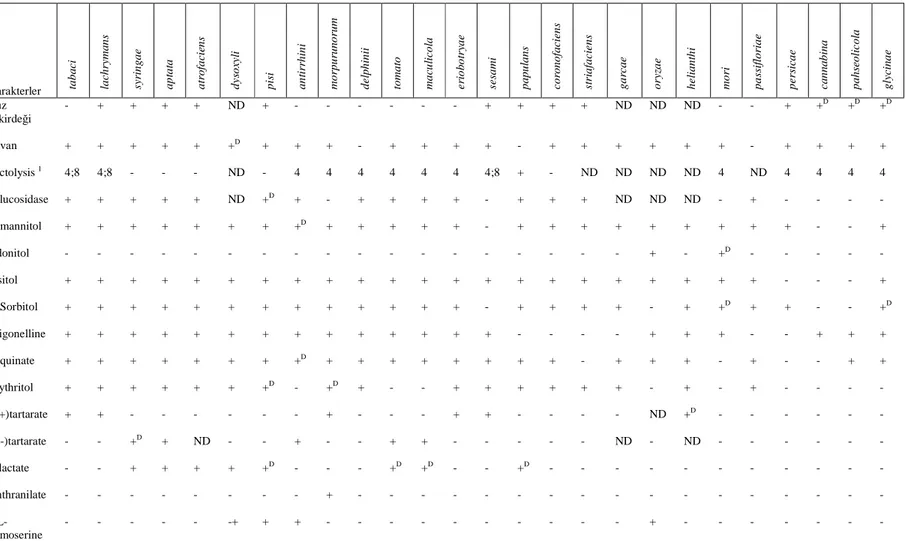
Çizelge 4. Pseudomonas syringae’nin Patovarlarının Genel Tanılanmasında Kullanılan Testler (Schaad, 2001) Karakterler ta b a ci la ch ry m a n s sy ri n g a e a p ta ta a tr o fa ci en s d y so xy li p is i a n ti rr h in i m o rp u ru n o ru m d e lp h in ii to m a to m a cu li co la e ri o b o tr ya e se sa m i p a p u la n s c o ro n o fa ci en s st ri a fa ci e n s g a rc a e o ry za e h e li a n th i m o ri p a ss if lo ri a e p e rs ic a e c a n n a b in a p a h se o li c o la g ly ci n a e Buz çekirdeği - + + + + ND + - - - + + + + ND ND ND - - + +D +D +D Levan + + + + + +D + + + - + + + + - + + + + + + - + + + + Pectolysis 1 4;8 4;8 - - - ND - 4 4 4 4 4 4 4;8 + - ND ND ND ND 4 ND 4 4 4 4 βglucosidase + + + + + ND +D + - + + + + - + + + ND ND ND - + - - - - D-mannitol + + + + + + + +D + + + + + - + + + + + + + + + - - + Adonitol - - - + - +D - - - - - Insitol + + + + + + + + + + + + + + + + + + + + + + - - - + D-Sorbitol + + + + + + + + + + + + + - + + + + - + +D + + - - +D Trigonelline + + + + + + + + + + + + + + - - - - + + + - - + + + D-quinate + + + + + + + +D + + + + + + + + - + + + - + - - + + Erythritol + + + + + + +D - +D + - - + + + + + + - + - + - - - - L(+)tartarate + + - - - + - - - + + - - - - ND +D - - - - D(-)tartarate - - +D + ND - - + - - + + - - - ND - ND - - - - L-lactate - - + + + + +D - - - +D +D - - +D - - - - - - - - - - - Anthranilate - - - + - - - - DL-homoserine - - - -+ + + - - - + - - - -
Çizelge 4. (Devam) Glutarate + + + + + + ND + + + + ND ND ND - ND ND + + + - ND ND +D - +D DL-glycerate + + + + + + ND + + + + ND ND ND + ND ND- + + + - ND ND - - - Gelatinin sıvılaşması + + + + + + ND + - + + ND ND ND +D - ND + + - - ND ND - - - Arbutin hydrolizi + + + + + + ND + - + + ND ND ND + ND ND + + - +D ND ND - - - Aesculin hydrolizi +D +D + + + + ND +D +D + + ND ND ND + ND ND + - - +D ND ND - - - Polygalacturonase +D + - - - - ND - - - - ND ND ND - ND ND - - - - ND ND - - - Pektat lyase +D +D - - - - ND - - + - ND ND ND + ND ND - - + - ND ND - - - Toxin + - + + + - ND - + - + + ND ND - + ND + - - - ND ND +D + +
I : pektat jelde oluşan çukurun pH’sı; 4=pH4.6/8=pH8.5
+ : %80 veya daha fazla izolat pozitif; +D : %80 veya daha fazla izolat geç pozitif; V : %21-79 izolat pozitif; - : %80 veya daha fazla izolat negatif; ND : belirlenmemiş, Hildebrand ve
3.4.1.5. Gram reaksiyon testi
Bakteri izolatların hücre duvarlarındaki farklılığı belirleyebilmek için bir lam üzerine, %3’lük KOH çözeltisinden bir damla damlatılmıştır. Ardından King B üzerinde geliştirilen 24-48 saatlik bakteri kültüründen öze ile alınarak KOH çözeltisi ile 5–10 s karıştırıldıktan sonra öze yukarıya doğru kaldırılmıştır. Gram negatif özellikte olan mikroorganizmalarda hücre duvarındaki peptidoglukan tabakası tek katlı olup, teikoik asit içermediğinden KOH ile kolayca parçalanmış, sitoplâzma sıvısı serbest hale geçişiyle bunun sonucunda da vizköz bir uzama görülmesi beklenilmiştir. P. s. pv. savastanoi pozitif olarak kabul edilmiştir (Saygılı, 1995).
3.4.1.6. Levan (Fruktan) testi
Bakteriyel izolatlar,
• Sakkaroz 5g • Nutrient agar 2 g • Destile su 100 ml
% 5 sukroz içeren Nutrient agar ortamına çizgi ekim yapılan bakteriyel izolatlar, 27 ºC’de 5 gün inkübe edilmiştir. Levan sucrase enziminin sakkarozu kullanması sonucu oluşan konveks, mukoid koloniler pozitif, konveks ve mukoid yapıda olmayan koloniler ise negatif olarak belirlenmiştir (Klement ve ark., 1990; Lelliot ve Stead, 1987).
3.4.1.7. Oksidaz testi
Kullanılan besi yeri;
• Nutrient agar 2g • Glukoz 1g • Destile su 100ml Kullanılan solüsyon;
• Tetra methyl-p-phenylendiamine dihydrochloride 1g • Destile su 100 ml
% 1 oranında glikoz içeren Nutrient agar besi yerinde gelişen 24-48 saatlik kolonilerden, öze yardımı ile bir miktar alınarak ve filtre kağıdı üzerine damlatılan % 1’lik Tetra methyl-p-phenylendiamine dihydrochloride iyice sürülmüştür. Bu işlemin sonucunda bakteri solüsyon karışımı;
10-60 saniye içinde maviye dönüşmüşlerse pozitif olarak 60 saniye sonra maviye dönüşürse geç pozitif 60 saniye sonra maviye dönüşmezse negatif olarak kabul edilmiştir( Kovacs, 1956).
3.4.1.8. Patates testi
Yüzey sterilizasyonu yapılan bir patates enine halkalar şeklinde kesilerek, bir petri kabına nemli kurutma kağıdının üzerine yerleştirilmiş ve King's B besi ortamında geliştirilmiş koloniler bir öze yardımıyla alınarak patatesin yüzeyine yayılmıştır. 27°C'de 3-4 gün sonunda patatesin yüzeyinde herhangi bir doku çökmesi pozitif olarak kabul edilmiştir.
3.4.1.9. Arjinin dihidrolaz testi (Arginine Dehydrolase Testi)
Mikroorganizmaların bu özelliğini belirtmek için yapılan bu testte Thornley 2A besi yeri kullanılmıştır. g/L • Pepton 1 • NaCl 5 • K2HPO4 0,3 • Agar 3 • L+HCl arginine 10 • Destile su 1 pH: 7,2
Tüplere 3 ml konulan besi yeri 121 0C’de 1.5 atm basınçta sterilize edilmiştir. Sonra tüplere öze ile bakteri kültürü aşılanmıştır ve tüplerin üzerine 2 ml steril parafin konulmuştur. Kültürler 27 º C’de 7–15 gün süre ile inkübe edilmiştir. Bakterinin arginine’i kullanması sonucu meydana gelen pembemsi kırmızı renk pozitif, açık pembe renk ise negatif sonuç olarak değerlendirilmiştir (Thornley, 1960).
3.4.1.10. Karbon kaynaklarının kullanımı
Elde edilen bakteriyel izolatların karbon kaynaklarını kullanım durumlarını belirlemek amacıyla aşağıda verilen teste tabi tutulmuşlardır(Ayers ve ark., 1919).
g/L • NH4H2PO4 1,0 • KCl 0,2 • MgSO4.7H2O 0,2 • Bromthymolbleu 0,08 • Agar 12,0 • Damıtık su 900 ml pH: 7,0
Agar dışındaki kimyasallar 900 ml saf su içerisine konularak pH 7.0’a ayarlanmış ve üzerine agar dökülerek tüplere 5’er ml konulmuştur. Daha sonra otoklavda 120 0C’de 1.5 atm’de 15 dakika sterilize edilmiştir.
Testte kullanılacak karbonhidratlardan (D-Sorbitol, D- mannitol, erythritol, inositol, β-glukosidase, inositol) 10 g tartılarak ve 100 ml su içerisinde eritilmiş, verilen pH değerine ayarlanmıştır ve filtrasyon yöntemi ile sterilize edilmiştir.
Otoklavda sterilize edilen ve içlerine 4.5 ml besi yeri bulunan tüpler, 45–50 0C’e soğutulan tüplerin üzerine sterilize edilen karbonhidratlardan 0.5 ml eklenilerek ve eğik agar olarak hazırlanmıştır. Bu tüplere bakteriyel izolat aşılanmış ve 24–27 0C’de inkübe edilmiştir. Tüplerdeki renk değişimi (sarı) pozitif olarak değerlendirilmiştir.
3.4.1.11. Jelatinin hidrolizi
Aşağıda verilen karışım hazırlandıktan sonra, jelatinin erimesi için 50 0C’de su banyosunda tutulmuş ve çözelti 5 ml olarak tüplere konulmuş, otoklavda sterilize edilmiştir. Tüplere bakteri ekildikten sonra 20 0C’de 7-14 gün inkübe edilmiştir. Tüplerdeki jelatin akıcı ise pozitif olarak değerlendirilmiştir (Schaad, 2001).
g/L • Peptone 5.0 • Beef extract 3.0 • Gelatin 120
3.4.1.12. Esculin hidrolizi
Bakteriyel izolatların esculin hidrolizini belirlemek için aşağıda verilen besi yeri hazırlanmıştır. g/L • Yeast extract 5.0 • NaCl 5.0 • MgSO4.7H2O 0.2 • K2HPO4 0.5 • NH4H2PO4 0.5
• Ferric ammonium citrate 50 mg
• Esculin 1.0
pH: 6.8
Yukarıda verilen besi yerinin pH’ı 6.8’e ayarlanmış ve otoklavda sterilize edilmiştir. Tüplere 5 er ml dağıtılan besi yeri üzerine bakteri ekimi yapıldıktan sonra 28 0C’de çalkalayıcıda 28 gün bekletilmiştir. Besi yeri kahverengi-siyah arası renk alanlar pozitif olarak değerlendirilmiştir (Sneath, 1956; Schaad, 1988).
3.4.1.13. Floresan pigment üretimi
Floresan pigment üreten izolatların belirlenmesi amacıyla, King B besi yeri hazırlanmıştır. Her bir izolat katılaşan besi yerine çizildikten sonra, 25 ºC’ye ayarlı inkübatörde 2 gün süreyle inkübe edilmiştir. Gelişen kültürler, ultraviyole lamba altında, karanlık odada gözlemlenmiştir, yeşil floresan pigment üretenler pozitif, diğerleri negatif olarak değerlendirilmiştir (King ve ark., 1954; Fahy ve Persley, 1983; Lelliot ve Stead, 1987).
3.4.1.14. Üreaz testi
Bakteriyel izolatların üreaz testi için aşağıda verilen ortam hazırlanmıştır. 800 ml.de • NH4H2PO4 0.5 g • K2HPO4 0.5 g • MgSO4.7H2O 0.2 g • NaCl 5.0 g • Yeast extract 5.0 g • Cresol red 16.0 mg
Otoklavdan sonra, ürea (stok solüsyon) 200*ml eklenir *20 g üzerine 180 ml su eklenir ve steril filtreden geçirilir.
Bu besi yeri, 25 cm’lik tüplere, 5’er ml konur. Bu tüpler inokule edilir ve 280C2de çalkalayıcı bir inkübatöre konulur. Kontrol tüp içinde ürea olmayan basal besi yeri içermeli ve inokule edilmelidir. Alkali durum ortaya çıktığında (pH=9.0 dolayında) kırmız renk oluşur, bu da ürez aktivitesi olduğunu gösterir.
3.4.2. Tütünde hipersensitif reaksiyon testi
Elde edilen bütün bakteriyel izolatlar King B besi yerinde 24-48 saat 27 °C’ ye ayarlı inkübatörde geliştirilmiştir. 108 hücre/ml yoğunlukta bakteriyel süspansiyon hazırlanmıştır. Süspansiyonlar 3cc’lik plastik enjektörlerle tütün (Nicotiana tabacum L. White Burley ) yapraklarının alt kısmından damar aralarına enjekte edilmiştir. Đnokule edilen bitkiler en az 8 saat ışıklı bir ortamda muhafaza edilerek inokluasyonun yapıldığı kısımda nekroz oluşup oluşmadığı tespit edilmiştir. Ölü doku oluşumu pozitif, oluşmaması ise negatif olarak değerlendirilmiştir (Klement ve ark.1966, Lelliot ve Stead, 1987).
3.4.3. Patojenisite testleri
NSA besi ortamı (Nütrient broth %0.8, sukroz %5, ağar % 0.2)' nda 1 gün içerisinde geliştirilerek, yaklaşık 108 cfu/ml'lik süspansiyonlar halinde sert bir uygulama materyali ile zeytin ve zakkum ağaçlarının yaklaşık bir yıllık dallarına açılan yaralara direk olarak uygulanmıştır. Enfekte edilmiş bitkiler sera koşullarında (25 ± 2°C'de sıcaklık) bekletilmiştir. Enfekte edilen dallarda bakteriyel ur simptomlarının oluşumu enfeksiyondan yaklaşık 60 gün sonra gözlenmeye başlanmıştır (Surico ve ark., 1984).
3.4.4. Moleküler tanı ve dna izolasyonu
Bu çalışmada kullanılan P.s. savastanoi izolatlarının total DNA'sı DNA izolasyon kit'i (Genomic DNA Purifıcation Kit, Cat No: Al 125, Promega) kullanılarak elde edilmiştir Kullanılan kit yöntemi şöyledir;
1. 5 ml' lik mikrofüj tüpüne 1 ml sıvı nütrient sakkaroz'da 27°C’de 24saat çalkalanmış bakteri kültürü konulur.
2. 13.000-16.000 devir/dakika'da 2 dakika santrifüj yapılarak, pellet oluşturulur. Daha sonra sıvı kısım boşaltılır.
3. 600 µl hücre parçalayıcı (lysing ) solüsyonu eklenir. Hücre süspansiyon içinde çözülünceye kadar yavaşça mikro pipetle karıştırılır.
4. Parçalanan hücreler 80°C de 5 dakika inkübe edildikten sonra oda sıcaklığına alınır. 5. Parçalanan hücrelerin üzerine 3µl Rnase solüsyonu eklendikten sonra 25 kez tüpler ters yüz edilerek karıştırılır.
6. Örnekler 37°C ‘de 15-16 dakika bekletildikten sonra oda sıcaklığına alınır.
7. RNase ile muamele edilen tüplerin üzerine 200µl, protein çöktürme solüsyonu eklenir. Parçalanan hücreler ile protein çöktürme sıvısının tamamen karışması için yüksek hızda 20 defa vortekslenir.
9. Buzdan alınan örnekler, 3 dakika süreyle, 13.000-16.000 devir/dakikada santrifüj edilir. 10. Đçinde DNA bulunan üst fazı temizlemek için 600µl izopropanol alkol ile karıştırılır. 11. DNA iplikçiği yığın halinde görülünceye kadar tüpler yavaş yavaş karıştırılır. 12. Karıştırılan örnekler 2 dakika 13.000-16.000 devir/dakikada santrifüj edilir.
13. Tüp içindeki üst faz, boşaltıldıktan sonra geriye kalan DNA' yı temizlemek için %70' lik etil alkol ile yıkanır.
14. Đki dakika 13.000-16.000 dakika/devir de santrifüj edilen örneklerden etilalkol uzaklaştırılır.
15. Tüpler kurutma kağıdı üzerine ters çevrilerek 10-15 dakika bekletilerek pelletin kuruması sağlanır.
16. DNA' nın uzerine100lt sulandırıcı DNA Rehidrasyon solüsyonu eklenerek, 65°C de 1 saat süreyle inkübe edilir. Periyodik olarak tüpler karıştırılır.
17. Hazır hale gelen DNA kullanılıncaya kadar +4°C de saklanır. (Basım ve Ersoy 2002)
3.4.4.1. Pseudomonas savastanoi pv. savastanoi’ nın DNA amplifikasyonu için spesifik primerlerin kullanımı
3.4.4.1.1. ĐAAL geni için spesifik primer kullanımı
PCR çalışmalarında P. s. pv. savastaoi’nin spesifik iaal geninin amplifikasyonu için; IAALF (5’-GGCACCAGCGGCAACATCAA-3’) ve
IAALR (5’CGCCCTCGGAACTGCCATAC-3’)