T.C.
DĠCLE ÜNĠVERSĠTESĠ
TIP FAKÜLTESĠ
ĠÇ HASTALIKLARI ANABĠLĠM DALI
ARTERĠYEL VE VENÖZ TROMBOZDA PAI-1
POLĠMORFĠZM SIKLIĞI VE TROMBOZLA ĠLĠġKĠSĠ
UZMANLIK TEZĠ
Dr. Ġkram DURÇ ÖZTÜRK
TEZ DANIġMANI
Prof. Dr. M. Orhan AYYILDIZ
TEġEKKÜR
Bilimsel düĢünme ve çalıĢmayı bizlere öğreten, engin bilgi ve birikimlerini bizimle paylaĢan, bugünlere gelmemizde büyük emeği olan, hekimliği bizlere öğreten değerli hocamız Prof. Dr. Ekrem MÜFTÜOĞLU’ na baĢta olmak üzere, Ġç Hastalıkları A.B.D. BaĢkanımız Prof. Dr. M. Emin YILMAZ’a yetiĢmemde büyük emekleri olan bütün değerli öğretim üyeleri; Prof. Dr. Orhan AYYILDIZ, Prof. Dr. Vedat GÖRAL, Prof. Dr. Abdurrahman IġIKDOĞAN, Prof. Dr. Kendal YALÇIN, Prof. Dr. Dr. Alpaslan TUZCU, Doç. Dr. Muhsin KAYA, Doç. Dr. Ali Kemal KADĠROĞLU, Yrd. Doç. Dr. Hasan KAYABAġI, Yrd. Doç. Dr. M.Ali KAPLAN, Yrd.Doç.Dr. Ali ĠNAL, Uz.Dr. YaĢar YILDIRIM, Uz Dr. Remzi BEġTAġ, Uz. Dr. CoĢkun BEYAZ, Uz. Dr. Feyzullah UÇMAK, Uz. Dr. Mehmet KÜÇÜKÖNER, Uz.Dr. Faruk KILINÇ’a teĢekkürlerimi sunuyorum.
Tezimin her aĢamasında yardımlarını esirgemeyen sayın Prof. Dr. Orhan AYYILDIZ, Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.B.D, Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D, Göğüs Hastalıkları ve Tüberküloz A.B.D, Radyoloji A.B.D baĢkanlarına ve değerli öğretim üyelerine, Hematoloji Labaratuarı çalıĢanlarına,
Birlikte çalıĢmaktan her zaman büyük mutluluk ve onur duyduğum tüm asistan arkadaĢlarıma ve Ġç Hastalıkları A.B.D çalıĢanlarına,
Asistanlık süresi boyunca desteklerini esirgemeyen sevgili ailem ve sevgili dostlarıma teĢekkürlerimi sunuyorum.
ĠÇĠNDEKĠLER Bölüm Sayfa No TEŞEKKÜR
1 İÇİNDEKİLER 2 SİMGELER KISALTMALAR 4 ŞEKİLLER VE TABLOLAR 5 1. GİRİŞ VE AMAÇ 6 2. GENEL BİLGİLER 7 2.1. Kan 7 2.2. Hemostaz 7 2.2.1. Vasküler Endotel 8 2.2.2. Trombositler 11 2.2.3. Koagülasyon sistemi 13 2.2.3.1. Pıhtılaşma Faktörleri 13
2.2.3.2. Pıhtılaşma Faktörlerinin Sınıflandırılması 16
2.2.3.3. K Vitaminine Bağımlı Faktörler 17
2.2.3.4. Trombine Duyarlı Faktörler 20
2.2.3.5. Kontakt Faktörleri 21
2.2.3.6. Fosfolipidler ve Kalsiyum İyonları 23
2.2.3.7. Koagülasyon İnhibitörleri (Antikoagülan Proteinler) 23
2.2.3.8. Pıhtılaşma Mekanizması 25
2.2.3.9. Pıhtılaşma Reaksiyonlarının Denetimi 28
2.2.4. Fibrinolitik sistem 28
2.2.4.1. Plazminojen Aktivatör İnhibitör-1 (PAI-1) 29
2.3. Tromboz 31
2.3.1. Arteriyel Tromboz 33
2.3.2. Venöz Tromboz 33
2.3.3. Edinsel Tromboz Nedenleri 34
2.3.4. Kalıtsal Tromboz Nedenleri 34
2.3.4.1. Faktör V Leiden Mutasyonu (APC Direnci) 37
2.3.4.3. Protein C Eksikliği 38 2.3.4.4. Protein S Eksikliği 39 2.3.4.5. Antitrombin Eksikliği 41
2.2.4.6. Hiperhomosisteinemi 42
2.3.4.7. Faktör VIII Yüksekliği 43
2.3.4.8. Fibrinojen Gen Mutasyonu 44 2.3.4.9. Faktör XIII Gen Mutasyonu 44 2.3.4.10. Plazminojen Aktivatör İnhibitör 1 (PAI-1) Gen Poliformizmi 45
3. GEREÇ VE YÖNTEM 50 4. BULGULAR 52 5. TARTIŞMA 56 6. ÖZET 61 7. SUMMARY 67 8. KAYNAKLAR 68
SĠMGELER VE KISALTMALAR
µm: Mikrometre
ATIII: Antitrombin III
T-PA: Doku plazminojen aktivatörü PAI-1: Plazminojen aktivatör inhibitörü-1 APTT: Aktiflenmis kısmi tromboplastin zamanı
PGI2: Prostasiklin
vWf: Von Willibrand Factor RES: Retikülo Endotelyal Sistem TF: Tissue factor (doku faktörü)
HMWK: Yüksek Molekül Agırlıklı Kininojen PTT: Kısmi tromboplastin zamanı
TFPI: Tissue factor pathway inhibitör
PK: Prekallikrein
TFPI: Doku faktörü yolu inhibitörü
D: Dalton
DVT: Derin ven trombozu
F V: Faktör V
F VIIIa: Faktör VIIIa
GIa: Gama – karboksi glutamik asit MTHFR: Metilentetrahidrofolat redüktaz 5,10-metilen THF: 5,10 metilentetrahidrofolat 5- metil THF: 5-metil tetrahidrofolat
PC: Protein C
PCR: Polimeraz zincir reaksiyonu
PS: Protein S
RFLP: Restriksiyon fragment uzunluk polimorfizmi
VTE: Venöz tromboembolizm
ġEKĠLLER
ġekil 1: Hemostaz 9
ġekil 2: Protein C Mekanizması 19
ġekil 3: Fibrin oluşumu 25
ġekil 4: Koagulasyon sisteminin aktivasyonu 27
ġekil 5: Fibrinolitik yolların aktivasyonu ve inhibisyonu 29
ġekil 6: Plasminojen aktivatör inhibitör-1 „in yapısı 30
TABLOLAR Tablo 1: Kan koagülasyon proteinlerinin adlandırılması ve özellikleri 15
Tablo 2: Pıhtılaşma işlevi 16
Tablo 3: Toplumda belli bir sıklığa ulaşabilen primer trombofili nedenleri 35
Tablo 4: Nadir rastlanan primer trombofili nedenleri 36
Tablo 5: Sekonder trombofili nedenleri 36
Tablo 6: Protein C ve protein S eksikliği tipleri,şekilleri ve klinik tipleri 40
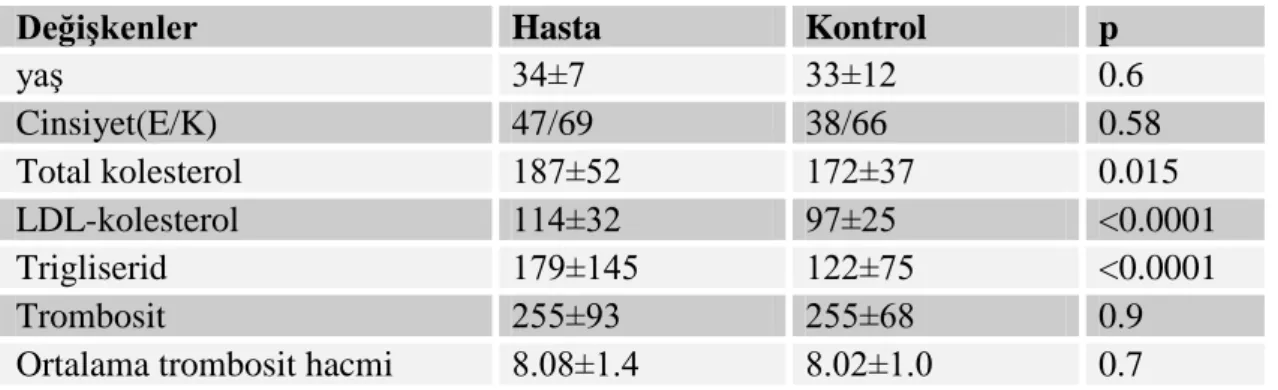
Tablo 7: Çalışmaya alınan hasta ve kontrol grubunun demografik özellikler 52
Tablo 8: Çalışma hastalarının tanılarına göre dağılımı 52
Tablo 9: Çalışma ve kontrol grubunun PAI polimorfizminine göre dağılımı 53
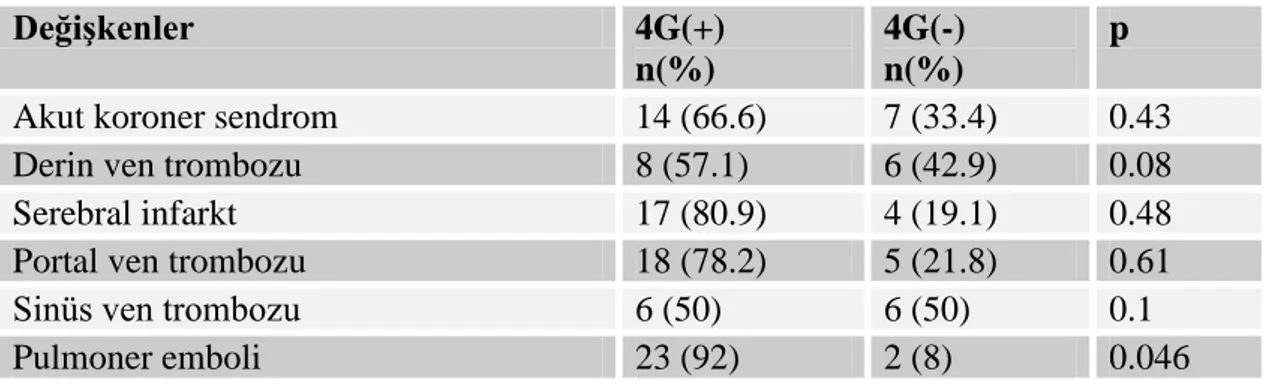
Tablo 10: Çalışmaya alınan tüm bireylerin 4G alel taşıyıcılığına göre dağılımı 53 Tablo 11: Akut trombozlu hastaların PAİ polimorfizmine göre dağılımı 54
Tablo 12: Akut trombozlu hastaların 4G allel taşıyıcılığına göre dağılımı 54
Tablo 13: Arteriyel ve venöz trombozlarda polimorfizm dağılımı 55 Tablo 14: Arteriyel ve venöz trombozlarda 4G allel taşıyıcılığı yaygınlığı 55
1.GĠRĠġ VE AMAÇ
Tromboz toplumda sık görülen multifaktöriyel bir hastalıktır. Erişkinlerde insidansı yaklaşık %1 iken, çocuklarda bu oran yılda 1/100.000 olarak belirtilmiştir. Tüm dünyada en önemli morbidite ve mortalite nedenlerinden biri olarak kabul edilen trombotik hastalıkların gelişimi multifaktöriyel olup çok sayıda edinsel ve kalıtsal faktörün değişik mekanizmalarla bu gelişime katkıda bulunduğu bilinmektedir.
Trombotik olay gelişme biçimi bakımından iki şekilde sınıflandırılabilir: venöz sistemde düşük kan akımı ve kan basıncı; veya arteryal sistemde yüksek kan akımı ve kan basıncı. Arteryel ve venöz trombüs arasındaki temel ayrım, trombüsün içerdiği kompozisyona ( arteryel platelet bakımından, venöz ise fibrin bakımından zengindir) ve damar duvar hasarının var olup olmadığına (arteryel trombüslerde gözlenir) göre yapılır. Tromboz gelişiminde, arteriyel ve venöz sistemde farklı etiyolojilerin rol oynadığı düşünülmektedir. Arteriyel sistemde endotel hasarı ve trombosit fonksiyon bozukluklarının tromboz gelişimine neden olduğu bilinmektedir. Kalıtsal venöz trombozda ise çoğunlukla pıhtılaşma sistemini kontrol eden doğal inhibitör mekanizma bozukluklarının rol oynadığı gösterilmiştir.
Tromboz etiyolojisi karmaşık olup genelde birden fazla faktör içerir. Çoğu kez kalıtsal ve çevresel risk faktörlerinin etkileşimi sonucu ortaya çıkar. Çevresel faktörler, cerrahi müdahale, obezite, cinsiyet, uzun süre hareketsiz kalmak, oral kontraseptif kullanımı ve hamilelik gibi doğrudan risk faktörleriyle bağlantılı ve yaşla artan bir insidans gösterir.Tromboza zemin hazırlayan çesitli kalıtsal faktörler, protein C eksikliği, antitrombin III eksikliği, protein S eksikliği, aktive protein C rezistansı(faktör V Leiden mutasyonu), protrombin G20210A mutasyonu, hiperhomosisteinemi, fibrinojen defektleri, plazminojen aktivatör inhibitörü-1 gen polimorfizmi, plazminojen eksikliği, trombomodulin gen mutasyonları, plazma proteinlerindeki anormalliklerdir. Plazminojen aktivatör inhibitörü-1 (PAI-1) 379 aminoasitten oluşan tek zincirli 52 kDA ağırlığında bir glikoproteindir ve doğal fibrinolitik sistemin endojen bir inhibitörü olarak görev yapmaktadır. PAI–1 ile ilgili 4G/5G gen polimorfizmi en sık görülen polimorfizmdir.
Çalışmamızda hastanemize başvuran arteriyel ve venöz trombozlu hastalarda PAI-1 4G/5G, PAI-1 4G/4G, 5G/5G gen polimorfizm sıklığını araştırdık.
2.GENEL BĠLGĠLER
2.1. KAN
Normal koşullarda kan, damar içinde sıvı halde bulunan bir dokudur. Metabolizma, gaz transportu, hormonlar yoluyla hücresel iletişim ve immün savunma dahil pek çok fizyolojik olayda kilit rol oynar. Ortalama bir kişinin kilogram başına yaklaşık 70 ml (70 ml/kg) kanı vardır (1, 2).
Kan hacminin neredeyse %50-60‟ı sıvı, geri kalanı ise hücrelerden oluşmaktadır. Plazma adı verilen sıvı bileşenin yaklasık %90‟ı su; geri kalan %10‟luk kısmı ise glukoz, aminoasitler ve diğer metabolitler, iyonlar, çeşitli protein ve hormonlar tarafından oluşturulur. Serum; plazmanın, koagülasyon faktörleri ve fibrinojenin uzaklaştırılmasından sonra geriye kalan kısmıdır (2, 3).
Kan, görev aldığı fizyolojik olayları yerine getirebilmek için nonkoagüle yani sıvı halini sürdürmek zorundadır. Damar sisteminde akışkanlığı sağlayan etkenler; damar sisteminin kasılabilir olması, göğüs boşluğundaki negatif basınç (emici güç), kalbin pompalama gücü ve venöz damarlarda kanın geri dönmesini engelleyen kapakçıklar olarak sayılabilir. Bunun yanı sıra damarın iç yüzeyinde, endotel hücrelerinin oluşturduğu kaygan yüzey de kanın sıvı halde akmasında önemli bir etkendir (2, 4, 5).
2.2. HEMOSTAZ
Kanın diğer bir hayati fonksiyonu; yaralanmayı takiben vasküler endotel, dolaşan trombositler ve koagülasyon faktörleri denilen kompleks enzim serileri arasındaki etkileşimler yoluyla koagülasyonu sağlamaktır. Damarın herhangi bir nedenle zedelenmesi sonucu oluşabilecek kan kaybının önlenmesi anlamına gelen hemostaz sisteminin iki önemli özelliği vardır (5, 6, 7).
İlk olarak, hemostaz bir fosfolipid yüzey üzerinde işlev görmek üzere tasarlanmıştır. Buna yüzey bağımlılığı denir ve bu sayede pıhtılaşma süreci sadece hasarlanmış bölgeyle sınırlı kalır, tüm dolaşım sistemini etkilemez. Hemostazın ikinci önemli özelliği ise; çok sayıda negatif geri besleme yolları (feedback loop) bulunmasıdır. Hemostazda görev alan her sistem, karşıt işlev gören bir inhibitör sistemle dengelenmiştir. Hatta çoğu kez bir sistem uyarıldığında karşıt sistemini kendi devreye sokar; bu sayede her sistem, karşıt sistemi ile eş zamanlı faaliyete
geçmiş olur. Dolayısıyla kanın pıhtılaşması (hemostaz) ve pıhtının erimesi (fibrinoliz) süreçleri birbiri ile yakından ilişkilidir ve sürekli bir etkileşim halindedir (2, 3, 4).
Hemostaz mekanizması 3 ana elementten oluşur (4): 1.Vasküler Endotel
2.Trombositler
3.Koagülasyon sistemi
2.2.1. Vasküler Endotel
Kan damarlarının çeperi pek çok önemli biyolojik fonksiyona sahip olan endotel hücrelerinin ince bir tabakasından oluşmuştur. 10-15 µm genişliğinde, 20-25 µm uzunluğunda olan endotel hücreleri uzamış nükleusları ile kan damarlarının iç yüzeyinin uzun ekseni boyunca sıralanarak tek katlı bir tabaka oluşturan poligonal hücrelerdir. Bu sayede damar endoteli nontrombojenik bir iç yüzey oluşturduğu gibi, vücudun değişik dokuları ile alısveriş halinde bulunan kan arasında seçici bir geçirgenlik işlevini de üstlenir. Normal koşullarda endotel yüzeyinin sağlam olması ve kanın sürekli akım halinde bulunması, pıhtılaşma sisteminin ve trombositlerin kendiliğinden aktive olmalarını engeller. Fakat travma ve bazı damar hastalıklarında bu yüzeyin bozulmasıyla birlikte koagülasyon sistemi ve trombositleri aktive eden
değişiklikler gözlenmektedir (7, 8, 9).
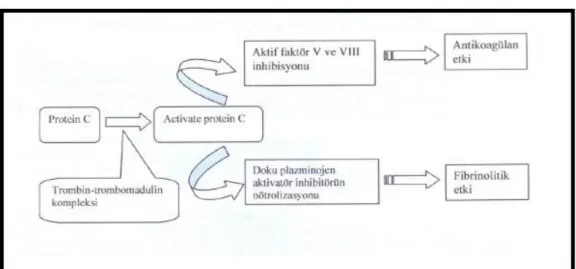
Damar endotel hücrelerinin dış membranı antitrombotik özelliklerden sorumludur. 50-60 angstrom kalınlığında glikokaliks denilen bu proteoglikan tabaka; heparan sülfat, dermatan sülfat ve heparin içerdiğinden dolayı damar endotelinin kana bakan yüzeyinde kaygan bir zemin oluşturur (2, 9, 11). Heparan sülfat, doğal bir antikoagülan olan Antitrombin III(AT-III) plazma proteinini üretir (7, 9). AT-III antikoagülan etkisini fibrinojeni fibrine dönüştürmekten sorumlu enzim olan trombin ve Faktör XIIa, FXIa, FXa, FIXa gibi bazı pıhtılaşma faktörlerini inhibe ederek gösterir (1, 9, 12). Dış membran ayrıca bazı reseptörleri içerir. Trombomodulin böyle bir membran reseptörüdür ve trombinle etkileşerek kuvvetli bir pıhtılaşma inhibitörü olan protein C‟nin aktivasyonunu hızlandırır. Aktif protein C; FV ve FVIII‟i inaktive ederek ve plazminojen aktivatörlerinin konsantrasyonunu arttırır ve trombozu kontrol altına alır (11, 13).
Endotel hücrelerinden sentezlenen protein S de aktif protein C‟nin antikoagülan aktivitesinde kofaktör olarak görev alır (2, 8). Ayrıca aktif protein C, damar endotelini uyararak Doku plazminojen aktivatörünün (t-PA) salgılanmasını sağlar. T-PA, plazminojenin plazmine dönüşmesinde kritik bir maddedir. Plazmin ise fibrinin parçalanmasından sorumlu olan proteolitik bir enzimdir. Plazminojenin plazmine dönüşümünde gerekli olan diğer bir aktivatör ise, endotel hücreleri ve böbrek hücrelerinde sentezlenen ürokinazdır. T-PA‟nın inaktivasyonu ise, yine endotel hücrelerinde sentezlenen ve ürokinazı da nötralize eden plazminojen aktivatör inhibitörü-1(PAI-1) tarafından gerçekleştirilir (7, 14, 15, 16).
Damar endotel hücreleri, kuvvetli bir trombosit antiagreganı ve vazodilatör olan prostasiklini(PGI2) de sentezler ve salgılarlar. Prostasiklin, trombosit aktivasyonunu inhibe eder ve kan damarının çapını arttırarak vazodilatasyonu uyarır. Bunu, trombosit zarında bulunan reseptörlere bağlanarak adenilat siklazı uyarıp trombosit cAMP düzeylerini yükselterek yaparlar. Bu yükselme trombositlerin agregasyonunu, şekil değişikliğini, kollajen ve von Willebrand faktörüne bağlanmasını yani trombüs oluşumunu engelleyici bir rol üstlenir (7, 11, 13, 17). Damar endotel hücreleri, faktör VIII‟i (FVIII) de kısmen sentezler. Dolaşan FVIII molekülü; bimoleküler bir kompleks yapı olup, prokoagülan özelliği vardır ve von Willebrand faktör (vWF) adını alır. Aktif trombositlerin membranı üzerinde özgün bir reseptörle etkileşerek, bunların subendotel bileşenlerine ve kollajene
adezyonunu kolaylaştıran von Willebrand faktörü hemostazda kritik rol oynar (7, 8, 17).
Endotel hücreleri ayrıca, hemostazda önemli diğer maddeleri de üretirler. Bunlar arasında, travma sonrası hasarlı subendotel ile trombositlerin etkileşiminde önemli olan kollajen tip IV gibi moleküller sayılabilir. Endotelde meydana gelecek bir hasar sonucu; nontrombojenik yüzeyin ortadan kalkmasıyla birlikte ortaya çıkan subendoteldeki kollajen lifleri, trombosit adezyonuna ve agregasyonuna neden olur (7, 18).
Aktive olmuş trombositlerden salınan ADP ve tromboksan, çevredeki diğer trombositleri de aktive ederek trombosit tıkacının büyümesini sağlar. Ayrıca subendoteldeki kollajen liflerinin aktive ettiği faktör XII, trombosit yüzeyinde aktive olan faktör XI ve haraplanmış endotel hücrelerinden salınan bir doku faktörü; koagülasyon mekanizmasını başlatır. Fibronektin gibi nonkollajen tipte proteinler de hücre aglutinasyonu, agregasyonu ve adezyonunda rol oynarlar (7, 9, 11, 12, 18).
2.2.2. Trombositler
Dolaşımdaki trombositler hemostazın sürdürülmesinde ana elementlerdir. Fonksiyonları, travma sonrası değişik endotelyal yapılarla etkileşim üzerine odaklanmıştır. 2-4µm çapında, yuvarlak ya da oval şekilli küçük hücreler olan trombositler, kemik iliği veya diğer hematopoietik yerlerde megakaryosit adı verilen dev öncü elementlerin fragmantasyonuyla oluşurlar. Trombositlerin çekirdeği yoktur ve hücre gelişiminin son aşamasını temsil ederler. Kandaki normal sayıları 150.000-350.000/mm3 „tür (19, 20).
Çift katlı lipid tabakasından olusan trombosit membranı glikokaliksle kaplıdır. Fonksiyonel önemi olan proteinler, bu çift katlı lipid tabakası içine gömülüdür. Hücre membranına yakın bölgelerde kanallar sistemi, endoplazmik retikulum artıkları, daha iç bölgede farklı yoğunlukta granüller bulunur. Mitokondriden zengin hücreler olup, endoplazmik retikulum ve golgi aygıtında çesitli enzimlerin sentezini gerçekleştirir ve bol miktarda Ca++ depo ederler. Sitoplazmalarında bulunan trombastenin, aktin, miyozin gibi kasılabilir proteinler sayesinde şekil değiştirebilir, kasılabilir, salgı yapabilir ve bir yere veya başka bir trombosite bağlanabilirler (20, 21).
Trombositlerde; lizozimler, α-granüller ve yoğun cisimcikler olmak üzere üç tip salgı granülü bulunur. Lizozimlerde asit hidrolazlar; α-granüllerde ise heparini nötralize eden trombosit faktör 4 (PF4), beta-tromboglobulin (ß-TG), fibrinojen, FV, Faktör VIII: von Willebrand faktörü (FVIII: vWF) ve çeşitli büyüme faktörleri gibi trombositlere özgü proteinler bulunur. Başlıca büyüme faktörleri; trombosit kökenli büyüme faktörü (PDGF), transforme edici büyüme faktörü-beta (TGF-ß) ve endotel hücresi büyüme faktörüdür (ECGF). Yoğun cisimcikler ise, trombositlerin metabolizmasıyla ilişkili maddeler içerirler. Ayrıca ADP ve ATP gibi nükleotid öncü depolarına sahiptirler. Bu nükleotid öncüleri, gerekli enerjinin oluşumu ve membran aktivitesini sağlarlar (6, 22, 23, 24).
Dolaşımdaki trombositler, bir damarın endotel örtüsünde herhangi bir hasar olmadıkça, endotele ve birbirlerine yapışmadan hareket ederler. Normalde insan trombositi kanda yaklaşık 10 gün dolaşır ve sonra Retikülo Endotelyal Sistem (RES) tarafından kaldırılır. Ancak travma veya bazı kan hastalıkları sonucu olusan vasküler hasar, trombosit cevabı denilen bir dizi olayı başlatır. Kollajen, elastik doku gibi belirli subendotel yapılarla birleşen damar endotel hücrelerinin hasarı trombosit adezyonunu uyarır. Trombosit adezyonu, damar çeperinde bulunan vWF‟ünün, trombosit membranı üzerinde glikoprotein1b (GP1b) reseptörü ile etkileşmesi sayesinde düzenlenir. Adhere olmuş trombositler, salgılama reaksiyonunu kolaylaştıran bir biçim değisikliğine uğrar; α-granüller ve yoğun cisimcikler, yüzey sistemi içine bileşenlerini salarlar ve bu bileşenler trombosit membranlarının iç kısmına ve çevresine yerleşir. Yoğun cisimciklerden salınan Ca++, koagülasyon
sistemi için gereklidir. ADP ve kuvvetli bir vazokonstriktör olan tromboksan A2
(TXA2), trombosit agregasyonunun tetiklenmesinde kritik bir rol oynar. Agregasyon,
trombosit ya da hemostatik tıkacın oluşumuyla sonuçlanır ve değişiklikler, koagülasyon faktörlerinin fibrin oluşturmak için etkileşeceği yüzeye destek verir. Damardaki hasar küçük ise, trombosit tıkacı tek başına kan kaybını tamamen durdurabilir; geniş ise trombosit tıkacına ek olarak kan pıhtısı da gereklidir (6, 10, 20, 23, 24).
2.2.3. Koagülasyon sistemi
2.2.3.1. PıhtılaĢma Faktörleri
Pıhtılaşma faktörleri sisteminde birbirlerinin aktivasyonunu ya da inhibisyonunu kontrol eden çok sayıda protein görev alır. Pıhtılaşma mekanizmaları ilk defa 1964 yılında iki farklı araştırma grubu tarafından ortaya atılan kaskad hipotezi ile anlaşılmaya başlamıştır.
Pıhtılaşma faktörleri merkezde protein bir kor ve çevresinde sialik asit rezidüleri içeren yan zincirlerden oluşmuş glikoproteinlerdir. Tüm faktörler normal koşullarda inaktiftir. Aktifleştikleri zaman Faktör XII, Faktör XI, Faktör IX, Faktör X ve protrombin (serin proteazlar) proteolitik enzim özelliği kazanırken Faktör VIII ve Faktör V bu proteoliz reaksiyonlarından bazılarını katalize eden kofaktörlere dönşürler. Aktifleştiğinde proteolitik özellik kazanan faktörler, diğer faktörlerin aktivasyonuna neden olan reaksiyonu katalize ederler. Sonuçta bir faktör aktifleşmeden önce bir reaksiyonda substrat iken, aktifleştikten sonra başka bir reaksiyonun enzimi haline gelir. Normalde dolaşımda bulunmayan tek faktör olan doku faktörünün (tissue factor, TF) aktifleşmesi gerekmez, endotel zedelenmesini takiben subendotelyal dokulardan çıktığı anda aktiftir. TF‟de Faktör VIIa ve Faktör Va gibi proteolitik enzim değil enzim kofaktörüdür. Pıhtılaşma reaksiyonlarının bazılarında bu faktörler dışında kalsiyum ve fosfolipitler de gereklidir (25,26).
Karaciğer hemostazda merkezi bir rol oynar. Karaciğer parankim hücreleri çoğu koagülasyon proteininin, koagülasyonun fizyolojik inhibitörlerinin birçoğunun ve fibrinolitik sistemin ana komponentlerinin sentez yeridir. Aynı zamanda karaciğer aktive pıhtılaşma faktörlerini ve plazminojen aktivatörlerini sistemik dolaşımdan temizleyerek hem hemostazı hem de fibrinolizi düzenler (27, 28). 1964 yılında öne sürülen kaskad hipotezine göre Faktör XII aktivasyonu ile başlayan kontakt (intrensek) yol ve subendotelyal bölgeden açığa çıkan TF ile başlayan doku faktörü (ekstrensek) yolundaki reaksiyon dizileri sonucunda iki yolun son ürünleri Faktör X‟un aktivasyonunu sağlar ve bundan sonra ortak olarak devam eden yol, trombin ve fibrin oluşumu ile biter.
Faktör III birdoku faktörüdür, plazmada bulunmaz. Faktör IV, Ca++ iyonudur. Diğer faktörler protein yapısındadır. Faktörlerin numaraları bulunuş sıralarına göre verilmiştir. Daha önce Faktör VI olarak numaralandırılan faktör,
Faktör V‟ in aktif şekli olduğundan listeden çıkarılmıştır. Son keşfedilen prekallikrein (Fletcher faktörü) ve yüksek molekül ağırlıklı kininojen (Fitzgerald faktörü) için numara verilmemiştir.
Faktör VIII dışındaki tüm pıhtılaşma faktörlerinin başlıca yapım yeri karaciğer parankim hücresidir. Kompleks bir molekül olan Faktör VIII‟in yalnız pıhtılaşma aktivitesi gösteren ve Faktör VIII: koagülan protein (VIII: C) olarak adlandırılan parçasının karaciğerde yapıldığı, diğer parçasını oluşturan ve multimerik yapıda bir glikoprotein olan von Willibrand Faktörünün ise başlıca endotel hücrelerinde ayrıca megakaryositlerde sentez edildiği gösterilmiştir. vWf multimerlerinin en önemli işlevlerinden biri FVIII‟in stabilizasyonunu ve dolaşımda taşınmasını sağlamak ve trombositlerin endotel altı dokuya adezyonuna yardım etmektir. Faktör II, VII, IX, X karaciğerde sentezleri sırasında K vitaminine ihtiyaç gösteren proteinlerdir. K vitamini bu proteinlerdeki glutamik asit rezidülerinin karboksilasyonunu sağlar. Böylece bu faktörler kalsiyum aracılığıyla fosfolipid yüzeylere tutunabilme yeteneği kazanırlar (25).
Plazmatik faktörler dışında pıhtılaşma reaksiyonları için gerekli fosfolipid yüzeyleri intrensek pıhtılaşma yolunda trombosit faktör 3, ekstrensek pıhtılaşma yolunda ise doku faktörü III (TFIII) tarafından sağlanır. Doku faktörü hücre membranlarının hemen tamamında bulunan glikoprotein-fosfolipid kompleksidir. Plazmayla temas eden kan hücrelerinin ve endotelin yüzeyinde bulunmaz. Monosit ve endotel hücrelerinin inflamatuar sitokinlerle uyarılması bu hücrelerde doku faktörünün indüklenmesine yol açar (25, 26).
Tablo 2: Pıhtılaşma işlevi(27)
2.2.3.2. PıhtılaĢma Faktörlerinin Sınıflandırılması
A- K Vitaminine Bağımlı Faktörler
1. Faktör II (Protrombin) 4. Faktör X
2. Faktör VII 5. Protein C
3. Faktör IX 6. Protein S
B- Trombine Duyarlı Faktörler
1. Faktör I (fibrinojen) 3. Faktör VIII
2. Faktör V 4. Faktör XIII
C- Kontakt Faktörleri 1. Faktör XII
2. Faktör XI
3. Yüksek Molekül Agırlıklı Kininojen (HMWK)
4. Prekallikrein
D- Fosfolipidler ve Kalsiyum iyonları E- Koagülasyon inhibitörleri (29)
2.2.3.3. K Vitaminine Bağımlı Faktörler
1) Faktör II (Protrombin) : Protrombin 72.000 Dalton molekül ağırlıklı bir proteindir. Yarı ömrü invivo olarak 79 – 96 saat arasında değişir. Protrombin, plazma konsantrasyonu en yüksek olan K vitaminine bağımlı bir protein olup, yapısal olarak başlıca iki bölgeye ayrılabilir. Bunlardan ilki 274 aminoasitten meydana gelen ve iki oligosakkarit tasıyan “pro” kısmı, diğeri ise 304 aminoasitten oluşan ve tek bir oligosakkarit zinciri taşıyan “trombine dönüşen kısım – pretrombin 2‟ dir (29). Pro kısmında yapısal olarak birbirine benzeyen, fakat fonksiyonel olarak farklı iki bölge vardır: 1-156. aminoasitler arasındaki bölge = protrombin fragman 1 ve 157 – 274. aminoasitler arasındaki bölge = protrombin fragman 2 olarak adlandırılır. Bu iki bölge üçlü disülfit bağları tasır ve ilmik bölgesi adını alır. Her biri ilmiğe benzediği için, bu şekilde adlandırılmıştır. Her iki bölgenin tersiyer yapıları birbirine çok benzer ancak primer yapılarındaki aminoasit dizileri çok farklıdır.(29) Fragman 1‟in aminotermal ucundaki 40 aminoasitlik dizisi ise ayrı bir bölge oluşturur. Bu bölge 10 adet gama–karboksi glutamik asit (GIa) ihtiva eder ve bunların 6 tanesi diğer K vitaminine bağımlı proteinlerde olduğu gibi çift yerleşim gösterir. Bu bölge GIa bölgesi olarak adlandırılır. Trombine dönüsen kısım (Protrombin 2)‟da 2 bölgeden meydana gelir: A ve B bölgesi. Trombinin aktif bölgesi B zincirindedir. Trombin bir disülfit köprüsü taşır ve çift zincirlidir. Bu molekül proteolitik aktiviteye sahiptir. Protrombinin fizyolojik aktivasyonu faktör Xa ve Va tarafından aktive edilir (29). 2) Faktör VII: Faktör VII, doku faktörü aracılığıyla pıhtılaşmayı başlatan ve molekül ağırlığı 45.000 – 54.000 D olan bir glikoproteindir. Faktör VIIa, faktör IX ve Faktör X‟u aktifleştirir. Yarılanma ömrü 2 – 6 saattir. Aktifleşme sırasında faktör VII, birbirine disülfit köprüsü ile bağlı çift zincirli bir yapı kazanır, bir aktivasyon peptidi ayrılmaz. Bu yapıda molekül ağırlığı 29500 D olan ağır zincir aktif bölgeyi içerir. NH2 – terminal bölgesinde meydana gelen ve molekül ağırlığı 2900 D olan hafif zincir ise K vitaminine bağımlı degişikliklere sahiptir (29).
3. Faktör IX: Faktör IX, molekül ağırlığı 55000 D olan bir glikoproteindir. Yarılanma ömrü 20 – 30 saattir. Molekül yapısı diğer K vitaminine bağımlı pıhtılaşma faktörlerine çok benzediği için saflaştırılması güçtür. İlk kez 1950 yılında Aggler ve arkadasları tarafından kısmi olarak saflaştırılmıştır. Faktör IX, sadece faktör XIa ile değil, doku faktörü ve faktör VIIa ile de aktifleşebilir. Fakat reaksiyon
hızı, aynı faktörlerin faktör X‟u aktive etmelerine göre 6–7 defa daha yavaş olup aktivasyonun fizyolojik önemi bilinmemektedir (30).
4. Faktör X: Faktör X, hem intrensek hemde ekstrensek yolun bir substratıdır. Molekül ağırlığı 55000 D, plazma yarılanma ömrü ise 20 – 40 saattir. Bu faktör diğer K vitaminine bağımlı faktörlerin aksine inaktif şeklinde de çift zincirlidir. Faktör X, faktör IXa, faktör VIIIa, Ca++ ve fosfolipid varlığında aktifleşir (30, 31).
5. Protein C: İlk kez 1960‟da bulunan K vitamine bağımlı bir protein olan protein C (PC), pıhtılaşma sisteminin önemli bir inhibitörüdür. Karaciğerde yapılan PC‟nin molekül ağırlığı 60 000 D kadardır (32). Plazmada yarı ömrü 8 – 10 saattir. Protein C dolaşımda zimo halde bulunduğundan aktive olmadıkça antikoagülan etki göstermez (33).
Koagülasyon sırasında ortaya çıkan trombin damar endotel hücrelerinin yüzeyindeki trombomoduline bağlanınca protein C aktivasyonu başlar. Aktive protein C‟nin (APC) antikoagülan ve profibrinolitik özellikleri vardır. APC antikoagülan etkisini proteoliz ile FVIIIa ve FVa‟yı inaktive ederek yapar. APC‟nin antienflamatuar etkisi ise mekanizması tam anlaşılmamış bir yoldan plazminojen aktivatör inhibitörü –1 (PAI–1)‟ i nötralize etmesine bağlıdır. APC‟nin profibrinolitik etkisi de vardır. Normalde plazma APC düzeyleri çok düsüktür, ancak trombojenik stimulus ile artar. Dolasımdaki aktivitesinin yarı ömrü 15 – 20 dakika kadardır. APC primer olarak protein C inhibitörü (PAI – 3) ve daha az miktarda α1-Proteinaz inhibitör ve α2 makroglobulin ile inhibe edilir (34).
1993‟de Dahlback tarafından aktive protein C resistansı tanımlanmıştır. Dahlbäck, derin ven tromboz vakalarının % 20‟ sinde ve ailesel venöz tromboz vakaların % 50‟sinde aktive protein C rezistansını saptamıştır. Kalıtsal koagülasyon defektleri içinde en sık sebep faktör V leiden mutasyonudur. Bu mutasyona bağlı olarak da aktif protein C rezistansı meydana gelir (35). Protein C geni kromozom 2q14-21‟de bulunmakta olup, 11 kb uzunluğunda, 9 ekzon ve 8 introndan oluşmaktadır (36).
ġekil 2: ProteinC Etki Mekanizması
6. Protein S: Molekül ağırlıgı 70 000 D olan K vitaminine bağımlı bir proteindir (35). 1977‟de Di Scipio ve arkadaşları tarafından tanımlanmıstır. Protein S, dolasımda hem serbest hem de bağlı olarak bulunur. Bağlı sekil C4b- bağlayıcı proteinle kompleks halindedir ve fizyolojik olarak aktif değildir. Protein S bir proteaz değildir. NH2 - terminal ucunda 11 GIa ihtiva eder (34). PC‟nin FVa ve FVIIIa‟yı inaktive ettiği reaksiyonların kofaktörüdür. PS, normalde plazmada ve plateletlerin granüllerinde bulunur (37).Protein S, APC‟nin FVIIIa ve FVa üzerindeki etkisini arttırır. Hepatositlerde, endotel hücrelerinde ve nöral tümör hücrelerinde yapılır. Plazma yarı ömrü 42 saattir. Plazmada Protein S‟nin %60‟ı 1:1 oranında C4b-bağlayan proteine (C4b- BP) bağlı olarak bulunur. C4b- BP bir akut faz reaktanı olup, klasik kompleman yolunda negatif regülatördür. Plazma protein S düzeyini hem C4b-BP düzeyi hem de protein S molekülünü birkaç yerinden parçalayan trombin düzeyi belirler (34).
Protein S molekülü trombin ile parçalanır ve proteinin Ca++ bağlama özellikleri değişir, fosfolipid bağlayamaz ve protein C‟nin kofaktörü olarak görev yapamaz (38). Protein-C ve protein-S aktifleşmiş protein-C‟yi içeren doğal antikoagülan sisteminin merkezinde yer alır. Bu sistem sadece pıhtılaşmayı önlemekle kalmaz, aynı zamanda fibrinolizi artırır. Trombin; endotel yüzeyinde trombomodülünün varlığında, prokoagülan aktivitesinin nötralize edildiği ve protein-C‟ yi aktifleştirme yeteneğinin arttığı bir kompleks olusturur. Bir kofaktör olan protein-S ile birlikte aktifleşmiş protein-C, faktör V ve VIII‟i inaktive ederek
trombin oluşumunu engeller. Aktifleşmiş protein-C aynı zamanda fibrinolizi de uyarır (Sekil 2). Bunu kısmen doku plazminogen aktifleştiricisinin önemli bir inhibitörünü nötralize etmek suretiyle yapar (34) . Kısmi protein-C eksikliği olan heterozigot olgularda genellikle adolesan çağda veya genç erişkin dönemde tromboembolik fenomen ortaya çıkarmaktadır (39, 40). Protein-S eksikliği de heterozigotlarda tromboemboliye yol açar. Protein-C veya protein-S eksiklikleri derin ven trombozu için önemli bir risk faktörüdür (40). Protein S geni kromozom 3p11.1-11.2‟ de bulunmakta olup, 80 kb uzunlugunda, 15 ekzon ve 14 introndan oluşmaktadır (36).
2.2.3.4. Trombine Duyarlı Faktörler
1. Faktör I (Fibrinojen): Fibrinojen, plazmada yüksek konsantrasyonda bulunan bir pıhtılaşma faktörüdür. Bu protein 340.000 Dalton molekül ağırlığındadır ve biyolojik yarılanma ömrü 100 saat dolayındadır (31). Fibrinojen yapısal olarak disulfid köprüleri ile kovalent bağlarla bir arada tutulan büyük bir moleküldür. Simetrik yarı moleküllerin her biri Aα , Bβ ve γ adını alan üç değisik polipeptid zincirini içeren bir küme olusturur. İki yarı molekül merkezi amino terminal bölgede anti paralel bir tarzda zincirler arası üç disulfid köprü ile birbirine bağlanır. Bunlardan ikisi γ zincirleri diğeri ise α zinciri arasındadır. Bβ ve γ zincirleri asparjin bağlı kompleks oligosakkaritler tasırlar. Bu zincirlerin üçü de karaciğerde sentezlenir. İlişkili olan genlerin üçü aynı kromozom üzerinde bulunur.
İnsanlarda bu kromozomların ifadeleri birbirleri ile uyumlu olacak tarzda düzenlenir. 6 adet zincirin amino terminal bölgeleri bir takım disülfid bağları tarafından birbirleri ile yakın konumda tutulurken buna karsılık karboksi terminal bölgeleri birbirlerinden açılarak asimetrik olarak uzanmıs bir molekül yapısının gelismesine yol açmaktadır. Zincirlerin amino terminal uçlarında yer alan sırası ile fibrinopeptid A ve fibrinopeptid B olarak isimlendirilmis bölümleri tirozin sülfatın yanı sıra aspartat ve glutamat kalıntılarının varlığı nedeniyle aşırı negatif yükler taşır. Bu negatif yükler plazmada fibrinojenin çözünürlülüğüne katkıda bulunur. Aynı zamanda fibrinojen moleküllerinin elektrostatik olarak birbirlerini uzaklaştırmalarına neden olarak agregasyonu engellemeye yardımcı olur (25). Bu molekül trombin ve
plazmin tarafından parçalanır. Trombin fibrinojenden fibrinopeptid A ve B oluşumunu indükler (31).
2. Faktör V: Bu protein 600.000 D molekül ağırlığındadır. Plazma ve trombosit granüllerinde bulunur. İnvivo yarı ömrü 12-15 saat arasındadır. Trombinin etkisi altında aktive edilir ve sonunda yine trombin ile inaktive edilir. Aktif protein C, Faktör V‟in fizyolojik inhibitörüdür.
Faktör V, Faktör Xa için kofaktördür. Fosfolipid ve Ca++ ile birlikte faktör II‟nin aktivasyonundan sorumludur. Faktör X‟un trombosit membranı üzerinde toplanmasını kolaylaştırır (32).
3. Faktör VIII: Faktör VIII 1 milyon Daltondan fazla molekül ağırlıklı bir glikoproteindir. Bu faktörün karbonhidrat kısmı onun koagülan aktivitesi için değil, trombosit bağlayıcı özellikleri için önemlidir. Faktör VIII kompleksi koagülan aktiviteye sahip düşük bir moleküler fraksiyon (Faktör VIIIC) ve von Willebrand aktivitesi gösteren yüksek bir moleküler fraksiyondan yapılıdır (Faktör VIII: VWF). Bu fraksiyonlar birbirine nonkovalent bağlarla tutturulur. Faktör VIII‟in “koagülan aktivite fraksiyonu” (faktör VIIIC) önce trombin ile aktive edilir, sonra inaktive edilir. Bu fraksiyon aynı sekilde plazmin tarafından da inaktive edilir. VWF Faktör VIII‟in plazmada taşınmasını sağlar ve trombositlerin kollajene bağlanmasında köprü görevi yapar (29).
4. Faktör XIII: Faktör XIII, 300.000 D molekül ağırlığında biyolojik yarılanma ömrü 100 saat dolayında olan bir proteindir. Bu molekül eş olmayan iki çift polipeptid zincirinden yapılmıştır. Faktör XIII, Ca++ varlığında trombin tarafından aktive edilir. Bundan başka yılan zehirleri, tripsin ve papain gibi proteazlar faktör XIII‟ü aktive edilebilir. Bu reaksiyonlar B zincir çiftinin yıkılmasını içerir. B zincir çift enzimatik olarak aktif kısımdır. Faktör XIIIa, bir fibrin monomer zincirinin glutamin bölgesi ile ikinci bir fibrin zincirinin lizin bölgesi arasında peptid bağlarının oluşumunu sağlar. Böylece fibrin enine bağlanır ve stabilize edilir (29).
2.2.3.5. Kontakt Faktörleri
Kontakt faktörleri: Faktör XII, Faktör XI, yüksek molekül ağırlıklı kininojen (NMWK)ve kallikreindir. Kontakt faktörler intrensek pıhtılaşma sisteminin ilk aktivasyon fazı sırasında (-) elektrik yüklü yüzeylere bağlanırlar. Böyle yüzeyler bazal membranlar, fosfolipitler, kollajen ve trombositlerdir. Kontakt faktörleri sadece
pıhtılaşma işleminin aktivasyonunda değil, ayrıca fibrinoliz, kinin ve kompleman sisteminin aktivasyonunda da rol oynar. Faktör XI dısında, bu faktörleri eksik olan hastalar hemorajik eğiliminden şikâyet etmezler.
İnvitro olarak koagülasyonu başlatan olaylar in vivo olarak hemostazı başlatan olaylarla aynı olmayabilir. İntrensek yolun baslangıç adımlarıyla ilgili üç protein Faktör XII, prekallikrein ve HMWK‟nın herhangi birinin yokluğu trombinin yavaş üretimine yol açar ve in vitro pıhtılaşma zamanı ile kısmi tromboplastin zamanını (PTT) uzatır. Bununla beraber bu üç proteindeki bir yetmezlik hemostazda herhangi bir defekte yol açmaz, tersine Faktör XI yetmezliği sıklıkla hemostatik yetmezlikle sonuçlanır. Bu klinik gözlemler in vivo olarak damar yaralanmasına yanıtın, üç temas proteinini atlayan ve direk olarak Faktör XI aktive eden bir reaksiyonu içerdiğini gösterir. Trombositler Faktör XII‟den bağımsız bir reaksiyonla Faktör XI‟in aktivasyonunda yer alabilir (29).
1. Faktör XII: Faktör XII, 80.000 D ağırlığında, biyolojik yarı ömrü 50-70 saat arasında bulanan bir glikoproteindir. Molekülün yıkımıyla 28.000 D ağırlığında enzimatik olarak aktif bir fragman oluşur (αXII a). Bu fragman yabancı yüzey bulunmasa bile aktiftir. βXII a ise etkili bir prekallikrein aktivatörü olduğu halde koagülasyon aktivitesi zayıftır (29).
2. Faktör XI: 160.000 D molekül ağırlıklı bir glikoproteindir. İki eş polipeptid zinciri bir diğerine disülfit köprüleriyle bağlanır. Faktör XI, Faktör XIIa tarafından aktiflendiğinde bu zincirin herbiri bölünür. Bunlar disülfit köprüleriyle bağlanırlar. Aktif merkez hafif zincir içindedir. Protein in vitro olarak stabil dir, plazma ve serumda bulunur. Biyolojik yarı ömrü 10-20 saat arasındadır (29).
3. Yüksek Molekül Ağırlıklı Kininojen (HMWK): HMWK 110.000 D molekül ağırlığında tek bir polipeptid zincirinden yapılıdır. Bu molekül faktör XI ile bir kompleks olusturur. HMWK sahip olduğu bir yüzey bağlayıcı bölüm yardımıyla negatif yüklü yüzeylere bağlanır ve Faktör XI‟in kallikrein tarafından yüzeye bağlanma aktivasyonunu hızlandırır (29).
4. Prekalliklein: 85.000 D molekül ağırlığında tek zincirli bir peptiddir. Prekallikrein, faktör XIIa tarafından kallikreine dönüstürülür. Kallikrein bir faktör XII aktivatörüdür. Prekallikrein yetmezliği, aktiflenmiş kısmi tromboplastin zamanının (APTT) önemli derecede uzamasına yol açar (29).
2.2.3.6. Fosfolipidler ve Kalsiyum Ġyonları
Fosfolipidler (-) trombosit membranında negatif yüklü bir yüzey olustururlar. Bu yüzey, pıhtılaşma faktörlerinin enzimatik aktivasyon bölgesidir. Fosfolipidler trombosit ve dokularda
bulunur. Trombosit faktörü 3, fosfatidil serinden olusur. Bu intrensek işlemin aktivasyon bölgesidir. Endotelyal lezyon varlığında lipoproteinler veya doku tromboplastinleri fosfatidil serin, -kolin, -etanalaminden olusan lipoprotein kompleksleridir. Ekstrensek sistemin tam aktivasyonu için lipid ve protein fraksiyonlarının her ikisi de önemlidir. Bu, parsiyel tromboplastin olarak sadece lipid fraksiyonuna gerek duyan intrensek aktivasyondan farklıdır.
Bazı lipoproteinler, protrombin zamanını saptamak için doku faktörü III‟ün benzerleri olarak işlev görürler. Beyin, plasenta ve akciğer ekstratları bu amaç için kullanılır. Bu tromboplastinler invitro olarak Ca++ eklenmesinden sonra, parsiyel tromboplastinlerden daha hızlı plazma koagülasyonuna neden olurlar. K vitaminine bağımlı faktörlerin enzimatik aktivasyonları için kalsiyum iyonlarına gerek vardır. Bu faktörler gamma-karboksil grupları yoluyla kalsiyum iyonlarına bağlanırlar (29).
2.2.3.7. Koagülasyon Ġnhibitörleri (Antikoagülan Proteinler)
Plazmada bulunan antikaogülan proteinler, Protein C yolunda bulunanlar, proteinaz inhibitörleri ve TFPI (tissue factor pathway inhibitör) olarak üç grupta incelenebilir. 1. Protein C Yolu
Protein C Protein S
Trombomodulin
Trombomodulin, damar endotel hücrelerinin yüzeyinde bulunur ve trombin için yüksek afiniteli polipiptid yapısında bir reseptördür. En önemli islevi trombini bağlaması ve oluşan trombin trombomodulin kompleksinin protein C aktivasyonunu sağlamasıdır(41).
2. Proteinaz Ġnhibitörleri
a) α2 makroglobulin: Esas yapım yeri karaciğerdir. Ancak trombositlerde, damar endotel hücrelerinde, akciğer fibroblastlarında ve alveoler makrofajlardada yapılır.
Koagülasyon yolundaki çok sayıda proteinazı inhibe eden α2 – makroglobulin trombin, kallikrein ve plazmin üzerinde de etkilidir. Antikoagülasyon etkisi dısında α2 –makroglobulin birçok büyüme faktörü ve stokini de bağlar. Bu nedenle immün sistemde rolü olabilir (41).
b) Serin Proteinaz inhibitör (Serpin) ailesi: Bu grup içinde C1 esteraz inhibitörü, antitrombinIII, α2-proteinaz inhibitör, heparin kofaktör II, protein C inhibitör, plazminojen aktivatör inhibitör-I. Bunlardan α-1 proteinaz inhibitör ve plazminojen aktivatör inhibitör I akut faz reaktanıdır.
*1-Proteinaz inhibitör (α-1-antitripsin): Plazmada en yüksek bulunan serpindir.Esas olarak hepatositlerde, daha az miktarda monosit ve makrofajlarda yapılır.Enflamasyonda 2-4 kat artar. Yarı ömrü 6 gündür. Vücutta baslıca görev: akciğer dokusunda aktive nötrofiller tarafından yapılan proteinaz, elastaz ve katepsin G‟yi inhibe etmesidir. Koagülasyon sisteminde FXIa, FXa, ve aktive protein C‟yi inhibe eder.(41)
*Antitrombin III (Heparin Kofaktör I): Karaciğerde yapılır. Plazmada yarı ömrü 61-72 saattir. AT-III endotel hücrelerinin yüzeyinde muhtemelen glikozaminoglikanlara bağlı olarak bulunur. FIXa, FXa ve trombin dahil birçok enzimin en önemli fizyolojik inhibitörüdür. Heparin AT-III‟ün etkisini birkaç bin kat arttırır. AT-III‟ün bağladığı bu proteinazlar, özellikle trombin- antitrombin III (TAT) kompleksi karaciğerde tutularak uzaklaştırılır. TAT kompleksinin temizlenmesinde trombomodulin de önemlidir. Trombomoduline bağlı bu kompleks hücre içine alınarak ortadan kaldırılır (41).
*C1 Esteraz inhibitörü: En çok yapıldığı yer karaciğerdir. Koagülasyon yolunda FXIIa, FXIa ve kallikrein dâhil birçok aktive kontakt faktörün primer inhibitörüdür. Ayrıca klasik kompleman yolunda C1r ve C1s‟in tek inhibitörüdür. Bu nedenle izole eksikliğinde anjio ödem olur.
*Protein C inhibitör (PAI-3): Akciğerde, böbrek tübüler hücrelerinde ve erkek üreme sisteminde yapılır. Aktive protein C‟nin primer inhibitörüdür. Aynı zamanda kallikrein, FXIa, FXa, trombin, trombin-antitrombin III (TAT) kompleksi ve
ürokinazı da inhibe eder. Protein C inhibitörünün, inhibitör etkisi heparin ile artar (41).
*Heparin Kofaktör II (Löserpin 2): Karaciğerde yapılır. İnhibe edebildiği tek koagülasyon enzimi trombindir. Trombin üzerindeki etkisi heparin ile 1000 kat artar. Ancak etkisi Antitrombin III‟den azdır.
c) TFPI (tissue factor pathway inhibitör): Endotel hcrelerinde yapılır ve çoğu bu hücrelerin yüzeylerinde heparin benzeri proteoglikanlara bağlı olarak bulunur. Heparin verildikten sonra plazmadaki TFPI ilk olarak membran yüzeyine bağlı TF/FVIIa/FXa kompleksindeki FXa‟ya bağlanarak inaktive eder, sonra TF/FVIIa kompleksine bağlanır. Dolaşımdaki bu komplekslerin temizlenmesi karaciğerde olur ve yarı ömürleri dakikalarca ifade edebilecek şekilde kısadır (41).
2.2.3.8. PıhtılaĢma Mekanizması Pıhtılaşma olayında 3 evre gözlenir:
1. Protrombini trombine dönüştürecek olan protrombinaz oluşumu, 2. Trombin oluşumu,
3. Fibrin oluşumu,
Protrombinaz oluşumu için Faktör X‟un aktive edilmesi gerekmektedir. İnvitro olarak faktör X‟un aktivasyonu intrensek ve ekstrensek pıhtılaşma sistemi ile gerçekleşir.
ĠNTRENSEK PIHTILAġMA SĠSTEMĠ
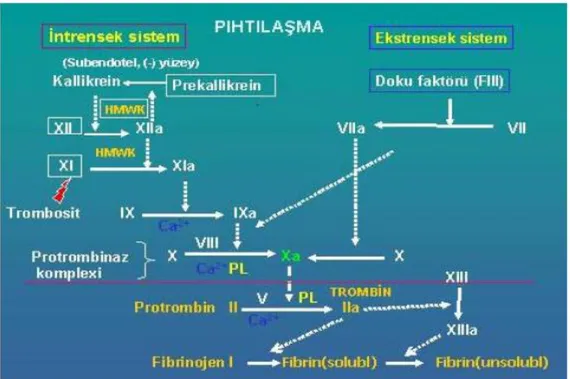
Kan koagülasyonunun intrinsik yolu, kontakt aktivasyon faktörlerinin; prekallikrein, FXI, FXII ve yüksek molekül ağırlıklı kininojenin görev aldığı pıhtılaşma yoludur. Fizyolojik olarak, kontakt aktivasyon vasküler travma tarafından başlatılan uyarılar ile oluşur. Konnektif doku elementlerinin (kollajen) bozulması ve açığa çıkması ile bu yüzeyle temas eden FXII, aktive edilmiş FXII denen proteolitik bir enzime dönüşür. İnaktif FXII, prekallikrein (PK) ve yüksek moleküler ağırlıklı kininojen (HMWK) denilen iki proteinle temas ederek aktifleşir. FXII aktivasyonunun kan koagülasyon süreci üzerine pek çok özgün etkisi vardır. Aktif FXII; HMWK ve PK varlığında, enzimatik etkisi ile FXI‟in inaktif zimojenini, aktif serin proteaz olan FXIa‟ya dönüştürebilme yeteneğine sahiptir. Bu aktiflenmiş koagülasyon faktörü de FIX zimojenini, aktif FIXa‟ya dönüştürür. Aktif FIX; iyonize kalsiyum, fosfolipidler ve aktiflenmiş FVIII ile beraber protrombin aktivatör kompleks oluşumunda anahtar bir başlatıcı olan FX‟u FXa‟ya dönüştürür. FXa, FV ve trombosit fosfolipidi ile birlşerek protrombin aktivatör kompleksini oluşturur; bu kompleks de protrombini trombine parçalar ve trombin molekülü, fibrinojenin fibrine dönüşümünü katalizler. Bu yola kontakt aktivasyon yolu da denmektedir (5, 6, 20).
EKSTRENSEK PIHTILAġMA SĠSTEMĠ
Ekstrinsik yol; diğer adıyla doku faktörü yolu, doku hasarı sonucu açığa çıkan doku tromboplastinin dolaşıma girmesiyle başlar. Doku tromboplastini (doku faktörü), diğer koagülasyon faktörleriyle karşılaştırıldığında farklıdır; bu madde dolaşım sistemi dışında beyin, böbrek, dalak ve damar endotel hücrelerinde de bulunmaktadır. Hem protein hem de lipid elementlerine sahiptir. Bu doku faktörünün protein kısmı çesitli fosfolipidlerle etkileşme
yeteneğindedir ve FVII‟nin FVIIa‟ya dönüşümünü katalizler. Aktif FVII de; iyonize olmuş Ca varlığında, FX‟u Fxa‟ya dönüştürür. FXa, doku tromboplastininin bir parçası olarak serbestlenen fosfolipid ve FV ile protrombin aktivatörü kompleksini olusturur.Son protrombin aktivatör kompleksinde; aktive edilmiş FX, gerçek bir proteaz olarak protrombini trombine parçalar ve aktiflenmiş trombin, fibrinojenin fibrine dönüşümünü katalizler (5, 6, 16, 20).
ORTAK YOL
Koagülasyon sisteminin; hem intrinsik hem de ekstrinsik yollarının son aktivitesi, FX‟un aktivasyonudur. Dolayısıyla, FX‟un FXa‟ya dönüşümüyle intrinsik ve ekstrinsik sistemler ortak yolda birleşirler. FXa, protrombinaz kompleksi denen bir grup molekülü oluşturmak için; FII, FV, Ca++ iyonları ve trombosit fosfolipidleri gibi diğer prokoagülanlarla birleşir. Oluşan bu kompleks, protrombinin (FII) trombine (FIIa) dönüşümünü katalizler. Trombinin fibrinojen üzerindeki proteolitik etkisiyle fibrin monomerleri polimerize olarak, uzun fibrin lifleri oluştururlar. Trombin aynı zamanda Ca++ iyonları varlığında, fibrin stabilize edici faktör olan FXIII‟ü aktive eder ve fibrin stabilizasyonunun sağlanmasıyla koagülasyon süreci sonlanmış olur (4, 5, 8, 20).
ġekil 4: Koagulasyon sisteminin aktivasyonu. HMWK: Yüksek molekül ağırlıklı kininojen, Ca: Kalsiyum, PL: Fosfolipit
2.2.3.9. PıhtılaĢma Reaksiyonlarının Denetimi
Plazmada pıhtılaşma faktörlerini nötralize eden inhibitörler vardır. Bunlar; antitrombinIII, Protein C, S ve doku faktörü yolu inhibitörü (TFPI) dür. Antitrombin III, trombini nötralize eden en önemli proteindir. Ayrıca F IX, X, XI,XII‟nin aktif şekillerinin nötralizasyonunu sağlar. Heparin ve endotel yüzeyinde bulunan heparan sülfat gibi maddeler etkisini şiddetlendirirler.
Protin C, S; K vitaminine bağımlı olarak sentez edilen bu iki antikoagülan; protein C(proenzim), protein S (non-enzimatik kofaktör), FVa ve FVIIIa‟nın inaktivasyonunda rol alırlar. Trombin damar intima yüzeyinde bulunan trombomodulin ile kompleks oluşturduktan sonra Protein C‟yi aktive eder (42, 43). Doku faktörü yolu inhibitörü (TFPI); Plazmada lipoproteinlere bağlı olarak bulunan bir glikoproteindir. Trombositlerde ve endotel yüzeyinde de bol olarak bulunur. TFPI, FXa ve doku faktörü/FVIIa kompleksini inhibe eder. Faktör Xa‟yı bire bir bağlanarak inhibe eder. Doku faktörü/FVIIa kompleksini inhibe etmesi için TFPI‟nin FXa, FVIIa ve doku faktörü ile dörtlü bir kompleks oluşturması gereklidir.
Pıhtılaşmanın kontrolü, her biri birkaç pıhtılaşma faktörünü inaktive eden inhibitörlerle ve fibrinolitik sistemle sağlanır. Normalde dengeli çalışan pıhtılaşma başlatıcı (protrombotik-prokoagülan) ve pıhtılaşma önleyici (antitrombotik-antikoagülan) mekanizmalar tromboz oluşmasını engeller (44).
2.2.4. Fibrinolitik sistem
Koagülasyon sistemi akut olarak stimule olduğunda fibrinojenden fibrin olusturulur ve bir dakikadan az bir zamanda lokal dolaşımdaki trombosit sayısı sıfırlanır. Eğer bu reaksiyon yalnızca stimülasyon yönünde olsaydı organizma için ölümcül bir fenomen olurdu. Ancak organizma bir iki dakika içerisinde fibrinolitik yanıt geliştirir. Endojen t-PA plazma düzeyleri birkaç yüz katına artar, fibrin depozitleri çözülür ve trombosit sayısı normale döner. Bu dengedeki bozukluklar kanama veya tromboza yatkınlığa neden olur (42).
Bu kaskatta endotel, trombositler, koagülasyon ve fibrinolitik plazma proteinleri rol oynar. Endotel hücrelerinde bulunan integral membran proteini trombomodulin bu reaksiyondaki anahtar noktadır. Trombomodulin trombine bağlanır ve trombinin substrat spesifitesini değiştirir. Böylelikle fibrinojen trombin için uygun bir substrat haline gelir. Trombomodulin bu sekilde fibrin oluşumunu
sağlarken diğer taraftan zimojen protein C‟nin antikoagülan enzim yapısındaki aktive protein C‟ye dönüşmesini sağlar. Bu enzim koagülasyon kaskatında FVa ve VIIIa inaktivasyonunu sağlar ve sonuçta trombin formasyonunu azaltır. Trombin trombomodulin ile bağlandığında zimojen trombin ile aktive olan fibrinolizis inhibitörü (TAFI)‟nin antifibrinolitik karboksipeptidaz B benzeri enzim aktive TAFI‟ye (TAFIa) dönüşmesini sağlar ki, bu enzimde plazminojen aktivasyonu azaltmak yoluyla fibrinolizisi inhibe eder (42, 43, 44).
Fibrinolitik sistem intravasküler trombüs oluşumuna karşı önemli bir savunma mekanizmasıdır. Fibrin formasyonu plazminojen ve aktivatör proteinleri bağlayarak sistemin aktifleşmesinde büyük rol oynar. Fibrinin plazmin yolaklı proteolizisi doku plazminojen aktivatörü (t-PA) için ek bağlantı bölgelerini açığa çıkarır, böylece reaksiyon pozitif feedback ile artarak devam eder. Plazmin fibrine bağlandığında ve proteolizis işlemini başlattığında t-PA maskelenir ve yıkım sürecinden korunarak reaksiyonun devamına neden olur. Bu şekilde sürekli aktif olan reaksiyonun dengesi plazminojen aktivatör inhibitörleri ile sağlanır (45).
2.2.4.1. Plazminojen Aktivatör Ġnhibitör-1 (PAI-1)
PAI-1 serpin ailesinden bir proteindir ve etkisini t-PA inhibisyonu yolu ile gösterir. PAI-1, t-PA ile birlikte fibrine bağlanır ve inhibitör etkisini gerçekleştirir. PAI-1 ve t-PA‟nın kaynağı endotel ve vasküler düz kas hücreleri olması nedeniyle
fibrinolizis lokal olarak kontrol edilmektedir (46). Aslında bu lokal dengenin vaskularize olmuş her vücut alanında mevcut olduğu ve bu lokal olayların toplamının fibrinolitik sistem aktivasyonunun düzeyini belirlediği yönünde güçlü kanıtlar bulunmaktadır (47).
Trombositlerdeki α-granüllerde depolanıp salgılanan PAI–1, ,379 aminoasitten oluşan 45–50.000 dalton ağırlığında tek zincirli bir glikoproteindir. PAI–1, t-PA ve ürokinazla 1:1 kovalen bağlı kompleks oluştururlar. Bu kompleks içinde t-PA ve ürokinaz aktivitelerini kaybeder. Böylece fibrinolizin kontrolsüz devam etmesi engellenmiş olur. Bu kompleksler karaciğerde hızla katabolize edilir. Bu sayede, fibrinoliz nanometre düzeyindeki küçük mesafelerde lokalize edilir. Normal plazmada bulunmayan başka plazminojen aktivatör inhibitörleri de vardır, PAI–2 plasentada, PAI–3 idrarda bulunur ( 46, 47, 48).
2.3. TROMBOZ
Tromboz deyimi; canlı bir organizmanın vasküler sisteminde, kanın elementlerinden trombus denilen anormal bir oluşumun meydana gelişini ifade eder ve hemostatik cevabın uygunsuz bir şekilde başlayıp ilerlemesi sonucu ortaya çıkan patolojik bir süreç olarak tanımlanabilir (8).
Normal şartlar altında hemostazı oluşturan faktörler, kanın akışkanlığını bozmadan devam ettirecek şekilde düzenlenmişlerdir. Bu hemostatik elementler; vasküler bir hasara karşı çabuk ve etkili bir biçimde cevap verebilmek için, pıhtı veya koruyucu bir tıkaç oluşturarak sonuçta aşırı kan kaybını önlemek üzere hazır halde bulunurlar (49). Patolojik süreç ise hemostatik elementlerin normal değerler arasında seyreden miktarlarının degişmesiyle birlikte hemostazın sağlanamaması sonucu kanama veya aşırı hemostaz sonucu trombus oluşumuyla başlar (50, 51). Trombusun temel yapısı 19.yüzyıl patologları (Zahn, 1875; Bizzozero,1882; Eberth & Schimmelbusch, 1886) tarafından açık bir şekilde tanımlanmıştır. Bu arastırıcılar trombusun; aktif, sirküle halde oluştuğunu ve statik sistemde oluşan kan pıhtısından tamamen farklı olduğunu ve bu oluşumda fibrin ağı içinde polimorfnükleer lökositlerin ve trombositlerin seçici bir sekilde depolandığını göstermişlerdir (49,50).Tromboz kanın akışı sırasında vasküler, selüler ve hümoral faktörlerin birbirleriyle etkileşimi sonucu gelişir. Kinetik bir süreç özelliğiyle, statik bir fenomen olan kan pıhtılaşmasından ayırt edilir (49).
Trombozun fizyopatolojisi; çökelmeye neden olan etmene bağlı olmaksızın, pıhtılaşma sisteminin tüm elemanlarını kapsar ve şöyle özetlenebilir:
a) Pıhtılaşma, trombositlerin tutunup yığılarak salındıkları endotel ve subendotel bölgesinde başlar.
b) Fibrin pıhtısı oluşur ve fibrinolitik süreç boyunca normalde trombozu sınırlandıran mekanizmalar aktive olur.
c) Patolojik trombus; koagülan, antikoagülan ve fibrinolitik süreçler arasındaki dengesizliğin sonucu olarak ortaya çıkar. Bu oluşumdan sonra trombusun tamamı ya da bir parçası emboli yapar (52).
Kanamaya neden olan bozukluklar yüzyıllardır bilindiği halde, bunun tersi yani tromboza neden olan bozuklukların tanımı oldukça yenidir. Rudolph
Virchow‟un 1856‟da tarif ettiği triad hala geçerli olup, buna göre tromboz gelişiminde 3 faktör rol oynamaktadır (49, 50).
1. Damar hasarı
2. Kan akımında yavaşlama
3. Kanın bileşimindeki değişiklikler
Tromboz fizyopatolojisinde rol alan bu faktörlerden herhangi biri ya da birkaçının birlikteliği trombus oluşumunu tetikleyebilir. Kan komponentleri ile ilgili anormallikler ise trombosit fonksiyonları (primer hemostaz), koagülasyon (sekonder hemostaz) ve fibrinolizis aşamalarında görülebilir. Örneğin koagülasyon sistemindeki faktörlerin normalde fazla bulunuşu, trombositlerin sayıca artması, trombositlerin adezyon ve agregasyon özelliklerinin artması gibi durumlarda hiperkoagülabilite ve trombozlar ortaya çıkmaktadır (53, 54).
Hiperkoagülabilite; kan komponentlerine ilişkin kuramsal bir kavram olup, kanın pıhtılaşmaya egiliminin artısı ya da daha geniş anlamda hemostatik dengenin tromboza kayan degişiklikler göstermesi olarak tanımlanabilir. Kanda pıhtılaşma faktörlerinin konsantrasyonlarının artması (faktör VII, faktör VIII, faktör IX) ya da aktif faktörlerin bulunması (aktif faktör IX), pıhtılaşma inhibitörlerinin eksikliği (antitrombin III, protein C, protein S), fibrinolitik aktivitede azalma, trombositoz ve trombosit reaktivitesinde artış gibi değişiklikler hiperkoagülabilite örnekleri olarak sayılabilir (53, 55, 56). Tromboz toplumda sık görülen multifaktöriyel bir hastalıktır. Erişkinlerde insidansı yaklasık % 1 iken, çocuklarda bu oran yılda 1/100000 olarak belirtilmiştir (57,58). Tromboz etiyolojisi karmaşık olup genelde birden fazla faktör içerir. Çoğu kez kalıtsal ve çevresel risk faktörlerinin etkileşimi sonucu ortaya çıkar (59,60).
Trombofili, tromboza eğilimi yansıtan bir deyimdir. Edinsel ya da kalıtsal olabilir. Tanınan kalıtsal trombofilik risk faktörlerinin sayısı, son yıllarda artış göstermiştir. Çok sayıda edinsel ve kalıtsal faktörün değisik mekanizmalarla, tromboz gelişimine katkıda bulunduğu bilinmektedir. Arteriyel ve venöz sistemlerde trombus olşumunun farklı olmasından dolayı bu iki sistemde farklı etiyolojilerin rol oynadığı düşünülmektedir (55, 56).
2.3.1. Arteriyel Tromboz
Yapılan son çalısmalar göstermiştir ki, günümüzde gelişmiş ülkelerde en sık rastlanan hastalık ve ölüm nedenleri arteriyel tromboembolik olaylara bağlıdır. Arteriyel trombozun en bilinen nedeni, aterosklerotik damar hastalığını takiben endotelde oluşan hasardır. Tipik olarak dorsal aorta ile iliak arterler ve koroner arterler gibi geniş ve orta ölçüdeki arterleri kapsar (61,62).
Arterlerdeki değişikliklerin bir sonucu olarak, lipid ve lipoprotein materyalleri subendoteliyal tabakalar içerisinde birikir. Bu birikimlerin; endoteliyal tabakaların nontrombojenik karakterlerini değiştirerek, trombosit tutunma ve agregasyonunu kolaylaştıran bir çevre oluşturduğu düşünülmektedir. Bu aktivitenin son ürünü, fibrin birikimi üzerinde bir trombosit tıkacı oluşmasıdır. Kan koagülasyon sisteminin daha ileri aktivasyonu, ilave fibrin birikimini ilerleterek total damar tıkanmasına yol açar. Beyaz trombus olarak bilinen arteriyel trombuslar; fibrin ve trombosit tabakalarından oluşmuş olup, hasarlı arter duvarına sıkıca bağlanırlar Arteriyel trombozun en bilinen şekilleri, akut miyokard infarktüsü ve serebral vasküler kazalardır (55, 56, 63, 64).
2.3.2. Venöz Tromboz
Venöz tromboz, lokal olarak venlerde oluşan trombusun dolaşımda tıkanıklığa yol açmasıdır. En önemli nedenleri; kan akımında yavaşlama (staz) ve pıhtılaşma sistemine ait bozukluklardır. Venöz trombus; çoğunlukla bacağın derin venlerinde, nadiren mezenter, beyin, retina ve karaciğer venlerinde oluşur. Fibrin, eritrosit ve trombositlerden oluşmuş olan bu yapıya kırmızı trombus adı da verilir. Oluştukları damar yüzeyinden koparak dolaşıma katılabilir ve embolizme neden olabilirler (54, 55, 65, 66). Klinik çalısmalar ve toplum taramaları; venöz tromboembolizmin her yıl 100000 kisiden 117‟sini etkileyen yaygın bir hastalık olduğunu ve kalıtsal tromboz nedenlerinin hemen hemen tamamının venöz tromboza eğilim oluşturduğunu göstermektedir. Genetik faktörler taşıyan bireylerde tromboz riski artmakla birlikte, hiçbir trombotik atak geçirmemeleri de mümkündür. Bu durum kalıtsal nedenlerin tek başına yeterli olmadığını, bunların yanında bazı edinsel faktörlerin de katkısı olduğunu göstermektedir (54, 56, 61, 64, 67).
2.3.3. Edinsel Tromboz Nedenleri *İleri yaş
*Damarsal bozukluklar: Ateroskleroz, diabetes mellitus, vaskülitler (Behçet hastalıgı vs.) ve polipropilen, polyester gibi prostetik materyaller
*Staz (kan akımında yavaslama), cerrahi girişim, immobilizasyon (uzun süre hareketsiz kalma), konjestif kalp yetersizliği
*Hiperviskosite (myeloproliferatif hastalıklar, waldenström makroglobulinemisi, multipl myelom, orak hücreli anemi, akut lösemi)
*Trombosit fonksiyon bozuklukları (myeloproliferatif hastalıklar ve portal ven trombozunun nadir bir sebebi olan (PNH) paroksismal noktürnal hemoglobinüri) *Hormonal değişiklikler (gebelik, postpartum dönem, östrojen ve türevlerinin kullanımı, oral kontraseptif kullanımı)
*Bunlardan başka; obezite, hiperlipidemiler, antifosfolipid sendromu, yaygın damar içi pıhtılaşması, travma, maligniteler (Trousseau sendromu), fibrinojen yüksekliği, nefrotik sendrom, inflamatuar bağırsak hastalıkları, protrombin kompleksi konsantrelerinin kullanımı, trombotik trombositopenik purpura, heparine bağlı trombositopeni, radyoterapi, FVII
yüksekliği, von Willebrand faktör yüksekliği, ilaçlar (L-asparaginaz, mitomisin, volüm arttırıcı sıvılar, vs.) (49, 68,6 9).
2.3.4. Kalıtsal Tromboz Nedenleri
Trombotik olayların ailesel olabileceği yüzyılın başında dikkat çektiği halde, pıhtılaşma sistemi konusundaki bilgilerin 1960‟ lı yılların sonunda netleşmesi ile kalıtsal trombozlar aydınlatılmaya başlanmıştır. İlk kez 1965 yılında Antitrombin eksikliğinin tromboza eğilim yarattığı gösterilmiş olup, ardından 1981‟de Protein C eksikligi ve 1984‟de Protein S eksiklikleri tanımlanmıstır. 1993‟te Dahlback ve arkadaşlarının APC (aktif protein C direnci) ve 1994‟te Bertina‟nın Faktör V Leiden mutasyonunu tanımlamaları ile trombozlu hastaların %20‟sinin etiyolojisinin aydınlatılması sağlanmıştır. Yine 1994‟te hiperhomosisteineminin, 1996‟da da protrombin genindeki bir mutasyonun (protrombin 20210) tromboza yol açtığı gösterilmiştir.
Buna rağmen; günümüzde kalıtsal tromboz olduğu düsünülen vakaların %40- 60‟nın nedenini ortaya koymak, tüm incelemelere rağmen hala mümkün olamamaktadır (70,71).
Kalıtsal venöz trombozda; çoğunlukla pıhtılaşma sistemini kontrol altında tutan doğal inhibitör mekanizma bozukluklarının rol oynadığı gösterilmistir. Bu risk faktörlerinden en iyi tanımlananları; Faktör V Leiden (APC direnci), protrombin G20210A mutasyonu, protein C, protein S ve antitrombin III eksiklikleridir. İlk trombotik atakla gelen hastaların yaklaşık yarısında; bu eksikliklerden birinin, trombozda altta yatan etken olduğu gösterilebilmektedir. Bunların dışında; hiperhomosisteinemi ve FVIII yüksekliği de önemli risk faktörlerindendir (72, 73, 74).
Tablo 3: Toplumda belli bir sıklığa ulaşabilen primer trombofili nedenleri(75)
Tablo 4: Nadir rastlanan primer trombofili nedenleri(75)
2.3.4.1. Faktör V Leiden Mutasyonu (APC Direnci)
Faktör V; karaciğer ve megakaryositlerde sentezlenen, 2196 aminoasitten oluşmuş, 330.000 D moleküler ağırlığında tek zincirli bir glikoproteindir. FV proteini, koagülasyon mekanizmasının hem intrinsik hem de ekstrinsik yollarında görev yapan bir kofaktördür. FVa, FXa ve trombosit fosfolipidleri ile birleşerek protrombin aktivatörü denilen kompleksi oluşturur; bu kompleks de protrombinin (FII), trombine (FIIa) dönüşümünü gerçekleştirir.
Trombinin, fibrinojeni fibrine dönüştürmesi ile de pıhtı oluşur. Protrombin aktivatör kompleksi içerisinde faktör V, önce tek zincirli ve inaktiftir. Pıhtılaşma başlayınca trombin; FV molekülünü belirli noktalardan keserek, birbirlerine Ca++ iyonları ile bağlı çift zincirli aktif molekül haline dönüştürür. Aktive olmuş faktör V (FVa), protrombin aktivasyon hızını yaklaşık 2000 kat arttırır (76, 77, 78).
Faktör Va‟nın inaktivasyonu; protrombin bağlanma bölgelerini içeren ve dolayısıyla da prokoagülan aktiviteye sahip olan ağır zincirin, aktif protein C (APC) tarafından kesilmesi ile gerçekleşir. Bu durumda APC antikoagülan etki gösterir (77, 79, 80). Ailesel APC Direnci 1990 yılında Dahlback ve arkadaşları tarafından, faktör V geni ise 1992„de Cripe tarafından tanımlanmıştır. 1993‟te Dahlback ve arkadasları; bazı kisilerde, aktif protein C‟nin bu etkisine karsı bir direnç (APC Direnci) olduğunu ve bu durumun en sık rastlanan kalıtsal tromboz faktörü olarak, venöz tromboz eğilimine neden olduğunu göstermişlerdir. 1994‟te de Bertina tarafından tanımlanan Faktör V geninde tek nokta mutasyonu, APC direncinin en önemli nedeni olarak bildirilmiştir (8, 81, 82).
FVa‟nın aktif protein C tarafından primer olarak inaktive edildiği bölge, 506. aminoasit olan arjininin (Arg ya da R) bulunduğu bölgedir. Dolayısıyla tek nokta mutasyonu sonucunda; genin 10. ekzonunun 169 nolu nükleotidinde G-C değisimi olması, molekülde aminoasit dizisini A-506-G seklinde değiştirmektedir. Burada arjinin aminoasidi yerine oluşan glutamin(Gln ya da Q) varlığında; FV‟in dogal antikoagülan olan protein C-protein S sistemine karşı duyarlılığı azalmakta, dolayısıyla APC tarafından inaktive edilmeye karşı dirençli olmaktadır. Bu mutant faktör V‟e de, Faktör V Leiden adı verilmektedir (83,84). FV geni, 1. kromozomda 1q21-1q25 bölgesinde lokalize olup kalıtım sekli otozomal dominanttır. Bu gende
gerçekleşen ve fonksiyon kaybından çok fonksiyon kazanımına yol açan FV Leiden mutasyonu, APC direncinin %90-95‟inden sorumludur. Sıklıkla asemptomatik olup; hamilelik, oral kontraseptif kullanımı ve cerrahi müdahaleler gibi bazı edinsel faktörlerin varlığında, tromboz gelişimine neden olur (85,86). FV Leiden mutasyonu, çoğunlukla bacakta derin ven trombozu ve eğer embolizasyon gelişiyorsa, pulmoner emboli olarak kendini gösteren bir hastalık olan venöz tromboembolizmde sık rastlanan kalıtsal bir faktördür. Heterozigot FV Leiden mutasyonu tromboz riskini 7-10 kat arttırırken; sıklığı genel populasyonda %0.05 olan homozigot mutasyon, bu riski 50-100 kat arttırmaktadır (87,88).
2.3.4.2. Protrombin G20210A Mutasyonu
Sentezi karaciğerde yapılan ve vitamin K‟ya bağımlı olan pıhtılaşma faktörüdür. Tek zincirli bir glikoprotein olan protrombin molekülü; 71.000 D ağırlıgında, 579 aminoasit içeren ve agırlıgının yaklasık % 10‟u karbonhidrattan olusan bir yapıdır. Protrombin; hidroliz ile trombin molekülüne dönüşerek, fibrinojenden fibrin oluşumunda görev alır (20).
Protrombin geni, 11. kromozomda 11p11-11q12 bölgesinde lokalize olmuştur. 1996 yılında Poort ve arkadaşları tarafından; protrombin geninin 3‟-translasyon yapılmayan bölgesinde, 20210. nükleotidde, guanin yerine adenin gelmesiyle meydana gelen tek baz değişim mutasyonu (G20210A) tanımlanmıştır ve bu mutasyonun, plazma protrombin düzeyini arttırdığı ve venöz tromboz eğilimine neden olduğu gösterilmiştir. Tromboz riskini 2-4 kat arttıran G20210A mutasyonunun, tromboz için en yaygın 2. kalıtsal risk faktörü olduğu bildirilmiştir (89, 90, 91, 92).
2.3.4.3. Protein C Eksikliği
Protein C; ilk kez 1960/1961‟de Seeger‟in laboratuvarında Mammen, Ulutin ve Seeger tarafından, bir laboratuvar çalısması esnasında izole edilmiş ve “Autoprotrombin II-antikoagülan” olarak adlandırılmıştır. 1976‟da ise Stenflo; plazmadan, vitamin K‟ya bağımlı yeni bir faktör izole etti ve “protein C” adını verdi. Mammen, Ulutin ve Seeger‟in tanımladıkları Autoprotrombin II-A ile Stenflo‟nun tanımladığı Protein C molekülü karşılaştırılarak, ikisinin de aynı madde olduğu gösterildi. Bugün, Autoprotrombin II-A yerine Protein C terimi tercih edilmektedir