TIP FAKÜLTESĐ
Biyokimya Ve Klinik Biyokimya
Anabilim Dalı
KRONĐK OBSTRÜKTĐF AKCĐĞER
HASTALARINDA SERUM ALFA–1 ANTĐTRĐPSĐN
DÜZEYĐ VE ALFA–1 ANTĐTRĐPSĐN MUTASYON
TĐPLERĐNĐN ARAŞTIRILMASI
(UZMANLIK TEZĐ)
Dr. Elif DEĞĐRMEN
TEZ DANIŞMANI
Prof. Dr. Abdurrahman KAPLAN
DĐYARBAKIR
2009
ÖNSÖZ
Çalışmamın gerçekleşmesinde sağladığı olanakların yanı sıra her aşamada değerli desteğini esirgemeyen ve yetişmemde bulunduğu katkılar ve gösterdiği yakın ilgi ve yardımlarından dolayı değerli hocam ve danışmanım Sayın Prof.Dr. Abdurruhman KAPLAN’a, Anabilim Dalı Başkanımız Sayın Prof.Dr. Naime CANORUÇ’a,
Dicle Üniversitesi Tıp Fakültesi Biyokimya Anabilim Dalında ihtisasım boyunca geçirdiğim süre zarfında desteklerini esirgemeyen değerli tüm hocalarıma,
Tezimin planlanması aşamasında yol gösterici yardımları, yakın ilgi ve desteği için D.Ü.T.F. Göğüs Hastalıkları A.B.D öğretim üyesi Sayın Yrd. Doç.Dr. Levent AKYILDIZ’a
Tezimin deneysel aşamasında yardımlarından dolayı Biyolog Bilge DEVECĐOĞLU’na, tezimin hazırlık ve yazım aşamasında yardımını esirgemeyen Dr.Beri H. BOZARSLAN’a
Đhtisas sürem boyunca birlikte çalıştığım güler yüzlerini ve yardımlarını esirgemeyen tüm asistan arkadaşlarıma ve tüm çalışanlara teşekkürlerimi sunarım.
Bugünlere gelmemde büyük emekleri olan anneme, babama ve tüm aileme sonsuz sevgilerimle…
ĐÇĐNDEKĐLER
Sayfa
Đç Kapak
Önsöz I
Đçindekiler Dizini II
Simgeler Ve Kısaltmalar Dizini ... IV
Şekiller Dizini V
Tablolar Dizini VI Türkçe Özet VII Đngilizce Özet IX
1.Giriş ve Amaç 1
2.Genel Bilgiler 3
2.1. Alfa-1 Antitripsinin Yapısı 3
2.2. Alfa-1 Antitripsin Geni Ve Alfa-1 Antitripsin Proteini 6
2.3. Alfa-1 Antitripsin Eksikliği Ve KOAH 9
2.4. Alfa-1 Antitripsin Geni Mutasyonları 12
2.5. En sık rastlanan AAT Geni Allelleri, Dağılımı ve Sonuçları 14
2.6. Kronik Obstüriktif Akciğer Hastalığı (KOAH) 18
2.7. KOAH’ın Tanısında Solunum Fonksiyon Testi 19
2.8. AAT’nin KOAH’taki Önemi 20
2.9. AAT Eksikliği Ve Tütün Dumanı Arasındaki Đlişki 20
3.Gereçler ve Yöntemler 22
3.1. Gereçler 22
3.1.1. Kan Örneklerinin Elde Edilmesi 22
3.1.2. Kullanılan Cihazlar 23
3.1.3. Kullanılan Kimyasal Maddeler Ve Kitlerin Bileşimi 23
3.2. Yöntemler 24
3.2.1. α1-Antitripsin Analiz Yöntemi 24
3.2.2. α1-Antitripsin Strip Yöntemi 25
3.2.3. AAT Strip Yöntemi ile α1-Antitripsin Mutasyon Analizi 25
3.2.3.1. DNA Đzolasyonu 25
3.2.3.3. Hibridizasyon 28 3.3. Sonuçlarının Yorumlanması Ve Değerlendirilmesi 29 3.3.1. AAT Genotip Sonuçlarının Değerlendirilmesi 29 3.3.2. Serum AAT Düzeylerinin Đstatiksel Değerlendirilmesi 31
4.Bulgular 33
5.Tartışma 38
6.Sonuç 44
SĐMGELER VE KISALTMALAR DĐZĐNĐ
KOAH Kronik Obstruktif Akciğer Hastalığı
AAT Alfa-1 Antitripsin
PĐ Proteaz inhibitör
DNA Deoksiribonükleik asit
EDTA Etilendiamintetraasetik asit
kDa Kilo dalton
µl Mikrolitre
mg/dl Miligram/desilitre
PCR Polimeraz Zincir Reaksiyonu
rpm Revolution per minute
PMNL Polimorfonükleer Lökositler
GOLD Global Initiative for Chronic Obstructive Lung Disease
FEV1 Zorlu Ekspirasyon Volümünün Birinci Saniyesi
FVC Zorlu Vital Kapasite
SFT Solunum Fonksiyon Testi
ŞEKĐLLER DĐZĐNĐ Sayfa
Şekil 1. Alfa-1 antitripsin’in yapısı 4
Şeki 2. Alfa-1 antitripsin’in tersiyer yapısı 5
Şekil 3. AAT molekülünün reaktif merkez büklümünün 2.0 A°’daki görünümü 6
Şekil 4. 14. Kromozom ve AAT geninin lokalizasyon 7
Şekil 5. PiZZ allelli AAT’nin Etkileri 9
Şekil 6. α1-antitripsin molekülünün Loop-Sheet polimerizasyonu 10
Şekil 7. AAT molekülü ve nötrofil elastazı arasındaki yapı fonksiyon ilişkisi 11
Şekil 8. α1-Antitripsin Strip Test Çubuğu (test strip) örneği 30
Şekil 9. AAT geninin S ve Z lokuslarına ilişkin olası tüm geneotiplerin stripteki
boyanma biçimleri 31 Şekil 10. PĐM/PĐM genotipli 4 KOAH’lı olguya ait AAT strip görüntüsü 35
TABLOLAR DĐZĐNĐ Sayfa
Tablo 1. Karekteristik mutasyon tiplerini içeren seçilmiş proteaz inhibitör
varyantlarının hücresel hasar ve hastalıklarla olan ilişkisi 13
Tablo 2. Ana AAT fenotiplerinde amfizem gelişme riski 15
Tablo 3.Çeşitli α1-antitripsin (AAT) fenotipleri ile ilişkili serum konsantrasyonları aralığı 16
Tablo 4. KOAH’ta risk faktörleri 19
Tablo 5. GOLD 2007’ye göre KOAH’ın spirometrik sınıflaması 20
Tablo 6. Çalışmamızda KOAH’lı olgulara ait AAT genotip verileri 33
Tablo 7. Çalışma populasyonumuzu tanımlayıcı veriler 36
Tablo 8. Kontrol ve KOAH grupları arasında Serum AAT düzeylerinin student’s t testine göre karşılaştırılması 36
Tablo 9. Evrelerin serum AAT düzeylerinin Tek yönlü Anova testine göre karşılaştırılması 37
Tablo 10. Sigara öyküsü pozitif olan ve halen aktif içici olan KOAH’lı grup ile sigara öyküsü pozitif olup 1 yıl ≥ süredir sigarayı bırakmış KOAH’lı grubun serum AAT düzeylerinin student’s t testine göre karşılaştırılması 37
ÖZET
AAT (α1-antitripsin), başlıca karaciğer tarafından üretilen bir akut faz proteinidir. Akciğer dokusunun nötrofil elastaz yoluyla yıkımını önlemektedir. AAT’nin yokluğu veya fonksiyon bozukluğu, akciğerde proteaz-anti proteaz dengesinde bozukluğa yol açar ve amfizem gelişmesi için duyarlılığı artırır.
Kronik obstrüktif akciğer hastalığının (KOAH) etiyolojisi ve ilerlemesi, genetik ve çevresel faktörler arasındaki karmaşık etkileşimden kaynaklanır. Dolaşımda miktar olarak en bol bulunan, proteaz inhibitörü olan α1-antitripsinin (AAT) gen kodlamasındaki varyasyonları, KOAH için belirlenen tek genetik risk faktörüdür.
Ciddi ve orta alfa–1 antitripsin eksikliği dünyadaki en yaygın, ciddi herediter hastalıklardan biridir. Ancak prevalansı bir ülkeden diğerine belirgin olarak farklılık göstermektedir.
Bu araştırmada, bölgemizde AAT allel sıklığını belirlemek amacıyla Dicle Üniversitesi Tıp Fakültesi Göğüs Hastalıkları Polikliniği ile Diyarbakır Göğüs Hastalıkları Hastanesi’nde KOAH tanısı konmuş toplam 61 olguda AAT geninde yaygın olarak gözlenen S, Z ve M allelerine ait genotipleme çalışması yapıldı. 30 kişiden oluşan kontrol grubu oluşturuldu. Kontrol ve hasta grubunu içeren olguların tümünde serum alfa–1 antitripsin düzeyi çalışıldı. KOAH tanılı olguların solunum fonksiyon testi bilgileri alınarak GOLD 2007’ye göre hastalar evrelendirildi. KOAH’lı hasta grubuna bu genetik hastalıkla ilişkilendirilebilecek sorulardan oluşan anket çalışması yapıldı.
Çalışılan 61 olgunun tümünde PĐM / PĐM genotipi saptandı. KOAH tanısı almış olguların serum AAT düzeyi kontrol grubuna göre istatiksel olarak anlamlı derecede yüksek bulundu(P<0,05). Evrelendirilmiş KOAH’lı grupta evreler arasında serum AAT düzeyleri açısından istatiksel olarak anlamlı bir farklılık bulunmadı. Sigara öyküsü pozitif olup halen aktif içici olan KOAH’lı grup ile sigara öyküsü pozitif olup 1 yıl ≥ süredir sigarayı bırakmış KOAH’lı grubun serum AAT düzeyleri arasında istatiksel olarak anlamlı bir farklılık bulunmadı.
AAT genotip ve düzey analiz verilerimiz daha geniş hasta popülasyonlarında yapılmış çalışmalar ve benzer literatürler ile karşılaştırılmalı olarak değerlendirildi. Bölgemizde mutasyon sıklığının tanımlanması ve AAT eksikliğinin kronik obstruktif
akciğer hastalığındaki önemini ortaya koymak için daha geniş olgu serilerinde benzer çalışmaların yapılması düşüncesindeyiz.
ABSTRACT
AAT is an acute-phase protein mainly produced by the liver. It protects the lung tissue from destruction by neutrophil elastase. Absence or dysfunction of AAT leads to a shift in the protease–antiprotease balance in the lung and increases its susceptibility for the development of emphysema.
Aetiology and progression of chronic obstructive pulmonary disease (COPD) result from a complex interplay between genetic and environmental factors. Variations in the gene coding for a1-antitrypsin (AAT), the most abundant protease inhibitor circulating in the blood, is the only established genetic risk factor for COPD.
Severe and intermediate AAT deficiency is one of the most common inherited diseases on a global scale, but its prevalence varies markedly from one country to another.
In this study, to determine the prevalence of AAT's allele in our region, we had genotype study of S, Z and M alleles which are frequently observed in gene of AAT, in total 61 case diagnosed as COPD in Pulmonary Disease Department, Faculty of Medicine, Dicle University and Diyarbakır Pulmonary Disease Hospital. A 30 people consisting control group is formed. Serum alpha1-antitrypsin levels are researched in all the cases that consisted of control and patient groups. Taken the information of respiratory function tests in cases diagnosed as COPD, patients are phased according to GOLD 2007. The patient group diagnosed as COPD is surveyed of questions which can be related to these genetic diseases.
PiMM genotype is confirmed in all 61 patients. The fact that the serum ATT levels of patients diagnosed as COPD were higher (P<0,05) then of control groups is statistically significant. In the group of phased COPD patients, in terms of serum AAT levels no statistically significant difference were found between the phases. Between the COPD patients that has been smoking and quitted one year ago, in terms of serum AAT levels no statistically significant difference were found.
Gathered data of AAT genotype and level analysis are comparatively analyzed with studies on wider patient populations and similar literatures. Similiar studies on more case/patient groups should be carried out to define the prevalence of mutation in our region and to emphasise the lack of AAT in chronic obstructive pulmonary disease.
1.GĐRĐŞ VE AMAÇ
α1-proteinaz inhibitör (Pi) olarakta bilinen insan AAT molekülü 394 aminoasitten oluşan, 52 kDa olan bir akut faz glikoproteinidir. 14.kromozomda kodlanmaktadır (14q31-32.1) (1). α1-antitripsin serin proteaz inhibitör ailesinin (SERPĐN) bir üyesidir (2) ve 14.kromozomun q kolundaki diğer serin proteaz inhibitör kümesiyle beraber bulunur (3). Alfa–1 antitripsin geni, serpin peptidaz inhibitör, alpha 1 antiproteinaz, antitripsin geni olarak da isimlendirilir. Bu isimlerin yanında A1A, A1AT, A1AT-HUMAN, alfa–1 antitripsin, PI, PI1 olarak da tanımlanmaktadır (4).
Büyük bir kısmı karaciğerde sentez edilir ve dolaşıma salınır. Daha az bir kısmı ise alveolar makrofajlar tarafından ve muhtemelen akciğer epitelyum hücrelerinde sentez ve sekrete edilir (1).
Vücuttaki bütün dokularda primer rolü nötrofil elastaz enzim etkisinin başlamasını engellemektir (5). Alfa–1 antitripsin eksikliği otozomal resesif bir hastalıktır (6). Alfa–1 antitripsin eksikliği olan hastalarda bulunan hastalıkla ilişkili en yaygın iki allel nokta mutasyon tarzında olan S ve Z allelleridir (2).
AAT’nin önemi, eksikliği durumunda ortaya çıkan akciğer amfizemi ve diğer kronik inflamatuar durumlar sonunda anlaşılmıştır (4). Z alleli α1-antitripsin mutasyonunun en önemli eksikliğidir. Z alleli α1-antitripsinin, hepatositin endoplazmik retikulumunda retansiyonuna ve bu bölgede anormal protein birikimine neden olur. Bu birikim periportal hücrelerde PAS-pozitif inklüzyon cisimciklerine neden olur. α1-antitripsinin homozigot Z mutasyonu sonucu gelişen bu intrahepatik birikim neonatal hepatit, juvenil siroz ve hepatosellüler karsinom için predispozisyon oluşturur. α1-antitripsinin plazma sirkülasyonundaki eksikliği akciğerlerde enzimatik hasara neden olur. Bu durumun erişkinlerde görülen, erken başlangıçlı amfizemin altında yatan neden olduğuna inanılıyor (5). AAT eksikliği olan bireyler (<11µmol/L) amfizem, siroz, pannikulit ve anti sitoplazmik nötrofilik antikor (C-ANCA)-pozitif vaskülit (Wegener granülomatozis) gibi klinik durumlar için risk taşırlar (7).
AAT geni önemli derecede heterojenite gösterir. Bu pek çok heterojenik varyasyonlar AAT’nin fonksiyon ya da ekspresyonunu etkilememektedir. Bununla birlikte bu gen ile ilişkilendirilmiş varyasyonların α1-antitripsinin konsantrasyonlarında azalmaya ve disfonksiyonel protein oluşumuna yol açtığı
gösterilmiştir. Alfa–1 antitripsin eksikliği olan hastalarda bulunan hastalıkla ilişkili en yaygın iki allel nokta mutasyon tarzında olan S ve Z allelleridir (2).
Bu araştırmada Diyarbakır’da Dicle Üniversitesi Tıp Fakültesi Göğüs Hastalıkları Polikliniği’inde ve Göğüs Hastalıkları Hastanesi’nde KOAH tanısı konmuş hastalarda bölgemizde antitripsin eksikliğini araştırmaya yönelik α1-antitripsin serum düzey analizi ve AAT genine ait M, S ve Z alelleri açısından genotipleme çalışması amaçlanmıştır.
2.GENEL BĐLGĐLER
AAT, başlıca karaciğer tarafından üretilen bir akut faz proteinidir. Akciğer dokusunun nötrofil elastaz yoluyla yıkımını önlemektedir. AAT’nin yokluğu veya fonksiyon bozukluğu, akciğerde proteaz-anti proteaz dengesinde kaymaya yol açar ve amfizem gelişmesi için duyarlılığı artırır. AAT eksikliğinin moleküler temeli, çoğunlukla SERPĐNA1 adlı AAT genindeki genetik varyasyondur. AAT, serin proteaz inhibitörleri (serpinler) süper ailesine aittir. AAT geni ve proteini yüksek derecede poliformdur. Mayıs 2005 itibariyle kamusal veri tabanlarında (http//snpper.chip.org) AAT genindeki 186 tek nükleotid polimorfizmi (SNP’ler) listelenmiştir. Đzolelektrik odaklama ile (IEF), proteaz inhibitörü (Pi) fenotipleri olarak adlandırılan >90 protein varyantı belirlenmiştir.
Kronik obstrüktif akciğer hastalığının (KOAH) etiyolojisi ve ilerlemesi, genetik ve çevresel faktörler arasındaki karmaşık etkileşimden kaynaklanır. Dolaşımda en çok bulunan proteaz inhibitörü olan α1-antitripsinin (AAT) gen kodlamasındaki varyasyonlar, KOAH için belirlenen tek genetik risk faktörüdür(8).
2.1 Alfa-1 Antitripsinin Yapısı
α1-antitripsin, tek bir 394 rezidülük polipeptit zincirinden oluşan bir glikoproteindir. Bu glikoproteinde karbonhidrat oranı % 12 dir. α1-antitripsinin toplam molekül ağırlığı 52 kDa’dur. Aktif bölge, “gerilmiş” (stressed) bir büklüm ihtiva eder; serpin proteazlar ile reaksiyonu esnasında reaktif bölgenin karboksi-terminal kısmından küçük bir parçanın ayrılması sonucu oluşan yapı da “gevşemiş” (relaxed) konfigürasyon olarak adlandırılır. α1-antitripsinin tersiyer yapısı globüler bir proteindir. Yaklaşık olarak 20 amino asitlik bir peptid parçasından oluşan
proteinin reaktif merkez büklümü, moleküler yüzey üzerinde dar bir alana yerleşmiştir (Şekil 1). α1-antitripsin molekülünün enzim inhibisyonu yapan bu kısmında 358. pozisyonda çok önemli olan metionin aminoasiti yerleşmiştir. Sigara içenlerde bu aminoasit oksidanlar tarafından oksidasyona uğrayarak metionin sülfokside dönüşür. Bu durum AAT’nin nötrofil elastaz üzerindeki inhibitör etkisinin normalden çok daha az olmasına neden olur. α1-antitripsin, serin proteazların aktif bölgesi ile tetrahedral yapı oluşturarak onların aktivitesini engeller (9,10,11).
Şekil 1. α1-antitripsin’in yapısı. Metionin rezidüsü içeren reaktif merkez büklüm
bölgesi nötrofil elastazı bağlar (11).
α1-antitripsin aktif haldeyken kristalize olmamasına karşın reaktif bölgenin proteolitik kesimi sonucu kristalize bir hal alır ve daha kararlı (relaxed) R formunu oluşturur. Kristalize yapının incelenmesi ile 3 adet β kırmalı (A-B-C) tabakadan ve 9 adet α heliks yapıdan oluştuğu görülmüştür (12,13). Reaktif merkez büklümündeki yarılma, 358. metionin aminoasiti ile 359. serin aminoasiti arasındaki bağda meydana gelir. AAT’nin aktif bölgesi sistein rezidüsü içerir (15). Proteinde disülfid köprüsü yoktur fakat tiyol grubu diğer proteinler ile disülfid bağı oluşturabilir (Şekil 2).
Şekil 2. α1-antitripsin’in tersiyer yapısı. Đki yönden resimlenen katlanmış
haldeki AAT’nin şerit şeklindeki yapısı ve siyah şerit olarak yapısındaki reaktif merkez büklümün gösterilmesi. Reaktif büklümün parçalanmasını takiben, reaktif merkez büklümü s4A olarak A β-tabakası içine katılır. s3A’da 194, s2B’de Trp-238, s1B’de Cys-232 ve s5A’da Glu-342 gösterilmiştir. Yapıda 3 adet β kırmalı A, B, C tabakaları ve 9 adet α heliks yapısı görülmektedir. s3A ve s5A arasında boşluğun açılmasını ve büklüm girişini kontrol eden kapak (shutter) domen kesik çizgilerle halka şeklinde gösterilmiştir. Reaktif büklümün merkeze yakın menteşe bölgesinin orta noktasında Glu-342 yerleşmiş ve P olarak gösterilmiştir. Distal menteşe D olarak gösterilmiştir (14).
Reaktif merkez büklümünün stabilitesi bir su molekülü tarafından sağlanır. 283.serin aminoasitinin OH grubu ile 357.prolin ve 359.serin aminoasitinin karbonil oksijenleri arasında hidrojen bağları meydana gelir (Şekil 3) (15).
Şekil 3. AAT molekülünün reaktif merkez büklümünün 2.0 A°’daki görünümü (15).
2.2 Alfa–1 Antitripsin Geni ve Alfa–1 Antitripsin Proteini
α1-antitripsin geni 14. kromozomun uzun kolunda (14q32.1) yer almakta olup, 5 ekzon ve 4 introndan oluşur. 12301 bç uzunluğunda olan α1-antitripsin geni karaciğerde eksprese olur ve 394 aa’lik tek bir polipeptit zincirinden oluşan, 52 kDa olan bir glikoprotein tarafından α1-antitripsin proteini kodlanır (Şekil 4) (16).
Şekil 4. 14. Kromozom ve AAT geninin lokalizasyonu
AAT geni 14. kromozom üzerinde serpin ailesinin proksimalinde, diğer antiproteaz genlerin (α1-antikimotripsin, kortikosteroid-binding globülin ve protein C inhibitörü genleri ) uç noktasında yerleşmiştir (16).
α1-antitripsin proteini yaklaşık 45 yıl önce klinik kimyager Laurell ve klinisyen Eriksson tarafından keşfedilmiştir. Kan α1-antitripsin düzeyi düşük olan kişileri tanımlamışlar ve bunun pulmoner amfizem ile ilişkili olabileceğini ileri sürmüşlerdir. α1-antitripsini eksik olan hastalar ve onların aile üyelerinde yapılan ek çalışmalarda AAT eksikliğinin pulmoner amfizem ile olan ilişkisi doğrulanmış ve kodominant olarak kalıtıldığı ileri sürülmüştür. Bu çok açık olmayan keşfi ortaya koyan araştırmalar sonucu, elde edilen bazı ipuçları takip edilerek bir sonuca bağlanmış ve proteaz eksikliğinin pulmoner amfizem gelişiminin altında yatan tek mekanizma olmadığı kanısına varılmıştır. Sonuç olarak fonksiyon ve
disfonksiyonların tanımlanmasıyla serin proteinaz inhibitör ya da SERPIN süper ailesi olarak adlandırılan yeni bir aile tanımlanmıştır (1).
AAT eksikliğinin bu ilk raporlarında klinik bulgularla AAT eksikliği ilişkisi pek açık değildi. Bununla birlikte bu buluştan bu yana günümüzde bu molekülün moleküler genetiği, degradasyon proteinlerinin etkisinden dokuları koruyucu fonksiyonu, eksikliğinin amfizeme ve diğer klinik bozukluklara (amfizem, astım, bronşiektazi, siroz, pannikulit, glomerülonefrit, çölyak hastalığı, endokrin ve ekzokrin pankreatik hastalıklar ve antisitoplazmik nötrofilik antikor (C-ANCA)- pozitif vaskülit (Wegener granülomatozis)) nasıl yol açtığı konusunda daha fazla bilgi elde edilmiştir.
AAT 394 amino asitten oluşan 9 α-heliks ve 3 β-tabakalı yaprak içeren globüler bir glikoproteindir. Pi (proteaz inhibitör) lokusun üzerinde kodlanmıştır. 14.kromozomun uzun kolu üzerinde lokalize edilmiştir (7). Büyük bir kısmı karaciğerde sentez edilir ve dolaşıma salınır. Daha az bir kısmı ise alveolar makrofajlar tarafından ve muhtemelen akciğer epitelyum hücrelerinde sentez ve sekrete edilir. Bu tane biçimindeki glikoprotein proteaza yüksek spesifite gösterir ve ona fare kapanı gibi etki eder. AAT’nin geniş spektrumlu antiproteaz aktivitesine sahip olduğu ve akciğerlerde birçok serin proteaz inhibisyonu yaptığı bulunmuştur. Primer fonksiyonu nötrofil elastaz enzim inhibisyonunu başlatmaktır (1).
α1-antitripsin karaciğer tarafından üretilen diğer akut faz proteinler gibi indüklenebilir. Serumda AAT’nin normal seviyeleri 150-350 mg/dL dir (17). α1-antitripsinin plazmadaki konsantrasyonu inflamasyon, enfeksiyon ve malign hastalıklarda 3–4 katına çıkabilir.
SERPIN ailesi içinde α1-kimotripsin, C1 esteraz inhibitor, antitrombin ve plazminojen aktivatör inhibitör-1 bulunmakta olup bunlar kompleman aktivasyonu, inflamatuar, koagülasyon ve fibrinolitik basamaklarda, proteinazların kontrolünü sağlamada çok önemli rol oynar (18).
AAT’deki nokta mutasyonlar hedef proteaz için bağlanma bölgesi görevini yapan mobil domainde meydana gelir. Bu da hepatosit içerisinde proteinlerin polimerizasyonu ile sonuçlanabilir. Bu yüzden dolaşıma etkin bir biçimde salgılanamaz ve akciğerlerde düşük AAT düzeyine yol açar. Etkin elastaz inhibitörü AAT’nin bu eksikliğinin amfizemin ortaya çıkmasına neden olduğu tahmin ediliyor.
Sonuç olarak karşı gelinmemiş elastaz aktivitesine bağlı akciğerlerin elastin matriksindeki tahrip edici etki artar (Şekil 5) (1).
Şekil 5. PiZZ allelli AAT’nin polimerizasyonu akciğerlerde antiproteinaz aktivitenin
azalmasına katkıda bulunur. Buna ek olarak AAT polimerizasyonu proinflamatuar stimulusu haraketlendirirken aktive nötrofilleri de bu bölgeye çeker (1).
2.3 Alfa–1 Antitripsin Eksikliği Ve Kronik Obstrüktif Akciğer Hastalığı
α1-antitripsinin plazma eksikliği ile amfizem ilişkilendirilmiş ve amfizemin α1-antitripsinin plazma düzeyinin normalin % 10 -15’i kadar azalmasından meydana geldiği görüşü yaygın olarak kabul görmüştür. AAT eksikliği akciğerleri savunmasız bırakmakta ve nötrofil elastaz tarafından kontrolsüz sindirimine neden olmaktadır. Z mutasyonu α1-antitripsin ile nötrofil elastaz arasındaki ilişkiyi yaklaşık olarak beş misli azaltır ki bu durumu daha da kötüleştirir. Öyle ki akciğerlerdeki mevcut kullanışlı antitripsin de normal M proteini gibi etkinliğini gösteremez. α1-antitripsin akciğere pasif difüzyonla ya da bronşial epitelial hücreler ve makrofajlar tarafından lokal sekresyonla sunulur. Z ya da diğer mutasyonları taşıyan her vakada proteinlerin sekresyonu sonrası bu proteinlerde mutasyondan dolayı polimer formuna kendiliğinden bir eğilim olduğu görülmüştür (5).
PİZZ antitripsin
Oksidasyon Polimerizasyon Azalmış inhibitör aktivite İnaktivasyon proinflamasyonAmfizem
Plazma eksikliğiŞekil 6. α1-antitripsin molekülünün Loop-Sheet polimerizasyonu (11).
Z allelli α1-antitripsin eksikliği ile ilişkilendirilmiş amfizemli hastalardan alınan akciğer lavaj ve doku örneklerinde normal α1-antitripsin fenotipine sahip amfizemli kişilerden alınan örneklerde olmayan polimerler saptanmıştır. Bu konformasyonel değişiklik (polimer yapıları) bir proteinaz inhibitörü olan antitripsini inaktive eder. Bu inaktivasyon alveollerde koruyucu özelliği olan antitripsinin zaten azalmış düzeylerinin daha fazla azalmasına yol açar. α1-antitripsinin monomer yapıdan polimer yapıya olan değişimi bundan başka olayları da başlatır. Polimer yapıları insan nötrofilleri için kemoatraktan olarak rol oynar. Bu etkinin büyüklüğü kemoatraktan C5a ile benzerlik gösterir. Z α1-antitripsin eksikliği bulunan kişilerden alınan bronkoalveolar lavaj ve akciğer parankimi doku kesitlerinde gösterilen fazla sayıdaki nötrofillerin varlığı polimerlerin bu kemoatraktan etkisini açıklayabilir. Ayrıca polimerler Z allelli α1-antitripsin eksikliğine bağlı çok erken başlangıçlı akciğer hastalığına sahip kişilerde aşikar olan aşırı miktardaki inflamasyona katkıda bulunabilir. Ve sigara içimi bırakıldıktan sonra bile progresif infamasyon devamlılık gösterebilir. Polimerlerin bu inflamatuar özellikleriyle, Z allelli α1-antitripsin eksiklikliği ile ilişkilendirilmekte olan (pannikülitis, pankreatitis, Wegener granülomatozis, glomerülonefritis ve astım) diğer inflamatuar durumlar açıklanabilir (5).
Nötrofil elastaz, insan PMNL’lerin primer granüllerininin bir proteolitik komponentidir. Sadece elastini değil diğer birçok konnektif doku bileşenlerini bozguna uğratan madde olarak bilinir. Major inhibitör enziminin (AAT) yeterli miktarının yokluğunda nötrofil elastaz akciğer parankimini aşındırıp panasiner
amfizeme neden olur. Normal şartlar altında AAT molekülü metionin rezidüsü içeren reaktif bölge büklümü aracılığıyla nötrofil elastazını bağlar ve nötralize eder. Bu yüksek enerjili metionin bağının kırılması AAT molekülünün yapısının değişmesine neden olur. Yapıdaki bu değişiklik AAT’nin nötrofil elastaza doğru yönelmesine ve fare kapanı benzeri bir mekanizma ile nötrofil elastazı yakalayarak inaktive etmesiyle sonuçlanır (7).
Şekil 7. AAT molekülü nötrofil elastazı (gri) kendi havuzu içerisine çeker(sol resim).
Daha sonra protein (nötrofil elastaz) molekülün üst kısmından daha aşağı çekilerek inaktive edilir(sağ resim).Bu ilişki reaktif büklüme (kırmızı) eklenen nötrofil elastazın β sheet A tabakası (yeşil) içerisine ekstradan bir iplik teli gibi girmesiyle gerçekleşir (19).
AAT’nin dolaşımdaki azalmış düzeyleri amfizem için risk olarak tanımlanmıştır. Çeşitli eksik fenotiplerle bağlantılı amfizem prevalansı kaynak alınarak ‘’koruyucu eşik’’ değeri konsepti geliştirilmiştir. Serum AAT değerinin 11µM ( ~ 80 mg/dl ) altında olması bireylerde amfizem için artmış risk olarak kabul edilmiştir (7).
2.4. Alfa–1 Antitripsin Geni Mutasyonları
AAT eksikliği akciğer hastalığı nedeni olan proteaz inhibitör anomalisi olarak çok yaygın olarak tanımlanmıştır (1). Bu tarihe kadar 120’nin üzerinde farklı allel tanımlanmıştır. Her üretim AAT molekülünün farklı fenotipik varyantıdır. Alleller kodominant olarak eksprese edilir. Bu 120 alellik varyantın isimlendirilmesi jel elektroforezindeki göç etme hızlarına göre yapılır. En hızlı göç eden varyant A, en yavaş hareket eden varyant ise Z olarak adlandırılmıştır. Diğer varyantlar da bu iki varyant arasında göç etme oranlarına göre benzer biçimde sıralanmıştır. Normal molekül orta derecede migrasyon gösterir ve M (middle’dan isim alıyor) olarak bilinirken Z molekülü en yavaş hareket edendir. Serum AAT düzeyi, α1-antitripsin eksikliğinde hastaların, hangi klinik gelişimler için risk altında olduğunun belirlenmesi açısından çok önemlidir. Bu yüzden alleller çeşitli klinik durumlarla ilişkilendirilen serum düzeylerine göre kategorize edilmiştir. Bu sınıflama (Tablo 1’de) gösterilmiştir (7).
Proteaz Đnhibitör Allel Mutasyon Tipi Hücresel Defekt Hastalıkla ilişkisi
NORMAL ALLELLER
M (farklı subtipleri) Subsitüsyon (1 bp) Yok Normal Xchristchurch Subsitüsyon (1 bp) Yok Normal EKSĐKLĐK ALLELLERĐ
S Subsitüsyon (1 bp) Đntrasellüler Harabiyet Akciğer Z Subsitüsyon (1 bp) intrasellüler Birikim Akciğer,Kc Mmalton Delesyon (3 bp) Đntrasellüler Birikim
Akciğer,Karaciğer
Siiyama Subsitüsyon (1 bp) Đntrasellüler Birikim Akciğer Mheerlen Subsitüsyon (1 bp) Đntrasellüler Harabiyet Akciğer Mprocida Subsitüsyon (1 bp) Đntrasellüler Harabiyet Akciğer Mmineral springs Subsitüsyon (1 bp) Đntrasellüler Harabiyet Akciğer NULL ALLELLER
QOgranite falls Delesyon (1 bp) Stop kodon; Akciğer mRNA’sız
QOludwigshafen Subsitüsyon (1 bp) Proteinsiz Akciğer,Kc QOhon-kong 1 Delesyon (2 bp) Truncated; Akciğer
Đntrasellüler Birikim
QOisola di procida Delesyon (17 bp) Kodlanan bölgenin Akciğer delesyonu; mRNA’sız
DĐSFONKSĐYONEL ALLELLER
Pittsburg Subsitüsyon (1 bp) Antitrombin 3 aktivitesi Kanama Mmineral springs Subsitüsyon (1 bp) Nötrofil elastazın defektif Akciğer
Đnhibisyonu
Z Subsitüsyon(1 bp) Nötrofil elastazın defektif Akciğer,Kc Đnhibisyonu
Tablo 1. Karekteristik mutasyon tiplerini içeren seçilmiş proteaz inhibitör varyantlarının
AAT’nin serum düzeyi ve moleküler fonksiyonuna dayanılarak alleller dört grupta sınıflandırılmıştır.
• Normal Alleller (AAT’nin normal plazma seviyeleri ile ilişkilidir ve normal fonksiyon gösterirler): M alleli
• Eksiklik Allelleri (AAT’nin <20µmol/L plasma düzeyleri ile ilişkilidir.): Z alleli, S varyantı ve diğer nadir varyantlar
• Null Alleller (Bu grup aleller ölçülemeyen AAT düzeyleri ile ilşkilidir. Bu alleller çok yaygın değildir. Ama görüldüğü zaman, akciğer hastalığı için yüksek risk oluşturur.): QO alleli
• Disfonksiyonel Alleller (Bu grup aleller AAT’nin normal plazma seviyeleri ile ilişkili; bununla birlikte mevcut AAT fonksiyon gösteremez ve bu grup aleller de hastalıklarla ilişkilidir.): F ve Pittsburg allelleri (7,20).
2.5.En sık rastlanan AAT Geni Allelleri, Dağılımı ve Sonuçları
Normal AAT alleli M tipi olup, Avrupa verilerine göre toplumun (beyez ırkta) %90-95’i homozigot PĐM (PĐMM) özelliktedir. Buna ek olarak en az 100 normal ve eksiklik alleli tanımlanmıştır (21,22). Protein elektroforezi kullanılarak tanımlanmış olan farklı AAT fenotipleri arasında, toplumda en yaygın görülen varyantlar olan M1, M2, M3, M4 %90 oranında bulunmuştur (16). AAT eksikliğini nadir görülen birçok genetik varyant düzenlemektedir (23). Çok polimorfik olan AAT geninin en yaygın iki varyantı ya da eksiklik alleli nokta mutasyon tarzında olan PĐS ve PĐZ allelleridir (1).
PĐS alleli AAT geninin 3. eksonunda meydana gelen substitüsyon (A→T) türündeki nokta mutasyonu sonucu proteinin aa dizisinde 264. pozisyondaki
Glutamik asit-Valin (Glu264GAA→ ValGTA) ile yer değiştirmesi sonucu oluşur.
PĐZ alleli ise AAT geninin 5.eksonunda meydana gelen substitüsyon (G→A) türündeki nokta mutasyonu sonucu proteinin aa dizisinde 342. pozisyondaki
glutamik asit -lizin amino asiti (Glu342 GAG → Lys AAG) ile yer değiştirmesi
Sadece % 1 oranında görülen Z alleli (PĐZZ) bütün varyantlar arasında hastalıkla ilişkili en yaygın mutasyondur. Z alleli amfizem gelişiminde halen bilinen tek genetik risk faktörüdür. Öyle ki, ciddi AAT yetmezliği olan kişilerin %95’inden çoğu bu fenotipe sahiptir. Bu kişilerin yarısından fazlası akciğer hastalığından kaybedilmektedir (20,22). Z mutasyonuna bağlı AAT’nin yaygın plazma eksikliği erken başlangıçlı panlobüler amfizem ile ilişkilidir. Azalmış AAT düzeyi (normalin ~% 10-15’i) sonucu antiproteaz aktivitenin koruyucu örtü etkisi bozulur. Z mutasyonuna bağlı AAT’nin lokal eksikliği akciğerler içerisinde polimer formasyonunu başlatır. Bu polimerler sadece AAT inaktivasyonunda değil aynı zamanda insan nötrofilleri için kemoatraktan olarak da rol oynarlar. Polimerik AAT’nin kemotaktik özelliği Z homozigot AAT’li kişilerde akciğerlerdeki fazla sayıdaki nötrofillerin varlığını açıklayabilir. Ve bu hastalardaki amfizemin patolojisi için yeni mekanizmalar ileri sürülmektedir (21).
S alleli % 2-3 oranında görülür. S alleli plazma AAT konsantrasyonunda hafifçe azalmaya yol açmaktadır (22). Buna karşın bu azalma Z allelindeki azalma ile aynı derecede değildir. PĐMS genotipinin KOAH için artmış risk taşıdığı dikkate alınmamıştır. Amerikan toraks derneğinin AAT eksikliği için sunduğu raporda da PĐMS heterozigotluğunun KOAH için olası bir risk faktörü olduğundan bahsedilmemiştir (3). Ana AAT fenotiplerinde amfizem gelişme riski (Tablo 2’de) gösterilmiştir.
Fenotip
Amfizem Riski
MM Risk yok
MS Risk yok
SS Risk yok
MZ Muhtemel zayıf risk artışı
SZ Zayıf risk artışı
ZZ Yüksek risk
Null Yüksek risk
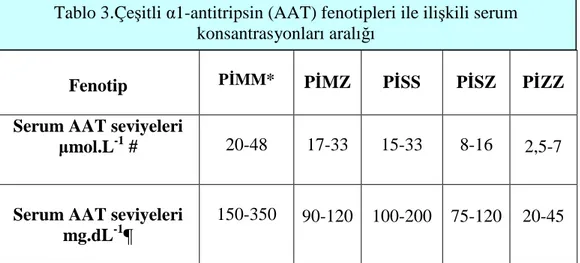
Çok nadir durumlarda, total AAT eksikliği iki boş allelin kalıtımından kaynaklanır (24). Bu nedenle, beyaz ırktaki orta derece ve ciddi AAT eksikliği fenotipleri, çoğunlukta S-Z- ve boş allellerin kombinasyonları sonucu meydana gelir. Ciddi AAT eksikliği (örneğin 11µmol. L-1 koruyucu eşiğin altındaki AAT seviyeleri ), Z veya boş alleli açısından homozigot veya heterozigot denekleri (örnekleri) içermektedir. Orta dereceli AAT eksikliği PĐMZ, PĐSS ve PĐSZ fenotipleri bulunan olguları içermektedir. Bunların serum seviyeleri normalin %20’sinden %60’ına kadar değişmektedir (örneğin 11 ile 20 µmol. L-1 arasında AAT seviyeleri)(8). Çeşitli α1-antitripsin fenotipleri ile ilişkili serum konsantrasyon aralığı (Tablo 3)’de gösterilmiştir (25).
Fenotip PĐMM* PĐMZ PĐSS PĐSZ PĐZZ Serum AAT seviyeleri
µmol.L-1 # 20-48 17-33 15-33 8-16 2,5-7
Serum AAT seviyeleri mg.dL-1¶
150-350 90-120 100-200 75-120 20-45
* PĐMM fenotipi ile ilişkili allellerin tüm kombinasyonlarını içermektedir;
# US kayıtlı saflaştırılmış standart kullanılarak ölçülen (µmol.L-1) ¶ Tipik ticari standart kullanılarak ölçülen (mg.dL-1) değerlerdir (25).
Dünya çapında birçok ülkede α-1 antitripsin eksikliğinin genetik epidemiyolojisini oluşturacak araştırmalar yapılmıştır. Homozigot, heterozigot ve taşıyıcıların sayısı belirlenmiştir. Bu yaklaşım ile α1- antitripsin eksikliğinin prevalansını oluşturacak verilerin oluşması sağlanmıştır (23). Yapılan çalışmalar Z allelinin kuzey Avrupada 107 ve 135 jenerasyon önce ve S allelinde Portekiz ile Đspanyanın Đber yarımadasında 279-470 jenerasyon önce ortaya çıktığını göstermektedir. Bu allellerin ilk ortaya çıktığı zamandan bu yana her iki allel de dünya çapındaki her major ırkta gözlenmektedir. Bununla birlikte, bu anormal alleller
Tablo 3.Çeşitli α1-antitripsin (AAT) fenotipleri ile ilişkili serum konsantrasyonları aralığı
direk Avrupalı soyundan olanlar içinde hala en yaygın prevalansa sahiptir. Kafkaslarda M varyantının tahmini prevalansı % 90-95’tir, S ve Z heterozigotlarda ise geriye dönük yapılan çalışmalarla ortaya konan tahmini prevalans sırasıyla % 2-3 ve % 1-3 tür (7).
Alfa–1 antitripsin eksikliği prevalans verileri analiz edildiğinde dünya çapında bütün major subgrupların bu genetik hastalıktan etkilendiği görülmüştür. Dünyada en az 116 milyon taşıyıcı (PĐMS ve PĐMZ) ve 3.4 milyon eksiklik allel kombinasyonuna (PĐSS, PĐSZ ve PĐZZ) sahip kişi bulunmaktadır. Bundan başka yine bu prevalans araştırmalarına ait veriler ışığında birkaç yargıya varılmıştır. Veriler göstermiştir ki α1-antitripsin eksikliği Afrikalı siyahlar, Araplar ve Orta-doğudaki Yahudiler, dünya çapındaki beyazlarda, Orta Asyada, Uzak Doğu Asyada, Güneydoğu Asyada da görülmektedir. Alfa–1 antitripsin eksikliği sadece Avrupalı beyazların çok yaygın, ciddi, kalıtsal bir hastalığı değil aynı zamanda dünyadaki diğer bütün ırkları etkileyen bir hastalıktır (23). Afrikada yapılan oldukça geniş kapsamlı bir çalışmada PĐS ve PĐZ allelleri varlığı Nijerya, Güney Afrika, Somali’de tespit edilirken; Angola, Bostwana, Kamerun, Mozambik, Namibya ve Kongo’da daha çok PĐS varyantı ve son olarakta Mali’de PĐZ varyantının daha sık olduğu belirlenmiştir (26). 1971-74 yılları arasında 200.000 Đsveçli yenidoğanda yapılan geniş çalışmada ciddi AAT eksikliğinin direk populasyon taraması yapılmıştır. Bu çalışmada, PĐZZ fenotipinin yenidoğandaki sıklığı 1/1600 canlı doğum olarak bulunmuştur (7). Đspanyanın kuzeybatısında genel popülasyonda rastgele seçilmiş 1116 kişide AAT fenotip taraması yapılmıştır. Bu kişilerin 857’sinde PĐMM, 202’sinde PĐMS, 31’inde PĐMZ, 13’ünde PĐSZ ve 13’ünde de diğer nadir görülen fenotipler tanımlanmıştır. PĐZZ fenotipi hiç tespit edilmemiştir. Popülasyonda analiz edilmiş Z allel sıklığının en fazla Avrupada olduğu ve S allel sıklığının ise dünyada diğer bölgelere benzer olduğu bulunmuştur (27). 20 Asya ülkesinde α-1 antitripsin eksikliği için en yaygın iki eksiklik allelini içeren toplam 31.177 kişiyi kapsayan tahmini prevalans çalışması yapılmıştır. Eksiklik allelleri PĐS ve PĐZ’in prevalanslarına ilişkin olarak Asya ülkeleri ve bölgeleri arasında belirgin farklılıklar saptanmıştır. Bu da prevalans üzerine yapılan diğer çalışmalarda belirtildiği gibi AAT eksikliğinin sadece Avrupa’da görülmediği, küçük grupları tutan bir genetik hastalık olmadığını göstermektedir. Bu yirmi Asya ülkesi arasında ve bunun yanı sıra Asya’da belirli bir coğrafi bölge içerisinde yer alan ülkeler arasında
PĐS ve PĐZ eksiklik allellerinin prevalansında belirgin farklılıklar bulunmuştur. En fazla sayıda ZZ fenotipi (3,000-14,000) Afganistan, Pakistan, Suudi Arabistan ve Tayland’da saptanmış; bu fenotip geri kalan ülkelerin her birinde <1,700 dir (28). 21 Avrupa ülkesinde toplam 75,390 kişide yapılan prevalans çalışmasında bu 21 ülke arasında PĐS ve PĐZ allellerinin dağılımı açısından ciddi farklılıklar görülmüştür. En fazla sayıda PĐZZ fenotipi (sekiz ülkenin her birinde 5,000-15,000 kişi PĐZZ fenotipli) taşıyan kişiler Đtalya, Đspanya, Almanya, Fransa, Đngiltere, Letonya, Đsveç ve Danimarka’da bulunmuştur. Bunun aksine en az sayıda PĐZZ fenotipi (altı ülkenin her biri için bu değer <1,000) taşıyan kişiler Finlandiya, Macaristan, Polonya, Estonya, Litvanya ve Đsviçre’de bulunmuştur. Geri kalan yedi Avrupa ülkesinde ılımlı sayıda (onların her biri için bu sayı ~1,000-2,000) PĐZZ fenotipli kişi olduğu kabul edilmiştir (29).
2.6. Kronik Obstüriktif Akciğer Hastalığı (KOAH)
Kronik obstrüktif akciğer hastalığı (KOAH), başta sigara olmak üzere zararlı toz ve partiküllerin yanı sıra diğer çevresel ve kişiye bağlı risk faktörlerinin etkisi ile ortaya çıkan; kısmen reverbsibl hava yolu obstrüksiyonu ve hava akımında azalma ile seyreden ilerleyici bir hastalıktır. Amfizem ve kronik bronşiti kapsar. Genetik olarak duyarlı kişilerin bu risk faktörleri ile uzun süre ve yüksek dozda karşılaşmaları sonucu kronik inflamasyon gelişerek kronik bronşit ve/veya amfizemin klinik, fizyolojik ve patolojik değişiklikleri ortaya çıkar (30). KOAH Amerika’da 4.sırada ölüm nedeni ve major morbidite sebebidir (31).
KOAH gelişiminde en önemli, kesinliği bilinen risk faktörleri sigara kullanımı, mesleki nedenlerle maruz kalınan etkiler ve AAT eksikliğidir. KOAH’ın bireysel genetik duyarlılık ile olumsuz çevre faktörlerinin karşılıklı etkileşimi sonucu geliştiği bildirilmektedir. Bunlara ek olarak bazı risk faktörlerinin de KOAH gelişiminde rol oynayabileceği düşünülmektedir. KOAH gelişiminde olası risk faktörleri Tablo 4’te görülmektedir.
KOAH’lı bireylerin yalnızca %25’inin KOAH tanısı ile bir sağlık kurumuna kayıtlı olduğu düşünülmektedir. Bu nedenle, KOAH prevalansı konusundaki bilgiler yetersizdir. Amerika Birleşik Devletleri’nde 1996 yılında 16 milyon KOAH hastası olduğu bildirilmiş, gerçek sayının ise 30-35 milyon olduğu tahmin edilmiştir. Dünya
Sağlık Örgütü (DSÖ) verilerine göre hastalık prevalansı, tüm dünyada erkeklerde binde 9,34 kadınlarda binde 7,3’tür (30).
Tablo 4.KOAH’ta risk faktörleri.
Çevresel Faktörler Kişiye Bağlı Faktörler
• Sigara içimi
• Mesleki toz ve dumanlar • Hava kirliliği • Sosyoekonomik faktörler/Yoksulluk • Beslenme • Solunum yolu infeksiyonları • Genetik faktörler
(Alfa-1 antitripsin eksikliği)
• Diğer genetik faktörler • Aile öyküsü
• Cinsiyet,Irk • Yaş
• Hava yolu hiperaktivitesi • Atopi
• Düşük doğum ağırlığı
2.7.KOAH’ın Tanısında Solunum Fonksiyon Testi
KOAH kısmi reversibilite gösteren, progresif ve yavaş seyirli bir hava akımı kısıtlanmasıyla karekterize bir durum olarak tanımlanmıştır. Hastalığın evrelendirilmesinde klinik semptom ve bulguların yanı sıra FEV1 ve FEV1/FVC
oranındaki azalma kriter olarak kullanılmaktadır. Dolayısıyla KOAH fizyolojik olarak tanımlanan bir hastalıktır ve bu hastalığın değerlendirilmesinde spirometrik testlerin büyük önemi bulunmaktadır (32).
KOAH tanılı olgularımızı GOLD 2007’yi kullanarak FEV1 ve FEV1/ FVC
değerlerine göre evrelendirdik.
Tablo 5.GOLD 2007’ye göre KOAH’ın spirometrik sınıflaması (33).
KOAH Şiddetinin Spirometrik Sınıflaması
Evre I:Hafif FEV1/FVC < 0.70
FEV1≥ 80% predicted
Evre II:Orta FEV1/FVC < 0.70 50% ≤ FEV1< 80% predicted
Evre III:Şiddetli FEV1/FVC < 0.70
30% ≤ FEV1< 50% predicted
Evre IV:Çok şiddetli FEV1/FVC < 0.70
FEV1 < 30% predicted ya da FEV1 < 50% artı kronik
respiratuar yetesizlik
2.8.AAT’nin KOAH’taki Önemi
AAT KOAH’a yol açtığı bilinen tek genetik bozukluktur. KOAH hastalarının tahminen sadece %1-2’sinde ciddi AAT yetmezliği olmasına rağmen KOAH’a yol açan çevresel ve genetik faktörlerin etkileşiminde bir model oluşturur. Amerikada 965 KOAH hastasında yapılan çalışmada % 1,9 oranında PĐZZ fenotipi bulunmuştur (22,34).
AAT enzimi, proteolitik enzimlerin major inhibitörü olup, alt solunum yollarında kuvvetli bir doku yıkıcı proteaz olan nötrofil elastazın akciğer dokusunda yapacağı yıkımı önler. Bu koruyucu mekanizma çalışmadığında, alveol duvarlarında hasar ve amfizem oluşur (35).
2.9.AAT Eksikliği Ve Tütün Dumanı Arasındaki Đlişki
Sigara kullanımı KOAH gelişiminde bilinen major çevresel risk faktörüdür. Bununla birlikte sigara içenlerin sadece küçük bir kısmında semptomatik hastalık gelişmektedir. Aile ve ikizlerde yapılan çalışmalar KOAH’ın gelişiminde genetik faktörlerin de katkısının olduğunu ortaya koymuştur (36). Erken başlangıçlı pulmoner
fonksiyonları ciddi azalma gösteren KOAH’lı kişilerde sigaranın etkileri bu kişilerin genetik duyarlılıklarına göre değişebilir (31).
Bu genetik defekti taşıyan kişilerde sigara içiciliği KOAH’ın ortaya çıkmasını kolaylaştırır (1). ZZ tipi AAT eksikliğine sahip bireylerde sigara kullanımı amfizem gelişiminde önemli bir risk faktörüdür (37).
Kuvvetli bir reaktif oksijen radikal kaynağı olan sigara dumanının sigara içmeyenlere kıyasla sağlıklı ve sigara kullananlarda serum ve alveol AAT, anti-elastaz aktivitesini azalttığı bulunmuştur. Yapılan çalışmalar ciddi ve orta derecede AAT eksikliği bulunan kişilerde tütün dumanına maruz kalan grupta, kalmayanlara göre akciğer fonksiyonlarındaki bozulmanın daha fazla olduğu görülmüştür (8).
Bu çalışmada, Dicle üniversitesi Tıp Fakültesi Göğüs Hastalıkları Polikliniği ile Diyarbakır Göğüs Hastalıkları Hastanesi’nde KOAH tanısı konmuş 10 Kadın 51 Erkek toplam 61 olguda, bölgemizdeki AAT allelerinin sıklığını araştırmaya yönelik AAT geninin en sık görülen iki varyantı olan S ve Z allellerinin genotipleme çalışması ve bu olgulardaki serum AAT düzeylerininin araştırılması amaçlanmıştır.
3.GEREÇLER VE YÖNTEMLER
3.1.GEREÇLER
3.1.1.Kan Örneklerinin Elde Edilmesi
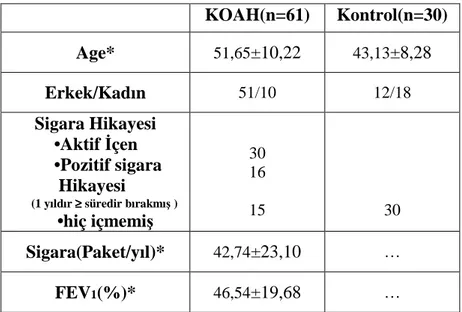
Bu araştırmada, Dicle Üniversitesi Tıp Fakültesi Göğüs Hastalıkları Polikliniği’nde ve Göğüs Hastalıkları Hastanesi’nde KOAH tanısı konmuş yaş ortalaması (51,65±10,22) olan 10 Kadın ve 51 Erkek toplam 61 olgu Anabilim Dalımız Moleküler Tanı Laboratuvarında çalışılmak üzere, AAT geninin en sık görülen iki varyantı olan S ve Z allelleri ”α1-antitripsin Strip Testi” ile α1-antitripsin mutasyonları açısından incelendi. KOAH tanılı bu 61 olgunun tümünde aynı zamanda serum AAT düzeyleri Dicle Üniversitesi Tıp Fakültesi Merkez Laboratuvarında BECKMAN COULTER IMMAGE (Immunochemistry system) cihazında nefelometrik yöntem kullanılarak ölçüldü. 30 kişiden oluşan kontrol grubu oluşturuldu. Kontrol grubu daha önce herhangi bir hastalık teşhisi almamış, genel kontrol amacıyla polikliniğe başvuran, sigara içmemiş ve yaş ortalaması (43,13±8,28) olan sağlıklı 30 olgudan seçildi ve onlarda da serum AAT düzeyleri çalışıldı. KOAH tanısı almış hastalar arasından toplam 61 olgu seçilirken bu genetik hastalıkla ilişkilendirilebilecek sorulardan oluşan anket çalışması yapıldı (Ailede birinci derece yakınlarda KOAH öyküsü olup olmadığı, KOAH’ın başlangıç yaşı ve hastalığın klinik seyri sorgulandı). Ailede birinci derece yakınlarda KOAH öyküsü pozitifliği bulunan 55 yaş altı veya 55 yaş üstü olup erken başlangıçlı KOAH tanısı alan ve olasılıkla AAT mutasyonu düşündüğümüz KOAH olguları seçilen 61 olgu içerisine dahil edildi. KOAH tanılı 54 olgunun solunum fonksiyon testi bilgileri alınarak GOLD 2007‘ye göre evrelendirildi. 7 KOAH’lı hasta solunum fonksiyon testine uyum sağlayamadığından evrelendirilemedi.
Bu analizler için KOAH tanılı 61 olgunun her birinden muhtemel mutasyon analizi için bir adet EDTA’lı tam kan tüpüne 2 cc ve serum AAT düzeylerini çalışmak için bir adet jelli biyokimya tüpüne 3 cc olacak şekilde kan örnekleri alındı. Yine 30 kişiden oluşan kontrol grubundan da serum AAT düzeylerini çalışmak için bir adet jelli biyokimya tüpüne 3 cc olacak şekilde kan örneği alındı. Bu kanlar soğuk zincir kuralına uyularak Dicle Üniversitesi Tıp Fakültesi (DÜTF) Biyokimya Anabilimdalı Merkez Laboratuvarına ulaştırıldı. Örneklerin kayıtları ve
numaranlanması işleminin ardından tam kan tüpü mutasyon analizinin yapıldığı Anabilim Dalımız Moleküler Tanı Laboratuvarına, jelli biyokimya tüpü serum AAT düzey analizinin yapıldığı Dicle Üniversitesi Tıp Fakültesi Merkez Laboratuvarı Nefelometri bölümüne gönderildi. Mutasyon analizinin yapıldığı Moleküler Tanı Laboratuvarında muhtemel mutasyon çalışmak üzere (-80 ºC’de) saklanmış EDTA’lı örneklerden DNA izolasyonu yapıldı ve örnekler (- 20 ºC’de) saklandı. Đzolasyon işlemlerinden sonra aynı Moleküler Tanı Laboratuvarında DNA’ları izole edilmiş bütün örneklerin PCR yardımı ile DNA ürünleri çoğaltıldı ve ardından çoğaltılmış DNA ürünleri, ”α1-antitripsin Strip Testi” ile α1-antitripsin mutasyonları açısından incelendi. Merkez Laboratuvarı Nefelometri bölümüne gönderilen örnekler 4500 rpm’de 5 dk santrifüj edilerek elde edilen serumlardan serum AAT düzeyleri çalışıldı. Çıkan sonuçların tümü daha önce oluşturulmuş hastaya ait solunum fonksiyon testi bilgilerinin de işlendiği anket çalışmasındaki bilgilere eklendi.
3.1.2.Kullanılan Cihazlar
1.Serum AAT analizörü (Beckman Coulter Immage, cihaz kodu:2528) 2.Santrifüj (Eppendorf Centrifuge 5702)
3.Mikrosantrifüj (Eppendorf Centrifuge 5415 C) 4.Isıtıcı Blok (Đnkübatör) (Bioer CHB202)
5.Hibridizasyon işlemi için (TECAN marka profiBlot T48 cihazı) 6.Vorteks (Karıştırıcı) (Jencons/Julabo Miximatic)
7.Derin Dondurucu(-80 ºC’de) (Heto Ultra Freze UF 4420) 8.Derin Dondurucu (- 20 ºC’de ) (Arçelik 2031 D)
9.Termal Döndürücü (Eppendorf Mastercycler Gradient) 10.Otomatik Pipet (Rainin 10-100µl,100-1000 µl ve 0,5-10 µl) 11.Spektrofotometre (Unicam 8625 UV/VIS)
3.1.3.Kullanılan Kimyasal Maddeler Ve Kitlerin Bileşimi
1.Serum AAT analiz kiti:
AAT reagent IMMAGE (Đmmunochemistry systems) (Kit Lot M705592.seri no:A694)
Kullandığımız kit ve yönteme göre serum AAT referans aralığımız: (88-174) mg/dl
2. α1-Antitripsin Strip Assay Kiti (α1-Antitripsin Mutasyon Analiz Kiti): (Hain Lifescience Genotype® AAT VER 1.0)
Primer Nucleotide Mix (PNM) 0,5 ml Control DNA (HCD) 25 µl Membrane Strips (STRIPS) 12 Adet Denaturation Solution (DEN) 0,3 ml Hybridization Buffer (HYB) 20 ml Stringent Wash Solution (STR) 20 ml Rinse Solution (RIN) 50 ml Conjugate Concentrate (CON-C) 0,2 ml Conjugate Buffer (CON-D) 20 ml Substrate Concentrate (SUB-C) 0,2 ml Substrate Buffer (SUB-D) 20 ml
DEN (<2% NaOH içerir), Conjugate Concentrate (Streptavidin-Alkalin Fosfataz içerir), Substrate Concentrate (Dimetil Sülfoksid, Substrat solüsyon içerir), Conjugate Buffer (1 % blocking reagent, <1% NaCl içerir), Substrate Buffer (<1% MgCl2, <1% NaCl içerir).
Kullanılan ”α1-antitripsin Strip Assay Lot numaraları” -Lot:(DL00040) -Lot:(DL00040) -Lot:(DL00046) -Lot:(DL00046) -Lot:(DL00046) 3.2.YÖNTEMLER
3.2.1 α1-Antitripsin Analiz Yöntemi
KOAH tanısı konmuş 61 olgunun ve daha önce herhangi bir hastalık teşhisi almamış genel kontrol amacıyla polikliniğe başvuran sigara içmemiş sağlıklı 30 olgunun her birinden jelli biyokimya tüpüne 3 cc olacak şekilde alınan kan
örneklerinden 4500 rpm’de 5 dk’da santrifüjle elde edilen serumlarda Dicle Üniversitesi Merkez Laboratvuarında bulunan Beckman Coulter firmasına ait IMMAGE (Immunochemistry system) cihazında nefelometrik yöntemle ticari ölçüm kiti kullanılarak serum AAT düzeyleri ölçüldü. KOAH’lı 61 olgunun tümü α1-antitripsin mutasyonları açısından incelendi.
3.2.2. α1-Antitripsin Strip Yöntemi
DNA*STRIP teknolojisine dayanan AAT genotip analiz testi insan alfa–1 antitripsin geni üzerinde yer alan PI*M/Z ve PI*S lokusların birlikte tanınmasına izin verir.α1-Antitripsin gen mutasyonlarını belirlemek için Polimeraz zincir reaksiyonu (PCR) ve Reverse-Hybridization usulleri üzerine kurulu bir testtir.
Metodoloji: Đşlem üç basamağı içerir. Bunlar: 1-DNA izolasyonu
2-α1-Antitripsin geninin biyotin ile işaretlenmiş primerler kullanılarak PCR ile
amplifikasyonu
3-Biotin işaretli amplifikasyon ürünlerinin bir şerit üzerine paralel bantlar şeklinde dizili immobilize edilmiş normal ve mutasyona özgü oligonükleotid problarını içeren membranları taşıyan bir test stribine bağlanması ve bu amplifikasyon ürünlerinin
hibridizasyonu.
Bağlı bulunan biotinlenmiş sekansların üzerine, ”streptavidin-alkalin fosfataz
konjugatının” eklenmesi ile alkalin fosfataz aracılı boyanma reaksiyonu gerçekleşir.
Bu görünüm bantların paterninin kolay ve hızlı bir şekilde ayrımının yapılmasını sağlıyor (38).
3.2.3.AAT Strip Yöntemi ile α1-Antitripsin Mutasyon Analizi 3.2.3.1.DNA Đzolasyonu
DNA izolasyon kit
(Invitek marka Invisorb® Spin Blood Mini Kit) Lysis Buffer A 15 ml
Binding Buffer B6 30 ml Elution Buffer D 15 ml
Wash Buffer I 30 ml (30 ml alkolle (% 96 ya da % 100’lük etanol) sulandırılır.) Wash Buffer II 18 ml (42 ml alkolle (% 96 ya da % 100’lük etanol) sulandırılır.)
EDTA’lı tam kan tüplerinde (-80 ºC’de) saklanmış örnekler oda ısısında çözünmeye bırakılır. Bu arada 1.5 ml’lik kapaklı ependorf tüpleri içlerine bırakılacak örneklerin numaraları ile işaretlenir. Tam kan tüpleri içerisindeki örnekler, kendilerine ait ependorf tüplerine alınmadan önce birçok defa ters yüz edilerek karıştırılır.
Lysis solüsyon ve diğer DNA izolasyon solüsyonları tam kan tüpleri ile eş zamanlı olarak oda ısısına gelmek üzere soğutucudan çıkarılırlar.
• 200 µl kan örneği, 200 µl lizis buffer A ve 20 µl Proteinaz K 1,5 ml’lik ependorf tüpüne konulur. Kapağı kapatılarak tüp kısa süreli vortekslenir.10 dk 56 ºC’de inkübasyona bırakılır.
• 400 µl Binding buffer B6 tüpe eklenir, 10 sn vortekslenir veya 3 defa pipetleme yapılır. Kısa bir spin yapıldıktan sonra sıvının tamamı RTA Spin filtreli tüpe aktarılır, 3 dk oda sıcaklığında inkübe edilir ve 12 000 rpm/2 dk santrifüj edilir.
• Toplama tüpü değiştirilir, filtre üzerine 500 µl Wash buffer R1 eklenir ve 12 000 rpm/1 dk santrifüj edilir.
• Toplama tüpü değiştirilir, filtre üzerine 800 µl Wash buffer R2 eklenir ve 12 000 rpm/1 dk santrifüj edilir.
• Filtre boş toplama tüpüne aktarılır maximum speed/4 dk santrifüj edilerek alkolden arındırılır.
• Filtre temiz 1,5 ml’lik ependorf tüpüne aktarılır ve alkolün tamamen uzaklaşması için 3 dk kapak açık biçimde oda sıcaklığında inkübe edilir.
• Filtre membranın tam ortasına ısıtılmış 56 ºC’deki 200 µl Elution buffer D eklenir, 5 dk oda sıcaklığında inkübe edilir.
• 10 000 rpm/1 dk santrifüj edilir ve filtre atılarak, ependorf içindeki ekstrakt alınır ve -20 ºC’de saklanır.
(Bu işlemler yapılırken kullanılan pipet uçlarının ve ependorf tüplerinin steril olmasına dikkat edilmelidir).
Elde edilen DNA ürünlerinin verimini hesaplamak için örneklerden alınan 20 µl’lik DNA ürünü 580 µl saf su ile 600 µl’ye tamamlandı ve sırasıyla 260 ve 280 nanometre dalga boylarında spektrofotometrik olarak optik dansiteleri belirlendi. Verim= OD260 / OD280 formülünden verim hakkında bilgi sahibi olundu. Bu formüle
göre elde edilen değerler (1,4-1,6) arasında bulunduğundan izolasyonun verimli olduğu kabul edildi.
3.2.3.2.In-vitro Amplifikasyon
Polimeraz zincir reaksiyonu, dizisi bilinen iki bölge arasında uzanan DNA parçasını çoğaltmak için kullanılır. PCR, lökositlerden veya değişik materyallerden elde edilen genomik DNA’nın istenilen bir bölgesinin, in vitro koşullarda, bu hedeflenen bölgeye özgü primer adı verilen özel baz dizileri kullanılarak milyon kez çoğaltılması yani ”amplifikasyonu” işlemidir. DNA üzerinde belirlenen; en az 50-100, en fazla 2500 nükleotid uzunluğundaki bir bölge hedeflenen bölgedir. Amplifikasyonda, önce DNA 95 ºC’ye kadar ısıtılarak çift iplikli DNA’nın ayrılarak; tek iplikli DNA haline geldiği Denaturation (denatürasyon) işlemi sağlanır. Đkinci aşamada ortamın ısısı 55-60 ºC’ye düşürülerek özgün primerlerin komplementer dizilere yapışması sağlanır. Bu aşamaya da yapışma anlamına gelen Anneling denir. Son aşamada ise; ısı 72 ºC’ye yükseltilerek DNA polimerazın yerini tutan Taq polimeraz enzimiyle ortamdaki dNTP’lerin (deoksi nükleotid trifosfat) 5’→3’ yönünde zincire eklenerek zincirin uzaması sağlanır. Bu son aşamaya da Extension adı verilir. Denatürasyon, Anneling ve Extension aşamalarından meydana gelen bir döngü her tekrar edildiğinde meydana gelen ürün sonraki döngüde kalıp görevi gördüğünden her bir başarılı döngü temel olarak istenilen DNA ürününün miktarını ikiye katlar. Taq DNA polimeraz ısıya dayanıklı olup 95 ºC’lik uzamış inkübasyonda canlı kalarak amplifikasyonun her aşamasında ortama yeniden enzim ekleme gereksinimini ortadan kaldırmıştır. Yüksek etkinliğe rağmen hedef dizilerin amplifikasyonu sınırsız bir işlem değildir. Normal tepkime koşullarında Tag DNA polimerazın miktarı amplifikasyonun 25-30 döngüsünden yani yaklaşık 106 defalık bir amplifikasyon düzeyine eriştikten sonra giderek kısıtlanır (39,40,41,42,43,44).
Bu prensiplere dayanarak çoğaltılan DNA izolasyon ürünleri, aşağıdaki prosedürler uygulanarak Eppendorf firmasına ait Mastercycler Gradient (Autorierter Thermocycler PCR ) cihazında amplifiye edildi:
• Amplifiye edilecek her örnek için bir reaksiyon tüpü hazırlanır. Tüpler örnek no’ları da üzerlerine yazıldıktan sonra buz üzerine konulur.
• Her örnek için bir PCR reaksiyon karışımı, buz üzerinde hazırlanır:
o PN Miks (PNM) 35 µl
o 10X PCR Buffer 5 µl o MgCl2 5 µl o TaqDNA Polymerase(1 U) 0,4 µl
o Örnek 5 µl
o Toplam PCR reaksiyon Hacmi= 50 µl
• Reaksiyon tüpleri termal döndürücüye yerleştirilir ve aşağıdaki termal döngü (thermocycling) programı uygulanır.
o Pre-PCR: 95 ºC / 5 dakika
o Termal Döngü I: 95 ºC / 10 saniye-60 ºC / 2 dakika
(Termal Döngü, 10 döngü olacak şekilde proglamlanmıştır)
o Termal Döngü II: 95 ºC / 10 saniye-55 ºC / 30 saniye-72 ºC / 30 saniye (Termal Döngü, 20 döngü olacak şekilde proglamlanmıştır)
o Nihai ekstansiyon (Final Extension): 72 ºC / 8 dakika
PCR ile amplifiye edilen örnekler +4 ile -20 ºC arasında saklanır.
3.2.3.3.Hibridizasyon
PCR ürünleri ”reverse hibridizasyon” tekniği ile analiz edilir. Bu test, bir nitroselüloz strip üzerine paralel diziler şeklinde immobilize edilmiş bir dizi oligonükleotid problara biotinile PCR ürünlerinin hibridize edilmesi esasına dayanır (45,46).
Conjugat buffer ve Substrat buffer aşağıdaki şekilde dilüe edilir:
• Conjugatın dilüsyonu (her bir strip için; Con-C’den 10 µl, Con-D’den 1000 µl alınır)
Hybridization Buffer, stringent buffer 47 ºC’de ısıtılır. Test stripleri, Rinse solüsyon, conjugat buffer (dilüe), substrat buffer (dilüe) oda ısısına gelene kadar bekletildikten sonra; her örnek için 20 µl DEN (denatürasyon) solüsyonu bir pipetle alınıp otomatik su banyosunda (TECAN marka profiBlot T48 cihazı) bulunan tray’de (striplerin yerleştirildiği plate) bulunan kuyucukların köşelerine bırakıldı. Daha sonra PCR ile çoğaltılan DNA ürünlerinden her örnek için yine 20 µl olacak şekilde bir pipetle alınıp kuyucuklara pipetlenmiş olan DEN solüsyonuna pipetlenerek karıştırılır ve oda sıcaklığında 5 dk inkübe edilir. Her bir örnek için bir test stribi temiz eldivenle alınıp bir pens yardımıyla kuyucuklara dikkatli bir şekilde yerleştirilir. Gerekli kit bileşimleri profiBlot T48 cihazına uygulandıktan sonra gerekli inkübasyon ve yıkama işlemlerinin sırası ve süresi dahil otomatik olarak profiBlot T48 cihazı tarafından gerçekleştirildi. Đşlem sonunda elde edilen test stripleri yorumlanmak üzere kurumaya bırakıldı. Kuruduktan sonra sonuç alınamadığı tespit edilen örnekler daha sonra tekrar edilmek üzere belirlendi. Daha sonra sonuç alınan örneklerin yorumlanmasına geçildi.
3.3.SONUÇLARIN YORUMLANMASI VE DEĞERLENDĐRĐLMESĐ 3.3.1 AAT Genotip Sonuçlarının Değerlendirilmesi
Çalışılan örnek stripleri formlar üzerine yapıştırılır ve ışıktan korunarak saklanır. Bir örneğin genotipi, GenoType® AAT kiti ile birlikte verilen değerlendirme skalasından yararlanarak örnekler değerlendirilir. Örnekler değerlendirilirken skaladaki strip üzerinde yer alan konjugat kontrol bandı ile örnekteki konjugate kontrol bandı aynı hizaya gelecek şekilde eşleştirilerek örnekler değerlendirilir.
Şekil 8. α1-Antitripsin Strip Test Çubuğu (test strip) örneği. Her strip total sekiz
reaksiyon zonu içerir (47).
Conjugate Control (CC); Bu bölgede bant oluşması verimli bir şekilde conjugate
bağlanmasının ve substrat reaksiyonunun gerçekleştiğini gösterir.
Specificity Control (Spec-C); Bu reaksiyon bölgesinin oluşmaması gerekir. Bu
çizginin koyu olarak oluşması testin spesifik olmadığını gösterir.(bu durum stringent wash sırasında ısının çok düşük olduğunu gösterir). Bu durumda test tekrar edilir.
Sensitivity Control MZ (Sens-MZ); Bu bölgede bant oluşması reaksiyonun optimal
sensitivitede gerçekleştiğini gösterir.
PĐM; Bu bölgenin boyanmış olması, AAT geninin 342. kodonunda wild tip nükleotid
(G)’nin olduğunu gösterir.
PĐZ; AAT geninin 342. kodonunda PĐZ eksiklik alleli olduğu zaman bu bölge koyu
olarak boyanır. Homozigot mutasyon varsa sadece bu bölge oluşur; eğer heterozigot mutasyon varsa PĐM bölgeside boyanır.
Sensitivity Control S (Sens-S); Bu bölgede bant oluşması reaksiyonun optimal
PĐS ̶ ; Bu bölgenin boyanmış olması, AAT geninin 264. kodonunda wild tip
nükleotid (A)’nın olduğunu gösterir.
PĐS+ ; AAT geninin 264. kodonunda S eksiklik alleli olduğu zaman bu bölge koyu
olarak boyanır. Homozigot mutasyon varsa sadece bu bölge oluşur; eğer heterozigot mutasyon varsa PĐS ̶ bölgeside boyanır (38).
Araştırılan iki lokusa ilişkin olası tüm genotipler bantlardaki boyanma biçimine göre aşağıda Şekil 8’de özetlenmiştir;
Şekil 9. AAT geninin S ve Z lokuslarına ilişkin olası tüm geneotiplerin stripteki
boyanma biçimleri (47).
Çalışmadaki bütün örnekler çalışılıp; test sonuçları referans membranlarla karşılaştırılıp genotipler yorumlandıktan sonra her örnek için elde edilen sonuçlar kaydedildi.
3.3.2 Serum AAT Düzeylerinin Đstatiksel Değerlendirilmesi
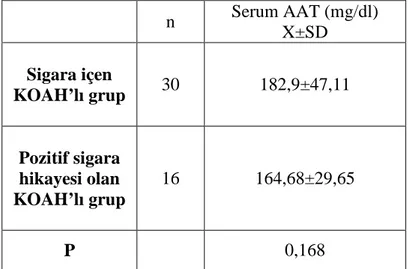
KOAH’lı olgu grubu ile kontrol grubunun serum AAT düzeylerinin değerlendirilmesi amacıyla Student’s t testi yapıldı. Sigara öyküsü pozitif olup halen aktif içici olan KOAH’lı grup ile sigara öyküsü pozitif olup 1 yıl ≥ süredir sigarayı bırakan KOAH’lı grubun serum AAT düzeyleri de student’s t testi ile değerlendirildi.
Solunum fonksiyon testi bilgilerine göre GOLD 2007’ye göre evrelendirilmiş dört KOAH’lı grup arasında serum AAT düzeylerini değerlendirme amacıyla ise One way Anova testi yapıldı. Đstatiksel değerlendirmede SSPS 15,0 kullanıldı.
4.BULGULAR
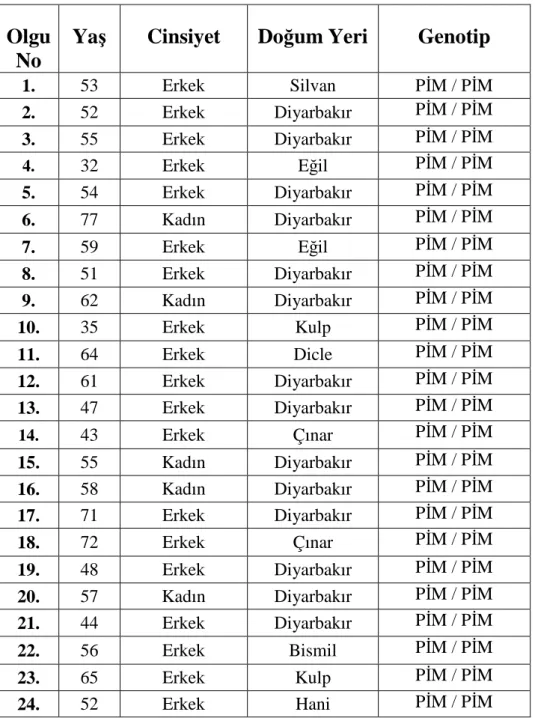
Bu çalışmada, Dicle Üniversitesi Tıp Fakültesi Göğüs Hastalıkları Polikliniğinde ve Göğüs Hastalıkları Hastanesi’nde KOAH tanısı konmuş yaş ortalaması (51,65±10,22) olan toplam 61 olgu, AAT geninin PĐS ve PĐZ mutasyonları açısından genotiplenmiştir. Đncelenen 61 olguda PĐS ve PĐZ allelleri açısından mutasyon saptanmamış ve tüm olguların normal allellere (PĐMM) sahip olduğu tespit edilmiştir.
Tablo 6. Çalışmamızda KOAH’lı olgulara ait AAT genotip verileri
Olgu
No
Yaş
Cinsiyet
Doğum Yeri
Genotip
1. 53 Erkek Silvan PĐM / PĐM 2. 52 Erkek Diyarbakır PĐM / PĐM 3. 55 Erkek Diyarbakır PĐM / PĐM 4. 32 Erkek Eğil PĐM / PĐM 5. 54 Erkek Diyarbakır PĐM / PĐM 6. 77 Kadın Diyarbakır PĐM / PĐM 7. 59 Erkek Eğil PĐM / PĐM 8. 51 Erkek Diyarbakır PĐM / PĐM 9. 62 Kadın Diyarbakır PĐM / PĐM 10. 35 Erkek Kulp PĐM / PĐM 11. 64 Erkek Dicle PĐM / PĐM 12. 61 Erkek Diyarbakır PĐM / PĐM 13. 47 Erkek Diyarbakır PĐM / PĐM 14. 43 Erkek Çınar PĐM / PĐM 15. 55 Kadın Diyarbakır PĐM / PĐM 16. 58 Kadın Diyarbakır PĐM / PĐM 17. 71 Erkek Diyarbakır PĐM / PĐM 18. 72 Erkek Çınar PĐM / PĐM 19. 48 Erkek Diyarbakır PĐM / PĐM 20. 57 Kadın Diyarbakır PĐM / PĐM 21. 44 Erkek Diyarbakır PĐM / PĐM 22. 56 Erkek Bismil PĐM / PĐM 23. 65 Erkek Kulp PĐM / PĐM 24. 52 Erkek Hani PĐM / PĐM
25. 54 Erkek Ergani PĐM / PĐM 26. 57 Kadın Kulp PĐM / PĐM 27. 61 Erkek Diyarbakır PĐM / PĐM 28. 67 Erkek Diyarbakır PĐM / PĐM 29. 63 Erkek Silvan PĐM / PĐM 30. 56 Erkek Eğil PĐM / PĐM 31. 61 Erkek Diyarbakır PĐM / PĐM 32. 36 Erkek Diyarbakır PĐM / PĐM 33. 53 Erkek Diyarbakır PĐM / PĐM 34. 47 Erkek Diyarbakır PĐM / PĐM 35. 41 Kadın Diyarbakır PĐM / PĐM 36. 35 Erkek Diyarbakır PĐM / PĐM 37. 51 Erkek Hani PĐM / PĐM 38. 49 Erkek Hani PĐM / PĐM 39. 44 Erkek Ergani PĐM / PĐM 40. 53 Erkek Diyarbakır PĐM / PĐM 41. 55 Erkek Ergani PĐM / PĐM 42. 54 Erkek Diyarbakır PĐM / PĐM 43. 59 Erkek Silvan PĐM / PĐM 44. 43 Erkek Lice PĐM / PĐM 45. 44 Erkek Diyarbakır PĐM / PĐM 46. 54 Erkek Çınar PĐM / PĐM 47. 52 Erkek Diyarbakır PĐM / PĐM 48. 52 Kadın Diyarbakır PĐM / PĐM 49. 48 Kadın Diyarbakır PĐM / PĐM 50. 54 Erkek Bismil PĐM / PĐM 51. 44 Erkek Kulp PĐM / PĐM 52. 42 Erkek Lice PĐM / PĐM 53. 51 Erkek Diyarbakır PĐM / PĐM 54. 52 Kadın Diyarbakır PĐM / PĐM 55. 52 Erkek Lice PĐM / PĐM 56. 37 Erkek Dicle PĐM / PĐM 57. 42 Erkek Ergani PĐM / PĐM 58. 16 Erkek Diyarbakır PĐM / PĐM 59. 53 Erkek Diyarbakır PĐM / PĐM 60. 47 Erkek Diyarbakır PĐM / PĐM 61. 49 Erkek Diyarbakır PĐM / PĐM
PĐM/PĐM genotipine sahip 61 KOAH’lı olgu içerisinde 4 KOAH’lı olguya ait AAT genotip strip görüntüsü Şekil 10’da aşağıda gösterilmiştir.