T.C.
DĐCLE ÜNĐVERSĐTESĐ TIP FAKÜLTESĐ
Biyokimya ve Klinik Biyokimya Anabimdalı
NON-OBEZ POLĐKĐSTĐK OVER SENDROMLU HASTALARDA ĐNSÜLĐN DĐRENCĐ VE SERUM SĐTOKĐN SEVĐYELERĐ
(UZMANLIK TEZĐ)
Dr. Nurettin FĐDAN
Tez Danışmanı:
Prof. Dr. Belkıs AYDINOL
DĐYARBAKIR
2009
ÖNSÖZ
Tezimin danışmanlığını yapan ve bilgi ve deneyimlerinden yararlandığım saygıdeğer hocam Prof.Dr.Belkıs AYDINOL’a, Anabilim Dalı Başkanımız Prof.Dr.Nuriye METE,ye, uzmanlık eğitimim süresince desteklerini ilgi alakalarını gösterdikleri saygıdeğer hocalarım Prof.Dr.Naime CANORUÇ, Prof.Dr.Sabri BATUN ve diğer tüm hocalarıma;
Tezime katkılarından dolayı Kadın Hastalıkları ve Doğum Anabilim Dalı Başkanı Prof.Dr.Umur KUYUMCUOĞULLARI’na ve Endokrinoloji Anabilim Dalı hocası Prof.Dr.Mithat BAHÇECĐ’ye,Anabilim dalımız hocası Yrd. Doçent Dr. Ebru KALE, ye;
Tezime katkılarından dolayı Halk Sağlığı Anabilim Dalı Araştırma Görevlisi Dr.Đzzettin TOKTAŞ’a, yeğenim Sultan ELHAKAN’a, Ergani Devlet Hastanesi Hemşirelerine, Dicle Üniversitesi Tıp Fakültesi Çocuk Acil Kliniği Hemşirelerine, Dicle Üniversitesi Tıp Fakültesi Kadın Hastalıkları ve Doğum Kliniği Doktorlarından Dr.Nazan ÇELĐK’e, Kadın Hastalıkları ve Doğum Polikliniği Hemşiresi Bahar DENĐZHAN’a Kontrol Grubum olan Anabilim Dalındaki arkadaşlarıma, tüm Asistan arkadaşlarıma;
Saygıdeğer dostum Psikiyatri Kliniği Doktoru M.Veysi CEYLAN’a; Çok sevdiğim aileme, abim Muharrem’e, kardeşim Ömer’e, eşim Dilek, biricik kızım Gamze’ye ve tezime katkılarından dolayı Nurullah ÇĐDEM’e sonsuz teşekkürlerimi sunarım.
Dr. NURETTĐN FĐDAN Diyarbakır- 2009
ĐÇĐNDEKĐLER Đç Kapak Sayfa Önsöz……….……….I Đçindekiler ………..……….….………II Şekil ve Tablolar Dizini………..…………III Türkçe Özet……….………IV Đngilizce Özet ……….….……….V
1.Giriş ve Amaç………,……..………..1
2.Genel Bilgiler……….,..………..2
2.1. Polikistik Over Sendromu………,,………..2
2.2 Đnsülin Direnci ve Hiperinsülinemi………,,………..……..7
2.3. Sitokinler………,,……….17 3.Gereç ve Yöntem………...………,,…,…..24 4.Bulgular………,,,,…………26 5.Tartışma……….…………..35 6.Sonuç………,,…………,,…………42 7. Kaynaklar………,,,,………….43
Şekil ve Tablolar Dizini………Sayfa Şekil 2.1………11 Şekil 2.2……….12 Tablo 2.1………16 Tablo 4.1-4.13………26-34
ÖZET
Bu çalışmanın amacı nonobez polikistik over sendromlu hastalarda insülin direnci ve serum sitokin seviyeleriyle ilişkisinin araştırılmasıdır.
Çalışmaya 36 nonobez PKOS’lu kadın ile benzer yaş ve vücut ve kütle indeksine sahip 25 sağlıklı kadın alındı. Bütün hastalara ESRM/ASRM Consensus kriterlerine göre PKOS tanısı konuldu. Bütün hastalar oligo-amenoreik, sağlıklı kontrol grubu ise ömenoreik idi. Her iki grupta serum glukoz, insülin ve sitokin düzeyleri ölçüldü.
Đnsülin direncini değerlendirmek için HOMA indeks kullanıldı.
PKOS ve kontrol grubunun glukoz değerleri açısından karşılaştırılması yapıldı. Anlamlı fark bulundu (p<0.001).
PKOS ve kontrol grubunun insülin değerleri açısından karşılaştırılması yapıldı. Anlamlı fark bulundu (p<0.05).
PKOS ve kontrol grubunun HOMA-IR skoru yönünden karşılaştırılması yapıldı. Hasta grubunda HOMA-IR skorları kontrol grubuna göre anlamlı olarak yüksek bulundu (p<0.05).
PKOS ve kontrol grubunun sitokin değerleri yönünden karşılaştırılması yapıldı. Anlamlı fark bulunamadı (p>0.05).
Çalışmanın sonunda değerlendirmeye aldığımız nonobez PKOS hastalarının kontrol grubuna göre insülin direncinin anlamlı olarak daha yüksek olduğu bulundu ancak insülin direncinin serum sitokin seviyeleriyle herhangi bir ilişkisini tespit edemedik
ABSTRACT
The aim of this study is to research the relationship between the insulin resistance and the levels of serum cytokine on the patients with non-obese polycystic ovary syndrome (PCOS).
Thirty-six women with non-obese PCOS and twenty-five healthy women having the similar age, body and mass index have been taken into the study. All the patients have been diagnosed with PCOS, according to the ESRM/ASRM Consensus criteria. All the patients have been oligo-amenorrheic and the healthy control group has been amenorrheic. In both groups, the levels of serum glucose, insulin and cytokine have been measured.
HOMA index has been used to evalaute the insulin resistance.The comparison of PCOS and control group in terms of glucose values has been made. There has been found a significant difference (p<0.001).
The comparison of PCOS and control group in terms of insulin values has been made. There has been found a significant difference (p<0.05).
The comparison of PCOS and control group in terms of HOMA-IR score has been made. Compared to control group, HOMA-IR scores in patient group have been found to be significantly high (p<0.05).
The comparison of PCOS and control group in terms of cytokine values has been made. There hasn’t been found any significant difference (p>0.05).
At the end of the study, it has been found that evaluated non-obese PCOS patients have significantly higher level of insulin resistance compared to control group. We couldn’t find any relationship between insulin resistance and serum cytokine levels.
1.GĐRĐŞ VE AMAÇ
Polikistik over sendromu (PKOS), reprodüktif dönemde en sık görülen endokrin bozukluktur. Patofizyolojisi multifaktöryel ve poligenik gibi görülmektedir. Tanı kriterleri son olarak 2003’te Rotterdamda ‘Concencus Conference on PCOS’(ESHRE-ASRM) toplantısında Polikistik over morfolojisi (bir overde 12 adet veya daha fazla 2-9 mm çapında folikül bulunması ve/veya biyokimyasal hiperandrojenizm ve oligo-ve/veya anovulasyon) parametrelerinden herhangi ikisinin varlığı şeklinde revize edilmiştir (1-2).
PKOS patogenezini açıklamak için birçok teori öne sürülmüştür. Günümüzde ençok üzerinde durulan teori, insülin sekresyonu ve aksiyonundaki defekt sonucu gelişen insülin direnci ve hiperinsülinemidir. Birçok PKOS’lu hastada obeziteden bağımsız olarak ĐD ve hiperinsülinemi bulunduğundan ve insülinin invitro ovaryan androjen üretimini direkt olarak etkilediği bilindiğinden PKOS patofizyolojisinden ĐD’nin önemli rol oynadığı düşünülmektedir (3-7).
PKOS’luların %50-70’i obezdir ve bu obezite tipik olarak Bel/Kalça oranının arttığı android obezitedir (7). Hastaların %30-50’si normal kiloda veya zayıftır ve bu grupta hastalığın patogenezi ve ĐD’nin mekanizması obezlerden farklıdır. ĐD hem zayıf hem obez PKOS’lularda görülebilmekle birlikte obezite ĐD için tanımlanmış bir risk faktörüdür. Obez PKOS’luların %75’i nonobez veya zayıf PKOS’luların ise %30’unda hiperinsülinemi ve ĐD vardır. Obez PKOS’lularda ĐD’nin şiddeti obezitenin derecesiyle korelasyon gösterir. Etkilenmiş zayıf PKOS’lularda ise intrensek ve hala tam olarak anlaşılmamış bir ĐD formu vardır (8-10). Ayrıca, obez PKOS’lularda insülin duyarlılığında bozukluk ve insülin seviyelerinde disregülasyon daha belirgin bulunurken, normal kilolu veya zayıf PKOS’lularda hipotalamo-hipofizer-adrenal aksa bağlı değişiklikler ön plandadır (11).
PKOS, menstruel anormallikler, anovulasyon, infertilite, abortus, gestasyonel diabet ve preeklampsi gibi reprodüktif bozukluklarla kendini gösterebilir. Bunlara ilaveten özellikle uzun dönemde disfibrinolizis, dislipidemi, bozulmuş glukoz toleransı, diabet, hipertansiyon ve kardiyovasküler hastalıklar tabloya eklenebilir (11-17).
Obez PKOS lularda TNF- α, IL-1, IL-6 gibi proinflammatuar sitokinlerin salındığına dair bazı yayınlar bulunmaktadır.Ayrıca antiinflammatuar sitokinlerden IL-10 un da salındığına dair görüş te bulunmaktadır.Biz de çalışmamızda TNF- α , IL-1, IL-6 nın yanı sıra IL-8, IL-10, ve IL-2 Reseptör soluble (IL-2 RS) düzeylerini ölçerek non obez PKOS lularda sitokinlerin ölçümünün anlamlı olup olmayacağını inceledik.Ayrıca bu çalışmada nonobez PKOS lu hastalarda insulin direnci ve serum sitokin seviyeleriyle ilişkisinin araştırılması amaçlandı.
2. GENEL BĐLGĐLER
2.1. POLĐKĐSTĐK OVER SENDROMU
Polikistik over sendromu (PKOS), değişik derecelerde adet düzensizliği, hirsutismus (kıllanma), akne ve obezite ile seyreden, ilk belirtileri erken ergenlik çağında ortaya çıkan bir sendromdur (18-20).
Sıklığı doğurganlık çağındaki kadınlarda %5-10, ergenlik dönemindeki kızlarda %3 olarak bildirilmektedir (21).
Ergenlik dönemindeki kızlarda kıllanma artışı, akne, adet düzensizliği, obezite, cildin yağlanmasında artma, erkek tipi saç dökülmesi varlığında PKOS’tan şüphe edilmelidir. Sendromun seyri son derece değişken olup bazen başlangıçta bu bulgulardan sadece bir yada ikisinin varlığı söz konusu olabilmektedir (22,23). Erişkin kadınlarda endokrin kökenli infertilitenin en sık nedeni olup, endometrium kanseri, tip 2 diabet, hipertansiyon, aterosklerotik kalp ve damar hastalıkları için risk faktörüdür. PKOS’lu olgularda obezite,
insülin direnci, hiperleptinemi ve dislipidemi gibi risk faktörlerinin varlığı kalp ve damar hastalıklarına eğilimin arttığını düşündürmektedir (24).
2.1.1 PKOS’un Tarihçesi
1844 yılında Chereau, ilk olarak yumurtalıklarda sklerokistik değişimler tanımlamıştır. 1935 yılında ise Stein ve Leventhal, menstruel düzensizlik bulgusu amenore, infertilite öyküsü, kıllanma ve obezite içeren klinik bulgularla bilateral polikistik overleri tanımlamışlar ve uzun bir süre sendrom Stein-Leventhal sendromu olarak anılmıştır (25).
1958 yılında McArthur ve arkadaşları, polikistik overli kadınlarda yüksek luteinize hormon (LH) düzeyleri gözlemişler ve 1971 yılında radyoimmunoassay (RIA) tekniğinin kullanıma girmesiyle biyokimyasal tanı gündeme gelmiştir. 1976 yılında Kahn ve arkadaşları ve 1980 yılında Burghen ve arkadaşları, insülin direnci ve polikistik over sendromu arasında ilişki kurarak kilometre taşı oluşturmuşlardır. Polikistik overlerin ultrasonografik bulgusu, 1981 yılında Swanson ve arkadaşları tarafından gösterilmiştir. 1985 yılında ise Adams ve arkadaşları, polikistik overlerin ultrasonografik varlığının tanı kriteri olabileceğini açıklamışlardır (25).
2.1.2 PKOS’un Tipleri Klasik PKOS
Klasik PKOS, ilk defa 1935 yılında Stein-Leventhal tarafından tanımlanan amenore, polikistik görünümlü overler, hirsutismus ve obeziteyi içeren klasik formdur (25). Sendromla ilgili çalışmalar ve hasta sayısı arttıkça hastaların sadec %50’sinin sendromun tanımlanan bütün özelliklerini taşıdığı anlaşılmıştır. Klasik PKOS’lu kadınların yaklaşık %65’inde hirsutismus, %65’inde anovulatuar semptomlar, %50’sinde obezite mevcuttur (22,23). Klasik PKOS’un laboratuvar bulguları arasında hiperandrojenemiye eşlik eden ultrasonografik olarak tespit edilmiş polikistik over görünümü ve artmış LH /
FSH ( folikül uyarıcı hormon ) oranı vardır.Ancak, günümüzde bu bulguların her ikisi de tanı için gerekli görülen laboratuar verileri olarak kabul görmemektedir (26).
Atipik PKOS
Atipik PKOS, ultrasonografik anormallikler olmaksızın, başka sebeplerle açıklanamayan kronik androjen artışı olan bireyler için kullanılmaktadır. Ergenlik çağında ve erişkin dönemde klinik ve laboratuvar verilerinden izlenen heterojenite nedeniyle hastaların yaklaşık yarısı bu gruba girmektedir (18).
PKOS’taki androjen artışının kaynağı, çoğunlukla fonksiyonel over hiperandrojenemisi (FOH), az sıklıkla ise fonksiyonel andrenal hiperandrojenemidir (18).
Fonksiyonel over hiperandrojenemi (FOH)
FOH, PKOS’lu olgularda % 80 saptanan gonadotropin hormon bağımlı aşırı androjen üretimidir. Overlerde androjen üretiminde bozukluk söz konusu olup, gonadotropin uyarımına aşırı şekilde sreroidogenik yanıt vatdır.Normalde overlerde androjen üretimi ağırlıklı olarak LH uyarımı ile korpus luteumda yapılır. Daha sonra FSH etkisi ile verilen aşırı yanıt sonucu LH etkisiyle intraovaryan androjen yoğunluğu artar. Özellikle testosteronda gözlenen artış sonucu küçük foliküller büyür ve tek bir folikülün dominant folikül haline gelmesi engellenir (27-30).
- Fonksiyonel adrenal hiperandrojenemi ( FAH )
FOH, PKOS’lu hastaların %25inde saptanan glukokortikoidler tarafından baskılanabilen adrenokortikotropik hormona ( ACTH ) bağımlı 17 ketosteroid artışıdır (18).
FAH ve FOH olgularının birbirleri ile etkileşimi over ve adrenal bezde benzer steroidogenik üretim aşamalarının yer almasından kaynaklanır.Özellikle p450c 17 enzim aktivitesinin hem over hem de adrenallerde mevcut olması buna örnek teşkil etmektedir (18).
2.1.3 PKOS’ta Klinik Bulgular
- Hirsutismus ( kıllanma )
Hirsutismus, androjenlere duyarlı bölgelerde koyu renkli terminal kılların çoğalması olup, erkeksi tipte kıllanma artışı olarak tanımlanmaktadır (31). Yüz, boyun, gövde, ekstremiteler, pubik ve aksiller bölgede kılların büyümesi androjenlere bağımlıdır. Terminal kılların çoğalması sadece androjenlerin fazlalığına değil aynı zamanda kişiden kişiye değişen reseptör duyarlılığına da bağlıdır (31). Bu nedenle PKOS’lu kadınlarda hirsutismus değişik derecelerde ortaya çıkabilmektedir (18). Hirsutismus derecelendirilmesi Ferriman-Gallwey skorlamasına göre yapılır. Sağlıklı kadınlarda normalde sekiz puanın altında olması gereklidir (32).
Kıllanma artışına akne vulgaris, androjenik tipte saç dökülmesi, yağlanma, aşırı terleme gibi hirsutismus eşdeğeri bulgular eşlik edebilmektedir. PKOS’lu kızlarda akne vulgaris, olguların yaklaşık %21’inde görülür ve tedaviye dirençlidir (21-23).
Hirsutismus ve hirsutismus eşdeğeri bulgular hiperandrojenemik kızlarda değişik oranlarda kendini gösterir ve olgularda hiperandrojenemi gösterilememekte, bu durum idyopatik ( nedeni belirlenemeyen ) hirsutismus olarak adlandırılmaktadır (18,33).
- Overlerde fonsiyon bozukluğu
PKOS’lu olguların üçte ikisinde anovulatuar semptomlar mevcuttur. Bu semptomlar, primer ve sekonder amenoreden oligomenoreye veya tam tersi
aşırı ve sık kanama periyotlarına kadar değişen spektrumda olabilir (22). Genellikle ergenlikten sonraki ilk iki yılda hipotalamus, hipofiz bezi ve ovaryan aksın olgunlaşmasına paralel olarak fizyolojik kabul edilen ve bu dönemdeki kızların yaklaşık yarısında izlenen anovulator periyotlar PKOS tanısında gecikmeye neden olabilir.Bu dönemde düzensiz adet siklusları olan genç kızlarda düzenli adet gören kızlara göre plazma androjenleri daha yüksek bulunmuştur. Kronik anovulasyon, endometrial hiperplazi ve karsinom açısından risk oluşturmaktadır (18,24).
- Obezite
Klasik PKOS’un en önemli bileşenlerinden birisidir ve PKOS ‘lu olgularda %38-88 sıklıkla görülmektedir (34). Karın bölgesinde cilt altında, karın içi organların çevresinde yağlanma artışı dikkati çeker. Bu nedenle bel kalça oranında artış belirgindir.Gövdesel yağ birikimindeki artışta hiperandrojeneminin etkili olduğu ve abdominal obezitenin insülin direnci ile korelasyon gösterdiği belirtilmektedir. Epidemiyolojik çalışmalarda bu tür bir yağ dağılımının vücut ağırlığından bağımsız olarak insülin direnci, hiperlipidemi, tip 2 diabet ve kardiyovasküler hastalık açısından risk oluşturduğunu ortaya koymuştur (34,35).
2.1.4 PKOS’ta tanı kriterleri
PKOS tanısı klinik muayene ve laboratuar bulguları birlikte değerlendirilerek konulur. PKOS hiperandrojenemik bir durum olduğundan öncelikle serum total testosteron, serbest testosteron ve DHEAS düzeyleri değerlendirilmelidir (36).
Hiperandrojenemili ergen kızlarda PKOS tanısı için PKOS’u taklit eden Virilizan tümörler, Hiperprolaktinemi, Nonklasik Konjenital Adrenal Hiperplazi ve Cushing sendromu dışlanmalıdır (36).
Klinik görünümün heterojen olması ve başka endokrin sorunlarla benzerliği nedeniyle PKOS tanısı konulabilmesi için pek çok toplantı yapılmıştır.
Bunlardan en çok bilinenler 1990 yılında yapılan National ınstıtute of Health ( NIH ) (36) toplantısıdır. Bu toplantıya göre araştırıcıların tanı kriterleri :
- ovulasyon bozukluğu - hiperandrojenizm varlığı
-hiperprolaktinemi, tiroid fonksiyon bozuklukları, nonklasik adrenal hiperplazinin dışlanması olarak bildirilmiştir.
Toplantıların sonuncusu ise 2003 yılında Rotterdam’da yapılmıştır (36). Bu toplantıya göre tanı kriterleri :
- oligo / anovulasyon
- hiperandrojenizmin klinik ve biyokimyasal işaretleri
- PKOS’u taklit eden ilişkili hastalıkların dışlanması ve ultrasonografide polikistik over varlığının gösterilmesi olarak kabul edilmiştir.
2.1.5 PKOS’lu Olgularda Uzun Dönem Hastalık Riskleri
PKOS’lu kadınlarda oligo veya anovulatuar siklusların doğurganlık çağında infertilitenin en sık nedeni olduğu bilinmektedir. Bu olgularda tip 2 diabet, dislipidemi, kardiyovasküler hastalık ve endometrium kanser riskinin yüksek olduğu bildirilmektedir. Ateroskleroza bağlı kalp-damar hastalıkları, hipertansiyon, gebelik diabeti, over kanseri ve metabolik sendrom da önemli risk faktörleri arasında sayılmaktadır (37,38).
2.1.6 PKOS’un Etiyolojisi
PKOS’un nedeni tam olarak bilinmemekle birlikte steroid hormon, gonadotropik hormon üretimi, androjen salınımında ifadelenen genlerde polimorfizmler ve glikoz toleransı, insülin direnci gibi metabolik bulgular içeren biyokimyasal faktörlerle etkileşim halinde, genetik temelli over kaynaklı bir bozukluk olduğu konusunda, çalışma sonucu yaygındır (18). Obezite ve ergenlik gibi çevresel faktörler insülin direnci gelişimini uyarmaktadır. PKOS’lu hastalarda insülin salınımında tip 2 diabettekine benzer dengesizlik gözlenir (39,40).
2.2 Đnsülin Direnci ve Hiperinsülinemi : Đnsülin direnci, dolaşımda yeterli konsantrasyonda insülin bulunmasına rağmen yeterli biyolojik cevabın oluşmamasıdır(41,42). Đlk olarak 1921’de Achard ve Thiers hiperandrojenemi ve insülin metabolizması arasındaki patofizyolojik ilişkiyi ‘sakallı kadınların diabeti’ olarak tanımladılar (43). Daha sonra 1976’de Kahn ve arkadaşlarının şiddetli ĐD olan genç kızlarda virilizasyon olduğunu belirlemesi hiperandrojenik kadınlarda insülin salınımının araştırılmasına yol açtı (44). ĐD ve hiperandrojenizm arasındaki ilişkiyi ise ilk olarak 1980’de Burghen ve arkadaşları, obez PKOS’lularda dolaşımdaki insülin seviyelerinin testosteron seviyeleriyle korele olduğunu gözlemleyerek tanımladılar (45). Önceleri hiperandrojenizmin ĐD’ne yol açtığı düşünülüyordu. Gerçekten de enerji verici olarak kronik androjen kullanımında veya kadından erkeğe transseksüellerde insülin duyarlılığının azaldığı gösterildi. Ancak, ooferektomi, GnRH agonisti veya antiandrojen ajan kullanımı insülin duyarlılığında değişikliğe yol açmadı. Ayrıca androjenlere bağlı oluşan ĐD’nin derecesi, insülin rezistans sendromlu veya akantozis nigrikanslı kadınlarda görülen hiperandrojenemiye bağlı ĐD’den daha hafif seyirli gibi görülmektedir (46-48).
Kronik doku direncine kompensatuvar cevap olarak hiperinsülinemi gelişir. Đnsülin direncini açıklamak için, periferal hedef doku direnci, azalmış hepatik klirens veya artmış panreatik duyarlılık geri mekanizmalar öne sürülmüştür. Öglisemik klemp tekniğiyle yapılan çalışmalar hiperinsülinemili hiperandrojenemik kadınların periferal insülin direncine ve azalmış hepatik insülin ekstraksiyonundan dolayı, azalmış insülin klirensine sahip olduklarını göstermiştir (49). Birçok araştırmacı PKOS’lu hastalarda ĐD’nin mekanizması üzerine odaklanmıştır. Bu alandaki araştırmaları anlamak için normal insülin sinyalinin nasıl olduğunu anlamak gerekir. Đnsülinin reseptörüne bağlanması insülin reseptörünün tirozin otofosforilasyonunu aktive eder, daha sonra intermedier proteinlerin fosforilasyonu aktive olur. Sonuçta glukoz taşıyıcı proteinler harekete geçer ve glukoz hücre içine taşınır (50). Đnsülin reseptörüyle sinyal iletimi,reseptör insülinin alfa-zincirine bağlanır.Beta-zincirlerinin tirozin
kinaz enzimini aktiflemesiyle beta-zincirindeki tirozin kalıntıları fosforillenir.Fosforillenme, üç aşamadan sonra GLUT-4(taşıyıcı protein),ün internal veziküllerden plazma zarına hareketini tetikler.
Đnsülin, pankreas β hücrelerinden salgılanan özellikle kas, yağ dokusu, karaciğer gibi organlarda glukoz alımını uyaran, yağ dokusunda da lipolizi inhibe eden önemli bir metabolik hormondur. Đnsülin sinyal kaskadının başlangıcında insülin, insüline duyarlı dokuların plazma membranındaki kendi reseptörüne bağlanır. Đnsülin reseptörleri heterotetramerik glikoproteinlerdir. Đki büyük α subüniti ekstraselüler olup insüline bağlanır. Đki küçük β subüniti ise temel olarak stoplazmiktir, tirozin kinaz içerir ve insülin reseptörünün asıl sinyal komponentidir (42). Đnsülinin α subünitine bağlanmasıyla tirozin kinaz aktive olur. Đnsülin reseptör substrat protein ailelerinden iki tanesi (IRS-1 ve IRS-2) intraselüler protein fosforilasyon kaskadını başlatır, daha sonra fosfatidil inositol 3 kinaz (PI-3 kinaz) glukozun glukoz transporter-4 (GLUT-4) aracılığıyla taşınmasını artırır (51).
PKOS da ĐD,nin moleküler mekanizması yeterince açık olmamakla birlikte, insülin reseptörlerinin ß subünitinde bağımsız serin fosforilasyonunun fazla olması(normalde tirozin fosforilasyonu) bazı PKOS,lularda rapor edilmiş olup, ĐD,de yeni bir mekanizma olarak öne sürülmüştür(51).
PKOS’lu hastalarda tip 2 DM’li hastalarda görülen farklı olarak insülin reseptör aksiyonundaki defekt bağlanma sonrası seviyede gibi görünmektedir ve postreseptör insülin sinyalinde ve glukoz taşınmasında tek bir defekti içermektedir (52-54). PKOS’da insülin direncinin orijinini açıklamak için çeşitli mekanizmalar öne sürülmüştür; GLUT4 glukoz taşıyıcısının düşük içeriği, insülin reseptörünün serin rezidülerinin aşırı fosfarilasyonu (bu durumda sinyal iletimi azalır) veya hücresel adenozinin azalması (52).
PKOS’lu kadınlarda adipositlerin insülin uyarısına cevabında da, insülinin reseptörüne normal bağlanması söz konusudur. Glukoz taşıyıcı proteinlerin aktivasyonu, glukozun hücre içine taşınması gibi daha sonraki
olayların azalması defektin postreseptör düzeyde olduğunu göstermektedir. Bu veriler, bazı PKOS’lu kadınların onları diğer insüline dirençli durumlardan ayıran altta yatan tek bir patofizyolojik nedenle, tek bir insüline direnç mekanizmasına sahip olabileceklerini göstermiştir (55,56).
PKOS’lularda periferal ĐD, reseptör kinaz aktivasyonundaki tek bir defekte bağlıdır. Reseptör kinaz aktivitesindeki defekt insülin reseptöründe tirozin fosforilasyonunu azaltır. Đnsülin reseptöründe tirozin fosforilasyonunun azalması serin fosforilasyonunun artmasına yol açar ve aşırı serin rezidü fosforilasyonu sinyal iletimini azaltır. Bu olay aynı zamanda adrenal ve overdeki P450c17α enzim sisteminde serin fosforilasyonu artırarak hiperandrojenizme yol açar. Serin fosforilasyonu, insülin reseptöründe tirozin kinaz aktivitesini inhibe ederken, tirozin fosforilasyonu tirozin kinaz aktivasyonunu artırır ve PKOS’lu hastaların en az %50’sinde aşırı serin fosforilasyonu ve normal sinyal iletiminde inhibisyon görülür. Serin fosforilasyonu hem overde hemde adrenalde Sit P450c17α aktivitesini artırarak androjen sentezini uyarır ki bu bazı PKOS’lu hastalarda ĐD ve hiperandrojenizmin mekanizmasını açıklayabilir (54,57).
ĐD, ovaryan ve adrenal androjen biyosentezinin anahtar ezimi olan sitokrom P450c17α’nın aşırı aktivitesiyle ilişkili olabilir. Sit P450c17α’nın 17-20 Liyaz ve 17α Hidroksilaz aktiviteleri de olduğu ve ovaryan androjen sentezinde anahtar rol oynadığı bilinmektedir. Ovaryan theca hücrelerinde 17α hidroksilaz progesteronu 170HP’na dönüştürür, bu da 17-20 Liyaz ile androstenediona dönüşür. Androstenedion 17β Redüktaz ile testosterona dönüşür. Đnsülin kendi reseptörlerine bağlanarak ovaryan ve adrenal androjen sentezini uyardığı gibi theca hücrelerinde LH’ya bağımlı androjen üretimini de uyararak hiperandrojenemiye yol açar. Hiperinsülinemideki düzelme dolaşımdaki androjenin dramatik olarak normal düzeylerine inmesine yol açar (59,60). Hiperinsülinemi, LH aracılı androjen sentezinin güçlü uyarıcısı olan IGF-1 57
reseptörlerinde up-regülasyon yapar ve karaciğerde IGFBP-1 üretimini suprese ederek buna sekonder olarak IGF-1’in biyoyararlığını arttırır (61-63). Đlaveten insülin ACTH’ya adrenal steroidogenez cevabını potansiyelize edebilir ve hepatik SHBG’yi inhibe ederek androjenlerin biyoyararlığını artırmak suretiyle hiperandrojenemiyi artırabilirler (63,64).
ĐNSÜLĐNĐN ETKĐLERĐ
1. Direkt olarak ovaryan steroidogenezi uyarır
2. Steroidogenezi uyarmada LH ve FSH ile sinerji gösterir 3. LH sentez ve pulsatilitesini artırır
4. ACTH’ya adrenal duyarlılığı artırır 5. LH’ya teka hücre duyarlılığını artırır
6. Adrenal ve ovaryan 17α hidroksilaz ve 17-20 liyaz aktivitesini artırır 7. IGFBP-1 düzeyini azaltır
8. Ovaryan IGF-1 reseptörlerinde up-regülasyon yapar 9. Hepatik SHBG sentezini inhibe eder
10. Ovaryan büyüme ve kist oluşumunda FSH ve hCG ile sinerjik etki gösterir (65,66).
Birçok PKOS’lu hastada obeziteden bağımsız olarak ĐD ve hiperinsülinemi bulunduğundan ve insülinin invitro ovaryan üretimini direkt olarak etkilediği bilindiğinden PKOS patofizyolojisinden ĐD’nin önemli rol oynadığı düşünülmektedir (65).
PKOS’luların %50-70’i obezdir ve bu obezite tipik olarak Bel/Kalça oranının arttığı android obezitedir (66). Hastaların %30-50’si normal kiloda veya zayıftır ve bu grupta hastalığın patogenezi ve ĐD’nin mekanizması obezlerden farklıdır. ĐD hem zayıf hem de obez PKOS’lularda görülebilmekle birlikte obezite ĐD için iyi tanımlanmış bir risk faktörüdür. Obez PKOS’luların %70’i non obez veya zayıf PKOS’luların ise %30’unda hiperinsülinemi ve ĐD vardır. Obez PKOS’lularda ĐD’nin şiddeti obezitenin derecesiyle korelasyon gösterir. Etkilenmiş zayıf PKOS’lularda ise intrensek ve hala tam olarak anlaşılmamış bir ĐD formu vardır (62). Ayrıca, obez PKOS’lularda insülin duyarlılığında bozukluk ve insülin seviyelerinde disregülasyon daha belirgin bulunurken, normal kilolu veya zayıf PKOS’lularda hipotalamo-hipofizer-adrenal aksa bağlı değişiklikler ön plandadır (67).
Insülin Growth Faktör-sistemi (IGF) insülinle yakından ilişkilidir ve ovaryan fonksiyonların regülasyonuna katkıda bulunur. Đnvitro çalışmalar, proinsulinin 70 aminoasitli polipeptit homoloğu olan IGF-1’in insan ve hayvan hücrelerinde ovaryan fonksiyonları etkilediğini göstermiştir (42,65). IGF-2, 67 aminoasitten oluşan, %70 IGF-1 , %50 oranında proinsülin homoloğudur ve insan overindeki temel IGF peptididir, etkileri IGF-1 ile benzerdir. Her iki IGF de etkilerini tip IGF-1 reseptörleri aracılığıyla gösterir (61,62).
Hiperinsülinemi, ovaryan tip1 IGF reseptörlerinde up-regülasyon yaparak overdeki IGF aksiyonunu artırır. IGF’lerin aktiviteleri düşük moleküler ağırlıklı IGFBP’ler tarafından düzenlenir. Đnsülin IGFBP-1 sentezini inhibe eder. Dolayısıyla hiperinsülinemi ovaryan IGFBP-1 sentezini inhibe etmek yoluyla
hiperandrojenizme yol açabilir. Çünkü IGFBP-1’in düşük intrafoliküler seviyesi, intraovaryan serbest IGF konsantrasyonunun artmasına yol açar. Dolaşımdaki IGFBP-1 karaciğerden insülinin inhibitör kontrolü altında sentezlendiği için, PKOS’lularda IGFBP-1 seviyeleriyle insülin arasında negatif korelasyon vardır. Dolayısıyla hiperinsülinemi varlığında hem dolaşımdaki hem de intraovaryan IGF biyoyararlığı artar ve bu da steroidogenezi uyarır (62,63).
PKOS’lu hastalarda vücut ağırlığı (GH)/IGF-1 sistemini etkiler. ĐD olan ancak obez bireylerdeki kadar belli olmayan nonobez PKOS’lu hastalarda IGF biyoyararlığının artmış olması sadece insülin uyarlı IGFBP-1’nin supresyonuna bağlı olmayıp, aynı zamanda hepatik IGF-1’in GH uyarlı üretiminin fazlalığına da bağladır (42).
Yakşalık 60 yıldır klinisyenler ve araştırmacılar insüline karşı doku direncinin bazı kronik hastalık durumlarında önemli rol oynadığını savunmaktadırlar (41). Đskelet kaslarının insülin aracılığı glukoz alımına direnç göstermesiyle klinik olarak ĐD oluşur. Đnsülin uyarlı glukoz alımının periferik dokularda temel bölgesi iskelet kasları olmakla birlikte, yağ dokusu, karaciğer ve endotelyal hücrelerde de ĐD gelişebilir (68-70).
ĐD’nin tanısı kolay değildir. Đnsülin direncinin veya duyarlılığının gösterilmesi için birçok test geliştirilmiştir. Bunlardan bazıları; bazal insülin düzeyi, hiperglisemik glukoz klemp tekniği, öglisemik hiperinsülinemik klemp tekniği, intravenöz insülin tolerans testi, oral glukoz tolerans testi ve homeostasis model assessment (HOMA)’dır. Đnsülin duyarlılığının in-vivo değerlendirilmesinde altın standart öglisemik hiperinsülinemik klemp tekniğidir ancak zaman alıcı ve pahalı bir yöntem olması ve klinik uygulama zorluğu nedeniyle genellikle başka yöntemler tercih edilir. Pratikte en sık kullanılanlar, açlık insülin düzeyi, açlık glukoz/insülin oranı, OGTT ve HOMA’dır (71,72).
a) Bazal Đnsülin Düzeyi: Đnsülin direncinin belirlenmesinde çok daha basit bir yöntem olarak açlık insülin düzeylerinin de insülin direncinin bir kriteri olabileceği gösterilmiştir. Bazal insülin düzeyi, her toplum için farklılıklar gösterir. Standardize edilmiş bir eşik değer bulunmamaktadır. Ancak bazı çalışmalarda 8 ĐU/ml üzeri, bazı çalışmalarda ise 15 ĐU/ml üzeri insülin direnci olarak kabul edilmiştir. Bazal insülin düzeyleri de öglisemik klemp tekniği ile korelasyon göstermektedir (71).
b) Açlık Glıkoz/Đnsülin Oranı (FGIR): Pratikte sıkça kullanılır. Açlık sonrasında alınan glukoz ve insülin seviyelerinin oranıdır. Her toplum için farklılıklar arzeder. Oranın düşük olması, insülin direnci varlığını gösterir. Ancak bu yöntemin, insülin duyarlılığının altta yatan fizyolojisini yansıtmada yetersiz kaldığı yönünde eleştiriler vardır. Açlık glukozu/açlık insülin oranının 4.5’ten küçük olması insülin direncini göstermektedir. Ancak, bu oranın doğruluğu non obez hastalarda doğrulanmamıştır (59,71).
c) Hiperglisemik Glukoz Klemp Tekniği: Metabolize edilen glukozun insüline oranı ile insülin duyarlılığı hesaplanır (metabolize glukoz/insülin) (71,72).
d) Öglisemik Hiperinsülinemik Klemp Tekniği: Đnsülin infüzyon sistemine iv olarak glukoz infüzyonu verilmesinde hastanın öglisemik sınırlarda tutulması prensibine dayanır (73,74). ĐD değerlendirilmesinde altın standart kabul edilir. Bu oldukça pahalı, zaman alan, hastalarca kolay kabul görmeyen, karmaşık, bir takım ekipman ve iyi eğitimli personel gerektiren bir yöntemdir. Öglisemik hiperinsülinemik klemp tekniği, bu nedenlerden dolayı insülin direnci ve ilgili bozuklukları araştıran çok sayıda vakayı içeren çalışmalar için uygun bir test değildir.
e) Đntravenöz Đnsülin Tolerans Testi: Pahalı olmayan hızlı, uygulaması kolay, nisbeten güvenli bir yöntemdir. Sonuç değer ne kadar çok yüksek olursa insülin direncinin o kadar az olduğu düşünülür (59,71).
f) Oral Glukoz Tolerans Testi ve Homeostasis Model Assesment: OGTT karbonhidrat metabolizmasını değerlendirmek üzere geliştirilmiş yaygın olarak kullanılan bir yöntemdir. Test esnasında ölçülen plazma insülin ve glukoz seviyeleri, pankreatik beta hücrelerinin insülin sekresyonunu ve dokuların insüline cevap kabiliyetini yansıtmasından dolayı, beta hücre fonksiyonlarını ve insülin duyarlılığını değerlendirmek için de sıklıkla kullanılır (59,74).
HOMA; beta hücre fonksiyonu ve insülin direnci hakkında bilgi veren ve değerlendirmede açlık plazma insülin ve glukoz seviyelerinin kullanıldığı bir yöntemdir. HOMA diğer tekniklere göre daha basit ve pahalı olmayan bir alternatif olarak yaklaşık 20 yıldır kullanılmaktadır. OGTT’de HOMA hesaplaması yapılarak ĐD ölçümünün daha kolay ve risksiz halledilebileceği yapılan çalışmalarda gösterilmiştir. Bu açlık glukozu ve insülin konsantrasyonunun aritmetik örneklemesinde insülin duyarlılığının belirlenmesinde kullanılan bir metoddur (71,72). Bu metoda göre yüksek HOMA puanları düşük insülin duyarlılığını göstermektedir. HOMA skorunun yapılan çalışmalara göre, bazı yayınlarda 2.5, bazı vakalarda ise 3.5’tan büyük olması insülin direnci varlığı ile ilşkilendirilmiştir (71,74). Normal kişilerde bu oran 2’nin altındadır. HOMA yöntemiyle değerlendirilen insülin direncinin artmış olması, bireylerin OGTT ile normal glukoz toleransına sahip gibi görünseler de, hayatlarının ileri dönemlerinde diabet gelişimi için risk taşıdıklarını gösterebilirler, aynı zamanda PKOS gibi klinik durumlarda da ĐD hakkında bilgi verir.
2.3. SĐTOKĐNLER
Đmmün sistemin etkin olma yollarından birisi de aktif maddeler salmalarıdır. Bu aktif moleküller organizmada lenfositler başta olmak üzere bir çok hücre tarafından salınabilirler ve bir çok fizyolojik olayda önemli rolleri vardır. Bu moleküllerin değişik hücrelerden salınanlarına sitokinler, T ve B lenfositleri tarafından oluşturulanlarına lenfokinler ve genel olarak da interlökinler denir. Monositler veya makrofajlar tarafından üretilen ve immün sistem hücreleri arasında iletişimi ve aktivasyonu sağlayan mediatörler ise “monokinler” olarak adlandırılırlar (75,76).
Bu mediatörlerin görevi genellikle lokal, bazen de sistemik yangısal reaksiyonlarda hücreler arası sinyaller ile tepkinin düzenlenmesidir. Genelde sitokinler hormonlar gibi belirli bezlerden değil, serbest hücrelerden salgılanır.
Sitokinler lökositler ve diğer hücrelerin hareketlerine, gelişmelerine ve farklılaşmalarına etki yaparak, konağın yabancı antijenlere ve zarar verici etkenlere karşı reaksiyonları düzenlerler. (76,77).
2.3.1. Sitokinlerin Genel Özellikleri
Sitokinler çok değişik özellikler göstermekle birlikte bazı ortak özelliklere sahiptirler (77).
- Hepsi küçük molekül ağırlığında (<80kDa) salınan moleküllerdir ve glikoziledirler.
- Hemen hepsi immünitede rol oynar, inflamasyonu düzenlerler ve bu yanıtın şiddeti ve süresini belirlemekte önemli rol oynarlar.
- Genellikle lokal olarak oluşturulurlar ve o bölgede etkili olurlar, hormonlar gibi endokrin etki göstermezler.
- Son derece, aktif moleküllerdir ve pikomolar yoğunluklarda etkili olurlar.
- Yüksek affiniteli hücre algaçları ile etkileşerek etkili olurlar ki bu algaçlar hücre yüzeylerinde genellikle düşük sayıdadırlar (hücre başına 10-10.000).
- Đnterlökinlerin hücre yüzeyine bağlanması o hücrenin RNA, protein sentezi ve davranışını etkiler.
- Her bir interlökinin etkisi, yoğunluğu, etkilediği hücre tipi ve o sırada ortamda olan diğer interlökinlere bağlı olmak üzere değişkenlik gösterir.
- Đnterlökinler bir etkileşim ağı oluştururlar, bir interlökin diğerinin salınmasına, algacının oluşmasına veya durdurulmasına neden olabilir. Ayrıca interlökinler salgılandıkları hücreyi de etkileyebilirler (otokrin etki).
- Genellikle kendiliğinden ve bir reaksiyon sırasında salgılanan ve önceden depolanmayan mediatör maddelerdir.
- Đnterlökinlerin birden fazla farklı hücre üzerinde etki gösterebilme özellikleri pleiotropism olarak adlandırılır.
2.3.2. Sitokinlerin Fonksiyonları
Sitokinler fonksiyonlarına göre şu şekilde sınıflandırılırlar.
- Doğal bağışıklığı sağlayanlar (Đnterferon, Tümör Nekrozis Faktör, Đnterlökin-1, Đnterlökin-6 ve interlökin-8 familyası).
- Lenfositlerin aktivasyonunu, büyümesini ve diferensiyasyonunu düzenleyenler (Đnterlökin-2, Đnterlökin-4 ve Transforming growth faktör-β).
- Yangı oluşturan hücreleri aktive eden sitokinler (immün interferon, lenfotoksin, interlökin-5).
- Hematopoiezisi stimule eden sitokinler (Đnterlökin-3, interlökin-7, granülosit-makrofaj koloni stimule eden faktör, granülosit koloni stimule eden faktör).
2.3.3. Đnterlökinler:
Đnterlökin-1 (IL-1): Đnterlökin-1’in esas kaynağı monositler ve tüm yerleşik makrofajlardır. Makrofajlar dışında T ve B lenfositleri, birçok endotelial ve epitelial hücreler, NK hücreler, mikroglia hücreleri ve mesangial hücreler IL-1 üretme yeteneğindedir (77-79).
- IL-1 yapımını her türlü hücre hasarı yapan etki uyarabilir. IL-1’in IL-1 alfa ve IL-1 beta olmak üzere iki moleküler tipi vardır. IL-1 başlıca lenfositler olmak üzere birçok hücre tipinde, pek çok organ ve doku sistemlerinde etkili bir sitokindir. TNF gibi hem hastalıkta hem de konağın savunmasında rol oynayan bir mediatördür (80).
Đnterlökin-2 (IL-2) (T Hücre Büyüme Faktörü):
IL-2 T lenfositlerinden (özellikle TH(T4), bu hücrelerin antijenlerle uyarımından sonra, salınır. Hem otokrin hem de parakrin özelliktedir, yani kendi salgıladığı hücreye ve yakınındaki T hücrelerine etki yapar. IL-2 4. kromozomda bulunan tek bir gen tarafından kodlanmaktadır, en önemli etkisi T lenfositlerini, B lenfositlerini ve NK (doğal öldürücü) hücrelerini onların aktivasyon sürecinin belirli noktasında iken çoğalmaya yönelmesidir. IL-2 büyüme faktörü etkisinin yanı sıra T lenfosit sitotoksisitesini de uyarır ve doğal öldürücü hücre aktivitesini artırır (75,81).
Đnterlökin-6 (IL-6): Đnterferon-β2, 26-kDa protein, B hücresi uyarıcı faktör-2 ve hybridoma growth faktör olarak da isimlendirilen bu interlökini yapan gen 7. kromozomda bulunur. IL-6 temelde T lenfositlerinden salınır ve B lenfositlerinin farklılaşmasını uyarır. Ancak B hücreleri, monositler, fibroblastlar, keratinositler, endotelyal hücreler, mesengium hücreleri ve pek çok tümör hücreleri gibi çeşitli tipte lenfoid ve lenfoid olmayan hücreler tarafından da üretilmektedir. IL-6 multifonksiyonel bir sitokindir. Đmmün cevap, hematopoezis ve akut faz reaksiyonlarını düzenler ve konağın savunma mekanizmasında merkezi bir rol oynar. IL-6’nın da bir sitokin reseptör proteinlerinin bulunduğu, diğer reseptör familyaları gibi bunların bir kısmının Ig benzeri yapılar gösterdikleri tesbit edilmiştir (82-85).
IL-6’nın salgılanmasına neden olan stimuluslar arasında IL-1, çeşitli antijen ve mitojenler bakteriyel endotoksinler ve TNF yer almaktadır. Bu interlökin diğer sitokinlerin sentezlenmelerinde kofaktör olarak etkidiği gibi timositler ve T lenfositler üzerinde de stimulatör rol oynar. IL-6’nın karaciğer hücreleri ve B lenfositleri üzerinde etkili olan 2 önemli fonksiyonu tanımlanmıştır.
1. Hepatositleri stimule eden faktör (HSF) olarak da bilinen IL-5 karaciğerden, doku yaralanmaları-yangıları sırasında C-reaktif protein (CRP), fibrinojen gibi akut faz proteinleri olarak bilinen bazı
plazma proteinlerinin sentezine sebep olur. Bu interlökin muhtemelen yangısal (iltihabi) yanıt sırasında kortikosteroid salınmasında önemlidir. IL-6 ile oluşturulan plazma proteinlerinin özellikleri IL-1 ve TNF ile oluşturulanları tamamlayıcı niteliktedir. 2. IL-6 B hücrelerinin diferensiyasyonları sırasında aktive olmuş B
hücrelerinin gecikmesi durumunda temel büyüme faktörü olarak ta görev yapar. Bu etkisi plasmasitomalar veya miyelomalar gibi malign plazma hücreleri için de geçerlidir. Özellikle aktive olmuş B lenfositleri üzerinde etkili olarak onların immünoglobulin yapacak olan plazma hücrelerine dönüşmesinde etkili olurlar (86,87).
Đnterlökin-8 (IL-8): IL-8 yapısal olarak homolog özellikteki birçok sitokinden ibaret bir aileye dahildir. Bu interlokin nötrofiller üzerinde daha etkili, eozinofilleri, bazofiller ve lenfositler üzerinde daha az olmak üzere aktive edici ve kemotaktik etkiye sahiptir. Aynı zamanda T lenfositleri için de kuvvetli kemotaktik aktiviteye sahip olup bu etkisini bütün T alt tiplerinde de gösterir. IL-8 makrofajlar, lenfositler, fibroblastlar ve endotelial hücrelerden salınabilmektedir. Bu interlökin salınması için en önemli uyarıcılar IL-1 ve tümör nekrozis faktördür. IL-8 ve bu familya ile ilgili sitokinler yangıda sekonder etkili mediatörler olarak görev yaparlar (88).
Đnterlokin-10 (IL-10): Başlangıçta sitokin sentezini inhibe edici faktör olarak tanımlanmıştır. Th (yardımcı T) lenfosit alt grupları, CD5+ B lenfositler ve monositler tarafından salgılanmaktadır. IL-10 B hücrelerinde MHC klas-II antijenlerin ekspresyonunu stimule eder. T lenfositlerin ve mast hücrelerinin farklılaşmasını hızlandırır. Monosit ve makrofajlar üzerine güçlü inhibitör etki gösterir. Böylece Th1 hücrelere antijen prezentasyonu engellenir ve sonuçta gama-INF üretimi inhibe olur. Ayrıca IL-10 direkt olarak IL-1, IL-6 ve TNF-alfa sentezini de inhibe eder (89).
TNF-α
TNF-α ilk defa farelerde tümörleri nekrotize edebilen makrofaj türevli faktör olarak tanımlanmıştır.Membrana bağlı 233 aminoasitden oluşan prekürsör protein olarak sentezlenir ve TNF- α dönüştürücü enzim ile 157 aminoasitten oluşan çözünür formu meydana gelir.Çözünür molekül TNFR1 ve TNFR2 reseptörlerine bağlanarak etkisini gösterir (90-92).
Aktive monosit/makrofajlar lokal ve dolaşımdaki TNF- α’nın başlıca kaynağıdırlar.Buna ek olarak beyinde (glial hücrelerde) ve kalpte (kardiyak myositlerde) lokal olarak TNF- α üretilir(92). Normal konsantrasyonlarda TNF- α’nın doku yenilenmesi ve onarımı,inflamasyon,sitotoksik reaksiyonlar ve anti-tümoral immunite gibi yararları vardır.Diğer yandan TNF- α’nın serumda yüksek seviyede olması akut şok gelişimi ve doku hasarı,katabolik hormon salınımı,gastrointestinal nekroz,akut renal tübüler nekroz,adrenal hemoraji ve ateş oluşumuna neden olmaktadır. TNF- α ‘ ya kronik olarak düşük dozda maruz kalınırsa, kilo kaybı, anoreksiya, protein katabolizması, lipit tüketimi, hepatosplenomegali, subendokardiyal inflamasyon, insülin direnci ve akut faz proteini salınımı gerçekleşmektedir (93). Đnflamasyon indüksiyonundaki önemli rolü nedeniyle TNF- α romatoid artrit, multipl skleroz, diyabet, astım, crohn hastalığı gibi çeşitli otoimmun hastalıklarda ve ayrıca kanserde potansiyel zararları olduğu gösterilmiştir (93). Doğal ya da cerrahi müdahale, menopoza giren kadınlarda dolaşımdaki TNF- α düzeyinin arttığını bildiren çalışmalar vardır. Bununla birlikte postmenopozal osteoporozda TNF- α’nın osteoblast aktivitesini inhibe ettiği ve osteoklastojenezisi stimüle ettiği gösterilmiştir. (94,95).
Makrofajlardan salgılanan TNF- α, endotel hücrelerini uyararak E ve P selektinler ile , özellikle ICAM-1 (Intracellular adhesion molecule-1), ve VCAM-1 (vascular cell adhesion molecule-1) gibi integrin ligandlarının ekspresyonunu artırır. Đnflamasyon bölgesindeki kan damarlarından geçen
efektör T hücreleri, zayıfça selektinlere bağlanır ve endotelyal yüzeyde yuvarlanırlar. Bu efektör T hücrelerinin integrinleri endotelde kendi ligandları ile karşılaşınca, T hücreleri endotele daha sıkı yapışır ve kan damarlarından inflamasyon bölgelsine olan göç süreci başlar (96,97).
3.GEREÇ VE YÖNTEM
Bu çalışma Nisan 2008-Şubat 2009 tarihleri arasında Dicle Üniversitesi Tıp Fakültesi (DÜTF), Kadın Hastalıkları ve Doğum Polikliniğine, adet görmeme ( oligo-amenero), kıllanma artışı ve infertilite şikayetleriyle başvuran, 2003 Rotterdam Concencus Conferance on PCOS (ASHRE/ASRM) kriterlerine göre PKOS tanısına uyan 36 hasta ve bu hastalarla benzer yaş grubunda ve benzer kiloda olan 25 sağlıklı kadın ile yapıldı. OKS kullananlar, steroid preparat, kullananlar, diabetik olanlar, herhangi bir sistemik (karaciğer, böbrek, kalp) hastalığı olanlar, herhangi bir nedenle insülin direncini etkileyen ilaçları kullanan hastalar ve sigara içenler çalışmaya alınmadı. Hastalara çalışmanın amacı ve yapılacak tahliller hakkında bilgi verildi, sözlü olarak katılmaya onay veren hastalar çalışmaya dahil edildi. Đlk başvuru esnasında hastaların boyları (m) ve kiloları (kg) ölçülerek, kg/m2 cinsinden vücut kütle indeksleri (VKĐ) hesaplandı. VKĐ’ leri 21-25 kg/m2 olan hastalar çalışmaya alındı. Aynı zamanda, çalışmaya alınan sağlıklı kadınların da VKĐ’leri 21-25 kg/m2 idi.
PKO’nun varlığı 2003 Rotterdam Concencus Conferance on PCOS ( SHRE ASRM) kriterlerine göre değerlendirildi. Bu kriterler;
1. Mastruel düzensizlik (Oligo-amenore, oligo-anovulasyon) 2. Klinik ve/veya biyokimyasal hiperondrojenizm
3. Ultrasonografik olarak PKO morfolojisi (Bir overde, 12 adet veya daha fazla 2-9 mm çapında folikül bulunması ve/veya over volümünün 10 cm3 ‘ün üzerinde olması) dir.
Çalışmamızda glukoz ölçümleri, Dicle Üniversitesi Tıp Fakültesi (DÜTF) Hastanesi Merkez laboratuvarında Architect C 16000 otoanalizörü kullanılarak Hexokinase/G-6-PDH yöntemi ile yapıldı. Đnsülin ölçümleri yine aynı laboratuvarda Modular Analytıcs E 170 cihazında Electrochemiluminescence inmunoassay yöntemi ile yapıldı. Sitokinlerin
ölçümleri yine aynı laboratuvarda Immulıte 1000 cihazında chemiluminescent immunometric assay yöntemi ile yapıldı.
Glukoz, insülin ve sitokinlerin (Đnterlökin-1ß, Đnterlökin-2 Reseptör, interlökin-6 interlökin-8, interlökin-10, TNF-α) düzeylerini çalışmak için hastalardan ve sağlıklı kontrol grubundan 10 saatlik gece açlığını takiben 5’er cc’lik periferik venöz kan alınarak 5000 devirde 5 dakika santrifüj edildi, elde edilen serumlar analiz edildi.
Açlık glukoz ve açlık insülin düzeyleri esas alınarak HOMA-IR skoru (insülin direnci indeksi) hesaplandı.
HOMA-IR= Açlık serum glukozu x açlık serum insülini 405
Açlık serum glukozu : mg /dl Açlık serum insülin : µU/ml
Çalışmamızda HOMA-IR skoru 2.77 ve üzeri olan değerleri insülin direnci göstergesi olarak aldık.
Çalışmanın sonunda istatistiksel analiz için SPSS 10.00 kullanıldı. Đstatistiksel anlamlılık seviyesi p<0.05 olarak kabul edildi.
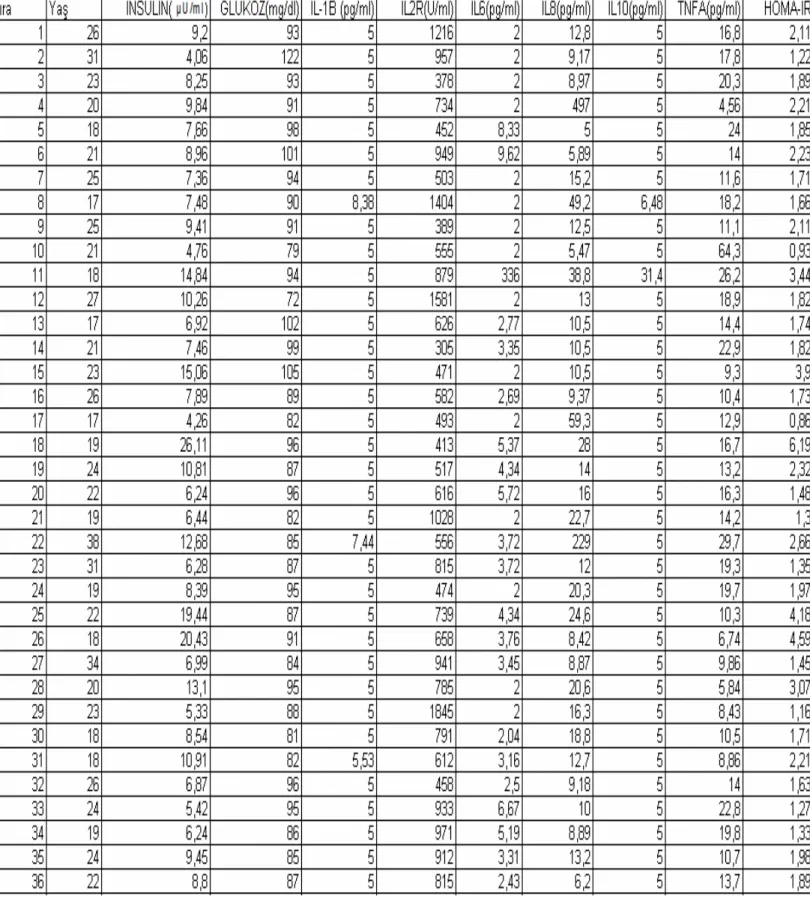
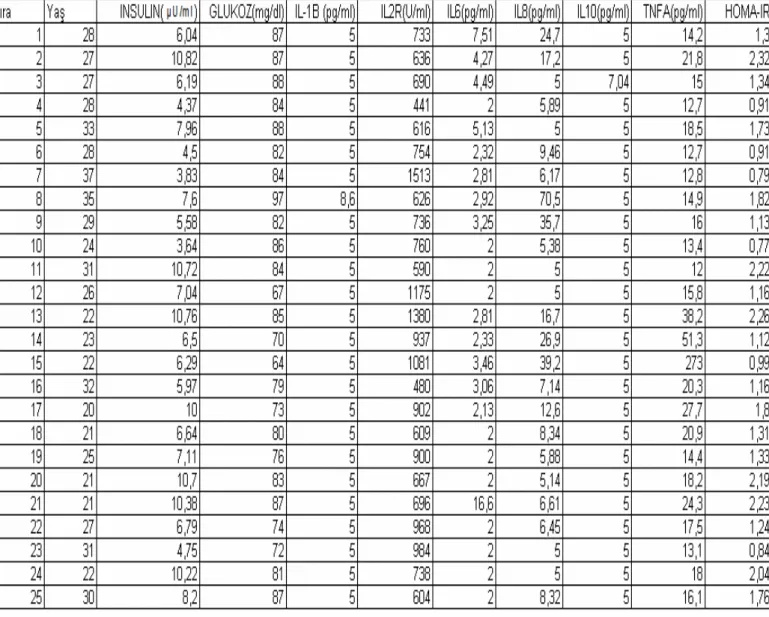
4. BULGULAR
Đnsülin değerleri açısından hasta ve kontrol grubu karşılaştırıldı.
Tablo.4.1. Hasta ve kontrol grubunun insülin değerleri açısından karşılaştırılması
Glukoz değerleri açısından hasta ve kontrol grubu karşılaştırıldı.
Tablo.4.2. Hasta ve kontrol grubunun glukoz değerleri açısından karşılaştırılması
Hasta grubunun tamamı oligomenoreik, kontrol grubunun tamamı ömenoreikti.
Hasta ve kontrol grubunun HOMA-IR skorları yönünden karşılaştırılması yapıldı.
TABLO:4.3. Hasta ve kontrol grubunun HOMA-IR skorları yönünden karşılaştırılması
Hasta ve kontrol grubunun interlökin-1 Beta düzeyi yönünden karşılaştırılması yapıldı.
TABLO:4.4. Hasta ve kontrol grubunun IL1B değerleri yönünden karşılaştırılması
Hasta ve kontrol grubunun interlökin-2 Reseptör düzeyi yönünden karşılaştırılması yapıldı.
TABLO:4.5. Hasta ve kontrol grubunun IL2 Reseptör değerleri yönünden karşılaştrılması
Hasta ve kontrol grubunun interlökin-6 düzeyi yönünden karşılaştırılması yapıldı.
TABLO:4.6. Hasta ve kontrol grubunun IL6 değerleri yönünden karşılaştırılması
Hasta ve kontrol grubunun interlökin-8 düzeyi yönünden karşılaştırılması yapıldı.
TABLO:4.7. Hasta ve kontrol grubunun IL8 değerleri yönünden karşılaştırılması
Hasta ve kontrol grubunun interlökin-10 düzeyi yönünden karşılaştırılması yapıldı.
TABLO:4.8. Hasta ve kontrol grubunun IL10 değerleri yönünden araştırılması
Hasta ve kontrol grubunun TNF-α düzeyi yönünden karşılaştırılması yapılması yapıldı.
TABLO:4.9. Hasta ve kontrol grubunun TNF-α değerleri yönünden karşılaştırılması
Tüm bu karşılaştırmalarda, Fisher’s Exact χ2 testi uygulandı.
Parametre Referans Aralığı Birimi
Đnsülin 3-17 µU/ml
Glukoz 70-109 mg/dl
Đnterlökin 1-ß 0.0-10.0 pg/ml
Đnterlökin 2-Reseptör 200-1000 U/ml
Đnterlökin 6 0.0-12.0 pg/ml
Đnterlökin 8 0.0-70.0 pg/ml
Đnterlökin 10 1.5-9.1 pg/ml
TNF-α 4.0-10.0 pg/ml
TABLO:4.10 Ölçülen parametrelerin referans aralıkları ve birimi
TABLO: 4.11 Ortalama, Standart Sapma ve (p) Değerleri ORTALAMA STANDART SAPMA P DEĞERĐ PCOS (N=36) 9.5039 4.7174 ĐNSULĐN KONTROL (N=25) 7.3040 2.3508 p<0.05 PCOS (N=36) 91.11 8.80 GLUKOZ KONTROL (N=25) 81.08 7.64 p<0.001 PCOS (N=36) 5.1764 .6874 IL 1β KONTROL (N=25) 5.1440 .7200 p>0.05 PCOS (N=36) 759.81 343.04 IL 2R KONTROL (N=25) 808.64 263.14 p>0.05 PCOS (N=36) 3.4578 2.0232 IL 6 KONTROL (N=25) 3.4036 3.0456 p>0.05 PCOS (N=36) 15.7758 11.7640 IL 8 KONTROL (N=25) 11.5512 9.8759 p<0.05 PCOS (N=36) 5.7744 4.3999 IL 10 KONTROL (N=25) 5.0816 .4080 p>0.05 PCOS (N=36) 16.3414 10.0943 TNFα KONTROL (N=25) 19.0200 7.2467 p>0.05 PCOS (N=36) 2.1393 1.1053 HOMA-IR KONTROL (N=25) 1.4688 .5199 p<0.05
HOMA-IR skoru ile sitokinlerin ilişkisini belirlemek amacıyla korelasyon analizi yapıldı.
HOMA-IR skoru yüksek olanlar(ID olan hastalar) ile IL1-ß arasında bir bağ bulunamadı (korelasyon katsayısı r:0.113, p:0.511). HOMA-IR skoru yüksek olanlar(ID olan hastalar) ile IL-2R arasında bir bağ bulunamadı (korelasyon katsayısı r:-0.278, p:0.101).
HOMA-IR skoru yüksek olanlar(ID olan hastalar) ile IL-6 arasında bir bağ bulunamadı(korelasyon katsayısı r:0.249, p:0.143).
HOMA-IR skoru yüksek olanlar(ID olan hastalar) ile IL-8 arasında bir bağ bulunamadı(korelasyon katsayısı r:0.203, p:0.235).
HOMA-IR skoru yüksek olanlar(ID olan hastalar) ile IL-10 arasında bir bağ bulunamadı(korelasyon katsayısı r:0.088, p:0.609).
HOMA-IR skoru yüksek olanlar(ID olan hastalar) ile TNF-α arasında bir bağ bulunamadı( korelasyon katsayısı r:-0.244, p:0.152).
5. TARTIŞMA
Polikistik over sendromu(PKOS), reprodüktif dönemde en sık görülen endokrin bozukluktur. Bu yaşta kadınların %5-10’unda görülür (98). Sendromun özellikleri klinik, endokrin ve metobolik olmak üzere üç başlık altında toplanabilir. Hormonal profilinde; LH/FSH yüksekliği, androjenlerde artış, PRL artışı, SHBG ve IGFBP-1’de azalma ve hiperinsülinemi bulunur. Hiperandrojenemi sonucunda klinik olarak akne, hirsutizm, sebore, alopesi ve akantozis nigrikans görülebilir. PKOS, menstruel anormallikler, anovulasyon infertilite, abortus, gestasyonel diabet ve preeklampsi gibi reprodüktif bozukluklarla kendini gösterebilir. Bunlara ilaveten özellikle uzun dönemde disfibrinolizis, dislipidemi, bozulmuş glukoz toleransı, diabet hipertansiyon, ve kardiyovasküler hastalıklar da tabloya eklenebilir (99-101). PKOS’un etyolojisi hala net olarak açıklanmamıştır. Klinik, biyokimyasal ve endokrin bulgulardaki ve ovaryan morfolojideki heterojenite hastalığın etyopatogenezinde de heterojeniteyi düşündürmektedir. Son yıllarda yapılan çalışmalarda özellikle insülin direnci ve hiperinsülinemi üzerinde durulmaktadır (51). PKOS’un fenotipik spektrumunda obez, aşırı değişik derecelerde insülin dirençli, belirgin hiperandrojenemisi olan ancak ĐD olmayan zayıf, nonobez veya normal kiloda ve ĐD olan zayıf veya normal kiloda hastalar olabilir (49,53). Chang ve arkadaşları ile Dunaif ve arkadaşları öglisemik klemp tekniğini kullanarak yaptıkları çalışmalarında hem obez hem de nonobez PKOS’luların benzer yaş ve kilodaki normal kadınlara göre daha insüline dirençli ve daha hiperinsülinemik olduğunu gösterdiler ve bu sonuçlar daha sonra birçok araştırmacı tarafından desteklendi (54). Dunaif ve arkadaşları, öglisemik glukoz klemp tekniğini kullanarak PKOS’lu hastalarda ĐD ve hiperinsülinemi arasındaki ilişkiyi gösterdikleri çalışmalarında, hastaları obez ve nonobez olarak sınıfladılar, total kilo yağdan yoksun (fat-tree) kiloya göre hastaların insülin uyarılı glukoz kullanımını değerlendirdiler ve ĐD’nin obeziteden ve vücut kompozisyonundaki değişikliklerden bağımsız olduğunu gösterdiler. Zayıf PKOS’luların insüline dirençli olduğunu gösteren çalışmalar bulunmakla
beraber, sağlıklı kontrol grubuyla karşılaştırıldığında zayıf PKOS’luların daha insüline dirençli olmadığını, buna karşılık bunlarda belirgin insülin hipersekresyonu bulunduğunu gösteren çalışmalar da vardır (58,67).
PKOS’luların %50-70’i obezdir ve bu obezite tipik olarak Bel/Kalça oranının arttığı android obezitedir. Hastaların %30-50’si normal kiloda veya zayıftır ve bu grupta hastalığın patogenezi ve ĐD’nin mekanizması obezlerden farklıdır (54,55). Zayıf veya normal kilolu PKOS’lularda da android vücut paterni ve intraabdominal yağ artışı gösterilmiştir. ĐD hem zayıf hem obezlerde risk faktörüdür. Obez PKOS’luların %75’i non obez veya zayıf PKOS’luların %30’unda hiperinsülinemi ve ĐD vardır (59). Obez PKOS’lularda ĐD’ nin şiddeti obezitenin derecesiyle korelasyon gösterir. Etkilenmiş zayıf PKOS’lularda ise intrensek ve hala tam olarak anlaşılmamış bir ĐD formu vardır (55).
PKOS’lularda ĐD’nin mekanizması yeterince açık değildir ve insülinin reseptörüne bağlanma sonrasında ve sinyal iletiminde defektler olduğu %50 hastada gösterilmiştir. Sonuç olarak PKOS’lularda ĐD’ne yol açan, insülin aksiyon ve sinyal iletimini etkileyen pek çok hücresel mekanizma olabilir. Bunun sonucu olarak aynı fenotipte farklı genetik mutasyonlar ve farklı moleküller anormallikler bulunabilir (8-10). Bu noktada ise insüline dirençli olan bireylerde overlerin hiperinsülinemiye duyarlı olmasındaki mekanizma hala anlaşılmamıştır.
Đnsüline karşı doku direnci bazı kronik hastalıkların gelişim sürecinde önemli rol oynar (41). PKOS’lu hastalar sadece bazı reprodüktif fonksiyon bozukluklarından muzdarip olmayıp, uzun dönemde dislipidemi, BGT, gestasyonel diabet, tip 2 diabet, hipertansiyon, ateroskleroz ve artmış kardiyovasküler hastalık insidansı gib metabolik ve kardiyovasküler sağlık problemleri ile de karşı karşıyadırlar (101-105). Dolayısıyla PKOS’ da Artmış uzun dönem metabolik ve kardiyovasküler komplikasyon oranından hiperinsülinemi ve ĐD sorumlu tutulmaktadır. Đnsüline karşı doku direnci kas ve yağ dokusunda meydana gelir ve yağ dokusunda insülin aksiyonunun defektif olması serbest yağ asitlerinin salınmasına ve bu da hepatik lipogenez ve
glukoneogenezin artmasına yol açar. Kaslarda ĐD oluşması diğer dokularda insüline normal veya fazla cevap verilmesine yol açabilir, örneğin hepatik lipid üretimi artar, hiperlipidemi gelişir, renal su-tuz retansiyonu artar, hipertansiyon gelişebilir. Ayrıca hiperinsülinemi, hem direkt olarak hemde IGF reseptörleri aracılığıyla vasküler düz kas hücrelerinde hipertrofi ve hiperplaziyi uyararak ateroskleroza yol açar (106). Hipersülinemi ovaryan fonksiyonları ve morfolojiyi sadece androjen üretimini direkt olarak uyararak ve gonadotropinlerle sinerji göstererek etkilemez aynı zamanda IGF sistemini aktive etmek yoluyla karaciğerden SHBG üretimini inhibe ederek de etkiler (61,63). IGF-1 ve insülinin techa interstisyel hücrelerinde proliferasyonu ve techa hücrelerinde LH uyarılı androjen üretimini uyardığı gösterilmiştir. IGF-1 ayrıca insan over fizyolojisinde, foliküler gelişim ve steroidogenezde etkilidir. Normal kadınlarda karşılaştırıldığında PKOS’lu kadınların ovaryan foliküler sıvısında IGF-1 konsantrasyonları belirgin olarak yüksektir. PKOS’lu kadınların serum IGF-1 düzeyleri de daha yüksektir (63). Buradan yola çıkarak insülin ve IGF sistemindeki değişikliklerin PKOS patogenezinde rol oynadığı düşünülebilir (63).
PKOS’lu kadınlarda benzer yaş ve vücut ağırlığına sahip sağlıklı kadınlardan, DM ve BGT prevalansı anlamlı olarak yüksektir (107-109). ĐD, obezitenin derecesine bağlı olarak genel populasyonun %10-25’ini etkilemektedir. ĐD ile ilişkili olarak görülen iki yaygın hastalıktan PKOS üreme çağındaki kadınların %6-10’unu, tip 2 diabet ise benzer yaş grubundaki kadınların %2’sini etkiler. PKOS’lu kadınların %50-70’inde, tip 2 diabetli kadınların %80-100’ünde değişik derecelerde ĐD bulunur.Legro ve arkadaşlarının 254 PKOS’lu hasta ile yaptıkları prospektif bir çalışmada obez PKOS’lularda %31 oranında BGT, % 7,5 oranında aşikar diabet saptanırken non obez PKOS’lu grubunda bu oranlar sırasıyla %10 ve %1.5 idi (110). Diğer çalışmalarda da benzer sonuçlar bildirilmiştir(111).
Hiperinsülinemik ĐD, bazı PKOS’lu hastaların karakteristiğidir(10,11). ĐD’nin tanısı kolay değildir. Đnsülin duyarlılığının in-vivo değerlendirilmesinde altın standart öglisemik hipersülinemik klemp tekniğidir ancak zaman alıcı ve pahalı bir yöntem olması ve klinik uygulama zorluğu nedeniyle genellikle başka
yöntemler tercih edilir. Pratikte en sık kullanılanlar, açlık insülin düzeyi, açlık glukoz/insülin oranı, OGGT ve HOMA’dır. Çalışmamızda ĐD’ni değerlendirmek için HOMA indeksini kullandık. HOMA (Homeastozis Model Assesment); beta hücre fonksiyonu ve ĐD hakkında bilgi veren ve değerlendirmede açlık plazma insülin ve glukoz seviyelerinin kullanıldığı bir yöntemdir (71,74). HOMA yöntemiyle değerlendirilen insülin direncinin artmış olması, bireylerin OGTT ile normal gibi görünseler bile, hayatlarının ileri dönemlerinde diabet gelişimi için risk taşıdıklarını gösterir.
Biz bu çalışmamızda daha önce yapılan çalışmalara benzer şekilde non-obez PKOS lularda insülin direncini yüksek bulduk.
Obezlerde IL-6 düzeylerinin artmış olmasını açıklayabilecek muhtemel mekanizma yağ dokusunun IL-6 üretip (112,113) salgılayabilme (114) özelliğine bağlanabilir. Gerçekten de IL-6 yapımı obez bireylerde daha yüksektir (115). Ancak nedeni anlaşılamamıştır. Açlık serum IL-6 konsantrasyonları Bastard ve arkadaşlarının yaptığı çalışmalarda (116) insülin direnci göstergesi olarak ölçülen tüm parametrelerle (açlık plazma insülini, açlık plazma glukozu, fasting insülin resistance index (FIRI) ve bel kalça oranı BKO) ilişkilidir. IL-6 düzeylerinin TNF- α ve leptine göre obeziteye insülin direnciyle daha sıkı ilişkili olduğu düşünülmüştür,(116).
Yağ dokusundan salgılanan ve insülin direncinde rol alan IL-6 pek çok dokudan da salgılanabilir ve yemeklerden sonra da yükselmektedir (117). Yağ stromal hücreleri ve adipozitleri içeren bir çok hücreden salgılandığı gösterilmiştir(112,118).
IL-6’nın hücresel düzeyde insülin direnci yaratma mekanizması tam olarak anlaşılmamıştır ancak artmış plazma serbest yağ asidi ve yağ oksidasyonu(119), yağ dokusu LPL aktivite azalması (120) ile birlikte olan katabolik durumu anımsatan fizyolojik değişikliklerin IL-6 ile ortaya çıkarılabileceği gösterilmiştir. Bu etkilerin tümü insülin etkisinin tersi etkilerdir ve böylelikle insülin etkisini bozarlar. Benzer şekilde IL-6’nın insülinin hepatik
glikojen metabolizması (119) üstündeki etkilerine ters etkileri sahip olduğu gösterilmiştir ve IL-6 glisemiyi (120) arttırır.
Plazma IL-6 yüksekliği ayrıca plazma serbest yağ asitleri ile de bir orantı içindedir(117). BKĐ >30 kg / m2 olan obezlerde IL-6 düzeyleri yüksek bulunmuş ve bu da insülin sensitivitesinde azalmayla ilişkilidir(117). Yine bir çalışmada yaş ve BKĐ aynı olan hastalarda ölçülen yüksek IL-6 plazma düzeyinin, insülin direncinden bağımsız olarak obeziteyi etkilediği de gösterilmiştir(117).
Mohammed Ali (112) yağ dokusundan salgılanan IL-6’nın obezitedeki rolünü obez bireylerde yağ dokusundan artmış oranda IL-6 salgılandığını göstererek kanıtlamıştır ve bu salgı bazal durumda dolaşımdaki IL-6 konsantrasyonunun %25’ini oluşturur.
Yudkin ve çalışma arkadaşları yaptıkları çalışmada, subkutan yağ dokusu tarafından IL-6 üretiminin arttığını bildirmişlerdir. Obez kentli ve köylü Hindistanlılarda yaptıkları çalışmada BKĐ, BKO, TNF- α, IL-6 ve leptin düzeylerini ölçmüşler, çalışmada bu sitokinlerin BKĐ ile pozitif yönde anlamlı ilişki olduğunu fakat BKO ile ilişkili olmadığını görmüşlerdir. Bugünki bilgiler IL-6’nın insülin direnci ile ilişkili olan major dolaşım konmponenti olarak gösterildiğidir(121).
IL-6 nın obeziteden bağımsız olarak insülin direnci ile patofizyolojik bağlantısı olabileceği ileri sürülmüştür, Çalışmamızda ID yüksek olan 5 PCOS hastasında IL-6 seviyesi normal bulundu. Ancak 1 hastada hem ID , hem de IL-6 yüksek bulundu.Genel olarak istatistiki anlamda incelendiğinde ise ID ile IL-6 arasındaki ilişki anlamsızdı.
TNF-α çeşitli immünolojik fonksiyonları ile bilinen önemli bir sitokindir. Önceleri tümör nekrozuna neden olabileceği ve hatta kanser enfeksiyon gibi durumlarla da ilişkili olabileceği düşünülmüştür. Obez kişilerde adipositlerde ve vasküler bağ dokusu hücrelerinde TNF-α reseptörlerinin sentezi artmaktadır(122). TNF- α bu etkileriyle obezite ve diyabette insülin direncinin gelişmesine katkıda bulunabilir. TNF-α, insülinin yağ ve kas dokusu üzerindeki etkisini inhibe eder(123). TNF-α insüline dirençli hayvanlarda lipid yıkımına neden olur (124). TNF-α konsantrasyonu ağırlık kaybı ve anti tip-2 diabetik tedavisi ile düşmektedir(125). TNF-α kullanımı tiroid hücre fonksiyonunun baskılanmasına neden olmaktadır (124). TNF-α’nın hipotalamus üzerinde de önemli etkileri vardır. Sıçanlarda intravenöz TNF-α enjeksiyonu GH sekresyonunu uyarır; TSH sekresyonunu ise inhibe eder (125). Böylece, TNF- α apoptoz yolu ile adiposit yıkımını kolaylaştırarak, lipogenezi inhibe ederek ve lipolizi arttırarak yağ dokusu miktarını ayarlamakta ve obezite üzerinde önemli ölçüde koruyucu etki göstermektedir (126).
TNF- α, nın yükselmesinin mekanizması obezlerde izah edilebilmektedir.Ancak non obezlerde artıp artmadığı arştırılmamış ve pek açık değildir.Çalışmamızda TNF- α değerleri kontrol ve hasta grubu ile karşılaştırıldığında anlamlı değildi.Yani non obez PKOS lularda TNF- α nın artmadığı gözlemlendi. ID ile TNF- α karşılaştırıldığında ID yüksek olan 3 hastada TNF - α yüksekti. Ancak genel olarak TNF - α ile ID arasında anlamlı bir ilişki yoktu.
IL-8 de proinflammatuar sitokinler arasında sayılmaktadır. Çalışmamızda IL-8 düzeyleri kontrol grubu ile kıyaslandığnda yüksek bulunmuştur. PKOS hastalarında yapılan bir çalışmada IL-8 seviyesinin değişmediği gözlenmiştir(127), Çalışmamızda ID ile IL-8 arasında anlamlı bir korelasyon bulunamadı,