T.C.
SELÇUK ÜNĐVERSĐTESĐ FEN BĐLĐMLERĐ ENSTĐTÜSÜ
NĐFEDĐPĐNĐN KARACĐĞER VE ĐNCE BAĞIRSAK ÜZERĐNDEKĐ ETKĐLERĐNĐN
IŞIK MĐKROSKOBĐK DÜZEYDE ĐNCELENMESĐ
Canan AKGÜL YÜKSEK LĐSANS TEZĐ
Biyoloji Anabilim Dalı
ARALIK-2012 KONYA Her Hakkı Saklıdır
TEZ BĐLDĐRĐMĐ
Bu tezdeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalışmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Canan AKGÜL Tarih: 11/12/2012
iv ÖZET
YÜKSEK LĐSANS TEZĐ
NĐFEDĐPĐNĐN KARACĐĞER VE ĐNCE BAĞIRSAK ÜZERĐNDEKĐ ETKĐLERĐNĐN IŞIK MĐKROSKOBĐK DÜZEYDE ĐNCELENMESĐ
Canan AKGÜL
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı
Danışman: Doç. Dr. Haluk ÖZPARLAK 2012, 87 Sayfa
Jüri
Doç. Dr. Haluk ÖZPARLAK Prof. Dr. Đlhami ÇELĐK Yrd. Dr. Sadettin ÜNSAL
Bu çalışmada ratlara 30 gün süreyle verilen yüksek dozdaki kalsiyum kanal blokörü nifedipinin, olası etkileri histolojik açıdan 30. günde ve ayrıca ilaç kesildikten sonraki 40. günde değerlendirilmiştir. Çalışma başlangıcında ratlar kontrol (n=16) ve nifedipin (n=16) grubu olmak üzere iki gruba ayrılmıştır. Nifedipin grubuna bir hafta süreyle toz formundaki 125 mg/kg nifedipin her gün standart rat yemine karıştırılarak verilmiştir. Đkinci haftadan itibaren üç hafta boyunca her gün 250 mg/kg nifedipin aynı yöntemle verilmiştir. Çalışmanın 30 ve 70. günlerinde ratların ince bağırsak ve karaciğerinden alınan doku örneklerinden rutin histolojik kesitler alınarak, genel histolojik yapıları ışık mikroskobunda değerlendirilmiş ve histometrik analizleri yapılmıştır. Đnce bağırsak ve karaciğer dokularına PAS yöntemi ve ayrıca karaciğer dokularına AgNOR boyaması da yapılmıştır. Çalışmanın sonunda nifedipin verilen ratların canlı ağırlık kazancında azalma tespit edilmiştir (p<0.05). Nifedipin uygulanan grubun ince bağırsağına ait villus alanında istatistiksel olarak önemli düzeyde azalma tespit edilmiştir (p<0.05). Villus alanında görülen bu azalmanın atrofiden kaynaklanabileceği düşünülmektedir. Nifedipin uygulaması kesilen grupta ise atrofide gerileme tespit edilmiştir. Nifedipin uygulanan gruptaki ratlara ait karaciğerde dikaryotik hepatosit oranında istatistiksel olarak önemli düzeyde artış tespit edilmiştir (p<0.05). Nifedipin uygulaması kesilen grupta ise dikaryotik hepatosit oranında önemli düzeyde azalma tespit edilmiştir (p<0.05). Hepatosit AgNOR parametrelerinden AgNOR alanı\Çekirdek alanı (%) nifedipin uygulanan grupta istatistiksel olarak önemli düzeyde artış göstermiştir (p<0.05). Bu artışın bazı enzimlerin artışından dolayısıyla da protein sentezindeki bir artıştan kaynaklanması muhtemeldir.
v ABSTRACT MS THESIS
LIGHT MICROSCOPIC INVESTIGATION OF EFFECTS OF NIFEDIPINE ON LIVER AND SMALL INTESTINE
Canan AKGÜL
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF MASTER OF SCIENCE IN BIOLOGY Advisor: Assoc. Prof. Dr. Haluk ÖZPARLAK
2012, 87 Pages Jury
Assoc. Prof. Dr. Haluk ÖZPARLAK Prof. Dr. Đlhami ÇELĐK Asst. Prof. Dr. Sadettin ÜNSAL
The aim of this study was to evaluate histologically possible effects of high dose nifedipine, calcium channel blocker which was administered to the rats for 30 days and also effects of the cessation of administration after 40 days. At the beginning of the study, the rats were divided into control (n=16) and nifedipine (n=16) groups. Everday, standard rat food containing 125 mg\kg powdered nifedipine was given to the nifedipine group for one week. During the following three weeks, 250 mg\kg nifedipine was given to the rats with the same method. On the 30th and 70th days of the study, routine histologic sections were obtained from the tissue samples of small intestine and liver. The general histologic structure of the liver and small intestine were evaluated and histometric data were analyzed with under the light microscope. PAS method was applied to small intestine and liver tissues and also AgNOR method was applied to liver tissues. There was a decrease in the live weight of the rats of nifedipine group (p<0.05). A statisticaly significant decrease was observed in the villus area which belongs to small intestine of the nifedipine-administered group (p<0.05). It was thought that the decrease of the villus area might be arisen from atrophy. Regression in atrophy was observed in the nifedipine-ceased group. A statisticaly significant increase was observed in the ratio of dikaryotic hepatocytes of the nifedipine-administered group (p<0.05). On the other hand, a statisticaly significant decrease was observed in the ratio of dikaryotic hepatocytes in the nifedipine-ceased group (p<0.05). A statisticaly significant increase was observed in one of the hepatocyte AgNOR parameters, AgNOR area\Nucleous area (%) in the nifedipine-administered group (p<0.05). This increase may be due to an increase in the synthesis of some enzymes and proteins.
vi ÖNSÖZ
Çalışmamız boyunca bilgi ve deneyimlerini esirgemeyen değerli hocalarım S.Ü. Veterinerlik Fakültesi Histoloji-Embriyoloji Anabilim Dalı Öğretim üyeleri Prof. Dr. Đlhami ÇELĐK, Prof. Dr. Emrah SUR ve Doç. Dr. Yasemin ÖZNURLU’ya,
Yüksek lisans eğitimim boyunca hoşgörüyle rehberlik eden ve yardımcı olan danışman hocam Doç. Dr. Haluk ÖZPARLAK’a,
Çalışmalarım boyunca yardımlarını esirgemeyen sevgili arkadaşım Merve GÖKMEN’e,
Deney hayvanlarına ilaç uygulama aşamasında ve dokuların alınmasında yardımlarını esirgemeyen Cem MANGIROĞLUN’a
Tez yazım aşamasında yardımcı olan kardeşlerim Aynur ve Aybüke AKGÜL’e, ayrıca Konya’da kaldığım süre boyunca benimle ilgilenen ablam Nalan AKGÜL DURMAZ ve eşi Mevlüt DURMAZ’a,
Beni bugünlere getiren anneme ve babama,
Teşekkür ederim.
CANAN AKGÜL KONYA-2012
vii ĐÇĐNDEKĐLER ÖZET ... iv ABSTRACT ...v ÖNSÖZ ... vi ĐÇĐNDEKĐLER ... vii SĐMGELER VE KISALTMALAR ... ix 1. GĐRĐŞ ...1 2. KAYNAK ARAŞTIRMASI ...3 2.1. Kalsiyum Kanalları ...3
2.2. Kalsiyum Kanal Blokörleri ...6
2.3. Nifedipin ... 10
2.4. Đnce Bağırsak ... 12
2.4.1. Duodenum ... 16
2.4.2. Jejunum ... 16
2.4.3. Đleum ... 16
2.4.4. Kalsiyum kanal blokörlerinin ince bağırsak üzerine etkileri ile ilgili çalışmalar ... 17
2.5. Karaciğer ... 18
2.5.1. Karaciğerin lobülleri ... 20
2.5.2. Đlaç ve toksine bağlı karaciğer hasarları ... 23
2.5.3. Karaciğer rejenerasyonu ... 24
2.5.4. Hepatoksisite ... 25
2.5.5. Kalsiyum kanal blokörlerinin karaciğer üzerine etkileri ile ilgili çalışmalar 25 2.6. AgNOR Proteinleri ... 26
2.6.1. AgNOR’ların gümüş nitrat ile boyanması... 28
3. MATERYAL VE YÖNTEM ... 31
3.1. Deney Grupları ... 31
3.2. Dokuların Alınması ... 32
3.3. Dokuların Takibi... 32
3.4. Kesitlerin Histokimyasal Boyaması ... 32
3.5. Kesitlerin Histometrik Değerlendirilmesi ... 33
3.6. Đstatistiksel Analizler ... 34
4. ARAŞTIRMA SONUÇLARI VE TARTIŞMA ... 35
4.1. Vücut Ağırlıklarının Değerlendirilmesi ... 35
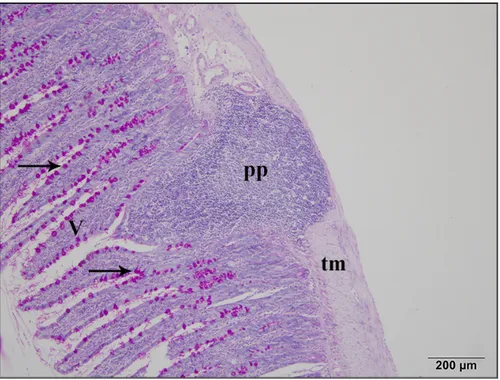
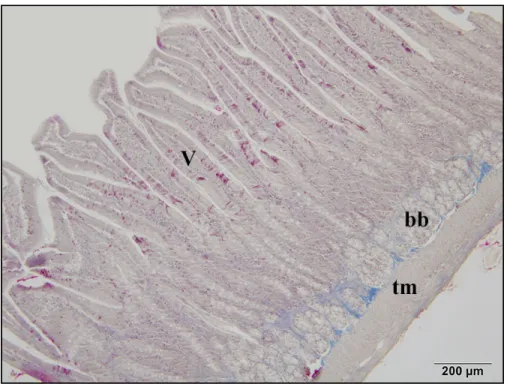
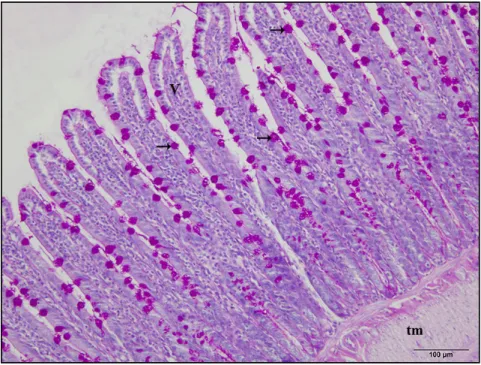
4.2. Đnce Bağırsak Dokusunda Görülen Histolojik Değişiklikler ... 36
viii
4.2.2. Nifedipinin ince bağırsak üzerindeki histolojik etkileri ... 41
4.3. Đnce Bağırsak Dokusundan Elde Edilen Histometrik Bulgular ... 45
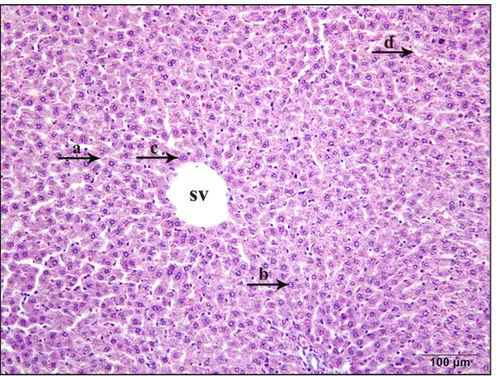
4.4. Karaciğer Dokusunda Görülen Histolojik Değişiklikler... 48
4.4.1. Kontrol grubunda karaciğer histolojisi... 48
4.4.2. Nifedipinin karaciğer üzerindeki histolojik etkileri ... 52
4.5. Karaciğer Dokusundan Elde Edilen Histometrik Bulgular ... 58
4.6. Tartışma ... 62 5. SONUÇLAR VE ÖNERĐLER... 71 5.1. Sonuçlar………71 5.2. Öneriler……….72 KAYNAKLAR ... 73 ÖZGEÇMĐŞ ... 87
ix
SĐMGELER VE KISALTMALAR AgNOR : Silver Staining Nucleolus Organizer Regions CYP-450 : Sitokrom P-450
H-E : Hematoksilen-Eozin IRI : Đskemi reperfüzyon hasarı IR : Đskemi reperfüzyon
NOR : Nucleolus Organizer Regions (Nükleolus organizer bölgeleri) PAS : Periodic Acid Schiff
PCNA : Proliferating Cell Nuclear Antigen
x
±SS : Aritmetik ortalama ± Standart sapma1. GĐRĐŞ
Kalsiyum kanal blokörleri, kalsiyum iyonlarının hücre membranından hücre içine girişini direkt olarak bloke ederler. En çok önerilen ajan L-tipi kalsiyum kanallarını bloke eden nifedipindir (Papatsonis ve ark., 1996). Nifedipin, dihidropiridin türevi ilaçların klinik kullanıma ilk gireni ve en fazla kullanılanıdır. Bu grup ilaçların prototipi olarak kabul edilen nifedipin ayrıca kısa sürede kan basıncını düşüren etkili bir ilaçtır. Bu özelliği nedeni ile yinelenen dozlarda verildiğinde kan basıncında belirgin dalgalanmalar ve buna bağlı refleks kalp stimülasyonu yapmaktadır. Nifedipin, oral verilişten sonra mide-bağırsak kanalından çabuk ve tama yakın bir derecede absorbe edilir. Sublingual verilişten sonra daha hızlı absorbe edildiği ileri sürülmüşse de ağız mukozasından hızlı absorbe edilmediği saptanmıştır. Mide-bağırsak kanalından absorbsiyondan sonra karaciğerden ilk geçişteki eliminasyonu fazla olmaz ve sistemik biyoyararlanımı yaklaşık %65’tir. Esas olarak, karaciğerde polar metabolitlere dönüştürülmek suretiyle inaktive edilir. Eliminasyon yarılanma ömrü yaklaşık 5 saattir. %70-80’i böbreklerle dışarı atılır. Nifedipinin sık görülen yan etkileri; baş ağrısı, palpitasyon (çarpıntı), yüzde ve bacaklarda cilt damarlarının vazodilatasyonuna bağlı olarak duyumsama, yüz kızarması ve ayak bileği ödemidir (Eliott ve Black, 2007).
Bir kimyasal veya ilacın ağızdan emilimi hem bağırsak hem de karaciğer metabolizması ile değiştirilebilir. Her ne kadar, bağırsakların kan akışı ve doku hacmi karaciğerden biraz daha düşükse de, yaygın mikrovillus yapısı, emilim için geniş bir yüzey alanı sağlamaktadır (Poet ve ark., 2003). Đlaç metabolizmasında etkili olan ince bağırsak, midenin pilorusundan sonra başlar ve kalın bağırsağa kadar uzanır (Çimen, 1987). Đnce bağırsak duodenum, jejunum ve ileum olmak üzere üç bölümden oluşur ve ince bağırsağın bu üç bölümünde bazı histolojik farklılıklar bulunsa da temelde yapıları aynıdır. Đnce bağırsaklar; besinlerin sindiriminin ve emiliminin gerçekleştiği bunların yanı sıra endokrin sekresyonun da yapıldığı bir organdır (Junqueira ve ark., 1998). Bağırsak epitel hücreleri (enterositler) geniş alanda ilaçları ve ksenobiyotikleri metabolize etme yeteneği olan enzimler içermektedir. Yapılan çok sayıda klinik çalışma, ilk geçiş metabolizmasında bağırsakların önemini göstermiştir. Đlaçların veya kimyasalların oral biyoyararlanımı, bağırsak emilimi ve onunla ilişkili ilk geçiş metabolizması ölçüsünün bir fonksiyonudur (Poet ve ark., 2003).
Karaciğer ise deri hariç vücudun en büyük organı ve en büyük bezidir. Diyaframın altında abdominal boşlukta yerleşmiş olan karaciğerin dolaşım sistemindeki
yeri, metabolitlerin biriktirilip taşınması ve toksik maddelerin detoksifikasyonu için çok uygundur (Junqueira ve ark., 1998). Karaciğer, vücutta ilaçları metabolize ve detoksifiye eden ayrıca terapötik ve çevresel kimyasal maddelerin potansiyel hasarına açık olan başlıca organdır. Đlaç ya da bir metabolitin, bir proteini immünojene dönüştürmesi gibi immün mekanizmalar, ksenobiyotik bir toksinin karaciğer tarafından aktif toksine dönüştürülmesi ve direkt toksisite başlıca hasar nedenleri olarak gösterilebilir (Kumar ve ark., 2000).
Çok düşük dozdaki nifedipinin karaciğer, kalp, böbrek ve pankreas dokuları üzerine etkilerine ait bir araştırma dışında başka bir literatüre rastlanılmamıştır (Dhar ve Farzan, 1994). Bu çalışmayla yüksek dozdaki nifedipinin karaciğer ve ince bağırsak üzerindeki etkileri ışık mikroskobu ile histolojik düzeyde değerlendirilmiştir. Ayrıca AgNOR parametreleri üzerindeki etkileri de ortaya konmuştur. Böylece nifedipin ile yapılan deneysel çalışmalara ve bu maddenin etkileri hakkındaki literatür bilgilerine katkı sağlanması amaçlanmıştır.
2. KAYNAK ARAŞTIRMASI 2.1. Kalsiyum Kanalları
Kalsiyum, canlı hücrelerin fonksiyon ve yapılarını sürdürebilmeleri için gerekli bir iyondur (Rasmussen, 1986). Gündelik yaşantımızda kalsiyum ihtiyacı bu iyon bakımından zengin süt ve süt ürünlerinden karşılanmaktadır. Kan kalsiyum düzeyi sağlıklı bir insanda 8.5-10.2 mg/dl seviyesindedir. Yetişkin bir insanda kalsiyumun %99’u mineralize olmuş dokularda (kemikler ve dişler), geriye kalan %1’lik kısmı ise kan, hücre dışı sıvılar ve farklı dokularda bulunmaktadır (Champe ve ark., 2005).
Kalsiyum iyonu doğadaki sinyal dönüştürücülerin en önemlilerinden biri olmakla beraber kasların kasılma ve uyarılmalarına da katkıda bulunmaktadır (Katz, 1996; Brunton ve ark., 2003). Kalsiyum iyonu çeşitli enzimatik reaksiyonlarda, uyarılabilir hücrelerin aktivasyonunda, hücresel sekresyonlarda elektriksel aktivitenin oluşturulmasında, homeostaz ve kemik metabolizmasını içeren temel biyolojik süreçlerde hayati rolleri olan bir iyondur (Berridge, 1993). Kalsiyum istirahat safhasındaki hücrenin negatif yüklü sitosolüne girdiğinde depolarize eden bir elektrik akımı meydana getirir. Kimyasal sinyalizasyona kalsiyumun katılımı, hücre içindeki özelleşmiş bir proteinde bulunan yüksek afiniteli kalsiyum bağlanma bölgesine büyük bir özgüllük ve sıkı bir şekilde bağlanmayla meydana gelmektedir (Katz, 1996). Hücre içi kalsiyum seviyesinin yükselmesi kas kasılmaları, kemotaksi, gen ekspresyonu, sinaptik plastisite, hormon ve nörotransmitterlerin salınımını da içeren çeşitli süreçleri başlatabilmektedir. Hücre içi kalsiyum miktarının kontrolünde bazı kanal ve pompalar rol oynamaktadır (Perez-Reyes, 2003).
Diyetle alınan kalsiyumun %30-40’ı bağırsaklardan emilir. Kalsiyum emiliminin büyük bölümü ince bağırsakların proksimalinden (duodenum, jejunum), az bir bölümü de ileum ve kolonda olur. Kalsiyum emilimi, oral olarak alınmasından sonraki 4 saat içinde tamamlanır (Champe ve ark., 2005). Plazmadaki kalsiyum konsantrasyonu bağırsaklardan kalsiyum emilimi, böbreklerden kalsiyum atılımı, geri emilimi, iskelette kalsiyum depolanması ve rezorpsiyonuyla sıkı bir şekilde düzenlenmektedir (Cashman, 2002; Cui ve Rohan, 2006).
Canlı hücreler, hücre içi ve hücre dışı alanlar arasında çeşitli molekül ve atomların değişimini sağlamak için özelleşmiş proteinler içeren ve geçirgen olmayan membranlarla kaplıdırlar. Membranlar arası değişim, taşıma ve kanallar vasıtasıyla
olmak üzere iki temel mekanizmayla gerçekleşmektedir. Taşıma işlemi kalsiyum pompası, sodyum-kalsiyum değiştiricisi, sodyum-potasyum pompasının dışında konsantrasyon veya elektrik gradientine karşı taşıyıcı kanallar tarafından sağlanır. Membrandaki kanallar ise açıldıklarında pasif transportun gerçekleştiği porlar gibi görünmektedirler. Kanalların açılması iki yolla gerçekleşir; birincisi, direkt kanala ya da kanaldaki diğer bir membran proteinine özgül bir ligandın bağlanmasıyla meydana gelir. Đkincisi, membranlar arası voltajın değişmesiyle gerçekleşir. Bu yollardan ilki glutamat ve asetilkolin reseptörleri gibi ligant kapılı kanallardır. Diğer yolun aktivasyonu ise voltaj kapılı kanallar vasıtasıyla gerçekleşir (Lacinova, 2005). Kalsiyum kanallarının; konjenital migren, serebellar ataksi, nöropatik/kronik ağrı, anjina, epilepsi, hipertansiyon, iskemi ve bazı aritmileri de içeren hastalıklarda rolünün olduğu bildirilmiştir. Bu hastalıkların bazılarının tedavisinde, yaygın olarak düz kas ve kalpte yerleşmiş olan L-tipi kalsiyum kanallarına spesifik, kalsiyum kanal blokörlerinin keşfedilmesinin katkıları olmuştur (Janis ve Triggle, 1991).
Kalsiyum hücre dışından hücre içine üç tip kanal aracılığıyla girer. Bu kanallar; a)Voltaja-duyarlı kalsiyum kanalları (nöron ya da kas hücreleri gibi uyarılabilir hücrelerde)
b)Reseptör-kontrollü kalsiyum kanalları (nörotransmitterlere yanıt olarak) c)Depo-kontrollü kalsiyum kanalları (hücre içi kalsiyum depoları boşaldığı zaman
aktive olan)
Kalsiyum iyonunun düzenlenmesi hücredeki kalsiyumun salınmasına ve plazma membranı boyunca kalsiyumun giriş ve çıkışıyla olmaktadır. Membran seviyesinde hücre içine kalsiyum girişi, kısmen membran depolarize olduğunda açılan voltaj bağımlı kalsiyum kanalları aracılığıyla meydana gelir. Voltaj bağımlı kalsiyum kanalları sodyum ve potasyum kanallarının da içinde bulunduğu homolog proteinlerinden meydana gelen katyon kanalları ailesine mensuptur. Reseptör bağımlı kalsiyum kanalları ya direkt ya da g proteini uyarıcı reseptörlerle ilişkilidir ve reseptör ligantlara (α1 adrenoreseptördeki noradrenalinin etkisi) cevap olarak açılır. Genelde kalsiyum kanalları iyon seçici kapaklar gibi görev yapan membrana dağılmış vaziyette ve huni şeklindeki glikoproteinlerdir. Her kanalın dışarı ve içeri doğru akımları geçirmesine müsait kapıları mevcuttur. Dışa doğru kapılar hızlı kanallarda tetrodotoksin, yavaş kanallarda ise kalsiyum kanal blokörleri tarafından bloke edilebilmektedirler. Özellikle yavaş kanallarda içeriye doğru olan kapıların, membranın fosforilasyon durumuna bağlı olduğu düşünülmektedir (Tsien ve ark., 1998).
Tsien ve ark. (1998) farmakolojik ve elektrofizyolojik teknikler kullanarak voltaj kapılı kalsiyum kanallarının üç tipini belirlemişlerdir. Bu üç tür voltaj kapılı kalsiyum kanalı L-tipi, T-tipi ve N-tipi şeklinde adlandırılan kalsiyum kanallarıdır. Bu kanallar aktivasyon ve inaktivasyon kinetiklerine, iletim özelliklerine, iyon seçiciliklerine, ilaç veya toksinlere olan duyarlılıklarına göre sınıflandırılmışlardır. Son olarak çeşitli sinir hücrelerinde yüksek eşikli voltaj kapılı kalsiyum kanalları da bulunmuş ve bu kanallar P-tipi kanallar (purkinje hücrelerinde) olarak adlandırılmıştır (Tsien ve ark., 1998). Bu kanallar değişik kriterlere göre sınıflandırılsalar da kanal aktivasyon modellerine göre olan sınıflandırma en çok kabul gören sınıflandırmadır. Kanal aktivasyon durumlarına göre bu kanallar düşük voltajla aktive olan veya düşük eşikli kanallar ve yüksek voltajla aktive olan veya yüksek eşikli kanallar olarak iki sınıfa ayrılır (Panza, 1985; Miranda ve Paeile, 1990).
1. Düşük voltajla aktive olan T-tipi (transient) kanallar
2. Yüksek voltajla aktive olan L-tipi (uzun etkili süreli), N-tipi (nöronal) ve P-tipi (purkinje) kanallarıdır.
Bu kanallar içinde özellikleri en iyi ortaya konabilen L-tipi voltaja bağlı kalsiyum kanallarıdır. Başlangıçta kalsiyumu regüle edici ilaçların kalp iletim sistemindeki iletimin yanında, kontraksiyon üzerine ve düz kas tonusu üzerine olan etkilerinin belirlenmesi için çalışmalar yoğunlaşmış sonraları kalsiyuma bağlı hücre sinyal iletim sisteminin çok yönlü fonksiyonu dolayısıyla kalsiyum kanal antagonistlerinin diğer alanlardaki etkileri de araştırılmaya başlanmıştır (Panza, 1985;
Miranda ve Paeile, 1990). L-tipi kanalların, özellikle kalp, düz kası ve iskelet kaslarında varlığı
gösterilmiştir. Bu kanallar, dihidropiridin (nifedipin) ve fenilalkilamin türevi (verapamil) kalsiyum kanal blokörlerine yüksek oranda duyarlıdırlar (Singer ve ark., 1991; Spedding ve Paoletti, 1992). L-tipi kanallar bilinen bütün kalsiyum kanal blokörleri tarafından inhibe edilir ve geçirgenlikleri beta-adrenerjik uyarı ile belirgin bir biçimde artar (Arık ve Korkmaz, 1999).
N-tipi kanallar, santral sinir sisteminde yaygın olarak presinaptik sinir uçlarında bulunurlar ve nörotransmitter salınmasına aracılık ederler. Bu tip kanallar klasik kalsiyum kanal blokörleri aracılığıyla inhibe olmamaktadırlar. N-tipi kanallar bir çeşit deniz salyangozundan elde edilen omegakonotoksin-GVIA ve aminoglikozid antibiyotikler tarafından bloke edilirler (Tulunay ve Ergun, 1999).
T-tipi kalsiyum kanallarının inaktivasyonları çok hızlı olduğu için sadece kısa süreliğine kalsiyum akımına müsaittirler. Bu kanallar kalpte ve sinir hücrelerinde mevcuttur. Amilorid ve mibefradil tarafından selektif şekilde bloke olurlar (Tulunay ve Ergun, 1999). L-tipi kanallara göre daha negatif potansiyelde çalışabilmektedir ve başlıca sinüs düğümü ve atriyoventriküler düğümde depolarizasyonun başlatılmasında görevlidirler (Arık ve Korkmaz, 1999).
P-tipi kalsiyum kanalları, serebellar purkinje hücrelerinde bulunmuştur ve beyindeki kalsiyum kanallarının birçoğu bu tip kanallardır. Huni ağlı bir örümcek türünün zehiriyle bloke edildiği bulunmuştur (Yousef ve ark., 2005).
Yapısal olarak L-tipi kalsiyum kanalındaki dört bağlanma yeri için dört tip major kalsiyum kanal bloköri tanımlanmıştır:
1. Dihidropiridinler: Nifedipin, amlodipin, ve felodipin 2. Fenilalkilaminler: Verapamil, gallopamil ve tiapamil 3. Benzodiazepinler: Diltiazem
4. Diğerleri: Flunarazin, sinnarazin ve lidoflazin (Hirning ve ark., 1988)
Bu bağlanma yerleri içinde nifedipinin örnek olarak verilebileceği dihidropiridin bağlanma yeri periferde en fazla bulunan bağlanma yeridir (Epstein, 1992; Spedding ve Paoletti, 1992). Bütün kalsiyum kanal blokörleri kendi bağlanma yerleri dışında dihidropiridin bağlanma bölgesi üzerinden kısmen de olsa etki gösterirler (Starke ve Wichmann, 1984). Bu durumda reseptör direkt fiziksel olarak bloke edilmeyip, açık olan kanal sayısının az olduğu bir durumda kanallar stabilize edilerek yapılabilmektedir (Nowycky ve ark., 1985).
2.2. Kalsiyum Kanal Blokörleri
Kalsiyum kanal blokörleri olarak adlandırılan ilaçlar yaklaşık olarak 1960’lı yıllardan beri kullanılmaktadır. Başta hipertansiyon olmak üzere anjina pektoris, atrial fibrilasyon, atrial ritm bozukluğu, supraventriküler taşikardi, subaraknoid hemorajilerin kısa süreli tedavisinde ayrıca migren, raynaud fenomeni, özafagial spazm ve bipolar hastalıkta kullanılmaktadır (Abernethy ve Schwartz, 1999; Hedge, 2005; Kayaalp, 2005).
Kalsiyum kanal blokörlerinin başlıca farmakolojik etkisi, uyarılabilir membranlarda kalsiyum kanalları aracılığıyla kalsiyumun hücre içine akışının bloke edilmesidir. Đstirahat durumundaki düz kasta hücre dışı kalsiyum konsantrasyonu hücre
içi kalsiyum konsantrasyonundan yaklaşık 10,000 kat daha fazladır ve plazma membranında kalsiyum geçirgenliğindeki küçük bir değişiklik hücre fonksiyonunda önemli değişikliklere sebep olabilir. Kalsiyum iyonunun hücre içi ikincil mesajcı gibi işlev gördüğü söylenebilir. Hücre fonksiyonlarının düzenleyicisi olarak hareket eden kalsiyumun hücre içinde artışını engelleyen kalsiyum kanal blokörlerinin hormonların salınması, kas kasılmaları, trombosit fonksiyonu ve nörotransmitter salınması gibi çeşitli fizyolojik süreçleri etkilediği gösterilmiştir (Berridge, 1993).
Kalsiyum kanal blokörleri yaygın olarak sitokrom P-450 (CYP-450) sistemi, özellikle de CYP3A4 izoenzim tarafından metabolize edilir (Pichard ve ark., 1990; Kroemer ve ark., 1993; Guengerich, 1999). Potansiyel olarak birçok ilaç etkileşmesi oluşabilir. Bu nedenle kalsiyum kanal blokörlerinin klerensi azalabilir, tedavi etkinliği değişebilir ve doz aşımı oluşabilir. Bu ilaç-ilaç etkileşimleri potansiyel olarak toksisiteye ve terapötik dozun değişmesine sebep olabilir. Kalsiyum kanal blokörleri büyük oranda ilk geçiş etkisine uğrar. Bu da potansiyel doz aşımına, ilacın dokudaki etki derecesinin artmasına ve sistemik toksisitenin uzamasına neden olur (Luomanmaki ve ark., 1997). Kalsiyum kanal blokörlerinin birçoğu büyük dağılım hacmine (Vd) sahip olsa da, nifedipinin dağılım hacmi istisnai olarak daha düşüktür (Vd=0.8-1.2 L/kg). Kalsiyum kanal blokörlerinin kontrollü salım yapan birçok preparatı günümüzde mevcuttur. Bu preparatların belirli besinlerle dramatik etkilere sebep olduğu düşünülmektedir. Miligram dozda alımında bile özellikle de pediatrik popülasyonda oldukça büyük şiddetli toksisite ihtimali artmaktadır (Belson ve ark., 2000). Sürekli salım yapan preparatlar gecikmiş absorbsiyon ve gecikmiş toksisite başlamasına neden olabilir. Hastalar sürekli etkili bir preparat aldıklarında toksisite işaretlerinin de gecikmiş olarak ortaya çıkması gözlemlenebilir. Doz aşımı veya doz artışı ile karşı karşıya kalındığında ortaya çıkan toksik etkiler, genellikle klinik etkilerin şiddetlenmiş halidir ve en sık rastlanılan klinik toksik bulgu hipotansiyondur. Özellikle daha fazla kardiyotoksik etkiye meyilli olan verapamil ve diltiazem alımında bradikardi de ayrıca sık rastlanılan bir etkidir (Henrikson ve Chandra-Strobos, 2003).
Bu ilaçların terapötik endikasyonlarının çokluğu nedeniyle daha fazla hasta bu ilaçları günlük temelde kullanmakta ve buna bağlı olarak, kazara ve kasten aşırı doz riski artmaktadır. Hastalar akut doz aşımları, kendi kendine ilaçla tedavi girişimleri sonucunda oluşan kazara doz aşımları, ilaç toksisitesi ve ilaç-ilaç etkileşmeleri ile oluşan toksisite sonucunda hastaneye başvurmaktadırlar. 2003 yılında kalsiyum kanal blokörlerine maruziyet nedeniyle 9,650 vaka rapor edilmiştir. Bu maruziyetlerden 3,554
vakada etki gözlenmemiş, 900 vakada minimal etkiler, 1,142 vakada orta dereceli etkiler, 339 vakada başlıca büyük etkiler rapor edilmiş ve 57 vaka ölümle sonuçlanmıştır. Kalsiyum kanal blokörlerine maruziyetlerin %5.2’si öldürücü olmuştur (Watson ve ark., 2004).
Günümüzde piyasada bulunan bütün kalsiyum kanal blokörleri hücre membranındaki L-tipi voltaja bağımlı kalsiyum kanalları üzerinde bulunan özel bağlanma yerlerine yüksek afiniteli olarak bağlanır ve bu kanalları bloke ederler. Böylece hücre içine kalsiyum girişini azaltarak etki gösterirler. Bu etkileri damar düz kası ve kalp hücreleri düzeyinde oluşturmaktadır. Kalsiyum girişini azaltarak damarları gevşetirler, kalp kasını ve diğer kalp hücrelerini deprese ederler (Hedge, 2005). Kısacası kalsiyum kanal blokörleri voltaja bağlı yavaş kalsiyum kanalları boyunca damar düz kas hücreleri ve kardiyak hücrelerin sitoplazmaları içine hücre dışından kalsiyum girişini bloke ederek etki gösterirler (Luft ve Haller, 1993). Nifedipin ve benzeri dihidropiridin türevlerinin kalsiyum kanalının açılma ve kapanma kinetiğini bozmadıkları, sadece açık kanal sayısını azaltarak etki yaptıkları saptanmıştır; ayrıca refrakter periyodu uzatma etkileri de yoktur. Verapamil ve metoksiverapamil, kalsiyum kanalının kinetiğini bozarak etki yapar, kanalın aktivasyonunu ortadan kaldırır ve refrakter zamanını uzatırlar. Bu şekilde verapamil ve benzerleri kanalın aktif şeklini daha güçlü bir şekilde bloke ederler (Hart ve ark., 1992). Arteriyollerde damar tonusu ve periferik damar rezistansını azaltarak vazodilatasyona yol açarlar ve antihipertansif etki gösterirler. Hipertansiyon tedavisinde kalsiyum kanal blokörlerinin antihipertansif etkinliği diğer antihipertansif ilaçlar ile artar (Messerli, 1994). Kalsiyum kanal blokörlerinin tümü periferik, koroner ve pulmoner arterlerde vazodilitasyona yol açarlar, venler üzerine etkileri yok denecek kadar azdır (Brunton ve ark., 2003).
L-tipi kalsiyum kanal blokörleri memeli hücrelerinin birçok normal fonksiyonunu değiştirir. Birçok kalsiyum kanal blokörü (hem in vitro hem de hayvanlarda) anjiyotensin-II, fenilefrin ve endotelin-1’in damar düz kası üzerindeki vazokonstriktif etkisini engeller. Bazı L-tipi kalsiyum kanalları plazma membranındaki kalmodulin, proteinkinaz (A, C ve/veya tirozinkinaz) ve birkaç nükleotid bağlayıcı protein tarafından modüle edilir. Antihipertansif kalsiyum antagonistleri aynı zamanda, hem kültürde hem de hayvanlarda vasküler düz kas hücrelerinin hem proliferasyonunu hem de büyümesini inhibe eder (Eliott ve Black, 2001). Dihidropiridin türevi blokörler ile fenilalkilamin ve benzodiazepin türevleri arasında, farmakolojik etki profili bakımından fark vardır. Bu farklılık damar düz kaslarındaki ve kalp kasındaki etki
güçleri arasındaki farka dayanır. Dihidropiridin türevleri vazoselektiftirler; damarları gevşeten doz ve konsantrasyonlarda kalp kası ve diğer kalp hücreleri üzerinde genellikle belirgin depresan etki yapmazlar. Fenilalkilamin ve benzodiazepin türevleri vazodilatör etki yapan doz düzeylerinde kalpte miyokard hücreleri ve özellikle nodal hücreler üzerinde belirgin depresyon yaparlar (Kayaalp, 2002). Diğer kalsiyum antagonistleri dihidropiridin türevleri ile karşılaştırıldığında atrioventriküler ileti ve sol ventrikül fonksiyonları üzerine etkisi en belirgin olan verapamildir. Diltiazemin bu etkileri verapamile göre daha azdır. Kalsiyum kanal blokörlerinin damar genişletici etkisi arteriyollerde belirgindir; venüller üzerindeki gevşetici etkisi önemsiz derecededir. Hipertansiyon ne kadar ağırsa bu ilaçların vazodilatör etkileri o kadar fazla belirgin olur. Arteriyel kan basıncını düşürmelerine karşın böbrek ve serebral kan akımında ve glomerülar filtrasyon hızında azalma yapmazlar. Glomerülar filtrasyon hızında yaptıkları belirgin artmanın afferent arteriyolü efferent arteriyole göre daha fazla genişletmelerine bağlı olması olasıdır. Vazodilatör etkilerinden kısmen damar endotelinden nitrik oksit salıvermeleri rol oynayabilir. Nifedipin ve diğer bazı dihidropiridin türevleri zayıf natriüretik ve diüretik etki gösterirler. Bu özellikleri nedeni ile uzunca bir süre tek başına kullanıldıklarında, su ve tuz retansiyonu ve buna bağlı kilo artması pek yapmazlar (Eliott ve Black, 2001).
Kalsiyum kanal blokörü ilaçlar, hafif ve orta derecedeki esansiyel hipertansiyonun tedavisinde tek ilaç olarak kullanılabilirler. Düşük reninli, plazma kalsiyum düzeyi düşük ve tuza duyarlı esansiyel hipertansiyonlularda, diğerlerine göre daha fazla etkili olabilirler. Kalp ile ilgili durumu olmayan komplikasyonsuz olgularda vazoselektif olmaları nedeniyle dihidropiridin türevi ilaçlar, diğer iki gruptakilere tercih edilir. Angina veya belirli taşaritmileri olan hipertansiyonlularda verapamil ve diltiazem tercih edilebilir. Nifedipin ve diğer dihidropiridin türevleri ağır hipertansiyon tedavisinde de yararlıdırlar. Vazoselektif ilaçlar pulmoner arter basıncını düşürürler. Bu nedenle primer pulmoner hipertansiyonun tedavisi için kullanılırlar (Eliott ve Black, 2001). Kalp bloğunda verapamil ve diltiazemin kullanımı kontrendikedir. Kalsiyum kanal blokörlerini kullanan hastaların %10’unda yan etkileri görülür. En fazla görülen yan etkileri baş ağrısı, yüzde kızarma ve lokal ayak bileği ödemidir. Bu yan etkiler ilaçların yaptığı vazodilatasyona bağlıdır. Kısa sürede antihipertansif etki gösteren, özellikle de sıvı nifedipin, vital organlara kan akımını azaltabilir ve vital organlarda iskemiyi indükleyebilir (Abuhandan, 2000).
2.3. Nifedipin
Nifedipin, dihidropiridin türevi ilaçların klinik kullanıma ilk gireni ve en fazla denenmiş olanıdır. Bu grup ilaçların prototipi olarak kabul edilmektedir (Eliott ve Black, 2001). Nifedipin, kalsiyumun L-tipi veya diğer adıyla “yavaş kalsiyum kanallarından” geçişini inhibe eder (Miller ve ark., 1982). Vasküler düz kas ve kardiyak hücrelerdeki kalsiyum kanallarını inhibe ederek uyarılabilir membranlarda kalsiyum akışını önleyerek etki gösterir. Periferal arteriyollerde vazodilatasyon sağlar ve kan basıncının düşmesine sebep olur (Kayaalp, 2005). Kan basıncını düşüren kısa etkili bir ilaçtır. Bu özelliği nedeni ile yinelenen dozlarda verildiğinde kan basıncında belirgin dalgalanmalar ve buna bağlı refleks kalp stimülasyonu yapar. Bu nedenle nifedipin ve kısa etki süreli birinci kuşak kalsiyum kanal blokörlerinin hemen salan şekilleri hipertansiyon tedavisinde tercih edilmez (Eliott ve Black, 2001). Vasospastik anjina ve kronik stabil anjina tedavisinde kullanılır (Kayaalp, 2005). Nifedipinin kalsiyum blokajının iki önemli karakteristiği, reversibl olması ve ilaç bırakılınca sona ermesidir (Miller ve ark., 1982).
Nifedipin, oral verilişten sonra mide-bağırsak kanalından çabuk ve tama yakın bir derecede absorbe edilir. Sublingual verilişten sonra daha hızlı absorbe edildiği ileri sürülmüşse de ağız boşluğundan hızlı absorbe edilmediği saptanmıştır (Eliott ve Black, 2001). Đlk geçiş eliminasyonu diğer kalsiyum kanal blokörlerine göre daha düşüktür ve oral biyoyararlanımı yaklaşık %65’tir. Modifiye salım yapan preparatlarda bu %90’lara kadar çıkabilmektedir. Hemen salım yapan şekillerinde eliminasyon yarı ömrü 2 saatken uzatılmış etkililerde 7 saate kadar çıkabilir ama genelde ortalama 5 saattir. Plazma proteinlerine bağlanma oranı %92-98’dir (Kayaalp, 2005). Esas olarak, karaciğerde polar metabolitlere dönüştürülmek suretiyle inaktive edilir (Eliott ve Black, 2001). Karaciğer mikrozomlarındaki CYP3A4 tarafından metabolize edilir (Sutton ve ark., 1997) ve %60-80’i inaktif metaboliti olarak atılır (Kayaalp, 2005). Atılımı böbrek ve bağırsak yoluyla olur (Miller ve ark., 1982).
Nifedipinin sık görülen yan etkileri, baş ağrısı, yüzde ve bacaklarda cilt damarlarının vazodilatasyonuna bağlı olarak duyumsama ile ayak bileği ödemidir. Ayrıca hafif hiperkalemi yapabilir. Daha seyrek olarak baş dönmesi, ağız kuruluğu, bacak krampı, bulantı yapabilir (Eliott ve Black, 2001).
Nifedipinle yapılan bir çalışmada farelere tek doz nifedipin oral olarak uygulanmış ve üç farklı zamanda ilacın farklı dokulardaki dağılımı ve üriner
sekresyonunun farmokinetik değişiklikleri incelenmiştir. Araştırmanın sonucunda, farelere verilen ilacın üç dozaj zamanlarında dokulardaki dağılımına bakılmış ve ilaç konsantrasyonu çoğunluğunun diğer dokulara kıyasla ince bağırsak, kalın bağırsak ve mide gibi organların yer aldığı gastrointestinal sistemde olduğu tespit edilmiştir (Qing-Ri ve ark., 2005).
Harcouet ve ark. (1997), çalışmalarında nifedipini siklosporin grubundan antibiyotik olan sefiksim ile aynı anda ratlara vermişler ve nifedipinin sefiksim emilimine olan etkisini araştırmışlardır. Sonuçlarında nifedipinin bu antibiyotiğin bağırsaktaki emilimini arttırdığını tespit etmişlerdir.
Uğurlu ve ark. (2003), farelerde kolonik anastomoz tedavisinde nifedipinin etkisini incelemişler ve kontrol gruplarına göre deney gruplarında anastomoz basınç değerlerini ve hidroksiprolin içeriğini önemli düzeyde yüksek bulmuşlardır. Araştırmacılar sonuçlarında, nifedipinin ilk postoperatif haftası sonrasında kolon anastomoz sabitliğini arttırdığını tespit etmişlerdir.
Başka bir çalışmada, kalp ve karaciğer mikrozomlarındaki oksijen tüketiminin nifedipin konsantrasyonuna bağlı olarak azaldığını gözlemişlerdir. Nifedipinin mikrozomal elektron transport sistemini bozabildiğini ayrıca kardiyak ve hepatik membranlarının sensitivitesini peroksidatif hasar yaratacak kadar değiştirebildiğini tespit etmişlerdir (Ferzaan ve Rajagopalan, 1989).
Dhar ve Farzan (1994) alloxanla yaptıkları çalışmalarında bir grup ratlara da üç hafta boyunca 0.5 mg\kg nifedipin vermişler ve nifedipinin karaciğer, kalp, böbrek ve pankreas dokuları üzerine etkilerini incelemişlerdir. Çalışmalarının sonucunda karaciğer, böbrek, kalp ve pankreas dokularında nifedipinin ışık mikroskobik seviyede
bir etkisinin olmadığını gözlemlemişlerdir. Nifedipinle yapılan diğer bir çalışmada ise nifedipine bağlı dişeti büyümesi
oluşturulan ratların periodontal dokularında apoptozis in situ olarak araştırılmıştır. Çalışmada ilk yedi gün boyunca 125 mg\kg nifedipin, kalan üç hafta boyunca da her gün 250 mg\kg nifedipini ratlara diyetle birlikte verilmiştir. Nifedipin verilen ratların bağ dokusu yüksekliği ve genişliği ile epitel dokusunda artış olduğu gözlenmiş; ancak apoptotik hücre oranlarında bir fark tespit edilmemiştir (Mangıroğlu, 2011).
2.4. Đnce Bağırsak
Đnce bağırsak, karın boşluğuna yerleşmiş olan sindirim borusunun mide ve kalın bağırsak arasında kalan kıvrıntılı boru şeklindeki parçadır (Murathanoğlu, 1996). Đnce bağırsak, yaklaşık 6-8 m uzunluğunda olup, sindirim borusunun en uzun parçasıdır. Proksimalde duodenum, ortada jejunum ve distalde ileum olmak üzere üç farklı histolojik bölüme sahiptir. Đnce bağırsak, sindirimin yapıldığı ve endokrin salgının oluşturulduğu son bölümdür (Erdoğan ve ark., 1996; Junqueria ve ark., 1998; Gartner ve Hiatt, 2001). Đnce bağırsakta mideden gelen kimus halindeki besin materyali, bağırsak bezlerinin enzimleri ve safra enzimleri, safrayla karışıp yapı taşlarına ayrılarak ince bağırsakta emilir. Đnce bağırsağın esas fonksiyonu olan bu emilim olayında üç yapı işlev görür (Murathanoğlu, 1996). Bunlar; dairesel katlantılar (Kerkring valfleri/valvulae conniventes, plika sirkularis), bağırsak villusları ve mikrovilluslardır. Dairesel katlantılar yüzeyi üç, villuslar on, mikrovilluslar yirmi kat büyütür. Tümü birden yüzeyi altı yüz kat arttırarak 200 m² lik alan oluştururlar (Erdoğan ve ark., 1996; Junqueria ve ark., 1998; Gartner ve Hiatt, 2001).
Dairesel katlantılar (Kerkring valfleri): Çıplak gözle görülebilen, tunika mukoza ve submukozanın birlikte yaptığı sirküler, spiral ya da yarım ay şeklindeki katlanmalardır. Duodenumun ilk 5 cm’lik bölümü dışında çok sayıda uzun katlantılar gözlenir (Junqueria ve ark., 1998; Gartner ve Hiatt, 2001; Gökmen, 2003). Jejunumun proksimal bölümünde de çok sayıda olup büyüktürler. Buradan itibaren ileumun ortasına kadar olan bölümde katlantıların sayıları azalarak küçülür ve distal bölümüne doğruda kaybolurlar (Arıncı ve Elhan, 2006).
Villuslar: Dairesel katlantılar mikroskobik olarak incelendiğinde mukoza yüzeyinde 0.5-1.5 mm uzunluğunda bağırsak villusları görülür. 1 mm² de 10-40 adet villus bulunur. Damardan zengin küçük parmak şeklinde çıkıntılar olan villuslar, ince bağırsağın tüm yüzeyinde bulunur ve bağırsağın iç yüzeyine kadife görünümü verirler. Duodenum ve jejunumda çok sayıda geniş ve yassı, ileumda ise sayıları az ve silindir şekillidirler (Erdoğan ve ark., 1996; Gartner ve Hiatt, 2001; Arıncı ve Elhan, 2006).
Mikrovilluslar: Bağırsak villuslarının üzerini örten epitel hücrelerinin apikal yüzündeki yüzey farklılaşmasıdır. Bir miktar sitoplazma ile birlikte hücre zarının lümene doğru yaptığı parmaksı çıkıntılardır. Mikrovilluslar, hücre yüzeyine dik ve birbirlerine koşut yerleşmiş olup eşit boydadırlar. Bu nedenle çizgili kenar olarak isimlendirilirler. Bağırsak örtü epitelinde 1 mm² de yaklaşık 3,000-4,000 adet
mikrovillus bulunur (Erdoğan ve ark., 1996; Gartner ve Hiatt, 2001; Ross ve ark., 2003; Akay, 2004).
Bağırsaklar, histolojik olarak içten dışa tunika mukoza, tunika submukoza, tunika muskularis ve tunika seroza olmak üzere dört katmandan oluşur (Ross ve ark., 1995).
Tunika mukoza; lamina epitelyalis, lamina propriya ve lamina muskularis mukoza katmanlarını içerir (Erdoğan ve ark., 1996). Villus yüzeyini döşeyen tek katlı prizmatik epitel hücreleri çok sayıda mikrovillus ve epitel tabakasında iki tip hücre bulundurur. Bunlar silindirik mikrovilluslu epitel hücresi ve goblet hücreleridir (Ross ve ark., 1995).
Đnce bağırsak epiteli altında bulunan lamina propriya gevşek bağ dokusu özelliğindedir (Ross ve ark., 1995). Lamina propriya epitelden belirgin bir bazal laminayla ayrılmıştır. Burada ayrıca lenfatik ağa yönelen kör sonlu lenf damarları (lakteal) bulunur. Đleum lamina propriyasında, diğer bölümlerden farklı olarak Peyer plakları görülür (Erdoğan ve ark., 1996; Eroschenko, 2001; Gartner ve Hiatt, 2001). Đnce bağırsak bezleri (Lieberkühn kriptaları), lamina propriyaya yerleşmişlerdir ve muskularis mukozaya kadar uzanan basit tübüler özellikteki bezlerdir. Salgılarını küçük bir delikle villuslar arasına boşaltırlar (Ross ve ark., 1995). Bu bezlerin çevresi gevşek bağ dokusuyla kuşatılmıştır. Bağırsak bezlerinde, emilim yapan prizmatik hücreler (absorbtif hücreler), indiferansiye hücreler (kök hücreler), goblet hücreleri, M (mikrofold) hücreleri, paneth ve enteroendokrin hücreleri olmak üzere altı tip hücre bulunur. Bezin üst yarısında emilim yapan hücreler ile goblet hücreleri yer alırken, bezin alt yarısında emilim yapan hücreler ile birkaç tane goblet hücresi, kök hücreler ve enteroendokrin hücreler gözlenir (Gartner ve Hiatt, 2001).
Emilim yapan hücreler: Epiteldeki hücrelerin çoğunluğunu oluşturan prizmatik şekilli bazalde yerleşik oval çekirdekli hücrelerdir (Erdoğan ve ark., 1996). Hücrelerin apikal yüzeyinde çok sayıda mikrovillus bulunur (Murathanoğlu, 1996). Bu hücrelerin esas işlevleri son sindirim ürünlerinin ve suyun emilimidir. Ayrıca yüzeyi korurlar ve yağ asitlerini trigliserit ve şilomikronlara çevirirler (Erdoğan ve ark., 1996; Gartner ve Hiatt, 2001).
Đndiferansiye hücreler: Yüksek mitotik aktiviteye sahip olan vücudun en hızlı çoğalan hücrelerindendir (Ross ve ark., 1995). Bir bakıma embriyonik özellik taşıyan (Murathanoğlu, 1996) gerektiğinde goblet, paneth ve epitel hücrelerine farklılaşarak onların yenilenmesini sağlayan hücrelerdir. Yeni oluşan bu hücrelerin villusun tepesine
kadar ilerleme süresi yaklaşık 5-7 gün kadardır (Gartner ve Hiatt, 2001; Ross ve ark., 2003). Bu hücreler hızlı yenilendiğinden antimitotik ilaçlardan oldukça fazla etkilenir (Ross ve ark,. 1995).
Paneth hücreleri: Lieberkühn bezinin bazalinde yerleşmiş piramidal seröz hücrelerdir. Bu hücrelerin apikal sitoplazmasında yer alan salgı granüllerinde bakteri hücre duvarının parçalanmasında fonksiyonel bir enzim olan lizozim bulunur. Granül içeriği ekzositozla hücre dışına verilir. Bu yolla da ince bağırsak florası düzenlenmiş olur. Paneth hücrelerinde, sindirimde fonksiyonel herhangi bir enzim üretimi yapılmaz (Ross ve ark., 1995; Murathanoğlu, 1996).
Enteroendokrin hücreler: Tüm gastrointestinal kanala yayılmış, diffus nöroendokrin sistem özelliklerini taşıyan bir kısım hücrelerdir. Đnce bağırsaklarda özellikle kriptaların alt bölümünde bulunurlar. Salgılarını bez hücrelerine değil kan damarlarına verirler. Sindirim sistemi fizyolojisinin düzenlenmesinde önemli rol oynarlar (Ross ve ark., 1995).
M (mikrofold) hücreleri: Peyer plaklarının ve diğer büyük lenfatik nodüllerinin üzerini örten (Ross ve ark., 1995), bağırsak lümeninden lamina propriyaya antijen taşıyan ve fagositoz yapan özelleşmiş epitel hücreleridir. Yassı şekillidirler. Üst ve alt yüzeylerinde çok sayıda invaginasyonlar görülür. Alt yüz invaginasyonları içinde çok sayıda B lenfositleri bulunur (Erdoğan ve ark., 1996; Junqueria ve ark., 1998; Gartner ve Hiatt, 2001). Apikal kısımlarında ise mikrovillus yerine mikrokıvrımlar (mikrofold) vardır. Lümen içindeki makromoleküllerini endositozla alıp altındaki lenfoid hücrelere tanıtır. Böylece bağırsak içindeki antijenlere karşı immun yanıtın oluşmasına katkıda bulunur (Ross ve ark., 1995).
Goblet hücreleri (Kadeh hücreleri): Emilim yapan prizmatik hücreler arasında serpilmiş olarak bulunan goblet hücreleri, tek hücreli endoepitelyal bezlerdir (Erdoğan ve ark., 1996). Tek tek yerleşen bu epitelyal hücreler, mide ve safra kesesinde mukus hücreleri, kalın ve ince bağırsakta ise goblet hücreleri olarak adlandırılır. Yüksek derecede polarize olan bu prizmatik hücreler, ince ve kalın bağırsakta temel olarak mukus üreten hücrelerdir. Goblet hücrelerin sayısı, duodenumdan ileuma ve kolona doğru giderek artar. Bu hücreler teka olarak adlandırılan, intraselüler kompartmanlarında membrana bağlı musin granüllerini biriktirebilme özelliğine sahiptirler (Blaser ve ark., 2002). Hücrenin bazal kısmı dardır ve yassılaşmış çekirdek burada yer alır. Granüllü endoplazmik retikulum tübülüsleri, serbest ribozomlar ve golgi kompleksi iyi gelişmiş olup, kuvvetli bazofilik boyanan bazal sitoplazmada yerleşmiştir.
Hücrenin apikal yüzünde az sayıda düzensiz mikrovilluslar görülür ve bu apikal yüzeyin 2/3’lük kısmı, açık boyanan salgı granülleriyle dolu olması nedeniyle genişlemiştir. Goblet hücreleri, epitel yüzeyinde kaygan ve koruyucu bir etkiye sahip olan mukusu salgılar (Erdoğan ve ark., 1996). Apikal sitoplazmaları golgi kompleksinden sentezlenen musin granülleri ile doludur. Musin granülleri, ince bir zarla çevrelenmiştir ve granül zarının hücre zarıyla kaynaşması ile içerik lümene verilir. Musin ekzositozla hücre dışına salındığında lümendeki su ile hidrate olarak mukusu oluşturur. Goblet hücrelerinin villusun tepesine doğru göçü esnasında, musinin kimyasal kompozisyonunda bir takım değişiklikler meydana gelir. Musinin sialik asit içeriği artar (Akiba va ark., 2000). Bu hücrelerin yaşamları oldukça kısadır ve musin salgıladıktan sonra öldükleri düşünülür (Gartner ve Hiatt, 2001; Kierszenbaum, 2006; Sinanoğlu, 2007).
Tunika mukozanın en dış katmanı ise lamina muskularis mukozadır. Đçte enlemesine dışta uzunlamasına düzenlenmiş düz kas hücrelerinden ve elastik liflerden oluşur. Đç tabakadaki kas hücrelerinin bir hücre sırası villus içinden epitelin bazal laminasına kadar uzanır. Sindirim sırasında kaslar kasılır. Bu kasılma villus boyunun kısalıp uzamasını sağlayarak besinin emilimine yardımcı olur (Erdoğan ve ark., 1996; Gartner ve Hiatt, 2001).
Tunika Submukoza: Elastik liflerden zengin düzensiz sıkı bağ dokusudur. Đçinde büyük kan ve lenf damarları ile sinirler yer yer de yağ doku kümeleri bulunur. Epitel tabakasının yakınında ve düz kas tabakası içinde bulunan sinir sonlanmalarından, bağırsak içeriğinin bileşimine ve bağırsak duvarının genişleme derecesiyle ilgili uyarıları alan nöron gruplarından oluşan submukozal pleksusu (Meissner) içerir. Duodenuma özgü olarak bu katmanda özel bezler (Brunner bezleri) bulunur (Erdoğan ve ark., 1996; Junqueria ve ark., 1998; Eroschenko, 2001; Gartner ve Hiatt, 2001).
Tunika Muskularis: Bu tabaka içte enlemesine dışta uzunlamasına yerleşim gösteren düz kas hücrelerinden oluşmuştur. Đki kas katı arasındaki gevşek bağ dokuda myenterik sinir pleksusu, kan ve lenf damarları bulunur. Đç dairesel kas katmanının kasılması mideden gelen besinlerin sindirim enzimleriyle karışmasını ve mukoza ile ilişkisini sağlar. Dıştaki uzunlamasına kas katmanının kasılması ise bağırsak içeriğinin lümende ilerlemesine yardımcı olur (Erdoğan ve ark., 1996; Junqueria ve ark., 1998; Gartner ve Hiatt, 2001).
Tunika Seroza: Đnce bir gevşek bağ dokusu tabakasıdır. Kan ve lenf damarları ile yağ dokusundan zengindir. Tek katlı yassı epitel (mezotelyum) ile örtülüdür. Karın
boşluğunda seroza mezenterler ve periton ile devamlılık gösterir. Sindirim organının diğer organ ya da yapılara bağlandığı bölümlerde serozanın yerini kalın bir adventisya alır. Adventisya, içinde damar ve sinirlerin yer aldığı bağ dokusundan meydana gelir, ancak mezotelyumu bulunmaz (Junqueria ve ark., 1998).
2.4.1. Duodenum
Đnce bağırsağın birinci bölümü olan duodenum, ince bağırsağın en kısa, en geniş çaplı ve en az hareketli olan bölümüdür (Gartner ve Hiatt, 2001; Arıncı ve Elhan, 2006). Ayrıca villusları da geniş ve kısadır. Tunika submukoza tabakasında Brunner bezlerini içermesi duodenumun diğer bölümlerden ayırt edilmesini sağlar. (Kierszenbaum, 2006). Brunner bezleri, parasempatik etki yapan ve midede salgılanan asitin etkisinden duodenumu koruyan alkali özellikte mukus salgılar. Aynı zamanda pankreas enziminin etkisi için pH’sini normal düzeye indirgeyici etki de yaparlar. Brunner bezlerinden salgılanan alkali salgılar, sindirim enzimlerinin sürekli işlevi için uygun ortamı sağlar ve bir polipeptid hormonu olan ürogastronu salgılar. Bu hormon midedeki parietal hücrelerce salgılanan hidroklorik asiti baskılar ve epitel hücrelerinde mitotik etkiyi arttırır (Erdoğan ve ark., 1996; Junqueria ve ark., 1998; Eroschenko, 2001; Gartner ve Hiatt, 2001).
2.4.2. Jejunum
Đnce bağırsağın duodenumdan sonra gelen bölümüdür (Gartner ve Hiatt, 2001). Villusları uzun ve parmaksı biçimdedir. Villusların en iç kısmında iyi gelişmiş bir merkezi lakteal içerirler. Jejunum, submukoza tabakasında bez içermez (Kierszenbaum, 2006).
2.4.3. Đleum
Đnce bağırsağın jejunumu izleyen distal bölümüdür (Gartner ve Hiatt, 2001). Peyer plaklarının (lenfatik nodüller) bulunması ileumun tanınmasına yönelik belirgin bir özelliğidir. Villusları, jejunumdakilere göre daha kısadır (Kierszenbaum, 2006). Đleumun belirleyici bir özelliği olan Peyer plakları, mukozada ve kısmen submukozada yer alan lenf folikülleridir. Mide bağırsak sistemi ile ilişkili lenfoid dokunun
(gut-associated lymphoid tissue-GAL) temelini bunlar oluşturur. Bir Peyer plağı, korona ve germinal merkez olarak iki esas bölüm içerir. Peyer plakları folikül ile ilişkili M hücreleri ve enterositlerden oluşmuş bir epitelle örtülüdür. Korona kısmı IgD dışında tüm immunoglobulin izotiplerini sentezleyen B lenfositlerini kapsar. Germinal merkez, IgA pozitif B lenfositleri, CD4 pozitif T lenfositleri ve antijen sunucu hücreleri içerir. Foliküller, lamina propriyanın yaygın lenfatik dokusundan gelişir ve foliküllerin mukoza yüzeyine ulaştığı bağırsak lümeni bölgesinde villuslar bulunmaz (Ross ve ark., 2003; Kierszenbaum, 2006).
2.4.4. Kalsiyum kanal blokörlerinin bağırsak üzerine etkileri ile ilgili çalışmalar Hem kemirgen hem de insan bağırsak epitel hücreleri (enterositler) geniş alanda ilaçları ve ksenobiyotikleri metabolize etme yeteneği olan enzimler içerdiğinden, yakın zamanda yapılan çok sayıda klinik çalışma ve klinik öncesi çalışma, ilk geçiş metabolizmasında bağırsakların önemini göstermiştir. Đlaçların veya kimyasalların oral biyoyararlanımı, bağırsak emilimi ve onunla ilişkili ilk geçiş metabolizmasıyla alakalıdır (Poet ve ark., 2003). Nifedipinin farelerdeki preoral biyoyararlanımının yaklaşık olarak %45-58 arasında olduğu bilinmektedir ve ilacın sistemik olarak tek sorumlusunun da karaciğer olduğu düşünülmekteydi. Bunun üzerine Grundy ve ark. (1997) çalışmalarında, farelerde nifedipinin ilk geçişteki eliminasyonunda bağırsak metabolizmasının da katkıda bulunup bulunmadığını incelemişlerdir. Bu araştırmacılar sonuçlarında sistemde bulunan nifedipinin temizlenmesinde karaciğerin etkisinin oldukça az olduğunu gözlemlemişler ve hepatik ekstrasyona ek olarak nifedipinin ilk geçiş eliminasyonun ince bağırsak duvarında meydana geldiğini tespit etmişlerdir. Bağırsak epitel hücreleri, çoğu ilacın emilimini engelleyen detoksifikasyon mekanizmalarına sahiptir ve burada P-4503A’nın (CYP3A) önemli rol oynadığı bilinmektedir (Hiroshi ve Yuichi, 2000). Son yapılan çalışmalarda ince bağırsaklardaki enterositler de CYP metabolik kapasitesine sahiptir ve bazı enzimler (3A4 gibi) söz konusu olduğunda enterositler içindeki derişim karaciğer ile kıyaslanabilir düzeydedir. Her ne kadar insan bağırsağındaki ve karaciğerindeki enzim profili farklı olsa da, hem karaciğerde hem de ince bağırsaklardaki yaygın olan enzim CYP3A4’tür (Poet ve ark., 2003).
Takahiro ve ark. (2002), çalışmalarında nifedipinin ince bağırsak mukozasından geçiş esnasında önemli derecede esktraksiyona maruz kaldığını göstermişlerdir. Bu olaydan da CYP3A2’nin sorumlu olduğu sonucuna varmışlardır.
Bağırsak ve nifedipinle ilgili yapılan başka bir çalışmada Sun ve ark. (1997), kalsiyum kanal blokörlerinin siklosporinin neden olduğu renal fonksiyon ve renal kan akışında görülen artışa karşı koruyucu etkisinin ince bağırsakta da benzer şekilde olup olmadığını araştırmışlardır. Ratlara, nifedipini siklosporin ile birlikte verdiklerinde bağırsak mukoza katmanındaki vasküler direnç, kan akışı değerleri ve absorptif fonksiyon ile beraber bağırsak dokusunda farklı olarak önemli bir değişiklik olmadığını gözlemlemişlerdir. Araştırmacılar sonuçlarında nifedipinin fare bağırsağında siklosporin nedenli zararlara karşı korumada etkili olduğunu tespit etmişlerdir.
Yapılan başka bir çalışmada Bassotti ve ark. (1998), nifedipin ve verapamilin yemek yemeye olan sigmoid myoelectric tepki üzerindeki etkilerini incelemişlerdir. Sonuçlarında kalsiyum kanal blokörlerinden olan nifedipinin, kolonik aktiviteyi inhibe ederek kabızlığa neden olabileceğini ileri sürmüşlerdir. Ayrıca verapamilin daha az sebep olmakla birlikte kolonik transiti azaltarak ve su absorbsiyonunu arttırarak farklı bir mekanizma ile kabızlığa yol açabileceğini belirtmişlerdir.
Verapamilin yan etkisi olan kabızlık üzerine yapılan diğer bir çalışmada Krevsky ve ark. (1992), verapamilin kabızlık etkisinin üst gastrointestinal geçiş üzerindeki etkiden dolayı değil kolonik geçişin gecikmesinden dolayı olduğunu belirtmişlerdir.
2.5. Karaciğer
Karaciğer insanda yaklaşık 1500 g olup, vücuttaki en büyük bezdir (Gartner ve Hiatt, 1997). Karın boşluğunun sağ üst bölümünde, diyaframın altında, mide ve bağırsakların üstünde yerleşmiştir (Karaöz, 2003). Karaciğerin dolaşım sistemindeki bu konumu, metabolitlerin bir araya getirilmesi, dönüştürülmesi, biriktirilmesi ve toksik maddelerin nötralize ve elimine edilmesi için uygundur. Bu eliminasyon ise karaciğerin lipit sindirimi için önemli bir ekzokrin salgısı olan safrada gerçekleşir (Junqueria ve Carneiro, 2003). Karaciğer ürettiği bu safrayı safra kanalları yoluyla duodenuma boşalttığından ekzokrin, sentezlediği bazı maddeleri kana doğrudan doğruya verdiğinden endokrin bir bez niteliği taşımaktadır (Kalaycı, 1986). Karaciğer, sindirim kanalından emilen besinlerin işlendiği ve vücudun diğer kısımları tarafından
kullanılmak üzere depolandığı bir organdır. Bu yüzden sindirim sistemi ile kan arasında bir geçiş bölgesi oluşturur. Organa kanın %70-80’i portal venden gelir, geri kalan az bir bölümü de hepatik arterle sağlanır. Đnce bağırsaklardan emilen maddelerin çoğu portal ven yoluyla karaciğere gelir, sadece kompleks lipitler lenf yoluyla taşınır (Junqueria ve Carneiro, 2003).
Karaciğer üç temel alanda merkezi rol oynar: Karbonhidratların, proteinlerin ve yağların metabolizması, ilaç ve alkol gibi dışarıdan vücuda alınan bazı maddelerin işlemden geçirilmesi ve yağ sindirimi için çok önemli olan safranın yapımı ve salgılanmasıdır (William ve Patrick, 2009).
Karaciğerin temel fonksiyonel hücreleri, büyük poligonal şekilli olan hepatosit hücreleridir. Oldukça fazla sayıda metabolik fonksiyonları ile endokrin ve salgı fonksiyonlarını gerçekleştirirler (Ross ve ark., 1995). Karaciğer parankimasının %80’nini oluşturan hepatositler, bir ya da iki çekirdeğe sahiptir. Dikaryotik hepatositler, çekirdek hacmi ve DNA içeriğinin artmasıyla endomitozis sonucu meydana gelir ve hepatositlerin %25’ini oluşturur, geri kalanı ise tek çekirdeklidir (Junqueria ve Carneiro, 1992). Çekirdek boyutları değişmekle beraber (Gartner ve Hiatt, 1997) çekirdekler büyük, yuvarlak ve merkezi yerleşimlidir. (Ross ve ark., 1995). Erişkin karaciğerinde mitoz nadirdir. Ancak hasar sonrası onarım döneminde yüksek mitotik aktivite gözlenir. Hepatositlerin sitoplazmaları, fazla sayıda mitokondri ve düz endoplazmik retikulum içermeleri sebebiyle granüllü ve eozinofiliktir. Düz endoplazmik retikulumda; ilaçların detoksifikasyonu, kolesterol sentezi ve glikojenin glikoza dönüşümü meydana gelir. Granüllü endoplazmik retikulum ise bazofilik yapı gösterir. Burada kan fibrinojenleri, protrombin ve kan albuminleri sentezlenir. Her hücrede, yaklaşık elli kadar golgi kompleksi bulunmaktadır. Diğer bir sitoplazmik bileşen, karaciğerde biriken glikojendir. Ayrıca karaciğerde, kolesterol, yağ asitleri, trigliseritler, basit yağlar gibi çeşitli lipitler de depolanmaktadır (Junqueria ve ark., 1992).
Karaciğeri en dıştan saran seröz zara, visseral periton adı verilir. Tek katlı yassı bir epitel türü olan mezotelyum ve altındaki ince bir bağ dokusundan oluşur. Visseral peritonun hemen altında kollajen ve elastik lif içeren özel bir kapsül vardır. Bu kapsüle, Glisson kapsülü ya da kapsüla fibroza denir (Karaöz, 2002; Abraham, 2006). Hilumda Glisson kapsülü içeriye doğru girer ve porta hepatisten itibaren organ içine doğru dallanan ve karaciğere giren hepatik arterle portal venin damar yoluna ve safra kanallarına eşlik eden bağ dokusu şeklinde devam eder (Parker, 1993; William ve Partrick, 2009). Böylece karaciğer loblara ve lobüllere ayrılır (Parker, 1993; Karaöz,
2002). Dört lobdan oluşan karaciğeri lobüllere ayıran bağ dokusu miktarı insanlarda az olduğu için, lobüllerin birbirinden ayrımının yapılması zordur (Parker, 1993). Lobüllerin birbirleriyle birleştiği bölümlerde bağ dokusu artarak enine kesitlerde üçgen biçiminde seçilen alanlar oluşturur. Bu alanlara portal alan veya Kiernan aralığı denir (Parker, 1993; Karaöz, 2002). Đnsan karaciğer lobulünde 3-6 portal alan bulunur ve her bir portal alanda portal venin bir dalı olan venül, hepatik arterin dalı olan bir arteriyol, bir safra kanalı ve lenfatik damarlar bulunur (Junqueria ve Carneiro, 2003). Portal alanda yerleşim gösteren bu üç önemli yapıya, portal üçgen veya portal triyat adı verilir (Karaöz, 2002; William ve Patrick, 2009). Lobül içindeki bağ dokusunda yalnızca retiküler fibriller bulunur. Karaciğer hücreleri ile sinüzoid kan damarları arasında yer alan retiküler fibriller karaciğer parankimasını taşıyıcı görev yapmaktadır (Kalaycı, 1986).
Şekil 2.1. Karaciğer lobülünün yapılanması (Anonim-c)
2.5.1. Karaciğerin lobülleri
Klasik karaciğer lobülleri: Silindirik ya da prizmatik şekilli olan karaciğer lobülleri, en küçük yapısal ve işlevsel biçimleri oluştururlar. Bunlara klasik lobül denir (Yurdakul ve ark., 2005). Lobüllerin her köşesinde Glisson üçgeni, ortasında vena sentralis denen lobüle giren kanın toplandığı damar bulunur. Vena sentralis çevresinde ışınsal seyirli, birbirleriyle anastomozlaşarak dallanan karaciğer hücreleri bir epitelyal ağ oluştururlar. Bu nedenle karaciğer için retiküler bez terimi de kullanılmaktadır. Tek
bir hücre kalınlığındaki karaciğer hücre kordonlarına Remark kordonu ya da karaciğer hücre kordonu denir. Karaciğer hücre kordonları arasında bulunan sinüzoid tipi damarlar, safra yolları ve retiküler fibrillerde benzeri şekilde retiküler bir düzenleme gösterirler (Kalaycı, 1986).
Portal lobül: Đnterlobüler aralık veya vena portanın dallarını taşıyan periportal alan merkez olmak üzere, komşu lobulusların vena sentralislerini birleştiren köşeli ve çoğunlukla üçgen şekilli prizmalardan oluşur (Erbengi, 1990). Portal lobüllerde safra klasik lobülün aksine periferden merkeze doğru akar. Portal lobül ekzokrin bez yapısına daha uygundur. Üç klasik karaciğer lobüllerinin vena sentralislerinin birleşmesiyle portal triad meydana gelir (Henrikson ve Kaye, 1986).
Đki komşu klasik lobül içerisindeki aynı interlobüler venden kanlanan hücre grupları hepatik asinüs olarak adlandırılırlar. Karaciğer asinüsünde sınırlar karaciğer parankiminin portal venin uç dallarından ve hepatik arterden beslenmesiyle bağlantılı olarak belirlenmiştir (Abraham, 2006; William ve Patrick, 2009). Đki komşu klasik lobül içerisindeki dağıtıcı arteriyol ve venülden kanlanan hücre gruplarından oluşur. Komşu iki lobülün portal alanları ile santral venlerinin birleştirilmesiyle oluşan baklava dilimi şeklindeki bir modeldir (Karaöz, 2002).
Şekil 2.2. Karaciğer lobülünün histolojik sınıflandırılması (Anonim-a)
Hepatositler; arterden gelen kanın, venöz sinüzoidler boyunca akışı, oksijenlenmede ve beslenmede farklı içerik ve kanlanmaya göre periferik zon, santral zon ve ara zon olarak üç bölgeye ayrılırlar.
Periferik zonda (zon I), kan damarları lobülün periferinden merkezine doğru ilerlediğinden, glikojen, oksijen ve diğer maddelerden en zengin kanla karışılaşan periferik hücrelerdir. Sürekli aktivite gösterirler. Kandaki zararlı maddelerden de ilk etkilenen bu hücrelerdir. Glikojen en çok bu hücrelerde depolanır, daha az olarak da iç zonlarda birikir. Açlık durumunda glikojenin yeniden kana verilmesi söz konusu
olduğunda ilk önce santral hücreler glikojeni boşaltmaktadır. Bu zonda glikojen tükenene kadar diğer zonlardaki hücrelerden glikojen verilmez (Kalaycı, 1986). Zon I glukoneogenezde daha aktiftir ve diğer bölgelere göre daha fazla alkalen fosfataz ve transaminaz içerir (Cormack, 1993).
Ara zon (zon II), kabaca klasik lobülün midzonal alanına isabet eder (Mills, 2007).
Santral zon (zon III), vena sentralis çevresindeki dar bir bölgeyi oluşturan dinlenme evresindeki hücrelerdir. Karaciğerde patolojik ve fizyolojik yağ birikimi santral zondaki hücrelerde başlar. Diyet yetersizliği gibi bazı durumlarda ise yağ depolanması periferik zonda daha fazla olur. Neden ortadan kalkınca depo yağda kaybolabilir (Kalaycı, 1986). Đskemik olaylardan (sentrilobüler nekroz) en çok zon III’teki hepatositler etkilenir. Đlaç metabolize edici enzimler yüksek yoğunluktadır ve glikoliz, lipogenez, detoksifikasyon gibi işlevler burada gerçekleşir (Ross ve ark., 2003).
Şekil 2.3. Karaciğer lobülünün fonksiyonel sınıflandırması (Anonim-b)
Maddeleri beslenme ve metabolizma için asinüse getiren terminal vasküler kollar, aynı asinüsün salgısal ürünlerini drene eden terminal safra kanallarına gider. Damarlar safra kanalları etrafında vasküler ağ oluşturur. Böylece sinüzoidal kan akımının sonucu olarak asinüste yapısal, salgısal ve fonksiyonel birlik kurulmuş olur. Asinüsün üç bölgesinin içinden geçen oksijen gradyanı (değişim ölçüsü), metabolik heterojenlik ile enzimlerin farklı dağılımları, iskemi ve toksik maddelerin neden olduğu karaciğer hasarının bölgesel dağılımını açıklar (Mills, 2007).
2.5.2. Đlaç ve toksine bağlı karaciğer hasarları
Đlaçların metabolize ve detoksifiye edildiği başlıca organ karaciğerdir. Bu nedenle karaciğer, terapötik maddelerin ve çevresel kimyasal maddelerin potansiyel hasarına karşı açıktır.
Bu hasarların başlıca nedenleri 1- Direkt toksisite
2- Ksenobiyotik bir toksinin karaciğer tarafından aktif toksine dönüştürülmesi 3- Bir ilaç ya da bir metabolitin bir proteini bir immünojene dönüştürmesi gibi immun mekanizmalardır (Kumar ve ark., 2000).
Đlaca bağlı karaciğer hasarının tanınması birkaç nedenden dolayı zordur. Tüm ilaç sınıfındaki bileşenlerin sebep olduğu ilaca bağlı karaciğer hasarı, doğal veya taklitçi karaciğer hastalığı oluşturabilir (Damjanov ve Linder, 1996).
Aşırı duyarlı bir reaksiyonun klinik bulguları tüm durumlarda oluşmayabilir ve bir hastanın ilaç kullanma hikayesi fazla güvenilir değildir. Çoklu ilaç terapisi alan hastalarda reaksiyona sebep olan ajanı belirlemek oldukça güçtür. Aynı ilaç farklı hastalarda farklı karaciğer hasarına yol açabilir. Karaciğer hasarı, diğer farmakolojik ajanların verilmesiyle uyarılmış olabilir (Damjanov ve Linder, 1996).
Đlaca bağlı ve ilaçtan bağımsız olarak oluşan lezyonların özellikleri arasındaki farkın iyi bilinmesi gerekmektedir. Ayrım, beklenen toksik etkiler ve beklenmeyen reaksiyonlar arasında yapılmaktadır. Beklenen reaksiyonlar, molekülün gerçek hepatotoksisitesinden kaynaklanan doza bağlıdır ve kısa latent periyotta oluşurlar (Damjanov ve Linder, 1996). Belirli bir dozu depolayan herhangi bir kişide meydana gelebilir. Beklenmeyen reaksiyonlar ise; kişinin antijenik bir uyarıya karşı artmış bir bağışıklık yanıt verme eğilimine ve kişinin ajanı metabolize etme hızına bağlıdır (Kumar ve ark., 2000). Beklenmeyen reaksiyonların doz ilişkisi belirgin değildir, latent periyodu uzun olabilir (haftalar ve aylar) (Damjanov ve Linder, 1996).
Tahmin edilebilen reaksiyonların çoğunun kaynağı asetaminofen (fenasitin olarak adlandırılır), tetrasiklin, antineoplastik ajanlar, Amonita falloides toksini, karbon tetraklorid ve belirli noktaya kadar alkol olarak kabul edilir (Kumar ve ark., 2000). Karaciğerdeki ilaca bağlı reaksiyonlar organın hücresel elemanlarında yapısal ve fonksiyonel değişikliklere neden olabilir ve çeşitli durumlar oluşturabilir (Damjanov ve Linder, 1996).
2.5.3. Karaciğer rejenerasyonu
Karaciğerde rejenerasyon özelliği oldukça fazladır. Karaciğerin bir bölümünün cerrahi operasyonla çıkarılmasından ya da toksik (hepatotoksik) maddelerin verilmesinden (karbontetraklorür, kloroform gibi) kısa bir süre sonra organ normal ağırlığını yeniden kazanır. Ratlarda karaciğerin %75’i çıkarılırsa bir ay içinde kaybedilen dokunun yenilendiği görülür. Đnsanlarda bu özellik biraz daha sınırlıdır (Kalaycı, 1986). Normal boyutlarına ulaşan karaciğerin büyümesi durur. Normal karaciğerden alınan bir kesitte hepatosit grupları çok seyrek mitoz gösterir (Starzi ve ark., 1977). Rejenerasyon, sağlam hepatositlerin mitozu ve büyümeleri ile sağlanır. Yeniden restore edilen karaciğerde parankimal hücrelerin normalden büyük olduğu ve dikaryotik hücrelerin çoğaldığı görülür (Kalaycı, 1986). Hayatın herhangi bir döneminde karaciğer hücrelerinin sadece %0.0012-%0.01’i mitoza uğramaktadır (Holt ve ark., 2000). Burada mitoz olayı kanda dolaşan galon denen mitoz inhibitörü maddelerle kontrol edilir (Kalaycı, 1986; Junqueira ve ark., 1998). Doku hasarında ya da kısmen çıkarılmasında yapılan galon miktarı düşer. Mitoz baskısı kalktığında ise hızlı bir mitoz görülür. Rejenerasyon ilerledikçe yapılan galon miktarı artar, mitoz giderek azalır ve biter. Bu olay kendi kendini düzenleyici bir kontrol mekanizmasıdır. Sürekli ya da tekrarlanan karaciğer hasarlarında, karaciğer hücre rejenerasyonu ile birlikte bağ dokusu artımı da hızlandığından, giderek karaciğer bağ dokusu artar ve siroz denilen patolojik durum ortaya çıkar (Kalaycı, 1986). Karaciğerde hasar oluşturan, fulminan hepatit gibi ağır hastalıklarda bile eğer retikülin çatısı (Tip III kollajen) korunmuşsa, karaciğer rejenerasyon ile eski halini alır. Hepatosit kaybı ne şekilde olursa olsun rejenerasyon histopatolojik olarak, hepatosit kordonlarının kalınlaşması ve çok çekirdekli hepatositlerin sayıca artması şeklinde izlenir (Chisari, 1997; Mahoney, 1999). Örneğin karbontetraklorür, karaciğer lobüllerinin santral zonlarında hücre harabiyetine neden olur. Nekrotik hepatositler otolizle yok edilirken, lobülün periferik zonundaki hücrelerin mitozu ile rejenerasyon başlar. 5-6 gün içinde de hücresel hasar tamir edilir (Kalaycı, 1986).