T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
Ocak-2016 KONYA Her Hakkı Saklıdır BUĞDAYDAN ĠZOLE EDĠLEN BAKTERĠYEL ÇĠZGĠ YANIKLIĞI ETMENĠ
Xanthomonas translucens’ĠN MOLEKÜLER
KARAKTERĠZASYONU
Keziban BÜYÜKDEVECĠ YÜKSEK LĠSANS TEZĠ Bitki Koruma Anabilim Dalı
iv ÖZET
YÜKSEK LĠSANS
BUĞDAYDAN ĠZOLE EDĠLEN BAKTERĠYEL ÇĠZGĠ YANIKLIĞI ETMENĠ
Xanthomonas translucens’ĠN MOLEKÜLER KARAKTERĠZASYONU
Keziban BÜYÜKDEVECĠ
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Bitki Koruma Anabilim Dalı
DanıĢman: Doç. Dr. Kubilay KurtuluĢ BAġTAġ 2016, 59 Sayfa
Jüri
Prof. Dr. Nuh BOYRAZ
Doç. Dr. Kubilay KurtuluĢ BAġTAġ Yrd. Doç. Dr. M. KürĢat DEMĠR
Bu çalışmada, buğday hastalıkları içinde büyük öneme sahip olan, tohumla taşınan, tohum kalitesi ve ürün üzerinde büyük zararlara ve ayrıca uygun şartlar altında epidemilere sebep olan Xanthomonas translucens isimli bakteriyel patojenin, moleküler metotlarla karakterizasyonunun yapılarak bölge için öneminin ortaya konulması amaçlanmıştır. Bölgemizde klasik yöntemlerle yapılan tanılama testleriyle etmenin patovarları şu ana kadar belirlenememiştir. Hastalıklar ile uygun mücadele stratejilerinin geliştirilmesi öncelikle etmenin doğru tespitine bağlıdır. Bu amaçla yürütülen çalışmada, X. translucens‟in patovarları, buğday, arpa, yulaf, çavdar, tritikale ve brom bitkilerinde yapılan patojenisite testlerinin yanı sıra klasik PCR, REP-PCR, ERIC PCR, BOX PCR, IS- PCR yöntemleriyle de moleküler düzeyde karakterize edilmiştir. Elde edilen bulgulara göre, çalışmada kullanılan 70 X. translucens izolatının 68 adedi X. t. pv. translucens ve sadece 2 adedi ise X. t. pv. undulosa olarak tanılanmıştır. X. translucens‟ in sebep olduğu bakteriyel çizgi yanıklığı hastalığının doğru ve kısa sürede tanılanması ile tahıllarda mücadele yöntemlerinin ve ıslah programlarının geliştirilmesi kolaylaşacaktır.
v ABSTRACT
Ph.D THESIS
MOLECULAR CHARACTERIZATION OF Xanthomonas translucens CAUSES BACTERIAL LEAF STREAK BLIGHT ISOLATED FROM WHEAT
Keziban BÜYÜKDEVECĠ
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF MASTER OF SCIENCE PLANT PROTECTION
Advisor: Doç. Dr. Kubilay KurtuluĢ BAġTAġ 2016, 59 Pages
Jury
Prof.Dr. Nuh BOYRAZ Doç. Dr. Kubilay KurtuluĢ BAġTAġ
Yrd. Doç. Dr. M. KürĢat Demir
In this study, a pathogen called by Xanthomonas translucens, having great importance among the wheat diseases, transmitted by seeds, causing to important losses on seed quality and yield and epidemics under favorable conditions, was aimed characterization of the pathogen by molecular methods and also to execute importance of the pathogen for the region. In our region, pathovars of the pathogen couldn‟t be determined by traditional methods so far. The development of appropriate control strategies with the disease primarily depends on the accurate identification. In the search going on with this purpose, pathovars of X. translucens were characterized by pathogenicity tests on wheat, barley, oat, rye, triticale and bromus plants, and also in molecular level using classical PCR, REP-PCR, ERIC-PCR, BOX-PCR, IS- PCR techniques. According to obtained data, it was identified 68 isolates as X. t. pv. translucens and only 2 isolates as X. t. pv. undulosa from totally 70 X. translucens isolates. Development of control methods and improvement programs in cereals will facilitate, through accurate and in short time identification of bacterial leaf streak blight disease caused by X. translucens.
vi ÖNSÖZ
Tez konumun belirlenmesinde bana önderlik eden, laboratuvar çalışmaları ve yazım aşamasında yardımlarını ve eleştirilerini esirgemeyen, değerli fikir ve katkılarıyla çalışmalarımı yönlendiren danışman hocam Sayın Doç. Dr. Kubilay K. BAŞTAŞ‟a, çalışmalarım sırasında desteklerini esirgemeyen arkadaşlarım, Şerife ÇETİN, Badel UYSAL ve Duygu KÖMÜRCÜ‟ ye teşekkürü bir borç bilirim.
Tüm hayatım boyunca maddi ve manevi desteklerini hiçbir zaman esirgemeyen ve gösterdikleri anlayışla bugünlere gelmemi sağlayan sevgili aileme ne kadar teşekkür etsem azdır.
Keziban BÜYÜKDEVECİ KONYA-2016
vii ĠÇĠNDEKĠLER ÖZET……… ... iv ABSTRACT………… ... v ÖNSÖZ………. ... vi ĠÇĠNDEKĠLER………. ... vii SĠMGELER VE KISALTMALAR ... ix 1. GĠRĠġ ... 1 2. KAYNAK ARAġTIRMASI ... 4 3. MATERYAL VE YÖNTEM... 13 3.1. Materyal ... 13 3.1.1. Bakteriyel izolatlar ... 13
3.1.2. Kullanılan kimyasal, alet ve ekipman ... 14
3.2. Yöntem ... 14
3.2.1. Xanthomonas translucens‟in izolasyonu ... 14
3.2.2. Bakteriyel izolatların geliştirilmesi ... 15
3.2.3. Etmenin tanısı ... 16
3.2.3.1. Koloni morfolojisi ... 16
3.2.3.2. Biyokimyasal testler ... 17
3.2.3.2.1. Gram reaksiyon testi ... 17
3.2.3.2.2. YDC‟de mukoid gelişim ... 17
3.2.3.2.3. 35oC‟de gelişim ... 17
3.2.3.2.4. XTS‟de gelişim ... 18
3.2.3.2.5. SX besi yerinde gelişim ... 18
3.2.3.2.6. Arjinin dehidrolaz testi (Arginine Dehydrolase Test) ... 18
3.2.3.2.7. Oksidaz testi ... 19
3.2.3.2.8. Esculinin hidrolizi ... 19
3.2.3.2.9. Cysteinden hidrojen sülfit (H2S) oluşumu ... 20
3.2.3.2.10. Floresan pigment üretimi ... 20
3.2.3.2.11. Üreaz aktivitesi ... 20
3.2.3.2.12. Arbinozdan asit oluşumu ... 21
3.2.3.3. Patojenisite testleri………..21
3.2.3.4. Tütünde aşırı duyarlılık testi………...22
3.2.3.5. X. translucens'in re-izolasyonu………..22
3.2.3.6. Moleküler Tanılama……...………...23
3.2.3.6.1. X. translucens izolatlarından DNA izolasyonu ... 23
3.2.3.6.2. X. translucens’in spesifik T1/T2 oligo nükleotit primerler ile klasik PCR çalışmaları ………24
3.2.3.6.3. IS-PCR metoduna göre gen profillerinin belirlenmesi ... 25
3.2.3.6.4. rep-PCR metoduna göre gen profillerinin belirlenmesi ... 25
3.2.3.6.5. BOX-PCR metoduna göre gen profillerinin belirlenmesi ... 26
3.2.3.6.6. Amplifiye edilen bakteriyel DNA örneklerinin elektroforez sisteminde yürütülmesi ve değerlendirilmesi ... 27
3.2.3.7. Soyağacı Analizi ....………...28
4. ARAġTIRMA SONUÇLARI ve TARTIġMA ... 29
4.1. Buğdaygil Bitkilerine X. translucens‟ in İnokulasyonu ... 29
4.2. X. translucens‟ in Re-izolasyonu ve Tanılanması ... 30
4.3. Tütünde Aşırı Duyarlılık (Hipersensetive Reaction =HR )Testi... 33
viii
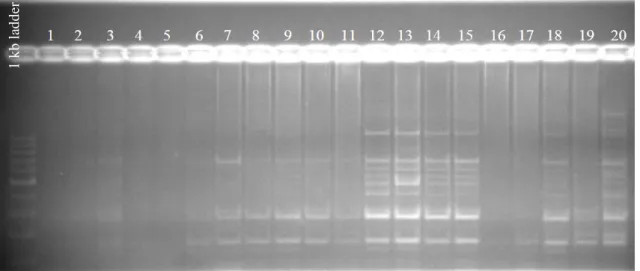
4.4.1. Spesifik T1/T2 primerleri ile amplifikasyon sonuçları ... 34
4.4.2. IS-PCR yöntemi kullanılarak J3 primeri ile elde edilen sonuçlar ... 35
4.4.3. Rep-PCR yöntemi kullanılarak ERIC primerleri ile elde edilen sonuçlar 36 4.4.4. Rep-PCR yöntemi kullanılarak BOX primeri ile elde edilen sonuçlar ... 37
4.5. Soyağacı Analizi Sonucu………38
5. SONUÇLAR VE ÖNERĠLER ... 39
5.1. Sonuçlar ... 39
5.2. Öneriler ... 4040
KAYNAKLAR…. ... 422
ix
SĠMGELER VE KISALTMALAR
AFLP: Amplified Fragment Length Polymorphism(Çoğaltılmış Fragment Uzunluk Polimorfizmi)
bp: Baz Çifti
EDTA: Etilendiamin Tetra-Asetik Asit
ERIC: Enterobacterial Repetetive Intergenic Consensus (Enterobakteriyel Tekrarlanan İnterjenik Palindromik Konsensus)
FAME: Fatty Acid Methyl Ester
IS-PCR: İnsertion Sequence-Based Polymerase Chain Reaction ITS: Internal Transcribed Spacer (İç Transkribe Edilen Ayırıcı
Bölge
K2HPO4: Potasyum Di Fosfat
KOH: Potasyum Hidroksit
MGSO47H2O: Magnezyum Sülfat Yedi Sulu
NACI: Soydum Klolür
NAOCI: Sodyum Hipoklorit
NH4H2PO4: Amonyum Fosfat
PCR: Polimeraz Zincir Reaksiyonu
PFGE: Pulsed Field Gel Electrophoresis(Dalgalı Alan Jel Elektroforezi)
Rep: Tekrarlanan Ekstrajenik Palindromik (Repetitive Extragenic Palindrome)
rpm: Rounds Per Minute (Dakikada Dönüş Hızı)
rRNA: Ribozomal Ribonükleik Asit
SDS: Sodyum Dodesil Sülfat
TAE: Tris –Asetat-Edta
TBE: Tris-Borik Asit-Edta
UPGMA: Aritmetik Ortalama Kullanarak Ağırlıksız Gruplama Yöntemi
UV: Ultra Viyole
1. GĠRĠġ
Buğday, tek yıllık bir bitki olup, her türlü iklim ve toprak koşullarında yetişebilecek çok sayıda çeşitlere sahip olması nedeniyle, dünyanın hemen her tarafında yetiştirilmektedir. Buğday gerek dünyada; gerekse ülkemizde en fazla üretilen tarım ürünüdür (İnceköse ve Açıkgöz, 2012).
Türkiye yüzölçümünün %30‟u (23,8 milyon hektar) tarım yapılabilir özelliktedir. Tarım alanlarının nadas alanları hariç %65,5‟i (15,6 milyon hektar) tarla bitkilerine ayrılmıştır. Bu alanın da yaklaşık %74‟ünde (11,5 milyon hektar) hububat ekilmektedir. Hububat ekim alanı içerisinde %67,2‟lik pay ile ilk sırada buğday, %23,7‟ lik payla ikinci sırada arpa ve %5,7‟lik payla mısır üçüncü sırada yer almaktadır. Bu ürünleri sırasıyla çavdar, çeltik, yulaf ve tritikale izlemektedir (Anonim, 2014a).
Buğday üretimi, ülkemizin her bölgesinde yapılmaktadır. Bu nedenle buğday, tarla bitkileri içerisinde ekiliş alanı ve üretim miktarı bakımından ilk sırayı almaktadır. Son 20 yılda buğday ekim alanları 7,5- 9,8 milyon hektar arasında; üretimi ise 17,2 – 22,05 milyon ton arasında değişmiştir. Ülkemizde artan nüfusla birlikte buğday talebi de artmaktadır. Ekmek, bulgur, makarna, irmik, bisküvi, nişasta ve buğdaya dayalı diğer unlu mamuller tüketimi dikkate alındığında buğday tüketimimiz 18-18,5 milyon ton düzeyindedir. Ülkemizde 2014 yılında, 79.192.084 da ekiliş alanında 19 milyon ton buğday üretimi gerçekleşmiş ve ortalama olarak 240 kg/da verim elde edilmiştir. Türkiye dünyanın en büyük tahıl üreten ülkeleri arasında önemli bir yere sahiptir. Türkiye toplam dünya buğday üretiminde 9. sırada iken, makarnalık buğday üretiminde 3. sırada yer almaktadır (Anonim, 2014b). Türkiye‟de toplam tahıl üretiminin büyük çoğunluğu İç Anadolu Bölgesi‟nde olup, bunu sırasıyla Marmara, Akdeniz, Güneydoğu Anadolu Bölgesi, Ege, Karadeniz ve Doğu Anadolu Bölgesi takip etmektedir. Türkiye tarla bitkileri ekilişinde %75,5 olan tahıl ekim alanı, İç Anadolu Bölgesinde %68,3, Türkiye‟nin yüzölçümü bakımından en büyük ili olan Konya‟da %87,4 gibi son derece yüksek bir orandadır. Tahıllar içerisinde en önemli payı ise buğday almaktadır (Anonim, 2014c).
Dünyada yılda tahminen 127.400.000 ton tohumluk kullanıldığı ve bu miktarın parasal değerinin 40–50 milyar dolar olduğu bildirilmektedir. Bazı tahminlere göre; ticari amaçlı tohum üretimi ise yaklaşık 30 milyon dolarlık bir paya sahiptir (Erkan, 1998).
Buğdayda değişik şekillerde zarar yaparak önemli verim kayıplarına neden olan pek çok abiyotik ve biyotik kökenli etmen bulunmaktadır. Buğdayda yaklaşık 40 adet fungal, bakteriyel ve viral hastalık önemli kayıplara neden olmakta bu hastalıkların çoğu tohumla tarladan tarlaya ve ülkeden ülkeye taşınmaktadır. Bunlar içerisinde Pseudomonas syringae pv. syringae, Pseudomonas fuscovaginae, Pseudomonas syringae pv. atrofaciens, Xanthomonas translucens ve Erwinia rhapontici tohumla taşınan önemli bakteriyel etmenlerdir (Duveiller ve ark., 1997).
Xanthomonas translucens arpada (Jones ve ark., 1917), buğdayda (Smith ve ark., 1919), çavdarda (Reddy ve ark., 1924), çayırlarda (Wallin, 1946) ve tritikalede (Zillnsky ve Borlaug, 1971) tanımlanmıştır.
Bakteriyel çizgi hastalığı çok farklı durumlarda ortaya çıkmaktadır. Örneğin yağmurlama sulamanın yapıldığı ılıman iklimli tarlalarda, fazla yağışlı subtropik yüksek yerlerde ve serin gecelerde ya da sıkı yaşanan iklim değişikliklerinde ve ani sıcaklık değişimlerinin olduğu ılıman bölgelerde rastlanır (Duveiller ve ark., 1997).
Etmenden dolayı kayıpların genellikle %10 civarında olmasına rağmen Idaho‟daki pek çok hastalanmış tarlada %40 kadar yüksek ürün kaybı rapor edilmiştir (Forster, 1982; Forster ve ark., 1986). Ciddi durumlarda, buğday kılçıklarının %5-10‟u enfeksiyonu ile tohumlarda çimlenme sorunu görülmektedir (Forster ve Schaad, 1988) ve hastalık bütün tarlayı çok şiddetli etkilediğinden hasata hiçbir şey kalmayabilir (Burton, 1931). Shane ve Baumer (1987) bayrak yaprakta %50 şiddetinde hastalığın oluşmasının, tane ağırlığında %8–13 kayıpla sonuçlandığını ve bayrak yaprakta %100‟lük hastalık şiddetinin ise %13–34 kayıpla sonuçlandığını hesaplamışlardır. Meksika‟da buğdayda ürün kaybına yüksek yağış miktarının, ılıman iklim koşullarının ve tek sürüm yapılan tarlalarda olduğu görülmüştür. Hastalıkla enfekte olmuş yaprakların varlığı bitkinin fotosentez mekanizmasını da önemli ölçüde etkilemektedir (Duveiller ve ark., 1997).
Hastalığın tipik belirtileri; yapraklar üzerindeki birkaç cm uzunluğa ulaşabilen parlak kahverengi, birbirine paralel ve uzunca lezyonlardır. Bu lezyonlar başlangıçta yaprak üzerinde ayrı ayrı görülebilir ama zamanla tüm yaprak yüzeyini kaplarlar. Parlak ışık altında bakıldığında çok kolayca fark edilebilir. Su emmiş gibi görünen bu lekeler üzerinde özelliklede nemli koşullarda bakteriyel akıntılar gözlenir. Bu akıntılar zamanla sarımtırak renkte ve granüler halde kuruyarak yaprak üzerinde kalır ve kolaylıkla yaprak yüzeyinden ayrılabilirler. Hububatın fide dönemlerinde hastalık kesinlikle hiçbir simptom sergilemez. Başak ve tohumlarda yüzeydeki renk bozulmasını takiben
erguvani siyahımsı bir görünüm meydana gelir. Hastalık zaman zaman fizyolojik bozuklukmuş gibi yanlış algılanabilir. Aşırı gün ışığına maruz kalan bitkilerde de benzer belirtiler gözlenebilir. Aşırı yağışlar hastalığın ağır enfeksiyon yapmasına sebep olur(Kotan, 2008).
Hastalıklar ile uygun mücadele stratejilerinin geliştirilmesi öncelikle etmenin doğru tespitine bağlıdır. Bu sayede daha etkili ve daha uygun mücadele yöntemlerinin geliştirilebilmesi söz konusu olabilecektir.
Günümüzde, bitkilerde görülen hastalıkların tanısında genellikle hastalık belirtileri, patolojik bulgular ve etmenlerin izolasyonları yanında daha çok immünolojik yöntemler ile teşhise yardımcı olan diğer testlerden faydalanılmaktadır. Özellikle bakteri enfeksiyonlarında spesifik etmeni her zaman izole etmek ve tanılamak mümkün olamamakta, bazen de etmenin tanısı haftalar almaktadır. Kimi zamansa asıl etmen yerine, ikincil organizmalar izole edilmekte, dolayısıyla hastalığın teşhis kriterleri buna göre düzenlenmektedir. Bu amaçla özellikle moleküler teknikler kullanılarak yapılan teşhisler, doğruluk ve zaman yönünden üstünlük sağlamaktadırlar (Baştaş ve ark., 2011).
Bu çalışmada da, buğday tohumlarıyla taşınan, büyük zararlara sebep olan ve ülkemizde de rapor edilmiş olan Xanthomonas translucens isimli bakteriyel patojenin, Konya iline ait izolatların tanılarının moleküler düzeyde yapılması, mücadele ve ıslah çalışmalarına yardımcı bulguların elde edilmesi planlanmıştır.
2. KAYNAK ARAġTIRMASI
Buğday geniş bir adaptasyon yeteneğine sahip olmasına rağmen fazla sıcak ve nemden hoşlanmayan bir serin iklim tahılıdır. Özellikle gelişiminin ilk dönemlerinde (çimlenme -kardeşlenme) sıcaklığın 8-10 °C, bağıl nemin %60‟ın üzerinde olması yeterlidir. Kardeşlenme ve sapa kalkma arasında da fazla sıcaklık istemez. 10-15 °C sıcaklık, %65 nem, az ışıklı ve yarı kapalı havalar uygundur. Sapa kalkma ile sıcaklık ve nem isteği artar. Başaklanma döneminin hemen öncesinde bağıl nemin yüksek olması buğday verimini olumlu yönde etkiler. Döllenme ile birlikte, düşük nem ve yüksek sıcaklık tanenin niteliğini yükseltir. Gelişme dönemine uygun dağılmış 500 mm bir yağış maksimum verim için yeterlidir. Bununla birlikte bazı buğday çeşitleri 250 mm yağış alan alanlarda da yetiştirilebilmektedir. Buğday değişik tip topraklarda yetişebilen bir bitkidir. Verimsiz kıraç topraklarda ve verimli taban alanlarda yetiştirilebilen birçok buğday çeşidi vardır. Bununla birlikte buğday için en uygun topraklar, drenajı yeterli olan derin killi tınlı topraklardır. Su tutma kapasitesi %25-30 olan toprak buğday için uygundur (Anonim, 2015).
Bitkisel üretim içersinde tohum en önemli üretim materyalidir. Ülkemizde 2014 yılında 19 milyon ton buğday üretimi gerçekleşmiştir (Anonim, 2014b). Üreticilerin dekara ortalama 20-22 kg tohumluk kullandığı düşünülerek yaklaşık 2.600.000 ton tohumluğun kullanıldığı görülür. Hastalıklı tohum; hastalığın yayılması, görülmesi ve çoğalmasında ilk kaynak olması dolayısıyla çok önemlidir. Tohum alışverişi hastalığın dağılımında etkili bir yol olup tohum kaynaklı hastalıklar, karantina ve tohum sertifikasyonu açısından da oldukça önemlidir. Uluslar arası tohum alışverişlerinde karantina yönünden, önceden bazı patojenler için sıfır tolerans istenirken son zamanlarda tohumların tarla ve laboratuar standartlarına uygun olması istenmektedir.
Fungal patojenlerin bitki patologları tarafından izole edildiği, incelendiği ve tanımlandığı; fakat buğday bakteriyel hastalıklarının tanımlanmasında sadece simptomlara bakıldığı ve patojenlerin izolasyonunun yapılmadığı ya da uygun testlere dayanarak tanımlamaların yapılmadığı raporlar sonucu ortaya çıkmıştır (Duveiller ve ark., 1997). Son yıllarda, bitki bakteriyolojisi yeni tekniklerin hızlı gelişmelerinden özellikle moleküler tekniklerden yararlanmaktadır, böylece taksonomik çalışmalarda ve tanımlama çalışmalarında oldukça hızlı, kısa sürede, vazgeçilmez sonuçlar elde edilmiştir (Maes ve ark.,1996).
Tahıllarda tohumla taşınabilen fungal, bakteriyel ve viral hastalıklar dünyada önemli ölçüde ekonomik kayıplara sebep olmaktadır. Ülkemizde tahıllardaki hastalıklar üzerine yapılan çalışmaların çoğunluğu fungal patojenlerle ilgilidir (Özkan ve Aktaş, 1975; Aktaş, 1982; Aktaş, 1984; Aktaş ve ark., 1994; Aktaş ve ark., 1995; Demirci, 1998; Aktaş ve ark. 2000; Hekimhan, 2010). Tahıllarda görülen başlıca bakteriyel hastalıklar; Xanthomonas translucens (pv. undulosa, pv. cerealis, pv. translucens, pv. secalis, pv. graminis), Pseudomonas syringae (pv. syringae, pv. atrofaciens, pv. japonica), Bacillus megaterium pv. cerealis, Clavibacter iranicus, Clavibacter michiganensis subsp. tessellarius, Clavibacter tritici, Erwinia rhapontici, Pseudomonas cichorii ve Pseudomonas fuscovaginae‟dir (Duveiller ve ark., 1997).
Yukarıda verilen Xanthomonas translucens türüne ait toplam 5 farklı pathovar hububat bitkilerinde özellikle ılıman ve nemli iklimlerde yapraklar üzerinde renkli lekelere sebep olmaktadır. X. t. pv. undulosa ilk defa buğdaydan izole edilmiş olup arpada da hastalık oluşturmaktadır (Bragard ve ark., 1997). X. t. pv. secalis‟ in konukçuları arasında ise buğday, pirinç, arpa, yulaf, yabani buğday ve ayrık yer almaktadır. X. t. pv. cerealis yulaf ve ayrıkta hastalık oluştururken; X. t. pv. translucens buğdaylarda patojen olup uygun koşullar oluştuğu zaman % 30–40 oranında bir verim kaybına sebep olabilmektedir. Bu hastalık Türkiye‟de de rapor edilmiştir (Sands ve Fourest, 1989; Demir ve Üstün, 1992; Baştaş ve ark., 2011).
Etmen dünya genelinde yaygındır. X. translucens’in neden olduğu bakteriyel çizgi hastalığı, patojen öncelikle arpada (Jones ve ark., 1917), daha sonrada sırasıyla buğday (Smith ve ark., 1919), çavdar (Reddy ve ark., 1924), çayırlar (Wallin, 1946) ve son olarak da tritikalede (Zillnsky ve Borlaug, 1971) tanımlanmıştır.
Bakteriyel çizgi hastalığı yağmurlama sulamanın yapıldığı ılıman iklimli tarlalarda, fazla yağışlı subtropik yüksek yerlerde ve serin gecelerde ya da sıkı yaşanan iklim değişikliklerinde ve ani sıcaklık değişimlerinin olduğu ılıman bölgelerde rastlanır (Duveiller ve ark., 1997).
Asya‟da hastalık Çin‟de (Chen ve Ding, 1981; Sun ve He, 1986), Pakistan‟da (Akhtar ve Alsam, 1985; Akhtar ve ark., 1986), İran‟da (Alizadeh ve Rahimian, 1989; Alizadeh ve ark., 1995) buğdayda; Hindistan‟da (Richardson ve Waller, 1974) tritikalede bilinmektedir. Yakın ve Orta Asya‟da hastalık makarnalık (Tritucum turgidum var. durum L.) ve ekmeklik buğdaylarda etkili olmakta ve sulanan Suriye topraklarında (Mamluk ve ark., 1990), İsrail‟de (CIMMYT, 1977), Türkiye‟de (Sands ve Fourest, 1989; Demir ve Üstün, 1992; Baştaş ve ark., 2011) tespit edilmiştir.
Etmenden dolayı kayıpların genellikle %10 civarında olmasına rağmen Idaho‟daki pek çok hastalanmış tarlada %40 kadar yüksek ürün kaybı rapor edilmiştir (Forster, 1982; Forster ve ark., 1986).
Ciddi durumlarda, buğday kılçıklarının %5-10‟u enfeksiyon yüzünden döllenme sorunu olmuş olabilir (Forster ve Schaad, 1988) ve hastalık bütün tarlayı çok şiddetli etkilediğinden hasata hiçbir şey kalmayabilir (Burton, 1931).
Shane ve Baumer (1987) bayrak yaprakta %50 şiddetinde hastalığın oluşmasının, tane ağırlığında %8–13 kayıpla sonuçlandığı ve bayrak yaprakta %100‟lük hastalık şiddetinin ise %13–34 kayıpla sonuçlandığını hesaplamıştır. Meksika‟da buğdayda ürün kaybına yüksek yağış miktarının, ılıman iklim koşullarının ve tek sürüm yapılan tarlalarda olduğu görülmüştür. Hastalıkla enfekte olmuş yaprakların varlığı bitkinin fotosentez mekanizmasını da önemli ölçüde etkilemektedir.
Hastalığın tipik belirtileri; yapraklar üzerindeki birkaç cm uzunluğa ulaşabilen parlak kahverengi, birbirine paralel ve uzunca lezyonlardır. Bu lezyonlar başlangıçta yaprak üzerinde ayrı ayrı görülebilir ama zamanla tüm yaprak yüzeyini kaplarlar. Parlak ışık altında bakıldığında çok kolayca fark edilebilir (Şekil 1a). Su emmiş gibi görünen bu lekeler üzerinde özelliklede nemli koşullarda bakteriyel akıntılar gözlenir. Bu akıntılar zamanla sarımtırak renkte ve granüler halde kuruyarak yaprak üzerinde kalır ve kolaylıkla yaprak yüzeyinden ayrılabilirler (Şekil 1b). Hububatın fide dönemlerinde hastalık kesinlikle hiçbir simptom sergilemez. Başak ve tohumlarda yüzeydeki renk bozulmasını takiben erguvani siyahımsı bir görünüm meydana gelir. Hastalık zaman zaman fizyolojik bozuklukmuş gibi yanlış algılanabilir. Aşırı gün ışığına maruz kalan bitkilerde de benzer belirtiler gözlenebilir. Aşırı yağışlar hastalığın ağır enfeksiyon yapmasına sebep olur(Kotan, 2008).
ġekil 1. Xanthomonas translucens hastağının belirtileri a. Hastalık belirtileri, b. Yapraklar üzerinde
bakteriyel damlacıklar (Anonim 2013).
X. translucens, spor oluşturmayan, aerobik, çubuk şekilli, tek polar kamçı ile hareketli gram negatif bir bakteridir. Besi yerinde yuvarlak, parlak, mukoid ve sarı renkte koloni oluştururlar (Schaad ve ark., 2001).
Tohumla taşınan bir hastalıktır. Depolama şartlarına bağlı olarak patojen 63-81 ay tohumda canlı kalabilmektedir. Taşınma oranı düşüktür ancak, uygun koşullarda ciddi epidemiler yapabilmektedir. Uzak mesafelere taşınması tohumla olmaktadır. Kısa mesafelerde ise yağmur, çiğ ve bitkilerin birbirlerine dokunması ile bitkiden bitkiye taşınmaktadır. Bakteriyel akıntıların afitlere kontaminasyonu ile de hastalık uzak mesafelere taşınabilmektedir (Kotan, 2008).
Patojenin hayatta kalması sadece konukçu enfeksiyonuna bağlı değildir. Çünkü konukçusu olmayan bitkilerde de epifitik olarak bulunabilmektedir. Patojen çok yıllık bitkilerde, hububat kalıntılarında ve toprakta da kışı geçirebilmektedir. Ilık nemli hava koşulları ve 22 ºC sıcaklık patojenin gelişimi için en uygun koşullardır. Geniş sıcaklık sınırlarında (15-30 ºC) yaşayabilmektedir (Duveiller ve ark., 1997).
Patojenin en önemli bulaşma kaynağı tohum olduğu için temiz tohumluk kullanılması büyük önem arz etmektedir. Tarla koşullarında hastalık ortaya çıktıktan sonra pestisit kullanılarak hastalığın önüne geçilemediği için kimyasal mücadele de daha çok tohum dezenfeksiyonu şeklinde yapılmaktadır. Tohum tedavisinde %5‟lik bakır asetat solüsyonunda 45 ºC‟de 20 dakika süreyle tohumların bekletilmesi ya da 72 ºC‟de 7 gün kuru sıcaklık uygulaması önerilen yöntemlerden bazılarıdır. Ancak tamamen tohum dezenfeksiyonu ya da tedavisi yöntemi ile de hastalığın kontrol altına alınması oldukça zordur. En uygun yolun dayanıklı bitki çeşitlerinin kullanımı olduğu belirtilmektedir (Kotan, 2008).
X. translucens’in tanılanmasında; KOH ile gram reaksiyonunun belirlenmesi (Fahy ve Presley, 1983), 35 ºC, King B besiyerinde fluoresans pigment oluşumu, XTS besi yerinde gelişim (Schaad and Forster, 1985), YDC‟de mukoid gelişim (Schaad, 1988), aesculin hidrolizi (Sneath,1956; Schaad, 1988), sisteinden H2S oluşumu (Klement ve ark.,1990), tütün yaprağında aşırı duyarlılık reaksiyonu (Klement ve ark.,1990; Lelliott ve Stead,1987; Mohan ve Schaad,1987) gibi biyokimyasal, fizyolojik ve morfolojik testler esas alınmaktadır.
Son yıllarda özellikle 1980‟li yılların başından itibaren nükleik asit karakterizasyonu, moleküler klonlama, sekans analizleri, rekombinat teknolojisi ve genetik materyaller üzerindeki çalışmalar, nükleik asit tabanlı problardan yararlanma olanakları giderek artmıştır. Ayrıca prokaryotik ve ökaryotiklerin genomlarındaki modifikasyonlar, restirüksiyon analizleri ve sistemleri üzerinde de son zamanlarda yoğun çalışmalar yapılmaktadır. 1985 yılında Saiki ve arkadaşları tarafından DNA veya RNA baz sıralarının sayısal olarak artırılması (amplifikasyon) teknolojisine dayanan
dolayısıyla mevcut yöntemlerle analiz edilebilmelerini sağlayan Polimeraz Zincir Reaksiyonu (PCR)‟ı geliştirilmiştir (Dönmez, 2004).
PCR son yıllarda enfeksiyöz etmenlerin teşhisinde, epidemiyolojide, genetik defektlerin saptanmasında ve diğer alanlarda geniş bir uygulama ortamı bulmuştur. PCR, izole edilen ve patolojik materyallerde bulunan hedef genetik materyallerin (DNA veya RNA) spesifik kısa zincirli oligonükleotid primerler yardımıyla enzimatik olarak sayısal çoğaltılması (amplifikasyon)‟dır. Bu hedef genetik materyal çok az sayıda ve hatta birçok veya sayısız diğer veya ilgisiz DNA‟lar arasında olsa bile çoğaltılabilir ve homojen bir DNA materyali haline getirilebilir ve kolayca da identifiye edilebilir (Saiki ve ark. 1988; Walker ve Dounan 1989; Arda, 1994).
PCR, bitki patolojisinde tohum saflığının belirlenmesinde, çeşitli türlerin tanısında ve türler arasındaki genetik akrabalığın belirlenmesinde kullanılmaktadır (Pinsonnet ve Nemse 1994; Leite ve ark., 1995; Pascula ve ark., 1995; Santos ve ark., 1997; Pastric ve Rainey, 1999; Maddox, 1998; Arı 1999; Hyman ve ark., 2000). Woese ve ark. (1985, 1987), bakterilerin ve diğer yaşam formlarının filogenetik ilişkisinin, genetik şifrenin değişmeyen bir bölgesinin kıyaslanması ile saptanabilir olduğunu ortaya koymuştur.
Prokaryotlarda ribozomal RNA (rRNA)‟yı kodlayan 16S, 23S ve 5S olmak üzere 3 gen bölgesi bulunmaktadır. Bunlar ara bölgelerle ayrılmakta ve sekansta, hem genus hem tür seviyesinde uzunluk açısından çeşitlilik göstermektedir. 16S ve 23S rRNA bölgeleri yüksek derecede korunmuş dizileri içeren bölgelerdir. Bu bölgelere özgü primerler kullanılarak PCR işlemi gerçekleştirilerek sekanslama işlemi neticesinde sonuca gidilebilir. 16-23S rRNA arasındaki bölgesinin çoğaltılması genellikle İç Transkribe Edilen Ayırıcı Bölge PCR (Internal Transcribed Spacer (ITS-PCR)) olarak tanımlanmaktadır. ITS-PCR; 16S-23S rRNA‟nın intergenik transkripsiyon bölgesi içindeki polimorfizmleri ortaya çıkarmakta ve bakteriyal türlerin karakterizasyonunda kullanılabilmektedir. Bu yüzden filogenetik analizler için önemli bir araç olarak görev yapabilir. rRNA genleri arasındaki ara bölge hedef bölge olduğu için yöntem aynı zamanda PCR-ribotiplendirme olarak da adlandırılmaktadır. Agaroz jelde ayrılan çoğaltılan bölgeler karşılaştırılmaktadır. Çoğaltılmış bölgenin restriksiyon analizi veya sekansı, yöntemin ayrım gücünü yükseltmektedir (Kıran ve ark., 2011).
Çetinkaya ve ark. (2012) bakterilerdeki bu genetik alan için uygunluğu incelenmekte olan kısımlar 5S, 16S (küçük alt ünite de denir) ve 23S rDNA‟yı şifreleyen genlerden meydana geldiğini bildirmişlerdir. Bakterilerde taksonomik
amaçlar için en çok kullanılan DNA parçası 16S rDNA genidir 16S rDNA geni sadece bakteriler arasında değil, aynı zamanda arkebakterilerin 16S rDNA geni ve ökaryotların 18S rDNA geni ile de karşılaştırılabilir.
Bakteri DNA‟sı içerisinde sürekli tekrarlayan elementler bulunmaktadır. DNA içindeki değişken sayıda tekrarlayan ve ökaryotik organizmalarda Rep olarak isimlendirilen bu elementler bakteri hücrelerinde merkezi korunmuş palindromik yapıya sahip sekanslardır. Fonksiyonları tam olarak bilinmemekle beraber bu bölgelerin kromozomal organizasyonda yer aldıkları düşünülmektedir (Kıran ve ark., 2011).
Versalovic ve ark. (1994) bakteriyel parmakizi için bakteriyel genomların içinde bulunan bu tekrarlanan DNA elementlerinin PCR ile amplifikasyonundan elde edilen spesifik bantların incelenmesiyle yapılan bir tiplendirme yöntemi tanımlamıştır.
Rep-PCR çoğu bakterinin genomunda birçok kopyasının doğal olarak bulunduğu, oldukça korunmuş ve tekrarlanan DNA sekanslarının amplifikasyonu üzerine kurulmuş bir genomik parmakizi tekniğidir. Bugüne kadar tekrarlanan DNA sekanslarının 3 türü tanımlanmıştır. Bunlardan birincisi; tekrarlanan ekstrajenik palindromik (REP) olarak adlandırılan 35-40 baz çifti büyüklüğünde ve çeşitli halkaları yapısında bulunduran elementlerdir. Enterobakteriyal Tekrarlanan İnterjenik Palindromik Konsensus (ERIC) ise; 124-127 baz çifti büyüklüğünde ve merkezi korunmuş palindromik yapıya sahip sekanslardır.
BOX dizisi ise 154 baz çiftlik box A, box B, ve box C şeklinde isimlendirilmiş korunmuş alt ünitelere sahip elementlerdir. Bakteriler arasında bütün bu alt üniteler arasında sadece box A-1 alt ünitesi oldukça korunmuştur. Tiplendirme amacıyla primerler DNA‟yı çoğaltmak için REP ve ERIC‟de tekrarlanan bölgelerin dışından, BOX‟da ise box A alt ünitesinden başlayacak şekilde tasarlanabilirler. Bu primerlerin kullanımıyla REP, ERIC ve BOX elementlerinin arasında yerleşmiş ayırıcı bölgeler çoğaltılabilmekte ve REP-PCR, ERIC-PCR ve BOX-PCR genomik parmakizi olarak adlandırılmaktadır. Toplu halde bu yöntemler Rep-PCR genomik parmak izi tekniği olarak tanımlanmaktadır (Versalovic ve ark., 1994). Bu teknikle tekrarlanan elementler PCR ile değişik boyutlarda DNA fragmentleri üretmek için çoğaltılmaktadır. PCR ürünleri daha sonra boyutlarına göre agaroz jel elektroforezinde ayrılmakta ve spesifik DNA parmak izi bantları oluşturulmaktadır. Daha sonra bu bantlar tanımlayıcı bilgisayar programı kullanılarak analiz edilmektedir. Rep veya ERIC dizilerinden kaynaklanan primerlerle yapılan PCR kolay uygulanabilmesi, çok sayıda izolat ile
çalışılabilmesi, ayırt ediciliğinin yüksek olması nedeni ile en yaygın kullanılan moleküler tiplendirme yöntemleri arasındadır (Kıran ve ark., 2011).
Carson ve ark. (2003) Rep-PCR‟nin ribotiplendirmeden daha doğru, tekrarlanabilir ve etkili bir yöntem olduğu sonucuna varmışlardır. Tekniğin uygulanması kolaydır, ayrıca hem çok sayıda hem de az sayıda örneğe uygulanabilir. Yöntemin en önemli dezavantajı söz konusu serilerdeki yüksek değişimdir. Bu nedenle çoğu durumda tür ayrımında kullanılamaz. Daha fazla türe uygulanabilirlik göstermekte olan Rep-PCR, PFGE ile karşılaştırıldığında daha düşük ancak plazmid profil analizleri veya genomik parmakizleri ile karşılaştırıldığında daha yüksek ayrım gücüne sahiptir (Olive ve ark., 1999).
Patojen-konukçu arasındaki uyumlu reaksiyonu kodlayan bazı genler (patojenisite, virülenslik, avirülenslik, toksin, enzim ve hormon üretimini kodlayan) vardır. Farklı patojenlerde bu tür genlerin baz dizilişleri, genlerin kromozom üzerindeki dağılımları ve tekrarlanma sıklıkları hakkında elde edilen genetik bilgiler patojenin kimliğini açıklamaktadır. O nedenle yukarıda bahsedilen genlerden bir veya bir kaçı için spesifik olarak sentezlenen oligonükleotit primerler yardımı ile farklı patojenlerden izole edilen genetik materyaller PCR ile kolayca amplifiye edilmektedir. Elde edilen PCR ürünlerinin agoroz jel üzerinde elektroforez edilmesiyle patojene spesifik bant veya bant profilleri belirlenerek hastalığa neden olan etmenin tanısı ve aynı zaman da hastalığın teşhisi yapılmaktadır (Miller ve Joaquim, 1993).
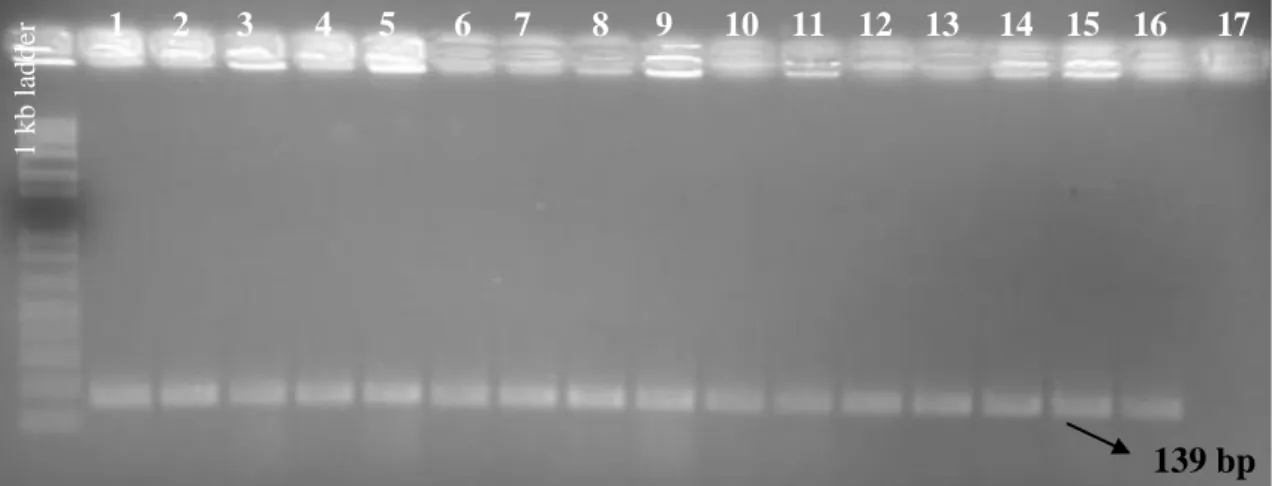
Maes ve ark. (1996) yılında tohumla taşınan ve tahıllarda yaprak yanıklığına neden olan X. translucens izolatlarını C1-C2 ve T1-T2 primerlerini kullanarak amplifiye etmişler, elde edilen PCR ürünlerini elektroforez sisteminde görüntüleyerek 139 bp bant oluşturanları X. translucens olarak tanımlamışlardır.
Bragard ve ark., (1997) 15 çim türünden izole edilen X. translucens olduğu düşünülen 68 izolatı, arpa, ekmeklik buğday, yulaf ve brom çeşitlerinde patojenisite testi, AFLP, yağ asiti analizleri (FAME) ve protein ekstraktının sodyum dodesil sülfat-poliakrilamid jel elektroforezi ile incelemişlerdir. X. translucens streynleri arpa ve ekmeklik buğday üzerinde görülen farklılıklara göre üç patojenisite grubuna ayırmışlardır.
Kölliker ve ark. (2006) tarafından 3 italyan çim çeşidi üzerinde patolojik görüntüleme ve AFLP analizi, 16S rDNA dizilimi kullanılarak X. t. pv. graminis‟in genetik çeşitliliğini, yem çayırlarında bakteriyel solgunluğa sebep olan faktörleri incelemişlerdir. Bu analizin amacı X. t. pv. graminis ırkını ve çoğrafik çeşitliliğinin iç
yüzünü anlama, dayanıklı bitki geliştirmeyi ve bitki koruma için stratejilerin geliştirilmesini sağlamak içindir. 306 polimorfik markör ve Nei ve Li‟nin kat sayılarına dayanarak %90 benzerlik ile farklı iki UPGMA (aritmetik ortalama kullanarak ağırlıksız gruplama yöntemi) kümesi ve AFLP analizi sonucunda X. t. pv. graminis olduğu varsayılan 29 izolatın 28‟inin pv. translucens, 1‟i X. t. pv. arrhenatheri olarak tanımlanmıştır. Coğrafik bölgelerin genetik çeşitliliğe önemli etkisi AFLP markörleri ve rakım, enlem ve boylam değişkenleri kullanılarak çoklu analizlerle saptanmıştır.
Raja ve ark. (2010) Pakistanın en önemli besin ürünü olan buğdayda X. t. pv. undulosa hastalığı nedeniyle verimde %20 kayıp olduğunu bildirmişlerdir. Hastalığın görülme oranı farklı buğday çesitlerinde (%10-83) değişken olurken, aynı buğday çeşitinde bakteriyel izolatların reaksiyonun (%0-72) olarak belirlemişlerdir.
Adhikari ve ark. (2011) tarafından North Dakota‟nın beş bölgesinden 226 X. t. pv. undulosa streyni tanılamışlar, 12 buğday çeşidi ve diğer tahıl konukçulara streynleri inokule etmişlerdir. Bütün streynlerin genetik farklılığını rep-PCR ve IS-PCR kullanarak tanımlamışlardır. Patojen populasyonları arasında coğrafi olarak istatistiki farklılıklar bulmuşlardır.
Iqbal ve ark. (2013) yılında Pakistan‟nın Punjab bölegesinde tarım yapılan sekiz farklı ekolojik bölgeden buğdayda bakteriyel yaprak yanıklığı etmeni olan X. t. pv. undulosa simptomları gösteren elli farklı buğday yaprağı toplamışlar ve bunlardan yirmi beş tanesini saflaştırmışlardır. Hasta buğday yapraklarından izole edilen patojen koloni morfolojisi, biyokimyasal, patojenisite testleri ile teşhis edilmiştir. Moleküler olarak 16S-23S rDNA bölgesi primeri olan C1-C2 ve spesifik primer olan T1-T2 birlikte kullanılmıştır. C1-C2 primerleriyle amplifiye edilem PCR ürünleri 300 bp bant oluşturarak patojenin Xanthomonas olduğu, T1-T2 primerleriyle amplifiye edilen PCR ürünleri 200 bp bant oluşturarak patojenin X. t. pv. undulosa olduğunu bildirmişlerdir.
Adriko ve ark. (2014) çalışmalarında gumD, ITS ve fyuA olarak adlandırılan 3 gen bölgesini hedefleyerek primer seti geliştirmişlerdir. X. t. pv. translucens, X. t. pv. undulosa I. grup Xanthomonaslar içinde X-fyuA ve X-ITS primerleri geliştirilerek teşhis etmişlerdir.
Charkhabi ve ark. (2015) dünya çapında buğday da önemli bir hastalık olan X. t. pv. cerealis‟in mücadelesinde kullanılan yöntemlerin yetersiz kalması üzerine dayanıklı genotip kullanmanın en etkili yol olacağını düşünmektedirler, bunun için Kerman bölgesinden toplanan ve saflaştırılan 20 X. t. pv. cerealis izolatı PABr/PBf primer çifti kullanılarak PCR amplifiye edilmiş ve 120bp bant oluşturan 9 izolat X. t. pv. graminis
olarak tanımlanmıştır. Patojenisitesi yüksek olan 6 izolat 645 buğday, arpa, çavdar çeşidine verilmiş 2 çavdar ırkı dayanıklı bulunmuştur. Bu iki çeşidin dayanıklı çavdar ve tritikale genotiplerinin geliştirilmesinde kullanılabileceğini tesbit etmişlerdir.
Ülkemizde etmenin varlığı ilk kez Demir ve Üstün (1992) tarafından Ege Bölgesinde belirlenmiştir. Araştırıcıların yaptıkları çalışmada, Ege Tarımsal Araştırma Enstitüsü buğday deneme parsellerinde görülen hastalıklı bitkilerden bakteri izole etmiş ve yapay inokulasyonlarla patojenliği belirlemiştir. İzolatları morfolojik, fizyolojik ve biyokimyasal özelliklerine göre Xanthomonas campestris pv. translucens olarak tanılamışlardır. Buğday izolatlarının arpa, çavdar, çeltik ve triticale yanında bazı yabani Gramineae türlerini de hastalandırdığını belirlemiş Ege bölgesinde yaygın üretimi yapılan ekmeklik ve makarnalık buğday çeşitlerinin X. c. pv. translucens'e duyarlı olduğu bu çeşitler içinde Ege 88 çeşidinin ise çok duyarlı olduğunu saptamışlardır.
Baştaş ve ark. (2011) yılında Konya ilinde yaygın olarak ekimi yapılan 36 farklı buğday çeşidini incelemişler etmenin izolasyon ve tanısında biyokimyasal, patojenisite testleri ve moleküler tanı yöntemlerini kullanmışlardır. PCR ile tanıda spesifik oligo nükleotid primerleri olan T1 ve T2 kullanılarak 139 bp‟lik spesifik bantları elde etmişlerdir. 265 adet buğday tohumu örneğinden 72 örneğin X. translucens ile bulaşık olduğunu tespit etmişlerdir. İncelenen buğday çeşitleri içersinde, X. translucens en fazla Gerek 79 (%63.63) ve en az Yıldız 98 (%6.25) çeşidi tohumlarından izole etmişlerdir. Etmenin, tüm buğday tohumlarındaki genel yüzde bulaşıklılık oranını %27.16 olarak belirlemişlerdir.
Hububat bitkilerinde, ülkemizde yapılan çalışmalarda Xanthomonas translucens (Sands ve Fourest, 1989; Demir and Üstün, 1992 ve Bastas ve ark., 2011)‟ den ibarettir. Görüldüğü gibi ülkemizde tahıllardaki bakteriyel hastalıklarla ilgili çalışma yok denecek kadar azdır. Bu açıdan yürütülen çalışma ilerki çalışmalara temel oluşturması ve ıslah çalışmalarına yardımcı olabilmesi yönüyle önem arz etmektedir.
3. MATERYAL VE YÖNTEM
3.1. Materyal
3.1.1. Bakteriyel izolatlar
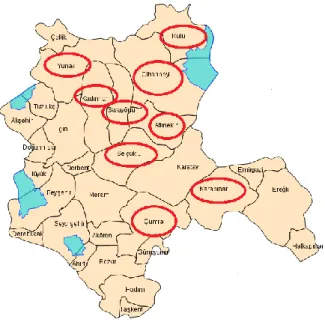
2007-2010 yılları arasında İç Anadolu Bölgesinden toplanan buğday tohumlarından izole edilen ve Selçuk Üniversitesi Ziraat Fakültesi Bitki Koruma Bölümü kültür koleksiyonunda bulunan bakterilerden rastgele seçilen 60 adet X. translucens izolatı, çalışma esnasından farklı tarlalardan simptomatolojik olarak tipik belirtiler gösteren buğday ve arpa bitkilerinden izole edilen 10 adet Xanthomonas translucens izolatı çalışmanın ana materyalini oluşturmaktadır. Araştırmamızda kullanılan ve kültür koleksiyonundan alınan 60 adet izolat, Konya ilinde buğday üretimi en fazla yapılan ilçelerden izole edilen kültürlerden rastgele seçilmiştir. Bu ilçeler Şekil 2‟de gösterilmiştir. Ayrıca denemelerde kullanılan Xanthomonas translucens (Xt3024) referans izolatı (Ankara Zirai Mücadele Araştırma Enstitüsü) ve negatif kontrol olarak kullanılan X.axonopodis pv. phaseoli (XaP23) izolatı (Selçuk Üniversitesi Ziraat Fakültesi Bitki Koruma Bölümü kültür koleksiyonu) oluşturmuştur.
Bitki materyali olarak, buğday (Triticum aestivum), arpa (Hordeum vulgare), yulaf (Avena sativa), çavdar (Secale cereale), tritikale (X Triticosecale) ve brom(Bromus inermis) bitkileri kullanılmış, bu bitkilerin tohumları S.Ü. Ziraat Fakültesi Tarla Bitkileri Bölümünden temin edilmişlerdir.
3.1.2. Kullanılan kimyasal, alet ve ekipman
Denemede kimyasal olarak; Nutrient Agar (NA) ve King B (KB) besiyerleri, NaCl, EDTA (etilendiamin tetra asetik asitmagnezyum bromid, 100 gr Merck 108409) Tris HCl, Titriplex III, Borik Asit, Cystein hydrocloride, Yeast extract, proteose pepton, K2HPO4, KH2PO4, Agar-Agar, Glycerol, Etanol, 6,5X Yükleme Boyası (Loading Dye) (Bromofenol mavisi 30,0 mg, 5XTBE 4,25 ml, Gliserin 5,75 ml), 5XTBE Tamponu (pH= 8)(Tris 54 g, Borik asit 27.5 g, EDTA 20 ml 0.5 M, Steril destile su 500 ml), 1xTBE Tamponu (100 ml 5XTBE, 500 ml steril destile su), PCR Master Mix (ThermoFisher Sciencetific PCR master mix (2X), spesifik oligonükleoitid primerler, marker (Fermantas100 bp Plus DNALadder SM 1153), kullanılmıştır.
Denemede alet ve ekipman olarak; Termal Cycler (Eppendorf Mastercycler Personal), Yatay Elektroforez Tankı (Thermo), Vorteks (WiseMix), Isı Bloğu (Techne), Hassas Terazi (Precisa), Jel Görüntüleme Sistemi (Prizma Quantum), Çalkalayıcı (Heidolph), Santrifüj (WiseSpin), pH metre, Mikropipet (20 μl, 100 μl, 200 μl, 1000 μl), otoklav, inkübatör (Nüve), Laminar kabin (Nüve) Eppendorf Tüpler (2 ml, 0.2 ml), laboratuar malzemeleri (petri kabı, beher, erlen, cam baget, lam, lamel, cam tüp, pipet, piset, öze) kullanılmıştır.
3.2. Yöntem
3.2.1. Xanthomonas translucens’in izolasyonu
Üretim alanlarından tipik hastalık simptomu gösteren buğday ve arpa bitkilerinin yaprak ve gövde kısımlarından örnekler alınmıştır. Hasta ve sağlıklı doku kısımlarını içeren bitki parçaları musluk suyunda iyice yıkandıktan sonra üç kere steril saf sudan geçirilerek yüzey sterilizasyonu sağlanmış, içinde steril su bulunan havanlarda ezilmiştir. Elde edilen ekstraktan 80 μl alınarak XTS besi yerine çizimler yapılmıştır. 28oC‟de 36-48 saatlik inkübasyondan sonra gelişen sarı renkli koloniler saflaştırılmış ve çalışmada kullanılmıştır (Rudolph ve ark., 1990).
3.2.2. Bakteriyel izolatların geliĢtirilmesi
Denemede kullanılan 70 adet X. translucens izolatı NA, KB, XTS, YDC besiyerlerine çizilip 28 ºC‟ de inkübe edilerek gelişimleri sağlanmıştır.
Nutrient Agar (NA) Besi yeri (Lelliot ve Stead, 1987)
g/L
Nutrient agar 13
Distile su 1
121oC‟de 15 dakika otoklav edilmiştir.
King B Besi Yeri (King ve ark, 1954)
g/L Proteose Peptone 20.0 Gliserin 0.01 K2HPO4 1.5 MgSO47H2O 1.5 Agar 15.0 Distile Su 1
121oC‟de 15 dakika otoklav edilmiştir.
XTS Besi Yeri (Schaad ve Forster, 1985)
g/L
Glukoz 5
Nutrient agar 23
Distile su 1
121oC‟de 15 dakika otoklav edildikten sonra 45oC‟ye soğutulup aşağıdaki antibiyotikler stok solüsyona eklenir.
L Cycloheximide (100 mg/ml, %75‟lik ethanol) 0.002 Cephalexin (10 mg/ml, %75‟lik ethanol) 0.001 Gentamycin (10 mg/ml, %75‟lik ethanol) 0.008
Yeast Extract-Dextrose-Kalsiyum Karbonat Agar (YDC) Besi Yeri (Schaad, 1988) g/L Yeast extract 10 Dextrose 20 Kalsiyum karbonat 20 Agar 15 Distile su 1 121oC‟de 15 dakika otoklav edilmiştir.
SX Agar Besi Yeri (Schaad ve White, 1974).
g/L Nişasta 10 Beef extract 1 Ammonium chloride 5 K2HPO4 2 Methyl violet 2B 0.001 Methyl green 0.002 Agar 15
121oC‟de 15 dakika otoklav edildikten sonra 45oC‟ye soğutulup aşağıdaki antibiyotikler stok solüsyona eklenir.
L Cycloheximide (100mg/ml %75‟lik ethanol) 0.005
3.2.3. Etmenin tanısı
3.2.3.1. Koloni morfolojisi
Nutrient Agar (NA), YDC agar, XTS Agar besi yerine çizilen buğday bakteriyel yanıklık izolatları ve orijinal bakteri kültürleri 48-60 saat 28oC‟de inkübasyondan sonra koloni gelişimine göre değerlendirilmişlerdir (Lelliot ve Stead, 1987; Schaad, 1988).
3.2.3.2. Biyokimyasal testler
X. translucens için gram reaksiyonu (%3‟lük KOH testi), oksidaz reaksiyonu (Kovacs, 1956), arginine dihiydrolase testi (Thornley, 1960), King B besi yerinde fluoresan pigment oluşumu, L(+) Arginine dehidrolaz aktivitesi, H2S üretimi, tütün yaprağında aşırı duyarlılık reaksiyonu (Klement, 1963; Klement ve ark., 1990; Lelliott ve Stead, 1987; Mohan ve ark., 1987) yapılarak elde edilen fitopatojen bakterilerin biyokimyasal özellikleri belirlenmiştir. Her bir test aynı sartlarda 3 kez tekrarlanmıştır.
3.2.3.2.1. Gram reaksiyon testi
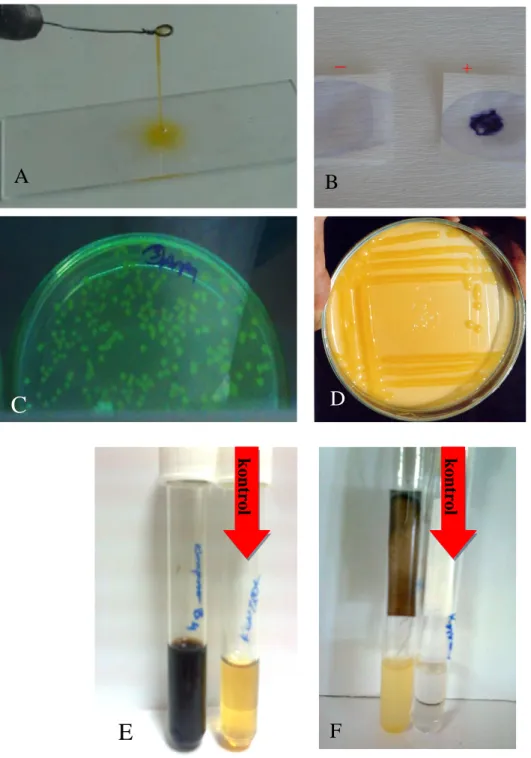
Bakteri izolatların hücre duvarlarındaki farklılığı belirleyebilmek için bir lam üzerine, %3‟lük KOH çözeltisinden bir damla damlatılmıştır. Ardından NA üzerinde geliştirilen 24–48 saatlik bakteri kültüründen öze ile alınarak KOH çözeltisi ile 5–10 s karıştırıldıktan sonra öze yukarıya doğru kaldırılmıştır. Gram negatif özellikte olan mikroorganizmalarda hücre duvarındaki peptidoglukan tabakası tek katlı olup, teikoik asit içermediğinden KOH ile kolayca parçalanmış, sitoplazma sıvısı serbest hale geçmesi ile bunun sonucunda da viskoz bir uzama görülmesi beklenilmiştir. X. translucens pozitif olarak kabul edilmiştir (Saygılı, 1995).
3.2.3.2.2. YDC’de mukoid geliĢim
YDC besi yerine çizilen X. translucens izolatları ve referans kültürler 48-60 saat 25 oC‟de inkübasyondan sonra sarı koloni gelişimine göre değerlendirilmiştir (Lellito ve Stead, 1987).
3.2.3.2.3. 35 oC’de geliĢim
NA besi yerine çizilen X. translucens izolatları ve referans kültürler 35 oC‟de 48-60 saat inkübasyonda sonra sarı koloni gelişimine göre değerlendirilmiştir (Lellito ve Stead, 1987).
3.2.3.2.4. XTS’de geliĢim
XTS besi yerine çizilen X. translucens izolatları ve referans kültürler 28 oC‟de 36-48 saat inkübasyonda sonra sarı koloni gelişimine göre değerlendirilmiştir (Schaad ve Forster, 1985).
3.2.3.2.5. SX besi yerinde geliĢim
SX besi yerine çizilen X. translucens izolatları ve referans kültürler 28 oC‟de 36-48 saat inkübasyonda sonra sarı koloni gelişmemesine göre değerlendirilmiştir (Schaad ve White, 1974).
3.2.3.2.6. Arjinin dehidrolaz testi (Arginine Dehydrolase Test)
Mikroorganizmaların bu özelliğini belirtmek için yapılan bu testte Thornley 2A besi yeri kullanılmıştır.
g/L Pepton 1 NaCl 5 K2HPO4 0,3 Agar 3 L+HCl arginine 10 Destile su 1 pH: 7,2
Tüplere 3 ml konulan besiyeri 121 ºC‟de 1.5 atm basıçta sterilize edilmiştir. Sonra tüplere öze ile bakteri kültürü aşılanmıştır ve tüplerin üzerine 2 ml steril parafin konulmuştur. Kültürler 27 ºC‟de 7–15 gün süre ile inkübe edilmiştir. Bakterinin Arginine‟i kullanması sonucu meydana gelen pembemsi kırmızı renk pozitif, açık pembe renk ise negatif sonuç olarak değerlendirilmiştir (Thornley, 1960)
3.2.3.2.7. Oksidaz testi
g/L
Tetra methyl-p-phenylendiamine dihydrochloride 1
Destile su 0.1
24-48 saatlik kolonilerden, öze yardımı ile bir miktar alınarak ve filtre kağıdı üzerine damlatılan %1‟lik Tetra methyl-p-phenylendiamine dihydrochloride iyice sürülmüştür. Bu işlemin sonucunda bakteri solüsyon karışımı;
10-60 saniye içinde maviye dönüşmüşlerse pozitif 60 saniye sonra maviye dönüşürse geç pozitif 60 saniye sonra maviye dönüşmezse negatif olarak kabul değerlendirilmiştir ( Kovacs, 1956).
3.2.3.2.8. Esculinin hidrolizi
Bakteriyel izolatların esculin hidrolizini belirlemek için aşağıda verilen besiyeri hazırlanmıştır. g/L Yeast extract 5 NaCl 5 MgSO4.7H2O 0,2 K2HPO4 0.5 NH4H2PO4 0.5 Destile su 1
Ferric ammonium citrate 0.5
Esculin 1
pH: 6,8
Yukarıda verilen besiyerinin pH‟ı 6.8‟e ayarlanmış ve otoklavda sterilize edilmiştir. Tüplere 5 er ml dağıtılan besiyeri üzerine bakteri ekimi yapıldıktan sonra 28 ºC‟de çalkalayıcıda 28 gün bekletilmiştir. Besi yeri kahverengi-siyah arası renk alanlar pozitif olarak değerlendirilmiştir (Sneath, 1956; Schaad, 1988).
3.2.3.2.9. Cysteinden hidrojen sülfit (H2S) oluĢumu
Aşağıda verilen besi yeri tüplere 5 ml konularak otoklavda sterilize edilmiştir. Bu tüplere bakteri aşılanmıştır. 5 mm genişlikte kesilen kurutma kağıtları %5‟lik kurşun asetat içine batırılmış, kurutulmuş ve otoklavda sterilize edilmiştir. Bu kağıtlar bakteri aşılanan tüplere yukarıdan aşağıya doğru sarkıtılmıştır. Bu tüpler 14 gün boyunca incelenmiştir. İnokule edilen bakteriler, sülfür içeren aminoasitlerden H2S oluştururlar. H2S meydana gelmesi tüplerdeki kurşun asetatlı kağıtların siyahlaşmasına neden olur. Tüplerdeki kurutma kağıdının siyah renk alması pozif olarak değerlendirilmiştir (Dye, 1968). gr/L NH4H2PO4 0.5 K2HPO4 0.5 MgSO4.7H2O 0.2 Yeast extract 0.2 Cystein hydrocloride 0.1 Distile su 1
3.2.3.2.10. Floresan pigment üretimi
Floresan pigment üreten izolatların belirlenmesi amacıyla, King B besiyeri hazırlanmıştır. Her bir izolat katılaşan besi yerine çizildikten sonra, 25 ºC‟ye ayarlı inkübatörde 2 gün süreyle inkübe edilmiştir. Gelişen kültürler, ultraviyole lamba altında, karanlık odada gözlemlenmiştir, yeşil floresan pigment üretenler pozitif, diğerleri negatif olarak değerlendirilmiştir (King ve ark., 1954; Fahy ve Persley, 1983; Lelliot ve Stead, 1987). 3.2.3.2.11. Üreaz aktivitesi g/L NH4H2PO4 0.5 K2HPO4 0.5 MgSO4.7H2O 0.2 NACI 5 Yeast extract 1.0
Crezol kırmızısı 0.016
Distile su 0.8
Bu maddeler tartılarak bir erlen içine konur ve sterilize edilerek 55 ºC‟ye ayarlı su banyosuna konur. Diğer taraftan %10‟luk urea solüsyonu steril filtrden geçirilir ve son konsantrasyon %2 olacak şekilde 200 ml tamamlanır. Tüplere 5 ml konur. Ortamda yeast extract olduğundan, tüpler üreli ve üresiz olmak üzere iki gruba ayrılarak aşılanır. Tüpler 7 gün sonra kontrol edilir. Üre amonyağa dönüşürse, pH değeri alkali yönde değişir. Bunlar pozitif olarak değerlendirilmiştir (Schaad, 2001).
3.2.3.2.12. Arbinozdan asit oluĢumu
Bu test için birçok besi yeri geliştirilmiştir. Karbonhidratlar, genel de otoklavda yüksek sıcaklıkta bozulduklarından, bakteri filtreleri veya tindalizasyon yolu ile steril edilir.
g/L
Pepton 10
Bromeresol purple(%1.5 etanol solüsyonu) 0.07
Distile su 1
Yukarıda verilen besi yeri hazırlanır ve yüplere 4.5 ml konur. Otoklavda 121 ºC‟de 15 dk sterilize edilir. Testte kullanılacak karbonhidrattan 10 g tartılır ve 100 ml suda eritilir. Daha sonra yukarıda belirtildiği gibi bakteri filtreleri veya tindalizasyon yolu ile steril edilir. Steril edlip 45-50 ºC‟ye soğutulan besi yerleri üzerine, steril edilen karbonhidrattan 0.5 ml eklenir.
Yukarıda hazırlanan tüplere, bakteri aşılanır ve bakteri türüne göre 24-27 ºC‟de inkübe edilir. Eğer asit oluşmuşsa, tüplerde renk değişimi olur (sarıya döner). Bu şekilde değişim pozitif olarak değerlendirilmiştir (Schaad, 2001).
3.2.3.3. Patojenisite testleri
Stok kültürden NA besi yerine transfer edilmiş 48-72 saatlik kültürlerinden, bakteri konsantrasyonu 108 hücre/ml olacak şekilde ayarlanarak hazırlanan solüsyonlar, kontrollü koşullarda saksılarda yetiştirilen (her bitki için 30–40 tohum olacak şekilde) ve çıkıştan sonra 20–30 günlük buğday, arpa, yulaf, çavdar, tritikale ve brom bitkilerine küçük basınçlı el pülverizatörü ile püskürtülerek inoküle edilmiştir. Negatif kontrol
olarak steril saf su bitkilere püskürtülmüştür. Bitkiler etiketlenerek 24 saat içleri nemlendirilmiş polietilen poşetlerle kapatılmış ve poşetler çıkarılmıştır. Bitkiler 27-28 oC‟de ve %80-85 nispi nemdeki geliştirme odasında tutulmuşlardır. İnokulasyondan 7-10 gün sonra yapraklarda tipik bakteriyel belirtiler gözlenmiştir. Simptom oluşan dokulardan patojenin yeniden izolasyonu ve tanısı yapılmıştır (Taylor, 1970; Lelliot ve Stead, 1987).
3.2.3.4. Tütünde aĢırı duyarlılık (Hipersensitive reaction) testi
Bakteriyel izolatlar NA besiyerinde 48 saat ve 28 °C‟de geliştirilmiş 108 hücre/ml yoğunlukta süspansiyonları hazırlanmıştır. Süspansiyonlar 3cc‟lik plastik enjektörlerle tütün (Nicotiana tabacum var. White Burley, var. Rustica ve var. Benthamiana) yapraklarına enjekte edilmiştir. Bakteri inokule edilen bitkiler 8 saat, aydınlık 16 saat karanlık ve %80 nispi nemli ortamda tutulmuşlardır. Bakteri inokulasyonu yapılan tütün yapraklarında 48 saat içinde nekroz oluşup oluşmadığı tespit edilmiştir. Nekrotik doku oluşumu pozitif reaksiyon olarak değerlendirilmiştir (Klement ve ark.1966, Lelliot ve Stead, 1987).
3.2.3.5. X. translucens’ in re-izolasyonu
Bakterinin bitkiden re-izolasyonunda, hastalıklı bitki yaprağı örnekleri akan musluk suyuyla yıkandıktan sonra, fungal patojenler ve bazı saprofitik mikroorganizmalarla bulaşık olabileceği düşünülen örneklere %0,5 NaOCl‟de 2 dk yüzey sterilizasyonu yapılmıştır. Hastalıklı yapraklar fosfat buffer saline içerisinde ezilerek elde edilen süspansiyon nutrient agara (NA besiyeri; nütrient agar 13g/L) drigalski spatula ile yayılmıştır (Schaad, 2001). 24-48 saatlik inkübasyondan sonra sarı renkteki kolonilerden KB besiyerine (proteose peptone 20 g, K2HPO4.3H2O 1,5 g, MgSO4.7H2O 1,5 g, agar 15 g, glyserol 10 g\L saf su pH=7.2) çizgi ekim yapılarak, gelişen bakterilerin UV lamba altında fluoresan özelliği incelenmiş ve bunu takiben tanılama testleri yapılmıştır (King ve ark., 1954).
Etmenin tanılanmasında morfolojik; hücre ve koloni morfolojisi, hareketlilik testi, biyokimyasal; oksidaz, gram reaksiyon, arginine dehydrolase, esculin‟ in hidrolizi, hidrojen sülfid (H2S) oluşumu, YDC besi yerinde mukoid gelişme, SX besi yerinde
gelişme, XTS besi yerinde gelişme, tütünde aşırı duyarlılık testleri aynı koşullarda her bir test için 3 kez tekrarlanarak yapılmıştır.
3.2.3.6. Moleküler tanılama
3.2.3.6.1. X. translucens izolatlarından DNA izolasyonu
Bakteri izolatlarından DNA izolasyonu, De Boer ve Ward (1995)‟a göre yapılmıştır. Bu yöntemde izlenen prosedür aşağıda verilmiştir.
1. Bakteri izolatları 9ml Nutrient broth sıvı besi yerine aşılanarak 24 saat geliştirilmiştir. 2. Bakteri süspansiyonundan 1ml steril ependorf tüpüne alınmış ve tüplerin ağırlıkları dengelenerek 14.000rpm‟de 20 dk. santrifüj edilmiştir.
3. Pellet alınarak süpernatant atılmıştır. Pelletin üzerine hücre parçalanmasını sağlamak üzere %1‟lik SDS+TAE bufferdan 100μl eklenmiş ve tüp karıştırıcısında karıştırılmıştır. 4. Tüpler 50 oC‟deki su banyosunda 3 saat bekletilmiştir.
5. 7.5M Amonyum asetat (1 ölçeğe yarım ölçek olacak şekilde) eklenerek karıştırılmıştır.
6. 14.000rpm‟de santrifüj yapılarak amonyum asetat artıklarının altta toplanması sağlanmıştır. Üste kalan DNA kesik bir pipet ucu ile alınmış (yaklaşık 130μl) ve yeni bir ependorf tüpüne aktarılmıştır.
7. Buna eşit miktarda (yaklaşık 130μl) derin dondurucuda soğutulmuş isopropanol eklenmiştir. Tüpler derin dondurucuda 45dk. bekletilmiştir.
8. 10.000rpm‟de 10dk. santrifüj yapılarak pellet alınmıştır.
9. Soğutulmuş %70‟lik alkolden 100μl ependorf tüplerine eklenmiş ve 10.000rpm‟de 10 dk. santrifüj yapılarak alkolle yıkama yapılmıştır.
10. Ependorf tüplerinden alkol dökülmüş ve steril kabinde bir saat kurumaya bırakılmıştır.
11. Ependorflar içerisine 40μl bidistile su (ddH2O) konarak tüp karıştırıcısında karıştırılmıştır.
12. Daha sonra bu DNA‟lar %1‟lik hazırlanan agarose jele verilerek izole edilip edilmedikleri tespit edilmiştir. Hazırlanan agaroz jel 70 miliamperde yarım saat yürütüldükten sonra etidyum bromid (10mg/ml) ile boyama yapılmış ve transliminatörde bantlar incelenmiştir.
3.2.3.6.2. X. translucens’in spesifik T1/T2 oligo nükleotit primerler ile klasik PCR çalıĢmaları
X. translucens‟in PCR yöntemi ile tanılanmasında spesifik T1/T2 primerleri kullanılmıştır. Bu primerlerin baz dizilimi aşağıdaki şekildedir.
T1 (5‟CCGCCATAGGGCGGAGCACCCCGAT3‟)
T2(5‟GCAGGTGCGACGTTTGCAGAGGGATCTTCTGCAAA-3‟) primerleri
kullanılmıştır (Maes ve ark., 1996).
PCR solüsyonu 0.2 ml ependorf tüplerde hazırlanmıştır. Solüsyonun içeriği aşağıda verilmiştir; Bakteri DNA 2 μl *PCR Master Mix 12.5 μl Forward primer 2 μl Revers primer 2 μl Steril saf su 6.5 μl Toplam hacim 25 μl
*PCR Master Mix (0.05 ünite/ μl Taq DNA, 4 mM MgCl2, 0.4 mM dATP, 0.4 mM dCTP, 0.4 mM dGTP ve 0.4 mM dTTP )(ThermoFisher Sciencetific PCR master mix (2X)
Termal cycler (Eppendorf Master Cycler Personal) da programlanan PCR protokolü:
90 ˚C‟de 2 dk, inkübasyon 93 ˚C‟de 30 sn, denaturasyon 53 ˚C‟de 45 sn, primer bağlanması 68 ˚C‟de 1 dk, aplikon sentezi 70 ˚C‟de 10 dk, inkübasyon
4 ˚C‟de 20 saat, olacak şekilde programlanarak, istenen DNA bölgelerinin amplifikasyonu yapılmıştır.
PCR ile amplifiye edilen fragmentlerin büyüklüğünün 139 bp olması pozitif olarak değerlendirilmişitir.
3.2.3.6.3. IS-PCR metoduna göre gen profillerinin belirlenmesi
IS-PCR metoduna göre denemede J3 spesifik oligonükleotid primeri kullanılmıştır. Bu primerin baz dizilimi aşağıdaki şekildedir.
J3(5′GCTCAGGTCAGGTCGCCTGG3′) primeri kullanılmıştır (Adhikari ve ark., 1999).
PCR solüsyonu 0.2 ml ependorf tüplerde hazırlanmıştır. Solüsyonun içeriği aşağıda verilmiştir; Bakteri DNA 2 μl *PCR Master Mix 12.5 μl Primer 2 μl Steril saf su 8.5 μl Toplam hacim 25 μl
*PCR Master Mix (0.05 ünite/ μl Taq DNA, 4 mM MgCl2, 0.4 mM dATP, 0.4 mM dCTP, 0.4 mM dGTP ve 0.4 mM dTTP )(ThermoFisher Sciencetific PCR master mix (2X)
Termal cycler (Eppendorf master cycler personal) da programlanan PCR protokolü:
95 ˚C‟de 7 dk, inkübasyon 94 ˚C‟de 1 dk, denaturasyon 68 ˚C‟de 3 dk, primer bağlanması 68 ˚C‟de 3 dk, aplikon sentezi 65 ˚C‟de 15 dk, inkübasyon
4 ˚C‟de 20 saat, ile olacak şekilde programlanarak, istenen DNA bölgelerinin amplifikasyonu yapılmıştır.
PCR ile amplifiye edilen fragmentlerin büyüklüğünün 150-1000 bp arasında olması pozitif sonuç olarak değerlendirilmiştir.
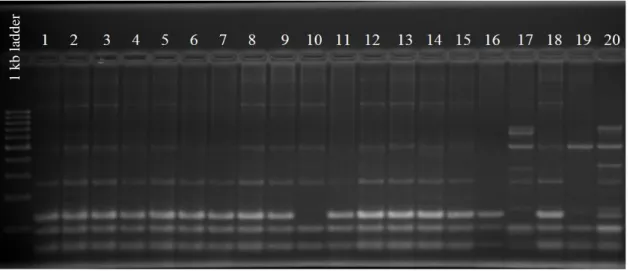
3.2.3.6.4. rep-PCR metoduna göre gen profillerinin belirlenmesi
Rep-PCR metodu ile yürütülen denemelerde ERIC IR ve ERIC 2 spesifik oligonükleotid primerleri kullanılmıştır. Bu primerin baz dizilimi aşağıdaki şekildedir.
primer 1 (ERIC IR; CAC TTA GGG GTC CTC GAA TGT A), primer 2 (ERIC 2; AAG TAA GTG ACT GGG GTG AGC G) kullanılmıştır (Versalovic ve ark., 1991).
PCR solüsyonu 0.2 ml ependorf tüplerde hazırlanmıştır. Solüsyonun içeriği aşağıda verilmiştir; Bakteri DNA 2 μl *PCR Master Mix 12.5 μl Forward primer 2 μl Revers primer 2 μl Steril saf su 6.5 μl Toplam hacim 25 μl
*PCR Master Mix (0.05 ünite/ μl Taq DNA, 4 mM MgCl2, 0.4 mM dATP, 0.4 mM dCTP, 0.4 mM dGTP ve 0.4 mM dTTP) (ThermoFisher Sciencetific PCR master mix (2X)
Termal cycler (Eppendorf master cycler personal) da programlanan PCR protokolü:
95 ˚C‟de 7 dk, inkübasyon 94 ˚C‟de 1 dk, denaturasyon 52 ˚C‟de 1 dk, primer bağlanması 65 ˚C‟de 8 dk, aplikon sentezi 65 ˚C‟de 16 dk, inkübasyon
4 ˚C‟de 20 saat, ile olacak şekilde programlanarak, istenen DNA bölgelerinin amplifikasyonu yapılmıştır.
PCR ile amplifiye edilen fragmentlerin büyüklüğünün 50-1100 bp arasında olması pozitif sonuç olarak değerlendirilmiştir.
3.2.3.6.5. BOX-PCR metoduna göre gen profillerinin belirlenmesi
BOX-PCR metodu ile yürütülen denemelerde BOX A1R spesifik oligonükleotid primerleri kullanılmıştır. Bu primerin baz dizilimi aşağıdaki şekildedir.
Primer BOX A1R (CTA CGG CAA GGC GAC GCT GAC G) primerleri kullanılmıştır (Versalovic ve ark., 1991).
PCR solüsyonu 0.2 ml ependorf tüplerde hazırlanmıştır. Solüsyonun içeriği aşağıda verilmiştir; Bakteri DNA 2 μl *PCR Master Mix 12.5 μl Primer 2 μl Steril saf su 8.5 μl Toplam hacim 25 μl
*PCR Master Mix (0.05 ünite/ μl Taq DNA, 4 mM MgCl2, 0.4 mM dATP, 0.4 mM dCTP, 0.4 mM dGTP ve 0.4 mM dTTP) (ThermoFisher Sciencetific PCR master mix (2X)
Termal cycler (Eppendorf master cycler personal) da programlanan PCR protokolü:
95 ˚C‟de 7 dk, inkübasyon 94 ˚C‟de 1 dk, denaturasyon 52 ˚C‟de 1 dk, primer bağlanması 65 ˚C‟de 8 dk, aplikon sentezi 65 ˚C‟de 16 dk, inkübasyon
4 ˚C‟de 20 saat, ile olacak şekilde programlanarak, istenen DNA bölgelerinin amplifikasyonu yapılmıştır.
PCR ile amplifiye edilen fragmentlerin büyüklüğünün 200-900 bp arasında olması pozitif sonuç olarak değerlendirilmiştir.
3.2.3.6.6. Amplifiye edilen bakteriyel DNA örneklerinin elektroforez sisteminde yürütülmesi ve değerlendirilmesi
PCR ürünleri %1‟ lik agaroz jelde (100 ml 1X TBE buffer solüsyonu, 1 gr agaroz (SeaKem) yaklaşık 50°C‟ye kadar soğutulduktan sonra taraklar yerleştirilmiş agaroz jel tankına dökülmüştür. Agaroz jel donduktan sonra içinde 1X TBE buffer bulunan elektroforez tankı içerisine yerleştirilmiştir. Daha sonra tarak jelden dikkatlice çıkarılmış ve oluşan çukurlara 2 μl (yükleme boyası) loading dye ve 8 μl PCR ürünü karışımı bir mikropipet yardımıyla karıştırılarak çukurlara yüklenilmiştir. PCR ürünleri 75 volt elektrik verilerek yaklaşık 2 saat yürütülmüştür. Oluşan bantların moleküler
ağırlıklarını belirlemek amacıyla 1 kb‟lik moleküler işaretleyici (marker, Fermantas 1 kb Plus DNA Ladder SM 1153) kullanılmıştır. Bantların UV ışık altında görülebilmesi için etidyum bromür ile (0.5 mg etidyum bromür/L steril saf su) 10 dakika bekletilerek boyanmış ve jel steril saf su ile çalkalanmıştır. Etidyum bromür ile boyanan jeller üzerindeki bantlar transiliminatörde oluşan bantlar incelenmiş ve fotoğraflanmıştır (Sambrook, 2001).
3.2.3.7. Soyağacı Analizi
Araştırma sonucunda skorlanabilen bantlar NTSYS-pc 2.1 ile genotipik varyasyonun sergilediği genetik benzerlik dendogramı UPGMA yöntemine göre oluşturulmuştur (Rohlf, 1992).
4. ARAġTIRMA SONUÇLARI ve TARTIġMA
4.1. Buğdaygil Bitkilerine X. translucens’ in Ġnokulasyonu
Sera koşullarında yetiştirilen 20–30 günlük buğday, arpa, yulaf, çavdar, tritikale ve brom bitkilerine küçük basınçlı el pülverizatörü ile püskürtülerek X. translucens inokule edilmiş ve 7-10. günde tipik hastalık simptomları gözlenmiştir.
Denemelerde kullanılan 70 X. translucens izolatından 68 adedi buğdaylarda, 2 adedi arpada simptom oluşturuken yulaf, çavdar, tritikale ve brom bitkilerinde simptom belirlenmemiştir.
ġekil 3. X. translucens‟ in inokulasyonundan bir hafta sonra oluşan tipik yaprak lekeleri.
Elde edilen simptomatolojik bulgulara göre; 68 izolatın X. t. pv. translucens olabileceği belirlenmiştir.
Bragard ve ark. (1997), 15 çim türünden izole edilen X. translucens olduğu düşünülen 68 izolatı, arpa, ekmeklik buğday, yulaf ve brom çeşitlerine inokule etmişler ve hepsinde farklı şiddette hastalık simptomlarını gözlemlediklerini bildirmişlerdir. Buğday
Arpa
Buğday Buğday
Bragard ve ark. (1995), buğdaydan izole edilen strainlerin triticale, çavdar, brom, arpa ve kuş yeminde tipik simptom oluşturduğunu belirtmişlerdir.
Maes v ark. (1996), Duveiller ve ark. (1997), Raja ve ark. (2010), Baştaş ve ark. (2011), Charkhabi ve ark. (2015), buğdaydan izole ettikleri izolatları tekrar buğday bitkisine inokule ederek tipik simptomları gözlemlemişlerdir.
4.2. X. translucens’ in Re-izolasyonu ve Tanılanması
X. translucens‟ in inokulasyonu ile oluşan simptomların etmen tarafından oluşturulup oluşturulmadığının desteklenmesi ve Koch postulatlarının uygulanması amacıyla etmenin re-izolasyon ve biyokimyasal, morfolojik, fizyolojik ve moleküler tanılama testleri yapılmıştır (Çizelge 1). Elde edilen bulgulara göre tüm izolatlar X. translucens olarak tanılanmışlardır. Kullanılan testler ve elde edilen bulgular (Duveiller ve ark., 1989; Sands ve Fourest, 1989; Young ve ark., 1996; Raja ve ark., 2010; Iqbal ve ark., 2013; Charkhabi ve ark., 2015) çalışmalarını destekler yönde bulunmuştur.
Çizelge 1. Enfeksiyon sonrası re-izolasyonu yapılan X. translucens'in tanılanması için yapılan testler ve
elde edilen bulgular (Schaad ve ark., 2001)
Testler X. translucens (referans izolat;Xt3024) Elde edilen X. translucens izolatları X. axonopodis pv.phaseoli (XaP23)
Gram Reaksiyon (%3‟lük KOH) _ _ _
35°C‟ de gelişme + + +
KB Besiyerinde fluoresan
pigment oluşumu _
_ _
XTS Besiyerinde gelişim + + _
YDC besi yerinde mukoid
gelişme + + +
SX besiyerinde gelişim _ _ +
Tütünde hipersensitif reaksiyon + + +
Esculinin hidrolizi + + +
Litmus milk testi Alkali Alkali Alkali
Üreaz aktivitesi _ _ _
Arginin dehidrolaz _ _ _
Oksidaz _ _ _
Arabinozdan asit oluşumu + + _
Sisteinden H2S oluşumu + + +