T.C
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI
YENİDOĞAN SEPSİSİNDE IL- 6, IL- 8,
TNF- α VE CRP’NİN TANI VE
PROGNOZDAKİ YERİ
(UZMANLIK TEZİ) Dr. Ruken YILDIRIM
TEZ YÖNETİCİSİ
Prof. Dr. M. Celal DEVECİOĞLU
TEŞEKKÜR
Uzmanlık eğitimim süresince bilgi ve tecrübelerinden yararlandığım değerli hocalarım; Anabilim Dalı Başkanımız Prof. Dr. Mehmet Ali TAŞ, tezimin her aşamasında büyük katkı ve desteği olan Prof. Dr. Celal DEVECİOGLU, diğer hocalarım Prof. Dr. Kenan HASPOLAT, Prof. Dr. Aydın ECE, Prof. Dr. Fuat GÜRKAN, Prof. Dr. Murat SÖKER, Doç. Dr. Mehmet BOŞNAK, Doç. Dr. Selahattin KATAR, Doç. Dr. Bünyamin DİKİCİ, Doç. Dr. Mehmet KERVANCIOĞLU, Yrd. Doç. Dr. Ayfer GÖZÜ, Yrd. Doç. Dr. Sultan MENTEŞ ECER, Yrd. Doç. Dr. Fatma ÇELİK, Yrd. Doç. Dr. Mustafa TAŞKESEN’ e ve tezimin istatistiksel analizinde yardımlarını esirgemeyen değerli hocam Prof. Dr. Yusuf ÇELİK’ e teşekkür ederim.
Uzmanlık eğitimimin her aşamasında ve hayatım boyunca her konuda desteklerini esirgemeyen aileme, bunun yanında tüm doktor, hemşire ve personel çalışma arkadaşlarıma ilgi ve yardımlarından dolayı teşekkür ederim.
Dr. Ruken Yıldırım Diyarbakır–2008
İÇİNDEKİLER
TEŞEKKÜR……….….…..ІІІ İÇİNDEKİLER………...VІ KISALTMALAR……… V TABLOLAR VE ŞEKİLLER………..……..VІІ GİRİŞ VE AMAÇ……….1 GENEL BİLGİLER………..2 MATERYEL VE METOD……….…31 BULGULAR………...33 TARTIŞMA………41 SONUÇLAR………...49 ÖZET………..51 SUMMARY………53 KAYNAKLAR………...55KISALTMALAR
CRP : C-reaktif protein Ig : İmmünglobulin
TNF : Tümör Nekroze eden Faktör IL : İnterlökin
ENS : Erken neonatal sepsis GNS : Geç neonatal sepsis NKE : Nozokomial enfenksiyon GBS : Grup B Streptokok EMR : Erken membran rüptürü KNS : Koagülaz negatif stafilokok
Gr : Gram
RDS : Respiratuar distress sendromu BPD : Bronko pulmoner displazi
DİK : Dissemine intravasküler koagülapati BOS : Beyin omurilik sıvısı
LP : Lomber ponksiyon NEK : Nekrotizan enterokolit İLS : İmmatür lökosit sayısı MNS : Mutlak nötrofil sayısı TLS : Total lökosit sayısı PCT : Prokalsitonin SAA : Serum amiloid A
MAS : Mekonyum aspirasyon sendromu
ELBW : İleri derecede düşük doğum tartılı bebekler G-CSF : Granülosit koloni stimülan faktör
DM : Diabetes mellitus
SLE : Sistemik lupus eritamatozus HIE : Hipoksik iskemik ansefalopati
GFR : Glomerüler filtrasyon hızı AG : Aminoglikozit
SS : Sefalosporin
MRSA : Metisiline rezistan stafilokok aureus ALT : Serum alanin transaminaz
TDP : Taze donmuş plazma IVIG : İntravenöz İmmünglobulin CIE : Counterimmunelektroforez ADH : Antidiüretik faktör
TABLOLAR ÇiZELGESi
Tablo 1: Erken ve geç sepsisin özellikleri………3
Tablo 2: Erken ve geç sepsis etkenleri……….9
Tablo 3: Töllner skorlaması………13
Tablo 4: Rodwell skorlaması sistemi………..18
Tablo 5:Olguların yaş ve cinse göre dağılımı ……..………..33
Tablo 6:Sepsisli olguların klinik belirti ve bulguları………..34
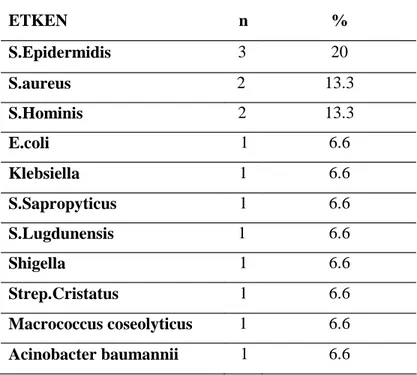
Tablo 7:Sepsisli olguların kan kültürü sonuçları………...……….34
Tablo 8:Erken ve geç sepsisli olguların kan kültürü sonuçları…….………..35
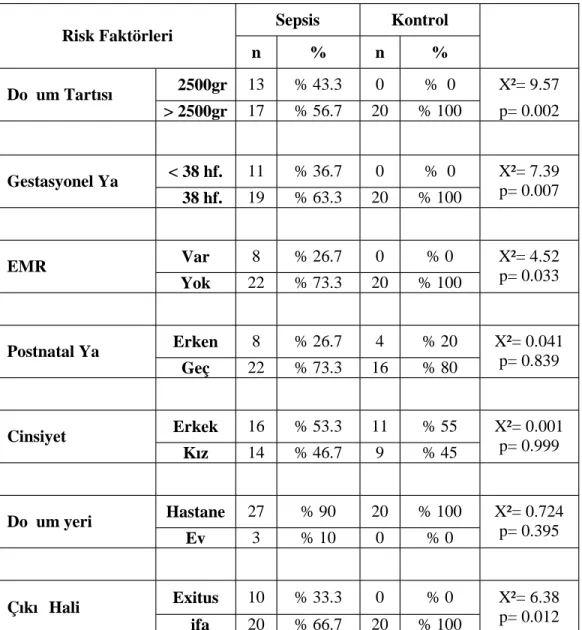
Tablo 9: Sepsis ve kontrol grupları arasında risk faktörlerinin karşılaştırılması……36
Tablo10:Erken ve geç sepsis olgularının mortalite ve hemokültür pozitifliği yönünden karşılaştırması………..………..37
Tablo11:Sepsis grubunda bakılan bazı parametreler………..38
Tablo12:Kan kültüründe üreme olan ve olmayan sepsislerde IL-6, IL8, TNF-α ve CRP düzeyleri……….38
Tablo13:Erken ve Geç başlangıçlı sepsislerde IL-6, IL8, TNF-α ve CRP düzeyleri……….39
Tablo14:Sepsis ve kontrol gruplarında IL-6, IL-8, TNF-α ve CRP düzeyleri….…..39
Tablo15: Sepsisli hastalarda IL-6, IL8, TNF-α ve CRP düzeylerinin prognoz ile ilişkisi………..40
ŞEKİLLER ÇİZELGESİ
Sekil-1: 35 haftadan büyük ve birden fazla risk faktörü olan asemptomatik bebeğe yaklaşım………..27GİRİŞ VE AMAÇ
Yenidoğan sepsisi, hayatın ilk bir ayında ortaya çıkan bakteriyemi ile birlikte görülen sistemik bulguları tanımlamak için kullanılır (1). Görülme sıklığı her bin canlı doğumda 1-8 arasında olan yenidoğan sepsisi uygulanan çok çeşitli tedavi yöntemlerine, son yıllarda antibiyotik kullanım alanında gelişmelere rağmen günümüzde halen hem term; hem de preterm olarak doğan çocukların önemli bir sağlık problemi olarak gündemdeki yerini korumaktadır (2).
Kliniğinin hızlı ve fatal seyretmesinden dolayı tanının erken konulması ve tedaviye erken başlanması gerekir. Yenidoğan hastalarda sepsis tanısı koymak güçtür, çünkü belirti ve bulgularla diğer neonatal distres nedenlerinden ayırt etmek oldukça zordur. Bu durum mortalite ve morbiditesinin yüksek olması nedeniyle sepsis olmayan ama sepsisi taklit eden yenidoğanlarda gereksiz olarak antibiyotik kullanma riskini de beraberinde getirir. Bu nedenle her hastanın ele alınmasında klinisyen dikkatli bir değerlendirme yapmalıdır. Hastanın ayrıntılı perinatal hikayesi, geliş semptomları ve bulguları iyi yorumlanmalı ve kesin tanısını koyarken hem yardımcı hem de spesifik tanı testlerinin sonuçları göz önünde bulundurulmalıdır.
Günümüzde sepsis tanısı için iyi bir anamnez, fizik muayene ve laboratuar tetkikleri dışında, kesin tanı kan kültüründe etkenin tespit edilmesi ile konmaktadır. Ancak kan kültür sonucu için en az 24-48 saat beklemek zorunda olmak, mortalitesi yüksek olan sepsiste tanıya yardımcı olacak yeni arayışlara neden olmaktadır.
Bu çalışmamızda sepsis düşünülmüş hastalar ile kontrol grubu klinik, laboratuar ve demografik özellikler açısından karşılaştırılmıştır. Çalışmada, 6, IL-8, TNF-α ve CRP’nin yenidoğan sepsisinde tanı ve prognoz açısından önemi ve güvenirliğinin saptanması amaçlanmıştır.
GENEL BİLGİLER
YENİDOĞAN SEPSİSİ:
Yenidoğan sepsisi yaşamın ilk ayında meydana gelen bakteriyemi ile birlikte sistemik enfeksiyon bulgularıyla karekterize bir hastalıktır (1). Klinik belirtileri nonspesifik olduğu için erken tanı ve tedavi önem kazanmaktadır. Tanı amacıyla alınan kan kültürlerinin güvenilirliği sınırlı ve zaman alıcıdır. Çünkü; anneye doğumdan önce antibiyotik verilmiş olması, kültür alınmadan önce bebeğe antibiyotik başlanması, yetersiz kan alınması, bakteri yoğunluğunun düşük olması gibi faktörler sepsisin her vakada kültürle kanıtlanmasını olanaksız hale getirmektedir (3,4).
Son yıllarda sepsisin patofizyolojisinin çok iyi ortaya konmasına rağmen tedavideki gelişmeler ne yazık ki destek tedavisinden ileri gidememiştir (5). Bu nedenle enfeksiyonlar yenidoğan döneminde mortalite ve morbiditenin önemli nedenlerinden biri olmaya devam etmektedir.
Yenidoğanda enfeksiyon sıklığının diğer yaş gruplarına göre fazla olmasında immün sistem immatüritesinin rolü mevcuttur. Fetus, intrauterin ortamda steril halde bulunur. Normal şartlarda fetus, amnios membranının yırtılmasıyla birlikte mikroorganizmalarla karşılaşır. Bu mikroorganizmalar öncelikle anne kaynaklı iken sonrada çevreden kaynaklanır. Yenidoğanın derisi ince ve zayıf olduğu için kolaylıkla hasara uğrayabilir ve enfekte olabilir. Göbek kordonu da doğum sonrası nekrotik bir duruma geldiği için mikroorganizmaların yerleşmesi için uygun bir ortam oluşturur. Yenidoğana uygulanan invaziv girişimler enfeksiyon gelişimini kolaylaştırır (6).
Enfeksiyonların anne kaynaklımı yoksa çevre kaynaklımı olduğunun ayrımı tam olarak yapılamasada yenidoğan sepsisi başlangıç zamanına göre iki ana gruba ayrılır.
Tablo1: Erken ve geç sepsisin özellikleri.(6,7)
Özellikler Erken sepsis Geç sepsis
Başlama yaşı Genellikle 4 günden küçük 5-28 gün
Prematüritelik Yüksek Seyrek, ancak nozokomial sepsiste sık
Obstetrik riskler Artmış kolonizasyon, amnionitis Seyrek
Klinik görünüm Solunum sıkıntısı, pnömoni, şok Ateş, MSS bulguları, fokal
bulgular
Menenjit %30 %75
Diğer sistemler Nadir Piyelonefrit, osteomyelit, septik artrit, sellülit
Patojenler
GBS, E.coli, Listeria, Klebsiella, Enterokok GBS, E.coli, Listeria, Saureus, KNS, Psödomonas, Streptokok Başlangıç tedavisi Ampisilin+Aminoglikozit veya Sefotaksim Ampisilin+Aminoglikozit veya Sefotaksim Mortalite % 15-50 % 10-20
Erken Başlangıçla Neonatal Sepsis (ENS):
Fulminan bir gidişe sahip olan ve hayatın ilk dört gününde ortaya çıkan ENS ‘de genellikle obstetrik kaynaklı komplikasyonların rolü mevcuttur. Patojen genellikle doğum kanalında kazanılır ve multisistemik tutulum görülür (8,9). Bu enfeksiyonlar ya doğrudan doğruya fetusu etkiler veya erken doğum ve gebelik komplikasyonlarına yol açar. Mikroorganizmalar fetusa transplasental veya assendan yolla bulaşabileceği gibi, doğum sırasında fetusun annenin genital sekresyonları veya kanı ile karşılaşması sırasında da bulaşabilir (6).
Erken başlangıçlı neonatal sepsis’in başlıca risk faktörleri prematürelik, düşük doğum ağırlığı, Erken Membran Rüptürü (EMR), korioamnionit, doğum kanalında grup B streptokok kolonizasyonu ve doğum travmalarıdır (8,10). Yenidoğan sepsisi
için birden fazla risk faktörünün bulunması sepsis olasılığını daha da arttırır. Mortalitesi %10-50 dir (11).
Geç Başlangıçlı Neonatal Sepsis (GNS):
Hayatın 4. gününden sonra, genellikle ilk haftadan itibaren görülür (8,12). Mikroorganizma doğum kanalından, hastaneden veya toplumdan kazanılabilir (8,9).
Erken neonatal sepsise göre doğum ve doğum sonrası komplikasyonlar ile ilişkisi daha azdır. Etken sıklıkla insanlarla (anne, sağlık personeli vs ) ve kontamine aletlerle alınır. GNS riskini arttıran faktörler bebekleri yaşatmak için hastanede yapılan işlemlerdir (8,13). Geç başlangıçlı sepsis hem fokal hemde multisistem organ tutulumu ile gider. GNS içerisinde önemli bir grubu nozokomial sepsis oluşturmaktadır.
Nozokomial enfeksiyonlar (NKE) hastane kaynaklı ve hastanede kazanılmış enfeksiyonlardır. Bu enfeksiyonun sıklığı gestasyon yaşı ve doğum tartısı ile ters orantılıdır. Özellikle prematüre bebeklerin immün sistemlerinin immatür oluşu, bu bebeklerde anneden geçen antikor düzeyinin yetersiz oluşu, mide asiditesinin yetersiz ve derilerinin kolayca hasarlanabilir oluşu enfeksiyonlara zemin hazırlar. Nozokomial enfeksiyon riskini arttıran diğer faktörler arasında hastalığın ağırlık derecesi, ventilatörde kalma süresi, hastanede kalma süresi, hastanenin yoğunluk derecesi, ünitedeki personel sayısının yetersiz olması, santral kateter kullanımı ile paranteral beslenme yapılması, özelliklede lipid emülsiyonlarının kullanılması, invaziv girişimlerin sık yapılması sayılabilir (6).
Gelişmekte olan ülkelerde nozokomial enfeksiyonların sıklığı 1000 canlı doğumda 1,7 ile 33 arasında değişmektedir. Bu hastalara ek olarak gastroenterit, pnömoni, flebit, idrar yolu enfeksiyonları ve omfalit eklendiğinde bu oran 1000 canlı doğumda 18 ile 130 arasına yükselmektedir (14). Ancak gelişmiş ülkelerde NKE sıklığı 1000 canlı doğumda 1-5 arasındadır (15). Yenidoğanının gestasyon yaşı ne kadar küçükse ve doğum tartısı ne kadar düşükse sepsis riskide o oranda artmaktadır. Yapılan birçok çalışmada nozokomial enfeksiyonlarda en sık izole edilen ajanların % 70’inde gram (+) ajanlar, %’18inde ise gram (-) ajanlar etken olarak tespit edilmişlerdir (16). Gram (+) organizmaların %50 den fazlasını Koagülaz (-) stafilokoklar oluşturmaktadır. Bu enfeksiyonlar el yıkama kurallarına sıkı bir şekilde
uyulmasıyla önlenebilir. Diğer gram (+) mikroorganizmalar arasında stafilokoklar ve enterokoklar sayılabilir (6).
Son yıllarda yenidoğan bakım ünitelerinde düşük doğum tartılı bebeklerin yaşatılmasıyla 30. günden sonra özellikle etken olarak stafilokok ve candida türleriyle oluşan çok geç başlangıçlı neonatal sepsis terimi kullanılmaya başlanmıştır (17). Bu sepsis de fatalite hızı % 5’in altındadır (8).
İNSİDANS VE MORTALİTE
Yenidoğan sepsis insidansı ortalama her bin canlı doğumda 1-8 arasında bildirilmiştir (2,18). Dünya genelinde yılda yaklaşık 4 milyon yenidoğanın öldüğü ve bu ölümlerin 1,5-2 milyonunun enfeksiyonlar nedeniyle gerçekleştiği tahmin edilmektedir (19). Yenidoğan sepsisinin mortalitesi antibiyotik kullanımının olmadığı yıllarda % 80-90 gibi yüksek oranlarda iken günümüzde yeni ve etkili antibiyotiklerin kullanıma girmesiyle bu oran %10-50’ye kadar inmiştir. Son yıllarda yaşam destek ünitelerinde küçük prematürelerin ve diğer riskli bebeklerin yaşam olasılığının artmasıyla sıklığı yeniden artış göstermiştir (18).
RİSK FAKTÖRLERİ
1-Anne ile ilgili risk faktörleri ;
Gebelik öncesi annenin var olan kronik bir hastalığı (Diabetes Mellitus (DM), Ağır hipotiroidi, Böbrek hastalığı, Kistik fibrozis, Astım, Epilepsi, Sistemik Lupus Eritamatozus (SLE ), anne yaşının 18 yaşından küçük veya 40 yaşından büyük olması sepsis olasılığını normale göre arttırmaktadır (20). Düşük sosyoekonomik düzey prematüreliğe yol açtığı gibi sepsis için de bir risk faktörüdür. Obstetrik kompikasyonlar erken sepsis için risk oluştururken, madde kullanımı ve diğer çevresel etkenler anatomik defekt riskini arttırdığı için geç neonatal sepsis için de risk oluşturmaktadır. Ayrıca annenin nullipar veya multipar oluşu ve düzenli prenatal bakımın yapılmaması da sepsis riskini arttıran faktörlerdendir (6). Annede üriner sistem enfeksiyonunun varlığı prematürite riskini arttırdığı gibi korioamnionit riskini de beraberinde arttırarak sepsis gelişme sıklığını yükseltmektedir (21). Ancak annede belirgin olarak enfeksiyon bulgusu varsa prematürelerde daha sık olmak üzere sepsis
riski %0,5-1 arasındadır. Annede bu kolonizasyona ek olarak erken membran rüptürü, ateş veya prematürite gibi komlikasyonların varlığı mevcut olan riski %4-7 lere korioamnionit varsa %20 lere kadar çıkarmaktadır (22,23,24,25).
Annenin sularının doğumdan 18-24 saat önce gelmesi önemli bir risk faktörüdür. Öyle ki EMR‘li annelerden doğan bebeklerde sepsis sıklığı normalden 10 kat daha fazla olarak karşımıza çıkmaktadır (yaklaşık %1 oranında). EMR’ li annede ek olarak korioamnionit varlığında risk %3-8’e kadar yükselmektedir. EMR ve prematüre birlikteliğinde bu risk %4-6 civarında hesaplanmıştır. Ayrıca Apgar skorunun < 6 olması durumunda da sepsis riski % 3- 4 olarak bulunmuştur (6).
Yenidoğana doğum sırasında forseps uygulanması, annede asemptomatik bakteriüri olması, doğum travmaları, antepartum kanama (1. ve 2. trimestr ), çoğul gebelik (özellikle ilk doğan çocukta doğum kanalındaki mikroorganizmalarla temas ettiği için daha sık ), polihidramnios, annenin sigara ve alkol alışkanlığının olması belirli oranlarda sepsis riskini arttırmaktadır (6).
Antenatal steroid kullanımının sepsis gelişimi üzerindeki riski tartışmalıdır. Bazı çalışmalarda, enfeksiyon riskinin artmadığı gösterilmesine rağmen, bazı çalışmalarda ise özellikle geç başlangıçlı neonatal sepsis riskini artırdığı gösterilmiştir (26). Bununla beraber antenatal steoridlerin prematüreleri solunum problemleri Respiratuar Distress Sendromu (RDS), Bronkopulmoner Displazi (BPD) vs. ve intraventriküler kanama gibi önemli sorunlardan koruduğu göz önünde bulundurulursa erken doğumda kullanılmaması düşünülemez. 34. gebelik haftasından sonra ise steroid kullanımının etkileri azaldığında, yalnız akciğer immatüritesinin kanıtlandığı vakalarda kullanılması enfeksiyon açısından koruyucu olabilir (27).
2-Bebeğe ait risk faktörleri;
Gerek erken, gerekse geç sepsis için en önemli risk faktörü düşük doğum ağırlığı ve prematüreliktir. Preterm olarak doğan bebeklerdeki risk normal term olarak doğan yenidoğanlara göre 3-10 kez daha fazladır (28). 1500 gr. altındaki bebeklerde ise term olarak doğan bebeğe göre sepsis riski 25 kat daha fazla görülmektedir. Ayrıca bu hastalarda mortalite sıklığı 4 kat artmaktadır (6,29). 2500 gr’ın üstünde doğan bebeklerde mortalite sıklığı %3 iken Extremely Low Birth Weight (ELBW) bebeklerdeki mortalite % 90’lara kadar ulaşmaktadır (30). Çünkü yenidoğanın immün sistemi erişkinlere göre sayısal ve fonksiyonel olarak zayıftır
(31). Hücresel, humoral, kompleman, mokrofaj/ fagosit sistemlerinden oluşan immün sistem yenidoğanda özellikle de prematür bebeklerde tam olarak gelişmemiştir.
Yenidoğanın cinsiyetinin erkek olması sepsis görülme sıklığını kesin olarak nedeni bilinmesede 4 kat kadar arttırmaktadır (32). Bu eğilimin nedeninin X kromozomu üzerinde bulunan ve timusun fonksiyonunu ve immünglobulin sentezini düzenleyen bir gen üzerinde durulmaktadır. Kızlarda bu genin çift olmasının enfeksiyona karşı koruduğu öne sürülmektedir (6).
Galaktozemili hastalarda E.coli sepsisi riski yüksektir. Neden olarakta galaktozun lökosidin bakterisidal aktivitesini inhibe etmesi olabilir (33). G-6-P-D enzim eksikliği, bazı metabolik hastalıklar, ikiz doğum (özellikle birinci doğan bebeğin assendan bir enfeksiyon ile karşılaşma olasılığı daha yüksektir ), enteral beslenmeye geç başlanması, yenidoğana bazı invaziv girişimler uygulanması, uzun süreli mekanik ventilasyon, vasküler kateter uygulanması, yenidoğanın bazı anatomik defekleri (obstrüktif üropati, gastroşizis, meningomyelosel vs.) sepsis riskini arttıran diğer faktörlerdir.
3-Çevresel risk faktörleri;
Anne karnında steril bir ortamda bulunan yenidoğanın mikroorganizmalarla ilk karşılaşması doğum kanalındaki mevcut flora ile olmaktadır. 3 gün içerisinde deri, boğaz ve burun delikleri gram (+) mikroorganizma ile (Alfa Hemolitik streptokok, S.aureus, S.epidermidis) bir hafta içerisinde ise gastrointestinal sistem Enterobacterler ile kolonize olmaktadır (34). Özellikle formula ile beslenen bebeklerde E.coli, anne sütü ile beslenenlerde ise ek olarak lactobacillus spp. ile kolonize olmaktadır.
Ayrıca antibiyotiklerin yoğun olarak kullanıldığı yoğun bakım ünitelerinde bulunan yenidoğanların dirençli antibiyotikler ile kolonize olması kolaylaşmaktadır. Yine yapılan bir çalışmada kirli ebe eli erken yenidoğan sepsisinin önemli bir nedeni olarak bulunmuştur (35).
ETYOLOJİ
Yenidoğan sepsis sıklığı zamana, coğrafi bölgeye, bir yenidoğan ünitesinden diğer yenidoğan ünitesine göre değişkenlik gösterir. Yenidoğan sepsisinde çok çeşitli
olarak ön plana çıkmıştır. Neden olarak annelerin vajinal florasının B grubu streptokoklarla çok sık kolonize olmalarıdır. Son yıllarda batı ülkelerindeki bazı yenidoğan merkezlerinde gr (-) mikroorganizmalara kayma söz konusudur. Özellikle burada B grubu streptokoklara karşı yürütülen tedavi ve profilaksinin rolü üzerinde durulmaktadır (36). Günümüzde halen GBS önemini korumaktadır. Özelliklede yenidoğan sepsisinin ve menenjitinin en önemli nedenini oluşturmaktadır.
Grup B Streptokoklar; gram (+), hareketsiz, sporsuz, fakültatif anaerob koklardır. Kolonileri etrafında dar bir beta hemoliz alanı bulunur. Basitrasine dirençlidir. Dokuz tane kapsüler serotip tanımlanmıştır. En sık izole edilen serotipleri 1a, 1b, 2, 3 ve 5’tir. Erken neonatal sepsisteki sıklığı birbirine yakın olan bu serotiplerden geç neonatal sepsis ve menenjitin yaklaşık %80- 90’ından serotip 3 sorumlu tutulmaktadır (37).
İkinci en sık bakteri grubu E.coli’dir. Gram (-), düzgün çomak şeklinde enterik basiller arasında yer alan E.coli, son 60 yılın en sık rastlanan etkeni olarak tespit edilmiştir (28). E.coli’nin K1 antijenik yapısına sahip olan şuşları enfeksiyonların çoğundan sorumlu tutulmaktadır. Özellikle yenidoğan menenjitinden ve sepsisinden sorumlu olduğu gibi kötü prognozun da göstergesidir.
Listeria monocytogenes, kontamine yiyecekler ile anneye bulaşır ve annede sepsisi veya grip benzeri bir tabloya neden olabilir. Listeria, transplasental olarak fetusa geçebilir (6).
Diğer bir etken deri ve mukoza florasında bulunan stafilokoklardır. Gram (+) üzüm salkımı şeklinde kümeler oluşturan koklardır. Hareketsizdir ve spor oluşturmazlar. Katalaz enzimi üretirler. S.aureus koagülaz (+) iken diğerleri ise Koagülaz (-) stafilokoklardır (KNS). İntravasküler kateteri olan, geniş spektrumlu antibiyotiklerin sık kullanıldığı aynı zamanda uzun süre yenidoğan yoğun bakım ünitelerinde kalan prematür bebeklerde KNS ve Candida (özellikle Candida Albicans) giderek artan oranlarda sepsis etyolojisinde rol oynamaktadır (%8-10) (7). S.aureusun kan ve doku kültüründe izole edilmesi mutlak hastalık işareti olarak kabul edilmektedir (6).
Anaerob mikroorganizmalarla meydana gelen bakteriyemiler, fokal enfeksiyon yokluğunda kendi kendini sınırlar. Ancak Bacterioides ve Clostridium suşları özellikle peritonit, fasiit veya menenjit gibi yaşamı tehdit eden hastalıklara neden
olabilir (37). Anaerobların neden olduğu yenidoğan sepsislerin sıklığı yapılan çeşitli çalışmalarda %7,5-23 arasında bulunmuştur (6,29).
Diğer gram(-) enterik basiller arasında Klebsiella, Enterobacter, Serratia, P.aeruginosa, Proteus şuşları ve Salmonella yenidoğan sepsisinde rol alan etkenlerdendir (37).
Tablo:2 Erken ve geç sepsis etkenleri
Erken neonatal sepsis :
GBS E.coli
L.monositogenez S.aureus
Diğer streptokoklar
Diğer Gram (-)ler (H.influenza, K.pnömonia, P.aeruginoza, Enterobakter)
Geç neonatal sepsis:
Koagülaz (-) stafilokoklar K.pnömonia
P.aeruginoza
Gram (-) enterik bakteriler Candida türleri
Ülkemizde en sık izole edilen etken gram (-) enterik basillerdir. Bunu stafilokoklar takip etmekte. B grubu streptokoklar ise nadiren izole edilmektedir (37).
PATOGENEZ
Normalde fetus anne karnında iken annenin genitoüriner sistem florasındaki mikroorganizmalardan sağlam zarlar aracılığı ile çok iyi korunmuştur. Ayrıca amniotik sıvı içindeki lizozim, transferin ve immünglobulinlerin özellikle E.coli gibi patojenler için bakteriostatik özellikte olduğu gösterilmiştir (38,39). Çeşitli savunma mekanizmalarına rağmen yenidoğana patojen mikroorganizmalar başlıca 3 yolla
1-İntrauterin enfeksiyon (transplasental geçiş): 1.trimester enfeksiyonu
embriyogenezisi etkileyerek konjenital malformasyonlara neden olurken 3.trimester enfeksiyonları ise doğumda aktif enfeksiyona neden olabilir. Transplasental enfeksiyon için maternal enfeksiyon olması şarttır. İntrauterin enfeksiyonlar düşük, ölü doğum, doğumsal malformasyonlar, IUGG, preterm doğum, nörolojik sekeller ve yenidoğan döneminde akut hastalık kliniği ile ortaya çıkan asemptomatik süregen enfeksiyon ile sonuçlanabilir (37).
2-İntrapartum enfeksiyonlar: Doğumdan hemen önce veya doğum sırasında
mikroorganizmanın anneden yenidoğana vertikal geçişi ile gerçekleşir. Amniotik sıvının boşalması ile doğum kanalının florası ile karşılaşan yenidoğanda, annenin GBS ile kolonize olması, EMR varlığı, koryoamionit varlığı, fetusun amniotik sıvıdaki bakterilerle teması ve mevcut sıvıyı aspire etmesiyle pnömoni veya sepsis kliniği ortaya çıkabilir.
3-Postnatal enfeksiyonlar: Geçiş anne, aile üyeleri, hastane personeli yada
kontamine olmuş malzemelerin kullanılması ile olabilir. Deri ve mukozalar mikroorganizmalar için doğal bir bariyerdir. Forseps kullanılarak yaptırılan doğumlar sırasında deride meydana gelen sıyrıklar veya konjenital defekler enfeksiyon için risk oluşturmaktadır (6). Yenidoğanlarda enfeksiyonun gelişiminde immün sistem immatüritesinin önemi büyüktür. Özellikle prematür bebeklerde daha ağır olmak üzere hem nonspesifik hemde spesifik bağışıklıkta eksiklikler söz konusudur (9,31). Fagositik sistemin ana hücreleri olan nötrofillerde hem sayısal hemde fonksiyonel farklılıklar bulunmuştur. Kemik iliğinde nötrofil miktarı erişkinlerin ancak %20 si kadardır. Bu nedenle ağır sepsisde nötrofil tüketiminin artması mortaliteyi arttırmaktadır (9,40,41).
Yenidoğanda mevcut kompleman düzeyi annedekinin yarısı kadardır. Bu pretermlerde daha düşüktür. Gebeliğin 8. haftasından itibaren maternal IgG antikorları fetusa geçmeye başlar. 30. haftaya gelindiğinde doğumdaki düzeyin yarısına ulaşmakta. Bu nedenle bebek ne kadar erken doğarsa o kadar hipogamaglobulinemik olacaktır. Materno-fetal transportu olmayan IgM konsantrasyonu yenidoğanda yaklaşık olarak normalin %10 ‘u kadardır. Gr (-) bakterilere karşı bakterisidal ve opsonik antikorlar IgM yapısında olduğu için yenidoğanlar E.coli’ ye karşı korumasızdırlar (11,40,41,42).
Sepsiste enflamatuar yanıt, çeşitli proenflamatuar sitokinler (TNF-α , IL-1 ve IL-6 ) ile kompleman ve koagülasyon sisteminin aktivasyonu ile gelişen yan ürünlerle ilişkili bir tablodur (37).
KLİNİK BULGULAR
Yenidoğan sepsisinin klinik bulguları oldukça değişkendir. Genel durumu iyi olan bir bebekte anormal saptanan her bulgu sepsisin bir belirtisi olabilir. Bazen sadece bir sistemle ilgili klinik bulgular izlenirken çoğunlukla multisistemik tutulumla karşımıza çıkmaktadır. Sepsisde vaka atlanmaması ve erken tanı konulması hem bebeğin yaşatılması hemde sekellerin önlenmesi açısından gereklidir (43). Sepsisle ilgili belirti ve bulgular solunum, gastrointestinal, kardiyovasküler ve merkezi sinir sistemi ile ilgili olsada en önemlisi bebeğin iyi görünmemesidir (17,30,32,38,43). Sepsis tanısını koymak ve tedaviye başlamak semptomların ve mevcut kliniğin ağırlık derecesi tamamen klinik yoruma açıktır. Sepsis düşündüğümüz hastada iyi bir anamnez ile maternal, perinatal ve neonatal risk faktörleri araştırılmalı. Annede EMR öyküsü, korioamnionit varlığı, pis kokulu akıntı, ateş öyküsü ve GBS kolonizasyonu sepsis riskini normal populasyona göre arttırdığı unutulmamalıdır.
Sepsisli yenidoğanda vücut ısısı yükselmiş, azalmış veya normal olabilir. Yenidoğanda ateş genellikle rektal ısının 38°C ve üstünde olmasıdır (7). Ateş yenidoğan döneminde her zaman için enfeksiyon bulgusu olmayabilir. Çevre ısısının artması, dehidratasyon varlığı, kernikterius, asfiksi, intraventriküler kanama ve ilaç yoksunluğu gibi nonenfeksiyöz durumlarda da ateş görülebilir. Yapılan çalışmalar 1 saatten uzun süren ısı yükselmesinin enfeksiyonla ilişkisi olduğunu ve enfeksiyonun diğer bulguları olmaksızın sadece ısı yükselmesinin nadir olduğunu göstermiştir (37). Septik term bebeklerde ateş daha sık görülürken, preterm bebeklerde hipotermiye daha sık rastlanır.
Sepsisli yenidoğanlarda kusma, batın distansiyonu, ishal, hematokezya, regürjitasyon, hepatomegali ve ileus bulunabilir. Bunlar nonspesifik belirtiler olmasına karşın, sepsisin ilk işareti olabilir. Yenidoğan muayenesinde barsak seslerinin azalması paralitik ileusta, barsak seslerinin alınmaması ise Nekrotizan
varlığı belirginse intrauterin enfeksiyonu düşündürür. Batın distansiyonunun artması, safralı ve fekaloid kusmalar, karın duvarında renk değişikliği ve morarma ilerlemiş sepsis bulgusu olarak ele alınmalıdır.
Solunum sıkıntısı erken dönemde gelişen bulgulardandır. Düzensiz solunum, siyanoz, burun kanadı solunumu, interkostal çekilmeler, taşipne ve apne görülebilir. Özellikle ilk bir haftadan sonra ortaya çıkan apnelerde sepsis düşünülmelidir. Bu bulguların prematür bebeklerde görülen RDS ve pnömoniden ayırt edilmesi güçtür (12). Yenidoğanda kardiak bir hastalık olmaksızın taşikardi, bradikardi, aritmi, hipotansiyon, kapiller dolum zamanında uzama ve periferik dolaşımın bozulması sepsis için önemli belirtilerdendir.
Yenidoğanın derisi doğal ışık altında incelenmeli, rengi, deri bütünlüğü ve döküntüleri değerlendirilmelidir. Sarılık sepsis kliniği ile başvuran hastaların yaklaşık 1/3 de ve özelliklede üriner sistem enfeksiyonu olan hastalarda sık görülür. Ciltteki solukluk bazen septik şokun belirtisi olabilir. Deri üzerinde apse, selülit, sklerem, omfalit, granülom benzeri lezyonlar görülebilir. Ayrıca peteşilerin varlığı sepsisin erken belirtisi olarak kabul edilirken purpura, trombositopeni ve Dissemine İntravasküler Koagülopati (DİK) geç dönemde ortaya çıkmakta .
Santral sinir sistemi tutulumu olan hastalarda huzursuzluk, letarji, hipotoni, tiz sesle ağlama, irritabilite ve konvülziyon saptanabilir. Fontanel gerginliği ve ense sertliği yenidoğanlarda nadiren rastlanan bulgulardandır. Menenjitin erken dönemdeki bulguları sepsis ile aynıdır. Konvülziyonlar %40 vakada menenjit tablosuna eşlik etmektedir. Hemiparezi, kranial sinirlerin tutulumu (en sık olarak 7., 3. ve 6. kranial sinirler) görülebilir. Yenidoğan sepsisinde hiperglisemi, hipoglisemi ve metabolik asidoz saptanabilir. Ayrıca diğer sistem tutulumları arasında artrit ve osteomiyelit de görülebilir.
TANI YÖNTEMLERİ
Mortalitesi ve morbiditesi yüksek olan yenidoğan sepsisinin erken tanısı ve tedavisi büyük öneme sahiptir. Günümüzde sepsis tanısı için bir çok yöntem geliştirilmesine rağmen hala mikroorganizmanın vücut sıvılarından izolasyonu standart ve en spesifik yöntemdir (8,43,44). Alınan kültürlerde üreme en erken 24 saat içinde sonuçlandığı için yapılan çalışmalar sepsisin kesin tanısını birkaç saat
içinde koyduracak sensivite ve spesifitesi yüksek bir test bulmaya yöneliktir. Ancak hala günümüzde bu şekilde bir test bulunamadığı için bir çok değişik testin bir arada kullanılarak en kısa sürede tanıya gitmek hedeflenmektedir.
Sepsisten şüphelenilen bir bebekte bir yandan kültürler alınırken bir yandan da tam kan sayımı, periferik yayma, idrar tahlili, lomber ponksiyon yapılması ve akciğer grafisi çekilmesi gerekmektedir. Amerika Birleşik Devletleri Hastalık Kontrol Komitesi tarafından kültür (-) yada kan kültürü olmayan ancak klinik olarak sepsis düşünülen yenidoğanlara “klinik sepsis” tanımlaması yapılmıştır (45).
Tanısı şüpheli olan olguların belirlenmesinde bazı skorlama yöntemleri geliştirilmiştir. Bunlardan bir tanesi Töllner skorlama sistemidir (46). Şüpheli sepsis olgularına klinik bir yaklaşım sağlayan bu skorlama yönteminde toplam degerin 4’ün altında olması (-), 5-10 arası olması süpheli sepsisi, 10’un üzerinde olması ise olası sepsisi gösterir.
Tablo 3. Töllner Skorlaması (46)
Puan 0 1 2 3
Deri renginde değişiklik Yok Orta Belirgin**
Periferikdolaşım bozukluğu Yok Bozuk Belirgin
Hipotoni Yok Orta Belirgin
Bradikardi Yok Var
Apne Yok Var
Respiratuar distres Yok Var
Hepatomegali Yok >4 cm
GİS bulgusu Yok Var
Lökosit sayısı Normal Lökositoz Lökopeni
Sola kayma Yok Orta Belirgin
Trombositopeni Yok Var
Metabolik asidoz (pH) Yok >7.2 <7.2
Spesifik tanı testleri A) Kültürler
1) Kan kültürü:
Neonatal sepsisin kesin tanısı pozitif kan kültürü ile konur. Yenidoğanda kültür için alınması gereken kan miktarı 0,5-1 ml’dir. Kan kültürünün sepsis için duyarlılığı en iyi koşullarda bile %50-80’dir (43). Birden fazla kan kültürü almak gerçek enfeksiyonu kontaminasyondan ayırmada oldukça yararlıdır. Annenin intrapartum antibiyotik tedavisi alması, yetersiz kan alınması, bakteriyeminin geçici olması ve alınan kanın uygun şartlarda çalışılmaması kan kültüründe mikroorganizmanın üretilememesiyle sonuçlanabilir.
Yapılan son çalışmalar üremenin elde edilmesinin alınan kan miktarına değil, kanın besiyerdeki dilüsyonuna bağlı olduğudur. Yenidoğanlarda kan kültüründe üremelerin %90’ dan fazlası 48 saat sonunda saptanır (4,8,13,43).
Klinik bulgularının sepsisle uyumlu olması durumunda kan kültürü negatif çıksa bile hastanın mevcut antibiyotik tedavisi tamamlanmalıdır. Sonuç olarak pozitif kan kültürü yenidoğan sepsisi için tanı koydurucu olsada negatif kültür sepsisi ekarte ettirmez (14,17,30,38,43,47-49).
2) Beyin omurilik sıvısı (BOS) kültürü :
Klinik bulgularla menenjit tanısı koymak zor olduğu için sepsis şüphesi olan her hastaya antibiyoterapi başlamadan önce lomber ponksiyon (LP) yapılması faydalıdır. Sepsis vakalarında LP rutin olarak uygulanmadığı taktirde menenjit vakalarının %37’si atlanmaktadır. Hastalardan sadece kan kültürü pozitif olan vakalarda LP yapıldığı taktirde normalde menenjit bulunan hastalarda yaklaşık olarak %28 oranında kan kültürü negatif bulunduğu için menenjit atlanabilir (50). Mikroorganizma BOS kültüründe izole edilebileceği gibi yapılan gram boyama ile etkenin gram negatif mi yoksa gram pozitif mi olduğu saptanabilir (4).
Yenidoğanda normal BOS değerleri oldukça geniş aralığa sahiptir. Enfekte olmayan BOS‘taki protein miktarı 20-170 mg/dl, glukoz miktarı 24-119 mg/dl, lökosit sayısı 25 hücre /mm³’tür. Bazen enfeksiyonu olmayan yenidoğanda lökosit sayısı 32 hücre/mm³ bulunabilir (6).
Solunum sıkıntısı ön planda olan hastalarda LP‘nin yapılması veya geciktirilmesi hala tartışma konusudur. Uzun süre entübeli olan ve pnömoni gelişen bebeklerde, NEK veya osteomiyelit gibi lokalize enfeksiyonu olanlarda ve işlemi tolere edemiyecek kadar genel durumu bozuk olan yenidoğanlarda lomber ponksiyon yapılmayabilir. Ancak menenjitin erken gelişen sepsislerin en az %25‘de, geç gelişen sepsislerin ise daha fazlasında bulunduğu göz önünde bulundurulursa BOS incelemesinin önemi ortaya çıkmaktadır (6).
3) İdrar kültürü:
Yenidoğanlarda idrar kültürü alınırken steril şartlarda alınmaya çalışılmalı. Torba ile alınan idrarda üreme olmaması anlamlı iken negatif çıkması enfeksiyonu ekarte ettirmez. Yaşamın ilk 3 gününde üreme olasılığı düşük olduğundan hastada şayet ürogenital sistem anomalisi yoksa alınması önerilmez. Ancak 3. günden sonra geç başlangıçlı sepsis için primer odak olabileceği için üretral kateterizasyon veya suprapubik aspirasyon ile idrar kültürü alınması gerekir (8,43).
4) Trakeal aspirat kültürü:
Uzun süre mekanik ventilatöre bağlı entübeli hastalar ve pnömonili yenidoğanlarda alınan kültürde kolonizasyon ile enfeksiyonun ayırımı güçtür. Ancak ilk 12 saatte alınan trakeal kültür faydalı olabilir. Pnömoni saptanmış ancak kan kültürü negatif olan yenidoğanların %44‘ünde trakeal aspirat kültürü pozitif bulunmuştur (32).
5) Diğer kültürler :
Hastanın klinik bulguları ve yapılan fizik muayenesine göre kültür alınmalıdır. Şayet deri ve mukozalarda lezyon varsa sürüntü veya biyopsi, eklemde şişlik ve enfeksiyon şüphesi varsa eklem aralığından aspirasyon yapılabilir. Alınan materyalden kültür ve gram boyama yapılır.
Dışkı kültürü Salmonella, Shigella, Campylobacter gibi etkenlerle meydana gelecek septisemi tanısına yardımcı olabilir. Ancak bu etkenler çoğu zaman gastrointestinal sistem kolonizasyonunu gösterir.
İlk saatlerde alınan mide aspiratı amnios sıvıda bulunan enfeksiyonu göstermekte. Buda yenidoğanda sepsis olduğunu göstermez.
B) Buffy coat incelemesi:
Kapiller veya venöz yoldan alınan 1ml EDTA’lı kan, 2500 devirde yaklaşık 15 dk çevrilir. Santrifüj edilmiş kanın plazma ve eritrosit arasında kalan “buffy coat” tabakası gram ve metilen mavisi yada akridin orange ile boyanır. Buradaki lökosit tabakasında bakterilerin görülmesi, sepsis tanısını destekler. Yenidoğan sepsisinde %70 oranında pozitif sonuç bulunur (6,29).
C) Bakteriyel antijenlerin taranması
Kültür sonuçları çıkmadan önce sepsis tanısını koymada yardımcı olur. Belirli antijenlere karşı geliştirilmiş antikor ile counterimmunelektroforez (CIE) kullanılarak bu ajanlar saptanabilir. Bu yöntem ile GBS, E.coli, Streptococcus pneumoniae ve Neisseria meningitidis antijenleri saptanabilir. Ancak sonuçları kültürler kadar duyarlı değildir.
Lateks aglutinasyon testleri ise GBS tanısında kullanılan hızlı, ucuz ve kolay bir testtir. CIE’ye göre duyarlılığı daha yüksek ancak spesifitesi düşüktür (6,37).
Nonspesifik yardımcı testler
Tarama testleri enfeksiyon olasılığını vurgulamak için başvurulan yardımcı tetkiklerdir. Yenidoğan sepsisi, sıklığı düşük olmasına rağmen tedavi edilmediği taktirde mortalitesi oldukça yüksektir. Bu nedenle yapılan testlerin hiçbir olguyu atlamayacak şekilde yüksek duyarlılığa sahip olması ve hastalığın olmadığı durumlarda ise sepsisin tamamen dışlanması için yüksek negatif tahmin değerine sahip olması gerekir.
Ancak günümüzde bir çok test bulunmasına rağmen hiç biri enfeksiyonu tanımlamak için yeterli duyarlılığa sahip değildir (4,43,51). Bu da sonuç olarak tanı koymak ve tedaviye başlamak için klinik değerlendirmenin klinisyen tarafından ayrıntılı bir şekilde yapılması sonucunu doğurur. Yapılan bu testler hastaya antibiyotik tedavisinin başlanması, devamı ve kesilmesi açısından da bize yardımcı olmaktadır (4,43,52).
1) Lökosit sayısı:
Sepsis tanısında lökosit sayısı ve lökosit oranları sık kullanılan yöntemlerden biri olmasına rağmen yenidoğanda kullanımı sınırlıdır. Sepsisli yenidoğanda lökositoz görülebildiği gibi lökopenininde görülmesi, yaşamın ilk günlerinde lökosit sayısının değişkenlik göstermesi tanıdaki önemini azaltmaktadır.
Bazen enfeksiyon dışı nedenler de hematolojik parametrelerde değişikliklere yol açabilir. Annede hipertansiyon, preeklemsi, perinatal asfiksi, intraventriküler kanama, pnömotoraks, konvülziyon, mekonyum aspirasyonu, uzamış ağlama durumlarında lökosit sayısında değişikliğe nötrofili veya nötropeniye neden olabilir (39).
Yapılan birçok çalışma yenidoğan sepsisinde total lökosit sayısının üst sınırını 30000-40000/mm³ kabul etmesine rağmen literatürde, lökosit sayısının değerli olduğuna dair çok az kanıt mevcuttur (43). Sepsis tanısı alan hastaların yaklaşık 1/3’ ünde beyaz küre sayısının normal bulunması sepsisin erken döneminde total beyaz küre sayısının güvenilir olmadığı sonucunu çıkarmıştır (53,54). Total nötrofil sayısı, lökosit sayısına göre daha değerlidir.
Doğumda total nötrofil sayısının alt sınırı 1750/mm³ iken, 12 saate ulaştığımızda bu alt sınır 7200/mm³ ulaşmakta. Ancak 72. saate gelindiğinde bu alt sınır yeniden 1750/mm³ sınırına inmektedir. Bundan dolayı ilk 48 saatte sepsis tanısında nötropeni önemli iken daha sonraki dönemde ise hem nötrofili hemde nötropeni enfeksiyon için önemlidir (6).
Diğer önemli bir parametre total immatür nötrofil (band) sayısıdır. Enfeksiyona sekonder olarak kemik iliğinde yapım arttığı için periferde genç hücre sayısında artış beklenir. Ancak bu cevap gecikmeli olarak oluştuğu için sepsisin erken tanısında kullanılmaz. Enfekte olmayan yenidoğanda total immatür nötrofil sayısı yükselmediği için band sayısının artması durumunda bakteriyeminin ayrıntılı olarak araştırılması gerekmektedir.
Sepsis tanısında immatür nötrofillerin total nötrofillere oranıda kullanılmaktadır. Bu oran enfekte olmayan yenidoğanda ilk gün 0.16, sonra 0.12, pretermlerde biraz daha yüksek saptanmıştır. Genel olarak I/T oranı 0.2’nin üstü anormal olarak değerlendirilir. I/T oranı stresli doğum eylemi ve oksitoksin kullanımı durumlarında artabildiğinden kullanımı sınırlıdır (37).
Sepsis tanısı koymak için mevcut yukarıdaki paremetrelere ek olarak lökositteki dejeneratif değişiklikler (toksik granülasyon, vakuolizasyon, döhle cisimcikleri ) ve trombositopeni kullanılarak Rodwell ve arkadaşları tarafından bir skorlama sistemi oluşturulmuştur. Burada her parametre için 1 puan verilmekte ve
Tablo 4 : Rodwell skorlaması sistemi
1. I/T oranının artışı
2. Total lökosit sayısının artması veya azalması 3. İmmatür/matür lökosit>0.3 olması
4. İmmatür lökositlerin artışı
5. Lökosit sayısı<5000 mm3 veya doğumda>25000 mm3, 12.-24.
saatlerde>30000 mm3, 2.günden sonra>21000 mm3
6. Nötrofillerde vaküolizasyon, Döhle cisimcikleri veya toksik granülasyon
görülmesi
7. Trombosit sayısı<150000 mm3 olması
2) Trombosit sayısı:
Trombositopeni, konjenital viral enfeksiyonlarda görülebildiği gibi postnatal kazanılmış enfeksiyonlar sonucuda gelişebilir. TORCH, sifilis, HIV ve parvovirüs B19 gibi ajanlarlarlada ortaya çıktığı için yenidoğan sepsisinin özgün olmayan geç bir bulgusudur. Yapılan çalışmalar trombositopeninin viral enfeksiyonlardan çok bakteriyel enfeksiyonlar sonrası geliştiğini ortaya koymuştur (55,56).
Trombositopeni ( ilk 10 günde trombosit sayısının 100.000/mm³, daha sonraki günlerde ise 150.000/mm³ altında olması) sepsis olduğu düşünülen yenidoğanların %10-60 ‘da bulunmuştur (57-60).
Mekonyum aspirasyonu, Exchange, mekanik ventilasyon, asfiksi ve umbikal kateterizasyon gibi sepsise yol açan durumlarda kültür negatif olsa bile sepsis olmaksızın tek başına trombositopeni görülebilir. Bu nedenle trombosit sayısı sepsis tanısında çok güvenilir değildir (61,38).
3) Akut faz reaktanları:
Karaciğer hücrelerinin sitokinler tarafından indüklenmesi ile üretildiğinden akut faz reaktanlarının artması için belirli bir süre geçmesi gerekir (4). Özellikle IL-1
beta, IL-6 ve TNF-α vasıtası ile sentezlenmektedir. 4-5. haftadan itibaren fetus tarafından yapılmaya başlanır (62-65).
Akut faz reaktanları enfeksiyon travma veya hücresel hasar sonucu karaciğerden sentezlenen proteinlerdir. Bunlar arasında C-Reaktif protein (CRP), fibrinojen, fibronektin, haptoglobulin, prokalsitonin (PCT), Serum Amiloid A (SAA), alfa 1 asit glikoprotein, C3 kompleman sayılabilir.
Yukarıda sayılan her bir akut faz reaktanının plazma yarılanma ömürleri ve enflamasyona yanıt hızları birbirinden farklıdır. Serum düzeyi ilk artan akut faz reaktanları CRP ve serum amiloid A‘dır (4). Ancak bulunan yüksek değerlerin enfeksiyöz veya nonenfeksiyöz nedenlere bağlı olup olmadığının tespit edilmesi zordur (38,66).
3.a C- Reaktif protein:
Yenidoğan sepsisinde üzerinde en çok çalışılmış akut faz reaktanıdır (4). 187 aminoasit içeren birbirine benzer 5 alt birimin bir araya gelmesiyle oluşur (67). Yenidoğanda normal düzeyi 1mg/dl altındadır (68-71). Enfeksiyon sonrası yaklaşık 6-8 saat içinde salgılanmaya başlayan CRP 24-48 saat sonra en yüksek seviyesine ulaşmaktadır. Yarılanma ömrü 4-7 saattir (72).
C-Reaktif Protein’nin salınımını uyaran majör faktör IL-6’dır. CRP ve kompleman bileşenleri mikroorganizmaların yok edilmesinde doğrudan görev almaktadır. Yaşamın ilk 12 saatinde ortaya çıkan erken başlangıçlı sepsislerde ve GBS enfeksiyonlarının bir kısmında CRP’nin yükselmediği görülürken buna karşılık EMR ve korioamnioniti olan annelerden doğan yenidoğanlarda, asfiksi, RDS, mekonyum aspirasyonu olan bebeklerde CRP’nin 10 kata kadar yükseldiği görülür. Bu nedenler CRP’nin özgünlüğünü azaltmaktadır.
Yapılan çalışmalar yenidoğan sepsisinde CRP’nin duyarlılığının %75-93 özgünlüğünün ise %62-95 arasında değiştiğini göstermektedir (6,43,47,73,75). Tanıda, tedavide ve komplikasyonların gelişmesinin değerlendirilmesinde tek bir CRP ölçümünden çok seri ölçümlerin yararlı olduğu görülmüştür (74,38,62,75). Ayrıca yüksek olan CRP’nin düşmeye başlaması tedavinin etkinliğinin değerlendirmesi ve antibiyotik tedavisinin sonlandırılması konusunda oldukça faydalı ve güvenilir bir kriterdir.
3. b Fibrinojen:
Enfekte yenidoğan ve normal yenidoğandaki düzeyleri birbirine yakın bulunduğu için sepsisin tanısında yeri sınırlıdır. RDS, DIC ve kan değişimi durumunda beraberinde enfeksiyon mevcut olsa bile kan fibrinojen düzeyi düşük bulunabilir.
3. c Fibronektin:
Çok fonksiyonlu ve yüksek molekül ağırlıklı bir glikoproteindir. Karaciğer hücrelerinde ve endotelyal hücrelerden yapılıp vücuda yayılır. Plazmadaki düzeyi yaşa göre değişkenlik göstermekte. Sağlıklı termde erişkindeki düzeyin yarısı kadarken pretermlerde 1/3’ü kadardır. Nötrofil ve makrofajların fagositozunu güçlendirerek retiküloendotelyal sistem (RES) için özgül olmayan bir opsonin gibi etki ederek immün yanıta yardımcı olur (37).
Enfeksiyon varlığında fibronektinin tüketilmesi sonucu plazma konsantrasyonu düşük bulunmuştur (47,76,77). Ancak asfiksi, RDS ve bronkopulmoner displazi (BPD) varlığında da plazmadaki düzeyi yine düşük bulunabilir.
3. d Haptoglobulin:
α-2 glikoprotein yapısında olup karaciğer tarafından salgılanan bir akut faz reaktanıdır. Haptoglobulin serumdaki serbest hemoglobini alarak retiküloendotelyal sisteme taşır. Enfekte yenidoğan ve normal yenidoğandaki seviyeleri birbirine yakın olduğu için günümüzde değerini yitirmiştir.
3. e Orosomukoid:
α -1- asit glikoprotein olarakta bilinen orosomukoid, başlıca hepatik ve parankimal hücrelerden sentezlenmekte. Enfeksiyon varlığında ise plazmadaki seviyesinin artmasına granülosit ve monositlerdeki sentezde katkıda bulunur. Fonksiyonu tam olarak bilinmemektedir. Plazma yarı ömrü 3-5 gündür.Yanlış pozitif ve yanlış negatif sonuçların fazla olması nedeniyle günümüzde kullanımı oldukça sınırlıdır.
3. f Prokalsitonin:
Yapılan son çalışmalarda yenidoğan sepsisinin tanısında yararlı ve belirleyici olan prokalsitonin (PCT) , 116 aminoasit içeren ve kalsitoninin öncü molekülü olarak bilinen bir proteinindir. Yarılama ömrü çok kısa olduğu için sağlıklı bir insanın serumunda gösterilemez. PCT’nin sistemik bakteriyal ve fungal enfeksiyonlarda
yükseldiği ancak inflamatuar ve viral enfeksiyonlarda yükselmediği yapılan birçok çalışmada gösterilmiştir (78). Enfeksiyon sonrası 2-6 saat içerisinde hızla artar 24 saat kadar yüksek kalmaktadır. Yarılanma ömrü 24-30 saat kadardır. Duyarlılık ve özgüllüğü çok yüksek (%87-100) bulunmuştur. Serumdaki düzeyi hastalığın şiddeti ve ölüm ile ilişkilidir. Hastalığın tanısında, tedaviye cevabının izlenmesinde ve prognozunun belirlenmesinde PCT oldukça yararlıdır (6).
C-Reaktif Protein ile kıyaslandığında kanda çok daha hızlı yükselmesi, yarı ömrünün hem sitokin hemde CRP’den daha uzun olması nedeni ile yenidoğan sepsisinin tanısında önemli bir gösterge olarak kabul edilmektedir (56). Ancak bazen yalancı negatif olgular bulunabilir. RDS, akut akciğer hasarı, ağır travma, hemodinamik yetersizlikler durumlarında çok yüksek düzeylerde saptanabilir (79).
3. g Serum amiloid A (SAA):
IL-1 ve TNF-α tarafından yapımı uyarılan SAA primer olarak karaciğerden sentezlenmektedir. Sekonder amiloidozda görülen amiloid fibrillerin serumdaki prekürsörü olarak kabul edilirler (80-82). Bakteriyal ve viral enfeksiyonlarda, klinik bulgular ortaya çıkmadan 2 gün öncesinde serumda artmaya başlar.
Yenidoğan ve erişkindeki serum seviyesi aynıdır. Ancak yenidoğanda özellikle SAA-1α izoformu artmaktadır. SAA genetiği ve biyokimyası hakkında yeterince bilgiye sahip olunsa bile görevleri halen tam olarak bilinmemektedir. İnflamatuar hastalıkların pek çoğunda SAA seviyesi yükselmektedir, enfeksiyonlarda ise bazal seviyenin 1000 katına kadar yükselebilir (normali: 1-5µg/ml) (83).
4) Sitokinler:
Çeşitli yaş gruplarında sepsisin etiopatogenezine yönelik yapılan çalışmalarda, bakterinin konak hücreye girmesinden itibaren immün mekanizmaların devreye girdiği ve çok sayıda sitokinin ve enflamasyon mediyatörlerinin rol aldığı gösterilmiştir (84).
Artmış sitokin seviyesi inflamatuar proçese karşı oluşan primer konakçı cevabıdır. Sitokinler makrofajlar, lenfosit ve endotelyal hücrelerden salınan glikoproteinlerdir. Yarılanma ömürleri kısadır. Sistemik inflamatuar yanıt (SIRS) gelişiminde proinflamatuar sitokinler (IL-6, TNF-α, IFN-γ) ile antiinflamatuar sitokinler (IL-4, IL-10) arasındaki denge, klinik belirtilerin ortaya çıkmasında çok
yapmakla görevlidirler. Ancak aşırı üretimleri zararlı olabilir ve doku hasarı yapabilir. Antiinflamatuar sitokinler ise, inflamatuar süreci azaltıcı ve homeostasisi tekrar sağlayıcı özelliklere sahiptir ancak fazla üretilmeleri, immun fonksiyonların bozulmasıyla sonuçlanır. Bu nedenle, 10’un sürekli yüksek bulunması veya 10/TNF-α oranının yüksek olması, kötü prognoz işareti olarak kabul edilebilir. IL-6/IL-10 oranının yüksek olması da kötü prognoz işaretidir ve şok, multiorgan yetersizliği ve ölüm ile ilişkili bulunmuştur(1).
Sitokinlerin (özellikle IL-1, IL-6, TNF-α, IL-8) ve bunlarla ilişkili reseptörlerin artışı ile sepsis arasında ilişki tam olarak kurulamamış ve bu sitokinlerin sepsis dışı birçok hastalıkta ciddi olarak artış gösterdiği belirlenmiştir (85,86). TNF-α, 1, IL-6 sepsiste akut faz cevabının major mediatörleridir
4. a Tümör nekrosis faktör-alfa(TNF-α):
Kaşektin olarakta bilinen TNF alfa T hücresi, makrofaj, naturel killer hücrelerinin lipopolisakkaritle uyarılması ile salgılanmakta. İnflamatuar cevabın önemli bir mediatörü olmakla beraber diğer mediatörleride uyarır. IL-2 yi uyararak T hücresinin proliferasyonunu arttırır (87,88).
Enfekte olan yenidoğanların yaklaşık %30’da dolaşımda tespit edilmiştir. Bu düşüklüğün nedeni olarakta yarılanma ömrünün kısa olması ve dolaşımda çabuk kaybolmasıyla açıklanmıştır (89). Yapılan birçok hayvan deneylerinde hipotansiyon, asidoz, kapiller sızıntı, akciğer ödemi, akciğer ve böbrekte hemorajik lezyonlara neden olduğu gösterilmiştir (90). TNF-α antikorlarının ise oluşan bu etkilere karşı koruyucu rol oynadığı gösterilmiştir. TNF-α’nın sepsis ve septik şoktaki rolünü araştıran bir çok çalışma yapılmıştır.
4. b İnterlökin-6 (IL-6):
Doku hasarı ve inflamasyona cevap olarak monosit, endotel hücreleri ve fibroblastlar gibi hücreler tarafından salınan bir sitokindir.
Proinflamatuar bir sitokin olan IL-6 karaciğerde CRP, fibrinojen, SAA gibi akut faz reaktanların sentezinde, T hücre proliferasyonunda ve sitotoksik T hücrelerinin farklılaşmasında rol oynar. IL-6’nın en önemli biyolojik etkinliği, B lenfosit maturasyonunu stimüle etmesidir. IL-6’nın etkisiyle B lenfositler, immünglobulin sentezleyebilen olgun plazma hücrelerine farklılaşırlar (65,91-93). IL-6 hem intrauterin hemde postnatal sepsiste artmaktadır. Amnion sıvıdaki artış
korioamnionit lehine yorumlanırken kordon kanındaki artışı ise intrauterin enfeksiyonu gösterir. Doğumdan sonra konjenital pnömoni, sepsis, NEK veya evre 3-4 İntra Kranial Kanama (İKK) gelişen yenidoğanlarda da kordon kanında IL-6 düzeyleri yüksek bulunmuştur (1). Kandaki seviyesinin 1000 pg/ml’den yüksek olması organ disfonksiyonu ve kötü prognoz ile yakından ilişkilidir (94).
C-Reaktif Protein’nin sentezini uyardığı için, bakteriyel enfeksiyonlarda CRP’den önce yükselebileceği ve daha erken tanı imkanı sağlayacağı ileri sürülmüştür (91,92). Ancak kan düzeylerinin hemen zirveye ulaşmasına rağmen yarı ömrü kısa olduğu için dolaşımda erken kaybolmaktadır (95). Klinik olarak sepsis düşünülen hastalarda ilk 48 saatte IL-6 ile birlikte CRP’de bakılması, her birinin tek tek bakılmasından daha duyarlı olacağı görüşü ağırlık kazanmıştır. Yapılan bir çok çalışmada sepsis vakalarında %64 ile %100’e varan oranlarda IL-6 seviyesinin plazmada yükseldiği saptanmıştır (29,96,97).
4. c İnterlökin-8 (IL-8 ):
Enfeksiyona cevap olarak monosit, makrofaj ve endotel hücreleri tarafından salgılanmakta. Bir çok özelliği ile IL-6’ya benzer. Serum seviyesi gestasyon yaşından ve postnatal yaşından bağımsızdır. En önemli fonksiyonu nötrofili aktive etmek ve kemotaksisdir. IL-8 sentezi IL-1, TNF, lipopolisakkaritler ve viruslar tarafından indüklenir. CRP ile birlikte sepsis tanısında kullanıldığında sensivitesi yüksektir (98). Erken ve geç sepsiste yüksek bulunur. Duyarlılığı %80’den fazla özgüllüğü ise %100’e yakındır.
TEDAVİ
A) Antibiyotik tedavisi:
Sepsis şüphesi olan yenidoğanda tanıya yönelik kan kültürü, gerekli görülen diğer kültürler alındıktan ve gerekli tetkikler yapıldıktan sonra tedaviye hemen başlanmalıdır. Çünkü sepsis mortalitesi ve morbiditesi yüksek bir hastalıktır.
Sepsis düşünülen yenidoğanda kullanılacak antibiyotiklerin seçimi bir çok faktöre bağlıdır. Bunlar arasında hastalığın başlama zamanı (erken başlangıçlı veya geç başlangıçlı sepsis), yenidoğan ünitesinde en sık karşılaşılan mikroorganizmalar ve bunların antibiyotik dirençleri, mevcut enfeksiyonun muhtemel odağı ve
yenidoğanla ilgili risk faktörlerinin varlığı sayılabilir. Yenidoğan gerek fizyolojik gerekse farmakolojik açıdan kendine özgü bir organizmadır. Vücut sıvı bileşimindeki farklılıklar, mevcut enzimlerin immatüritesi, renal fonksiyondaki değişmeler, verilen antibiyotiğin emilimini, metabolize edilmesini ve vücuttan atılım süreçlerini etkiler.
Sepsis düşündüğümüz hastalara genellikle iki antibiyotik birden başlanmalıdır. Amaç; antibakteriyel spektrumu genişletmek, kullanılan ilaçların sinerjistik etkilerinden faydalanmaktır. Ayrıca tekli antibiyotik kullanımı dirençli suşların ortaya çıkması ve bakterisidal etkinin oluşması için yüksek doz kullanımı ile toksisite riskini artırması nedeniyle önerilmemektedir (6,11).
Erken başlangıçlı neonatal sepsiste seçilecek antibiyotik tedavisi gram (+) koklara, özellikle B grubu streptokolara ve gram (-) enterik bakterilere yönelik olmalıdır. Başlangıçtan uygulanacak ampirik tedavide mutlaka penisilin veya penisilin türevi bulunmalı. Ampisilin bir çok antimikrobiyal kombinasyonda Enterekoklara, L.monocytogenes’e ve penisiline duyarlı olan diğer gram (+) koklara etkili olduğundan bir çok merkezde ilk seçilen penisilin türevidir. Aminoglikozitler (AG) ise gram(-) mikroorganizmalara karşı etkili olduğu için ampisilin ile birlikte ENS’de kombine olarak kullanılmaktadır. AG’ler içinde gentamisin en sık kullanılandır. Ayrıca amikasin, netilmisin ve tobramisin kullanılan diğer AG’lerdir. Nozokomiyal enfeksiyonlarda seçilecek AG olarak amikasin tercih edilmeli. Yapılan bir çalışmada AG kullanılan yenidoğanların 1/3’de ototoksik belirtilerin görülebileceği bildirilmiştir (99). Bu nedenle 7 günden fazla AG kullanan yenidoğanlara 3 aydan önce işitme tarama testi yapması önerilir.
Ampisilin Enterekok ve Listeria’ya karşı penisilinlerden daha fazla etkili iken, grup A - B streptokok ve pnömokoklara karşı daha az etkilidir. Gentamisin ile birlikte enterekok, listeria ve GBS’ye karşı sinerjistik etki gösterir (6).
GBS penisiline duyarlı olduğu kadar ampisilin ve 3.kuşak sefalosporinlere de (SS) duyarlıdır.
Listeria enfeksiyonlarında ilk seçilecek ilaç ampisilindir. Sefalosporinlerin Listeria’da etkinliği oldukça zayıftır.
E.coli’de ampisilinin tek başına etkinliği az olduğundan AG grubu ile kombine edilerek kullanılmaktadır.
Toplumdan edinilmiş GNS’te etkenler GBS ve gram (-) enterik basillere ek olarak S.pneumoniae, H.influenza tip B ve N.meningitidis ile meydana gelmektedir. Burada da ilk seçilecek ilaç kombinasyonu penisilin/ampisilin ve aminoglikozitlerdir. Menenjit sıklıkla geç başlangıçlı sepsise eşlik ettiğinden seçilecek ilacın merkezi sinir sistemine geçişinin iyi olması gerekir. Bu nedenle en sık kullanılan ilaçlar ampisilin ve 3. kuşak sefalosporinlerdir (Sefotaksim en sık kullanılan SS’dir).
3. Kuşak sefalosporinler kullanılırken riskleri ve yararları gözden geçirilmelidir. Bu antibiyotikler normal gastrointestinal kolonizasyonunun oluşumunu engelledikleri gibi dirençli bakteriler ve mantarlarla oluşacak enfeksiyonları kolaylaştırır. Ancak neonatal bir çok patojene etkili olması, serum ve BOS konsantrasyonlarının yüksek oluşu ve toksisite açısından serum konsantrasyonlarının izlenmesi gerekmediği için kullanım kolaylığı sağlar.
Direçli enfeksiyon riskini arttırması nedeniyle şüpheli yenidoğan sepsisinde 3. kuşak SS başlanması pek önerilmez. 4. kuşak bir SS olan sefepim, özellikle uzamış ve komplike olmuş enfeksiyonlarda ve 3. kuşak sefalosporinlere karşı direnç geliştirmiş bakteriyel enfeksiyonlarda kullanılmalıdır. Gram (+) ve gram (-) bakterilerle birlikte metisiline duyarlı S.aureus ve P.aeruginosa’ya karşıda etkilidir.
Nazokomiyal geç başlangıçlı sepsislerde tedavi, KNS, gram(-) enterik basiller, mantar, psödomonas ve serratia suşlarına yönelik olmalıdır. Bu nedenle tedaviye penisilinaza dirençli bir antistafilokokal penisilin ( nafsilin, oksasilin, metisilin gibi ) ve aminoglikozit veya 3. kuşak SS ile başlanmalıdır. Şant ve kateter varlığında etken olarak daha sık stafilokoklar görülmektedir. Stafilikokların çoğu penisilinaz ürettiği için ampisilin, penisilin ve SS’e dirençlidir. Bu hastalarda tedavide penisilinaza dirençli metisilin, nafsilin veya vankomisin başlanabilir. Vankomisin genel olarak tüm stafilokoklara, streptokoklara ve enterkoklara etkilidir.
Son yıllarda yenidoğan yoğun bakım ünitelerinde antibiyotik direnci önemli bir sorun olarak karşımıza çıkmaktadır. Özellikle vankomisine duyarsız S.aureus ve vankomisine dirençli Enterokokların görülmesi endişe vericidir. Bu nedenle MRSA’nın endemik olduğu yenidoğan ünitelerinde vankomisin kullanılımına devam edilmesine rağmen ampirik vankomisin kullanımı sınırlandırılmalıdır. Linezolid, MRSA’ya karşı etkili olan ve yenidoğanda kullanımı onaylanmış yeni bir
Psödomonas şüphesi olan enfeksiyonlarda seftazidim ve/veya bir aminoglikozit kullanılmalıdır. Yada antipsödomonal penisilinler karbenesilin, tikarsilin veya piperasilin gibi ilaçlar kullanılmalıdır. İntraabdominal enfeksiyonlarda NEK şüphesi varsa tedaviye metranidazol ilave edilir.
Erken Membran Rüptür’lü anneden doğan bebekte şayet membran rüptürü 24 saatten az ise antibiyotik başlamaya gerek yoktur. Şayet 24-72 saat arasında term doğan, korioamnionit olmayan, apgar skoru iyi ve bebeğin genel durumu stabil ise antibiyotik tedavisi başlanmaz. Ancak CRP, I/T oranı, sedimantasyon bakılması antibiyotik başlanması açısından yol gösterici olabilir. Preterm doğan bebekler ise klinik bulguları iyi olsa bile kan kültürü alınıp ikili antibiyotik başlanır ve kültür negatif gelene kadar tedaviye devam edilir. Bu hastalarda penisilin veya ampisilin ve aminoglikozit ile tedaviye başlanır (6). Membran rüptür zamanı 72 saatten uzun olan term bebeklerde herhangi bir klinik bulgu olmasa da kan kültürü alınıp ikili antibiotik başlanır ve steril olduğu öğrenilinceye kadar mevcut tedaviye devam edilir (1).
Yenidoğanlarda verilecek antibiyotiklerin dozu ve sıklığı bebeğin gestasyon yaşına, postnatal yaşına, tartısına, karaciğer ve böbrek fonksiyonlarının durumuna bağlıdır.
Aminoglikozidler, vankomisin ve kloramfenikol gibi antibiotiklerin serumdaki mevcut düzeylerinin takibi, tedavinin yönlendirilmesinde bize oldukça fayda sağlamakta (1).
Yenidoğan enfeksiyonlarından sorumlu patojenin belirlenmesinden ve antibiyotik durumunun saptanmasından sonra tedavinin en etkin antibiyotik ile sürdürülmesi gerekir. Bir çok yenidoğana sepsis şüphesi ile ampirik olarak tedavi başlanır. Ancak az bir bölümünde sepsis kültür ile kanıtlanmaktadır. Kültür sonucu negatif gelen hasta klinik duruma göre değerlendirilir. Şayet bebeğin genel durumu iyi sepsis bulguları yok ise antibiyotik kesilir. Hasta 24 saat gözlemde tutulduktan sonra taburcu edilir. Kültür sonucu negatif gelen ancak genel durumu iyi olmayan ve klinik olarak sepsis düşündüğümüz hastada tedaviye devam edilmelidir.
Neonatal sepsiste antibiyotik tedavisinin süreleri her vakada değişmekle beraber fokal enfeksiyonu olmayanlarda 7-10 gün, gram(-) enterik bakterilerle oluşan menenjitlerde 21 gün, GBS ve L.monocytogenes ile oluşan menenjitlerde ise 14 gündür.
Şekil 1 : 35 haftadan büyük ve birden fazla risk faktörü olan asemptomatik bebeğe yaklaşım (6)
12-24saatte klinik değerlendirme lökosit/formül
sepsis skoru<2 sepsis skoru>2 semptom/ semtom/ belirti var belirti yok
sepsis skorunu tekrarla Kötüleşme Normal Antibiyotiklere Başla Kültür(+)veya Kültür(-) veya LP bozuk LP normal
Şüpheli veya 48 saat tedavi Kanıtlanmış et ve iyi ise
Bakteriyemide taburcu et Hastanede 48 7-10 gün,
Saat gözle ve menenjitte 14-21 İyi ise eve gün tedavi Taburcu et
Kan kültürü al LP düşün Akc. grafisi
B) Destek tedavisi:
Sepsiste destekliyici tedavi oldukça önemlidir. Sepsis tanısı almış bebekler mutlaka yenidoğan yoğun bakım ünitelerinde monitorize edilerek takip edilmelidir. Elektrolit ve glukoz düzeyi normal sınırlarda tutulmalı, asit baz dengesi izlenmeli, uygun sıvı – elektrolit tedavisi uygulanmalı, hastanın enteral veya parenteral beslenmesi sağlanmalı, hipovolemi, hiponatremi, hipoglisemi ve hipokalsemi düzeltilmeli. Uygunsuz ADH salınımı varsa sıvı kısıtlanmasına gidilmeli. Septik şok varlığında sıvı tedavisine ek olarak inotropik ajanlar uygulanmalı (8,9,13). Hipoksi varsa düzeltilmeli, solunum sıkıntısı olan hastaya gerektiğinde ventilatör desteği sağlanmalı (8,19,13,43). Sepsiste steroid kullanımı hala tartışmalıdır. Adrenal yetersizlik varlığında kullanılabileceği söylensede yenidoğan sepsisinde bununla ilgili pek çalışma yoktur. Ayrıca sepsis ve menenjit vakalarında kernikterius sıklığı arttığında bu hastaların bilurubin seviyelerinin yakından takip edilmesi gerekir. Hastada konvülziyon varlığında antikonvülsif tedavi başlanmalı ve nedeni araştırılmalıdır.
Neonatal sepsiste DİK gelişebilir. Bu hastalarda trombosit, PT, aPTT, hemoglobin ve fibrin yıkım ürünleri izlenmelidir. DİK varlığında kanama olursa eritrosit, TDP ve trombositopeni varlığında ise trombosit süspansiyonu verilmelidir. Tedavinin amacı antibiyotik tedavisi kesilmeden en az 3 gün öncesinde, kültürlerin negatif olması, lökosit ve CRP değerlerinin normal olması ve bebeğin asemptomatik hale gelmesidir.
C) İmmünoterapi:
Yenidoğanın immün sistemindeki yetersizlik, bakteriyal sepsisli hastalarda immünoterapi tedavi yaklaşımını doğurmuştur (18,100). Yenidoğanların bağışıklık sisteminde 3 majör madde (spesifik antikorlar, kompleman ve nötrofiller) yetersizdir. Bakteriyal patojenlerin opsonizasyonu, fagositozu ve öldürülmeleri için bu 3 maddenin birlikte çalışması gerekir. Dolayısıyla , bu maddelerin ayrı ayrı verilmeleri yerine, kombine şekilde verilmesinin sepsisten korunmada daha etkili olabileceği düşünülmektedir. Anneden bebebeğe immünglobulin geçişi özellikle 32. haftadan sonra artmaya başlar. Bu durum pretermlerde mevcut olan yetersizliği daha da belirginleştirir. Bu nedenle intravenöz immünglobulin (IVIG)‘nın yenidoğan
enfeksiyonlarından koruma ve bu enfeksiyonların tedavisindeki yeri araştırılmış, mortalite ve hospitalizasyon süresinde önemli bir etki saptanmamıştır. Prematüre ve/veya düşük doğum ağırlıklı bebeklerde enfeksiyon veya sepsis profilaksisi için rutin intravenöz immünglobulin (IVIG) uygulaması önerilmemektedir (8,10,13,101). Yapılan bazı çalışmalar yenidoğan sepsisinde IVIG uygulamasının yararlı olduğunu söylesede, mortaliteyi azalttığı kanıtlanmamıştır (4,9,43).
Ağır yenidoğan sepsisinde kemik iliğinin baskılanması sonucu nötrofil salınımı azalmakta. G-CSF, kemik iliğinden immatür nötrofillerin salınımını arttırırken mevcut nötrofillerin maturasyonu içinde gereklidir (102). Rekombinan G-CSF verilmesiyle nötrofil sayısı ve havuzu arttırılarak mortalite azaltılmaya çalışılır. Bu amaçla 5-10 µg/kg olacak şekilde kullanımı önerilmektedir (1,6).
Sepsiste oluşan bulgular ve komplikasyonların çoğu inflamasyon sırasında ortaya çıkan mediatörlere bağlıdır. Bunlardan anti-TNF antikorları ve IL-1 reseptör antikorları tedavide denenmektedir.
TNF-α’nın endoksemi ve ağır enfeksiyonlarda rol oynadığı, septik şok ve ölüme neden olduğu yapılan hayvan çalışmalarında yüksek doz TNF-α’nın insandakine benzer septik şoka yol açtığı gösterilmiştir (88). Bu çalışmalar yapılırken TNF-α’nın etkisini inhibe eden antikorların tedavide kullanılması gündeme gelmiş ve tavşanlar üzerinde yapılan çalışmada ölümcül dozda endoksin verildikten yaklaşık 30-45 dk. sonra anti-TNF antikoru içeren serum verilen bu hayvanlarda hipotansiyon ve ölüm görülmemiştir (56).
Bir metilksantin türevi olan pentoksifilinin 30mg/kg’dan 3 gün süreyle verilmesinin TNF yapımını baskıladığı ve gr (-) sepsisli pretermlerin yaşama olasılığını arttırdığını bildiren yayınlar mevcuttur (18,63,103).
Sepsisli bebeklerde görülen pıhtılaşma bozukluğunun tedavisinde antitrombin IV kullanılabilir.
Bakterilerin akciğerdeki sürfaktanı inaktive ederek solunum yetersizliği geliştirdiği sepsislerde ekzojen sürfaktan verilebilir.
Septik şokta oluşan hipotansiyon ve kardiyovasküler bozuklukların etyolojisinde nitrik oksit (NO) fazlalığının etkili olduğunun anlaşılmasından sonra NO sentetaz inhibitörleri kullanılan vakalarda olumlu sonuçlar alınmıştır (104).