T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ TIBBİ BİYOKİMYA ANABİLİM DALI
ANKİLOZAN SPONDİLİT HASTALARINDA GÜNCEL
İNFLAMATUAR SİTOKİNLERİN İNCELENMESİ
DIŞ KAPAK
Dr. İSMAİL GASER (TIPTA UZMANLIK TEZİ)
ii BOŞ SAYFA
iii TEZ DEĞERLENDİRME JÜRİ TUTANAĞI
iv T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ TIBBİ BİYOKİMYA ANABİLİM DALI
ANKİLOZAN SPONDİLİT HASTALARINDA GÜNCEL
İNFLAMATUAR SİTOKİNLERİN İNCELENMESİ
Dr. İSMAİL GASER (TIPTA UZMANLIK TEZİ
İÇ PAK SAYFASI Prof. Dr. NURİYE METE
(TEZ DANIŞMANI)
v TEŞEKKÜR
Uzmanlık eğitimim süresince bilgi, hoşgörü ve yardımlarını esirgemeyen tez danışmanım ve anabilim dalı başkanı sayın Prof. Dr. Nuriye METE’ye,
Anabilim dalında eğitimime katkı sunan biribirinden değerli tüm saygıdeğer hocalarıma,
Uzmanlık eğitimlerini tamamlayıp bizlerle manevi bağlarını koparmayan ve hiç bir konuda desteklerini benden esirgemeyen sayın Uzm. Dr. Cemal POLAT , sayın Uzm. Dr. Murat AR, sayın Uzm. Dr.Cahit TEKİN ve sayın Uzm. Dr.Rahile ARSLAN'a
Çalıştığım süre zarfında hiçbir şekilde kırgınlık yaşamadığım aksine bana adeta bir aile ortamı havasını solutan çok kıymetli asistan arkadaşlarım Dr. Baver AKCAN DUMAN ve Dr. Ömer KENANOĞLU’na,
Tezimde çalıştığım hastaları bana yönlendiren Fizik Tedavi ve Rehabilitasyon asistanı sayın Dr. Özkan YÜKSELMİŞ’e,
Ve burada ismini tek tek sayamadığım birbirinden değerli onlarca laboratuar çalışanımıza
TEŞEKKÜR EDERİM.
Sevgili aileme en derin sevgilerimle…
Dr. İsmail GASER Diyarbakır/2017
Not: Bu tez Dicle Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü tarafından desteklenmiştir (Proje numarası: Tıp 16.033) .
vi ÖZET
Ankilozan spondilit(AS), erken evrede sakroiliyak eklemlerde inflamasyona yol açan ve hastalık ilerledikçe aksiyel omurgayı da etkileyebilen, inflamatuvar bel ağrısı, artrit, entezit ve sistemik tutuluma sebep olabilen, kronik inflamatuvar bir hastalıktır. Hastalık genç erişkinleri hayatın 3. dekatında etkiler ve erkeklerde kadınlardan daha sık görülür. Hastalığın patogenezinde başta genetik faktörler ve inflamatuvar sitokinler olmak üzere birçok faktör suçlanmasına rağmen hala hastalığın patogenezi net değildir. Bu çalışmamızda patogenezi tam olarak bilinmeyen AS hastalığında serum TNF-α, IL-33, IL-36α ve IL-36β düzeylerini incelemeyi amaçladık.
Dicle Üniversitesi Tıp Fakültesi Hastanesi, Fizik Tedavi ve Rehabilitasyon Polikliniklerinde takip edilen; Modifiye New York Kriterleri’ne göre AS tanısı konan 59 gönüllü hasta ve 30 gönüllü sağlıklı dahil edildi. Tüm hastaların hastalık aktiviteleri BASDAI, ASDAS-CRP ve ASDAS-ESH indeksleri kullanılarak hesaplandı. Tüm katılımcılar için ESH, CRP, hemogram parametreleri, serum TNF-α, IL-33, IL-36α ve IL-36β düzeyleri Dicle Üniversitesi Hastaneleri Merkez Laboratuarı’nda çalışıldı. Serum TNF-α, IL-33, IL-36α ve IL-36β düzeyleri ELISA yöntemiyle ölçüldü.
Hasta ile kontrol grubunun demografik verileri arasında anlamlı bir fark saptanmadı. Hasta grubu ile kontrol grubu arasında serum TNF-α, IL-33, IL-36α ve IL-36β konsantrasyonları bakımından anlamlı fark bulunmadı. BASDAI, ASDAS-CRP ve ASDAS-ESH ile serum TNF-α, IL-33, IL-36α ve IL-36β düzeyleri arasında korelasyon bulunmadı. TNF-α, IL-33, IL-36α ve IL-36β konsantrasyonları arasındaki korelasyona bakıldı ve sadece IL-36α ve IL-36β konsantrasyonları arasında hem hasta grubunda hem de kontrol grubunda çok güçlü korelasyon bulundu(Hasta: r=0,904, p=0.000; Kontrol: r=0.865, p=0.000).
Sonuç olarak, Ankilozan spondilit hastalarıyla kontrol grubu arasında serum TNF-α, IL-33, IL-36α ve IL-36β düzeyleri açısından anlamlı fark bulunmadı.
Anahtar kelimeler:Ankilozan spondilit, TNF-α, IL-33, IL-36α, IL-36β ,ELISA
vii ABSTRACT
Ankylosing spondylitis(AS) is a chronic inflammatory disease that causes inflammation in sacroiliac joints in the early stages and can cause inflammation of the backbone as the disease progresses, inflammation of the backbone, arthritis, enthesitis and systemic involvement. The disease affects young adults on the third decade of life and is more common in males than females. The pathogenesis of the disease is still unclear, although many factors, especially genetic factors and inflammatory cytokines, have been implicated in the pathogenesis of the disease. We aimed to investigate serum TNF-α, IL-33, IL-36α and IL-36β levels in ankylosing spondylitis in whom pathogenesis is not known precisely in this study.
Dicle University Medical Faculty Hospital, Physical Therapy and Rehabilitation Outpatient Clinic; According to the Modified New York Criteria, 59 voluntary patients with AS were diagnosed and 30 volunteers were included. Disease activities of all patients were calculated using the BASDAI, ASDAS-CRP and ASDAS-ESH activity indices. For all participants ESH, CRP, hemogram parameters, serum TNF-α, IL-33, IL-36α and IL-36β levels were studied in the Dicle University Hospitals Central Laboratory. Serum levels of TNF-α, IL-33, IL-36α and IL-36β were measured by ELISA method.
No significant difference was found between the patient and the control group in terms of demographic data. There was no significant difference in serum TNF-α, IL-33, IL-36α and IL-36β concentrations between the patient group and the control group. There was no correlation between serum TNF-α, IL-33, IL-36α and IL-36β levels in BASDAI, ASDAS-CRP and ASDAS-ESH disease activity indices. The correlation between TNF-α, IL-33, IL-36α and IL-36β concentrations was examined and there was a strong correlation between IL-36α and IL-36β concentrations in both patient group and control group (Patient: r = 0.904, p = 0.000; Control: r = 0.865, p = 0.000). In conclusion, serum TNF-α, IL-33, IL-36α and IL-36β levels were not significantly different between ankylosing spondylitis patients and control group.
viii İÇİNDEKİLER
DIŞ KAPAK ... i
BOŞ SAYFA ... ii
TEZ DEĞERLENDİRME JÜRİ TUTANAĞI ... iii
İÇ PAK SAYFASI ... iv TEŞEKKÜR ... v ÖZET... vi ABSTRACT ... vii İÇİNDEKİLER ... viii SİMGELER VE KISALTMALAR ... x TABLOLAR DİZİNİ ... xi ŞEKİLLER DİZİNİ ... xii 1.GİRİŞ ve AMAÇ ... 13 2.GENEL BİLGİLER ... 16
2.1.Ankilozan Spondilit Hastalığı ... 16
2.1.1.Tarihçe 17 2.1.2.Epidemiyoloji 17 2.1.3.Etiyopatogenez 18 2.1.4.Histopatoloji 21 2.1.5.Sınıflama ve Tanı Kriterleri 22 2.2.Sitokinler 24 2.2.1.Tümör Nekrozis Faktör-Alfa( TNF-α) 25 2.2.2.İnterlökin-1 Sitokin Ailesi 26 3.GEREÇ VE YÖNTEM ... 30
3.1. Gereçler ... 30
3.2. Kimyasal Maddeler ... 30
3.3. Örneklerin Toplanması ve İşlenmesi ... 30
3.4. Hastalık Aktivitesi Belirlenmesinde Kullanılan Testler ... 32
3.5. Yöntemler ... 37
3.5.1. C-reaktive protein(Nefelometrik yöntem) 37
3.5.2. Sedimantasyon ölçümü 37
ix 3.5.4.TNF-α tayini 39 3.5.5. IL-33 tayini 43 3.5.6.IL-36α tayini 47 3.5.7. IL-36β tayini 48 3.5. İstatistiksel Analiz ... 50 4. BULGULAR ... 51 5.TARTIŞMA ... 60 6.SONUÇ VE ÖNERİLER ... 69 7.KAYNAKLAR ... 71 BOŞ SAYFA ... 81
x SİMGELER VE KISALTMALAR
AS Ankilozan Spondilit
ASAS Uluslararası Spondiloartrit Değerlendirme Birliği ASDAS Ankilozan Spondilit Hastalık Aktivite Skoru
BASDAI Bath Ankylosing Spondylitis Disease Activity Index CRP C-reaktif protein
DMARD Hastalığı düzenleyen antiromatizmal ilaçlar ERAP Endoplazmik retikulum aminopeptidaz ESH Eritrosit sedimantasyon hızı
İBA İnflamatuar bel ağrısı İBH İnflamatuar barsak hastalığı NF-Kb Nükleer Faktör-kB
NSAİİ Steroid olmayan anti inflamatuvar ilaçlar PsA Psöriyatik artrit
pSS Primer sjogren sendromu
RA Romatoit artrit
ReA Reaktif artrit
SI Sakroiliak
SLE Sistemik Lupus Eritematozus SpA Spondiloartrit
TGF-β Doku büyüme faktörü-β TNF-α Tümör Nekrozis Faktör-Alfa
xi TABLOLAR DİZİNİ
Tablo 1. Roma Kriterleri,1961 ... 22
Tablo 2. New York Kriterleri,1966 ... 23
Tablo 3. Modifiye New York Kriterleri, 1984 ... 23
Tablo 4. Hasta ve kontrol grubunun demografik verileri. ... 51
Tablo 5. Hasta-kontrol grupları için aile öyküsü, sigara, alkol ve ilaç kullanımı ile ilgili verileri. ... 52
Tablo 6. Hasta ve kontrol grubu için, CRP, ESH, WBC ,HGB,PLT,IL-33,IL-36α ,IL-36β ve TNF-α düzeylerinin istatistiksel verileri. ... 53
Tablo 7. Hasta-kontrol değerlerinin normal dağılıma uygunluk testi sonuçları ... 54
Tablo 8. Hasta ve kontrol değerlerinden normal dağılım gösterenlerin (Yaş, Boy, BMİ ve PLT) Student t testiyle karşılaştırılması ... 55
Tablo 9. Hasta ve kontrol grubunun değerlerinin Mann-Whitney U testiyle karşılaştırılması. ... 56
Tablo 10. BASDAİ'ye göre aktif ve pasif hastalardaki IL-33, IL-36α, IL-36β ve TNF-α oranlarının Mann-Whitney U testiyle karşılaştırılması ... 56
Tablo 11. ASDAS-CRP'ye göre aktif ve pasif hastalardaki IL-33, IL-36α, IL-36β ve TNF-α oranlarının Mann-Whitney U testiyle karşılaştırılması ... 57
Tablo 12. ASDAS-ESH'ye göre aktif ve pasif hastalardaki IL-33, IL-36α, IL-36β ve TNF-α oranlarının Mann-Whitney U testiyle karşılaştırılması ... 57
Tablo 13. IL-33, IL-36α, IL-36β ve TNF-α konsantrasyonlarının BASDAİ ile korelasyonu ... 58
Tablo 14. IL-33, IL-36α, IL-36β ve TNF-α konsantrasyonlarının ASDAS-CRP ile korelasyonu. ... 58
Tablo 15. IL-33, IL-36α, IL-36β ve TNF-α konsantrasyonlarının ASDAS-ESH ile korelasyonu. ... 59
Tablo 16. IL-33, IL-36α, IL-36β ve TNF-α konsantrasyonlarının birbirleriyle korelasyonu. ... 59
xii ŞEKİLLER DİZİNİ
Şekil 1. N-peptit uzunluğuna göre IL-1 alt aileleri ve reseptörleri ... 26
Şekil 2.IL 36 sitokinlerin organlara göre hastalıklardaki rolleri ... 28
Şekil 3. BASDAI hastalık aktivite indeksi ... 33
Şekil 4. ASDAS-CRP Hesaplama Formu ... 35
Şekil 5. ASDAS-ESH Hesaplama Formu ... 36
Şekil 6.) Sedimantasyon ölçüm cihazı çalışma prensibi. ... 38
Şekil 7. Anti- human TNF-alfa antikor kaplı mikro kuyucuk ... 39
Şekil 8.Birinci inkübasyon( TNF-α ölçümü) ... 39
Şekil 9.İkinci inkübasyon (TNF-α ölçümü) ... 40
Şekil 10. Üçüncü inkübasyon (TNF-α ölçümü) ... 40
Şekil 11.HRP ile reaksiyona giren substrat (TNF-α ölçümü) ... 41
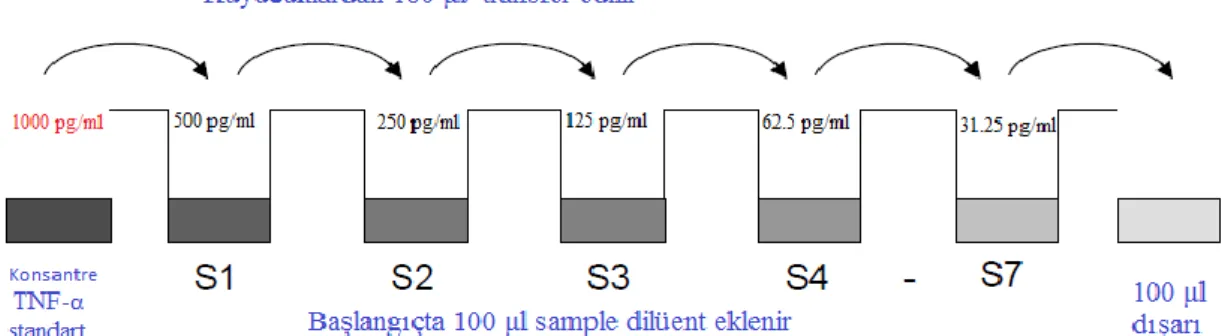
Şekil 12. Standartları hazırlanması ( TNF-α ölçümü) ... 41
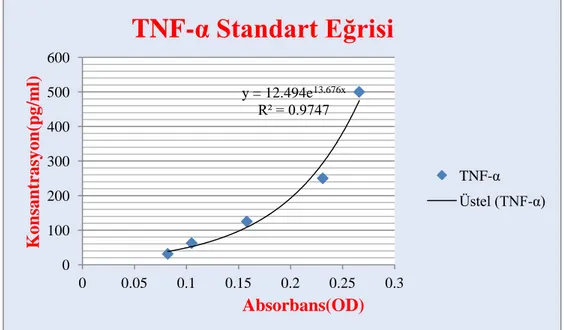
Şekil 13.TNF-α standart eğrisi ... 42
Şekil 14. Anti-human IL-33 antikor kaplı mikro kuyucuk ... 43
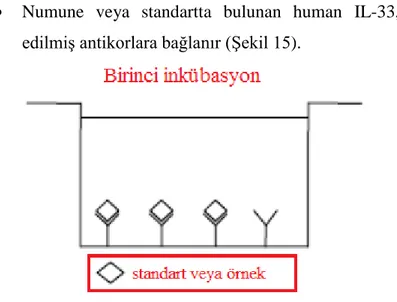
Şekil 15. Birinci inkübasyon ( IL-33 ölçümü) ... 43
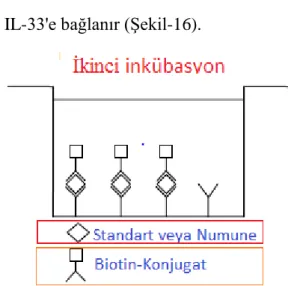
Şekil 16. İkinci inkübasyon( IL-33 ölçümü) ... 44
Şekil 17. Üçüncü inkübasyon( IL-33 ölçümü) ... 44
Şekil 18. Dördüncü inkübasyon ( IL-33 ölçümü) ... 45
Şekil 19. HRP ile reaksiyona giren substrat ( IL-33 ölçümü) ... 45
Şekil 20.IL-33 standart eğrisi ... 46
Şekil 21. IL-36α standart eğrisi ... 48
13 1.GİRİŞ ve AMAÇ
Ankilozan Spondilit (AS); etiyolojisi bilinmeyen, en sık sakroiliak eklemleri ve omurgayı tutan, ayrıca diğer eklemleri, entezis bölgelerini etkileyebilen ve eklem dışı tutulum da yapabilen otoimmün, kronik inflamatuvar bir hastalıktır. AS'nin klinik belirtileri genellikle geç adölesan ve erken erişkinlik döneminde başlar. Hastalık genç erişkinleri hayatın 3. dekatında etkiler ve erkeklerde kadınlardan daha sık görülür [1]. AS'nin prevalansı genel olarak %0.1 ile %1.4 arasındadır. AS prevalansı Avrupa'da ortalama 10000'de 23.8, Asya'da 16.7, Kuzey Amerika'da 31.9, Latin Amerika'da 10.2 ve Afrika'da 7.4' tür [2] .
Romatoit Artrit’li hastalarda Tümör Nekrozis Faktör-Alfa'nın (TNF-α) rolü son yıllarda araştırılmış,TNF-α’yı bloke eden ajanlarla çeşitli çalışmalar yapılmış ve TNF-α’nın eklem hasarını ve hastalık progresyonunu azaltıcı etkisi gösterilmiştir. AS ile RA’nın etyopatogenezi farklı olmakla birlikte, AS’de de TNF-α’nın inflamasyonda rol oynayabileceği düşünülmektedir. Bir çalışmada konsantrasyonu hastalık aktivitesi ile korelasyon göstermemesine rağmen AS’li hastaların serumunda inflamatuvar olmayan bel ağrılı hastalara göre daha yüksek miktarda TNF-α’ya rastlanmıştır [3]. Daha yeni bir çalışmada AS’li hastaların sakroiliak eklem biyopsilerinde yüksek miktarda TNF-α mRNA ve protein bulunmuştur [4]. Spondiloartrit(SpA) ve inflamatuvar bağırsak hastalıkları arasındaki ilişki de AS'de TNF-α’nın bir rolü olabileceğinin kanıtı olabilir. Erken dönem Crohn hastalığına benzeyen mikroskobik ve makroskobik bağırsak inflamasyonu AS’li hastaların %20-60'ında görülmektedir. AS’deki bağırsak lezyonları sessiz olabilir ve daha çok akut periferik artritli hastalarda rastlanmıştır. İnvitro çalışmalar Crohn’lu hastaların bağırsak mukozasında TNF-α üretiminin arttığını göstermiştir. Klinik çalışmalar da anti-TNF-α monoklonal antikoru olan İnfliksimab'ın bu inflamatuvar bağırsak hastalığında tedavi edici etkisini ortaya koymuştur [5]. Daha sonra ankilozan spondilit hastalarında yapılan bir anti-TNF(etanercept-infliksimab) ilaç çalışmasında anti-TNF-α ilaç kullananlarda %80'e kadar olumlu etkiler gözlenmiştir [6, 7]. TNF-α inhibitörlerine AS'li hastaların dramatik yanıt vermesi
14 TNF-α'nın AS patogenezinde rol aldığının en önemli göstergesi olmuştur. Ancak her hastada TNF-α inhibitörlerine yanıt alınamamış olması diğer sitokinlerin de patogenezde rolünün olabileceğini düşündürmektedir. Biz de çalışmamızda TNF- α ile birlikte Ankilozan spondilit hastalığında etkinliği olabileceğini düşündüğümüz güncel sitokinler olan IL-33, IL-36 alfa(IL-36α) ve IL-36 beta'yı(IL-36β), incelemeyi amaçladık.
IL-33, IL-1 Reseptör ailesinden ST-2'yi uyararak NF-kB yolağını aktive ederek etki gösteren proinflamatuvar bir sitokindir. Yapılan bir çalışmada AS hastalarında serum IL-33 düzeyi IL-33 mRNA düzeyi ve ST-2 reseptör düzeyi sağlıklı kontrollere göre anlamlı yüksek bulunmuştur [8]. Yapılan diğer bir çalışmada IL-33 serum düzeyi BASDAI(Bath Ankylosing Spondylitis Disease Activity Index) ile aktivitesi belirlenmiş aktif ankilozan spondilit hastalarında yüksek bulunmuş aynı zamanda c-reaktif protein (CRP) ve eritrosit sedimantasyon hızı (ESH) düzeyleri ile de korelasyon göstermiştir [9]. Yapılan başka bir çalışmada IL-33 serum düzeyi BASDAI ile aktivitesi belirlenmiş aktif ankilozan spondilit hastalarında yüksek bulunmuş aynı zamanda TNF-α ile de korelasyon göstermiştir [10].
IL-36α ve IL-36β, IL-1 Sitokin reseptör ailesinden sitokinlerdir. IL-36α ve IL-36β proinflamatuvar etki gösterirler. IL-36 sitokinler keratinositler, epitel hücreleri, monosit/makrofaj,plazma hücreleri ve T hücrelerince sentezlenirler [11]. Diğer inflamatuvar sitokinlerin sentezini (TNF-α,IL-17A, IL-22) arttırırlar aynı zamanda diğer sitokinler de bu sitokinlerin sentezini arttırırlar [12]. RA hastalarında yapılan bir çalışmada IL-36α'nın plazma hücrelerinden yüksek düzeyde sentezlendiği bulunmuştur [13]. Başka bir çalışmada IL-36α ve IL-36β'nın RA’da sağlıklı kontrollere kıyasla anlamlı yüksek bulunmuş ve IL-36α düzeyi CRP ile korelasyon göstermiştir [14]. Yapılan kesitsel çalışmalarda aktif SLE hastalarında plazma IL-36α ve periferal IL-36R +B lenfositlerin daha fazla üretildiği bulunmuştur [15]. Primer sjogren sendromu (pSS) olan hastalarda yapılan bir çalışmada hastaların tükürük ve serumunda IL-36α anlamlı yüksek bulunmuş ve hastalık aktivitesi ile korelasyon göstermiştir [16]. İnflamatuar barsak hastalığı olan hastaların mukozalarında (özellikle ülseratif kolit) IL-36α sentezinde artış bulunmuştur [17]. Diğer bir çalışmada Chron Hastalığı olanlarda IL-36α sentezinin uyarıldığı
15 bildirilmiştir [18]. Yapılan bir çok fare modeli çalışmasında ve genetik çalışmalarda IL-36 sitokinlerin yaygın püstüler psöriazis patogeneziyle ilişkili olduğu gösterilmiştir. Bu sitokinler daha çok keratinositlerden salgılanmış olup, mononükleer hücreler, makrofaj, dentritik hücrelerde de pozitif bulunmuştur. Farelerdeki psöriazis modellerinde ve insan psöriazisinde IL-36α, IL-36β, ve IL36Ra mRNA düzeyleri anlamlı şekilde indüklenmiş ve IL-1β ve Th17 sitokinleri (IL-17A,IL-22,IL-23,CCL20) ile korale bulunmuştur [12, 19]. IL-36 sitokinlerin ankilozan spondilit patogenezindeki etkisi ve hastalıkla ilişkisiyle ilgili yapılmış hiçbir çalışma bulunmamaktadır. Çalışmamız bu konuda ilk olacaktır. Amacımız IL-33 ve interlökin 36 sitokinlerin (IL-36α, IL-36β) ankilozan spondilit hastalığıyla ilişkisi olup olmadığını, bu sitokinlerin hastalıkla ilişkisi varsa hastalık patogeneziyle ilişkisi bilinen TNF-α ile korelasyonunun olup olmadığını incelemektir. Bu çalışmamız patogenezi tam olarak bilinmeyen Ankilozan Spondilit hastalığının patogenezinin anlaşılmasına ve ilerde yapılacak anti-sitokin tedavi çalışmalarına katkı sağlayacaktır.
16 2.GENEL BİLGİLER
2.1.Ankilozan Spondilit Hastalığı
Spondiloartropati (SpA), ortak patofizyolojik, klinik, radyolojik ve genetik özelliklere sahip olan kronik romatizmal hastalıklara verilen isimdir. Karakteristik semptom ve bulguları kronik inflamatuvar bel ağrısı (İBA), periferik eklem artriti ve iskelet-dışı tutulumdan meydana gelen klinik tabloyu kapsar [20]. Spondiloartropati şemsiyesi altına, ankilozan spondilit (AS), reaktif artrit (ReA), psöriyatik artrit(PsA), inflamatuvar barsak hastalıklarıyla birlikte olan artritler (enteropatik artritler), jüvenil idiyopatik artrit, ve sınıflandırılamayan spondiloartritler girer [21].
Ankilozan spondilit spondiloartropatilerin en önemli üyesidir. Ankilozan spondilit(AS) terimi, teşhisin bir hastada ancak klinik olarak omurgada ankiloz geliştikten sonra konulabildiği 1900'lü yıllarda hastalarda ankiloz geliştiği için kullanılmıştır. Radyografinin artan kullanımı ile 1930'lu yıllarda hastalığın normalde sakroiliak(SI) eklemlerde başladığı anlaşılmıştır [21, 22].
Genellikle erken evrede sakroiliyak eklemlerde inflamasyona yol açar ve hastalık ilerledikçe aksiyel omurgayı da etkileyebilir. Klinik bulgular arasında inflamatuvar bel ağrısı, özellikle alt ekstremitelerde olan asimetrik periferal oligo-artrit ve kasların kemiklere yapıştığı yerlerde entezit yer alır [23]. Hastalığa, akut anterior üveit, aort yetmezliği, kardiyak iletim bozuklukları, akciğer üst loblarının fibrozisi, böbrekte amiloid birikimi gibi iskelet dışı bulgular eşlik edebilir [24, 25].
Hastalık genç erişkinleri hayatın 3. dekatında etkiler ve erkeklerde kadınlardan daha sık görülür [1].
Hastalığın patogenezinde başta genetik faktörler ve inflamatuvar sitokinler olmak üzere birçok faktör suçlanmasına rağmen hala hastalığın patogenezi net değildir [6, 7, 26].
17 2.1.1.Tarihçe
1693'te İrlandalı bir doktor olan Bernard Connor, belirgin bir omurga eğriliğine sahip olan bir insan iskeletinde AS'yi ilk defa tarif etmiştir. Bununla birlikte, Rusya'da Wladimir von Bechterew'in (1893), Almanya'da Adolph Strümpell'in (1897), Fransa'da Pierre Marie'nin (1898) ve Connor'un tanımlamaları, AS'nin ilk tanımlamaları olarak literatürlere geçmiştir. Von Bechterew'in klasik AS tanımlaması, Bechterew hastalığı teriminin ortaya çıkmasına neden olmuş bu erken anatomik ve klinik tanımlar ayrı bir hastalık varlığı olarak AS'yi oluştursa da, AS kavramı bilimsel ve tıptaki röntgen ve diğer gelişmelerin ortaya çıkışı ile gelişmiştir. 1850’de Brodie 31 yaşında omurga ankilozu gelişmiş ve beraberinde şiddetli göz inflamasyonu geçiren erkek hastanın klinik özelliklerini tanımlamıştır. 19.yy ikinci yarısında AS’nin klinik tanımı Strumpell, Vladimir Bechterew ve Pierre Marie tarafından yapılmıştır [27, 28]. Erken hastalardaki sakroiliit ve ileri hastalıkta sendromlar da dahil olmak üzere AS'nin radyolojik bulguları, 1930'lu yıllarda Krebs, Scott, Forestier ve Robert tarafından tanımlanmıştır. [27, 29]. Bu tanımlar, AS'nin klinik seyrini aydınlatmaya yardımcı olmuş ve günümüzde hastalığın tanı ve evrelemesinde hala kullanılmaktadır.
2.1.2.Epidemiyoloji
AS genç erişkinleri etkileyen bir hastalıktır. Genellikle yaşamın üçüncü on yılında, nadiren 45 yaşından sonra ortaya çıkar [2]. HLA-B27 pozitif hastalarda, HLA-B27 negatif hastalara göre yaklaşık 5 yıl erken başlar [24]. Ankilozan spondilit yaygınlığı belirli bir popülasyonda HLA-B27 prevelansını yansıtmaktadır ve HLA-B27 pozitif olanlarda olmayanlara göre daha sık görülür[30].
Erkeklerde kadınlardan daha sık görülür fakat oran bölgesel değişiklik göstermekle birlikte yaklaşık 2-3:1 kadardır[24] . Türkiye'de erkek kadın oranı 1.2-3:1'dir [31, 32].
AS'nin dünyada görülme sıklığı bölgesel değişiklik gösterir. AS'nin prevalansı genel olarak %0.1 ile %1.4 arasındadır . AS prevalansı Avrupa'da ortalama 10 000'de 23.8, Asya'da 16.7, Kuzey Amerika'da 31.9, Latin Amerika'da 10.2 ve Afrika'da 7.4'tür [2] .
18 Farklı ülkelerdeki çalışmalarda ankilozan spondilit insidansı yılda 100.000 kişi başına 0-5 ve 14 arasında görülmektedir [33] . Türkiye'de AS sıklığıyla ilgili yapılan çalışmalar kısıtlıdır. Kullanılan tanı kriterleri ve bölgesel farklılıklardan dolayı farklı sonuçlar ortaya çıkmıştır. Önen F. ve arkadaşlarının 2008'de İzmir'de 2887 kişiyle yaptıkları bir çalışmada SpA prevelansı erkeklerde %0.88, kadınlarda %1.22; AS prevelansı toplumda %0.49, erkeklerde %0.54, kadınlarda %0.44 olarak bulunmuştur [32]. Çakır N. ve arkadaşlarının 2012'de Havsa'da Roma kriterlerine göre 18,771 kişide yaptığı bir araştırmada AS prevalansı çalışma popülasyonunda %0.12, erkeklerde %0.18 ve kadınlarda % 0.06 bulunmuştur [31].
2.1.3.Etiyopatogenez
Ankilozan spondilit ve diğer spondiloartritlerin nedeni net olarak bilinmemektedir. Patogenezde iki temel özellik inflamasyon ve omurgada yeni kemik oluşumudur. İnflamasyonun yeni kemik oluşumunu tetiklediği varsayılsa da, inflamasyon ile osteoproliferasyon arasında yakın ilişki yoktur. Spondiloartritlerde, özellikle ankilozan spondilitte güçlü bir genetik etki vardır. Bu etkinin yaklaşık üçte biri HLA-B27 ile açıklanmaktadır. Geri kalan, henüz büyük ölçüde tanımlanmamış, MHC ve MHC dışı genlerle ilişkilidir [34]. Ankilozan spondilit hastalarında HLA-B27 %90-95 pozitiftir ve hastalığa yakalanma riski, HLA-B27 pozitif bireylerde yaklaşık %5'e kadar yükselir ayrıca hastaların HLA-B27 pozitif yakınlarında da risk oldukça yüksektir, ancak HLA-B27 pozitif bireylerin çoğu sağlıklıdır [35, 36].
HLA-B27'ye ilaveten, iki başka genetik lokus ankilozan spondilit ile ilişkilendirilmiş ve işlevsel fonksiyonu olabilir: endoplazmik retikulumda eksprese edilen bir aminopeptidaz kodlayan ve immün efektör hücrelere MHC sınıf 1 sunumu için peptitlerin hazırlanmasına katılan endoplazmik retikulum aminopetidaz (ERAP) ve sitokin interlökin-17'yi salgılayan yardımcı T hücreleri ve diğer proinflamatuvar hücreleri aktive eden interlökin-23 reseptörü genleridir [37]. ERAP1 ankilozan spondilit ile ilişkilidir. ERAP1 sadece HLA-B27 pozitif bireylerde ankilozan spondilit riskini etkiler. Bu bulgular, HLA-B27'nin ankilozan spondilitte, antijenik
19 peptidlerin anormal işlemesini içeren bir mekanizma ile faaliyet gösterdiğine dair güçlü kanıtlar sunmaktadır [38].
Bakteriler ile HLA-B27 arasındaki muhtemel etkileşim, spondiloartritlerin patogenez modellerinde çok önemli bir role sahiptir. Reaktif artritin Chlamydia trachomatis ile genitoüriner enfeksiyonlar veya Shigella, Salmonella, Yersinia ve Campylobacter spp gibi gram-negatif enterobakterilerin sebep olduğu enterit tarafından tetiklenmesi gerçeği bu yaklaşımı destekler, ancak diğer spondiloartritlerde enfeksiyonların tetiklemesine dair kanıtlar yüzeyseldir [39]. Reaktif artritli HLA-B27 pozitif hastaların yaklaşık %10-20'si, 10-20 yıl sonra ankilozan spondilitin tam klinik tablosunu geliştirir [40]. Crohn hastalığı, HLA-B27 pozitifliği ve ankilozan spondilit arasındaki ilişki ile spondiloartritlerin patogenezinde bakterilerin olası bir rolü daha da desteklenmektedir: Crohn hastalığı olan HLA-B27 pozitif hastaların% 54'ünde ankilozan spondilit gelişirken, HLA-B27 negatif hastalarda sadece % 2,6 bu hastalık gelişir [41]. Bilinen Crohn hastalığı olmayan Ankilozan spondilitli hastaların yaklaşık% 50'sinde bağırsak mukozasında Crohn hastalığına benzeyen makroskobik veya mikroskobik mukozal kronik lezyonlar tespit edilmiştir [42]. Aksiyel spondiloartrit, vakaların yaklaşık % 15-20'si klinik olarak inflamatuvar bağırsak hastalığı, sedef hastalığı veya reaktif artrit ile birlikte bulunur [24]. Ancak, bu hastalıklar klinik olarak sessiz olabilir; bu nedenle bu ilişki çok daha yüksek olabilir [43, 44]. Bu nedenle, dermal yüzeylerin (sedef hastalığı) ve mukozal yüzeylerin (iltihabı bağırsak hastalığı) bariyer hasarları ve bunun ardından bağışıklık sisteminin mikroorganizmalara maruz kalması patogenez ile alâkalı görünmektedir.
Ankilozan spondilit patogenezinde suçlanan bir başka etmende inflamasyon sürecinde rol alan inflamatuvar sitokinlerdir. Bu sitokinlerden en fazla çalışılan ve en fazla ilişkili bulunan sitokin TNF- α'dır. Yapılan birçok çalışmada TNF-α serum düzeyi AS hastalarında sağlıklı kontrollere göre yüksek bulunmuştur [3, 45]. Sakroiliyak eklemlerden alınan sinovyum biyopsilerinde TNF-α ve reseptörünün ekspresyonu yüksek bulunmuştur [45] . SpA ve inflamatuvar bağırsak hastalıkları arasındaki ilişki de AS de TNF-α’nın bir rolü olabileceğinin kanıtı olabilir. Erken dönem Crohn hastalığına benzeyen mikroskobik ve makroskobik bağırsak
20
inflamasyonu AS’li hastaların %20-60’inda görülmektedir. AS’deki bağırsak lezyonları sessiz olabilir ve daha çok akut periferik artritli hastalarda rastlanmıştır. invitro çalışmalar Crohn’lu hastaların bağırsak mukozasında TNF-α üretiminin arttığını göstermiştir. Klinik çalışmalar da anti-TNF-α monoklonal antikoru olan infliksimabın bu inflamatuvar bağırsak hastalığında tedavi edici etkisini ortaya
koymuştur [5]. Daha sonra ankilozan spondilit hastalarında yapılan bir anti-TNF(etanercept-infliksimab) ilaç çalışmasında anti-TNF-α ilaç kullananlarda
%80'e kadar olumlu etkiler gözlenmiştir [6, 7]. TNF-α inhibitörlerine AS'li hastaların dramatik yanıt vermesi TNF-α'nın AS patogenezinde rol aldığının en önemli göstergesi olmuştur. Ancak her hastada TNF-α inhibitörlerine yanıt alınamamış olması diğer sitokinlerin de patogenezde rolünün olabileceğini düşündürmektedir.
IL-33, IL-1 Reseptör ailesinden ST-2'yi uyararak NF-kB yolağını aktive ederek etki gösteren proinflamatuvar bir sitokindir.Yapılan bir çalışmada AS hastalarında serum IL-33 düzeyi IL-33 mRNA düzeyi ve ST-2 reseptör düzeyi sağlıklı kontrollere göre anlamlı yüksek bulunmuştur [8]. Yapılan diğer bir çalışmada IL-33 serum düzeyi BASDAI(Bath Ankylosing Spondylitis Disease Activity Index) ile aktivitesi belirlenmiş aktif ankilozan spondilit hastalarında yüksek bulunmuş aynı zamanda c-reaktif protein(CRP) ve eritrosit sedimantasyon hızı (ESH) düzeyleri ile de korelasyon göstermiştir [9]. Yapılan başka bir çalışmada IL-33 serum düzeyi BASDAI ile aktivitesi belirlenmiş aktif ankilozan spondilit hastalarında yüksek bulunmuş aynı zamanda TNF-α ile de korelasyon göstermiştir [10].
AS'nin karakteristik özelliklerinden biri ankilozdur, buna rağmen patogenezi ile ilgili az şey bilinmektedir. İnflamasyonla beraberliğinden dolayı özellikle yapılan çalışmalarda TGF-B süper ailesinden olan kemik morfogenik proteinleri (BMP) ankilozla ilişkilendirilmiştir. BMP ailesinin üyeleri, yani BMP-2, -3 ve -7, osteoblast farklılaşmasında kritik bir rol oynadıkları ve mezenkimal hücreleri uyararak AS'deki entezit ve ankiloz oluşumuna katkı sağladıkları bulunmuştur [46, 47]. Yapılan diğer bir çalışmada BMP-2 ve BMP-7'nin AS hastalarında aşırı üretildiği ve serum BMP-7 düzeylerinin AS'de gözlenen radyografik hasarlarla korale olduğu bulunmuştur [48].
21 AS etiyopatogenezinde genetik faktörler, çevresel faktörler ve immün sistemden salgılanan sitokinler suçlansa da bu konu hala netleşmemiştir. Bu konuda yeni yapılacak çalışmalara ihtiyaç vardır.
2.1.4.Histopatoloji
AS histopatolojik olarak sakroiliyak eklemler ve periferik entezislerde subkondral kemik iliğinin inflamasyonu ile karakterizedir ve tipik olarak agregan ve tip II kollajenden zengin, simfizis pubis, manubriosternal eklem, intervertebral disk, aort kökü ve duvarı, anterior uvea, arterlerin media katmanı gibi fibrokıkırdak içeren bölgeleri tutar [49].
Sinovit, pannus oluşumu, miksoid kemik iliği, yüzeysel kıkırdak yıkımı, entezit, intraartiküler fibrozis, yeni kemik oluşumu ve kemik ankilozu, AS'de oluşan değişikliklerdir[50].
Ankilozan spondilit hastalarından sakroiliak eklem biyopsi örneklerinin incelenmesinde immünhistolojik ve in situ hibridizasyon tekniklerinin kullanılması ile yapılan bir çalışmada sakroiliak eklemlerde CD3 +, CD4 +, CD8 +, CD14 +, CD45RO + ve CD45RA + hücreler (T hücreleri ve makrofajlar) SI eklemlerinin sinovyal kısmında bulunmuş ayrıca eklem aralığındaki sızıntılarda yüksek miktarda tümör nekroz faktörü-α (TNF-α) mRNA ve yeni kemik oluşum yeri yakınında düşük miktarda aktive edici büyüme faktörü-β (TGF-β) mRNA tespit edilmiştir [4]. Daha sonraları yapılan çalışmalar TGF-β'nın yeni kemik oluşumuyla ilişkili olabileceğini göstermiştir [46, 47] .
Sakroiliit AS'nin tanımlanmış en erken belirtisidir, ancak periferik eklemler ve eklem dışı yapılar da etkilenebilir. Subkondral dokular granülomatöz olur ve plazma hücreleri, lenfositler, mast hücreleri, makrofajlar ve kondrositlerle infiltre olur. Zamanla etkilenen eklemlerde düzensiz erozyonlar ve skleroz gelişir.Eklem aralığındaki yapılar kademeli olarak fibrokartilaja dönüşür ve daha sonra kemikleşir. Bu lezyonlar omurgada oluştuğunda, disk kıkırdağının anulus fibrozusu ve omur kemiği marjının birleşimi geri dönüşü olmayan hasara uğrar. Dış anulus fibrozus kemiğe dönüşür ve zamanla vertebra füzyona uğrar. Hastalığın ileri
22 aşamalarında füzyon tipik olarak omurgayı yükselterek "bambu omurgası" olarak adlandırılan uzun kemikli bir sütun oluşturur [29, 50].
2.1.5.Sınıflama ve Tanı Kriterleri
Sınıflama,belirli bulgular kombinasyonunu taşıyan hastaları farklı gruplara bölmek demektir. Kriterler, spesifik bir sınıfa dahil edilecek hastalarla bu sınıfa dahil edilmeyecek hastaları tanımlamaya yarar.
Tablo 1. Roma Kriterleri,1961 Klinik Kriterler
1-Üç aydan fazla süren ve istirahatla düzelmeyen bel ağrısı ve sertlik 2-Torakal bölgede ağrı ve sertlik
3-Lomber omurga hareketlerinde kısıtlılık 4-Göğüs ekspansiyonunda kısıtlılık 5-İritis öyküsü veya sekel varlığı Radyolojik Kriterler
6-Radyolojik olarak AS'ye özgün bilateral SİE değişikliklerinin olması Kesin AS için,eğer:
1- Evre 3-4 bileteral sakroiliit ve en az 1 klinik kriter 2-En az 4 klinik kriter varsa
AS birçok kriter tanımlanmıştır. AS' de tanı çoğu hastalıkta olduğu gibi klinik, laboratuar ve görüntüleme kriterlerine göre konur. Günümüze kadar AS için farklı kriterler tanımlanmıştır. Ankilozan spondilit (AS) için ilk tanı kriterleri 1963'te Roma konferansında belirlenmiştir (Tablo-1). 1966'da Roma kriterlerinden özgüllüğü düşük olan torasik ağrı ve duyarlılığı düşük olan üveit çıkarılmış ve New York kriterleri tanımlanmıştır (Tablo-2) [51]. Bu kriterlere göre yapılan çalışmalarda
duyarlılığın düşük olmasından dolayı bu kriterlerde modifikasyona gidilmiş ve 1984 yılında modifiye New York kriterleri yayınlanmıştır (Tablo-3). Bu modifikasyonla New York kriterleriyle %76 olan duyarlılık %83'e çıkmış ve özgünlük %99'dan %98'e düşmüştür [52]. Modifiye New York Kriterleri günümüzde hala etkin olarak kullanılmaktadır.
23 Tablo 2. New York Kriterleri,1966
Klinik Kriterler
1- Lomber omurgada 3 planda hareketlerinde kısıtlılık: öne fleksiyon, lateral fleksiyon, ve ekstansiyon
2-Dorsolomber bileşke veya lomber omurgada ağrı veya ağrı öyküsü
3-Dördünçü interkostal aralıktan ölçülen göğüs ekspresyonunun 2,5 m ve altında olması
Radyografilerin evrelemesi
Evre 0:Normal Evre 1:şüpheli Evre 2: Minimal sakroiliit Evre 3: Orta derece sakroiliit Evre 4: Ankiloz
Kesin AS için,eğer:
1- Evre 3-4 bileteral sakroiliit ve en az 1 klinik kriter
2-- Evre 3-4 tek taraflı veya evre 2 tarafta sakroiliit ve ilk klinik kriter veya ikinci ve üçüncü klinik kriterler varsa
Tablo 3. Modifiye New York Kriterleri, 1984 Klinik Kriterler
1-En az üç aydır süren egzersizle düzelen ve istirahatla azalmayan bel ağrısı ve sertlik
2- Lomber omurganın sagital ve frontal bölgede hareket kısıtlılığı 3- Göğüs ekspansiyonunun normal yaş ve cinsiyete göre azalması 4a.) İki tarafta evre 2-4 sakroiliit
4b.) Tek tarafta evre 3-4 sakroiliit
Kesin AS tanısı için: 4a veya 4b ve veya klinik kriterlerden biri varsa(1-3) tanı konur.
24 2.2.Sitokinler
Sitokinler, immün sistem hücrelerinin birbiri ile olan ilişkilerini düzenleyen protein veya glikoprotein yapıda maddelerdir [53]. Sitokinler, inflamasyon, hücre büyümesi, yara iyileşmesi ve yaralanmaya karşı sistemik yanıtı da içine alan bağışıklık ve inflamatuvar olayları düzenlerler [54]. Yüzün üzerinde sitokin tanımlanmıştır ve bu konuda devam eden çalışmalarda bunlara sürekli yenileri eklenmektedir.
Sitokinler, hormonlarla benzer özellikler taşısalar da, hormonlar sitokinlerden farklı olarak tipik şekilde özelleşmiş hücrelerden üretilir ve damar içine salınır. Aynı zamanda uzakta etki gösterirler ki bu durum hormonların endokrin etkisidir. Sitokinlerin ise sentez ve salgılanmaları geçici ve kısa sürelidir, depolanmazlar. Çok düşük konsantrasyonlarda hormonlara benzer biçimde reseptörlere bağlanarak etkilerini gösterirler. Otokrin, parakrin ve endokrin etkileri mevcuttur [55].
Sitokinler, immün yanıtın başlamasını ve sürmesini düzenleyerek mikroplara ve yabancı antijenlere karşı oluşacak immün dirençte aracılık ederken immün yanıtın şeklini de tayin ederler. Ancak aşırı sentezlendikleri takdirde, patogenezi olumsuz yönde indükleyerek doku ve organlara zarar verebilirler [56].
Sitokinlerin etkileri hakkında bilgilerin çoğu in-vitro çalışmalara dayanmaktadır. Sitokinler in-vivo olarak sadece tek başlarına değil, diğer sitokinlerle birlikte salındıklarından, in-vivo olarak etkilerinin belirlenmesi oldukça zordur. Bundan dolayı, in-vivo olarak hangi etkilerinin önemli olduğu halen tam olarak bilinmemektedir. Son yıllardaki gelişmeler rekombinant sitokinlerin ve sitokin antagonistlerin elde edilmesini sağlamış, bu gelişmeler de klinisyenlere birçok hastalığın gidişatını değiştirme olanağı sağlamıştır [53]. Özellikle ASAS tavsiyelerine göre konvansiyonel tedavilere rağmen, sürekli olarak yüksek hastalık aktivitesi olan hastalara anti-TNF tedavi verilmesi önerilmektedir [57].
25 2.2.1.Tümör Nekrozis Faktör-Alfa( TNF-α)
TNF-α ilk olarak 1984 yılında lenfosit ve monosit hücrelerinden izole edilmiş ve kültür ortamındaki tümör hücrelerini öldürmüş aynı zamanda in-vivo olarak tümörü geriletmiştir [58]. 1985 yılında ise insan kaynaklı TNF-α üretilmeye başlanmış ve ilerleyen zamanlarda anti-TNF-α antikorlar ile solubl TNF reseptörleri üretilmiş ve birçok inflamatuvar hastalığın tedavisinde kullanılmaya başlanmıştır [59]. TNF-alfa, makrofajlar ve çeşitli hücreler tarafından eksprese edilen, 26 kDa'luk kütleye sahip bir transmembran proteindir. TNF-alfa, çeşitli uyarılara yanıt olarak TNF-alfa aktive edici dönüştürücü enzim (TACE) tarafından 17 kDa'luk bir proteine dönüştürülerek hücrelerden salgılanır [60]. Makrofajlardan TNF salınımında en güçlü uyaran lipopolisakkaritlerdir (LPS). Organizmada TNF-α üretimi farklı zamanlarda farklı hücreler tarafından gerçekleştirilmektedir. Örnek verecek olursak, LPS ile uyarılmayı takiben asıl olarak monosit ve makrofajlar, bakteriyel yükün fazla olduğu durumlarda T hücreleri ve erken alerjik yanıtta mast hücreleri TNF-α sentezlemektedir [61].
TNF-α, inflamatuvar sitokinlerin (IL-1 beta, IL-6, IL-8) salınımını uyarır, bir seri kritik kemokinin artışına sebep olur (MCP-1, MIP-2, RANTES, MIP-1α) aynı zamanda endotel adezyon moleküllerinin (ICAM-1, VCAM-1, E-selektin) güçlü bir aktivatörüdür. TNF-α'nın bu fonksiyonları, inflamatuvar reaksiyon sürecinin başlamasını ve sürdürülmesini düzenler [62, 63].
TNF-α, monositler (makrofaj, histiosit, dendritik hücre, Langerhans hücresi, Kupffer hücreleri, mikroglia, osteoklastlar) ve nötrofiller üzerindeki kemotaktik aktivitesinden dolayı inflamatuvar bir sitokin olarak bilinmektedir [64]. IL-1 ile benzer fonksiyonel özelliklere sahip bir sitokin olup, bu iki sitokin inflamasyonun temel mediatörleridir. Ateş, sitotoksik aktivite artışı, endotel hücresi aktivasyonu, hepatosit aktivasyonu, makrofaj aktivasyonu, osteoklast aktivasyonu, araşidonik asid türevlerinin sentezinin indüksiyonu, nötrofil adezyonu, anjiyogenez, fibroblast ve mezanşimal hücre proliferasyonu ve trombomodulin ekspresyonunun inhibisyonu gibi birçok olaydan sorumludur. Endotel aktivasyonuyla, endotel hücrelerinden inflamasyon aracı maddelerinin (LTB4, TXA2, PAF, IL-8 gibi) salınımı ve endotel
26 yüzeyindeki reseptör görevi gören adezyon moleküllerinin (VCAM-1, E-Selektin, P-Selektin) ifadesi artar. Bu reseptörler sayesinde nötrofil ve monosit adezyonu gerçekleşir ve sonuçta vasküler hasarlanma ve permeabilite artışı olur [56].
2.2.2.İnterlökin-1 Sitokin Ailesi
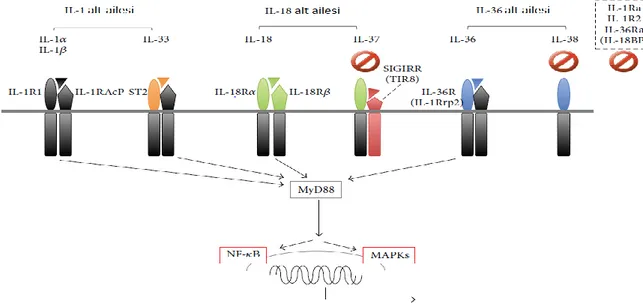
IL-1 ailesi, 11 üyeye sahiptir ve öncü peptitlerin N-terminal uzunluğuna göre 3 alt aileye ayrılır (Şekil 1). IL-1 alt ailesi, IL-lα, IL-β, IL-1 Reseptör antagonisti (IL-1Ra) ve IL-33'den oluşur. IL-18 alt ailesi IL-18 ve IL-37'den oluşur. IL-36α, IL-36β, IL-36γ ve IL-38, IL-36 alt ailesine aittir [65].
Her IL-1 ailesinden sitokin için reseptör, özgün veya ortak alt birimlerin heterodimerinden oluşmaktadır. IL-1R aksesuar proteini (IL-1LRAcP), IL-18Rβ ve SIGIRR (TIR8), sinyalleme alt birimleri iken, IL-1R1, ST2, IL-18Rα ve IL-36R, ligand bağlayıcı alt birimlerdir. Bu grubun 7 üyesi, IL-1α, IL-1β, IL-18, IL-33, IL-36α, IL-36β ve IL-36, proinflamatuvar aktivite, IL-1Ra, IL-36Ra,IL-37 ve IL-38 antiinflamatuvar aktivite gösterirler [65]. İnterlökin-1(IL-1) reseptör ailesinin ligantları olan sitokinler, akut ve kronik inflamasyonla ilişkilidir ve inflamasyonda önemli bir rol oynamaktadır [66].
27 2.2.2.1.İnterlökin-33
IL-33, IL-1 alt ailesine aittir ve eskiden IL-1F11 olarak adlandırılmıştır. IL-33Rα, IL-33 için ligand bağlama zinciridir ve IL-33 için eş-reseptör IL-1RAcP'dir ve bu eş-reseptörü aynı zamanda IL-1α ve IL- 1β da kullanır(şekil 1) [65, 67]. Ligandı bağlayabildiğinden ancak IL-1RAcP'nin sinyal vermesini gerektirdiği için IL-33Rα zinciri, IL-1R1'e benzerdir [68].
IL-33'ün egemen biyolojik aktivitesi Th2 sitokinlerin, IL-4, IL-5 ve IL-13'ün indüksiyonu ve aynı zamanda bir Th2 tipi sitokin için öngörülen diğer özelliklerdir. Bu nedenle, allerjik tip astım gibi akciğer inflamasyonunda IL-33'ün rolü kapsamlı olarak incelenmiştir. IL-33'ün solunum yollarına verilmesi, naif farelerin akciğerlerinde anında alerjik bir reaksiyon başlatır ve antijene duyarlı farelerdeki cevabı kötüleştirir [69]. İnsan IL-33'ü farelere uygulandığında, akciğerlerde eozinofilik infiltrasyon ve allerjik rinittetekine benzer alerjik konjonktivit görülür [70]. IL-33Rα'da eksik olan fareler, Schistosoma yumurta antijenine Th2 yanıtı vermez ve IL-33 eksik fareler, Strongyloides venezuelensis'e karşı oldukça duyarlıdır [71].
İnsan IL-33'ü farelere enjekte edildiğinde,arteryel duvarda ve bağırsak lümeninde değişiklikler gibi etkileyici patolojik bulgular gözlenmiştir [72]. IL-33Rα'da eksik olan farelerde, kalpte miyokard hipertrofisi, ventrikül genişlemesi ve fibroz gibi bulgular görülür; bu da IL-33'ün kalpte koruyucu bir rol oynadığını göstermektedir [73].
2.2.2.2. İnterlökin-36 alt ailesi
IL-1 ailesi üyeleri IL-1F5, IL-1F6, IL-1F8, IL-1F9 ve IL-1F10 şu an sırasıyla; IL-36Ra, IL-36α, IL-36β, IL-36γ ve IL-38 olarak adlandırılmaktadır [74]. IL-36 alt ailesinin her bir üyesi günümüzde IL-36R olarak adlandırılan IL-1Rpr2'ye bağlanmaktadır. IL-36 alt ailesi IL-1 alt ailesi ile yakından ilişkilidir, çünkü IL-1α ve IL-1β ve IL-33'e benzer şekilde IL-36R, IL-1RAcP ile bir sinyal kompleksi oluşturur [74]. IL-36 sitokinler birçok hastalıkla ilişkili bulunmuştur [75]. Bu sitokinlerin organlara göre ilişkili olduğu hastalıklar şekil 2' de belirtilmiştir [75].
28 Şekil 2.IL 36 sitokinlerin organlara göre hastalıklardaki rolleri
2.2.2.2.1. İnterlökin-36α ve interlökin-36β
IL-36α ve IL-36β, IL-36R aracılığıyla agonistik özelliklere ve sinyallere sahiptir [65]. Bu IL-36 sitokinleri temel olarak keratinositler, bronşiyal epitel, beyin dokusunda ve monosit/makrofajlarda ifade edilir [72]. IL-36β kendisinin ekspresyonunu indükleyebilmektedir ve bu nedenle IL-1'e benzer bir otokrin/parakrin döngü, sitokinlerin IL-36 alt familyasında mevcut gibi gözükmektedir [12]. IL-36 sitokinler birçok hastalıkla ilişkili bulunmuştur [75]. Bu sitokinlerin organlara göre ilişkili olduğu hastalıklar Şekil 2' de belirtilmiştir.
29 IL-36α ve IL-36β , keratinositlerde, IL-22 ile sinerjik hale getirilebilen IL-17 ve TNF ekspresyonunu indükleyebilmektedir [12]. Aynı zamanda birkaç literatür çalışması, epidermal büyüme faktörü sinyalizasyonunun IL-36α ve IL-36β'nın cildin ekspresyonunu düzenlediğini ortaya koymaktadır, bu çalışmalar IL-36α ve IL-36β agonistlerinin deri homeostazında önemli bir rol oynadığını düşündürmektedir [76]. Buna paralel olarak, bazal keratinositlerde IL-36α genini aşırı ifade eden transgenik farelerin psöriatik deri lezyonlarının karakteristikleri olan derinin akantoz ve hiperkeratozunu sergilediği gözlemlenmiştir [77].
Romatoit artrit(RA) hastalarında yapılan bir çalışmada IL-36α mRNA'sının plazma hücrelerinden over eksprese edildiği bulunmuştur [13]. Başka bir çalışmada IL-36α ve IL-36β'nın RA’da sağlıklı kontrollere kıyasla anlamlı yüksek bulunmuş ve IL-36 α düzeyi CRP ile korelasyon göstermiştir [14]
Yapılan kesitsel çalışmalarda aktif SLE hastalarında plazma IL-36α ve periferal IL-36R +B lenfositlerin daha fazla üretildiği bulunmuştur [15].
pSS(primer sjogren sendromu) olan hastalarda yapılan bir çalışmada hastaların tükürük ve serumunda IL-36α anlamlı yüksek bulunmuş ve hastalık aktivitesi ile korelasyon göstermiştir [16].
İnflamatuar barsak hastalığı olan hastaların mukozalarında( özellille ülseratif kolit) IL-36 α sentezinde artış bulunmuştur [17]. Diğer bir çalışmada Chron Hastalığı olanlarda IL-36 α sentezinin uyarıldığı bildirilmiştir [18].
Dahası, IL-36R, mikroglial hücreleri ve astrositlerden yüksek oranda eksprese edilmektedir,bununle birlikte, IL-36β, nöron hücrelerinden ve glial hücrelerinden eksprese edilmektedir. Bu da IL-36 sitokinlerin intrakranial inflamasyonda da rolünün olabileceğini göstermektedir [78].
30 3.GEREÇ VE YÖNTEM
3.1. Gereçler
Transferpette® S 10-100 µL (Germany)
Transferpette® S 100-1000 µL (Germany)
Wisemix® VM-10 vortex mixer (Korea)
Santrifüj (NF 048, Nüve, Türkiye)
Immage 800 (Beckman Coulter, U.S.A.)
SDM-100 ESH ölçüm cihazı (Medikodardanel Ltd. Şti. Çanakkale/Türkiye)
CELL-DYN Ruby Hemogram cihazı(Abbott Park, IL, Abbott Laboratories, U.S.A.)
ELx800 ELISA Okuyucusu(Biotek, BioTek Instruments, U.S.A)
ELx50 ELISA yıkayıcısı(Biotek, BioTek Instruments, U.S.A)
3.2. Kimyasal Maddeler
Human TNF-α ELISA kiti (eBioscience, Katalog No:BMS223/4, Lot No:124009026)
Human IL-33 ELISA kiti(eBioscience, Katalog No: BMS2048, Lot No:144719020)
Human IL-36α ELISA kiti (SunRed, Katalog No: 201-12-9422, Lot No:201703)
Human IL-36β ELISA kiti (SunRed, Katalog No: 201-12-9437, Lot No:201703)
3.3. Örneklerin Toplanması ve İşlenmesi
Bu çalışma T.C. Dicle Üniversitesi Hastaneleri Merkez Laboratuvarı’nda yürütüldü. Dicle Üniversitesi Tıp Fakültesi hastanesi, Fizik Tedavi ve Rehabilitasyon Polikliniklerinde takip edilen; Modifiye New York Kriterleri’ne göre AS tanısı konan 59 gönüllü hasta ve 30 gönüllü sağlıklı dahil edildi.
31 Diyabet,Tiroit disfonksiyon, prednol kullanan hastalar, anti-sitokin(biyolojik ajan) tedavi alan hastalar, AS dışı inflamatuvar veya enfektif nedenle ağrısı olan, eşlik eden başka inflamatuvar hastalığı olan hastalar çalışmaya dahil edilmedi. Katılımcılardan Şubat 2017-Mayıs 2017 tarihleri arasında örnekler toplandı. Katılımcılara çalışma hakkında bilgi verilip Bilgilendirme ve Olur Formu imzalatıldı ve çalışma için Dicle Üniversitesi Tıp Fakültesi Etik Kurulu’ndan onay alındı (Karar No: 332/ 11.11.2016).
Her katılımcıdan 10-12 saatlik açlık sonrası, 10-15 dk. dinlendirildikten sonra venöz kan alındı. Hemogram testi için etilendiamintetraasetikasit (EDTA) içeren mor kapaklı, CRP testi için sarı kapaklı jelli düz, Eritrosit Sedimentasyon hızı (ESH) için sitrat içeren siyah tüpe, ELISA çalışmaları için jelli düz sarı kapaklı vakumlu tüplere kan alındı, alınan kan örnekleri uygun koşullarda laboratuara iletildi.
Hemogram (ABBOTT-CELL DYN RUBY, U.S.A) , ESH(Berkhun SDM-100) ve CRP (BECKMAN COULTER-IMMAGE 800, U.S.A.)) testleri rutin laboratuarımızda yer alan cihazlar kullanılarak hemen çalışıldı.
TNF-α ,IL-33, IL-36α,IL-36β testleri için alınan serum örnekleri eppendorf tüplere ayrılarak analiz yapılana kadar -80 ºC’de saklandı. Her iki grupta; hasta ve kontrol örnekleri, yeterli sayıya ulaştıktan sonra; TNF- α ,IL-33, IL-36α ve IL-36β düzeyleri için ayrılan serum örnekleri, çalışma prospektüsüne uyularak ELISA (Enzyme-Linked ImmunoSorbent Assay) yöntemiyle, Biotek ELx50 ELISA yıkayıcısı ve Biotek ELx800 ELISA okuyucusu kullanılarak çalışıldı.
Çalışmaya alınan AS hastalarının aile öyküleri, BASDAI, ASDAS-CRP, ASDAS-ESH aktivite indeksleri kaydedildi. Ayrıca bütün katılımcıların (hem hasta, hem de kontrol grubu) çalışmaya katılım tarihi, yaş, cinsiyet, boy, kilo, vücut kitle indeksi başka hastalıkları olup olmadığı, varsa kullandıkları ilaçlar, alkol ve sigara alışkanlıkları kaydedildi.
32 3.4. Hastalık Aktivitesi Belirlenmesinde Kullanılan Testler
Çalışmamızda, hasta grubunda AS aktivitesinin izleminde BASDAI, ASDAS-CRP ve ASDAS-ESH testleri kullanıldı. BASDAI, hasta tarafından uygulanır ve yorgunluk, aksiyel ağrı, entezopati ve sabah tutukluğunu içeren 6 adet görsel analog skalası(VAS) ölçümünden oluşur (Şekil 3). İlk 4 soruya 5 ve 6. sorunun ortalaması ilave edilir ve çıkan sonuç 5‘e bölünerek 0-10 arasında bir değer elde edilir. BASDAI ≥4 ise aktif hastalık olarak değerlendirilir. Türkçe versiyonunun geçerliliği ve güvenilirliği kanıtlanmıştır [79].
33 Şekil 3. BASDAI hastalık aktivite indeksi
34 Diğer kullandığımız aktivite indekslerimiz ise ASDAS-CRP ve ASDAS-ESH'dir. Günümüzde tek bileşenli ölçütler veya indekslerin sınırlamaları vardır çünkü bunlar hastalığın yalnızca bir yönünü ölçmekte, tamamen hasta ya da hekim odaklıdır ve objektifliği azdır bunun için Uluslararası Spondiloartrit Değerlendirme Birliği(ASAS), ASDAS'da kullanılmak üzere bir hastalık Disease Activity Score (DAS) geliştirmiştir [80]. ASDAS-CRP ve ASDAS-ESH'de AS kaynaklı boyun sırt veya kalça ağrısının şiddeti, sabah tutukluğu, boyun, sırt ve kalça dışındaki eklemlerde genel ağrı/şişme düzeyi ve genel değerlendirmenin yanında ASDAS-CRP'de, CRP düzeyi, ASDAS-ESH'de, ESH düzeyi skalaya eklenerek sonuçların daha objektif olması sağlanmıştır ( Şekil 4 ve Şekil 5) [81]. ASDAS-CRP AS'de, ASDAS-ESH'den daha çok değerlidir ve aktivasyonu belirtmede daha çok tercih edilir. ASAS aktivite skoru 1.3'ün altındaki değerleri pasif hastalık aktivitesi, ≥1.3 ve <2.1 değerleri orta derecede aktif hastalık aktivitesi, >2.1 ve ≤3.5 olan değerleri yüksek hastalık aktivitesi, >3.5 olan değerleri aşırı yüksek hastalık aktivitesi olarak belirtiştir(Şekil 4 ve Şekil 5) [81]. Skalanın hesaplanmasında ASAS'ın belirlediği formülü kullandık. ASAS'ın önerdiği gibi hesaplanan aktivite skoru>2.1 olan sonuçları yüksek aktif, bunun altındaki sonuçları ise hastalık aktivitesi açısından pasif kabul ettik [82].
35 Şekil 4. ASDAS-CRP Hesaplama Formu
36 Şekil 5. ASDAS-ESH Hesaplama Formu
37 3.5. Yöntemler
3.5.1. C-reaktive protein(Nefelometrik yöntem)
Prensip: Serum C-reaktive protein (CRP) konsantrasyonları İmmünotürbidimetrik ölçüm metodu ile IMMAGE 800 cihazında ölçüldü. İmmünotürbidimetrik ölçüm metodunun prensibi; serumdaki CRP, lateks partiküllere yapıştırılmış anti-CRP antikorlarıyla birleşip aglütinasyon (çökme) gerçekleşir, bu çökme 572 nm dalga boyunda absorbans vermektedir. 572 nm dalga boyundaki absorbans artışı örnekteki CRP konsantrasyonu ile doğru orantılıdır. Yöntemin linearitesi 0.02 ile 32.00 mg/dl’dir. Kantitasyon sınırı 0.02 mg/dl’dir. Serum/plazma referans değerleri (yetişkin): ≤ 0,5 mg/dl’dir.
İşlemler: Katılımcılardan alınan venöz kan, sarı kapaklı jelli biyokimya tüpüne alındı ve 20-25 dk kanın pıhtılaşması beklendi. Daha sonra 4000 rpm’de 5 dk santrifüj edilip elde edilen serum ile otoanalizörde CRP VARIO kiti (cat no/lot: 6K263041) ile ölçümü yapıldı.
3.5.2. Sedimantasyon ölçümü
Prensip: İnflamasyonun non-spesifik belirteçlerinden eritrosit sedimantasyon hızı, in vitro olarak antikoagülan varlığında, eritrositlerin başta fibrinojen ve eritrositin negatif yüzey yükü olmak üzere çeşitli faktörlerden dolayı belirli bir zaman diliminde rulo formasyonu oluşturarak çökmesi esasına dayanır. Referans aralıkları şöyledir; çocuklar için 0-10 mm/saat, erkekler için 0-15 mm/saat (<50 yaş) ve 0-20 mm/saat (>50 yaş), kadınlar için 0-20 mm/saat (<50 yaş) ve 0-30 mm/saat (>50 yaş) [83].
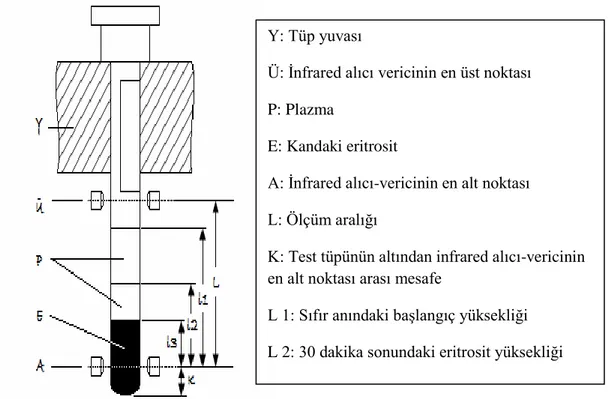
Plazma sedimantasyon düzeyi İnfrared alıcı verici metodu kullanılarak SDM-100 cihazında ölçüldü. İnfrared alıcı verici metodunun prensibi; tüpteki eritrositler yerçekimi yardımıyla çökmeye başlar ve saydam plazma, tüpün üst tarafında birikir. Cihaz, plazma ve eritrositin kesişme noktasını hareketli bir infrared alıcı verici ile belli bir süre tarayarak sedimantasyon değerini hesaplar. İnfrared alıcı verici Ü ve A arasında gidip gelirken (Şekil 6), alıcının vericiden gelen sinyali almadığı konum, yoğun kan hücrelerine ulaşıldığı konumdur. Bu konuma ulaşılana
38 dek alıcı mikrobilgisayara sinyal gönderir. Mikrobilgisayar bu sinyalleri kullanarak eritrositlerin çökme miktarını ölçer.
Şekil 6.) Sedimantasyon ölçüm cihazı çalışma prensibi.
İşlemler: Katılımcılardan 1’er adet 1.6 ml siyah kapaklı sedimantasyon tüpüne (tri sodyum sitrat’lı) venöz kan alındı. Kanın antikoagülanla iyice karışması için tüp 6-8 kere alt üst edildi. Tüp dikey olarak cihazdaki (SDM-100) yuvalardan birine yerleştirildi. Yarım saat beklendi, çıkan sonuç kaydedildi.
3.5.3. Hemogram düzeyleri
EDTA’ lı tüpe alınan kan örneğinden tam kan sayımları, Cell-Dyn Ruby (Abbott Diagnostics, Abbott Park, IL, USA) cihazında flow sitometri yöntemiyle çalışıldı. Tam kan sayımı analizinde: WBC, Hb, Plt, MPV, Nötrofil, Lenfosit parametrelerine bakıldı.
Y: Tüp yuvası
Ü: İnfrared alıcı vericinin en üst noktası P: Plazma
E: Kandaki eritrosit
A: İnfrared alıcı-vericinin en alt noktası L: Ölçüm aralığı
K: Test tüpünün altından infrared alıcı-vericinin en alt noktası arası mesafe
L 1: Sıfır anındaki başlangıç yüksekliği L 2: 30 dakika sonundaki eritrosit yüksekliği L 3: 60 dakika sonundaki eritrosit yüksekliği
39 3.5.4.TNF-α tayini
eBioscience (eBioscience, Katalog No: BMS223/4, Lot No:124009026) marka Human ELISA kiti kullanılarak yapıldı. Optik dansite ölçümü ELx800 (Biotek, BioTek Instruments, U.S.A) marka cihazda 450 nm dalga boyunda gerçekleştirildi.
Test prensibi:
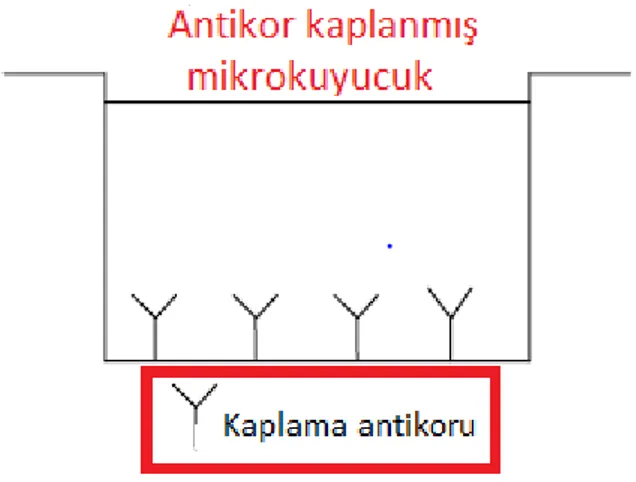
1.Anti-human TNF-alfa kaplama antikorları mikrokuyucuklara adsorbe edilir (Şekil 7).
Şekil 7. Anti- human TNF-alfa antikor kaplı mikro kuyucuk
1. Numune veya standartta bulunan TNF-alfa, mikrokuyucuklara adsorbe edilmiş antikorlara bağlanır. Sonrasında biyotinle konjüge edilmiş anti-TNF-alfa antikoru eklenir ve birinci antikor tarafından yakalanan TNF-alfa'ya bağlanır (Şekil 7).
40
2. İnkübasyon işleminden sonra, bağlanmamış biyotinle konjüge edilmiş anti-TNF-α antikorları, bir yıkama aşamasında temizlenir. Streptavidin-HRP
eklenir ve biyotinle konjüge edilmiş anti-TNF-α antikoruna bağlanır (Şekil 9).
Şekil 9.İkinci inkübasyon (TNF-α ölçümü)
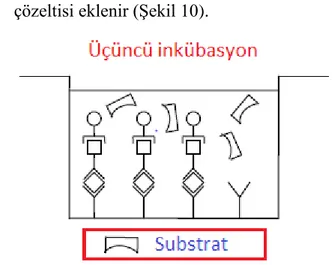
3. İnkübasyon işleminden sonra, bağlanmamış Streptavidin-HRP, bir yıkama aşaması sırasında temizlenir ve kuyucuklara HRP ile reaksiyona giren substrat çözeltisi eklenir (Şekil 10).
41 4. Renkli bir ürün, numune veya standartta bulunan TNF-α miktarıyla orantılı olarak oluşur (Şekil 11). Reaksiyon, asit ilave edilerek sona erdirilir ve 450 nm'de absorbans ölçülür. Standart eğrisi, TNF-α standart seyreltmesinden hazırlanır ve numunelerdeki TNF-α konsantrasyonu hesaplanır.
Şekil 11.HRP ile reaksiyona giren substrat (TNF-α ölçümü)
Testin yapılışı:
1. Mikrokuyucuk stribi Wash Buffer ile iki kez yıkandı.
2. Mikrokuyucuklara 100 µl Sample Diluent, tüm standart kuyucuklarına eklendi. Pipet 100 µl ilk kuyucuklara standart hazırlanmış ve 100 µl aktararak standart seyreltmeler oluşturuldu. Son kuyucuktan 100 µl atılıp standartlar hazırlandı (Şekil 12).
42 3. Kör kuyucuğuna 100 µl Sample Dilüent eklendi.
4. Örnek kuyularına 50 µl Sample Dilüent eklendi 5. Belirlenmiş örnek kuyularına 50 µl örnek eklendi.
6. Biyotin-Konjugat üreticinin talimatına göre hazırlanıp, tüm oyuklara 50 µl Biotin-Konjugat eklendi.
7. Mikrokuyucuk şeritlerinin üzeri kapatıldı ve oda sıcaklığında (18 ° ila 25 ° C) 2 saat inkübasyona bırakıldı.
8. Mikrokuyucuk şeritleri Wash Buffer ile 4 kez yıkandı.
9. Streptavidin-HRP üreticinin talimatına göre hazırlanıp, tüm kuyucuklara 100 µl Streptavidin-HRP ilave edildi.
10. Mikrokuyucuk şeritlerinin üzeri kapatıldı ve oda sıcaklığında 1 saat inkübasyona bırakıldı.
11. Mikrokuyucuk şeritleri Wash Buffer ile 4 kez yıkandı.15.
12. Tüm kuyucuklara 100 µl TMB Substrat Çözeltisi eklendi ve oda sıcaklığında (18 ° ila 25 ° C) yaklaşık 10 dk inkübasyona bırakıldı.
13. Tüm kuyucuklara 100 µl Stop Solüsyon eklendi.
14. Testin OD ölçümü 450 nm dalga boyunda yapıldı ve testin standart eğrisi çizilerek konsantrasyonlar hesaplandı (Şekil 13).
Şekil 13.TNF-α standart eğrisi
y = 12.494e13.676x R² = 0.9747 0 100 200 300 400 500 600 0 0.05 0.1 0.15 0.2 0.25 0.3 Kon san tr asyon (pg/ m l) Absorbans(OD)
TNF-α Standart Eğrisi
TNF-α Üstel (TNF-α)43 3.5.5. IL-33 tayini
eBioscience (eBioscience, Katalog No: BMS2048) marka human ELISA kiti kullanılarak yapıldı. Optik dansite ölçümü ELx800 (Biotek, BioTek Instruments, U.S.A) marka cihazda 450 nm dalga boyunda gerçekleştirildi.
Test prensibi:
Anti-human IL-33 kaplama antikorları mikrokuyucuklara adsorbe edilir (şekil 14).
Şekil 14. Anti-human IL-33 antikor kaplı mikro kuyucuk
Numune veya standartta bulunan human IL-33, mikrokuyucuklara adsorbe edilmiş antikorlara bağlanır (Şekil 15).
44
İnkübasyon işleminden sonra, antikora bağlanmamış IL-33 (örnek veya standart), bir yıkama aşamasında temizlenir. Sonrasında biyotinle konjüge edilmiş anti-human IL-33 antikoru eklenir ve birinci antikor tarafından yakalanan IL-33'e bağlanır (Şekil-16).
Şekil 16. İkinci inkübasyon( IL-33 ölçümü)
İnkübasyon işleminden sonra, bağlanmamış biyotinle konjüge edilmiş anti-human IL-33 antikorları, bir yıkama aşamasında temizlenir. Streptavidin-HRP eklenir ve biyotinle konjüge edilmiş anti-human IL-33 antikoruna bağlanır (Şekil-17).
45
İnkübasyon işleminden sonra, bağlanmamış Streptavidin-HRP, bir yıkama aşaması sırasında temizlenir ve kuyucuklara HRP ile reaksiyona giren substrat çözeltisi eklenir (Şekil 18).
Şekil 18. Dördüncü inkübasyon ( IL-33 ölçümü)
Renkli bir ürün, numune veya standartta bulunan IL-33 miktarıyla orantılı olarak oluşur (Şekil 19). Reaksiyon, asit ilave edilerek sona erdirilir ve 450 nm'de absorbans ölçülür. Standart eğrisi, IL-33 standart seyreltmesinden hazırlanır ve IL-33 numune konsantrasyonu hesaplanır.
Şekil 19. HRP ile reaksiyona giren substrat ( IL-33 ölçümü) Testin yapılışı:
1. Mikrokuyucuk stribi Wash Bufferile iki kez yıkandı. 2. Tüm kuyucuklara 50 µl Sample Diluent eklendi.
46 3. Standart kuyucuklarına 50 µl hazırlanmış Standart çözeltiden eklendi.
4. Kör kuyucuğuna 50 µl Calibrator Diluent eklendi.
5. Örnek kuyucuklarına 50 µl örnek eklendi, sonrasında mikrokuyucuk şeritlerinin üzeri kapatıldı ve oda sıcaklığında (18 ° ila 25 ° C) 2 saat inkübasyona bırakıldı. 6. Mikrokuyucuk şeritleri Wash Bufferile 6 kez yıkandı.
7. Biyotin-Konjugat üreticinin talimatına göre hazırlanıp, tüm oyuklara 100µl Biotin-Konjugat eklendi, sonrasında mikrokuyucuk şeritlerinin üzeri kapatıldı ve oda sıcaklığında (18 ° ila 25 ° C) 1 saat inkübasyona bırakıldı.
8. Mikrokuyucuk şeritleri Wash Bufferile 6 kez yıkandı.
9. Streptavidin-HRP üreticinin talimatına göre hazırlanıp, tüm kuyucuklara 100 µl Streptavidin-HRP ilave edildi, sonrasında mikrokuyucuk şeritlerinin üzeri kapatıldı ve oda sıcaklığında (18 ° ila 25 ° C) 1 saat inkübasyona bırakıldı. 10. Mikrokuyucuk şeritleri Wash Bufferile 6 kez yıkandı.
11. Tüm kuyucuklara 100 µl TMB Substrat Çözeltisi eklendi ve oda sıcaklığında (18 ° ila 25 ° C) yaklaşık 30 dk inkübasyona bırakıldı.
12. Tüm kuyucuklara 100 µl Stop Solüsyon eklendi.
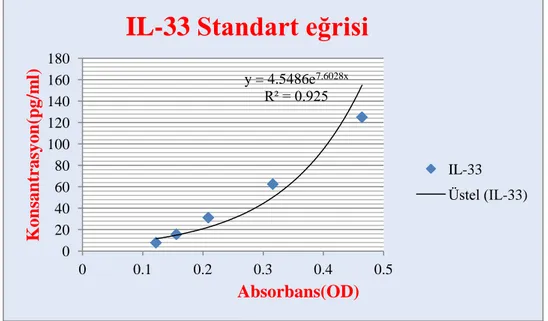
13. Testin OD ölçümü 450 nm dalga boyunda yapıldı ve testin standart eğrisi çizilerek konsantrasyonlar hesaplandı (Şekil 20).
Şekil 20.IL-33 standart eğrisi
y = 4.5486e7.6028x R² = 0.925 0 20 40 60 80 100 120 140 160 180 0 0.1 0.2 0.3 0.4 0.5 Kon san tr asyon (pg/ m l) Absorbans(OD)
IL-33 Standart eğrisi
IL-33 Üstel (IL-33)
47 3.5.6.IL-36α tayini
SunRed (SunRed, Katalog No: 201-12-9422) marka Human ELISA kit kullanılarak yapıldı. Optik dansite ölçümü ELx800 (Biotek, BioTek Instruments, U.S.A) marka cihazda 450 nm dalga boyunda gerçekleştirildi.
Test prensibi: Kullanılan kit insan numunelerinde (serum/plazma) IL-36α düzeyini belirlemek için çift antikor sandviç ELISA metoduyla çalışır. Önceden insan İnterlökin 36α (IL-36α) monoklonal antikor ile kaplanmış monoklonal antikor enzim kuyucuklarına İnterleukin-36α (IL-36α) konur. Sonrasında biotinlenmiş IL-36α antikoru ilave edilir ve Streptavidin-HRP ile kombine edilerek inkübasyona bırakılır. Sonrasında bağlanmamış enzimler yıkanarak uzaklaştırılır. Yıkanmış kuyucuklara kromojen A, B solüsyonları ilave edilerek mavi renk oluşturulur. Son olarak ilave edilen asidin etkisiyle renk sarıya döner. Oluşan renk parlaklığıyla numuneler içerisindeki insan IL-36α konsantrasyonu pozitif korelasyona sahiptir.
Testin yapılışı: Test öncesi standartlar aşağıda açıklandığı Şekilde hazırlandı.
Standart 5(48 ng/L); 120 μl orjinal standart+120 μl standart diluent
Standart 4(24 ng/L); 120 μl standart 5+120 μl standart diluent
Standart 3(12 ng/L); 120 μl standart 4+120 μl standart diluent
Standart 2(6 ng/L); 120 μl standart 3+120 μl standart diluent
Standart 1(3 ng/L); 120 μl standart 2+120 μl standart diluent
Blank kuyucuğu: Sadece kromojen A, B ve stop solüsyonu kondu. Biyotine IL-36α antikoru ve numune konulmadı. Geri kalan uygulamalara diğer kuyucuklarla beraber devam edildi.
Standart kuyucukları: Kuyucuklara 50 μl standart, 50 μl Streptavidin-HRP kondu. Standart önceden biyotine antikor ile kombine edildiği için yeniden ilave edilmedi. Geri kalan uygulamalara diğer kuyucuklarla beraber devam edildi.
Test kuyucukları: Test kuyucuklarına, 40 μl numune, 10 μl IL-36α antikoru ve 50 μl Streptavidin-HRP ilave edildi. Dikkatli bir Şekilde çalkalayarak, sıvının karışması ve kuyucukların zeminine oturması sağlandı.
48
Kuyucukların ağzı kapatılarak 60 dakika 37 C˚ ' de bir saat inkübasyona bırakıldı.
Kuyucuklardaki sıvı uzaklaştırıldıktan sonra önceden distile su ile otuz kat sulandırılan konsantre yıkama solüsyonuyla beş defa yıkama yapıldı.
Kuyucuklardaki tüm sıvı uzaklaştırıldıktan sonra 50 μl kromojen A, 50 μl kromojen B ilave edilerek karışmaları sağlandı.
Kuyucukların ağzı kapatılarak 37 C˚' de on dakika inkübe edildi.
On dakika sonra her kuyucuğa 50 μl stop solüsyonu ilave edildilerek reaksiyon sonlandırıldı. Testin OD ölçümü 450 nm dalga boyunda yapıldı. IL-36α standart eğrisi şekil 20'de verildi.
Şekil 21. IL-36α standart eğrisi
3.5.7. IL-36β tayini
SunRed(SunRed, Katalog No: 201-12-9437) marka human ELISA kiti kullanılarak yapıldı. Optik dansite ölçümü ELx800(Biotek, BioTek Instruments, U.S.A) marka cihazda 450 nm dalga boyunda gerçekleştirildi.
Test prensibi: Kullanılan kit insan numunelerinde (serum/plazma) IL-36β düzeyini belirlemek için çift antikor sandviç ELISA metoduyla çalışır. Önceden insan IL-36β
y = 0.052x + 0.2168 R² = 0.9852 0 0.5 1 1.5 2 2.5 3 0 20 40 60 A b sorban s(OD) Konsantrasyon(ng/L)
IL-36α Standart Eğrisi
OD
49 monoklonal antikor ile kaplanmış monoklonal antikor enzim kuyucuklarına IL-36β konur. Sonrasında biotinlenmiş IL-36β antikoru ilave edilir ve Streptavidin-HRP ile kombine edilerek inkübasyona bırakılır. Sonrasında bağlanmamış enzimler yıkanarak uzaklaştırılır. Yıkanmış kuyucuklara kromojen A, B solüsyonları ilave edilerek mavi renk oluşturulur. Son olarak ilave edilen asidin etkisiyle renk sarıya döner. Oluşan renk parlaklığıyla numuneler içerisindeki IL-36β konsantrasyonu pozitif korelasyona sahiptir.
Testin yapılışı: Test öncesi standartlar aşağıda açıklandığı Şekilde hazırlandı.
Standart 5 (48 ng/L); 120 μl orjinal standart+120 μl standart diluent
Standart 4 (24 ng/L); 120 μl standart 5+120 μl standart diluent
Standart 3 (12 ng/L); 120 μl standart 4+120 μl standart diluent
Standart 2 (6 ng/L); 120 μl standart 3+120 μl standart diluent
Standart 1 (3 ng/L); 120 μl standart 2+120 μl standart diluent
Blank kuyucuğu: Sadece kromojen A, B ve stop solüsyonu kondu. Biyotine IL-36β antikoru ve numune konulmadı. Geri kalan uygulamalara diğer kuyucuklarla beraber devam edildi.
Standart kuyucukları: Kuyucuklara 50 μl standart, 50 μl Streptavidin-HRP kondu. Standart önceden biyotine antikor ile kombine edildiği için yeniden ilave edilmedi. Geri kalan uygulamalara diğer kuyucuklarla beraber devam edildi.
Test kuyucukları: Test kuyucuklarına, 40 μl numune, 10 μl IL-36β antikoru ve 50 μl Streptavidin-HRP ilave edildi. Dikkatli bir Şekilde çalkalayarak, sıvının karışması ve kuyucukların zeminine oturması sağlandı.
Kuyucukların ağzı kapatılarak 60 dakika 37 C˚ ' de bir saat inkübasyona bırakıldı.
Kuyucuklardaki sıvı uzaklaştırıldıktan sonra önceden distile su ile otuz kat sulandırılan konsantre yıkama solüsyonuyla beş defa yıkama yapıldı.
Kuyucuklardaki tüm sıvı uzaklaştırıldıktan sonra 50 μl kromojen A, 50 μl kromojen B ilave edilerek karışmaları sağlandı.