T.C.
NEVŞEHİR HACI BEKTAŞ VELİ ÜNİVERSİTESİ
FEN BİLİMLERİ ENSTİTÜSÜ
BERLANDINA PLUMALIS (O. PICKARD-CAMBRIDGE,
1872) (ARANEAE: GNAPHOSIDAE) TÜRÜNÜN
SİTOGENETİK ÖZELLİKLERİNİN ARAŞTIRILMASI
Tezi Hazırlayan
Ömer UÇAR
Tez Danışmanı
Doç. Dr. Zübeyde KUMBIÇAK
Biyoloji Anabilim Dalı
Yüksek Lisans Tezi
Haziran 2019
NEVŞEHİR
T.C.
NEVŞEHİR HACI BEKTAŞ VELİ ÜNİVERSİTESİ
FEN BİLİMLERİ ENSTİTÜSÜ
BERLANDINA PLUMALIS (O. PICKARD-CAMBRIDGE,
1872) (ARANEAE: GNAPHOSIDAE) TÜRÜNÜN
SİTOGENETİK ÖZELLİKLERİNİN ARAŞTIRILMASI
Tezi Hazırlayan
Ömer UÇAR
Tez Danışmanı
Doç. Dr. Zübeyde KUMBIÇAK
Biyoloji Anabilim Dalı
Yüksek Lisans Tezi
Haziran 2019
NEVŞEHİR
TEŞEKKÜR
Yüksek lisans öğrenimim süresince yardım ve desteklerini esirgemeyen tez çalışmamın her aşamasında beni yönlendiren danışman hocam Doç. Dr. Zübeyde KUMBIÇAK’a, Desteğini hiçbir zaman eksik etmeyen Hatice POYRAZ’a,
BERLANDINA PLUMALIS (O. PICKARD-CAMBRIDGE, 1872) (ARANEAE:
GNAPHOSIDAE) TÜRÜNÜN SİTOGENETİK ÖZELLİKLERİNİN ARAŞTIRILMASI
(Yüksek Lisans Tezi)
Ömer UÇAR
NEVŞEHİR HACI BEKTAŞ VELİ ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
Haziran 2019 ÖZET
Ülkemizde Gnaphosidae familyasının 145 türü bulunmasına rağmen Berlandina cinsinin sadece iki türü bulunmaktadır. Bu çalışmada Berlandina plumalis’e ait sitogenetik özellikler; diploid sayı (2n), eşey sistemi, karyotip özellikleri ve mayoz bölğnme karakteristikleri araştırılmıştır. Çalışmada ergin erkek örümcekler kullanılmıştır. Kromozom preparatlarının yapılmasında standard havada kurutma yöntemi uygulanmıştır. Bu yöntemde sırasıyla hipotonik, fiksasyon, asetik asit işlemi ve boyama aşamaları uygulanmıştır. Çalışma sonucunda Berlandina plumalis’e için diploid sayı (2n) ve eşey sistemi 2n♂=22, X1X20 şeklinde bulunmuştur. Kromozomların telosentrik
tipte olduğu ve kademeli olarak azalış gösterdikleri belirlenmiştir. Karyotip ve mayoz bölünme özelliklerinin familya karakteristikleri ile uyumlu olduğu sonucuna ulaşılmıştır.
Anahtar kelimeler: Araneae, Berlandina, kromozom, sitogenetik, mayoz
Tez Danışman: Doç. Dr. Zübeyde KUMBIÇAK Sayfa Adeti: 39 sayfa
INVESTIGATION OF CYTOGENETIC PROPERTIES OF BERLANDINA
PLUMALIS (O. PICKARD-CAMBRIDGE, 1872) (ARANEAE: GNAPHOSIDAE)
SPECIES
(M. Sc. Thesis) Ömer UÇAR
NEVŞEHİR HACI BEKTAŞ VELİ UNIVERSITY
GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCES
June 2019
ABSTRACT
There are 145 spider species of Gnaphosidae family in Turkey, but there are only two species of Berlandina genus distributed in our country. In this study, the cytogenetic properties of Berlandina plumalis; such as diploid number (2n), sex system, karyotype characteristics and meiotic division characteristics were investigated. Adult male spiders were used in the study. Standard air-drying method was used to make chromosome preparations. In this method, hypotonic, fixation, acetic acid treatment and staining steps were applied respectively. As a result of the study, the diploid number (2n) and sex chromosome system for Berlandina plumalis were found as 2n♂=22, X1X20. The
chromosomes were of telosentric type and relative chromosome lengths were gradually decreased in size. It was concluded that karyotype and meiotic division characteristics are compatible with family characteristics.
Keywords:Araneae, Berlandina, chromosome, cytogenetic, meiosis Thesis Supervisor: Assoc. Prof. Dr. Zübeyde KUMBIÇAK
İÇİNDEKİLER
KABUL VE ONAY SAYFASI ... i
TEZ BİLDİRİM SAYFASI ... ii
TEŞEKKÜR ... iii
ÖZET... iv
ABSTRACT ... v
İÇİNDEKİLER ... vi
TABLOLAR LİSTESİ ... viii
ŞEKİLLER LİSTESİ ... ix
RESİMLER LİSTESİ ... x
SİMGELER VE KISALTMALAR LİSTESİ ... xi
1. BÖLÜM GİRİŞ ... 1
2. BÖLÜM GENEL BİLGİLER ... 2
2.1. Örümcekler Genel Özelikleri ... 2
2.1.1. Gnaphosidae familyası ve Berlandina cinsi hakkında genel bilgiler ... 4
2.2. Sitogenetik İle İlgili Bilgiler..………..………..5
2.2.1. Nükleus (Çekirdek) ve nükleolus (Çekirdekçik) ... 5
2.2.2. Kromozom ... 6
2.2.2.1. Kromatinin yapısı ve nükleozomlar ... 6
2.2.2.2. Kromozom morfolojisi ... 8
2.2.2.3. Karyotip ve idiyogram ... 9
2.2.3. Hücre bölünmeleri ... 9
2.2.3.2. Mayoz bölünme ... 12
3. BÖLÜM MATERYAL ve METOT ... 15
3.1. Materyal ... 15
3.1.1 Örümceklerin toplanması ... 15
3.1.2. Laboratuvarda kullanılan cihazlar ... 15
3.1.3. Kimyasalların hazırlanması ... 16
3.2. Metot ... 18
3.2.1. Preparasyon aşaması ... 17
3.2.2. Preparatların boyanması………...17
3.2.3. Mikroskop incelemesi, fotoğraflama ve karyotip yapılması……….18
4. BÖLÜM BULGULAR ... 19
4.1. Sitogenetik Özellikler ... 20
4.2. Mayoz Bölünme Özellikleri. ... 22
5. BÖLÜM TARTIŞMA VE SONUÇ………29
KAYNAKLAR ... 34
TABLOLAR LİSTESİ
Tablo 3.1. Çalışmada kullanılan Berlandina plumalis’a ait, arazi çalışması bilgileri…16 Tablo 4.1. Berlandina plumalis’in sistematikteki yeri………...21 Tablo 4.2. Metafaz evrelerinin ölçüm sonuçlarına göre kromozom uzunlukları, tipi ve
sentromerik index bilgileri……….23 Tablo 5.1. Gnaphosidae familyasına ait yapılan sitogenetik çalışmalar……….32
ŞEKİLLER LİSTESİ
Şekil 2.1. Araknida takımının diğer canlılarla olan ilişkilerine ait bir diyagram ...2
Şekil 2.2. Bir örümceğin genel görünüşü ……….3
Şekil 2.3. Örümceklerde ağ yapan organın yapısı ………...4
Şekil 2.4. Nükleozomun genel olarak şekli ……….……7
Şekil 2.5. Bir kromozomun oluşum aşamaları ………....……….…....7
Şekil 2.6. Kromozom tipleri .…...………...8
Şekil 2.7. Mitoz bölünmenin evreleri ……...………...11
Şekil 2.8 Mayoz Bölünmenin evreleri ..………...………...14
RESİMLER LİSTESİ
Resim 4.1. Berlandina plumalis’e ait mitotik metafaz evresi ……….. 20
Resim 4.2. Berlandina plumalis’e ait profaz I’in leptoten evresi ………….…...…23 Resim 4.3. Berlandina plumalis’e ait profaz I’in zigoten evresi ………….…….…23
Resim 4.4. Berlandina plumalis’e ait profaz I’in pakiten evresi …………..………24
Resim 4.5. Berlandina plumalis’e ait profaz I’in diploten evresi ……….…………25
Resim 4.6. Berlandina plumalis’e ait profaz I’in diyakinez evresi ……..…………26
Resim 4.7. Berlandina plumalis’e ait geç anafaz I evresi ……….…27
SİMGELER VE KISALTMALAR LİSTESİ
p Kromozomda kısa kolu
q Kromozomda uzun kolu
X Eşey kromozomu Y Eşey kromozomu T Telosentrik µm Mikrometre ♂ Erkek birey ♀ Dişi birey
DNA Deoksiribonükleik asit
RNA Ribonükleik asit
n Haploid kromozom sayısı
2n Diploid kromozom sayısı
NOR Nükleolar organize edici bölge
0
C Santigrat derece
% Yüzdelik birim
mm Milimetre
pH Çözeltideki bazlık veya asitlik derecesi hakkında bilgi veren birim
ml Mililitre
G1 Hücre büyümesi evresi (1. büyüme)
G2 Bölünmeye hazırlık evresi (2. büyüme)
G0 Dinlenme evresi
S Sentez evresi
RCF Kromozomun relatif uzunluğu
CI Sentromerik indeks
H1 Bağlayıcı histon
KH2PO4 Potasyum dihidrojen fosfat
1. BÖLÜM
GİRİŞ
Örümcekler eklembacaklıların (Phylum: Arthropoda) örümcekgiller (Classis: Arachnida) sınıfında yer alan ve Dünya üzerinde 119 familyadan ve 4140 cinsten olmak üzere toplam 48227 türle temsil edilen canlılardır [1]. İnsanlarla temas halinde olan örümcekler; ağ yapma özelikleri, karnivor beslenmeleri ve bu sebeple zirai mücadelede kullanılmaya aday canlılar olmaları, sahip oldukları zehirlerin kimyasal yapıları gibi bir çok bakımdan çeşitlilik göstermeleri ve tür sayılarındaki zenginlikleri nedeniyle bilim adamları tarafından ilgi odağı haline gelmiştir [2, 3, 4, 5]. Ayrıca yapılan çalışmalar sonucunda örümcekler; kirlilik açısından zengin olan habitatlarda daha fazla bulunması nedeniyle, kirlenme etkisinin gösterilmesinde bir indikatör olarak kullanılmaktadır [6]. Bu nedenle örümcekler, ekolojik değişimi yansıtacak iyi bir belirleyici takson olmuştur [7].
Örümcek karyotiplerinin çalışılması; türlerin taksonomik pozisyonlarını daha net bir şekilde belirlemek ve bazı durumlarda farklı türlerin sitogenetik özelliklerini karşılaştırmak açısından önem arz etmektedir. Örümceklerde karyotipik veriler literatürde oldukça azdır [8]. Yaklaşık 48000 taksondan sadece 842 türü sitogenetik açıdan çalışılmıştır. Öncü çalışmalar sonucunda örümcekler X0’dan X1X2X3…X13’e
kadar çeşitli eşey sistemlerine sahiptirler. Yaygın olarak da X1X20 eşey sistemine
rastlamak mümkündür [9].
Yer örümcekleri olarak bilinen Gnaphosidae familyası Dünya’da 158 cins ve toplamda 2532 türe [1]; Türkiye’de ise 32 cins ve toplamda 147 türe sahiptir [10]. Sitogenetik açıdan ise Gnaphosidae familyası 22 cins ve toplamda 53 türü karyolojik olarak incelenmiştir [9]. Rakamlara bakıldığında yapılan çalışmaların yetersiz olduğu açıkça gözlenmektedir.
Bu tez çalışmasında ülkemizde yaşayan Gnaphosidae familyasına ait Berlandina
plumalis (O. Pickard-Cambridge, 1872) türünün sitogenetik özelliklerinin araştırılması
hedeflenmiştir. Bu amaç doğrultusunda, karyolojik verilerin ilk kez ortaya konmasıyla birlikte türün kromozom sayısı, kromozom morfolojisi ve mayoz bölünme esnasındaki davranışları da ilk kez değerlendirilmiştir.
2. BÖLÜM
GENEL BİLGİLER
2.1 Örümceklerin Genel Özellikleri
Örümcekler Arthropoda (Eklembacaklı) şubesinin Chelicerata (Keliserliler) alt şubesi içerisinde yer almaktadır. Keliserli eklembacaklılar, Paleozoik çağın Ordovisyen döneminden beri bilinmektedir ve bu grup içerisinde ise atnalı yengeçleri, keneler, akarlar, akrepler, kamçılı akrepler, güneş akrepleri, soyu tükenmiş olan dev su akrepleri ve örümcekler gibi bazı gruplar yer almaktadır (Şekil 2.1). Vücutları iki tagmata adı verilen bir prosoma (sefalothoraks) ve opistosoma (abdomen)’dan oluşmaktadır. Chelicerata alt şubesine karakteristik olan, prosoma bölgesi üzerinde altı çift üyenin bulunmasıdır. Bunlar sırasıyla bir çift ağız parçası olan keliser, bir çift pedipalp ve dört çift ise yürüme bacaklarıdır. Bu grupta bulunan hayvanlarda anten bulunmaz [11, 12].
Şekil 2.1. Araknida takımının diğer canlılarla olan ilişkilerine ait bir diyagram [13]
Büyük bir araknid grubu içerisinde yer alan örümcekler ise; Paleozoik çağın Silüriyen döneminden bu yana varlıklarını sürdürmektedirler. Vücudun genel olarak segmentsiz
yapıda olan sefalothoraks ve abdomen kısımları pedisel adı verilen bir yapı ile birbirine bağlanmaktadır. Ayrıca segmentli bir abdomene sahip örümcekler de bulunmaktadır. Ön üyeler; duyu alınımında, besinlerin kontrolünde ve erkeklerde çifleşme organı olarak görev yapan pedipalp, ucunda zehir dişlerinin bulunduğu bir çift keliserden oluşmaktadır (Şekil 2.2) [14].
Şekil 2.2. Bir örümceğin genel görünüşü [15]
Örümceklerin vücut yapısı baş ve göğüs kısmının tek bir yapı olarak yer aldığı sefalotoraks (prosoma) ve abdomen (opistosoma) olarak adlandırılan iki bölümden oluşur. Bu iki kısım birbirlerine pedisel adı verilen dar bir kısım ile bağlanır. Sefalotoraks dorsalinde karapaks adı verilen sert zırh ile ventrali ise sternum adı verilen bir plaka ile kaplıdır. Ağız, gözler ve üyeler sefalatoraksta yer alır. Genelde basit yapıda gözlere sahip olup göz sayıları 2-8 arasında değişiklik göstermektedir [16]. Familya ve cins tayininde, gözlerin konumu, sayısı ve yapısı ile ilgili karakterlerden yararlanılmaktadır [17].
Sefalotoraksta, 6 çift üye bulunur. Üyeler birinci çifti ağzın ön tarafında yer alan ve kaidesinde zehir bezleri bulunan keliserlerdir [18]. İkinci çift üyeler pedipalpus olarak adlandırılır. Beslenme esnasında pedipalp besinin tutulmasında görevlidir. Ayrıca erkek
örümceklerde şişkin bir yapıya sahip olan pedipalpuslar spermlerin dişiye aktarılmasında önemli bir yapıdır. Diğer üyeler ise yürüme bacaklarını oluşturmaktadır. Opistosoma bölgesi, boşaltım sistemi, üreme organları ve örü bezlerinin yer aldığı vücut bölümüdür. Erkek örümceklerin abdomen bölgesinin her iki tarafında bir çift testis bulunur. Sperm kanalları uzun ve kıvrımlı bir yapıda olup, olgunlaşan spermler bu kanallar aracılığıyla epigastrik çöküntünün ortasından dışarıya atılır. Bu açıklıktan dışarı atılan spermler erkek örümceklerin pedipalpuslarının uç bölgelerinde bulunan embolüste depo edilir ve buradan da çiftleşme esnasında spermlerin dişiye aktarılmasını sağlanır (Şekil 2.3 ) [16, 17, 19].
Şekil 2.3. Örümceklerde ağ yapımı [20]
2.1.1 Gnaphosidae familyası ve Berlandina cinsi hakkında genel bilgiler
Gnafosid örümcekler, her yerde kolayca bulunabilen ve taş altlarında saklanabilen ya da çimenler üzerinde görülebilen canlılardır. Yer örümcekleri olarak da bilinirler. Gnafozid familyasına ait örümcekler, 1-15 mm arasında farklı vücut büyüklüklerine sahip vücutları koyu kahverengi, siyah veya griden yeşile kadar değişen renklerde olabilen ve bacaklarının ucunda bir çift tırnak taşıyan canlılardır. Ayrıca gözlerin büyüklükleri ve dizilişleri ve ön ağ bezi kabartılarının şekli Gnafozid familyasını diğer familyalardan
ayıran önemli bir özelliktir [17]. Bu gruba ait örümceklerin çoğu gececildirler. Bu örümcekler Diptera, Lepidoptera, Coleoptera, Hymenoptera gibi böcek gruplarıyla beslenebilmektedirler [21].
Gnaphosidae, dünya çapında beşinci en büyük örümcek ailesi içerisinde yer almaktadır [1]. Günümüzde Gnaphosidae Pocock, 1898 familyası ülkemizde 32 cins içerisinde yer alan 147 türle temsil edilmektedir [10].
Berlandina Dalmas, 1922 cinsine ait günümüzde dünya çapında bilinen 38 türü
bulunmaktadır. [1]. Bu bilinen 38 türden gününmüze kadar sadece Berlandina cinerea (Menge 1872) türünün karyolojik özelikleri belirlenmiş olup [22], cinsin diğer türlerine ilişkin veri bulunmamaktadır [9]. Ülkemizde ise bu cinse ait Berlandina plumalis (O.P.-Cambridge, 1872) ve Berlandina pulchra (Nosek, 1905) olmak üzere iki tür tesbit edilmişir [10].
2.2 Sitogenetik İle İlgili Bilgiler
2.2.1 Nükleus (Çekirdek) ve nükleolus (Çekirdekçik)
Çekirdek, ökaryotik hücrelerin hayatlarını devam ettirebilmeleri ve çoğalabilmeleri için gerekli olan tüm metabolizmik reaksiyonları yöneten ve düzenleyen genetik talimatların yer aldığı en büyük organeldir. Ortalama çapı ise 5 µm olan nükleus, çift zarlı bir kılıf ile sarılıdır. İç zar; nükleus laminası olarak adlandırılan fibrilli, ağsı bir katman ile desteklenmektedir. Bu filamentler; laminler A, B ve C olarak isimlendirilen üç proteinden meydana gelir. Hücre bölünmelerinin profaz evresinde, lamin proteinlerinin fosforilasyonu ile nükleus zarı yıkılır. Lamin proteinlerinin defosforilasyonu ise kromozomların etrafında tekrar nükleus zarının oluşmasını sağlar. Ayrıca genetik materyali kontrol ederek onun etkili bir şekilde çalışmasına yardımcı olmaktadır [23]. Çekirdek ile sitoplazma arasında taşımada görevli özel proteinler yer almaktadır [24]. Bölünme safhasında olmayan hücrelerde, nükleus içerisinde nükleolus adı verilen ribozomal RNA’ların üretildiği alanlar yer almaktadır. Hücrenin protein sentezinin yoğunluğuna bağlı olarak sayıları artar ve mitoz-mayoz bölünme sırasında kaybolarak telofaz evresinde tekrardan şekillenmektedir [23].
2.2.2 Kromozom
İlk kez 1848 yılında Hofmeister tarafından Tradescantia bitkisinin polen hücrelerinde tesbit edilen ve 1877 yılında Flemming tarafından Salamandra maculata hücrelerinde mitoz bölünmenin evreleri boyunca hareketleri net bir şekilde gözlenen bu yapılara 1888 yılında Valdeyer tarafından kromozom ismi verilmiştir [25, 26, 27]. Çekirdek içerisindeki DNA, kromozom olarak adlandırılan birimler halinde organize olmuş halde yer almaktadır. Ökaryotik bir hücrenin nükleusunda DNA ipliği sayısınca kromozom bulunmaktadır. Kromozom; histon ve histon olmayan proteinler aracılığıyla kısalıp kalınlaşarak hücre bölünmesi sırasında görülebilir hale gelen DNA molekülüdür. Hücre bölünmesinin ardından kromozom yapısını oluşturan bileşenler açılarak kromatin denen yapıyı oluştururlar [28, 29, 30].
2.2.2.1 Kromatinin yapısı ve nükleozomlar
Ökaryotlarda DNA, hücre döngüsünün interfaz evresinde kromatin iplikler şeklinde düzenlenmiştir. Ökaryotik kromatin yapısı, kromozomal DNA ile ilişkili az miktarda RNA molekülü ve çok sayıda protein barındırmaktadır. DNA ipliği ile proteinlerin birleşerek meydana getirdiği kromatin iplik; nükleozom yapısı, solenoid yapı ve ardından ilmek halkasının oluşması aşamalarından geçerek metafaz kromozomu şeklini alır [31]. Bu proteinler, yapısında artı yüklü aminoasitler olan arjinin ve lizini çok fazla bulunduran ve nükleozom yapısını oluşturan “histon proteinleri” ile bazik özelikte olmayan replikasyon ve transkripsiyon gibi ökromatinin aktivitesinin düzenlenmesinde ve yapısal oluşumunda görev alan “histon olmayan” proteinlerdir [28, 29, 32].
Histon proteinleri ökaryotik canlılarda histon proteinleri benzer yapıdadır, ancak histon olmayan proteinler doku ve hücre tipine bağlı olarak değişiklik gösterebilir. Histon proteinleri, H1, H2A, H2B, H3 ve H4 olarak adlandırılan pozitif yüklü proteinler olup, DNA’nın yapısındaki şeker fosfat omurgasındaki negatif yüklü fosfat omurgasına sıkı bir şekilde bağlanırlar. DNA ipliği, birer çift H2A, H2B, H3 ve H4 proteinlerinin bir araya gelmesiyle oluşan histon oktomerinin etrafına DNA molekülünün 1,7 tur sarılması sonucu nükleozom yapısı oluşmaktadır. H1 histon proteinin eklenmesi ile birlikte DNA oktomer etrafında yaklaşık iki tam dönüş yapar ve böylece kromatozom olarak adlandırılan boncuk tanesi yapısı oluşur [33] (Şekil 2.4).
Şekil 2.4. Nükleozomun genel olarak şekli [34].
Üzerinde boncuk taneleri şekline nükleozomları bulunduran kromatin iplikler tekrar heliks şeklinde sarılarak her bir dönüşte altı nükleozom içeren solenoid yapıları meydana getirir. Solenoid yapıdaki uzun kromatin döngüleri, High-Mobility Group (HMG) proteinler, histon olmayan proteinler ve RNA molekülleri tarafından oluşturulan metafaz kromozomunun şekline sahip yapısal bir kromozom iskelesine tutunarak yoğunlaşmaya devam eder ve sonunda metafaz kromozomu yapısının oluşmasını sağlar (Şekil 2.5) [35, 36].
2.2.2.2 Kromozom morfolojisi
Kromozom yapısında sentromer bölgesi, telomer bölgeleri ve nükleolar organizer bölgeleri (NOR) görülebilir. Sentromer bölgesi kardeş kromotitlerin birbirine tutunmasını sağlayan birincil boğumlanma bölgeleridir. Sentromer bölgelerinin dış tarafında kinetokor adı verilen ve hücre bölünmesi esnasında kromozomların hareketini sağlamak amacıyla iğ ipliklerinin tutunduğu bir bölge bulunur [38]. Kromozomların ayrımında sentromer ve kinetokor bölgelerinin doğru bir şekilde oluşması hücre sağkalımı için hayati öneme sahiptir [39]. Sentrozom kromozomu iki kola ayırır ve kromozomların sınıflandırılmasında bu iki kolun uzunluklarından yararlanılır. Bu kollardan “p” (petit) kısa kolu ve “q” ise uzun kolu simgelemek için kullanılır. Kromozomlar sentromer pozisyonlarına göre metasentrik (sentromerin kromozomun tam ortasında yer alması), submetasentrik (sentromerin bir uca doğru hafif kaymış olması), akrosentrik (sentromer bir uca daha yakın olması) ve telosentrik (sentromerin en uçta olduğu kısımdır) olarak adlandırılır (Şekil 2.6) [38, 40].
Prokaryot canlılarda halkasal DNA bulunmaktadır. Oysa ökaryot canlıların nükleusunda yer alan DNA linear yapıdadır. Bu durum kromozomları, uçlarında kırılma ve kromozomların birbirine yapışması gibi bir takım sorunlar oluşmasına açık hale getirir. Ancak kromozomların uç bölgelerinde bulunan telomer bölgeleri kromozom uçlarının stabilitesinin sağlanmasında hayati rol oynar.
Bazı kromozomların uç bölgelerinde ikincil bir boğumlanma daha görülebilir. Bu boğumlanmanın devamında ribozom organelinin bir bileşeni olan ribozomal RNA’ların oluşmasında görev alan genlerin yer aldığı NOR olarak adlandırılan DNA parçası bulunur. NOR bölgeleri interfaz evresinde nükleolusu oluşturur. NOR bölgesi içeren kromozomlar, bu bölgenin bölünme esnasındaki görünüşünden dolayı satellit kromozomlar olarak ta adlandırılmaktadır[28, 32, 38].
2.2.2.3 Karyotip ve İdiogram
Bir organizmaya ait kromozomların sentromer yerleri, kol uzunlukları ve NOR bölgesi içerip içermemesi gibi morfolojik özellikleri dikkate alınarak homolog çiftlerin oluşturulup büyükten küçüğe doğru belirli bir düzene göre dizilmesi işlemine karyotip denilmektedir. Her tür için karakteristik olan karyotip çalışmalanın yapılabilmesi çin kromozomların en yoğun halde bulunduğu metafaz evresi fotoğrafları kullanılır. Karyotipten faydalanılarak türlerin karyotiplerinin haritalaması çıkartılarak elde edilen grafik gösterimine idiogram denilmektedir [38, 42, 43, 44]. Karyotip ve idiyogram verilerinden sayısal ve yapısal mutasyonların saptanmasında ve tür teşhisinde yararlanılabilir.
2.2.3. Hücre bölünmeleri
Hücre döngüsü, bir hücre bölünmesinin tamamlanmasından, diğer hücre bölünmesinin tamamlanmasına kadar geçen olaylar bütünü hücre döngüsü olarak adladırılır. Ökaryotik hücrelerde mitoz bölünme ve mayoz bölünme olmak üzere iki çeşit hücre bölünmesi gözlenebilir. Genetik olarak birbirinin aynısı iki hücrenin oluştuğu mitoz bölünme sayesinde hücre sayısı klonal olarak artar. Böylece bir hücreli canlılarda çoğalmanın sağlanması, çok hücrelilerde ise büyüme-gelişme, yaraların onarımı ve rejenerasyon gibi olayların gerçekleşmesini sağlanır. Kromozom sayısının yarıya inmesi ile sonuçlanan mayoz bölünme ise hem genetik olarak çeşitliliğin sağlanmasında hemde
kromozom sayısının döllenme sonucunda tekrar diploid hale dönmesinde önemli bir rol oynar [24].
2.2.3.1. Mitoz bölünme
Mitoz bölünme genel olarak interfaz evresi, mitotik evre ve sitokinez olmak üzere üç aşamadan oluşmaktadır. İnterfaz safhası, iki çekirdek bölünmesi arasında geçen hücrelerin normal metabolik işlevlerini yerine getirdiği ve aynı zamanda hacim olarak büyüdüğü evredir. İnterfaz evresi kendi içerisinde G0, G1, S ve G2 olarak dört aşamada incelenebilir. G0 evresinde, hücre aylarca hatta yıllarca bölünmeksizin kaldığı ve canlı vücudu içerisindeki görevlerini yerine getirdiği evredir. G1 evresi hücrenin mitoz bölünmeden sonra uğradığı ilk evredir. Mitoz bölünmeyi tamamlayan hücre genetik olarak atasının aynısıdır ancak hacim olarak atasının yarısı büyüklüğe sahiptir. Bu durumdaki yavru hücre G1 evresi olarak adlandırılan hızlı bir büyüme sürecine girer. G1 evresi sonunda hücre ya G0 evresine geçer ya da içerden veya dışardan gelen bölünmeyi indükleyici etmenler tarafından S evresine itilirler. S evresi DNA replikasyonun gerçekleştiği, sentrozom organelinin kendisini eşlediği evredir. Replikasyonun tamamlanmasının ardından G2 evresi olarak adlandırılan ve bölünme esnasında ihtiyaç duyulacak proteinler ve benzeri maddelerin üretildiği kısa bir evre gelir. Mitoz bölünme için gereken hazırlıklar tamamlandıktan sonra hücre mitotik faz (M faz) olarak adlandırılan bölünme evresine girer. Mitoz bölünme çekirdek zarının yıkılması, kromatin ipliğin yoğunlaşıp kromozom haline gelmesi, kromozomların hareketi, kromozom yapısının tekrar çözülmesi ve çekirdek zarının yeniden oluşması gibi olaylar gözönüne alınarak, profaz, prometafaz, metafaz, anafaz ve telofaz olmak üzere beş evrede incelenebilmektedir [35, 45, 46].
Profaz evresinde, çekirdek içerisindeki kromatin iplikler histon ve histon olmayan proteinlerin yardımıyla kısalıp kalınlaşarak kromozom halini almaya başlar. Profazın başında her bir kromozom, sentromerleri aracılığıyla birbirine tutunmuş iki kardeş kromatitten oluşmaktadır. Her bir sentromerin dış tarafında kromozomların iğ ipliklerine tutunmasını sağlayan kinetokorlar gözlenir. Profazın sonuna doğru nükleoluslar giderek küçülür ve kaybolurlar [47].
Prometafaz evresinde; kromozomlar daha da yoğunlaşırlar. Çekirdek zarının yıkılmasıyla sentrozomdan uzanan mikrotübüller kinetokorlara tutunarak kinetokor
mikrotübüllerini oluşturmaya başlarlar [24].
Metafaz evresinde; kromozomlar iyice kısalıp kalınlaşarak en yoğun haline ulaşır ve iğ iplikçikleri aracılığıyla hücrenin ekvatoral düzlemine dizilirler. Kinetokora bağlanan mikrotübüller, organizmalar arasında büyük farklılıklar göstermektedir.Maya (Saccharomyces) bir tane mikrotübül bağlanırken, memelilerde ise kinetokora 30-40 mikrotübül bağlanabilmektedir (Şekil 2.7) [28].
Şekil 2.7. Mitoz bölünmenin evreleri [48]
Anafaz evresinde kardeş kromatitler birbirlerinden ayrılarak zıt kutuplara doğru hareket ederler. Böylece her bir kromatit artık bağımsız birer kromozom olarak adlandırılır. Kinetokorlara bağlı olmayan mikrotübüllerin uzamasıyla birlikte, hücrenin boyu da
Sentrioller
Nükleus Nükleus zarı Hücre zarı Sitoplazma İğ iplikleri Kardeş kromatitler İnterfaz Profaz Prometafaz Sentromer Kutup iği Mikrotübül Kromatit Kardeş hücreler Metafaz Anafaz Telofaz Ekvatoral düzlem
uzamıştır. Bu evrenin sonlarına doğru hayvan hücrelerinde sitoplazma bölünmesini gerçekleştirmek üzere hücre zarı ekvatoral düzlem boyunca yavaş yavaş boğumlanmaya başlar. Telofaz evresi kardeş kromatitlerin zıt kutuplara ulaşmasıyla birlikte başlar. Bu evrede kromozomların etrafında yeniden çekirdek zarı oluşmaya başlar. Kromozom materyali gevşeyerek kromatin iplikleri haline döner. Nükleoluslar yeniden görünür hale gelir. İğ iplik mikrotübülleri depolimerize olurlar. Bir önceki evrede başlamış olan sitokinez geç telofazda tamamlanır. Böylece genetik olarak birbirinin aynısı iki yavru hücre oluşur (Şekil 2.7) [24].
2.2.3.2 Mayoz bölünme
Hücre mayoz bölünmeye başlamadan önce, mitoz bölünmede de olduğu gibi G1, S ve G2 evrelerini içeren bir interfaz evresi geçirerek DNA’sını bir kez replike eder. Böylece mayoz bölünmeye katılan her bir kromozom, iki kardeş kromatide sahiptir. Bir interfaz evresinin ardından mayoz I ve mayoz II olmak üzere iki kez çekirdek bölünmesi gerçekleşir. Sonuçta diploit (2n) bir hücreden haploit (n) dört yavru hücre meydana gelir. Mayoz I; profaz I, metafaz I, anafaz I ve telofaz I evrelerinden meydana gelir. Mayoz bölünmenin en uzun evresini profaz I evresi oluşturur. Profaz I evresi; leptoten, zigoten, pakiten, diploten ve diyakinez olarak beş alt aşamada incelenebilir [24].
Leptoten evresinde, kromozomal yapılar çok ince, uzun ve karmaşık yapıda olmaları sebebiyle ışık mikroskobunda ayırtedilebilmeleri zordur. Ancak, bu evrede bazı türlerin erkek bireylerinde, eşey kromozomlarının otozomlara göre daha çok yoğunlaşması ve daha koyu boyanması nedeniyle heteropiknotik özellikte görülmesi mümkündür [49]. Ayrıca,bu evrenin sonuna doğru aynı karakterlerin kalıtımından sorumlu biri anneden diğeri babadan gelen ve homolog kromozomlar olarak adlandırılan kromozomlar yan yana dizilerek bivalentleri oluştururlar. Herbir bivalent tetrat adı verilen dört kromatitten oluşmaktadır. Zigoten evresinde, homolog kromozomlar arasında sinaptonemal kompleks (SC) olarak adlandırılan mayotik rekombinasyondan sorumlu bir yapı meydana gelir [36, 49]. Pakiten evresinde kromozomlar yoğunlaşmaya devam ederken, aynı zamanda homolog kromozomların kardeş olmayan kromatitleri arasında genetik madde alış verişi yani krossing-over gerçekleşir. Diplotenin başlangıcında, SC’nin bozulması ile birlikte homolog kromozomlar birbirlerinden ayrılmaya başlar. Çekirdek zarının yıkılmasının ardından homolog kromozomlar kinetokor bölgelerinden
iğ ipliklerince tutularak ekvator düzlemine doğru hareke geçerler (Şekil 2.8).
Metafaz I evresinde homolog kromozomlar ekvatoral düzlemde yanyana dizilirler. Anafaz I evresinin başlangıcında bivalenti meydana getiren homolog kromozomlar birbirlerinden ayrılıp zıt kutuplara çekilir. Telofaz I evresinde kromozomların zıt kutuplara ulaşması ile birlikte kromozom materyalinin etrafında çekirdek zarı oluşur. Mayoz I ve II arasında kısa bir interkinez olarak adlandırılan kısa bir evre görülebilir. Ancak burada bir replikasyon söz konusu değildir [24, 28, 29, 46].
Anafaz II safhasında kardeş kromatitler birbirlerinden ayrılarak zıt kutuplara doğru çekilmeye başlar. Ancak bazı canlılarda eşey kromozomları birbirlerinden ayrılmadan aynı kutba çekilirler. Telofaz II evresi kardeş kromatitlerin zıt kutuplara ulaşması ile başlar. Kromozomların etrafında çekirdek zarı oluşur. Kromozomlar tekrar kromatin iplikler haline dönüşürler [49].
Şekil 2.8. Mayoz bölünmenin evreleri [37]. Leptoten
Zigoten
Erken pakiten Geç pakiten
Diploten Diakinez Profaz I Metafaz I Anafaz I Telofaz I Metafaz II Anafaz II Telofaz II
3. BÖLÜM
MATERYAL VE METOT
3.1. Materyal
3.1.1. Örümceklerin toplanması
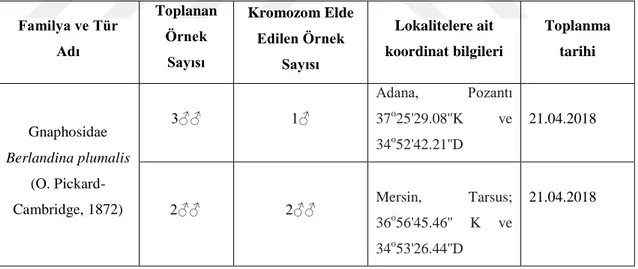
Çalışmada kullanılan Berlandina plumalis (O. Pickard-Cambridge, 1872) örnekleri taş, kurumuş yaprak yığınları ve kütük altlarından elle toplanmıştır (Tablo 3.1). Örümceklere arazi çalışması sırasında herhangi bir işlem uygulanmamış olup kannibalist olmaları nedeniyle her bir örümcek ayrı plastik tüplere konularak etiket bilgileri (lokalite adı, koordinatlar, habitat özellikleri, toplayan kişi, örnek numarası) düzenlenmiştir.
Tablo 3.1. Çalışmada kullanılan Berlandina plumalis’a ait, arazi çalışması bilgileri Familya ve Tür Adı Toplanan Örnek Sayısı Kromozom Elde Edilen Örnek Sayısı Lokalitelere ait koordinat bilgileri Toplanma tarihi Gnaphosidae Berlandina plumalis (O. Pickard-Cambridge, 1872) 3♂♂ 1♂ Adana, Pozantı 37o25'29.08''K ve 34o52'42.21''D 21.04.2018 2♂♂ 2♂♂ Mersin, Tarsus; 36o56'45.46'' K ve 34o53'26.44''D 21.04.2018
Laboratuvara getirilen örnekler, ergin hale gelinceye kadar haftada iki kez meyve sinekleri (Drosophila melanogaster) ile beslenmiştir.
3.1.2. Laboratuvarda kullanılan cihazlar
1. Streo mikroskop: Gonadların çıkarılması amacıyla örümceklerin diseksiyonunda 2. Buzdolabı: Örümceklerin diseksiyondan önce hareketlerinin yavaşlatılması
3. Ph metre: Giemsa boyamada kullanılan fosfat tamponunun ph ayarlamasının yapılması,
4. Isıtıcı tabla: Yayma preparat yapımı aşamasında asetik asitin buharlaştırılması, 5. Faz-kontrast mikroskobu: Preparatların boyama yapılmadan incelenmesi,
6. BX53 araştırma mikroskobu, DP26 kamera ataçmanı ve CellSens programı: Preparatların incelenmesi, fotoğraflarının çekilmesi, kromozom ölçümlerinin yapılması, mayoz bölünme evrelerinin incelenmesi,
3.1.3. Kimyasalların hazırlanması
a. Fizyolojik tuz çözeltisi
Omurgasız hayvanlar için izotonik tuz çözeltisi kullanılır. Bunun için,
9 gr NaCl, 0.4 gr KCl, 0.2 gr NaHCO3 ve 0.33 gr CaCl2.2H2O tartılarak 1000 ml suda
çözdürülür.
b. Hipotonik çözelti
2,8 gr KCl tartılarak 500 ml distile suda çözdürülür. 0.075 M KCl çözeltisi kullanılır.
c. Fiksatif
3:1 oranında etanol (veya metanol): glasiyal asetik asit karışımı hazırlanır. Bu çözelti taze olarak kullanılmalıdır.
d. Asetik asit çözeltisi
% 60’lık asetik asit çözeltisi kullanılır. 12 ml asetik asit, 8 ml distile su ile karıştırılır. Bu çözelti taze olarak kullanılmalıdır.
e. Giemsa çözeltisi
% 5’lik giemsa çözeltisi hazırlanır. Bunun için öncelikle fosfat tamponu hazırlanmalıdır.
f. Fosfat tamponu
ayarlanarak kullanılır. Kromozomların boyanması sırasında 5 ml giemsa boyası, 95 ml’lik fosfat tamponu ile karıştırılarak kullanılır.
3.2. Metot
3.2.1. Preparasyon aşaması
Örümceklerden kromozom preparatlarının hazırlanması, Pekar ve Král [50] metoduna göre yapılmıştır. Bu metodun ana basamakları aşağıda verilmiştir:
Ergin hale gelen erkek örümcekler, hareketlerinin kısıtlanması amacıyla buzdolabının -20 °C’lik bölümüne konularak burada 30 sn kadar bekletilmiştir. Buzdolabından çıkarılan örümcekler, stereo mikroskop altında prosoma
bölgesinden sıkılarak öldürülmüştür.
İzotonik tuz çözeltisi içerisinde, prosoma ve opistosoma bölgeleri birbirinden ayrılarak, opistosoma bölgesinden diseksiyonla gonadları çıkarılmıştır.
Gonadlar hipotonik çözelti içerisinde 20 dk bekletilmiştir.
Süre sonunda gonadlar fiksatif içerisine alınarak 10 ve 20 dk olmak üzere iki kez fikse edilmiştir.
Süre sonunda gonadlar temiz bir lam üzerine konulmuştur, daha sonra gonadın üzerine bir damla asetik asit çözeltisi damlatılmıştır. Lamlar bu aşamada, 42 °C’ye ayarlanmış ısıtıcı tabla üzerine konulmuştur.
Süspansiyon haline gelen bu karışım tamamen buharlaşıncaya kadar yayma işlemi gerçekleştirilmiştir.
Daha sonra preparatlar en az 24 saat süreyle havada kurumaya bırakılmıştır.
Kurutulan preparatlar faz-kontrast mikroskobunda incelenerek preparatların bölünen hücreler içerip içermedikleri tespit edilmiştir.
3.2.2. Preparatların boyanması
Dik şale içerisine 95 ml fosfat tamponu konulmuştur.
Fosfat tamponunun üzerine 5 ml Giemsa boyası konularak % 5’lik Giemsa çözeltisi hazırlanmıştır.
Ayrı bir dik şale içerisine daha önce hazırlanmış olan preparatlar yerleştirilmiştir. Giemsa çözeltisinin üzerindeki tortu tabakası temizlenerek preparatların bulunduğu
şale üzerine dökülmüştür.
55 dk süreyle boyama işlemi gerçekleştirilmiştir.
Süre sonunda preparatlar önce musluk suyunda, daha sonra distile su ile yıkanarak havada kurumaya bırakılmıştır.
Preparatlar kuruduktan sonra özel kutulara konularak +4 °C’lik ortamda muhafaza edilmiştir.
3.2.3. Mikroskop incelemesi, fotoğraflama ve karyotip yapılması
Hazırlanmış olan preparatlar, öncelikle CX21 (Olympus) marka ışık mikroskobunda taranarak hücre bölünmeleri ve özellikle mitotik metafaz evresi içerip içermedikleri araştırılmıştır.
Tespit edilen hücrelerin preparat üzerindeki konumunu gösteren koordinatlar ve hangi evre olduğuna ilişkin bilgiler kaydedilmiştir.
Tüm preparatların ön incelemesi tamamlandıktan sonra, iyi kalitede olan mitoz ve mayoz bölünmeye ait evrelerin fotoğrafları BX53 araştırma mikroskobuna bağlı DP26 kamera sistemi ve CellSens programı (Olympus) ile çekilmiştir.
Karyotip yapılması için 10 metafaz evresi ve mayoz bölünme özelliklerinin belirlenmesi amacıyla bölünmeye ait evreler fotoğraflanmıştır.
Karyotip yapılması aşamasında metafaz evrelerine ait her bir fotoğraftaki kromozomlar numaralandırılarak, bu kromozomların uzunlukları mikrometrik (µm) olarak CellSens programı (Olympus) ile ölçülmüştür.
Ölçüm yapılırken kromozoma ait, kısa kol (p), uzun kol (q), toplam kol uzunluğu (p+q), sentromerik index (CI) ve relatif kromozom uzunlukları hesaplanmıştır. Ölçülen kromozom uzunluklarına göre homolog kromozom çiftleri bulunmuştur. Otozomal kromozom çiftleri, uzunluk sırasına göre azalan şekilde Photoshop CS3
programında karyotipi hazırlanmıştır.
Mayoz bölünmeye ait evrelerin incelenmesinde ise eşey kromozomlarının piknotik karakterleri, çekirdekteki konumu, bivalentlerin kiyazma özellikleri gibi sitogenetik karakterler değerlendirilmiştir.
Kromozom morfolojisinin belirlenmesinde Levan vd. [51] referans olarak alınmıştır. Buna göre metasentrik = 1.0-1.69, submetasentrik = 1.7-2.99, subtelosentrik= 3.0-6.99 and telosentrik = 7.0-∞ olarak değerlendirilmiştir.
4. BÖLÜM
BULGULAR
Dünyada Berlandina Dalmas, 1922 cinsinin 38 türü bulunmaktadır. Bunlardan B.
plumalis (O.P.-Cambridge, 1872) ve B. pulchra (Nosek, 1905) olmak üzere iki tür
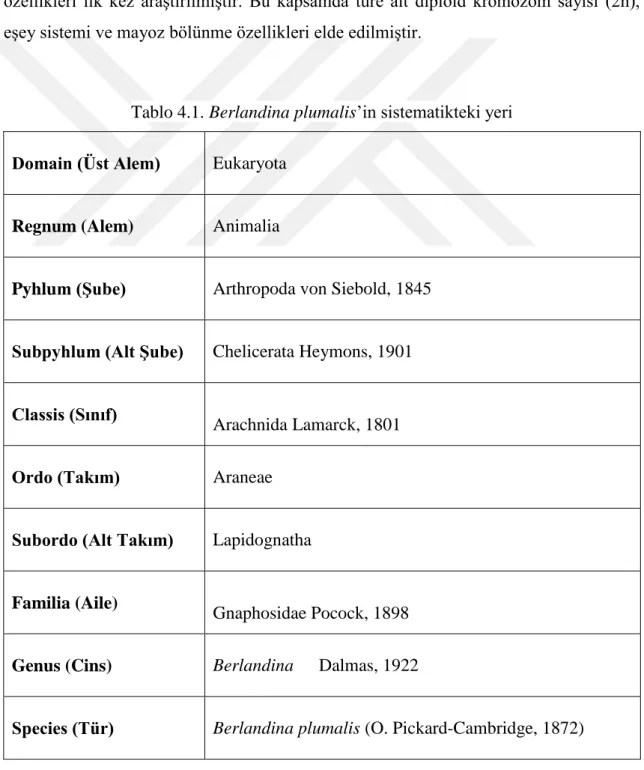
ülkemizde bulunmaktadır. B. pulchra ülkemiz için endemik bir tür olup B. plumalis Batı Afrika, Akdeniz'den Orta Asya'ya ve İran’a kadar yayılış göstermektedir. B. plumalis’e ait sistematik bilgiler Tablo 4.1’de verilmiştir. Bu çalışmada, B. plumalis’in sitogenetik özellikleri ilk kez araştırılmıştır. Bu kapsamda türe ait diploid kromozom sayısı (2n), eşey sistemi ve mayoz bölünme özellikleri elde edilmiştir.
Tablo 4.1. Berlandina plumalis’in sistematikteki yeri
Domain (Üst Alem) Eukaryota
Regnum (Alem) Animalia
Pyhlum (Şube) Arthropoda von Siebold, 1845
Subpyhlum (Alt Şube) Chelicerata Heymons, 1901
Classis (Sınıf)
Arachnida Lamarck, 1801
Ordo (Takım) Araneae
Subordo (Alt Takım) Lapidognatha
Familia (Aile)
Gnaphosidae Pocock, 1898
Genus (Cins) Berlandina Dalmas, 1922
4.1. Sitogenetik Özellikler
Yapılan çalışmada türe ait karyotip özellikleri erkek bireylerde 2n♂=22, X1X20 şeklinde
bulunmuştur (Resim 4. 1). Eşey sistemi, ♂X1X20/♀X1X1X2X20 şeklindedir. Eşey
kromozomları birbirinin homoloğu değildir.
Levan vd. [51]’nin, kromozomların sınıflandırılması yöntemine göre kısa kolun (p) = 0 olması nedeniyle tüm kromozomlar telosentrik tiptedir. Otozomların uzunlukları kademeli olarak azalış göstermektedir. Otozomal relatif kromozom uzunlukları % 9.57 ile % 7.05 arasında değişmektedir. X1 ve X2 eşey kromozomlarının relatif uzunlukları
ise sırasıyla % 9.03 ve % 8.06 şeklindedir. X1 eşey kromozomu karyotipte 3. otozomal
çiftten büyük, X2 ise 7. otozomal çiftten büyüktür (Tablo 4.1). X2/X1 (%) oranı ise %
89.3’tür.
Resim 4.1. Berlandina plumalis’e ait mitotik metafaz evresi (2n♂=22, X1X20)
Şekil 4.1. Berlandina plumalis’e ait karyogram (Skala=10 µm)
Tablo 4. 1. Metafaz evrelerinin ölçüm sonuçlarına göre kromozom uzunlukları, tipi ve sentromerik index bilgileri (±: Standart sapma, T: telosentrik)
No Uzun kol (q) (µm) Kısa kol (p) (µm) Toplam uzunluk (p+q) (µm) Sentromer ik index (CI) Relatif uzunluk (%) Kromozo m tipi 1 7.33±0.28 0 7.33±0.28 0 9.57 T 2 7.02±0.42 0 7.02±0.42 0 9.16 T 3 6.80±0.12 0 6.80±0.12 0 8.87 T 4 6.62±0.37 0 6.62±0.37 0 8.64 T 5 6.47±0.19 0 6.47±0.19 0 8.44 T 6 6.23±0.25 0 6.23±0.25 0 8.13 T 7 6.08±0.10 0 6.08±0.10 0 7.93 T 8 5.84±0.36 0 5.84±0.36 0 7.62 T 9 5.69±0.22 0 5.69±0.22 0 7.43 T 10 5.40±0.18 0 5.40±0.18 0 7.05 T X1 6.92±0.24 0 6.92±0.24 0 9.03 T X2 6.18±0.16 0 6.18±0.16 0 8.06 T
4.2. Mayoz Bölünme Özellikleri
Mayoz bölünme, mayoz I ve mayoz II olmak üzere iki kez gerçekleşen çekirdek bölünmesini içermektedir. Mayoz I’in profaz I evresi, leptoten, zigoten, pakiten, diploten ve diyakinez olmak üzere beş alt evrede gerçekleşir.
Profaz I’in leptoten evresinde, interfazda kromatin materyali halinde bulunan genetik materyal, yoğunlaşmaya başlar, ancak kromatinin kromozom haline gelmemiş olması nedeniyle henüz sayılabilecek bir özellikte değildir. Bu evrede eşey kromozomları, otozomlardan daha hızlı bir yoğunlaşma göstererek sayılabilir hale gelmiştir. Eşey kromozomları pozitif heteropiknotik özellikte olup otozomlardan daha koyu boyanmıştır. Eşey kromozomları çekirdek yüzeyinde konumlanmıştır. Bu evrede eşey kromozomları arasında bir bağlanma noktası bulunmaktadır (Resim 4. 2).
Zigoten evresinde kromatin materyali kısalmaya ve kalınlaşmaya devam etmektedir. Biri anneden diğeri babadan gelen homolog kromozomlar arasında homoloji araması, bu evrede gerçekleşir. Homolog kromozomlar arasında sinaptonemal kompleks denilen yapı gelişir ve bu kromozomları bir arada tutar. Kromatin iplikleri daha belirgin bir hale gelmiştir. Ancak bu evrede eşey kromozomlarında tekrar bir gevşeme meydana gelerek “eşey vezikülü” oluşumu gözlenmiştir. Eşey vezikülü, pozitif heteropiknotik bir özellikte olup çekirdek yüzeyine yerleşmiştir (Resim 4. 3).
Resim 4.2. Berlandina plumalis’e ait profaz I’in leptoten evresi (Oklar eşey
kromozomlarını göstermektedir) (Skala=10 µm)
Resim 4.3. Berlandina plumalis’e ait profaz I’in zigoten evresi (Ok işareti eşey
Pakiten evresinde zigoten sonunda oluşan bivalentler daha belirgin hale gelir. Bivalentlerin kısalma ve kalınlaşmaları devam eder. Leptoten ve zigotende pozitif heteropiknotik olan eşey kromozomları, pakiten evresinde izopiknotik özellikte olup otozomlardan ayırt edilememiştir (Resim 4.4).
Diploten evresinde, bivalentler sayılabilir duruma gelmiştir. Bu evrede 10 otozomal bivalent ve iki eşey kromozomu belirlenmiştir. Eşey kromozomları birbirinin homoloğu olmadığı için bivalent meydana gelmemiştir. Çünkü “homoloji araması”na uyum göstermemişlerdir. Yani iki univalent eşey kromozomu olarak saptanmışlardır (Resim 4.5).
Diyakinez evresinde kromozomların kısalma ve kalınlaşmaları sona yaklaşmıştır. Bu evrede 10 otozomal bivalent ve iki univalent eşey kromozomu belirlenmiştir. Eşey kromozomları pozitif heteropiknotik olarak birlikte hareket etmişlerdir (Resim 4.6).
Resim 4.5. Berlandina plumalis’e ait profaz I’in diploten evresi (Ok işareti eşey
kromozomlarını göstermektedir) (Skala=10 µm)
Diploten ve diyakinez evrelerinde, bivalentlerin genellikle bir kiyazmaya sahip oldukları bulunmuştur. Kiyazma tipleri terminal, proksimal ve interstitial tiptedir. İnterstitial tipteki kiyazmalar, diyakinez evresinde sayıca daha fazla görülmüştür ve bu özellik metafaz I evresinde de devam etmiştir.
Resim 4.6. Berlandina plumalis’e ait profaz I’in diyakinez evresi (Ok işareti eşey
kromozomlarını göstermektedir) (Skala=10 µm)
Anafaz I’de kardeş kromatitler arasında bulunan kohezin, sentromer bölgesi hariç geri kalan kısımlarda yıkıma uğrar. Böylece tetradın yarısı yani kardeş kromatitlerin bir çifti (diyad) bölünmekte olan hücrenin iki zıt kutbuna doğru hareket eder.
Eşey kromozomları pozitif heteropiknotik özelliklerini kaybederek izopiknotik olarak otozomlardan ayırt edilememişlerdir. Ancak, bu evrede otozomlara ait kardeş kromatitlerin bir çifti, zıt kutuplara doğru normal bir şekilde hareket etmiş olsa da eşey kromozomu X1 ve X2 zıt kutuplara doğru değil, birlikte tek bir kutba doğru hareket
etmiştir (Resim 4.7).
Eşey kromozomları yapısal olarak otozomlardan ayırt edilebilmiştir. Çekirdek yüzeyinde konumlanmışlardır. Bu evrede otozomal kromozomları oluşturan kardeş kromatitler uç noktalarından birbirine bağlı durumdadırlar. Oluşan iki yeni çekirdekte n=12 (10 otozom + X1X2) ve n=10 kromozom bulunmuştur.
Resim 4.7. Berlandina plumalis’e ait geç anafaz I evresi (Oklar eşey kromozomlarını
göstermektedir) (Skala=10 µm)
Profaz II evresi, anafaz I evresine benzerlik göstermektedir. Ancak kromozomların süperspiral yapıları, anafaz I’den ayırmaktadır. Kardeş kromatitler hala uç noktalarından birbirlerine bağlı olarak bulunmaktadır.
Eşey kromozomları izopiknotik özellikte olup otozomlarla eşit derece boyanmıştır. Bu evrede eşey kromozomlarının otozomlardan daha fazla kısalma ve kalınlaşma göstermesinden dolayı otozomlardan ayırt edilebilmiştir. Eşey kromozomları, birlikte ve çekirdek yüzeyinde konumlanmıştır (Resim 4. 8).
Metafaz II evresinde sentromerler ekvatoral düzlemde dizilirler. Kardeş kromatitler arasındaki kohezin yıkıma uğrayarak anafaz II başlar.
Bu evrede de eşey kromozomları izopiknotik özellik göstermiştir. Eşey kromozomları birlikte bir kutba doğru hareket etmişlerdir. Böylece oluşan dört yeni çekirdekte n=12 (10 otozom + X1X2) ve n=10 kromozom bulunmuştur.
Resim 4.8. Berlandina plumalis’e ait profaz II evresi (Oklar eşey kromozomlarını
5. BÖLÜM
TARTIŞMA VE SONUÇ
Dünyada 119 familya ve 4140 cinse ait 48000’in üzerinde örümcek türünün yaşadığı bilinmektedir. Gnaphosidae familyası 2532 tür ile en zengin dördüncü familyayı (Salticidae = 6139 tür, Linyphiidae = 4605 tür, Araneidae = 3101 tür) oluşturmaktadır [1]. Ülkemizde ise 52 familya ve 339 cinse ait toplam 1117 örümcek türü yayılış göstermektedir. Ayrıca 30 cinse ait 145 tür içermesi nedeniyle Gnaphosidae familyası ülkemizin en zengin örümcek familyasıdır [52].
Günümüze kadar yapılan sitogenetik çalışmalarda 303 cinse ait 843 türün kromozomal özellikleri elde edilmiştir. Bu sonuç, henüz örümceklerin sadece % 1.75’i hakkında diploid sayı ve eşey sisteminin tespit edildiği anlamına gelmektedir [9]. Böylece elde edilen yetersiz veriler, örümceklerin karyotip özellikleri, eşey sistemi değişim mekanizmaları ve gruplar arasındaki sitogenetik benzerlik/farklılıkları açıklamada yetersiz kalmaktadır. Örümceklerin üreme dönemlerinin kısa bir zaman aralığında gerçekleşmesi, onlardan kromozom elde etme oranını da düşürmektedir. Bu nedenle örümcek sitogenetiği çalışmaları yavaş bir şekilde ilerlemektedir.
Gnaphosidae familyasının 22 cinse ait 53 türü karyolojik açıdan araştırılmıştır. Bunlar arasında en çok çalışılan cinsler Haplodrassus Chamberlin, 1922, Nomisia Dalmas, 1921, Pterotricha Kulczyński, 1903 ve Zelotes Gistel, 1848’dir (Tablo 5.1). Yapılan çalışmalarda familyada diploid sayının 2n=21 ile 30 arasında değiştiği görülmektedir. Ancak en çok karşılaşılan diploid sayı 2n=22 şeklindedir. Bu da diploid sayının familya içerisinde korunduğunu göstermektedir.
Familyada ♂X1X2/♀X1X1X2X2 ve ♂X0/♀XX şeklinde eşey sistemi görülmekle birlikte
♂X1X2/♀X1X1X2X2 eşey sisteminin familya için karakteristik bir özellik olduğu
görülmektedir.
Gnaphosidae örümcekleri kromozom morfolojisi açısından değerlendirildiğinde telosentrik/akrosentrik tipte kromozomların varlığı dikkati çekmektedir. Tek kollu kromozomlar, araneomorf örümceklerin genel karakteristik özelliklerinden birini yansıtmaktadır [53].
Bugüne kadar çalışma konumuzu oluşturan Berlandina cinsi ile ilgili olarak Berlandina
cinerea (Menge, 1872) türü araştırılmıştır. Buna göre diploid kromozom sayısı ve eşey
sistemi 2n♂=22, X1X20 şeklinde kaydedilmiştir. Çalışmamızda B. plumalis’e ait diploid
kromozom sayısı ve eşey sistemi 2n♂=22, X1X20 şeklinde olup familya özellikleri ile
uyumludur.
Tablo 5. 1. Gnaphosidae familyasına ait yapılan sitogenetik çalışmalar [53].
Tür Adı 2n Eşey Sistemi Kromozom Morfolojisi Örnekleme Alanı
Berinda ensigera
(O.Pickard-Cambridge, 1874)
22 X1X2 20T+X1X2T Türkiye Berinda hakani Chatzaki &
Seyyar, 2010
22 X1X2 20T+X1X2T Türkiye Berlandina cinerea (Menge, 1872) 22 X1X2 20A+X1X2A Finlandiya
Callilepis cretica (Roewer, 1928) 22 X1X2 20A+X1X2A Türkiye Callilepis imbecilla (Keyserling,
1887)
22 X1X2 ---- ----
Callilepis nocturna (Linnaeus,
1758)
22 X1X2 20A+X1X2A Finlandiya
C. nocturna (Linnaeus, 1758) 22 X1X2 20A+X1X2A Çekoslavakya
Cesonia sincera Gertsch &
Mulaik, 1936
22 ---- ---- ABD
Cesonia sp. 22 X1X2 ---- Hindistan
Civizelotes caucasius (L. Koch,
1866)
22 X1X2 20T+X1X2T Türkiye Drassodes lapidosus (Walckenaer,
1802)
22 X1X2 20A+X1X2A Finlandiya
Drassodes lutescens (C.L Koch,
1839)
21 X 20T+XT Türkiye
Drassodes pubescens (Thorell,
1856)
22 X1X2 20A+X1X2A Türkiye
Drassodes sp. 22 X1X2 20A+X1X2A Japonya
Drassodes sp. 21 X ---- Hindistan
Drassyllus praeficus (L. Koch,
1866)
22 X1X2 20A+X1X2A Türkiye Drassyllus pumilus (C.L. Koch,
1839)
22 X1X2 20A+X1X2A İsrail/
Türkiye
Drasssylus sur Tuneva & Esyunin,
2003
22 X1X2 20A+X1X2 Türkiye
Gnaphosa kailana Tikader, 1966 22 X1X2 ---- Hindistan
G. kailana Tikader, 1966 22 X1X2 20A+X1X2A Hindistan
Gnaphosa muscorum (L. Koch,
1866)
22 X1X2 20A+X1X2A Finlandiya
Gnaphosa sp. 22 X1X2 ---- Hindistan
Gnaphosa sp. 22 X1X2 ---- Hindistan
Gnaphosa sp. 22 X1X2 20T+X1X2T Hindistan
Haplodrassus cognatus (Westring,
1861)
22 X1X2 20A+X1X2A Finlandiya
Haplodrassus dalmatensis (L.
Koch, 1866)
22 X1X2 20A+X1X2 Türkiye Haplodrassus morosus
(O.Pickard-Cambridge, 1872)
22 X1X2 20A+X1X2A Türkiye Haplodrassus signifer (C.L. Koch,
1839)
22 X1X2 20A+X1X2A İsrail Hitobia unifascigera (Bösenberg &
Strand, 1906)
22 X1X2 20A+X1X2A Japonya
Megamyrmaekion sp. 22 X1X2 ---- Hindistan
Micaria albovittata (Lucas, 1846) 22 X1X2 20T+X1X2T Türkiye Micaria nivosa L. Koch, 1866 22 X1X2 20A+X1X2A Finlandiya
Nomisia conigera (Spassky, 1941) 22 X1X2 20A+X1X2 Türkiye
N. conigera (Spassky, 1941) 22 X1X2 ---- Türkiye
Nomisia exornata (C.L. Koch,
1839)
22 X1X2 20A+X1X2A Türkiye Nomisia orientalis Dalmas, 1921 22 X1X2 20A+X1X2A Türkiye
Nomisia ripariensis
(O.Pickard-Cambridge, 1872)
Phaeocedus sp. 22 X1X2 ---- Hindistan
Phaeocedus sp. 22 X1X2 20A+X1X2A Hindistan
Poecilochroa variana (C.L. Koch,
1839)
22 X1X2 20A+X1X2A Finlandiya
Pterotricha dalmasi Fage, 1929 22 X1X2 20A+X1X2A İsrail Pterotricha kochi (O.
Pickard-Cambridge, 1872)
22 X1X2 20A+X1X2A Türkiye Pterotricha lesserti Dalmas, 1921 22 X1X2 20A+X1X2A Türkiye
Pterotricha procera
(O.Pickard-Cambridge, 1874)
22 X1X2 20A+X1X2A İsrail
Scopoides sp. 22 X1X2 ---- Hindistan
Scotophaeus blackwalli (Thorell,
1871)
24 X1X2 ---- Hindistan
S. blackwalli (Thorell, 1871) 24 X1X2 22A+X1X2A Hindistan
Scotophaeus domesticus Tikader,
1962
30 X1X2 ---- Hindistan
Trachyzelotes lyonneti (Audouin,
1826)
22 X1X2 20T+X1X2T Türkiye Trachyzelotes malkini Platnick &
Murphy, 1984
22 X1X2 20T+X1X2T Türkiye
Urozelotes rusticus (L. Koch, 1872) 21 X ---- Hindistan
Zelotes aeneus (Simon, 1878) 20 X1X2 ---- Türkiye
Zelotes petrensis (C.L. Koch, 1839) 23 X ---- Türkiye
Zelotes strandi (Nosek, 1905) 22 X1X2 20A+X1X2A Türkiye Zelotes subterraneus (C.L. Koch,
1833)
22 X1X2 20A+X1X2A Finlandiya
Mayoz bölünmenin birinci evrelerinden profaz I (leptoten, zigoten, pakiten, diploten ve diyakinez) ve metafaz I evrelerinde eşey kromozomlarının pozitif heteropiknotik özellikte olması araneomorf örümceklerin genel özellikleri arasında yer almaktadır. Çalışmamızda da leptoten, zigoten, diploten, diyakinez ve metafaz I evrelerinde eşey kromozomları pozitif heteropiknotik özellik göstermiştir. Ancak pakiten evresinde eşey
kromozomu veya eşey vezikülü ayırt edilememiştir. Bu da eşey kromozomlarının pakiten evresinde izopiknotik karakterde olduğunu ortaya koymuştur. Dolayısıyla elde edilen bu sonuç familya özelliklerinden farklılık göstermektedir. Ayrıca anafaz I, profaz II, metafaz II ve anafaz II evrelerinde ise eşey kromozomlarının izopiknotik özellikte olup otozomlardan ayırt edilememesi familya için karakteristik bir özelliktir. Çalışmamızda anafaz I, profaz II ve metafaz II evrelerinde eşey kromozomlarının daha sıkı paketlenme göstererek otozomlardan ayırt edilmesi B. plumalis’e özgü bir özellik olarak elde edilmiştir.
Sonuç olarak, bu çalışmada B. plumalis’e ait sitogenetik veriler ilk kez elde edilmiştir. Bu veriler ise başta Gnaphosidae familyasının, sonrasında ise Araneae takımının sitogenetik verilerine ilave bilgiler sunmaktadır. Ayrıca uluslararası veri bankasına ülkemiz örümceklerinden kayıtlar girilerek katkı sağlanmış olacaktır.
6. KAYNAKLAR
1. Platnick, N. I. “The World Spider Catalog”, versiyon20.0. American museum of natural history, http://research.amnh.org/entomology.spiders.catalog.index.html, 2019.
2. Çavuşoğlu, K. Ve Yalçın, E., “Eresus Cınnabarınus (Olıvıer, 1789) (Araneae, Eresıdae) Örümceğinin Zehir Aygıtı Üzerine Morfolojik Bir Çalışma”, Sdü Fen
Edebiyat Fakültesi Fen Dergisi, 2(2), 126-135, 2007.
3. Ghavami S., “The role of spiders in citrus orchards in northern part of Iran”,
Sonbol. J. Agri. Sci., 150: 33-34, 2006.
4. Ghavami, S., “The role of spiders (arachinida: araneae) of Iran”, J. agri. sci. 163: 54, 2007.
5. Poyraz, H., “Gnaphosidae familyasına ait bazı örümcek türleri üzerinde sitogenetik çalışmalar”, Nevşehir Hacı Bektaş Veli Üniversitesi Fen Bilimleri Enstitüsü, Yüksek Lisans Tezi, s. 1-2, Nevşehir, 2017.
6. Koponen S., “Greece book of abstract-Ground-living spiders (Araneae) at heavily and slightly polluted sites in subarctic”, 25Th ECA Eurepean congress of Aracnology, 16-21 August, 2009.
7. Kaçar, G., “Biodiversity of Spider Species, Interactions with Horticultural Crops and A New Record for Turkey”, Pakistan J. Zool., vol. 47(2), pp. 545-550, 2015. 8. Gorlova, O. Yu., Gorlov, I. P., Nevo, E. and Logonov, D., V., “Cytogenetic studies
on seventeen spider species from Israel”, Bull. Br. arachnol. Soc., 10 (7), 249–252, 1997.
9. Araujo, D., Schneider, M.C., Paula-Neto, E., Cella, D.M. “The spider cytogenetic database”, Available in, http://www.arthropodacytogenetics.bio.br.spiderdatabase, January, 2019.
10. Danışman, T., Kunt, B. K., Özkütük, R. S., “The Checklist of the Spiders of Turkey World Spider Catalog Version 19.5, 2019.
11. Hickman, C. P., Roberts, L. S., Keen, S. L., Eisenhour, D. J., Larson, A., I'Anson, H., “Zooloji Entegre Prensipler” , Çeviri Editörü, Gündüz, E., Palme Yayınevi, s.
823, 2016.
12. Demirsoy, A., “Yaşamın Temel Kuralları – Omurgasızlar = İnvertebrata”, Cilt II, Kısım I, Meteksan A.Ş., Ankara.
13. Logunov, D.V., Gromov A.V. “Spiders of Kazakhstan”, Siri Sci. Press, p. 232, Manchester, 2012.
14. Theodore, H., Savory, M.A., “The Biology Of Spıders”, Sidgwick & Jackson LTD, p.376, London, 1928.
15. İnternet: Spider Anatomy https://identify-spiders.com/spider-anatomy
16. Foelix, R. F., “Biology of Spiders Third edition”, Oxford University press. Newyork, 2011.
17. Seyyar, O., “Doğu Akdeniz Bölgesi’nin Yer Örümcekleri (Araneae, Gnaphosidae) Faunası”, Erciyes Üniversitesi Fen Bilimleri Enstitüsü, Doktora Tezi, Kayseri, 2009.
18. Babaşoğlu, A., “Örümcekgiller (ARACHNİDA)”, Kültür kitabevi, Niğde, 1999. 19. Akan, Z., “Örümceklerde (Arachnida=Araneae) sitotaksonomik bir araştırma”,
Gaziantep Üniversitesi, Fen Bilimleri Enstitüsü, Yüksek Lisans Tezi, Gaziantep,
2004.
20. “Biology of spiders” D. L. A. Underwood Biology 316 - General Entomology http://www.csulb.edu/~dlunderw/entomology/4-Araneae.pdf.
21. Gajbe, U. A., “Stuies On Some Spiders Of The Family Gnaphosidae (Araneae: Arachnida) From Madhya Pradesh, Indıa”, Rec. zool. Surv. India: 105 (Part 3-4) : 111-140, 2005.
22. Hackman, W., “Chromosomenstudien an Araneen mit besonderer berücksichtigung der geschlechtschromosomen”, Acta Zoologica Fennica, 54, p. 1-101, 1948.
23. Yıldırm, A., Bardakçı, F., Karataş, M. ve Tanyolaç, B., “Moleküler Biyoloji”, 2. Baskı, Nobel yayın dağıtım, Ankara, 2010.
24. Reece, J. B., Urry, A. L., Cain, M. L., Wasserman, S. A., Minorsky, P. V. and Jackson, R. B., “Campbell Biyoloji”, Çeviri Editörleri, Gündüz, E., Türkan, İ.,
Palme Yayıncılık, Ankara, 2013.
25. Baker, J., “The cell-theory: a restatement, history, and critique: Part V. The multiplication of nuclei”, Q J Microscop Sci, 3(96),449–481, 1955.
26. Cremer, T., Cremer, C., “Centennial of Wilhelm Waldeyer's introduction of the term "chromosome" in 1888”. Cytogenet Cell Genet., 48, 66-67, 1988.
27. Yanagida, M., “The role of model organisms in the history of mitosis research”,
Cold Spring Harb Perspect Biol 6(9), 2014.
28. Klug, W. S., Cummings, M.R., Palladino, M. A. “Genetik Kavramlar”, Çeviri Editörleri, Sümer, S., Tuncer, M., Açık, L., Palme Yayıncılık, Ankara, 2018.
29. Topaktaş, M., “Genetik”, Nobel Akademik Yayıncılık, 2014.
30. Kuru, M., Ergene, S., “Genetik”, Palme Yayıncılık, Ankara, 2011.
31. Turner, P. C., McLennan, A. G., Bates, A. D., White, M. R. H. “Moleküler Biyoloji”, Çeviri Editörleri, Konuk, M., Nobel Akademik Yayıncılık, 2004.
32. Temizkan, G., “Moleküler Genetik”, s. 28, 34, Nobel Tıp Kitapevleri, 2014.
33. Annunziato, A. “DNA Packaging: Nucleosomes and Chromatin”, Nature
Education, 1(1), 26, 2008.
34. Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., Walter, P., “Hücrenin Moleküler Biyolojisi 4. Baskı”, Çeviri Editörleri, Buyru, N., Dalay, N., Özgüç, M., Öztürk, M., Sakızlı, M., Garland Science, TÜBA, Ankara, 2008.
35. Lodish, H., Berk, A., Zipursky, S. L., Matsudaira, P., Baltimore, D., Darnell, J., 2000. Molecular Cell Biology, 4th edition New York: W. H. Freeman; ISBN-10: 0-7167-3136-3
36. Karol, S., Ayvalı, C., ,Suludere, Z., “Hücre Biyolojisi”, Öğün Matbaacılık, Ankara, 2000.
37. Turnpenny, P., Ellard, S., “Emery’s Elements of Medical Genetics, Section A The Scientific Basis of Human Genetics 15.edition”, pp. 11-31, Elsevier, china. 2017. 38. Topaktaş, M., Rencüzoğulları, E., “Sitogenetik”, Nobel Yayın Dağıtım, Ankara,
2010.
chromosome segregation”, Curr Opin Cell Biol., 25(3),334–340, 2013.
40. Çam, P., “Mesocricetus Brandti (Nehring, 1898) (Mammalıa:Rodentıa)’ Nin Hibrit Bireylerindeki Kromozomal Düzenlenmeler” Fen Bilimleri Enstitüsü,Yüksek Lisans Tezi, Ankara, 2006.
41. Pierce, B. A., “Genetics: A Conceptual Approach”, 2nd edition. Freeman and
company, USA., 2006.
42. Canpolat, E. “Erzurum Karasu Havzası’nda Yaşayan Pelophylax Rıdıbundus’da (Ova Kurbağası) Karyotipik Ve Genotoksik Çalışmalar”, Atatürk Üniversitesi Fen
Bilimleri Enstitüsü, Yüksek Lisans Tezi, Erzurum, 2017.
43. Arslan, N., “Çankırı İli Kemiricilerinin (Mammalia: Rodentia) Karyolojisi”, Fen
Bilimleri Enstitüsü, Yüksek Lisans Tezi, Çankırı, 2016.
44. Şahin, E., “Türkiye Dıanthus L. (Caryophyllaceae) Taksonları Üzerine Karyolojik Çalışmalar”, Bozok Üniversitesi Fen Bilimleri Enstitüsü, Yüksek Lisans Tezi, Yozgat, 2015.
45. Fletcher, H., Hickey, I., “Genetik”, Çeviri Editörü : Acar, H., Nobel Akademik
Yayıncılık, 2015.
46. Cooper, G.M., Hausman, R.E., “Hücre Moleküler Yaklaşım”, İzmir Tıp Kitabevi, , Çeviri Editörleri, Sakızlı, M., Atabey, N., İzmir, 2006.
47. Bekoğlu, Yılmaz, D., “ Ergene Nehri Suyunun Secale Cereale L. Tohumunun Çimlenmesi Ve Kök Ucu Mitoz Bölünme Üzerine Etkisi” Yüksek Lisans Tezi, Edirne, 2013.
48. Jorde, L. B., Carey, J. C., Bamshad, M. J., “Medical Genetics, Chapter 2 Basic Cell Biology: Structure and Function of Genes and Chromosomes 5. Edition”, Elsevier, p. 24, Philadelphia, PA. 2016.
49. Bernard, J., “Meiosis (Developmental and Cell Biology Series)”, Cambridge University Press. 2005.
50. Pekár, S., Král, J., “A Comparative Study of the Biology and Karyotypes of Two Central European Zodariid Spiders (Araneae, Zodariidae)”, Journal of
51. Levan, A., Fredga, K., Sandberg, A. A., “Nomenclature of centromeric position on chromosomes”, Hereditas, 52, 201-220, 1964.
52. Demir, H. and Seyyar, O., “Annotated Checklıst Of The Spıders Of Turkey” Mun.
Ent. Zool. Vol. 12, No. 2, June 2017.
53. Araujo, D., Schneider, M. C., Paula-Neto, E., Cella, D. M., “Sex Chromosomes and Meiosis in Spiders:A Review, Meiosis - Molecular Mechanisms and Cytogenetic Diversity”, Dr. Andrew Swan (Ed.), ISBN: 978-953-51-0118-5, 2012.
ÖZGEÇMİŞ
Ömer UÇAR 18.09.1990 tarihinde Diyarbakır/Bismil’de doğdu. İlk, orta ve lise öğrenimlerini Adana ilinde okudu. 2009 yılında Ağrı İbrahim Çeçen Üniversitesi’nin Eğitim Fakültesi Fen Bilgisi Öğretmenliği bölümünü kazandı ve 2013 yılında mezun oldu. 2015 yılında ise Nevşehir Hacı Bektaş Veli Üniversitesi Biyoloji Bölümü Yüksek Lisans eğitimine başlayıp halen eğitimine devam etmektedir.

![Şekil 2.1. Araknida takımının diğer canlılarla olan ilişkilerine ait bir diyagram [13]](https://thumb-eu.123doks.com/thumbv2/9libnet/4406022.75019/17.892.203.766.572.1034/şekil-araknida-takımının-diğer-canlılarla-olan-ilişkilerine-diyagram.webp)
![Şekil 2.2. Bir örümceğin genel görünüşü [15]](https://thumb-eu.123doks.com/thumbv2/9libnet/4406022.75019/18.892.174.809.367.720/şekil-bir-örümceğin-genel-görünüşü.webp)
![Şekil 2.3. Örümceklerde ağ yapımı [20]](https://thumb-eu.123doks.com/thumbv2/9libnet/4406022.75019/19.892.162.733.445.850/şekil-örümceklerde-ağ-yapımı.webp)
![Şekil 2.5. Bir kromozomun oluşum aşamaları [37].](https://thumb-eu.123doks.com/thumbv2/9libnet/4406022.75019/22.892.186.800.796.1065/şekil-bir-kromozomun-oluşum-aşamaları.webp)
![Şekil 2.6. Kromozom tipleri [41]](https://thumb-eu.123doks.com/thumbv2/9libnet/4406022.75019/23.892.204.739.593.1142/şekil-kromozom-tipleri.webp)
![Şekil 2.7. Mitoz bölünmenin evreleri [48]](https://thumb-eu.123doks.com/thumbv2/9libnet/4406022.75019/26.892.193.734.409.1014/şekil-mitoz-bölünmenin-evreleri.webp)
![Şekil 2.8. Mayoz bölünmenin evreleri [37]. Leptoten](https://thumb-eu.123doks.com/thumbv2/9libnet/4406022.75019/29.892.178.784.119.829/şekil-mayoz-bölünmenin-evreleri-leptoten.webp)