T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
ORAL GLUKOZ TOLERANS TESTİ’NDE
KAN ŞEKERİ
YÜKSEKLİĞİ İLE HbA1c ARASINDAKİ İLİŞKİ
UZMANLIK TEZİ Dr. Dilek GENEŞ
DİYARBAKIR 2012
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
ORAL GLUKOZ TOLERANS TESTİ’NDE
KAN ŞEKERİ
YÜKSEKLİĞİ İLE HbA1c ARASINDAKİ İLİŞKİ
UZMANLIK TEZİ Dr. Dilek GENEŞ
TEZ DANIŞMANI
Prof. Dr. Alpaslan Kemal TUZCU
DİYARBAKIR 2012
İç Hastalıkları İhtisas Eğitimim süresince gerek bilgisi, gerek tecrübesi, gerek iş ve eğitim disiplini, gerek hoşgörü ve saygınlığı ile örnek aldığım, bilgi birikimini ve desteğini bizden hiçbir zaman esirgemeyen hekimliği bizlere öğreten hocamız Prof.Dr. O.Ekrem MÜFTÜOĞLU’na başta olmak üzere yetişmemde büyük emekleri olan değerli hocalarım İç Hastalıkları A.B.D. Başkanımız Prof.Dr. M.Emin YILMAZ, Prof.Dr. M.Orhan AYYILDIZ, Prof.Dr. Kendal YALÇIN, Prof.Dr. Abdurrahman IŞIKDOĞAN, Prof.Dr. Alpaslan Kemal TUZCU, Prof.Dr. Muhsin KAYA, Prof.Dr. Vedat GÖRAL, Prof.Dr. Ali Kemal KADİROĞLU, Doç.Dr. Deniz GÖKALP, Yard.Doç.Dr. Ali İNAL, Yard.Doç.Dr. M.Ali KAPLAN, Yard.Doç.Dr. Mehmet KÜÇÜKÖNER, Yard.Doç.Dr. Zülfükar YILMAZ, Uzman Dr. Ebubekir ŞENATEŞ, Uzman Dr. Yaşar YILDIRIM, Uzman Dr.Nazım EKİN, Uzman Dr. Zuhat URAKÇI, Uzman Dr. M.Sinan DAL’a saygı ve teşekkürlerimi sunarım.
Tez oluşturmamda büyük emeği geçen tez danışmanım İç Hastalıkları öğretim üyesi Prof.Dr. Alpaslan Kemal TUZCU hocama teşekkürlerimi sunarım.
Tezimi hazırlarken desteklerini ve deneyimlerini benden esirgemeyen Uzman Dr. Coşkun BEYAZ, Uzman Dr. Faruk KILINÇ ve tüm endokrinoloji bölümüne teşekkürlerimi sunarım.
Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.B.D., Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D., Göğüs Hastalıkları ve Tüberküloz A.B.D. ve Radyoloji A.B.D. başkanlarına ve değerli öğretim üyelerine teşekkürlerimi sunarım.
Birlikte çalışmaktan büyük mutluluk ve onur duyduğum tüm asistan arkadaşlarıma ve İç Hastalıkları A.B.D. çalışanlarına teşekkürlerimi sunarım.
Ayrıca bu günlere gelmemde büyük pay sahibi olan, sevgi ve desteklerini hiçbir zaman benden esirgemeyen babama, kardeşlerime, fedakarlık ve sevgi abidesi olan anneme sonsuz sevgilerimi ve teşekkürlerimi sunarım.
Dr. Dilek GENEŞ
İÇİNDEKİLER
Sayfa No
ÖNSÖZ 2
İÇİNDEKİLER 3
TABLO VE ŞEKİL LİSTESİ 4
SİMGELER VE KISALTMALAR LİSTESİ 6
ÖZET VE ANAHTAR SÖZCÜKLER 8
ABSTRACT AND KEYWORDS 10
GİRİŞ VE AMAÇ 12
1-GENEL BİLGİLER 14
1.1-DiYABETES MELLİTUS 14
1.1.1-Tanım ve Tarihçe 14
1.1.2-Epidemiyoloji 15
1.1.3-Diyabetes Mellitus’un Etiyolojik Sınıflandırılması 17
1.1.4-Diyabetes Mellitus’un Patogenezi 18
1.1.4.1-Beta Hücre Disfonksiyonu 23
1.1.4.2-Hepatik Glukoz Üretiminde Artış 26
1.1.4.3-İnsülin Direnci 26
1.1.5-Diyabetes Mellitus Tanısı 29
1.1.5.1-Standart OGTT Protokolü ve OGTT Uygulaması 30
1.1.5.2-Diyabet Tanı Kriterleri 32
1.1.5.3-Tanı Testi Olarak Hemoglobin A1c 36
1.1.5.4-Fruktozamin 40 1.1.6-Diyabet ve Dislipidemi 41 2-MATERYAL ve METOD 43 3-BULGULAR 44 4-TARTIŞMA 57 5-KAYNAKLAR 64
Sayfa No
29 TABLO 1: Glukoz Hemostazisi ve Diyabet Spektrumu Tip 1 Diyabet, Tip 2 Diyabet,
Diğer Spesifik Tipler ve Gestasyonel Diyabetin Normal Glukoz Toleransından Diyabete Kadar Olan Spektrumu
32 TABLO 2: Diyabet Tanı Kriterleri (ADA 1997, WHO 1999)
32 TABLO 3: Glukoz Tolerans Durumlarının Tanı Kriterleri (ADA 2006)
32 TABLO 4: WHO/IDF -2006 Diyabet ve Ara Glisemi Kademeleri İçin Tanı Kriterleri
33 TABLO 5: Diyabetes Mellitus ve Glukoz Metabolizmasının Diğer Bozukluklarında
Tanı Kriterleri
35 TABLO 6: Prediyabet ve Diyabet Açısından Taranması Gereken Asemptomatik
Erişkinler
36 TABLO 7: ADA, WHO ve IADPSG’ye Göre GDM Tanı Kriterleri
37 TABLO 8: HbA1c’yi %1 Düşürmenin Komplikasyon Gelişme Riskine Etkisi
38 TABLO 9: Glisemi ve HbA1c İlişkisi
38 Şekil 1: Glikozile Hemoglobin (HbA1c ) Oluşumu
44 TABLO 10: OGTT’de Kan Glukozu ve HbA1c Ortalamaları
45 TABLO 11: HbA1c ile AUC İlişkisi
45 TABLO 12: Hastaların Demografik Özellikleri
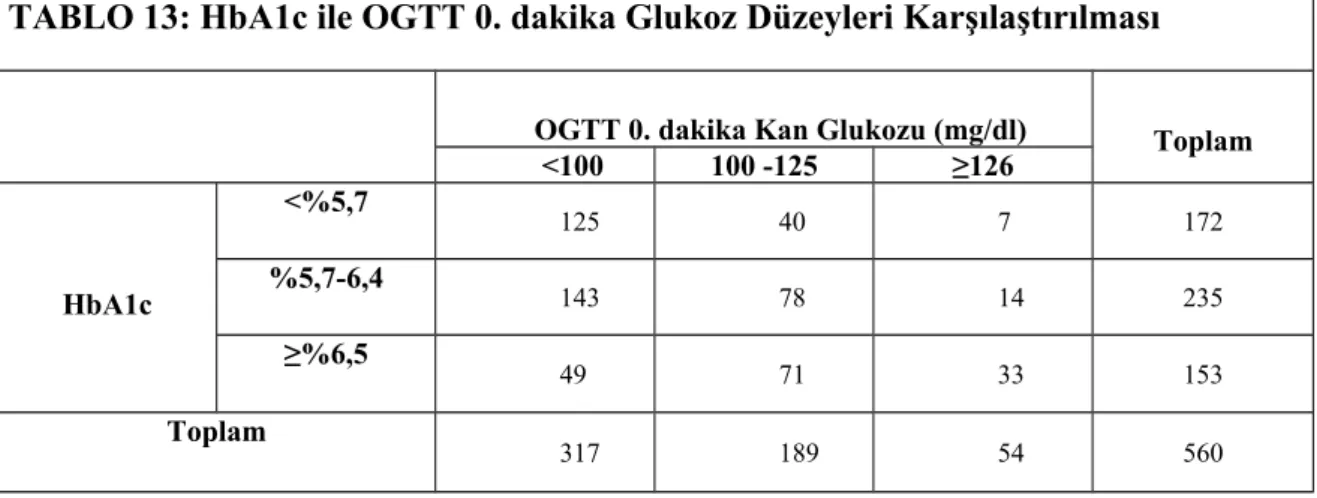
49 TABLO 13: HbA1c ile OGTT 0. dakika Glukoz Düzeyleri Karşılaştırılması
49 TABLO 14: HbA1c ile AKŞ Karşılaştırılması
50 TABLO 15: HbA1c ile OGTT 120. dakika Glukoz Düzeyleri Karşılaştırılması
50 TABLO 16: HbA1c ile OGTT 120. dakika Karşılaştırılması
50 TABLO 17: HbA1c %5,7 ile Diyabet Olanların Karşılaştırılması
51 TABLO 18: HbA1c %6,5 ile Diyabet Olanların Karşılaştırılması
51 TABLO 19: AKŞ ile Diyabet Olanların Karşılaştırılması
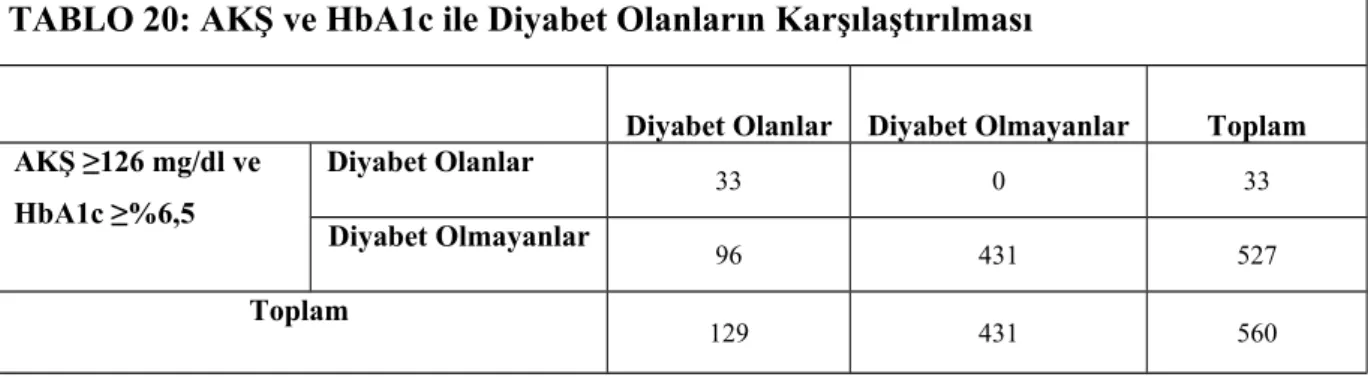
51 TABLO 20: AKŞ ve HbA1c ile Diyabet Olanların Karşılaştırılması
52 TABLO 21: HbA1c Düzeyleri ile Glukoz Tolerans Durumu 1
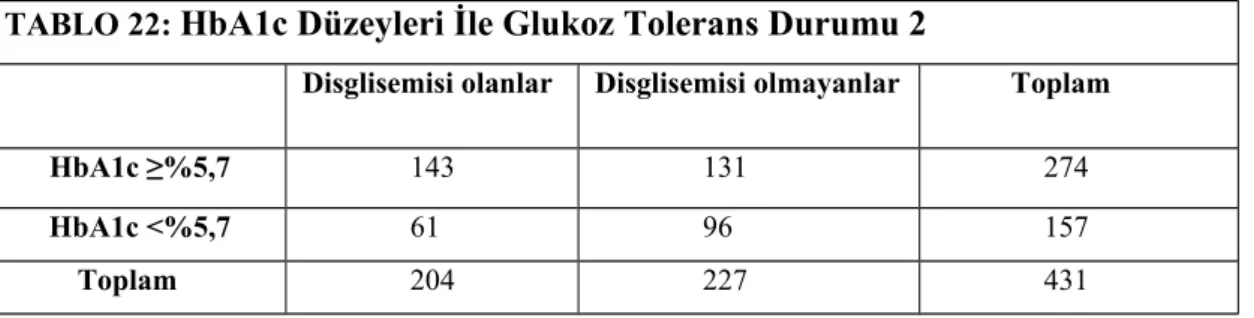
52 TABLO 22: HbA1c Düzeyleri ile Glukoz Tolerans Durumu 2
53 TABLO 23: HbA1c Düzeyleri ile IFG Karşılaştırılması 1
53 TABLO 24: HbA1c Düzeyleri ile IFG Karşılaştırılması 2
53 TABLO 25: HbA1c Düzeyleri ile IGT Karşılaştırılması 1
54 TABLO 27: OGTT’de Kan Glukoz Düzeyleri ile HbA1c ve AUC Korelasyonu
55 TABLO 28: Diyabet Tanısında HbA1c Düzeyleri ile Sensitivite ve Spesifite
Değerleri
55 Şekil 2: Diyabet ve HbA1c İlişkisi
56 TABLO 29: Disglisemi Tanısında HbA1c Düzeyleri ile Sensitivite ve Spesifite
Değerleri
56 Şekil 3: Disglisemi ve HbA1c İlişkisi
ADA: American Diabetes Association (Amerikan Diyabet Birliği) AKŞ: Açlık Kan Şekeri
APG: Açlık Plazma Glukozu ATP: Adenozin Trifosfat AUC: Area Under Curve
CGRP: Kalsitonin Geni ile İlişkili Peptid (Calcitonin Gene Releated Peptid) CVO: Serebrovasküler Olay
DCCT: Diabetes Control and Complications Trial DM: Diyabetes Mellitus
EASD: Avrupa Diyabet Çalışma Birliği GDM: Gestasyonel Diabetes Mellitus GIP: Gastrik İnhibitör Polipeptid GLP: Glukagon Like Peptide GLUT: Glukoz Transporter HBA1c: Hemoglobin A1c HDL: High Density Lipoprotein
HPLC: Yüksek Performanslı Likid Kromatografi (High Performance Liquid Chromatography)
IADPSG: International Association of Diabetes in Pregnancy Study Group (Uluslararası Diyabetik Gebelik Çalışma Grupları Birliği )
IDF: Uluslararası Diyabet Federasyonu
IGT: Bozulmuş Glukoz Toleransı (Impaired Glucose Tolerance )
IFCC: Uluslar arası Klinik Kimyacılar Federasyonu (International Federation of Clinical Chemistry)
IFG: Bozulmuş Açlık Glukozu (Impaired Fasting Glucose ) IP3: İnozitol Trifosfat
IRS: İnsülin Reseptör Substratı KKY: Konjestif Kalp Yetmezliği KVH: Kardiyovasküler Hastalık
LADA: Latent Autoimmune Diabetes in Adults LDL: Low Density Lipoprotein
MODY: Maturity Onset Diabetes of the Young
NGSP: Ulusal Glikohemoglobin Standardizasyon Programı (National Glycohemoglobin Standardization Program)
NHANES: National Health and Nutrition Examination Survey NIDDM: İnsüline Bağımlı OImayan Diyabetes Mellitus
NPV: Negative Predictive Value
OGTT: Oral Glukoz Tolerans Testi PPV: Positive Predictive Value
ROC: Receiver Operating Characteristic
TURDEP: Türkiye Diyabet Epidemiyolojisi Araştırması UKPDS: United Kingdom Prospective Diabetes Study WHO: Dünya Sağlık Örgütü (World Health Organization)
ÖZET
Amaç: Oral glukoz tolerans testi yapılan bireylerde prediyabet ve diyabet tanısı
konulmasında HbA1c’nin önemi; HbA1c’nin tarama ve tanıdaki yararlılığının araştırılması, sensitivite ve spesifitesinin belirlenmesi amaçlandı.
Metod: Haziran 2010 ve Eylül 2012 tarihleri arasında Dicle Üniversitesi Tıp
Fakültesi Endokrinoloji Bilim Dalı’na (bölümüne ) başvuran tüm oral glukoz tolerans testi yapılan kişiler çalışmaya alındı. Gestasyonel diyabet dışlanma kriteriydi. 15-84 yaşları arasında, 560 kişiden [363’ü (%64.5) kadın, 197’si (%35.1) erkek] oluşan grupta 0. ve 120. dakikalarda; bu grup içerisinde 232 kişide ise 0,30,60,90,120. dakikalarda kan glukozu bakıldı. Test ile eş zamanlı gönderilen HPLC yöntemine göre çalışılan HbA1c düzeyleri ile karşılaştırma yapıldı. Area under curve glukoz için bakıldı.
İstatistik Analiz: Ki-kare, Pearson korelasyon, Student-t testi, One way ANOVA,
Post-hoc test (Bonferroni correction), ROC eğrisi kullanıldı. Grupları karşılaştırmak için ki-kare kullanıldı, p<0,05 istatiksel olarak anlamlı kabul edildi. Testin hasta ile hasta olmayan bireyleri ayırmada doğruluk oranı için ROC eğrisi kullanıldı.
Bulgular: Çalışmamızda 129 kişi (%23) diyabet tanısı almıştı. Diyabet olanlarda yaş
ortalaması 50,7±11,4; HbA1c ortalaması %6,72±1,06; AUC ortalaması 474.3±103.5 idi. OGTT 90. dakika ile HbA1c korelasyonunda r:0,464 p:0,001 iken AUC korelasyonunda r:0,971 p:0,001 idi. Diyabet tanısında HbA1c %6,5 ile sensitivite %55.0, spesifite %80.9, PPV:%46, NPV:%85 (p:0,001) bulduk. Diyabet tanısında optimum cutoff değeri ile HbA1c %6,1 için sensitivite %71.3 spesifite %65.4 idi. HbA1c %5,7 ile sensitivite %88.3 spesifite %36.4 iken HbA1c %7,6 ile spesifite %100 idi. Prediyabet tanısında HbA1c %5,7 ile sensitivite %70.0, spesifite %42.2, PPV:%52, NPV:%61 (p:0,001) idi; ancak prediyabet tanısında optimum cutoff değer ile HbA1c %5,9 için sensitivite %58.8 spesifite %61.7 bulduk.
Sonuç: Bizim toplumumuzda HbA1c %6,5 düzeyinin diyabet tanısında, HbA1c %5,7 düzeyininse prediyabet tanısında düşük sensitivite ve spesifite nedeniyle HbA1c kullanılabilecek uygun bir parametre gibi görünmemektedir. HbA1c maliyeti AKŞ’den daha yüksek olmasına rağmen önlenebilir komplikasyonların öngörülmesinde, diyabet tedavisinin yönlendirilmesinde fayda sağlayabilir. Diyabet tarama ve tanısında tek başına AKŞ bakılmasına karşın HbA1c’nin AKŞ ile beraber bakılması sensitiviteyi düşüreceğinden ve ek maliyet getireceğinden birlikte kullanımını uygun bir yaklaşım olarak değerlendiremedik.
Diyabet tanısında optimum cutoff değeri ile HbA1c %6,1 için sensitivite ve spesifite tatmin edici değerlerde bulunamadı. HbA1c ölçümü diyabet tanısında ek yarar sağlayacak gibi görünmese de OGTT yapılmasında sakınca olan durumlarda (örneğin KKY, CVO), yoğunbakım hastalarında HbA1c %7,6 değerinin diyabet tanısında kullanılması önerilebilir.
AUC ve HbA1c ile en iyi OGTT 90. dakikasının korelasyon gösterdiğini gözlemledik. Diyabet tanı kriteri olarak 90. dakika için belirlenecek bir değerin saptanması OGTT için harcanacak zamanın kısalması nedeniyle ek yarar sağlayabilir.
Anahtar Kelimeler: DM, oral glukoz tolerans testi, HbA1c, prediyabet, bozulmuş
ABSTRACT
Aims: The importance of HbA1c in the diagnosis of prediabetes and diabetes; investigation the effectiveness of HbA1c in screening and diagnosis, determining the sensitivity and specifity of HbA1c in patients whom conducted oral glucose tolerance test.
Methods: The people whom conducted oral glucose tolerance test between June 2010 and September 2012 at Dicle University Faculty of Medicine, Department of Endocrinology were studied. The patients with gestational diabetes excluded from the study. The study group consists of 560 people [363 persons (64.5%) female and 197 people (35.1%) were male] between the ages 15 and 84. In this group from 232 people; 0,30,60,90,120. minutes and from others 0 and 120. minutes blood glucose level was measured. Concurrently with the blood glucose test HbA1c levels were studied by the HPLC method and the results were compared.
Statistic Analyses: Chi-square, Pearson correlation, Student-t test, One way ANOVA, Post-hoc tests (Bonferroni correction),ROC curve were used. Chi-square test was used to compare groups, p <0.05 was considered statistically significant. The ROC curve was used to show the accuracy rate of test in distinguishing patient and non-patient individuals.
Results: In our study, 129 people (23%) had been diagnosed with diabetes. In patients with diabetes; mean age 50.7 ± 11.4, mean HbA1c 6.72% ± 1.06, mean AUC were 474.3 ± 103.5. OGTT 90. minute with HbA1c correlation r: 0,464 p: 0,001 and AUC correlation were r: 0,971 p: 0.001 respectively. For the diagnosis of diabetes HbA1c 6.5%; 55.0% sensitivity and 80.9% specificity, PPV:46%, NPV:85% (p:0.001) was found. HbA1c 5.7%; 88.3% sensitivity and 36.4% specificity, while 7.6% the specificity was 100% by HbA1c. For the diagnosis of prediabetes with HbA1c 5.7%; 70.0% sensitivity, 42.2% specifity, PPV:52%, NPV:61% respectively (p:0,001). However, the optimal cutoff value in the diagnosis of prediabetes for HbA1c level of 5.9%; 58.5% sensitivity and 61.7% specifity was found.
Conclusions: HbA1c level 6.5% in the diagnosis of diabetes and HbA1c level 5.7% in the diagnosis of prediabetes is not a suitable parameter due to the low sensitivity and specificity in our society. Although the cost of HbA1c is higher than fasting blood glucose, HbA1c can be useful in the management of diabetes and help to prevent the complications of diabetes. Fasting blood glucose is only used in diagnosis and screening of diabetes, however using fasting blood glucose and HbA1c measurement together can reduce the sensitivity and cause more expenditure; so it is not appropriate to use fasting blood glucose and HbA1c measurament together. The sensitivity and specificity for optimal cut-off value of HbA1c 6.1% in the diagnosis of diabetes was not found satisfactory. Measurement of HbA1c in the diagnosis of diabetes does not seem to provide additional benefit but it can be used in some occasions which the oral glucose tolerance test can be harmful (eg Heart diseases, CVO) ,also HbA1c value 7.6% can be used in diagnosis of diabetes for intensive care patients. OGTT 90. minute level is best correlated with AUC and HbA1c levels. Using OGTT 90. minute level as a criterion for the diagnosis of diabetes may provide additional benefits by reducing duration needed for diagnosis.
Keywords: DM, oral glucose tolerance test, HbA1c, prediabetes, impaired fasting glucose, impaired glucose tolerance.
GİRİŞ VE AMAÇ
Diyabetes mellitus (DM) insülin sekresyonu, insülin etkisi veya her ikisindeki bozukluktan kaynaklanan hiperglisemi, glikozüri ve buna eşlik eden birçok klinik ve laboratuvar bulgusu ile karakterize kronik progresif bir metabolik hastalıktır (1,2). İnsülinin hedef dokulardaki eksik etkisine bağlı karbonhidrat, yağ ve protein metabolizmasında bozukluklar meydana gelir (1,3). Klinik bulgular klasik olarak poliüri, polifaji, polidipsi, zayıflama ve bazen de bulanık görme gibi semptomlardır. DM’ un etkileri çeşitli organlarda uzun süreli hasar, fonksiyon bozukluğu ve yetersizliği içerir. DM’ un uzun vadedeki etkileri, progresif gelişen spesifik komplikasyonlara yol açar. Hastalığa bağlı morbidite ve erken mortalitenin en önemli nedenidir (4). Toplumların çoğunda son dönem böbrek yetersizliği, körlük, travma dışı amputasyonların en önemli nedeni diyabettir (2).
Tip 2 diyabet en yaygın görülen metabolizma hastalığıdır. Gelişmiş ülkelerde toplumun %5-10’u tip 2 diyabetlidir. Tüm dünyada tanı koyulan diyabet vakalarının % 90-95’inin Tip 2 DM, % 5-10’unun da Tip 1 DM ve % 2-3’ünü diğer diyabet formları oluşturur. Diyabetlilerin %30-50’sinin henüz tanı konulmamış vakalar olduğu sanılmaktadır (5). İnsanların yaşam sürelerinin giderek uzaması, fiziksel aktivitenin azalması ve obezitenin artması, diyabetes mellitus insidans ve prevalansında bir patlamaya neden olmuştur (6).
Son 20 yıl içinde diyabetin tanısı önemli ölçüde değişmiştir. Tanı için 75 g glukoz ile standart oral glukoz tolerans testi (OGTT) yapılması, açlık kan glukoz düzeyine göre daha sensitif ve spesifik olmakla birlikte, bu testin aynı kişide günden güne değişkenliğinin yüksek olması, emek gerektirmesi, yoğun ve maliyetli olması rutin kullanımını güçleştirmektedir. Diğer taraftan, AKŞ’nin daha kolay uygulanabilmesi ve ucuz olması klinik pratikte kullanımını artırmaktadır.
Günümüzde IFG ve IGT, “Prediabet” olarak adlandırılmaktadır. Bunun nedeni, epidemiyolojik kanıtların bu düşük düzeydeki karbonhidrat intoleransının bile makrovasküler komplikasyonların birlikteliğini ve sıklıkla diyabete ilerlediğini göstermesidir. Uluslararası Diyabet Uzmanlar Komitesi HbA1c %5,7-6,4 (39-46 mmol/mol) aralığında bulunan bireylerin diyabet açısından yüksek riskli olduklarını ve koruma programlarına alınmaları gerektiğini bildirmiştir.
HbA1c ölçümden önceki ortalama 3 aylık glukoz kontrolünü yansıtır. HbA1c'nin %50'si son bir ayda, %30'u ölçümden önceki ikinci ayda ve geri kalan %20'si ölçümden önceki üçüncü ayda oluşan glisemik değişiklikleri yansıtır. Standardizasyonundaki sorunlar ve tanı eşiğindeki belirsizlik nedeniyle glikozillenmiş HbA1c’nin diyabet tanı aracı olarak kullanılması uzun yıllar önerilmemiştir. ADA, EASD, IDF ve Uluslararası Klinik Kimyacılar Federasyonu (IFCC: International Federation of Clinical Chemistry) temsilcilerinin oluşturduğu Uluslararası Diyabet Uzmanlar Komitesi 2009 yılında yaptığı bir dizi toplantı sonucunda, uluslararası standardizasyon kurallarına uyulması koşulu ile HPLC (yüksek performanslı likid kromatografi) yöntemine göre kalibre edilmesi şartıyla diyabet tanısı için HbA1c kesim noktasını %6,5 (48 mmol/mol) olarak belirlemiştir. Bazı uzmanlar HbA1c ≥ %6,5 ile birlikte AKŞ ≥126 mg/dl bulunan kişilere diyabet tanısı konulmasını ve bu yaklaşımın OGTT’ye alternatif olarak kullanılmasını önermektedir.
Bu çalışmamızda oral glukoz tolerans testi yapılan bireylerde prediyabet ve diyabet tanısı konulmasında HbA1c’nin önemi; HbA1c’nin tarama ve tanıdaki yararlılığının araştırılması, sensitivite ve spesifitesinin belirlenmesi amaçlandı.
1
.
GENEL BİLGİLER
1.1.DİYABETES MELLİTUS
1.1.1.Tanım:
Diyabetes mellitus (DM) insülin sekresyonu, insülin etkisi veya her ikisindeki bozukluktan kaynaklanan hiperglisemi, glikozüri ve buna eşlik eden birçok klinik ve laboratuvar bulgusu ile karakterize kronik progresif bir metabolik hastalıktır (1,2). İnsülinin hedef dokulardaki eksik etkisine bağlı karbonhidrat, yağ ve protein metabolizmasında bozukluklar meydana gelir (1,3). Klinik bulgular klasik olarak poliüri, polifaji, polidipsi, zayıflama ve bazen de bulanık görme gibi semptomlardır. Diyabetes Grekçe’de ‘sifon’ anlamına gelmekte olup çok miktarda idrar çıkarımını tanımlamak için kullanılmıştır. Mellitus ise yine Grekçe bal anlamına gelmekte olan ‘mel’ sözcüğünden üretilmiştir (7).
DM’nin etkileri çeşitli organlarda uzun süreli hasar, fonksiyon bozukluğu ve yetersizliği içerir. DM’nin uzun vadedeki etkileri progresif gelişen spesifik komplikasyonlara yol açar. Bunlar mikrovasküler komplikasyonlar (retinopati, nefropati ve nöropati) ve makrovaküler komplikasyonlar (miyokard infarktüsü, inme ve periferik arter hastalığı) olarak 2 grupta incelenebilir. Hastalığa bağlı morbidite ve erken mortalitenin en önemli nedenidir (4). Toplumların çoğunda son dönem böbrek yetersizliği, körlük, travma dışı amputasyonların en önemli nedeni diyabettir (2). Diyabetli olmayan yaşıtlarına kıyasla kardiyovasküler olay riski 2-4 kat daha yüksektir. Birçok ülkede diyabet ölüme neden olan hastalıklar arasında 5. sıradadır (5).
Tarihçe:
Diyabetes Mellitus hakkındaki bilgiler milattan önceki yıllara uzanmaktadır. M.Ö. 1500 yıllarında Mısır Ebers papirüslerinde aşırı idrarla seyreden bir hastalık tanımlanmıştır (8). Bu belgelerde bol su içme ve bol idrardan bahsedilmektedir. M.Ö. 150 yıl önce, Kapadokya’da Areteus, ilk defa “diabetes” adını kullanmıştır (9,10). M.S. 9. y.y.’de İslam hekimi Razi ve 10-11. y.y.’de İslam hekimi İbn-i Sina, bu hastaların idrarının tatlı olduğundan ve susuzluk hissinden söz etmişlerdir (4,10). 1674 yılında Thomas Willis, idrarın bal ve tatlı karışımı bir tadı olması nedeniyle hastalığa Diabetes Mellitus (Mellitus: Bal) adını
vermiştir (8). 1777-1778’de Pool ve Cawley kimyasal olarak idrarda glukoz varlığını kanıtlamışlar. İdrarda kantitatif olarak şeker arama metodunu Fehling, 1850 yılında tarif etmiştir. 1869 yılında Paul Langerhans pankreastaki hücre tiplerini belirlemiş ve Langerhans adacıklarını tanımlamıştır (8). 1889’da Oskar Minkowski, deneyleri ile Diabetes Mellitus’da sorumlu organın pankreas olduğunu kanıtlamıştır (4,10). 1910’da Jean de Meyer tarafından diyabetiklerde pankreasa ait salgıda azalma olduğu gösterilmiştir. Kanadalı diyabetli bir çocuğa 1922’de enjekte edilen pankreas ekstresinin, yüksek kan glukoz düzeyini düşürdüğü, glukozüri ve ketonüriyi kontrol altına aldığı gösterilmiştir. 1921 yılında insülin Banting ve Best tarafından keşfedilmiş, 1922 yılında Leonard Thompson tarafından ilk kez insanda kullanılabilmiştir (11). 1964 yılında insülin molekülü sentez edilmeye başlanmıştır (5). İnsülinin moleküler yapısı 1955’te Sanger tarafından gösterilmiş ve bu buluşu kendisine Nobel ödülü kazandırmıştır. Steiner, 1967’de insülin prekürsörü olan proinsülini, 1980’de Bell insülin genini göstermişlerdir. Freychetin ve Cuatrecasas 1985’de insülin reseptör genini klonlamışlardır (12). 1983'de ilk biyosentetik insan insülini üretilip, kullanılmaya başlanmıştır.
1.1.2.Epidemiyoloji
Tip 2 diyabet en yaygın görülen metabolizma hastalığıdır. Gelişmiş ülkelerde toplumun %5-10’u tip 2 diyabetlidir. Tüm dünyada tanı konulan diyabet vakalarının % 90-95’inin Tip 2 DM, % 5-10’unun da Tip 1 DM ve % 2-3’ünü diğer diyabet formları oluşturur. Diyabetlilerin %30-50’sinin henüz tanı konulmamış vakalar olduğu sanılmaktadır (5). İnsanların yaşam sürelerinin giderek uzaması, fiziksel aktivitenin azalması ve obezitenin artması, diyabetes mellitus insidans ve prevalansında bir patlamaya neden olmuştur (6). Dünya Sağlık Örgütünün Türkiye verilerine bakıldığında 2000 yılındaki 2,92 milyon diyabetik birey sayısının 2030 yıllarında 6,42 milyona ulaşacağı öngörülmektedir (13). Geçtiğimiz yüzyılın son çeyreğinde Dünya’da ve ülkemizde diyabetli sayısının artması ve önümüzdeki çeyrek yüzyıl için öngörülen artışlar “diyabet epidemisi” tanısını haklı kılmaktadır. Bu epidemi hem gelişmiş ülkeleri hem de gelişmekte olan ülkeleri vurmuştur (5,14). Thrifty (tutumlu) Genotip Hipotezi’nde ileri sürülen “genlerin modern yaşam tarzının gerektirdiği şartlara adapte olamaması” ya da Thrifty Fenotip Teorisi’nde ileri sürüldüğü gibi “intrauterin malnütrisyon ortamına göre ayarlanmış metabolizmanın ileri yaşlardaki zengin beslenme tarzına adapte olamaması ” veya basitçe, enerji alımının enerji tüketimini aşması bu
epidemiden sorumlu olduğu düşünülen başlıca mekanizmalardır (2,15,16). Diyabet prevalansı ülkeler arasında ve farklı etnik gruplarda belirgin düzeyde değişiklik göstermektedir. Papua YeniGine’deki kabilelerde, Eskimolar arasında veya Çin’de %1 olan prevalans, Avustralya yerlilerinde, Mikronezya’daki Naurulularda veya Pima Kızılderililerinde %20-45’e kadar çıkabilmektedir. Prevalansdaki bu farklılık uluslar arasında daha da belirginleşmektedir. Örneğin Beyaz ırka göre Amerika Birleşik Devletleri’nde Afrika kökenli Amerikalılar arasında iki kat, Meksika kökenli Amerikalılar arasında iki buçuk kat ve yerli Amerikalılar arasında 5 kat daha fazla diyabet görülmektedir (17,18). Farklı toplumlarda görülen diyabet prevalansındaki bu çeşitlilik büyük olasılıkla genetik ve çevresel faktörlerden kaynaklanmaktadır.
Dünya genelinde 2025 yılında diyabet prevalansının erişkin populasyonun %5.4 olacağı ve bu olguların %75’inin gelişmekte olan ülkelerde bulunacağı tahmin edilmektedir (19,20). NHANES (National Health and Nutrition Examination Survey) verilerine göre diyabet prevalansının 20-39 yaşları arasındaki erkeklerde %1.6 iken 75 yaş üstü erkeklerde %21.1 olduğunu görülmüştür. Bu da gelecek yıllarda diyabet prevalansında öngörülen artışın en az yarısından yaşlanan dünya popülasyonunun sorumlu olacağını işaret etmektedir (21,22). Bozulmuş glukoz toleransının 20-44 yaş grubunda %3-5 olan prevalansı, 65-74 yaş grubunda %20-30’a yükselmektedir (23). Ülkemizde 1997-1998 yıllarında yapılan Türk Diyabet Epidemiyoloji Çalışma Grubu (TURDEP-I) çalışmasında 20 yaş üzerindeki 24.788 kişi arasında tip 2 DM prevalansının %7.2 olduğu, bozulmuş glukoz toleransının (IGT) %6.7 olarak bildirilmektedir. 2010’da yine ülkemizde yapılan TURDEP-II çalışmasında 26.499 kişi arasında izole IFG %14.5, izole IGT %7.1, IFG ve IGT %5.7 olduğu bildirildi. TURDEP-II’ye göre Türk erişkin toplumunda diyabet sıklığının %13.7’ye ulaştığı görülmüştür. Daha önceki çalışmanın aksine kentsel ve kırsal diyabet sıklığı arasında çok anlamlı bir fark kalmamıştır. TURDEP-II çalışmasına göre 40-44 yaş grubundan itibaren nüfusun en az %10’u diyabetlidir (TURDEP-I’de ise %10’nun üzerindeki diyabet sıklığı 45-49 yaş grubunda başlamaktaydı). Buna dayanarak Türkiye’de diyabetin 1998 yılına göre yaklaşık olarak 5 yaş daha erken başladığı düşünülebilir. Sonuç olarak TURDEP-II çalışmasında Türkiye’de 12 yılda diyabet sıklığı %90, obezite ise %44 artmıştır.
1.1.3.Diyabetes Mellitus’un Etiyolojik Sınıflandırılması (ADA 1997) (1,24)
I. Tip 1 Diyabet ( Beta hücre harabiyeti, genelde mutlak insülin eksikliği vardır) A.Otoimmun
B. İdiopatik
II. Tip 2 Diyabet (İnsülin rezistansının ön planda olduğu durumdan, insülin sekresyonunun ön planda olduğu
duruma kadar değişiklik gösterir)
III. Diğer Spesifik Tipler
A-Beta hücre fonksiyonunda genetik defektler E- İlaç yada kimyasal maddeler -MODY 1 (Kromozom 20, HNF-4α) -Vacor
-MODY 2 (Kromozom 7, glukokinaz) -Pentamidin -MODY 3 (Kromozom 12, HNF-1α) -Nikotinik asit -MODY 4 (Kromozom 13, insulin promoter faktor-1;IPF-1) -Glukokortikoidler -MODY 5 (Kromozom 17, HNF-1β) -Tiroid hormonu -MODY 6 (Kromozom 2, NeuroD1) -Diazoksit
-Mitokondriyal DNA - β-adrenerjik agonistler -Diğerleri -Tiazidler
B- İnsülin etkisinde genetik defektler -Dilantin - Tip A insülin rezistansı -Alfa-interferon - Leprechaunizm -Diğerleri
-Rabson-Mendenhall sendromu F- Enfeksiyonlar
- Lipoatrofik diyabet - Konjenital rubella - Diğerleri - Sitomegalovirus
C- Ekzokrin pankreas hastalıkları - Diğerleri
-Pankreatit G- İmmün aracılıklı nadir görülen diyabet formları -Travma/pankreatektomi -“Stiff-man” sendromu
-Neoplazm - Anti-insülin reseptör antikorları
-Kistik fibrosis - Diğerleri
-Hemakromatozis H- Diyabetle birlikteliği olan diğer genetik sendromlar -Fibrokalküloz pankreas - Down sendromu
-Diğerleri - Klinefelter sendromu D- Endokrinopatiler - Turner sendromu
- Akromegali - Wolfram sendromu - Cushing sendromu - Friedreich ataksisi - Glukagonoma - Huntington koresi
- Feokromasitoma - Laurance- Moon Biedl sendromu - Hipertiroidizm - Myotonik distrofi
- Somatostatinoma - Porfiria
- Aldosteronoma - Prader Willi sendromu -Diğerleri - Diğerleri
1.1.4.Diyabetes Mellitus’un Patogenezi
İnsülinin Moleküler Yapısı, Sekresyonu ve Etkileri: İnsülin pankreastaki
langerhans adacıklarının beta hücreleri tarafından üretilen polipeptit yapıda 6000 dalton molekül ağırlığında bir hormondur. Beta hücreleri pankreas kütlesinin yaklaşık %1’ini oluşturur (25). İnsülin birbirine iki disülfür köprüsü ile bağlı kısa (A) ve uzun (B) iki aminoasit zincirinden oluşmaktadır. A zinciri 21, B zinciri 30 aminoasit içerir. A zincirinde zincir içi bir disülfür köprüsü daha bulunur. İnsülin sentezinde önce tek zincirli 110 aminoasitli bir öncül molekül olan preproinsülin oluşur. 24 aminoasitlik N-terminali kopar, sinyal peptidi ayrılır ve proinsülin oluşur. Bu molekül kendi içinde kıvrılır ve üç disülfür köprüsü oluşur, golgi kompleksinde yer alan proteazların etkisiyle 35 aminoasitlik C-peptid segmentini kaybeder. C peptidin ayrılmasıyla oluşan insülin proinsülinden daha insoluble bir molekül haline gelir ve Zn+2 iyonu ile birlikte hekzamerik kristaller halinde çöker. Beta hücresinin uyarılması ve insülin salınımındaki bağlantıda Ca+2 önemli rol oynar. Ca+2 insülin yüklü veziküllerin hücrenin içinden membranın iç yüzeyine taşınmasını ve ekzositozla salgılanmak üzere yapışmalarını sağlar. İnsülin parsiyel ekzositozla salgılanırken onunla birlikte ekimolar miktarda C-peptid de salgılanır (25). C-peptid insülin sekresyonunun periferik göstergesidir ve insülin gibi karaciğer tarafından tutulmaz (26).
İnsülin reseptörü, birbirine sülfhidril bağları ile bağlı iki α ve iki β alt birimden oluşan bir tetramerdir, tek bir polipeptit olarak sentezlenir. Hücre dışında bulunan alfa subüniti ekstrasellülerdir ve insülin bağlanma yeri bulundurur. Her beta subünitinin hidrofobik bölümü plazma membranı içinde yer alır. Beta subünitinin sitozolik bölümü, bir tirozin kinazdır ve insülin ile aktive olur. İnsülinin kendi reseptörünün alfa subünitlerine bağlanması, konumsal değişikliklere neden olur. Bu değişiklikler beta subünitlerine iletilir ve beta subünitindeki özgün bir tirozin biriminin hızlı otofosforilasyonuna neden olur. Reseptör tirozin kinaz aktivitesiyle insülin reseptör substratı (IRS-1, IRS-2) adı verilen bir peptidin tirozinlerinin fosforile edildiği düşünülmektedir. IRS-1 geni silinmiş farelerde glukoz homeostazının bozulduğu, glukoza intoleransın geliştiği bulunmuştur. Belirgin diyabet oluşmaması, kaybolan IRS-1 yerini, kısmen IRS-2 tarafından tutulmasıyla açıklanmıştır.
Beta hücrelerinin en duyarlı olduğu uyaran glukozdur. Birçok dokuda insülin varlığında glukoz taşınımı artmaktadır. Hücrelerin yüzeyinde glukoreseptörler denilen glukoza özgü reseptörler mevcuttur. İnsülin glukoz taşıyıcılarının (glukoz transport molekülleri, GLUT) hücre içi vezikül havuzundan hücre yüzeyine devamlı hareketini sağlamaktadır; ayrıca beta hücrelerinde glukozun membranın dış yüzünden içeri taşınmasını sağlayan glukoz taşıyıcıları (GLUT-2) bulunur.
İnsülin Sekresyon Evreleri:
1. Erken faz: Erken insülin sekresyonu ilk 8-10 dakikada gerçekleşir. İnsülinin büyük
kısmı bu sürede salınır. Bu dönemde depolanmış olan insülinin salındığı düşünülmektedir.
2. Geç faz: Erken fazı takiben uyarı devam ediyorsa ikinci salgı dönemi başlar. 2-3
saat içerisinde artarak devam eder. Bu evrede yeni sentezlenen insülinin de salındığı düşünülmektedir.
3. Üçüncü saatten sonra başlayan ve 24-36 saat süren bu fazda insülin spontan olarak
azalmaya devam eder. Bu dönem, bazal insülin salınımı olan fazdır (27,28).
Bu salgılanmada beta hücreleri içine giren glukozun metabolitleri de etkili olur. Buradaki anahtar enzim glukokinazdır. Beta hücrelerindeki glikoliz intrasellüler ATP düzeyini arttırır; bu da ATP’ye duyarlı K+ kanallarını kapatır ve hücrede depolarizasyona neden olur. Depolarizasyon sonucunda membrandaki voltaj bağımlı Ca+2 kanalları açılır ve hücre içine Ca+2 girişi artar. Geç fazda etkili diğer bir mekanizma da hücre membranında fosfoinozitid hidrolizinin artışı ile protein kinaz C’nin aktivasyonu ve oluşan IP3 ile hücre içi Ca+2 artışıdır. İnsülin sekresyonu ile ilgili yapılmış çalışmalarda her 10 dakikada bir küçük miktarlarda insülinin pulsatil olarak plazmaya salgılandığı, 80 ve 150 dakika aralıklarla daha büyük miktarlarda insülinin plazmaya verildiği tespit edilmiştir.
İnsanda pankreasta depo edilmiş olarak bulunan insülin miktarı yaklaşık olarak 10 mg kadardır. Pankreas bazal olarak, yani bir uyarı olmadan 1 ünite/saat (yaklaşık 40 mikrogram) insülin salgılar. Günde salgılanan miktarı yaklaşık olarak 2 mg (50 IU) kadardır. İnsülinin plazma yarı ömrü ise ortalama 5-6 dakikadır ve karaciğer, böbrek ve çizgili kaslardaki hedef hücreler tarafından yakalanmış insülinin yarı ömrü 3 saate kadar uzar.
İnsülinin glukoz metabolizması üzerine etkileri özellikle üç dokuda belirginleşir. Bunlar karaciğer, kas ve yağ dokusudur. İnsülin verilmesinden birkaç dakika sonra, yağ dokusundan yağ asidi salınmasında belirgin düşme görülür. İnsülin, yağ dokusunda hormon duyarlı lipazın aktivitesini inhibe ederek dolaşımdaki yağ asitlerini azaltır. Çoğu dokuda aminoasitlerin hücre içine girişini ve protein sentezini uyarır (25). Glukoz homeostazının düzenlenmesi; kan glukoz düzeyleri, karaciğerde glukoz üretimi ve insüline bağımlı dokular (yağ ve kas) ile insüline bağımlı olmayan dokularda (beyin, böbrek, eritrosit) glukozun kullanımı arasındaki denge sayesinde sağlanır. Bu denge pankreas endokrin hormonları olan insülin ve glukagon tarafından idare edilir (29). Sağlıklı insanlarda açken karaciğerde glikoneogenez ve glikojenoliz üzerinden gerçekleşen glukoz yapımının glukoz kullanımı ile aynı miktarda olması, plazma glukoz düzeylerinin kontrol altında tutulması ile sonuçlanır (17).Yemek sonrası karaciğerden glukoz çıkışı ile dokular tarafından alınıp kullanılan glukoz miktarı arasındaki bu denge bozulur, kandaki glukoz düzeyi yükselir ve insülin glukoz homeostazının devamında esas rolünü üstlenir. İnsülin, karaciğerde glukoz yapımını baskılar (glikojenolizi ve glikoneogenezi), periferik dokularda yağ ve kaslarda glukozun alınımını ve kullanımını arttırır (17,18,29).
Besinler insülin salgılatıcılarının temelini oluşturur. Karbonhidratlar (glukoz, fruktoz, mannoz), aminoasitler ve yağ asitleridir. Aminoasitlerin tümü insülin salgılatırlar, en güçlü etkinliğe sahip olanı arginindir ve neredeyse glukoza eşdeğer etki gösterir. Lösin daha zayıf etkili aminoasittir. Yağ sindirimi sonucunda oluşan yağ asitleri ve i.v. infüzyonla verilen yağ asitleri de insülin salgılanmasını arttırır. Bu etkilerini sindirim sisteminde salgılanmasını arttırdıkları gastrik inhibitör polipeptid (GIP) aracılığıyla yaparlar. Ayrıca uzun süreli açlıklarda plazmada serbest yağ asitlerinin düzeyinin artması ketoasidoz gelişmesini engeller. GIP dışında mide ve barsak hormonlarından glukagon like peptid 1 (GLP-1), gastrin, sekretin, kolesistokinin, vazoaktif intestinal peptid, enteroglukagon insülin salgılanmasına neden olur. Glukagon pankreasın alfa hücrelerinden salgılanır ve insülinle beraber karbonhidrat metabolizmasında önemli rol oynar. Glukoz glukagon salınımını inhibe eder, glukagon ise glisemiyi arttırarak indirek yolla insülin salınımını arttırır. İnsülin alfa hücreleri üzerine parakrin etki göstererek glukagon salgısını direk azaltır. Glukagon aşırı insülinin yol açtığı hipogliseminin düzeltilmesinde en önemli faktördür. Ventromedial hipotalamusun uyarılması ile insülin salgısı inhibe olurken, ventrolateral kısım insülin salgısını arttırır. Bu etki vagal stimulasyonla olur, yemek yeme eyleminin sefalik fazındaki insülin artışından sorumludur. Sempatik sistem insülin salgısını inhibe edici etki göstermekle birlikte her iki
yönde de etkilidir. İnsülin sekresyonunu uyaran diğer önemli maddeler büyüme hormonu, glukokortikoidler, prolaktin, plasental laktojen hormon, cinsiyet hormonları ve parasempatomimetik ajanlardır. Hipertiroidi, Z hücrelerinin glukoza duyarlılığını arttırır. PTH düşük dozlarda beta hücresini uyarırken yüksek dozlarda inhibe eder. Somatostatin, dopamin, serotonin, adacık amiloid polipeptid ve epinefrin insülin sekresyonunu inhibe ederler.
Çizgili kas ve yağ dokusunda insülin GLUT-4 yardımıyla transloke olur. İnsülin bağlandıktan sonra, hormon reseptör kompleksi hücre içine alınır. Hücre içinde, insülin lizozomlarda yıkılır. Reseptörler de yıkılabilir; fakat çoğu hücre yüzeyine geri döner. Yüksek insülin düzeyleri reseptör yıkımını arttırır, böylece yüzey reseptörlerinin sayısı azaltılır (down regülasyon) (25). İnsülin başta karaciğer, böbrek ve çizgili kaslar olmak üzere yağ dokusu, monosit, eritrosit, granülosit, plasentada yıkılır. Pankreastan salındıktan sonra yaklaşık %50’si hepatositlerde yıkılır. Böbreklerde glomerüllerden süzülür ve proksimal tubulusta reabsorbsiyona uğrar, tubulus hücrelerinde kısmen yıkılır. İnsülinin hücre içinde yıkımında birçok enzim rol alır, bunların en önemlisi glutation insülin transhidrojenazdır (25).
Diyabetes Mellitus Patogenezi: DM oluşumunda birinci sebebin insülin yokluğu,
yetersizliği veya insülin reseptör direnci olduğu bilinmektedir. Bu olayın etyolojik nedeni henüz aydınlanmamıştır. Tip 1 ve Tip 2 diyabette etiyolojik neden ne olursa olsun sonuçta hiperglisemik tablo her iki tip diyabetin en belirgin sonucudur (30). Glukoz tarafından uyarılan pankreas beta hücrelerinin insülin sekresyonu sürecinde iki faz dikkati çeker; biri hızlı diğeri yavaş sürekli insülin salgısı fazıdır. İnsülin pulsatil bir düzende salgılanır. İnsülin sekresyonunda birinci fazın yokluğu ve pulsatil salgı düzeninde değişiklikler Tip 2 DM gelişimine giden yolda beta hücre fonksiyon bozukluğunun ilk belirtileridir ve genellikle klinik belirtiler ortaya çıkmadan tespit edilebilir (31).
Son yıllarda tip 2 diabetes mellitus patogenezi ile ilgili olarak yapılan çalışmaların çoğu insülin direnci ve buna neden olan dokuların (karaciğer, kas, yağ) rolleri, bozulmuş insülin sekresyonu ve genetik faktörler üzerine yoğunlaşmıştır. Genetik faktörler tip 2 diyabet oluşumunda kuvvetle etkilidir. Hastalığın oluşumunda birden fazla anormal gen polimorfizmi rol oynamaktadır. Ayrıca her biri genetik kontrol altında olan insülin sekresyonu ve sensitivitesi bozuklukları da görülebilmektedir. Beta hücresinde monogenetik defektlerle
ilişkili diyabet formları arasında MODY ve mitokondriyal diyabet yer almaktadır. MODY (Maturity Onset Diabetes of the Young); sıklıkla erken yaşta (genellikle 25 yaş öncesi) başlayan orta derecede hiperglisemi ile karakterizedir. İnsülin etkisinde ya hiç defekt yoktur ya da minimal defektler vardır. Bunun yanında insülin sekresyon bozukluğu mevcuttur. Otozomal dominant geçişlidir. Hastalarda ve diğer aile bireylerinde de diyabet öyküsü vardır. Otoantikorlar negatiftir (32). Mitokondriyal diyabette DNA nokta mutasyonları gösterilmiştir. Bunlarda insülin bağımlı olmayan diyabetes mellitus yanında; sağırlık, myopati, tiroid disfonksiyonu, hiperkalsemi ve büyüme hormonu eksikliği bulunur (32,33). İnsülinin etkisindeki genetik defektlerden kaynaklanan diyabette, insülin reseptörlerindeki mutasyonların yanında akontozis nigrikans, kadınlarda virilizasyon ve büyük kistik overler bulunabilir (32).
Tip 2 Diyabetes Mellitus (DM) hastalarının önemli bir bölümü tipik olarak obez ve hiperinsülinemik iken, insülin hiposekresyonunun görüldüğü obez olmayan Tip 2 DM hastaları da bulunmaktadır ve tanıyı izleyen birkaç ay veya yıl içinde oral hipoglisemik ilaçlarla yapılan tedavi başarısız olmakta, bunun sonucunda da insülin bağımlılığına doğru bir ilerleme olmaktadır. Diğer bir deyişle klasik Tip 1 DM ve Tip 2 DM, sadece diğer bir sınıflandırma ölçeğinin zıt kutuplarıdır. Bunun bir göstergesi olarak Tip 2 DM grubundaki bazı kişiler ilk klinik prezentasyonda Tip 2 DM olarak tanınırlar fakat gerçekte yavaş ilerleyen bir Tip 1 DM hastasıdırlar. Zayıf olan hastalarda yavaş gelişen tip 1 diyabet varyantı olan LADA olma olasılığı mevcuttur. Bu durum son yıllarda yavaş seyirli tip 1 diyabeti veya yetişkinlerin Latent Otoimmün Diabeti (LADA) olarak bilinmektedir (34). Obezite ile insülin direnci arasında doğrudan ilişki vardır ve tip 2 diyabet gelişen hastaların %80’i diyabet öncesi dönemde obezdir. Obezite, diyabetin açığa çıkmasına, var olan diyabetin daha da kötüleşmesine neden olur. Adipositler; insülin sekresyonu, insülin etkisi ve vücut ağırlığı gibi süreçleri ayarlayan bazı biyolojik ürünleri sekrete ederler ve insülin direnci gelişimine katkıda bulunabilirler (35). Ancak obezite olmadan da tip 2 diyabetes mellitus gelişebilir. Obez tip 2 diyabetes mellitusta insülin direnci daha ön planda iken, obez olmayanlarda insülin sekresyon bozukluğu ön plana geçer (36).
İnsülin tarafından uyarılan glukoz uptake’inde azalma veya insülin direnci Tip 2 DM gelişiminde en erken tespit edilebilen fonksiyon bozukluklarıdır. Glukoz uptake’inde bu azalma azalmış insülin duyarlılığına yol açar (28,31,37,38). Tip 2 diyabetin ortaya çıkışında
insülin eksikliği ile seyreden beta hücre fonksiyon bozukluğundan veya insülin direncinden hangisinin primer olarak sorumlu olduğu güncel bir tartışma konusudur.
Tip 2 diyabetin patogenezi karmaşık olup başlıca üç patofizyolojik fenomen ile karakterizedir (39):
Göreceli insülin yetersizliği ile birlikte pankreas beta hücre disfonksiyonu (insülin salgılanma defekti)
İnsülin direnci
Hepatik glukoz üretimi artışı
1.1.4.1.Beta Hücre Disfonksiyonu
İnsülin Salgısında Kantitatif Bozukluklar: Preklinik dönemde varolan insülin
direnci, normale göre daha fazla insülin salgılanarak aşılmaya çalışılır. Normal glukoz toleransı ancak bu şekilde sürdürülebilir (40). Açlık glukoz düzeyi 80 mg/dl’den 140 mg/dl’ye yükseldiğinde insülin düzeyi normal sağlıklı bireylere göre 2-2.5 kat artar. Açlık glukoz düzeyi 140 mg/dl’yi geçtiğinde ise beta hücrelerinde insülin salgılanması daha fazla artamaz ve açlık hiperglisemisi arttıkça insülin salgılanması da kademeli olarak azalmaya başlar. İnsülin salgısının azalmaya başladığı bu sırada hepatik glukoz üretimi artmaya başlayarak açlık glisemisinin yükselmesine büyük katkıda bulunur. 250-300 mg/dl arasındaki açlık glisemi düzeyinde ise insülin salgılanması ciddi olarak azalır. İnsülin salgısındaki bu değişime Starling eğrisi adı verilmektedir (12,41).
İnsülin Salgısında Kalitatif Bozukluklar
Birinci faz insülin salgısının bozulması: İntravenöz glukoz verilmesini izleyen ilk 10 dakikada insülin salgısında hızlı artış olur ve 2–4 dakika arasında bu artış pik yapar. 6. dakikadan itibaren hızını kaybeder. Birinci faz insülin salgısının kaybolması ile glukagonun hepatik glikoneogenezi arttırıcı etkisi belirginleşir (40). Birinci faz insülin salgı defektinin insülin direncinin patogenezinde de rol oynadığı ileri sürülmüştür.
Pulsatil insülin salgısının bozulması: Normalde insülin her 5-15 dakikada bir periyodik olarak salgılanır. Salgılanma hızlı ve kısa süreli dalgalanmalar şeklinde olup glukagon düzeyi ile senkronizedir. Bu pulsatil salgılanma biçimi hedef dokularda insülin
kalmasını sağlar. Pulsatil olmayan sürekli insülin salgılanması ise reseptörlerde down regülasyona yol açarak insülin direncine yol açar. Tip 2 diyabetli ve obez hastalarda bu defektler kilo verilmesi ve metabolik kontrol ile büyük oranda düzelmekle beraber tamamen normalleşmez (40).
Proinsülin salgılanmasında anomaliler: Proinsulin insülinin ancak %5’i kadar
biyolojik etkiye sahip olup insülin immunoreaktivitesinin normal bireylerde %2-4’unu, NIDDM’lu bireylerde ise %8-10’unu oluşturur. Proinsülinin %70’ini 32-33 split (kırılmış) proinsülin oluşturur. Proinsülin ve split proinsülinlerin klirensleri yavaş olduğundan ve de insülin ölçümünde kullanılan rutin RIA yöntemleri insülinin yanında proinsülinleri de (sağlam ve kırılmış) ölçtüğünden insülin düzeyleri olduğundan yüksek bulunur. Buradan yola çıkarak plazmadaki sağlam ve 32-33 kırılmış proinsülin konsantrasyonlarının ölçümünün (çift işaretli immunometrik yöntemler ile) insülin direncine veya beta hücre salgılama kapasitesine ya da her ikisine bağlı olarak beta hücresinde oluşan fonksiyon bozukluğunu yansıtabileceği ileri sürülmektedir.
Düşük doğum ağırlığı (Thrifty fenotip hipotezi): Sadece beta hücre yetmezliği olan
bireylerin Tip 2 diyabete yakalanacağını düşünmekle birlikte erişkin yaşta ortaya çıkan bozulmuş glukoz toleransı ve Tip 2 diyabet arasında bağlantının olabileceğini öne sürmektedir. İnutero malnütrisyon sonucunda nütrisyonu idareli kullanmak için karaciğer ve pankreas gibi daha az hayati organların daha az beslenmesine yol açar (40). Bu adaptasyon erişkin yaşta eklenen risk faktörleri ile de bozulmaktadır (obezite, insülin direnci, normal yaşlanma süreci).
Glukoz toksisitesi: Hiperglisemi diyabetik hastalarda insülin duyarlılığını azaltarak
ve hepatik glukoz outputunu artırarak glukoz toleransını daha da bozabilir. Başka bir neden olmaksızın sadece yüksek glukoz düzeyleri pankreastan insülin salgılanmasını bozabilir ve insülin direnci yaratır (glukotoksisite). Hiperglisemi durumunda sıkı metabolik kontrol ile (diyet, oral antidiyabetik ve insülin tedavisi) insülin salgılanmasının düzeldiğinin gözlenmesi hipergliseminin kendisinin insülin salgılanması üzerine baskılayıcı bir etkisinin olabileceğini düşündürmüş, glukotoksisitenin Tip 2 diyabette insülin sekresyonuna etkisini gösteren önemli bir bulgu olmuştur (28,31). Yüksek glukoza sürekli maruz kalan beta hücresinde insülin gen transkripsiyonunun bozulduğu bunun da insülin sentezi ve sekresyonunu azalttığı gösterilmiştir (36).
Lipotoksisite: Diyabetik hastaların dolaşımında bulunan yüksek serum yağ asitleri,
karaciğerde insülin etkisine karşı bir dirence yol açar. Artmış yağ oksidasyonu, glukoz uptake’i ve glikojen sentezini bozabilir (lipotoksisite) (17). Mitokondride beta oksidasyon artışının bu olayı oluşturduğu bildirilmektedir. Aynı şekilde bu mekanizma ile kas dokusunda insülin direnci ve karaciğerde glukoneojenez artışı gözlenmekte, beta hücresinde hücre içi fatty acyl-CoA azalmasıyla insülin sekresyonu da azalmaktadır (28). Yüksek düzeyde serbest yağ asitlerine maruz kalma sonucunda beta hücresinde trigliserid birikerek apoptozise yol açmaktadır.
Amilin (Adacık amiloid polipeptid): Amilin normalde pankreasın beta hücreleri
tarafından üretilir ve glukoz yüklenmesine cevap olarak insülin ile birlikte salınır. Kanda insülinden çok düşük seviyede bulunmaktadır (insülinin 1:10-50 oranında). Amilin adacıklarda amiloid olarak depolanır. Beta hücrelerini çevreleyen amilin, bu hücrelerin glukoz sinyallerini alımına karşı bir ölçüde engel olur. Daha önemlisi amiloid beta hücrelerine toksiktir ve ilerlemiş Tip 2 diyabet olgularında izlenen beta hücre kaybına katkıda bulunur (12,41). Son zamanlardaki çalışmalarda normal kişilerde plazma amilin düzeyinin yüksek olmasına karşın belirgin etki görülmemesi ve amilin infüzyonunun insülin sekresyonu üzerine etkisinin olmaması amilinin Tip 2 diyabet patogenezinde belirgin rolü olmadığını göstermiştir (28,31,38).
Calcitonin Gene Related Peptid (Kalsitonin geni ile ilişkili Peptid, CGRP):
Amiline moleküler olarak %46 oranında benzemektedir; ancak hayvan deneylerinde intravenöz olarak verildiğinde insülin salgılanması üzerine herhangi bir etkisi görülmemiştir (36,40).
İnkretinler (GLP-1, GIP, G-alanin): Oral glukoz verildiğinde insülin
sekresyonunun artmasına neden olan faktörlerdir. Glukagon like peptide 1 (GLP-1) ince barsakta sentezlenen potent insülin salgılatıcısıdır. Tip 2 DM’de GLP-1’e karşı beta hücre rezistansı bulunmuştur. Güçlü bir insülin salgılatıcısı olan gastrik inhibitör polipeptid (GIP) farmakolojik dozda verildiğinde postprandiyal insülin salgılanması üzerine herhangi bir etkisi görülmemiştir. İnsan g-alanininin insülin salgısı üzerine bir etkisi gözlenmemiştir (40).
İnsülin Salgılanması Bozukluğunda Genetik Nedenler: Glukozun beta hücresi
tarafından tanınmasında, insülin sentezi ve salgılanmasında rol oynayan spesifik proteinlerdeki mutasyonlar beta hücre disfonksiyonundan sorumlu tutulmaktadır. Bu mutasyonlar oldukça nadir olup Tip 2 diyabetlilerin %1-2 sini oluşturmaktadır (40). Şimdiye dek glukokinaz geni, mitokondriyal DNA geni, insülin geni ve insülin proçesindeki enzimlere ait genlerde mutasyonlar tanımlanmıştır.
1.1.4.2.Hepatik Glukoz Üretiminde Artış
Hepatik glukoneogenezdeki artışın nedeni henüz kesin olarak bilinmemekle birlikte hiperglukagonemi ve laktat, alanin ve gliserol gibi glukoneojenik prekürsörlerin artışı söz konusudur. Sonuçta açlık hiperglisemisine neden olur (36). Hepatik glukoneogenez artışının diyabetiklerde primer defekt olduğunu gösteren pek az bulgu vardır. Bu faktörün sekonder olay olduğu ancak glukoz toksisitesini daha da arttırdığı düşünülmektedir (40).
1.1.4.3.İnsülin Direnci
İnsülin direnci, insülinin normal konsantrasyonda olmasına rağmen yeterli biyolojik yanıt oluşturamamasıdır. Dolaşımdaki normalin üzerindeki insülin düzeyleri plazma glukozunu normale getireceğinden bu direnç görecelidir (35). Son yıllarda Tip 2 diyabetin oluşmasında dördüncü bir görüş olarak primer defektin hiperinsülinemi olduğu ve insülin direncinin hiperinsülinemiye bağlı olarak oluştuğu hipotezi ortaya atılmıştır (42,43). Hiperinsülineminin nonoksidatif glukoz kullanımını veya glikojen sentezini bozarak insülin direncine yol açabileceği ileri sürülmektedir. Klinik olarak periferik insülin sensitivitesini ölçmek mümkündür. Bunun için kullanılan altın standart test, öglisemik insülin klemp testidir (32).
İnsülin direnci anatomo-patolojik olarak da iskelet kasında, yağ dokusunda ve karaciğerde olmak üzere sınıflandırılmaktadır (44). İnsülin direncinde hepatik glukoz süpresyonu bozulur. Kas ve yağ dokusunda da insülin aracılığı ile olan glukoz kullanımı azalır. Bu durumda insülin salgısının arttırılması ile metabolik durum kompanse edilir. Böylelikle hipergliseminin önlenebilmesi için beta hücreleri sürekli olarak insülin salgısını arttırır. Sonuçta normoglisemi sağlanırken insülin düzeylerinde de normale oranla 1.5-2 kat yüksek bir seviye oluşur (45). Bu hiperinsülinemik kompansasyon sürecindeki beta
hücrelerinde başlangıçta herhangi bir bozukluk yoktur; fakat beta hücresinde fonksiyon kaybı başladığında insülin salgısı da giderek azalmakta ve diyabet ortaya çıkmaktadır. İnsülin duyarlılığının önemli bir belirleyicisi olan vücut yağı olguların sadece üçte birinde insülin direnci ile ilişkili bulunurken, intraabdominal yağ dokusu olguların büyük bir çoğunluğunda insülin direnci ile ilişkili bulunmuştur. İnsülin direnci hücresel olarak prereseptör, reseptör ve postreseptör olmak üzere üç düzeyde sınıflandırılmaktadır. İnsülin direncinin oluşmasında reseptör ve özellikle postreseptör düzeyindeki defektler daha önemli olup, prereseptör düzeyindeki defektler daha az rol oynar. Akromegali, Cushing sendromu veya feokromositoma insülin etkisinde azalma ile karakterizedir ve karbonhidrat metabolizması bozulmuştur. İnsülin direncinin hücresel düzeydeki nedenleri arasında üzerinde en fazla çalışılanı defektif insülin bağımlı glukoz transportu ve kullanımıdır. Bu defektler kas ve karaciğerde glikojen sentezinde azalma ile kendini gösterir. Hücresel glukoz metabolizmasında hız kısıtlayıcı basamağın plazma membranından glukoz transportu olduğu göz önüne alındığında GLUT-4 ön plana çıkmaktadır. GLUT-4 düzeylerindeki düşüklük insülin direncinin gelişmesinden, GLUT-2 düzeylerindeki düşüklük ise glukoza karşı erken insülin cevabının yokluğundan sorumlu tutulmaktadır (17).
İnsülin direnci yaş, cins, ırk, vücut yağ kitlesi ve dağılımı, egzersiz, kan basıncı, ailesel diyabet anamnezi (genetik), sigara kullanımı ve iskemik kalp hastalığı gibi faktörlerce etkilenmektedir (32,46,47). Hepatik glukoz çıkışında artış öncelikle açlık plazma glukozundaki yükselmeyi etkilerken, periferik glukoz kullanımında (kas ve yağ dokusu) azalma postprandiyal hiperglisemiye neden olur (35). Hipergliseminin kademeli olarak gelişmesi ve başlangıçta klasik semptomların çok fark edilir olmaması nedeniyle hastalık uzun yıllar tanı almayabilir; ancak bu hastalarda mikro ve makrovasküler komplikasyonların gelişme riski artmıştır (48,49,50).
İnsülin direncine göre diyabet gelişimi 4 dönemde incelenmektedir. Bunlar:
1-Preklinik Diyabet Dönemi (Normoglisemik Hiperinsülinemik Dönem): Tip 2
diyabetin henüz klinik belirti vermediği bu dönemde beta hücre fonksiyonları nispeten normaldir fakat mevcut olan periferik insülin direnci normale göre daha fazla insülin salınarak aşılmaya çalışılır ve bu şekilde açlık ve postprandiyal şekerleri normal sınırlar içinde tutulur. OGTT normaldir (51). Açlık ve postprandiyal insülin düzeyleri ise yüksek
2-Bozulmuş Glukoz Toleransı (Postprandiyal Hiperglisemik Hiperinsülinemik Dönem): Beta hücreleri üzerinde oluşan aşırı yük zamanla beta hücre bitkinliğine ve insülin
salgısında azalmaya neden olunca glukoza intolerans başlar ve bu durumda açlık glisemisi normal olduğu halde postprandiyal glisemi yükselir. Bu dönemde genellikle hiperinsülinemi devam etmekle birlikte periferdeki direnci aşabilecek düzeyde insülin salınamamaktadır. Bu dönemde postprandiyal insülin düzeyleri sağlıklı bireylere göre hala yüksek olsa bile birinci döneme göre bir hayli azalmıştır. Bozulmuş glukoz toleransını tanımlayabilmek için OGTT yapmak gereklidir. IGT genellikle IFG ile birliktedir. IGT’de karaciğerden glukoz çıkışını engelleyerek açlık hiperglisemisi olmayacak kadar insülin etkisi mevcut olduğundan postprandiyal hiperglisemi IGT için daha duyarlı bir göstergedir. IFG ve IGT’nin görülme sıklığı yaş ilerledikçe artar (52). DM gelişmedikçe bu kişilerde DM’ye spesifik mikrovasküler komplikasyonlar görülmez; fakat bunun önemi gelecekte diyabet ve makrovasküler komplikasyonlar (kardiyovasküler hastalık) için risk faktörü olmasıdır (52,53). Hem IFG hem de IGT’nin birlikte olması (kombine glukoz intoleransı) durumunda bu bozukluklukların tek başına bulunmasına göre diyabet riski 2 kat artmaktadır (5).
3.Erken Klinik Diyabet Dönemi (Hiperglisemik Hiperinsülinemik Dönem):
Normal glukoz toleransı saptanan preklinik birinci dönem ve postprandiyal glukoz intoleransı saptanan ikinci dönem de açlık hiperglisemisi gelişmediğinden bu iki dönemi kompanse periferik insülin direnci dönemi olarak adlandırmak uygun olacaktır. İnsülin direncinin giderek artması ile kompansasyon bozulmaya başlar ve bu esnada karaciğerde glukoz yapımı artarak açlık plazma glisemisinin yükselmesine yol açar.
4-Klinik (Aşikar) Diyabet Dönemi (Hiperglisemik Hipoinsülinemik Dönem):
Açlık plazma glisemisi 140 mg/dl’yi geçince insülin salgısı azalmaya başlar; ancak yine de insülin direnci devam eder. İnsülin direncinin zirvede olduğu bu dönemde giderek artan glisemi insülin salgı artışıyla kompanse edilemediği için glukoz toksisitesi nedeniyle beta hücreleri insülini daha az salgılamaya başlarlar. Bu dönemdeki insülin direncinin ağırlaşmasında serbest yağ asidleri artışının yani lipotoksisitenin de payı vardır. Birinci faz insülin salgısının kaybı ve insülin pulsatilitesinin bozulması gibi insülin salgısında kalitatif anormallikler insülinin dokularda oluşturacağı etkiyi bozarak doğrudan insülin direncine yol açabilir. İnsülin eksikliği altta yatan insülin direncini şiddetlendirmektedir (51). Beta hücre disfonksiyonu ve insülin direncinin ilerlemesi ile tip 2 diyabet ortaya çıkar.
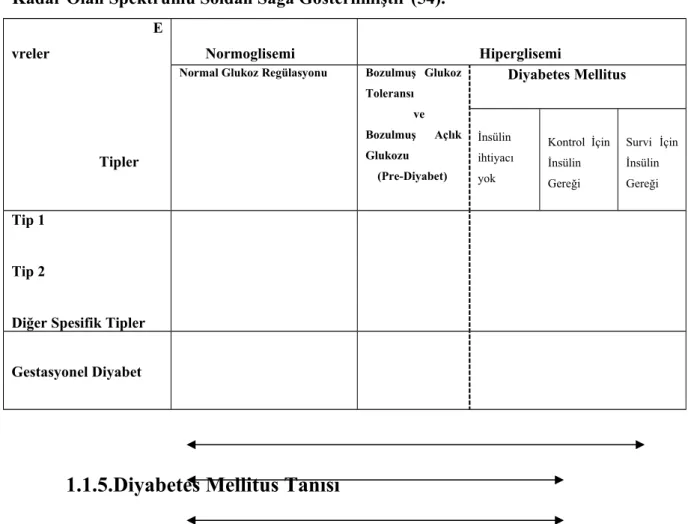
TABLO 1: Glukoz Hemostazisi ve Diyabet Spektrumu Tip 1 Diyabet, Tip 2 Diyabet, Diğer Spesifik Tipler ve Gestasyonel Diyabetin Normal Glukoz Toleransından Diyabete Kadar Olan Spektrumu Soldan Sağa Gösterilmiştir (54).
E vreler Tipler Normoglisemi Hiperglisemi
Normal Glukoz Regülasyonu Bozulmuş Glukoz Toleransı ve Bozulmuş Açlık Glukozu (Pre-Diyabet) Diyabetes Mellitus İnsülin ihtiyacı yok Kontrol İçin İnsülin Gereği Survi İçin İnsülin Gereği Tip 1 Tip 2
Diğer Spesifik Tipler Gestasyonel Diyabet
1.1.5.Diyabetes Mellitus Tanısı
Son 20 yıl içinde diyabetin tanısı önemli ölçüde değişmiştir. 1979’da Ulusal Diyabet Veri Grubu (National Diabetes Data Group) ve 1980’de Dünya Sağlık Örgütü (WHO) diyabet kriterlerini ve sınıflamasını standardize etmeyi amaçlamışlardır. Daha sonra 1985 yılında WHO tanı kriterleri revize edilmiştir (55,56,57). Pek çok diyabetli kişide 1985 WHO kriterlerine göre diyabet tanısı koyduracak 2. saat glukoz düzeyleri saptandığı halde, açlık için belirlenmiş düzeylere ulaşılamaması nedeniyle 1997 yılında, Amerikan Diyabet Birliği (ADA) yeni tanı ve sınıflama kriterlerini yayınladı ve açlık kan glukoz düzeyi sınırının daha aşağı çekilmesini önermiştir (3,56). Hemen ardından 1999’da Dünya Sağlık Örgütü (WHO) bu kriterleri küçük revizyonlarla kabul etmiştir (58). Daha sonra 2003 yılında, bozulmuş açlık glukozu (IFG) tanısı için ADA tarafından küçük bir revizyon yapılmıştır. WHO ve Uluslararası Diyabet Federasyonu (IDF) tarafından 2006 yılı sonlarında yayınlanan raporda ise 1999 kriterlerinin korunması benimsenmiştir. Buna karşılık, ADA ve Avrupa Diyabet Çalışma Birliği (EASD) 2007 yılında yayınlanan son konsensus raporlarında ise 2003
Tanı kriterleri venöz plazmada glukoz oksidaz yöntemi ile yapılan ölçümleri baz almaktadır. Kan şekerini değerlendirmede kan örneği alma yeri önemlidir. Açlıkta kapiller kan glukozu (glukoz çubuğu ile), koldan alınan venöz kana göre açlıkta 5-10 mg kadar, toklukta 20 mg kadar yüksek ölçülebilir. Ayrıca kapiller kan veya venöz plazmada kan şekeri ölçümleri venöz tam kan örneklerinden yaklaşık 20 mg/dl (1mmol/lt) daha yüksektir. Glukoz tam kandan bakılacağı zaman alındıktan hemen sonra bakılmalıdır; çünkü glukoz kan hücreleri tarafından kullanılır ve saatte %7 oranında azalır (1).
Tanı için 75 g glukoz ile standart oral glukoz tolerans testi (OGTT) yapılması, açlık kan glukoz düzeyine göre daha sensitif ve spesifik olmakla birlikte, bu testin aynı kişide günden güne değişkenliğinin yüksek olması, emek gerektirmesi, yoğun ve maliyetli olması rutin kullanımını güçleştirmektedir. Diğer taraftan, AKŞ’nin daha kolay uygulanabilmesi ve ucuz olması klinik pratikte kullanımını arttırmaktadır. OGTT ile diyabet tanısı aldığı halde, AKŞ ile diyabet saptanmayan kişilerde HbA1c yüksek değildir (<%6). Hastalığın aşikar klinik başlangıcı nedeniyle Tip 1 diyabet tanısı için çoğu kez OGTT yapılması gerekmez.
1.1.5.1.Standart OGTT Protokolü (1,5)
OGTT diyabet tanısı için kullanılan en duyarlı testtir. Ancak testin standardize edilememesi ve hastalar tam olarak hazırlanmadan uygulanması hatalı değerlendirmelere yol açabilmektedir. OGTT sırasında birçok faktör glukoz toleransına etki ederek hiperglisemik bir eğrinin ortaya çıkmasına yol açabilir. Kişi testten önce en az 3 gün yeterli miktarda (≥150 g/gün) karbonhidrat içeren beslenme programına alınmalıdır. Test 3. günün akşamından itibaren 8-14 saatlik açlığı takiben sabah yapılır. Testten önceki akşam 30-50 g karbonhidrat içeren bir öğün tüketilmesi önerilir. Test sırasında sigara içilmemeli ve mutad fizik aktivite yapılmalıdır. Enfeksiyon, diğer akut hastalıklar, ağır stres, uzun sürmüş inaktivite, aşırı fizik aktivite bulunmamalıdır. Kortikosteroidler, diüretikler, oral kontraseptifler, difenilhidantoin, psikotrop ajanlar, tiroksin, beta blokerler, nikotinik asit gibi ilaçlar testten en az 1 hafta önce kesilmelidir. Malabsorbsiyonlarda, ağır karaciğer ve böbrek yetersizliklerinde, hipopotasemi durumunda, Addison, Cushing Sendromu, hipertiroidi, Akromegali, Feokromositoma gibi hastalıkların aktif dönemlerinde test ertelenmelidir.
OGTT Uygulanması (1,5):
8-14 saatlik açlık sonrası sabah 0. saatte (açlık) kan alınır. Açlık periyodunda sadece su içilmesine izin verilir. Vakanın glukoz içmeye başladığı an, testin başlangıcı kabul edilir. 300 ml suda eritilmiş 75 g glukoz 5 dakikada içirilir (gebelerde 100 g içirilir.) (çocuklara 1.75 g/kg, en fazla 75 g). 0, 30, 60, 90 ve 120. dakikalarda glukoz ölçümü için kan alınır (100 gr OGTT’de 3. saatte de kan alınmalı) ve hastada reaktif hipoglisemi düşünülüyorsa test süresi gerektiğinde 5 saate kadar uzatılmalıdır. Glisemi tayini hemen yapılmayacak ise, kan örnekleri sodyum florür (1 ml kan için 6 mg) içeren tüplerde toplanarak santrifüj edilir, plazması ayrılır ve glukoz ölçümüne kadar dondurulması gerekir. Test sırasında hastanın fazla efor yapması, birşeyler yemesi ve su dışında birşeyler içmesi kesinlikle yasaklanmalıdır.OGTT Endikasyonları (1):
Ailede DM hikayesi olanlar
Ailesinde MODY tipi diyabet bulunanlar Gestasyonel diyabetin araştırılması amacı ile
Tarama testlerinde AKŞ’nin 110 mg/dl üzerinde olması
Yüksek bir postprandiyal kan şekeri varsa (ADA diyabet kriterlerini sağlamayan) Anamnezde iri bebek (>4kg) doğurma, spontan abortus, prematür doğum, ölü doğum,
neonatal ölüm, polihidroamniyoz veya toksemi olan hastada hamilelik varsa
İzah edilemeyen nöropati, retinopati, erken ateroskleroz, koroner damar hastalığı, serebrovasküler hastalık veya periferik damar hastalığı olanlarda ve bu patolojilere 50 yaş altında rastlanması halinde
Operasyon, stres, travma, infarktüs, diyabetojenik ilaç kullanımı veya gebelik esnasında hiperglisemi ya da glikozüri saptanan vakalarda bu olaylar geçtikten sonra Reaktif hipoglisemiyi düşündürecek semptomları olan kişilerde uygulanmalıdır.
1.1.5.2.Diyabet Tanı Kriterleri
1. AKŞ’nin >126 mg/dl ( 7.0 mmol/l) olması (en az 8 saatlik açlık sonrası alınan kanda)*
veya
2. Diyabetes mellitusun poliüri, polidipsi ve açıklanamayan kilo kaybı gibi klasik semptomlarının varlığında, son öğüne bakılmaksızın günün herhangi bir saatinde plazma glukozunun >200 mg/dl ( 11.1 mmol/l) olması
veya
3. OGTT sırasında 2.saat plazma glukozunun >200 mg/dl ( 11.1 mmol/l) olması. Test Dünya Sağlık Örgütünün önerdiği gibi suda çözünmüş 75 g anhidroz glukoz ile yapılmalıdır.
*Kesin hiperglisemi yokluğunda farklı günlerde yapılan ölçümlerle doğrulanması gerekir.
TABLO 3: Glukoz Tolerans Durumlarının Tanı Kriterleri (ADA 2006)
Durum Açlık plazma glukozu
(mg/dl)
OGTT 2. saat plazma glukoz (mg/dl)
Bozulmuş açlık glukozu (IFG) 100-125 <200
İzole IFG 100-125 <140
Bozulmuş glukoz toleransı (IGT) <126 140-199
İzole IGT <100 140-199
Kombine IFG/IGT 100-125 140-199
Normal glukoz toleransı <100 <140
TABLO 4: WHO/IDF-2006 Diyabet ve Ara Glisemi Kademeleri İçin Tanı Kriterleri
Durum Açlık plazma glukozu
(mg/dl)
OGTT 2. saat plazma glukoz (mg/dl)
Diyabet ≥126 ≥200
Bozulmuş glukoz toleransı <126 140-199
Bozulmuş açlık glukozu 110-125 <140
Hipergliseminin ve metabolik ayarsızlığın belirgin olmadığı durumlarda testler tekrar edilmelidir. OGTT’nin rutin olarak uygulanması önerilmemektedir. Diyabet için yüksek risk taşıyan bireyler tanı amaçlı olarak OGTT ile değerlendirilmelidir (1).
TABLO 5: Diyabetes Mellitus ve Glukoz Metabolizmasının Diğer Bozukluklarında Tanı Kriterleri(*) Aşikar DM (mg/dl) İzole IFG(**) (mg/dl) İzole IGT (mg/dl) IFG + IGT (mg/dl) DM Riski Yüksek APG (≥8 st açlıkta) ≥126 100-125 <100 100-125 -OGTT 2.st PG (75 g glukoz) ≥200 <140 140-199 140-199 -Rastgele PG ≥200+ Diyabet semptomları - - - -A1C(***) ≥%6.5 (≥48 mmol/mol) - - - %5.7-6.4 (39-46 mmol/mol) (*)Glisemi venöz plazmada glukoz oksidaz yöntemi ile ‘mg/dl’ olarak ölçülür. (**) 2006 yılı WHO/IDF Raporunda normal APG kesim noktasının 110 mg/dl ve IFG 110-125 mg/dl olarak korunması benimsenmiştir. (***)Standardize metotlarla ölçülmelidir.
DM: Diabetes mellitus, APG: Açlık plazma glukozu, 2.st PG: 2. saat plazma glukozu, OGTT: Oral glukoz tolerans testi, A1C: Glikozillenmiş hemoglobin A1c, IFG: Bozulmuş açlık glukozu (impaired fasting glucose), IGT: Bozulmuş glukoz toleransı (impaired glucose tolerance), WHO: Dünya Sağlık Örgütü, IDF: Uluslararası Diyabet Federasyonu.
Buna göre diyabet tanısı dört yöntemle konulabilir. Çok ağır diyabet semptomlarının bulunduğu durumlar dışında, tanının daha sonraki bir gün, diğer bir yöntemle de doğrulanması gerekir.
Günlük pratikte OGTT yapılan bazı kişilerde açlık ve 2.saat glukoz normal (yada IFG/IGT aralıklarında) bulunmasına rağmen 1.saat PG düzeyinin 200 mg/dl’nin üzerinde olduğu görülmektedir. Bu vakaların tıpkı aşikar diyabet gibi takip edilmesi oldukça yaygın kabul gören bir yaklaşımdır.
AKŞ 8-14 saat açlıktan sonra sabah bakılan kan şekeridir. DM tanısı için ilk etapta AKŞ’ye bakılır. 1 hafta arayla AKŞ 125 mg/dl üzerinde ölçülürse DM tanısı konulur. AKŞ 100-125 mg/dl ölçülürse OGTT yapılır. Ayrıca açlık plazma glukozu normal olan, ancak diyabet açısından yüksek risk grubunda bulunan bireylerde OGTT ile IGT ve diyabet tanısı konulabilir (1). ‘Sınırda Diyabet’ ya da ‘Latent Diyabet’ diye anılan IGT ve IFG, artık prediyabet olarak kabul edilmektedir. IGT ve IFG terimleri normal glukoz dengesi ile diyabet