SİYAH HARDAL TOHUMUNDAN (Brassica nigra L.) LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE KARAKTERİZASYONU
Mustafa TIRANCIOĞLU Yüksek Lisans Tezi Biyokimya Anabilim Dalı
Mustafa TIRANCIOĞLU
Dumlupınar Üniversitesi
Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliği Uyarınca Fen Bilimleri Enstitüsü
Biyokimya Anabilim Dalında YÜKSEK LİSANS TEZİ
Olarak Hazırlanmıştır.
Danışman: Prof. Dr. Metin BÜLBÜL
KABUL VE ONAY SAYFASI
Mustafa TIRANCIOĞLU’nun YÜKSEK LİSANS tezi olarak hazırladığı SİYAH HARDAL TOHUMUNDAN (Brassica nigra) LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE KARAKTERİZASYONU başlıklı bu çalışma, jürimizce Dumlupınar Üniversitesi Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliğinin ilgili maddeleri uyarınca değerlendirilerek kabul edilmiştir.
29/09/2017 Üye: Prof. Dr. Metin BÜLBÜL (Danışman)
Üye: Yrd. Doç. Dr. Derya KOYUNCU ZEYBEK
Üye: Yrd. Doç. Dr. Zerrin PAT
Fen Bilimleri Enstitüsün Yönetim Kurulu'nun .../…../2017 gün ve ... sayılı
kararıyla onaylanmıştır.
Prof. Dr. Hasan GÖÇMEZ
Fen Bilimleri Enstitüsü Müdürü
ETİK İLKE VE KURALLARA UYGUNLUK BEYANI
Bu tezin hazırlanmasında Akademik kurallara riayet ettiğimizi, özgün bir çalışma olduğunu ve yapılan tez çalışmasının bilimsel etik ilke ve kurallara uygun olduğunu, çalışma kapsamında teze ait olmayan veriler için kaynak gösterildiğini ve kaynaklar dizininde belirtildiğini, Yüksek Öğretim Kurulu tarafından kullanılmak üzere önerilen ve Dumlupınar Üniversitesi tarafından kullanılan İntihal Programı ile tarandığını ve benzerlik oranının %29 çıktığını beyan ederiz. Aykırı bir durum ortaya çıktığı takdirde tüm hukuki sonuçlara razı olduğumuzu taahhüt ederiz.
Prof. Dr. Metin BÜLBÜL Mustafa TIRANCIOĞLU
SİYAH HARDAL TOHUMUNDAN (Brassica nigra) LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE KARAKTERİZASYONU
Mustafa TIRANCIOĞLU Biyokimya, Yüksek Lisans Tezi , 2017 Tez Danışmanı: Prof. Dr. Metin BÜLBÜL
ÖZET
Lipazlar yapıları incelendiğinde yağ asitlerinden ve gliserolden oluşturulan esterlerin su ile etkileşimi sonucunda ikiye ayrılan veya lipit yapılarında bulunan ester bağlarının oluşumunda katalizör görevini üstlenen enzimler olarak bilinirler. Çalışma ile lipaz saflaştırılan bitkisel kaynaklara bir alternatif oluşturulmuş ve ilk defa hardal tohumundan lipaz enziminin eldesi gerçekleşmiştir. Hardal tohumundan lipaz eldesi konusunda hardal tohumunun yapısında bulunan proteinlerin yağsızlaştırılması ile başlanmıştır. Jel filtrasyon kromotografisi prosesleri kullanılarak hardal tohumu lipazı saflaştırılmıştır.
Bütün saflaştırma yöntemlerinde Bradford metoduna göre protein tayini yapılmış ve titrasyon işlemleri ile lipaz aktivitesi tayini gerçekleştirilmiştir. Buna bağlı olarak spesifik aktivitelerin hesaplanması yapılmıştır. İşlemler sonucunda hardal tohumu lipazının 37,89 kat saflaştırıldığı tespit edilmiştir. Saflaştırılan lipaz enzimi SDS-PAGE ile karakterizasyonu yapılmıştır. Enzim en yüksek aktiviteyi pH 5,6 ve 60 derecede göstermiş, ayrıca stabil pH ve stabil sıcaklık seviyeleri de 6,8 ve 4 ˚C olarak tespit edilmiştir. Lipaz enziminin depolanma kararlılığını belirlemek amacıyla iki hafta boyunca stabil şartlarda +4 ˚C derecede aktivitesini koruduğu tespit edilmiştir. Lipaz enzimleri için önemli parametrelerden olan Km ve Vmax değerleri hesaplanmış, substrat olarak da triolein kullanılmıştır. Km değeri 0,1222 mM ve Vmax
değeri ise yaklaşık 1,0195 U/dk.mg enzim olarak bulunmuştur.
PURIFICATION AND CHARACTERIZATION OP LIPASE ENZYME FROM BLACK MUSTARD SEED (Brassica nigra)
Mustafa TIRANCIOĞLU Biochemistry, M. S. Thesis , 2017 Thesis Supervisor: Prof. Dr. Metin BÜLBÜL
SUMMARY
When lipases are investigated, they are known as enzymes which act as catalysts in the formation of ester bonds, which are separated into fatty acids and glycerol-derived esters as a result of interaction with water or lipid structures.
In this study, it is aimed that the mustard seed is an oily seed and that the obtained lipase is obtained pure and characterized. An alternative to lipase-purified plant sources was established by the study and the first time the enzyme of the lipase enzyme from mustard seed was realized.
The lipase enzyme purified from mustard seeds is initiated by de-oiling the proteins found in mustard seeds. The mustard seed lipase was purified using gel filtration chromatography.
In all purification steps protein quantity was measured according to Bradford method and lipase activity was measured by titrimetric method. Specific activity was calculated and it was determined that lipase was purified 37.89 fold.
Maximum acitivity of cotton seed lipase was observed at pH 5.6 and 60 ˚C. It was found that stabil pH and stabil temperature 6.8 and 4 ˚C, respectively.
To determine storage stability of purified lipase, activities were measured for two weeks. After two weeks lipases in 4 ˚C were protect their catalytic activity.
To calculate Km and Vmax of mustard seed lipase, triolein was used substrate and Km
value was calculated as 0,1222 mM, Vmax value was calculated as 1.0195 U/dk.mg. Key Words: Mustard seed, Gel filtration, Characterization, Lipase, Purification.
TEŞEKKÜR
Yüksek lisans eğitimim boyunca bilgi ve tecrübelerinden yararlandığım, tez konumun seçilmesinde, hazırlanmasında ve tüm aşamalarında maddi-manevi büyük ilgi ve desteğini gördüğüm tez danışmanım değerli hocam Sayın Prof. Dr. Metin BÜLBÜL’e,
Çalışmalarım sırasında bilgi ve tecrübelerini esirgemeyen, her konuda sabırla yardımcı olan Dumlupınar Üniversitesi Biyokimya Bölümü Arş. Gör. Ekrem TUNCA’ya,
Laboratuvar çalışmalarım ve geçen 6 sene boyunca her zaman desteğini hissettiğim, bana her konuda yardımcı ve yanımda olan sevgili hayat arkadaşım Gülnur KALKAN’a,
Tüm hayatım boyunca her türlü maddi ve manevi desteği benden esirgemeyen, her zaman yanımda olan ve olacaklarını bildiğim canım anne ve babama,
İÇİNDEKİLER Sayfa ÖZET ... v SUMMARY ... vi ŞEKİLLER DİZİNİ ... x ÇİZELGELER DİZİNİ ... xi
SİMGELER VE KISALTMALAR DİZİNİ ... xii
1. GİRİŞ ... 1
1.1. Hardal ve Hardal Tohumu ... 2
2. ENZİMLER ... 4
2.1. Enzim Aktivitelerine Etki Eden Faktörler ... 5
2.1.1. pH’ın enzim aktivitesine etkisi ... 5
2.1.2. Sıcaklığın enzim aktivitesine etkisi ... 5
2.1.3. Substrat konsantrasyonunun enzim aktivitesine etkisi ... 6
2.1.4. Tuz ve iyonik şiddetin enzim aktivitesine etkisi ... 6
3. LİPAZLAR ... 7
3.1. Lipaz Enzimi ve Yapısı ... 7
3.1.1. Lipaz enziminin üç boyutlu yapısı ... 8
3.1.2. Lipaz enziminin etki mekanizması ... 9
3.2. Lipaz Enziminin Uygulama Alanları ... 9
3.3. Lipaz Kaynakları Ve Lipaz Saflaştırılması ... 9
3.4. Lipazlarda Aktivite Tayini ... 10
4. MATERYAL VE METOT ...11
4.1. Materyal ...11
4.1.1. Kullanılan kimyasal malzemeler ...11
4.1.2. Kullanılan alet ve cihazlar ...11
4.1.3. Kullanılan çözeltilerin hazırlanması ... 12
4.2. Metotlar ... 13
4.2.1. Enzimlerin aktivite tayin yöntemleri ... 13
4.2.2. Bradford yöntemi ile kantitatif protein tayini ... 14
4.2.3. Homojenatın hazırlanması ... 14
İÇİNDEKİLER (devam)
Sayfa
4.2.5. Sephadex® jel hazırlanması ... 15
4.2.6. Saflaştırılan proteinlerin SDS-PAGE ile karakterizasyonu ... 15
4.2.7. Lipaz enzimi için optimum pH çalışmaları ... 15
4.2.8. Lipaz enzimi için optimum sıcaklık çalışmaları ... 16
4.2.9. Lipaz enzimi için stabil-pH çalışmaları ... 16
4.2.10. Lipaz enzimi için stabil-sıcaklık çalışmaları ... 16
4.2.11. Lipaz enziminin depo kararlılığı tayini ... 16
4.2.12. Km ve Vmax değerlerinin belirlenmesi ... 16
5. SONUÇ VE TARTIŞMA ... 17
5.1. Sonuç ... 17
5.1.1. Hardal tohumu lipazının hidrolitik aktivitesinin tayini ... 17
5.1.2. Hardal tohumundan saflaştırılan lipaz enziminin saflaştırma basamakları ... 17
5.1.3. Hardal tohumundan saflaştırılan lipazın optimum pH’nın belirlenmesi ... 18
5.1.4. Hardal tohumu lipazının optimum sıcaklığın belirlenmesi ... 20
5.1.5. Hardal tohumu lipazının enziminin depo kararlılığının belirlenmesi ... 21
5.1.6. Lipaz enziminin Km ve Vmax değerlerinin belirlenmesi ... 22
5.1.7. Hardal tohumundan saflaştırılan lipazın stabil pH aktivitesi ... 23
5.1.8. Hardal tohumundan saflaştırılan lipazın stabil sıcaklık değerinin belirlenmesi ... 24
5.1.9. SDS-PAGE ile enzimin karakterizasyonu ... 25
5.2. Tartışma ... 26
ŞEKİLLER DİZİNİ
Şekil Sayfa
5.1. pH’ın hardal tohumundan saflaştırılan lipaza etkisi. ... 19
5.2. Sıcaklığın hardal tohumundan saflaştırılan lipaz enzimine etkisi. ... 20
5.3. Hardal tohumundan saflaştırılan lipazın depo kararlılığı. ... 21
5.4. Hardal tohumundan saflaştırılan lipazın Michaelis-Menten grafiği. ... 22
5.5. Hardal tohumundan saflaştırılan lipazın Lineweaver-Burk grafiği. ... 23
5.6. Hardal tohumundan saflaştırılan lipazın stabil pH aktivitesi. ... 24
ÇİZELGELER DİZİNİ
Çizelge Sayfa
5.1 Hardal tohumu yapısındaki lipaz enziminin saflaştırma basamaklarında aktivite değişimi . 17
5.2. Hardal tohumundan saflaştırılan lipazın saflaştırma basamakları. ... 18
5.3. Hardal tohumu lipazı enziminin optimum pH değerleri. ... 19
5.4. Hardal tohumu lipazının optimum sıcaklık değerleri. ... 20
5.5. Hardal tohumu lipazının depo kararlılığı. ... 21
5.6. Hardal tohumundan saflaştırılan lipazın değişik substrat konsantrasyonlarındaki enzim aktivite değerleri. ... 22
5.7. Hardal tohumundan saflaştırılan lipazın stabil pH aktivitesi değerleri. ... 23
SİMGELER VE KISALTMALAR DİZİNİ
Simgeler Açıklamalar
Km Michealis Menten sabiti
Vmax Doygun substrat konsantrasyonunda enzimin ulaşabileceği max hız
mg miligram mL mililitre mM milimolar nm nanometre dk dakika μg mikrogram
1. GİRİŞ
Enzimler, canlı gözelerinde yer alan metabolik bir tepkimeye yol açarak reaksiyon hızının artmasına neden olan, protein yapısında bulunan organik özellikteki maddelerdir. Enzimler etkilerini yalnızca bir tür üzerinde gösterirler. Oldukça spesifik özellikte yapılardır ve bu derece önemli olmalarındaki kilit yapı, aktivitelerinin kontrol edilebilir olmasıdır. Enzimler, sadece optimum özellik gösterdikleri ortamlarda değil, diğer dış ortamlarda da iyi etkinlik gösterirler. Bu sebeplerden ötürü enzimlerin kullanım alanları oldukça geniştir (Jaeger, 1994). Enzimlerin kimyasal yapıları incelendiğinde oldukça karmaşık yapıda oldukları tespit edilmiştir. Bunun en önemli sebeplerinden olarak enzimler üç yapıda bulunurlar ve doğrusal bir polipeptit zincirin kendi kendine kıvrılması sonucunda oluşmuşlardır (Jaeger, 1999). Karmaşık ve oldukça mükemmel yapılarda olmaları, laboratuar ortamında sentetik olarak üretilen katalizörlerle karşılaştırıldığında, çok daha etkili oldukları bilinmektedir. Bu nedenle;
➢ Enzimlerin görev aldıkları doku veya hücre kısımlarının tespit edilmesi,
➢ Biyokimyasal reaksiyonlarda hangi görevlerde ve nasıl işlediğinin ortaya çıkarılması,
➢ Etkilerini hangi mekanizma ile gösterdikleri,
➢ Kinetik özelliklerinin tüm ayrıntılarıyla incelenmesi ve
➢ Bunlara bağlı olarak enzimlerin saflaştırılarak elde edilmesi büyük önem taşımaktadır.
Sadece canlı metabolizmada etkin olmayan enzimler, endüstriyel alanda birçok çalışmada yer almakta ve sanayide de büyük uygulama alanına sahiptirler. Enzimler çeşitli yağlardan elde edilebilir. Bunların çoğunluğunun bitkisel kaynaklı yapılar ve hayvansal bazlı olması birçok alanda kullanılabilirliğinin kanıtlarındandır (Pandey, 1999).
Canlı yapılar incelendiğinde, temel besin maddelerinden olan yağlar, insan vücudunun beslenme alternatifleri içerisinde önemli bir yere sahiptir. Yaşamsal faaliyetlerin devamı için gerekli besin maddelerinin başında gelmektedir. Global Dünyada nüfusun artışı sebebiyle, yağ üretiminin yeterli seviyelerde olmamasından dolayı, yağ üretimi maddi anlamda daha uygun seviyelerde görülen bitkisel kaynaklı olan yağlı tohumlar üzerine yoğunlaşmıştır. Buna bağlı olarak yağlı tohumlar denildiğinde ilk akla gelen, soya fasulyesi, ayçiçeği, kolza, pamuk çiğidi, palm çekirdeği, yer fıstığı, susam ve Hindistan cevizidir (Anonim, 2004).
İçerdikleri yağ miktarı, protein, karbonhidrat, mineral maddeler ve vitaminler sebebiyle canlı beslenmesinde hem insanlar hem de hayvanlar olarak önemli yerlere sahip olan yağlı
tohumlar bunların haricinde sanayi içinde en önemli hammadde kaynakları arasında yer almaktadır (Arıoğlu, 2003). Hayvansal yağlar olarak olaya bakıldığında üretiminin pahalı olması ve yeterli seviyede olmamasından dolayı insan diyetinde gereksinim duydukları yağların büyük çoğunluğu, bitkisel kaynaklı yapılardan elde edilmektedir (Oerlikon, 2010).
Ülkemiz ılıman iklim koşulları sayesinde birçok bitkinin yetiştirildiği nadir gelişmiş ülkeler arasında yer almaktadır. Bu sebeple ülkemiz hem yağ üretimi hem de yağlı tohum ithalatçısı olma yolunda hızla ilerlememize sebep olmaktadır (Büyükşahin, 2008).
Son yıllarda, yağlı tohumlardan enzimlerin saflaştırılması konusundaki çalışmalar oldukça artmış ve bilim dünyası bu konu üzerine yoğunlaşmışlardır (Nelson, 2005). Enzimlerin kimya sektöründe ve biyoteknoloji alanında oldukça çeşitli alanlarda kullanımlarının olması bu katalizörlerin daha ekonomik bir şekilde kullanışlı hale getirilmesi amaç edinilmiştir. Bu sebeple özellikle son 20 yıl içinde enzim immobilizasyonu üzerinde araştırmalar yoğun şekilde devam etmektedir. Çalışmalar incelendiğinde endüstriyel anlamda immobilize lipaz enzimlerinin serbest lipaz enzimlerinin yerine geçtikleri ve kullanımlarının yoğunlaştığı yadsınamaz bir gerçektir. Endüstriyel üretim yapıldığında, yağ işlemlerinde, yüzey aktif madde üretimlerinde, ilaç sanayinde, deterjanlar ve birçok tekstil ürününün sentezlerinde çeşitli sentetik olan reaksiyonların biyokatalizör olarak lipaz enzimleri kullanılmaktadır. Lipaz enzimleri, suda çözünmeyen taşıyıcı görevini üstlenen bir yapıya fiziksel veya kimyasal olarak bağlanarak suda çözünmeyen ürün veren bir kopolimerizasyona enzim molekülünün monomer olarak katılmasıyla ve suda çözünmeyen bir matriks veya suda çözünmeyen mikrokapsüllerde tutuklamakla immobilize edilirler (Farias, 1997). Sonuç olarak lipazlar, istenilen özelliklerde olan yağ çeşitlerinin eldesinde, deterjan üretiminde, eczacılık sektöründe özellikle krem ve merhem yapımında, gıda katkı maddelerinde ve yüzey aktif madde imal edilmesinde, ağır sanayide fabrika atığı yağların atık sularından ayrıştırılmasında ve özellikle önemli yere sahip olan gliserin eldesin de kullanılmaktadır (Kıran, 2006).
1.1. Hardal ve Hardal Tohumu
Hardal, turpgiller ailesine mensup (Brassicaceae) tohumları baharat olarak kullanılan, sarı çiçekleri olan otsu yapıda bir bitkidir. Hardal yapısı incelendiğinde, on kadar farklı çeşitte türü olmasına karşın bunların arasından üç tanesi baharat olarak bilinir ve yaygın olarak kullanılır. Bilinen ve yaygın olarak kullanılan hardal beyaz, siyah ve kırmızı hardaldır. Alt yaprakları 10-15 cm uzunluk 4-7 cm eninde loplu, yan kısımları kısa orta lopları oldukça büyük üst yaprakları ise mızrak şeklinde oldukça küçük yapıdadır. Çiçekleri salkım gibi topluca bir arada bir kısmı olgunlaşıp fasulye kapsülü gibi bir şekil alırken diğer taraftan yeni çiçekler açar,
çiçeklerin sapların ucunda topluca bir arada yarı küre şeklinde, taç yaprakları 4 adet 8-10 mm büyüklüğünde, sarı veya altın sarısı renktedir. Meyveleri kapsül şeklinde, 1-3 cm uzunluğunda, 1-2 mm eninde içinde 7-11 adet tohum bulunur. Hardal bitkisinin ana vatanı Akdeniz havzasıdır. Keskin kokulu ve acı tatta tohumlu bir bitki olan hardal, ilk çağlardan bu yana pek çok farklı biçimde kullanılırdı. Hardalın 100 gramında 8,2gram yağ vardır ve kolesterol değeri sıfırdır (https://tr.m.wikipedia.org, 2016). Hardal tohumunun bileşimindeki maddeleri önem sırasına göre şu şekilde sıralayabiliriz;
Glikosinolatlar 51-5 arasında olup en önemlisi %1-1,2 arasında sinigrosid teşkil eder. Hardal tohumundaki sinigrin ile myrosinoz enzimi hücrelerin ayrı ayrı bölümlerinde olmaları nedeniyle birbirlerinden etkilenmezler. Hardalın ezilmesi ile birlikte enzim myrosinoz sinigrin’i parçalar ve ortaya bir eterik yağ olan alil hardal yağı, glikoz ve potasyum bisülfata ayrılır. Fenilpropan türevleri; sinapin i örnek gösterebiliriz. Sinapin kolin estersinapinasit’den oluşur. Tohumların çillenmesi ile sinapiosid ve koline parçalanır. Sabit yağlar %30 oranında olur ve bunun da %80 i trigiliseritler teşkil eder. Trigliseritler %40 Erucaasit, %17 Linolasit, Tohumlarının %30 u proteinler ayrıca %4-6 mineraller ve zamk içermektedir.
2. ENZİMLER
Enzimler, metabolizmada gerçekleşen kimyasal ve metabolik olaylar için katalizör görevini üstlenen, hayvanlarda, bitki ve mikroorganizmaların yapıları içerisinde salgılanan protein yapısında bulunan makro moleküllerdir (Pekin, 1980). Enzimler yapıları incelendiğinde, karbon, oksijen, hidrojen ve azottan meydana gelen, hücrelerde biyokimyasal olarak gerçekleşecek reaksiyonlarda katalizör görevi gören ve biyokimyasal olarak gerçekleşen olayların vücutta yaşam ile uyumlu bir şekilde gerçekleşmesinde rol alan maddelerdir (Aehle 2004). Enzimler katalizör olarak, kimyasal reaksiyonların hızlarının arttırılmasında ve bir molekülün diğer bir moleküle dönüştürülmesinde kullanılırlar. Bu işlemler sırasında olayda görev alan enzimin yapısında herhangi bir değişiklik olmaz (Singh, 2012).
Genel olarak enzimler, yüksek katalitik akiviteye sahip, seçici olma ve spesifik özellikte olma gibi özelliklere sahiptirler. Doğal yaşamın devam etmesi açısından hayati önemde olan metabolik olaylarda incelendiğinde yapıda gerçekleşen yüzlerce spesifik reaksiyonu oldukça yüksek katalitik aktivite ile gerçekleşmesini sağlayan yapılardır. Enzimlerin bu özelliklerinden ötürü kimyasal katalizörlerden farklı olması spesifik özellikte olmalarındandır. Tarihsel süreç açısından enzimler incelendiğinde aslında insanlar enzimlerin varlığının fark etmesi ve ortaya konulmasından çok daha önce enzim yapılarının gerçekleştirdikleri aktivitelerden dolayı bir şekilde ve farkında olmadan yararlanmayı bilmişlerdir. Bira ve şarap yapımında, ekmek, yoğurt ve peynir gibi fermente besinlerin üretiminde çok eski zamanlardan itibaren gerçekleştirilmekteydi (Nelson, 2004).
Fermantasyon tanımı incelendiğinde, organik maddelerin canlı hücreler tarafından anaerobik koşullar altında metabolize edilerek biyolojik olarak değişime uğratılması olayıdır. Biyolojik olarak gerçekleşen bu değişim süreci ise gerçekte canlı hücrelerin yapısında bulunan enzimler tarafından rahatlıkla gerçekleştirilmektedir. Son dönemlerde enzimler üzerine yürütülen çalışmalar yoğunlaşmıştır. Bu çalışmalar; çok sayıda enzimin saflaştırılmasına, birçoğunun kimyasal mekanizmasının nasıl işlediğine ve yapısının açıklanmasına, genel olarak enzimlerin çalışma prensiplerinin aydınlatılmasına ışık tutmuştur. Yapılan çalışmalar ve gelişen teknoloji sayesinde bugün için yaklaşık 3000 dolayında enzim saf preparat halinde elde edilmiş ve kullanıma sunulmuştur (Fucıños, 2005). Enzimler doğal ortamlarının dışında optimum koşullar sağlandığında diğer doğal olmayan ortamlarda da aktivite gösterir ve bu sebeple pek çok alanda enzimler kullanılabilmektedir. Enzimlerin katalitik özellikleri diğer sentetik katalizörlerle karşılaştırıldığında çok daha etkilidir.
Bu sebeple enzimlerin bulundukları dokular yahut hücre bölümlerinin belirlenmesi, biyokimyasal olarak oluşan reaksiyon işlevlerinin ortaya çıkması, etki mekanizması ve kinetik özellikleri ayrıntılarıyla incelenmesi ve enzimlerin saflaştırılıp elde edilmesi çok önemlidir. (Telefoncu, 1986).
2.1. Enzim Aktivitelerine Etki Eden Faktörler
Enzimlerin yapılar üzerinde maksimum düzeyde etkinlik göstermeleri yani bir enzimin aktivitesinin belirlenebilmesi amacıyla enzimin bulunduğu bölgenin ve kullanılacak olan değişkenlerin optimize edilmesi gerekmektedir. Bazı durumlarda enzim aktivitesi istenilen düzeylerde seyretmezken, bazı durumlarda ise beklenen reaksiyonların kolaylıkla yürüdükleri enzimatik reaksiyonlarda sıklıkla karşılaşılan durumlardan biridir.
2.1.1. pH’ın enzim aktivitesine etkisi
Enzimler yer aldıkları reaksiyonların hızlarına direk etki ederler ve yer aldıkları reaksiyon hız değerleri farklı hidrojen iyonu konsantrasyonlarına göre değişkenlik göstermektedir. Çünkü reaksiyonların uygun şartları sağlayıp reaksiyonun gerçekleşebilmesi için yapılarda aktif olarak görev alan grupların belirli yükler ile yüklenmeleri gerekmektedir. pH değerindeki olası değişimler yapı üzerinde dağılım gösteren yüklerde de değişim göstermektedirler. Enzimlerin maksimum düzeyde aktivite gösterdiği pH değeri, ilgili enzimin optimum pH değerine eşittir. Bu pH değerinin altında veya üstündeki bir değerlerde enzimin optimum şartlar altında bulunduğu üç boyutlu yapısı değişmemesine rağmen aktif bölge olarak görev yapan yapıların istenilen yüke sahip olmadığından dolayı enzim aktivitelerinde azalmalar meydana gelmektedir. Enzim çalışmalarında ortam şartlarının belirli olması amacıyla yani optimum pH koşullarında çalışabilmek adına tampon çözeltiler kullanılmakta ve ortamın pH değeri sabit tutulmaya çalışılmaktadır.
2.1.2. Sıcaklığın enzim aktivitesine etkisi
Enzimler protein yapılı maddeler olduklarından ortamdaki herhangi bir sıcaklık değişmelerine karşı tepki gösterirler. Enzimler belirli sıcaklık aralıklarında uygun etkinlikte çalışır. Enzimin maksimum aktivite gösterdiği yani en iyi çalışabileceği sıcak optimum sıcaklık olarak adlandırılır. Daha düşük ve daha yüksek sıcaklık değerlerinde, enzimlerin çalışma hızında bir azalama meydana gelmektedir.
Enzimlerin yapıları yüksek sıcaklıklara çıkıldığında tamamen bozulduğu gözlemlenirken, düşük sıcaklıkta yapılarında herhangi bir bozulma tespit edilmemiştir. Sıcaklığı düşük ortamlar, enzimin yapısında herhangi bir bozulmaya sebep olmadığından, dondurmak
suretiyle besin maddelerinin saklanması, enzimlerin inaktif hâle geçirilmesiyle mümkün olmaktadır.
Kinetik kurallarına göre reaksiyon ortamında sıcaklık değeri arttıkça reaksiyon hızının da artması gerekmektedir. Enzimatik reaksiyonlar aktivite-sıcaklık bakımından incelendiğinde normal kimyasal reaksiyonlarla bire bir uygunluk göstermemektedirler. Enzimatik reaksiyonlar da ancak belli sıcaklık aralığına kadar reaksiyon hızının arttığı tespit edilmiştir. Yüksek sıcaklıklara çıkıldığında enzimin üç boyutlu yapısının dönüşümsüz olarak bozulmasından kaynaklanan aktivite düşüklüğü ve aynı zamanda düşük sıcaklıklarda ise enzimin hareket kabiliyetini kaybettiğinden aktivite göstermesi için uygun konformasyona gelmesi zaman aldığından aktivitelerde düşüşlerin yaşandığı bilinmektedir.
2.1.3. Substrat konsantrasyonunun enzim aktivitesine etkisi
Enzimlerin görev aldığı enzimatik reaksiyonlarda enzim-substrat arasındaki bağlantı başlangıçta substrat konsantrasyon değerinin artmasıyla enzimatik tepkimenin hızının da arttığı bu nedenle enzim aktivitesinin de yükseldiği görülmektedir. Substrat konsantrasyonu reaksiyon ortamında belli bir üst limit değerine ulaştığında hız anlamında incelendiği zaman iki ihtimalden üzerinden bahsedilmesi gerekmektedir. Substratı inhibe edici etkisi olduğunda reaksiyon hızında bir düşüşün meydana geldiği, inhibe edici etkisi bulunmayan durumlarda substrat konsantrasyonu değeri ne kadar artarsa artsın reaksiyon hızının değişmeden sabit kaldığı gözlemlenmektedir.
2.1.4. Tuz ve iyonik şiddetin enzim aktivitesine etkisi
Bazı enzimlerin aktivite değerleri reaksiyon ortamına eklenen uygun değişik tuzlar ile arttırılabilmekte veya azaltılabilinmektedir. 0,5 M tuz konsantrasyonunun üzerinde çoğu enzim inhibe olurken bazı enzimler ise aktivitelerini arttırabilmektedirler.
3. LİPAZLAR
3.1. Lipaz Enzimi ve Yapısı
Lipazlar büyük ölçüde endüstriyel potansiyeli bulunan ve fizyolojik anlamda da büyük öneme sahip enzimlerdir (Vakhlu, 2006). Lipazlar sulu ortamlarda triaçilgliserollerde bulunan karboksilester bağları ile etkileşime girerek yağ asitleri ve gliserol oluşturan triaçilgliserolester hidrolazlardır (Catoni, 1999).
Lipazlar, hücre dışı enzim üreten mikroorganizmalardan elde edilmektedir ve diğer enzimlerle kıyaslandığında, daha maliyetsiz ve farklı kaynaklardan kolaylıkla elde edilebilmektedirler (Chen 2003). Bu sebeple biyokatalizör olarak kullanım alanları oldukça geniştir. Endüstriyel enzimlerin % 80’i hidrolitik enzimleri oluşturmaktadır. Proteaz ve karbohidrazlar gibi enzimler uzun yıllardır endüstriyel anlamda birçok yerde kullanılmaktadır (Dutta 2009). Günümüzde lipazlar, oldukça geniş uygulamalar ile giderek artan bu pazarın yaklaşık % 10’luk kısmını oluşturmaktadır (Saxena, 1999).
Lipazlar kullanıldıkları alanlarda; ➢ Esterleşme,
➢ Transesterleşme
➢ Hidroliz tepkimelerini düşük sıcaklıkta katalizlemeleri, ➢ Kimyasal olarak üretilemeyen özel bileşiklerin üretimini, ➢ Bölgesel spesifik özelikleri,
➢ Ester bağına spesifik olmaları, ➢ Yüksek substrat seçicilikleri ve
➢ Yan ürün oluşumunu engellemeleri gibi avantajlara sahiptirler (Saxena, 1999). Lipazlar 3 tip reaksiyonda katalizör görevi görmektedir:
i) Hidroliz: Su ortam oranı incelendiğinde, suyun fazla olduğu sulu ortamlarda gerçekleşen olaydır ve ester hidrolizinin baskın olduğu reaksiyondur.
ii) Esterifikasyon: Susuz olan ortamlarda veya düşük oranda su bulunan ortam şartlarında gerçekleşmektedir.
iii) Transesterifikasyon: Bir esterin yapısında bulunan asit bölümü diğeriyle yer değiştirdiğinde (eğer açil ürünü veren serbest bir asitse asidoliz etkileşimi; açil veren bir esterse
interesterifikasyon reaksiyonu; açil alan grup nükleofil bir alkol olduğunda alkoliz; açil almış grup bir amin grubu ise de aminoliz reaksiyonu) oluşmaktadır (Divakar, 2007).
Esterazlardan farklı özellikleri bakımından, lipazlar yağ-su ara yüzeyine adsorbe olabildiklerinde aktif olurlar ve çözünmüş substrat içeren sulu çözeltilerde düşük aktivite gösterirler. Çok az suyun bulunduğu ortamlarda ise lipazlar esterifikasyon, alkoliz ve asidoliz gibi tersinir reaksiyonları da gerçekleştirebilmektedir (Jaeger, 1994).
Lipazlar lipolitik aktivitesi ile birlikte esterolitik aktiviteye de sahiptir ve geniş bir substrat seçiciliğinde regio-, kemo- ve enantiyoseçici katalizör olarak etki etmektedir. Bununla birlikte substrat aralığını da büyük ölçüde arttırmaktadır. Ökaryotlarda, lipazlar lipoprotein metabolizması, yağların parçalanması, adsorplanması ve tekrar düzenlenmesi gibi çok sayıdaki lipid metabolizmasında görev almaktadırlar. Bitkilerde ise enerji değişim dokularında yer almaktadır (Godfrey, 1996).
Lipaz substratları suda oldukça düşük çözünürlüğe sahip triaçilgliserollerdir. Lipazların katalitik gücü, protein mühendisliği, solvent mühendisliği, yönlendirilmiş evrim gibi yöntemler kullanılarak daha seçici hale getirilmektedir (Jaeger, 1999).
Lipazlar, yağ-su ara yüzeyinde etki gösteren aktif bölgesinde serin bulunan, serin hidrolazlardır. Katalitik üçlü Ser-Asp/Glu-His oluşmaktadır ve genellikle aktif bölgesinde serin içeren Gly-x-Ser-x-Gly konsensus dizisine sahiptir. Lipazların 3 boyutlu yapısı incelendiğinde alfa-Beta hidrolaz katlanması içerdiği görülmektedir (Nardini, 1999).
3.1.1. Lipaz enziminin üç boyutlu yapısı
Yapıları üzerinde araştırma yapılan lipaz enzimlerinin incelenen büyük bir bölümü, hücre dışı salgılanan, moleküler ağırlığı 20 ve 60 kDa arasında değişim gösteren asidik glikoproteinlerdir (Villeneuve P. 2000). Çok sayıda saflaştırılmış lipaz enzimleri % 2 ile %15 arasında karbonhidrat içerir. Memeliler, bakteriler ve fungal kaynaklı lipaz enzimlerinin primer yapıları tespit edilmiş ve aminoasit sayılarının 270 ile 641 arasında değiştiği belirlenmiştir. Tüm lipaz enzimleri “α /β- hidrolaz katlanması” olarak bilinen karakteristik olan bir katlanma şekli ortaya koyarlar. Lipaz enziminin iç kısmında 8 farklı β zincirinden (β1- β8) oluşmuş merkezi β tabakası ve bunu saran 6 adet α-heliks (A-F) zincirinden meydana gelmektedir. Aktif bölge serin, aspartik (glutamik) asit ve histidin aminoasitlerini içeren katalitik üçlüden oluşmaktadır (Jaeger, 1998).
3.1.2. Lipaz enziminin etki mekanizması
Lipaz enziminin katalizör olarak görev aldığı esterleşme tepkimesinin mekanizma şekli serin hidrolazlara benzemektedir. Mekanizma sonunda iki adet tetrahedral yapılı ara bileşik meydana gelmektedir. Oluşan ilk tetrahedral ara bileşik katalitik üçlüdeki serin rezidüsünün asit üzerine nükleofilik atağı ile oluşmaktadır. Ara bileşik bir molekül su kaybettiğinde açil-enzim kompleksi ortaya çıkmaktadır (Faiz, 2005). Bir sonraki basamakta alkol molekülü açil-enzim kompleksine nükleofilik olarak saldırı yapar ve ikinci tetrahedral ara bileşik oluşmuş olur. En son olarak ise bir ester molekülü kaybedilir ve enzim doğal formuna geri döner (Gandhi, 2000). 3.2. Lipaz Enziminin Uygulama Alanları
Ticari olarak üretilen enzimlere özellikle de mikrobiyal ve bitkisel kaynaklı olan enzimlere ilgi pek çok sanayi alanında gün geçtikçe ilgi giderek artmaktadır. Enzimler tarafından katalize edilen reaksiyonlar kimyasal metotlarla üretilenlere göre maliyetleri daha uygun ve daha basit yöntemlerle elde edilebilmektedir. Enzimler başta gıda sektörü, eczacılık, deterjan sanayi, tekstil ve kozmatikte olmak üzere pek çok alanda yaygın olarak kullanılmaktadır. Son yıllarda doğal ürünlere olan ilginin artmasıyla birlikte rutin kimyasal işlemlerle yapılan çoğu ürün enzim kullanımı ile yapılmaya başlanmıştır. Günümüzde lipazlardan peynir, tereyağ, sos ve çorba gibi birçok ürünün üretiminde yaygın olarak kullanılmaktadır.
Gıda sektörü haricinde birçok alanda kullanılan lipazlar sıralandığında süt ürünlerinde, deterjanlarda, kağıt endüstrisinde, organik madde sentezinde, biyodizel üretiminde, biyosensör olarak, ve kozmatik alanlarında kullanılmaktadırlar (Jaeger, 1997).
3.3. Lipaz Kaynakları Ve Lipaz Saflaştırılması
Günümüz dünyada lipaz üretimi konusunda doğal çevrede birçok kaynak bulunmaktadır. Mayalar ve küf mantarlarından çeşitli yöntemlerle lipazlar saflaştırılmıştır (Saxena, 2003). Çeşitli bitki tohumlarından saflaştırma işlemler başarılı bir şekilde elde edilmiştir (Chang 2007). Bakteri çeşitlerinden lipaz saflaştırma işlemleri konusunda günümüzde oldukça fazla çalışmalar yapılmıştır. Ayrıca bazı balık türlerinden yağlı dokulardan ve çeşitli sindirim organlarından da lipaz eldesi başarılı bir şekilde gerçekleştirilmiştir (Aryee, 2007). Lipazların saflaştırma işlemleri sırasında çeşitli metotlar geliştirilmiştir. Amonyum sülfat çöktürmesi, jel filtrasyon kromotografisi, iyon değiştirme kromotografisi gibi çeşitli metotlar saflaştırma işlemlerinde kullanılmaktadır.
3.4. Lipazlarda Aktivite Tayini
Lipaz enzimleri, trigliseridlerin hidroliz olmasıyla serbest yağ asidi ve gliserol oluştururlar. Deneysel olarak spektrofotometrik veya titrimetrik analiz yöntemiyle, yüzey gerilim metodu ve yüksek performanslı sıvı kromotografisi yöntemi ile serbest kalan yağ asitlerinin tayininde kullanılmaktadır. Lipaz enzim aktivite tayini amacıyla literatür de en çok kullanılan yöntemler arasında spektrofotometre ve titrimetrik analiz yöntemleri lipaz ile ilgili olan çalışmalarda başta gelmektedir.
4. MATERYAL VE METOT
4.1. Materyal
4.1.1. Kullanılan kimyasal malzemeler
Metanol, asetik asit, aseton, amonyum sülfat, gum arabik, sodyumdeoksikolat, NaHCO3
(sodyumhidrojenkarbonat), NaH2PO4.2H2O (sodyumdihidrojenfosfat), Na2HPO4
(sodyumhidrojenfosfat), SDS (sodyumdodesilsülfat), gliserol, Tris (tris(hidroksimetil) aminometan), N,N-metilenbisakrilamit, N,N,Nı,Nı-tetrametiletilendiamin (TEMED), bromfenolblue, glisin, 2-merkaptoetanol, Sephadex G-100, Coomassie Brilliant Blue R250, Coomassie Brilliant Blue G250, Marker, Sigma-Aldrich, Merck ve Fluka firmalarından temin edilmiştir. Çalışmalarda kullanılan hardal tohumu ve zeytinyağı ise piyasadan temin edilmiştir. 4.1.2. Kullanılan alet ve cihazlar
Enzimin saf olarak elde edilebilmesi için kolona yüklenen jelin içinden geçirilecek olan enzim çözeltisinin sabit hızda akmasını sağlayan Ismatec RegloDigital marka peristaltik Pompa kullanılmıştır.
Aktivite ve çözelti hazırlama bölümlerinde pH ölçümlerini gerçekleştirmek amacıyla SCHOTT Lab850 marka pH metre kullanılmıştır.
Sabit hızda karıştırma yapmak amacıyla Heidolp ReaxTop marka vortex kullanılmıştır. Yağsızlaştırma işlemi sonunda tohum posalarının ayrılması enzim çözeltisinin temiz bir şekilde alınmasını sağlama amacıyla Sigma K30 marka soğutmalı santrifüj kullanılmıştır.
Aktivite ölçümlerinde DAIHAN MSH-20A marka ısıtıcılı manyetik karıştırıcı kullanılmıştır.
Hazırlanan enzim çözeltilerinin optimum aktivite tayinlerinde uygun ortam koşullarını sağlamak amacıyla BINDER marka etüv kullanılmıştır.
Tartımları yapmak üzere SHIMADZU ATX220 marka analitik terazi kullanılmıştır. Protein miktarlarının ölçümlerinin yapılabilmesi için SHIMADZU UV1700 PharmaSpec marka spektorofotometre kullanılmıştır.
Ortam koşullarının sağlanabilmesi için DAIHAN WB-11 marka su banyosu kullanılmıştır.
Karakterizasyon işlemlerinde kullanılmak üzere HEALTEC MiniGES Elite300 marka elektroforez tankı, elektroforez güç kaynağı kullanılmıştır.
Aktivite tayinleri sırasında BIOHIT Proline marka mikropipetler kullanılmıştır.
Çözelti hazırlama da kullanılan sular için Merck Millipore marka saf su Cihazı kullanılmıştır.
Tohumların öğütülmesinde ev tipi öğütücü
Saklama koşullarını sağlamak amacıyla da ev tipi buzdolabı kullanılmıştır. 4.1.3. Kullanılan çözeltilerin hazırlanması
➢ 0,1 M, pH = 7,0 fosfat tamponunun hazırlanması;
5,4603 g NaH2PO4.2H2O (sodyumdihidrojenfosfat) tartıldı. pH’ı 1,0 M NaOH ile 7,0 ye
ayarlandı. Hacmi 350 ml olacak şekilde saf su ile tamamlandı. ➢ %10’luk gum arabic hazırlanması;
18 g gum arabic tartıldı ve 180 ml suda çözüldü. Üzerine 21 ml zeytinyağı ilave edildi. Çözelti soğuk ortamda hazırlandı.
➢ Sodyumdeoksikolat hazırlanması;
0,8 g sodyumdeoksikolat tartıldı ve 50 ml saf suda çözüldü. ➢ TRİS hazırlanması;
0,6058 g tris tartıldı. pH’ı 1 M HCl ile 7,0’ye ayarlandı ve hacmi 100 ml’ye tamamlandı.
➢ 0,05 M NaH2PO4 tamponu hazırlanması;
15,601 g NaH2PO4 tartıldı bir miktar suda çözüldükten sonra 1,0 M NaOH ile pH 7,0
ayarlandı hacmi 2000 ml olacak şekilde ayarlandı. ➢ 1,0 MTris-HCl pH 8,8 hazırlanması;
12,114 g Tris tartıldı ve yaklaşık 60 ml de çözüldükten sonra pH 8,8’e 1,0 M HCl ile ayarlandı. Son hacim 100 ml olacak şekilde ayarlandı. Çözelti 4°C’de muhafaza edildi.
12,114 g Tris tartıldı ve yaklaşık 60 ml de çözüldükten sonra pH 6,8’e 1,0 M HCl ile ayarlandı. Son hacim 100 ml’ye ayarlandı. 4°C’de muhafaza edildi.
➢ 6X Numune yükleme çözeltisinin hazırlanması;
a) %60 griserol, 300 mM Tris-HCl pH 6,8, 12 mM EDTA, %12 SDS, 864 mmM β-merkaptoetenol ve %0,05 bromofenol blue.
b) 10 ml hazırlamak için; 6 ml griserol, 3 ml1 M Tris-HCl pH 6,8, 0,035 g EDTA 1,2 g SDS, 60 ml β-merkaptoetenol, 0,05 g bromofenol blue birbirine ilave edilerek 6X numesi hazırlandı.
➢ %40 Akrilamid hazırlanması;
19,48 g akrilamid, 0,52 g bis-akrilamid 50 ml son hacimde çözüldü. ➢ %10 Amonyum persülfat hazırlanması;
0,1 g amonyum persülfat 1 ml saf suda çözüldü. ➢ %10 SDS çözeltisinin hazırlanması;
4 g SDS 40 ml saf suda çözüldü. ➢ Boyama çözeltisinin hazırlanması;
%0,1 Coomassie Brilliant Blue R250, %50 metanol ve %10 asetik asit birbiri içine eklendi.
➢ Yıkama çözeltisinin hazırlanması;
%10 metanol, %7 asetik asit olacak şekilde hazırlanır. ➢ NaOH çözeltisinin hazırlanması;
0,1 g NaOH tartıldı ve hacmi 250 ml’ye tamamlandı. 4.2. Metotlar
4.2.1. Enzimlerin aktivite tayin yöntemleri
Aktivite tayini yapmak amacıyla %10’luk gum arabic’den 10 ml bir behere alındı, üzerine hazırlanan sodyumdesikolat çözeltisinden 2 ml ve TRİS tamponun’dan 4 ml ilave edilerek manyetik karıştırıcıda karıştırıldı. Hazırlanan karışımın sıcaklığı 37°C sabitlendi ve pH 7 olacak şekilde NaOH ilavesi yapıldı.
pH değerinin sabitlendiği noktada karışım üzerine 1 ml enzim ilave edildi ve 5 dakika boyunca enzim ilave edilen çözelti karıştırılarak pH’ın düşmesi gözlemlendi. Süre süre tamamlandıktan sonra 0,01 M NaOH çözeltisi ile pH değeri pH 7 olacak şekilde tekrar ayarlandı ve harcanan NaOH miktarı kaydedildi.
4.2.2. Bradford yöntemi ile kantitatif protein tayini
Oldukça duyarlı olan bu yöntem (5-100 μg/ml); organik boyaların, proteinlerin asidik ve bazik grupları ile etkileşerek, renk oluşturmasını esas alır. Mavi rengin oluşmasında proteinin amino asit bileşimi (özellikle arjinin gibi bazik amino asitler ve aromatik amino asitler) önemlidir. Yöntemle temel alınan olgu, boya normal şartlarda 465 nm’de maksimum absorbans verirken, protein ile bağlandığı zaman 595 nm dalga boyunda maksimum absorbans vermesidir (Bradford, 1976).
Protein tayin işlemlerinde; 1 mL sinde 1 mg protein ihtiva eden standart sığır albümin çözeltisinden tüplere 10, 20, 30, 40, 50, 60, 70, 80, 90 ve 100 μL olacak şekilde alındı ve saf su yardımı ile tüm tüplerin hacmi 0,1 mL olacak şekilde tamamlandı. Tüplere 5 mL coomassie brillant blue G-250 reaktifi ilave edildi ve vorteks ile sabit hızda karıştırıldı. Karıştırma işlemine 10 dakika devam edildi ve süre sonunda 595 nm’de 3 mL lik küvetlerde köre karşı absorbans değerleri okundu. Kör olarak 0,1 mL aynı tampon ve 5 mL Coomassie Brillant Blue G-250 reaktifinden oluşan karışım kullanılmıştır. Absorbans değerlerine karşılık gelen mikrogram protein değerleri standart grafik üzerine işlendi.
4.2.3. Homojenatın hazırlanması
Hardal tohumundan lipaz enziminin saflaştırılması amacıyla öncelikle tohum yapısında bulunan proteinlerin yağsızlaştırma işlemine tabi tutulması gerekmektedir. Literatürde yapılan çalışmalardan da bilindiği üzere yağsızlaştırma işleminde kullanılan en uygun çözelti asetondur ve çalışmada yağsızlaştırma işlemi için aseton kullanılmıştır. Asetonun kullanılmasının nedeni ise aktiviteye en az zarar vermesi ve yağları en iyi çözen çözücülerden biri olmasıdır. Hardal tohumu yağının saflaştırılması için şu işlemler yapılmıştır.
50 g olarak tartılan ve öğütücüde öğütülen hardal tohumu üzerine 150 ml 4°C’de aseton ilave edildi ve 40 dakika boyunca buz banyosu içerisinde manyetik karıştırıcı ile karıştırıldı. Daha sonra hardal tohumu posasını ayırmak amacıyla süzgeç kağıdı ile karışım süzüldü. Yağsızlaştırılmış hardal tohumu posaları kurutularak yapıda var olan aseton iyice uçuruldu. Tohumların asetondan iyice ayrıldığına emin olunduktan sonra 0,1 M ve pH 7,0 olarak hazırlanan 350 ml fosfat tamponu (NaH2PO4.2H2O) içerisinde 24 saat +4°C buzdolabında
karıştırıcı ile karıştırılarak bekletildi. 24 saat sonunda dolapta muhafaza edilen karışım süzgeç kağıdı ile süzüldükten sonra katı kısmı atıldı. 20,000 rpm’de santrifüjlenerek katı kısmın kalmamasına özen gösterildi.
4.2.4. Amonyum sülfat çöktürmesi
Yapılan aktivite tayinlerinden sonra en aktif durumun amonyum sülfat çöktürmesi yapmadan süpernetant kısmından elde edildiği tespit edilmiştir.
4.2.5. Sephadex® jel hazırlanması
2 g Sephadex G-100 100 ml, 0,1M ve pH 7,0 olacak şekilde hazırlanan fosfat tamponu aktarıldı ve manyetik karıştırıcıda bir miktar karıştırıldı. 24 saat bekletildi 4°C’de muhafaza edildi böylece jelin iyice şişmesi sağlandı. 24 saat sonunda beher dibine çökmüş olan jel manyetik karıştırıcıda dikkatli bir şekilde karıştırılarak kolona aktarıldı. Jelde meydana gelebilecek çatlamaları önlemek, jelin kolon içerisinde iyice dengeye gelmesini sağlamak amacıyla hazırlanan tampon çözelti jel içerisinden geçirildi. Gerekli görsel kontrollerde yapıldıktan sonra homojenat kolona yüklendi. Kolona yavaşça fosfat tamponu eklenerek eluatların kolondan üçer ml’lik franksiyonlar halinde tüplere toplanması sağlandı.
4.2.6. Saflaştırılan proteinlerin SDS-PAGE ile karakterizasyonu
Hazırlanan %12’lik ayrıştırma jeli üzerine %3,75’lik yığma jeli ilave edilerek numuneler kuyuya yüklendi. Daha sonra 100V’da yaklaşık 2 saat 10 dk numuneler yürütüldü. Yürütme işlemi tamamlandıktan sonra jelin boyanması için; %0,1 Coomassie Brilliant Blue R250 çözeltisi hazırlandı. Jel bu çözelti içerisine yatırılarak vorteks üzerinde sabit hızda kuyuların boyanması gerçekleştirildi. Boyama işleminin tamamlandığına kanaat getirildikten sonra jelin yıkanması işlemine geçildi. Yıkama çözeltisi için; %10’luk metanol ve %7’lik asetik asit içeren renksizlendirme çözeltisi hazırlandı. Jel bu çözelti içerisinde tamamen temizleninceye kadar vorteks üzerinde sabit hızda yıkamalar tekrarlandı.
4.2.7. Lipaz enzimi için optimum pH çalışmaları
Hardal tohumundan saflaştırılan lipaz enziminin maksimum aktivite gösterdiği pH değerini belirlemek amacı ile pH 4 ile pH 13,2 arasında aktivite ölçümleri gerçekleştirildi ve saflaştırılan lipaz enziminin en yüksek aktivite gösterdiği pH değeri tespit edildi.
4.2.8. Lipaz enzimi için optimum sıcaklık çalışmaları
Hardal tohumundan saflaştırılan lipaz enziminin maksimum aktivite gösterdiği sıcaklığı belirlemek amacıyla 0, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60°C sıcaklık değerlerinde 13 farklı deneme yapıldı. Yapılan aktivite ölçümleri sonucunda enzimin maksimum hidrolitik aktivite gösterdiği sıcaklık belirlendi.
4.2.9. Lipaz enzimi için stabil-pH çalışmaları
Hardal tohumundan saflaştırılan lipaz enziminin maksimum aktivite gösterdiği pH değerini belirlemek amacıyla pH 7,0 ile pH 11,0 arasındaki 0,1M sodyumhidrojenfosfat tamponu hazırlandı. Bu tamponlar içerisinde enzim aktivite ölçümleri gerçekleştirilerek hardal tohumu lipazının stabil olduğu pH belirlendi.
4.2.10. Lipaz enzimi için stabil-sıcaklık çalışmaları
Hardal tohumundan saflaştırılan lipaz enziminin maksimum aktivite gösterdiği stabil sıcaklığı belirlemek için 30, 40, 50, 60, 70, 80°C sıcaklıklarda 6 farklı deneme yapıldı. Bu denemelerin sonunda enzimin maksimum aktivite gösterdiği stabil sıcaklık belirlendi.
4.2.11. Lipaz enziminin depo kararlılığı tayini
Jel filtrasyonu kromatografisi sonunda elde edilen lipaz enzimi depo kararlılığının belirlenmesi amacıyla iki hafta boyunca 4C’de buzdolabında saklandı. Buzdolabında muhafaza edilen numunenin üçer gün aralıklarda aktivite tayini ölçümleri yapıldı. Bu şekilde elde edilen enzimin aktivitesini koruduğu süre sınırı belirlenmiş oldu.
4.2.12. Km ve Vmax değerlerinin belirlenmesi
Enzimle katalizlenmiş reaksiyonlar doyumlu olduğu için, kataliz hızları artan substrata doğrusal bir tepki göstermez. Enzimatik reaksiyonlarda, reaksiyonun hızının en yüksek olduğu değerin yarısına eşit olduğu andaki substrat konsantrasyonu Km değerine eşittir ve Km sabit bir
değer almaz. Km değeri pH, sıcaklık ve substratın yapısına bağlı olarak değişmektedir.
Km ve Vmax kinetik sabitlerinin belirlenmesi için enzim kaynağı olarak kullanılan eluatın
sabit hacmine karşılık, substrat olarak kullanılan trioleinin farklı konsantrasyonları (5, 10, 15, 20, 30, 40, 50, 60 mM) kullanılarak aktivite tayinleri yapılmıştır.
Hız değerlerinin substrat konsantrasyonuna bağlı olarak iki parametre arasında çizilen Michaelis-Menten grafiği yardımıyla Km ve Vmax değerleri hesaplanmıştır.
5. SONUÇ VE TARTIŞMA 5.1. Sonuç
Sonuç olarak aktivite tayinleri hesaplamaları tartışılmıştır. 5.1.1. Hardal tohumu lipazının hidrolitik aktivitesinin tayini
Hardal tohumu yapısında yer alan lipaz enziminin hidrolitik aktivite tayini için, saflaştırılan lipazın hidrolizini yaptığı yağ asitlerinin, NaOH ile titrasyon edilmesine dayanan titrimetrik bir proses yolu kullanılmıştır.
Titrimetrik analiz yöntemi ile lipaz aktiviteleri belirlenen homojenat ve elüatın enzimatik aktivite değerleri Çizelge 5.1’de gösterilmiştir.
Çizelge 5.1. Hardal tohumu yapısındaki lipaz enziminin saflaştırma basamaklarında aktivite değişimi.
Saflaştırma Basamağı Aktivite (EU/ml) SpesifikAktivite
(EU/mg.protein)
Homojenat 1,6 0,018
Jel Fraksiyon 12,6 0,682
Çizelge 5.1’den anlaşılacağı gibi saflaştırma işlem basamaklarında iyi hidrolitik spesifik aktivite değerini jel fraksiyonu göstermiştir. Bu durum enzim aktivitesinin saflaştırılmasıyla doğru orantılı olduğunu göstermekte olup, ham ekstrakt çözeltisi ile kıyaslandığında enzim aktivitesi yaklaşık 37,89 kat artmıştır.
5.1.2. Hardal tohumundan saflaştırılan lipaz enziminin saflaştırma basamakları
Titrimetrik analiz yöntemiyle saflaştırılmış lipaz aktiviteleri belirlenen homojenat ve elüat enzimatik aktivite değerleri Çizelge 5.2’de gösterilmiştir.
Çizelge 5.2. Hardal tohumundan saflaştırılan lipazın saflaştırma basamakları. İŞLEM Aktivite (EU/ml) Toplam Hacim (ml) Protein (mg/ml) Toplam Protein (mg) Toplam Aktivite (EU) Spesifik Aktivite (EU/mg protein) Yüzde Verim Saflaştırma Katsayısı Homojenat 1,6 120 88,16 10579,2 192 0,018 100 1 Sephadex G-100 12,6 3 18,48 55,44 37,8 0,682 19,68 37,89
5.1.3. Hardal tohumundan saflaştırılan lipazın optimum pH’nın belirlenmesi
Lipaz enziminin en yüksek aktivite verdiği pH değerlerini belirtmek amacı ile; ➢ 0,1 M pH 4 - 4,4 - 4,8 - 5,2 ve 5,6 asetik asit tamponları,
➢ 0,1M pH 6,4 - 6,8 - 7,2 - 7,6 ve 8,0 sodyumdihidrojen fosfat tamponları, ➢ 8,4 - 8,8 ve 9,2’de tris tamponları,
➢ pH 9,6 - 10,0 - 10,4 - 10,8 ve 11,2’de sodyumbihidrojenkarbonat tamponları
➢ 0,1 M pH 11,6 - 12,0 - 12,4 - 12,8 ve 13,2 sodyumhidrojenfosfat tamponları hazırlandı.
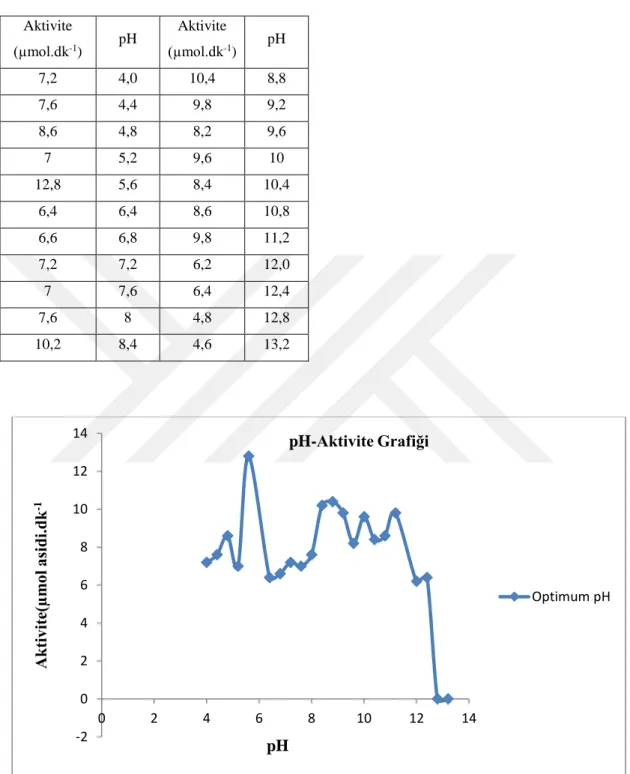
Hardal tohumunun bu tamponları kullanılarak, daha önce lipazın hidrolitik aktivitesi bölümünde belirtildiği gibi aktivite tayinleri yapıldı ve enzimin maksimum aktivite gösterdiği pH değerleri 12,8 olarak belirtildi (Çizelge 5.3 ve Şekil 5.1).
Çizelge 5.3. Hardal tohumu lipazı enziminin optimum pH değerleri. Aktivite (µmol.dk-1) pH Aktivite (µmol.dk-1) pH 7,2 4,0 10,4 8,8 7,6 4,4 9,8 9,2 8,6 4,8 8,2 9,6 7 5,2 9,6 10 12,8 5,6 8,4 10,4 6,4 6,4 8,6 10,8 6,6 6,8 9,8 11,2 7,2 7,2 6,2 12,0 7 7,6 6,4 12,4 7,6 8 4,8 12,8 10,2 8,4 4,6 13,2
Şekil 5.1. pH’ın hardal tohumundan saflaştırılan lipaza etkisi. -2 0 2 4 6 8 10 12 14 0 2 4 6 8 10 12 14 A kti vi te( µm ol asi di.dk -1 pH pH-Aktivite Grafiği Optimum pH
5.1.4. Hardal tohumu lipazının optimum sıcaklığın belirlenmesi
0-60°C aralığında pH 7,0’da hardal tohumu lipazının aktivitesi ölçüldü ve bu ölçümlerin sonunda maksimum hidrolitik aktivite gösterdiği sıcaklığı 60°C olarak belirlendi (Çizelge 5.4. ve Şekil 5.2).
Çizelge 5.4. Hardal tohumu lipazının optimum sıcaklık değerleri. Hidrolitik Spesifik Aktivite
(μmol yağ asidi.dk-1 ) Sıcaklık (°C )
7,4 0 8,4 5 9 10 9,8 15 8,8 20 8,6 25 8,4 30 11,6 35 13,8 40 13,2 45 12,8 50 15,8 55 17,4 60
Şekil 5.2. Sıcaklığın hardal tohumundan saflaştırılan lipaz enzimine etkisi. 0 2 4 6 8 10 12 14 16 18 20 -10 10 30 50 70 Ak tiv it e( µm ol as idi .dk -1 Sıcaklık Optimum Sıcaklık Sıcaklık
5.1.5. Hardal tohumu lipazının enziminin depo kararlılığının belirlenmesi
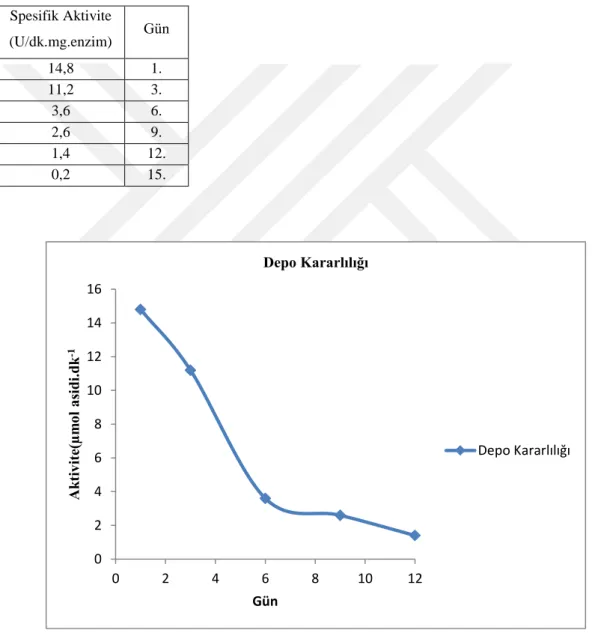
Hardal tohumu lipazının jel filtrasyonundan sonraki formu iki hafta boyuna 4°C’de saklandı ve üç günde bir sabit hacimlerde alınarak standart şartlarda (37°C, pH 7,0 ve substrat: zeytinyağı) aktivite ölçümleri yapıldı (Çizelge 5.5). İki hafta boyunca belirtilen şartlarda saklanan hardal tohumu lipazının aktivite kaybı yaklaşık %98 olduğu görüldü (Şekil 5.3).
Çizelge 5.5. Hardal tohumu lipazının depo kararlılığı. Spesifik Aktivite (U/dk.mg.enzim) Gün 14,8 1. 11,2 3. 3,6 6. 2,6 9. 1,4 12. 0,2 15.
Şekil 5.3. Hardal tohumundan saflaştırılan lipazın depo kararlılığı. 0 2 4 6 8 10 12 14 16 0 2 4 6 8 10 12 Ak tiv it e( µm ol as idi .dk -1 Gün Depo Kararlılığı Depo Kararlılığı
5.1.6. Lipaz enziminin Km ve Vmax değerlerinin belirlenmesi
Hardal tohumundan saflaştırılan lipazın Km ve Vmax değerlerini bulunması amacıyla
trioleinin 10, 20, 50, 100, 200, 500 mM’lık konsantrasyonlarında aktivite ölçümleri yapılmıştır (Çizelge 5.6).
Çizelge 5.6. Hardal tohumundan saflaştırılan lipazın değişik substrat konsantrasyonlarındaki enzim aktivite değerleri.
[S] (mM) V (U/dk.mg enzim) 1/[S] (x 10-3) 1/(U/dk.mg enzim) 1/V (x 10-3) 1/(U/dk.mg enzim) 0 0 -8,181 0 10 0,81 2,39 1,24 20 0,86 1,19 1,17 50 0,92 0,48 1,09 100 0,97 0,24 1,02 200 1,03 0,12 0,97 500 1,07 0,05 0,93
Yukarıda yer alan tablodan yararlanılarak, substrat konsantrasyonuna karşı reaksiyon hızlarının arasında çizilen Michaelis-Menten grafiği verilmiştir (Şekil 5.4).
Şekil 5.4. Hardal tohumundan saflaştırılan lipazın Michaelis-Menten grafiği. 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 1,1 0 5 10 15 20 25 V [S] Michaelis-Menten
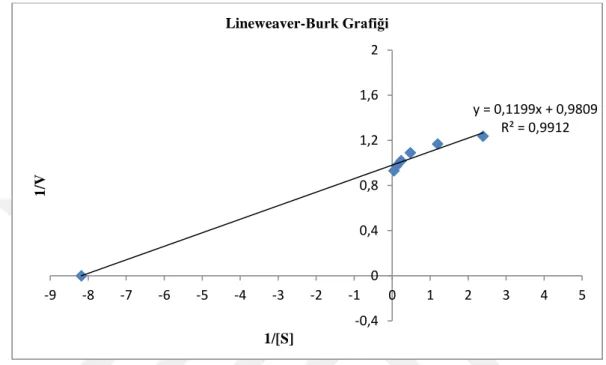
Km ve Vmax değerlerinin hesaplanması için Lineweaver-Burk grafiği çizilmiştir (Şekil
5.5).
Şekil 5.5. Hardal tohumundan saflaştırılan lipazın Lineweaver-Burk grafiği.
5.1.7. Hardal tohumundan saflaştırılan lipazın stabil pH aktivitesi
Hardal tohumundan saflaştırılan lipazın stabil pH’ını belirlemek amacı ile pH 7,0 için 0,1M sodyumdihidrojen fosfat tamponu, pH 8,0-9,0 için 0,1M tris tamponları, pH 10,0 için 0,1M sodyumhidrojenkarbonat tamponu, pH 11,0 0,1 M sodyumhidrojenfosfat tamponları hazırlanmıştır. Bu tamponlar içerisinde yapılan enzim aktivite ölçümleri tespiti sonucunda enzimin stabil olarak kaldığı pH değeri belirlendi.
Çizelge 5.7. Hardal tohumundan saflaştırılan lipazın stabil pH aktivitesi değerleri.
Aktivite (μmol yağ asidi.dk-1) pH/Gün 4,8 5,2 5,6 6,4 6,8 1 11 12,6 14,8 16,8 12,6 2 9,2 10,4 13,8 15,4 12,2 3 7,6 9,6 11,2 12,6 11,6 4 7 9,2 11 12,4 11,2 5 6,6 8,6 10,2 12 10,4 y = 0,1199x + 0,9809 R² = 0,9912 -0,4 0 0,4 0,8 1,2 1,6 2 -9 -8 -7 -6 -5 -4 -3 -2 -1 0 1 2 3 4 5 1 /V 1/[S] Lineweaver-Burk Grafiği
Şekil 5.6. Hardal tohumundan saflaştırılan lipazın stabil pH aktivitesi.
5.1.8. Hardal tohumundan saflaştırılan lipazın stabil sıcaklık değerinin belirlenmesi
Saflaştırılan enziminin en yüksek aktiviteye sahip stabil sıcaklık değerini belirtlemek için 4, 20, 30, 40, 50, 60 sıcaklıklarda 6 farklı sıcaklıkta deneme yapıldı. Bu deneylerin sonunda en yüksek hidrolitik aktivite stabil sıcaklık 4 °C olarak belirlendi.
Çizelge 5.8. Hardal tohumundan saflaştırılan lipazın stabil sıcaklık aktivitesi.
Aktivite (μmol yağ asidi.dk-1) Sıcaklık (°C)/saat 4 20 30 40 50 60 24 14,8 14,8 14,6 17,2 9,6 9,6 48 13,8 14,6 14,2 15 9 9,4 72 11,2 11,6 12,6 10,2 8,6 8,8 96 11 9,6 8,2 7 4,6 2,4 120 10,2 4,4 6,8 6,2 3,4 1,8 0 2 4 6 8 10 12 14 16 18 0 20 40 60 80 100 120 140 Akti vi te(µ m o l a si d i. d k -1 Saat pH 5,6 pH 6,4 pH 6,8 pH 7,2 pH 7,6
Şekil 5.7. Hardal tohumundan saflaştırılan lipazın stabil sıcaklık aktivitesi.
5.1.9. SDS-PAGE ile enzimin karakterizasyonu
SDS-PAGE için; %12’lik ayrıştırma jeli üzerine %3,75’lik yığma jeli ilave edildi. Numuneler tek tek kuyulara yüklendikten sonra 100V’da yaklaşık olarak 2 saat 10 dk yürütülür. Boyama için; %0,1 Coomassie Brilliant Blue R250 ile yapıldı. Yıkama için; %10 metanol ve %7’lik asetik asit ile yapıldı. Bantlar belirginleşince fotoğrafı çekildi.
0 2 4 6 8 10 12 14 16 18 20 0 20 40 60 80 100 120 140 Ak tiv it e( µm ol as idi .dk -1) Saat 4 20 30 40 50 60
Şekil 5.8. Hardal tohumundan saflaştırılan lipazın SDS-PAGE ile karakterizasyonu. Elektroforez sonucuna göre lipaz enzimi, standart ile birlikte değerlendirildi ve enzimlerin saflığı belirlendi.
5.2. Tartışma
Birçok endüstriyel alanda ve sanayide kullanılan lipaz enzimlerinin, günümüzde bir çok bitkisel yapılı olanlar, hayvanlar ve mikroorganizma yapılılardan saflaştırıldığı ve bazı kinetik özelliklerinin incelenmesi konusunda son yıllarda yapılan çalışmalar gün geçtikçe artmaktadır. Lipaz enziminin hardal tohumlarından saflaştırma işlemleri ile ilgili literatür incelendiğinde herhangi bir deneysel çalışmaya rastlanmamıştır. Çalışmamızda hardal tohumundan saflaştırılan lipaz enzimi ilk kez tarafımızdan yapılmış ve çeşitli kinetik özellikleri irdelenmiştir.
Bitki tohumlarının yapısında yer alan yağların yapıdan ayrılması amacıyla çözücü olarak, hekzan, aseton kloroform, izopropanol gibi çözücüler literatürde kullanılan başlıca çözücülerdir. Çalışmamızda hardal tohumundaki yağı uzaklaştırmak için Hird ve grubunun yaptığı çalışmada yürütülen proses şekli hardal tohumu lipazının proteinlerinin yağsızlaştırılmasında kullanılmıştır. Soğuk ekstraksiyon metodu ile protein yapılardan yağları uzaklaştırarak işlem gerçekleşmiştir.
Lipaz enzimlerin birçok bitki, hayvan ve mikroorganizmalardan saf olarak alınması konusunda birçok çalışma yapılmış ve farklı yöntemler kullanılmıştır. Bu yöntemler ve çalışmalar incelendiğinde çeşitli çalışmalarda saflaştırma oranları da değişmektedir. Yapılan
çalışmalarda lipaz, palm meyvesindeki bir bakteriden 1250 kat, pirinç kepeğinden 7,6 kat, ayçiçek tohumundan 603 kat, Aspergillus niger’den 50 kat, sütten izole edilmiş olan Serratia marcescens’ten 20.88 kat olarak ve Pseudomonas sp.’den 37 kat olarak saflaştırılmıştır. Çalışmamızda hardal tohumu lipazı 37,89 kat saflaştırılmıştır. Elde edilen sonuca göre yapılan çalışmada, diğer bitkilerle kıyaslandığında uygunluk göstermektedir.
Enzimin gösterdiği aktivite açısından pH’ın etkisi ve dayanıklılığı üzerine yaptığımız çalışmalar ışığında kayısı tohumu lipaz enziminin optimum pH’sının substratlara göre değiştiği tespit edilmiştir.
Bitkisel yapıda olan ve yapısında yağ ihtiva eden tohumlar üzerine yapılan çalışmalar incelendiğinde lipaz enzim aktivitesinin sıcaklık değerlerinin değişimiyle oluşan etkisi ve dayanıklılığı üzerine de çalışmalar mevcuttur. Optimum sıcaklığın 30-60°C arasında, sıcaklık stabilitesinin de çeşitli sıcaklık aralıklarında olduğu bilinmektedir. Palm yağı (Elaeis guineensis)’ndan lipaz enzimi saflaştırılması çalışmasında optimum sıcaklığının 30°C, acı bakladan lipaz enzimi saflaştırılması çalışmasında ise 25°C olduğu belirtilmiş, Trichosporon asteroide’ten saflaştırılmış lipaz enziminin optimum sıcaklık değerinin 60°C olduğu ve enzimin 70°C’deki sıcaklık değerine karşı stabil değerler olduğu bulunmuştur. Hardal tohumu lipazının sıcaklık stabilitesi üzerinde yapılan çalışmamızda enzimin 10-60°C değerleri arasında farklı inkübasyon sürelerinde dahi kararlılığını koruduğu (fazla bir aktivite kaybının olmadığı) görülmüştür.
Çalışmamızda sıcaklık ve pH stabilite değerleri göz önünde bulundurulduğunda enzimin sıcaklığa dayanıklı bir enzim ve pH stabilitesinin de kararlı bir yapıda olduğu görülmüştür. Substrat özgünlüğü, optimum pH ve sıcaklığa gibi özelliklere bağlı olduğu gibi ısı stabilitesi de enzimin kaynağına bağlı olmaktadır. Saflaştırma işlemine tabii tutulan hardal tohumu lipazının; enzim aktivitesi, optimum sıcaklık değeri ve pH değeri, aktivasyon enerjisi, Km ve Vmax
değerleri, depo karalılığı, stabil sıcaklık ve pH’ı, UV metoduyla absorbsiyon tayini gibi anlizler ayrı ayrı incelenmiştir.
Gopinath ve grubu; Cunnighamella verticillata’dan saflaştırılan mikrobiyal bazlı lipaz emzimini 18.9 kat saflaştırmayı başarmışlardır. Mikrobiyal bazlı lipaz ile %70 doygunlukta hazırlanan amonyum sülfat çöktürmesi işlemi, Tris-HCl tamponu kullanılarak diyaliz çalışması, iyon değişimi kromatografisi, Sephadeks G-100 ile jel filtrasyonu kromatografisi yöntemleri enzimi saf olarak elde edebilmek amacıyla yapılan çalışmalardandır. California-Laurel (Umbellularia California) tohumlarından yapılan çalışma da lipaz izolasyonunda %80 amonyum sülfat çöktürmesi ile saflaştırma işlemine başlanmış, Tris-HCl tamponuna karşı
diyaliz yapılmış, DEAE Sephadeks A-50 ile kolon kromatografi işlemleri yapılarak enzimin saflaştırılması yapılmış ve saflığın 8-20 kat arasında olduğu bulunmuştur. Aspergillus carneus lipazına önce %85’lik amonyum sülfat çöktürmesi daha sonrada hidrofobik etkileşim kromotografisi yöntemi ile saflaştırılmıştır (Saxena vd., 2003). Ceviz tohumu proteinlerini sırasıyla amonyum sülfat çöktürmesi, dializ, sephadex G-100 jel filtrasyonu kromatografisi uygulanarak lipaz enzimi yaklaşık olarak 29 kat saflaştırılmıştır (Demirkan, 2008).
Farklı bitkisel kaynaklardan örneğin; Badem tohumu, fındık tohumu, buğday tohumu ceviz tohumu gibi lipaz saflaştırma çalışmaları da oldukça fazladır. Araştırmacıların lipaz saflaştırma sırasında kullandıkları metotlar yaklaşık olarak bizim çalışmamız ile örtüşmektedir.
Hardal tohumundan saflaştırılan lipazın substrat spesifitesini ölçmek amacıyla, zeytinyağı ve triolein substart olarak kullanılmıştır. En yüksek aktivite değeri trioleinde olarak belirlenmiştir. Doğal kaynaklı yağlar içerisinde ise en yüksek hidrolitik aktivite zeytinyağı kullanılarak elde edilmiştir. Elde edilen veriler literatürde ki çalışmalarla kıyaslandığında Prabhu ve arkadaşlarının yaptığı pirinç kefeğinden saflaştırdıkları lipaz enzimi çalışmasında enzime en uygun substrat olarak tribütirin belirlemişlerdir (Prabhu vd., 1999). Pirinç kepeği kullanılarak yapılan bir başka çalışmada ise en uygun substrat triolein tespit edilmiştir (Bhardwaj vd., 2001). B. Stearothermophilus MC 7 lipazının en uygun substratı tribütirin olarak belirlenmiştir (Kambourova vd., 2003).
Saflaştırma çalışmasına tabii tutulan hardal tohumu lipazının kinetik özellikleri de çalışmada incelenmiştir, Michaelis-Menten (Şekil 5. 5) ve Lineweaver-Burk grafiği (Şekil 5.6) çizilerek triolein için Km değeri 0,1222 mM ve Vmax değeri ise yaklaşık 1,0195 U/dk.mg enzim
olarak tespit edilmiştir. Literatürdeki çalışmalarda lipaz enzimi için belirlenen Km ve Vmax
sonuçları; pirinç kepeğinden saflaştırılan lipaz enziminin triplein için Km değeri 6,71 mM (Bhardwaj vd., 2001), ceviz tohumundan saflaştırılan lipaz enzimi triolein için Km ve Vmax
değerleri ise 48mM ve 0,0023 U/dk.mg enzim (Demirkan, 2008) ve Bacillus Stearothermophilus MC 7 lipazının p-nitrofenil palmitat için Km ve Vmax değerleri sırasıyla 0,33
mM ve 188 U/dk.mg enzim (Kambourova vd., 2003) ve Aspergillus niger F044 lipazının Km ve Vmax değerleri ise 7,37 mM ve 25,91 U/dk.mg enzim (Yu vd., 2007) olarak bulunmuştur.
Karakterizasyon işlemi olarakta elektroforez sonuçları hardal tohumundan saflaştırılan lipazın standartlar ile birlikte değerlendirilmesi sonucunda uygun olduğu tespit edilmiş ve hardal tohumundan elde edilen saflaştırılan lipazın aktivite ölçümlerinden sonra 37,89 kat saflaştırıldığı tespit edilmiştir. Elde edilen sonuçlara göre ülkemizde de bol miktarda bulunan ve
ekonomik anlamda da büyük maliyetleri olmayan hardal tohumundan lipaz enziminin saflaştırılmasıyla çeşitli endüstriyel alanlarda kullanılabileceği düşünülmektedir.
KAYNAKLAR DİZİNİ
Aehle, W., (2004), “Enzymes in ındustry production and application”. Wiley-VCH Verlag, Weinheim,, 2004: 484.
Anonim, (2004), www.fao.org, 2004.
Arıoğlu, H. H., Çalıskan, S., Sögüt, T., Güllüoğlu, L., Zaimoğlu, B., (2003), Türkiye’de yağlı tohum üretimini arttırabilme olanaklarının belirlenmesi üzerine araştırmalar. Türkiye Yağlı Tohumlar Sempozyumu. Bildiri Kitabı, s. 103-114.
Aryee, A. N. A., Simpson, B. K., Villalonga, R. (2007), “Lipase fraction from the viscera of grey mullet (Mugil cepalus) Isolation, partial purification and some biochemical characteristics”, Enzyme and Microbiyal Technolongy,, 2007: 40, 394-402.
Büyükşahin, H. (2008), “Bitkisel yağ sanayicileri derneğinin yağ sektörüne bakışı”, Bitkisel yemeklik yağlar sempozyumu ve sergisinde bildiri.
Catoni, E., (1999), “Overexpression and Protein Engineering of Lipase A and B from Geotrichum candidum CMICC335426, Doctorate Thesis”, Department of Chemistry, University of Stuttgart.
Chang, S. F., Chang, S. W., Yen, Y. H., Shieh, C. J. (2007), “Optimum immobilization of Candida rugosa lipase on Celite by RSM”, Applied Clay Science, 2007: 37, 67-73.
Chen, L., Danial, R. M., Coolbear, T. (2003), “Detection and Impact of Protease Lipase Activities in Milk Powders”, International Dairy Jurnal, 2003: 13(4), 255– 275.
Divakar, S., Manohar, B. (2007), “Use of Lipases in Industrial Production of Esters”, Structure Function and Applications‘, Julio Polaina ve Andrew.
Dutta, S., Ray, L. (2009), “Production and Characterization of An Alkaline Thermostable Curde Lipase from an İsolated Strain of Bacillus cereus C7”, Applied Biochemistry and Biotechnology, 2009: 159, 142 – 154.
Faiz, Ö. (2005), “Yeni bir termofilik bakterinin, Anoxybacillus gonensis A4, hücredışı lipaz/esteraz yeteneğinin incelenmesi ve karakterizasyonu”, Trabzon, Yüksek Lisans Tezi, 2-6. Farias, R,N, Torres M. Canela, R. (1997), “Spectrophotometric determination of the positional specificity of nonspesific and 1,3-spesific lipase”. Analytical Biochemistry, 252(1),186-189. Fucıños, P., Abadín, C. M., Sanromán, A., Longo, M. A, Pastrana (2005), “Identification of extracellular lipases/esterases produced by Partial purification and preliminary biochemical”, Journal of Biotechnology, 117, 233-241.
Gandhi, N. N., Patil, N. S., Sawant, S. B. ve Joshi J. B., (2000), “Lipase-catalyzed Esterification”, Catalysis Reviews-Science and Engineering, 42(4):439-480.
KAYNAKLAR DİZİNİ (devam)
Godfrey, T. ve West, S., (1996), “Introduction to Industrial Enzymology”, Industrial Enzymology, 2nd ed., Macmillan Press London.
https://tr.m.wikipedia.org , (2016).
Jaeger K. E., Schneidinger B., Rosenau F., Werner M. (1997), “Bacterial lipases for biotechnological applications”, Journal of molecular catalysis B: Enzymatic, 3-12.
Jaeger, K, E., Dijkstra, B. W. ve Reetz, M. T. (1999), “Bacterial Biocatalysts: Molecular Biology, Three-Dimensional Structures, and Biotechnological Applications of Lipases, Annu. Rev. Microbiol, 53:315- 351.
Jaeger, K. E. ve Reetz, M. T. (1998), “Microbial Lipases form Versatile Tools for Biotechnology”, Tıbtech, 16:396–403.
Jaeger, K. E., Dijkstra, B. W. ve Reetz, M. T. (1999), “Bacterial Biocatalysts: Molecular Biology, Three-Dimensional Structures, and Biotechnological Applications of Lipases”, Annual Review of Microbiology, 53:315–351.
Jaeger, K. E., Ransac S., Dijkstra W. B., Colson C., Margreet H. ve Misset O., (1994), “Bacterial Lipases”, FEMS Microbiology Reviews, 15: 29-63.
Jaeger, K. E., Ransac, S., Dijkstra, B. W., Colson, C., van Heuvel, M., Misset, (1994), “Bacterial lipases”, FEMS Microbiology Reviews, 15: 29- 63.
Kıran, Ö. E., Çömlekçioğlu, U., Dostbil, N. (2006), “Bazı mikrobiyal enzimler ve endüstrideki kullanım alanları”, KSÜ. Fen ve Mühendislik Dergisi, 2006: 9:12.
Nardini, M. ve Dijkstra, B. W., (1999), “Alpha/Beta Hydrolase Fold Enzymes: The Family Keeps Growing”, Current Opinion in Structural Biology, 1999: 9(6):732-737.
Nelson, D. L., Cox, M. M. (2004), Lehninger principles of biochemistry, Chapter. W. H. FREEMAN, Fourth Edition.
Nelson, D. L., Michael, M. C. (2005), Lehninger biyokimyanın ilkeleri, (Çev.: Nedret K.), 5.Baskıdan çeviri, Palme Yayıncılık Ankara.
Oerlikon, (2010), The fiber year, A World survey on textile and nonwovens industry, 2010: 2009/10.
Pandey, A., Benjamin, S., Soccol C. R., Nigam, P., Krieger, N., Soccol, U. T. (1999), The Realm of Microbial Lipases in Biotechnology, Biotechnol. Appl. Biochem, 1999: 29: 119-131.
Pekin, B., (1980), Biyokimya mühendisliği (Temel ilkeler), Ege Üniversitesi, Kimya Fakültesi Yayınları No 3., İzmir.


![Şekil 5.4. Hardal tohumundan saflaştırılan lipazın Michaelis-Menten grafiği. 00,10,20,30,40,50,60,70,80,911,105101520 25V[S]Michaelis-Menten](https://thumb-eu.123doks.com/thumbv2/9libnet/4362358.73068/34.892.164.778.771.1092/şekil-hardal-tohumundan-saflaştırılan-lipazın-michaelis-grafiği-michaelis.webp)