1
ANTEP FISTIĞI BİTKİSİNDEN (PİSTACİA VERA L.). LİPAZ ENZİMİ SAFLAŞTIRILMASI VE KİNETİK ÖZELLİKLERİNİN İNCELENMESİ
Duygu MERCAN ÜLKÜ Yüksek Lisans Tezi Biyokimya Anabilim Dalı
ANTEP FISTIĞI BİTKİSİNDEN (PİSTACİA VERA L.). LİPAZ ENZİMİ SAFLAŞTIRILMASI VE KİNETİK ÖZELLİKLERİNİN İNCELENMESİ
Duygu MERCAN ÜLKÜ
Dumlupınar Üniversitesi
Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliği Uyarınca Fen Bilimleri Enstitüsü Biyokimya Anabilim Dalında
YÜKSEK LİSANS TEZİ Olarak Hazırlanmıştır.
Danışman: Dr. Öğr. Üyesi Müge GİDİŞ
KABUL VE ONAY SAYFASI
Duygu MERCAN ÜLKÜ’nün YÜKSEK LİSANS tezi olarak hazırladığı “ANTEP FISTIĞI BİTKİSİNDEN (PİSTACİA VERA L.). LİPAZ ENZİMİ SAFLAŞTIRILMASI VE KİNETİK ÖZELLİKLERİNİN İNCELENMESİ” başlıklı bu çalışma, jürimizce Dumlupınar Üniversitesi Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliğinin ilgili maddeleri uyarınca değerlendirilerek kabul edilmiştir.
23/05/2018
Prof. Dr. Önder UYSAL
Enstitü Müdürü, Fen Bilimleri Enstitüsü
---Prof. Dr. Metin BÜLBÜL
Bölüm Başkanı, Biyokimya Bölümü ---
Dr. Öğr. Üyesi Müge GİDİŞ
Danışman, Ebelik Bölümü, Dumlupınar Üniversitesi
---
Sınav Komitesi Üyeleri
Dr. Öğr. Üyesi Müge GİDİŞ
Ebelik Bölümü, Sağlık Yüksek Okulu, Dumlupınar Üniversitesi ---
Prof. Dr. Metin Bülbül
Biyokimya Bölümü, Dumlupınar Üniversitesi
---
Prof. Dr. Eyüp Başkale
ETİK İLKE VE KURALLARA UYGUNLUK BEYANI
Bu tezin hazırlanmasında Akademik kurallara riayet ettiğimizi, özgün bir çalışma olduğunu ve yapılan tez çalışmasının bilimsel etik ilke ve kurallara uygun olduğunu, çalışma kapsamında teze ait olmayan veriler için kaynak gösterildiğini ve kaynaklar dizininde belirtildiğini, Yüksek Öğretim Kurulu tarafından kullanılmak üzere önerilen ve Dumlupınar Üniversitesi tarafından kullanılan İntihal Programı ile tarandığını ve benzerlik oranının % 27 çıktığını beyan ederiz. Aykırı bir durum ortaya çıktığı takdirde tüm hukuki sonuçlara razı olduğumuzu taahhüt ederiz.
ANTEP FISTIĞI (PISTACIA VERA L. ). TOHUMU LİPAZININ SAFLAŞTIRILMASI VE KİNETİK ÖZELLİKLERİNİN İNCELENMESİ
Duygu MERCAN ÜLKÜ
Biyokimya Bölümü, Yüksek Lisans Tezi, 2018 Tez Danışmanı: Dr. Öğr. Üyesi Müge GİDİŞ
ÖZET
Hücresel yapılar için önemli metabolik görevleri olan enzimler çeşitli amaçlarla kullanılmak üzere gündelik ve ekonomik hayata girmiştir. Son yıllarda lipazlar ile katı ve sıvı yağların enzimatik modifikasyonu giderek önem kazanmıştır. Endüstrinin hemen her alanında kullanılan lipazlar genellikle mikroorganizma ve son zamanlarda da yağlı bitki tohumlarından elde edilmektedir. Kolay bulunabilmeleri, katalitik aktivitelerinin çok yüksek olmaları, istenmeyen yan ürün oluşturmamaları gibi avantajları bulunan bitkisel kaynaklı lipazlar gıda, deterjan ve ilaç endüstrilerinde kullanılabilmektedir. Yağların hidrolizlenme yeteneklerinden dolayı lipazlar evlerde deterjan ürünlerinde temizleme etkilerini arttırabilmek amacı ile katkı maddesi olarak kullanılmaktadır. Bu çalışmada bol yağlı bir bitki tohumu olan Antep fıstığı tercih edilmiş ve saflaştrıma işlemleri sonucunda enzim aktiviteleri belirlenmiştir. Yağsızlaştırma işlemi sonucunda aktivite 5 ml NaOH olarak ölçülmüştür. Amonyum sülfat çöktürmesi işleminden sonra ise aktivite ölçümü 8ml NaOH’a kadar arttığı görülmüştür. Kinetik özellikleri belirlenen Antep fıstığı bitki tohumu lipazının stabil ve optimum sıcaklık ve ph değerleri tespit edilip deterjan endüstrisinde kullanılan diğer lipaz enzimleri kinetik özellikleri ile karşılaştırılıp yorumlanmıştır. Antep fıstığı lipaz enzimi kinetik özelliklerinin deterjan endüstrisinde kullanımı uygun bulunmuştur.
Anahtar Kelimeler: Antep fıstığı, lipaz enzimi, deterjan endüstrisi, kinetik özellikler, karakterizasyon
PURIFICATION AND INVESIGATION OF KINETIC PROPERTIES OF LIPASE ENZYME FROM TURPENTINE (PISTACIA VERA L.).
Duygu MERCAN ÜLKÜ Biochemistry, MSc. Thesis, 2018 Thesis Supervisor: Assist Prof. Müge GİDİŞ
SUMMARY
Enzymes with important metabolic functions for cellular structures have entered into everyday and economical life for various purposes. In recent years, the enzymatic modification of lipases and fats and oils has become increasingly important. Lipases used in almost every field of industry are usually obtained from microorganism and recently from oil seeds. Plant-derived lipases can be used in food, detergent and pharmaceutical industries, with advantages such as their easy availability, their high catalytic activity and their inability to form unwanted by-products. Due to the hydrolytic ability of oils, lipases are used as additives with the purpose of increasing cleaning effects in detergent products in households. . In this study, Antep peanut, which is an abundant fatty plant seed, was preferred and enzyme activities were determined as a result of the purification process. As a result of the degreasing process, the activity was measured as 5 ml NaOH. After the ammonium sulfate precipitation, the activity measurement was found to increase up to 8 ml NaOH. The stability and optimum temperature and pH values of Antep peanut plant seed lipase with determined kinetic properties were determined and compared with the kinetic properties of other lipase enzymes used in the detergent industry. The use of antep peanut lipase enzyme kinetics in the detergent industry has been found suitable.
Key Words: Antep peanut (Pistacia vera), lipase enzyme, detergent industry, kinetic properties, characterization
TEŞEKKÜR
Yüksek lisans dönemi boyunca araştırma dönemimde ve tez yazımı aşamasında bana engin bilgileri, sonsuz ilgisi ve sevgisiyle destek olan çok saygı değer hocam sayın Dr. Öğretim Üyesi Müge GİDİŞ’e şükran ve saygılarımı sunarım.
Yüksek Lisans ders dönemi ve laboratuvar çalışmalarımda bana yardımcı olan çok sevgili hocam Prof. Dr. Metin BÜLBÜL’e cok teşekkür ederim.
Araştırmam boyunca her an yanımda olup bana hem manevi destek hem de yardımcı olan sayın Arş. Gör. Ekrem TUNCA ya teşekkürü bir borç bilirim.
Yüksek lisans dönemim boyunca hem maddi hem manevi desteklerini benden esirgemeyen her anımda bana yar ve yardımcı olan çok sevgili annem Ayşe MERCAN ‘a babam Hasan MERCAN ’a ve kardeşim Yunus MERCAN ’a çok teşekkür ederim…
Uzun ve yorucu deney saatlerinde bana ve aileme manevi destek olup uzun zaman bana yardımcı olan çok sevgili eşim Gürkan ÜLKÜ’ye şükranlarımı sunuyorum.
İÇİNDEKİLER
Sayfa ÖZET ... v SUMMARY ... vi ŞEKİLLER DİZİNİ ... xii ÇİZELGELER DİZİNİ ... xiiiSİMGELER VE KISALTMALAR DİZİNİ ... xiv
1. GİRİŞ ... 1
2. ENZİMLER ... 2
2.1. Enzim Tarihçe ... 2
2.2. Enzim Tanımı ve Özellikleri ... 3
2.3. Enzimlerin Adlandırılması ... 4 2.4. Enzimlerin Sınıflandırılması ... 5 2.4.1. Oksidoredüktazlar ... 5 2.4.2. Tranferazlar ... 5 2.4.3. Hidrolazlar ... 6 2.4.4. Liyazlar ... 6 2.4.5. İzomerazlar ... 7 2.4.6. Ligazlar ... 7
2.5. Enzimlerin Yapısal Özellikleri ... 7
2.5.1. Aktif bölgeler ... 8
2.5.2. Katalitik etkinlik ... 8
2.5.3. Spesifiklik... 9
2.5.4. Düzenleme ... 10
2.5.5. Hücre içindeki konumları ... 10
2.6. Enzim Aktivitesi ... 10
İÇİNDEKİLER (devam)
Sayfa
3. LİPAZLAR ... 14
3.1. Lipazların Yapısı ... 14
3.2. Lipazların 3 Boyutlu Yapısı ... 15
3.3. Lipaz Enziminin Arayüzey Aktivasyonu ... 15
3.4. Lipaz Enziminin Kaynakları ... 16
3.5. Lipaz Enziminin Termostabilitesini Etkileyen Faktörler ... 17
3.6. Lipazların Reaksiyonları ... 17
3.6.1. Esterlerin hidrolizi ... 17
3.6.2. Esterlerin sentezi ... 18
3.6.3. Trans esterifikasyon ... 18
3.7. Lipazların Katalitik Özelliklerine Göre Sınıflandırılması ... 19
3.7.1. Spesifik olmayan lipazlar ... 19
3.7.2. 1, 3-Bağlarına spesifik lipazlar ... 20
3.7.3. Yağ asidi spesifik lipazlar ... 20
3.8. Mikrobiyal Lipazlar ... 20
3.8.1. Bakteriyel lipazlar ... 21
3.8.2. Fungal lipazlar ... 22
3.8.3. Bitkisel lipazlar ... 22
3.8.4. Hayvansal lipazlar ... 23
3.9. Lipazların Endüstriyel Uygulamaları ... 23
3.9.1. Deterjan endüstrisinde lipazlar ... 23
3.9.2. Gıda endüstrisinde lipazlar ... 24
3.9.3. Kâğıt hamuru ve kâğıt endüstirisinde lipazlar ... 24
3.9.4. Organik sentezlerde lipazlar ... 24
3.9.5. Zirai ilaç üretiminde lipazlar ... 25
3.9.6. İlaç endüstirinde lipazlar ... 25
3.9.7. Kozmetikte ve kokulu bileşiklerin üretiminde lipazlar ... 25
3.9.8. Ester sentezlerinde lipazlar ... 25
İÇİNDEKİLER (devam)
Sayfa
3.10. Lipazların Analiz Yöntemleri ... 25
3.10.1. Kaltitatif analiz ... 26
3.10.2. Kantitatif analiz ... 26
4. ANTEP FISTIĞI (PİSTACİA VERA L. ) ... 28
4.1. Antep Fıstığı (Pistacia vera L. ) Türü ve Özellikleri ... 28
5. MATERYAL VE METOD ... 32
5.1. Materyal ... 32
5.1.1. Kullanılan kimyasallar ... 32
5.1.2. Kullanılan alet ve cihazlar ... 32
5.2. Metodlar ... 32
5.2.1. Antep fıstığı bitkisinin temini ve yağsızlaştırma işlemi ... 32
5.2.2. Aktivite tayin yöntemi ... 33
5.2.3. Sephadex G-100 jel hazırlanması ile jel filtrasyon kromatografisi ... 33
5.2.4. Saflaştırılan proteinlerin SDS-PAGE ile karakterizasyonu ... 33
5.2.5. Optimum pH çalışmaları ... 34
5.2.6. Optimum sıcaklık çalışmaları ... 34
5.2.7. Depo kararlılığının tayini ... 34
5.2.8. Stabil-pH çalışmaları ... 34
5.2.9. Stabil-sıcaklık çalışmaları ... 34
5.2.10. Km ve Vmax değerleri ... 34
6. SONUÇ VE TARTIŞMA ... 36
6.1. Sonuç ... 36
6.1.1. Antep fıstığı meyvesi lipazının hidrolitik aktivitesinin tayini ... 36
3.16.1.2. Antep fıstığı meyvesi lipazının saflaştırma basamakları ... 36
6.1.3. Antep fıstığı bitki tohumu lipazının optimum pH hesaplanması ... 37
İÇİNDEKİLER (devam)
Sayfa
6.1.5. Antep fıstığı tohumu lipaz enziminin depo kararlılığının belirlenmesi ... 39
6.1.6. Antep fıstığı tohumu lipaz enziminin stabil pH aktivitesi ... 40
6.1.7. Antep fıstığı tohumu lipazının stabil sıcaklığının belirlenmesi ... 41
6.1.8. Lipaz enziminin Km ve Vmax değerlerinin delirlenmesi ... 42
6.1.9. Antep fıstığı tohumu lipaz enziminin SDS-PAGE ile karakterizasyonu ... 44
7. SONUÇ VE TARTIŞMA ... 45
ŞEKİLLER DİZİNİ
Şekil Sayfa
2.1. Laktat dehidrogenaz reaksiyonu. ... 5
2.2. Serin hidroksi metil transferaz reaksiyonu. ... 6
2.3. Üreaz reaksiyonu. ... 6
2.4. Pirüvat dekarboksilaz reaksiyonu. ... 6
2.5. Metil malonil CoA mutaz reaksiyonu. ... 7
2.6. Pirüvat karboksilaz reaksiyonu. ... 7
2.7. Holoenzim şematik gösterimi. ... 8
2.8. Enzim- substrat kompleksi. ... 8
2.9. Bir substratın bir enzime üç noktadan bağlanması. ... 9
2.10. Sıcaklığın enzim aktivitesine etkisi. ... 11
2.11. pH’ın enzim aktivitesine etkisi. ... 12
2.12. Enzim konsatrasyonunun enzim aktivitesine etkisi. ... 12
3.1. Lipaz enziminin 3 boyutlu yapısı. ... 15
3.2. Sulu ve susuz çözeltilerde lipazlar tarafından katalizlenen reaksiyonlar. ... 19
4.1. Türkiye Antep Fıstığı üretimi dağılım haritası ve yıllara göre üretim alanları ... 30
6.1 Antep fıstığı bitki tohumunun lipazının optimum pH’sı. ... 38
6.2. Sıcaklığın Antep bitkisi lipazına etkisi. ... 39
6.3. Antep fıstığı tohumunun lipazının depo kararlılığı. ... 40
6.4. Antep fıstığı tohumu lipazının stabil pH aktivitesi. ... 41
6.5. Anetp fıstığı tohumu lipazının stabil sıcaklık aktivitesi. ... 42
6.6. Antep fıstığı tohumu lipazının Michaelis-Menten grafiği. ... 43
6.7. Antep fıstığı tohumu lipazının Lineweaver-Burk grafiği. ... 43
ÇİZELGELER DİZİNİ
Çizelge Sayfa
3.1. Mikrobiyal lipazların endüstriyel alanlarda kullanımı ... 21
4.1. 100 gr Antep Fıstığında bulunan vitamin ve mineral içerikleri ... 28
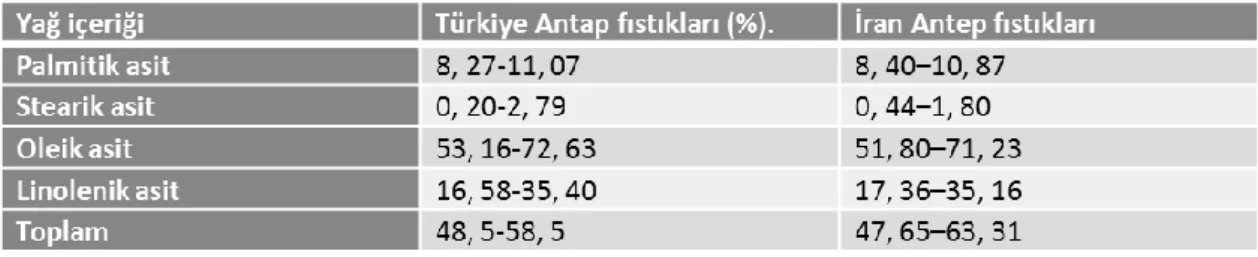
4.2. Türkiye ve İran Antep fıstıklarının yağ içerikleri ... 29
4.3. Dünya ülkelerinde Antep Fıstığı üretim miktarı ve üretim payı. ... 29
4.2. Türkiye 2000-2015 yılları arası Antep fıstığı üretimi. ... 31
6.1. Antep fıstığı lipazının saflaştırma basamaklarında aktivite değişimi. ... 36
6.2. Antep fıstığı lipazının aktivite durumu. ... 36
6.3. Antep fıstığı lipazının optimum pH değerleri. ... 37
6.4. Antep Fıstığı bitki tohumu lipazının optimum sıcaklık değerleri. ... 38
6.5. Antep fıstığı lipazının depo kararlılığı. ... 39
6.6. Antep fıstığı tohumunun lipazının stabil pH aktivitesi. ... 40
6.7. Antep fıstığı tohumu lipazının stabil sıcaklık aktivitesi. ... 41
SİMGELER VE KISALTMALAR DİZİNİ
Simgeler Açıklamadk dakika
EU Enzim Ünitesi
Km Michealis Menteen sabiti
mg miligram
mL mililitre
mM milimolar
nm nanometre
Vmax Doygun substrat konsantrasyonunda enzimin ulaşabileceği max hız
1. GİRİŞ
Enzimler canlı hücrelerde meydana gelen metabolik reaksiyonların çoğunu hızlandıran veya düzenleyen biyokatalizörlerdir. Fizyolojik şartlarda etkiledikleri reaksiyonun hızını 10 üzeri 10- 10 üzeri 12 kat arttırmaktadır. Enzimlerin günlük hayatta kullanımı çok eski medeniyetlere kadar dayanmaktadır. Günümüze kadar yaklaşık olarak 4000 adet enzim modeli açıklanmıştır. Bunlardan da yaklaşık 200’ü gıda, kozmetik, farmasötik, deri, tekstil, kağıt ve deterjan gibi çeşitli ticari alanlarda kullanılmaktadır. Son yıllarda lipazlar, hem sulu hem de susuz ortamda gerçekleşmesi güç reaksiyonları hızlandıran biyokatölizörler olarak ticari hayatta varlığını sürdürmektedir. Lipazlar bitkisel, hayvansal, mikrobiyal veya fungal kaynaklı olabilir. Çok miktarda triaçilgliserol içeren fidan dokularından izole edilir. Bitkilerde enerji depolayan dokularda bulunur. Bitkisel kaynaklı lipazlar oda sıcaklığında yüksek aktiviteye sahip olmaları ve kolay bulunabilmeleri açısından ticari olarak kullanılır. Bitkisel kaynaklı lipazlar, mikrobiyel ve fungal lipazlara göre daha yavaş bir hızla triaçilgliserolleri hidroliz ederler. Varlığı uzun zamandır bilinen ve çeşitli endüstriyel alanlarda kullanılan enzimlerin başında kuşkusuz ki lipaz enzimi gelmektedir. Uzun yıllardır mikrobiyal, fungal ve hayvansal kaynaklı lipaz enzimleri saflaştırılmaktadır. Son yıllarda deterjan endüstrisinde kullanılmak üzere bitkisel kaynaklı lipaz enzimleri saflaştırılmakta ve kullanım alanlarını belirlemek için kinetik özellikleri belirlenerek enzimlerin özgünlüğü ortaya koyulmaktadır. Her enzimin farklı etkileri ve görevleri olabileceği gibi özellikleri belirlenen enzimler kullanım amacına göre sınıflandırılmaktadır. Daha önceki yıllarda yapılan araştırmalar, lipaz enziminin genellikle yağlı bitki tohumlarından saflaşabildiğini göstermektedir(Demirkan, 2008; Kılar ve Bülbül, 2015). Antep fıstığı bitkisi genel itibari ile %55 civarında yağlı bir tohum olmasından dolayı bu çalışma için oldukça uygun bir bitkidir. Bu çalışmadaki amaç Antep fıstığı bitki tohumundan lipaz enzimi saflaştırarak kinetik özelliklerini belirlenmesi ile endüstriyel alanda kullanılabilirliğini tespit etmek ve sonrasındaki araştırmalara referans oluşturmaktır.
2. ENZİMLER
2.1. Enzim Tarihçe
Maya anlamına gelen enzim terimi ilk kez W. Künhe tarafından kullanılmıştır (Aehle, 2007). İnsanlar çok öncelerden beri bilmeden de olsa ezimatik reaksiyonlardan yararlanmıştır. Bunlara başlıca verilebilecek örnekler günlük yaşamımızda da karşımıza çıkan ekmek, maya, kımız, boza gibi gıdalardır. Fermentasyon, bir maddenin oksidatif fosforilasyon olmadığı durumlarda, glikoz yoluyla enerji üretimini sağlayan bir biyodeğişim olayıdır. Bu olay ise gerçekte canlı hücrelerin sahip olduğu enzimler tarafından gerçekleştirilmektedir (Hammamchı, 2014).
İlk kez 1833’de Payen ve Persoz presipitasyon yolu ile alkol kullanarak malt ekstiresinden nişasta sindiren enzimi ayırt etmişler ve bu enzime diyastaz enzimi adını vermişlerdir. Bu keşfin akabinde 1836 da ise Schwan mide suyundan pepsini elde etmiştir. Kristal halde bulunan ilk enzim olan ureaz enzimi 1926 yılında Summer tarafından elde edilebilmiştir. Pepsin, Tripsin gibi diğer kristalize enzimler ise 1930-1936 yılları arasında yapılan çalışmalarla elde edilebilmiştir (Ası, 1996). Genel bir şekilde ifade edecek olunursa, enzimlerle ilgili temel bilgiler ilk 1570 yılında elde edilmiştir. (Gözükara, 1994; Peçe, 2014). Tamamen izole bir enzim üzerinde ilk çalışmayı İsveçli kimyager S.S. Berzelius 1835 yılında gerçekleştirmiştir ve katalizör kavramını ilk defa 1838 yılında ortaya çıkartmıştır.(Keha ve Küfrevioğlu, 2010; Gözükara, 1994; Peçe, 2014). 1838'de Gagnrard ve Schav birbirlerinden habersiz bir şekilde fermantasyonunu incelemiş ve bunun maya denilen bazı mikroorganizmalar tarafından gerçekleştirildiğini açıklamıştır (Gözükara, 1994; Peçe, 2014). 1850'li yıllarda Louis Pasteur şekerin mayayla alkole fermentlenmesinin "fermentler" tarafından katalizlendiği ortaya koymuştur (Cox ve Nelson, 2005; Keha ve Küfrevioğlu, 2010). 1879 yılında W. Kuhne, canlı mekanizmadaki katalizörü diğerlerinden ayırmak için "enzim" ifadesini kullanmıştır. 1885 yılında Blumenthol, peynir yapmak için, ilk defa ‘’rennin’’ enziminin özütünü teknolojik aşamada üretmeyi başarmıştır. Buncher, maya hücrelerinden enzimleri izole etmiştir (Güngör, 2008). 1915 yılında izole edilebilen lipaz ve proteaz enzimlerinin etkileri araştırılarak çamaşır yıkama sularına katılmış ve oldukça etkili bir temizleyici olduğu Rahm tarafından ortaya koyulmuştur. Gözükara, 1994; Peçe, 2014). Bu gelişmler sonucunda 1930'larda 80 adet enzim tanınmakta iken günümüzde ise 2500 enzimin var olduğu bilinmektedir (Gözükara, 1994; Peçe, 2014). Bugün tespit edilen enzimlerin çoğu saf bir şekilde elde edilmiştir ve 200’den fazlası kristellendirilmiştir. Genetik çalışmalar sonucunda da henüz tespit edilmemiş birçok enzimin olduğu bilinmektedir (Keha ve Küfrevioğlu, 2010).
2.2. Enzim Tanımı ve Özellikleri
Enzimler, hücrelerde biyokimyasal reaksiyonları katalizleyen protein yapısında (katalitik RNA moleküllerinin küçük bir grubu hariç) kimyasal reaksiyonları hızlandıran ve gerek olmadıkça hiçbir yan ürün vermeden %100 verimle çalışan, girdikleri reaksiyondan yapısı bozulmadan çıkabilen moleküllerdir (Bülbül, 2014). Kataliz deyimi, Yunanca’da kimyasal reaksiyonlarda etkili olan, reaksiyonu hızlandıran kolaylaştıran anlamında kullanılır (Telefoncu, 1993). Protein yapılı olan enzimlerin en küçük yapıtaşı aminoasitlerdir. Proteinler ve enzimler arasındaki en büyük fark kuşkusuz ki enzimlerin biyokimyasal olayları katalizleme yetenekleridir. (Enzyme Technical Association, 2001; Wolfson vd., 2008). Çok önemli reaksiyonları hücre içinde ve dışında gercekleştirdiği için hayatımızda birçok alanda yer tutmaktadır (Wiseman, 1987). Enzimler düşük aktivasyon enerjisi gerektirirler. Canlı metabolizmalarda yer alan pek çok reaksiyon vücut sıcaklık ve basıncında yürütülebilmektedir. Biyokimyasal tepkimeler genelde farklı bir enzim tarafından katalizlenir. Enzimler katalizledikleri reaksiyonlarda ‘substrat’ ile anahtar kilit modelinde sıkı bir şekilde ilişkide olmasına rağmen, tepkime sonunda zarar görmeden çıkarlar (Çelebi, 1980).
Enzimler canlı organizma yapısında oldukça önemli role sahiptirler. pH sıcaklığının optimum koşulları altındaki sıvı çözeltilerde etkindir. Biyolojik olmayan katalizörlerin hemen hemen hiç biri bu doğal özelliklere sahip değillerdir (Cox ve Nelson, 2005).
Her enzimin katalizlediği biyolojik reaksiyonları için maksimum olduğu pH değerleri mevcuttur. Bu değerler çok önemlidir çünkü eğer bu değerlerin altında ya da üstünde olunursa aktivite düşer. Her enzimin maksimum performansta çalıştığı aktivite eğrileri farklıdır (Sümergen, 2011).
Yüksek sıcaklıklarda biyoteknolojik reaksiyonları gerçekleştirmek oldukça faydalıdır. Sıcaklığın arttırılması organik bileşiklerin çözünürlüğü ve biyolojik kullanılma açışından önemlidir. Sonuç olarak küçük alanda yüksek reaksiyon hızı gerçekleştirilir (Niehaus vd., 1999). Besin öğeleri vücutta enzim yardımı ile kullanılıp kimyasal tepkimeler sonucu vücut yapısına dönüşür. Tüm yaşam boyunca vücudumuzda gerçekleşen olaylar için enzim reaksiyonları gereklidir. Enzimler nükleik asitler yani DNA denetiminde sentezlenir. DNA yapısında oluşan küçük bir hata enzimlerin yanlış sentezlenmesine neden olur. Hatalı sentezlenen enzim etkinlik göstermez (Sharma vd., 2001).
Birçok enzim endüstiriyel alanda kullanılmaktadır. Ticari olarak kullanılan enzimlerin %59 ‘unu proteazlar, %28’ini karbohidrazlar, %3 ünü lipazlar oluşturmaktadır. (Wiseman, 1995).
Enzimlerin saflaştırılması ve kristalizasyonu, enzimoloji açısından büyük bir öneme sahiptir. Fakat sadece bu konu saflaştırma olarak değerlendirilmemelidir. Bu çalışmalar, yaşayan hücrelerde enzimlerin lokalizasyonunun belirlenmesi, fotosentez, solunum biyolojik oksidasyon ve biyokimyasal reaksiyonlardaki görevlerin tespit edilmesi, etki mekanizmasının incelenmesi ve kinetik özelliklerin tüm ayrıntılarıyla belirlenmesini amaçlamaktadır (Yenigün, 2000).
2.3. Enzimlerin Adlandırılması
a) Geleneksel adlandırma;Birçok enzim substrat adının sonuna –az eki getirilerek veya substrat adından sonra katalizlenen reaksiyon tipi ile ilgili bir kelime getirilerek adlandırılmaktadır (Tsai, 2007).
b) Sistematik adlandırma
Enzimler, Uluslararası Biyokimya ve Moleküler Biyoloji Birliğine (IUBMB) bağlı Enzim Komisyonu (E. C) tarafından 4 numara ile tanımlanmaktadır. Örnek olarakta, E. C. X. Y. Z. V şeklinde gösterilmektedir.
Enzim kodlanması;
Sistematik adlandırmadaki 6 ana grup da kendi aralarında katalizledikleri reaksiyonlara göre alt gruplara ayrılmıştır. Her enzim için bir kod numarası verilir. Enzim kod numarasının (E. C). X. Y. Z. V şeklinde 4 rakamdan oluşur. İlk rakam enzim ana grubudur. İkinci rakam alt grubu, üçüncü rakam alt grubu, son rakam ise aynı tip reaksiyonu katalizleyen enzimler arasındaki sırayı gösterir
E.C.3.1.1.3
2.4. Enzimlerin Sınıflandırılması
2.4.1. Oksidoredüktazlar
Oksidasyon ve redüksiyon tepkimeleridir. Bir başka deyişle yükseltgenme ve indirgenme reaksiyonlarının katalizlendiği enzim gruplarıdır (MEGEP, 2007).
Şekil 2.1. Laktat dehidrogenaz reaksiyonu.
2.4.2. Tranferazlar
Alıcı ve verici moleküller arasında hidrojen dışında atom veya atomların transfer edildiği enzimlere denir (Koç, 2013).
Enzim sıra numarası Lipaz
Alıcı Karboksil eser hidrolazı
Alt sınıfı ve etkilediği bağ Ester hidrolazı
Şekil 2.2. Serin hidroksi metil transferaz reaksiyonu.
2.4.3. Hidrolazlar
Bir mol su katılmasıyla bağların hidrolizini katalizleyen enzimlere denir (Bülbül, 2014).
Şekil 2.3. Üreaz reaksiyonu.
2.4.4. Liyazlar
Bileşiklerden su molekülü çıkışı olmadan substratlardan grupların uzaklaştırılması ve çift bağların oluşması reaksiyonlarını gerçekleştiren enzim gruplarıdır (Bülbül, 2014).
2.4.5. İzomerazlar
Molekül içinde değişiklik yapan ve onun uzayda dizilişini değiştiren enzimlere denir (MEGEP, 2007).
Şekil 2.5. Metil malonil CoA mutaz reaksiyonu.
2.4.6. Ligazlar
Enerji kullanılarak yüksek enerjili fosfat bağı içeren bileşiklerden fosfat bağının koparılmasını sağlayan enzimlerdir (Bülbül, 2014).
Şekil 2.6. Pirüvat karboksilaz reaksiyonu.
2.5. Enzimlerin Yapısal Özellikleri
Bazı enzimler yalnız proteinden oluşmuştur. Bu yüzden enzimler proteinlere ait tüm yapısal özellikleri içerirler ve gösterirler. Enzimlerin yapı ve görev bakımından farklı olan ‘apoenzim’ ve koenzim/kofaktör olarak isimlendirilen 2 farklı grubu vardır (MEGEP, 2007).
Apoenzim; protein yapısında ve bu özelliği nedeni ile kolayca denatüre olabilmesi özelliği ile enzimin yalnız belirli reaksiyonları katalizlemesini sağlarlar. Bu tür enzimler aktive olmak için protein yapılarını oluşturan aminoasit kalıntılarına ihtiyaç duyarlar. Fakat bazı enzimler bu tür amino aist kalıntılarına ihtiyaç duymazlar. Bunun yerine aktive olabilmek için
başka kimyasal elementlere ihtiyaç duyarlar. Fe+2, Mg+2, Mn+2, Zn+2 gibi bir veya daha fazla inorganik (Kofaktör) iyon ya da oranik iyonlara (Koenzim) bağlanarak aktive olmaktadırlar. Koenzim ya da kofaktör yapıları tek başına aktive değillerdir. Ancak bir apoenzim ile bağlandığında holoenzim yapısında aktif hale geçmektedirler (Pandey ve Ramachandran, 2006).
Şekil 2.7. Holoenzim şematik gösterimi.
2.5.1. Aktif bölgeler
Enzimlerin ihtiyaç duyulan aktiviteyi göstermeleri için organik madde veya metal iyonlarından oluşan enzimin fonksiyonel bağlanma kısımlarına aktif bölge denir. Enzimlerin reaksiyonları bu aktif bölge denen bu yuvalarda de gerçekleşir (Champe vd., 2007; Adam ve Yiğitoğlu, 2012; Bülbül, 2014). Aktif bölgeye bağlanan ve aktivite gösteren moleküle ise substrat denir. Substrat ve enzim anahtar-kilit modelinde çalışırlar (Şekil.2.8). Bu görüntüye enzim substrat kompleksi denir (ES). Enzim bu kimyasal reaksiyondan bozunmadan çıkar. Enzim bu kompleksten çıktıktan sonra ürünler elde edilir (Adam ve Yiğitoğlu, 2012; Bülbül, 2014).
Şekil 2.8. Enzim- substrat kompleksi.
2.5.2. Katalitik etkinlik
Enzimler biyolojik reaksiyonları katalize ettikleri için genel olarak biyokatalizörler sınıfına girer. Doğal enzimler molekül büyüklükleri bakımından kollaidal tanecikler sınıfına girer. Bundan dolayı kimyasal kataliz yönünden enzimler mikro heterojen katalizörler grubuna girerler. Enzimlerin katalitik aktiviteleri katalize ettikleri reaksiyonun hızının tayini ile hesaplanır.1 mol
aktif enzim tarafından 1 dakikada ürüne dönüştürülen substratın mol sayısına Turnover sayısı denir. Enzim aktivitesi bu sayı ile belirlenir. Turnover sayısına ‘’enzim birimi ya da ünitesi’’ de denilir. Enzim birimi (UI) dakikada 1 mikromol substrat dönüşümünü katalizleyen miligram enzim miktarıdır(Keklikçioğlu, 2009).
2.5.3. Spesifiklik
Enzimler birbirine çok benzeyen substratalar arasında kolayca ayrım yapabilen özel ve özgün moleküllerdir (Cox ve Nelson, 2005). Enzimleri diğer katalislerden ayıran en önemli özelliklerinden biri substrat spesifikliğidir. Örneğin Hidrojen iyonları disakkaritlerin, polisakkaritlerin, lipitlerin ve proteinlerin hidrolizini bunları atırt etmeden yapar fakat bu dördü içinde farklı enzim gerekir. Enzim spesifikliği her bir enzim aktif alanının tek olmasının sonucudur (Stuart, 1995). Enzimler başlıca dört tür spesifite gösterir; Mutlak spesifite, Nisbi spesifite, Sterospesifite, Bağ Spesifikliği.
Mutlak spesifite
Enzim kendine uyumlu bir tek substrata etki eder. Örneğin üreaz, karbonik anhidraz ve fumaraz bu gruba girer. Enzimlerin çoğu mutlak spesifite göstermektedir (http://www.mustafa altinisik.org.uk/89-1-09.pdf).
Nisbi spesifite
Proteolik enzimler ve estraz enzimlerinin örnek gösterilebilineceği bu spesifitede bir enzim birden fazla substrata etki edebilmektedir.
Sterospesifite
Enzimlerin çoğu substratın yalnızca bir steroizomerik haline karşı önemli derece spesifiklik gösterir (Stuart, 1995). (Şekil 2.9). Örneğin Arjinaz enzimi, L-arjinini etkilerken D arjinini etkilemez (Worthingon Biochemical Corparation, 1972; Açıkel vd., 2006).
Bağ spesifikliği
Bağ spesifikliği olan enzimler en düşük spesifikliğe sahiptir. Çünkü bağın çevresindeki yapısal özelliklere bakmaksızın sadece belli bir tipteki kimyasal bağa bağlanırlar. Lipidlerde ester bağların hidrolizini katalizleyen lipazlar bu gruba örnek gösterilebilir (Stuart, 1995).
2.5.4. Düzenleme
Enzimler aktive ve inhibe özelliklerini kullanarak ürünlerin oluşma hızı ve hücrelerin gereken ihtiyaçlarını karşılayacak şekilde enzim aktivitesini düzenleyebilirler (Champe vd., 2007).
2.5.5. Hücre içindeki konumları
Hücrelerde enzimler özel organellere konuşlandırılmıştır. Bu spesifikliği sayesinde substrat ve ürün için yarışan diğer tepkimelerden kendini korur. Tepkimeler için uygun ortam sağlayarak hücrelerdeki bir çok enzimi hedefe uygun şekilde organize eder (Champe vd., 2007; Adam ve Yiğitoğlu, 2012).
2.6. Enzim Aktivitesi
2.6.1. Enzim aktivitesini etkileyen faktörler
Enzimlerin etkinliğini, dolayısıyla kimyasal tepkimelerin hızını arttıran veya azaltan pek çok faktör vardır. Bu faktörler; substrat konsantrasyonu, enzim konsantrasyonu, pH, sıcaklık, su aktivitesi, reaksiyon süresi, reaksiyon ürünleri, enzim inhibitörleri ve aktiviteleri, radyasyon, basınç, kaynama güçleri ve ışık gibi çeşitli fiziksel faktörler ve hormonlardır. Enzimatik bir reaksiyonda reaksiyon hızı bu faktörlerden değişik ve farklı dercelerde etkilenmektedir. Enzimatik reaksiyonlar bir bütün olarak incelenerek aktivite hızı belirlenmelidir (MEGEP, 2006).
Sıcaklık
Sıcaklık artarken tepkime hızıda artış göstermektedir. Fakat bu artış sadece çok küçük bir alanda gözlemlenir. Hız ilk başta sıcaklık artışına bağlı olarak artar (Şekil 2.10). Bu durumun nedeni tepkici moleküllerin kinetik enerjilerindeki artmasıdır. Enzimdeki bu kinetik enerji artışı, en sonunda, enzimin yapısında bulunan zayıf hidrojen ve hidrofobik bağların yıkılmasını sağlayan enerjiyi aşar. Bu sıcaklıkta proteinlerin yapı bozulumu gözlenir ve oluşan çökeleğin katalitik etkinliği yok olur. Vücut sıcaklığını 37 0C'de sürdüren insandan alınan enzimler, 45-55 0C
sıcaklıklarına kadar genellikle kararlı bir haldedirler. Doğal sıcak su kaynaklarında veya okyanus tabanındaki hipertermal akıntılarda yaşayan mikroorganizmalardan temin edilen enzimler 100 0C
veya daha üstü sıcaklıklarda kararlı olabilmektedirler. Isıya tabi tutulma süresi bu yüzden önemlidir. Örneğin, oda sıcaklığındaki birkaç saatlik süre, 150 0C'de birkaç saniyelik süreden
daha denatüre edici etkiye sahip olabilir. Bundan dolayı canlı dokulardan saflaştırılan enzimler, soğuk oda, buzdolabı, derin dondurucu gibi yerlerde korunmalı ve uzun süreli sıcaklığa maruz bırakılmamalıdır.
Enzimler belirli özgün bir sıcaklık derecesinde %100 verimle çalışır. Bu sıcaklık derecesi her enzim için farklılık göstermektedir. Enzimler maksimum derecede %100 verimle çalıştığı bu sıcaklığa optimal sıcaklık denir. Optimal sıcaklık bitkilerde 50-550C’lere yükselebilirken genel
olarak hayvanlarda 36-37 0C’dir. Enzimler bu optimal sıcaklık sınırlarını aşan ortamlarda
bulunduklarında protein yapıları bozunur. Bu yüzden enzim optimal dereceye geldiğinde aktivite en yüksekken bu sıcaklık aşıldığında enzim bozunmaya başlar. Bu yüzden tepkime enzim yokluğunda hızını azaltır (Murray vd., 2004; Ünaldı ve Yöntem, 2011; www.mustafa altinisik.org.uk ).
Şekil 2.10. Sıcaklığın enzim aktivitesine etkisi.
pH
Enzim substrat ve koenzim moleküllerinde asitli veya bazlı grupler içerir. ES komplekslerinin en kararlı şekilde oluşması yani başka bir deyişle hızının maksimum olması için bu grupların belirli bir iyonlaşma durumunda olması gerekir (Tüzün, 1992). Her enzimin aktivitesinin maksimum olduğu pH değeri vardır. Bu pH değerlerine enzimin optimal pH'sı denir (Şekil 2.11). Bu değerlerin altında ve üstünde aktivite hızı yavaşlar (Keha ve Küfrevioğlu, 2010). Enzimlerin optimum pH’sı normal hücre içi pH’sı aynı değildir (Keha ve Küfrevioğlu, 2010). Canlı hücreler ortamın pHının nötre yakın olduğu bilinmektedir. Her enzimin pH’ 3 ile 8 arasında olan bir optimum pH’ı olduğu bilinmektedir. Ancak pek çok enzimin pH’ı 7 ya da 7’ye yakındır.
Enzimlerle yapılan labratuar çalışmalarında reaksiyon ortamının pH’ı bilinmesi gerekir çünkü çok asitli ya da çok bazikli bir ortamda enzim molekülünün yapısı bozulacağından dolayı raksiyon hızı tersinmez 0’a düşmez (Stuart, 1995).
Şekil 2.11. pH’ın enzim aktivitesine etkisi.
Enzim konsantrasyonu
Ortamda bulunan enzim miktarı arttıkça enzimatik reaksiyon hızıda doğru orantılı olacak şekilde artar (Şekil 2.12) (Ünaldı ve Yöntem, 2011).
Şekil 2.12. Enzim konsatrasyonunun enzim aktivitesine etkisi.
Substrat konsantrasyonu
Enzim miktarının sabit tutulduğu bir ortamda substrat yoğunluğu arttıkça, tepkimenin hızı yükselir. Tepkime hızı maksimum seviyeye geldikten sonra sabit kalır. Enzim ile substrat, E+S=ES halindeyken enzim çalışırken enzim görevini yapıp tekrar serbest iken ve birleşmek için substrat araken çalışmaz. Eğer ortamda yoğun bir halde substrat varsa enzim sürekli çalışır
duruma gelir. Bu optimum substrat düzeyinin üzerindeki substrat değerleri, enzim reaksiyon hızına bu yüzden artık katkıda bulunmaz (MEGEP, 2007). Sabit enzim konsantrasyonunda reaksiyonun hızı belli bir aşamaya kadar substrat konsantrosyonuyla artmaktadır. Bu durumdaki artışta ise reaksiyon hızını değiştirmemektedir. Bu durum reaksiyon kinetiklerinin iki fazlı olduğunu göstermektedir.
Zaman
Bir enzim tarafından kataliz edilen bir reaksiyon devam ederken hızı zamanla düşer. Bunun sebebi meydana gelen ürünlerin aralarında birleşerek aksi yönde bir reaksiyon oluşturması, enzimin zamanla inaktive olması, substratın tükenmesi gibi nedenler olabilir (Ası, 1999).
Reaksiyon ürünleri
Reaksiyon sonucu oluşan ürünlerin birleşerek ters yönde bir reaksiyon oluşturmaları durumunda reaksiyon hızı düşebilir. Reaksiyon ürünlerinin bir bölümü ise substratla benzerlik gösterebilir, böylece aktivite yine azalır.
Fiziksel etmenler
Bazı fiziksel etmenler enzimatik aktiviteye etki ederler. Kuvvetli çalkalama, bazı ışınlar enzimin aktivitesini etkileyebilir. Buna örnek olarakda tükrük amilazını verebiliriz. Kırmızı ve mavi ışıklar tükrük amilazının aktivitesini azlatıcı yönde etki gösterirken UV ışınları bunun tam tersi etki göstererek aktiviteyi hızlandırır (Ünaldı ve Yöntem, 2011).
3. LİPAZLAR
3.1. Lipazların Yapısı
Gliserol ester hidrolaz (E. C. 3. 1. 1. 3) veya lipazlar yağ su fazında mono-di-ve trigliseritleri hidrolizleyen enzimleridir. Lipazlar hayvanlar, mikroorganizmalar, bitkiler tarafından üretilebilmektedir. Bazı fasulye ve hububat türleri ve mikroorganizmalar bu enzimin kaynaklarıdır. Mikrobiyal lipazlar, birçok mantar küf ve bakteriden elde edilmektedir (Shahani, 1975).
Lipazların hidroliz tepkime ürünleri digliserid, monogliserid ve yağ asididir ve aşağıdaki gibi reaksiyon izlerler (Brocher ve Holf, 1979).
Trigliserid + H2o Digliserid + Yağ asidi Dliserin+ H2o monogliserin + Yağ asidi Monogliserin + H2o gliserin + Yağ asidi
Lipazlar gliserin ve yağ asitlerinin esterlerinin veya düşük molekül ağırlığındaki alkollerin çeşitli esterlerini hidroliz eder. Her lipaz aynı estere etki etmez örnek verecek olursak esterazlar eteral tuzlar üzerine etkili olurken fosfatazlar esterlerden fosforik asidi ayırırlar. (Sarıışık, 2001). Şu ana kadar farklı türlerden (hayvan, bitki, mikroorganizma) saflaştırılan lipazların üç boyutlu yapılarının birbirine benzerlik gösterdiği görülmüş ve 1990-1995 yılları arasında 11 değişik lipaz türünün yapısı gün ışığına çıkarılmıştır (Öztürk, 2002).
Lipazlar, hem sulu hem de susuz solvent sistemlerinde aktivite gösterdikleri için endüstride ve tıp alanında önemli bir yere sahiptirler. Bu enzimlerin lipid içeren atık suların enzimatik degradasyonu, organik sentez, deterjan formülasyonu, biyosürfektanların sentezi, oleo kimyasal endüstri, süt endüstrisi, agrokimyasal endüstri, kâğıt yapımı, besin, kozmetik, kimyasal analiz ve ilaç prosesinde umut verici uygulama alanları bulunmaktadır. Ticari olarak kullanılabilen lipazlar, genellikle mikroorganizmalardaki geniş çeşitlilikteki ekstraselüler lipazlardır. Mikrobiyal lipazların yüksek biyoteknolojik potansiyelleri; organik solventlerde stabil olmaları, kofaktöre gereksinim duymamaları, genis substrat spesifitesine sahip olmaları ve yüksek enantiyoselektivite göstermelerinden kaynaklanmaktadır (Saraç vd., 2008).
Lipazlar genel olarak tanımlanması gerektiğinde kısaca yağlar ve yağ asitlerini hidrolizleyen enzimlerdir. Lipazlar yağ asitlerininin zincir uzunluğun, doyma derecesi, yağ asidinin pozisyonu ve substratın fiziksel durumuna uygun spesifik gösterirler. 4-10 karbon atomlu
yağ asitleri daha uzun zincirli yağ asitlerinden daha hızlı hidroliz olurlar ve karmaşık yapılı halden serbest hale geçerler (Abbas vd., 2002). Lipazlar, genel olarak C ve N olmak üzere iki kısma ayrılmış bir polipeptit zincirinden oluşur. Bunlardan N-kısmı, katalitik serinden yüzeye kadar uzanan ve uzun bir yağ asidi zinciri taşıyan hidrofobik tünel ile aktif merkezi kapsar (Akoh ve Mın, 1998).
3.2. Lipazların 3 Boyutlu Yapısı
Günümüze kadar yapılan çalışmalarda tüm lipazların karakteristik olarak katalitik grupları içeren merkezi bir Beta bandı ile alfa/beta hidrolaz yapıdaki proteinlerin içyapısı incelendiğinde ise paralel beta kıvrımlı bantların heliks şeklindeki alfa yapıları ile ayrıldığı ve süper heliksel olarak gömülü bir şerit şeklini almıştır (Şekil 3.1) (Malcata ve Hıll, 1991). Merkezi beta bandı ile alfa bandı arasında lipaz aktif bölgesi bulunur. Bu bölgedeki çalışmalar sayesinde aktif bölge varlığı görülmüştür. C ucuna yakın kısımda bulunan histidin amino asidi , üç boyutlu yapıda nükleofilik aminoaside hidrojen bağları ile bağlıdır. Ayrıca bir asidik amino asit yine hidrojen bağı ile nükleofilik amino aside bağlıdır. Bu üçlü grubun, enzimin katalitik aktivitesinde büyük rol oynadığı gözlemlenmiştir (Jaeger vd., 1993).
Şekil 3.1. Lipaz enziminin 3 boyutlu yapısı.
3.3. Lipaz Enziminin Arayüzey Aktivasyonu
Ara yüzey aktivasyonu ilk kez 1936 yılında Holverda vd. ve daha sonrada 1945 yılında Schonheyder ve Vokqvartz tarafından incelenmiştir (Verger, 1997). Sulu bir ortamda monomerlerin en yüksek konsantrasyonuna doygunluk adı verilir. Bu doygunluk noktası triaçilgliseroller için emülsiyon formunun başlangıcıdır. Lipolisis, su yağ ara yüzünün oluşumu ile oluşur. Lipolitik enzimler gurubundan esteraz enzimi (E. C. 3. 1. 1. 1) de lipaz enzimi (E. C. 3. 1. 1. 3) gibi ester bağlarını kırmasına rağmen, esteraz ve lipaz aktiviteleri arasında belirgin
farklar vardır. Esteraz suda çözünebilen substratlara doygunluk noktasına gelmeden etki eder. Fakat lipaz enzimi için bu doygunluk noktası şarttır (Jeager vd., 1994).
3.4. Lipaz Enziminin Kaynakları
Hayvansal ve mikrobiyal kaynaklı lipazların büyük çoğunluğu optimum aktivitelerini pH 5-7 arasında gösterir, fakat kullanılan substrata ve tuzların varlığına bağlı olarak değişir. Lipazlar genellikle optimum aktivitelerini 30-40 oC arasında gösterir (Kurashıge vd., 1989; Nelson vd.,
1977; Grosskopf, 1965).
Lipaz enzimlerinin substratları genelde bitkisel ve hayvansal yağ kaynaklıdır. Zeytinyağı, tereyağı ve sentetik gliseritler literatürde belirtilen substratlar arasında gösterilmektedir. Yağların sıvı ya da katı olması da aktivasyon hızını etkilemektedir. Lipaz enziminin etkisini gösterebilmesi için substrat modelindeki yağın su içinde dağılmış olması gerekir. İncelenen trigliseritlerin içerdikleri yağ asitlerinin doymuş ve doymamış olması da enzimatik parçalamada etkilidir. Hayvansal kaynaklı lipaz eldesi genel olarak lipaz enzimi bakımından zengin olan pankreas oranından sentezlenmektedir. Bitkilerde lipazlar yağlı tohumlardan elde edilir. Az da olsa bazı hububatlardan da elde edilebilir (Mukherjee ve Hills, 1994). Yağ içeriği fazla olan özellikle zeytin, ayçiçeği, fındık bitkilerde lipaz enzimi mevcuttur (Arpigny ve Jaeger, 1999).
Mikrobiyal lipazlar pozisyona bağlı spesifiklerine göre iki grupta incelenmektedir. Birinci grup seçici olayan grup ve trigliseritin her üç pozisyonundan da yağ salınımı sağlarlar. Bu seçici olmayan lipazlar trigliseritlerin tamamının serbest yağ asitlerine ve gliserole hidrolizini gerçekleştirebilirler. İkinci grup ise sadece belirli pozisyonlardaki yağ asitlerini hidrolizlerler. Lipaz enzimleri bazen yağ asitlerine özeldir (Savary ve Densnuelle, 1956; Iwai, 1988).
Ökaryotlarda lipazlar; yağların sindirimi, absorpsiyon yeniden oluşum ve lipoprotein metbolizmasının içinde olduğu lipit metabolizmasının farklı aşamaları için oldukça gereklidir. Bitkilerde lipaz enzimi enerji ihtiva eden dokularda bulunmaktadır (Balashev vd., 2001). Lipazlar doğada oldukça bol bulunmasına rağmen daha önceki yıllarda sadece mikrobiyal lipazlar önem taşımaktaydı (Klibanow, 2001; Saxena vd., 2003). Ayrıca lipazların hayvan ve bitkilerden elde edilmesi daha zordur. Çünkü bu dokularda hücrenin ya da hücre duvarının parçalanması gerekir. Bunun içinde hücre duvarı parçalayıcı enzimlere ihtiyaç duyulur. Bu enzimler ekstrat içine koyulduğunda enzimlere zarar verileceği kaçınılmaz olur (Wiseman, 1995).
3.5. Lipaz Enziminin Termostabilitesini Etkileyen Faktörler
Termofilik mikroorganizmaların ürettikleri enzimler, yüksek sıcaklıklarda optimum aktivite ve stabilite gösterirler. Yüksek sıcaklıklarda enzimlerin stabil kalması, termofilik canlıların ekstrem koşullarda, metabolik faaliyetlerinin devamını sağlayan temel unsurlardan biridir. Lipaz enziminin sıcaklık stabilitesini, hidrojen bağı sayısının artması, beta yapılarının uzaması ve sayıca artması, metallerin varlığı gibi faktörler arttırmaktadır (Tyndall vd., 2002).
3.6. Lipazların Reaksiyonları
Lipaz enzimlerinin reaksiyonlarını endüstiriyel uygulamalara göre aşağıdaki şekilde sınıflandırılmıştır, (Yamane, 1968; Kurashige, 1989).
Esterlerin Hidrolizi Esterlerin Sentezi Trans Esterifikasyon a) Asidolisis b) Alkolisis c) İç esterifikasyon
3.6.1. Esterlerin hidrolizi
Lipazlar ile katı ve sıvı yağların hirolizi sonucunda geleneksel kimyasal metotların kullanıldığı hidrolize göre daha seçilmiş, spesifik yağ asitleri elde edilebilir (Ishida, 1984; Mukataka vd., 1987). Trigiliseritlerin yüksek basınç ve sıcaklık altında geleneksel yöntemlerle elde edilen koyu renkli ürün karışımı ile saflaştırma gerektirmektedir. Enzim katalizli lipolisis reaksiyonları ise daha normal şartlarda yürümektedir. İstenilen özellikte spesifik ürünler elde edilebilmektedir (Macrae, 1989).
Lipazların özellikleri elde edildikleri kaynaklara göre değişkenlik gösterebilirler. (Futumoto vd., 1963). Genel olarak lipazların birçoğu orta uzunluktaki yağ asitlerinin hidrolizini kolaylıkla gerçekleştirebilir.
3.6.2. Esterlerin sentezi
Lipaz enzimlerinin reaksiyonları tersinir reaksiyonlardır. Reaksiyon ortamının nemi reaksiyonun yönünü belirlemektedir. Sistemin nem oranı değiştirilerek hidroliz ve sentez dengesiyle oynanabilmektedir. Eğer sistemde ne fazla ise hidroliz sentezden daha fazladır. (Hensen ve Eigtved, 1985; Lazar ve Seifen, 1985).
3.6.3. Trans esterifikasyon
Asidolisis
Bu reaksiyonlarda trigliserit ve serbest yağ asit karışımları lipaz enzimleri için substrat olarak kullanılır. Asidolisis reaksiyonlarında trigliseritin açil grupları serbest yağ asitleri ile yer değiştirerek yağ asitleri zenginleştirilmiştir ve yeni trigliseritler meydana gelmesi sağlanmıştır (Posorske vd., 1988).
Spesifik olmayan lipazlar, trigliseritlere her üç pozisyonda rastgele yağ asitleri eklerler. Spesifik lipazlar ise sadece 1. Ve 3. Pozisyonda yeni yağ asitlerinin ilave edilmesini sağlayabilmektedirler. Trigliserit asidolisis reaksiyonları ile spesifik özellikte yeni ve değerli ürünler üretilebilmektedir. Örnek vermek gerekirse anlatılan reaksiyon neticesinde yapılan çalışmalarda ucuz ve kalitesiz olan kakao yağından asidolisis reaksiyonu sayesinde daha değerli ve kaliteli kakao yağı elde edilmiştir. Kakao yağı özellikle gıda ve kozmetik endüstrisinde çok fazla aranan maddedir (Choo ve Ong, 1987; Klara, 1985).
Alkolisis
Lipaz katalizli alkolisis reaksiyonları ile bir trigliserit ve yağ alkolünden, balmumu esterleri elde edilebilmektedir. Substrat olarak gliserol trigliseritleri kullanılır. Ve sonuç olarak monogliseritler oluşur (Holmberg ve Osterberg, 1968; Yamane vd., 1987).
İç esterifikasyon
Bir trigiliserit karışımının fiziksel özelliklerinin değiştirilerek, yeni modifiye yağ kompozisyonların elde edilmesi işlemine iç esterifikasyon denir. Bu tür reaksiyonlarla elde edilen ürünler kimyasal katalizörlerle elde edilemez. Bazı tropikal bitkilerin yağları ile yapılan araştırmalarda hurma yağı ve fraksiyonları ile makine yağları, Hindistan cevizi, soya fasulyesi yağının arasındaki 1, 3 spesifik iç esterifikasyon reaksiyonları dikkat çekmektedir (Macrae, 1983).
3.7. Lipazların Katalitik Özelliklerine Göre Sınıflandırılması
Lipazlar hidrolazlar sınıfında yer alır. Yağ asidi esterlerinin hem hidrolizini hem katalinizi sağlarlar. Katalizleme işlemi hidrofilik yüzeyli substratın oluşturduğu bu ara yüzeyde gerçekleşir. Enzim aktivitesi için bu ara yüzey gereklidir. Bu ara yüzeyde su ve yağ vardır (Sökmen, 2005). Lipazlar tarafından katalizlenen bir ester hidroliz-ester sentez reaksiyon mekanizması Şekil.3.2’de gösterilmiştir (Muller vd., 1987; Sökmen, 2005). Bu reaksiyonlar geri dönüşümlüdür. Reaksiyonun ilerleyişi H2O ve R’OH derişimlerine bağlı olmakla beraber suyun fazla olması enzimin hidrolitik aktivitesine, alkolün fazla olması ise sentaz aktivitesine neden olmasıdır (Sökmen, 2005).
Şekil 3.2. Sulu ve susuz çözeltilerde lipazlar tarafından katalizlenen reaksiyonlar.
3.7.1. Spesifik olmayan lipazlar
Spesifik olmayan lipazlar, triaçilgliserollerin tüm pozisyonlarındaki açil gruplarını koparabilme yeteneğine sahiptir. Triaçilgliserolleri, gliserol ve serbest yağ asidlerine kadar parçalarlar. Reaksiyon sonunda ürün olarak mono-, diaçilgliserolleri oluşturur (Sökmen, 2005).
3.7.2. 1, 3-Bağlarına spesifik lipazlar
Bu gruptaki lipazlar, nötral yağları eşdeğer konuma sahip olan 1 ve 3 pozisyonlarından spesifik olan hidroliz ederler. Reaksiyon bittiğinde ise triaçilgliserollerden yağ asidleri 1, 2 (2, 3).-diaçilgliseroller ve 2-monoaçilgliseroller ürün olarak oluşur. Kimyasal olarak kararsız halde bulunan 1, 2 (2, 3).-diaçilgliserol ve monoaçilgliseroller sırasıyla 1, 3diaçilgliseroller ve 2-monoaçilgliserollerle izomerleşir. Bu şekilde izomerleşen bu ürünler tekrar substrat olarak kullanılabilir. 1, 3 bağlarına spesifik lipazlarda spesifik olmayan lipazlar gibi triaçilgliserolleri gliserol ve serbest yağ asdilerine kadar parçalayabilirler (Sökmen, 2005).
3.7.3. Yağ asidi spesifik lipazlar
Yağ asidi spesifik lipazlar açilgliserollerdeki bazı asidlerine spesifiktir. Sadece bu yağ asidlerinin oluşturduğu ester bağlarını parçalarlar (Sökmen, 2005). Bu gruptaki lipazlar esterleşme reaksiyonunda kullanılırsa oluşacak ürünler çok sınırlı olup amaca uygun triaçilgliseroller sentezleyebilmektedirler (Akşamoğlu, 1997).
3.8. Mikrobiyal Lipazlar
Enzimler hakkında bilgiler çok eski zamanlara dayanır. Mikrobiyal yolla üretimi son zamanlarda önem kazanmıştır (Çizelge 3.3). İlk kez 1987’de Bucher yaşayan hücreden aktif enzim saflaştırılabileceğini göstermiştir. Küf enzimlerinin ilk kez ticari olarak kullanılmaları 20. Yüzyılın başında başlarken, bakteriyel enzimlerin kullanımı ise 1. Dünya savaşı sıralarında başlamıştır (Casid, 1968).
Çeşitli yağ esterlerin hidrolizlerini katalizleyen lipazlar, hayvan, bitki ve mikroorganizmalar tarafından üretilirler. Bunların içinde özellikle mikrobiyal kökenli lipazlar ticari olarak önemli yer tutar (Ghos, 1996). Bu mikroorganizmalar yalnızca enzim üretme yeteneklerine göre değil, mikroorganizmaların toksik ve patojen olmasına göre seçilirler. Bugün endüstride kullanılan birçok enzim mikrobiyal kaynaklıdır (Demain ve Solomon, 1981). Lipaz üreten mikroorganizmalar, endüstriyel atıklar, sebze yağı üreten fabrikalar, mandıralar, yağ içeren tohumlar, çürümüş gıdalar gibi farklı yaşam habitatlarından elde edilebilir. Tek bir sudan birçok farklı enzim elde edilebilinir. Ve bu enzimler farklı genetik orjine sahip olabilirler ya da farklı bir amino asidin modifikasyonu sonucu üretilebilinirler (Seren, 2013).
Çizelge 3.1. Mikrobiyal lipazların endüstriyel alanlarda kullanımı (Sharma vd., 2001)
3.8.1. Bakteriyel lipazlar
Bakteriyel lipazlar, bitkisel ve hayvansal lipazlara göre daha kolay elde edilebilirliği yüzünden daha çok tercih edilir. Bu durumun başlıca nedeni mikroorganizmaların kolay yetiştirilebilmesi ve genetiklerine kolayca müdahale edilebilinmesidir (Patil vd., 2011). Yapılan deneysel çalışmalarda Bacillus prodigiosus, B pyocyaneus ve B. fluorescens’ de bu enzimlerin varlığı görülmüştür. Günümüzde en çok çalışılan, lipaz üreten bakteriler; Serratia marcescens, P. aeuginosa ve P. fluorescens dir (Arpigny ve Jeager, 1999). Bakteriyel lipazların bazıları glikoprotein yapıda bazıları lipoprotein yapıdadır. Bu organizmaların gelişmesi için besin ihtiyaçları yağ, şeker ve çeşitli karbon kaynaklarıdır (Uluğ, 2011).
Lipaz üretimi için bakteri seçimi
Lipaz sentezi için seçilecek olan bakteri türünde aranılacak ilk özellik tabiki de lipazı bol üretmesidir. Bunun dışında bakteri seçim parametreleri aşağıdaki gibidir (Jeager ve Eggert, 2002).
Kısa bir fermantasyon süresinde organizma bol lipaz verimi sağlamalıdır.
Ektraselüler enzim üretimi tercih edilir bunun nedeni hücre zarı ve mabranı parçalamadan enzim izalasyonu sağlamaktır.
Seçilecek bakteri türü toksik madde ve antibiyotik üretmememlidir., ucuz besi yeri ortamında kolayca ve hızlı bir şekilde üreyebilmelidir. Enzime zarar verecek yan ürün oluşturmamalıdır.
Bakteri enzim verimliliği açısından kararlı olmalıdır.
Kültürler saflaştırma işlemleri sırasında (filtrasyon veya santrifüjleme) problem çıkarmamalıdır.
İntraselüler enzimler durumunda hücreler kolayca parçalanmalıdır.
3.8.2. Fungal lipazlar
Fungal lipazlar ile ilgili çalışmalar ilk olarak 1950’li yıllarda başlamıştır. Bundan sonra birçok araştırmacı termal stabilite, substrat özgüllüğü ve organik ve organik çözücülerdeki aktivitelerinden dolayı enzim kaynağı olarak önemli olduğu belirtilmiştir (Ghos vd., 1996). Fungal lipazlarları elde etme maliyeti düşük olduğundan dolayı ve daha kararlı olmaları da göz önüne alınınca bakteriyel lipazlardan daha yararlı olduğu gözlemlenmiştir (Patil, 2011). Ticari lipaz üreticileri başlıca şunlardır. Aspergillus niger, A. terreus, A. carceus, R. delemar, Mucor miehei (Ghos ve vd., 1996). Genellikle çalışmalarda toprak, limon, ekmek gibi ortamlardan elde edilen funguslar kullanılır (Demirkan, 2008). Son yıllarda yapılan araştırmalara göre fungal lipaz üretimine besiyeri içeriğinde bulunan glikoz, nişasta, maltoz ve fruktoz gibi karbon kaynaklarından en iyi lipaz üretiminin fruktoz bulunan ortamda olduğu tespit edilmiştir (Thota vd., 2012)
3.8.3. Bitkisel lipazlar
Bitkilerde enerji depolayan ve çok miktarda triaçilgliserol içeren fidan tohumlarından elde edilen lipazlar genellikle oda sıcaklığında yüksek aktiviteye sahiptirler. Bitkisel kaynaklı lipazlar kolay bulunabilmeleri ve düşük maliyetli olmaları sebebi ile endüstiri alanında çokca tercih edilir. Bitkisel lipazlar mikrobiyal ve hayvanlsal kaynaklı lipazlara göre daha düşük hızla triaçilgliserolleri hidroliz ederler (Sökmen, 2005; Patil, 2011).
Bitkisel kaynaklı lipazlar lipidlerin biyotransformasyonu için biyokatölizör olarak gününüzde çok önem kazanmıştır. Hint yağı bitkisi lipazının trisinoleine, palmiye yağı lipazının trikoprin veya trilavrine karşı ilgisinin daha fazla olması bitkisel lipazların substrat seçiciliğinin olduğunu gösterir (Sökmen, 2005). Farklı bitkisel kaynaklardan izole edilen lipazlar vardır, örnek olarak buğday tohumu (Kapranchikov, 2004), badem tohumu (Başkurt, 2005), fındık tohumu (Kılıç, 2003), kayısı çekirdeği tohumu (Sökmen, 2005) ve pamuk tohumu (Akbulut, 2014) sayılabilir. Ağaçların değişik türlerinden de lipaz elde edebilmenin mümkün olabileceğini de
Teksas’tan Kuzey Kalifornia’ya kadar uzanan kıyı şeridinde yetişen Sapiun sebiferum’den (Çin don yağı ağacı) elde edilen lipaz enzimi ile literatüre kaydeilmiştir (Gao vd., 2008).
3.8.4. Hayvansal lipazlar
Hayvan kaynaklı lipazlar zengin bir kaynağa sahiptir ancak mikrobiyal kaynaklı lipazların kullanışlılığı nedeni ile çok fazla çalışma konusu olamamıştır. Bu duruma rağmen birçok böcek, balık ve memeliden lipaz elde edilmiştir. Hayvansal lipazlar endüstiride yağların sindirimi konusunda önemli yer tutmuştur (Walton ve Cowey, 1984; Patil vd., 2011).
Balıklardan lipaz eldesi de son dönemlerde yapılan çalışmalar olmuştur. Kefalin sindirim organlarından izole edilen lipaz enzimi de hayvansal kaynaklı lipazlara örnek gösterilebilir. Bununla birlikde bir çok balık türünden (Atlantik morinası, leopar köpek balığı, gök kuşağı alabalığı, sardunya, çizgili levrek, somon balığı gibi) yağlı dokularından lipaz elde edilmiştir (Aryee vd., 2007). Tunus’un bir bölgesinde canlı yakalanan yengeçlerin pankreası çıkarılmış 20
oC saklanmış ve lipaz elde edilmiştir (Cherif vd., 2007).
3.9. Lipazların Endüstriyel Uygulamaları
Lipazlar; yağlar, deterjanlar, kimyasallar ve ilaçların sentezinde, kâğıt yapımında kozmetik üretiminde gayet geniş bir kullanım alanına sahiptir. (Saxena vd., 2003; Shu vd., 2005; Michail vd., 2006). Endüstriyel lipazların çoğu mikrobiyal kaynaklıdır ve genellikle küf mantarı ve bakterilerden elde edilmektedir. Doğal kaynaklardan ekstrasyonla elde edilen lipazlar az çalışılmış bir alandır (Prabhu vd., 1999).
3.9.1. Deterjan endüstrisinde lipazlar
Kıyafetlerimizi kirleten unsurların en önemli nedenleri proteinler, yağlar ve nişastadır. Bu lekeleri yüksek sıcaklıkta kimyasal deterjanlar ile gidermek mümkündür. Fakat enzimler sayesinde bu enerji en az seviyeye indirilebilir. Ayrıca çimen, kan ve süt lekerini çıkarmada biyolojik olmayan deterjanlar ile karşılaştırıldığında çok daha etkili olduğu gözlemlenmiştir (Kıran vd., 2006). Deterjan yapımında enzim kullanımı, endüstriyel alanda artmıştır. Deterjanlarda kullanılması için lipazın, termostabil ve makinede yıkanma alkali ortamda aktif kalmaya gereksinimi vardır. Yaklaşık 1000 ton lipaz her yıl yaklaşık 13 milyon ton deterjan üretiminde kullanılmaktadır (Sharma vd., 2002).
Yağları hidrolizleme yeteneklerinden dolayı lipazlar endüstride ve evlerde kullanılan deterjanlarda katkı maddesi olarak kullanılır. (Demirkan, 2008). Deterjanlarda kullanılan lipazların avantajları şunlardır;
Düşük substrat spesifitesine sahiptirler ve değişik bileşenlerdeki yağları hidrolizleyebilirler.
Yüksek pH (10-11) ve yüksek sıcaklıklara (30-60 oC) dirençlidir.
Zarar verici surfaktanlara ve enzimlere dayanabilirler.
Lipaz enziminin bu avantajları sayesinde deterjan endüstrisinde önemli yeri vardır (Kazlauskas ve Bornscheuer, 1998; Cardenas vd., 2001; Joseph vd., 2008).
3.9.2. Gıda endüstrisinde lipazlar
Yağlar ve yağ asitleri gıdaların önemli bileşenleridir. Lipazlar, trigliseridlerdeki yağ asitlerinin yerlerini yer değiştirir ve lipidlerin özelliklerinin değiştirilmesini ve arzu edilen lipidlerin elde edilmesini sağlar (Undurraga vd., 2001; Dalla Rosa vd., 2008).
Gıda endüstrisinde önemli yer tutan lipazlar çok geniş kullanım alanına sahiptir. Mandıra ürünlerinde güzel koku oluşturmasında, tereyağına aroma kazandırma işleminde faydalanılmıştır (Yılmaz, 2010). Çikolatada bulunan yağların 37 oC’de erimesi aranan özelliktir. Lipaz
enzimlerinin katalizlediği hidroliz ve sentez reaksiyonları sayesinde bu yağların yerine başka yağlarda kullanılabilir (Sharma, 2001; Undurraga vd., 2001). Ayrıca terayağının lipaz katalizörü interesterifikasyon reaksiyonu ile uzun zincirli doymuş yağ asitlerinin yerine doymamış yağ asitlerinin geçmesi sağlanmıştır (Sharma vd., 2001). Farklı kaynaklardan elde edilen lipazların her biri peynire ayrı bir tat verir (Kumar vd., 2005; Türk, 2008). Lipazlar ayrıca içki sanayinde de katkı maddesi, et ve balık ürünlerinden yağların uzaklaştırılması işlemlerine yardımcı olarakda kullanılabilirler (Kazlauskas vd., 1998; Kumar vd., 2005).
3.9.3. Kâğıt hamuru ve kâğıt endüstirisinde lipazlar
Ağaç sakızı ve odunun hidrofobik bileşenleri kâğıt hamuru ve kâğıt üretiminde birçok probleme sebebiyet vardır (Jeager; 1998) kâğıt yapımında ziftin hamurdan uzaklaştırılması için lipaz enzimi kullanılmaktadır. Japonlar kâğıt üretiminde odun triaçilgliserolllerin %90’dan fazlasını hidroliz etmek için Candida rugosa adlı bir mantar lipazını kullanmıştır (Sharma vd., 2001).
3.9.4. Organik sentezlerde lipazlar
Organik kimyada katalizör olarak kullanılan lipazların büyük çoğunluğu mikrobiyal kökenlidir. Bu enzimler hidrofilik ve lipofilik yüzeyler arasında çalışmaktadır. Ve reaksiyon karışımındaki organik çözünenleri tolere ederler(Ghos vd., 1996; Yılmaz, 2010). Organik
kimyasal sentezlerde lipazların kullanımı, sürekli artış gören ticari bir kar payına sahip olmaya başlamıştır (Rubin, 1997).
3.9.5. Zirai ilaç üretiminde lipazlar
Lipazlar bitkilerde bulunan böcek ve haşerelere karşı insektisid olarak kullanılan bazı enantiomerik ilaçların üretiminde de kullanılmaktadır (Sökmen, 2005).
3.9.6. İlaç endüstirinde lipazlar
Kimyasal yollarla elde edilemeyen ilaçların sentezinde, kiral bileşikler elde etmek için lipaz enzimlerinden yararlanılır (Kierkels, 1990).
3.9.7. Kozmetikte ve kokulu bileşiklerin üretiminde lipazlar
Lipazlar koku ve tat veren maddeleri sentezlediklemelerinden dolayı kozmetik ve parfüm endüstrisinde tercih edilmektedir (Türk, 2008).
3.9.8. Ester sentezlerinde lipazlar
Lipazlar ester sentezinde katalizör olarak kullanılır. Kısa zincirli yağ asitlerinden esterler üretilir ve bu esterler gıda sektöründe tatlandırıcı olarak yararlanılır (Rhehlik, 2006). Bitkisel yağların esterifikasyonu sayesinde elde edilen biyodizel yakıt olarak kullanılmaktadır (Gao vd., 2008; Lu vd., 2006).
3.9.9. Yağ endüstrisinde lipazlar
Yağ endüstrisinde lipazların kullanımı enerjinin kullanımını sağlarlar ve reaksiyonlar sonucu sıcaklıkta bozulmalarını en aza indirgerler (Vulfson, 1994; Bornsceuer, 2000).
3.10. Lipazların Analiz Yöntemleri
Enzim aktivitesinin tayini aslında enzimatik reaksiyonun hızının belirlenmesi tayinidir. Bu nedenle aktivite için kullanılan yöntemler hız içinde kullanılabilir. Aktivite tayininde ya kaybolan substrat miktarı ya da meydana gelen ürüne bakılarak tayin yapılabilmektedir. Lipazlar trigliseritleri hidrolize ederler ve serbest yağ asitlerinin oluşmasına neden olur. Bu nedenle, bu enzimler için analiz metodları genel olarak serbest yağ asitlerinin oluşumunun analizi etrafında şekillenmiştir (Beisson vd., 2000).
3.10.1. Kaltitatif analiz
Lipaz üreten suşlar geleneksel olarak tribütirin agarda incelenir Dört karbonlu sentetik bir trigliserid olan tribütirinin hidrolizi ile oluşan zon ya esteraz ya da lipaz aktivitesini gösterir Ayrıca Tween 20 ve Tween 80’li besiyerlerinde de bakteri kolonilerinin etrafında kristalleşmenin görülmesi esteraz veya lipaz aktivetesini göstermektedir. Yapılan bazı çalışmalarda, zeytinyağı ilave edilen katı besiyerleri lipaz pozitif kolonilerin araştırılmasında kullanılmıştır (Haki ve Rakshit, 2003).
Alternatif olarak katı besiyerlerine indikatör eklenerek renkli zon oluşumu gözlenmiştir. Nile blue sülfat, victoria blue, metil red, fenol red indikatör olarak kullanılmıştır (Beisson vd., 2000).
3.10.2. Kantitatif analiz
Titrimetri
Hidrolaz sınıfı enzimlerin katalizlediği reaksiyonların hemen hemen hepsinde H + açığa çıkar. Oluşan H+ konsantrasyonu reaksiyon hızı ile orantılıdır (Beisson vd., 2000). Özellikle substratları suda iyi çözünmeyen hidrolazların aktivite tayinleri için titrasyon çok uygun bir yöntemdir. Burada substrat olarak uluslararası kabul gören triolein veya buna ucuz bir alternatif olan zeytinyağı 24 kullanılır. Bununla birlikte lipazlar, kısa zincirli triaçilgliserollerle karşılaştırıldığında, triolein gibi uzun zincirli triaçilgliserolleri daha yüksek oranda hidrolize etmektedir (Jaeger ve Eggert, 2002). Lipolitik reaksiyonda, asidin serbest bırakılması titrimetrik olarak analiz edilebilir. Nicel yöntemde reaksiyon yönünde pH ölçülür. Titrimetrik metotlar zamana bağlı olarak serbest yağ asitlerinin serbest bırakılmasıyla sodyum veya potasyum hidroksitin nötralizasyon oranını ölçmektedir
Spektrofotometrik yöntem
Genel olarak yağ asidi zinciri çeşitli uzunluğa sahip p-nitrofenil esterleri substrat olarak kullanılır ve meydana gelen p-nitrofenol 410 nm’de spektrofotometrik olarak ölçülür. Kısa zincirli esterler suda çözünür ve o nedenle bu hidroliz lipaz aktivitesinden ziyade esteraz aktivitesinin ölçülmesini sağlar. Bununla birlikte pnitrofenil palmitat lipaz aktivitesinin ölçülmesi için kullanılır. Bu analiz için sınırlayıcı olan enzimatik aktivitenin asidik pH’da p-nitrofenol’ün absorbans vermemesinden dolayı asidik pH’da yapılamamasıdır. Enzimatik aktivite sadece nötral veya alkali pH değerlerinde bu prosedürle tespit edilebilir (Kouker ve Jaeger, 1987).
Florimetrik analiz
Floresan bileşikler lipaz analizi için kullanılırlar. Metod, lipaz aktivitesinden dolayı serbest bırakılan floresan yağ asitlerinin ölçümünü gerektirir. Triaçilgliserollerin alkil grubunun, pirenil gibi floresan grupla yer değiştirmesiyle analiz gerçekleşir. Floresan özellikte serbest pirenil grupları oluşur. Triaçilgliseroller hidrolize olduktan sonra pürin grupları 400 nm’de yer değiştirir. Floresan olmayan metilum belliferil oleat substratı, lipaz etkisinden sonra floresan 4-metilum belliferon’un serbest bırakır. Hızlı bir yöntem olmasına rağmen substratların pahalı olması bunların kullanımını sınırlandırmaktadır (Jacks ve Kircher, 1967).
Kromatografik prosedür
Kromatografi; lipit substratında, enzim katalizinin hidrolizini takiben serbest bırakılan yağ asitlerinin direk tespit edilmesi için kesin bir metottur. Spesifik kolonlar vasıtasıyla ürün veya artakalan substratın miktar tayini ve analizi yapılır. Rutin analizler için zaman alıcı olmasına rağmen substrat spesifikliğinin tayininde kullanımı tavsiye edilmektedir. TLC; triaçilgliserollerden serbest yağ asitlerinin kalitatif analizde, işaretlenmiş triaçilgliseroller densitometrik veya autoradiografik metotları kullanılarak uygulanır. Bunlar çok hassas metotlar olmalarına rağmen zaman alıcıdır. GC; resmi American Oil Chemists Society metoduna göre; yağ asitleri bunların metil esterlerine çevrilir ve GC ile miktar tayinleri yapılır. High Performance Liquid Chromatography (HPLC); lipolizis ürünleri kolaylıkla HPLC kullanılarak tanımlanabilir. Naftil laurat’ın substrat olarak kullanıldığı Maurich tarafından lipaz aktivitesini tanımlanması için HPLC metodu geliştirilmiştir (Maurich vd., 1991).
4. ANTEP FISTIĞI (PİSTACİA VERA L. )
4.1. Antep Fıstığı (Pistacia vera L. ) Türü ve Özellikleri
Ülkemiz antep fıstığı üretimi bakımından önemli bir yere sahiptir ve GAP projesi tamamlanması ile üretimde yüksek oranda artış olmuştur (Pala vd., 1994).
Antep fıstığı (Pistacia vera L.), sakız ağacıgiller familyasından, kabuklu bir meyve türüdür. Yağlı ve ince kabuklu olan bu meyve ağaçta yetişir (MEGEP, 2010). Antep fıstığı en eski sert kabuklu meyvelerden biridir. Antik çağlarda kral sofralarında yer aldığı ve elit sınıflar tarafından tüketildiği bilinen Antep Fıstığının kültüre alınış tarihi Eti Uygarlığına dayanır. Birinci yüzyılın başlarında doğal yetişme alanlarından biri olan Suriye’den İtalya’ya götürülmüş ve diğer Akdeniz ülkelerine yayılmıştır (Gül ve Yavuz, 2011).
Lezzetli bir meyve olan Antep fıstığı sert kabukludur ve sert kabuklu meyvelerin streoller, vitaminler, mineraller, yağ asitleri, fenolik bileşikler dâhil olmak üzere sahip olduğu besin bileşenleri, antioksidan ve antiproliferatif özellikleri onu daha cazip hale getirmektedir (Tsantili vd., 2011). Antep fıstığının ağırlıkça vitamin ve mineral içerikleri Çizelge 4.1’de verilmiştir (Gül ve Yavuz, 2011).
Çizelge 4.1. 100 gr Antep Fıstığında bulunan vitamin ve mineral içerikleri (Gül ve Yavuz, 2011).
Yapılan çalışmalar neticesinde Türkiye’de yetişen Antep fıstıklarının yağ içerikleri %54-60 aralığında olduğu tespit edilmiştir. Fakat Antep fıstığının anavatanı olarak kabul gören İran fıstıklarıyla aralarında yağ asidi içerikleri ile farklılık göstermiştir. Aşağıdaki çizelgede bu oranlar verilmiştir (Seferoğlu vd., 2006).