1
1.GİRİŞ
DMAH’ lar kimyasal, enzimatik, ultrasonografik veya gamma irradyasyon yöntemleri kullanılarak standart heparinin depolimerizasyonu sonucu elde edilirler (1). Günümüzde değişik yöntemler kullanılarak pek çok DMAH üretilmiş ve ticari olarak kullanıma sunulmuştur. Molekül ağırlığını azaltırken etkileşime girdiği proteazlara etkisi değişmekte, trombine olan etkisi azalmakta, ancak anti-Xa aktivitesi devam etmektedir (2).
D vitamini, kemik metabolizması ve nöromüsküler fonksiyonlar için önemli rolleri olduğu bilinen steroid yapıda bir hormondur. Pek çok vertebralı organizma D vitamini ihtiyacını yeterli güneş ışığı maruziyeti ile deriden fotokimyasal yolla sentezleyerek sağlar. Bu yüzden, D vitamini gerçek bir vitamin değil bir prohormondur. D vitamini, kalsiyum ve fosforun kan düzeylerinin düzenlenmesinde, kemik döngüsünün uygun biçimde devamının sağlanmasında gereklidir (3).
Osteoporoz, kemik kütlesi ve kemik dokusunun mikro yapısının bozulmasına bağlı kemik kırılganlığının artmasıyla karakterize, çok nedenli ve sık rastlanan bir iskelet sistemi hastalığıdır (4). 50 yaş üstündeki erkeklerin % 13’ünde, kadınların ise % 40’ında hayatı boyunca osteoporoza bağlı kırık riski vardır. 50 yaş üzerindeki kadınların kardiyovasküler hastalık riski % 40, osteoporoz riski % 40, meme, over ve uterus kanser riski ise % 15 olduğu göz önüne alınırsa hastalığın önemini bir kere daha vurgulamış oluruz (5).
Çift enerji X Işını Absorbsiometri = [Dual Energy X Ray Absorbsiometry (=DEXA)]; 1987’de kullanıma girmiş ve günümüzde en çok kullanılan yöntem olup, vertebralar, femur boynu ve diğer anatomik bölgelerden ölçüm yapılabilir. DPA’ ya göre daha hızlı ve daha yüksek çözünürlükte ölçüm yapar. Kortikal ve trabeküler kemik içeriğinin kantitatif ölçümünü birleştiren bu yöntem, kemiğin dayanıklılığı hakkında daha güvenilir bilgi verir ve ölçüm süresi kısadır (6).
Çalışmamızda, heparine oranla yan etkileri daha düşük olan ve plasental geçişi olmayan LMWH’ nin yenidoğan ratlarda indirekt yollar aracılığı ile KMD ve Osteoporoz gelişimi üzerine bir etkisinin olup olmadığını belirlemek amaçlanmıştır.
2
2. GENEL BİLGİLER 2.1. Heparin
Heparin mast hücrelerinde histamin ve seratonin ile birlikte bulunan bir mukopolisakkarittir. Bu nedenle mast hücrelerinden zengin dokulardan elde edilir. Yapı olarak tekrarlayan sülfatlanmış glukronik asit, iduronik asit ve glukozaminden meydana gelmiştir. Yüksek miktarda anyonik sülfat ve karboksilik gruplar içermesi nedeniyle molekül yapısı asidik yapıdadır. Bu asidik yapının klinik uygulamalarda iki önemli rolü vardır; birincisi asidik yapısı nedeniyle plazmadaki proteinlere, endotel hücrelerine ve monositlere kolaylıkla bağlanır ve plazmadan temizlenmesi oldukça hızlıdır. Tedaviye başlarken öncelikle bu özelliği dikkate alınarak, damar içine 5000 Ü puşe edilir ve infüzyona geçilir. İkincisi ise yüksek doz heparin kullanıldığı durumlarda (by pass cerrahisinde) veya heparine bağlı kanamalarda heparinin nötralizasyonu için kuvvetli bazik bir madde olan protamin sülfat kullanılmaktadır (1).
Heparin moleküler ağırlıkları dolayısıyla zincir uzunlukları, antikoagülan aktivitesi ve farmakokinetik özellikleri farklı bir karışımdan meydana gelmiştir. Heparinin ortalama molekül ağırlığı 15000 Da (3000-30000) yani yaklaşık 45 monosakkarit ünitesinden oluşmuştur. Heparin doğal bir madde olduğundan, üretim sırasında biyolojik standardizasyonu zor olmakta, her seferinde farklı kompozisyonda (farklı molekül ağırlığında) ürün elde edilebilmektedir (2).
Heparin molekülünün ancak 1/3’ünde antikoagülan özellik olup, diğer 2/3’lük kısmı ise antitrombinden bağımsız etkilerinde rol almaktadır. Molekülün ağırlığı fazla olan zincirlerin dolaşımdan uzaklaştırılması daha kolay olmakta, belli bir süre sonra düşük molekül ağırlıklı kısım yoğunlaşmaktadır. Uzun zincirler kolay uzaklaştığı için molekülün anti-IIa aktivitesi azalmakta, anti-Xa aktivitesi ise korunmaktadır. Bu farmakokinetik özellik ilacın laboratuvar yöntemleri ile izlenmesinde önem kazanmaktadır.
3
Etki mekanizmasında veya yan etkilerinin oluşumunda önemli rol oynadığı bilinen proteinler; antitrombin III, heparin kofaktör II, doku faktör yolu inhibitörü (DFYİ) ve platelet faktör 4’dür. Bugün insan plazmasında 750’den fazla heparini bağlayan protein olduğu bilinmekte, ancak bu bağlanmaların etki mekanizmasındaki önemi hala anlaşılamamıştır (4).
2.1.1.Antitombin III: Antirombinin; trombin, F IXa, F Xa, F XIa ve F XIIa’ yı inhibe edebilmesi için heparine ihtiyacı vardır. Bu inhibisyon reaksiyonları heparinsiz ortamda oldukça yavaş seyrederken, heparin bu tepkimelerin hızını yaklaşık 1000 kat arttırmaktadır. Bu faktörler içinde özellikle trombin ve FXa’ nın inhibisyonu önem kazanmakta, heparin; trombin ve F Xa’ yı eşit oranda inhibe etmektedir. Yani anti-Xa ve anti-IIa 1:1 dir. Heparinin antitrombini bağlayan beş şeker ünitelik (pentasakkarit) özel bir bölümü vardır (7,8). Trombin ve F Xa’ nın birlikte inhibe edilebilmesi için, heparin molekülünün özel pentasakkarit bölümünün de içinde olduğu en az 18 şeker ünitelik uzunlukta olması gerekmektedir. Sadece F Xa’ nın inhibisyonu için özel pentasakkarit kısmı yeterlidir. Böylece heparin zincirindeki şeker sayısını azalttığımızda, antitrombin aktivitesi azalırken, anti-Xa aktivitesi hala korunmaktadır. İşte DMAH kavramında bu mekanizma yatmaktadır. Son yıllarda bu özel pentasakkarit bölgesi sentetik olarak sentezlenmiş, antitrombotik özellikleri saptanmış (9) ve selektif F Xa inhibitörü olarak kullanım alanına girmiştir (10).
2.1.2.Heparin Kofaktör II (HCH): Antitrombinik aktivitede HCH’ nin işlevi antitrombin kadar önemli değildir. Ancak bazı özel durumlarda önem kazanmaktadır. Antitrombin eksikliği olan bireylerde veya HCH’ ye bağlanan dermatan sülfat gibi bazı ilaçların etki mekanizmasında rol oynamaktadır.
2.1.3.Doku Faktörü Yolu İnhibitörü (DFYİ-TFPI): Heparinin antitrombinden bağımsız etkilerinin başında, vasküler endotelden DFYİ salınımı gerekmektedir. Plazmadaki DFYİ düzeyi kandaki plazma miktarı ile paralel olarak artmaktadır (11).
4
2.1.4.Platelet Faktör 4 (PF4): Heparinin in vivo nötralizasyonunda ve heparine bağlı immün trombositopeninin oluşum mekanizmasında rol oynayan trombositlerin alfa granüllerinde bulunan bir kemokindir. PF4’ün hemostazdaki etkileri dışında pek çok non – hemostatik işlevi de gösterilmiştir (12).
2.1.5.Heparinin Plateletlere Olan Etkisi
Heparin trombosit işlevlerini in vitro ortamlarda deneysel koşullara bağlı olarak ya aktive eder ya da inhibe eder.
Ancak bu etki genellikle konsantrasyona ve moleküler ağırlığına bağlı olarak inhibisyon yönündedir. Ayrıca heparin, von Willebrand faktöre de bağlanarak işlevlerini inhibe etmektedir (13).
2.1.6.Heparinin Nonhemostatik Etkileri
Antikoagülan/antitrombotik etkileri yanında heparinin başka etkileri de tanımlanmıştır (13).
1. Damar duvar geçirgenliğini arttırır
2. Damar düz kas hücrelerinin proliferasyonunu inhibe eder 3. Anjiogenezisi inhibe eder
4. Tümör hücresinin oluşumunu ve metastazını inhibe eder
5. Osteoblast aktivitesini baskılaması yanında osteoklastları aktifleştirebilir 6. DFYİ aracılığıyla apoptozisi uyarır
7. Trombinin ve F Xa’ nın inflamatuar etkilerini ortadan kaldırır 8. Endotel hücrelerinde profibrinolitik faktörlerin salınımını arttırır
Heparinin başka değişik etkileri de tanımlanmıştır örneğin antienflamatuar etki (14) lipid metabolizması üzerine etkisi (15) farklı pankreatik enzimlerin aktivasyonu üzerine etkisi (16).
5
2.2. Düşük Molekül Ağırlıklı Heparin
Düşük molekül ağırlıklı heparinler (DMAH) kimyasal, enzimatik, ultrasonografik veya gamma irradyasyon yöntemleri kullanılarak standart heparinin depolimerizasyonu sonucu elde edilirler (1). Avrupa farmakopesine göre bir heparin derivesine DMAH diyebilmek için aşağıdaki özellikleri içermesi gerekmektedir (17). 1. Ortalama molekül ağırlığı 8 kDa’dan az olmalı,
2. F Xa’ yı inhibe etme gücü 70 U/mg Anti-Xa’ dan büyük, FIIa’ yı inhibe etme gücü 40 U/mg’dan küçük olmalı,
3. Anti-Xa aktivitesi ile anti-IIa aktivite oranı > 1,5 olmalıdır.
Hangi yöntem kullanılırsa kullanılsın elde edilen DMAH molekül olarak standart heparinin 1/3’ü kadardır (ortalama 5000 Da).
Günümüzde değişik yöntemler kullanılarak pek çok DMAH üretilmiş ve ticari olarak kullanıma sunulmuştur. Molekül ağırlığını azaltırken etkileşime girdiği proteazlara etkisi değişmekte, trombine olan etkisi azalmakta, ancak anti-Xa aktivitesi devam etmektedir (2).
Adezyon moleküllerinin aktivasyonuyla lökosit göçü endotel hücrelerarası bağlantıların bozulmasına, ödeme ve inlamatuar infiltrasyona neden olarak kapiller perfüzyonun durmasına ve sonuçta nekroza neden olur. Heparin trombüs aktivitesini ve trombüs oluşumunu azaltarak bu döngünün erken basamaklarını inhibe eder. Dolayısıyla kan viskozitesini azaltır, kapiller dolaşımı arttırır. Sternbergh ve arkadaşları (18), Becker ve arkadaşları (19) heparinin postiskemik endotelyal hücre disfonksiyonunu önlediğini ve serbest oksijen radikallerini aktive ederek lökosit adezyonunu azalttığını göstermişlerdir.
DMAH' lar, normal böbrek fonksiyonu olan hastalarda venöz tromboembolinin (VTE) önlenmesi ve tedavisinde unfraksiyone heparinin yerini almıştır (20). Antitrombotik ve hemorajik doz aralıkları unfraksiyone heparine göre
6
daha geniş olduğu için daha güvenli kullanılabilen ilaçlardır. Molekül ağırlıkları düşük olmasına rağmen, gebeliğin hiçbir döneminde plasentayı geçmezler. Unfraksiyone heparin gibi DMAH' da antikoagülan etkisini antitrombin III' e bağlanıp trombin (faktör IIa) ve faktör Xa' nın inhibisyonunu artırarak gösterir. Trombini inaktive etme kapasitesi molekül ağırlığına bağlı olduğu için, DMAH' ın anti-Xa aktivitesine göre daha düşük bir anti-IIa aktivitesi vardır ve böylece benzer antikoagülasyon seviyelerinde daha az kanama riski taşır (21,22). Ayrıca trombosit fonksiyonlarını daha az inhibe etmesi, mikrovasküler permeabiliteyi artırmaması ve endotelyal faktörler ile Von Willebrand faktör için daha az afinite göstermesi nedeniyle de daha az kanamaya sebep olur.
Azalmış anti-IIa aktivitesi sebebiyle DMAH' ın antikoagülan etkisinin aPTT ile monitörizasyonu mümkün değildir ve anti-Xa aktivitesi ölçülmelidir (23).
DMAH' ın, unfraksiyone heparine göre daha uzun yarı ömrü vardır ve plazma proteinlerine daha az bağlanır, dolayısıyla biyoyararlanımı farklı dozlarla değişmez. DMAH böbrekten atılır. Gebe olmayan hastalarda DMAH, minimal laboratuvar monitorizasyonu ile güvenle kullanılabilirler. Ancak gebe hastalarda bu durum farklıdır. Gebelikte plazma hacmi ve filtrasyon hızı artışı olması, artmış renal klirens, plasental heparinaz üretimi ve kilo değişimleri, gebelikteki DMAH farmakokinetiğini değiştirebilir. Bu nedenle gebeler, normal bireylere göre daha yüksek ve daha sık DMAH dozlarına ihtiyaç duyabilirler (24). DMAH, FDA tarafından gebelik kategorisi B grubuna dahil edilmiştir. Plasentayı geçmedikleri için fetüs için güvenlidir. Anne sütüne geçmezler ve emziren annelerde güvenle kullanılabilirler (21). DMAH yarı ömrü gebelikte azaldığı için, günlük iki doz uygulaması tek doz uygulamalarına tercih edilmelidir. Çoğunlukla sabah dozundan 4-6 saat sonra antifaktör Xa plazma seviyesi ölçülerek doz ayarlaması yapılır. Ancak DMAH tedavisinin laboratuvar monitörizasyonu ile ilgili sınırlamalar vardır. Mevcut anti- Xa kitleri arasında uyumun zayıf olması, farklı DMAH preparatlarının farklı anti-Xa aktivitelerinin olması ve DMAH uygulanmasından sonra kan alım zamanlamasının çok önemli olması bu sınırlamalardan bazılarıdır (20).
7
Kısaca DMAH' ın unfraksiyone heparine göre üstünlükleri; daha iyi biyoyararlanım, uzun plazma yarı ömrü (veya daha yüksek antifaktör Xa aktivitesi), farmakokinetik ve farmakodinamiğinin daha iyi tahmin edilebilir olması, osteoporoz yapma potansiyelinin daha az olması ve HİT insidansının daha düşük olması olarak sayılabilir. Bununla birlikte, yüksek doz DMAH' ın vajinal doğum sonrası 500 ml.’ den fazla kan kaybıyla ilişkili olduğu bildirilmiştir (25). Protamin DMAH’ ın sadece anti-IIa aktivitesini tamamen nötralize eder, anti-Xa aktivitesinin ise tamamını nötralize etmez (maksimum %60 nötralize eder) (24).
DMAH' lar Trombine yeteri oranda bağlanamadıklarından bu yoldan etkileri azalmıştır. FXa’ yı inaktive edici etkileri normaldir. Plazma proteinlerine heparin gibi bağlanmzlar bundan dolayı doz-yanıt ilişkisi daha doğru tahmin edilebilir. Makrofaj ve endotel hücrelerine bağlanmaları daha azdır. Trombositlere bağlanma oranları düşük olduğundan trombositopeni olasılığı düşüktür. Osteoblastlara bağlanmaları, dolayısıyla osteoklastların aktivasyonu ve osteoporoz riski azdır. Renal yoldan atıldıkları için böbrek yetmezliğinde yarı ömürleri uzar. unfraksiyone heparinin Anti Xa/Anti IIa oranı 1/2 iken, DMAH’ larda bu oran yaklaşık 2/1–4/1 şeklindedir (26).
8
DMAH’ lerin cilt altına günde bir kez yapılması genel cerrahi hastalarında ölüm oranını plaseboya göre büyük oranda azalttığı gösterilmiştir. DMAH’ ın ve DDSH’ nın etkilerini kıyaslayan birçok meta analiz sonucunda ikisinin de, genel cerrahi hastalarında VTE’ yi eşit oranda önlediği anlaşılmıştır. Hatta birçok çalışma, günde bir ya da iki kez verilen DMAH’ ın etkisinin standart heparinden daha fazla, kanama ve hematom yan etkisinin ise daha az olduğunu ortaya koymuştur. Kontrol grubu ile kıyaslandığında DMAH’ lar büyük kalça ve diz ameliyatlarında tromboz insidansını, kanama riskini artırmaksızın %70 oranında düşürür. Bu ilaçların belirgin avantajı sabit dozda günde bir ya da iki kez yapılabilmeleri ve laboratuar takibi gerektirmemeleridir. Ayrıca DDSH’ ye göre HİT yan etkisi de daha azdır. Kalça protezi yapılan hastalarla yapılan bir çalışmada, bu yan etkinin standart heparinle %2,7 oranında görüldüğü, DMAH ile %0 olduğu ortaya konmuştur (27).
Ortopedik hastalarda kanama riski dikkate alınarak, tedaviye genellikle ameliyattan 12–24 saat sonra başlanır. Yüksek risk taşımayan genel cerrahi hastalarında ilk doz (<3400 U) ameliyattan 2 saat önce yapılır. Bu uygulama, kanama riskini arttırmadığı gibi, ameliyat sırasında ya da girişimden sonra erken dönemde olabilecek DVT' yi önlemek gibi ek bir yarar da sağlar. Yüksek risk taşıyan hastalarda yüksek doz (>3400 U) ilaç kullanılması gerektiğinde ameliyat sırasında olabilecek büyük kanamaları önlemek amacı ile ameliyattan 10–12 saat önce verilmelidir.
Epidural anestezi ya da post-op analjezik verilebilmesi için yerleştirilmiş epidural kateteri olan hastalarda ve spinal ponksiyon yapılacak olan hastalarda çok dikkatli kullanılması gereklidir. Bu durumda epidural ve spinal hematomlar gelişebilir (27).
DMAH' ler sadece cerrahi hastalarında değil, medikal hastalarda da DVT riskini yaklaşık olarak %60 ile %90 oranında azaltır. Medikal hastalarda DMAH ile standard heparinin etkileri kıyaslandığında bunların hemen hemen birbirine eşit olduğu görülmüştür. Ancak DMAH' lar daha güvenlidir. Felçli ve medulla spinalis
9
travması olanlarda, standart heparine kıyasla daha etkilidir. Akut medikal hastalığı olanlarda, 6–14 gün süre ile, günde bir kez 40 mg subkutan enoksaparin verilerek yapılan korunma ile DVT riski % 63 oranında azaltılabilir. Yüksek DVT riski taşıyan, mekanik ventilasyona bağlı, akut dekompanse kronik obstriktif akciğer hastalarında kiloya göre ayarlanan 0,4 ml (3800 U) veya 0,6 ml (5700 U) nadroparin ile yapılan korunma plaseboya göre DVT riskini anlamlı ölçüde azaltır (%28,2'den %15,5'e düşürülmüştür).
2.3. D Vitamini
D vitamini, kemik metabolizması ve nöromüsküler fonksiyonlar için önemli rolleri olduğu bilinen steroid yapıda bir hormondur. Pek çok vertebralı organizma D vitamini ihtiyacını yeterli güneş ışığı maruziyeti ile deriden fotokimyasal yolla sentezleyerek sağlar. Bu yüzden, D vitamini gerçek bir vitamin değil bir prohormondur. D vitamini, kalsiyum ve fosforun kan düzeylerinin düzenlenmesinde, kemik döngüsünün uygun biçimde devamının sağlanmasında gereklidir (28).
İnsanlarda D vitamini eksikliği ve buna bağlı sağlık sorunları Avrupa’nın kuzeyinde sanayileşme ile başlamıştır. Hava kirliliği, kapalı alanlarda yaşamın artması ve güneş ışınlarına maruziyetin azalması sonucu çocuklarda ‘raşitizm’ ortaya çıkmıştır. Yirminci yüzyıla girerken Kuzey Avrupa ve Amerika’da çocukların %80-90’ında raşitizm saptanmıştır (29). Hess ve Unger 1921 yılında güneş ışınlarına maruz bırakılan raşitik çocuklarda dramatik iyileşme gözlemlemişlerdir. Böylece, besinlerin D vitamini ile güçlendirilmesi gündeme gelmiştir. Bu nedenle Birleşik Devletler’ de süt, bebek mamaları, kahvaltılık gevrekler ve diğer bazı besinler D vitamini ile güçlendirilmiştir. Ancak 1950’li yıllarda İngiltere’de hiperkalsemi olgularının bildirilmesi üzerine Avrupa genelinde D vitamini ile güçlendirilmiş süt ürünlerine yasaklama getirilmiştir (29).
Ulusal Sağlık ve Beslenme Grubu’nun (NHANES) verilerine göre Amerika Birleşik Devletleri’nde adölesan ve erişkinlerin sadece dörtte birinde D vitamini düzeyi yeterlidir ve çocukların da %61’inde D vitamin yetersizliği mevcuttur (30).
10
Bu veriler D vitamin eksikliğinin giderek artan önemini ortaya koymaktadır.
D vitamini düzeylerinin kanda tespit edilebilmesini sağlayan teknik gelişmeler sonrası yapılan çalışmalarda, genel düşüncenin aksine erişkin ve sağlıklı olduğu tahmin edilen bireylerde de D vitamin eksikliğinin tahmin edilen düzeylerin çok üzerinde olduğu görülmüştür. D vitamini eksikliğinde gelişebilecek olumsuz durumlar göz önüne alındığında, sık görülen bu durumun aslında ciddi bir sağlık sorunu olduğu ortaya çıkmaktadır.
2.3.1. D Vitamin Metabolizması
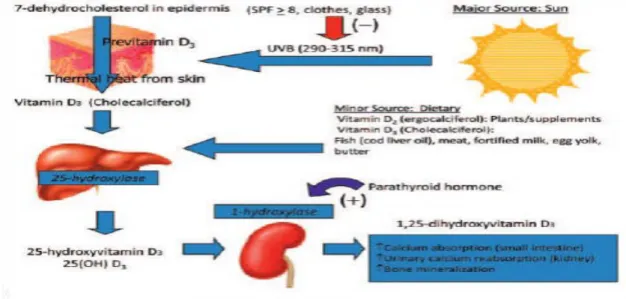
İnsanlarda D vitamini iki şekilde bulunur. 28 karbon molekülü içeren vitamin D2 (ergokalsiferol) ve 27 karbon molekülü içeren vitamin D3’dür (kolekalsiferol). Vitamin D3, deride güneş ışınları ile 7-dehidrokolesterolden sentezlenir. Güneşin 290-315 nanometre dalga boyundaki ultraviyole B (UVB) ışınları ile 7-dehidrokolesterol önce previtamin D3’e ve ardışık izomerizasyon ile vitamin D3’e dönüştürülür. Vitamin D3 dışarıdan az miktarda da olsa diyetle, güçlendirilmiş mandıra ürünleri ve yağlı balıklarla alınır. Özellikle ringa balığı ve uskumru vitamin D3 açısından zengindir. Vitamin D2 ise bitkilerin güneş ışınları ile karşılaşması ile oluşur (31) (Şekil 2.1).
11
Güneş ışınları ile oluşan vitamin D3, ihtiyacın %90-95’ini karşılar. Deriden sentez edilen ve besinlerle alınan vitamin D3 ve vitamin D2, karaciğerde 25 hidroksi (OH) vitamin D3 [25(OH)D3] ve 25 hidroksi (OH) vitamin D2’ye [25(OH)D2], sitokrom P450 vitamin D 25 Hidroksilaz enzimi ile dönüştürülür. CYP2R1 enzimi anahtar enzimdir ve bu enzimdeki homozigot mutasyon dolaşımda düşük 25(OH)D3 düzeyi ile vitamin D eksikliğinin klasik semptomlarına neden olur (30). 25(OH)D vitamini, hem 25(OH)D3 hem 25(OH)D2’yi tanımlamak için kullanılır. Karaciğerde sentezlenen 25(OH)D vitamini, kanda D vitamini bağlayan proteine (DBP) bağlanarak böbrek tübül hücrelerine taşınır. D vitamini bağlayan protein (DBP)’in aminoasit yapısı albumine benzer ve 25(OH)D, 1,25(OH)2D3 ve 24,25(OH)2D3 metabolitlerine yüksek affinite ile bağlanır (31,32).
DBP-25(OH)D kompleksi, proksimal renal tübül hücrelerine girer. Burada serbest kalan 25(OH)D, mitokondrideki sitokrom P450 monooksijenaz 25(OH) vitamin D, 1-alfa hidroksilaz enzim sistemi (CYP27B1) ile aktif form olan 1,25(OH)2 D3’e dönüştürülür. Eğer 1,25(OH)2 D3 vitamini kanda yeterli düzeyde ise 25(OH) D’nin bir kısmı daha az aktif olan ve katabolize edilen 24,25(OH)2 D3’e dönüştürülür (33,34).
Hücrelere bağlanan aktif 1,25(OH)2 D3 hücre düzeyinde iki yol ile işlevsellik kazanır. Bu yolaklar yavaş ‘genomik’ ve hızlı ‘genomik olmayan’ yolaklar olarak adlandırılır (35). Genomik yolakta DBP’ lerle dokulara taşınan 1,25(OH)2 D3 hücre içine girerek D vitamin reseptörü (VDR) ile kompleks yapar. D vitamin reseptörü (VDR), steroid, tiroid hormonu ve retinoik asit reseptörleri gibi DNA’dan RNA transkripsiyonunu düzenler (36,37). Bu kompleks, retinoik asit-X reseptörünü de yanına alarak üçlü kompleks halinde belirli DNA bölgelerine bağlanır. Bu üçlü kompleks, D vitaminine cevap veren elementler (VDRE) ile bazı genlerin (osteokalsin, kalsiyum bağlayan protein, 24 hidroksilaz gibi) transkripsiyonunu arttırırken, bazı genlerin ise (IL-2 ve IL-12 gibi) transkripsiyonunu azaltır.
Genomik olmayan yolakta ise D vitamini plazma membranındaki D vitamin reseptörlerine bağlanarak sitoplazma içerisinde protein kinaz C, mitojenle aktive olmuş protein kinaz, fosfolipaz A2 ve fosfolipaz C gibi ikincil mesaj yolaklarını
12
aktive eder (35,38). Bu yolak sonucunda hücre membranındaki kalsiyum kanalları aktifleşir. Bu yolak daha çok pankreas beta hücrelerinde, düz kaslarda, kalp kası hücrelerinde, barsak hücrelerinde ve monositlerde aktiftir. Bu yolağın psöriazis, tip 1 diyabet, romatoid artrit, multipl skleroz, Crohn hastalığı, hipertansiyon, kardiyovasküler hastalıklar ve bazı sık görülen kanserlerin gelişimi ile ilgili olduğu ileri sürülmektedir (31,32).
D vitamininin kemik metabolizması üzerine üç temel etkisi vardır:
1- D vitamini, barsaktan kalsiyum emilimini arttırır. Barsak epitelyum hücrelerinde VDR’ ye bağlanan D vitamini kalsiyum bağlayan proteinin sentezini arttırarak kalsiyumun aktif transportunu sağlar. Kalsiyum aktif transport yanında, barsaklardan ve hücre kenarlarından difüzyonla da emilir. Aktif transportun eşik değeri varken difüzyon sisteminin eşik değeri yoktur ve diyetle alınan kalsiyum miktarına bağlıdır. D vitamini varlığında diyetteki kalsiyumun %30-40’ı emilirken D vitamini yetersizliğinde bu oran %10-15’e düşer. D vitamini, barsaklardan fosfor emilimini de uyarır.
2- D vitamini, kemik dokusu üzerine etki eder. Bunun için, parathormon ile birlikte hareket eder (39,40). Aktif D vitamini, kemik dokusunda osteoblastlardaki VDR’ ye bağlanarak osteoblastlarda NF-κβ (RANKL) proteinin sentezini arttırır. RANKL proteini preosteoklastlardaki RANKL reseptörüne bağlanarak preosteoklastların olgun osteoklastlara dönüşmesini sağlar. Olgun osteoklastlar, çeşitli hidrolitik enzimler salgılayarak kemik matriksten kalsiyum ve diğer minerallerin mobilizasyonunu sağlar. (41,42)
3- D vitamini, böbreklerden de kalsiyum emilimini arttırır. Renal distal tübül hücrelerinden filtre edilen kalsiyumun %1’i emilir. D vitamini, parathormon ile birlikte distal tübül hücrelerine etki eder. Kalsiyum düşüklüğünde ilk aşamada D vitamini barsaklardan kalsiyum ve fosfor emilimini arttırır. Bu yeterli olmazsa, parathormon kemik kalsiyumunu mobilize etmek için D vitamini sentezini arttırır. Parathormon ve hipofosfatemi, böbreklerde 1,25(OH)2 D3 sentezini arttıran en
13
önemli faktörlerdir (39,43). Parathormon, renal proksimal ve distal tübül hücrelerinde kalsiyum emilimini arttırırken fosfor atılımını arttırır. Hipofosfatemi ise parathormondan bağımsız olarak böbreklerde 1,25(OH)2 D3 sentezini uyarır (31,32).
2.3.2. D Vitamin İhtiyacı
D vitamini eksikliği olmaması için doğumdan itibaren ilk bir yıl günde 400 IU, 50’li yaşlara kadar 200-400 IU ve 50 yaşından sonra ise 400-600 IU D vitamini alınması ve günde 5-15 dakika güneş ışınları ile karşılaşma önerilmektedir (31). Ayrıca, yeni yapılan çalışmalarda genel sağlık ve iyilik hali için 25(OH) D3 vitamini düzeyinin 30 ng/ml olması gerektiği belirtilmektedir. Bu nedenle serum 25(OH) D3 vitamin düzeyini 30 ng/ml’ye yükseltmek için çocuk ve erişkinlere günde 800-1000IU D vitamin alımı önerilmektedir (45,46). Amerikan Pediatri Akademisi de yaşamın ilk birkaç günü içinde başlayarak tüm bebeklere, çocuklara ve adölesanlara günde 400 IU D vitamini önermektedir (47). Hastanede yatarak izlenen veya prematüre doğan bebeklerde hastanede kalış süresinin uzaması, güneş ışığına maruz kalmanın azalmasına ve ciltten D vitamini sentezinin yetersizliğine yol açarak D vitamini durumunu olumsuz yönde etkiler (48). Fototerapi, UVB ışını içermediği için ciltten D vitamini sentezlenemez. Total parenteral beslenme, güçlendirilmemiş formül mama ve anne sütü de bu bebeklerde kalsiyum, fosfor ve D vitamini yetersizliğine neden olur. Bu nedenlerle, prematüre bebekler metabolik kemik hastalığı gelişmesi açısından yüksek riske sahiptirler. Bu durum, yetersiz kalsiyum, fosfor, D vitamini alımı ve ekstremitelerin hareketsizliği sonucu gelişen çoklu etyolojiye sahip bir hastalıktır (49). Annedeki 25(OH) D3 vitamini kolayca plasenta yoluyla fetüse geçer. Gebeliğin 24. haftasında fetal böbrekler endokrin etki, diğer dokular parakrin etki için 1,25(OH)2 D3 vitaminini sentezleyebilme kapasitesini kazanır. Hem preterm hem de term bebekler için doğumda yenidoğanın serum 25(OH) D3 düzeyi, annenin serum 25(OH)D3 düzeyinin %50-70’i kadardır (44,49). 2.3.3. D Vitamin Durumunun Değerlendirilmesi
Serum 25(OH) D3 vitamini düzeyi, dolaşımdaki D vitamin durumunun değerlendirilmesindeki en iyi göstergedir (50). Yarılanma süresi sağlıklı bireylerde
14
2-3 haftadır (1,25(OH)2 D3’ün 12-24 saat). Bu nedenle serum 25(OH) D3 vitamini düzeyi, D vitamini eksikliklerini değerlendirmede kullanılan temel parametredir. Plazma 1,25(OH)2 D3 vitamin düzeyi, vitamin eksikliği durumlarında normal, yüksek ya da düşük saptanabilir, bu nedenle D vitamini durumunu değerlendirmede kullanılmaz. D vitamin eksikliği, yetersizliği, yeterli düzeyi ve toksik düzeyleri belirleyecek sınır değerlerini tanımlamak ve belirlemek güçtür (51,52,53).
Son yıllarda adölesan ve erişkinlerde yapılan çalışmalarda, D vitamin eksikliği serum 25(OH) D3 düzeyi ≤15ng/ml ve D vitamin yetersizliği 15-20 ng/ml olarak tanımlanmaktadır. Parathormonu aktive etmeyecek en düşük 25(OH) D3 düzeyi 30 ng/ml’dir (75 nmol/L). Erişkinlerde D vitamini için yeterli düzey >30 ng/ml (75 nmol/L) olarak kabul edilmektedir (52, 54, 55). İnfant ve yenidoğanlarda yeterli ve yetersiz D vitamini arasındaki sınır çizgisi açık olarak tanımlanmamıştır. Bebeklerdeki en uygun serum D vitamin düzeyleri üzerinde halen fikir birliği yoktur. İnfantlarda D vitamin eksikliği için alt sınır değeri 12 ng/ml alınmıştır. Türkiye’den bildirilen bir çalışmada ise yenidoğan kord D vitamin düzeyi 12ng/ml altında olması D vitamin eksikliği olarak tanımlanmıştır (56). Tablo 2' de adölesanlarda serum 25(OH) D3 düzeylerine göre D vitamin durumu gösterilmektedir (57).
Tablo 2.2.Serum 25(OH) D3 Düzeyinin Değerlendirilmesi (57).
Yapılan bir çalışmada 25(OH) D3 düzeyinin, kızlarda erkeklerden ve pubertal çocuklarda prepubertal çocuklardan daha düşük olduğu gösterilmiştir (sırasıyla
15
p<0,01; p<0,05). Tip 1 diyabetlilerin %70’inde D vitamini eksikliği, %23’ünde D vitamini yetersizliği, obezlerin %46,8’inde D vitamini eksikliği ve %40,2’sinde yetersizliği, diğer hastalıklar grubunda ise %40 oranında D vitamini eksikliği, %43 oranında D vitamini yetersizliği gösterilmiştir (41).
2.3.4. D Vitamininin Kemik Metabolizması Dışındaki Etkileri
Vücutta çoğu doku ve hücrelerde VDR bulunmasının anlaşılması üzerine D vitaminin pek çok biyolojik fonksiyonları araştırılmaya başlanmıştır. Bağırsaklar, böbrekler ve kemik dokusu, D vitamin metabolizmasının etkilediği organlardır. Son yıllarda ise beyin, kalp, mide, pankreas, akciğer, deri, meme, üreme organları, T ve B
lenfositler, monositler gibi pek çok yapıda VDR varlığı gösterilmiştir (42). D vitamini, hem kalsiyum metabolizması hem de diğer sistemler üzerine olan
etkilerini, hücre içi ve hücre dışı VDR’ leri aracılığıyla göstermektedir. Ayrıca, 25(OH) D3vitamininin böbrek dışı dokularda CYP27B1 enzimi ile 1,25(OH)2 D3‘e dönüşebildiği gösterilmiştir (31,42). Tüm bu veriler D vitamininin parakrin ve otokrin düzenleyici özellikleri olduğunu göstermektedir (48,58,59). 25(OH) D3 vitamininin, parakrin ve otokrin etkilerle böbrek dışı hidroksilasyonu hücre proliferasyonunu inhibe ederek, hücresel farklılaşmayı sürdürerek ve immün sistemi düzenleyerek etki eder (48). Son yıllarda yapılan çalışmalarda, düşük serum 25(OH) D3 düzeylerinin, çeşitli kanser tipleri (meme, prostat, kolon), otoimmün hastalıklar (romatoid artrit, sistemik lupus eritamatozus ve multipl skleroz), kas-iskelet sistemi hastalıkları, nörolojik hastalıklar ve diyabet ile ilişkili olduğu bildirilmiştir (31,60). Ayrıca, kötü vitamin D durumu preeklampsi, osteoporoz, diş çürükleri, kardiyovasküler hastalıklar (hipertansiyon, kalp yetmezliği) ile de ilişkilidir (29, 61).
D vitamini kalsiyum metabolizmasında temel rolü oynayan steroid yapıda bir hormondur. Kalsiyumla yakından ilişkisi dışında D vitamininin, hücre büyümesi ve farklılaşması ile ilgili işlevleri de keşfedilince nörolojik ve psikiyatrik patolojilerdeki rolleri tartışılmaya başlanmıştır. Yapılan çalışmalarda D vitamininin nöronların büyüme, gelişme ve farklılaşmasında önemli rol oynadığı; bu duruma ikincil olarak yaşamın erken dönemlerinde D vitamini eksikliğinin birçok nöropsikiyatrik hastalığın (şizofreni, otizm, multipl skleroz, Alzheimer, Parkinson v.b) insidansında
16
artışa neden olduğu sonucuna ulaşılmıştır.
D vitamini ve beyin arasındaki ilişkinin ilk dolaylı kanıtı; sağlıklı yetişkinlerde yapılan serebrospinal sıvı incelemesinde D vitamininin metabolitlerinin bulunmasıyla ortaya çıkmıştır (Daha sonraki yıllarda bu bulgu kemirgen beynindeki 1,25(OH)2D3 vitamini dağılımının gösterilmesiyle de desteklenmiştir) (62). Elde edilen bu kanıtlar dolaylı kanıtlar olup bilim adamları için pek de ikna edici olmamıştır çünkü henüz özgül bir reseptör tanımlanmamıştır. Yapılan immünohistokimyasal çalışmalarla beynin birçok bölgesinde spesifik D vitamini reseptörlerinin gösterilmesi ise D vitamininin beyin gelişiminde rol alması ile ilgili ilk önemli kanıt olarak bilim dünyasına damgasını vurmuştur (62). ”Bilim dünyasının bu konuyla ilgili son zamanlardaki keşfi olan insan beyinde 1-hidroksilaz varlığının gösterilmesi ise santral sinir sisteminin, D vitamininin inaktif formu olan 25(OH) D3’ den aktif formu olan 1,25(OH)2 D3 sentezleyebileceğini akıllara getirmiştir (63). Böylece serum 25(OH) D3 seviyesi, santral sinir sisteminde de aktif D vitamini sentezini etkileyebilecektir (64). Gelişimsel D vitamini eksikliklerinin başta şizofreni ve otizm (65) olmak üzere birçok psikiyatrik hastalığa yol açtığı hipotezi, hayvan modelleri (65) kullanılarak yapılan birçok çalışmada doğrulanmakta, bununla beraber D vitamininin parkinson hastalığı, multipl skleroz, epilepsi ve kronik stres durumlarında nöral koruyucu etkisinin olabileceğine dikkat çekilmektedir.
2.3.5. D vitamini ve Gebelik
Gebelik süresince, vitamin D ve kalsiyum metabolizmasında önemli değişiklikler oluşur. Böbrekte, 1,25(OH)2D3 vitamin sentezi gebelikte artar. Ek olarak, plasenta ve desidua tabakası CYP27B1 enzimi ile önemli miktarda aktif D vitamini sentezler. Böylece gebelik sonrası dönem ve gebe olmayan kadınlara göre üçüncü trimesterdeki gebe bir kadında aktif D vitamini iki kat daha yüksek düzeyde bulunur. Sentez, metabolizma ve fonksiyonlar gebelik süresince karışıktır. İnsan endometriyal desidua tabakasında 1,25(OH)2D3 vitamini ve 24,25(OH)2D3 vitamini, plasentada 24,25(OH)2D3 vitamini sentezlenir. Gebelikte, 1,25(OH)2D3 vitamini ve CYP27B1 enzimi otokrin ve parakrin etki ile immün düzenleyici fonksiyon görür. 1,25(OH)2D3, desiduadaki dendritik hücreleri ve makrofajları etkiler. Bu etkileşim ile
17
maternal-fetal kesişim noktasındaki Treg hücreler uyarılır (66). Ayrıca 1,25(OH)2D3 vitamini Th1 sitokin salınımını baskılayarak ve Th2 sitokin salınımını arttırarak fetüsün implante olmasını sağlar (67). Bu şekildeki Th2 sitokin üstünlüğü, implante olan embriyonun rejeksiyonunu önler. Aktif D vitamini, endometriyal hücrelerin desidua tabakasına dönüşümüne de yardımcı olur. Böylece 1,25(OH)2 D3; implantasyona, normal gebeliğin sürdürülmesine, kalsiyum ile normal fetal büyümenin sağlanmasına, birçok plasental hormonun salınımlarının kontrolüne, proenflamatuvar sitokinlerin salgılanmalarının sınırlanmasına yardımcı olur.
Gebelikte D vitamini alımı, anne sağlığı ve ileri dönem olumsuz sonuçların önlenmesi için önemlidir. Gebelik süresince D vitamin eksikliği; preeklampsi, insülin direnci, gebelik diyabeti ve sezeryan doğum riski ile ilişkilidir (62). Özellikle gebelikte vitamin D eksikliği ülkelere ve başka faktörlere bağlı olarak yaklaşık % 20-85 arasında değişir (63). Preeklampsi sıklığı, 25(OH) D3 sentezinin azaldığı kış aylarında artar. D vitamin eksikliği, preeklampsi riskini arttırır. D vitamini desteği yapılan gebelerin yapılmayan kontrollere göre preeklampsi sıklığı azalır. İnsülin direnci, glukoz intoleransı ve diyabet, D vitamini eksikliği ile ilişkilidir. 1,25(OH)2D3 pankreastan insülin seksiyonunu düzenler. Erken gebelik sırasındaki vitamin D eksikliği, ileri dönem gebelik diyabeti için risk faktörüdür.
2.4. Kemik Mineral Dansitesi
2.4.1. Normal Kemiğin Fizyolojisi ve Fizyopatolojisi:
Kemik dokusu; erişkin ve çocuklarda sürekli olarak şekil ve modelde biçimlenme "modelling" ve yeniden biçimlenme "remodelling" süreci gösteren aktif bir dokudur. Yeniden biçimlenme belirli bölgelerde "Bone remodelling unit" de (BMU) olur. Mineralizasyonu tamamlanmış bölge, osteoklastlar tarafından yıkılırken, osteoblastlar bölgeye gelir ve yeni kemik dokusunu oluşturarak bu alanları doldururlar. Eski kemik, yeni kemik dokusu ile yer değiştirir. Kortikal kemikte yıkım trabeküler kemiğe göre daha hızlıdır. Büyümenin durmasından sonra kemik oluşumu ve yıkımı arasındaki eşit denge kemik kütlesinin devamını sağlar. Herhangi bir dengesizlik kemik kütlesini değiştirecektir. Çocuk ve adölesanda kemikte
18
biçimlenme dönemi daha yoğundur. Kemik kaybının olduğu yaşlılıkta, yıkım hızı yapım hızından fazladır. Kemikte biçimlenme periostal yüzeyde ve büyüme plağında kartilaj dokunun kalsifikasyonu şeklindedir ve mevcut mineralize dokunun yeniden biçimlenmesi, büyümekte olan çocukta devam eden bir olaydır. Yeniden biçimlenme, hormonlar ve bölgesel olarak üretilen büyüme faktörleri tarafından yürütülen bir işlemdir. Bu işlem paratiroid, kalsitonin, insülin ve büyüme hormonu gibi peptid hormonlar; 25(OH)2 D3, 1,25(OH)2 D3, glukokortikoidler, cinsiyet steroidleri gibi steroid hormonlar ve tiroid hormonları tarafından düzenlenir. Bunların yanı sıra büyüme faktörleri ve prostaglandinler, dolaşımdaki hormonların etkisiyle, bölgesel hücrelerden üretilir.
Olgun kemik; osteoblastlar tarafından üretilen ve önemli bir kısmını tip-1 kollajenin oluşturduğu organik matriks ve kristal formda kalsiyum ve fosfor içeren mineralden oluşur. Kemik yapımı osteoblastlar, yıkımı ise osteklastlar ve osteotik osteositler tarafından yürütülür. Bu işlemler sırasında kemikte sürekli bir döngü ve yeniden yapılanma vardır (68).
2.4.2. Kemik Hücreleri:
Osteositler hem woven (yeni kemik yapımının gerektiği büyüme dönemlerinde veya bazı metabolik kemik hastalıklarında oluşan immatür kemik dokusu, arada kollajen lifler rastlantısal olarak bulunur) hem de lameller kemikte (katmanlar halinde oluşan kollajen liflerinin oluşturduğu erişkin kemik dokusu) bulunan hücrelerdir. Osteositler, osteoblast farklılaşmasının son aşamasında oluşurlar. Osteositler kemik yapımında güce duyarlı olarak görev yaparlar. Osteoblastlar; mineralize matriks üzerinde bulunan ve yeni kemik yapımından sorumlu hücrelerdir. Osteoblastlar çoğunlukla tip 1 kollajen ve nonkollajen protein salgılar. Mineralize olmamış kemikte ‘osteosid’ mineralizasyonun başlaması için bir matriks oluşur. Matriks oluşumunu bitiren osteoblastlar apopitoza gider. Osteoblastlar daha önceden oluşmuş olan woven kemik üzerine lameller kemik oluşturur (1-2 mikrom/g). Osteoid'in ortalama kalınlığı 10 mikrondur ve lameller kemiğin kemikleşmesi ortalama 10 gün sürmektedir (69).
19
Osteoklastlar kemik rezorpsiyonundan sorumlu hücrelerdir. Normal koşullar altında kemikte az sayıdadırlar kemik yapım-yıkımının fazla olduğu metafizde daha fazladırlar. Osteoklastlar proteolitik enzimler olan katepsin, matriks metalloproteinaz ve hidrojen iyonu salgılarlar (68).
2.4.3.Organik Matriks
Organik matriksin %90 tip 1 kollajenden oluşur. Kalan %10 ise kollajen dışı kısımdan oluşur (osteokalsin, fibrinonektin, sialoprotein, osteopentin, proteoglikan, glikoproteinler). Tip 1 kollajen esas yapı taşını oluşturur. Tip 1 kollajen iki al ve bir a2 zincirinden oluşmaktadır. Prokollajen molekülleri üçlü heliks yapıyı oluşturmadan önce proteolitik yıkım ile N ve C terminal propeptidler ile taşınırlar ve kemik yapım göstergesi olarak işlev yaparlar. Tip 1 kollajen yapısı; pirolidin, deoksiprolidin ve C terminal telopeptidlerdir.
2.4.4.Kemik Yapım-Yıkım Döngüsü
Kemik yapım-yıkım döngüsü osteoklast ve osteoblastların uyum içinde çalışması ile oluşur. Osteoklast ve osteoblastlar kortikal kemik içinde “basic mıılticellular unit” olarak bilinen yapı ve trabeküler kemik içinde “bone structural unit” (BMU) olarak bilinen yapı içinde etkileşime girerler.
BMU kemiğe mikrohasar sonrası, sitokinler ile karşılaşmadan sonra veya kendiliğinden oluşur (PTH, IGF, IL1, IL 6, PGE, kalsitriol TNF aktive ederken, östrojen inhibe eder).
Osteositler, IL1, PTH ve kalsitriol stroma hücrelerini aktive ederek M-CSF (makrofaj koloni stimülan faktör) oluşturur. M-CSF hücrelerin preosteoklasta dönüşmesine neden olurken; stromal hücreler aynı zamanda preosteoblast oluşumuna neden olur. Preosteoblastlar hücre yüzeyinde RANK ligand eksprese eder (RANK-L). Preosteoklastlar üzerinde ise RANK adı verilen membran reseptörleri bulunur.
20
RANK-L bu reseptörleri aktive ettiğinde hücreler birleşir ve olgun multinükleuslu osteoklastlara farklılaşır. Osteoklastlar kemiği rezorbe etmeye başlarlar bu sırada asit ve katepsin salgılarlar. Preosteoblastlardan osteoblast oluşur ve RANK-L oluşumu durur. Bu arada olgun osteoblastlar tarafından yapılan osteoprotegerin (OPG) RANK-L’ a bağlanabilir ve preosteoklastların aktivasyonu durur. Olgun osteoklastlar matriks yüzeyi üzerinde bir boşluk oluşturarak kemiği rezorbe eder, hidrojen ve katepsin salgılar. Herhangi bir bölgede rezorbsiyon yaklaşık 2 hafta sürer. Osteoklastlar daha sonrasında apopitoza uğrar.
Osteoblastlar; adiposit veya osteoblasta dönüşebilen kemik iliği stromal hücrelerinden oluşur. Osteoblast farklılaşması için Runx2 (Cbfal) gereklidir. Runx2 transkripsiyon faktörlerini kodlar ve bunların ekprese olması osteoblast oluşumuna neden olur. Aktif osteoblastlar osteoid katmanları oluşturur ve boşalan kaviteyi doldururlar. Aynı zamanda büyüme faktörü osteopontin, osteokalsin, osteoproteerin ve bazı proteinleri salgılar. Osteoid, 6 mikron kalınlığına ulaştığında mineralize olmaya başlar. Osteoblastlar aynı zamanda PHEX ve FGF-23 üzerinden fosfat metabolizmasını regüle eder. Mekanizma tam olarak bilinmemektedir. Osteoblast yaşam ömrü östrojen ve diğer hormonlar tarafından kontrol edilmektedir. Kavite doldurulduktan aylar sonra yeni kemiğin yoğunluğu giderek artar, daha sonra osteoblastlar kemikten kalsiyum salgılanmasına neden olan hücre dizisi haline dönüşürler. Bazı osteoblastlar ise kemikte kalarak osteosidlere dönüşürler ve kemiğe yüklenen mekanik stresi algılarlar (68).
2.4.5. Kemik Yoğunluğunu ve Kemik Kazanım Hızını Belirleyen Faktörler
2.4.5.1. Genetik Belirleyiciler
Zirve kemik kütlesinin oluşumunda rol oynayan genetik faktörler henüz çok iyi belirlenmemiştir. Zirve kemik kütlesinde (ZKK) kazanılan miktar %70-80 oranında genetik; %20-30 çevresel faktörler tarafından belirlenir. Beslenme, yaşam biçimi ve fizik aktivite zirve kemik kütlesine ulaşmada en önemli faktörlerdir (70).
21
Genetik farklılıkların belirlenmesi ilk kez İ.Ö. 430 yılında Herodot’un bir yazısı ile başlamaktadır. Bu yazıda İranlıların kafataslarına çakıl taşı ile vurulduğunda çok zayıf olduğu ve rahatlıkla delik açılabileceği, ancak Mısırlıların kafataslarına taş ile vurulduğunda bile kırılamayacağı belirtilmektedir.
Kemik yapım belirleyicilerinin biyokimyasal göstergeleri (alkalen fosfataz, propeptid tip 1 kollajen) genetik kontrol altındadır. Yıkım göstergeleri için tam bir fikir birliği yoktur. Birçok gen ZKK’ nin belirlenmesinde aday olarak gösterilmektedir (65).
-Vitamin D reseptör geni, vitamin D kemik hücre gelişimini, kemik yapım-yıkımını ve kalsiyum dengesini reseptör üzerinden etkilemektedir. Reseptör mutasyonu kemik kütlesinin oluşumunda rol oynamaktadır
-Östroien reseptör geni
-TGF beta geni, kemik matrikste bulunur, rezorbsiyon ve formasyonu ayarlamaktadır.
-IL 6, osteoklast farklılaşması ve cinsiyet hormonlarının kemik ürerindeki etkilerini düzenler
-Kollajen tip 1 genleri, Spl bağlanma bölgesindeki mutasyonlar osteoporoza neden olmaktadır
-IGF-I geni, kemik üzerinde trofik etkilerinin olması nedeni ile önem taşımaktadır, ancak kemik kütlesi üzerindeki etkileri tam olarak belirlenmemiştir.
2.4.5.2. Etnik Köken
Etnik köken; kemik yoğunluğunun oluşumunu etkilemekte ve kişilerde değişik derecede osteoporotik kırıklara neden olmaktadır. Etnik köken nedeni ile kemik yoğunluğunda etkilenme, kemik büyüklüğündeki değişiklikler ve kalsiyum alımındaki farklılıklar nedeni ile de ortaya çıkmaktadır (69).
22
2.4.5.3. Cinsiyet
Kemik kütle ve yoğunluğu her iki cinsiyet arasında farklılıklar göstermektedir. Puberte evre dört ve beşte cinsiyetler arasındaki fark belirginleşir. Her yaş grubunda erkek çocuğunda kemik kütlesinin kız çocuklarına göre daha faza olduğu gösterilmiştir (68).
2.4.5.4.Puberte
Anormal pubertal gelişimi olan kişilerde osteopeni saptanması pubertedeki hormonal değişikliklerin normal kemik kütlesinin oluşumunda etkin olduğunu göstermiştir. Çocuklarda kemik kütlesini belirleyen faktörlerden bir tanesi puberte evresidir. Her iki cinsiyette de kemik kütlesinde pubertede %37-40 oranında artış olmaktadır (71).
2.4.5.5. Hormonlar
Cinsiyet steroidleri eksikliğinde yeniden yapılanma hızlanmaktadır. Osteoblastogenezis ve osteoklastogenezis aynı zamanda artar. Ancak kemik yıkım hızı, yapım hızından daha fazladır. Bu nedenle yeni oluşan kemik eskisinden daha az yoğundur. Kemik elemanları daha gevşektir, kortikal kemik kaybı görülür. Osteoblast ve osteositlerin yaşam süresi azalırken kemik yıkım hücreleri osteklastların yaşam süresi uzamaktadır. Kısaca cinsiyet steroid eksikliğinde kortikal genişlik trabekül sayısı, osteid ve mineralizasyon aktivitesi azalır. Bu etkiler östrojen tarafından sentezleri arttırılan M-CSF, İL-1, İL-6, TNF-a, RANK-L ve etkisi azalan osteoprotogerin ile ortaya çıkar.
Büyüme hormonu; kemik mineralizasyonunu doğrudan ve IGF-I, IGFBP-3 sentezinde azalmaya yol açarak dolaylı olarak etkiler. IGF-I; osteoblast farklılaşmasını, çoğalmasını ve fonksiyonlarını olumlu yönde etkileyen lokal büyüme faktörüdür.
23
Tiroid hormonları hem osteoblastik hem de osteoklastik aktivitevi artırır. Hipertiroidide osteklastik aktivite artışı daha ön plandadır ve kemik kütle kaybı gelişir. Artmış osteoblastik aktivite olsa bile kemik yıkımı karşılanamaz. (69)
Glukokortikoidler; çocukluk çağında çok çeşitli hastalıkların tedavisinde kullanılır ve çocukluk cağının en önemli osteoporoz nedenlerinden biridir. Glukokortikoidler doğrudan ve dolaylı olarak kemik mineralizasyonunu bozar. Etki kullanım süresine ve doza bağlıdır. Erişkinlerde inhale 5000 mg kümülatif dozun vertebral KMY’ de 1 SD kayıba yol açtığı gösterilmiştir. Glukokortikoidlerin uzun süreli kullanımında osteoblastik aktivite ve osteoblastlann yaşam süresi baskılanır ve osteoklastların yapımı artar ve yaşam süresi uzar. Trabeküler kemik kalınlığı azalır. Zamanla osteonekroz gelişir. Kortikal kemikte kayıp daha belirgindir. Diğer taraftan gastrointestinal sistemden kalsiyum emilimi azalır, renal kayıplar artar, ortaya çıkan sekonder hiperparatiroidi kemik kaybından sorumludur. Glukokortikoid kullanımı ile kemik kaybı bifaziktir. İlk birkaç ay hızlı kayıp dönemidir ve yaklaşık %10-20 kayıp olur. Daha sonraki aylarda kayıp hızı yavaşlar ve % 2-5’e iner (72).
2.4.5. 6. Beslenme
Uygun miktarda kemik kazanımı ve devamı için çeşitli nutrisyonel faktörlere gereksinim vardır. En önemlileri kalsiyum, fosfor, magnezyum, bakır, çinko, manganez gibi mineraller ve kemik matriks için gereken uygun miktarda enerji ve protein, D, C ve K vitaminidir. Beslenmede en önemli öğe uygun miktarda günlük kalsiyum ve vitamin D alımıdır.
2.4.5.7. Fiziksel Aktivite
Kemiğin yapım ve yıkımı metabolik faktörlerin yanı sıra mekanik faktörler ile de kontrol edilmektedir. Mekanostat teorisine göre, fiziksel aktivite kemik için gerekli fizyolojik etkin gerginliğin altına düştüğü zaman kemik yıkımı yapımından fazla olacaktır. Fizyolojik yüklenme sınırında ise kemik korunur hatta kemik yapımında artış olur. Aşırı fiziksel aktivite ise organize olamayan yeni kemik oluşur
24
(73). Fiziksel aktivite, mekano-reseptör görevi üstlenen osteositleri uyararak kemik yapımını arttırmaktadır. Çocuklar ve genç erişkinlerde kemiğe yüklenmeyi arttıran egzersizler alansal kemik mineral yoğunluğu (aKMY) ve Hacimsel kemik mineral yoğunluğu (vKMY) kontrollere göre anlamlı olarak arttırmaktadır (71). Koşma, atlama, sıçrama ve jimnastik hareketleri gibi fiziksel harekelerin özellikle puberte öncesi ve kemik yapımının hızlandığı puberte döneminde yapılması büyük önem kazanmaktadır (73).
Kemiğe yüklenmenin arttığı jimnastik ve halter gibi egzersizlerin uygulandığı kişilerde kemik kazanımında belirgin artış sağlanmıştır. Buna karşın yüzme gibi vücuttan ağırlığın kaldırıldığı sporlarda kemik kütlesinde artış saptanmamıştır (71).
Erişkin dönemde yapılan egzersiz ve bunun sonunda kazanılan kemik kütlesi egzersizin bırakılması ile ortadan kaybolmaktadır. Çocukluk çağında yapılan fiziksel aktivitenin erişkin dönemde kemik kaybının hız ve zamanlamasını etkileyip etkilemedği tam olarak bilinmemektedir, ancak erken dönemde yapılan yoğun fiziksel aktivite sonucunda kazanılan kemik miktarı erişkin döneme etki ettiğini gösteren çalışmalar vardır. Fiziksel aktivitenin etkileri bölgeye özgüdür. Yoğun olarak yapılan egzersiz hipotalamus-hipofiz-gonad aksını etkileyerek kan östrojen düzeylerinde düşme yapar ve kemik yoğunluğunu ters yönde etkiler (74).
2.4.6.Çocuk ve Adölesanlarda Osteoporoz Nedenleri
Çocukluk çağında osteoporoz nedenleri primer ve sekonder olarak tanımlanır (75). 2.4.6.1. Primer Nedenleri:
Çocukluk çağında, primer osteoporoz intrinsik iskelet defekti nedeniyle ortaya çıkan bir sorundur. Osteoporoza neden olan hastalıkların birçoğu bağ dokusunun kalıtsal hastalıkları olup, tek istisna idiyopatik juvenil osteoporozdur. Sekonder osteoporoz nedenlerine göre daha nadir görülürler.
25
Primer Osteoporoz
1. Osteogenezis İmperfekta (Oİ)
Oİ; 1/10 bin-1/15 bin sıklığında görülen, her iki cinsiyette eşit dağılım gösteren, tüm etnik grup ve ırklarda aynı oranda rastlanan, artmış kemik kırık riski, osteoporoz, deformiteler ve kısa boyla seyreden, çoğunluğu otozomal dominant olarak kalıtılan metabolik bir kemik hastalığıdır.
Tip 1 kollajeni kodlayan, 7 ve 17. kromozomlar üzerinde yerleşmiş COL1 A1 ve COL1 A2 genlerindeki 800' ü aşkın mutasyon etiyolojiden sorumludur, %10’undan daha azı otozomal resesif olarak kalıtılır (76).
1.Klinik Bulgular
Bulgular kemik dışında tip 1 kollajen içeren diş, deri ve sklerada da görülür. Klinik çok değişken olabilir. Bulgular doğumdan itibaren olabildiği gibi hiç görülmeyebilir. Tekrarlayan kırıklar, kronik kemik ağrısı, iskelet deformitesi, mavi sklera, eklem gevşekliği bulgular arasında yer alır. Hipoakuzi ve vertigo eşlik edebilir. Ağır olgularda ikinci trimesterde uzun kemiklerin eğikliği, kırıklar, ekstremite kısalığı ve azalan baş ekojenitesi ultrasonografik olarak gösterilebilir. Letal osteogenezis imperfekta intrauterin olarak kesin bir şekilde tanımlanamayabilir (77,78,79).
2.İdiyopatik Juvenil Osteoporoz (IJO)
Primer osteoporozun nadir nedenlerinden birisidir, ilk kez Dent ve arkadaşları tarafından tanımlanmıştır. İskelet dışı tutulumu olmayan kalıtımsal geçiş tanımlanmamış geçici çocukluk çağı osteoporozudur. İJO’ nun nedeni halen bilinmemektedir. Semptomlar genellikle pubertede başlar, daha önce sağlıklı olan 8-12 yaş grubu çocukta sırt, kalça ve ayakta ani ağrı ve yürüme güçlüğü ile ortaya çıkar. Vertebral kompresyon kırıkları sıktır, alt / üst segment oranının bozulmasına
26
neden olur. Uzun kemik metafizlerinde kırık oluşabilir. Muayene normal olabileceği gibi, kifoz, kifoskolyoz, güvercin göğsü, boy kaybı ve uzun kemik deformiteleri oluşabilir. İdiyopatik juvenil osteoporoz tanısı konulmadan önce mutlaka Oİ ve tüm sekonder osteoporoz nedenleri dışlanmış olmalıdır. Kemik mineral dansitesi ciddi olarak azalmıştır. Süngerimsi kemik volümü azalmıştır, düşük kemik yapım hızı mevcuttur (80,81).
Patofizyoloji: Nedeni bilinmemektedir. Ancak iskelet büyümesi sırasında artmakta olan yüke adapte olamaz ve sınır aşıldığı zaman kırıklar oluşmaya başlar.
2.4.6.2. Sekonder Osteoporoz:
Çocukluk ve adölesan yaş grubunda osteoporoz endokrin, nutrisyonel, kronik hastalıklar ve bazı tedaviler sonucunda sekonder olarak ortaya çıkabilir.
İmmobilizasyon: Mekanik uyarı her yaşta kemiğin güçlenmesi için en önemli etken olup, immobilizasyon osteoporozun en sık nedenidir. Frost’ un kemik mekanostat teorisine göre duyarlı osteositleri etkileyen doğal uyaranlar yerçekimi ve bölgesel kasların kontraksiyonudur. Mekanik stresin azalması osteoblast ilişkili kemik yapımını inhibe eder, osteoklast ilişkili kemik rezorbsiyonunu uyarır ve kullanmama osteoporozu denilen duruma yol açar. Sağlıklı kişilerde kas kitlesi kemik kitlesi ile yakın ilişkili bulunmuştur.
Nöromusküler hastalıklar: Temel nedeni aktivite kaybıdır. Serebral palsi en sık görülen nedendir. Osteoporozun ciddiyeti olgunun hastalığının ağırlık derecesi ile değişir. Büyüme ve beslenme problemleri aynı yönde etki yapar. Duchenne musküler distrofisi olan ve steroid kullanan olgularda vertebra kırıkları üçüncü yıldan sonra başlar ve 8 yıl içinde %75 olguda saptanır.
Renal hastalıklar: Kronik metabolik asidoza, kalsiyum ve fosfor kaybına neden olan ve steroid kullanılan durumlar ve transplantasyon, osteoporoz ile ilişkili bulunmuştur.
27
Endokrin hastalıklar: Trabeküler, kortikal ve total kemik dansitesi tip 1 diabetes mellitus çocuk ve adolesanlarda düşük bulunmuştur. Trabeküler kemik dansitesi hastalığın süresi ile, total kemik dansitesi ise HbAlc düzeyi ile ilişkili bulunmuştur. Çeşitli hipogonadal durumlarda osteoporoz görülür. özellikle cinsiyet hormonları osteoblastlara proliferasyon, farklılaşma, mineralizasyon ve gen ekspresyonu düzeyinde kuvvetli etkiye sahiptir. Hem kadın ve erkek hem de çocukta gonadal steroidler yaşam boyu kemik sağlığında en önemli faktördür. Yapısal puberte gecikmeli çocuklarda, puberte başlangıç yaşının diğer çocuklara göre daha geç olması nedeniyle, pik kemik kitlesine ulaşım gecikmekte ve osteopeni ya da osteoporoz için bu dönemde geçici risk oluşmaktadır. Atletik amenorede GnRH aksı bozuklukları ve Turner sendromunda östrojen azlığı, Prader Willi sendromunda yüksek kemik döngüsü, büyüme hormonu eksikliğinde kemik kitle yapısındaki eksiklik temel rolü oynar (82).
Malnutrisyon/Malabsorbsiyon: Nutrisyonel yetersizliğe bağlı düşük ÎGF-I düzeyleri ile kemik oluşumu azalmaktadır. Anoreksiya nervoza, blumia, malnutrisyon vitamin (C, K, D) ve bakır eksiklikleri, total parenteral beslenme, kortizol yüksekliği, düşük vücut kütle indeksi, hipogonadizm ve düşük Ca düşük mineral yoğunluğu ile ilişkilidir. Çölyak, enflamatuar barsak hastalığı, kolestatik karaciğer hastalıkları gibi durumlarda proenflamatuar sitokinler, glukokortikoid kullanımı, büyüme geriliği, gecikmiş puberte, inaktivite, yetersiz Ca ve D vitamini osteoporoza neden olur (83).
Kronik hastalıklar: Juvenil romatoid artritte artan osteoklast aktivitesi kemik rezorpsiyonunu artırır. Epilepsili çocuklarda multifaktöriyel olmakla birlikte, antikonvülzif tedavinin osteoporoza yatkınlığı artırdığı saptanmıştır. Antikonvülzan tedavinin kemik mineral dansitesi üzerine etkisi, uzun zamandan beri bilinmektedir. Antikonvülzanlar hepatik mikrozomal enzim indüksiyonu yaparak 25(OH) D vitamini metabolizmasını hızlandırmakta ve onun inaktif formu olan 24,25(OH)2 D3’e dönüşümünü sağlamaktadır.
28
İlaçlar: Steroidler, metotreksat, heparin başlıca olmak üzere birçok ilaç osteoporotik etkiye sahiptir. Sistemik glukokortikoid kullanımında azalan kemik döngüsü ve kemik yapımını izleyen hızlı bir kemik kaybı vardır. Osteoblast ve osteoklastların apoptozu, azalan osteoklast gen ekspresyonu, azalan osteoblastogenezis, bozulan intestinal kalsiyum absorbsiyonu ve renal reabsorbsiyonun yanı sıra, RANK-RANKL-OPG sistemini de etkileyerek kemik rezorpsiyonuna neden olur. Metotreksat kullanımı osteoblastik protein sentezini ve vitamin C metabolizmasını bozarak etki eder. Uzun süre heparin kullanılması da kemik rezorbsiyonunu artırıp kollajen sentezini inhibe ederek kemik metabolizmasını etkiler.
Prematürite: Normalde kemik mineralizasyonunun %80’i son trimesterde oluşur. Prematüre osteopenisi postnatal, intrauterin dönemde kazanılması gereken miktarı karşılayamayan yetersiz kalsiyum ve fosfor alınımına bağlıdır. Yetersiz kilo alımı ve intrauterin ortama benzemeyen çevre faktörleri de katkıda bulunur (77). 2.4.7.Çocukluk Çağı Osteoporozunda Tanı, Tedavi Çocuk ve Adölesanlarda Kemik Mineralizasyonunun Değerlendirilmesi
Osteoporoz çocukluk çağının nadir bir sorunu olmasına rağmen, ciddi ağrı, kırık ve eğer düzgün tedavi uygulanmazsa yaşam boyu devam edebilecek hareket kısıtlılığına yol açan bir hastalıktır. Çocukluk çağında osteoporoz sıklıkla birkaç kırık oluştuktan veya eşlik eden kronik bir hastalığın değerlendirilmesi sırasında düşünülmektedir. Bu nedenle artmış farkındalık en az erişkinler kadar önemlidir çünkü çocukluk çağı ve adölesan dönemde gelişecek kemik mineral yoğunluğunda azalma erişkin dönmede artmış osteoporoz riski oluşturacaktır.
1.Kemik Metabolizmasının Radyolojik Değerlendirilmesi
Kemik mineral içeriği, çeşitli yöntemler ile değerlendirilebilir. Çocuklukta bugün yaygın olarak DEXA, kantitatif bilgisayarlı tomografi (KBT) ve kantitatif ultrasonografi (KUS) kullanılmaktadır. Bu yöntemlerin veriyi elde etme yolları
29
farklıdır ve kısmen tartışmalıdır. İdeal teknik kolay uygulanmalı, pahalı olmamalı, zararlı olmamalıdır. Ayrıca periferik ve vertebral iskeletin kortikal ve trabeküler kemiğinin ayrı ayrı volüm ve yoğunluğunu verebilmeli, kemik boyundan, vücut ölçüleri ve yumuşak dokudan etkilenmemelidir (83).
1.X ray
Yoğunluk azalmasının X ray ile gösterilebilmesi, kemik kütlesinde %20-50 oranında kayıp olduğunda mümkündür. Kemik mineralizasyonunda kayıp ile birlikte vertebrada deformite ve bikonkavitede artma görülür. Tarama testi ve izlem için uygun değildir (83).
2.Radyografik Absorbsiyometri (RA)
Çok eski ve kullanımı bırakılmış bir teknik olmakla beraber, bilgisayar programlarının modernleşmesi ile bu teknik çocuklukta ve erişkinlerde tekrar kullanılmaya başlamıştır ancak normal değerler geliştirilmemiştir. Ayrıca bu yöntem ile gelecek kırık riskinin belirlenmesinde kısıtlılıklar vardır (68).
3.Ultrasonografi
Kemik kantite ve kalitesini gösterir. Kortikal ve spongiyöz kemik dışında kemik iliğinden de veri alır. Çocuklar için radyasyon olmaması ve taşınabilir olması nedeni ile kullanışlıdır. Normal verilere gereksinim vardır, ayrıca ayağın yerleştirilme pozisyonu ve çocuğun büyümesi nedeniyle izlem yapılması zordur (84). 4.Lineer Absorbsiyon Yöntemleri
En sık kullanılan yöntem DEXA’dir. DEXA ile yapılan ölçümler, alansal yoğunluğu vermektedir (aKMY g/cm2). DEXA ölçümünde kullanılan KMÍ (kemik mineral içeriği), kemiğin çizgisel bir bölümünde bulunan mineral miktarını
30
göstermektedir (lineer yoğunluk). DEXA’ da KMİ için kullanılan birim gramdır. Yoğunluk ise bir maddenin ağırlığının hacmine oranıdır. DEXA’da taranan alan ile bu alandaki mineral miktarı arasındaki orandır. Bu nedenle gerçek yoğunluğu vermez. Elde edilen sayı alansal KMY’ dir. Daha büyük bir vertebra daha geniş bir alana sahip olduğundan daha farklı görünecektir. Uzun boylu ve büyük vertebrası olan kişi ile aynı yaşta kısa boylu ve küçük vertebrası olan kişinin KMY farklı olacaktır. İki boyutlu dansitometre çekimi buna neden olmaktadır.
aKMY klinik olarak kullanılabilir olmasına rağmen kemik kalınlığından etkilenmektedir. Çocuklarda kemik boyutu değiştiğinden KMY; yaş, kemik yaşı ve antropometrik değerler ile değişkenlik gösterir. Bu nedenle, boy, puberte ve kemik yaşına göre hesaplanan normal değerler kişinin klinik durumuna göre kullanılmalı ve z skoru bu şekilde hesaplanmalıdır.
Kemik boyutuna göre gerçek lomber vertebral ve femoral KMY değerleri matematik modeller (vertebra küp veya silindir, femur boynu silindir kabul edilerek) kullanılarak tahmin edilebilir (85). Hacimsel KMY (vKMY g/cm3), yaş ve antropometrik ölçüler sonucu kemik geometrisinde oluşan değişikliklere bağlı hataları azaltır. Bununla birlikte, trabeküler ve kortikal kemiği ayıramaz yalnızca entegre KMY hakkında bilgi verir. Adolesan ve çocukluk çağında lomber vKMY’ deki artış, aKMY’ ye göre daha az olmasına rağmen yine de yaşa ve büyümeye bağlıdır. Yaşa ve büyümeye göre olan bu artış kızlarda erkeklere göre daha yüksek değerlerdedir. Bunun nedeni kız çocuklarında vertebranın kesitsel alanının erkeklere göre %11 daha küçük olmasıdır. Sonuçta, vKMY yaşın etkisini kaldırmakla beraber kemik şekli hakkında bir tahmine dayanmaktadır.
DEXA Ölçümünde Kullanılan Cihazlar
- Hologic QDR 4500 A (fan beam)
- Hologic QDR 4500 Elite (fan beam)
- Hologic QDR 1000 (pencil beam)
- Norland
31
‘Pencil beam ’ tekniği ile ölçüm yapılan tekniklerde ışın hastanın arkasından tek bir ışın hüzmesi şeklinde verilirken, ‘fan beam’ tekniğinde ışın yelpaze şeklinde verilmektedir. Hologic ‘Pencil beam’ ve ‘fan beam’ arasındaki ilişki yaklaşık %97’dir. Bir makinede yapılan ölçümün diğer makine ile karşılaştırılması güçtür. Örneğin Lunar marka makinede çekilmiş olan kalça KMY, Hologic marka makinede çekilen KMY’ den yaklaşık %5 kadar daha fazladır. Eğer mutlak karşılaştırma yapılması gerekiyorsa bazı özel formüller kullanılabilir (85).
Kemik mineral yoğunluğunun değerlendirilmesinde; çekim hangi bölgeden yapılıyorsa o bölgenin yoğunluğu değerlendirilmektedir ve tüm vücudu yansıtmamaktadır. Trabeküler kemiğin yoğun olduğu bölgeler ilk kırılmaya müsait bölgelerdir. Lomber vertebra ve kalçanın özellikle ölçülmesinin nedeni trabeküler kemiğin fazla olduğu bölgeler olması nedeniyledir. Unutulmaması gereken KMY tedavi veya hastalık seyrinin izlemi için kullanılacaksa aynı bölgelerden ölçüm yapılmalıdır (30,81).
KMY ölçümü artmış kırık riski olan kişiler için planlanan bir yöntemdir. Tedavi uygulamaları tek bir ölçüm üzerine yapılmamalıdır. Teknik olarak uygun koşullarda tüm olgularda lomber bölgeden ve baş dahil olmadan yapılan tüm vücut KMY ölçümü kullanılmalıdır.
2.4.8.Kemik Metabolizmasının Biyokimyasal Göstergeleri
Biyokimyasal belirleyiciler, tanı ve hastaların tedavisinin izleminde önemli yer tutmaktadır. Yapım ve yıkım belirleyicileri olarak iki grupta toplanırlar. İdrar ve serumda ölçülebilirler. İdrarda ölçülenler; idrar kreatinine veya 24 saatlik örneğe göre değerlendirilmelidir. Hem kemik yapım hem de yıkım belirteçleri çocuk ve adölesanlarda erişkinlere göre daha yüksektir ve büyüme hızına bağlıdır. Kemik metabolizmasının idrar ve serum belirteçleri sadece iskeletten salınım hızı ile değil aynı zamanda karaciğer ve böbrekten atılım hızı ile de orantılıdır. Unutulmaması gereken; idrar kreatinin atılımı kas kütlesinin göstergesidir ve birçok klinik durumda anormal olabilir. Kemik belirtecinin kreatinine oranı sadece artmış kemik veya
32
kollajen yapım yıkımını göstermez, aynı zamanda azalmış kas kütlesi nedeni ile de ortaya çıkabilmektedir (83).
2.4.9. İki Enerjili x-ray Absorbsiyometri (DEXA)
Çocuk ve erişkin hastalarda güvenli ve en yaygın kullanımı olan yöntemdir (86,87,88). Enerji kaynağı X-ışını ve kollimasyon ışın pencil beam ya da fan beam şeklindedir. BSİ DEXA cihazının ana ünite ve elemanları aşağıda sıralanmıştır: i) İnceleme masası
ii) Tarayıcı sistem iii) X-ışını tüpü iv) Detektör
v) Foton çoğaltıcı sistem (PMT) vi) Amplifiyeler
vii) Bilgisayar
viii) Görüntüleme ünitesi (monitörü)
DEXA' da bir x-ray tüpü enerji kaynağı olarak kullanılır. Sistem genellikle 70 ve 140 keV olmak üzere iki farklı seviyede enerji çıkışı sağlar. Kemik ve yumuşak dokular arasında attenüasyon düşük enerjiler için daha fazladır. Her iki enerjinin attenüasyon profilleri bilgisayar aracılığı ile formüllere girilir ve kemik komponenti için sonuç hesaplanır. Standart DEXA çalışması lomber vertebra ve proksimal femur ölçümlerini kapsar. Proksimal femur değerlendirilmesinde, femur boynu, trokanter ve Ward üçgeni bölgesinden kemik mineral yoğunluğu belirlenir. Tüm kalça eklemi veya femur boynuna çizilen ilgi alanı fraktür riski değerlendirmesi için en uygun bölgedir, kalça üzerine ilgi alanı uygulaması daha geniş bir kemik örneklemesi sağlaması nedeniyle daha kesin bir takip kriteri olabilir (86,89). Hastayı maruz bıraktığı radyasyon dozu vertebra grafisinin 1/1000’i kadardır. Bu tekniğin asıl avantajları rezolüsyonun iyi olması, görüntü kalitesinin iyi olması ve görüntüleme zamanının 20-40 dakikadan 2-5 dakikaya inmiş olmasıdır. Küçük deney hayvanlarında da yüksek rezolüsyonlu bölgesel veya tüm vücut ölçümüne olanak
33
sağlaması, DEXA yöntemini deneysel çalışmalarda da en çok kullanılan yöntem haline getirmiştir. Tüm vücut taramalarında ilgi alanları uygulanarak bölgesel kemik yoğunluğu ve yumuşak doku analizi yapmak mümkündür.
Küçük deney hayvanlarında yüksek rezolüsyonlu bölgesel taramalar özellikle girişimsel çalışmalarda büyük avantaj sağlamaktır.
Bir DEXA sisteminin doğruluğu, teknik olarak, gerçek kemik mineral yoğunluğunu ne ölçüde belirlediğidir. Değişim katsayısı (CV) tekrarlayan ölçümler ile saptanır. DEXA sisteminin sağladığı yüksek foton akışı CV değerini % 2- 4’ten yaklaşık %1’e indirmiştir. Genel olarak klinikte ölçümler yılda bir tekrarlanır. Hastalara steroid başlanması veya overektomi yapılması gibi durumlarda planlama değiştirilir (90). İnsan dışında küçük deneklerle uygulanan görüntüleme protokollerinde, CV değeri, o an kullanılan cihaz ve denekler için yeniden hesaplanmalıdır. Örnek olarak kliniğimizde yürütülen Holagic QDR 4500A sistemi için üretici firma tarafından belirtilen küçük deney hayvanları modu CV değeri % 1.2’dir. Araştırma protokolünde belirlenen ilgi alanları için CV değerlerini saptamak üzere çalışma grubu dışından ve aynı yaş grubundan bir sıçana, 10 ardışık tüm vücut DEXA taraması yapıldıktan sonra uygulanan her bir ilgi alanı için CV= 100 x (standart sapma/ortalama) formülü kullanılarak CV değerleri belirlenmektedir (91).
Deney hayvanlarının tür ve cinsiyetine bağlı olarak BMD ve BMC değerleri farklılık gösterir. Deney planlanırken, DEXA sisteminde denekler için normallerin tanımlandığı bir veri tabanı olmadığı unutulmamalıdır (92)
34
3. GEREÇ VE YÖNTEM
Bu çalışma için; Dumlupınar Üniversitesi Hayvan Deneyleri Yerel Etik kurulundan 27/07/2016 tarih ve 2016.09.01 karar numarasıyla onay alındı. Çalışma Eylül 2016 – Ekim 2016 tarihleri arasında Dumlupınar Üniversitesi Deney Hayvanları Yetiştirme Uygulama ve Araştırma Merkezi’nde (DEHYUAM) gerçekleştirildi. Dumlupınar Üniversitesi DEHYUAM’ de üretilmiş, Ağırlıkları 200-300 gr arasında değişen gebe Wistar-albino grubu ratların yenidoğan bebeklerinde üzerinde çalışma yapıldı. 10 adet gebe rat randomize olarak her bir grupta 2 rat olacak şekilde toplam 5 çalışma grubuna ayrıldı;
1. Grup: Herhangi bir ilaç yada müdahalede bulunulmayan kontrol grubu, 2. Grup: Düşük doz enoksaparin grubu (1000 anti-Xa IU/kg clexane subkutan
enjekte edildi),
3. Grup: Yüksek doz enoksaparin grubu (2000 anti-Xa IU/kg clexane subkutan enjekte edildi),
4. Grup: Düşük doz enoksaparin + D vitamini grubu (1000 anti-Xa IU/kg clexane subkutan enjekte edilecek ve 50.000 IU/kg D vitamini per oral verildi),
5. Grup: Yüksek doz enoksaparin + D vitamini grubu (2000 anti-Xa IU/kg clexane subkutan enjekte edilecek ve 50.000 IU/kg D vitamini Per oral verildi),
Ratlar doğal ortamlarında çiftleştirildi. Gebe oldukları, Servikal sıvılarından alınan smear örnekleri ile kesinleştirildi. Gebe kaldıktan sonra her bir rat ayrı ayrı metal parmaklığı olan plastik kafeslere yerleştirildi. Ratların bulundukları Oda sıcaklığı 21-23 oC (ortalama 22o C) tutularak normotermik olmaları sağlandı. Tüm gebe ratlar standart fare yemi olan %21 protein içeren Pellet yem ile beslendi, su ihtiyaçları şehir şebekesinden karşılandı ve gece/gündüz döngüleri 12/12 saat olacak şekilde ayarlandı. Düşük doz ve yüksek doz enoksaparin verilecek olan ratlara gebe kaldığı ilk günden doğuma kadar olan sürede hergün enoksaparin (Clexane® 6000 anti-Xa / 0.6 ml kullanıma Hazır Enjektör, sanofi) subkutan uygulandı. Gebelik sonunda her bir gruptan elde edilen ortalama sağlıklı 7 rat, toplamda 35 adet yenidoğan ratın kemik mineral yoğunluğu (KMD) ölçümleri; Dumlupınar Üniversitesi Tıp Fakültesi



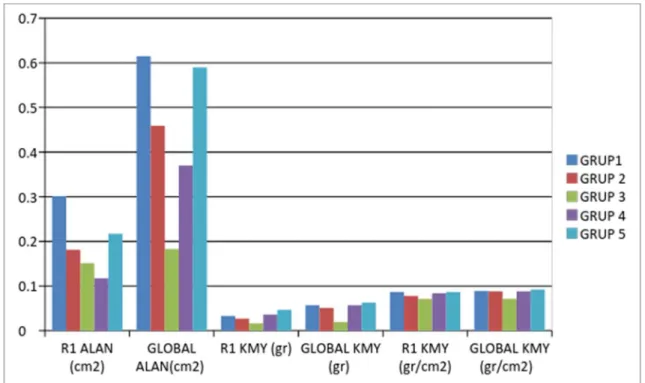
![Tablo 4.2. Tüm Rat Gruplarının R1 ve Global Kemik Mineral Yoğunluğu [gr/cm 2 ] Değerleri Açısından Kontrol grubu İle Karşılaştırılması](https://thumb-eu.123doks.com/thumbv2/9libnet/4376191.73789/40.892.160.798.208.615/gruplarının-global-mineral-yoğunluğu-değerleri-açısından-kontrol-karşılaştırılması.webp)