T.C.
DĠCLE ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ
ĠÇ HASTALIKLARI ANABĠLĠM DALI
BÖLGEMĠZDE VĠRAL HEPATĠTLERDE HEPATĠT E VĠRÜS
ENFEKSĠYONU SIKLIĞI VE RĠSK FAKTÖRLERĠNĠN
BELĠRLENMESĠ
Dr. Songül BESKĠSĠZ
ĠÇ HASTALIKLARI UZMANLIK TEZĠ
TEZ DANIġMANI
Prof. Dr. Kendal YALÇIN
T.C.
DĠCLE ÜNĠVERSĠTESĠ TIP FAKÜLTESĠ
ĠÇ HASTALIKLARI ANABĠLĠM DALI
BÖLGEMĠZDE VĠRAL HEPATĠTLERDE HEPATĠT E VĠRÜS
ENFEKSĠYONU SIKLIĞI VE RĠSK FAKTÖRLERĠNĠN
BELĠRLENMESĠ
Dr. Songül BESKĠSĠZ
ĠÇ HASTALIKLARI UZMANLIK TEZĠ
TEZ DANIġMANI
Prof. Dr. Kendal YALÇIN
i
ÖNSÖZ
Bilimsel düĢünme ve çalıĢmayı bizlere öğreten, engin bilgi ve birikimlerini bizimle paylaĢan, bugünlere gelmemizde büyük emeği olan, hekimliği bizlere öğreten değerli hocamız Prof. Dr. Ekrem MÜFTÜOĞLU‘na baĢta olmak üzere, Ġç Hastalıkları A.B.D. BaĢkanımız Prof. Dr. M.Emin YILMAZ‘a yetiĢmemde büyük emekleri olan bütün değerli öğretim üyeleri; Prof. Dr. Kendal YALÇIN, Prof. Dr. Mehmet Orhan AYYILDIZ, Prof. Dr. Abdurrahman IġIKDOĞAN, Prof. Dr. Alpaslan Kemal TUZCU, Prof. Dr. Muhsin KAYA, Prof. Dr. Ali Kemal KADĠROĞLU, Doç.Dr. Muhammed Ali KAPLAN, Doç. Dr. Mehmet KÜÇÜKÖNER, Doç. Dr. Zülfükar YILMAZ, Yrd. Doç. Dr. YaĢar YILDIRIM, Yrd. Doç. Dr. Zuhat URAKÇI, Uzman Dr. Zafer PEKKOLAY, Uzman Dr. Hikmet SOYLU, Uzman Dr. Abdullah KARAKUġ, Uzman Dr. Hüseyin KAÇMAZ, Uzman Dr. Zeynep ORUÇ, Uzman Dr. Halis YERLĠKAYA, Uzman Dr. Belma Özlem BALSAK, Uzman Dr. Bahattin GÖKDEMĠR‘e teĢekkürlerimi sunarım.
Tezimi oluĢturmamda büyük emeği geçen tez danıĢmanım Ġç Hastalıkları öğretim üyelerinden Prof. Dr. Kendal YALÇIN hocama teĢekkürlerimi sunarım.
Tezimi hazırlarken bana yardımcı olan Uzman Dr. Elif Tuğba TUNCEL ve Uzman Dr. Ali Veysel KARA‘ya teĢekkürlerimi sunarım.
Tezimi hazırlamamda büyük emeği geçen Biyoistatistik A.B.D. öğretim üyelerinden Prof. Dr. Ömer SATICI hocama katkılarından ve sabrından dolayı teĢekkürlerimi sunarım. Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.B.D. Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D. Göğüs Hastalıkları ve Tüberküloz A.B.D. ve Radyoloji A.B.D. baĢkanlarına ve değerli öğretim üyelerine, birlikte çalıĢmaktan büyük mutluluk ve onur duyduğum asistan arkadaĢlarıma ve Ġç Hastalıkları A.B.D. çalıĢanlarına teĢekkürlerimi sunarım.
Hastaları taramamda büyük yardımı dokunan hastanemizin Probel sorumlusu Cahver YILDIRIM‘a teĢekkürlerimi sunarım.
Ayrıca bugünlere gelmemde büyük pay sahibi olan ve desteklerini hiçbir zaman benden esirgemeyen annem, babam, kardeĢlerime ve her zaman en büyük desteğim olan değerli eĢime ve güzel kızım Elçin Bejan‘a teĢekkürlerimi sunarım.
ii
ÖZET
Amaç: Bölgemizde viral hepatitli hastalarda kontrol grubuyla karĢılaĢtırmalı
olarak HEV sıklığının ve iliĢkili risk faktörlerinin belirlenmesi amaçlandı.
Yöntem: 2011 Mayıs ve 2015 Mart tarihleri arasında Dicle Üniversitesi Tıp
Fakültesi Gastroenteroloji Bilim Dalı‘na baĢvuran 18 yaĢ ve üzeri 1025 hasta alındı. Retrospektif olarak incelenen hastaların epidemiyolojik, klinik, laboratuar parametreleri analiz edildi. ÇalıĢma grupları HBsAg pozitif (n=284), HCV pozitif (n=38), anti-delta pozitif (n=82) ve HBsAg, anti-HCV ve anti-anti-delta‘nın negatif olduğu kontrol grubundan (n=621) oluĢturuldu. Anti-HEV IgG ve IgM mikro-ELISA yöntemi ile çalıĢıldı.
Bulgular: Tüm hastalarda yaĢ ortalaması 49.29±15.39 yıl idi ve anti-HEV IgG
pozitifliği %56.4 (578/1025) saptandı. ÇalıĢma gruplarında HEV seropozitifliği HCV hastalarında %76.3 (29/38) oranıyla en yüksek, HBV hastalarında %50 (142/284), HDV hastalarında %70.7 (58/82), kontrol grubunda ise %56.2 (349/621) tespit edildi (p=0.001). ÇalıĢma gruplarında yaĢ ortalaması en yüksek HCV hastalarında 51.84±15.77 yıl ile saptandı (p=0.001). Anti-HEV IgG pozitifliği yaĢ gruplarına göre değerlendirildiğinde; en yüksek oranın >61 yaĢ bireylerde olduğu (141/578, %24.4), en düĢük oranın ise 18-30 yaĢ grubunda olduğu (68/578, %11.8) tespit edildi (p<0.001).
Anti-HEV IgG pozitifliğini etkileyen faktörlerin lojistik regresyon analizinde; ileri yaĢ, kırsal kökenli olmak, eğitim seviyesinin düĢük olması, evli olmak, hayvanlarla temas öyküsünün olması, ALT değerinin yüksek, GGT değerinin yüksek, trombosit değerinin düĢük, anti-delta pozitif olması, anti-HCV pozitif olması ve anti-HAV IgG pozitif olması HEV seropozitifliğinde anlamlı risk faktörleri olduğu görüldü.
Sonuç: Bu çalıĢma ile bölgemizde HCV ve HDV kökenli viral hepatitli
hastalarda kontrol grubuna göre anlamlı olarak daha yüksek oranda HEV seropozitifliği saptandı. HEV infeksiyonunun bölgemizde eğitim seviyesi düĢük olanlarda, kırsal alanda yaĢayanlarda, ileri yaĢta olanlarda, evli olanlarda, hayvancılıkla uğraĢanlarda, sirotik hastalarda daha sık görüldüğü saptandı. Ayrıca ALT ve GGT yüksekliği, trombosit düĢüklüğü, anti-delta pozitifliği, anti-HCV pozitifliği ve anti-HAV IgG pozitifliği lojistik regresyon analizinde anti-HEV IgG pozitifliğinde risk faktörü olarak
iii belirlenmiĢtir. Bu bulgular HEV infeksiyonunun kontrolünde riskli hastaların belirlenmesi ve koruyucu önlemlerin alınması konusunda katkı sağlayabilir.
Anahtar sözcükler: Hepatit E virüsü, hepatit B virüsü, hepatit C virüsü, hepatit
iv
ABSTRACT
Aim: We aimed to detect prevalence and associated risk factors of hepatitis E
virüs in patients with viral hepatitis as compared to control group in our region.
Material and methods: 18 years old or older 1025 patients who admitted to
Dicle University Faculty of Medicine Department of Gastroenterolgy between may 2011 and march 2015 were enrolled to our study. Epidemiological, clinical and laboratory parameters of patients were analysed retrospectively. Patients were divided in to groups as HBsAg positive (n=284), anti-HCV positive (n=38), anti-delta positive (n=82) and control group (n=621) which HBsAg, anti-HCV ve anti-delta were negative in these patients. Patients files and test results were analysed retrospectively. Anti-HEV IgG ve IgM were studied by micro-ELISA method.
Results: The mean age of the patients was 49.29±15.39 years and Anti-HEV IgG seropositivity was determined 56,4% of all patients (578/1025). HEV seropositivity was 76,3% in patients with HCV (29/38), 50% in patients with HBV (142/284), 70,7% in patients with HDV (58/82) and 56.2% in control group (349/621). Highest mean age in the groups was detected in HCV patients as 51.84±15.77 years ( p=0.001). Rate of Anti-HEV IgG seropositivity according to age groups was highest in patients older than 61 years old ( 141/578, 24.4%) and lowest in patients between 18-30 years old (68/578, 11.8%) (p<0.001). Advanced age, rural origin, low education level, being married, history of contact with animals, high ALT levels, high GGT levels, low platelet levels, anti-delta seropositivity, ani-HCV seropositivity and anti-HAV IgG seropositivity was found to be significant risk factors for HEV seropositivity in the logistic regression analysis.
Conclusion: The study revealed that statistically significantly higher HEV
seropositivity in patients with HCV and /or HDV according to control group in our region. HEV seropositivity was more frequent in married patients and patients with low education level, rural origin and cirrhosis. These findings may contribute the control of HEV infection, determination of patients at risk for HEV infection and taking preventive measures.
Keywords: Hepatitis E virus, hepatitis B virus, hepatitis C virus, hepatitis D
v
ĠÇĠNDEKĠLER
ÖNSÖZ ... ÖZET ... ABSTRACT ... ĠÇĠNDEKĠLER ... TABLO LĠSTESĠ ………. ġEKĠL LĠSTESĠ... SĠMGELER VE KISALTMA LĠSTESĠ ... 1. GĠRĠġ VE AMAÇ ... 2. GENEL BĠLGĠLER ... 2.1. Hepatit E Virüsü... 2.1.1. Tarihçe... 2.1.2 .Virüsun Genel Özellikleri... 2.1.3. Genom ve Proteinler...2.1.3.1. Open Reading Frame 1 (ORF-1)……… 2.1.3.2. Open Reading Frame 2 (ORF-2) ……….
2.1.3.3. Open Reading Frame 3 (ORF-3) ……… 2.1.4. HEV Genotipleri... 2.1.5. Replikasyon Döngüsü... 2.1.6. Patogenez ve Ġmmünite... 2.1.7. Klinik Bulgular... 2.1.8. Epidemiyoloji………. 2.1.8.1. BulaĢ Yolları……….
2.1.8.2. YaĢ ve Cinsiyet Dağılımı………. 2.1.8.3. Mevsimsel Dağılım………. 2.1.8.4. Coğrafi Dağılım……… 2.1.9. Laboratuvar Tanısı……… 2.1.10. Tedavi ve Korunma……….. 3. MATERYAL-METOD ... 4. BULGULAR ... 4.1. Hastaların Epidemiyolojik Özellikleri………..
i ii iv v vii vii viii 1 2 2 2 3 5 6 6 7 7 9 11 12 13 13 13 13 14 18 19 21 23 23
vi 4.2. Klinik Özellikler...29 4.3. Laboratuvar………... 4.4. Lojistik Regresyon Analizi………... 5. TARTIġMA ... 6. SONUÇ... 7. KAYNAKLAR ... 29 30 32 37 38
vii
TABLO LĠSTESĠ
Tablo 1: Viral hepatitlerin geliĢiminde bazı önemli aĢamalar Tablo 2: Dünyadaki HEV epidemileri
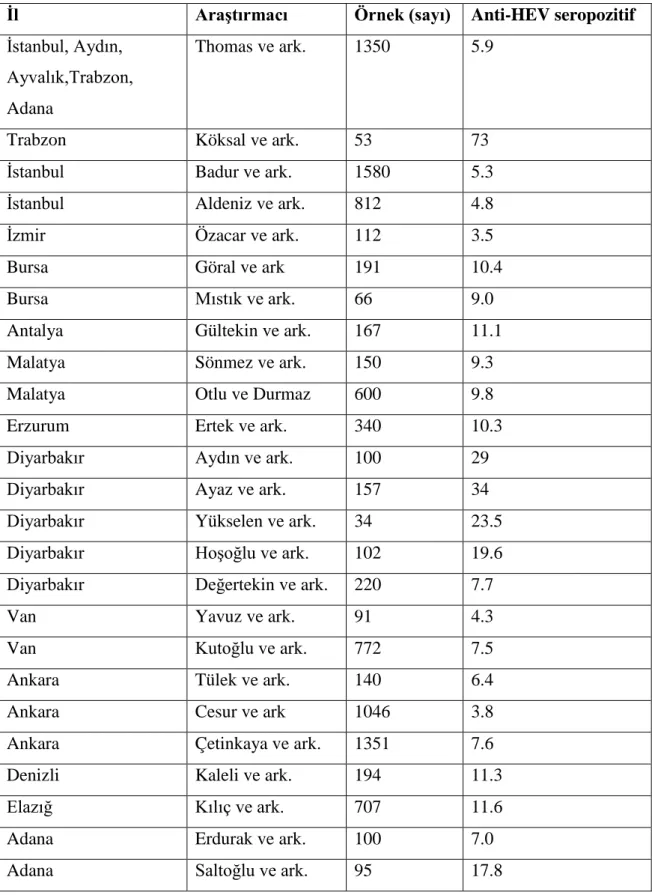
Tablo 3: Türkiye‘de anti-HEV seropozitifliği
Tablo 4: Anti-HEV IgG seropozitifliğin yaĢ spesifik seroprevalansı
Tablo 5: Anti-HEV IgG seropozitifliğin gruplara göre yaĢ spesifik seroprevalansı Tablo 6: Tüm olguların epidemiyolojik ve klinik özellikleri
Tablo 7: Tüm olguların laboratuvar parametreleri
Tablo 8: Gruplar arası epidemiyolojik ve klinik özelliklerin karĢılaĢtırılması Tablo 9: Grupların laboratuvar parametreleri
Tablo 10: Anti-HEV IgG pozitifliğini etkileyen faktörlerin lojistik regresyon analizleri
ġEKĠL LĠSTESĠ
ġekil 1: HEV üç boyutlu ve elektron mikroskopi görünümü ġekil 2: HEV‘in genomik yapısı
ġekil 3: ORF-1 bölgesinin Ģematik organizasyonu
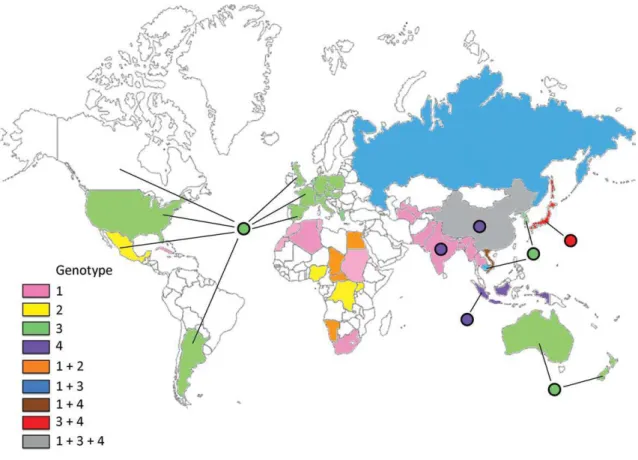
ġekil 4: Ġnsan ve domuz Hepatit E virüsunun filogenetik analizi ġekil 5: HEV genotiplerinin dünya üzerindeki dağılımı
ġekil 6: HEV‘nun replikasyon döngüsü ġekil 7: HEV vakalarının global dağılımı
ġekil 8: Hepatit E virüsü enfeksiyonunun zaman çizelgesi ġekil 9: Farklı çalıĢma gruplarında anti-HEV IgG pozitifliği ġekil 10: Tüm olgularda cinsiyete göre anti-HEV IgG pozitifliği ġekil 11:Anti-HEV IgG pozitif olguların yaĢ ve cinsiyet dağılımı
viii
SĠMGELER VE KISALTMA LĠSTESĠ
Ab : AntikorABD : Amerika BirleĢik Devletleri Ag : Antijen
ALT : Alanin aminotransferaz AST : Aspartat aminotransferaz DNA : Deoksiribonükleik asit EIA : Enzyme immunoassay
ELISA : Enzyme linked immunosorbent assay GGT : Gama Glutamil Transpeptidaz
HBsAg: Hepatit B surface (yüzey) antijeni HAV:Hepatit A virüsü
HBV : Hepatit B virüsü HCV : Hepatit C virüsü HDV : Hepatit D virüsü HEV : Hepatit E virüsü
ICTV : The International Committee on Taxonomy of Virüses IgA : Immünglobülin A
IgG : Immünglobülin G IgM : Immünglobülin M ORF : Open reading frame PCR : Polymerase chain reaction
RbRp : RNA‘ ya bağımlı RNA polimeraz RNA : Ribonükleik asit
RT-PCR : Revers transcriptase polymerase chain reaction UTR : Untranslated region
1
1. GĠRĠġ VE AMAÇ
Hepatit E virüsü (HEV) 27- 34 nm büyüklüğünde, zarfsız, ikozahedral yapılı, tek sarmallı ve pozitif polariteli bir RNA virüsüdür (1). Hepatit E virüsü, hepatit A virüsü (HAV)‘nden sonra fekal-oral yolla bulaĢan hepatitin en sık görülen ikinci sebebidir. Hepatit E virüsünün neden olduğu hepatit kliniği asemptomatik bir tablodan fulminan hastalığa kadar değiĢen spektrumlarda görülebilir (2).
Dünyadaki yaygınlığı, ekonomik geliĢme ile yakından iliĢkili olup coğrafik bölge, sosyoekonomik düzey ve yaĢ gibi faktörlere bağlı olarak sıklığı büyük ölçüde değiĢmektedir (3,4,5). GeliĢmiĢ ülkelerde seropozitiflik oranları %1 ile 20 arasında olduğu gösterilmiĢtir (6). Ülkemizde ise yapılan çalıĢmalarda HEV seroprevalansının %3.5-73 arasında olduğu gösterilmiĢtir (7,8).
Bu çalıĢmada Dicle Üniversitesi Tıp Fakültesi Gastroenteroloji Bilim Dalı‘na baĢvuran 18 yaĢ ve üzeri viral hepatitli hastalarda HEV seropozitifliğinin retrospektif olarak araĢtırılması, olguların epidemiyolojik, klinik, laboratuvar özelliklerine göre değerlendirilip HEV infeksiyonu ile iliĢkili risk faktörlerinin belirlenmesi amaçlanmıĢtır.
2
2. GENEL BĠLGĠLER
2.1. Hepatit E Virüsü 2.1.1. Tarihçe
Ġnsanlık tarihinin en eski hastalıklarından olan viral hepatitler ilk kez Hipokrat tarafından tıbbi kayıtlara geçilmiĢtir. Hastalığın ilk bilimsel tanımı ise 1865 yılında ünlü patolog Virschow tarafından ―kataral ikter‖ olarak yapılmıĢtır (9). II. Dünya SavaĢı‘nda askerlerde görülen sarılık salgınında farklı klinik tabloların ortaya çıkması, viral hepatit tablolarında birden fazla etkenin sorumlu olabileceği düĢünülmeye baĢlanmıĢ. 1963 yılında Blumberg‘in hepatit B virüs antijeninin keĢfi ile birden fazla hepatit etkeni olduğu kesinlik kazanıp, viral hepatitler ile ilgili geliĢmeler hızlanmıĢtır (9).
Tablo 1: Viral hepatitlerin geliĢiminde bazı önemli aĢamalar (9)
-Hastalığın kataral ikter olarak tanımı (Virchow, 1865)
-Hastalığın enfeksiyöz hepatit ve serum hepatiti olarak ayırımı (1940) -Avusturalya antijenin keĢfi (Blumberg, 1963)
-MS-1 ve MS-2 tipleri ile immunolojik çalıĢmalar (Krugman ve ark. 1967) -HAV‘nun gösterilmesi (Feinstone, 1973)
-NANBV kavramının geliĢtirilmesi (Prince, 1974) -HDV‘nun keĢfi (Rizetto, 1977)
-HBV partikülünün (virion) gösterilmesi (Dane,1979)
-ET-NANBV‘nin insandan Cynomolgus macaque‘lara nakli (Balayan ve ark. 1983) -NANBV karakteristikleri (Bradley ve ark. 1986)
-HCV‘nun klonlanması(Choo ve ark. 1989) -HEV‘nun klonlanması (Reyes ve ark. 1990) -HEV‘nun tam genom dizisi(Tam ve ark. 1991)
Hepatit A (HAV) ve hepatit B virüsü (HBV) tanımlandıktan sonra açıklanamayan hepatit olguları devam etmiĢtir. 1974 yılında ne-A ne-B virüsü kavramları geliĢtikten sonra, bu grupta birbirinden farklı iki virüsün olduğu anlaĢılmıĢtır. Bu virüslardan birinin, HBV‘ye benzer Ģekilde kan ve kan ürünleriyle parenteral yolla bulaĢtığı belirlenmiĢ ve bu virüs daha sonra hepatit C virüsü (HCV)
3 olarak tanımlanmıĢtır (10). Diğer virüsün ise HAV‘a benzer Ģekilde kontamine su ve su ürünleriyle bulaĢtığı ancak serolojik tanı testlerinin geliĢtirilmesiyle, epidemiyolojik olarak HAV‘a benzeyen fakat serolojik olarak HAV‘dan farklı olduğu tespit edilmiĢ. Enterik olarak bulaĢan bu viral hepatite ne-A ne-B hepatiti (ET-NANBV), etken olan virüse ile Hepatitis E virüsü (HEV) adı verilmiĢtir (11).
Hepatit E virüsu, 1983 yılında Balayan ve arkadaĢları tarafından tanımlanmıĢ (12). Dr.M.S.Balayan, Afganistan‘daki Rus askerler arasındaki non-A non-B hepatiti salgını esnasında, dokuz askerden topladığı dıĢkı ekstrakları ile kendisini oral yolla enfekte etmiĢ ve kendisinde de benzer semptomların ortaya çıkması sonucu, bu etkenin fekal-oral yolla bulaĢtığını doğrulamıĢtır. 1990 yılında Reyes ve arkadaĢları enfekte
cynomolgus maymunlarının safrasından HEV‘na ait bir gen parçasını klonlamıĢlardır
(13). Tam ve arkadaĢları ise 1991 yılında tam genom dizisini çıkarmıĢlardır (14).
Enterik yolla bulaĢan ilk viral hepatit epidemisi 1955-1956 yıllarında Yeni Delhi‘de (Hindistan) Ģehrin içme suyunun dıĢkı ile kontaminasyonu sonucu geliĢen ve 29000 kiĢinin etkilendiği ikterik hepatit epidemisidir (15). Salgından yaklaĢık 25 yıl kadar sonra, etkilenen kiĢilerin serumları incelendiğinde A ve B Hepatitlerine ait markerlar tespit edilememiĢtir. Hemen hemen aynı dönemde Khroo ve arkadaĢları 1979 yılında KaĢmir Vadisi‘nde (Hindistan) ortaya çıkan viral hepatit epidemisinde de hepatit A ve B markerlarının negatif olduğunu belirlemiĢtir (16).
2.1.2. Virüsun Genel Özellikleri
Hepatit E virüsü 27-34 nm büyüklüğünde, küçük, zarfsız, tek sarmallı pozitif polariteli RNA virüsüdür (1,17). Viral genom, kapsidle çevrilidir ve kapsid, ikozahedral simetride dizilmiĢ 60 kapsomerden oluĢur (ġekil 1). Kapsid proteini (kapsomer) tek tiptir, ancak farklı HEV genotipleri arasında dizi farklılıkları göstermektedir. Her bir kapsid proteini, S (Shell), M (Middle) ve P (Protruding) olmak üzere üç kangaldan oluĢmuĢtur (18,19). Bu kangallar birbirleriyle ardı ardına bağlıdırlar ve özellikle P kangalı dimerik çıkıntı oluĢturmak suretiyle viriona tipik görünümünü verir. P kangalı ayrıca hücreye tutunmada iĢlev görür ve antijenik özelliği nedeniyle nötralizan antikorların hedefidir (19).
4
ġekil 1:A: HEV üç boyutlu görünümü(Zheng Liu Structure and Function of the Hepatitis E virüsCapsid Related to Hepatitis E Pathogenesis Viral Hepatitis www.interchopen.com)
B:HEV elektron mikroskopi görünümü (File:Hepatitis E virüs.jpg|thumb|Hepatitis E virüs)
Hepatit E virüsü morfolojik benzerlikten dolayı önceleri Caliciviridae ailesinde sınıflandırılmıĢtır. Yapılan çalıĢmalar sonucu HEV‘in genom organizasyonunun farklı olduğu gösterilmiĢ; 2004 yılında ailesi belirlenemeyen Hepevirüs cinsine alınmıĢ, daha sonra, 2009 yılında ise bu cins Hepeviridae ailesine dahil edilmiĢtir (17,18). Moleküler teknolojilerin daha da ilerlemesi ile HEV suĢları arasındaki genomik farklılıklar ve genetik çeĢitliliğin aydınlatılması sonucunda, The International Committee on Taxonomy of Virüses (ICTV) bünyesindeki çalıĢma grubu tarafından, 2014 yılından itibaren HEV‘in, Hepeviridae ailesi, Orthohepevirüs cinsi içinde Orthohepevirüs A olarak yer alması önerilmektedir (http://www.ictvonline.org/virüsTaxonomy.asp).
HEV dayanıksız bir virüs olup dondurulup çözülmeye ve yüksek tuz konsantrasyonuna karĢı kolayca bozulabilirken, oldukça elveriĢsiz faktörlerin bulunduğu (güneĢ ıĢığı, yüksek sıcaklık, düĢük osmotik basınç gibi) ortamlarda stabil kalabilmektedir (20). Sıvı nitrojen içerisinde saklanması virüsun kapsit yapısını korumaktadır. +4 ºC ve –20 C° de saklanması sırasında virüsun yapısı bozulur ve zamanla birlikte genom içermeyen virüs parçacıkları oluĢur. Bu virüs parçacıkları +4 C°de 14 gün içerisinde agrege olmaktadır. Bu agregasyonun safrada bulunan IgA ve IgM‘lere bağlı olarak geliĢebileceği düĢünülmektedir (21).
5
2.1.3.Genom ve Proteinler
Hepatit E virüsunun genomu; lineer, tek iplikli, 7.2 kilobaz(kb) büyüklüğünde, pozitif polariteli RNA‘dan oluĢmaktadır (18). Genomik RNA, 5‘ ve 3‘ uçlarında protein kodlamayan (untranslated region; UTR) kısımlar ile üç farklı okunma bölgesi (open reading frame; ORF) içerir (14). Genomun her iki ucunda UTR bölgeleri yer alır; 5‘ucunda 7mG (7-metil guanozin) bulunur, 3‘ ucu ise poliadenillenmiĢtir. Genomda protein kodlayan 3 ORF bölgesi bulunur. ORF-1 bölgesi, yapısal olmayan proteinlerin; ORF-2 bölgesi yapısal kapsid proteini; ORF-3 bölgesi ise düzenleyici rolü olan küçük fosfoproteinlerin kodlanmasından sorumludur (ġekil 2) (18,19).
6
2.1.3.1. Open Reading Frame 1 (ORF-1)
HEV genomunun yapısal olmayan bölgesinin tamamını içerir. BaĢlangıçta yaklaĢık 186 kDa (1693 aminoasit) büyüklüğünde bir poliprotein kodlamakta, daha sonra büyük protein molekülü kesilerek yapısal olmayan proteinleri oluĢturmaktadır. Bu proteinler, viral transkripsiyon ve replikasyonu düzenler ve virüsun, konak immun yanıtından kaçıĢını düzenler (18,23,24).
ġekil 3: ORF-1 bölgesinin Ģematik organizasyonu
ORF-1 bölgesinin yapısal olmayan proteinlerinden metiltransferaz, viral genonum 5‘ ucunda kep oluĢumunda görev alır ve 5‘ metil guanozin parçası HEV enfektivitesinde ve replikasyonunda önemlidir. Papain benzeri sistein proteaz, çeĢitli proteinleri hidrolize eder ve ayrıca proteinlerin ubikütin aktivitesini engeller. Helikaz, nükleozid trifosfataz aktivitesine sahiptir, ayrıca 5‘-3‘ RNA çift ipliğinin açılmasında rol oynar. RNA‘ya bağımlı RNA polimeraz (RbRp) ise, pozitif iplikli diğer RNA virüslarının RbRp‘lerine benzer olarak, korunmuĢ sekiz motif içermekte ve viral replikasyonu sağlamaktadır. Virüsun yapısal olmayan proteinleri arasında bulunan X, Y ve PPR (prolinden zengin menteĢe kangalı) proteinlerinin ise fonksiyonları bilinmemektedir (18).
2.1.3.2. Open Reading Frame 2 (ORF-2)
Yapısal proteinlerin en uzunudur. ORF-2 genomun 3‘ ucuna yerleĢmiĢ ve 1980 baz uzunluğundadır. Kapsid proteinine benzeyen bir protein kodlamaktadır. ORF-2‘nin tamamıyla ekspere olması halinde kapsid proteini yanında 56,5 kDa ağırlığında çözünebilir bir protein de oluĢmaktadır. Bu protein, anti-HEV antikorlarinin gösterilmesinde oldukça aktif bir antijendir ve immünizasyonda kullanabileceği konusunda umut vermektedir (22,25).
7
2.1.3.3. Open Reading Frame 3 (ORF-3)
HEV‘nun morfogenezinde ve hücreden çıkıĢında rol oynayan ORF-3 bölgesi, 13.2 kDa ağırlığında, 123 aminoasit kodlayan en küçük parçacıktır (20,21,26). ORF-1‘in 3‘ ucunun sonundan bir nukleotid içeriden baĢlamakta ve ORF-2 ile ORF-1 arasında 37 bazlık boĢluktan sonra ORF-2 içinde ilerlemektedir. ORF-3‘ün aminoucunun son yarısı küçük bir hidrofilik segmentin ayırdığı iki hidrofobik peptitden oluĢmuĢtur. Ġkinci hidrofobik bölge ‗transmembrane peptid‘ dir. Fonksiyonu tam bilinmemekle birlikte bu proteinin hücre membranı ile iliĢkili olduğu düĢünülmektedir (21). Yapılan çalıĢmalarda 3‘ün bir fosfoprotein kodladığı ve bu proteinin ORF-2‘de olduğu gibi anti-HEV pozitif serumlarla reaksiyon verdiği gösterilmiĢtir. Buna rağmen hasta serumundaki HEV antikorlarını saptamada ORF-2 ile kodlanan antijenik proteinler daha duyarlıdır (26).
2.1.4. HEV Genotipleri
HEV‘nun memelileri enfekte eden 4 major genotipi ve bir kuĢ genotipi olduğu kabul edilmektedir (ġekil 4) (23,27). Hindistan yarımadasındaki ilk HEV salgınlarında saptanan genotip, Genotip (G) 1 olarak isimlendirilmiĢ; daha sonra 1986 yılında Meksika‘da izole edilen genotipin G1 ile %75 oranında nükleotid dizi benzerliği saptanmıĢ ve bu tip de G2 olarak adlandırılmıĢtır (28). 1997 yılında evcil domuzlarda saptanan yeni HEV genotipi, G1 ve G2 ile %74-75 oranında dizi benzerliği göstermiĢ ve G3 olarak tanımlanmıĢtır (29,30). Daha sonra Çin‘de, Japonya‘da, Tayvan‘da ve Vietnam‘da akut hepatitli hastaların serumlarında farklı bir HEV genotipi tanımlanmıĢ ve G4 olarak isimlendirilmiĢtir (27,31). HEV genotipleri, ayrıca çeĢitli alt tipler içerirler. Buna göre; G1‘in 5 (1a-1e), G2‘nin 2 (2a,2b), G3‘un 10 (3a-3j) ve G4‘ün 7 adet (4a-4g) alt tipi bulunmaktadır (32).
8
ġekil 4: Ġnsan ve domuz Hepatit E virüsunun filogenetik analizi (27).
HEV genotiplerinin dağılımı, sosyoekonomik ve coğrafik özellikler gösterir (18,33). Genotip 1 ve 2, hayvan rezervuarları tanımlanmamıĢ olup hijyenik koĢulları kötü olan ülkelerde çok yüksek seroprevalansa sahiptir ve baĢlıca su kaynaklı salgınlardan ve bu bölgelerdeki sporadik olgulardan sorumludur (34). Genotip 3 ve 4 ise, hem insanlarda hem de diğer memeli rezervuarlarda (domuz, yaban domuzu, geyik, fare, tavĢan, sığır) bulunur ve zoonotik özellik taĢırlar (35).
Genotiplerin dünya üzerindeki dağılımına bakıldığında; G1, Asya, Afrika ve Orta Doğu‘da; G2, Meksika ve Batı Afrika‘da; G3, Kuzey Amerika, Avrupa, Latin Amerika ve Japonya‘da; G4 ise Çin, Tayvan, Güneydoğu Asya‘da yayılım göstermektedir (ġekil 5) (33,36).
9
ġekil 5: HEV genotiplerinin dünya üzerindeki dağılımı (Okamoto, 2007) (36).
2.1.5. Replikasyon Döngüsü
HEV‘nun replikasyon stratejisi tam olarak bilinmemektedir. Öngörülen modelde HEV‘nun alphavirüs cinsine benzer Ģekilde replike olduğu düĢünülmektedir (18,19). BaĢlıca hedef hücresi hepatositler olup hayvan modellerinde yapılan çalıĢmalarda, maymunlarda biliyer epitelyum hücrelerini; domuzlarda ise ince bağırsak, dalak, lenf nodları, kolon ve periferal kan monositlerini enfekte ettiği gösterilmiĢtir (18,19). Virüsun ısı Ģok proteini (HSP)-70/90 ve/veya heparan sülfat reseptörlerine tutunarak, klatrine bağımlı endositoz yoluyla hücre içine girdiği belirlenmiĢtir (37,38).
Hücreye giriĢi takiben kapsid soyulur ve viral RNA serbest hale geçer. Viral RNA, hücre sitoplazmasında poliribozomlara giderek ORF-1‘in translasyonunu gerçekleĢtirir ve yapısal olmayan poliprotein sentez edilir. Bu poliproteinin parçalara ayrılarak fonksiyonel hale gelmesi viral proteaz tarafından gerçekleĢtirilir. Bu Ģekilde oluĢan RbRp, pozitif iplikli RNA genomundan komplementer negatif iplikli RNA genomunu sentezler ve sonra bu ipliği kalıp olarak kullanarak, genomik ve subgenomik
10 pozitif iplikli RNA ipliklerini oluĢturur. Subgenomik RNA (mRNA)‘lardan ORF2 (yapısal proteinler) ve ORF3 ürünleri sentez edilir. Yapısal proteinler, translasyondan sonra endoplazmik retikulum içine taĢınarak endopeptidaz enziminin etkisiyle glikozillenir ve olgunlaĢır. Bu iĢlemden sonra kapsid proteinleri hücre periferine taĢınır; burada viral RNA‘ların 5‘ ucuyla etkileĢerek genomu paketler ve progeni virionlar tam olarak bilinmeyen bir yolla -olasılıkla ekzositoz ile- hücre dıĢına çıkarlar (ġekil 6) (18,19). Virionların paketlenmesi ve hücreden çıkıĢında, ORF3 proteinlerinin önemli rol oynadığı bildirilmiĢtir (39).
ġekil 6: HEV‘nun replikasyon döngüsü (Dianjun Cao and Xiang-Jin Meng Molecular biology and replication of hepatitis E virüs).
11
2.1.6. Patogenez ve Ġmmünite
Hepatit E enfeksiyonunun inkübasyon dönemi 28-40 gün olup, virüsun alınmasından sonra 42-46. günler arasında karaciğer enzimleri en yüksek seviyeye ulaĢmaktadır. Kanda HEV-RNA pozitifliği ise, semptomlar baĢladıktan iki hafta sonra saptanmakta ve 4-16 hafta süresince devam etmektedir (40).
Deneysel HEV enfeksiyonu iki dönemlidir. Birinci dönem enfeksiyonun baĢlangıç dönemi olup virüs hepatositlerde replike olur. Bu dönemde, virüsun hepatositlere direkt etkisi ya da sitolitik etkili immün yanıt nedeniyle hafif bir klinik hepatit geliĢir. Ġkinci dönem ise, HEV enfeksiyonuna karĢı hümoral immün yanıtın baĢladığı dönemdir. Bu dönemde virüs immunolojik olarak temizlenir ve vireminin sona ermesinden sonra serokonversiyon oluĢur. Ancak karaciğerde patolojik değiĢiklikler artmıĢtır (18,41).
Hepatit E virüsu, karaciğerden safra kesesine ve ardından bağırsaklara geçtikten sonra dıĢkı ile atılmaktadır. Virüsun dıĢkıda en yoğun olarak bulunduğu dönem, inkübasyon periyodunun son haftası ve akut hastalık tablosunun ilk iki haftasıdır (1). Viremi süresi ise 1 hafta ile 4 ay arasında değiĢebilir (1,42). Virüs, alanin aminotransferaz (ALT) artıĢından önce ve yükselme döneminde kanda mevcuttur.
Karaciğerin histopatolojik incelenmesinde, nonspesifik inflamatuvar değiĢiklikler veya geniĢlemiĢ portal alanlarda mononükleer hiperplazi, safra kanaliküllerinin proliferasyonu, parankimde yer yer nekroz alanları ve çevresinde psödoglandüler biçimde dizilmesi ile karakterize kolestatik hepatit görünümü tanımlanmıĢtır (43).
HEV enfeksiyonunda serumda spesifik IgG, IgA ve IgM tipi antikorlar oluĢmaktadır. HEV-IgM pozitifliği, ALT‘nin yükselmesinden hemen önce baĢlar ve ALT düzeyi pik yaptığında en yüksek titreye ulaĢır. IgM antikorları 4-6 ay sonrasına kadar serumda saptanabilmekte, bu süre salgınlarda 12 aya kadar uzayabilmektedir (23,42). Enfeksiyonun daha erken döneminde serumda saptanan IgA antikorları, mukozal immünitenin göstergesidir, ancak bu antikorlar hızlı bir Ģekilde kaybolmaktadır (44). HEV-IgG antikorlarının kalıĢ süresi kesinlik kazanmamıĢtır. Bu antikorların 6-12 ay içinde kaybolduğu belirtilmekle birlikte, enfeksiyonu geçirenlerde 20 ay, hatta 14 yıl sonra bile pozitif kalabildiği gözlenmiĢtir (23). Herhangi bir HEV
12 genotipine karĢı oluĢan nötralizan antikorlar, serolojik tipin tek olması nedeniyle, diğer HEV genotiplerine karĢı da çapraz koruma sağlamaktadır (45).
Ġnsanlarda HEV‘e karĢı oluĢan hücresel immün yanıt ile ilgili bilgiler sınırlıdır. ORF-2 ve ORF-3 tarafından kodlanan immünojenik proteinler, T hücre yanıtına neden olur ve akut hepatit E‘li hastalarda, HEV‘e özgül ve uzun süreli CD4+ ve CD8+ T hücre yanıtları saptanır (46,47). T hücre aracılı immün yanıt, akut hepatitin iyileĢmesini sağlamakla birlikte, immünopatogenezde de rol oynayabilmektedir (47,48).
2.1.7. Klinik Bulgular
HEV enfeksiyonları semptomatik ve asemptomatik seyredebilir. Ġnkübasyon süresi 2-9 hafta arasında değiĢmekte olup ortalama 45 gündür. Ġnkübasyon döneminin ardından, diğer akut hepatit tablolarından çok farklı bir klinik tablo göstermeyen, kendini sınırlayan bir hastalık oluĢur (1,42). Hastalık %70 oranında belirti vermeden seyreder. Enfeksiyonun asemptomatik veya subklinik formu daha çok çocukluk yaĢ grubunda, semptomatik formu ise 15-40 yaĢ grubunda gözlenmektedir. EriĢkin yaĢtaki semptomatik hastalık, sıklıkla kolestatik hepatit Ģeklinde seyreder (42,49). Akut ve semptomatik hastalık daha çok iĢtahsızlık, bulantı, kusma, ateĢ, karın ağrısı Ģeklinde görülmektedir. HEV, fulminan hepatit ve subakut hepatik yetmezliğe neden olabilir. Yeni Delhi‘de yapılan bir çalıĢmada sporadik fulminan hepatitli hastaların %62‘sinde HEV gösterilmiĢtir (50). Mortalite oranı erkekler ve hamile olmayan kadınlarda ortalama %1-3 iken gebe kadınlarda bu oran %12-42 arasındadır (43,51). Özellikle üçüncü trimesterde fulminan hepatit ve koagülopati sonucu ölüme neden olmaktadır. Hepatit E infeksiyonu yüksek oranda perinatal ölümlere yol açmaktadır (20).
Önceleri HEV‘in kronikleĢmediği yönündeki bilgilere karĢın, 2007 yılında Japonya‘da T hücre lenfoması nedeniyle kemoterapi alan bir hastada kronik HEV enfeksiyonu tanımlanmıĢtır (52). Bunu takiben, baĢta solid organ transplantasyonu yapılan hastalar olmak üzere, immün sistemi baskılanmıĢ kiĢilerde kronik HEV enfeksiyonları bildirilmiĢtir (43,53-56).
Hepatit E enfeksiyonlarının karaciğer dıĢında, farklı organ ve dokularda da hasara yol açtığı bildirilmektedir (42). Kas zayıflığı, poliradikülopati, Guillain-Barre sendromu, ensefalit, glomerülonefrit ve kriyoglobulinemi, HEV enfeksiyonunda rastlanan ekstrahepatik komplikasyonlardır (42,57,58).
13
2.1.8. Epidemiyoloji 2.1.8.1. BulaĢ Yolları
HEV‘nun klasik bulaĢ yolu fekal-oral yol olup, endemik bölgelerde görülen salgınlar ve sporadik enfeksiyonlar kontamine su kaynaklıdır. Bu durum epidemik bölgelerde kanalizasyon ile kirlenen yağmur veya nehir sularının açık su kaynaklarına karıĢması sonucunda meydana gelir (6,17). Buna karĢın, 2008 yılında Uganda‘da kiĢiden kiĢiye bulaĢ nedeniyle 100.000‘den fazla kiĢinin etkilendiği bir salgın bildirilmiĢtir (59). Fekal-oral yolla bulaĢan genotipler sıklıkla G1 ve G2‘dir (6,60).
Besin kaynaklı bulaĢlar nadirdir. Bu tip bulaĢ HEV ile enfekte hayvanların (geyik, domuz, yaban domuzu, tavĢan), iyi piĢmemiĢ etlerinin tüketilmesiyle gerçekleĢir (61, 62). Bu yolla bulaĢan HEV genotipleri ise G3 ve G4‘dür (62).
Bu iki temel bulaĢ yolunun dıĢında; vertikal bulaĢ, kan transfüzyonu, nozokomiyal bulaĢ ve mesleki maruziyet sonucu kazanılan HEV enfeksiyonları bildirilmiĢtir (5,63,64).
2.1.8.2. YaĢ ve Cinsiyet Dağılımı
Hastalık daha çok genç ve orta yaĢ (15-40 yaĢ) grubunda görülmekte, çocuk ve yaĢlılarda nadir rastlanmaktadır (65). Yapılan çalıĢmalar, HEV seropozitifliğinin yaĢla birlikte arttığını göstermektedir (6,42).
HEV enfeksiyonunun belirli bir cinsiyette yoğunlaĢtığını kanıtlamak için veriler yetersiz olup, erkeklerin iĢ ve sosyal yaĢamda daha aktif olduklarından bu enfeksiyona kadınlardan daha fazla yakalandıkları belirtilmektedir (65,66).
Solid organ transplantasyonu yapılan hastalar, immün yetmezliği olan diğer hastalar ve gebeler fulminan ve kronik HEV enfeksiyonu açısından risk altında olan gruplardır (2,53,54).
2.1.8.3. Mevsimsel Dağılım
HEV epidemileri, özellikle yağmur mevsimini takip eden Kasım, Aralık ve Ocak aylarında daha yoğun görülmektedir (67).
14
2.1.8.4. Coğrafi Dağılım
HEV, alt yapı ve hijyen koĢullarının iyi olmadığı, geliĢmekte olan ülkelerin çocuğunda epidemiyolojik sorunlar yaratmaktadır (6,65,66). HEV ile ilgili ilk çalıĢmalar, özellikle sosyoekonomik düzeyi düĢük, alt yapı imkanları yetersiz, Ģehir suyunun kanalizasyon Ģebekesiyle kontaminasyonu önlenemeyen Hindistan, Tacikistan, Meksika ve bazı Afrika ülkerinde yapılmıĢtır (32,34,67)
Hepatit E virüs prevalansının yüksek olduğu ve büyük salgınlar yaptığı geliĢmemiĢ/geliĢmekte olan endemik ülkeler Orta Doğu, Orta ve Güneydoğu Asya, Kuzey ve Orta Afrika ve Meksika; prevalansının düĢük olduğu ve sporadik olgular Ģeklinde enfeksiyon yaptığı düĢük endemik bölgeler ise Avrupa, Kuzey ve Güney Amerika ve Kuzeydoğu Asya‘dır (ġekil 7). Yüksek endemik bölgelerde su kaynaklı salgınlar ortaya çıkmaktadır. Hindistan baĢta olmak üzere, Sudan, Somali, Etiyopya, Çin, Uganda ve Meksika‘dan çok sayıda kiĢinin etkilendiği birçok salgın bildirilmiĢtir (6,42) (Tablo 2). En son bildirilen HEV salgını, Nisan 2014‘de Etiyopya‘nın batısında Sudanlı mülteciler arasında ortaya çıkmıĢ ve 1117 kiĢi etkilenmiĢtir (68).
HEV enfeksiyonu, geliĢmiĢ ülkelerde sporadik olarak görülmektedir. Sporadik olgular özellikle sosyoekonomik düzeyi yüksek, altyapı tesisleri geliĢmiĢ Ġngiltere, Hollanda, Almanya, Fransa, Norveç, Japonya, Amerika gibi ülkelerden rapor edilmiĢtir (35). Bu olguların çoğunda endemik bölgelere seyahat öyküsü mevcuttur; ancak gıda kaynaklı enfeksiyonlar da görülmektedir (36,65,69).
15
Tablo 2: Dünyadaki HEV epidemileri (43).
Bölge Tarih Vaka sayısı Kaynak
Hindistan (Yeni Delhi) 1955-1956 29000 Kontamine su
Hindistan (Ahmedabad) 1975-1976 2572 Kontamine su
Hindistan (Kampur) 1991 79 000 Kontamine su
Nepal (Kathmandu Vadisi) 1973-1974 10000 Belirlenemedi
Nepal (Kathmandu Vadisi) 1981-1982 6000 Belirlenemedi
Nepal (Kathmandu Vadisi) 1987 587 Kontamine su
Pakistan (Karachi, Sargodha) 1985-1987 133 Belirlenemedi
Burma (Mandalay) 1976-1977 20000 Kontamine su
Burma (Rangoon) 1982-1983 399 Kontamine su
Endonezya (Borneo) 1987-1988 2000 Kontamine su
Kırgızistan 1955-1956 10810 Belirlenemedi
Çin (Kuzeybatı) 1986-1988 119280 Kontamine su
Yangon (Myanmar) 1989 600 Belirlenemedi
Cezayir 1980-1981 788 Kontamine su
FildiĢi Sahili (Tortiya) 1983-1984 623 Belirlenemedi
Çad 1983-1984 38 Kontamine su
Sudan (Doğu) 1985 2012 Kontamine su
Somali (Mülteci kampı) 1985-1986 2000 Kontamine su
Mısır (Kahire, Benha) 1983,1987 36 Kırsal kesim
Etyopya 1988-1989 423 Kontamine su
Meksika (Huitzilla) 1986 94 Kontamine su
16
ġekil 7: HEV vakalarının global dağılımı, 2015.
(http://www.cdc.gov/hepatitis/hev/hevfaq.htm)
Türkiye, Hastalık Kontrol ve Önleme Merkezi (CDC) tarafından yayınlanan epidemiyoloji haritasına göre HEV enfeksiyonları açısından yüksek endemik bölgeler arasındadır (ġekil 7). Ülkemizde HEV seroprevalansı ile ilgili ilk veri, Thomas ve arkadaĢlarının 1992 yılında yaptıkları çalıĢmadır (8). Türkiye‘nin beĢ farklı bölgesini kapsayan bu çalıĢmada, toplam seropozitiflik %5.9 (80/1350) olarak bildirilmiĢ ve seropozitifliğin 30‘lu yaĢlarda yükselmeye baĢladığı (%3.7), 40‘lı yaĢlarda ise en yüksek düzeye (%9.1) ulaĢtığı gösterilmiĢtir (8). Bu çalıĢmayı takip eden yıllarda çalıĢmalar devam etmiĢ ve ülkemizdeki anti-HEV seropozitifliği netlik kazanmaya baĢlamıĢtır. Trabzon‘da 1994 yılında yılında yapılan çalıĢmada, non A- non B hepatitli hastaların %73‘ünde anti-HEV IgG pozitifliği, sağlıklı kiĢilerde ise %0 tespit etmiĢlerdir (70).
Ġki kıtanın birleĢtiği bir noktada bulunan ülkemizde anti-HEV seropozitifliği farklılık göstermektedir. Güneydoğu Anadolu bölgesi kaynaklı çalıĢmaların sonuçları bu bölgemizin, HEV epidemilerinin görüldüğü ülke sonuçlarına yakın olduğunu ortaya koyarken, diğer bölgelerde tespit edilen %3-17 anti-HEVseropozitifliğinin sporadik hepatit E vakalarının görüldüğü geliĢmiĢ ülkelerin sonuçları ile benzerlik gösterdiğini ortaya çıkarmaktadır. Ülkemizde yapılan bu çalıĢmalar Tablo 3‘de sunulmuĢtur (43).
17
Tablo 3: Türkiye‘de anti-HEV seropozitifliği (43).
Ġl AraĢtırmacı Örnek (sayı) Anti-HEV seropozitif
Ġstanbul, Aydın, Ayvalık,Trabzon, Adana
Thomas ve ark. 1350 5.9
Trabzon Köksal ve ark. 53 73
Ġstanbul Badur ve ark. 1580 5.3
Ġstanbul Aldeniz ve ark. 812 4.8
Ġzmir Özacar ve ark. 112 3.5
Bursa Göral ve ark 191 10.4
Bursa Mıstık ve ark. 66 9.0
Antalya Gültekin ve ark. 167 11.1
Malatya Sönmez ve ark. 150 9.3
Malatya Otlu ve Durmaz 600 9.8
Erzurum Ertek ve ark. 340 10.3
Diyarbakır Aydın ve ark. 100 29
Diyarbakır Ayaz ve ark. 157 34
Diyarbakır Yükselen ve ark. 34 23.5
Diyarbakır HoĢoğlu ve ark. 102 19.6
Diyarbakır Değertekin ve ark. 220 7.7
Van Yavuz ve ark. 91 4.3
Van Kutoğlu ve ark. 772 7.5
Ankara Tülek ve ark. 140 6.4
Ankara Cesur ve ark 1046 3.8
Ankara Çetinkaya ve ark. 1351 7.6
Denizli Kaleli ve ark. 194 11.3
Elazığ Kılıç ve ark. 707 11.6
Adana Erdurak ve ark. 100 7.0
18
2.1.9. Laboratuvar Tanısı
Hepatit E virüsünün tanısı için birçok özgül test geliĢtirilmiĢtir. Bu testler; immun elektron mikroskopi, floresan antikor test, western blot, enzim immunassay (EIA) ve revers transkripsiyon polimeraz zincir reaksiyon (RT-PCR) yöntemidir (71).
Akut hepatit E seyrinde; ALT, AST, bilirubin ve kolestatik formda alkalen fosfataz (ALP) düzeyleri yükselir. Bu yükseklik ortalama 2-3 hafta, bazı olgularda daha uzun süre devam etse bile ortalama 2 ay içinde değerler normal düzeylere döner (72).
Rutin tanı laboratuvarında anti-HEV IgM, IgA ve IgG antikorlarının saptanmasında en yaygın kullanılan yöntem ELISA‘dır. Bu yöntemde ORF-2 ve/veya ORF-3‘ün kodladığı antijenler veya sentetik peptitler kullanılır (73). HEV-IgM antikorları, hastalığın baĢlangıcından 1-4 hafta sonra olguların %96‘sında fazlasında tespit edilir. Ġlk 4 hafta pik değere ulaĢır (ġekil 8). Enfeksiyonun baĢlangıcından 3 ay sonra IgM‘nin serumda saptanma oranı %50‘ye düĢer ve genellikle 6 ay içinde kaybolur (23,42,71). HEV-IgG antikorları, hastalığın baĢlangıcından 2-4 hafta sonra en üst düzeye ulaĢır. HEV-IgG titresi, daha sonra hafif bir düĢüĢ gösterse de, 20 aydan daha uzun süre kalıcıdır (ġekil 8) (23,71).
PT-PCR tekniği ile dıĢkı, serum, safra ve karaciğerde viral RNA araĢtırılması en duyarlı yöntemdir (32,74). Viral dönemin kısa süreli oluĢu, etkenin dıĢkıda daha uzun süre bulunuĢu nedeniyle, moleküler tanıda dıĢkı örneği tercih edilmektedir (ġekil 8). Ancak inhibitör maddelerin dıĢkıda yoğun olarak bulunması bu yöntem için dezavantajdır (75). PT-PCR yöntemi, klinik tanının yanı sıra, izolatların genotiplendirilmesi, hayvansal ve çevresel örneklerde virüs varlığının araĢtırılması ve moleküler epidemiyolojik çalıĢmalardada baĢarıyla kullanılmaktadır (33,42,76,77).
19
ġekil 8: Hepatit E virüsü enfeksiyonunun zaman çizelgesi (71).
2.1.10. Tedavi ve Korunma
HEV enfeksiyonu kendi kendini sınırlıyan bir hastalık olduğundan, çoğu hastada özgül bir tedaviye ihtiyaç yoktur. Akut viral hepatitler için söz konusu olabilecek destek tedaviler yeterlidir (1,42). Fulminan olgular hariç, HEV enfeksiyonunun prognozu genellikle iyidir (1). Akut veya akut on kronik karaciğer yetmezliği durumunda serebral ödemi takip etmek ve karaciğer nakil ihtiyacı açısından hastaları yoğun bakım ünitelerinde takip etmek gerekir (78). Kronik ve fulminan hepatitin geliĢtiği durumlarda HEV enfeksiyonlarının tedavisi uygulanır (79). Enfeksiyonun kronikleĢtiği immun sistemi baskılanmıĢ hastalarda, tedavi olarak pegile interferon (alfa-2a ve alfa-2b) ya da ribavirin, tek baĢlarına ya da birlikte 3 ile 12 ay arasında uygulanmaktadır (46,54,80,81). Antiviral tedaviye baĢlamadan önce, immunsupresif ilaçların kesilmesi ya da azaltılması ile de viral eliminasyon sağlanmaktadır (82). Antiviral tedavinin etkinliği ile ilgili çalıĢmalara gereksinim bulumaktadır (83).
20 HEV enfeksiyonu, fekal-oral yolla bulaĢan bir hastalık olması nedeniyle, baĢta su kaynakları olmak üzere tüm besin kaynaklarının dıĢkı ile kontaminasyonundan korunması, genel sanitasyon önlemleri, çevresel ve kiĢisel hijyen bilincinin geliĢmesi ile önlenebilir. Salgınlar sırasında suyun kaynatılması ya da klorlanması yararlı olacaktır. Zoonotik bulaĢın önlenmesi için de, yiyeceklerin (domuz ve geyik eti) hijyen ve piĢirme kurallarına uygun olarak hazırlanması gereklidir (62,84,85).
HEV‘na karĢı üzerinde çalıĢılan 2 farklı aĢı bulunmaktadır (86). Bunlardan birisi, HEV‘nun ORF-2 proteinin (aminoasit 112-607) yüksek oranda immunojenik olan VLPs lerin toplandığı baculovirüs sentezleme siteminde ekspresyonu ile elde edilmiĢ rekombinant aĢıdır. AĢı ile ilgili çalıĢmada 2000 gönüllü Nepalli askerde 0,1 ve 6. ayda olmak üzere 3 doz uygulanmıĢ. AĢının %100 serokonversiyon oluĢturduğu ve koruyuculuğunun 2 yıla kadar %95.5 olduğu gösterilmiĢtir (87). Diğer aĢı ise virüsun p239 proteininin Escherichia coli‘de ekspresyonu ile hazırlanan bir rekombinant aĢıdır. Bu aĢı ile ile ilgili çalıĢmada 100000‘den fazla Çinli eriĢkinde 3 doz ugulanmıĢtır. AĢının koruyuculuğu takip edilen 13 ay boyunca %100 bulunmuĢtur (88). Bu aĢının gebelerde de koruyu olduğu gösterilmiĢtir. 2012 yılında bu aĢı Çin‘de onay alarak kullanıma girmiĢ olup (Hecolin®), 16 yaĢından büyük kiĢilerin immünizasyonunda kullanılmaktadır.
21
3. MATERYAL-METOD
Bu çalıĢmaya Dicle Üniversitesi Tıp Fakültesi Gastroenteroloji Bilim Dalı‘na 2011 Mayıs - 2015 Mart tarihleri arasında baĢvuran 18 yaĢ ve üzeri 1025 hasta alındı. Hastaların yaĢ, cinsiyet, biyokimya (ALT, AST, GGT, Total bilirubin, albumin), tam kan (hemoglobin, trombosit), koagülasyon (INR), demografik kriterleri (orjin (kent/kırsal), eğitim durumu (ilkokul ve altı-düĢük, ortaokul ve üstü-yüksek), medeni durumu (evli/bekar), gebelik (var/yok), ailede bilinen viral hepatit öyküsü (var/yok), hayvanlarla temas, madde bağımlılığı (var/yok), alkol kullanımı (var/yok)), siroz durumu (var/yok), viral hepatitli hastalarda enfeksiyon zamanı ve antiviral ilaç kullanımı retrospektif olarak incelendi.
ÇalıĢma hastaları dört gruba ayrıldı. HbsAg pozitif olan değiĢik klinik formlardaki tüm hastalar HBV grubu, delta pozitif olan hastalar HDV grubu, anti-HCV pozitif olan hastalar anti-HCV grubu, gastroenteroloji poliklinik ve kliniğinde ayaktan ve yatarak takip edilen HBsAg, anti-HCV ve anti-delta negatif olan hastalar kontrol grubu olarak tanımlandı.
Anti-HEV IgG ve IgM tayini için hastanemiz merkez laboratuvarında standardize edilmiĢ ticari bir mikroELISA kiti (Triturus cihazı-Grifols firması, Ġtalya) kullanılmıĢtır.
HBsAg, anti-HBs, HBeAg, anti-HBe, anti-HBc IgG ve anti-HCV incelemeleri hastanemiz Mikrobiyoloji laboratuarında MakroEIA yöntemi ile Roche firmasının Cobas e 601 cihazında (ELECSYS 2010, Roche Diagnostics GmbH, D-68298 Mannheim, Germany) Roche firmasının orijinal kitleri ile çalıĢıldı. Anti-HDV total düzeyi, Grifols markasının Triturus modeli ile mikroelisa yöntemi ile çalıĢıldı.
Tam kan; EDTA‘lı tüpte CELL-DYN 3700 cihazında (Abbott-Amerika) otomatik optik lazer empedans sistemiyle 3 sayımın ortalaması alınarak çalıĢıldı.
ALT, AST, GGT, albumin, total bilirubin; Jelli biyokimya tüpünde Architect C 16000cihazında (Amerika) enzimatik yöntemle çalıĢıldı.
Ġstatistiksel incelemeler; veriler Excel paket programından SPSS (Statistical Package for Social Sciences) 21 paket programına aktarıldı. DeğiĢkenler kategorik, sıralı ve sürekli ölçüm değiĢkenleri olarak tanımlandı ve bu değiĢkenler için uygun testler kullanıldı. Ġki bağımsız grubu karĢılaĢtırmak için Student‘s t-testi kullanıldı.
22 Sayımla belirlenen kategorik değiĢkenler için ki-kare testi kullanıldı. Ġkiden çok grubu karĢılaĢtırmak için tek yönlü varyant analiz (one-way ANOVA) uygulandı. Önemli olan grup ortalamasını tespit etmek için post-hoc comparison testleri kullanıldı. Risk faktörlerinin belirlenmesine yönelik olarak çok değiĢkenli analiz lojistik regresyon testi kullanılarak yapıldı. P değeri <0.05 olanlar anlamlı kabul edildi.
23
4. BULGULAR
4.1. Hastaların Epidemiyolojik Özellikleri
2011 Mayıs ile 2015 Mart tarihleri arasında Gastroenteroloji Bilim Dalı‘na baĢvuran 18 yaĢ ve üzeri 566 erkek ve 459 kadın olmak üzere toplam 1025 hasta çalıĢmaya alındı. ÇalıĢma hastaları dört gruba ayrıldı (HBsAg pozitif hastalar, HBsAg ve anti-delta pozitif hastalar, anti-HCV pozitif hastalar, non-viral grup). HBsAg pozitif olan 284 kiĢi HBV grubu, anti-delta pozitif olan 82 kiĢi HDV grubu, anti-HCV pozitif olan 38 kiĢi HCV grubu olarak tanımlandı. HBsAg, anti-HCV ve anti-delta‘nın negatif saptandığı 621 kiĢi kontrol grubu olarak tanımlandı.
Tüm hastaların %56.4‘ünde (578/1025) anti-HEV IgG pozitifliği, %3.6‘sında (37/1025) anti-HEV IgM pozitifliği saptandı. HBV hastalarında %50 (142/284), HDV hastalarında %70.7 (58/82), HCV hastalarında %76.3 (29/38), kontrol grubunda %56.2 (349/621) anti-HEV IgG pozitif saptanmıĢ olup HCV hastalarında pozitiflik oranı diğer gruplara göre anlamlı olarak yüksek bulundu (p=0.001) (ġekil 9).
Anti-HEV IgG pozitif saptanan olguların %58‘i erkek (328/578), %54.5‘i (250/578) kadın olup, cinsiyetler arasında anlamlı fark bulunmadı (P=0.26). Tüm olguların yaĢ ortalaması 49.29±15.39 yıl saptandı. Grupların yaĢ ortalaması; HBV
grubunda 40.39±14.77 yıl, HDV grubunda 44.98±13.92 yıl, HCV grubunda51.84±15.77 yıl, kontrol grubunda ise 44.78±17.47 yıl saptandı (p=0.001). Ġncelenen olguların cinsiyet ve yaĢ gruplarına göre dağılımları Tablo 4 ve ġekil 10-11‘de görülmektedir.
ġekil 9: Farklı çalıĢma gruplarında anti-HEV IgG pozitifliği (%)
0% 20% 40% 60% 80% 100% HBV HDV HCV KONTROL
Anti-HEV IgG (+)
24 ġekil 10: Tüm olgularda cinsiyete göre anti-HEV IgG pozitifliği (n)
Tablo 4: Anti-HEV IgG seropozitifliğin yaĢ spesifik seroprevalansı (n, %)
YaĢ grupları Erkek (n, %) Kadın (n, %) Toplam (n, %)
18-30 40, %12.2 28, %11.2 68, %11.8
31-40 68, %20.7 52, %20.8 120, %20.8
41-50 65, %19.8 58, %23.2 123, %21.3
51-60 81, %24.7 45, %18 126, %21.8
>61 74, %22.6 67, %26.8 141, %24.4
ġekil 11: Anti-HEV IgG pozitif olguların yaĢ ve cinsiyet dağılımı (n)
0 50 100 150 200 250 300 350 ERKEK KADIN Anti-HEV IgG(+) Anti-HEV IgG(-) 0 10 20 30 40 50 60 70 80 90 18-30 31-40 41-50 51-60 >61 ERKEK KADIN
25
Tablo 5: Anti-HEV IgG seropozitifliğin gruplara göre yaĢ spesifik seroprevalansı (n,%)
YaĢ grupları HBV HDV HCV Kontrol
18-30 18, %12.7 7, %12.1 2, %6.9 41, %11.7 31-40 39, %27.5 14, %24.1 4, %13.8 63, %18.1 41-50 33, %23.2 14, %24.1 7, %24.1 69, %19.8 51-60 31, %21.8 13, %22.4 8, %27.6 74, %21.2 >61 21, %14.8 10, %17.2 8, %27.6 102, %29.2 P Değeri P<0.001 P=0.13 P=0.23 P<0.001
Anti-HEV IgG pozitifliği yaĢ gruplarına göre değerlendirildiğinde; en yüksek oranın 61 yaĢın üzerindeki bireylerde %24.4 olduğu (141/578) tespit edildi. Bunu %21.8 (126/578) oranı ile 51-60 yaĢ grubu takip etmektedir. Olguların yaĢ dağılımına bakıldığında; kadın olgulardaki en yüksek oran %26.8 (67/250) ile 61 yaĢın üzerindeki grupta görülmekte, bunu %23.2 (58/250) ile 41-50 yaĢ grubu ve %20.8 (52/250) oranı ile 31-40 yaĢ grubu izlemektedir. Erkek olguların yaĢ dağılımındaki en yüksek oran ise %24.7 (81/328) ile 51-60 yaĢ grubu olup, bunu %22.6 (74/328) oranıyla >61 yaĢ grubu ve %20.7 (68/328) 31-40 yaĢ grubu izlemektedir. Tüm olgularda HEV-IgG pozitifliğinin yaĢ gruplarına göre dağılımı ki-kare testi ile incelendiğinde, yaĢ grupları arasında istatistiksel olarak anlamlı fark bulundu (p<0.001). Gruplardaki HEV IgG pozitifliği, HBV‘li hastalarda 31-40 yaĢ arası grupta %27.5 oran ile (p<0.001) ve kontrol grubunda >61 yaĢ grubunda %29.2 lik oran ile anlamlı yükseklik saptandı (p<0.001) (Tablo 5).
Tüm olgularda, anti-HEV IgG pozitiflik oranı orijinine göre değerlendirildiğinde; olguların %50.4‘ü (253/502) kent kökenli olduğu, %49.6‘sı (249/502) kırsal kökenli olduğu tespit edildi. Kırsal kökenli kiĢilerin %70.9‘unda (249/351), kent kökenli kiĢilerin ise %46‘sında (253/550) seropozitiflik görüldü (Tablo 6). Kırsal kökenli olmanın seropozitiflik üzerine anlamlı risk faktörü olduğu görüldü (p<0.001).
Tüm olgularda anti-HEV IgG pozitiflik oranı eğitim seviyesine göre değerlendirildiğinde; olguların %61.6‘sında (305/495) eğitim seviyesinin düĢük, %38.4‘ünde (190/495) eğitim seviyesinin yüksek olduğu saptandı (p<0.001) (Tablo 6).
26 ÇalıĢma gruplarında ise eğitim seviyesinin HBV (%62.1, 151) grubunda yüksek, HDV (%44.9, 31) ve HCV (%45.5, 15) grubunda düĢük, kontrol grubunda ise (%50.4, 275) fark olmadığı saptandı (Tablo 8). Eğitim düzeyinin tüm gruplardaki dağılımında istatistiksel olarak anlamlı fark görüldü (p=0.007).
Anti-HEV IgG pozitif olan hastaların %84.3‘ü evli (463/549), %15.7‘si bekar (86/549) saptandı (p<0.001) (Tablo 6). Toplam hastaların 41‘inde (%10) gebelik mevcuttu. Bu gebelerin %4.6‘sında (10/41) anti-HEV IgG pozitifliği görüldü (p<0.001). ÇalıĢma gruplarında ise medeni durum (p=0.24) ve gebeliğin bulunması (p=0.79) istatistiksel olarak fark yaratmadı (Tablo 8).
Anti-HEV IgG pozitif olan hastaların %35.3‘ünde (171/485) ailede bilinen viral hepatit öyküsü mevcuttu (p=0.49) (Tablo 6). Tüm gruplarda ise ailede hepatit öyküsü en yüksek oran %85.7 (60/70) ile HDV‘de saptandı. HBV‘de %69.5 (162/233), HCV‘de %19.3 (6/31), kontrol grubunda ise %12.7 (68/534) olup istatistiksel olarak anlamlı fark saptandı (p=0.001) (Tablo 8).
Anti-HEV IgG pozitif olan hastaların %53.1‘inde (260/490) hayvanlarla temas öyküsünün olduğu tespit edildi (p=0.001). Hayvanlarla temas öyküsü olan hastaların %72.6‘sında (260/358) seropozitiflik saptandı (Tablo 6). HBV hastalarının %35.5‘i (84/236), HDV hastalarının %56.5‘i (39/69), HCV hastalarının %46.8‘i (15/32), kontrol hastalarının ise %40.7‘sinde (220/544) hayvanlarla temas öyküsünün olduğu öğrenildi (Tablo 8). Hayvanlarla temas öyküsünün varlığı hem tüm olgularda hem de çalıĢma gruplarında anlamlı olduğu görüldü (p=0.01).
Anti-HEV IgG pozitif olan hastaların %2‘sinde (10/493) madde kullanımı saptandı (p=0.23) (Tablo 5). HBV hastalarının %2.9‘u (7/239), HDV hastalarının %7.2‘sinde (5/69), HCV hastalarının %6.06‘sında (2/33), kontrol hastalarının ise %1.6‘sınde (9/544) madde kullanımı olduğu öğrenildi (p=0.02) (Tablo 8).
Anti-HEV IgG pozitif olan hastaların %12.4‘ünde (61/493) alkol kullanımı mevcuttu (p=0.01) (Tablo 6). Alkol kullanım oranı HBV hastalarında %18.9 (45/239), HDV hastalarında %21.8 (15/69), HCV hastalarında %33.4 (11/33), kontrol hastalarında ise %9.1 (49/544) olup gruplar arsında anlamlı fark bulundu (p=0.001).
27
Tablo 6: Tüm olguların epidemiyolojik ve klinik özellikleri (n, %)
Tablo 7: Tüm olguların laboratuvar parametreleri. Anti-HEV IgG (+) (n=578) Anti-HEV IgG (-) (n=447) P değeri ALT, U/L 102.96±298.76 157.46±433.20 P<0.01 AST, U/L 96.84±318.50 108.76±307.04 P>0.05 GGT, U/L 81.41±135.54 73.23±158.83 P>0.05 Albumin, g/dl 3.52±1.88 3.64±0.77 P>0.05 Total bilirubin, mg/dl 1.59±3.02 1.72±3.58 P>0.05 Hemoglobin, g/dl 12.49±2.54 13.09±4.04 P<0,01 Trombosit, K/uL 217432.56±110303.89 234580.72±102067.73 P<0,01 PTT, INR 1.11±0.33 1.07±0.25 P>0.05 Anti-HEV IgG (+) (n=578) Anti-HEV IgG (-) (n=447) P değeri YaĢ (yıl) 49.29±15,39 36,79 ± 15,44 P<0.001 Cinsiyet (erkek, %) 328 (% 58) 238 (%42) P=0.26 Kent/kırsal (kent, %) 253 (% 46) 297 (%54) P<0.001 Eğitim seviyesi (düĢük, %) 305 (% 72.8) 114(%27.2) P<0.001 Medeni durum (evli, %) 463 (% 61.4 ) 290(% 38.6) P<0.001
Gebelik (var, %) 10 (% 24.4) 31 (% 75.6) P<0.001
Ailede bilinen hepatit öyküsü (var, %) 171 (% 57.7) 125 (% 42.3) P=0.49 Hayvanlarla temas öyküsü (var, %) 260 (% 72.6) 98 (% 27.4) P=0.001 Madde alım öyküsü (var, %) 10 (% 43.5) 13 (% 56.5) P=0.23 Alkol kullanım öyküsü (var, %) 61 (% 50.8) 59 (% 49.2) P=0.28 Siroz varlığı (Var, %) 115 (% 69.2) 51 (% 30.8) P<0.001 Anti-viral tedavi alımı (Var, %) 166 (% 62.6) 99 (% 37.4) P=0.01
28
Tablo 8: Gruplar arası epidemiyolojik ve klinik özelliklerin karĢılaĢtırılması HBV (n=284) HDV (n=82) HCV (n=38) Non-viral (n=621) P değeri YaĢ (yıl) 40.39±14.77 44.98±13.92 51.84±15.77 44.78±17.47 P=0.001 Cinsiyet (erkek, %) % 67.2 % 73.1 % 55.2 % 47.3 P=0.001 Kent/kırsal (kent, %) % 66.1 % 54.3 % 63.6 % 59.5 P=0.19 Eğitim seviyesi (düĢük, %) % 37.9 % 55.1 % 54.5 % 49.6 P=0.007 Medeni durum (evli, %) % 78.6 % 85.3 % 74.3 % 75.5 P=0.24
Gebelik (var, %) % 7.4 % 10.5 % 6.7 % 10.8 P=0.79
Ailede hepatit öyküsü (var, %) % 69.5 % 85.7 % 19.3 % 12.7 P=0.001 Hayvanlarla temas (var, %) % 35.5 % 56.5 % 46.8 % 40.7 P=0.01 Madde alım öyküsü (var, %) % 2.9 % 7.2 % 6.06 % 1.6 P=0.02 Alkol kullanım öyküsü (var, %) % 18.9 % 21.8 % 33.4 % 9.1 P=0.001 Siroz varlığı (Var, %) % 14.4 % 67.5 % 34.2 % 9.4 P=0.001 Anti-viral tedavi alımı (Var, %) % 63.9 % 82.4 % 58.8 % 3.3 P=0.001
Anti-HEV IgG (+) % 50 % 70.7 %76.3 % 56.2 P=0.001
Anti-HAV IgG (+) % 98.9 % 100 % 100 % 99 P=0.07
Tablo 9: Grupların laboratuvar parametreleri HBV (n=284) HDV (n=82) HCV (n=38) Non-viral (n=621) P değeri ALT, U/L 214.71±543.65 105.91±303.48 50.84±51.91 93.88±259.09 P=0.001 AST, U/L 151.90±389.92 112.90±338.37 48.79±39.94 81.06±275.78 P=0.01 GGT, U/L 69.49±154.69 64.42±91.92 74.08±88.95 84.13±150.96 P=0.45 Albumin, g/dl 3.76±0.74 3.51±0.81 3.27±0.84 3.44±0.78 P=0.001 Total bilirubin, mg/dl 1.88±3.81 2.46±4.53 1.42±1.22 1.44±2.84 P=0.03 Hemoglobin, g/dl 13.88±2.42 13.1±2.40 12.18±2.83 12.21±3.62 P=0.001 Trombosit, K/uL 222155.7± 78306.4 170222.2± 121939.5 165201.05± 68056.8 237049.8± 114709.2 P=0.001 PTT, INR 1.06±0.26 1.18±0.24 1.15±0.27 1.08±0.32 P=0.01
29
4.2. Klinik Özellikler
Anti-HEV IgG pozitif olan hastaların %19.9‘unda (115/577) siroz saptandı (p<0.001) (Tablo 6). HBV hastalarının %14.4‘ünde (41/284), HDV hastalarının %67.5‘inde (54/80), HCV hastalarının %34.2‘sinde (13/38) ve kontrol hastalarının %9.4‘ünde (58/620) siroz saptandı (Tablo 8). Gruplar arasında anlamlı fark saptandı (p=0.001).
Anti-HEV IgG pozitif olan hastaların %31.5‘i (166/527) antiviral tedavi aldığı saptandı (p=0.01) (Tablo 6). HBV hastalarının %63.9‘u (165/258), HCV hastalarının %58.8‘i (20/34), HDV hastalarının ise %82.4‘ü (61/74) antiviral tedavi almıĢ olup diğer gruplardan anlamlı olarak daha yüksek bulundu (p=0.001).
4.3. Laboratuvar
Tüm hastaların laboratuvar parametreleri Tablo 7 ve Tablo 9‘de özetlenmiĢtir. ALT değeri anti-HEV IgG pozitif olanlarda 102.96±298.76 U/L olup istatiksel olarak anlamlı fark saptandı (p<0.01). Pozitif olan olguların hemoglobin değeri 12.49±2.54
g/dl, trombosit değeri 217432.56±110303.89 K/uL olduğu görüldü. Hemoglobin ve trombosit içinde anlamlı fark saptandı (p<0.01).
Gruplardaki en yüksek ALT düzeyi HBV hastalarında görülmüĢ olup
214.71±543.65 U/L saptandı, en düĢük ALT düzeyi ise HCV hastalarında 50.84±51.91
U/L görüldü (p=0.001). AST düzeylerine bakıldığında en yüksek olduğu grup HBV, en düĢük saptanan grup HCV olarak görüldü (p=0.01). HBV‘de AST düzeyi 151.90±389.92 U/L, HDV‘de 112.90±338.37 U/L, HCV‘de 48.79±39.94 U/L, non-viral grupta ise AST düzeyi 81.06±275.78 U/L olarak saptandı. Albumin düzeyinin en düĢük olduğu grup HCV olup düzeyi 3.27±0.84 g/dl olduğu görüldü. En yüksek albumin
düzeyi ise HBV hastalarında olup 3.76±0.74 g/dl saptandı (p=0.001). Total bilirubin
düzeyinin en yüksek olduğu hasta grubu HDV olup 2.46±4.53 mg/dl saptandı. HBV‘de
total bilirubin düzeyi 1.88±3.81 mg/dl, HCV‘de total bilirubin düzeyi 1.42±1.22 mg/dl, non-viral grupta total bilirubin düzeyi 1.44±2.84 mg/dl saptandı (p=0.03).
Hemoglobinin en düĢük olduğu hasta grubu HCV olup 12.18±2.83 g/dl saptandı. HBV
hastalarında hemoglobin düzeyi 13.88±2.42 g/dl, HDV hastalarında hemoglobin düzeyi
13.10±2.40 g/dl, non-viral grupta hemoglobin düzdeyi ise 12.21±3.62 g/dl saptandı
30
165201.05±68056.80 K/uL saptandı.HBV‘de trombosit değeri 222155.7±78306.4 K/uL, HDV‘de trombosit değeri 170222.2±121939.5 K/uL, non-viral grupta ise trombosit değeri 237049.8±114709.2 K/uL saptandı (p=0.001). HBV grubunda INR düzeyi
1.06±0.26, HDV grubunda INR düzeyi 1.18±0.24, HCV grubunda INR düzeyi 1.15±0.27, non-viral grupta INR düzeyi 1.08±0.32 saptanmıĢ olup gruplar arasında
istatistiksel olarak anlamlı fark görüldü (p=0.01).
4.4. Lojistik Regresyon Analizi (Risk faktör analizi)
Epidemiyolojik faktörlerin tek değiĢkenli analizinde (univariate); 35 yaĢ üzerinde olmak, kırsal kökenli olmak, eğitim seviyesinin düĢük olması, evli olmak, gebe olmamak, hayvanlarla temas öyküsünün olması istatiksel risk faktörleri olarak saptandı. Cinsiyet ve ailede bilinen viral hepatit öyküsünün olması anti-HEV IgG seropozitifliğinde risk faktörü olarak görülmedi (Tablo 9).
Epidemiyolojik faktörlerin çok değiĢkenli analizinde (multivariate); artan yaĢ ve eğitim düzeyinin düĢük olması anti-HEV IgG seropozitifliğinde risk faktörü olarak saptandı (Tablo 9).
Laboratuvar parametrelerin tek değiĢkenli analizinde (univariate); ALT değerinin 35‘in üzerinde olması, GGT değerinin 50‘den büyük olması, trombosit değerinin 150000‘den küçük olması, anti-delta pozitif olması, anti-HCV pozitif olması ve anti-HAV IgG pozitif olması HEV seropozitifliğinde risk faktörü olduğu saptandı. HBsAg pozitifliği ise anti-HEV IgG pozitifliğinde risk faktörü olarak görülmedi. Laboratuvar parametrelerin çok değiĢkenli analizinde (multivariate) ise anti-HEV IgG pozitifliğinde risk faktörleri olarak görülmedi (Tablo 10).
31
Tablo 10: Anti-HEV IgG pozitifliğini etkileyen faktörlerin lojistik regresyon analizleri Univariate OR (95 CI) P değeri Multivariate OR (95 CI) P değeri YaĢ (>35 ve ≤35 yaĢ) 1.77 (1.61-1.95) P<0.001 0.32 (0.16-0.67) P=0.002 Cinsiyet (erkek/kadın) 1.15 (0.89-1.47) P=0.26 1.06 (0.8-1.41) P=0.66 Orjin (kent/kırsal) 2.86 (2.15-3.81) P<0.001 0.59 (0.17-2.08) P=0.42
Eğitim seviyesi (düĢük/ yüksek) 0.25 (0.19-0.33) P<0.001 0.25 (0.11-0.57) P=0.001 Medeni durum (evli/bekar) 2.56 (1.88-3.48) P<0.001 1.18 (0.55-2.54) P=0.65 Gebelik (var/yok) 0.25 (0.11-0.52) P<0.001 1.07 (0.28-4.1) P=0.92 Ailede hepatit öyküsü (var/yok) 1.12 (0.84-1.49) P=0.41 1.44 (0.57-3.65) P=0.43 Hayvanlarla temas (var/yok) 3.33 (2.49-4.45) P<0.001 2.77 (0.82-9.3) P=0.09
ALT, U/L (35 ve üstü) 0.75 (0.58-0.97) P=0.02 0.69 (0.8-1.63) P=0.40
GGT, U/L (50 ve üstü) 1.26 (0.96-1.65) P=0.09 0.72 (0.3-1.72) P=0.46
Trombosit, K/uL (150000 ve altı) 0.55 (0.4-0.74) P<0.001 1.11 (0.42-2.89) P=0.46
HBsAg pozitifliği (var/yok) 0.92 (0.71-1.19) P=0.56 1.3 (0.52-3.26) P=0.57
Anti-delta pozitifliği (var/yok) 1.91 (1.17-3.1) P=0.009 0.52 (0.13-2.06) P=0.35
Anti-HCV pozitifliği (var/yok) 2.47 (1.19-5.1) P=0.01 1.14 (0.1-12.65) P=0.91
32
5. TARTIġMA
Hepatit E virüsü enfeksiyonu dünyada epidemik ve sporadik olmak üzere iki formda karĢılaĢılmaktadır. HEV infeksiyonu, çevresel sanitasyonun ve hijyen koĢullarının yetersiz olduğu ülkeler baĢta olmak üzere dünyanın birçok bölgesinde epidemilere neden olurken, sosyoekonomik düzeyi yüksek, alt yapı tesisleri yeterli, geliĢmiĢ batı ülkerinde sporadik olarak ortaya çıkmaktadır (1,6,17,35,42,65,68,69). Temel bulaĢ yolu fekal-oral yol olmakla birlikte, HEV enfeksiyonlarının zoonotik özellik taĢıdığı günümüzde kabul edilen bir gerçektir (61,62,89,90).
GeliĢmekte olan ülkelerde HEV seroprevalansı; Mısır‘da %17.2, Suudi Arabistan‘da %8.4, Yemen‘de %33, Tayland‘da %15.7, Hindistan‘da %50, Nepal‘de %16-31, Somali‘de %78 olarak bildirilmektedir (34,91,92,93). Buna karĢın geliĢmiĢ ülkelerde HEV seroprevalansı daha düĢük olup, ABD‘nde %2.1, Avusturalya‘da %0.4, Ġngiltere‘de %3.9, Ġspanya‘da %5.5 ve Yunanistan‘da %2.2 oranlarında rapor edilmektedir (36,42,61,69,89,91,94).
Ülkemizde ise HEV seroprevalansı ile ilgili çalıĢmalarda genel seropozitiflik oranı yaklaĢık %6 olarak verilmekte; ancak çalıĢmanın yapıldığı bölgelere, yaĢ gruplarına ve olgu gruplarına göre bu oran değiĢmektedir. Ülkemizde çeĢitli bölgeleri kapsayan bu çalıĢmalarda %3.5 ile %73 arasında değiĢen oranlar bildirilmektedir (tablo 3)(43). Thomas ve arkadaĢlarının yaptıkları çalıĢmada, Türkiye‘nin beĢ ayrı bölgesinden toplanan serumlarda anti-HEV sıklığı %5.9 saptanmıĢ olup Türkiye‘yi hepatit E‘nin endemik olarak görüldüğü bölgeler arasında değerlendirmiĢlerdir (8). Köksal ve arkadaĢlarının Trabzon‘da non-A non-B akut hepatitli 53 hastanın 39‘ unda anti-HEV antikoru saptayarak seroprevalansı %73 olarak değerlendirmiĢlerdir (70). Karslıgil ve arkadaĢlarının Gaziantep‘te normal bireylerde yaptıkları çalıĢmada %11.2 (95), Bozkurt ve arkadaĢlarının Van ilinde yaptıkları çalıĢmada %7.5 (96), Eker ve arkadaĢlarının Edirne ilinde yaptıkları çalıĢmada %2.4 (97), Karaayak Uzun ve arkadaĢlarının Ġzmir‘de yaptıkları çalıĢmada HEV seroprevalansı %6.7 olarak saptamıĢlardır (98).
Diyarbakır‘da Değertekin ve arkadaĢlarının 1995 yılında 220 normal popülasyonda yaptıkları çalıĢmada HEV seroprevalansı %7.7 (99), Ayaz ve arkadaĢlarının 1996 yılında 7-17 yaĢ arası 382 olguda yaptıkları çalıĢmada %12.8 (100),
33 HoĢoğlu ve arkadaĢlarının 1997 yılında 156 laboratuvar çalıĢanlarında yaptıkları çalıĢmada %17.3 (101), Yükselen ve arkadaĢlarının 1997 yılında 34 normal popülasyonda yaptıkları çalıĢmada %23.5 (102), Aydın ve arkadaĢlarının 1999 yılında Trabzon ve Diyarbakır illerinde normal popülasyonda eĢ zamanlı yaptıkları çalıĢmada sırasıyla %3 ve %29 (103), Olcay ve arkadaĢlarının 2000 yılında Ankara, Manisa ve Diyarbakır‘da normal popülasyonda eĢ zamanlı yaptıkları çalıĢmada sırasıyla %2.7, %3.8, %11.7 (7), Ceylan ve ark.nın 2003 yılında 46 tarım iĢçisi ve 45 kontrol grubunda yapılan çalıĢmada HEV seroprevalansını sırasıyla %34.8 ve %4.4 saptamıĢlardır (104).
Bu çalıĢma ile Dicle Üniversitesi Tıp Fakültesi Gastroenteroloji Bilim Dalı‘na baĢvuran 18 yaĢ ve üzeri viral hastalarda HEV seropozitifliğinin retrospektif olarak araĢtırılması, olguların epidemiyolojik, klinik, laboratuvar özellikleri değerlendirilip, HEV infeksiyon seropozitifliğini etkileyen faktörlerin ortaya çıkarılması amaçlandı. Ayrıca bölgemizde HEV infeksiyonu ile iliĢkili risk faktörlerinin belirlenmesi hedeflenmiĢtir.
Bu amaçla yürüttüğümüz çalıĢmada, tüm hasta gruplarında toplam anti-HEV IgG seropozitiflik oranı %56.4 (578/1025) olarak bulundu. Bu sonuçların daha önceleri hem Diyarbakır‘da yapılan çalıĢmalardan; hem de Türkiye‘de diğer bölgelerde yapılan çalıĢmalardan daha yüksek oranda anti-HEV seropozitifliği olduğu görüldü (7,8,95-106). Bu durumun temel nedenlerinden çalıĢmamızda diğer çalıĢlmalardan farklı olarak viral hepatitli hasta grubunun çalıĢılmıĢ olması olabilir.
Anti-HEV seropozitifliği; HBV hastalarında %50 (142/284), HDV hastalarında %70.7 (58/82), HCV hastalarında %76.3 (29/38), non-viral grupta ise %56.2 (349/621) görüldü (p=0.001). Non-viral gruptaki seropozitiflik tüm çalıĢma popülasyonumuzdaki oranla benzer saptandı. HCV‘li hastalardaki yüksek oran bu hasta grubundaki daha ileri yaĢa bağlı olabilir.
ÇalıĢmamızda hastaların yaĢ ortalaması 49.29±15.39 yıl olarak bulundu.
Gruplardaki yaĢ ortalaması; HBV de 40.39±14.77 yıl ile en düĢük, HCV‘de
51.84±15.77 yıl ile en yüksek olduğu görüldü (p=0.001). Anti-HEV IgG seroprevalansının yaĢ ilerledikçe arttığı görüldü (Tablo 4) (ġekil 11). Tüm bu veriler birlikte irdelendiğinde; HEV-IgG antikorlarının, genç eriĢkinlerde pozitifleĢmeye baĢladığı, eriĢkinlerde yükselme gösterdiği ve ileri yaĢlarda en yüksek düzeye ulaĢtığı ifade edilebilir (p<0.001). Anti-HEV IgG seroprevalansının yaĢ ile birlikte arttığını