EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ENFEKSİYON HASTALIKLARI VE KLİNİK MİKROBİYOLOJİ ANABİLİM DALI
Prof. Dr. Sercan Ulusoy
İZMİR VE ÇEVRESİNDE
AKUT MENENJİT EPİDEMİYOLOJİSİ
UZMANLIK TEZİ Dr. Hasip Kahraman Tez Yöneticisi Doç. Dr. Hüsnü Pullukçu İZMİR 2014
I TC
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ ENFEKSİYON HASTALIKLARI VE KLİNİK MİKROBİYOLOJİ ANABİLİM DALI
Prof. Dr. Sercan Ulusoy
İZMİR VE ÇEVRESİNDE AKUT MENENJİT EPİDEMİYOLOJİSİ
UZMANLIK TEZİ Dr. Hasip Kahraman Tez Yöneticisi Doç. Dr. Hüsnü Pullukçu İZMİR 2014
II
Tezimin her aşamasında, bilgi ve deneyimleri ile bana destek olan Sayın Doç. Dr. Hüsnü Pullukçu ve Prof. Dr. Candan Çiçek’e, çalışmamıza katılan ve destekleyen tüm kliniklere yetişmemde emeği geçen Enfeksiyon Hastalıkları ve Klinik
Mikrobiyoloji Anabilim Dalı’ndaki tüm değerli hocalarıma, iyi ve kötü zamanları paylaştığımız araştırma görevlisi arkadaşlarıma, desteğini ve yardımını her zaman yanımda hissettiğim sevgili eşim Bilge Akman Kahraman’a teşekkürü borç bilirim…
III
İÇİNDEKİLER
ÖZET IV
ABSTRACT V
TABLOLAR VI
ŞEKİLLER, EKLER VII
GİRİŞ ve AMAÇ 1
GENEL BİLGİLER 3
Toplum Kökenli Akut bakteriyel menenjitler 3
Epidemiyoloji ve etiyoloji 3 Patogenez 7 Klinik özellikler 11 Tanı yöntemleri 12 Tedavi 15 Viral menenjitler 17 Epidemiyoloji ve etiyoloji 16 Patogenez 19 Klinik bulgular 21 Tanı yöntemleri 22 Tedavi 24 Ensefalitler 24 Epidemiyoloji ve etiyoloji 25 Patogenez 27 Klinik bulgular 27 Tanı yöntemleri 28 Tedavi 30 GEREÇ VE YÖNTEM 33 BULGULAR 39 TARTIŞMA 57 SONUÇ ve ÖNERİLER 68 EKLER 70 KAYNAKLAR 75
IV Özet
Mortalite ve morbiditesi yüksek olan akut menenjitlerde, hastaların acil olarak değerlendirilmesi ve tedavilerinin düzenlenmesi hayat kurtarıcıdır. Bu nedenle, duyarlılığı ve özgüllüğü yüksek olan moleküler testlerle etken hızla saptanabilir, etkene yönelik uygun tedavi düzenlenebilir ve gereksiz yere verilen antibiyotikler erken dönemde kesilebilir. Polimeraz Zincir Yöntemi (PZR), duyarlılığı ve özgüllüğü yüksek (%91-100) bir yöntem olarak etkeni hızla saptayabilme avantajına sahip olmakla birlikte, maliyetinin yüksek olması ve her merkezde uygulanamaması gibi nedenlerle kullanımı sınırlı kalmaktadır.
Çalışmamızda yer alan olguların %61’inde etken gösterilmiştir. Bakteriyel menenjitli olguların %24’ünün BOS kültüründe etken saptanırken, bu oran PZR ile %58 olarak bulunmuştur. Çalışmamızda mikst enfeksiyonlar dikkat çekmiştir; olguların 38’inde PZR ile tek etken saptanırken, 20’sinde çoklu etken saptanmıştır. Literatürle uyumlu olarak en sık saptanan bakteriyel etken pnömokok olurken, en sık saptanan virüs ise enterovirüs olmuştur. Olgularımızın %43’ünde BOS kültür örneklemesi öncesinde antibiyotik kullanım öyküsü mevcuttu.
Çalışmamızda ayrıca farklı merkezlerdeki ampirik tedavi seçimleri ve tedavide kortikosteroit kullanımı değerlendirilmiş ve merkezler arasında uygulama farklılıkları olduğu görülmüştür. Bu çalışma, bölgemizdeki menenjit etkenleri ve bunlara yönelik tedavi seçimleri ile ilgili verilerin sağlanmasına yardımcı olmuştur. Sonuç olarak, çalışmamızdan elde ettiğimiz verilerin ışığında, akut menenjit olgularında etiyolojik tanı amacıyla moleküler testlerin kullanımını önermekteyiz.
Anahtar kelimeler: akut bakteriyel menenjitler, polimeraz zincir reaksiyonu, viral menenjitler, ensefalit
V Abstract
Acute meningitis is an important disease which has high morbidity and mortality. So, immediate evaluation of the patients and regulation of treatment are life saving approaches. Therefore, by using molecular tests with high sensitivity and specificity, etiological agents can be determined rapidly, appropriate treatment can be arranged and unnecessary use of antibiotics can be discontinued in the early stages. The sensitivity and specificity of PCR is around 91-100%. One of the advantages of PCR is its rapidity in determining the etiology, but its use is limited because of its high cost and difficulties in appliance at all centers.
In this study, etiological agents have been shown in 61% of all patients. In 24% of cases of acute bacterial meningitis, etiology was determined in cerebrospinal fluid cultures while this ratio was 58% by PCR. Mixed infections were also noted in our study; single agent was detected by PCR in 38 of the cases, where as multiple agents were identified in 20 patients. Consistent with the literature, the most common bacterial and viral pathogen were pneumococcus and enterovirus respectively. Fourtythree percent of our patients had history of antibiotic use prior to sampling of CSF for culture.
In this study, empirical treatment options chosen in different centers and also the frequency of corticosteroid use in those centers were evaluated, and eventually differences in implementation procedures were observed. So, this study provided important data about agents and treatment options of acute meningitis in our region. Finally, we recommend the use of molecular tests for the etiological diagnosis of patients with acute meningitis.
Key words: acute bacterial meningitis, polymerase chain reaction, viral meningitis, encephalitis
VI TABLOLAR
Tablo No Tablo Adı Sayfa
Tablo 1 ABM'de görülen belirti ve bulguların sıklığı 11
Tablo 2 IDSA rehberine göre pürülan menenjitli olgularda ampirik antibiyotik tedavisi 16
Tablo 3 Olguların çalışmaya katılan merkezlere göre dağılımı 39
Tablo 4 Olguların yaş gruplarına göre dağılımı 40
Tablo 5 Olguların başvuru yakınmalarının dağılımı 40
Tablo 6 Risk faktörlerinin değerlendirilmesi 41
Tablo 7 Ek hastalıkların dağılımı 41
Tablo 8 Menenjit türüne göre laboratuvar bulgularının değerlendirilmesi 42
Tablo 9 Kraniyal görüntüleme bulguları 43
Tablo 10 BOS bulgularına göre olguların dağılımı ve mortalite ile ilişkisi 43
Tablo 11 BOS ve hemokültürde üreyen etkenlerin dağılımı 44
Tablo 12 PZR'de saptanan tüm etkenlerin menenjit türüne göre dağılımı 45
Tablo 13 PZR ile saptanan bakteriyel etkenlerin dağılımı 45
Tablo 14 PZR ile saptanan bakteriyel etkenlerin yaş gruplarına göre dağılımı 46
Tablo 15 Tüm olgularda PZR ile saptanan herpesvirüslerin yaş gruplarına göre dağılımı 47
Tablo 16 Viral menenjit/ensefalit tanılı olgularda PZR ile herpes virüslerin yaş gruplarına göre dağılımı 47
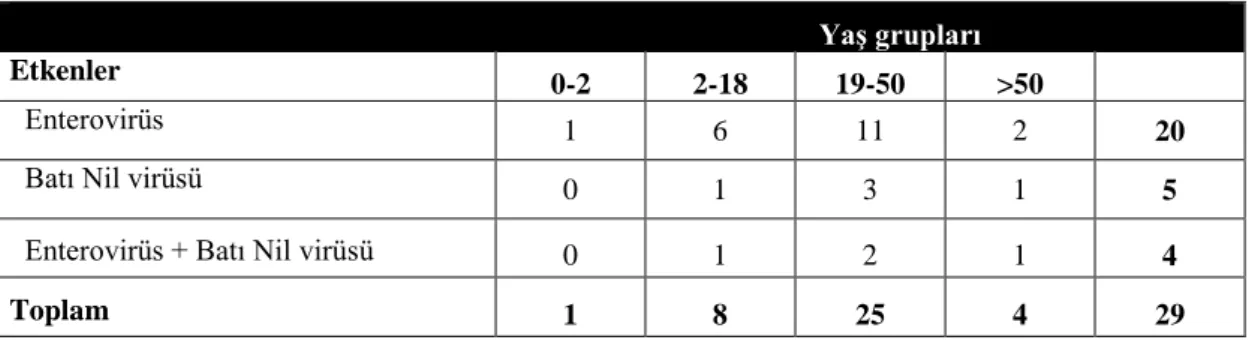
Tablo 17 : Tüm olgularda PZR ile saptanan enterovirüs ve Batı Nil virüslerinin yaş gruplarına göre dağılımı 48
Tablo 18 Viral menenjit/ensefalit ile uyumlu bulguları olan olgularda PZR ile saptanan enterovirüs ve Batı Nil virüslerinin yaş gruplarına göre dağılımı 48
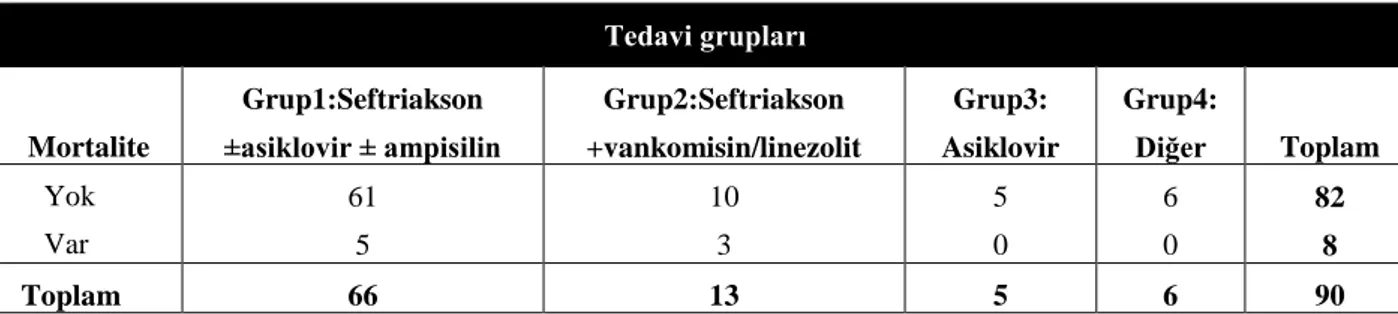
Tablo 19 Tüm olgularda ampirik antibiyotik tedavisinin ve mortalitenin değerlendirilmesi 49
Tablo 20 Pürülan menenjit olgularında ampirik tedavinin ve mortalitenin değerlendirilmesi 50
Tablo 21 Mortalite üzerindeki prognostik faktörler 51
Tablo 22 Takibinde komplikasyon gelişen veya ex olan olguların değerlendirilmesi 52
Tablo 23 Çalışmaya alınan olguların yaş, Glasgow koma skoru, LP öncesi antibiyotik öyküsü,
VII
ŞEKİLLER ve EKLER
Şekil No Şekil Adı Sayfa
Şekil 1 Bakteriyel menenjit patogenezi 10
Ek No Ek Adı Sayfa
Ek 1 Bilgilendirilmiş Gönüllü Olur Formu 70
1 1.GİRİŞ VE AMAÇ
Akut menenjitler, beyin zarlarının çeşitli mikroorganizmalar nedeniyle yangılanması sonucunda birkaç saat veya gün içinde gelişen, ateş yüksekliği, baş ağrısı, ense sertliği, nörolojik bulgular ve beyin omurilik sıvısında (BOS’ta) hücresel ve biyokimyasal değişikliklerle kendini gösteren ve yaşamı tehdit eden merkezi sinir sistemi (MSS) enfeksiyonlarıdır. Akut menenjitlerin etiyolojisinde en sık virüsler ve bakteriler yer alırlar (1,2).
Toplum kökenli akut bakteriyel menenjitlerin büyük çoğunluğunu Streptococcus
pneumoniae, Neisseria meningitidis, Haemophilus influenzae, Listeria monocytogenes ve grup B streptokoklar oluşturmaktadır (3,4). Etkenlerin dağılımı yaşa, sosyoekonomik
özelliklere, aşı uygulamalarına ve altta yatan risk faktörlerine göre değişebilmektedir (3,5).
Tanı ve tedavideki gelişmelere rağmen, akut bakteriyel menenjitler mortalite ve morbiditesi yüksek olan enfeksiyon hastalıklarıdır (6,7). Akut bakteriyel menenjitler, dünyada enfeksiyon hastalıklarına bağlı ölümlerden sorumlu olan ilk on hastalık içerisinde yer almaktadır (7). Akut menenjit hastalarının tanısında klinik değerlendirmenin yanı sıra, eğer kontrendike bir durum yoksa acil olarak lomber ponksiyon (LP) ile BOS örneğinin alınması ve hızlı bir şekilde makroskobik, mikroskobik, biyokimyasal ve mikrobiyolojik olarak incelenmesi gerekmektedir (1,5).
Akut viral menenjitlerin ve meningoensefalitlerin etiyolojisinde ise enterovirüsler, herpesvirüsler, kabakulak, kızamık, insan bağışık yetmezlik virüsü ve flavivirüsler en sık karşımıza çıkan etkenlerdir. Bu etkenlerle ortaya çıkan menenjit/menengoansefalitler yılda yaklaşık 100.000’de 5-15 oranında görülür (8). Etiyolojik etken, çeşitli vücut bölgelerinden alınan örneklerin hücre kültürü, seroloji,
2
nükleik asit amplifikasyon testleri ve histopatolojik olarak incelenmesi ile belirlenir. Olguların %32-75’inde ileri tanı yöntemleri kullanılmasına rağmen etiyolojik etken belirlenememektedir (9).
Ülkemizde akut menenjit epidemiyolojisiyle ilgili yeterli veri bulunmamaktadır. Türkiye’den yayınlanmış makaleler incelendiğinde, çocuk yaş grubunda az sayıda veri olduğu görülmüştür. Erişkin yaş grubunda ise kültür ve PZR’nin birlikte kullanıldığı bir çalışmaya rastlanmamıştır. Bu çalışma ile, bölgemizdeki akut menenjit etiyolojisini araştırmak, erişkin hastalarda PZR kullanımına ilişkin veri elde etmek ve sorunlu bakterilerin antibiyotiklere direnç oranlarını gözlemlemek mümkün olacaktır.
3 2.GENEL BİLGİLER
2.1.Toplum Kökenli Akut Bakteriyel Menenjit
2.1.1.Epidemiyoloji ve Etiyoloji
Toplum kökenli akut menenjitlerin ve meningoensefalitlerin insidansı bölgelere, mevsimlere, yaş gruplarına, sosyoekonomik düzeye bağlı olarak farklılık göstermektedir (10). Ülkemizde ve dünyada halen önemli bir mortalite nedeni olan akut menenjitlerin en sık nedeni virüsler ve bakterilerdir (2).
Toplum kökenli akut bakteriyel menenjit (ABM) insidansı, gelişmiş ülkelerde 100.000’de 2,6-6 arasında bildirilmekte iken, bu oranın gelişmekte olan ülkelerde en az 10 kat daha fazla olduğu düşünülmektedir. S. pneumoniae, N. meningitidis, H.
influenzae olguların %80’inden fazlasından sorumludur. Ek olarak L. monocytogenes, B
grubu streptokoklar, gram olumsuz enterik basiller, enterokoklar ve stafilokoklar da menenjit etkeni olarak karşımıza çıkabilmektedir (2). Amerika Birleşik Devletleri’nde 1998-2007 yılları arasında yapılan bir sürveyans çalışmalasında 3188 bakteriyel menenjit olgusu değerlendirilmiştir. Bu çalışmada 1998-1999 yıllarında menenjit insidansı 100.000’de 2 olarak bulunurken, bu oranın 2006-2007 yılları arasında 100.000’de 1.38’e gerilediği gözlenmiştir. Aşı uygulamalarının sonucu olarak ABM insidansında azalma ve epidemiyolojide çeşitli değişiklikler saptanırken, mortalitede anlamlı derecede bir azalma sağlanamamıştır. Etkenlerin dağılımına bakıldığında S.
pneumoniae %58, grup B streptokoklar(GBS) %18,1, N. meningitidis %13,9, H. influenzae %6,7, L. monocytogenes %3,4 oranında izole edilmiştir. Aynı çalışmada
2003-2007 yılları arasında erişkin yaş grubundaki 1083 ABM atağı değerlendirildirilmiş ve S. pneumoniae %70,6, N. meningitidis %11,5, grup B streptokoklar %7,3, H.
4
Brezilya’da 1962-1982 yılları arasındaki 4100 hastane ve toplum kökenli akut bakteriyel menenjit olgusunun incelendiği derlemede, atak hızı 100.000’de 45,8, ortalama ölüm oranı ise %33 bulunmuştur. Olguların %62’sinde etkenin S. pneumoniae,
N. meningitidis ve H. influenzae olduğu görülmüştür. Ülkemizdeki etkenlerin
dağılımına baktığımızda, Arda ve arkadaşlarının 1994-2003 yılları arasında Türkiye’deki akut pürülan menenjit olgularını değerlendirdiği havuz analizi çalışmasında, kültüründe üreme saptanan 784 olgunun %58’inde S. pneumoniae, %32’sinde N. meningitidis,%4’ünde ise S. aureus’un izole edildiği belirtilmiştir. Bu çalışmada H. influenzae sadece iki olguda saptanmıştır.
Etkenler
Streptococcus pneumoniae Menenjiti:
Sporsuz, hareketsiz, gram olumlu, kapsüllü bir diplokok olan S. pneumoniae toplum kökenli ABM’de en sık karşımıza çıkan mikroorganizmadır (1,2). Amerika’da akut menenjit olgularının %58’inde etken pnömokoklardır (3). Bu olguların %19-26’sı ölümcül seyretmektedir. Pnömokok menenjiti olgularında kötü prognoz faktörleri; Glasgow koma skorunun düşük olması, kraniyal sinir tutulumu, sedimentasyon yüksekliği, BOS’taki lökosit sayısının <1000 hücre/mm3
olması ve BOS proteininin yüksek olmasıdır. Splenektomi, multipl miyelom, hipogamaglobulinemi, alkolizm, malnütrisyon, kronik karaciğer veya böbrek hastalığı, malinite, diabetes mellitus gibi durumlarda pnömokok enfeksiyonu riski artar (1). Kafa tabanı kırığı ve BOS kaçağı gibi durumlarda oluşan menenjitlerde en sık görülen etken pnömokoklardır (11). Bakterinin kapsüler yapılarına göre 90’dan fazla serotip tanımlanmış olmakla birlikte, bakteremik pnömonilerin, bakteremilerin ve akut menenjitlerin %82’sinden 18 serotip sorumludur (1).
5
Neisseria meningitidis Menenjiti:
Neisseria spp. sporsuz, hareketsiz, gram olumsuz diplokoklardır. Nazofarinksin
saprofit florasında herhangi bir patolojiye neden olmadan yer alabilmektedir (2). N.
meningitidis çocuklarda ve genç erişkinlerde, toplum kökenli ABM etiyolojisinde en sık
karşımıza çıkan etkenlerdendir. Ortalama mortalite oranı %3-13’tür (3). Olguların %98’i sporadiktir (12). İnsandan insana damlacık yolu, yakın temas ile bulaşmasından dolayı askeri birlikler, okul, kreş gibi kalabalık ortamlarda salgın yapabilmektedir. Meningokok enfeksiyonları gelişmekte olan ülkelerde önemli bir sorundur. Özellikle Sahra altı Afrika meningokok menenjiti kuşağı olarak bilinmektedir (10). Kapsüler polisakkarit, fimbria, pili, lipopolisakkarit tabaka, IgA proteaz, Omp virülansta rol oynayan önemli yapılardır. N. meningitidis, kapsüler polisakkarit yapılarının farklılığına göre serogruplara, Omp yapılarına göre serotiplere ayrılmaktadır. Bugüne dek 13 serogrup ve 20 serotip tanımlanmıştır. Kompleman veya properdin yetmezliği olan hastalarda ölüm oranı ve meningokok menenjitinin tekrarlama riski daha yüksektir (1).
Haemophilus influenzae Menenjiti:
Haemophilus spp. gram olumsuz, küçük, hareketsiz kokobasillerdir (2). Daha
önceleri ABD’de tüm menenjit olgularının %45-48’ini H. influenzae oluştururken, günümüzde olguların sadece %7’sinde izole edilmektedir (3,13). Olguların %3-6’sı ölümcül seyretmektedir (1). H. influenzae için kapsül önemli bir virülans faktörüdür ve kapsül antijenlerine göre 6 serotip tanımlanmıştır. Menenjite neden olan suş tip B’dir. Bu suşun %75’i beta laktamaz üretir ve bu durum ampirik tedavinin belirlenmesi açısından önem taşımaktadır (2). Sinüzit, pnömoni, epiglottit, diyabet, alkolizm, splenektomi, bağışık yetmezlik veya BOS kaçağı gibi durumlar H. influenzae menenjiti açısından risk faktörleridir (14,15). ABD ve Kuzey Avrupa’da H. influenzae tip B
6
suşuna karşı geliştiren konjuge aşıların rutin aşılama programına alınmasından sonra H.
influenzae tip B’nin etken olduğu invaziv enfeksiyonların sıklığında %90’dan fazla
azalma sağlanmıştır. Ancak gelişmekte olan ülkelerde aşının maliyetinden dolayı, belirgin bir azalma kaydedlememiştir (1).
Listeria monocytogenes Menenjiti:
L. monocytogenes gram olumlu, sporsuz bir basildir. Buzdolabında +4°C’de
üreyebilir. 37°C’de hareketsiz olan bu bakteri, 30°C’nin altındaki sıcaklıklarda hareketlidir (2). Amerika’daki menenjit olgularının %8’ini L. monocytogenes oluşturur ve bu olguların %15-29’u ölümcül seyreder (13,16). Onüç serotip tanımlanmıştır; ancak menenjit olgularının %80’inden fazlasında 1b,2b ve 4b serotipleri sorumludur. L.
monocytogenes enfeksiyonları 1 ay altındaki bebekler, 60 yaş üstü erişkinler, alkolikler,
bağışık yetmezlikli hastalarda daha yaygın olarak görülür (2,17-19). Gebeler etkeni genital sistem ve rektumda asemptomatik olarak taşıyabilir ve etken doğum kanalından geçiş sırasında bebeğe bulaşabilir (1).
Streptococcus agalactiae Menenjiti:
Yenidoğan menenjitlerinin yaklaşık yarısının etkeni grup B streptokoklardır ve fatalite hızı %7-27’dir (1,20). Asemptomatik gebelerin, vajinal ve rektal kültür örneklerinde %15-35 oranında kolonizasyon saptanabilir ve bu taşıyıcılık durumu kronik veya aralıklı olabilmektedir. Bakterinin inokülüm oranlarına ve kolonize olan alanların sayısına göre bebeğe geçişi de artmaktadır. Yenidoğan menenjitlerinin çoğu yaşamın ilk haftasından sonra alt tip 3’e bağlı gelişmektedir (21). Erişkin yaş grubunda, 60 yaş üzerinde olmak, diyabet, gebelik veya postpartum dönem, kardiyak hastalık, kollajen hastalıklar, malignite, alkolizm, karaciğer-böbrek yetmezliği, kortikosteroit kullanımı B grubu streptokok menenjitlerine yatkınlığı artıran durumlardır (1).
7 2.1.2.Patogenez
Bakteriyel menenjitlerin en sık etkenleri olan S. pneumoniae, N. meningitidis ve
H. influenzae sağlıklı çocuk ve erişkinlerin nazofarenksinde sıklıkla herhangi bir
yakınmaya neden olmadan uzun süre kolonize olabilirler (2). Mikroorganizmanın virülans faktörleri ile konağın savunma mekanizmaları arasındaki olumsuz etkileşim sonucunda patolojik olaylar başlar (22). Akut bakteriyel menenjit gelişimi dört evrede incelenebilir; 1- Bakteriyel kolonizasyon ve mukozal invazyon, 2- Damar içinde hayatta kalma, 3- Subaraknoit alan ve ventriküler boşlukta bakterinin çoğalması ve yangının indüklenmesi, 4- Yangının ilerlemesi ile patolojik sonuçların oluşması ve MSS hasarı (2).
Bakteriyel Kolonizasyon ve Mukozaya İnvazyon
Menengiyal patojenlerin çoğu mukozada kolonizasyonu sağlayacak yüzey yapılarına sahiptir. Örneğin N. meningitidis ve H. influenzae’nın fimbriyaları mukozal kolonizasyon ve adezyonda, S. pneumoniae’da fosfokolin, nöraminidaz A ve IgA1 proteaz kolonizasyonda rol alır (1). S. pneumoniae, N. meningitidis ve H. influenzae kapsül yapıları ile salgısal IgA’nın etkisinden korunurken, IgA proteaz salgılayarak IgA’nın parçalanmasına neden olurlar (2).
Damar İçinde Hayatta Kalma
Bakterinin damar içinde hayatta kalabilmesi için, kolonizasyon ve invazyon sonrası subaraknoit boşluğa ulaşana kadar, vücut savunma mekanizmalarından korunması gerekmektedir. Kapsül, bakteriyi dolaşımdaki antikor, kompleman ve nötrofil fagositozuna karşı koruyan temel savunma mekanizmasıdır (1). Kapsüllü bakteriler klasik kompleman aracılı bakterisidal aktiviteye karşı dirençlidir. Etkene yönelik özgül antikapsüler antikorların olmadığı durumlarda, alternatif kompleman
8
sistemi konakçı savunmasını üstlenir. Etkenin kapsüler polisakkarit antijenleri, alternatif kompleman yolunu aktifleştirerek, komplemanların bakteri yüzeyine tutunmasını sağlar ve opsonizasyonu kolaylaştırır. Bunun sonucunda fagositoz gerçekleşir ve bakteriler damar içi ortamdan uzaklaştırılmış olur. Splenektomi, orak hücreli anemi gibi durumlarda alternatif kompleman sistemi uygun yanıt veremez ve kapsüllü bakterilere bağlı gelişen menenjitlere yatkınlık artar (23).
Subaraknoit Alan ve Ventriküler Boşlukta Bakterinin Çoğalması ve Yangının İndüklenmesi
Bakterilerin santral sinir sistemine geçiş basamakları tam olarak aydınlatılamamıştır. Uzamış bakteremi sonucunda, bakterilerin koroid pleksus epitelinden doğrudan BOS’a ya da MSS vasküler endotelinden beyin parankimine geçebildiği düşünülmektedir (23).
BOS’ta nötrofil, plazma hücresi, kompleman komponentleri ve immünglobulin gibi savunma mekanizmalarının koruyucu düzeyde olmamasından dolayı, mikroorganizmaların çoğalması için elverişli bir ortam mevcuttur (23). Bakteriler, tümör nekroz faktörü (TNF), interlökin (IL)-1, IL-6, IL-8, IL-10, IL-12, IL-16 gibi yerel kemokinlerin salınımını artırarak, lökositlerin damar endotel hücrelerini geçerek, dolaşımdan BOS’a geçişinde önemli rol oynamaktadırlar. Bunun sonucunda BOS’ta nötrofilik pleositoz gerçekleşir. Nötrofil göçü enfeksiyonu sınırlamaya yönelik savunma mekanizmalarından biri olsa da, subaraknoit alandaki yangısal yanıtın artışı, bakteriyel menenjitteki birçok patolojik olaydan sorumludur (2).
9
Yangının İlerlemesi ile Patolojik Sonuçların Oluşması ve Merkezi Sinir Sistemi Hasarı
Endoteliyal aktivasyon ve vasküler yangının etkisiyle, subaraknoit alandaki kan damarlarında vaskülit, beyin damarlarında daralma, tromboz, kanama sonucunda beyinde iskemi ve nekroz gelişebilir. Kafa içi basıncın artması, serebral kan akımının değişmesi, hipoksi, bakteriyel komponentlerin ve konağın yangısal yanıtı sonucunda kalıcı nörolojik hasar gelişebilir (2,23). Menenjitin patogenezi şekil 1’de özetlenmiştir.
10 Şekil 1: Menenjitin patogenezi (1)
Lokal invazyon Nazofarenkse kolonizasyon
Bakteremi
Meningiyal invazyon
Subaraknoit aralıkta bakterinin çoğalması
Bakteri komponentlerinin salınımı
Makrofajlar, nötrofiller ve MSS hücreleri Serebral mikrovasküler endotele etkisi
Sitokinler
Serebral vaskülit Subaraknoit boşlukta
enflamasyon
BOS akışına karşı direnç artışı
Hidrosefali KBB geçirgenliğinde artış İntersitisyel ödem Vazojenik ödem Kafa içi basınç artışı Sitotoksik ödem Serebral enfarkt
Serebral kan akımında azalma ve serebral regülasyonun kaybı
11 2.1.3.Klinik Bulgular
Bakteriyel menenjitin erken döneminde ateş yüksekliği, iştahsızlık, halsizlik ve üst solunum yolu enfeksiyonuna ilişkin yakınmalar gibi özgül olmayan semptomlar mevcuttur. Bu dönem çoğu olguda kısa süreli olup hızla yerini lokal belirti ve bulgulara bırakır. Lokal belirti ve bulgular meninks iritasyonuna bağlı olarak ortaya çıkan baş ağrısı, ense sertliği, bulantı, kusma, Kernig ve Brudzinsky olumluluğu ile serebral disfonksiyon belirtileri olan konfüzyon, deliryum, letarji ve komayı içerir (1,24,25). ABM’de en sık karşılaşılan belirti ve bulgular ateş yüksekliği, baş ağrısı, meninks iritasyon bulguları ve serebral disfonksiyon belirtileridir (1). Bu bulgular olguların yaklaşık 2/3’ünde birlikte bulunurken, olguların hemen hemen hepsinde bu bulgulardan en az bir tanesi mevcuttur (26). Ancak bir yaşın altındaki çocuklar, özellikle yenidoğanlar, yaşlı hastalar, bağışık yetmezlikli hastaların bulunduğu özel hasta gruplarında ABM’nin klasik belirti ve bulguları görülmeyebilir (24). ABM’de görülen belirti ve bulguların sıklığı tablo 1’de özetlenmiştir.
Tablo 1: ABM'de görülen belirti ve bulguların sıklığı (1)
Semptom veya bulgu Görülme sıklığı(%)
Baş ağrısı ≥85 Ateş ≥80 Meningismus bulguları ≥80 Bilinç değişikliği ≥75 Kusma ~35 Nöbet ~30
Fokal nörolojik bulgular 10-35
12
Ek olarak olguların %10-30’unda kraniyal sinir felçleri, özellikle III, IV, VI ve VII. sinirler veya ekstremitelerde parezi, nöbet gibi fokal serebral bulgular ortaya çıkabilir (2,25). Bakteriyel menenjitli hastalarda etkenle ilişkili bazı belirti ve bulgular da görülebilir. Meningokok menenjiti olgularında erken dönemde eritemli ve makül şeklinde başlayan döküntü daha sonra peteşiyal ve purpirik forma dönüşür. Benzer döküntüler S. pneumoniae ve H. influenzae tip b’nin etken olduğu ağır sepsis olgularında da görülebilmektedir (1,27, 28).
2.1.4.Tanı Yöntemleri
Akut bakteriyel menenjitlerin tanısı klinik bulgulara ve BOS incelemesine dayanmaktadır. Klinik belirti ve bulgular menenjiti düşündürüyorsa acil olarak LP yapılmalıdır (5). LP kararı vermeden önce hastada kafa içi basınç artışı bulguları ve kitle lezyonu olup olmadığının veya LP’nin kontrendike olduğu diğer durumların dışlanması gerekmektedir (2). HIV enfeksiyonu varlığında, bağışık yetmezliği olan hasta gruplarında, kafa içi kitle veya inme gibi MSS hastalığı öyküsü olanlarda, yeni gelişen fokal nörolojik defisit, nöbet geçirme ve papil ödemi bulguları olanlarda LP sonrası olası herniasyon gelişme riski açısından kraniyal bilgisayarlı tomografi (BT) çekilmesi önerilmektedir. Menenjit düşünülen hastada trombositopeni (<50.000/mm3
), LP yapılacak bölgede cilt enfeksiyonu veya kafa içi kitle nedeniyle LP yapılamıyorsa, kan kültürleri alındıktan sonra hemen tedaviye başlanmalıdır. Bu gibi durumlar yoksa LP yapılmalı ve işlemden sonra tedaviye başlanmalıdır (5).
BOS incelemesinde ilk basamak açılış basıncının ölçülmesidir. Normalde 180 mm H2O olan BOS basıncı ABM olgularında 200-500 mm H2O arasındadır. Normalde berrak görünümde olan BOS’ta beyaz küre sayısının 200 hücre/mm3
, eritrosit sayısının 400 hücre/mm3, bakteri sayısının 105cfu/ml, BOS protein miktarının 150 mg/dl ve
13
üzerinde olduğu durumlarda BOS’un görünümü bulanıklaşır. Normal koşullarda BOS’ta beyaz küre sayısı 0-10 hücre/mm3 arasındadır. Tedavi edilmemiş ABM’de BOS’ta beyaz küre sayısı genellikle 1000-5000 hücre/mm3
arasındadır ve hücrelerin çoğunu polimorfonükleer lökositler oluşturur (2).
Normal koşullarda BOS’taki glukoz miktarı 50-80mg/dL arasındadır ve bu değer, eş zamanlı serum glukoz değerinin %60-70’idir. Akut bakteriyel menenjitte BOS glukozunun serum glukozuna oranı 0,31’in altındadır. BOS proteininin normal değeri 15-45mg/dL arasındadır (1). ABM’de BOS protein miktarı genellikle artmış olup 100-500mg/dL arasındadır. Bununla beraber, yenidoğan menenjtinde ve ağır bağışık yetmezlikli hastalarda, BOS protein miktarı ve BOS beyaz küre sayısında artış olmayabilir (2).
Gram boyama ABM tanısında hızlı, etkili, ucuz bir yöntem olup, hastaların %60-90’ında mikroorganizmanın tanımlanmasında duyarlılığı %100’e yakındır (1,29). Örnekteki bakteri yoğunluğuna göre Gram boyamada etkenin saptanma oranı değişir; bakteri sayısı 103cfu/ml ve altında olduğunda pozitiflik oranı %25 iken, bakteri sayısı >105cfu/mlolduğunda bu oran %100’e yakındır (30). ABM’de Gram boyamada etkenin saptanma oranları etkene göre de değişir; S. pneumoniae %90, H. influenzae %86, N.
meningitidis %75, gram olumsuz basiller %50 ve L. monocytogenes %30 oranında
saptanabilir. Gram boyama antibiyotik kullanımından hızla etkilenir ve yöntemin duyarlılığı %20’ye kadar düşebilir (5). Ayrıca, uygun tedavi sonrası 24 saat içinde Gram boyama negatifleşir (2).
Beyin omurilik sıvısı kültüründe etkenin üretilmesi ABM tanısında altın standarttır; kültür hemen, hatta mümkünse hasta başında yapılmalıdır. Örnekler %5’lik koyun kanlı agara, zenginleştirilmiş çikolatalı agara, Eozin-Metilen-Blue agara, sıvı
14
besiyerine ve kan kültürü şişesine ekilmelidir (2). Daha önce antibiyotik almamış hastaların %70-85’inin BOS kültüründe üreme saptanır ve kültür sonucu için 48 saat beklenmesi gerekir (5). Bakteremik seyreden olgularda etken kan kültürlerinden de izole edilebildiği için eş zamanlı kan kültürü de alınmalıdır. İzole edilen mikroorganizmaların antibiyotik duyarlılıkları araştırılmalıdır (2).
Bakteriyel antikorları kullanarak, BOS’taki bakteriyel hücre duvarı komponentlerini ve kapsül polisakkaritlerini saptayan çok sayıda hızlı tanı testi mevcuttur; ancak henüz hiçbiri rutin kullanıma girmemiştir. Sonuçlarının negatif olması menenjit tanısını dışlamaz (5).
Daha önce tedavi almamış olgularda BOS’ta laktat düzeyi, bakteriyel ve bakteriyel olmayan menenjitlerin ayırıcı tanısında yararlıdır. Ancak serebral iskemi, vasküler yetmezlik, anaerobik glikolizis ve BOS’taki lökositlerin metabolizması sonucunda laktat değerinde artış saptanabilir. Bu parametreninin, ABM tanısında rutin olarak kullanımı önerilmemektedir (5).
Akut bakteriyel menenjit tanısında kültür sonuçlarının geç alınması ve Gram boyama sonuçlarının yeterli duyarlılıkta olmaması gibi nedenlerle tanıda PZR’nin yeri ve kullanımı konusunda çok sayıda çalışma yapılmaktadır (2). Geniş tabanlı PZR’nin duyarlılığı %100, özgüllüğü %98,2, pozitif prediktif değeri 98,2, negatif prediktif değeri %100 olarak saptanmıştır (31). Bu nedenle ABM’nin erken tanısında, kültürde ve Gram boyamada etkenin saptanamadığı olgularda etiyolojik ajanın saptanmasında, bakteriyel menenjitin dışlanması, başlanmış olan antibiyotik tedavisinin kesilmesi ve antibiyotik profilaksisinin gerekliliği konusunda yararlı olacağı düşünülmektedir (5,31).
15 2.1.5.Tedavi
Beyin omurilik sıvısında mikrobiyal patojenlere karşı savunma mekanizmalarının yok denecek kadar az olmasından dolayı bakteri BOS’a ulaştıktan sonra burada hızlıca çoğalır. Bu nedenle erken tanı koyabilmek ve olası etkene yönelik tedaviye erken başlamak hayati öneme sahiptir (2). Tedavide, antibakterisidal etkili, BOS’a geçişi iyi olan ve olası etkenleri kapsayan antimikrobiyal ilaçlar kullanılmalıdır (1).
Antimikrobiyal ilaçların BOS’a geçişini etkileyen parametreler, düşük molekül ağırlığı, lipitte çözünürlük, proteine az bağlanma, fizyolojik pH’da düşük iyonizasyon ve kan beyin bariyerinin durumudur. Antibakteriyellerin etkinliğinin iyi olabilmesi için, ilacın BOS konsantrasyonunun, minimal bakterisidal konsantrasyonun 10-20 kat üstünde olması gereklidir. Ek olarak, kullanılacak antibakteriyelin pürülan BOS’ta bakterisidal aktivitesinin olması ve BOS’ta stabil kalabilmesi önemlidir. BOS’ta laktat birikimi ile pH azalır. Protein konsantrasyonunun artması, serbest ve etkin antimikrobiyal oranının azalmasına neden olabilmektedir. Tedavi ile meningeal enflamasyon azalır ve bunun sonucunda da antimikrobiyallerin BOS’a geçişi azalır (2).
Akut bakteriyel menenjit düşünülen olguda hedefe yönelik tedavi Gram boyalı preparatların değerlendirilmesi sonucunda planlanabilir (5). Gram boyama sonucunda etkenin saptanamadığı veya lomber ponksiyonun yapılamadığı durumlarda ampirik tedavi yaşa ve altta yatan hastalıklara göre planlanmalıdır (1). Hedefe yönelik veya ampirik olarak başlanan tedavide olası etkenlerin bölgesel direnç profilleri dikkate alınmalıdır. Amerikan Enfeksiyon Hastalıkları Derneği’nin (IDSA) 2004 menenjit tanı ve tedavi rehberinde 3. kuşak sefalosporinlere (seftriakson, sefotaksim) direnç nedeniyle vankomisin eklenmesi önerilmektedir. Ülkemizde 3. kuşak sefalosporinlere direnç
16
%0,3-2 oranında görülmektedir ve 3. kuşak sefalosporinler sıklıkla tedavide tek başına kullanılmaktadır (5,32-34). Yaşa ve altta yatan hastalıklara göre ampirik antibiyotik önerileri Tablo 2’de verilmiştir. Kültür antibiyogram sonuçlarına göre hedefe yönelik veya ampirik olarak başlanan tedavi tekrar değerlendirilir ve tedavi etkene ve duyarlılık durumuna göre yeniden düzenlenir (5).
Tablo 2: Akut pürülan menenjitli olgularda ampirik antibiyotik tedavisi (5)
Predispozan faktör Antibiyotik tedavisi
Yaş <1 ay
1-23 ay 2-50 yaş
>50 yaş
Ampisilin + sefotaksim veya ampisilin + aminoglikozit
Vankomisin + 3. kuşak sefalosporin*₸ Vankomisin + 3. kuşak sefalosporin*₸↑
Vankomisin + 3. kuşak sefalosporin* + ampisilin
Bağışık yetmezlik durumu Vankomisin + ampisilin + sefepim veya meropenem
Kafa tabanı kırığı Vankomisin + 3. kuşak sefalosporin*
Kafa travması; kraniyal operasyon sonrası Vankomisin + seftazidim veya sefepim veya meropenem
*Sefotaksim veya seftriakson
₸Bazı uzmanlar deksametazon verilen hastalara rifampisin eklenmesini önermektedir.
17 2.2.Viral Menenjitler
Viral menenjitlerin en sık etkeni enterovirüslerdir. Diğer sık karşılaşılan etkenler herpes virüs ailesi, kabakulak virüsü ve flavivirüslerdir, bunların dışında başka virüsler de menenjit etkeni olarak karşımıza çıkabilir. Genelde iyi huylu ve kendini sınırlayan enfeksiyonlara neden olsalar da herpes simplex virüsü (HSV) ve flavivirüsler ciddi mortalite ve morbidite nedeni olabilirler (8).
2.2.1.Epidemiyoloji ve Etiyoloji
Ayrıntılı inceleme yapılmadığı takdirde, aseptik menenjitli olguların sadece %10’unda etken belirlenebilir. Öte yandan, ayrıntılı epidemiyolojik ve mikrobiyolojik araştırmalar uygulandığında, etken % 70’e ulaşan oranlarda gösterilebilmektedir (2).
Etkenler
Enterovirüs Menenjiti:
Enterovirüsler picornavirüs ailesindendir; zarfsız kapsit yapısına sahip, ribonükleik asit (RNA) virüsleridir (35). Isıya, deterjanlara, asidik ortama dayanıklıdırlar (36). Tanımlanmış aseptik menenjit sendromlarının %85-95 etkeni enterovirüslerdir. Centers for Disease Control and Prevention (CDC) verilerine göre ABD’de yılda 30,000-75000 semptomatik enterovirüs menenjiti görülmektedir (1,37).
Tüm dünyada yaygın olarak görülen entovirüs menenjitleri, en sık yaz ve sonbahar mevsimlerinde karşımıza çıkar (1). ABD’de olguların %80’ninden 14 enterovirüs serotipi sorumludur. 1997-1999 yılları arasında CDC’nin ulusal enterovirüs sürveyans sisteminde en sık karşılaşılan serotipler, ekovirüs 30, 11, 9, 6, 7, koksaki virüs B2 ve A9, ekovirüs 18 ve 16, koksaki virüs B1 ve B3, enterovirüs 71, koksaki virüs B4 ve ekovirüs 25’tir (37,38).
18 Kabakulak Menenjiti:
Aşılanmamış topluluklarda, kabakulak virüsü, aseptik menenjitlerin ve ensefalitlerin en yaygın etkenlerinden biridir; semptomatik menenjit, kabakulak olgularının %10-30’unda görülür (39). Bununla birlikte ABD’deki son kabakulak salgınında 2597 kabakulak olgusunun sadece 11’inde menenjit saptanmıştır (40). Kabakulak menenjiti olgularının %40-50’sinde tükrük bezlerinde büyümeye ait bulgu saptanamaz. Genellikle iyi huylu ve kendi kendini sınırlayan enfeksiyonlara neden olur. En sık 5-9 yaş arasındaki çocuklarda görülür. Erkeklerde kızlara oranla 2-5 kat daha fazla görülür (39,41).
Herpesvirüs Ailesi Menenjitleri:
Herpesvirüs ailesi; herpes simpleks virüsü (HSV) 1-2, varisella zoster virüsü (VZV), sitomegalovirüs (CMV), Ebstein Barr virüsü (EBV), human herpes virüsü (HHV) 6-7 ve 8’i içermektedir. Bu virüslerle oluşan enfeksiyonlarda, özellikle HSV menenjitlerinde, nörolojik komplikasyonların meydana geldiği bilinmektedir. Tüm aseptik menenjitli olgularının %0,5-3’ünün etkeni herpes virüsleridir (42). HSV’nin etken olduğu aseptik menenjitler, genellikle HSV 2’ye bağlı olarak gelişen primer genital enfeksiyonla ilişkili olup, primer enfeksiyonu olan kadınların %36’sında, erkeklerin ise %13’ünde eş zamanlı olarak görülebilir. HSV ensefaliti olguları tedavisiz kaldığında genellikle ölümle sonuçlanır ancak HSV’nin etken olduğu aseptik menenjitler kendiliğinden iyileşen bir hastalık olarak görülür (1)
VZV’de nörolojik tutulum iyi seyirli bir menenjitten çok ensefalit biçimindedir. EBV ve CMV özellikle bağışık yetmezliği olan olgularda, mononükleoz sendromunun yanısıra aseptik menenjite yol açabilir (2). HHV6 enfeksiyonunda, altıncı hastalık (roseola infantum) bulguları olsun veya olmasın menenjit gelişebilir; ancak HHV6,
19
MSS’ye yerleşerek devamlılık gösterebilir ve asemptomatik olguların BOS’unda izole edilebilir (1,43).
Diğer Virüs Menenjitleri:
Birçok virüs aseptik menenjit etkeni olarak karşımıza çıkabilmektedir. ABD’de flavirüs ailesinden St. Louis ensefalit virüsü, artropot kaynaklı aseptik menenjitin en sık etkenidir. Semptomatik olguların %15’inde aseptik menenjit görülür (41). Bunun dışında arbovirüs ailesinden California ensefaliti virüs grubu, Colorado kene ateşi virüsü olan coltivirüs ve klinikte daha sık ensefalitle karşımıza çıkan Batı Nil virüsü de aseptik menenjit etkeni olarak saptanabilir (8).
2.2.2.Patogenez ve Patofizyoloji
Enfeksiyonun Başlangıcı
Virüsler mukozalarda kolonize olabilir. Buna karşın konakta enfeksiyon gelişimini önleyen bir çok savunma mekanizması bulunmaktadır. Örnek olarak solunum sisteminde; epiteli kaplayan mukus tabakası ve mukosiliyer aktivite mevcuttur. Eğer virüs bu aşamaları geçebilirse alveoler makrofajlar tarafından etkisiz hale getirilir. Sindirim sisteminde; mide asiditesi çoğu virüsü etkisiz hale getirir, sonrasında safra ve diğer sindirim enzimleri ile virüs zarfları, kapsit proteinleri ve lipoprotein membranları parçalanır. Ancak enterovirüs, adenovirüs, reovirüs, parvovirüs gibi zarfsız aside dirençli virüsler sindirim sisteminde çoğalabilme yeteneğine sahiptir (44).
Konak daha önce etkenle karşılaşmış ise salgısal IgA yardımı ile virüsü etkisiz hale getirebilir. Konak savunma mekanizmalarından kurtulan virüsler çoğalıp yayılabilir (44).
20
Viremi ve Merkezi Sinir Sistemine İnvazyon
Virüsün kan yoluyla yayılması sonucunda MSS enfeksiyonu gelişebilir. Çoğu nörotropik virüs öncelikle sinir sistemi dışındaki dokularda çoğalır, sonrasında viremi ile kan beyin bariyerini (KBB) geçip çeşitli yollarla MSS’ye ulaşabilir. Örnek olarak bazı virüsler KBB’nin temel yapıları olan kılcal damar endotelini enfekte ederken, bazıları doğrudan gliyal hücreleri enfekte eder, bazıları ise enfekte lökositler aracılığıyla MSS’ye ulaşabilirler (44,45).
Virüsün Merkezi Sinir Sistemi İçinde Yayılması
MSS’ye giriş yöntemi ne olursa olsun, hastalığın gelişimi, virüsün duyarlı hücrelere tutunması ve girmesini, sinir sistemi içinde yayılımını ve hücresel değişiklikleri gerektirir. Örnek olarak koroid pleksus üzerinden subaraknoit aralığa giriş yapan virüsler, BOS içinde dağılarak meningiyal ve ependimal hücrelere ulaşır, sonrasında ise gliyal hücreler ve nöronların enfeksiyonu şeklinde devam eder. Diğer virüsler ise hücreler arası boşlukları kullanarak veya aksonal ve dentritik hücreler boyunca hareket ederek veya hareketli lökositler aracılığıyla MSS’ye yayılım gösterebilirler (44). MSS enfeksiyonu oluştuğunda, başlangıçtaki yangısal yanıtın immünolojik olarak özgül olduğu ve virüse karşı duyarlı hale gelmiş bir lenfosit topluluğu tarafından oluşturulmuş olduğu düşünülmektedir. Buna rağmen bazı viral MSS enfeksiyonlarında enflamatuar yanıt yetersiz olabilir. Bu durumun virüsün özelliğinden çok konağın yaşından kaynaklandığı düşünülmektedir (44,45). Enflamasyon durumunda KBB’deki geçirgenliğin artmasından dolayı B lenfositler BOS’a geçer ve burada plazma hücrelerine farklılaşır; bu dönemden sonra BOS içinde özgül antikorlar giderek artar. Örnek olarak, kabakulak menenjitli olguların BOS’unda özgül IgG düzeyleri yaklaşık 1 yıl süreyle yüksek kalabilir.
21 2.2.3.Klinik Bulgular
Enterovirüs menenjitlerinde klinik bulgular olguların yaşına ve bağışıklık durumuna göre değişmektedir. Yenidoğanlarda (özellikle ≤ 2hafta) sıklıkla ateş yüksekliği, kusma, beslenememe, döküntü ve üst solunum yolu bulguları görülür. Nörolojik bulgu olarak ense sertliği, ön fontanelde şişkinlik görülebilir ancak bu bulgular 1 yaş altındaki çocuklarda daha nadirdir (38,41). Mental durumda değişiklik olabilir ancak fokal nörolojik bulgular sık değildir. İki hafta ve altındaki yenidoğanlarda meningoensefalit şeklinde yaygın tutulum ve %10-70 oranında ölüm görülebilirken, 2 haftadan büyük çocuklarda ve erişkinlerde yaygın hastalık riski çok nadir olup hastalığın prognozu genellikle iyi seyirlidir. Ateş yüksekliği iki haftadan büyük yenidoğanların %76-100’ünde görülür ve bu olguların yarısından çoğunda ense sertliği de mevcuttur. Bu durum yürüme çağındaki bebekler ve daha büyük yaş gruplarında daha az sıklıkla karşımıza çıkmaktadır. Kusma, beslenememe, döküntü, ishal, öksürük, üst solunum yolu enfeksiyonu bulguları ve miyalji gibi özgül olmayan bulgular görülebilir. Ek olarak, enfeksiyondan sorumlu olan entorovirüs türüne göre döküntü, miyoperikardit, konjonktivit, herpanjina ve el ayak ağız hastalığı görülebilir (41,46). Örnek olarak vücutta dağınık makülopapüler döküntüler ekovirüs 9 menenjitini, orofarenks arka bölümünde ağrılı veziküller (herpanjina) koksaki virüsü A enfeksiyonunu, plörezi ve perikardit olması ise koksaki virüsü B enfeksiyonunu düşündürmelidir (1).
Kabakulak menenjitinde en sık görülen klinik bulgular ateş, kusma ve baş ağrısıdır (39). Ateş genellikle yüksektir ve 72-96 saat sonra düşer. Tükrük bezi büyümesi olguların yaklaşık %50’sinde görülür. Kabakulak menenjitinde, MSS bulguları genellikle parotit bulgularının ardından ortaya çıkar. Ense sertliği, uykuya meyil ve karın ağrısı olabilir. Ateşin düşmesi genellikle klinik düzelme ile birliktedir ve
22
komplike olmayan olgularda hastalığın süresi 7-10 gündür. Kabakulak virüsü ile oluşan enfeksiyonlarda nadiren de olsa ensefalit, nöbet, polinörit, kraniyal sinir felci, miyelit, Guillain Barre sendromu ve ölüm gelişebilir (39).
Herpesvirüs menenjiti sıklıkla HSV-2 ile ilişkili olup, primer genital enfeksiyon sırasında ya da hemen sonrasında görülür ve genellikle ense sertliği, baş ağrısı ve ateşle karakterizedir (47). Menenjitli hastalarda farenjit, lenfadenopati ve splenomegali varlığında EBV, yaygın papüloveziküler döküntü varlığında VZV enfeksiyonu düşünülmelidir (2).
2.2.4.Tanı Yöntemleri
Beyin Omurilik Sıvısının Değerlendirilmesi
Entorovirüs menenjitli olguların çoğunda BOS’ta pleositoz mevcuttur; ancak klinik olarak menenjit bulguları olan ve BOS’ta enterovirüs izole edilen bazı olgularda lökosit görülmeyebilir (41,46). Hücre sayısı genellikle mm3’te 100-1000 arasındadır; ancak bazen >1000lökosit olabilir. BOS’ta yüksek sayıda lökosit saptanması, daha çok etken olarak enterovirüslerin izole edildiği menenjitlerle ilişkilidir (1). Enfeksiyonun erken döneminde BOS’ta nötrofil hakimiyeti görülürken, 6-48 saat sonra bu durum lenfosit hakimiyetine dönüşür. Bu nedenle nötrofil hakimiyeti bakteriyel ve viral menenjit ayırımında tek başına kullanılmamalıdır (48). BOS’ta genellikle hafif protein artışı ve glukozda azalma görülebilir ancak uç değerler de rapor edilmiştir (1). Enterovirüs menenjitlerinin özgül tanısı virüsün hücre kültüründe izole edilmesi ile konur (49). Buna rağmen doku kültürünün duyarlılığı enterovirüs serotipleri için %65-75 arasındadır ve bu ortamda üremesi için ortalama geçen süre 3,7-8,2 gün arasındadır (41,50). Entorovirüs enfeksiyonlarının hızlı tanısında, değişken serotiplere karşı ortak antikorun olmaması ve BOS’ta viral partiküllerin düşük konsantrasyonlarda
23
bulunmasından dolayı serolojik tetkikler kullanılamamaktadır (41,46). Enterovirüs menenjitlerinin tanısında hücre kültürü altın standart olmasına karşın; sürecin yavaş ve pahalı ve duyarlılığının da düşük olması nedeniyle, son yıllarda tanıda polimeraz zincir reaksiyonu kullanılmaktadır. PZR’nin hızlı, duyarlı ve özgül olması, viral kültür yöntemlerine alternatif olarak kullanılmasına olanak sağlamaktadır (1,8). Enterovirüs menenjiti tanısında revers transkriptaz (RT) PZR’nin duyarlılığı yapılan değişik çalışmalarda %86-100, özgüllüğü ise %92-100 olarak bulunmuştur (1). PZR yönteminin kullanımı ile tanı süresi ve buna bağlı olarak hastanede kalış süresi ve olası bakteriyel enfeksiyona yönelik verilen antibakteriyel ilaçların kullanımı da azalmıştır (51).
Kabakulak menenjitli olguların hemen hemen hepsinde BOS’ta pleositoz (genelllikle <500 hücre/mm3) vardır. Olguların %80-90’nında mononükleer hücre hakimiyeti görülür ve pleositoz haftalarca devam edebilir. Bazı çalışmalarda, olguların yaklaşık yarısında BOS protein miktarının normal düzeylerde olduğu bildirilmiştir. BOS glukoz düzeyi çoğu olguda normal seviyelerde olmasına rağmen, olguların %25’inde normal değerlerin altında saptanabilir. Serum örneğinden yapılan kompleman fiksasyon testi ve hemaglütinasyon inhibisyon testleri, kabakulak tanısında kullanılabilecek en güvenli serolojik testlerdir. Etken, BOS’tan yapılan hücre kültüründe semptomların başlangıcından itibaren 1 hafta içinde üretilebilirse de bu yöntemin duyarlılığı %30-50 arasında değişmektedir (39). Gelecekte, PZR gibi moleküler teknikler yardımıyla, kabakulak menenjitleri daha hızlı ve güvenilir şekilde tanınabilecektir (1).
HSV tip 2 menenjitli hastaların BOS örneklerinde genellikle lenfosit hakimiyeti (<500 hücre/mm3) ve normal glukoz düzeyleri mevcuttur (46). BOS protein düzeyleri, çoğunlukla enteroviral menenjitli olgulardakine göre daha yüksek saptanmaktadır (52).
24
Etken, BOS örneğinden doku kültürü yöntemiyle izole edilebilir. PZR’nin HSV menenjiti tanısında kullanımı umut vericidir (1).
2.2.5.Tedavi
Günümüzde enterovirüslerin tedavisinde onaylanmış bir ilaç bulunmamaktadır. Tedavi destekleyicidir; ancak gelecekte bu durumun değişmesi beklenmektedir. Plekonaril, entorovirüslerin de dahil olduğu pikorna virüslere etkili olan, BOS’a iyi geçen, oral olarak ve tüm yaş gruplarında kullanılabilen antiviral etkili bir ilaç olup, yapılan çalışmalarda tedavi uygulanan hastalarda klinik, virolojik ve radyolojik bulgularda düzelme sağladığı gösterilmiştir (38,53).
HSV tip 2 menenjitlerinde genellikle sekelsiz olarak düzelme sağlanır. Hafif menenjiti olan olgularda antiviral tedavinin etkinliği çok açık değildir. Antiviral tedavi HSV tip 2 kaynaklı tekrarlayan iyi huylu lenfositik menenjit olgularında önerilir ancak etkinlik ve güvenliğin değerlendirildiği yeterli sayıda kontrollü çalışma bulunmamaktadır (1,54).
2.3.Ensefalitler
MSS’nin parankim enfeksiyonu sonucunda oluşan hastalıklar ensefalomiyelitler olarak isimlendirilir. Ensefalit ve menenjit arasında kesin bir sınır çizmek olası değildir. Her menenjite bir miktar ensefalit eşlik eder ve bu durum tersi için de söz konusudur. Adlandırma primer tutulum bölgesine göre yapılır. Bu ayrımın tam olarak yapılamadığı durumlarda ise meningoensefalit şeklinde adlandırılır (55). Etkenin saptandığı olgularda en sık virüsler karşımıza çıksa da, olguların %32-75’inde etken saptanamaz (9).
25 2.3.1.Etiyoloji
Herpesvirüs ailesinden HSV-1, HSV-2, VZV, CMV, EBV, HHV6, HHV7, HHV8 ve Simian herpes virüs B insanda nöroinvaziv hastalık yapabilir (56).
HSV ABD’de sporadik ensefalitlerin en sık etkenidir. ABD genel popülasyonunda görülme sıklığı 1/250000 olup, yılda yaklaşık 1250-2000 olgu görülür. Bağışıklık yetmezliği olmayan hasta grubunda HSV ensefalitlerinin %90’ında etken HSV1, diğerlerinde ise HSV-2’dir. HSV, viral ensefalitlerin en sık nedeni olmasına rağmen, olguların sadece %10’unda etkendir (57,58,59). HSV ensefaliti cinsiyet ve mevsimden etkilenmez, ancak yaş grubu olarak olguların kümelendiği iki tepe noktası vardır; olguların 1/3’ü 20 yaşın altında, yarısı ise 50 yaşın üstündedir (57).
Primer VZV enfeksiyonu genellikle 1-9 yaş arasındaki çocuklarda görülür ve yetişkinlerde seropozitiflik oranı % 95’den fazladır. Primer enfeksiyondan sonra virüs arka kök ganglionlarına yerleşir ve burada latent olarak kalıp konağın bağışıklık durumuna bağlı olarak tekrar aktive olabilir. VZV’nin MSS tutulumu primer enfeksiyon veya virüs reaktivasyonu sonrasında gelişebilir (56).
CMV insanların sık karşılaştığı virüslerden birisidir ve yetişkin yaş grubunda seroprevelansı %90-100 arasındadır. Tükürük ve genital sekresyonlar aracılığı dışında, ayrıca kan ürünlerinin verilmesi ve organ transplantasyonu gibi işlemler yoluyla da bulaştığı gösterilmiştir. CMV, akut enfeksiyonlara ve latent virüsün aktifleşmesi sonucunda gelişen enfeksiyonlara neden olabilir. Primer CMV enfeksiyonu genellikle klinik olarak sessizdir; fakat mononükleoz sendromuna da neden olabilir. CMV enfeksiyonunun nörolojik komplikasyonları olan retinit, ensefalit ve nöropati genellikle bağışık yetmezliği olan olgularda görülür (56).
26
Primer EBV enfeksiyonu asemptomatik olabileceği gibi, servikal lenfadenopati, eksüdatif farenjit ve splenomegali ile seyreden mononükleoz sendromuna da neden olabilir. EBV’ye bağlı olarak önemli bir MSS hastalığı gelişme oranı %1’den daha azdır. Ancak menenjit, ensefalit, transvers miyelit ve Guillain Barre sendromu gibi çok sayıda ciddi enfeksiyona neden olabilir (60).
HHV6 roseola infantum etkenidir ve sık karşılaşılan enfeksiyonlardandır. Primer enfeksiyonda roseola infantum, febril nöbetler ve lenfadenopati ile karşımıza çıkabilir. Sonrasında virüs latent olarak vücutta kalır ve periyodik olarak aktive olabilir. HHV6, bağışıklık yetmezliği olan olgularda gelişen ensefalitlerde gittikçe artan sıklıkta izole edilmektedir (56).
Herpes virüs B, insan herpesvirüs ailesinden değildir, ancak insanları enfekte edebilir. Maymunlarda ömür boyu asemptomatik olarak taşınan virüsler insanlarda ölümcül enfeksiyonlara neden olur. Virüs insanlara maymunların ısırması, tırmalaması veya enfekte vücut sıvılarının mukoza ile teması sonucunda bulaşabilir (61).
Vektör kaynaklı arbovirüsler insanları enfekte etmeden önce sivrisinek ve kene gibi vektörlerde çoğalıp, sonrasında insanları enfekte eder. Bu vektörlerin sık olduğu bölge ve iklimlerde epidemilere yol açarlar. ABD’de ensefalit epidemilerinin en sık etkenleri St. Louis, California ve Batı Nil virüslerinin etken olduğu arboviral ensefalitlerdir (55).
Enterovirüsler de arbovirüsler gibi mevsimsel epidemilerle seyreder ve daha çok yılın sıcak aylarında fekal oral yolla yayılırlar. Viral menenjitlerin büyük çoğunluğundan sorumlu olan enterovirüsler, ensefalomiyelitlerin sadece %2’sinden sorumludur (55). Enteroviral ensefalitler genellikle yenidoğan veya hipogammaglobülinemisi olanlarda görülür (56).
27
Kuduz insanlara genellikle enfekte hayvanların ısırması sonucunda bulaşır. ABD’de kuduz olgularının %93’ü vahşi hayvanların ısırması sonucunda gelişirken, gelişmekte olan ülkelerde olguların çoğu köpek kaynaklıdır (56).
Subakut sklerozan panensefalit (SSPE) etkeni kızamık virüsüdür; ancak bu virüs, normal kızamık virüsünden farklı olarak M proteinini kodlayamaz. Virüs hücre dışına çıkamaz ve bağışıklık sisteminden korunur. SSPE’li olguların yarısından fazlası 2 yaşın altında geçirilmiş kızamık enfeksiyonu öyküsüne sahiptir (55).
2.3.2.Patogenez ve Patofizyoloji
Patogenez ve patofizyoloji viral menenjitlerle benzer olup etkene göre giriş yolu değişmektedir. Örnek olarak enterovirüsler barsak mukozasından girerken, kızamık, kabakulak gibi virüsler solunum mukozasından, arbovirüsler ve kuduz virüsü enfekte hayvanın ısırması ile vücuda girerler. Virüsler nöronların içine girerken özel reseptörlere bağlanırlar. Örnek olarak; kuduz virüsü asetilkolin reseptörüne, HIV ise CD4 reseptörüne bağlanır. Nörona girdikten sonra virüs, hücrenin genetik materyalini ve protein sentez sistemlerini kullanarak çoğalır ve sonunda hücrenin ölümüne neden olarak çevreye yayılır. Bazı virüsler enfekte ettikleri hücrenin DNA’sına entegre olarak yıllarca orada kalabilirler. Etkene göre sinir hücreleri içinde ışık mikroskobu ile görülebilen inklüzyon cisimcikleri saptanabilir (55).
2.3.3.Klinik Bulgular
Akut viral ensefalitlerde başlıca klinik bulgular baş ağrısı, ateş yüksekliği ve bilinç değişikliğidir. Bu duruma sıklıkla fokal nörolojik yetmezlik bulguları da eklenmektedir (9). En sık karşılaşılan fokal nörolojik bulgular, hemiparezi, afazi, ataksi, kraniyal sinir felci, miyoklonus ve nöbettir (62).
28
Etiyolojik etkene göre farklı klinik tablolar karşımıza çıkabilmektedir. Bradikinezi, rijidite, istirahat sırasında tremor gibi parkinsonizm bulguları flavivirüs ensefalitlerini (Batı Nil, St. Louis, Japon ensefaliti virüsleri) düşündürmektedir. Afazi, hafıza kayıpları, kişilik değişikliği gibi temporofrontal lob bulguları limbik ensefaliti akla getirir ve bu durum enfeksiyöz etken olarak HSV ve HHV6’yı, enfeksiyöz olmayan patolojilerden de neoplastik ve otoimmün hastalıkları düşündürmektedir. Nöbet, genellikle bazal gangliyonlar ve talamus gibi derin gri cevher katmanlarının tutulumu ile ilişkili olup, en sık HSV ensefalitlerinde ve daha az sıklıkla flavivirüs enfeksiyonlarında karşımıza çıkabilir. Serebellit, EBV, VZV, kabakulak ve flavivirüs enfeksiyonlarında görülebilir. Flavivirüs, enterovirüs 71 ve polio virüs enfeksiyonları medulla spinalisin ön boynuzunu tutar ve bu olgularda akut flask paralizi de gelişebilir (56,62).
2.3.4.Tanı Yöntemleri
BOS’un Değerlendirilmesi
Beyin omurilik sıvısının değerlendirilmesi ensefalit tanısının temelini oluşturmaktadır ve kontrendikasyonun olmadığı tüm hastalara uygulanmalıdır (9). Tipik BOS bulguları, lenfosit hakimiyetinde pleositoz, normal BOS glukozu ve artmış BOS proteinidir. Lökosit sayısı genellikle 50-500 hücre/mm3 arasındadır. Flavivirüs, özellikle de Batı Nil virüsü enfeksiyonlarında, nötrofil hakimiyeti görülebilir. Nötrofil hakimiyeti Batı Nil virüsü enfeksiyonlarında %37 oranında görülürken, bu oran HSV ensefalitlerinde %5-24 arasındadır (56).
Bazı nöroinvaziv virüslerin tanısında PZR yüksek duyarlılık ve etkinlikte kullanılabilmektedir (63). HSV için duyarlılık %98, özgüllük %94 olarak bulunmuştur (57,64). Antiviral tedavi başlanan ve geç dönemde örnekleme yapılan olgularda
29
PZR’nin duyarlılığı azalmaktadır (64). PZR’nin VZV DNA’yı saptamadaki özgüllüğü %95’ten fazla iken, duyarlılığı %30 civarındadır (65). EBV’nin PZR ile değerlendirilmesi fayda sağlayabilirse de, elde edilen pozitif sonuçlar klinik, serolojik ve görüntüleme yöntemleri ile birlikte değerlendirilmelidir. Çünkü etken latent olarak mononükleer hücrelerde de bulunabilir ve bu durum yanlış pozitifliklere neden olabilir. Aynı durum HIV ve HHV6 ensefalitleri için de geçerlidir (56).
Kraniyal Görüntüleme
Kontrendikasyon yoksa ensefalit şüphesi olan tüm hastalara kraniyal manyetik rezonans görüntüleme (MRG) uygulanmalıdır. Kraniyal görüntülemedeki farklı anormalliklerin hangi spesifik ensefalit formuna ait olduğu henüz tam olarak tanımlanamamıştır. Ancak bazı farklı ensefalit formlarında MRG bulguları olası etkenler hakkında ipucu sağlayabilir. Temporal ve limbik lob anormallikleri HSV ve HHV6 ensefalitlerinde, subepandimal tutulum ise CMV ventrikülitinde görülür. VZV vaskülopatilerinde MRG’de birçok alanda hemorajik enfarktlar ve demiyelizan lezyonlar saptanır (66). PZR ile HSV pozitifliği saptanan ensefalit olgularının %90’ında MRG’de temporal lob patolojisi, %36’sında ek olarak frontal lob patolojisi vardır. Olguların yarısından fazlasında bulgular tek taraflıdır. Olguların sadece %9’unda frontotemporal bölge dışında patoloji saptanır (67).
Batı Nil virüsü ensefalitlerinde bilgisayarlı tomografi (BT) hemen her zaman normaldir, MRG’de ise patolojik bulgu görülme oranı HSV’ye göre daha azdır ve olguların yaklaşık 1/3’ünde MRG normal olarak değerlendirilir. Tutulum genellikle bazal gangliyonlar, talamus ve beyin sapındadır. Japon ensefaliti olgularında MRG bulguları Batı Nil virüsü ensefalitleri ile benzerdir. Enterovis 71 ensefalitlerinde orta beyin, pons ve medullada patolojik tutulum görülür (56).
30 Elektroensefalografi (EEG)
Viral ensefalitli olguların EEG bulguları genellikle anormaldir; fakat mevcut bulgularla özgül etiyolojik tanı nadirdir. EEG’de en sık anormal bulgu yaygın yavaşlamadır (68). EEG’de fokal anormallikler özellikle HSV ensefalitli olgularda görülür ve HSV ensefalitlerinde anormalliklerin %75-80’i temporal lobtadır. Batı Nil virüsü ensefalitlerinde EEG anormallikleri %60-90 oranında görülür ve en sık bulgu yaygın ve düzensiz yavaş dalgalardır (56).
2.3.5.Tedavi
Etiyolojide çok sayıda virüs tanımlanmasına rağmen özgül tedavi herpesvirüslerle ve özellikle HSV ile sınırlıdır. Ancak ensefalit şüphesi olan tüm olgularda tanı testleri tamamlanana kadar ampirik tedavi olarak asiklovir başlanmalıdır. Olguların çoğunda tedavinin temeli destek tedavisidir (9).
HSV ensefalitli olgularda tedavide tercih edilecek ilaç asiklovirdir (10mg/kg 8 saatte bir, 14-21 gün süreyle). Fakat tedaviye rağmen mortalite oranları yüksektir (18 aylık izlemde %28) (9). Herpes enfeksiyonu tanılı hastalarda prognozu kötüleştiren durumlar, yaş (>30 olması), bilinç durumu (Glasgow koma skorunun <6 olması), semptomların başlangıcı ile asiklovir tedavisi arasında geçen süredir (>4 gün) (69). Yeterli süre boyunca damar içi asiklovir kullanıldıktan sonra tedaviye oral asiklovir ile devam edilmesinin faydası gösterilememiştir (70). HSV ensefalitlerinde eş zamanlı kortikosteroit tedavisinin yararı henüz kanıtlanamamıştır (71). Buna rağmen, randomize olmayan bir çalışmada, kortikosteroit tedavisi alanlar ile plasebo grubu karşılaştırılmış ve steroit kullanan hastalarda daha iyi sonuçlar elde edildiği belirtilmiştir (72).
VZV ensefalitlerinde antiviral tedavinin etkinliğini gösteren çalışma bulunmamaktadır. Asiklovir 10-15mg/kg 8 saatte bir 10-14 gün süreyle kullanılır.
31
Tedavi seçiminin temeli, olgu sunumlarına ve kısa olgu serilerine dayanmaktadır (73). VZV ensefalitli bazı olgularda gansiklovirin etkinliği gösterilmiştir ve alternatif tedavide kullanılabileceği belirtilmiştir (74). Bağışıklık yetmezliği olmayıp yaygın VZV ensefaliti ve vaskülopatisi olan olgularda kortikosteroit tedavisi kullanımı önerilmektedir ancak bu konuda yeterli çalışma bulunmamaktadır (73,75).
CMV ensefalitlerinde optimal antiviral tedavi tam olarak tanımlanamamıştır. Gansiklovir 5mg/kg 12 saatte bir, 2-3 hafta süreyle tedavide kullanılabilirse de bu rejim ile tedavi başarısızlıkları yaygındır. Gansiklovir ve foskarnet tedavisinin üç hafta süreyle kullanımı önerilmektedir. Sidofovirin kan beyin bariyerini geçişi ile ilgili yeterli çalışma yoktur ve alternatif tedavide nu ilaç önerilmemektedir (9).
İn vitro çalışmalarda, asiklovirin EBV replikasyonunu inhibe ettiği gösterilmiştir, ancak mononükleoz ve MSS enfeksiyonlarının tedavisinde belirgin yarar sağladığı gösterilemediğinden kullanımı önerilmemektedir (9).
Primer veya tekrarlayan HHV6 enfeksiyonlarında, antiviral tedavilerin etkinliğinin gösterildiği randomize kontrollü çalışma bulunmamaktadır. Kemik iliği transplantasyonu yapılan olgularda, HHV6 ile ilişkili ensefalitlerin foskarnet veya gansiklovir ile başarıyla tedavi edildiğini gösteren olgu sunumları bulunmaktadır; fakat bu ilaçlarla antiviral profilaksi uygulanması sırasında reaktivasyon gelişebildiği bildirilmiştir. Bağışıklık yetmezliği olmayan olgularda antiviral tedavinin etkinliği hakkında veri bulunmamaktadır (9).
Herpes virüs B ensefalitlerinde asiklovir 12,5-15mg/kg, 8 saatte bir kullanımı önerilir. Bu tedavi ile tamamen iyileşen olgular bildirilmiştir; ancak tedavinin etkinliği sistematik olarak değerlendirilmemiştir. Valasiklovir ve gansiklovir de önerilen ilaçlardandır (76).
32
Ensefalit etkeni olan diğer virüslerle ilgili antiviral tedavinin etkinliği konusunda yeterli veri bulunmamaktadır. Sağlıklı erişkinlerde gelişen kızamık virüsü ensefalitlerinde ribavirin tedavisi ile bulguların süresininin ve ciddiyetinin azaldığı bildirilmiştir. Ancak şu an için bu ilacın tedavide kullanımı önerilmemektedir (9). Batı Nil virüs ensefalitlerinde ribavirin tedavisi denenmiş ancak yararı gösterilememiştir (77,78). Çocuk hasta grubunda, influenza-B ensefalitlerinde oseltamivir tedavisi denenmiş ancak iyileşmeye etkisi net olarak değerlendirilememiştir (79).
33 3. GEREÇ VE YÖNTEM
3.1.Çalışma planı
- Ege Üniversitesi Tıp Fakültesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji ve Tıbbi Mikrobiyoloji Anabilim Dalları ile görüşülerek çok merkezli yürütülecek olan çalışmanın alt yapısı planlandı. Çalışma kapsamında Ege Üniversitesi Pediyatrik Enfeksiyon Hastalıkları BD, Ege Üniversitesi Nöroloji AD, Atatürk Eğitim Araştırma Hastanesi (EAH) Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği, Tepecik EAH Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği, İzmir EAH Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji Kliniği, Celal Bayar Üniversitesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD, Dr Behçet Uz Çocuk EAH, Dokuz Eylül Üniversitesi Enfeksiyon Hastalıkları ve Klinik Mikrobiyoloji AD ve Çocuk Hastalıkları AD ile çalışmanın alt yapısı hakkında görüşüldü ve çalışmaya katılım konusunda onamları alındı.
- Ege Üniversitesi Tıp Fakültesi Araştırma Etik Kurulu’ndan onay alındı.
- Ege Üniversitesi Bilimsel Araştırma Projeleri Şube Müdürlüğü’ne çalışmaya mali destek sağlanması amacıyla başvuruldu.
- Etik kurul başvurusu sırasında ayrıntılı olarak hazırlanmış olan “bilgilendirilmiş gönüllü olur formu”, hasta ve hasta yakını bilgilendirildikten sonra, hastalar ya da birinci derece yakınları tarafından dolduruldu. ( EK:1 )
- Çalışmaya alınan her hasta için tarafımızca, demografik özellikleri, klinik ve laboratuvar bulguları gibi bilgilerin yer aldığı ve takiplerinin yapıldığı “olgu rapor formu” dolduruldu. ( EK:2 )
34
- Çalışmaya alınan hastaların BOS ve kan örneklerinin biyokimyasal, bakteriyolojik ve serolojik sonuçlarının takibi yapıldı.
- Alınan örnekler çalışma gününe dek -80 ˚C’de saklandı.
- Ege Üniversitesi Bilimsel Araştırma Projeleri Şube Müdürlüğü’ne başvurularak tez çalışmasında kullanılacak tüm malzemelerin rektörlük projesi kapsamında satın alma işlemleri yapıldı.
- Tüm örneklere bakteriyolojik ve virolojik açıdan nükleik asit arama testleri yapıldı.
- Proje hakkında Ege Üniversitesi Bilimsel Araştırma Projeleri Şube Müdürlüğü’ne düzenli olarak rapor verildi.
3.2.Hastalar
Nisan 2012-Şubat 2014 tarihleri arasında Ege Üniversitesi Tıp Fakültesi, Atatürk EAH, Tepecik EAH, Celal Bayar Üniversitesi ve Dokuz Eylül Üniversitesi Tıp Fakültesi’ne merkezi sinir sistemi enfeksiyonu bulguları ile başvuran ve klinik/fizik bakı/radyolojik/laboratuvar bulgularıyla merkezi sinir sistemi enfeksiyonu olduğu düşünülen ve yatırılarak takip veya tedavi kararı verilen toplam 103 hasta çalışmaya alındı.
Çalışmaya alınma ölçütleri:
- Akut menenjit ya da ensefalit kliniği olan ve beyin omurilik sıvılarından örnek vermeyi kabul eden hastaların tümü çalışmaya alınmıştır.
Çalışmaya alınmama ölçütleri:
35 - Hastane kaynaklı akut menenjit tanılı hastalar
- Mantar menenjiti saptanan hastalar
- Kronik menenjit tanısı alan ya da etkeni saptanan hastalar çalışmaya dahil edilmemiştir.
3.3.Olgu Rapor Formu
Uygun kriterleri karşılayan hastaların ilk vizitlerinde cinsiyet, yaş, ek hastalıklar, risk faktörleri, klinik belirti ve bulgular, serum ve BOS’un biyokimyasal ve mikrobiyolojik bulguları, kraniyal görüntüleme bulguları, tedavi ve takibini içeren hasta rapor formları dolduruldu (Ek 2). Hastaların kontrol amaçlı 2. vizitleri yapılarak klinik ve laboratuvar sonuçları ile tedaviye verdikleri yanıtlar değerlendirildi. Hastalar taburcu edilmeden önce, uygulanan tedavinin etkinliği ve komplikasyonlar açısından tekrar değerlendirildiler ve sonuçlar olgu rapor formuna kaydedildi.
3.4.Örneklerin Alınması ve Saklanması
- Her hastadan lomber ponksiyon ile BOS örneği alındı.
- Alınan örnekler bekletilmeden çalışmaya katılan merkezlerin Tıbbi Mikrobiyoloji Bakteriyoloji laboratuvarlarına gönderilerek standart besiyerlerine ekim yapıldı (Bakteriyolojik çalışma ilgili kliniklerin laboratuvarlarında gerçekleştirildi).
- Konvansiyonel kültür yöntemi uygulanan örneklerin kalan kısmı, daha sonra polimeraz zincir reaksiyonu ile toplu olarak çalışılmak üzere -80°C’de saklandı.
3.5.Örneklerin Standart Besiyerlerine Ekilmesi
- Örnekler Tıbbi Mikrobiyoloji Bakteriyoloji laboratuvarlarında kanlı agar, çikolata agar ve Eosin Metylen Blue (EMB) Agar besiyerlerine ekildi.