T.C
EGE ÜNİVERSİTESİ
TIP FAKÜLTESİ
ORTOPEDİ VE TRAVMATOLOJİ ANABİLİM DALI
İskemik Kalan Ekstremitede Reperfüzyon Sonrası Oluşan İskemi Reperfüzyon
Hasarını Azaltmak İçin Deneysel Sıçan Modelinde Feniramin Maleat, Çevresel
Hipotermi ve Hiperterminin Etkisinin Araştırılması
UZMANLIK TEZİ
Dr. Kubilay EROL
TEZ DANIŞMANI
Doç. Dr. Levent Küçük
İZMİR
ARALIK 2018
ÖNSÖZ
Uzmanlık eğitimime bilgi ve tecrübesiyle katkıda bulunan Ortopedi ve Travmatoloji Anabilim Dalı Başkanımız Prof. Dr. M. Halit Özyalçın’a, diğer hocalarıma ve uzmanlarıma,
Tez çalışmamın tamamı boyunca öğretici ve yol gösterici olan; bilgisini, deneyimini, ve yardımlarını benden esirgemeyerek bana destek olan danışman hocam Doç. Dr. Levent
Küçük’e,
Fikir alışverişinde bulunduğum, eğitim sürecinin zorluk ve güzelliklerini birlikte paylaştığım zor zamanlarımda hep yanımda olan asistan arkadaşlarıma,
Tezimin istatistik kısmındaki yardımlarından dolayı biyoistatistik ve tıbbi bilişim ABD’dan Prof. Dr. Mehmet Orman’a,
Hayatıma girdiği andan itibaren her zaman yanımda hissettiğim, yaşadığım zor günleri atlatmamı sağlayan, beni her zaman bir adım ileriye taşıyan ve uzmanlık eğitimim sürecinde
en büyük destekçim olan eşim Fatma EROL’a,
Doğduğu günden itibaren hayatımızı güzelleştiren, beni ve eşimi hep gülümseten,evimizin neşesi sevgili oğlum Erdem EROL’a
Tüm hayatım ve eğitimim boyunca her daim bana destek olan ve bugünlere gelmemi sağlayan annem Sultan EROL’a, kardeşim Alpaslan Erol’a ve bugünlerimi görmesini çok istediğim
ama yakın zamanda aramızdan ayrılan babam Mehmet Erol’a
Teşekkürlerimle…
Dr. Kubilay Erol
İÇİNDEKİLER ÖNSÖZ……….…….…..I İÇİNDEKİLER……….…..II ŞEKİLLER DİZİNİ………...…...V RESİMLER DİZİNİ………..………..…..….V TABLOLAR DİZİNİ…….………...VI KISALTMALAR DİZİNİ………..VIII ÖZET……….…....X ABSTRACT………...….XII 1 GİRİŞ VE AMAÇ ... 1 2 GENEL BİLGİLER... 3 2.1 İskemi ... 3 2.2 Reperfüzyon... 5
2.3 İskemi Reperfüzyon Hasarının Görüldüğü Durumlar ... 6
2.4 İskemi Reperfüzyon Hasarının Nedenleri ... 7
2.4.1 Serbest Oksijen Radikalleri ... 7
2.4.2 Polimorf Nüveli Lökositler ... 11
2.4.3 Endotel Hücresi ... 12
2.4.4 Kompleman Sistemi ... 13
2.4.5 Fosfolipaz A2 Aktivitesi ... 13
2.4.6 Sitokinler ... 13
2.4.7 Nitrik Oksit (NO) ... 14
2.5 Serbest Radikallerin Organik Bileşiklere Etkisi ... 14
2.5.1 Serbest Radikallerin Proteinlere Olan Etkisi... 14
2.5.2 Serbest Radikallerin Karbonhidratlara Etkisi... 15
2.5.3 Serbest Radikallerin Lipitlere Etkisi ... 15
2.5.4 Serbest Radikallerin DNA Üzerindeki Etkileri ... 16
2.6 İskemi Reperfüzyon Sonrası Oluşan İskelet Kası ve Uzak Organ Hasarı... 16
2.7 İskemi Reperfüzyon Hasarını Azaltmak İçin Uygulanan Tedaviler ... 17
2.7.1 Lökosit Tedavisi ... 17
2.7.2 Antioksidan Maddelerle Tedavi ... 17
2.7.3 Hipotermi ... 20
2.7.5 Antitrombotik ve Fibrinolitik Tedavi ... 21
2.8 N-Asetil Sistein (NAC) ... 21
2.8.1 N-Asetil Sisteinin Endikasyonları ve Kullanım Alanları ... 21
2.8.2 N-Asetil Sisteinin Antioksidan Etkisi ... 22
2.9 Feniramin Maleat... 22
2.9.1 Feniramin Maleatın Endikasyonları ... 22
2.9.2 Feniramin Maleatın Yan Etkileri... 23
2.9.3 Feniramin Maleatın İskemi Reperfüzyon Hasarına Etkisi ... 23
3 GEREÇ VE YÖNTEM ... 24
3.1 Gereç... 24
3.2 Cerrahi Teknik ... 25
3.3 İskeminin Oluşturulması... 26
3.4 Deney Grupları ... 27
3.4.1 Grup 1 (Kontrol Grubu) ... 27
3.4.2 Grup 2 (İskemi Reperfüzyon Grubu) ... 27
3.4.3 Grup 3 (İskemi Reperfüzyon + Periferik Soğutma) ... 27
3.4.4 Grup 4 (İskemi Reperfüzyon + Periferik Isıtma) ... 29
3.4.5 Grup 5 (İskemi Reperfüzyon + Feniramin Maleat)... 30
3.4.6 Grup 6 (İskemi Reperfüzyon + NAC) ... 30
3.5 Cerrahi İşlem Sonrası Hayvanların Bakımı ... 31
3.6 Doku Örneklerinin Alınması ... 31
3.7 Hayvanların Sakrifiye Edilmesi... 32
3.8 Biyokimyasal İşlem ve Ölçümler ... 32
3.8.1 Dokuların Homojenizasyonu... 32
3.8.2 Tiyobarbitürik Asitle Reaksiyona Giren Maddelerin (TBARS) Ölçümü ... 33
3.8.3 Süperoksit Dismutaz (SOD) Ölçümü ... 33
3.8.4 Katalaz (KAT) ölçümü ... 34
3.8.5 Myeloperoksidaz (MPO) ölçümü ... 34
3.8.6 Poli ADP riboz polimeraz (PARP) ölçümü... 35
3.8.7 Kas Dokusunda Yirmidördüncü Saatteki İnflamasyonun Belirlenmesi ... 35
3.8.8 Kas Dokusunda Bir Hafta Sonrasında Oluşan Kronik İnflamasyonun Değerlendirilmesi ... 35
3.8.9 Kas Dokusunda iNOS Pozitifliğinin Değerlendirilmesi ... 36
3.9 İstatistiksel Yöntemler ... 36
4.1 Biyokimyasal Analiz Sonuçları ... 37
4.1.1 Kas Dokusunda TBARS Ölçüm Sonuçları ... 37
4.1.2 Kas Dokusunda MPO Enzim Aktivitesi Ölçüm Sonuçları ... 41
4.1.3 Kas Dokusunda PARP Enzim Aktivitesi Ölçüm Sonuçları ... 46
4.1.4 Kas Dokusunda Katalaz Enzim Aktivitesi Ölçüm Sonuçları ... 49
4.1.5 Kas Dokusunda SOD Enzim Aktivitesi Ölçüm Sonuçları ... 53
4.2 Histopatoloji Sonuçları ... 59
4.2.1 Yirmi Dördüncü Saatte Dokuların Akut İnflamasyon Durumu ... 59
4.2.2 Yirmi Dördüncü Saatte Dokuların Akut İnflamasyon Derecesi ... 61
4.2.3 Birinci Hafta Sonunda Dokuların Kronik İnflamasyon Durumu ... 63
4.2.4 Birinci Hafta Sonunda Dokuların Kronik İnflamasyon Derecesi ... 65
4.2.5 Kas Dokusunda iNOS Boyanma Sonuçları... 66
4.2.6 Kas Dokusunda iNOS Boyanma Yoğunluğu Sonuçları... 68
5 TARTIŞMA ... 71
6 SONUÇ ... 81
7 KAYNAKÇA ... 82
ŞEKİLLER DİZİNİ
Şekil 1. Hücre hasarında stoplazmada artan kalsiyumun kaynakları ve etkileri………….…....4
Şekil 2. İskemi durumunda ksantin dehidrogenaz enziminin ksantin oksidaza dönüşümü ve serbest radikallerin oluşması……….……..6
Şekil 3. Lökositlerin damar endoteli ile etkileşim mekanizması…………..………11
Şekil 4. Kas dokusu TBARS (nmol/mgprt) düzeylerinin analizi………..41
Şekil 5. Kas dokusu MPO (U/mgprt) düzeylerinin analizi……….………..……45
Şekil 6. Kas dokusu PARP ( ng/mgprt) düzeylerinin analizi ………...49
Şekil 7. Kas dokusu katalaz enzim(U/mgprt) düzeylerinin analizi………...…53
Şekil 8. Kas dokusu SOD enzim (U/mgprt ) düzeylerinin analizi ………...……57
Şekil 9. Kas dokusundaki oluşan inflamasyon derecesinin gruplar arası analizi………..62
Şekil 10. Gruplar arası akut ve kronik inflamasyonun karşılaştırılması…………..……….…65
Şekil 11. Kas dokusundaki kronik inflamasyon derecesinin analizi………..……….….…….66
Şekil 12. iNOS pozitifliğinin gruplar arası değerlendirilmesi………..67
Şekil 13. iNOS yoğunluğunun gruplar arası analizi………...……….69
RESİMLER DİZİNİ Resim 1. Cerrahi öncesi hazırlık ve cerrahi yaklaşım……….…..25
Resim 2. İskeminin oluşturulması………..……….……..26
Resim 3. Femoral artere uygulanan atravmatik klemp……….26
Resim 4. Periferik sıcak ve soğuk uygulama hazırlığı………..……….…...28
Resim 5. Reperfüzyon döneminde sıcak ve soğuk uygulama……….…….30
Resim 6. Gastrokinemiustan doku örneği alınması………..32
Resim 7. Kas lifleri arasına dağılmış PNL………61
Resim 8. İnflamatuar hücrelerin az izlenmesi ve izlenmemesi………...………..62
TABLOLAR DİZİNİ
Tablo 1. Tüm gruplara ait TBARS düzeyleri………...…….…....37
Tablo 2. Sham grubu TBARS düzeylerinin diğer gruplarla karşılaştırılması…………..…...38
Tablo 3. İR grubu TBARS düzeylerinin diğer gruplarla karşılaştırılması………..….….……38
Tablo 4. İR+soğuk grubu TBARS düzeylerinin diğer gruplarla karşılaştırılması…….…...…39
Tablo 5. İR+Sıcak grubunun TBARS düzeylerinin diğer gruplarla karşılaştırılması………...39
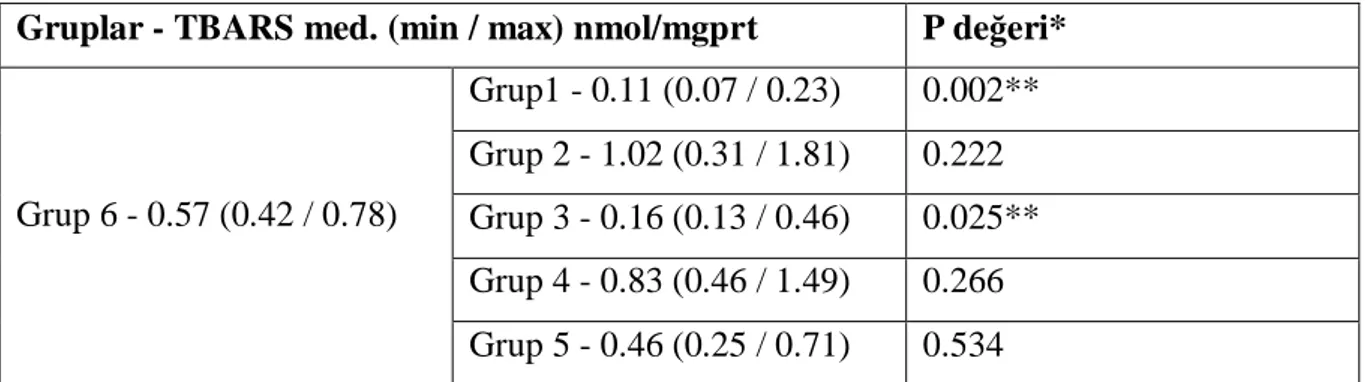
Tablo 6. İR+feniramin grubunun TBARS düzeylerinin diğer gruplarla karşılaştırılması……40
Tablo 7. İR+NAC grubunun TBARS düzeylerinin diğer gruplarla karşılaştırılması……...…40
Tablo 8. Tüm gruplara ait MPO düzeyleri………41
Tablo 9. Sham grubunun MPO düzeylerinin diğer gruplarla karşılaştırılması……….42
Tablo 10. İR grubunun MPO düzeylerinin diğer gruplarla karşılaştırılması……...………….43
Tablo 11. İR+soğuk grubunun MPO düzeylerinin diğer gruplarla karşılaştırılması……...….43
Tablo 12. İR+Sıcak grubunun MPO düzeylerinin diğer gruplarla karşılaştırılması………….44
Tablo 13. İR+feniramin grubunun MPO düzeylerinin diğer gruplarla karşılaştırılması…..…44
Tablo 14. İR+NAC grubunun MPO düzeylerinin diğer gruplarla karşılaştırılması………….45
Tablo 15. Tüm guplara Ait PARP düzeyleri……….46
Tablo 16. Sham grubunun PARP düzeylerinin diğer gruplarla karşılaştırılması..………46
Tablo 17. İR grubunun PARP düzeylerinin diğer gruplarla karşılaştırılması…………...……47
Tablo 18. İR+soğuk grubunun PARP düzeylerinin diğer gruplarla karşılaştırılması…...……47
Tablo 19. İR+sıcak grubunun PARP düzeylerinin diğer gruplarla karşılaştırılması…...…….48
Tablo 20. İR+feniramin grubunun PARP düzeylerinin diğer gruplarla karşılaştırılması…...48
Tablo 21. İR+NAC grubunun PARP düzeylerinin diğer gruplarla karşılaştırılması………....49
Tablo 22. Tüm gruplara ait katalaz düzeyleri………...50
Tablo 23. Sham grubunun katalaz düzeylerinin diğer gruplarla karşılaştırılması………50
Tablo 24. İR grubunun katalaz düzeylerinin diğer gruplarla karşılaştırılması………..51
Tablo 25. İR+soğuk grubunun katalaz düzeylerinin diğer gruplarla karşılaştırılması……...51
Tablo 26. İR+sıcak grubunun katalaz düzeylerinin diğer gruplarla karşılaştırılması...………52
Tablo 28. İR+NAC grubunun katalaz düzeylerinin diğer gruplarla karşılaştırılması………...53
Tablo 29. Tüm gruplara ait SOD düzeyleri……….…..54
Tablo 30. Sham grubunun SOD düzeylerinin diğer gruplarla karşılaştırılması………54
Tablo 31. İR grubunun SOD düzeylerinin diğer gruplarla karşılaştırılması……….55
Tablo 32. İR+soğuk grubunun SOD düzeylerinin diğer gruplarla karşılaştırılması………….55
Tablo 33. İR+sıcak grubunun SOD düzeylerinin diğer gruplarla karşılaştırılması……..……56
Tablo 34. İR+feniramin grubunun SOD düzeylerinin diğer gruplarla karşılaştırılması……...56
Tablo 35. İR+NAC grubunun SOD düzeylerinin diğer gruplarla karşılaştırılması………..…57
Tablo 36. Biyokimyasal parametrelere göre grupların karşılaştırılması………...58
Tablo 37. Dokuların akut inflamasyon durumuna göre grupların karşılaştırılması……..…....60
Tablo 38. Grupların akut inflamasyon dereceleri………..………...61
Tablo 39. Dokuların kronik inflamasyon durumuna göre grupların karşılaştırılması……...64
Tablo 40. Grupların kronik inflamasyon dereceleri………..66
Tablo 41. Gruplardaki İNOS boyanma oranları………...67
Tablo 42. Grupların iNOS yoğunlukları………...68
KISALTMALAR DİZİNİ
ATP : Adenozin tri fosfat Ca : Kalsiyum
Cu : Bakır
DNA : Deoksiribonükleik asit eNOS : Endotelyal NOS GSG : Glutatyon
GSH-Px : Glutatyon peroksidaz GSSG : Glutayon disülfittir H2O2- : Hidrojen peroksit
HOCl- : Hipoklorik asit
HRP : Horseradish Peroxidase IL-1 : İnterlökin-1
ICAM-1 : İntraselüler adezyon molekülü iNOS : İndüklenebilen NOS
İRH : İskemi reperfüzyon hasarı K : Potasyum KAT : Katalaz MDA : Malondialdehit Mn : Manganez MPO : Myeloperoksidaz Na : Sodyum
NAC : N-asetil sistein
NAD : Nikotinamid adenin dinükleotid
NADPH : Nikotinamid dinükleotid fosfat NF- κβ : Nükleer faktör-κβ
NO : Nitrik oksit NOS : Nitrik oksit sentaz
nNOS : Nöronal NOS O2- : Süperoksit
OD : Optik yoğunluk
PAF : Platelet aktive edici faktör
PARP : Poli adenozin difosfat riboz polimeraz
PECAM-1 : Platelet endotelyal hücre adezyon molekülü-1 PDS : Polidiakson
PLA2 : Fosfolipaz A2
PNL : Polimorf nüveli lökositler PSGL-1 : P-selektin glikoprotein-1 SOD : Süperoksit dismutaz SOR : Serbest oksijen radikalleri TBA : Tiyobarbitürik asit
TBARS : Tiyobarbitürik asit ile reaksiyona giren maddeler TNF-α : Tümör nekroz faktör α
TxA2 : Tromboksan A2
VCAM-1 : Vasküler hücre adhezyon molekülü-1 Zn : Çinko
ÖZET
Amaç: İskemik kalan dokunun reperfüzyonu ile birlikte ciddi doku hasarına neden olan iskemi reperfüzyon hasarı oluşur. Reperfüzyon akut inflamatuar kaskadı tetikleyerek hücre ölümüne, doku fonksiyonlarında bozulmaya ve nekroza neden olabilmektedir. Bu çalışmada deneysel olarak iskemi reperfüzyon hasarı oluşturulmuş ratlarda sistemik uygulanan feniramin maleatın ve çevresel sıcaklık değişimlerinin iskemi reperfüzyon hasarını azaltmaya yönelik etkilerinin araştırılması planlanmıştır. Elde edilen sonuçların daha önce yapılan hayvan çalışmalarında iskemi reperfüzyon hasarını azaltmadaki etkisi gösterilmiş olan ve sistemik olarak uygulanan N-asetil sistein (NAC) ile karşılaştırılması amaçlanmıştır.
Gereç ve yöntem: Deney hayvanı olarak ağırlıkları 250-350 gr arasında olan 42 adet Sprague- Dawley rat kullanıldı. Ratlar eşit sayıda (n=7) olacak şekilde rastgele 6 gruba ayrıldı (sham, iskemi reperfüzyon (İR), İR+soğuk, İR+sıcak, İR+feniramin, İR+NAC). Sham grubu dışındaki gruplarda iskemi oluşturmak için genel anestezi altında, 3 saat boyunca, ratların sağ alt ekstremite femoral arterleri klemplendi ve kolateral dolaşımı engellemek için elastik turnike uygulandı. Reperfüzyon başlangıcında; İR+soğuk grubundaki ratların iskemik kalan ekstremitelerine periferik soğutma ve İR+sıcak grubundaki ratların iskemik ekstremitelerine periferik ısıtma işlemi 2 saat boyunca uygulandı. İR+ feniramin grubuna sistemik feniramin ve İR+NAC grubuna sistemik NAC reperfüzyon öncesi uygulandı. Yirmi dört saatlik reperfüzyon süresinin sonunda genel anestezi altında ratların sağ alt ekstremite gastrokinemius kasından histopatolojik ve biyokimyasal inceleme için doku örneklemesi yapıldı. Ayrıca birinci haftanın sonunda genel anestezi altında ratların sağ alt ekstremite tibialis anterior kasından histopatolojik inceleme için doku örnekleri alındı ve hayvanlar sakrifiye edildi. Yirmi dördüncü saatte alınan doku örneklerinde; oksidatif parametreler olan katalaz (KAT), myeloperoksidaz (MPO), süper oksit dismutaz (SOD), tiyobarbitürik asit ile reaksiyon veren maddeler (TBARS) ve poli adenozil difosfat riboz polimeraz (PARP) düzeyleri ölçüldü. Ayrıca hematoksilen eozin boyama ile inflamatuar hücreler değerlendirildi. Birinci haftanın sonunda alınan doku örnekleri hematoksilen eozin boyama ile kronik inflamasyon ve indüklenebilir nitrik oksit sentaz (iNOS) çalışılarak doku hasarı değerlendirildi.
Bulgular: Kas dokusunda TBARS, MPO, KAT, SOD, PARP düzeyleri sham grubunda iskemi reperfüzyon yapılan diğer gruplara oranla anlamlı derecede düşük bulunurken (p<0.001). İR ve İR+sıcak grubunda diğer gruplara oranla anlamlı dercede yüksek bulundu (p<0.05). İR ve İR+sıcak grubunda akut ve kronik inflamasyon oranları ile iNOS boyanma şiddeti diğer
gruplara oranla belirgin yüksek bulundu. İR+NAC ve İR+feniramin gruplarında TBARS, PARP, SOD, MPO, KAT düzeylerinin, iNOS boyanma şiddeti ve akut – kronik inflamasyon derecesinin anlamlı olarak düşük olduğu görüldü. Ayrıca İR+soğuk grubunda İR+NAC ve İR+feniramin grubuna oranla TBARS, MPO, KAT, SOD, PARP düzeyleri anlamlı derecede daha düşük saptandı.
Sonuç: Kas dokusunda görülen İRH’ı ciddi hücre ve doku hasarına neden olmaktadır. Çalışmamızda NAC ve feniramin maleatın kas dokusunda oluşan İRH’nı önemli ölçüde azalttığını, aynı zamanda erken reperfüzyon döneminde uyguladığımız periferik soğutmanın İRH’nı NAC ve feniramin maleattan daha etkin bir şekilde azalttığını gördük. Periferik ısıtmanın ise İRH’na belirgin etkisinin olmadığını gözlemledik. Elde ettiğimiz bulgular yeni çalışmalarla desteklenerek İRH’nın önlenmesinde NAC, feniramin ve periferik soğutma gibi tedavi yöntemlerinin klinik uygulamalarda kullanımına ışık tutacaktır.
ABSTRACT
Background: Ischemia-reperfusion (IR) injury is the tissue damage which caused by reperfusion of an ischemic tissue. Reperfusion triggers a cascade of acute inflammatory events which leading to cellular death and tissue dysfunction and necrosis. IR is commonly caused by tourniquet, amputation and replantation in orthopedic surgery. In this study, we aimed to investigate the protective effects of pheniramine maleate (Ph) and periferic hypothermia in rats which had been created experimentally ischemia reperfusion injury and compare the results with n-acetyl cysteine (NAC) known as an effective molecule for reducing IR.
Materials and methods: Forty two Sprague-Dawley rats were seperated into 6 groups randomly (sham, IR, IR+local hypothermia, IR+local hyperthermia, IR+Ph, IR+NAC; n:7). To create ischemia we clamped the right femoral artery and applied tourniquet to the right hind limbs of rats during the 3 hours under general anesthesia. At the beginning of reperfusion, administered systemic Ph to the rats in the IR+Ph group and administered NAC to the rats in the IR+ NAC group. During two hours, the right hind limbs of rats in the IR+local hypothermia group were cooled by using cold water tank. And the right hind limbs of rats in the IR+local hyperthermia group heated similarly. At the end of the 24 hours reperfusion time, the right gastrocnemius muscles of all rats were sampled. In theese muscle samples; the oxidative parameters (Myleloperoxidase (MPO), supeoxide dismutase (SOD), catalase (CAT), thiobarbituric acid reactive substances (TBARS), poly adp ribose polymerase (PARP) levels) and inflammatory cells histopatologically were evaluated. The end of the one week reperfusion period, tibialis anterior muscles of all rats were sampled, then all of the rats were sacrificed. In these muscle samples, the iNOS staining and inflammatory cells histopathologically were evaluated.
Results: In the IR group and IR+hyperthermia group, the levels of TBARS, PARP, SOD and CAT were found higher compared with those in the sham group. On the contrary, these oxidative parameters were found lower in IR+H, IR+Ph and IR+NAC groups compared with IR and IR+hyperthermia groups. Compared with the sham group; mononuclear inflammatory cells, tissue iNOS score and intensity staining in the IR, IR+hyperthermia groups were established increased. On the other hand, the histopathological parameters were found decreased in IR+H, IR+Ph, IR+NAC groups compared with the IR, IR+hyperthermia groups.
Conclusion: In this study, we showed that NAC and Ph reduce the IR in muscle clearly, also hypothermia was more effective than NAC and Ph in reducing IR in muscle. Hyperthermia was
found not effective in reducing or increasing IR. If our results are confirmed with new studies, NAC, Ph and hypothermia can be used for preventing or management of IR in clinical practises. Keywords: ischemia reperfusion, pheniramine, NAC, iNOS, hypothermia, muscle.
1 GİRİŞ VE AMAÇ
Günümüzde cerrahi teknik ve aletler ile birlikte mikrocerrahinin de gelişmesiyle ampüte olan uzuvlar yerine dikilmekte, dolaşım bozukluğuna neden olan damar yaralanmaları tamir edilmekte, arteryal tıkanıklıklar kataterler vasıtasıyla açılmaktadır. Ancak damarların revaskülarize edilip doku dolaşımı ve oksijenlenmesinin tekrar sağlanmasına kadar geçen sürede doku iskemik kalmakta ve iskemik kalan dokuda toksik metabolitler birikmektedir. İskemi süresinin belirli bir zamanı geçmesiyle dokuda geri dönüşümsüz hasar meydana gelmektedir. Bu geri dönüşümsüz hasarın önlenmesi için doku reperfüzyonu sağlanmaktadır. Ancak belirli bir süre iskemik kalan dokunun reperfüze edilmesi ile gerçekleşen bir dizi reaksiyon sonucunda da doku hasarı meydana gelmektedir [1,2].
Dokuların iskemiye duyarlılıkları farklılık göstermektedir. Kemik, deri gibi dokular iskemiyi daha uzun süre tolere edebilirken; kas dokusu ve intestinal dokunun iskemiye toleransı çok düşüktür. Ekstremitelerde oransal olarak en fazla bulunan doku kas dokusudur. Kas dokusunda dört saati geçen iskemi durumunda geri dönüşümsüz hasar oluşmaktadır [3].
Arteriyel tıkanıklık veya ampütasyon nedeniyle kan dolaşımı ve oksijenlenmesi bozulan dokunun revaskülarize edilmesinden sonra, reperfüzyon döneminde meydana gelen biyokimyasal değişiklikler ve oluşan oksidatif maddelerin sebep olduğu doku hasarına iskemi reperfüzyon hasarı (İRH) denmektedir [4].
Uzun süre iskemik kalan dokuda hücresel şişme ve iyon gradiyentinin bozulmasına bağlı olarak hücre içi kalsiyum artmakta, mast hücreleri, kompleman sistemi ve lökositler aktive olmaktadır. Aktive olan lökositler, endotel ile etkileşerek interstisyel alana geçmekte ve doku hasarına neden olmaktadır. Ayrıca iskemi sonucunda adenozin tri fosfat (ATP) yıkımı artmaktadır. ATP yıkımı sonucunda oluşan; hipoksantini ürik aside dönüştüren ksantin dehidrogenaz enzimi, iskemiye bağlı olarak ksantin okdidaza dönüşmekte ve serbest oksijen radikallerinin oluşmasına neden olmaktadır. Oluşan serbest oksijen radikalleri; hücre zarına, hücrenin yapısında bulunan deoksiribonükleik asit (DNA), lipit ve proteinlere doğrudan toksik etki göstermektedir [5].
Birçok çalışmada iskemi reperfüzyon hasarını başlatan ve hasarın ilerlemesine yol açan en önemli faktörün serbest oksijen radikalleri olduğu bildirilmiştir. Bu nedenle İRH’nı önlemek için serbest oksijen radikallerini detoksifiye eden ajanlar, oksidasyon sistemini bloke eden maddeler ve antioksidan sistemlerin çalışmasını güçlendiren maddeler tedavide denenmektedir [6-8].
Ekstremite ampütasyonları, uzuv kaybıyla sonuçlanan morbiditesi yüksek yaralanmalardır. Gelişen teknoloji ve mikroaletler yardımıyla ampüte olan birçok uzuv replante edilebilmektedir. Replantasyon için özveri ve uzun mesailer harcanmaktadır. Ancak başarılı bir replantasyondan sonra reperfüze olan dokuda İRH’na bağlı olarak doku hasarı gelişmektedir [9].
Replantasyon yapılan uzuvlara; dolaşımın devam etmesi, vazokontrüksiyon oluşmaması ve trombozun engellenmesi için çevresel ısıtma uygulanmaktadır.
Literatürde İRH’nı azaltmaya yönelik birçok antioksidan madde (askorbik asit, α tokoferol, melatonin, β karoten vb.), ilaç (siklosporin, ilioprost, N-asetil sistein (NAC), tramadol vb.) ve antioksidan enzimlerin kofaktörleri (selenyum, çinko vb.) ile yapılmış hayvan deneyi çalışmaları bulunmaktadır. Daha önceki çalışmalarda NAC’in iskelet kası, akciğer ve karaciğer dokusunda oluşan İRH’nı azalttığı gösterilmiştir [10-12].
Çalışmamızda İRH’na uğrayan ekstremitede feniramin maleatın ve çevresel sıcaklık değişimlerinin İRH’na etkilerinin; kontrol grubu ve NAC uygulanan pozitif kontrol grubuyla karşılatırarak araştırılması amaçlandı. Elde edilen sonuçlar, günlük klinik pratikte turnike uygulamaları, ampütasyon, replantasyon, flep cerrahisi gibi işlemlere bağlı görülen İRH’nın ve İRH’na bağlı lokal ve sistemik komplikasyonların azaltılmasında kullanılacak tedavi yöntemlerinin belirlenmesinde yol gösterici olacaktır.
2 GENEL BİLGİLER
2.1 İskemi
İskemi, dolaşımla dokuya yeterli miktarda kanın ulaşamaması sonucu hücreler için gerekli oksijenin ve diğer metabolitlerin sağlanamaması ve dokuda oluşan artık ürünlerin kan dolaşımı ile uzaklaştırılamaması olarak tanımlanmaktadır. Hipoksi ise dokuya ulaşan oksijenin yetersiz olması durumudur. Hipoksinin en sık nedeni ise iskemidir [13].
İskemi durumunda oksijen eksikliğine bağlı olarak aerobik mekanizma devam edememekte, oksidatif fosforilizasyon kısa sürede sona ermekte ve anaerobik mekanizmalar devreye girmektedir. Bu süreçte hücre hasarına neden olacak birçok metabolit oluşmaktadır. Hücredeki glikojen depoları kısa zaman içinde tükenmektedir. ATP ve kreatinin gibi yüksek enerjili fosfat sentezi azalmakta, ATP tüketimi artmaktadır. Anaerobik metabolizmaya bağlı olarak hücrede laktat ve diğer toksik metabolitler oluşmaktadır [14].
ATP sentezinin azalması sonucunda hücre zarında görev yapan sodyum (Na+) -
potasyum (K+) ATPaz pompası çalışamamakta ve hücre içinde Na+ birikmektedir. Hücre içinde
artan Na+ hücre içine su girişine neden olmakta ve hücre şişmektedir. Hücre içinde artan Na+
ve membran potansiyellerinin değişmesine bağlı olarak hücre içinde kalsiyum (Ca++) artışı
olmaktadır. Artan Ca++ hücredeki fosfolipaz A
2, proteazlar ve lizozomal enzimleri
aktifleştirmektedir. Aktive olan fosfolipaz A2, hücre membranında bulunan fosfolipitleri
araşidonik aside dönüştürmektedir. Araşidonik asit ise lökotrien ve prostoglandin gibi inflamatuar mediatörlerin sentezinde ön ürün olarak rol almaktadır [15]. Araşidonik asitten lipoksijenaz yoluyla sentezlenen lökotrienler, lökositlerin vasküler adezyonunu ve kapiller geçirgenliği artırmaktadır. Kapiller geçirgenlik artışı ile damar dışına çıkan lökositler, reperfüzyon sonrası oluşan hücre ve doku hasarının derecesini artırmaktadır [3].
Şekil 1. Hücre hasarında sitoplazmada artan kalsiyumun kaynakları ve etkileri [16]
Doku iskemisi sırasında adezyon moleküllerinin sentezinde de artış meydana gelmektedir. Artan adezyon molekülleri lökositlerin iskemik bölgeye göçünü artırmaktadır. Endotelde nitrik oksit (NO) sentezi inhibe olmakta ve trombosit aktivasyonu gerçekleşmektedir. Bunlara ek olarak aktive olan kompleman sistemi platelet aktive edici faktör (PAF) salınımını artırmaktadır. Tüm bu nedenler iskemik dokuyu reperfüzyon hasarına daha hassas hale getirmektedir. Doku reperfüzyonu zamanında sağlanırsa bu değişiklikler geri dönebilmektedir. Ancak iskemi devam ederse geri dönüşümsüz hasar meydana gelmektedir [17].
Kritik iskemi zamanı, iskemiye maruz kalan dokunun canlılığını devam ettirebildiği maksimum süre olarak tanımlanmaktadır. İskemiye maruz kalan hücrenin metabolik aktivitesi ve adaptasyon mekanizmalarına göre kritik iskemi zamanı değişmektedir [18]. Uzun süreli iskemide geri dönüşümsüz hasar ve hücre nekrozu kaçınılmazdır. Geri dönüşümsüz hasarın en önemli göstergesi; iskemi sırasında hasara uğrayan mitokondri ve hücre zarının fonksiyonlarının, reperfüzyon sağlandıktan sonra geri dönmemesidir [19].
Geri dönüşümsüz hasar mekanizmaları
1. Hücre zarındaki fosfolipitlerin yıkılmasına bağlı olarak hücre zarının geçirgenliğinin bozulması,
2. Hücre içinde artan kalsiyumun lizozomal enzimleri aktifleştirmesi ve hücre iskeletini bozması,
3. Toksik oksijen radikallerinin oluşması, 4. Lipit yıkım ürünlerinin oluşmasıdır.
Bu mekanizmalar ile hücredeki gen ekspresyonu, hücre zarı bütünlüğü, protein sentezi ve oksidatif fosforilasyon bozulmakta ve hücre zaman içerisinde nekroza gitmektedir [20].
2.2 Reperfüzyon
Reperfüzyon; iskemik kalan dokunun kan dolaşımının yeniden başlamasıdır. İskemik kalan dokunun rejenerasyonu ve oluşan toksik metabolitlerin uzaklaştırılması için reperfüze olması gerekmektedir. Ancak iskemik kalan dokuda reperfüzyon ile oluşan metabolitler, iskeminin oluşturduğu hasardan çok daha ciddi bir hasara yol açmaktadır [21].
İskemi nedeniyle artan ATP yıkımı sonucu hipoksantin ve ksantin gibi pürin metabolitleri hücrede birikmektedir. Normal şartlarda hipoksantin ksantin dehidrogenaz vasıtasıyla ürik asite metabolize olmaktadır. Ancak iskemik kalan dokuda ksantin dehidrogenaz inhibe olarak ksantin oksidaza dönüşmektedir. Ksantin dehidrogenaz substrat olarak nikotinamid adenin dinükleotid (NAD) kullanırken, ksantin oksidaz substrat olarak oksijeni kullanmaktadır [22]. Ksantin oksidaz reperfüzyon sonrası iskemik dokuya gelen oksijen molekülü ile hipoksantini katalizlemekte ve bir dizi reaksiyon sonucunda serbest oksijen radikalleri (SOR) olan süperoksit
(O2-) ve hidrojen peroksit (H2O2-) oluşumuna neden olmaktadır. Reperfüzyon sonrası oluşan bu
radikaller iskemi reperfüzyon hasarının en önemli mekanizmalarından birini teşkil etmektedir [23].
Şekil 2. İskemi durumunda ksantin dehidrogenaz enziminin ksantin oksidaza dönüşümü ve
serbest radikallerin oluşması [24].
Reperfüzyon ile oluşan SOR doğrudan lipit peroksidasyonuna neden olmaktadır. Hücre membranında bulunan çoklu doymamış yağ asitlerinin yapısını bozarak hücrenin bütünlüğünü ve fonksiyonel yapısını hasara uğratmaktadır [22,25].
Polimorf nüveli lökositler (PNL) ve endotel hücre aktivasyonu reperfüzyon hasarında önemli rol oynamaktadır. Normal şartlarda endotelin PNL’e afinitesi düşüktür. Ancak reperfüzyon hasarında endotel hücrelerinde adezyon molekülleri artmakta, PNL endotele yapışmakta ve diapedez yoluyla interstisyel alana geçmektedir. PNL; nikotinamid dinükleotid fosfat (NADPH) oksidaz enzimi ile SOR açığa çıkararak ve proteolitik enzimlerin salınmasına neden olarak doku hasarı oluşturmaktadır. İnterstisyel alandaki aktive olmuş PNL SOR’nin en önemli kaynaklarındandır [22,27,28].
2.3 İskemi Reperfüzyon Hasarının Görüldüğü Durumlar
Ekstremite ampütasyonu sonucu kopan uzuv replante edilince doku perfüzyonunun tekrar başlaması ile birlikte İRH meydana gelmektedir. Deri, kemik ve tendon gibi yapılar iskemiye karşı dayanıklı iken kas dokusu iskemiye ve İRH’na karşı en hassas dokudur. Ekstremitelerde oransal olarak en fazla kas dokusu bulunmaktadır. Bu nedenle replante veya revaskülarize edilen uzvun içerdiği kas dokusuyla doğru orantılı olarak İRH artmaktadır. Parmaklar; kas
dokusunun olmaması ve iskemiye dayanıklı dokulardan oluşması nedeniyle iskemiye ve İRH’na karşı daha dayanıklıdır. Ancak ekstremite proksimaline doğru gittikçe ampütatın kas içeriği artmakta, soğuk iskemi süresi kısalmakta ve replantasyon sonrası oluşan İRH artmaktadır. Ampütasyonlarda proksimale gidildikçe yapılacak revaskülarizasyon ve doku onarımı kolaylaşırken, iskemiye dayanıklılık azalmakta ve revaskülarizasyon sonrası oluşan İRH artmaktadır.
Şok, yaygın sıvı kaybına neden olan yanıklar, sepsis ve pankreatit gibi durumlar hipovolemiye neden olarak dokuların iskemiye maruz kalmasına neden olmaktadır. Bu durumlar düzeltildikten sonra reperfüzyon ile birlikte vücuttaki tüm dokularda İRH meydana gelmektedir [29].
Miyokard infarktüsü ve serebrovasküler olaylarda arteryel tıkanıklık açılıncaya dek doku iskemik kalmaktadır. Uygulanan cerrahi işlem veya trombolitik tedavi sonrası arteryel tıkaç açıldıktan sonra reperfüzyonla birlikte kalp ve beyin dokusunda İRH meydana gelmektedir [29]. Cerrahi işlemler esnasında kanama kontrolü için geçici olarak koyulan damar klempleri ve turnikeler uygulandığı bölgenin distalinde iskemiye neden olmaktadır. Ayrıca arrest olan ve kardiyopulmoner resüsitasyon yapılan hastalarda bütün dokular iskemiye maruz kalmaktadır. Kardiyak cerrahi esnasında aort veya periferik damarlara uygulanan klemplere bağlı olarak veya akut arter tıkanıklarına bağlı olarak dokularda iskemi meydana gelmektedir. Altta yatan nedenlerin düzeltilerek iskemik kalan dokuların reperfüzyonu sağlandıktan sonra dokularda İRH gelişmektedir. Organ nakli operasyonlarında donörden alınan organ alıcıya nakledilinceye kadar iskemik kalmaktadır. Arteryel ve venöz anastomozlar yapılınca reperfüze olan organda İRH kaçınılmazdır. Oluşan İRH greft fonksiyonlarını olumsuz olarak etkilemektedir [28,29].
Doku defekti olan alanları rekonstrükte etmek için uygulanan serbest flep cerrahisinde; donör sahadan alınan flebin defektif alana transfer edilerek damar anastomozaları yapılmasına kadar geçen sürede flep iskemik kalmaktadır. Anastomoz sonrası oluşan reperfüzyon ile birlikte flepte İRH oluşmaktadır.
2.4 İskemi Reperfüzyon Hasarının Nedenleri 2.4.1 Serbest Oksijen Radikalleri
Hücrede oluşan serbest radikallerin büyük çoğunluğu oksijen kaynaklıdır. Son yörüngesinde eşleşmemiş elektron bulunduran ve bu nedenle stabil olmayan reaktif oksijen moleküllerdir [30]. SOR vücutta fizyolojik şartlarda savunma sisteminde kullanılmak üzere bir
miktar oluşmakta ve vücuttaki endojen antioksidan sistemler sayesinde organizmanın kendisine zarar vermeleri önlenmektedir.
Vücuttaki serbest oksijen radikallerin endojen kaynakları: • Mitokondriyal elektron transport zinciri
• Endoplazmik retikulum ve sitokromlar • Aktive olmuş lökosit ve makrofajlar • Peroksizom
• Otooksidasyon
• Araşidonik asit metabolizması • Yaşlanma
Vücuttaki serbest oksijen radikallerin eksojen kaynakları: • Radyasyon
• Aşırı oksijen konsantrasyonu • Sigara dumanı
• Antineoplastik ilaçlar (bleomisin, adriyamisin) • Zehirli gazlar
Vücuttaki fizyolojik koşullarda endojen olarak oluşan SOR’nin büyük bölümü elektron transport zinciri reaksiyonlarında oluşmaktadır. Oluşan bu radikaller vücuttaki antioksidan sistemler aracılığı ile etkisiz hale getirilmektedir. Normal koşullarda SOR’nin oluşumu ve etkisiz hale getirilmesi denge halindedir [15,31].
Fizyolojik koşullarda üretilen SOR fagositer hücrelerin mikroorganizmaları öldürmesinde kullanılmaktadır. Ancak SOR antioksidan sistemlerin kapasitesini aşacak kadar yüksek düzeyde oluştuğu zaman, hücrenin temel yapıtaşları olan proteinler, lipitler, karbonhidratlar ve nükleik asitlerin yapısını bozmaktadır. Bu temel bileşenlerden özellikle lipitler SOR’ne karşı çok hassastır. Lipitlerin yapısındaki çoklu doymamış yağ asitleri, serbest radikallerle kolayca reaksiyona girerek lipit peroksitleri oluşturmaktadır [32,33].
SOR’nin üretimi İRH sonrasında arttığı gibi hücrelerin normal fizyolojisinin bozulmasına neden olan radyasyon, kanserler, ateroskleroz ve yaşlanma gibi durumlarda da artmaktadır. Bu durumlarda sentezi artan SOR hücrelerin yapısını bozarak apoptozu
En önemli oksijen kaynaklı serbest radikaller aşağıdaki gibidir: • Süperoksit radikali (O2ˉ)
• Hidrojen peroksit (H2O2)
• Hidroksil radikali (OH-)
• Nitrik oksit (NO-)
2.4.1.1 Süperoksit Radikali (O2ˉ)
Aerobik hücrelerde oksijen molekülüne bir elektron ilavesi ile süperoksit radikali oluşmaktadır. Süperoksit tek başına hücreye ciddi zarar vermemekte ancak hidrojen peroksitin üretiminin ana kaynağını oluşturması ve geçiş metallerinin (bakır, demir vb) indirgeyicisi olması nedeniyle önem arz etmektedir. Antioksidan bir enzim olan ve oksidan hasar durumlarında dokuda seviyesi artan süperoksit dismutaz (SOD) enzimi süperoksit radikalini hidrojen peroksite dönüştürmektedir. Süperoksit radikali fizyolojik bir serbest radikal olan NO ile birleşerek reaktif bir oksijen türevi olan peroksinitrit oluşumuna neden olmakta ve sonuçta
NO’in etkileri inhibe olmaktadır [35].
e-
O2 O2ˉ
2.4.1.2 Hidrojen Peroksit (H2O2)
Süperoksit radikali hidrojen molekülü ile birleşerek hidrojen peroksiti oluşturmaktadır.
Hidrojen peroksit membranlardan kolayca geçebilen uzun ömürlü oksidan bir maddedir. H2O2
reaktif bir molekül olmamasına rağmen süperoksit radikali ile reaksiyona girip en reaktif molekül olan hidroksil radikalinin oluşmasına neden olduğu için reaktif oksijen türevi olarak sayılmaktadır.
Oluşan H2O2 fizyolojik şartlarda katalaz (KAT) veya glutatyon peroksidaz (GSH-Px)
tarafından toksik olmayan metabolitlerine dönüştürülmektedir. KAT
GSH-Px
H2O2+2GSH2 H2O + GSSG
GSH-reduktaz
GSSG + NADPH + H+ NADP+ + 2GSH
H2O2’ten hidroksil radikali iki şekilde oluşmaktadır. Haber-Weiss tepkimesi ile
süperoksit anyonu varlığında yavaş katalizlenen bir reaksiyonla oluşabildiği gibi ortamda bulunan indirgeyici metaller (demir, bakır) varlığında fenton reaksiyonu ile hızla katalizlenerek de hidroksil radikali oluşabilmektedir [36].
2 O2ˉ + 2 H2O2 2 O2 + 2OH- + 2OH
-Haber- Weiss tepkimesi
Fe+2 Fe+3 H2O2 2OH
-Fenton reaksiyonu
2.4.1.3 Hidroksil Radikali
Hidroksil radikali hidrojen peroksitten Haber-Weiss reaksiyonu veya Fenton reaksiyonu aracılığı ile oluşmaktadır. Aynı zamanda suyun iyonizan radyasyona maruz kalması sonucu da oluşabilmektedir. Hidroksil radikali oldukça kısa ömürlü ve reaktif bir moleküldür. Hücrede DNA, lipitler, karbonhidratlar ve proteinler gibi makromoleküllerle reaksiyona girerek oksidatif hasara neden olmaktadır. Serbest radikaller arasında en reaktif ve en sitotoksik olanıdır. Bu nedenle hidroksil radikalinin oluşumunun önlenmesi çok önemlidir [37].
2.4.1.4 Nitrik Oksit
Normal şartlarda NO; savunma mekanizmalarında kullanılmak üzere makrofaj, endotel, nötrofiller tarafından üretilmektedir [38]. Bakteri, mantar, parazit ve tümör hücrelerinin
öldürülmesinde kullanılmaktadır. Yüksek konsantrasyonlarda süperoksit radikali ile reaksiyona girerek oksidan bir molekül olan peroksinitrit oluşumuna neden olmaktadır [39].
2.4.2 Polimorf Nüveli Lökositler
İskemi reperfüzyon sonrası endotel ile kompleman sistemi aktive olarak lökositleri aktive eden kemotaktik faktörlerin salınımına neden olmaktadır. Aktive olan PNL’deki P-selektin glikoprotein-1 (PSGL-1) adezyon molekülü iskemi reperfüzyon sonrası endotel hücrelerinde
sentezi artan P-selektine ve yine PNL’deki β-2 integrin endotel hücrelerindeki endotelyal
intraselüler adezyon molekülüne (ICAM-1) bağlanmaktadır. Lökositlerin hasarlı bölgedeki endotele adezyonu ve agregasyonu artmaktadır. Ardından endotel hücresine tutunmuş olan lökositler damar dışına çıkarak hasarlı bölgeye doğru göç etmektedir. İnterstisyel alana geçen lökositler prostaglandin ve lökotrien üreterek inflamasyonun şiddetlenmesine yol açmaktadır. Lizozomal enzimlerin salınmasına ve SOR’nin üretilmesine neden olarak doku hasarına sebep olmaktadır [40].
Şekil 3. Lökositlerin damar endoteli ile etkileşim mekanizması (PGSL-1: P-selektin glikoprotein 1, CD11b/CD18: Lökosit fonksiyon antijeni 1, ICAM-1: Endotelyal hücre içi adezyon molekülü-1, PECAM: Trombosit-endotel adezyon molekülü-1) [16]
PNL sitoplazmasında bulunan azurofilik granüllerde NADPH oksidaz, elastaz ve myeloperoksidaz (MPO) gibi enzimler bulunmaktadır. Ayrıca iskemi etkisi ile PNL’de ksantin oksidaz enzimi de artmaktadır. İskemi sonrası reperfüzyonun başlaması ile birlikte dokuya gelen oksijenin %70’lik kısmı NADPH oksidaz enzimi ile süperoksit anyonlarına
dönüştürülmektedir. Süperoksit anyonu SOD enzimi veya spontan tepkimeyle H2O2’ye
dönüşmektedir. PNL’de bulunan MPO enzimi H2O2’i klor iyonu varlığında güçlü bir oksidan
madde olan hipoklorik asite (HOCl-) dönüştürmektedir [41]. MPO enzimi PNL’in sitoplazmik
granüllerinden salınmakta ve dolaylı olarak dokudaki PNL’in birikimini yansıtmaktadır.
MPO
H2O2 +Cl HOCl- +OH
-Aktive olan nötrofiller kompleman sisteminin aktivasyonuna neden olan proteolitik enzimler salgılamakta ve endotel hasarı oluşturmaktadır. Endotel geçirgenliği artmakta ve lökositlerin dokuya göçü kolaylaşmaktadır. Dokuya geçen PNL’den salınan elastaz, proteaz gibi enzimler ve üretilen SOR doku ödemi, tromboz ve hücre ölümüne neden olmaktadır. Gelişen
ödeme ve endotel disfonksiyonuna bağlı olarak endotelyal vazodilatasyon
gerçekleşememektedir. Endotel lümeninde biriken lökositler ve tombositler mikrovasküler dolaşımı engelleyecek şekilde vasküler tıkaç oluşturmaktadır. Bu duruma “no reflow fenomeni” adı verilmektedir. Ayrıca üretilen toksik maddeler başta akciğer olmak üzere diğer organlarda da hasara neden olmaktadır [40,42,43].
2.4.3 Endotel Hücresi
Oksidatif strese maruz kalan endotel hücresi aktive olmaktadır. Aktive olan endotel hücresi SOR için hedef konumundayken bir taraftan da SOR üretimine neden olmaktadır. Endotel hücresinde normal şartlarda mikrovasküler dolaşımın düzenlenmesinde görev alan NO ve endotelin üretilmektedir [44]. NO arteryel dolaşımda vazodilatasyon yaparak endotelinin etkisini bloke ederken venlerde ise tam tersi etki göstermektedir. Bu iki molekülün üretimi normal şartlarda denge halinde iken İRH’nda endotelin oransal olarak artmaktadır. Sonuç olarak arterlerde vazodilatasyon venlerde ise vazokonstrüksiyon oluşmaktadır [45].
İskemi ve reperfüzyon sonrası endotel hücreleri oksidatif strese maruz kalarak kompleman aktivasyonu ve lökosit adezyon moleküllerinin sentezinin artmasına neden olmaktadır. SOR’nin
etkisi ile endotel hücrelerinden tromboksan A2 (TxA2), interlökin-1 (IL-
1), prostaglandinler (PGI2, PGG2), PAF, büyüme faktörleri, endotelin ve NO salınmaktadır.
Bunlara ek olarak aktive olan endotel hücresinden kendi bazal membranının sindirilmesine neden olan kollajenazlar salgılanmaktadır [44].
Endotel hücresi fizyolojik koşullarda iyon ve biyokimyasal moleküllere karşı bariyer olarak görev alarak, sentezlenen prostaglandinlerin dolaşımdan uzaklaştırılmasını sağlayarak homeostaziste görev almaktadır. İRH’nda aktive olarak bu fonksiyonları bozulmuş olan endotel hücresi hasarın artmasına neden olmaktadır.
2.4.4 Kompleman Sistemi
Reperfüzyon sonrası açığa çıkan SOR ve PNL’den salınan enzimler kompleman sistemini aktifleştirmektedir. Kompleman sistemi aktive olunca proinflamatuar kompleman faktörleri olan C3a, C5a, C3b ve C5b-9 oluşmaktadır. C5b-9 membran atak kompleksi olarak adlandırılmakta ve İRH’da önemli rol oynamaktadır. Anaflatoksinler olan C3a ve C5a lökositleri aktive ederek ve sitokin sentezini uyararak inflamatuar yanıtın şiddetini artırmaktadır. Lökosit aktivasyonu ve kemotaksisin uyarılmasına ek olarak TNF-α, IL-1, IL-6 üretimini artırarak inflamatuar yanıtı şiddetlendirmektedir [46].
Ayrıca kompleman tarafından sentezi uyarılan lökosit adezyon molekülleri mevcuttur: • Vasküler hücre adhezyon molekülü-1 (VCAM-1)
• E-Selektin • P-selektin • İCAM-1’dir.
Bu moleküller lökositlerin marjinasyon ve diapedezini sağlayarak İRH oluşumunda önemli rol almaktadır [47,48].
2.4.5 Fosfolipaz A2 Aktivitesi
İskemi ve sonrasında gelişen reperfüzyon sonrası artan hücre içi kalsiyumun etkisiyle
fosfolipaz A2 (PLA2) aktive olarak membran fosfolipitlerinden yağ asitlerini parçalamaktadır.
Ayrıca prostaglandin metabolizmasını artırarak membran PAF, PECAM-1 ve IL-6 üretimini artırmaktadır. Antiinflamatuar bir sitokin olan IL-10 sentezini inhibe etmektedir. Bu etkileri
nedeniyle aktivitesi artan PLA2 enzimi İRH oluşumunda ve hasarın artmasında önemli rol
oynamaktadır [49]. 2.4.6 Sitokinler
İskemi reperfüzyon durumunda IL-1, IL-6, IL-8 tümör nekroz faktör α (TNF-α) sentezi artmaktadır. IL-1 ve TNF-α vasküler hasar oluşumuna neden olmaktadır. Ayrıca endotelde sentezlenen IL-8 PNL için güçlü bir kemoatraktandır [50].
2.4.7 Nitrik Oksit (NO)
Nitrik oksit fizyolojik koşullarda belli oranda sentezlenen bir radikaldir. L-arjininden nitrik oksit sentaz (NOS) enzimi aracılığı ile sentezlenmektedir. Üç tip NOS enzimi tanımlanmıştır. Bunlar nöronal NOS (nNOS), toksin veya sitokinle indüklenebilen NOS (iNOS)
ve endotelyal NOS (eNOS)’tur. nNOS ve eNOS enzimleri normal şartlarda
kalsiyum/kalmodulin bağımlı olarak çalışmakta ve az miktarda NO sentezi yapmaktadır. Bu enzimlerin oluşturduğu NO, İRH’nın oluşturduğu doku hasarının azaltılmasında önemli rol oynamaktadır. Ancak İRH durumunda açığa çıkan sitokinler vasıtasıyla iNOS enzimi indüklenerek çok fazla miktarda NO sentezi gerçekleşmekte ve nitrik oksitten peroksinitrit oluşumu da artarak doku hasarı meydana gelmektedir. Bu nedenle iNOS aktivitesinin selektif olarak azaltılması ile İRH’nın azaldığını gösteren çalışmalar mevcuttur [51].
NO’in vazodilatasyon, nörotransmisyon, hemostaz, yara iyileşmesi, inflamasyon ve sitotoksisite gibi süreçlerde önemli rolü bulunmaktadır. Bu nedenle sitoprotektif ve sitotoksik etkiler gösterebilmektedir [52].
Fizyolojik koşullarda üretilen NO herhangi bir enzim tarafından katalizlenmemekte ve
oksihemoglobin ile girdiği reaksiyon sonucu nitrata (NO3-) dönüşerek aktivitesi sonlanmaktadır.
NO, endotel hücresinin vazodilatasyonunu sağlamakta ve trombosit agregasyonunu inhibe etmektedir. Bu sayede dokuya giden kan akımının artmasını ve devamlılığını sağlamaktadır [52,53].
Serbest radikal olarak reaktivitesi düşük olan NO ortamda bulunan diğer serbest radikaller ve inidirgeyici metaller ile kolayca reaksiyona girmektedir. NO süperoksit ile reaksiyona girdiğinde peroksinitrit oluşmaktadır [55]. Oluşan bu molekül hidroksil anyonuna benzer etkiler göstermektedir. Peroksinitrit protein ve lipitlere yüksek afinite göstererek bu yapıların oksidasyonuna sebep olmaktadır. Ayrıca yüksek konsantrasyona ulaşan NO molekülü demir içeren mitokondri ve DNA enzimleri ile reaksiyona girmekte ve bu enzimlerin aktivitelerini baskılamaktadır [56,57].
2.5 Serbest Radikallerin Organik Bileşiklere Etkisi 2.5.1 Serbest Radikallerin Proteinlere Olan Etkisi
Serbest radikaller proteinlerin yapısında bulunan aminoasitlere etki ederek proteinlerin yapısını bozmaktadır. Yapısında sülfidril grubu bulunduran metiyonin ve sistein gibi aminoasitler serbest radikallerin etkilerine karşı daha hassastır [58,59].
Hücresel fonksiyonların yürütülmesinde çok önemli role sahip olan enzimler ile hücre zarında bulunan reseptörlerin birçoğu protein yapısındadır. Enzim ve reseptörler serbest radikallere karşı daha hassastır. Serbest radikal hasarına maruz kalan enzim ve reseptörlerin yapısındaki proteinlerin sekonder ve tersiyer yapıları değişmekte ve fonksiyonları bozulmaktadır [60].
2.5.2 Serbest Radikallerin Karbonhidratlara Etkisi
Hidroksil radikali karbonhidratlara doğrudan etki ederek karbonhidratın yapısında bulunan karbon atomu merkezli serbest radikal üretimine neden olmaktadır. Bu nedenle hücresel olaylarda önemli rolü olan karbonhidratların yapısını ve fonksiyonunu bozmaktadır [61]. 2.5.3 Serbest Radikallerin Lipitlere Etkisi
Lipitler serbest radikalllerin etkilerine karşı en hassas moleküllerdir. Hücre zarında bulunan kolesterol ve doymamış yağ asitleri serbest radikallerle kolayca reaksiyona girerek lipit peroksidasyon ürünlerini oluşturmaktadır [62].
Çoklu doymamış yağ asitlerinin oksidatif süreçler sonucu yıkımı lipit peroksidasyonu olarak bilinmektedir. Hücre membranında serbest radikaller aracılığı ile kendi kendini aktifleyen bir dizi reaksiyon sonucu lipit peroksit radikalleri ve lipit serbest radikalleri oluşmaktadır. Bu maddeler oksidatif hasarın önemli göstergeleridir ve dokular için oldukça zararlıdır. Hücre membranı ile organellerin yapısında bulunan lipitlerin serbest radikaller aracılığıyla hasarlanması sonucu membran ile organel zarlarının yapı ve fonksiyonu bozulmaktadır. Membran geçirgenliği artmaktadır. Hücre içi potasyum ve magnezyum konsantrasyonu artışına bağlı protein sentezi bozulmaktadır. Lizozomal zarların da hasarlanmasıyla proteolitik enzimler sitoplazmaya salınmakta ve hücre hasarı şiddetlenmektedir [62].
Hücre membranındaki oksidatif hasar genellikle çoklu doymamış yağ asitlerindeki konjuge çift bağlardan bir elektron atomu içeren hidrojen molekülünün çıkarılması ve bunun sonucunda yağ asidi zincirinin lipit radikali özelliği kazanmasıyla başlamaktadır [63].
Lipitlerin peroksidasyonu sonucu oluşan lipid peroksitleri, serbest radikaller ve geçiş metallerinin varlığında yıkılmakta ve biyolojik olarak aktif olan aldehit formlarını oluşturmaktadır. Bu maddeler doğrudan hücrede veya diffüzyon ile yayılarak diğer dokularda hasar oluşturmaktadır [37].
Üç veya daha fazla çift bağ içeren yağ asitlerinin peroksidasyonu sonucu malondialdehit (MDA) oluşur. MDA lipit peroksidasyonunun özgün bir göstergesi olmamakla beraber lipit peroksidasyonu ile anlamlı bir korelasyon göstermektedir. Bu nedenle dokuda MDA ölçümü lipit peroksidasyon seviyesinin belirlenmesinde kullanılmaktadır. Ancak doğrudan MDA’i ölçen bir test bulunmamaktadır. MDA tiyobarbitürik asit (TBA) ile reaksiyon vermektedir. TBA ile MDA’ten başka okside lipitler, sialik asit ve aldehit bileşikleri ile reaksiyona girmektedir. Bu nedenle bu testle yapılan ölçüm sonuçları, TBA ile reaksiyona giren maddeler (TBARS) olarak adlandırılmaktadır. Ancak saf lipitler ile yapılan çalışmalarda TBARS ölçümünün lipit
peroksidasyonu ile iyi bir korelasyon gösterdiği saptanmıştır. Bu nedenle TBARS ölçümü
yaygın olarak lipit peroksidasyon göstergesi olarak kullanılmaktadır [37]. 2.5.4 Serbest Radikallerin DNA Üzerindeki Etkileri
İskemi ve reperfüzyon sonrasında oluşan SOR, DNA üzerindeki pürin ve primidin bazlarına olan etkisiyle DNA yapısını oluşturan temel nükleotidlerin hidroksillenerek hasara ve
mutasyona uğramasına neden olmaktadır [64].
SOR nükleer ve mitokondriyal DNA üzerindeki timin nükleotidleri ile doğrudan etkileşime girerek DNA zincirinin kırılmasına neden olmaktadır. Bu durum sonucunda DNA onarım mekanizmaları aktive olmaktadır. DNA onarımında görevli olan poli adenozin difosfat riboz polimeraz (PARP) enzimi aktive olmaktadır. PARP aynı zamanda nükleotid polimerizasyonu ve protein modifikasyonunda görev almaktadır. Bu nedenle İRH sonucunda dokuda PARP enzimi artmaktadır [65].
2.6 İskemi Reperfüzyon Sonrası Oluşan İskelet Kası ve Uzak Organ Hasarı
İskemiye tolerans; etkilenen doku, organa ve etkilenen dokunun mevcut olan kollateral dolaşımına göre değişmektedir. Doku iskemisinde; iskelet kasında dört saatte, sinir dokusunda sekiz saatte, yağ dokusunda yirmi dört saatte, kemikte ise yaklaşık dört günde geri dönüşümsüz hasar meydana gelmektedir [9].
İskelet kası ekstremitelerde oransal olarak en fazla bulunan ve iskemiye karşı en hassas olan dokudur. Bu nedenle ekstremitelerde oluşan İRH’nın büyük bölümünden iskelet kası sorumludur. İskemik kalan kas dokusunda üçüncü saatin sonunda geri dönüşümsüz değişiklikler başlamakta ve altı saatin sonunda ise kas dokusunda yüzde doksanın üzerinde nekroz görülmektedir.
Kas dokusunda İRH ekstremite ampütasyonları ile oluşabileceği gibi operasyonlarda kanama olmaması ve iyi görüş sağlamak için kullanılan turnikelerin uzun süre uygulanması, akut arteryel tıkanıklıklarda ve kas dokusunu içeren serbest flep operasyonları sonucunda oluşmaktadır [66].
Kas dokusunda iskemi sonrası öncelikle glikojen ve kreatin fosfat depoları tükenmektedir. Bu safhada nekroz görülmese de iskeminin devam etmesiyle kastaki ATP depoları tükenmekte ve nekroz oluşmaktadır. Ekstremite distalindeki kas dokusu çabuk soğuması nedeniyle proksimaldeki dokulara göre iskemiye daha dayanıklıdır [67].
İskemi sonrasında reperfüzyon sağlandığında kas dokusunda aktive olan PNL, trombosit ve endotel hücreleri ile etkileşerek mikrovasküler dolaşımda tıkaç oluşturmaktadır. Buna bağlı olarak reperfüzyon ile bu bölgelere kan akışı sağlanamamakta, interstisyel sıvı birikimi artmakta ve endotelin fonksiyonu bozulmaktadır. Reperfüzyona rağmen hasarlı bölgedeki oluşan mikrovasküler tıkaçlara bağlı kan dolaşımının sağlanamaması sonucu no reflow fenomeni görülmektedir [68,69].
İRH iskelet kasında neden olduğu olumsuz lokal etkiler (ödem, kas nekrozu vb.) dışında, uzak organ hasarına ( böbrek, akciğer, karaciğer vb.) neden olarak sistemik inflamatuar yanıt sendromu ve multiple organ yetmezliği gibi ciddi sistemik tabloların oluşmasına yol açmaktadır [9,28,70].
2.7 İskemi Reperfüzyon Hasarını Azaltmak İçin Uygulanan Tedaviler 2.7.1 Lökosit Tedavisi
Lökositlerin iskemi reperfüzyon hasarındaki etkilerini azaltmak için aktivasyonlarını engelleyen, hasarlı bölgeye göçlerini artıran inflamatuar madde ve adezyon moleküllerinin sentezinin azaltılmasına yönelik tedaviler uygulanmaktadır. PAF, histamin, lökotrien–B4, TNF-α gibi maddelerin salınımı ve sentezinin inihibisyonu lökositler aracılığı ile oluşan iskemi reperfüzyon hasarının azaltılmasında etkili olmaktadır [18,27].
2.7.2 Antioksidan Maddelerle Tedavi
Serbest radikal oluşumunu önleyen veya oluşan serbest radikallerin organizma için zararsız formlara dönüşmesini sağlayan maddelere antioksidan maddeler denilmektedir [71].
Antioksidan maddeler bu etkilerini; kararsız yapıdaki serbest radikallere aktardıkları elektronla serbest radikallerin kararlı hale gelmesini sağlayarak, serbest radikal üretimine neden
olan tepkimeleri durdurarak, serbest radikallerin protein, DNA ve lipitler üzerinde oluşturduğu hasarı tamir ederek, serbest radikalleri bağlayıp zararlı etkilerini ortadan kaldırarak
göstermektedirler [72]. Antioksidanlar endojen veya eksojen kaynaklı olabilmektedir.
2.7.2.1 Eksojen Antioksidanlar
2.7.2.1.1 Vitamin Olan Eksojen Antioksidanlar
E vitamini (α tokoferol): Antioksidan potansiyeli yüksek yağda çözünen bir vitamindir. Temel antioksidan etkisini hücre membranındaki çoklu doymamış yağ asitlerini serbest oksijen radikallerinin oluşturduğu hasara karşı koruyarak göstermektedir. Süperoksit ve hidroksil radikallerini indirgeyerek hücre membran hasarının oluşmasını engellemektedir [73,74].
C vitamini (askorbik asit): Suda çözünen bir vitamindir. Süperoksit ve hidroksil radikalini indirgeyerek antioksidan aktivite göstermektedir. Ayrıca yağda çözünen radikallerin temizlenmesi sonucu ortaya çıkan α tokoferoksili tekrar antioksidan formu olan α tokoferole dönüştürmektedir. C vitamini ferri demiri indirgeyerek ferro demire dönüştürmektedir. Ferro demir fenton reaksiyonu ile hidroksil radikali oluşumuna neden olabildiği için bu etkisi prooksidan özellik göstermektedir. Ancak sadece düşük konsantrasyonlarda prooksidan özellik
gösterdiği, yüksek konsantrasyonlarda güçlü antioksidan olduğu gösterilmiştir [75,76].
A vitamin (β karoten): Yağda çözünen bir vitamindir. Süperoksit radikalini indirgeyerek antioksidan aktivite göstermektedir [77,78].
Folik asit (Vitamin B9): Suda çözünen bir vitamindir. DNA sentezinde kullanılmaktadır. Serbest radikallerin etkilerine karşı antioksidan aktivite göstermektedir. Vitamin E ve Vitamin C’nin antioksidan etkisini artırmaktadır [79].
2.7.2.1.2 İlaç Olarak Kullanılan Eksojen Antioksidanlar [80] • Ksantin oksidaz enzim inhibitörleri (allopürinol)
• Rekombinant SOD
• GSH-Px aktivitesini artıran ilaçlar (NAC) • Nötrofil adezyon inhibitörleri
• Sitokin reseptör blokerleri • Demir şelatörleri
• NADPH oksidazı inhibe eden ilaçlar (adenozin, kalsiyum kanal blokerleri, non steroid antiinflamatuar ilaçlar)
2.7.2.2 Endojen Antioksidanlar
Endojen antioksidanlar enzimatik ve non enzimatik olarak ikiye ayrılmaktadır. 2.7.2.2.1 Endojen Enzimatik Antioksidanlar
Süperoksit dismutaz (SOD): Süperoksit radikalinin hidrojen peroksit ve oksijene dönüşümünü sağlayan enzimdir. Oluşan hidrojen peroksit daha sonra katalaz veya glutatyon
peroksidaz enzimleri ile zararsız formlara dönüştürülmektedir [81].
SOD enziminin üç farklı formu bulunmaktadır. Bakır (Cu), çinko (Zn) ve manganez (Mn) içeren alt tipleri bulunmaktadır. Cu ve Zn içeren formları sitozolde bulunurken Mn içeren formu ekstraselüler olarak boşlukta bulunmaktadır. Bu elementler SOD enziminin aktivitesi için gereklidir. Literatürde İRH sonucunda bu elementlerin replase edilmesi ile İRH’nın azaldığını gösteren çalışmalar mevcuttur [82].
Katalaz (KAT): Yapısında dört tane protein alt birim bulunan bir hemoproteindir. Protein alt birimlerinde NAPH molekülü içermektedir. KAT enzimi büyük oranda peroksizomlarda az bir oranda da sitozolde bulunmaktadır. Hidrojen peroksitin su ve oksijene dönüşümünü sağlamaktadır. Böylece hidrojen peroksitten hidroksil radikalinin oluşumunu önlemektedir [83,84].
Glutatyon peroksidaz (GSH-Px): Yapısında selenyum içeren bu enzim sitozolde bulunmaktadır. Hidrojen peroksitin suya dönüşümünü katalizlemekte ve bu rekasiyon sırasında elektron verici olarak glutatyonu (GSG) kullanmaktadır. Tepkimeye giren redükte glutatyon okside olmaktadır. Okside glutatyon glutayon disülfittir (GSSG). GSH-Px; hücre membranının oksidan hasara karşı korunmasında önemli olan α tokoferolün eksikliğinde, hücre membranını oksidan hasara karşı korumaktadır [85,86].
Glutatyon redüktaz: GSH-Px aktivitesi sonucu okside olmuş glutatyonu NAPH kullanarak redükte haline çeviren enzimdir. Bu enzim aktivitesi için NADPH gerekmektedir. Bu nedenle NADPH oksidaz inihbitörleri İRH’nın azaltılmasında etkili olmaktadır [87].
2.7.2.2.2 Endojen Non Enzimatik Antioksidanlar [37,72] • Albümin • Bilirubin • Sistein • Koenzim Q • Melatonin • Glutatyon • Ürik asit • Serüloplazmin • Transferrin • Ferritin • Hemoglobin • Laktoferrin
Ayrıca literatürde kalsiyum kanal blokerleri, ilioprost, anjiotensin dönüştürücü enzim inhibitörleri, α lipoik asit, melatonin, tramadol kullanımında İRH’nın azaldığını gösteren çalışmalar mevcuttur [88].
2.7.3 Hipotermi
Hipotermi iskemik dokunun metabolizmasını yavaşlatarak ve reperfüzyon döneminde yaralanma bölgesine kan akımını azaltarak İRH’nda azalma sağlamaktadır. Hızlı ve etkin bir hipotermi iskemik kalan dokuda lökosit infiltrasyonunu baskılamakta ve reperfüzyon döneminde ortaya çıkan SOR’nin oluşumunu azaltmaktadır. Birçok hayvan deneyinde iskemik bölgenin soğutulması sonucunda etkilenen dokunun canlılığının arttığı gösterilmiştir [89,90]. 2.7.4 Kompleman Tedavisi
Kompleman sisteminin aktivasyonunun engellenmesinin İRH’nı azalttığı birçok hayvan deneyi çalışmasında gösterilmiştir. Kompleman sistemi klasik yol, lektin bağımlı yol veya alternatif yol ile aktive olmaktadır. İRH’nı azaltmak için bu üç yolun veya herhangi birinin
inhibisyonu kullanılabilmektedir [91].
Rekombinant olarak üretilen kompleman reseptör 1, C3 konvertazı inhibe ederek kompleman sistem aktivasyonunu bloke etmektedir. Benzer şekilde C1 esteraz inhibitörü de kompleman sisteminin aktivasyonunu engellemektedir [92,93].
Kompleman sisteminin aktivasyonunu bloke eden ilaç, enzim veya antikorlar lökosit infitrasyonunu ve lökosit endotel etkileşimini azalttığı için İRH’nı azaltmaktadır. Ancak kompleman sisteminin inhibisyonu ile çalışmalar daha çok hayvan deneyi düzeyindedir. İnsanlarda yapılmış yeterli çalışma yoktur.
2.7.5 Antitrombotik ve Fibrinolitik Tedavi
Heparin antitrombotik etkinliğnin yanısıra P ve E selektin blokajı yapmakta ve bu etkisiyle lökosit endotel etkileşimini engelleyerek anti inflamatuar etki göstermektedir. Aynı zamanda venöz kılcallarda lökosit endotel ve trombosit etkileşimini bloke etmekte ve mikrotrombüs oluşumunu engellemektedir.
Fibrinolitik bir ajan olan doku plazminojen aktivatörü de lökositlerin adezyonunu ve interstisyel alana geçisini bloke ederek doku inflamasyonunda ve ödeminde azalma sağlamaktadır [90].
2.8 N-Asetil Sistein (NAC)
Klinik pratikte çok fazla kullanılan bir ilaç olan NAC, L-sisteinin N-asetillenmiş türevidir. Oral ve parenteral uygulanabilmekte ve büyük oranda karaciğerde metabolize olmaktadır. Atılımının %70’i karaciğer ve akciğer ile olurken %30’u böbrek aracılığı ile olmaktadır. Temel
etki mekanizması endojen glutatyon miktarının artırılmasıdır. Glutatyon hücre
proliferasyonunun sağlanmasında, prostaglandin ve lökotrien sentezi ve regülasyonunda görev almaktadır. Ayrıca endojen antioksidan olarak görev yapmaktadır. Toksisite potansiyeli düşüktür. Nadiren mide bulantısı, kusma ve taşikardi yapabilmektedir [94].
2.8.1 N-Asetil Sisteinin Endikasyonları ve Kullanım Alanları
Klinik uygulamalarda en sık mukolitik olarak kullanılmaktadır. NAC, mukus polimerleri arasındaki disülfidril bağlarını parçalayarak mukusun viskositesini azaltmaktadır. Ayrıca parasetamol intoksikasyonuna bağlı olarak gelişen karaciğer hasarınıın azaltılmasında ve tedavisinde de kullanılmaktadır [95].
Bunların dışında yapılan birçok deneysel çalışmada alzheimer, kokain bağımlılığı, esrar bağımlığı ve patofizyolojisinde glutamat disfonksiyonu olan şizofreni tedavisinde etkili olduğu gösterilmiştir. Ancak etki mekanizması tam olarak aydınlatılamamıştır. Ayrıca doksorubisinin kardiyak toksisitenin ve kemoterapi yan etkilerinin azaltılmasında, edinsel immun yetmezlik sendromunun ve akut respiratuvar distres sendromunun tedavisinde, ağır metal toksisitesinde
2.8.2 N-Asetil Sisteinin Antioksidan Etkisi
NAC’in SOR ile oluşan hücre hasarına karşı koruyucu etkileri bulunmaktadır. Yapısında glutatyon içeren asetillenmiş sülfidril grubu nedeniyle glutatyon prekürsörü olarak görev almaktadır. Glutatyon ise hücre içindeki en önemli antioksidan kaynaklarından birisidir. Hidrojen peroksitin suya dönüştürülmesinde kullanılmaktadır. Ayrıca glutatyonun endoteli koruyucu ve mikrodolaşımı artırıcı etkileri bulunmaktadır. Bu sayede iskemi reperfüzyon hasarının azaltılmasında önemli rol oynamaktadır. Deneysel çalışmalarda NAC’in inflamatuar sitokin ve prostoglandinlerin salınımını engellediği ve inflamasyonun artmasını sağlayan bir transkripsiyon faktörü olan nükleer faktör-κβ (NF- κβ) sentezini azalttığı gösterilmiştir. Ayrıca
NAC, İRH sonrasında oluşan SOR’ni doğrudan bağlayarak da etki göstermektedir [98-100].
2.9 Feniramin Maleat
Histamin H1 reseptörlerini bloke eden bu ilaç birinci kuşak antihistaminikler grubunda
bulunmaktadır. Histamin reseptörlerine selektivitesi düşüktür. Düşük dozlarda sadece H1
reseptörlerini bloke ederken yüksek dozlarda diğer histamin reseptörlerini de bloke etmektedir. Histamin reseptörlerinin bulunduğu santral sinir sitemi, düz kas, kalp, damarlar, solunum sistemi hücreleri ve dış salgı bezlerinde histaminin etkisini bloke etmektedir. Büyük oranda karaciğerde sitokrom p-450 enzim sistemi ile metabolize olmakta ve idrarla atılmaktadır [101].
2.9.1 Feniramin Maleatın Endikasyonları
Kan beyin bariyerini kolay geçebilen bu ilaç santral sinir sisteminde uyanıklığı sürdüren histaminerjik nöronları bloke ederek sedasyon ve uyku hali oluşturmaktadır. Ancak alkol ve hipnosedatif ilaçların yaptığı gibi sedasyona ek öfori ve keyif arttırıcı etkisi bulunmamaktadır. Bu nedenle uyku problemi yaşayan kişilerde kullanılmaktadır. Ayrıca vestibülokohlear sistem üzerine olan etkisi sayesinde taşıt tutması tedavisinde profilaktik olarak kullanılmaktadır.
Parkinson hastalarında ekstrapiramidal belirtileri baskılamak için parenteral
uygulanabilmektedir [102].
Kan transfüzyonu sırasında veya sonrasında görülen ürtiker, kaşıntı ve flushing gibi belirtilerin giderilmesinde kullanılmaktadır. Ayrıca histaminin primer mediatör olarak rol oynadığı lokal ürtiker, anjioödem, böcek sokması tedavisi ile alerjik rinit tedavisinde kullanılmaktadır [101,102].
Sedatif etkisi fazla olduğu için diğer ilaçlarla birlikte genel anestezi öncesi premedikasyonda kullanılabilmektedir. Alerjik reaksiyona neden olma ihitimali fazla olan kemoterapötik ilaçların premedikasyonunda kullanılmaktadır [102].
2.9.2 Feniramin Maleatın Yan Etkileri
En sık görülen yan etkisi santral sinir sistemi depresyonuna bağlı olarak gelişen sedasyon, uyku halidir. Parasempatolitik etkileri nedeniyle ağız kuruluğu, kabızlık, idrar retansiyonu ve taşikardi oluşturabilmektedir. Çok nadir olarak da trombositopeni ve nötropeni yapabilmektedir. Toksisitesinde genellikle santral sinir sistemi beliritilerine bağlı uyku hali, koma ve psikoz görülebilmektedir. Toksisite durumunda semptomatik tedavi uygulanmaktadır [101].
2.9.3 Feniramin Maleatın İskemi Reperfüzyon Hasarına Etkisi
H1 reseptör blokajı sayesinde histaminin oluşturduğu vazodilatasyon ve kapiller
geçirgenlik artşını önlemektedir. İnflamasyonda önemli rolü olan IL-4 ve IL-13’ün bazofillerden salınımını engellemektedir [103,104]. İskemi reperfüzyon sonrası lökositlerin migrasyonu ve diapedezinde önemli rolü olan ICAM-1, VCAM-1 ve P Selektin ekspresyonunu bloke etmektedir [105-107].
İntraselüler kalsiyum konsantrasyonunun artması sonucu H1 resptörleri aracılığı ile
protein kinaz C aktive olarak NOS aktivitesini artırmaktadır. Ardından fosfolipaz A2 aktive
olarak araşidonik asit metabolitlerini oluşturmakta ve membran lipitlerinin parçalanmasına
neden olmaktadır. Ayrıca H1 reseptörleri proinflamatuar transkripsiyon faktörü olan nükleer
faktör-κβ’nin (NF- κβ) sentezini artırmaktadır. H1 resptörlerinin blokajı bu etkileri antagonize
etmektedir [108,109].
Literatürde feniramin maleatın böbrek, beyin, akciğer ve testis dokusundaki İRH’nın azaltılmasındaki olumlu etkilerini gösteren çalışmalar mevcuttur. Ancak iskelet kası İRH’na etkisi ile ilgili çalışma bulunmamaktadır [110,111].
![Şekil 1. Hücre hasarında sitoplazmada artan kalsiyumun kaynakları ve etkileri [16]](https://thumb-eu.123doks.com/thumbv2/9libnet/3030223.2422/18.893.166.628.125.425/sekil-hucre-hasarinda-sitoplazmada-artan-kalsiyumun-kaynaklari-etkileri.webp)