İSTANBUL MEDENİYET
ÜNİVERSİTESİ
LİSANSÜSTÜ EĞİTİM ENSTİTÜSÜ
ÇEVRE VE ENERJİ SİSTEMLERİ MÜHENDİSLİĞİ
AKTİF KARBONUN LAKKAZ ENZİMİYLE
BİYOREJENERASYONU
YÜKSEK LİSANS TEZİ
ZEYNEP MERVE TİRYAKİ
İSTANBUL MEDENİYET
ÜNİVERSİTESİ
LİSANSÜSTÜ EĞİTİM ENSTİTÜSÜ
ÇEVRE VE ENERJİ SİSTEMLERİ MÜHENDİSLİĞİ
AKTİF KARBONUN LAKKAZ ENZİMİYLE
BİYOREJENERASYONU
YÜKSEK LİSANS TEZİ
ZEYNEP MERVE TİRYAKİ
TEZ DANIŞMANI: PROF. DR. ÖZGÜR AKTAŞ
ONAY
İstanbul Medeniyet Üniversitesi, Lisansüstü Eğitim Enstitüsü’nde Yüksek Lisans öğrencisi olan Zeynep Merve TİRYAKİ’nin hazırladığı ve jüri önünde savunduğu “AKTİF KARBONUN LAKKAZ ENZİMİYLE BİYOREJENERASYONU” başlıklı tez başarılı kabul edilmiştir.
JÜRİ ÜYELERİ İMZA
Tez Danışmanı:
Prof. Dr. Özgür AKTAŞ ... İstanbul Medeniyet Üniversitesi
Üyeler:
Prof. Dr. Erkan ŞAHİNKAYA ... İstanbul Medeniyet Üniversitesi
Prof. Dr. Kozet BAKIRCI ... Marmara Üniversitesi
ETİK İLKELERE UYGUNLUK BEYANI
İstanbul Medeniyet Üniversitesi Lisansüstü Eğitim Enstitüsü bünyesinde hazırladığım bu Yüksek Lisans tezinin bizzat tarafımdan ve kendi sözcüklerimle yazılmış orijinal bir çalışma olduğunu ve bu tezde;
1- Çeşitli yazarların çalışmalarından faydalandığımda bu çalışmaların ilgili bölümlerini doğru ve net biçimde göstererek yazarlara açık biçimde atıfta bulunduğumu;
2- Yazdığım metinlerin tamamı ya da sadece bir kısmı, daha önce herhangi bir yerde yayımlanmışsa bunu da açıkça ifade ederek gösterdiğimi;
3- Alıntılanan başkalarına ait tüm verileri (tablo, grafik, şekil vb. de dahil olmak üzere) atıflarla belirttiğimi;
4- Başka yazarların kendi kelimeleriyle alıntıladığım metinlerini kaynak göstererek atıfta bulunduğum gibi, yine başka yazarlara ait olup fakat kendi sözcüklerimle ifade ettiğim hususları da istisnasız olarak kaynak göstererek belirttiğimi,
beyan ve bu etik ilkeleri ihlal etmiş olmam halinde bütün sonuçlarına katlanacağımı kabul ederim.
TEŞEKKÜR
Yüksek lisans çalışmalarım boyunca bilgi, deneyim ve yardımlarını esirgemeyen, eğitimimin başlangıcından sonuna kadar tecrübeleri ile yol gösteren değerli hocam Prof. Dr. Özgür AKTAŞ’a minnet ve şükranlarımı sunarım.
Bu tez çalışmasının planlanması ve yürütülmesi süresinde beni yönlendiren, her an didaktik yaklaşımlarıyla bilimsel doğruları bulma konusunda yol gösteren, her zaman desteklerini hissettiğim Sayın Dr. Arş. Gör. Işık ÇOBAN’a ve Sayın Dr. Arş. Gör. Songül YAŞAR YILDIZ’a minnet ve şükranlarımı sunarım.
Verdikleri katkıdan ötürü çalışma arkadaşlarım Ece İŞLER, Güldenur ÖZTEMUR, Zeynep TAYRAN, Ahmet ŞAHİN, Emir Kasım DEMİR ve Mehmet Emin KAZANCI’ya gönülden teşekkür ederim. Her konuda destekleri ile bana güç veren kuzenim Begüm Asena TİRYAKİ ve sevgili dostum Sevdenur DEMİREL’e şükranlarımı sunarım.
Her zaman yanımda olan maddi ve manevi varlıklarını benden hiç eksik etmeyen bugünlere gelmemi sağlayan, hayat boyu haklarını ödeyemeyeceğim annem Ayten TİRYAKİ’ye, babam Özkan TİRYAKİ’ye, abim İbrahim Safa TİRYAKİ’ye, kardeşim Seyit Musa TİRYAKİ’ye sonsuz teşekkürlerimi sunarım.
Ayrıca çalışmaya maddi desteklerinden dolayı İstanbul Medeniyet Üniversitesi Bilimsel Araştırma Projeleri Destek Birimi’ne (Proje No: F-GAP-2018-1270) ve TÜBİTAK (Proje No:118Y010)’a teşekkürlerimi sunarım.
Ocak, 2020 Zeynep Merve TİRYAKİ
İÇİNDEKİLER
ONAY ... İ ETİK İLKELERE UYGUNLUK BEYANI ... İ TEŞEKKÜR ... İİ İÇİNDEKİLER ... İİİ KISALTMA LİSTESİ ... Vİ TABLO LİSTESİ ... Vİİ ŞEKİL LİSTESİ ... İX ÖZET... Xİİİ 1. GİRİŞ ... 1 2. LİTERATÜR ÖZETİ ... 3 2.1. AKTİF KARBON ... 3
2.1.1. Aktif Karbonun Arıtmada Kullanımı ... 4
2.1.2. Aktif Karbonun Aktivasyonu ... 6
2.1.3. Adsorpsiyon ... 7
2.1.4. Desorpsiyon ... 8
2.2. BİYODEGREDASYON ... 11
2.2.1. Fenolik Bileşiklerin Biyodegredasyonu ... 11
2.2.1.1. Fenol ile Yapılan Gı̇derı̇m Çalışmaları... 13
2.2.1.2. 2-Nitrofenol ile Yapılan Giderim Çalışmaları ... 15
2.2.1.3. Bisfenol-A ile Yapılan Giderim Çalışmaları ... 17
2.2.2. Lakkaz Enzimiyle Fenolik Bileşiklerin Degredasyonu ... 18
2.2.2.1. Enzimatik Reaksiyonlar ... 18
2.2.2.2. Enzimlerin İmmobilizasyonu ... 20
2.2.2.3. Lakkaz Enzimi ... 20
2.3. ENZİMATİK BİYOREJENERASYON ... 27
2.3.1. Biyorejenerasyon ... 27
2.3.2. Ekzoenzimatik Reaksiyonlara Bağlı Biyorejenerasyon ... 28
2.3.3. Biyorejenerasyona etki eden faktörler ... 30
3. YÖNTEM ... 33
3.1. MATERYAL ... 33
3.2. ADSORPSİYON DENEYLERİ ... 35
3.3. DESORPSİYON DENEYLERİ ... 39
3.4. BİYODEGREDASYON DENEYLERİ ... 40
3.5. ENZİMATİK BİYOREJENERASYON DENEYLERİ ... 41
3.6. ANALİZLER ... 43
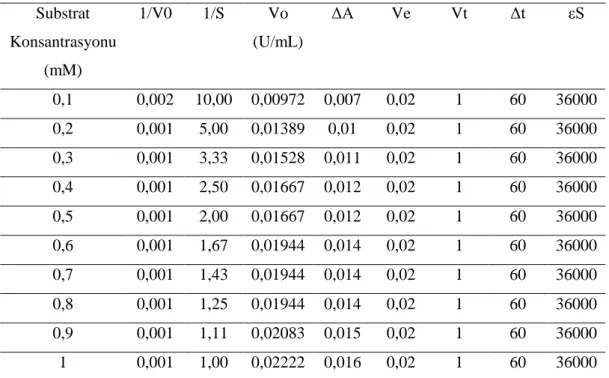
3.6.1. 4-AAP Metodu ... 43
3.6.2. Lakkaz Enziminin Aktivite Tayini ... 47
3.6.3. HPLC Analizleri ... 52
3.6.4. KOİ Analizleri ... 56
3.6.5. İyon Kromotografi Analizleri ... 57
4. BULGULAR VE TARTIŞMA ... 58
4.1. FENOL İLE YAPILAN ÇALIŞMALAR ... 58
4.1.1. Aktif Karbon ile Fenolün Adsorpsiyonu ... 58
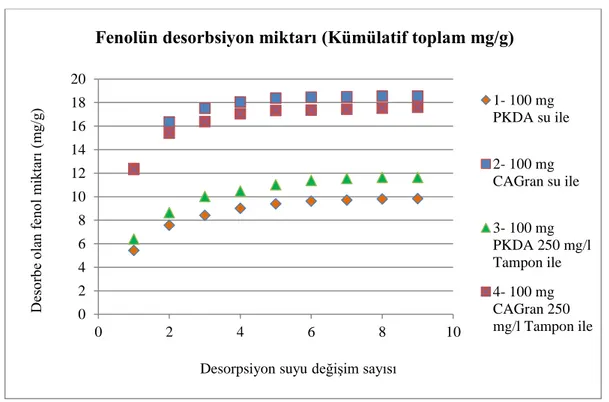
4.1.2. Aktif Karbon ile Fenolün Desorpsiyonu ... 59
4.1.3. Lakkaz ile Fenolün Biyodegredasyonu ... 60
4.1.4. Aktif Karbon ile Fenolün Enzimatik Biyorejenerasyonu ... 65
4.1.5. HPLC’ de Yapılan Ölçümlerin Değerlendirilmesi ... 67
4.2. 2-NİTROFENOL İLE YAPILAN ÇALIŞMALAR ... 70
4.2.1. Aktif Karbon ile 2-Nitrofenolün Adsorpsiyonu ... 70
4.2.2. Aktif Karbon ile 2-Nitrofenolün Desorpsiyonu ... 71
4.2.3. Lakkaz ile 2-Nitrofenolün Biyodegredasyonu ... 72
4.2.4. Aktif Karbon ile 2-Nitrofenolün Enzimatik Biyorejenerasyonu ... 77
4.2.5. HPLC’de Yapılan Ölçümlerin Değerlendirilmesi ... 79
4.2.6. İyon Kromotografi’de Yapılan Ölçümlerin Değerlendirilmesi ... 81
4.3.1. Aktif Karbon ile Bisfenol-A Adsorpsiyonu ... 84
4.3.2. Aktif Karbon ile Bisfenol-A’nın Desorpsiyonu ... 90
4.3.3. Lakkaz ile Bisfenol-A’nın Biyodegredasyonu ... 95
4.3.4. Aktif Karbon ile Bisfenol-A’nın Enzimatik Biyorejenerasyonu ... 101
4.3.5. HPLC’de yapılan ölçümlerin değerlendirilmesi ... 105
5. SONUÇ VE ÖNERİLER ... 106
KAYNAKÇA ... 110
KISALTMA LİSTESİ
2-CP : 2-Clorophenol
2-NF : 2-Nitrofenol 2-NP (2-NF) : 2- Nitrophenol (2-Nitrofenol)
4-AAP : 4-Aminoantipyrine
ABD : Anabilim Dalı
AK : Aktif Karbon
BAK : Biyolojik Aktif Karbon
BP : Bisphenol-A
NOM : Natural Organic Matter GAK : Granüler Aktif Karbon
HMW : High Molecular Weight
HPLC : High Performance Liquid Chromtography KOİ : Kimyasal oksijen ihtiyacı
LMW : Low Molecular Weight
nm : nanometre Ph : Phenol
PACT : Powdered Activated Carbon Treatment PCPs : Penta Chloro Phenol
PZG : Plane of Zero Gradient
RPM : Rounds Per Minute
SOCs : Syntetic Organic Compounds
SRT : Çamur bekleme süresi
TAK (PAC) : Toz Aktif Karbon (Powdered Activated Carbon)
TABLO LİSTESİ
Tablo 1. Çalışmada kullanılan fenolik bileşiklerin özellikleri ... 33
Tablo 2. Kullanılan aktif karbonların özellikleri... 34
Tablo 3. 4-AAP metoduyla belirlenen fenol için standart ölçümü ... 44
Tablo 4. 4-AAP metoduyla belirlenen 2-nitrofenol için standart ölçümü ... 45
Tablo 5. 4-AAP metoduyla belirlenen bisfenol-A için standart ölçümü ... 46
Tablo 6. Lakkaz enzimi aktivite tayin yöntemi ... 49
Tablo 7. Lakkaz enziminin aktivite tayini sonuçları ... 51
Tablo 8. Lakkaz enzimi aktivite tayin sonuçları ... 52
Tablo 9. HPLC’de yapılan fenol için standart ölçümleri ... 53
Tablo 10. HPLC’de yapılan 2-NF için standart ölçümleri ... 54
Tablo 11. HPLC’de yapılan BPA için standart ölçümleri ... 55
Tablo 12. Fenolik bileşikler için hesaplanan KOİ ... 57
Tablo 13. PKDA ve CAgran aktif karbonlarının fenol adsorpsiyon kapasiteleri ... 58
Tablo 14. PKDA ve CAgran aktif karbonlarında 25 °C’ de fenol desorpsiyon ve biyorejenerasyon verimlerinin karşılaştırılması ... 66
Tablo 15. Lakkaz Enzimiyle (1 U/mL) fenolün enzimatik biyorejenerasyon verimlerine sıcaklığın etkisi ... 67
Tablo 16. Lakkaz Enzimiyle (1 U/mL) fenolün enzimatik biyodegredasyon deneyi sırasında alınan numunelerin HPLC’ de ölçülmesi ... 68
Tablo 17. PKDA ve CAgran aktif karbonlarının 2-NF’ü adsorpsiyon kapasiteleri ... 70
Tablo 18. 2-NF’ün pH 7’de 50 °C’de biyorejenerasyon kapasitesi ... 77
Tablo 19. Lakkaz enzimiyle (1 U/mL) 2-nitrofenolün enzimatik biyodegredasyon numunelerinin HPLC’ de ölçülmesi ... 80
Tablo 20. Bisfenol-A adsorpsiyonu için Freundlich izoterm katsayıları ... 86
Tablo 21. Bisfenol-A adsorpsiyonu için Langmuir izoterm katsayıları ve hesaplanan RL değerleri ... 89
Tablo 22. PKDA ve CAgran aktif karbonlarının bisfenol-A adsorpsiyon kapasiteleri ... 90 Tablo 23. PKDA ve CAgran aktif karbonlarının bisfenol-A desorpsiyon kapasiteleri ve yüzdeleri ... 91 Tablo 24. Bisfenol-A desorpsiyonu için elde edilen Freundlich izoterm katsayıları . 93 Tablo 25. Bisfenol-A desorpsiyonu için elde edilen Langmuir izoterm katsayıları .. 95 Tablo 26. 0,2 U/mL Lakkaz Enzimiyle 200 mg/L BPA’nın 25°C’de enzimatik biyorejenerasyon verimleri... 102 Tablo 27. 1 U/mL Enzim Aktivitesi Dozunda Lakkaz Enzimiyle 200 mg/L BPA’nın 25°C’de enzimatik biyorejenerasyon verimleri ... 104 Tablo 28. 1 U/mL enzim aktivitesi dozunda lakkaz enzimiyle 100 mg/L BPA’nın 50°C’de enzimatik biyorejenerasyon verimleri ... 105 Tablo 29. Fenolik bileşiklerin HPLC ölçümlerinde elde edilen piklerinin karşılaştırılması ... 105
ŞEKİL LİSTESİ
Şekil 1. Lakkaz üreten Trametes versicolor mantarı ... 21
Şekil 2. Trametes Versicolor’dan elde edilen lakkazın bakır merkezleri (Riva, 2006). ... 21
Şekil 3. Fungal lakkaz enzimlerinin reaksiyon mekanizmaları (Tuncer, 2010). ... 22
Şekil 4. Lakkazın BPA gideriminde oluşan ürünler (Atacağ Erkurt, 2015) ... 24
Şekil 5. Lakkaz ile BPA degredasyonunda oluşan ürünler (Hongyan vd., 2019) ... 25
Şekil 6. Biyorejenerasyon sırasında kirletici konsantrasyonları (Çeçen ve Aktaş, 2011: 191) ... 28
Şekil 7. 25 °C çalışmalarında kullanılan çalkalama sistemi ... 35
Şekil 8. 25°C’de ve 50°C’de enzimatik degradasyon ve biyorejenerasyon deneylerinde kullanılan çalkalamalı ısıtıcılar ... 40
Şekil 9. 4-AAP metoduyla fenol için konsantrasyon kalibrasyonunun belirlenmesi çalışmaları ... 44
Şekil 10. 4-AAP metoduyla belirlenen Fenol konsantrasyon kalibrasyon eğrisi ... 45
Şekil 11. 4-AAP metoduyla belirlenen 2-NF konsantrasyon kalibrasyon eğrisi ... 46
Şekil 12. 4-AAP metoduyla belirlenen bisfenol-A konsantrasyon kalibrasyon eğrisi ... 47
Şekil 13. 2,2’-Azino-bis(3-etilbenziltiazolin-6-sülfonik asit) diammonyum tuzu (ABTS) ... 48
Şekil 14. Lineweaver-Burk Lineerizasyon Metodu ... 50
Şekil 15. ABST ile lakkaz enziminin aktivite tayininde elde edilen kalibrasyon eğrisi ... 51
Şekil 16. HPLC’de yapılan fenol için konsantrasyon kalibrasyonu grafiği ... 53
Şekil 17. HPLC’de konsantrasyon kalibrasyonunun belirlenmesi için ölçülen 100 mg/L fenol ... 54
Şekil 19. HPLC’de konsantrasyon kalibrasyonunun belirlenmesi için ölçülen 200 mg/L 2-NF ... 55 Şekil 20. HPLC’de yapılan BPA için konsantrasyon kalibrasyonu grafiği ... 56 Şekil 21. HPLC’de konsantrasyon kalibrasyonunun belirlenmesi için ölçülen 100 mg/L BPA ... 56 Şekil 22. Fenolün distile suyla ve tamponlanmış suyla PKDA ve CAgran’dan desorpsiyon kapasiteleri ... 60 Şekil 23. 25 °C 1 U/mL ve 5 U/mL dozlarda Lakkaz enziminin fenol degredasyonu (Ph:7,2) ... 61 Şekil 24. 25 °C pH 7,2’de ve pH 4,7’de 1 U/mL dozda Lakkaz enziminin fenol degredasyonu... 62 Şekil 25. 50°C’de ve pH 7,2’de 1 U/mL dozda Lakkaz enziminin fenol degredasyonu ... 63 Şekil 26. Fenol ile biyodegredasyon çalışmalarında görülen kahverengi çökelti ... 63 Şekil 27. Enzim yokluğunda abiyotik ortamda fenol konsantrasyonu ... 64 Şekil 28. Lakkazın fenolü biyodegredasyonu için ph7 şartlarında yapılan deneyde 1 saatlik giderimin tespiti için alınan numunenin HPLC’de ölçülmesi ... 69 Şekil 29. Lakkazın fenolü biyodegredasyonu için ph7 şartlarında yapılan deneyde 4 saatlik giderimin tespiti için alınan numunenin HPLC’de ölçülmesi ... 69 Şekil 30. 2-NF’nin distile suyla ve tamponlanmış distile suyla PKDA ve CAgran’dan desorpsiyon kapasiteleri ... 72 Şekil 31. 25°C’de ve pH 7 ve pH 5’te 1 U/mL dozda Lakkaz enziminin 2-NF degredasyonu... 74 Şekil 32. 25°C’de ve pH 7 ve pH 5’te 1 U/mL dozda Lakkaz enziminin 350 ve 170 mg/L ... 74 Şekil 33. 25°C’de ve pH 7 ve pH 5’te 1 U/mL dozda Lakkaz enziminin fenol ve 2-NF degredasyonu... 75 Şekil 34. 25 °C’de, pH 6’da enzim yokluğunda abiyotik 2-NF profili ... 75 Şekil 35. Lakkazın 2-NF’yi biyodegredasyonu için ph5 şartlarında yapılan deneyde 1 saatlik giderimin tespiti için alınan numunenin HPLC’de ölçülmesi ... 81 Şekil 36. Lakkazın 2-NF’yi biyodegredasyonu için ph5 şartlarında yapılan deneyde 24 saatlik giderimin tespiti için alınan numunenin HPLC’de ölçülmesi ... 81
Şekil 37. pH5'te 2-NF'nin stok ölçümü 200 mg/L ... 82
Şekil 38. pH7 2-NF'nin stok ölçümü 160 mg/L ... 82
Şekil 39. Lakkazın 2-nitrofenolü biyodegredasyonu için ph7 şartlarında yapılan deneyde 3 saatlik giderimden sonra alınan numunenin İyon Kromotografi’de ölçülmesi ... 83
Şekil 40. Lakkazın 2-nitrofenolü biyodegredasyonu için ph7 şartlarında yapılan deneyde 10 saatlik giderimden sonra alınan numunenin İyon Kromotografi’de ölçülmesi ... 83
Şekil 41. Lakkazın 2-nitrofenolü biyodegredasyonu için ph5 şartlarında yapılan deneyde 3 saatlik giderimden sonra alınan numunenin İyon Kromotografi’de ölçülmesi ... 83
Şekil 42. PKDA için BPA adsorpsiyonu ... 84
Şekil 43. CAgran için BPA adsorpsiyonu ... 85
Şekil 44. PKDA için Freundlich adsorpsiyon izotermi ... 86
Şekil 45. CAgran için Freundlich adsorpsiyon izotermi ... 86
Şekil 46. PKDA için Langmuir adsorpsiyon izotermi ... 88
Şekil 47. CAgran için Langmuir adsorpsiyon izotermi ... 89
Şekil 48. Bisfenol-A’nın distile suyla PKDA’dan kümülatif desorpsiyonu ... 91
Şekil 49. Bisfenol-A’nın distile suyla CAgran’dan kümülatif desorpsiyonu ... 92
Şekil 50. PKDA için Freundlich desorpsiyon izotermi ... 93
Şekil 51. CAgran için Freundlich desorpsiyon izotermi ... 93
Şekil 52. PKDA için Langmuir desorpsiyon izotermi ... 94
Şekil 53. CAgran için Langmuir desorpsiyon izotermi ... 95
Şekil 54. 1 U/mL Lakkaz enzim aktivitesinde farklı BPA konsantrasyonlarında pH 7 ve 25C şartlarında degradasyon ... 96
Şekil 55. 1 U/mL Lakkaz enzim aktivitesinde farklı pH koşullarında (5 ve 7) ve 25C şartlarında BPA (50 mg/L) degradasyonu... 97
Şekil 56. Farklı Lakkaz enzim aktivitesi dozlarında (1 U/mL ve 0,2 U/mL) pH 7 ve 25°C şartlarında BPA (100 mg/L) degradasyonu ... 98
Şekil 57. pH 7’de enzim yokluğunda abiyotik ortamda 25 °C’de BPA konsantrasyonu değişimi ... 99
Şekil 58. Enzim yokluğunda abiyotik ortamda 50 °C’de BPA konsantrasyonu değişimi ... 99 Şekil 59. Lakkaz ile 50°C’de pH 7 ve pH 5 şartlarında BPA degradasyonu ... 100
ÖZET
Aktif karbon, konvansiyonel biyolojik atıksu arıtma tesislerinde yaygın olarak kullanılmaktadır. Aktif karbon biyolojik sistemlerde kombine edildiğinde toksik etkisi olan organik bileşikleri adsorplamaktadır ve mikroorganizmaları bu toksik etkilerden korurken, aktif çamurdaki mikrobiyal topluluk da zamanla bu bileşiklere aklime olmaktadır. Böylece mikroorganizmalar zamanla bileşiklerin parçalanması için uygun enzimleri üretmektedirler. Adsorplanmış bileşiklerin konsantrasyon gradyanıyla veya enzimatik aktivitelerle aktif karbonun gözeneklerinden desorbe olmaları ve sonrasında aklime olmuş mikroorganizmalarla biyolojik olarak ayrıştırılmalarına aktif karbonun biyorejenerasyonu denmektedir. Biyorejenerasyon, aktif karbonun kullanım süresini arttırarak aktif karbon ilavesi veya rejenerasyonuyla ilgili masrafları azaltmaktadır. Literatürdeki çalışmalarda aktif karbonun enzimatik biyorejenerasyonun gerçekleşmesi birçok kez tahmin edilmiştir, fakat doğrudan enzim kullanılmadığı veya işlev gören enzimler tespit edilmediği için enzimatik biyorejenerasyon kesin olarak tespit edilememiştir. Bu çalışmada, hedef bileşik olarak öncelikli mikrokirleticiler arasında bulunan fenol, 2-nitrofenol ve bisfenol-Anın arıtılmasında aktif karbonun enzimatik biyorejenerasyonu incelenmiştir. Bu amaçla kimyasal ve termal olarak aktive edilmiş granüler aktif karbonlar ile adsorpsiyon, abiyotik desorpsiyon ve enzimatik biyorejenerasyon çalışmaları yapılmıştır. Fenolik bileşikleri reaksiyona soktuğu literatürden bilinen lakkaz enzimi enzimatik degredasyon ve biyorejenerasyon çalışmalarında kullanılmıştır. Sonuçlar enzimatik biyorejenerasyon verimleri ile abiyotik desorpsiyon verimleri arasında hedef bileşik ve aktif karbon türüne bağlı olarak değişen değerlerde önemli farklar olduğunu göstermiştir. Bu sonuçlar literatürde ilk defa sadece hücre dışı enzimlerden kaynaklanan biyorejenerasyonu nicel olarak göstermiştir.
Anahtar Kelimeler: aktif karbon, biyorejenerasyon, fenol, 2-nitrofenol, bisfenol-A, lakkaz
ABSTRACT
Activated carbon is widely used in conventional biological wastewater treatment plants. When activated carbon is combined in biological systems, it adsorbs organic compounds that have toxic effects and protects microorganisms from these toxic effects, while the microbial community in the activated sludge acclimates to these compounds in time. Thus, microorganisms produce enzymes suitable for decomposition of these compounds within time. The desorption of the adsorbed compounds due to formation of a concentration gradient or by enzymatic activities through the pores of the activated carbon and subsequent biodegradation by microorganisms that have been considered is called bioregeneration of activated carbon. Bioregeneration reduces the costs associated with the addition or regeneration of activated carbon by increasing the lifetime of the activated carbon.
In the literature, enzymatic bioregeneration of activated carbon has been predicted many times, but enzymatic bioregeneration could not be determined precisely because neither direct enzyme was used nor functional enzymes were detected. In this study, enzymatic bioregeneration of activated carbon in the purification of phenol, 2-nitrophenol and bisphenol-A, which are among the primary micro-pollutants as target compound, was investigated. For this purpose, adsorption, abiotic desorption and enzymatic bioregeneration studies were carried out with chemically and thermally activated granular carbons. The laccase enzyme, which is known from the literature to react with phenolic compounds, has been used in enzymatic degradation and bioregeneration studies. The results showed that there were significant differences between enzymatic bioregeneration yields and abiotic desorption yields with varying values depending on the target compound and the type of activated carbon. This was the first time in the literature that bioregeneration caused only by extracellular enzymes was shown quantitatively.
Keywords: activated carbon, bioregeneration, phenol, 2-nitrophenol, bisphenol-A, laccase
1. GİRİŞ
Aktif karbon, içme suyu ve atıksu arıtımında yoğun olarak kullanılmaktadır. Aktif çamur ve membran biyoreaktör prosesleriyle entegre edilerek özellikle endüstriyel atık suların veya zor ayrışan mikrokirleticilerin arıtılmasında arıtma performanslarını önemli ölçüde arttırmaktadır. Çoğunlukla endüstriyel atıksulardan gelen ve bu atıksularda yüksek konsantrasyonlarda bulunan fenolik bileşiklerin önemli bir bölümü öncelikli kirleticiler arasına girmektedir ve biyolojik proseslerde arıtılamamakta veya toksik etki yapmaktadır. Bu nedenle, çalışmamızda hedef bileşikler olarak biyolojik sistemlerde inhibitör etkileri olan ve yüksek konsantrasyonlarda klasik biyolojik sistemlerde artımı zor olan fenolik bileşikler seçilmiştir. Özellikle fenolün literatürde farklı adsorpsiyon, biyorejerasyon veya enzimatik biyodegradasyon çalışmalarında hedef bileşik olarak kullanılması, literatürle karşılaştırma imkanı vermektedir. Biyolojik ayrıştırılması çok zor olması ve inhibitör özellikleri nedeniyle ikinci bileşik olarak da 2-nitrofenol seçilmiştir. Diğer hedef bileşik olan bisfenol-A endokrin bozucu özelliğiyle öncelikli kirleticiler arasında yer almaktadır. Atık sulardan giderilmesinin ve yüzeysel sularına karışımının önlenmesinin önemli olması nedeniyle bu bileşikle yapılan arıtma çalışmaları son yıllarda sıklık kazanmıştır.
Çalışmanın amacı, termal ve kimyasal olarak aktive edilmiş karbonların sadece hücre-dışı enzimlerden kaynaklanan biyolojik rejenerasyon kapasitesini tespit etmek ve abiyotik desorpsiyondan olan farklarını incelemektir. Bu amaçla fenol, 2-nitrofenol ve bisfenol-A bileşiklerinin adsorplanabilme, desorplanabilme ve enzimatik biyorejenerasyon kapasitelerinin belirlenmesi hedeflenmektedir. Enzimatik biyorejenerasyon verimleri ile abiyotik desorpsiyon verimlerinin karşılaştırılması ve aralarındaki farkın tespit edilmesi konsantrasyon gradyanına ek olarak sadece enzimlerden kaynaklanan biyorejenerasyonu deneysel olarak göstermiş olacaktır. Termal ve kimyasal olarak aktive edilmiş iki farklı aktif karbon kullanılarak aktif
karbonun aktivasyon yönteminden kaynaklanan yüzey özelliklerinin adsorpsiyona, desorpsiyona ve enzimatik biyorejenerasyona etkisinin ortaya konulması da amaçlanmıştır. Ayrıca, çalışmanın sonuçlarının uzun vadede biyolojik arıtma tesislerinde kullanılan aktif karbonun sistem içerisinde iyi derecede biyorejenere edilmesini sağlayarak kullanım ömrünü uzatma, verimini arttırma ve sık rejenerasyon gereksinimini azaltarak maliyetin düşürülmesi hususunda yenilikçi bir yaklaşıma öncülük etmesi de amaçlanmaktadır.
Çalışmada öncelikle aktif karbonların adsorpsiyon ve desorpsiyon kapasiteleri hesaplanmıştır. Daha sonra abiyotik ortamda yalnız lakkaz ile fenolik bileşiklerin teması sağlanarak lakkazın fenolik bileşikleri giderim potansiyeli incelenmiş ve giderim için uygun olan şartlar belirlenmiştir. Son olarak aktif karbona bileşiklerin doyurulması, ardından enzimle rejenerasyonunun sağlanması ve post-adsorpsiyon çalışmalarıyla iki aktif karbon tipi için biyolojik olarak rejenerasyon potansiyeli belirlenmiştir. Ayrıca hedef fenolik bileşiklerin biyodegredasyon mekanizmaları ve polimerizasyonları, aromatik halkalarının kırılması veya degredasyonları sırasında enzimin etkisiyle oluşabilecek ara ürünler araştırılmıştır. Giderimin uygun şekilde izlenmesi ve oluşabilecek ara ürünlerin tahmini için farklı ölçüm metodları denenmiştir.
2. LİTERATÜR ÖZETİ
2.1. AKTİF KARBON
Aktif karbon, şekilsiz, gözenekli yapısından dolayı geniş yüzey alanına sahip olan, adsorpsiyon yoluyla çözünmüş inorganikleri ve organikleri tutan, aktivasyon işleminden geçirilmiş yüksek karbon içeriğine sahip maddedir.
Aktif karbonun hammaddesi olarak kömür, linyit, odun, turba, fındık kabuğu, hindistan cevizi kabuğu kullanılabilir. İç yüzey alanının büyük olmasından dolayı fazla miktarda madde adsorbe edilebilir. Adsorptif yüzey alanı 500-1500 m²/g’ dır. Gözenekli yapısı çözünenleri ve gazları adsorbe eder. Toplam gözenek hacmi 0,7-1,8 cm³/g’ dır.
Toz Aktif Karbon -TAK (Powdered Activated Carbon - PAC) ve Granül Aktif Karbon – GAK (Granular Activated Carbon - GAC) şeklinde bulunur. Üretim prosesi karbonizasyon ve aktivasyon olmak üzere iki aşamadır.
Adsorbsiyon yüzeyindeki gözenekler; Ultramikroporlar <0,7 nm
Mikroporlar <2 nm Mezoporlar 2-50 nm
Makroporlar <50 nm olarak sınıflandırılır.
En fazla adsorpsiyon mikro ve mezoporlarda olmaktadır (Çeçen ve Aktaş, 2011: 13).
Aktif karbon, karbon atomlarının kaynaşmış altıgen halkalarından oluşan mikro kristallerden oluşur. Grafit ile benzer yapıdadır. Mikrokristallerin arasındaki boşluklara gözenek denir. Adsorpsiyonun çoğunun gerçekleştiği aktif karbon mikrogözenekleri 3-35 Å ara katman mesafesine sahip iki paralel kristal düzlemi
arasında iki boyutlu boşluklar biçimindedir. Mikrokristallerin çapı kabaca bir karbon altıgen genişliğinin dokuz katıdır. Adsorpsiyon, mikrokristallerin düzlemsel yüzeylerinde ve fonksiyonel grupların uçlarında oluşur. Mikrokristallerin üzerindeki adsorpsiyon van der Waals kuvvetlerinden kaynaklanır.
Aktif karbon yüzeyi çeşitli oksijen kompleksleri içerir. Bu kompleksler AK yüzeyinde güçlü karboksilik, zayıf karboksilik, fenolik ve karbonil grupları olmak üzere dört çeşittir ve asitli yüzey oksidi formlarında bulunurlar. Ayrıca, halkalı eterler de bulunur. Yüzey oksitlerin varlığı aktif karbonlara polar bir nitelik katar. Yüzey fonksiyonel gruplar çeşitli organik moleküllerin adsorpsiyonunda önemli rol oynamaktadır. Örneğin aromatik bileşikler karbon yüzeylerindeki karbonil oksijenlerini elektron verici - alıcı kompleksleştirme mekanizmasıyla adsorbe eder. Çözeltinin aromatik halkası elektron tutucu olarak hareket ederken, karbonil oksijen elektron verici olarak hareket eder. Adsorpsiyon mikrokristal düzlemlerin yüzey fonksiyonel grupları ile hidrojen bağlanması ve fenolik protonların halkaları ile kompleksleşmesiyle oluşur.
AK’da kalsiyum, sülfat ve fosfat bulunur. Asidik veya bazik fonksiyonel grupları AK yüzey özelliklerini etkiler. AK’ da kül miktarı % 1-12’ dir. Kül; silika, alümina, oksitler, toprak alkali metaller içerir. Su arıtımında TAK kullanılıyorken, kül miktarının yüksek olması reaktör duvarlarına yapışmamayı sağlamasından daha avantajlı olmaktadır (Çeçen ve Aktaş, 2011: 15).
2.1.1. Aktif Karbonun Arıtmada Kullanımı
Aktif karbon, endüstriyel proseslerde, hava filtrelerinde, su ve atıksu arıtımında çeşitli organik ve inorganik türleri tutmak amacıyla yaygın olarak kullanılmaktadır. Özellikle, konvansiyonel biyolojik atık su arıtma tesislerinde giderilemeyen veya biyolojik arıtımı zor olan organik bileşiklerin arıtımı için kullanılır. Aktif karbon, kirleticileri adsorbe eder ve arıtma verimini arttırarak çıkış suyunun deşarj standartlarına uygun olmasına yardımcı olur.
Aktif karbon ayrıca biyolojik sistemlerle kombine edilmek suretiyle de yaygın olarak kullanılmaktadır. Toz aktif karbon takviyeli aktif çamur sistemleri ve biyolojik granüler aktif karbon filtrelerinde, aktif karbon toksik etkisi olan veya biyolojik olarak ayrışmaya dirençli organik bileşikleri adsorplayarak mikroorganizmaları bu toksik etkilerden korurken aynı zamanda bu bileşiklerin sistemde kalma süresini uzatır. Buna bağlı olarak zamanla bu bileşiklere aklime olan mikroorganizmalar da aktif karbona adsorplanmış bileşiklerin konsantrasyon gradyanına bağlı olarak veya enzimatik aktiviteler sonucunda desorbe olması sonrasında biyolojik olarak ayrıştırılmasını sağlar. Bu mekanizmaya aktif karbonun biyorejenerasyonu denilir. Aktif karbon ile kombine edilmiş sistemlerde biyorejenerasyonun gerçekleşmesi, aktif karbonun biyolojik sistem içerisinde kullanım süresini artırarak aktif karbon ilavesi veya aktif karbonun rejenerasyonuyla ilgili masrafları önemli ölçüde azaltır (Çeçen ve Aktaş, 2011).
Toz aktif karbon ilaveli arıtma, aktif çamur prosesine TAK eklenmesi ile adsorpsiyon ve biyodegredasyonun aynı askıda büyüme reaktöründe olmasıdır. Anaerobik arıtmada ve membran biyoreaktörlere TAK eklenmesiyle de kullanılmıştır. SRT ile aynı sürede TAK sistemde tutulur. TAK atık çamurda kalır ve ayırma işlemi gerektirmemektedir. Endüstriyel atıksu, kentsel atıksu ve içme suyu arıtımında kullanılır. Granüler aktif karbon ilaveli arıtmada GAK üzerinde bağlı büyüyen prosesle biyofilm tabakası geliştirilir. Genellikle ozonlamayla birlikte kullanılması daha verimli olur. Yüzey suları, yeraltı suları, kentsel atıksu, içmesuyu ve depolama sahası sızıntı suyu arıtımında kullanılır. Yüzey ve yeraltı suları arıtımında doğal organik maddelerin (NOM) ve sentetik organik bileşiklerin (SOCs) gideriminde etkilidir. Biyolojik Aktif Karbon - BAK (Biological Activated Carbon - BAC), biyolojik prosese GAK eklenmesiyle oluşturulur. Örneğin, Avustralya’ da Gerroa ve Namibia’da Windhoek arıtma tesislerinde, kentsel atıksuların arıtımında fizikokimyasal çöktürme, kum filtrasyonu ve ozonlama aşamasından sonra ayrı olarak BAK filtrasyonunun uygulanır ve sonrasında mikrofiltasyon veya UV dezenfeksiyonu devam eder (Çeçen ve Aktaş, 2011: 141).
TAK ve GAK gelişmiş ayrı biyolojik arıtma sistemleri ve entegre sistemlerde organik kimyasallar, petrokimyasallar, tekstil boyaları, organik mikrokirleticiler, hormonlar, ilaç atıkları, kişisel bakım ürünlerinde bulunan kimyasallar (PCPs), tarım ilaçları gibi maddelerin giderimi için evsel, endüstriyel atıksularda ve sızıntı sularında kullanılmaktadır (Çeçen ve Aktaş, 2011: 30).
2.1.2. Aktif Karbonun Aktivasyonu
Aktif karbonun üretim prosesi karbonizasyon ve sonrasında aktivasyon olmak üzere iki aşamadır.
Karbonizasyon: Katran ve diğer hidrokarbonlar gibi istenmeyen ürünleri kaldırmak üzere kurutulur ve ısıtılır. Piroliz edilir, O2’ siz ortamda 400 – 600°C’ de karbonize edilir. Bu uçucu düşük molekül ağırlıklı fraksiyonu giderir ve malzemenin aktivasyona girmesine neden olur.
Aktivasyon: Aktif karbon hazırlanırken aktivasyonu kimyasal ve termal olarak iki şekilde yapılabilir.
Termal Aktivasyon: 800°C’ nin üstünde buhar veya yüksek sıcaklıklarda CO2gibi oksidasyon gazlarının kullanılmasıyla termal olarak aktivasyon sağlanabilir.
Kimyasal Aktivasyon: Hammaddenin fosforik asit (H3PO4), çinko klorür (ZnCl₂) ve
potasyum hidroksit (KOH) gibi kimyasallarla doyurulmasını içerir. Mikrogözenekler aktivasyon işlemi sırasında oluşur. Hammadde elde edilen aktif karbonun özelliklerinde ve performans üzerinde büyük bir etkiye sahiptir (Çeçen ve Aktaş, 2011: 13).
Aktivasyon şekli adsorpsiyonun kimyasal veya fiziksel olmasını, adsorpsiyon kapasitesini, desorpsiyon verimini (adsorpsiyonun tersinirliğini) ve buna bağlı olarak biyolojik sistemlerde biyorejenerasyonu etkiler. Aktivasyonu kimyasal olarak yapılmış karbonlarda baskın mekanizma fiziksel adsorpsiyondur ve adsorbe etme miktarı termal olarak aktive edilmişlere göre daha azdır. Bununla birlikte fiziksel adsorpsiyonun desorbe olması kolay olur ve tersinirliğinin fazla olduğu görülmüştür. Termal aktivasyon yapılmış karbonlarda kimyasal adsorpsiyon mekanizması baskındır ve tersinirliğinin az olduğu görülmüştür. Termal aktive edilmiş karbonlarda, kimyasal
aktive edilmiş karbonlara göre adsorpsiyon verimi daha yüksek, desorpsiyon verimi daha düşüktür (Aktaş ve Çeçen, 2006a).
Fenolik bileşiklerle yapılan önceki çalışmalar özellikle termal olarak aktive edilmiş karbonlarda biyorejenerasyonun konsantrasyon gradyanına bağlı desorplanabilirlikten daha fazla olduğunu ve hücre dışı enzimlerle (enzimatik) biyorejenerasyonun gerçekleşmiş olabileceğini göstermektedir (Aktaş, 2006). Fenoller için termal aktive edilmiş karbonlar adsorpsiyon kapasitelerinin yüksek olması ve biyorejenerasyon veriminin yüksek olması nedeniyle tercih edilir (Aktaş ve Çeçen, 2006a).
2.1.3. Adsorpsiyon
Adsorpsiyon, bir yüzey veya arayüzdeki maddelerin birikimi veya konsantrasyonudur. Adsorban (adsorbate), adsorbe edilen maddedir. Adsorbsiyon yüzeyi (adsorbent), maddelerin tutunduğu yüzeydir. Adsorpsiyon sıvı-sıvı, gaz-sıvı, sıvı-katı, gaz-katı ara yüzlerde oluşabilir. AK’ da emici faz katıdır. Katı- sıvı faz arasında varsayımsal bir yüzey tabakada iki bölge tanımlanır. Bu tabakalar AK yüzey tabakası ve katı yüzeyin kuvvet alanında kalan akışkan kısmıdır. Sıvı fazın yüzeyinde oluşan yüzey gerilimi sıvı molekülleri arasındaki cazibe kuvvetlerinden kaynaklanır. Yüzey gerilimini düşüren bir çözünen madde yüzeyde yoğunlaşır. Adsorpsiyon kuvvetleri, çözünürlük kuvveti (maddenin hidrofobik ve hidrofilik olması) ve cazibe kuvvetidir (elektrik, van der Waals ve kimyasal kuvvetler). Van der Waals kuvvetleriyle adsorpsiyon genelde fiziksel adsorpsiyondur (phsisorption). 150°C’ nin altında baskındır. Fiziksel olarak adsorbe edilmiş molekül ara yüzey içinde serbestçe dolaşır. Kimyasal adsorpsiyona göre daha az kuvvetle bağlıdır. Kimyasal adsorpsiyonda (chemisorption) elektron değişimi ve kuvvetli kimyasal bağ oluşur, yüksek adsorpsiyon enerjisi mevcuttur (Çeçen ve Aktaş, 2011: 17).
Aktif karbona adsorbe edilebilen organik gruplar, evsel ve endüstriyel atıksularda ve içme suyu kaynaklarında bulunan, böcek ve bitki ilaçları, aromatik çözücüler, klorlu aromatikler, fenolik bileşikler, klorlu çözücüler, yüksek moleküler ağırlığa sahip alifatik asitler (HMW), HMW aminler, aromatik aminler, aromatik asitler, eterler, yağlar, alkoller, yüzey etkin maddeleri, çözünmüş organik boyalardır. Düşük molekül
ağırlıklı bileşikler (LMW), LMW aminleri gibi yüksek polariteye sahip bileşikler, glikoller, bazı eterler, nitrozaminler adsorpsiyon için uygun değildir.
2.1.4. Desorpsiyon
Adsorpsiyonun tam tersi mekanizmasıdır. Doymuş aktif karbonun yüzeyi ile sıvı faz (saf su) arasında oluşacak konsantrasyon gradyanı sayesinde desorpsiyon gerçekleşir. Biyorejenerasyon, konsantrasyon gradyanı ve enzimlerin etkisi ile adsorplanan kirleticilerin suya salınmasıyla sıvı fazda bulunan enzimlerin veya mikroorganizmaların kirleticileri parçalamasıdır. Giderim devam ettikçe konsantrasyon gradyanı oluşur ve kirleticiler sıvı faza geçmeye devam eder. Bu nedenle desorpsiyon, biyorejenerasyonun önemli aşamalarından biridir.
Desorpsiyon ve biyorejenerasyon arasındaki ilişki:
Biyorejenerasyon sadece kolaylıkla desorbe olabilen bileşiklerle sınırlı değildir. Ancak humik maddeler gibi bazı kompleks substratların AK’dan biyorejenerasyonu sınırlı olmaktadır. Çünkü bunların adsorpsiyonu tersinir değildir (irreversable). Bu nedenle biyorejenerasyon adsorpsiyonun tersine çevrilebilirliği ile kontrol edilir. AK desorbe olamayan (nondesorbable) bileşiklerle yüklendiğinde biyorejenere olamaz. Böyle durumlar düzensizlik veya gecikme (irreversibility) olarak adlandırılır.
Tersinir olmayan adsorpsiyona yol açan iki mekanizma vardır. Bunlardan biri adsorban moleküllerin, karbon yüzeyinin aktif bölgeleri üzerindeki özel fonksiyonel gruplara yüksek enerjili kovalent bağlanmasıdır. Yüzey fonksiyonel grup ve adsorbanın tipine bağlı olarak yeterince güçlü bir bağ ve dirençli desorpsiyon oluşturmaktadır. Bu nedenle kimyasal adsorpsiyon geri dönüşümü olmayan adsorpsiyonu açıklamaktadır. Diğer taraftan geri dönüşümlü (reversible) adsorpsiyon, van der Waals kuvvetleri ve zayıf yük transfer komplekslerinin bir sonucudur. Fiziksel adsorpsiyon enerjisi zayıf olduğundan daha tersinirdir. İkinci olasılık fenolik bileşiklerin oksijen varlığında AK üzerinde oksidatif polimerizasyonudur. Bir oksidatif birleştirme reaksiyonu geçiren fenol molekülleri (PhOH) aktif karbon üzerinde geri dönülmez şekilde adsorbe olabilmektedir. Moleküler oksijen, denklemde
gösterildiği fenoksi radikalleri (PhO*) üretmek için fenol molekülleri ile reaksiyona sokularak oksidatif birleştirme reaksiyonlarında bir başlatıcı olarak hareket etmektedir (Çeçen ve Aktaş, 2011: 196).
Fenollerin oksidatif polimerizasyonu:
PhOH + O2 → PhO* (fenoksi radikalleri) + HO2*
PhO- (fenol iyonu) + O2 → PhO* + O2* PhOH + HO2* → PhO* + H2O2
PhOH + H2O2 (hidrojen peroksit) → PhO* + H2O + HO*
PhOH + HO* → PhO* + H2O
Her fenolik molekülden bir hidrojen atomunun çıkarılmasıyla oluşan fenoksi radikalleri (PhO*) oda sıcaklığında diğer fenoksi radikalleri ile doğrudan bağlanmaya katılabilirken, aktif karbon yüzeyi bir katalizör görevi görür. Nitrofenoller haricindeki fenolik bileşiklerin oksidatif bağlanmasının, adsorpsiyonun tersinirliğini azalttığı bulunmuştur (Vicid vd. 1993). Fenoksi grupları adsorbanın oksitlenme olasılığını etkilemektedir. Genel olarak doymamış gruplar (karboksil ve nitro grupları) oksidasyona karşı duyarlılığı azaltırken, doymuş gruplar (metil grupları) oksidasyon olasılığını arttırmaktadır.
Fenolik bileşiklerin adsorpsiyonu tamamen fiziksel tipte değildir. Ayrıca literatürde fenolik olmayan bileşikler için oksidatif polimerizasyon bildirilmemiştir. Örneğin, bir çalışma fenolik bir bileşiğin ve o-cresolün adsorpsiyonunun moleküler oksijen varlığında arttığını gösterirken, fenolik olmayan bir bileşiğin 3-klorobenzoik asitin adsorpsiyonunun oksijen varlığından etkilenmediğini göstermiştir. (Jonge vd., 1996)
Fenoller için aktif karbonun fiziksel formundan (toz veya granüler) çok aktivasyon tipi ve yüzeyin kimyasal özellikleri fenolün adsorbe edilebilirliği ve tersinirliği üzerinde daha önemli rol oynamaktadır (Aktaş ve Çeçen, 2006b). Termal olarak aktive edilmiş karbon yüksek oranda tersinir olmayan adsorpsiyona ve düşük
biyorejenerasyona sahiptir. Bunun sebebi termal olarak aktive edilmiş karbonların oksijene olan ilgisi ve oksijen ile temas ettiğinde yüzey kimyasında olan değişimdir (Çeçen ve Aktaş, 2011: 197). Termal aktivasyon oksijen olmadan gerçekleştirildiği için reaktif bir yüzeye yol açar. Kimyasal aktivasyonda ise aktif karbon tamamen oksitlenmiş aktif bölgeleri olan bir yüzeye sahip olduğundan oksijen ile etkileşimi yüzeyi etkilememektedir (Aktaş, 2006).
Fenolün oksidatif polimerizasyonu, termal olarak aktifleştirilmiş karbonların düşük biyorejenerasyonu için makul bir açıklamadır. Bununla birlikte, termal olarak aktifleştirilmiş karbonların biyorejenerasyon verimleri, enzimatik biyorejenerasyon nedeniyle toplam desorpsiyondan yüksek olabilmektedir (Aktaş, 2006).
2.2. BİYODEGREDASYON
Biyodegredasyon, biyolojik olarak parçalanabilir, yavaş biyolojik parçalanabilir ve adsorbe edilebilir bileşikler için geçerlidir. Yavaş biyodegrede olabilen bileşikler yeterli süre verildiğinde bozunabilirler.
Toz aktif karbonlu (TAK) aktif çamur arıtma (Powdered Activated Carbon Treatment – PACT) sistemlerinde bu bileşikler TAK tarafından adsorbe edilirler ve çamur yaşı süresince biyokütleyle temas halindedirler. AK içermeyen biyolojik arıtma tesislerinde yavaş parçalanabilen organik bileşikler çıkış suyuyla atılırlar. AK’lu sistemlerde kloroform, klorinli benzenler gibi parçalanamayan bileşikler adsorbe edilirler ve bağlı mikroorganizmalar tarafından metabolize edilirler.
AK’a adsorplanan kirleticiler sistemde daha uzun süre kalırlar. Örneğin PACT ‘da çözünmüş organikler SRT ile eşit sürede sistemde kalırlar (10-50 gün). Konvansiyonel sistemlerde HRT ile aynı sürede sistemde kalırlar (6-36 saat). Sonrasında atık çamur ile birlikte sistemden atılırlar. GAK’ da çamur bekleme süresi daha uzun olduğundan bağlı ve askıda mikroorganizmalar aklime olurlar ve biyodegredasyon verimi artar (Aktaş, 2011).
2.2.1. Fenolik Bileşiklerin Biyodegredasyonu
Su Kirliliği Kontrolü yönetmeliğine göre atıksularında en çok fenolik bileşik içeren endüstriler olan petrol, tekstil, kimya ve kömür sanayilerinden çıkan atıksuyun alıcı ortama deşarj standartı 1 mg/L olarak sınırlandırılmıştır. Fenolik bileşiklerin giderim yöntemleri arasında aktif karbona adsorpsiyon yaygın olarak kullanılmaktadır. Aktif karbona adsorpsiyon yöntemi ile fenol için yapılan bir çalışmada yaklaşık %60 oranında giderim verimi sağlanabilmektedir (Aktaş ve Çeçen, 2006).
Fenolik bileşikler, suda yaşayan hayvanlar, bitkiler ve mikroorganizmalar için biyolojik aktivitelerde inhibitör görevi yaparlar. Aynı zamanda akut toksisite etkisiyle tüm canlılar için tehlikeli olabilmektedirler. Fenoller, toksik etkilerinden
yararlanılarak mikrop öldürücülerin, ilaçların, herbisitlerin, boyaların ve asitlerin üretiminde dezenfektan ve antiseptik olarak kullanılırlar. Fenole maruz kalmak karaciğerde, böbrekte, ciltte, sindirim sisteminde, sinir sisteminde ve üst solunum yollarında hasara neden olabilir (Aktaş, 2006). 1 g fenolün insanlarda öldürücü bir etkiye sahip olduğu ve vücutta fenol birikiminin kansere yol açabileceği bilinmektedir. Bu etkilerinden dolayı Amerikan Gıda ve İlaç Dairesi (FDA – Food and Drug Administration) içme sularında fenol konsantrasyonunu 0,001 mg/L olarak sınırlandırmıştır. Türkiye’de ise Tarım ve Orman Bakanlığı tarafından İçme Suyu Temin Edilen Suların Kalitesi ve Arıtılması Hakkında Yönetmelik ile içme sularında fenol konsantrasyonu 0,01 mg/L olarak sınırlandırılmıştır.
Kirletici madde konsantrasyonu açısından zengin olan endüstriyel atıksularda yüksek konsantrasyonlarda fenolik bileşik bulunurlar. İlaç, maden, plastik, kağıt, tekstil, gıda, deri endüstrilerinin atıksuları ve patlayıcı üretimi, reçine üretimi, petrol rafinerileri, kömür işleme tesisleri, demir-çelik fabrikaları atık suları fenol ve fenol türevi bileşikleri yüksek oranda içeren endüstriyel atıksulardır. Su Kirliliği Kontrolü yönetmeliğine göre atıksularında en çok fenolik bileşik içeren endüstriler olan petrol, tekstil, kimya ve kömür sanayilerinden çıkan atıksuyun alıcı ortama deşarj standartı 1 mg/L olarak sınırlandırılmıştır.
Fenollerin gideriminde fiziko-kimyasal, kimyasal ve biyolojik yöntemler kullanılır. Biyolojik yöntemler, az maliyetli ve zararsız ürünler oluşması nedeniyle daha çok tercih edilmektedir. Biyolojik uygulamalarda aktif çamurla fenollere aklime olmuş mikroorganizmaların kullanımı ve membran uygulamaları yaygındır. Biyolojik proseslerde halkasal yapıyı parçalayan karışık bakteri kültürü veya fungus türleri kullanılmaktadır. Halkaya bağlı grupların sayısı, bağlanma yeri, karmaşıklığı giderimi etkileyen faktörler arasındadır. Biyolojik arıtımda bazı fenoller mikroorganizmalar tarafından karbon ve enerji kaynağı olarak kullanılabilmektedir (Deveci, 2014). Fiziksel ve kimyasal giderim yöntemleri olan koagülasyon-flokülasyon, iyon değişimi, adsorpsiyon, klorlama ve membran proseslerinden yaygın olarak kullanılanları aktif karbona adsorpsiyon ve iyon değişim reçineleri uygulamalarıdır.
Fenoller bakteriler tarafından aerobik şartlarda karbondioksite, anaerobik şartlarda karbondioksit ve metana dönüştürülür. Fenollerin biyolojik parçalanması sonucu yapısına, mikroorganizma türüne ve ortama göre benzoat, kateşol, ß- ketoadipat, cis-cis mukonat, asetat, oksalik asit, maleic asit, formik asit ve suksinat gibi farklı çeşitlerde oluşan çok sayıda ara ürün vardır. Aromatik halkalar oksijen kullanılarak orto veya meta oksidasyonu ile açılırlar. Kararlı yapıda olan fenol oksijen ile kararsız yapıda olan kateşole dönüştürülür (Deveci, 2014).
Klorlu aromatik bileşiklerin aerobik olarak degredasyonunda hidroksilasyon ve deoksijenasyon ile kateşollerin oluşması ile başlamaktadır. Oluşan ara ürünlerin aromatik halkası kırılır ve klor uzaklaşır. Son olarak oluşan ürünler minerilize edilir ve böylece parçalanma reaksiyonu tamamlanmaktadır. Klorlu aromatik bileşiklerin parçalanmasında Arthrobacter, Phanerochaete, Pseudomonas, Alcaligenes gibi mikroorganizmaların kullanıldığı bildirilmiştir (Deveci, 2014).
Enzimlerin halkasal yapıları parçalama özelliği beyaz çürükçül fungusların odun çürütme özelliğinden gidilerek tespit edilmiştir. Fenolik bileşiklerin gideriminde enzim kullanılmasının, mikroorganizma kullanılmasına göre bazı avantajları bulunmaktadır. Enzimlerle yapılan çalışmalarda klorlu fenollerin daha az toksik metabolitlere parçalandıkları görülmüştür (Hammel ve Tardone, 1988).
2.2.1.1. Fenol ile Yapılan Gı̇derı̇m Çalışmaları
Sulu çözeltilerde fenolik bileşiklerin giderimi için beyaz çürükçül fungus türü Phanerochaete chrysosporium’un kullanıldığı bir çalışmada fungus alginate, Ca-alginate-polyvinyl alcohol (PVA) ve pektine tutundurulmuştur. Tutunan mikroorganizmaların serbest mikroorganizmalara göre daha yüksek oranda giderim sağladığı tespit edilmiştir. (Wu ve Yu, 2007).
Fenolik bileşiklerin parçalanmasında Phanerochaete chrysosporium, Geotrichum
candidum, Aspergillus niger ve Aspergillus terreus fungal türlerinin
aktivitesinin beyaz çürükçül fungus türü olan Phanerochaete chrysosporium türünde olduğu tespit edilmiştir (Garcia vd., 2000).
Bu iki çalışmadan beyaz çürükçül fungusların fenol türevi bileşikleri oldukça iyi giderebildikleri anlaşılmaktadır.
Pseudomonas putida kültürüyle fenolün parçalanmasının incelendiği bir çalışmada
1000 mg/L fenol için ölçülebilir bir parçalanma ve mikroorganizma gelişimi gözlenmemiştir. Sonrasında ortama glikoz ve maya kültürü eklenerek yüksek konsantrasyonlardaki fenolün farklı karbon kaynakları ilavesiyle degredasyonu incelenmiştir. 750 mg/L konsantrasyonda fenol bulunan ortama 0,2 g/L ile 4 g/L arası değişen derişimlerde maya kültürü eklenmiştir. Maya kültürünün 2 g/L’den az olduğu durumlarda giderim verimi, 2 g/L’den çok olduğu durumlara göre daha iyi olmuştur. Maya kültürünün fazla olmasının enzim aktivitesini engellediği tespit edilmiştir. Glikoz eklenmesinin degredasyon mekanizmasındaki değişimini incelemek için reaktöre glikoz eklenmiştir. 1 g/L’den az konsantrasyonlardaki glikoz fenolün giderimine yardımcı olurken, fazla konsantrasyonların giderimi azalttığı görülmüştür (Loh ve Tan, 2000).
Pseudomonas putida kültürüyle benzen, fenol ve toluen bileşiklerinin
degredasyonunun incelendiği bir çalışmada hedef bileşiğe adapte olmuş kültürün, adapte olmamış olanlara göre daha kısa sürede degrede ettikleri görülmüştür. Yaklaşık 90 mg/L benzen ve tolueni 24 saatte parçalayan kültürün, adaptasyondan sonra 6 saatte parçaladığı gözlemlenmiştir. 50 mg/L fenol 90 saatte giderilebiliyorken, kültürün adaptasyonundan sonra giderim 18 saatte olmuştur. Fenolün gideriminin ve mikroorganizmaların adaptasyonunun benzen ve tolüene göre daha uzun sürede gerçekleştiği görülmüştür (Abuhamed vd., 2004).
P. putida kültürüyle fenol, benzen ve toluen hedef bileşik olarak seçilerek tek ve
karışık derişimde hazırlanan havalandırmalı, kesikli reaktörler kullanılmıştır. Tek bileşik içeren reaktörlerde adaptasyon süreci benzen için 6,5, toluen için 7 ve fenol için 18 saattir. Giderim süreleri benzen için 14, toluen için 13, fenol için 85 saattir. Hedef bileşiklerin karışık bulunduğu reaktörlerde fenol ve tolüenin bulundurğu
reaktörde mikroorganizmalar önce tolüeni, fenol ve benzenin bulunduğu reaktörlerde mikroorganizmalar önce benzeni karbon kaynağı olarak kullanmışlardır. Toluen ve benzenin bulunduğu reaktörde ikisini eş zamanlı kullanmışlardır. Aromatik hidrokarbonların birlikte bulunduğu ortamda mikroorganizmaların fenol ve türevi bileşikleri daha karbon kaynağı olarak en son kullandıkları ve giderim ve adaptasyon süreçlerinin uzun olduğu görülmektedir (Reardon vd., 2000).
2.2.1.2. 2-Nitrofenol ile Yapılan Giderim Çalışmaları
2-NF ve fenolün aktif çamurla gideriminin karşılaştırıldığı bir çalışmada ortamda tek karbon kaynağı olarak fenol bulunduğunda aklime olmamış kültürle giderilebiliyorken, ortamda tek karbon kaynağı olarak 2-NF bulunduğunda 2-NF’nin giderilemediği görülmüştür. Ortamda 2-NF ve fenol birlikte bulunduğunda 2-NF’nin giderimi sağlanmıştır. Ortama fenolün eklenmesiyle değişen şartlar mikrobiyal toplulukta değişime yol açmıştır. Bu şekilde aklimasyonu sağlanmış olan aktif çamur 2-NF’yi giderebilmiştir. Fenolün çoğu 24 saat içinde uzaklaştırılmış, tamamı ise 48 saat içinde uzaklaştırılmıştır. Aklimasyonsuz çamurda fenol 24 saat içinde uzaklaştırılabiliyorken 48 saate çıkmasının sebebi 2-NF’nin ortamda inhibisyon etkisi yapmasıdır. 2 günlük sürenin bitiminde fenol ortamdan tamamen uzaklaştırılmasına rağmen 2-NF için giderim olmamıştır. 2-NF’nin tamamının giderimi 2 günün ardından 6 günlük havalandırmayla sağlanmıştır. Bunun sonucunda mikroorganizmaların öncelikli karbon kaynağı olarak fenolü tercih ettikleri ve 2-NF’nin gideriminin fenole göre daha zor olduğu görülmüştür. Aklimasyon aşamasında üretilen ve fenole özgü olmayan fenol monooksijenaz enzimleri 2-NF’nin biyolojik olarak parçalanmasında rol oynamıştır. Deneyler sonunda ölçülen fenolik olmayan KOİ, fenolün biyodegredasyonu sırasında oluşabilecek yan ürünlerden ve 2-NF’nin çözünür mikrobiyal ürünlerinden (SMP) kaynaklanmaktadır (Aktaş, 2006).
Bu çalışmada, fenolün 2-CP ve 2-NF için iyi bir büyüme substratı olduğu görülmüştür. Biyorejenerasyon çalışmaları da biyodegredasyonda olduğu gibi 2-NF’nin AK’dan çıkarılması ortamda aklime edilmiş çamurun varlığında yani fenol bulunduğunda sağlanmaktadır. Böylece çalışmada, biyorejenerasyona metabolik bir susbstrat varlığının etkisi de ortaya koyulmuştur. Çalışmada elde edilen adsorpsiyon kapasiteleri AK’ a adsorpsiyon rekabetini yani daha kuvvetli bağlanmanın hangi hedef
bileşik için olacağını ortaya koymuştur. Sonuçlar, adsorpsiyon enerjilerinin ve ilk yüklenme koşullarının biyorejenerasyonda etkili olduğunu göstermiştir. Hem desorpsiyon hem de biyolojik bozunma, başlangıç adsorpsiyon koşullarına ve bileşiklerin biyodegrede olabilirliklerine bağlı olarak biyorejenerasyonda hız sınırlayıcı olabilmektedir. Çözücü ekstraksiyonları, desorbe edilemeyen ve biyorejenere edilemeyen önemli miktarda kimyasal olarak adsorbe edilmiş molekül olduğunu göstermiştir (Aktaş, 2006).
Aynı zamanda çalışmanın sonunda AK’da biyorejenerasyonun ekzoenzimlerle olmasının tespitinin gerekliliği ve bu konunun üzerinde çalışılmasının yenilikçi ve pratik çözümler geliştirilmesi açısından önemi vurgulanmaktadır (Aktaş, 2006).
Nitrofenollerle yapılan başka bir çalışmada nitrofenollerin yüksek toksisiteye sahip oldukları ve insan vücudunda aktive olma yetenekleri nedeniyle kansere sebep oldukları ve düşük biyodegredasyonları ile çevrede ciddi kirlilik oluşturdukları rapor edilmiştir (Liu vd., 2011) 2-NF’nin, nitrofenolün diğer izomerik formlarından daha toksik olduğu ve sudaki yüksek çözünürlüğü ve stabilitesi bilinmektedir (Alam vd., 2017).
2-nitrofenolün yapısındaki aromatik halka nedeniyle klorlama ile yapılan giderim işlemlerinde stabil ve zehirli olan klorlu yan ürünler oluşmaktadır (Kupeta vd., 2018). Doğal sularda 2-nitrofenol konsantrasyonu 0.01-2.0 μg/L arasında olmak üzere sınırlandırılmıştır (Huong vd., 2016).
Nitrofenollerin atık sudan giderimi için fotokatalitik degradasyon, fenton işlemi, biyodegradasyon işlemi ve adsorpsiyon dahil olmak üzere çeşitli yöntemler uygulanmaktadır. Bu tekniklerin arasında, basit tasarımı ve kolay kullanımı nedeniyle adsorpsiyon yaygın olarak kullanılmaktadır. Bu adsorpsiyon yöntemlerinde son yıllarda araştırmacılar aktif karbonun yanı sıra tarımsal ürünlerden veya endüstriyel katı atıklardan elde edilen çeşitli düşük maliyetli adsorbanları incelemektedirler (Nguyen vd., 2013).
Yapılan bir çalışmada subkritik su hidrolizi ile işlendikten sonra pirinç kabuklarının ve pirinç samanının adsorban olarak kullanılarak 2-nitrofenolü adsorpsiyon kapasitesi
incelenmiştir. PH 7 için 493 K'de 2-NF’nin başlangıç konsantrasyonu 100 mg/L subkritik su ile hidrolize edilmiş pirinç samanı için 92.97 ± 1.31 mg/g olacak şekilde yüksek adsorpsiyon kapasitesi elde edilmiştir. Bu çalışmada, lignoselülozik biyoetanol tesisinden gelen katı yan ürünler değerlendirilmiştir (Abaide vd., 2019).
2.2.1.3. Bisfenol-A ile Yapılan Giderim Çalışmaları
Son yıllarda giderimi üzerine çalışmaların arttığı diğer fenolik bileşik Bisfenol-A’dır. Endokrin bozucu bileşiklerden olan bisfenol-A, polikarbonat plastikler ve epoksi reçinelerin üretiminde sıklıkla kullanılan endüstriyel bir kimyasaldır. Bisfenol-A’nın kadın üreme sistemi üzerinde endokrin bozucu özelliğinin yanı sıra prostat ve meme kanseri gelişmesi, obesitede artış, erkek spermlerinde azalma, balık ve memelilerde fertilitenin azalması gibi hem insan sağlığı üzerine hem de ekolojik açıdan birçok olumsuz etkisi bilinmektedir (Asadgol vd., 2014). Konvansiyonel aktif çamur tesislerinde bir miktar giderimi sağlansa bile tamamen giderimi oldukça zordur ve yüksek maliyetli ileri kimyasal oksidasyon yöntemlerine ihtiyaç duyulmaktadır (Asadgol vd., 2014). Bu açıdan bisfenol-A ile yapılacak olan enzim ilavesiyle güçlendirilmiş biyolojik veya aktif karbona adsorpsiyon gibi fizikokimyasal yöntemlerle kombine edilmiş biyolojik sistemlerde arıtılabilirlik çalışmaları önem kazanmaktadır.
Nehir suyunda bisfenol A biyodegredasyonuna sahip bakterilerin izolasyonunu ve aerobik ve anaerobik şartlar altında BPA bozunmasının farkını belirlemek için yapılan bir çalışmada üç nehir suyu örneğine eklenen 1 mg/L BPA’nın aerobik koşullar altında hızlı bir şekilde giderildiği görülmüştür. Aerobik koşullarda BPA 2-3 günde yarılanmıştır ve 10 günde tamamen bozunmuştur. Anaerobik şartlarda ise 10 gün boyunca giderim % 10’dan az bir miktarda tespit edilmiştir. Ayrıca, yüksek BPA giderimi (yaklaşık % 90) gösteren iki bakteri türü Pseudomonas sp. ve Pseudomonas
putida’dır (Kang ve Kondo, 2002).
GAK’da endokrin bozucu bileşiklerin adsorpsiyonunun incelendiği bir çalışmada nonilfenol ve bisfenol-A adsorpsiyonu için, kullanılmış karbonlar dahil çeşitli karbonlar denenmiştir. Kömür bazlı saf karbonun, daha büyük gözenek hacmi
nedeniyle nonilfenol ve bisfenol-A'nın adsorpsiyonunda diğer karbonlardan daha etkili olduğu bulunmuştur. Amitrol ile çalışıldığında biyolojik bozulma ile etkili bir şekilde uzaklaştırılsa da, az miktarda adsorbe olmuştur. Tüm karbonlar, karbon türü ve çalışma yılına bakılmaksızın amitrol için düşük adsorpsiyon kapasiteleri göstermiştir. Amitrolü adsorbe etmeye alışkın olan kullanılmış karbonlarda bulunan mikroorganizmalar, amitrolü saf karbondan daha iyi uzaklaştırmıştır. Endokrin bozucu bileşiklerin adsorpsiyon mekanizması hakkında fikir veren bu çalışmada gözenek hacminin adsorpsiyon için önemli olduğu ancak elektriksel etkileşim nedeniyle yüzey yükünün ve pH’nın da önemli olduğu görülmüştür (Choi vd., 2005).
2.2.2. Lakkaz Enzimiyle Fenolik Bileşiklerin Degredasyonu
2.2.2.1. Enzimatik Reaksiyonlar
Enzimler canlı organizmalardaki çoğu kimyasal reaksiyonları kolaylaştıran veya hızlandıran protein yapısındaki biyolojik katalizörlerdir. Enzimlerin protein yapısına apoenzim denir. Bazı enzimler katalizleme reaksiyonları için apoenzime bağlanan metal iyonu olan kofaktöre veya kompleks bir organik bileşik yapısında olan koenzime ihtiyaç duyarlar. Her enzimde apoenzimlerin yapısındaki aminoasit türleri ve dizilişleri farklıdır. Bu nedenle apoenzim enzimin özelliğini belirleyen kısımdır (Sekme, 2011). Enzimler aktif ya da inaktif olma durumlarına göre, faaliyet gösterdikleri yere göre ve katalizledikleri reaksiyonlara göre sınıflandırılmaktadırlar. Aktif halde bulunan enzimler etki ettiği reaksiyonun çeşidine göre ve etki ettikleri maddenin sonuna “az” eki getirilerek adlandırılmaktadır. İnaktif halde bulunanlar substratın sonuna “jen” eki getirilerek adlandırılır. Salgılanıp faaliyet gösterdikleri yere göre sınıflandırmada hücre içindeki enzimlere “hücre içi” ve salgılandıkları yerden başka yerde faaliyet gösterenlere ise “hücre dışı” enzimler denmektedir. Uluslararası Enzim Komisyonu (IEC), 1961 yılında yayımladığı raporda, enzimlerin katalizledikleri tepkimelere göre sınıflandırılmaları için bir numara dizisi oluşturulmuştur. Bu numaralandırma sistemine göre enzim kodu (EC) kısaltmasıyla başlar ve 4 sayı içeren bir kod numarası içerir (EC.1.10.3.2). Numaralardan ilki katalizlenen tepkimenin türünün ait olduğu sınıftır. 2. ve 3. Sayılar alıcı ve verici
gruplarını, 4. sayı ise adlandırılan enzimi belirtmektedir. Bu düzenlemeye göre enzimler, katalizledikleri tepkime türüne göre oksidoredüktazlar, transferazlar, hidrolazlar, liyazlar, ı̇zomerazlar, ligazlar (sentetazlar) olarak 6 gruba ayrılmıştır (Şimşek, 2011).
Enzim substrat kompleksinde substrat molekülü enzimin aktif merkezine bağlanarak enzim-substrat kompleksi olarak adlandırılan kararsız bir bileşik oluşturur. Bu bileşik enzim-ürün kompleksine dönüşür. Son olarak enzim ve ürün ayrılır, serbest kalan enzim tekrar katalizleme reaksiyonlarında kullanılabilir (Şimşek, 2011).
E + S ES EÜ E + Ü
Enzimler canlı hücreler tarafından hücre içi ve hücre dışı enzimler olarak sentezlenirler. Sentezlenen enzimler hücreler canlılığını yitirdiğinde de bir süre aktif kalırlar. Tüm canlı hücrelerde oluşan reaksiyonlar enzimlerle uzak veya yakın bir şekilde ilgilidirler. Protein yapısında olmalarından dolayı proteinler gibi ısı ile denatüre olurlar ve ayrıca ortamın asit veya alkali olmasına hassastırlar.
Enzimler ile katalizlenen reaksiyonlar diğer reaksiyonlara göre 103-108 kat daha hızlı gerçekleşmektedir. Enzim tepkimelerinde substratın tamamı ürüne dönüştürülmektedir, yani yan ürün meydana gelmemektedir. Enzim çok büyük bir moleküldür fakat asıl tepkimenin yürütüldüğü aktif merkez küçük bir bölgedir. Enzim ile substrat birbirlerine elektrostatik, hidrojen ve Van der Waals bağları gibi zayıf bağlarla bağlanır (Şimşek, 2011).
Enzimli reaksiyonların hızları bazı faktörler tarafından etkilenmektedir. Bu faktörler substrat konsantrasyonu, enzim konsantrasyonu, sıcaklık, iyonlar, pH, varsa kofaktör konsantrasyonu, inhibitör veya aktivatör konsantrasyonudur (Sekme, 2011).
Enzimler kağıt, deri, tekstil ve yiyecek-içecek endüstrileri gibi birçok endüstriyel uygulamalarda kullanılmaktadır. Biyolojik atıklar öncelikle hidrolazla işlemden geçirilerek biyolojik polimerleri bir ön arıtma basamağında bozunur. Hidrolazlar, atıkları biyolojik uygulamalara uygun hale getirir ve hayvansal besleme, kültür ortamları, ve biyodizel gibi çeşitli çıkışlara sahip katma değerli şekerlere, proteinlere
ve lipidlere biyo-iletkenlik sağlar. Oksidoredüktazlar ve liyazlar doğadaki çeşitli spesifik kirleticilerin biyotransformasyonu için kullanılır. Oksidoredüktazlar tekstil atık sularının, fenolleri, ilaçları ve hormonları içeren suların çoğunlukla filtrasyon teknolojileri ile bağlantılı olarak detoksifikasyonu için değerlidir. Oksidoredüktazlar bir substrattan diğerine elektron transferini katalize eder. Oksitlenmiş substrat elektron verici olarak adlandırılır (Demarche vd., 2012).
2.2.2.2. Enzimlerin İmmobilizasyonu
Enzimler aktifliklerinin korunmasıyla uzun süre ve tekrar kullanımlarının sağlanması ve istenildiğinde ortamdan uzaklaştırılabilmeleri için katı bir destek maddesine tutturularak immobilize edilmektedirler. Suda çözünmeyen bir destek materyali tutunma veya birbirlerine bağlanma şeklinde immobilize olabilirler. Bu immobilizasyon kimyasal, fiziksel veya her iki şekilde tutunma şeklinde olabilmektedir.
Kimyasal immobilizasyonda yüzey silanlama, yüzeyin fonksiyonel gruplarla kaplanması veya aktifleştirilmesiyle enzimin yüzeye tutunmasıdır ve sağlam kovalent bağlar oluşur. Kovalent bağlanma veya çapraz bağlanma şeklinde olabilmektedir. Fiziksel immobilizasyonda enzimin daha zayıf bağlarla polimer matriksi, membran gibi destek materyallerine tutunmasıdır. Adsorpsiyon ve hapsetme şeklinde olabilmektedir.
İmmobilizasyon için kullanılan destek materyalinin yüzeyinin hidrofilik, hidrofobik yapısı, fonsiyonel grupları, gözenekliliği gibi özellikleri enzimlerin aktivitesini belirlemektedir. İmmobilizasyon ile yeni bir ortam oluşturulması enzimin Km (Michealis sabiti – enzimin affinitesi) değerini, aktivitesini, aktif bölgesini ve optimum pH ve sıcaklık değerlerini değiştirebilir (Şimşek, 2011).
2.2.2.3. Lakkaz Enzimi
Lakkaz, EC 1.10.3.2 kodlu, her molekülü 4 bakır iyonu taşıyan bir oksidoredüktaz enzimidir. Aromatik ve aromatik olmayan farklı bileşiklerin kataliz reaksiyonlarında oksidasyon için moleküler oksijeni kullanmaktadır. Fenolik bileşiklerin oksidasyonu oksijenin suya indirgenmesiyle sağlanır.
Lakkaz enzimi bakteriler, böcekler, yüksek yapılı bitkiler ve beyaz çürükçül mantarlardan elde edilebilmektedir. Bu mantarlardan bazıları Coriolopsis Gallica,
Trametes versicolor, Trametes hirsuta, Corilous hirsutus, Pyricularia oryzae’ dir.
Mantarlardan elde edilen lakkazlar izoenzimlerin kompleksler oluşturarak oligomerize olmalarından meydana gelmektedir. Monomerlerin moleküler kütleleri 50-110 kDa arasındadır. Lakkaz enzimlerinin protein kısmına bağlanmış karbonhidrat kısmı enzimin yüksek kararlılık göstermesini sağlamaktadır (Tuncer, 2010).
Şekil 1. Lakkaz üreten Trametes versicolor mantarı
Şekil 2. Trametes Versicolor’dan elde edilen lakkazın bakır merkezleri (Riva, 2006).
Lakkazın yapısındaki bakır iyonlarından biri Tip1 (mavi bölge) bölgesine bağlıdır ve diğer 3 bakır iyonu Tip2 ve Tip3 bölgelerinin oluşturduğu trinuklear kümeye bağlıdır (Tuncer, 2010). Lakkazda bulunan farklı bakır merkezleri, indirgenmiş bir substrattan
aldıkları elektronları, toksik ara-ürünlerin oluşmasına yol açmadan, atmosferik moleküler oksijene aktarırlar. Bu reaksiyon Tip1 bakır tarafından katalizlenen substratın dört monoelektronik oksidasyonu ile olur. Daha sonra elektronlar moleküler oksijenin indirgendiği ve suyun bırakıldığı trinuklear kümeye aktarılırlar (Şekil 3) (Tuncer, 2010).
Şekil 3. Fungal lakkaz enzimlerinin reaksiyon mekanizmaları (Tuncer, 2010).
Tip1 bakır ile dört-basamakta her defasında 1 elektron transferiyle substrat molekülleri oksitlenir. Lakkaz molekülünün yeniden oksidasyonu (yükseltgenmesi) iki basamaklı olarak Tip3 bakır çifti tarafından dört elektronun, moleküler oksijene transferi ile sağlanır. Substratların oksidasyonu reaktif radikallerin oluşmasına yol açmaktadır. Oluşan reaktif radikaller ise enzimatik olmayan reaksiyonlar ile polimerlerin parçalanması, aromatik halkaların kırılması ve monomerlerin çapraz-bağlanması reaksiyonlarına katılırlar (Tuncer, 2010).
Polimerlerin parçalanması düşük moleküler kütleli redoks aracıları bileşikler ile katalizlenmektedir. Bu aracı moleküllerin lakkaz tarafından aktivasyonu gerçekleştirildikten sonra, aktif enzim bölgesinden polimerlerin hedef bölgelerine diffüzlenirler.
Monomerlerin oksidasyonuyla oluşan radikaller enzimatik olmayan eşleşme reaksiyonlarına katılırlar. Monomerlerin çapraz-bağlanması için pirogallol, p-kresol,
guaikol, 2,6- dimetoksifenol gibi fenolik bileşiklerin ve aromatik anilinlerin enzimatik oksidasyonu ile radikaller oluşur. Bu radikaller birbiri ile tepkimeye girerek C-C, C-N ve C-O bağları aracılığıyla kovalent olarak bağlanırlar ve dimerleri, oligomerleri veya polimerleri oluştururlar. Oluşan son ürünün yapısı, ara ürünlerin reaktivitesi ve reaksiyonun gerçekleştiği ortamın pH’sı ile belirlenir (Tuncer, 2010).
2.2.2.4. Lakkaz Enzimiyle Fenolik Bileşiklerin Giderim Çalışmaları
Lakkaz Enzimi ilk olarak japon lake ağacı Rhus vernicifera’ da belirlenmiştir (Yoshida, 1883). Bakteriyel lakkazın kristal yapısı Enguita ve arkadaşları (2003) tarafından aydınlatılmştır. Lakkaz enzimi ile en fazla çalışma funguslarda gerçekleştirilmiştir. Fungal enzimlerin lignin parçalanmasına katıldıkları kabul edilmektedir ancak, detoksifikasyon prosesi, morfojenez, patojenisite ve başka fonksiyonlarının da olabileceği bilinmektedir. Lakkazlar, toprak ve suların biyolojik remediasyonu, gıda ve tekstil endüstrisindeki uygulamalar ve kimyasal sentez reaksiyonları gibi aşamalı uygulamalarda, ekolojik önemleri nedeniyle giderek artan bir ilgiye sahiptirler (Otto ve Schlosser, 2014). Beyaz çürükçül funguslar gibi önemli lakkaz üretici mikroorganizmalar farklı kirleticilerin biyolojik giderimi için kullanılmaktadır (Asadgol vd., 2014). Uhnakova vd. (2009) bromlu fenollerin
Trametes versicolor fungusu ve ürettiği lakkaz enzimiyle biyodegredasyonunu
araştırmışlardır. Zhang vd. (2008) 2,4-diklorofenol (2,4-DCP), 4-klorofenol ve 2-klorofenolün, Coriolus versicolor fungusunun ürettiği lakkaz enzimiyle degredasyonu üzerine çalışmışlardır.
Funalia trogii’nin endokrin bozucu bileşik olan bisfenol A'nın giderilmesi için
kullanıldığı bir çalışmada Trametes versicolor'dan elde edilen ticari saf lakkazın biyodegradasyon verimlilikleri, F. trogii'nin ham ekstraktı ve T. versicolor'dan elde edilen saf lakkazla karışımı ve termal olarak inaktive edilmiş F. trogii ham ekstraktı karşılaştırılmıştır. BPA hem ham ekstrakt hem de karışım ile tamamen giderilmiştir. BPA konsantrasyonu HPLC ile analiz edilmiştir ve BPA metabolitleri GC-MS ile karakterize edilmiştir. Analiz sonuçlarına göre 2 saatlik inkübasyon süresinden sonra BPA tamamen giderilmiştir. Degredasyon ürünleri olarak nonane, 5- (2-metilpropil) ve 4-etil-2-metoksi-fenol oluşmuştur ve T. versicolor'dan elde edilen saf lakkazda ve
F. trogii'nin ham ekstraktında benzer ürünler oluşmuştur (Atacag Erkurt, 2015) (Şekil
4).
Şekil 4. Lakkazın BPA gideriminde oluşan ürünler (Atacağ Erkurt, 2015)
BPA'nın gideriminin ham lakkaz çözeltisi kullanılarak incelendiği bir çalışmada 3 ve 6 saat reaksiyondan sonra dönüşüm ürünleri, gaz kromatografısi ile saptanmıştır. Analiz sonuçları, lakkaz ve BPA arasındaki reaksiyonun kendiliğinden olduğunu ve 24 saatteki bozulma oranının % 88.76'ya ulaştığını göstermiştir. Lakkaz tarafından katalize edilen BPA ara ürünleri arasında etilbenzen, p-ksilen ve sikloheksanon 1-metil-4-izopropenil-2-sikloheksenol bulunmuştur. Bu bulgu, T. versicolor'dan ham