BİYOSENSÖRLER GELİŞTİRİLMESİ BAHTİYAR SARIBOĞA
DOKTORA TEZİ KİMYA ANABİLİMDALI
FEN BİLİMLERİ ENSTİTÜSÜ
FENİLKETONÜRİ (PKU) TEŞHİSİNDE POTANSİYOMETRİK BİYOSENSÖRLER GELİŞTİRİLMESİ
BAHTİYAR SARIBOĞA
DOKTORA TEZİ
KİMYA ANABİLİMDALI
PROF. DR. HALİL KORKMAZ
FEN BİLİMLERİ ENSTİTÜSÜ
Bu çalışma jürimiz tarafından 16.09.2008 tarihinde yapılan sınav ile Kimya Anabilim Dalı’nda DOKTORA tezi olarak kabul edilmiştir.
Başkan : Prof. Dr. İrfan KÜFREVİOĞLU
Üye : Prof. Dr. Halil KORKMAZ ( Danışman )
Üye : Prof. Dr. İbrahim IŞILDAK
Üye : Prof. Dr. Abdülkerim BEDİR
Üye : Doç. Dr. Nihat TINKILIÇ
ONAY :
Yukarıdaki imzaların adı geçen öğretim üyelerine ait olduğunu onaylarım. .../.../2008
Prof. Dr. Hasan GÜMÜŞ Fen Bilimleri Enstitüsü Müdürü
ÖZET
Fenilketonüri (PKU), yenidoğan bebeklerde fenilalanin hidroksilaz enzim yetersizliğinden kaynaklanan ve tedavi edilebilir zeka geriliklerinin en önemli nedeni olan bir hastalıktır. Fenilketonuri hastalığının teşhisi için, plazma’da fenilalanin miktarını tayin eden potansiyometrik biyosensörlerin ve ölçüm yöntemlerinin geliştirilmesini amaçlamaktadır. Geliştirilen potansiyometrik enzim biyosensörler, yeni bir teknoloji kullanılarak ilk kez laboratuarlarımızda geliştirilen mikro büyüklükte bütünüyle katı-hal (kompozit) NH4+ seçici elektrotların yüzeyine, fenilalanin dehidrogenaz ve fenilalanin amonyak liyaz gibi, enzimlerin immobilizasyonu ile hazırlandı. Fenilalanin dehidrogenaz enzimi ile hazırlanan biyosensör çalışmadı. Fenilalanin amonyak liyaz enzimi ile hazırlanan biyosensörün seçiciliği, tayin limiti, kullanım ömrü, cevap zamanı ve tekrarlanabilirliği gibi potansiyometrik performansını ortaya koyan özellikler, durgun ve hareketli ortamlarda (akış-enjeksiyon sistemi gibi) belirlendi. Performansları belirlenen biyosensörler, fenilalanin ilavesi yapılmış fosfat tampon çözeltilerine ve Ondokuz Mayıs Üniversitesi Tıp Fakültesi Hastanesinden temin edilen gerçek plazma örneklerine fenilalanin tayini için uygulandı. Elde edilen veriler Ondokuz Mayıs Üniversitesi Tıp Fakültesi merkez laboratuarında uygulanmakta olan yüksek basınç sıvı kromatografi (HPLC) yöntemiyle elde edilen değerlerle karşılaştırmalı olarak incelendi. Verilerin merkez laboratuvarındaki ölçüm değerleriyle uyum içerisinde olduğu görüldü. Bütün bu sonuçlar geliştirilen fenilalanin biyosensör ve buna dayalı ölçüm yöntemin fenilketonüri hastalığının rutin tayininde etkin bir şekilde kullanılabileceğini göstermektedir.
Anahtar Sözcükler: Fenilketonüri hastalığı, Mikro büyüklükte kompozit NH4+ elektrot, Mikro büyüklükte fenilalanin biyosensör, Fenilalanin dehidrogenaz, Fenilalanin amonyak liyaz
ABSTRACT
Phenylketonuria (PKU) is arised by deficiency of phenylalanine hydroxilase enzyme of newborn babies and assumed to be the main reason of treatable IQ defficiencies. The development of potentiometric phenylalanine biosensor that could be applied for the measurement of phenylalanine levels in the blood as an indicator. Potentiometric biosensors developed in respect to the above aim were prepared by immobilization of phenylalanine dehydrogenase and phenylalanine ammonia lyase enzymes onto the surface of micro-sized all solid-state (composite) NH4+ selective electrode membrane that are invented in our lab with a novel sensor fabrication technology. Phenylalanine biosensor prepared with phenylalanine dehydrogenase didn’t work. Potentiometric performance characteristics of the developed micro sized biosensors prepared with phenylalanin ammonia lyase such as selectivity, sensitivity, detection limit, response time, life time and reproducibility were examined under static and dynamic conditions e.g. flow injection analysis by using a computer-controlled potentiometric measuring system. Then the sensors were evaluated for the determination of phenylalanine via applying standard phenylalanine solutions and real plazma samples provided from medical Hospital of Ondokuz Mayıs University. The obtained data from the real plazma samples was comperatively examined with the data received by the HPLC method that has been in use for long time in the hospital. The data obtained from the micro-sized biosensors was in agreement with the data obtained from the HPLC method. Overall the results indicate that the phenylalanine biosensor and the method of the measurement developed here could be efficiently applied for the rutin analysis of the phenylketonuria disease.
Keywords: Phenylketonuria disease, Micro-sized composite NH4+ electrode, Micro-sized phenylalanine biosensor, Phenylalanine dehydrogenase, Phenylalanine ammonia lyase.
TEŞEKKÜR
Çalışmalarım süresince fikir ve tecrübelerini paylaşan, bilgilerimizde temelleri atan çok değerli hocam Prof. Dr. Halil KORKMAZ’a sonsuz teşekkürlerimi sunarım.
Çalışmalarım boyunca her konuda yardımlarını gördüğüm, bilgi ve tecrübelerinden yararlandığım ve bilimsel hayatı sevdiren çok değerli hocam Sayın Prof. Dr. İbrahim IŞILDAK’a şükran dolu teşekkürlerimi sunarım.
Yardımlarını gördüğüm, bilgi ve tecrübelerinden yararlandığım Tıp Fakültesi Biyokimya Bölümünden değerli hocam Sayın Prof. Dr. Abdülkerim BEDİR’e çok teşekkür ederim.
Çalışmaların buraya kadar gelmesinde büyük maddi katkısı olan TÜBİTAK (Proje no: 105S123)’a çok teşekkür ederim.
Yakın ilgi ve yardımlarını esirgemeyen Sayın Doç. Dr. Müberra ANDAÇ’a Sayın Doç. Dr. Adem ASAN, Sayın Doç. Dr. Nihat TINKILIÇ’a ve tecrübelerini bizlerle paylaşan, tasarladığı sistemlerle laboratuarlardaki çalışmalarımıza teknik destek ve aynı zamanda kişiliğiyle örnek olan Sayın Doç. Dr. Ömer ANDAÇ’a çok teşekkür ederim.
Çalışmalarım sırasında onların zamanlarınından almama rağmen büyük fedakarlıklar gösteren ihtiyaç duyduğum her an yanımda ve bana destek olan, meslektaşım ve çok değerli hayat arkadaşım Sevgili Nezaket SARIBOĞA’ya ve hayatımıza mutluluk, sevinç ve anlam katan biricik yavrumuz Sevgili Canan SARIBOĞA’ya çok teşekkür ederim.
Laboratuvar ortamını beraber paylaştığım ve bu ortamı güzelleştiren arkadaşlarım; Sayın Osman ÇUBUK’a, Murat YOLCU’ya, Tülin ŞAKA, Fatih ÇOLDUR’a, Arş. Gör. Sema KALKAN, Derya BAL, Ebru GÜRSOY, Emel EREN, Deniz KARSLI SEMİZ, Arş. Gör. Rukiye DUMANLI ve Cihan TOPÇU’ya teşekkür ederim. Ayrıca tez yazımı sırasında yaptığı çizimlerle bana destek olan sevgili arkadaşım Sayın Hasan SARAL’a teşekkürlerimi bir borç bilirim.
Bilgi, tecrübe ve yardımlarını gördüğüm Kimya Bölümündeki çok değerli hocalarıma ve arkadaşlarıma, sağladıkları malzemeler ve teknik desteklerinden dolayı Uzman Kazım CANBOLAT ve Uzman Mustafa AL’a teşekkür ederim.
Bu günlere gelmemi sağlayan, maddi ve manevi desteklerini esirgemeyen Sevgili Annem Gülnaz SARIBOĞA’ya ve Babam Ziya SARIBOĞA’ya sonsuz minnertarlık ve teşekkürlerimi sunarım. Ayrıca sevgili kardeşim Hakan TÜRKCAN’a teşekkürlerimi sunarım.
İÇİNDEKİLER
SİMGE VE KISALTMALAR LİSTESİ ...1
ŞEKİLLER LİSTESİ...2
ÇİZELGELER LİSTESİ...6
1. GİRİŞ...7
2. GENEL BİLGİLER...7
2.1. Amino Asit Metabolizmasından Kaynaklanan Hastalıklar...7
2.2. Fenilketonüri (PKU) ...14
2.2.1. Oluşumu ...14
2.2.2 Genetik bilgi...18
2.2.3 Tanı...20
2.2.4. Tedavisi...23
2.3. İyon Seçici Elektrotlar ...25
2.3.1. İyon Seçici Elektrotların Biyomedikal Uygulamaları ...30
2.3.2 İyon-Seçici Elektrotların Performansına Etki Eden Faktörler ...33
2.3.2.1. Cevap Zamanı...33
2.3.2.2. Tayin Limiti...34
2.3.2.3. Seçicilik...35
2.4. Enzimlerin Elektrot Yüzeylerine İmmobilizasyonu ...36
2.4.1 Enzim İmmobilizasyon Metotları...37
2.4.1.1 Fiziksel Metodlar ...42 2.4.1.2. Adsorbsiyon...42 2.4.1.2 Dış Membrana Tutuklama...43 2.4.1.3. Tutuklama...44 2.4.1.4. Elektropolimerizasyon ...44 2.4.1.5 Elektrot Modifikasyonu ...45 2.4.1.2. Kimyasal Metotlar ...46 2.4.1.2.1 Kovalent Bağlama...46 2.4.1.2.2 Çapraz Bağlama...48
2.4.1.2.2.1 Glutaraldehid İle Çapraz Bağlama...50
2.4.1.2.2.2 Bifonksiyonel Reaktiflerle Çapraz Bağlama ...50
2.4.1.2.4. Tek Tabaka İçerisine Enzim Yerleştirme...52
2.5 Biyosensör...52
2.5.1 Biyo-algılayıcılar (biyoreseptör) ...56
2.5.2 Sinyal Çevirici (Transducer) ...56
2.5.3 Potansiyometrik Enzim Biyosensörler...58
2.5.3.1 pH Biyosensörler ...58 2.5 3.1.1. Penisilin...58 2.5.3.1.2. Glukoz ...60 2.5.3.1.3. Üre...60 2.5.3.2. Amonyum Biyosensörler ...60 2.5.3.2.1 L-Amino Asit...60 2.5.3.2.2 Glutamin...61 2.5.3.2.3 Aspartam ...61 2.5.3.2.4 Üre...62 2.5.3.3. Amonyak Biyosensörler...62 2.5.3.3.1 Kreatinin...62 2.5.3.3.2 Adenozin ...62 2.5.3.3.3 Aspartam ...63 2.5.3.3.4 Üre...63 2.5.3.3.5 Glutamin...63 2.5.3.4. Karbondioksit Biyosensörler...64 2.5.3.4.1 Okzalat ...64 2.5.3.4.2 Tirozin...64 2.5.3.4.3 Üre...65 2.5.3.4.4 Digoksin ...65 2.5.3.4.5 Malat ...65 2.5.3.5 İyot Biyosensör...65 2.5.3.5.1 Glukoz ...66 2.5.3.5.2 Fenilalanin ...66 2.5.3.5.3 Östradiol...66 2.5.3.6 Gümüş-Sülfit Biyosensör...67 2.5.3.6.1. Sistein...67 3. MATERYAL VE YÖNTEMLER...69
3.1. Kimyasal Maddeler...69
3.2. Kullanılan Cihazlar ve Yöntemler...69
3.2.1 Cihazlar ...69
3.2.2. Sensör Hazırlama Yöntemleri ...73
3.2.2.1. Mikro Kompozit Membran Amonyum Sensörlerin Hazırlanması...73
3.2.2.3. Fenilalanin Biyosensör Hazırlanması ...75
4. BULGULAR ...77
4.1. Mikro Kompozit Amonyum Elektrot İçin Potansiyometrik Bulgular...77
4.2. Fenilalanin Biyosensörün Potansiyometrik Davranışı ...82
4.2.1. Fenilalanin Dehidrogenaz Enzimi İle Hazırlanan Fenilalanin Biyosensör...83
4.2.2. Fenilalanin Amonyak Liyaz Enzimi İle Hazırlanan Fenilalanin Biyosensör ...85
4.3. Plazma Analizleri ...89
4.3.1. HPLC İle Yapılan Analizler...90
4.3.2. Geliştirilen Fenilalanin Biyosensör İle Yapılan Analizler...100
4.3.2.1. Durgun Ortam Ölçümleri ...100
4.3.2.2. Akış Enjeksiyon Analiz Çalışmaları...105
5. TARTIŞMA ...110
6. SONUÇ VE ÖNERİLER...111
SİMGE VE KISALTMALAR LİSTESİ
BH4 Tetrahidrobiyopterin
DNA Deoksiribonükleik asit DOS Dioktil sebatat
EDTA Etilen diamin tetra asetik asit
EM Emission
EX Exatiation PKU Fenilketonüri
HPLC Yüksek basınçlı sıvı kromatografisi
IUPAC International Union of Pure and Applied Chemistry IFCC International Federation of Clinical Chemistry İSE İyon seçici elektrot
KTpClB Potasyumtetrakis fenilkloroborat LAO L-Amino asit oksidaz
NADH Nikotinamid dinükleotit NH4Cl Amonyum klorür
NPOE Nitrofeniloktil eter PHE Fenilalanin PO Peroksidaz PVC Polivinilklorür TDAMCl Tetradodesilamonyumklorür THF Tetrahidrofuran TRY Tirozin
ŞEKİLLER LİSTESİ
Şekil 2.1. Aminoasit katabolizmasına genel bir bakış...8
Şekil 2.2. Üre çevrimi ile sitrik asit çevriminin bağlantısı ...9
Şekil 2.3. Amino asitlerin sitrik asit çevrimine giriş basamakları ...10
Şekil 2.4. Bazı amino asitlerin asetil CoA ya dönüşümü ...11
Şekil 2.5. Aminoasit metabolizmasından kaynaklanan bazı hastalıkları ...13
Şekil 2.6. Fenilalaninin tirozine dönüşümü ...14
Şekil 2.7. Fenilalanin hidroksilaz enziminin 3 boyutlu görüntüsü ...15
Şekil 2.8. PKU hastalığı sonucu fenilalanin türevlerinin oluşum reaksiyonları...16
Şekil 2.9 PKU’nin bireylere kalıtımsal geçişi gözlenmektedir...19
Şekil 2.10. Fenilalanin normal ve hastalık durumunda izlediği metabolik yol ...23
Şekil 2.11. İyon seçici elektrotların kullanımını şematik gösterimi...26
Şekil 2.12. İyon seçici elektrotlarda kullanılan bazı iyonofor maddelerin kimyasal yapıları...30
Şekil 2.13. IUPAC’a göre cevap zamanı...33
Şekil 2.14. IUPAC’a göre tayin limiti...34
Şekil 2.15. Seçicilik katsayısının kalibrasyon grafiği ile gösterimi...36
Şekil 2.16. Biyomoleküllerin immobilizasyon metotları. ...39
Şekil 2.17. Dış membran tutuklama yöntemiyle hazırlanmış ticari glukoz sensör...43
Şekil 2.18. Pirolün elektrokimyasal polimerizasyonu için genel mekanizma ...45
Şekil 2.20. Çapraz bağlamada kullanılan bazı kimyasal maddelerin formülleri ...49
Şekil 2.21. Biyosensör çeşitleri...53
Şekil 2.22. Biyosensörlerin çalışma prensibi...54
Şekil 2.23. Biyosensörlerin çalışma metotları ...57
Şekil 2.24. Östradiol–17β’nın antijenle modifiye edilmiş iyot seçici elektrotla tayini...67
Şekil 3.1. Bilgisayar kontrollü çok kanallı potansiyometre cihazı ...70
Şekil 3.2. Akış enjeksiyon analiz sistemi. ...71
Şekil 3.3. Agilent 1100 seri bilgisayar kontrollü HPLC cihazı ...72
Şekil 3.4. Kompozit Amonyum-Seçici Sensör ...74
Şekil 3.5. Mikro kompozit NH4+ duyarlı elektrotların fotoğrafı...75
Şekil 3.6. Fenilalanin Biyosensör...76
Şekil 4.1. Kompozit amonyum elektrotun NH4+, K+ ve Na+ iyonlarına karşı Potansiyel (mV)-Zaman (s) grafiği ...77
Şekil 4.2. Kompozit amonyum elektrotun NH4+, K+ ve Na+ iyonlarının Potansiyel (mV) -log C (M) grafiği...78
Şekil 4.3. Kompozit amonyum elektrotun potansiyel (mV)-pH grafiği...79
Şekil 4.4 Kompozit amonyum sensörün Potansiyel (mV)-Sıcaklık (oC) grafiği...80
Şekil 4.5. Geliştirilen mikro kompozit amonyum sensörün fosfat tamponunda ve deiyonize suda çözünmüş olan NH4+, iyonuna karşı potansiyometrik davranışı Potansiyel (mV)-Zaman(s) grafiği. ...82
Şekil 4.6. Geliştirilen kompozit amonyum sensörün ve fenilalanin biyosensörün fosfat tamponunda çözünmüş olan NH4+ iyonuna karşı potansiyometrik davranışı...83
Şekil 4.7. Geliştirilen fenilalanin biyosensörün fosfat tamponunda (pH=10,5) çözünmüş
olan fenilalanine karşı potansiyometrik davranışı...84
Şekil 4.8. Fenilalanin Amonyak Liyaz enziminin katalitik etkisi sonucu oluşan ürünler ...86
Şekil 4.9. Fenilalanin biyosensörün 5X10–3 M fosfat tamponundaki (K+ = 1,38x10–4 M ve Na+ = 0,1 M) ve Deiyonize su içerisinde çözünmüş olan NH4+’a potansiyometrik davranışı...87
Şekil 4.10. Fenilalanin Biyosensörün Potansiyel (mV)-Sıcaklık (oC) grafiği (1000 µM fenilalanin içeren fosfat tamponu çözeltisi)...88
Şekil 4.11. Fenilalanin biyosensörün potansiyel (mV)-pH grafiği (1000 µM fenilalanin içeren fosfat tamponu çözeltisi) ...88
Şekil 4.12. Kalibrasyon çözeltisinin kromotogramı...91
Şekil 4.13. İçerisinde fenilalanin ve tirozin miktarları normal değerler kabul edilen (hastalık olmayan ve %6’lık perklorik asitle hazırlanan) standart çözeltinin kromotogramı...92
Şekil 4.14. İçerisinde fenilalanin ve tirozin miktarları Patalojik değerler kabul edilen (hastalık olan ve %6’lık perklorik asitle hazırlanan) standart çözeltinin kromotogramı 93 Şekil 4.15. Plazma kromotogramı...94
Şekil 4.16. 250 µM fenilalanin ve 55 µM tirozin içeren plazma kromotogramı ...95
Şekil 4.17. 400 µM fenilalanin ve 55 µM tirozin içeren plazma kromotogramı ...96
Şekil 4.18. 1000 µM fenilalanin ve 55 µM tirozin içeren plazma kromotogramı ...97
Şekil 4.19. 2000 µM fenilalanin ve 55 µM tirozin içeren plazma kromotogramı ...98
Şekil 4.20. Fenilalanin miktarı bilinmeyen plazma numunesi...99
Şekil 4.21. Fenilalanin biyosensörün farklı konsantrasyonlarda fenilalanin içeren plazma numunelerine karşı potansiyometrik davranışı ...101
Şekil 4.22. Fenilalanin biyosensörün farklı konsantrasyonlarda fenilalanin içeren plazma numunelerine ve kandaki iyonlara eşdeğer konsantrasyonda iyon içeren fosfat tamponunda çözünmüş fenilalanine karşı potansiyometrik davranışı...102 Şekil 4.23. Fenilalanin Biyosensörün durgun ortamda fenilalanin miktarı farklı plazma numunelerine karşı Potansiyel (mV)-Konsantrasyon (µM) grafiği ...103 Şekil 4.24. Akış enjeksiyon analiz sistemi ...105 Şekil 4.25 Hareketli ortam hücresi...106 Şekil 4.26. Fenilalanin biyosensörün hareketli ortamda farklı konsantrasyonda fenilalanin içeren fosfat tamponu ve plazma numunelerine karşı potansiyometrik davranışı...107 Şekil 4.27. Fenilalanin biyosensörün hareketli ortamda farklı konsantrasyonlarda fenil alanin içeren plazma numunelerine sergilediği potansiyel (mV) ve konsantrasyon (µM) kalibrasyon grafiği...108
ÇİZELGELER LİSTESİ
Çizelge 2.1 Aminoasit metabolizması yıkımından kaynaklanan hastalıklar ...12
Çizelge 2.2 Ülkemizde ve diğer bazı ülkelerde fenilketonüri görülme sıklığı ...17
Çizelge 2.3. Plazma Fenilalanin düzeyleri ...20
Çizelge 2.4. İyon seçici elektrotların potansiyometrik bazı özellikleri...28
Çizelge 2.6. Enzim immobilizasyon çok kullanılan yöntemlerinin karşılaştırılması...38
Çizelge 2.7. Enzim immobilizasyonunda kullanılan reaktif gruplar ve reaksiyona girdikleri amino asitler ...40
Çizelge 2.8. Enzimlerin kovalent bağlama ile immobilizasyonda bağ oluşumuna katılan amino asit grupları...47
Çizelge 2.10. Potansiyometrik Enzim Biyosensörler (Mulchandam ve ark 1998)...59
Çizelge 2.11 Ticari olarak üretilen biyosensörler ...68
Çizelge 4.1. Mikro kompozit amonyum sensörün performans özellikleri ...81
Çizelge 4.2. Fenilalanin biyosensörün kanda bulunan iyonlara eşdeğer şekilde hazırlanan 5x10–3 M fosfat tamponunda çözünmüş fenilalanine karşı gösterdiği performans ...89
Çizelge 4.3. Plazma örneğinde HPLC ile bulunan fenilalanin ve tirozin miktarları...100
Çizelge 4.4. Farklı konsantrasyonlardaki plazma numunelerinin fenilalanin biyosensör ile hesaplanan değerleri ...103
Çizelge 4.5. Plazma numunelerinin HPLC ve Fenilalanin biyosensörle hesaplanan değerleri ...104
Çizelge 4.6. Fenilalanin biyosensörün durgun ortam, hareketli ortam ve HPLC ile farklı konsantrasyonlarda fenilalanin içeren plazma değerleri ...108
1. GİRİŞ
Fenilketonüri hastalığı teşhisinde indikatör maddeler olarak bilinen fenilalanin ve tirozin; mikrobiyal inhibisyon, kromatografik ve spektrofotometrik yöntemler kullanılarak tayin edilmektedir. Ancak bu yöntemlerin zaman alıcı ve pahalı olması, yeterli duyarlılıkta olmaması, karmaşık enstrümantasyon, özel laboratuvar imkanları ve oldukça tecrübeli insan gücü gereksinimi rutin analizlerde kullanımını sınırlamaktadır. Bu nedenle daha basit, hızlı ve ekonomik tayin yöntemlerine gereksinim vardır.
Fenilketonüri hastalığının hızlı ve ekonomik teşhisini sağlamak amacıyla, mikro büyüklükte yeni tip kompozit fenilalanin biyosensörlerin geliştirilmesi ve plazmadaki fenilalanin miktarının geliştirilen biyosensörlerle etkili bir şekilde ölçülmesi araştırılmıştır. Bu amaç doğrultusunda yeni tip mikro büyüklükte kompozit NH4+ sensörler kullanılarak potansiyometrik fenilalanin biyosensörler hazırlandı. Hazırlanan NH4+ sensörlerin ve fenilalanin biyosensörlerin potansiyometrik performansları incelendi. Kompozit NH4+ sensörün üzerine fenilalanin amonyak liyaz enziminin immobilizasyonu ile hazırlanan fenilalanin biyosensörün, fosfat tamponu ve plazma numunelerinde farklı konsantrasyonlarda fenilalanin ölçümü için başarıyla uygulanabileceği gözlemlendi.
2. GENEL BİLGİLER
Bu bölümde ilk olarak fenilketonüri hastalığının oluşumu, tanısı ve tedavisi, hakkında literaür ışığında incelenecektir. İyon seçici elektrotlar, enzimlerin elektrotlar üzerine immobilizasyonları ve biyosensörler hakkında genel bilgiler verilecektir.
2.1. Amino Asit Metabolizmasından Kaynaklanan Hastalıklar
Amino asitlerin metabolizması iki kısımda incelenebilir (Şekil 2.1). Birincisinde α-amino grupları transaminasyon ve oksidatif deaminasyon reaksiyonları ile uzaklaştırılıp üreye çevrilmektedir (Şekil 2.2). İkinci olarak da karbon iskeletleri glukoza çevrilebilen ya da sitrik asit çevriminde kullanılabilecek ara bileşiklere
dönüştürülmektedir. Sitrik asit çevrimine aminoasitlerin giriş basamakları Şekil 2.3’de ve bazı amino asitlerin asetil CoA ya dönüşümü Şekil 2.4’de gösterilmiştir.
Şekil 2.4. Bazı amino asitlerin asetil CoA ya dönüşümü
Bu reaksiyonlar sırasında bazı enzimlerde genetik hatalar meydana gelmekte ve sonuç olarak reaksiyonlar gerçekleşmemektedir. Bu durum çoğunlukla kalıtsal hastalıklar nedeniyle meydana gelmektedir. Bu hastalıklarla ilgili bilgiler Çizelge 2.1’de görülmektedir.
Çizelge 2.1 Aminoasit metabolizması yıkımından kaynaklanan hastalıklar
Hastalık
Görülme sıklığı (Dünyada 100.000 doğum)
Hatalı işlem Hatalı Enzim Belirtileri ve etkileri Albinizm <3 Tirozinden melanin sentezi Tirozin 3-monooksigenaz (Tirozinaz) Saçların beyaz renkte olması, deride pembeleşme Alkaptonüri <0,4 Trozin yıkımı Homojentisate 1,2-dioksigenaz
İdrarın koyu renkte olması, romatizma, gelişimde gecikme,
Argininemia <0,5 Üre sentezi Arjinaz Zihinsel gerilik
Arjininosuksinik asidoz
<1,5 Üre sentezi Arjinosüksinaz İstem dışı kas kasılması, kusma
Karbamoil fosfat sentetaz I
eksikliği
<0,5 Üre sentezi Karbamoil fosfat sentetaz Uyuşukluk, kusma, erken ölüm Homosistinüri <0,5 Metiyonin yıkımı Sisteionin β-sentetaz Kemik gelişiminde bozukluk, zihinsel gerilik Akağaç şurubu hastalığı <0,4 İzolösin, lösin ve valin parçalanması α-keto asit dehidrogenaz kompleksi İstem dışı kas kasılması, zihinsel gerilik, erken ölüm Metilmalonik asidoz <0,5 Propiyonil-CoA’ nın süksinil-CoA ya dönüşümü Metilmalonil-CoA mutaz İstem dışı kas kasılması, zihinsel gerilik, erken ölüm, kusma Fenilketonüri <8 Fenilalaninin tirozine dönüşümü Fenilalanin hidroksilaz Kusma, zihinsel gerilik
Fenilalaninin Asetil-CoA ya dönüşümü sırasında gerçekleşen reaksiyonlar ve bu reaksiyonları katalizleyen enzimlerdeki hatalardan kaynaklanan hastalıklar Şekil 2.5’de gösterilmiştir. Aminoasit metabolizmasında en sık görülen hastalık fenilketonüridir. (Davis ve ark. 2005)
2.2. Fenilketonüri (PKU)
2.2.1. Oluşumu
Fenilketonüri (PKU) insanda ilk keşfedilen ve metabolik hata sonucu oluşan kalıtsal bir hastalıktır. PKU ile ilgili bilgiler 1934 yılında Asbjörn Fölling, zihinsel bozukluğu ve fenilalanin seviyesi yüksek olan hastalara kendi isimlendirdiği “Imbecilites phenylpyruvica” tanısını koymasıyla başlamıştır. Daha sonra 1946’da Penrose ve Quastel, hastalığa fenilketonüri ismini vermişlerdir (Müslümanoğlu ve ark. 2004; Nelson ve ark. 2004 ).
Fenilalanin hidroksilaz EC 1.14.16.1 (Fenilalanin 4-monooksigenaz) karışık fonksiyonlu oksidazların bir üyesidir (Şekil 2.7). Bu enzimler eş zamanlı olarak substrata O2 ile hidroksil grubunu ilave ederler ve diğer oksijen atomunu da H2O ya indirgerler. Fenilalanin hidroksilaz reaksiyonu katalizleyebilmesi için kofaktör olarak tetrahidrobiyopterine ihtiyaç duyar. Elektronlar NADH (Nikotinamid dinükleotit) üzerinden O2 geçer ve tetrahidrobiyopterin dihidrobiyopterine dönüşür. Bu reaksiyonun gerçekleşmesini dihidrobiyopterin redüktaz katalizler. Şekil 2.6’da reaksiyonlar gösterilmiştir.
Şekil 2.7. Fenilalanin hidroksilaz enziminin 3 boyutlu görüntüsü (http://en.wikipedia.org/wiki/Image:Phenylalanine_hydroxylase.jpg den alınmıştır.)
Fenilketonüri, otozomal resesif bir hastalıktır. Şekilde 2.6’da görüldüğü gibi PKU fenilalanin tirozine dönüşmesi sırasında görev alan fenilalanin hidroksilaz, dihidrobiyopterin redüktaz veya dihidrobiyopterin sentazdan herhangi birinin genindeki bir hatadan ortaya çıkabilir. Klasik PKU, fenilalanin hidroksilaz enzimindeki genetik hatadan kaynaklanmaktadır.
PKU yenidoğan bebeklerde fenilalanin hidroksilaz enzim yetersizliğinden kaynaklanan ve tedavi edilebilir zeka geriliklerinin en önemli nedeni olan bir hastalıktır. Fenilalanin hidroksilaz, kanda fenilalanin’i tirozine dönüştürmektedir. Yeni doğan bebeklerde fenilalanin hidroksilaz enzimi eksikliğine bağlı kanda ve diğer vücut
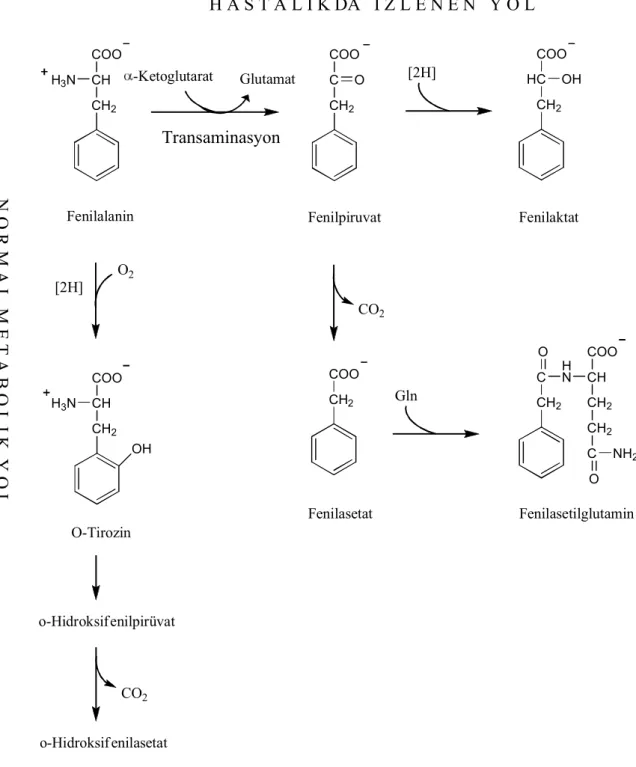
sıvılarında fenilalanin, fenillaktat, fenilpiruvat ve o-hidroksifenilasetat birikir, tirozin düzeyi azalır. Şekil 2.8’de bu maddelerin oluşumları gösterilmiştir.
Şekil 2.8. PKU hastalığı sonucu fenilalanin türevlerinin oluşum reaksiyonları
Doğumda normal olan bebekte beslenmeyi takiben metabolize olamayan ve biriken fenilalanin ve türevleri beyin dokusuna toksik etki göstermesi çok çabuk ve olumsuzdur. Genel olarak çocuğun akranlarından geri olduğu fark edilmeye başlanır. Özellikle erken tedavi edilmeyen çocuklarda akıl fonksiyonlarında önemli gerilik izlenir. IQ düzeyi 50’nin altındadır. Hayatın ilk gün-haftalarında fenilalanin’den kısıtlı diyet tedavisine alınan fenilketonürili bebekte fenilalanin birikimi ve beyin dokusuna yaptığı zararlı etki önlenir. Bebek akranlarına uyan bir gelişim gösterir. Tedavi iyi ve yeterli sürede uygulandığında çocuk beklenen zeka seviyesine ulaşır. Bunu
başarabilmek için erken tanı çok önemlidir. Bu yüzden PKU kısa sürede teşhis edilip tedaviye başlanmalıdır (Özalp 2000). Ülkemizde ve diğer bazı ülkelerde fenilketonüri hastalığının görülme sıklığı Çizelge 2.2’ de verilmiştir.
Çizelge 2.2 Ülkemizde ve diğer bazı ülkelerde fenilketonüri görülme sıklığı
Yukarıdaki çizelgeden de anlaşılacağı gibi PKU dünyada en sık ülkemizde görülmektedir. Sağlık bakanlığı verilerine göre ülkemizde yılda yaklaşık 1.500.000 bebek doğmakta ve çizelgede belirtilen orandan yaklaşık olarak her yıl 300–400 çocuk bu hastalıkla doğmaktadır. Ülkemizde doğan bebeklerde kısa süre, ekonomik ve
ÜLKE SIKLIK TÜRKİYE 1/4500 İRLANDA 1/6.110 İTALYA 1/7.000 ALMANYA 1/9.000 İNGİLTERE 1/10.000 U.S.A 1/13.000 FRANSA 1/18.000 ÇİN 1/20.000 JAPONYA 1/143.000 FİNLANDİYA 1/200.000
güvenilir şekilde tarama yapılması gerekmektedir. Ülkemizde ve birçok gelişmiş ülkede, PKU için yeni doğanlarda tarama testleri zorunlu olarak yapılmaktadır.
2.2.2 Genetik bilgi
Fenilalanin hidroksilaz geninin komplementer cDNA sı çoğaltılmış ve bakterilere protein sentezlettirilmiştir. Bu sayede, çok miktarda enzim elde edilmiş ve üzerinde çalışmalara başlanmıştır. Enzim geninde 100 den fazla mutasyon taşıyan 70’in üzerinde “Restiriction fragment lenght polymorphism” (RFLP) bulunmuştur. Gen, 12. kromozomda bulunur ve 13 ekzon, ortalama 90 kb lık bir DNA parçası içinde yer almıştır (Dawn ve ark. 1996). PKU’nin moleküler biyoloji yönünden incelenmesi, taşıyıcıların saptanmasında ve hastalığın doğum öncesi tanısında faydalı olmakla birlikte gen tedavisi için çalışmalar sürdürülmektedir (Scriver 2007).
Sağlık bakanlığı verilerine göre çekinik genle taşınan bu hastalığın taşıyıcı sıklığı ülkemizde yüksektir. Her 100 kişiden dördünün bu hastalığı taşıyor olması hastalığın ülkemizde sıklıkla izlenmesinin nedenidir. Şekil 2.9’da (U.S. national library of medicine den alınmıştır) bireylere genetik olarak geçişi şematik olarak gösterilmektedir.
Şekil 2.9 PKU’nin bireylere kalıtımsal geçişi gözlenmektedir.
Biyopterin kofaktörünün biyosentezini katalizleyen enzimlerdeki genetik hatadan kaynaklanan PKU’de bulunmaktadır. Biyopterin, fenilalaninin, tirozin ve triptofanın hidroksillenmesinde kullanılır. Bu nedenden dolayı biyopterin metabolizmasındaki enzimdeki bir hatadan dolayı hem PKU hem de diğer metabolik yollar etkilenebilir. Bu enzimler dihidropterin redüktaz, guanozin trifosfatsiklohidraz ve 6-piruvoil tetrahidropterin sentazdır. Birinci enzim BH4 rejenerasyonundan, son iki enzim BH4’ün biyosentezinden sorumludur (Zurflüh ve ark. 2007).
Son zamanlarda yapılan araştırmalarda beyinde bulunan serbest fenilalaninin artması ve büyük yapılı nötral amino asitlerin (tirozin ve metiyonin) azalması protein sentezinin azalmasına sebep olmaktadır. Bu da myelinin turnover sayısını artırmakta ve dopamin, nöronefrin ve nörotransmitter sistemlerde anormaliklere neden olmaktadır. Beyin korteksi doğumda normalken daha sonra miyelinleşme (sinir lifi çevresinde miyelin kılıfının oluşması) ve sinaptik gelişmede anormallikler oluşmaktadır (Davis ve ark. 2005, Shaw ve ark. 2007).
Fenilalanin yıkım ürünleri melanin sentezini inhibe etmektedir. Beyindeki normal metabolizma bozulur. Beyinde bulunan piruvat kinaz, fenilpürivik asitin
inhibisyonuyla santral sinir sistemi fonksiyonunun bozulmasına neden olmaktadır. Çünkü beyin nörotransmitırları (sinirler arasında iletimi hızlandıran madde) olan serebrosit, sülfatid, dopamin, serotonin sentezi fenilalaninle inhibe olur. Yüksek fenilalanin konsantrasyonunda miyelinizasyon (sinir hücrelerini koruyucu kılıf oluşumu) bozulmaktadır (Behrman ve ark. 1996; Baydar ve ark. 1997; Shaw ve ark. 2007).
2.2.3 Tanı
PKU’nin erken tanısı tedavisinde en önemli adımdır. Bu yüzden ülkemizde ve birçok ülkede tarama testleri kapsamına alınarak tüm yenidoğan bebeklerde bu hastalık taranmaktadır. Yeni doğan bebek normal beslendiğinde biriken en önemli bileşik, fenilalanindir. Sağlıklı bebeklerde normal plazma fenilalanin derişimleri olarak ortalama, <120 µM dir. 120 ile 600 µM hiperfenilalaninemi olarak adlandırılmaktadır. Klasik PKU’da plazma fenilalanin derişimi daima 20 mg/dL (1200 µM) üzerindedir ve 60 mg/dL (3640 µM)’e kadar yükselebilmektedir. Plazma fenilalanin düzeyleri ile ilgili bilgiler Çizelge 2.3’de verilmiştir. PKU lu hastaların idrarlarında fenilalanin ve fenilpirüvik asit derişimi 1000 µM üzerindedir (Davis ve ark. 2005; Montogomery ve ark. 2000; Shaw ve ark. 2007).
Çizelge 2.3. Plazma Fenilalanin düzeyleri
Plazma fenilalanin düzeyi, µM
Klasik PKU >1200 µM
Orta dereceli PKU 600–1200 µM Hiperfenilalanemi 120–600 µM
Normal <120 µM
Fenilalanin hidroksilaz karaciğerde bulunmaktadır; böbrek ve pankreasda da az miktarlarda saptanmıştır. Hücre içindeki fenilalanin hidroksilaz aktivitesini ölçmek zordur çünkü enzim yalnızca karaciğerde bulunmaktadır (Baydar ve ark. 1997). Bu
nedenlerden dolayı PKU hastalığının tesbiti için geliştirilen yöntemler fenilalanin miktarının ölçümüne odaklanmıştır (Gaw ve ark. 1999).
PKU’nin tanısı için ilk zamanlarda idrarda fenilpirüvatın FeCl3 ile verdiği reaksiyona dayalı tarama testi yapılmıştır (Moisio ve ark. 1998; Clague ve ark. 2002). Günümüzde ise en yaygın olarak kullanılan yöntem Guthrie testi (Guthrie 1963)’ dir. Ancak bu test sadece kalitatif bilgi vermektedir ve duyarlılığı düşüktür. Dolayısıyla kanda ve plazmada fenilalanin veya tirozin miktarını tayin edebilen yeni metotlara ihtiyaç duyulmaktadır. Guthrie testinin önemli dezavantajları uzun ve zahmetli bir süreç izlemesi ve testten alınan sonuca göre hastaya tanı konulamaması ve % 5 gibi yüksek oranda yanlış pozitif sonuç vermesidir (Clague ve ark. 2002). Guthrie testi, Bacillus subtilis’in fenilalanin içermeyen ortamda ürememesi esasına dayanmaktadır. Bacillus subtilis, fenilalanini çeper oluşumunda kullanılır. Besi yerine ilave edilen β-tienilalanin kanda normalde bulunan fenilalaninnin etkisini yok eder. Böylece üreyen bakterinin oluşturduğu zon büyüklüğü ile hastalığın teşhisi yapılır. Bu üremenin alanı fenilalanin miktarına bağlıdır (Özalp 2000; Peker ve ark. 2000). PKU hastalığının ön tanısı bu testin pozitif sonucuna göre yapılmaktadır. Fakat PKU tanı konulabilmesi için kandaki fenilalanin düzeyinin belirlenmesi gerekmektedir.
Fenilalanin tayini için; Guthrie testi, iyon kromatografik (Allard 2004), Spektrofotometrik (Campell ve ark. 1992; Dorota ve ark. 2006; Hilton 1982; Atherton 1988; Spierto 1982; Wendel 1989, 1990) ve flourimetrik metotlar (Kiba ve ark. 1997; Allen ve ark. 1999) geliştirilmiştir. Bu metotların zaman alıcı olması, yeterli duyarlılıkta olmaması çoğu karmaşık enstrümantasyon, özel laboratuvar imkânları ve oldukça tecrübeli insan gücü gereksinimi rutin analizlerde kullanımını sınırlamaktadır (Wendel 1989). Fenilalanin dehidrogenaz ve tirozin dekarboksilaz enzimlerine dayalı enzimatik metotlar da geliştirilmiştir (Donahue ve ark. 1996; Dorota ve ark. 2006; Wendel 1989, 1990; Wibrand 2004). Geliştirilen enzimatik metotların önemli dezavantajları spektrofotometrik veya kolorimetrik ölçümlere ihtiyaç göstermesidir. Bu nedenle yeni analiz yöntemleri üzerine çalışmalar yapılmaktadır. Özellikle son yıllarda yapılan araştırmalar elektrokimyasal biyosensörler üzerine yoğunlaşmıştır. Fenilalanin dehidrogenaz ile amperometrik, fenilalanin amonyak liyaz enzimi ile potansiyometrik fenilalanin biyosensörler hazırlanarak fenilalanin tayininde kullanılması üzerine çalışmalar yapılmıştır (Huang ve ark. 1998; Wang ve ark. 2006; Weiss ve ark. 2007 ).
Plazma fenilalanin düzeyi 16.5 mg/dl üzerine çıktığı zaman transaminasyon reaksiyonu hızlanır, fenilketonlar ve diğer yan ürünler kanda yükselir. Hastanın idrarında ve terinde fenilalanin yanında fenilpiruvat, fenilasetat, fenillaktat ve fenilasetilglutamin gibi anormal metabolitler de bulunur. Fenilalaninin dekarboksilasyon ürünü olan feniletilamin insanda çok önemli değildir. Şekil 2.10’da fenilalanin normal reaksiyonlar sonucu ve hastalık durumunda oluşan ürünler gösterilmiştir.
Hastalarda genellikle klinik bulgular şunlardır;
• Kusma
• Ter ve idrarda fare kokusu oluşmaktadır. • Zeka geriliği
• Çevreye karşı ilgisizlik • Hiperaktivite
• Hastaların bir kısmında melanin oluşumundaki defekt nedeniyle saç, göz ve deri rengi açıktır. (Davis ve ark. 2005; Gaw ve ark. 1999)
CH2 CH COO H3N Fenilalanin -Ketoglutarat Glutamat CH2 C O COO Fenilpiruvat [2H] CH2 HC OH COO Fenilaktat O2 [2H] CH2 CH H3N COO OH O-Tirozin o-Hidroksif enilpirüvat CO2 o-Hidroksif enilasetat CO2 CH2 COO Fenilasetat Gln CH 2 C HN O CH COO CH2 CH2 C O NH2 Fenilasetilglutamin Transaminasyon N O R M A L M E T A B O L I K Y O L H A S T A L I K DA I Z L E N E N Y O L
Şekil 2.10. Fenilalanin normal ve hastalık durumunda izlediği metabolik yol
2.2.4. Tedavisi
PKU’li hastaların tedavilerindeki en önemli adım kanlarındaki serbest fenilalanin miktarının normal değerlerde tutulmasıdır. Böylece hastalık kontrol altına alınmakta ve etkilerinin ortaya çıkması önlenmektedir. Hazırlanan gıdalarda bulunan
fenilalanin ve tirozin protein sentezine yetecek miktardadır. Bunun için ticari firmalar tarafından hazırlanmış özel mamalar vardır; PKU–1, Milupa (Almanya), Phenyldon, Nutricia (Hollanda) , Lofenelac, (Amerika) (Hoeksma ve ark. 2005). Bu mamalar, fenilalaninden yoksun veya fakir aminoasit karışımıdır. Çocuğun yiyecek listesi protein ihtiyacını karşılamakla birlikte yaşına göre biraz yüksek kalori içeren yağ ve karbonhidratça zengin fenilalaninden kısıtlıdır. Büyümeyi sağlamak için bir küçük bardak süte (doğal protein için) izin verilir. Çünkü fenilalanin büyüme ve gelişme için gerekli olan vazgeçilmez bir protein yapıtaşıdır. Eksikliğinde, anemi, raş, diyare, letarji, iştahsızlık gelişir ve ölüm olabilir. Bu hastalıkta tirozin esansiyel aminoasittir. Tirozin, protein metabolizması, dopamin, norepinefrin, epinefrin, melanin ve tiroksin sentezi için gereklidir. Son zamanlarda doktorlar bu tedavinin ömür boyu devam edilmesini uygun görmektedirler. Gebelikte mutlaka diyete uyulmalı ve fenilalanin seviyesi 1–2 mg/dl arasında tutulmalıdır (Davis ve ark. 2005).
PKU’li hastalarının aspartam gibi yapay tatlandırıcılar kullanmamaları gerekmektedir (Gaw ve ark. 1999). Aspartam, aspartik asit, fenilalanin ve metanolden oluşmuştur. Hayvanlarda yapılan in vivo deneylerde kanlarında bulunan fenilalanin miktarlarının arttığı gözlenmiş ve bu nedenle PKU hastalarının aspartam kullanılması uygun görülmemiştir (Baydar ve ark. 1997).
T.C Sağlık Bakanlığı 1993'den bu yana tüm Türkiye kapsamında fenilketonüri tarama programını başlatmıştır. Doğum yapılan tüm kuruluşlar, bebek hastaneden taburcu edilirken (yaşamın ilk haftası içinde) topuğundan özel bir filtre kağıdına birkaç damla kan örneği almakla görevlendirilmiştir. Ayrıca yenidoğan ve süt çocuğu izlemlerinin ve aşılarının yapıldığı Ana Çocuk Sağlığı ve Aile Planlaması Merkezleri, Sağlık Ocakları ve özel hekim muayenehanelerine de tarama için kullanılan özel filtre kağıtları dağıtılmakta, örnekler alınmaktadır. Toplanan örnekler T.C Sağlık Bakanlığına bağlı Yenidoğan Tarama Merkezlerine gönderilir. Ülkemizde dört Yenidoğan Tarama Merkezi mevcuttur. (Hacettepe Tıp Fakültesi-Ankara; İstanbul Tıp Fakültesi-İstanbul; Dokuz Eylül Tıp Fakültesi-İzmir; Cumhuriyet Tıp Fakültesi-Sivas). Tarama testi şüpheli bulunan bebekler merkeze davet edilir. Kontrol testleriyle hastalığı kesinleşen bebekte hemen tedaviye başlamak gerekir (Sağlık bakanlığı, http://www.saglik.gov.tr/TR/BelgeGoster.aspx?F6E10F8892433CFF71BE64510F6C8B C93647010FE3D42BA1, 02.08.2008).
Çalışma için gerekli olan örnek miktarının azlığı ve örnek alımının kolaylığı yenidoğan taraması için önemli avantajlardır. Ayrıca çalışma tekniğinin kolay ve hızlı olması da analizin konvansiyonel metotlara göre daha kısa sürede sonuçlanmasını sağlar.
2.3. İyon Seçici Elektrotlar
İyon seçici elektrotlar (İSE) 1906’da Cremer’in kimyasal sensör olan pH cam membran elektrotu bulmasıyla başlamıştır. İSE biyomedikal, endüstriyel ve çevre gibi birçok alanda kullanılmaktadır. Cam elektrot en yaygın olarak kullanılan sensördür. Performansı yüksek olan cam pH elektrot ve kristal membran sensörler üstün özelliklere sahip olmalarına rağmen kimyasal kullanım alanları sınırlıdır.
Potansiyometrik ölçüm yöntemleri tayinler basit ve ucuz olarak yapılmaktadır. Düzenekte referans elektrot, çalışma elektrotu (İSE) ve potansiyel ölçüm cihazına ihtiyaç duyulmaktadır. Şekil 2.11’de potansiyometrik ölçüm düzeneği görülmektedir. Referans elektrot ve iyon seçici elektrot ölçüm yapılacak numunelere temas ettiklerinde referans elektrot sabit potansiyeli sergilerken iyon seçici elektrot analiz edilen iyonun konstrasyonuna bağlı olarak farklı potansiyel sergiler. Bu farklılık sayesinde iyonların aktivitesi tayin edilir (Mcmahon 2007).
Referans elektrotlarda aranan özellikler zamanla değişmeyen potansiyele sahip olmaları, nernst eşitliğine uymaları ve tersinir olmalarıdır. Kalomel elektrot, gümüş gümüş klorür elektrot ve katı referans elektrot olmak üzere üç farklı türdedir (Skoog ve ark. 2000).
İyon seçici elektrotlarda meydana gelen potansiyel farkının değeri analiz yapılan türe ve derişime bağlı olmakla beraber membranın cinsine ve çözeltide bulanan diğer iyonların cins ve miktarına bağlı olarak etkilenir. Bu etki,
(
+∑
)
+ = kiCj Ci n sabit E 0.059.logkij: elektrodun i iyonu ve j iyonuna göre seçimlilik katsayısı
eşitliği ile belirlenir. Bu tür elektrotlarda kullanılan membranlar az çözünen bir tuzun tek kristalinden hazırlanmaktadır (Telefoncu ve ark. 1999). Kalibre sistemlerde
aktiviteleri bilinen standart çözeltiler kullanılır. Potansiyometrik ölçümler iyon konsantrasyonundan çok iyon aktivitesini gösterir. İyonun aktivite katsayısı biliniyorsa aşağıdaki formül yardımıyla konsantrasyonu hesaplanır.
log a/c = log γ a. İyonun aktivitesi c. İyonun konsantrasyonu γ. Aktivite katsayısı
bu formülün daha kullanılabilir şekli
logc = loga-log γ ’dır (Holme ve ark. 1998).
Cam elektrotlar kullanılarak seçici bir şekilde yapılan iyon seçici elektrotların geliştirilmesinde temel fikir olmuştur. Çok çeşitli sayıda yapılan cam membranlar cam elektrotların seçiciliğini değiştirmektedirler (Rusling 2003). Böylece birçok sayıda katyon duyarlı elektrotlar bu sayede geliştirilmiştir. Fakat bu elektrotlar Na+, K+, Ca+2 ve NH4+ gibi hepsine duyarlı olduğu için yalnızca birine seçici olarak davranmamaktadır. Özellikle de H+ iyonu çok fazla girişim yapmaktadır. Bu elektrotları temel dizaynı Şekil 2.11’de verilmiştir.
Potansiyometrik sensörler üzerine son onbeş yıldır yapılan çalışmalar daha kullanışlı olan polimerik membran İSE’a dönüşmekte olduğunu göstermektedir. Polimerik membran sensörlerin yapımına 1960’lı yıllarda başlanmıştır. Biyomedikal uygulamalarda ve klinik kimyada birçok analitik metodun yerini almıştır. Katı kontak İSE sağlamlık, karallılık ve fiyatlarının uygun olması gibi birçok avantaja sahiptirler (Mcmahon 2007). Fakat sadece geniş kullanım alanına sahip matriksler önemli sayıda analize izin vermektedirler. Bu sensörlerle ölçülebilen yüz çeşit madde vardır. Geniş ölçüm aralığına sahip olan İSE analitik metotlar içerisinde önemli yer teşkil etmektedirler.
Membranlar üzerine yapılan çeşitli fizikokimyasal teknikler ve elektrokimyasal yöntemlerle (elektrokimyasal empedans spektroskopisi, voltametri ve kronoamperometri) çok karmaşık olan yapıları karakterize edilmektedir (Lisowska-Oleksiak 2006; Martinhon ve ark. 2006; Cortina-Puig ve ark. 2007; Mousavia ve ark. 2008 ).
Sensörlerin karakteristik özelliklerinin optimizasyonu ve geliştirilmesi önemli olması nedeniyle birçok araştırma grubu bu konu üzerine çalışmalar yapmaktadır. Moleküllerin düzgün bir şekilde dizaynı sayesinde yeni sensör materyalleri seçici, duyarlı, düşük tayin limitlerine sahip ve dayanıklı hale getirilmeye çalışılan önemli araştırmalar yapılmaktadır. Bu alanda çok kullanılan iyonofor maddelerin kimyasal yapıları Şekil 2.12’de gösterilmektedir. Çizelge 2.4’de iyon seçici elektrotlar ve bazı özellikleri verilmektedir ( Boyer 2000 ).
Çizelge 2.4. İyon seçici elektrotların potansiyometrik bazı özellikleri
İyonlar Konsantrasyon aralığı, M Girişim yapan türler
Amonyum 10o-10-6 Uçucu aminler
Bromür 10o -5x10-6 S-2, I-
Kadminyum 10o-10-7 Ag+, Hg+2, Cu+2, Pd+2, Fe+3
Karbondioksit 10-2-104 Sr+2, Mg+2, Ba+2, Ni+2, uçucu zayıf asitler Klor 10o-8x10-6 ClO4-, I-, NO3-, SO4-2, Br-, OH-, F-, HCO3-2 Bakır doygun-10-8 S-2, Ag+, Hg+2
Siyanür 10-2-10-6 S-2, I-, Br-, Cl-,
İki yüklü katyonlar 10o-6x10-6 Na+, Zn+2, Cu+2, Ni+2, Fe+2, Sr+2,
Flor doygun-10-6 OH -İyot 10o-2x10-5 S-2 Kurşun 10o-10-7 Ag+, Hg+2, Cu+2, Cd+2, Fe+3 Nitrat 10o-6x10-6 I-, Br-, NO2- Nitrit 10-2-5x10-7 CO2 Potasyum 10o-10-5 Cs+, NH4+, H+ Gümüş 10o-10-7 Hg+2 Sodyum doygun-10-6 Li+, Cs+, K+ tiyosiyanat 10o-5x10-6 Br-, Cl-, OH
-Şekil 2.12. İyon seçici elektrotlarda kullanılan bazı iyonofor maddelerin kimyasal yapıları
İSE’da önemli bir adımda katı kontak sensörlerin geliştirilmesiyle atılmıştır. Bu sensörler kolayca minyatürize edilebilir yapıda oldukları için seri şekilde üretime uygun, analiz için düşük örnek hacmi kullanması, in vivo ölçüme uygun ve mikroçip teknolojisine uyumlu olması gibi önemli özelliklere sahiptirler. Mikro sensörler bir araya getirilerek elde edilen sensör dizileri ile birçok maddenin analizi yapılabilmektedir.
2.3.1. İyon Seçici Elektrotların Biyomedikal Uygulamaları
Klinik kimyada fizyolojik sıvılarda bulunan elektrolitleri belirlemede İSE anahtar görevini üstlenmeye devam etmektedir. Her yıl dünyada yapılan milyonlarca rutin ölçümlerde İSE’lar tarafından gerçekleştirilmektedir. Polimer İSE tarafından analizi yapılan kandaki fizyolojik öneme sahip iyonlar Çizelge 2.5.’de verilmiştir. pH, Ca+2, K+ ve Na+ sensörler Uluslar arası Klinik Kimya Federasyonu (International Federation of Clinical Chemistry, IFCC) tarafından onaylanmış ve ticari analizörlerde kullanılmaktadır. Mg+2, Li+ ve Cl- iyonları fizyolojik sıvılarda (idrar, hemodiyaliz çözeltileri ve benzerlerinde) İSE kullanılarak yaygın bir şekilde ölçüm yapılmaktadır.
Fizyolojik sıvılarda, çok yüklü iyonların (heparin, protamin), çözünmüş karbondioksit, fosfatlar ve diğer analiz edilecek maddeler üzerine yapılan çalışmalar devam etmektedir.
Diğer analitik yöntemlerden farklı olarak İSE iyonun konsantrasyonu yerine aktivitesini ölçer. Bu durum özellikle klinik uygulamalarda önemlidir. Hastalıklar genellikle iyon aktiviteleriyle ilgilidir. İSE’ın çoğu in vitro çalışmalarda ( Caves ve ark. 2003; Eggert ve ark. 1999) kullanılmakta ve aynı zamanda in vivo ölçümlerde kullanım performansına sahiptirler. İn vivo ölçümler için çalışmalar devam etmektedir (Nagy ve ark. 1985; Somps ve ark. 1996). Sensörlerin iki yönden uygun olması gerekmektedir. Birincisi, in vivo çevreye olan etkisinin (yaralama, enfeksiyon ve benzeri) minumum olmasıdır. İkincisi, bu ortamda bulunan protein, hücre ve benzeri biyomoleküllerin sensörün cevap zamanını ve çalışmasını etkilememesi gerekmektedir. Tavşan, fare ve koyun gibi hayvanların kaslarında in situ (üzerinde) elektrolit ölçümleri mikro sensör dizileri ile gerçekleştirilmiştir (Ward 1989).
Sensörlerin kullanımlarının basit olması, taşınabilir cihazlara ve hastanelerde bulunan cihazlarda kullanılmasına imkan sağlamaktadır. Özellikle hastaların odalarında bulunan cihazlara yerleştirilerek zaman tasarrufu sağlanmaktadır. Bir başka ifadeylee modern cihazlarda bu sensörlerin kullanımı sayesinde saatte 1000 den fazla örnekte bir düzine analiz edilecek maddelerin tayini yapılmaktadır. Kan elektrolitlerinin analizi klinik kimyada yapılan en önemli analizlerden biridir ve İSE büyük küçük tüm ticari analiz cihazlarına yerleştirilmektedir. Çizelge 2,6’da bu tip elektrotların kanda çalışma performansları verilmiştir.
Farmakolojik analiz İSE için önemli diğer bir alandır. Birçok ilacın farmaklojik formülleri ve üretim işlemleri sırasında İSE’ın kullanıldığı çalışmalarda belirtilmiştir. İlaçlar ve onlardan oluşan metabolitlerin biyolojik sıvılarda eş zamanlı olarak ölçülmektedir. İSE şu an farmakolojik kimyada yaygın olarak kullanılmalarınin nedeni, son yıllarda yapılan çalışmalarda sergiledikleri yüksek potansiyelleri sayesindedir (Othman ve ark. 2004; Santos ve ark. 2004; Shamsipur ve ark. 2005; Emília ve ark. 2006; Fahimeh ve ark. 2007; Bohets ve ark. 2007). Mikrosensörler ve minyatür sensörler hücre dışı sıvısının ölçümünde uygun bir sensörlerdir. Fizyologlar ve biyologlar bu özelliği canlı organizmadaki değişiklikleri takip etmek için kullanmaktadırlar (Smith ve ark. 2001; Saulis ve ark. 2007). Mikro çoklu analiz sistemleri ve lab on a chip cihazları mikrosensörlerle bir araya getirilerek minyatürizasyona ve otomasyona uygun cihazlar geliştirilmekte ve bu cihazlarla önemli biyomedikal uygulamalarda in vitro ölçümler yapılmaktadır. Seri üretilen ve in vivo
ölçümler alabilen mikrosensörlere talep yüksektir (Uhlig ve ark. 1996; Zhang ve ark. 2008; Wróblewski ve ark. 2004).
Çizelge 2.5. Kanda bulunan önemli iyonların konsantrasyon aralıkları ve uygun membranların seçicilik aralıkları (a Lityum tedavisi alan hasta, b Toplam karbondioksit konsantrasyonu, cAspirin tedavisi alan hasta)
İyon Konsantrasyon aralığı, mM
Membran kompozisyonu Seçicilik log K
H+ pH: 7.35–7.45 Tri-n-dodesilamin, KTpClpB, PVC/DOS Na+:-10.4, K+:-9.8 Ca+2: < -11.1 Li+ 0.5–1.5a 7-tetradesil-2,6,9,13-tetraoksatrisiklo [12/4/4/01/14] dokosan, KTpClpB, PVC/DBPA Na+:-3.1, K+:-3.6 Ca+2: < -5.0
Na+ 136–145 Kalik [4] zarenkravn-4 iyonofor, KTpClpB, PVC/NPOE
Li+:-2.8, K+:-5.0 Mg+2:-4.5, Ca+2: -4.4
K+ 3.5–5.0 Valinomisin, NaTFPB, PVC/DOS Na+:-4.5, Ca+2:-6.9 Mg+:-7.5 Ca+2 2.2–2.6 N,N,N`,N`-tetrasiklohegzil-3-oksapentandiamid (ETH129), KTpClpB, PVC/NPOE Na+:-8.3, K+:-10.1 Mg+2:-9.3 Mg 0.8–1.3 Tetraamit iyonofor, KTpClpB, PVC/NPOE Li+:-3.7, K+:-1.4 Na+:-3.2, Ca+2: -2.5 Cl- 98-106 2,7-di-tert-bütil-9,9-dimetil-4,5 ksantediamin, TDAMCl, PVC/DOA
Cl-:-6.9, NO3-: -3.4
CO3-2 35-40b Twezer tip karbonat iyonofor, TDAMCl, PVC/DOA
Cl-:-6.9, NO3-: -3.4
İyon seçici elektrot da membranın yüzeyine bir reaksiyonu katalizleyen bir enzimin immobilizasyonu sağlanarak elektrotun özelliklerine enzimin seçiciliği eklenir. Bu tür sensörlere biyosensörler denir. Bu konu ile detaylı bilgi biyosensörler başlığı altında verilecektir.
2.3.2 İyon-Seçici Elektrotların Performansına Etki Eden Faktörler
2.3.2.1. Cevap Zamanı
İyon-seçici elektrotlarda cevap zamanı elektrodun fiziksel yapısıyla ilgili bir özelliktir. Cevap zamanı, genel olarak membranın duyarlı kısmıyla çözeltideki iyonun dengeye gelmesi için geçen zaman olarak tarif edilmektedir. IUPAC’a göre dengeye gelme zamanının % 95’i olarak alınır ve t95 olarak gösterilir. Bu durum Şekil 2.13’de grafiksel olarak gösterilmiştir.
Şekil 2.13. IUPAC’a göre cevap zamanı
Girişim yapan iyonlar, bir Nernst potansiyel farkı oluşması için taşınması gereken iyonların aktif elektrot yüzeyine ulaşmalarını geciktirir ve cevap zamanını etkiler.
Genel olarak cevap zamanı aşağıdaki işlemlerle azaltılabilir; 1. Etkili karıştırma (veya akış hızının artırılması),
2. Membran yüzeyinden kirliliklerin uzaklaştırılması veya çok küçük membran yüzeyli mikroelektrotlar kullanılması,
Nötral taşıyıcı membranlarda, aktif maddeye (ligant veya kompleks) çözeltideki iyonun tutunma hızı, cevap zamanını etkileyen en önemli faktördür. Bunun dışında;
1. İyon ekstraksiyon kapasitesi 2. Difüzyona karşı direnç 3. Membran kalınlığı
4. Membrandaki çözücünün polaritesi de cevap zamanını etkileyen faktörlerdir.
2.3.2.2. Tayin Limiti
İyon-seçici elektrotların tayin limiti, membran ara fazında ölçülebilir bir potansiyel farkı meydana getiren en düşük iyon konsantrasyonu olarak tanımlanır.
IUPAC’a göre çoğunlukla tayin limiti, tek yüklü anyon ve katyonlara duyarlı elektrotlarda elektrodun sabit potansiyel sergilediği potansiyel değerinden ± 18 mV farklılık gösterdiği potansiyel değerine karşılık gelen madde miktarı alınırken, bu potansiyel farkı iki yüklü anyon ve katyonlar için ± 9 mV olarak kabul edilmiştir. Şekil 2.14.’de IUPAC’a göre tayin limiti grafiksel olarak gösterilmiştir.
Şekil 2.14. IUPAC’a göre tayin limiti
Çoğu iyon-seçici elektrot için tayin limiti 10-5 mol.L-1 civarındadır. Bazılarında ise 10-7 mol.L-1’e kadar düşebilir. Bu limitler, ortamda bulunan girişim yapan iyonlar ve moleküller ile ters yönde etkilenebilir (yoğunlaştırılmış sulu çözeltilerde su molekülleri iyonların hidrofobik membrana girişini önler ve tayin limiti ters yönde etkilenir).
2.3.2.3. Seçicilik
İdeal olarak sadece tek bir iyona duyarlı bir elektrot yoktur. X iyonunu ölçmek için kullanılan bir elektrot Y iyonuna da duyarlı olabilir. Diğer iyonların varlığı elektrot performansını önemli ölçüde etkiler. Bu iyonların girişimi, elektrot membranının yapısına bağlı olarak çeşitli şekillerde olabilir.
Seçicilik ilk kez Nicolsky tarafından hidrojen ve sodyum iyonlarına duyarlılık gösteren cam elektrot için kullanılmış ve aşağıdaki eşitlikle verilmiştir. Pek çok ISE çoğunlukla aşağıdaki eşitliğe uygun davranır [20].
(18)
ax = Ölçülecek iyonun aktivitesi ay = Girişim yapan iyonun aktivitesi nx, ny = Herbir türün yükü
pot y x,
k = Seçicilik katsayısı
Denklem, bir elektrodun ölçülecek iyonu X’e ve bütün girişim yapan iyonlara cevabını gösterir. Elektrodun farklı iyonik türlere karşı duyarlılığı seçicilik katsayısı ile belirlenir. Y'ye duyarlılık pot y x, k = = ax / aynx / ny (19) X'e duyarlılık olarak verilir.
Seçicilik katsayısı ( pot y x,
k ) büyüdükçe elektrodun ölçülecek iyona duyarlılığı azalır ve log ax-potansiyel grafiği yataya doğru gider. Örneğin; kalsiyum seçici bir elektrot için Na+ girişimi söz konusu ise ve kCaNa=10-3 ise elektrot Ca2+ iyonuna Na+ iyonundan 1000 kez daha duyarlı olduğu sonucu çıkarılır. Girişim yapan iyonun yokluğunda Nernst değişimi gözlenir. Seçicilik katsayısı çeşitli metodlarla bulunabilir. Bunlar;
1. Ayrı çözelti metodu ( separate solution method ),
2. Ana iyonun girişim yapan iyon çözeltisine ilavesi metodu, 3. Girişim yapan iyonun ana iyon çözeltisine ilavesi metodu
(
)
[
nx/ny]
y pot y x, x 0 k a Σ a log 0592 , 0 E E= + + nSeçicilik katsayısının hesaplanmasında bu metotlardan herhangi birisi kullanılabilir. Çalışmada ayrı çözelti metodu kullanıldı. Ayrı çözelti metodunda, elektrodun hem ana iyona karşı hem de girişim yapan iyona karşı kalibrasyonu alınır ve Şekil 2.15’de gösterildiği gibi kalibrasyon grafikleri karşılaştırılarak seçicilik katsayısı hesaplanabilir.
Şekil 2.15. Seçicilik katsayısının kalibrasyon grafiği ile gösterimi
2.4. Enzimlerin Elektrot Yüzeylerine İmmobilizasyonu
Enzimler, sulu ortamlarda veya immobilize edilerek farklı yüzeylerde biyolojik fonksiyonlarını sürdürebilirler. Enzimler için “immobilize” kelimesi bir yüzey üzerine yerleştirilmiş ve aynı zamanda biyolojik özelliklerini koruyan anlamına gelmektedir. İmmobilize enzimler, serbest halde bulunan enzimlere göre çok az dezavantajlara sahiplerdir.
İmmobilize enzimlerin ve immobilizasyon metotlarının avantajları;
1. Tekrar kullanılama imkân sağladıklarından dolayı maliyeti düşürmektedirler. 2. Serbest enzimler kullanıldığında meydana gelen kirlilikten dolayı tekrar enzimin ortamdan uzaklaştırılması gerekmektedir. İmmobilize enzimler kullanıldığında kirlilik meydana gelmemektedir.
3. İmmobilize enzimler daha kararlı bir yapıya sahip olduklarından dolayı fiziksel (sıcaklık, pH) değişimlerden serbest enzimlere göre daha az etkilenirler.
İmmobilize enzimlerin serbest enzimlere göre dezavantajı ise hazırlanması sırasında maliyetin yükselmesi (immobilizasyon metoduna ve kullanılan kimyasallara
göre farklılık göstermektedir) ve aktivitelerinin serbest olanlara göre daha düşük olmasıdır.
Analitik yöntemler içerisinde enzim immobilizyonu ile hazırlanan biyosensör kullanımı artmaktadır. Kullanım ömrünün uzun olması, cevap zamanın kısa ve girişimin az olması gibi özelliklerinden dolayı enzim biyosensörler gıda ve insan sağlığı gibi birçok alanda oldukça yaygın bir şekilde kullanılmaktadır (Guisan 2006).
2.4.1 Enzim İmmobilizasyon Metotları
İmmobilizasyon tekniklerinde en önemli adım enzimin ve elektrot yüzeyinde bulunan matriksin fiziksel ve kimyasal özellikleri incelenerek doğru metodun seçilmesidir. İmmobilizasyon sonrasında enzimin kararlılığında ve kinetik özelliklerinde değişiklikler gözlemlenir. Bunun nedeni matriks yüzeyine yerleştirilmiş olmaları ve reaksiyon sonucunda açığa çıkan ürünlerdir. Enzimlerin immobilizasyon sonrası genellikle aktivitelerinde çözünemediklerinden dolayı azalma meydana gelirken matriks bir yapının içerisinde bulunmalarından dolayı denaturasyona uğramaları gecikmektedir (Guisan 2006).
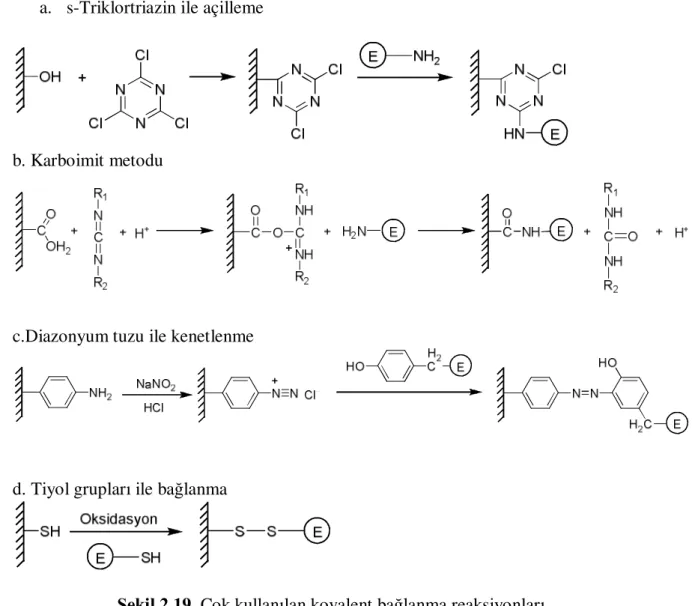
Biosensörlerin yüzeyine enzim immobilizasyon yöntemleri fiziksel ve kimyasal metodlar başlığı altında incelenmektedir. Bu metotlardan dört tanesi yaygın olarak kullanılmaktadır. Bunlar; 1. Adsorbsiyon, 2. Tutuklama, 3. Kovalent bağlanma 4. Çapraz bağlama ve 5. Biyolojik bağlama. Bu metotların avantaj ve özellikleri Çizelge 2.6’da verilmiştir. Şekil 2.16 de immobilizasyon metotlarından beş tanesinin yapısı gösterilmiştir Çapraz bağlama metodu kolay uygulanabilirliği ve maliyetinin düşük olması nedeniyle en çok kullanılan yöntemdir. Enzim immobilizasyonunda kullanılan maddelerde bulunan reaktif gruplar ve reaksiyona girdikleri amino asitler Çizelge 2.7’de gösterilmiştir.
Çizelge 2.6. Enzim immobilizasyon çok kullanılan yöntemlerinin karşılaştırılması
Özellikleri Adsorbsiyon Tutuklama Kovalent bağlanma Çapraz bağlama
Matriks materyali
İnorganik maddeler: iyon değiştirici reçineler, aktif karbon, silika jel, kil, alüminyum dioksit, titanyum, seramik Organik maddeler: nişasta kollagen, modifiye sefaroz, CM selüloz
Kollagen, poliakrilamit, jelatin, silikon,
poliüretan, stirilpridin grubu ile polivinil alkol, Aljinat, Karajenan,
Agaroz, selüloz, polivinil korür, iyon değiştirci reçineler, gözenekli cam
Glutaraldehid, bis-izosiyanat, bis-diazobenzidin, diazonyum tuzları, ovalbumin ve bovin plazma albumin
Bağlanma şekli
Tersinir: pH sıcaklığa veya iyon yüküne göre enzim yüzeyden
ayrılabilir.
Fiziksel tutuklama Kimyasal bağlanma
Peptid bağı, alkilasyon, poli-fonksiyonel gruplarla bağlanma Tutuklama Enzim tutunma seviyesi Düşük Düşük Yüksek Yüksek
Şekil 2.16. Biyomoleküllerin immobilizasyon metotları. A Adsorpsiyon. kovalent olmayan zayıf elektrostatik etkileşimler, van der Waals etkileşimleri hidrojen bağları ve hidrofobik etkileşimler. B Kovalent Bağlanma. Güçlü kimyasal bağlar sayesinde biyomoleküller kararlı bir şekilde yüzeye bağlanırlar. C Çapraz bağlama moleküller birbiri arasında ve elektrot yüzeyine kovalent bağlanır. D Tutuklama biyomoleküller polimer ağın içerisine hapsedilir. E Dış membrana tutuklama
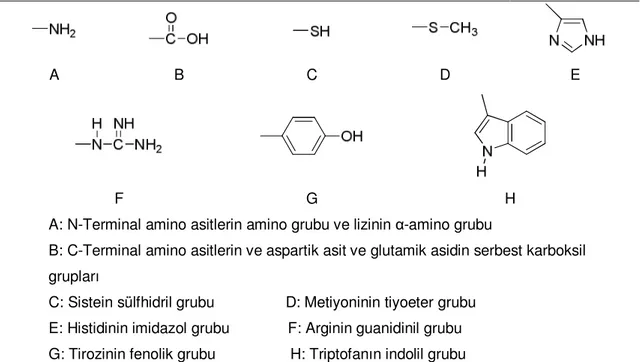
Çizelge 2.7. Enzim immobilizasyonunda kullanılan reaktif gruplar ve reaksiyona girdikleri amino asitler
Taşıyıcının reaktif grubu Enzimdeki fonksiyonel grup ve ilgili amino asiti Diazonyum tuzu -NH2 (Lys, N-Terminal) -SH (Cys) Asit anhidrit -NH2 (Lys, N-Terminal) (Tyr) -CH2CON3 Açilazid -NH2 (Lys, N-Terminal) -SH (Cys) (Tyr) İmidokarbonat -NH2 (Lys, N-Terminal) -R-NCS
İzotiyosiyanat -NH2 (Lys, N-Terminal)
İzosiyanat
-NH2 (Lys, N-Terminal)
-CH2COCl
Açil klorür -NH2 (Lys, N-Terminal)
Siklik karbonat
O-Açilizoüre
-NH2 (Lys, N-Terminal)
Woodward Reaktifi KTürevi
-NH2 (Lys, N-Terminal) 5-Floro-2,4-dinitroanilid -NH2 (Lys, N-Terminal) Triazinil -NH2 (Lys, N-Terminal) -NH2 (Lys, N-Terminal) -OH (Ser) -SH (Cys) Vinilsülfonil NH2 (Lys, N-Terminal) -SH (Cys) -OH (Ser) O O O Vinilketo NH2 (Lys, N-Terminal) -SH (Cys) -OH (Ser) -CHO Aldehid NH2 (Lys, N-Terminal)
-COOH (Asp, Glu, C-Terminal) NH2 (Lys, N-Terminal)
İmin NH C OC2H5 İmidoester NH2 (Lys, N-Terminal) -CN
Siyanür NH2 (Lys, N-Terminal)
Disülfid artığı -SH (Cys) Civa türevi -SH (Cys) -NH2 Amin
-COOH (Asp, Glu, C-Terminal) NH2 (Lys, N-Terminal) Kondanse edici reaktif varlığında
gerçekleşir
-CONHNH2 Açilhidrazid
-COOH (Asp, Glu, C-Terminal) NH2 (Lys, N-Terminal) Kondanse edici reaktif varlığında
gerçekleşir
2.4.1.1 Fiziksel Metodlar
2.4.1.2. Adsorbsiyon
İmmobilizasyonda kullanılan en eski ve basit yöntemdir (Telefoncu 1999). Katı matriks üzerine enzim kolay ve hızlı bir şekilde fiziksel adsorbsiyon yöntemi kullanılarak immobilize edilmektedir. Bu metotda enzim ile matriks arasında van der Waals gibi zayıf bağlar ile hidrofobik, hidrofilik veya iyonik etkileşimlerle meydana gelmektedir. Enzimin aktif bölgesi bu bağlanmadan etkilenmez ve aktivitesini korur (Mulchandam ve ark 1998).
Birçok enzimin immobilizasyonu adsorbsiyon yöntemine göre gerçekleştirilmektedir. Çözünmeyen enzimler için adsorbsiyon yönteminin temel
avantajı kimyasal madde kullanmaya gerek olmaması ve hazırlanması basit bir kaç adımda gerçekleştirilebilmesidir. Sonuç olarak adsorbsiyon ucuz, kolay uygulanabilir ve enzimleri etkilemeyen metottur (Gorton 2005). Zayıf bağlar nedeniyle protein desorbsiyonu (pH, sıcaklık ve iyon yükünün değişmesinden kaynaklanan) problem olarak görülmektedir. Diğer bir dezavantajı ise spesifik bir adsorbsiyon olmadığından diğer protein yapıdaki biyolojik maddelerde yüzey de girişim yapabilmektedir (Guisan 2006; Zhang ve ark. 2008).
2.4.1.2 Dış Membrana Tutuklama
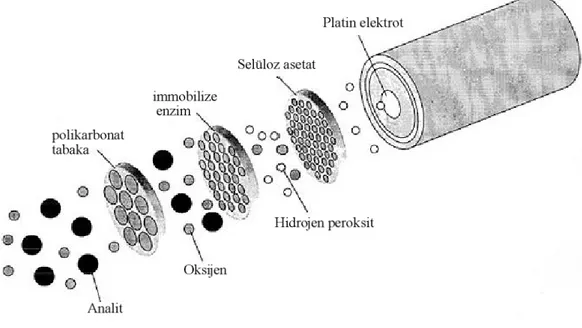
Bu metot elektrot yüzeyindeki membran içerisine enzimin hapsedilmesiyle gerçekleştirilir. Membran içerisinde kalan oluşan uygun boşluklardan substrat difüze olur ve reaksiyon gerçekleşir. Çok çeşitli sayıda membran bulunmaktadır. Örneğin naylon, selüloz nitrat, selüloz asetat, epoksi reçinesi, kollagen, polisülfonlar, poliakrilatlar ve polikarbonatlar. Bu metotun dezavantajları substratların, oluşan ürünlerin ve membranda bulunan inhibitörlerin hareketi ile ilişkilidir. Bu maddeler enzim tabakasının inhibisyonuyla hatalı ölçüm almasına sebep olabilir (Rusling 2003). Şekil 2.17’de ticari glukoz sensör şematize edilmiştir.
2.4.1.3. Tutuklama
Polimerleşme sırasında enzim diyaliz membranlarına ya da gözenekli jel matrikslerine tutuklanarak enzim immobilizyonu yapılır. Düşük molekül ağırlıklı substratlarla reaksiyon ürünlerinin difüze olması bazı yapılarda mümkündür. Poliakrilamid jeller, polivinil alkoller, yüklü polimerler, katyonik ve anyonik gruplar gibi çok sayıda materyal enzim tutuklama metodunda kullanılır (Rusling 2003).
Genellikle bu immobilizasyon metodu bütün enzim türleri (dehidrogenazlar, alkol oksidazlar, kolinesterazlar, kolin oksidazlar, glukoz oksidazlar ve tirozinazlar) için uygundur. Bununla birlikte diğer sistemlere göre kolay uygulanabilir ve ucuzdur. Bu metodun dezavantajları ise ortamda serbest radikaller bulunduğunda veya enzim immobilizasyonu sağlandıktan sonra polimerizasyonu tamamlamak için elektroda ultraviyole radyasyon uygulandığında enzim aktivitesini kaybedebilmektedir (Gorton 2005). Bu problemler biyosensörün cevap zamanını ve kararlılığını etkilemektedir. Son zamanlarda jel matriks temelli immobilizasyon metotları yaygın olarak biyosensör yapımında kullanılmaktadır. Çünkü jel materyalleri spesifik özeliklere sahip olmaları nedeniyle biyosensörlerin sağlamlık, ısıya dayanıklılık, çözücü ortamlarından etkilenmeme, organik ve sulu ortamlarda çalışabilme gibi özelikleri kazanmasını sağlamıştır (Guisan 2006; Zhang ve ark. 2008).
2.4.1.4. Elektropolimerizasyon
Enzimler, polipirol, polifenol, polianilin ve politiyofen gibi fiziksel olarak iletken polimerler kullanılarak immobilize edilebilmektedirler. Elektrokimyasal potansiyostatik ve galvanostatik yöntemler kullanılarak monomerlerin polimerizasyonu ile hassas ve ince tabaka şeklinde enzimler immobilizasyonu sağlanır. Bu tekniğin avantajları immobilizasyon işleminin kontrol edilebilmesi, birçok elektrot materyalinin kullanılabilir olması (platin, altın ve karbon) ve minyatürizasyona uygun olmasıdır. Hazırlama işleminin basit olmasına rağmen bu yöntemin dezavantajı immobilize olan enzim miktarının tam olarak belirlemenin zor olmasıdır (Rusling 2003). Şekil 2.18’de pirolün elektropolimerizasyonu gözlenmektedir.
N H Elektrot -e N H Nu: N H NH N N H H H H N N H H H H -2H+ Elektrot -e -2H+ N N H H Elektrot -e N N H H vb. vb. N N N N H H H H
Şekil 2.18. Pirolün elektrokimyasal polimerizasyonu için genel mekanizma
2.4.1.5 Elektrot Modifikasyonu
Enzim imobilizasyonu ticari olarak bulunan aktif hale getirilmiş grafit ya da epoksi-grafit içeren materyaller üzerine enzim ilave edilerek yapılabilir. Bu işlem
elektrodun yüzeyinde duyarlı bir tabaka elde etmek için yapılır. Bu yöntemle yapılan elektrotlar kararlılığı çok iyi ve kullanım ömrü uzundur (Gorton 2005).
2.4.1.2. Kimyasal Metotlar
2.4.1.2.1 Kovalent Bağlama
Çok yaygın olarak kullanılan bu yöntemde enzim ile elektrot yüzeyinde bulunan matriks arasında kovalent bağ meydana gelir. Bu bağ enzim ve matriksde bulunan fonksiyonel gruplar arasında meydana gelir. Enzimin aktif bölgesinin kovalent bağ oluşumuna katılmaması gerekir bu nedenle kovalent bağlanma işlemi sırasında çözeltiye enzim inhibitörleri ilave edilir. Uygun koşullar altında proteinlerin fonksiyonel grupları kovalent bağlanabilmektedirler. Örneğin zincirin α-amino grupları, lizin ve arjinin ɛ-grupları, zincirin α-karboksil ɛ-grupları, aspartik asit ve glutamik asitlerin β- ve γ-karboksil grupları, tirozinin fenol halkası, sisteinin tiyol grubu, serin ve treoninin hidroksil grupları, histidinin imidazol grubu ve tritofanın indol grubu. Enzimlerin kovalent bağlanmasında kullanılabilecek aktif gruplar Çizelge 2.8’de verilmiştir (Guisan 2006).
Çizelge 2.8. Enzimlerin kovalent bağlama ile immobilizasyonda bağ oluşumuna katılan amino asit grupları
A B C D E
F G H
A: N-Terminal amino asitlerin amino grubu ve lizinin α-amino grubu
B: C-Terminal amino asitlerin ve aspartik asit ve glutamik asidin serbest karboksil grupları
C: Sistein sülfhidril grubu D: Metiyoninin tiyoeter grubu E: Histidinin imidazol grubu F: Arginin guanidinil grubu G: Tirozinin fenolik grubu H: Triptofanın indolil grubu
Protein üzerinde bulunan amino grupları ve fenolik kısımlar hariç diğer fonksiyonel gruplar reaksiyonlarla ile bir araya gelebilmektedir (Zhang ve ark. 2008). Amino etil selüloz, karboimidli bir ortamda enzimdeki karboksil gruplarıyla bağ oluşturur. Proteindeki tiol kısımları yükseltgenerek N-akriol-sistein ve çapraz bağlayıcı akrilamid kopolimerleriyle bağ oluşturmaktadır. Birçok ticari aktive edilmiş membranlar kovalent olarak enzim immobilizasyonunda kullanılmaktadır (Mulchandam ve ark 1998). Şekil 2.19’da çok kullanılan kovalent bağlanmalara örnekler görülmektedir.