T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI Prof. Dr. Savaş KANSOY
FENİLKETONÜRİ VE HİPERFENİLALANİNEMİLİ ÇOCUKLARDA
FENİLALANİN KISITLI DİYET İLE TETRAHİDROBİYOPTERİN’İN
OKSİDATİF STRES PARAMETRELERİ ÜZERİNE ETKİSİNİN
KARŞILAŞTIRILMASI
METABOLİZMA ve BESLENME
YANDAL UZMANLIK TEZİ
Uz. Dr. Mehtap KAĞNICI
TEZ YÖNETİCİSİ
Prof. Dr. Mahmut ÇOKER
ÖNSÖZ
Ege Üniversitesi Tıp Fakültesi Çocuk Sağlığı ve Hastalıkları Anabilim Dalı Metabolizma Bilim Dalı yandal eğitimim süresince desteğini aldığım; tecrübe, ilgi ve emeğini paylaşan ve yetişmemde büyük katkısı olan sayın değerli hocam Prof. Dr. Mahmut Çoker’e çok teşekkür ederim.
Tezimde büyük katkıları ve emeği olan sayın hocam Prof. Dr. Eser Yıldırım Sözmen’e, eğitimim süresince yardımlarını esirgemeyen sayın hocam Prof. Dr. Sara Habif’e,
Tecrübe, bilgi ve sevgisini benimle paylaşan sevgili hocam sayın Doç. Dr. Sema Kalkan Uçar’a,
Anabilim Dalı Başkanımız sayın hocam Prof. Dr. Savaş Kansoy başta olmak üzere tüm Çocuk Sağlığı ve Hastalıkları Anabilim Dalı öğretim üyelerine, Yandal uzmanlık eğitimim süresince beraber çalıştığım uzman arkadaşlarım Ebru Canda, Melis Köse, diyetisyen arkadaşım Yasemin Atik Altınok’a, Metabolizma Laboratuarında görev yapan teknisyen arkadaşlarıma, istatistiksel analizler sırasında yardımlarından dolayı EÜTF Tıbbi İstatistik Anabilim Dalı çalışanlarına, Çocuk Sağlığı ve Hastalıkları bölümünde çalışan doktor, hemşire, personel ekibine ve minik sevimli hastalarıma çok teşekkür ederim.
Ayrıca yaşamımın her anında koşulsuz sevgi ve destekleriyle yanımda olan sevgili eşime, biricik oğluma ve canım aileme sevgilerimi sunarım.
Uz. Dr. Mehtap Kağnıcı
Bu çalışma EÜTF Araştırma Projeleri Alt Komisyonu tarafından desteklenmiştir. Proje No: 2013-TIP-071
İÇİNDEKİLER
KISALTMALAR ...v
TABLOLAR VE ŞEKİLLER ...viii
1. GİRİŞ VE AMAÇ ... 1
2. GENEL BİLGİLER ... 4
2.1. Fenilalanin metabolizma bozuklukları ... 4
2.1.1. Hiperfenilalaninemiler ... 5 2.1.2. Fenilketonüri ... 6 2.1.3. BH4 metabolizma bozuklukları ... 7 2.2. Fenilketonürinin Sıklığı ... 8 2.3. Tanı ve Sınıflandırma... 8 2.4. Tedavi ve prognoz ... 9
2.4.1. Beslenme ( diyet ) tedavisi... 9
2.4.2. Diğer tedavi yöntemleri ... 15
LNAA Tedavisi ... 15
PAL Enzim Tedavisi... 16
Glikomakropeptid Tedavisi ... 16
Gen Tedavisi... 16
2.5. Tetrahidrobiyopterin ( BH4; sapropterin ) Tedavisi... 16
2.5.1. BH4 Etki Mekanizması... 17
2.5.2. BH4 ile Tedavi ... 17
2.5.3. Sapropterin yanıtlılığını belirlemede BH4 yükleme testi ... 18
2.5.4. BH4 yanıtlı hastaların izlemi... 20
2.6. Oksidatif Stres ... 22
2.6.1. Serbest Radikaller ve Oksidatif Hasar ... 22
2.6.2. Antioksidan Savunma Sistemi... 23
2.6.3. Oksidatif Stres ve Nörodejenerasyon ... 23
2.6.4 Oksidatif Stres Parametreleri... 24
Glutatyon peroksidaz ( GSHPx ) ... 24
Katalaz ( CAT ) ... 24
Tiyobarbitürik asit reaktif türleri ( TBARS ) ... 25
Paraoksonaz ( PON )... 25
Asimetrik Dimetilarjinin ( ADMA ) ve arjinin ... 26
Homosistein ... 27
Nitrit / Nitrat ( NOx ) ... 28
Vitamin E... 29
2.7. Fenilketonüri’de oksidatif stres ... 29
2.7.1. Fenilketonüride diyet kısıtlaması... 29
2.7.2. Reaktif türevlerin aşırı oluşumu... 30
2.8. BH4 ve oksidatif stres ilişkisi ... 31
3. GEREÇ VE YÖNTEM... 33 3.1. Çalışma Grubu ... 33 3.1.1. Kapsam... 33 3.1.2. Çalışmanın yürütülmesi ... 33 3.2. Yöntemler... 35 Homosistein düzeyi... 35
Glutatyon peroksidaz düzeyi... 35
Nitrit / Nitrat düzeyi... 35
8-hidroksi-2-deoksiguanozin düzeyi ... 36
Vitamin E düzeyi... 36
Asimetrik dimetilarjinin düzeyi ... 36
Arjinin düzeyi ... 36
Paraoxonaz aktivitesi ... 36
Paraoxonaz /aril esteraz aktivitesi ... 36
Bazal malondialdehit düzeyi ... 36
Serum oksidasyona yatkınlığı ( TBARS ) ... 37
Katalaz aktivitesi ... 37 3.3. İstatistiksel Yöntem... 37 4. BULGULAR ... 38 5. TARTIŞMA ... 53 6. SONUÇLAR... 63 7. KAYNAKLAR ... 67 8. TÜRKÇE ÖZET... 78 9. İNGİLİZCE ÖZET... 80 10.EKLER... 83
10.1. Etik Kurul Onayı... 83
10.2. Bilgilendirilmiş Gönüllü Olur Formu... 84
10.3. Hasta Rapor Formu ... 88
KISALTMALAR
ABD : Amerika Birleşik Devletleri ADMA : Asimetrik dimetil arjinin ATP : Adenozin trifosfat A vit : A vitamini BH2 : Dihidrobiyopiterin BH4 : Tetrahidrobiyopterin Ca² : Kalsiyum CAT : Katalaz C vit : C vitamini
DBK : Demir Bağlama Kapasitesi
DDAH : Dimetil arjinin dimetil amino hidrolaz DHPR : Dihidropteridin redüktaz
dl : Desilitre
DNA : Deoksiribonükleik asit EC : Enzim komisyon numarası EDTA : Etilendiamintetra-asetat EEG : Elektroensefalogram
ELİSA : Solid-faz enzim-linked immunosorbent eNOS : Endotelyal nitrik oksit sentaz
E vit : E vitamini FA : Fenilalanin
FAH : Fenilalanin hidroksilaz enzimi
Fe : Demir
FKÜ : Fenilketonüri
GSH : Glutatyon
GSHPx : Glutatyon Peroksidaz GTP : Guanozin trifosfat
GTPCH : Guanozin trifosfat siklohidrolaz
Hb : Hemoglobin
Hcy : Homosistein
HFA : Hiperfenilalaninemi
H2O : Su
H2O2 : Hidrojen peroksit
HPLC : High Performance Liquid Chromatography HVA : Homovalinik asit
HIAA : Hidroksi indol asetik asit IQ : Intelligence Quotient
iNOS : indüklenebilir nitrik oksit sentaz
Kb : Kilobaz
Kg : Kilogram
Km : ‘Michaelis’ sabiti
L : Litre
LDL : Low density lipoprotein LNAA : Large neutral amino acid
mg : Miligram
MDA : Malondialdehid MR : Manyetik Rezonans
mRNA : Messanger RNA
μmol : Mikromol
NADH : Redükte nikotinamid adenin dinükleotid NADPH : Nikotinamid Adenin Dinükleotid Fosfat
nmol : Nanomol
NO : Nitrik oksit NOS : Nitrik oksit sentaz
nNOS : Nöronal nitrik oksit sentaz
NO₂⁻ : Nitrit
NO₃⁻ : Nitrat
Non-FKÜ-HFA : Nonfenilketonürik hiperfenilalaninemi NOx : Nitrit / Nitrat
8-OHdG : 8-hidroksi-2-deoksiguanozin
OMIM : Online Mendelian Inheritance in Man
PAL : Fenilalanin amonya liyaz
PCD : Pterin-4a-karbinolamin dehidrataz
PON : Paraoksonaz
PON1 : Paraoksonaz
PON2 : PON aril esteraz
PRMT : Protein arjinin metil tranferaz PP : Pirofosfat
PTPS : Pirüvoyil tetrahidrobiopterin sentaz
Q10 : Ubiquinone-10
rAv : Rekombinan Anabaena variabilis
rAvPAL – PEG : Rekombinan Av fenilalanin amonya liyaz- pegilasyon PUFA : Çoklu doymamış yağ asidi
RNS : Reaktif nitrojen türevi ROS : Reaktif oksijen türevi SDS : Standart deviasyon skoru SOD : Süperoksit dismutaz
SPSS : Statisitical package for social sciences SR : Sepiapterin redüktaz
SS : Standart sapma SSS : Santral sinir sistemi VA : Vücut ağırlığı Vit B12 : Vitamin B12
VKİ : Vücut kitle indeksi TAS : Total antioksidan durum
TABLOLAR VE ŞEKİLLER
TABLOLAR
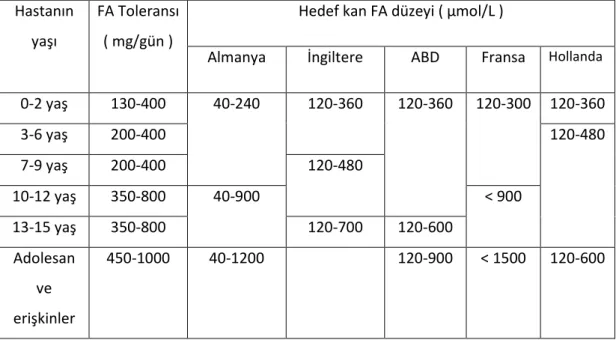
Tablo 2.1. Günlük FA toleransı, farklı ülkelere göre hedef kan FA düzeyleri... 10
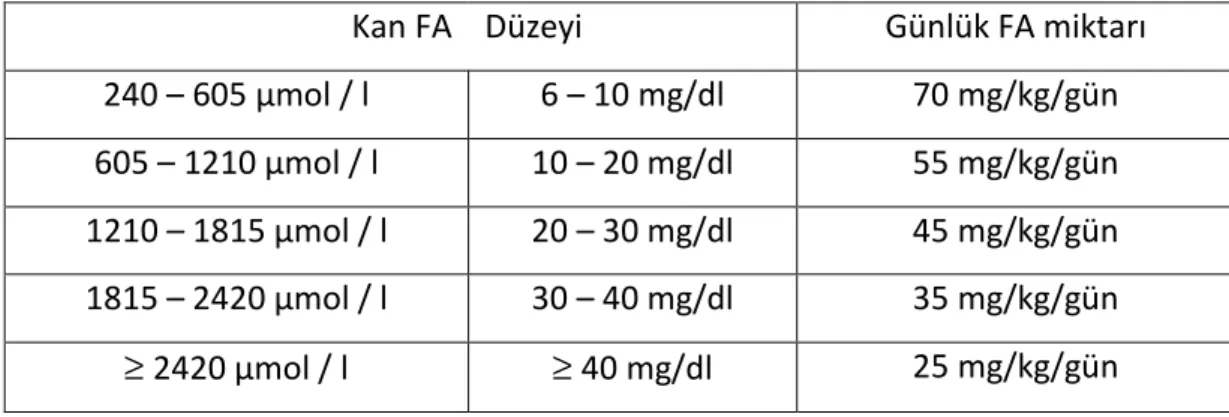
Tablo 2.2. Kan FA düzeylerine göre hesaplanan günlük FA tüketimi... 11
Tablo 2.3. Hasta yaşına göre hesaplanan günlük FA tüketimi ... 12
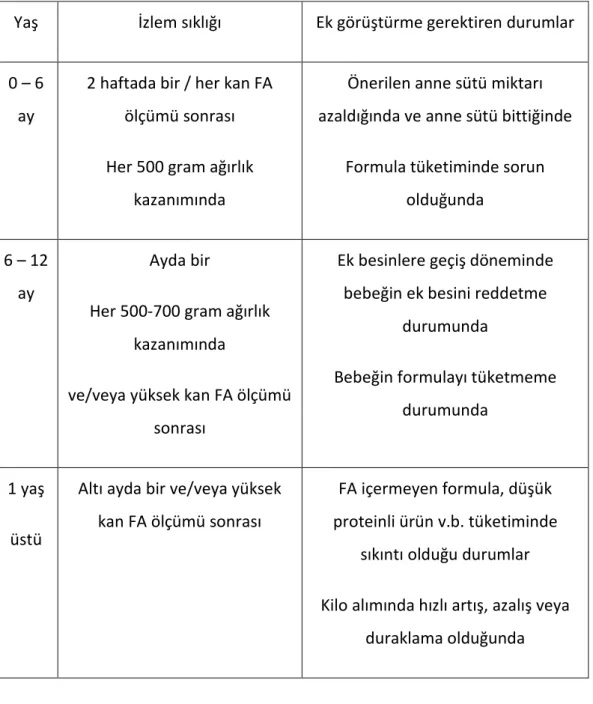
Tablo 2.4. Hastaların beslenme izlem sıklığı ... 13
Tablo 2.5. Hastaların poliklinik izlem sıklığı... 14
Tablo 2.6. Hedef kan FA değerleri... 14
Tablo 2.7. Bilim dalımızda uygulanan BH4 yükleme testi protokolü ... 19
Tablo 4.1. Hastaların bazal tanımlayıcı özellikleri ... 38
Tablo 4.2. Çalışma gruplarının bazal tanımlayıcı özellikleri ... 39
Tablo 4.3. Çalışma gruplarının FA, tirozin değeri, FA toleransı, protein tüketimi ve teste yanıt yüzdesi yönünden değerlendirilmesi ... 40
Tablo 4.4. Çalışma gruplarının bazal beslenme parametreleri yönünden değerlendirilmesi... 41
Tablo 4.5. Çalışma gruplarının bazal oksidatif stres parametreleri açısından değerlendirilmesi... 42
Tablo 4.6. Çalışma gruplarının 6. ay oksidatif stres parametreleri açısından değerlendirilmesi... 43
Tablo 4.7. BH4 yanıtlı ve BH4 kullanan grubun bazal ve 6. ay oksidatif stres parametreleri açısından değerlendirilmesi ... 44
Tablo 4.8. BH4 yanıtlı ve diyet ile takipli grubun bazal ve 6. ay oksidatif stres parametreleri açısından değerlendirilmesi ... 45
Tablo 4.9. BH4 yanıtsız ve diyet ile takipli grubun bazal ve 6. ay oksidatif stres parametreleri açısından değerlendirilmesi ... 46
ŞEKİLLER
Şekil 2.1 Fenilalanin Metabolizması ... 5
Şekil 2.2. ADMA’nın oluşumu ve yıkılımı ... 27
Şekil 2.3. Fenilketonüride oksidatif stres... 31
Şekil 2.4. Düşük BH4 seviyelerinde BH4-NOS ayrılması ve ROS oluşumu ... 32
Şekil 4.1. Gruplarının bazal ve 6. ayda oksidatif stres parametreleri ortalaması yönünden karşılaştırılması ( PON, PON aril esteraz, GSHPx )... 47
Şekil 4.2. Gruplarının bazal ve 6. ayda oksidatif stres parametreleri ortalaması yönünden karşılaştırılması ( CAT )... 47
Şekil 4.3. Gruplarının bazal ve 6. ayda oksidatif stres parametreleri ortalaması yönünden karşılaştırılması ( MDA– bazal TBARS, TBARS, arjinin, Hcy) .. 48
Şekil 4.4. Gruplarının bazal ve 6. ayda oksidatif stres parametreleri ortalaması yönünden karşılaştırılması ( NOx ) ... 48
Şekil 4.5. Gruplarının bazal ve 6. ayda oksidatif stres parametreleri ortalaması yönünden karşılaştırılması ( vitamin E ) ... 49
Şekil 4.6. Gruplarının bazal ve 6. ayda oksidatif stres parametreleri ortalaması yönünden karşılaştırılması ( ADMA, 8OHdG ) ... 49
Şekil 4.7. BH4 yanıtlı ve BH4 kullanan grupta bazal CAT ile MDA-bazal TBARS pozitif korelasyonu... 50
Şekil 4.8. BH4 yanıtlı ve BH4 kullanan grupta 6. Ay stimüle TBARS – FA pozitif korelasyonu ... 50
Şekil 4.9. BH4 yanıtlı ve BH4 kullanan grupta 6. Ay PON – FA negatif korelasyonu.... 51
Şekil 4.10. BH4 yanıtsız diyet grubunda bazal vitamin E – 8OHdG negatif korelasyonu ... 51
Şekil 4.11. BH4 yanıtsız diyet grubunda 6. Ay stimüle TBARS – Arjinin negatif korelasyonu ... 52
1. GİRİŞ VE AMAÇ
Hiperfenilalaninemiler, fenilalaninin ( FA ) tirozine dönüşümünü sağlayan fenilalanin hidroksilaz ( FAH ) enziminin eksikliği veya bu enzimin kofaktörü olan tetrahidrobiyopterinin ( BH4 ) üretim veya döngüsündeki bozukluk sonucu ortaya çıkan heterojen bir grup hastalıktır. Klasik fenilketonüri ( FKÜ ), FAH enziminin tama yakın eksikliğinden kaynaklanan ve tedavi edilmediğinde ağır mental gerilikle karakterize otozomal resesif geçişli, en sık görülen doğumsal amino asid metabolizması hastalığıdır ( OMIM 2626000 ) ( 1, 2 ). Enzimi kodlayan gen 12. kromozomda yer alır ve 560'dan fazla mutasyon tanımlanmıştır ( 3 ).
Hiperfenilalaninemiler; FAH enzim aktivitesine, tedavi öncesi kan FA düzeyine ve tedavi sırasında beslenme ile alınabilen günlük FA miktarına göre sınıflandırılır. Klasik FKÜ'de açık beslenme ile bir başka deyişle sağlıklı çocuk beslenmesinde belirtilen protein alımı ile kan FA düzeyi 20 mg/dl veya 1200 μmol/L'nin üzerindedir. 10 – 20 mg/dl veya 600 – 1200 μmol/L arasında olan hafif FAH eksiklik durumunda ‘’hiperfenilalaninemi ( HFA ) veya hafif FKÜ’’, kan FA düzeyi 120 – 600 μmol/L veya 2 – 10 mg/dl arasında olan kan FA düzeyleri ise ‘’hafif HFA’’ olarak adlandırılır ( 1, 3 ). FKÜ, tanısı yenidoğan tarama yöntemiyle yenidoğan döneminde konduğunda uygun tedaviyle klinik bulgularının engellenebildiği bir metabolizma hastalığıdır. Yaklaşık 60 yıl önce geliştirilen ve etkinliği gösterilen FA kısıtlı diyet tedavisinin hayatın ilk haftası içinde başlanması ve ömür boyu sürdürülmesi gereklidir ( 2 ). Son zamanlarda fenilketonüri tedavisinde gelişmeler olmuştur. Bunlardan rutin uygulamaya girmiş olanı kofaktör olan BH4’ün, rezidüel fenilalanin hidroksilaz enzimi olan hastalara kullanımıdır. BH4’ün sentetik analoğu olan sapropterin’e yanıtlı olduğu belirlenen FKÜ hastalarına, FA kısıtlı diyetle birlikte sapropterin'in verilmesi; FA düzeylerinde daha fazla düşme, günlük FA toleransında artış, FA kısıtlı diyette serbestleşme sağlayarak, normal IQ ve nöropsikolojik fonksiyon sağlar ( 2, 3, 4, 5, 6 ).
FA metabolizmasında kofaktör olarak görev yapan BH4’ün metabolizma bozuklukları; pterin metabolizması bozuklukları grubunda değerlendirilir. BH4 metabolizma bozukluğu olan hastalar geçmişte ‘’malign FKÜ veya malign HFA’’
olarak adlandırılırken, günümüzde altta yatan enzim eksikliğine göre adlandırılırlar. HFA ve santral sinir sisteminde bozukluğa neden olurlar. Klasik FKÜ tedavisinden farklı olarak BH4 ve nörotransmitter tedavisi gerektirirler ( 1, 7 ).
FA yüksekliğinin etiyolojileri farklılık gösterse de oluşturdukları patoloji ortaktır. FA artışı tedavi edilmediğinde, nörotoksik etki sonucunda yapısal beyin hasarı, ciddi mental retardasyon ve psikiyatrik bozukluklara yol açar. Yüksek FA seviyeleri depresyon, anksiyete ve dikkat eksikliği oluşturarak bireylerin FA kısıtlı diyete uymalarını daha da zorlaştırmakta ve bu psikiyatrik problemler kısır döngüde artarak devam etmektedir. Söz edilen patolojilerin oluş mekanizması aşağıda sıralanmıştır ( 4 ):
1. Myelin anormallikleri: FA artışı ile myelinizasyon gecikmesi ve erişkinlerde dismyelinizasyon oluşumu
2. Kan beyin bariyerinde transport bozukluğu: FA ve diğer esansiyel amino asid transportu ortak olduğundan FA artışı sonucu dopamin ve seratonin öncüleri olan tirozin ve triptofan geçişinin azalması
3. Nörotransmitter eksikliği: Dopamin seviyesinde azalma
Yukarıda açıklanan mekanizmaların yanı sıra oksidatif yolağın etkilenmesi de son zamanlarda tartışılmaktadır. Fenilketonürili çocuklarda daha fazla ve abartılı reaktif oksijen ve nitrojen ürünleri üretimi sonucunda oksidatif streste belirgin bir artış vardır. FKÜ'de gelişen oksidatif stres oluşumunun 2 temel nedeni;
1. Diyet kısıtlamasının, enzimle oluşan ve enzim dışı antioksidan savunma mekanizmalarını bozması
2. Hastalığın kendi doğası ve oluşan metabolitler nedeniyle reaktif radikallerin aşırı oluşumudur ( 8, 9, 10 ).
Oksidatif streste artış ile beraber protein oksidasyonu ile karboniller, karbonhidrat oksidasyonu ile hidrokarbonlar, lipid oksidasyonu ile plazma aldehidleri ve malondialdehid ( MDA ) oluşur. Bütün bunların etkisiyle hücresel
yapılarda zedelenme ve hücre ölümü gerçekleşir. Sayılanların dışında asimetrik dimetil arjinin ( ADMA ) de patogenezde rol oynar. ADMA, nitrik oksit sentaz ( NOS ) enzim inhibisyonu yaparak, L-arjininden nitrik oksit ( NO ) sentezlenmesini engelleyen metillenmiş bir arjinin türevidir. ADMA, potent bir vazodilatör olan NO sentezini engelleyerek endotel disfonksiyonuna yol açmaktadır. FKÜ'de FA kısıtlı diyet ve BH4 tedavisi ile ADMA, NO metabolizması ve oksidatif stres ilişkisini ortaya koyan çalışmalar mevcuttur ( 8, 10-13 ).
Homosistein sülfür içeren bir amino asid olup, DNA ve/veya RNA demetilasyonu sırasında metionin demetilasyonu sonucu oluşmaktadır. Sülfür içeren bir amino asid olan homosisteinin plazma düzeylerinde artışı; kardiyovasküler hastalıklar, osteoporoz, böbrek yetmezliği, diyabetik mikroanjiyopati gibi pek çok hastalıkta risk faktörüdür. FKÜ hastalarında homosistein ve protein alımının değerlendirilmesi; oksidatif stres, endotelyal disfonksiyon ve NO düzeylerinin ayarlanması konularında önemli bilgiler verir ( 8, 10-14 ).
Bu çalışmada; Ege Üniversitesi Tıp Fakültesi Çocuk Sağlığı ve Hastalıkları Anabilim Dalı, Metabolizma Bilim Dalı’nda FKÜ ve HFA nedeniyle izlenen, FA kısıtlı diyet ve BH4 tedavisi alan hastalarda, oksidatif stres sürecinin incelenmesi amaçlanmıştır. Buna yönelik olarak BH4 tedavisi başlamadan önce ve tedavinin altıncı ayında alınan kan örneklerinde aşağıdaki parametrelerle oksidatif stres değerlendirmesi yapılmıştır: glutatyon peroksidaz, katalaz, paraoksonaz, paraoksonaz aril esteraz, asimetrik dimetilarjinin, homosistein, nitrit / nitrat, arjinin, malondialdehit, tiyobarbitürik asit reaktif türleri, vitamin E ve 8-hidroksi-2-deoksiguanozin. Böylelikle, FKÜ tedavisinde yeni bir uygulama olan BH4 tedavisi etkinlik ölçümü bir başka açıdan gerçekleştirilmiş olacaktır.
2. GENEL BİLGİLER
2.1. Fenilalanin metabolizma bozuklukları
FA aromatik yapıda olan esansiyel bir amino asittir. Karaciğerde FAH enzim sistemi tarafından metabolize edilir. İlk basamakta irreversibl katabolizma ile hidrolize edilerek tirozine dönüştürülür. FAH enzimi kofaktör olarak aktif pterin olan BH4'e ihtiyaç duyar. BH4, üç basamakta guanozin trifosfat ( GTP )' tan oluşur ( 1 ). Hidroksilasyon reaksiyonu boyunca BH4, inaktif pterin-4a-karbinolamin'e dönüşür. İki enzim; dihidropteridin redüktaz ( DHPR ) ve pterin-4a-karbinolamin dehidrataz ( PCD ), q- dihidropterin yoluyla BH4'ün rejenerasyonunu sağlar. BH4 aynı zamanda tirozin hidroksilaz ve triptofan hidroksilaz için de kofaktör olup, dopamin, katekolamin, melanin ve seratonin ile NOS için de gereklidir ( Şekil 2.1. ) ( 1 ). FAH enziminin eksikliği veya BH4 üretim veya döngüsündeki bozukluk sonucu HFA yanı sıra; tirozin, L-dopa, dopamin, melanin, katekolaminler ve 5-hidroksitriptofan eksikliği oluşur. Tirozine hidroksilasyonu engellenen FA, transaminasyon ile fenilpirüvik asite dönüşür ve idrarda atılır ( 1, 7 ).
Şekil 2.1. Fenilalanin Metabolizması ( 1 )
2.1.1. Hiperfenilalaninemiler
Hepatik FAH enzimini kodlayan gende ve pterin metabolizmasında görevli enzimleri kodlayan genlerde oluşan mutasyonlar sonucunda FA metabolize edilemez ve kanda düzeyleri yükselir, HFA gelişir ( 2, 7 ). HFA terimi tüm etyolojik varyantları kapsar, yani klinik tabloyu tanımlamaktan çok sonucu açıklamaya yöneliktir. Hafif HFA'de doğal kan FA düzeyleri 200 – 600 μmol/L arasında olup benign bir klinik durum olarak bilinmektedir ( 15 ). FKÜ ise FAH aktivitesindeki ciddi eksiklik sonucu oluşur ve tedavisiz bırakıldığında kalıcı santral sinir sistemi hasarına
Guanozin trifosfat ( GTP ) GTPCH Dihidroneopterin trifosfat 6-pirüvoyiltetrahidropterin SR Tetrahidrobiyopterin Pterin-4a-karbinolamin q-dihidrobiyopterin Tirozin
PA
H
Tirozin Dopamin PTPS Neopterin DHPR Fenilalanin L-DOPA HVA Biyopterin Primapterin Triptofan 5-OH-Triptofan Serotonin 5HIAA Arjinin Sitrülin + NO PCD FAHneden olur. Bu nedenle gerek klasik FKÜ, gerekse de hafif HFA / atipik FKÜ’de kan FA düzeyleri yaşam boyu 120 – 360 μmol/L arasında tutulmalıdır ( 4, 15 ).
2.1.2. Fenilketonüri
FKÜ ilk kez 1934’de Folling tarafından infant ve çocuklarda progresif, geriye dönüşümsüz nörolojik bozukluk olarak tanımlanmış, tedavisiz bireylerde mental, davranışsal, nörolojik ve fiziksel yetersizlik geliştiği bildirilmiştir. Zeka geriliği nedeniyle izlenen hastaların idrarlarında, demir-3-klorür ile anormal bir renk oluştuğunu fark etmiş, fenilpirüvik asit atılımı saptayarak hastalığı “İmbecillitas Phenylpyrouvica” olarak isimlendirmiştir ( 16 ). Geç tanı alan hastalarda ciddi mental retardasyon ( IQ ≤ 50 ), idrarda fare kokusu ( fenilasetik asid atılımı nedeni ile ), egzema ( % 20 – 40 ), azalmış saç, cilt ve iris pigmentasyonu ( melanin sentezinde azalma sonucu ), büyüme geriliği, mikrosefali ve nörolojik bozukluklar ( % 25 epilepsi, % 30 tremor, % 5 ekstremitelerde spastisite, % 80 EEG anormallikleri ) gelişir. Tedavisiz FKÜ'lü çocukların beyinlerinde dendrit dallanmasında azalma, sinaptogeneziste yetersizlik ve myelinizasyonda bozulma görülür. Diğer nörolojik belirtiler; kas tonusunda artış ile birlikte piramidal bulgular, hiperreflexi, parkinson benzeri belirtiler, yürüyüş bozuklukları ve tiklerdir. Tüm tedavisiz hastalar davranış problemleri, hiperaktivite, amaçsız hareketler, sterotipi, agresiflik, anksiyete ve sosyal uyumsuzluk gösterir. Klinik fenotip, kan FA düzeyi ile korele olup, FAH eksikliğinin derecesini yansıtır ( 1, 4, 16 ).
Otozomal resesif geçişli bir hastalık olan fenilketonüride, 12. kromozomda yer alan FAH geninde mutasyon vardır. Bugüne dek 560'dan fazla mutasyon tanımlanmıştır ( 1, 3, 17 ). Genotipler ile biyokimyasal fenotip, tedavi öncesi FA düzeyleri ve FA toleransı arasında yakın korelasyon gösterilmiştir. Ancak genotip ile klinik fenotip, nörolojik ve davranışsal etkilenme arasındaki ilişki zayıftır. Mutasyon analizi, tedavinin yönetiminde klinik uygulamaya katkısı az olmakla beraber, BH4 yanıtıyla birlikte olan genotiplerin belirlenmesine katkısı olabilir ( 2, 17 ).
FKÜ'de beyin hasarı FA yüksekliği ile ilişkilendirilmiş olmakla beraber, patogenez tam olarak anlaşılamamıştır. Fenilalanin metabolizmasındaki bozukluk sonucu tirozin yarı esansiyel aminoasid haline gelir. Tirozinin kan düzeyindeki
azalma; melanin, dopamin, norepinefrin gibi biyojenik aminlerin yetersiz sentezine neden olur. FA, tirozin, triptofan gibi büyük nötral amino asitlerin ( large neutral amino asid - LNAA ) kan beyin bariyerini geçmeleri, L-tipi amino asit taşıyıcısı ile gerçekleşir. Bu taşıyıcı için sayılan amino asitler kendi aralarında yarışırlar. Kan FA düzeylerinde artış, beyinde diğer büyük nötral amino asidlerin dengesizliğine, sonuç olarak da tirozin ve seratonin konsantrasyonunda azalmaya neden olur. Normalde 4/1 olan kan/beyin FA oranı bozulur. HFA, beyin amino asid transportu üzerine yaptığı etkilerine ek olarak, tirozinin dopamine hidroksilasyonunu ve triptofanın seratonine dekarboksilasyonunu da azaltır. Metabolik yolun bozulması sonucu oluşan ve biriken fenilketonlar ( fenilprüvat, fenilasetat ve fenillaktat ) da toksik etki yaratır ( 1 ). Sayılanlara ek olarak son zamanlarda oksidatif stres artışının da santral sinir sistemi patolojilerinin oluşumunda çok büyük rol oynadığı öne sürülmektedir ( 8, 10, 12, 13 ).
2.1.3. BH4 metabolizma bozuklukları
BH4, fenilalanin hidroksilaz enziminin koenzimidir. BH4 eksikliklerinin de HFA’ya yol açacağı çok açıktır. Geçmişte BH4 metabolizması bozuklukları malign ( atipik ) FKÜ olarak adlandırılmakla birlikte artık günümüzde altta yatan enzim eksikliği ile anılmaktadır. Bu grup hastalık yenidoğan döneminde kalıcı HFA vakalarının %2’sinden azını oluşturmaktadır. Guanozin trifosfat siklohidrolaz ( GTPCH ) eksikliği, pirüvoyil tetrahidrobiopterin sentaz ( PTPS ) eksikliği, pterin-4a-karbinolamin dehidrataz ( PCD ) eksikliği, dihidropteridin redüktaz ( DHPR ) eksikliği bu grubu oluşturan hastalıklardır ( şekil 2.1. ). Tedavide diyetle FA kısıtlamasının yanı sıra nörotransmitter öncüleri ( L-dopa, karbidopa ve 5-hidroksitriptofan ), BH4 ve folinik asit kullanılır ( 1, 7 ).
2.2. Fenilketonürinin Sıklığı
FKÜ, en sık görülen doğuştan metabolik hastalıktır ( 2 ). İnsidansı ülkeden ülkeye farklılık göstermektedir. Finlandiya'da 1:100,000 – 1:200,000 olup, her 2 – 4 yılda 1 yeni vaka görülürken ( 18 ), Türkiye, Suudi Arabistan gibi akraba evliliğinin
yüksek olduğu ülkelerde 1:3500 – 6500 görülme sıklığı ile en yüksek prevelansa sahiptir ( 3, 18 ). Özalp ve arkadaşlarının ( 19 ) 2001 yılında yaptığı pilot çalışmada Türkiye’de HFA insidansı 1:4,172 ve FKÜ insidansı 1:5,049 bulunmuştur. Günümüzde Sağlık Bakanlığı tarafından yürütülen ulusal yenidoğan tarama programı ile yenidoğan bebeklerin doğumdan sonra % 95’inden fazlası FKÜ, biotinidaz eksikliği ve konjenital hipotroidi açısından taranmaktadır ( 20 ).
Klasik ve ağır formlar Kuzey ve Batı Avrupa'da daha sıktır. İrlanda’da FKÜ sıklığı 1:4500 olup, Polonya'da tüm vakaların % 70'i klasik FKÜ'dir ( 21 ). Güney Avrupa'da hafif varyantlarda artış ( en yüksek insidans İspanya’da ) görülürken, Kuzey Amerika'da FKÜ prevelansı; 1:15,000 ‘dir. Orta batı müslüman ülkelerinde akrabalığa bağlı insidans yüksek ( 1:3672 ), zenciler, yerliler ve asyalılarda ise düşük sıklıktadır ( 15 ).
2.3. Tanı ve Sınıflandırma
FKÜ’lü bebeklerde doğumda kan FA düzeyi normaldir, ancak beslenmeyi takiben yaşamın ilk günlerinde hızla yükselir. Tamamen sağlıklı doğan bebekte yüksek FA değerlerine bağlı oluşan nörolojik hasar geri dönüşümsüzdür. Bu nedenle erken tanı ve tedavi çok önemlidir. Bu noktadan yola çıkılarak yenidoğan tarama testleri ile asemptomatik dönemde, hasta yenidoğan bebeklerin tanınması amaçlanır. Farklı ülkeler ve merkezlerde taramada kullanılan yöntemler ( Guthrie mikrobiyolojik inhibisyon testi, fluorometrik ve enzimatik teknikler, yüksek basınçlı sıvı kromotografisi, ardışık kütle spektroskopisi ) yanı sıra ileri araştırma gerektiren sınır değerler arasında farklılıklar vardır ( 1, 18 ). Tarama sonucuyla yakalanan hastada tekrarlayan kantitatif FA ölçümü ile tanı doğrulanmalıdır. HFA tanısı konduktan sonra kofaktör defektleri de araştırılmalı, BH4 metabolizma bozuklukları dışlanmalıdır ( 7 ). Ender görülse de prematürite, hasta yenidoğanlarda parenteral beslenme uygulaması ve karaciğer hastalıkları da ısrarlı HFA nedeni olarak sayılabilir ( 16, 17 ).
FAH eksiklikleri, normal yani yaşına uygun miktarda proteinli diyet alırken saptanan kan FA düzeylerine göre sınıflandırılır:
Klasik FKÜ: Kan FA düzeyi ≥ 1200 μmol/L ( ≥ 20 mg/dl ); FAH aktivitesi < %1
Hafif FKÜ veya HFA: Kan FA düzeyi > 600 μmol/L ve < 1200 μmol/L ( 10 – 20 mg/dl );
FAH aktivitesi % 1 – 5
Non-FKÜ HFA veya Hafif HFA: Kan FA düzeyi 360 - 600 μmol/L ( 6 - 10 mg/dl ); FAH
aktivitesi > % 5
Prenatal tanı, indeks vakanın mutasyonunun bilinmesi durumunda amniyosentez veya koryonik villus örneklemi sonrası DNA analizi ile FAH geninin incelenmesi olasıdır ( 1 ).
2.4. Tedavi ve prognoz
2.4.1. Beslenme ( diyet ) tedavisi
FAH eksikliğinde tedavideki esas amaç, kan FA konsantrasyonunu düşürerek nöropatolojik etkilenmenin engellenmesidir. Kan FA düzeyi, rezidüel FAH aktivitesi ve diyet ile alınan FA'nin başlıca göstergesidir. Bir başka deyişle hastanın alabildiği günlük fenilalanin miktarı, var olan FAH enzim aktivitesine bağlı olarak değişir. Enzim aktivitesi ne kadar yüksekse, hastanın metabolize edebileceği FA miktarı o kadar çok olacak ve kan FA düzeyi de normal sınırlarda kalacaktır. FKÜ hastalarında, kan FA yüksekliğini düşürmenin en etkili yolu, diyet ile alınan FA’nin kısıtlanmasıdır. Hangi hastalara tedavinin başlanacağı, hastaların normal protein içeren diyet alırken bakılan kan FA düzeylerine göre belirlenir. Farklı ekoller arasında küçük farklılıklar (tedavi başlama sınırı İngiltere için > 400 μmol/L, Almanya için > 600 μmol/L, ABD için > 360 - 600 μmol/L ) olmakla birlikte ( Tablo 2.1. ) ( 1, 16, 22 ), yenidoğan ve infantlarda > 600 μmol/L FA değerlerinde tedavi başlanmakta, < 360 μmol/L ise FA kısıtlı diyet başlanmadan takip edilmektedir ( 16, 21, 22, 23 ). Yaş ile birlikte tedavi sırasında izin verilen FA düzeyleri de yükselmektedir ( 1, 16, 22, 23 ).
Tablo 2.1. Günlük FA toleransı, farklı ülkelere göre hedef kan FA düzeyleri ( 1 )
Hedef kan FA düzeyi ( µmol/L ) Hastanın
yaşı
FA Toleransı ( mg/gün )
Almanya İngiltere ABD Fransa Hollanda
0-2 yaş 130-400 120-360 3-6 yaş 200-400 120-360 7-9 yaş 200-400 40-240 120-300 10-12 yaş 350-800 120-480 120-360 13-15 yaş 350-800 40-900 120-700 120-600 < 900 120-480 Adolesan ve erişkinler 450-1000 40-1200 120-900 < 1500 120-600
Diyette alınan FA’nın, hastanın kan FA düzeylerini normal sınırlarda tutacak şekilde kısıtlanması, diğer besin ögelerinin eksiksiz yerine konması ( diğer amino asid, vitamin ve mineral desteği ), beslenme tedavisinin hayatın ilk haftasından başlanarak yaşam boyu sürdürülmesi, normal kognitif gelişime olanak sağlar.
Kan FA yüksekliğini normal sınırlara indirmek için uygulanan beslenme tedavisinin bazı özellikleri aşağıda sıralanmıştır:
1. Kısıtlama yapılmayan doğal gıdalar: FA içeriği çok düşük ( < 30 mg/100 gr ) olan
karbonhidrat, meyve ve bazı sebzelerdir.
2. Hesaplanarak kısıtlanan doğal ve işlenmiş gıdalar: FA içeriği orta düzeyde ( 30 –
100 mg/100 gr ) olan patates, ıspanak, brokoli, özel ekmek ve özel makarna çeşitleridir. Ancak sanayide üretilen un ve ürünleri FA içermez.
3. Temel protein kaynağı olarak kullanılan ve hastanın ağırlığına, kan FA
düzeylerine göre hesaplanan, FA içermeyen amino asid karışımları: Tirozin ve diğer amino asidler, vitamin, mineral ve eser elementlerle desteklenmiştir.
Yukarıda belirtilen özellikler temel olmak üzere uygulamada farklılıklar olabilir. Örneğin İngiltere'de protein değişimi sistemi uygulanmakta, her 1 gr doğal proteinin FA içeriği 50 mg kabul edilerek günlük beslenme reçeteleri ayarlanmaktadır ( 1, 16 ). Et, balık, peynir, yumurta, süt, yoğurt, pirinç, mısır, ekmek gibi yüksek FA içeren doğal protein kaynağı besinler tamamen kısıtlanır. Aspartamın kimyasal yapısının L – aspartil L – fenilalanin metil ester olduğu göz önüne alındığında, tatlandırıcı olarak aspartamın kullanıldığı içecek ve besinlerin FKÜ hastalarının diyetine uygun olmadığı kolayca anlaşılabilir. Ayrıca çocukluk çağında sık görülen enfeksiyon dönemlerinde katabolik sürece karşı yüksek enerjili içeceklerle destek verilmelidir ( 1, 16 ).
FA içermeyen infant formulaları, yeterince esansiyel yağ asidleri, eser elementler, vitamin ve mineralleri içerir. Anne sütünün daha düşük FA içeriği nedeni ile anne sütü ile beslenen bebeklerde FA'siz formulalar, ölçülü miktarlarda anne sütünü takiben verilir. Anne sütünün yokluğunda, hesaplanan miktarlarda normal formulalardan esansiyel günlük FA ihtiyacı karşılanır ( 1, 16 ). Tüm anlatılanlar eşliğinde, hastanın kan FA değerlerine ve yaşlara göre hesaplanacak günlük FA tüketim örnekleri Tablo 2.2. ve 2.3.’de verilmiştir.
Tablo 2.2. Kan FA düzeylerine göre hesaplanan günlük FA tüketimi ( 16 )
Kan FA Düzeyi Günlük FA miktarı
240 – 605 μmol / l 6 – 10 mg/dl 70 mg/kg/gün 605 – 1210 μmol / l 10 – 20 mg/dl 55 mg/kg/gün 1210 – 1815 μmol / l 20 – 30 mg/dl 45 mg/kg/gün 1815 – 2420 μmol / l 30 – 40 mg/dl 35 mg/kg/gün ≥ 2420 μmol / l ≥ 40 mg/dl 25 mg/kg/gün
Tablo 2.3. Hasta yaşına göre hesaplanan günlük FA tüketimi ( 16 )
Yaş FA Tirozin Protein Enerji
0 – 3 ay 25 – 70 mg/kg 300 – 350 mg/kg 3.0 – 3.5 g/kg 120 ( 95 – 145 ) kcal/kg 3 – 6 ay 20 – 45 mg/kg 300 – 350 mg/kg 3.0 – 3.5 g/kg 120 ( 95 – 145 ) kcal/kg 6 – 9 ay 15 – 35 mg/kg 250 – 300 mg/kg 2.5 – 3.0 g/kg 110 ( 80 – 135 ) kcal/kg 9 – 12 ay 10 – 35 mg/kg 250 – 300 mg/kg 2.5 – 3.0 g/kg 105 ( 80 – 135 ) kcal/kg 1 – 4 yaş 200 – 400 mg/gün 1.72 – 3.00 g/gün ≥ 30 g/gün 1300 ( 900 – 1800 ) kcal/gün 4 – 7 yaş 210 – 450 mg/gün 2.25 – 3.50 g/gün ≥ 35 g/gün 1700 ( 1300 – 2300 ) kcal/gün 7 – 11 yaş 220 – 500 mg/gün 2.55 – 4.00 g/gün ≥ 40 g/gün 2400 ( 1650 – 3300 ) kcal/gün 11 – 15 yaş ( kız ) 250 – 750 mg/gün 3.45 – 5.00 g/gün ≥ 50 g/gün 2200 ( 1500 – 3000 ) kcal/gün 11 – 15 yaş ( erkek ) 225 – 900 mg/gün 3.85 – 5.50 g/gün ≥ 55 g/gün 2700 ( 2000 – 3700 ) kcal/gün 15 – 19 yaş ( kız ) 230 – 700 mg/gün 3.45 – 5.00 g/gün ≥ 55 g/gün 2100 ( 1200 – 3000 ) kcal/gün 15 – 19 yaş ( erkek ) 230 – 700 mg/gün 4.42 – 6.50 g/gün ≥ 65 g/gün 2800 ( 2100 – 3900 ) kcal/gün ≥ 19 yaş ( kız ) 220 – 700 mg/gün 3.75 – 5.00 g/gün ≥ 60 g/gün 2100 ( 1400 – 2500 ) kcal/gün ≥ 19 yaş ( erkek ) 290 – 1200 mg/gün 4.35 – 6.50 g/gün ≥ 70 g/gün 2900 ( 2000 – 3300 ) kcal/gün
FA kısıtlı beslenme uygulanan hastaların malnütrisyon / obezite ve laboratuarda metabolit kontrolleri düzenli olarak yapılmalıdır. İleriye dönük etkilenmeyi engellemenin en önemli koşulu, izlemdir. Buna yönelik bilgi Tablo 2.4.’de verilmiştir.
Tablo 2.4. Hastaların beslenme izlem sıklığı ( 16 )
Yaş İzlem sıklığı Ek görüştürme gerektiren durumlar
0 – 6 ay
2 haftada bir / her kan FA ölçümü sonrası
Her 500 gram ağırlık kazanımında
Önerilen anne sütü miktarı azaldığında ve anne sütü bittiğinde
Formula tüketiminde sorun olduğunda
6 – 12 ay
Ayda bir
Her 500-700 gram ağırlık kazanımında
ve/veya yüksek kan FA ölçümü sonrası
Ek besinlere geçiş döneminde bebeğin ek besini reddetme
durumunda
Bebeğin formulayı tüketmeme durumunda
1 yaş
üstü
Altı ayda bir ve/veya yüksek kan FA ölçümü sonrası
FA içermeyen formula, düşük proteinli ürün v.b. tüketiminde
sıkıntı olduğu durumlar
Kilo alımında hızlı artış, azalış veya duraklama olduğunda
Hastaların beslenme denetimlerine dayanak oluşturacak klinik ve laboratuar izlem sıklığı hastaya göre değişmekle beraber, kabul gören uygulamalara bir örnek Tablo 2.5.’te verilmiştir. Gerek poliklinik gerekse beslenme kontrolleri ile hastalarda olması hedeflenen kan FA düzeyleri ise Tablo 2.6.’da gösterilmiştir.
Tablo 2.5. Hastaların poliklinik izlem sıklığı ( 1 )
Kan FA ölçüm sıklığı Fizik bakı sıklığı
Yaş Kan FA Klinik
0 – 3 yaş Haftalık 3 ayda bir
4 – 6 yaş 2 haftada bir 3 – 6 ayda bir
7 – 9 yaş 2 haftada bir 6 ayda bir
10 – 15 yaş Aylık 6 ayda bir
> 16 yaş 2 – 3 ayda bir Yılda bir
Tablo 2.6. Hedef kan FA değerleri ( 16 )
Yaş Kan FA değerleri µmol / l
< 10 yaş 40 – 240
10 – 15 yaş 40 – 600
> 16 yaş 40 – 900
Erişkin 40 – 1200
Hasta izleminde kan FA yüksekliğinin yanı sıra, uygun olmayan diyet durumunda esansiyel bir aminoasit olan FA eksikliği gelişebilir. Bu ciddi bir durumdur ve ölümle sonuçlanabilir. Hastada büyüme geriliği, protein enerji malnütrisyonu, deri döküntüleri, megaloblastik anemi, nöbet, ishal ve saç dökülmesi görülebilecek belirti ve bulgulardır. Uygun olmayan diyetin bir başka klinik yansıması da vitamin – mineral eksiklikleridir. Örneğin D ve B12 vitamini eksikliği, kalsiyum,
selenyum, çinko, demir, retinol ve çoklu doymamış yağ asitleri eksikliklerine yönelik klinik ve / veya laboratuar kanıtları, izlemde dikkatle aranır ( 1, 2, 16, 24, 25, 26 ).
FA kısıtlı diyet tedavisinin pahalı oluşu, lezzet ve nutrisyonel yetersizliği uygulama zorluklarına neden olmakta, bu durum hastalarda, özellikle adolesanlarda diyet uyumunda azalmaya yol açmaktadır. Geçmişte okul çocuklarında beyin gelişiminin tamamlandığı düşüncesi ile diyetin açılması yapılmaktaydı. Diyete devam edenlerde davranış ve kognitif gelişimin, diyeti sonlandıranlardan daha iyi olduğunun kanıtlanması üzerine standart öneri; FA kısıtlı diyetin ömür boyu sürdürülmesi şeklindedir ( 24 ). FKÜ hastalarında erken tedavi ile bireylerin zeka skorları ( IQ ) normal aralıkta ( 90 – 110 arası ) tespit edilmiş, ancak bazı çalışmalarda etkilenmemiş kardeş veya aile bireylerinden bir miktar düşük bulunmuştur. Bu durum tedavinin iyi kontrol edilmemesi, kronik hastalığa bağlı stres, diyet kısıtlaması ile ilişkili nöro-psikolojik eksiklik, frontal lob fonksiyon eksikliği, emosyonel, psikolojik, psikiyatrik problem, anksiyete ve depresyonla ilişkili olabilir ( 2, 4, 16, 26, 27, 28 ).
2.4.2. Diğer tedavi yöntemleri
FKÜ’de diyet ile tedavi, özenli bir şekilde uygulandığında çok başarılı olmasına karşın zor, pahalı ve ebeveynlerin sosyal, kültürel ve ekonomik durumlarına göre başarı oranlarının değiştiği bir tedavi şeklidir. Özellikle yaş ilerledikçe adolesan ve erişkinlerde tedaviye uyum sorunları ve diyetin gevşetilip bırakılması ile karşı karşıya kalınır. Diyete ek veya alternatif daha kolay uygulanabilen tedaviler; Tetrahidrobiopterin ( sapropterin ), büyük nötral aminoasid ( LNAA ) suplementasyonu, FA amonya liyaz ( PAL ) enzim replasmanı, glikomakropeptidler ile gen tedavisi geliştirilmektedir ( 1, 2, 5, 22 ).
LNAA Tedavisi
Büyük nötral aminoasidler ( FA, tirozin, triptofan, lösin, izolösin ve valin ) aynı taşıma mekanizması için yarışırlar. L – tipi amino asid taşıyıcısı ile kan – beyin bariyerini geçerler. FA içermeyen ve enteral yolla kullanılan LNAA tedavisi ile beyin
FA konsantrasyonu azalır, nöropsikolojik fonksiyonlar üzerinde olumlu etki gözlenir ( 16, 29, 30 ). Tedaviden en iyi yararlanacak grup, etkin diyet tedavisini uygulayamayan hastalardır ( 31 ).
PAL Enzim Tedavisi
Rekombinan Anabaena variabilis ( rAv ) - PAL ile yapılan deneysel çalışmalarda FA düzeyi azalır ( 32 ). Polietilen glikol polimer bağı ( PEGilasyon ) ile kovalent bağlanma, alıcının immün sisteminden gizlenmesine, immünojenite ve antijenitesinde azalmaya neden olur. rAvPAL – PEG, FA’yı insanlar için zararsız bileşiklere ( transcinnamic asid ) çevirirken, ilacın lokal ve sistemik reaksiyonlarını azaltır. 0.1 mg / kg doz subkutan enzim enjeksiyonu ile FKÜ’li hastalarda FA etkin biçimde azalır. Devam eden faz 2 çalışmalarda, tekrarlanan dozlarda rAvPAL – PEG, FKÜ’de güvenli ve etkilidir ( 1, 32 ).
Glikomakropeptid Tedavisi
Peynirden elde edilen protein derivesi olup, spesifik esansiyel amino asidlerden zengindir. FKÜ’lü bireylerde FA, tirozin ve triptofan içermeyen alternatif doğal protein kaynağıdır ( 26, 31 ).
Gen Tedavisi
Farklı FAH gen transfer aracıları ( viral olmayan vektörler, rekombinan adenoviral vektör, rekombinan retroviral vektör ve rekombinan adeno aracılı viral vektör ) ile yapılan hayvan modellerinin insanlarda da başarılı olabilmesi için güvenli gen transfer vektör çalışmalarına gereksinim vardır ( 2 ).
2.5. Tetrahidrobiyopterin ( BH4; sapropterin ) Tedavisi
BH4, FAH enzimi dahil dört aromatik amino asid hidroksilaz, alkilgliserol monooksijenaz ve üç NOS'ı içeren bir grup enzimin doğal kofaktörüdür. BH4, neredeyse tüm hücre ve dokularda bulunur ve monoamin nörotransmitter oluşumu, kardiyovasküler, endotelyal ve immün yanıt gibi çok sayıda biyolojik olayda rolü
vardır. BH4 eksikliği sadece HFA'ye yol açmaz, tirozin hidroksilaz enzim disfonksiyonu ve nörotransmitter eksikliği ile ağır nörolojik bozukluğa neden olur ( 33, 34 ).
İlk kez Kure ve arkadaşlarının ( 35 ) 1999 yılında BH4'ün kan FA düzeyini düşürdüğünü göstermesinden sonra, BH4 aktif 6R izomerinin sentetik formulasyonu olan sapropterin dihidroklorid, HFA ve FKÜ'de yanıtlı olgularda kullanım için onay almıştır ( 2, 33-38 ). Çalışmalar, BH4 yükleme testine yanıt veren HFA ve FKÜ tanılı hastalarda etkili ve güvenli bir tedavi desteği olabileceğini göstermiş ve tedaviye sapropterin dihidroklorid eklenmesi ile hastalarda daha iyi kan FA kontrolü sağlandığını, diyette izin verilebilen FA miktarının arttığını ve hatta diyette FA kısıtlanmasının sona erdirilebildiğini ortaya koymuştur. Ancak BH4’e yanıt veren hastalar; rezidü FAH enzim aktivitesi taşıyan hastalardır. BH4’ün rezidüel mutant FAH enziminin aktivitesini veya dayanıklılığını arttırdığı düşünülmektedir ( 1, 2, 16, 33-38 ).
2.5.1. BH4 Etki Mekanizması
Sapropterin moleküler şaperondur. BH4, protein kümelenme hızını ve yıkımını yavaşlatarak enzim proteininin yanlış katlanmasını (misfolding) düzeltir. Mutant FAH proteinini kodlayan mRNA'yı etkileyerek hücre içi etkin FAH konsantrasyonunu arttırır. Günde tek doz 5 – 10 mg/kg BH4 tedavisi, yüksek olan kan FA düzeyini düşürür, diyetle alınan FA toleransını arttırır. Hafif FKÜ hastalarında yüksek rezidüel FAH aktivitesi olduğundan, hastalar BH4'e yanıtlıdır. Genotip tek başına belirleyici olmadığı için, FKÜ tanılı tüm hastalar, BH4 yanıtlılığı açısından test edilmelidir ( 1, 2, 16, 33-41 ).
2.5.2. BH4 ile Tedavi
FAH enziminin kofaktörü BH4’ün sentetik analoğu olan sapropterin ( kuvan ), Aralık 2007'de FKÜ tedavisinde onaylanan yeni tedavi yöntemidir ( 42-43 ). FAH enziminin tetramer yapısına girerek enzim stabilizasyonunu ve regülasyonunu arttırarak FKÜ'de defektif yolakta FA - tirozin dönüşümünü sağlar, FA toleransını arttırır. Yükleme testini takiben BH4'e yanıtlı ( kan FA düzeyinde en az % 30 düşme ) olgularda düşük FA
içeren diyetle birlikte veya diyet tedavisine alternatif olarak kullanılmaktadır. Amerika’da sapropterin kullanımında yaş kısıtlaması olmadığı için birçok klinikte her yaş grubunda tedaviye başlanmaktadır. Avrupa’da ise 4 yaş ve üstünde onaylıdır ( 2, 16 ). BH4 yanıtlı olduğu belirlenen hastalarda sapropterin'in, FA kısıtlı diyetle birlikte verilmesi; FA düzeylerinde daha fazla düşme, FA kısıtlı diyet olmaksızın normal IQ ve nöropsikolojik fonksiyon sağlar ( 4-6, 44 ). Tedavi dozu 10 – 20 mg/kg/gün olacak şekilde ayarlanarak su, elma suyu, formula içinde eritilerek uygulanır.
2.5.3. Sapropterin yanıtlılığını belirlemede BH4 yükleme testi
BH4 yükleme protokolü ilk olarak 1970'lerde tanısal amaçlı; FAH yetersizliği ve BH4 eksikliği ayrımını yapmak için kullanılmıştır ( 5 ). Son 20 yıldır Avrupa'da tanı ve tedavi amacıyla kullanılmaktadır ( 42, 43 ).
Sapropterin yanıtlılığı değerlendirmek için 1 gün ile 4 hafta arasında değişen sürelerde ağızdan tek ve yüksek doz BH4'ün verildiği farklı protokoller bulunmaktadır. En sık kullanılan uygulamada, tek doz 10 mg/kg BH4 verildikten sonra başlangıç FA düzeyine göre % 30 ve üzerinde düşme BH4 yanıtlılığı olarak kabul edilir ( 2, 17 ).
Bilim dalımızda günlük uygulamada 48 saatlık BH4 yükleme testi kullanılmaktadır ( Tablo 2.7. ) Test yapılacak ve FA kısıtlı diyet alan hastanın diyetle aldığı FA miktarı, toz FA ile test öncesi 3 gün boyunca kademeli olarak ( ilk gün 5 mg/kg, ikinci gün 10 mg/kg, üçüncü gün 15 mg/kg 4 bölünmüş dozda ) arttırılarak kan FA düzeyi yükseltilip sabitlenir. Testin 1. gününde kan FA düzeyleri kontrol edilir. Klasik FKÜ’de 20 ± 2 mg/dl, Hafif FKÜ’de 15 ± 2 mg/dl, HFA’de 10 mg/dl ( 600 μmol/L ) üzerinde kan FA düzeyi sağlanması hedeflenir. Testin 2. gününde 20 mg/kg tek doz oral BH4 yüklemesi yapılır. Sapropterin sonrası 4. - 8. ve 24. saatlerde kan FA düzeyi kontrol edilir. Testin 3. gününde 20 mg/kg tek doz oral BH4 yüklemesi tekrarlanır. BH4 öncesi ve BH4'ün verildiği 2. ve 3. günlerde 15 mg/kg, 4 bölünmüş dozda FA yüklemesine devam edilir. Testin 4. gününde yani ilk BH4 uygulamasından 48 saat sonra bakılan kan FA düzeyinde, başlangıca göre % 30 ve üzerinde düşme BH4 yanıtlılığı olarak kabul edilirken, % 30'un altındaki değerler yanıtsız olarak kabul edilmektedir.
Amerika Birleşik Devletleri’nde uygulanan uzun protokolde ise 20 mg/kg BH4 2 – 4 hafta süresince her gün verilirken, haftalık kan FA ölçümü yapılır. Avrupa'da olduğu gibi, % 30'un üzerinde yanıt, klinik olarak anlamlı kabul edilir ( 38 ). 48 saatlik test ile BH4'e yanıtlı olguların büyük bir bölümü saptanabilir. Diyet ve enfeksiyon gibi kan FA düzeyini etkileyen faktörlerin etkisi daha azdır. Ancak uzun testlerle geç yanıt veren olguların kaçırılma olasılığı azalır ( 2 ).
BH4 yükleme testi her yaşta uygulanabilir. Ancak test duyarlılığının yenidoğanlarda düşük olabileceği, 3 aydan sonra hepatositlerin matürasyonu ile testin daha güvenilir olduğu düşünülmektedir. Öte yandan diyet tedavisi başlanmadan önce kan FA değeri yüksek bulunduğunda 24 saatlik kısa BH4 yükleme testi yapılarak, yenidoğanlarda BH4 yanıtlılığının saptanması ve böylece bebeğin anne sütü, doğal protein alımı ile beslenmesi de uygun bir yaklaşımdır. Yanıt vermeyen yenidoğanlarda FA kısıtlı diyet tedavisini geciktirmemek için 24 saatlik kısa BH4 yükleme testi tercih edilebilir ( 2, 17 ).
2.5.4. BH4 yanıtlı hastaların izlemi
BH4 cevabı olan hastaların sapropterin kullanımı ile diyet FA toleransı belirgin şekilde artmaktadır. BH4 cevabı olan hastalarda, klasik formda bile, diyetle kombine sapropterin; tek başına diyete göre daha fazla FA düşüşü sağlayabilir. Hafif FKÜ formlarında, erken infant döneminde eğer bebek anne sütü ile besleniyorsa, FA eşik değerin altında kalabileceği için tedavi gerektirmeyebilir. Bu hastalar ek gıdaya geçtikçe FA düzeyinde kademeli bir artış görülür. BH4 tedavisi öncesinde diyet tedavisi tek seçenek olmaktaydı. Ancak doğumdan sonra değil de ilerleyen zamanda başladığı için uyum problemleri olabilmekteydi. Burton ve arkadaşlarının ( 5 ) 4 yaş altı 6 olguda yaptığı çalışmada, sapropterin’in tek başına diyet ayarlamasına gerek kalmadan yeterli olabildiği öngörülmekte ve doğal protein alım artışının avantajlarından bahsedilmektedir.
Düşük diyet FA toleransı olan veya diyete uymakta zorlanıp yetersiz metabolik kontrolü olan hastalarda, diyete yeni bir protein eklenemese bile sapropterin'den fayda görebilirler ( 25 ). 2 yıllık boylamsal bir çalışmada 6 hastada
doğal protein alımı ile büyümelerinin daha fazla, doğal proteinin büyümeye etkisinin FA'siz proteinden daha iyi olduğu tespit edilmiştir ( 5 ).
Yapılan çalışmalarda ciddi yan etki görülmemiştir, yanıtlılık oranı % 20 olarak bildirilmektedir ( 1 ). Gastrointestinal yan etkiler sapropterin'in başlatılmasıyla oluşur ve dozun bölünmesi ya da yemekle alınması gibi önlemlerle düzelir. Veriliş dozu ve şekli önemlidir. Tavsiye edilen şekli tabletlerin suda veya elma suyunda çözdürülmesidir. Çalışmalarda emilimin daha iyi olmasından dolayı ilacın yemekle birlikte alınması önerilmekte, tabletlerin puding, elma püresi ve FA içermeyen diyette ezdirilmesi de eşit derecede etkin bulunmuştur ( 5 ). İnfantlarda az miktar suda çözdürülen sapropterin şırınga ile verilebilir. Doz değerlendirmesine gelince, bazı kliniklerde 20 mg/kg/gün olarak başlanıp ancak çok düşük FA düzeylerinde ( 60 μmol/L ) idame sağlanırsa doz azaltılır. Alternatif olarak 10 mg/kg/gün olarak başlanıp doz artımı, daha iyi metabolik kontrol ihtiyacında uygulanabilir ( 5 ).
Amerika Birleşik Devletleri’nde sapropterin 20 mg/kg dozda kullanılmaktadır. Avrupa'dan bildirilen yayınlarda her hastanın yararlanacağı belirli bir doz olduğu, bunun üzerine çıkmanın fazladan bir yarar sağlamayacağı görüşü hakimdir. Bu nedenle düşük dozda başlanıp, daha fazla FA toleransı sağlayacak doza ulaşılınca da doz sabitlenir. Doz yaşa bağlı değildir. Dozun genotip – fenotip ilişkisinden etkilendiği görülmektedir. Uzun dönem tedavide hafif tiplerde düşük doz BH4 gerekmektedir. Sapropterinin 20 mg/kg'dan daha yüksek dozda kullanımının klinik yararı arttırmadığı, farmakokinetik çalışmalarda, ilaç alımından 2-4 saat sonra en yüksek kan düzeyine ulaşıldığı ve ilacın yarılanma ömrünün 6 saat olduğu bildirilmektedir. İlaç genellikle günde tek doz kullanılmaktadır. Ancak gün içinde kan FA düzeyindeki dalgalanmaları önlemek için günlük toplam dozun 2 veya 3'e bölünerek verilmesi de önerilmektedir ( 2, 5, 17 ).
BH4 başlanması ile diyetle alınan FA miktarı haftalık küçük miktarlarda başlanarak giderek arttırılmalı, maksimum FA toleransı belirleninceye kadar kan FA düzeyi yakından izlenmelidir. BH4 yükleme testinde kan FA düzeyinde yüksek oranda düşüş gösteren hafif fenotipteki hastalar hızla normal diyete geçerken, daha ağır fenotipte olup, kan FA düzeylerinde daha düşük oranda düşüş gösteren hastalar ile geç yanıtlılarda BH4 tedavisi ile diyetteki FA miktarı arttırılabilir ancak uzun dönemde
FA kısıtlı diyet tamamen kaldırılamaz. BH4 verilmesi ile FA toleransında artış gözlenmiyorsa, BH4 yükleme testinde yanlış pozitif yanıt olarak düşünülmelidir( 5,43).
Sonuç olarak, kan FA düzeyinin 360 μmol/L düzeyinin altında tutulması; nörokognitif ve davranışsal fonksiyonlar için önem arzetmekte olup ( 45 ), BH4 cevabı olan hastalarda diyetle kombine sapropterin tedavisi kan FA düzeyi regülasyonu için kullanılabilir ( 5 ).
2.6. Oksidatif Stres
2.6.1. Serbest Radikaller ve Oksidatif Hasar
Serbest radikaller, dış atomik veya moleküler yörüngesinde bir veya birden fazla eşleşmemiş elektron bulunduran ve sonucunda yüksek oranda reaktif ve kararsız olup hücresel hasar oluşturan molekül veya molekül parçalarıdır. Reaktif oksijen ( ROS ) ve nitrojen ( RNS ) türevleri hem süperoksit, nitrik oksit ve hidroksil radikal gibi serbest radikalleri, hem de hidrojen peroksit ve peroksil nitrit gibi molekülleri içerir. ROS’ların çoğu hücrede mitokondri içinde oksijenin suya indirgenmesinin tamamlanamaması neticesinde oluşur ( 46 ). ROS‘lar fizyolojik koşullarda sinyal iletimi, gen transkripsyonu ve guanilat siklaz regülasyonu gibi görevlerde bulunurken patolojik koşullarda aşırı üretim sonucunda protein, lipid, karbonhidrat ve DNA gibi biyomoleküllerde oksidatif hasar ve hücre ölümü ile sonuçlanan süreci oluştururlar ( 47, 48 ). Proteinlerin oksidasyonu, yan zincirlerinde karbonil gruplarının oluşumuna sebebiyet verir. Bu durum, enzimlerin aktif kısımlarının bozulmasına veya yapısal proteinlerin düzeninin değişmesine ve sonuçta inaktivasyona neden olur. Hasara duyarlı doymamış yağ asitlerinin oksidasyonu, lipid peroksitlerin oluşumuna sebep olur ve kısır döngüyle oluşan peroksitler daha çok doymamış yağ asidini okside ederler. Yağ oksidasyonu, hücre zarı ve mitokondri geçirgenliği etkileyerek hücresel homeostazı bozar ( 49, 50 ). Ek olarak lipid peroksidasyonunun son ürünleri, protein sentezini ve hücresel membran enzim aktivitelerini engelleyerek mutajenik ve sitotoksik etki oluştururlar. DNA oksidasyonu, DNA replikasyonunun bozulmasına sebebiyet veren mutasyonlara yol açabilir ( 51 ).
2.6.2.AntioksidanSavunma Sistemi
Serbest radikal kaynaklı hücresel hasarı önlemek veya azaltmak için vücutta enzim kaynaklı ve enzim dışı antioksidan savunma mekanizmaları çalışır. Enzim kaynaklı olanlar süperoksit dismutaz ( SOD ), glutatyon peroksidaz ( GSHPx ), katalaz ( CAT ) ‘dır. SOD, süperoksitin parçalanmasını sağlarken sonucunda oluşan hidrojen peroksit, GSHPx ve CAT ile ortadan kaldırılır. Enzim dışı antioksidan savunma mekanizmaları ise glutatyon, ürik asit, bilirubin, melatonin, plazma proteinleri gibi endojen maddeler ve vitamin C ve E, selenyum, karetenoidler ve flavanoidler gibi diyet ürünleridir. Glutatyon, çeşitli ROS’ları ( lipid peroksil radikal, peroksinitrit, hidrojen peroksit ) direk ya da indirek enzim yoluyla temizleyebilir. Vit C, E, karotenler ve bilirubin lipid peroksidasyonunu engellemekte etkilidir ( 13, 48, 52, 53 ).
2.6.3. Oksidatif Stres ve Nörodejenerasyon
Beyinde serbest radikaller ve reaktif türevler süreklilik içerisinde oluşmaktadır. Beyindeki yüksek enerji ihtiyacı nedeniyle, vücuttaki oksijenin büyük kısmı beyinde tüketilmekte olup sonuçta mitokondride süperoksit üretimi artmıştır. Beyinde çoğunlukla ferritin olarak depolanan demir, hasar sonucunda beyin dokusundan serbest şekilde mobilize olmakta ve çoklu reaktif radikallerin oluşumuna sebebiyet vermektedir. Beyinin oksidatif hasara duyarlı olmasına yol açan ek faktörler arasında nöronal membranlar arasıda fazla Ca² akışı olması, glutamat gibi uyarıcı amino asidlerin varlığı, otooksidan moleküller dopamin ve noradrenalin’in yüksek konsantrasyonda bulunması ve beyinde antioksidan savunma sistemlerinin, özellikle katalaz aktivitesinin zayıf oluşu sayılabilir ( 54 ). Ek olarak nöronal membran lipidleri, yüksek doymamış yağ asidi içerikleri nedeniyle serbest radikal saldırısı ve peroksidasyona fazlasıyla hassastır ( 55 ).
2.6.4. Oksidatif Stres Parametreleri Glutatyon peroksidaz ( GSHPx ):
GSHPx, peroksidaz aktivitesine sahip bir enzim grubu olup görevi, hidrojen peroksiti suya çevirmek ve lipid hidroperoksidazları alkol karşılıklarına indirgemektir.
Vücutta tanımlanmış beş alt tipi vardır: GPx1: Hücresel glutatyon peroksidaz
GPx2: Gastrointestinal glutatyon peroksidaz GPx3: Extrasellüler, plazma glutatyon peroksidaz GPx4: Fosfolipid hidroperoksit glutatyon peroksidaz GPx5: Epididime özgü glutatyon peroksidaz
1. izotipi vücutta en sık bulunan formudur. Monomer olan 4. alt tipi dışında diğer tüm alt tipler tetramer yapısındadır.
Aşağıdaki tepkime ile hidrojen peroksitin indirgenmesi sağlanmaktadır. Bu süreçte kofaktör olarak selenyum ve elektron kaynağı olarak glutatyon kullanılır:
2GSH + H2O2 → GS-SG + 2 H2O
FKÜ hastalarında selenyum ve GSHPx ilişkisi incelendiğinde, çeşitli sonuçlar karşımıza çıkmaktadır. Plazma selenyum düzeylerinin plazma-eritrosit GSHPx düzeyleri ile pozitif korelasyonu mevcuttur ( 56 ). Ancak iyi kontrollü FKÜ hastalarında eritrosit GSHPx düzeyleri, normal olan plazma selenyum düzeylerinden bağımsız olarak düşük bulunmuştur ( 57 ). Bu durumda GSHPx aktivitesi azalmasının sadece selenyum düzeyleri ile ilgisi olmadığı gözükmektedir. Aktivitenin azalmasının sebepleri arasında dengesiz kan aminoasit profilinin oluşturduğu düşük eritrosit metionin seviyesi ( 57 ), FA’nın GSHPx enzim aktivitesi inhibisyonu ve yıkımını arttırması sayılabilir ( 58 ).
Katalaz ( CAT ):
Hücre içinde peroksizomda yerleşimli bir enzimdir. 4 polipeptit zincir alt ünitesi olan bir tetramer olup her biri hidrojen peroksitle tepkimeye girmesi için demir grubu barındırır. Birinci görevi hidrojen peroksiti su ve oksijene çevirmektir
( katalitik fonksiyon ). Tepkimesi aşağıda özetlenmiştir:
2 H2O2 → 2 H2O + O2
İkinci görevi olan hidrojen donörlerinin oksidasyonu, peroksidatif fonksiyonunu oluşturur.
Yaş ve cinsiyetten bağımsız olmakla birlikte düzeyi vücuttaki oksidan-antioksidan dengesinden etkilenir. Oksidatif stresin arttığı hastalıklarda yükseldiği bildirilmiştir ( 54, 55, 59 ).
Tiyobarbitürik asit reaktif türleri ( TBARS ):
Oksidatif stres sonucunda oluşan lipid peroksitlerin ayrışmasıyla malondialdehit ( MDA ) oluşur. Lipid peroksitler çoklu doymamış yağ asitlerinden köken almaktadır. Stabil değillerdir ve MDA gibi kompleks reaktif karbonil bileşiklere ayrışırlar. MDA, tiyobarbitürik asit ile kontrollü reaksiyonu sonucunda oluşan TBARS, lipid peroksidasyonunu tarama ve izleme için yerleşik bir göstergedir ve çeşitli modifikasyonlar ile insan, hayvan ve gıda gibi objelerde değerlendirme için kullanılmaktadır. Testin lipid peroksidasyonlarına özgünlüğü konusunda çeşitli tartışmalar olsa da, kan örneğinin uyulması gereken koşulları sağlanırsa lipid peroksidasyonuna oldukça özgün olduğu belirtilmektedir ( 52 ).
Yukarıda açıklandığı üzere oksidatif süreçli hastalıklarda artış beklenebilir.
Paraoksonaz ( PON ):
PON, kalsiyum bağımlı karaciğerde sentezlenen glikoprotein yapısında bir enzimdir. Paraoksonaz ve aril esteraz enzim aktivitesine sahip bir hidrolaz olup, organik fosforlu paraoksanları subtsrat olarak kullanır ve organofosfatların hidrolizinde görev yapar.
PON enziminin 3 formu mevcut olup, tümünün antioksidan özellikleri mevcuttur. % 65 ortak altyapıyı paylaşırlar. Birinci form karaciğerde sentezlenir ve kanda HDL ile taşınıp lipid peroksitleri metabolize ederek LDL’nin oksidasyonunu engeller ( 60 ). Serum konsantrasyonu inflamasyon ve dejeneratif süreçlerle değişebilir. İkinci form endotelde bulunan hücresel protein olup, oksidatif hasara
karşı koruyucudur. Üçüncü form ise birinci forma benzer görev yapmakla birlikte, inflamasyon ve okside lipidlerin seviyesinden etkilenmez.
PON 1 enzim düzeyi gebelik, sigara tüketimi, hormonlar, akut faz proteinleri ve yaş ile etkilenir. Prematüre infantlarda erişkin miktarının yarısında bulunur. Erişkinlerde yaşla beraber azalır. Cinsiyetten bağımsızdır.
Oksidatif süreçli hastalıklarda azalma beklenebilir ( 12, 61-63 ).
Asimetrik Dimetilarjinin ( ADMA ) ve arjinin:
ADMA, proteinlerde bulunan arjinin rezidülerine, protein arjinin metil tranferaz ( PRMT ) enzimi tarafından metil gruplarının eklenmesi sonucunda meydana gelen metillenmiş arjinin türevidir. ADMA’nın hücre içi miktarları protein metilasyonu, protein yıkım hızı ve ADMA’nın dimetil arjinin dimetil amino hidrolaz ( DDAH ) enzimi tarafından yıkılma hızına bağlıdır. Hücre içerisinde oluşan ADMA daha sonra dolaşıma verilmektedir. ADMA’nın metabolize edilmesi sonrasında sitrülin ve dimetilamin oluşur ( 62, 63 ) ( Şekil 2.2. ).
Arjinin, doğada en sık bulunan aminoasitlerden olup esansiyel olmamasına karşın koşula göre yarı esansiyel veya esansiyel olarak değerlendirilir. Sitrülin’den arjininosüksinat sentaz ve arjininosüksinat liyaz sitozolik enzimlerinin sıralı etkileri ile proksimal renal tübüllerde oluşturulur.
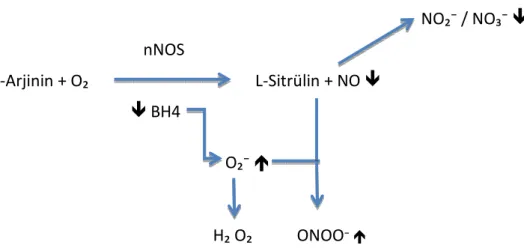
Nitrik oksit ( NO ), L-arjinin’den Nitrik Oksit Sentaz ( NOS ) enzimi aracılığıyla vücudun neredeyse her hücresinde oluşur. NO potent bir vazodilatör olup hemostaz, lökosit adezyonu, nöral iletim özellikleri yanı sıra antiproliferatif ve antisklerotik etkileri mevcuttur.
ADMA, NOS enziminin kompetitif inhibitörü olarak görev yapar. Bu şekilde NO düzeyini azaltmakla beraber ek olarak oksidatif stres artışında NOS enziminin ayrılmasına yol açıp süperoksit gibi serbest radikal oluşumunu sağlamaktadır. Sonuçta meydana gelen süperoksit ise, NO ile tepkimeye girerek peroksinitrit oluşturmakta ve NO’nun biyoyararlanımını azaltmaktadır ( 64 ).
çeşitli şekillerle ADMA düzeyini etkilemekte olup miktarının artışı PRMT enziminin aktivitesini arttırmakta, tersi durumda enzim aktivitesi azalmaktadır. Proteoliz aşamasıda düşük Hcy düzeyi ile azalmaktadır ( 65 ). Ek olarak, Hcy’nin DDAH enziminin in vitro inhibitörü olduğu gösterilmiş olup, azalmasının DDAH enziminin aktivitesini arttırabileceği düşünülmektedir ( 66 ). Bu sebepler çerçevesinde, yapılan çalışmalarda ADMA düzeyinin FKÜ hastalarında düşük olduğu saptanmıştır ( 11, 67 ).
Şekil 2.2. ADMA’nın oluşumu ve yıkılımı
Proteinler Metilamin + Sitrulin Met SAM
Hcy SAH
Metile proteinler ADMA Proteoliz
Homosistein:
Hcy, sülfür içeren ve protein yapısına katılmayan bir aminoasit olup diyetle alınmayıp, metiyonin metabolizması sırasında ara ürün olarak oluşmakta ve plazmada % 70-80’i albumine bağlı olarak bulunmaktadır. Serbest halde bulunan kısım stabil değildir, hemen homosistin ve homosistein disülfite dönüşmektedir. Total homosistein düzeyi, hem bağlı hem de serbest olan kısmı yansıtmaktadır.
Hcy protein sentezinde kullanılmaz ancak iki ana metabolik yolağın ortasında bulunur. İlk olarak geriye dönüşümsüz sülfürasyon reaksiyonunda serin aminoasiti ile birleşerek sistatyonin beta sentaz enzimi tarafından sistatyonine dönüşür. Bu reaksiyonda piridoksin kofaktör olarak görev yapar. Sistatyonin daha sonra sisteini oluşturur ve idrarla atılır. Böylece vücuttan sülfür içeren maddeler uzaklaştırılır. Ayrıca Hcy reversibl olarak metionin sentaz enzimi tarafından folik asit yolağından metil grubu alarak metillenir ve esansiyel amino asit olan metiyonin oluşur. Bu reaksiyonda kobalamin kofaktördür.
Hcy artışı, süperoksit oluşumunu arttırarak oksidatif streste rol almaktadır PRMT
( 68 ). Ayrıca Hcy’nin NOS’un ayrılarak NO sentezinin engellenmesini de oluşturduğu, bunun hücre içinde BH4’ün azalmasından kaynaklandığı gösterilmiştir ( 69 ).
Hcy’nin fenilketonüri’de azaldığını gösteren çalışmalar mevcut olup, bunun sebebinin FA kısıtlı diyette doğal protein alımının kısıtlanması, folik asit desteği ( folik asit artışı plazma hcy düzeyini düşürmekte ) ve protein metabolizma değişikliğine bağlı vücutta Hcy talebinin azalması olduğu öne sürülmüştür ( 14, 70 ).
Nitrit / Nitrat ( NOx ):
Kanda NOx, yaygın olarak endotelyal NOS aktivitesinin ve indirekt olarak NO seviyelerinin göstergesi olarak kullanılmaktadır. NO vücutta oksijen tarafından çok hızlı bir şekilde ( bir saniyeden az ) nitrit ( NO₂⁻ ) ve nitrata ( NO₃⁻ ) indirgenir ( 71 ).
NOx’un vücutta hem NO’nun yıkım ürünleri olduğu, hem de tekrardan NO üretimi için kullanılabileceği belirtilmektedir. Hipoksik koşullarda, hemoglobin, myoglobin, ksantin oksiredüktaz, askorbat ve polifenoller ile nitrit NO’ya redükte olur. Vücutta NOx kaynağı olarak iki kaynak mevcuttur. Bunlar diyet ve endojen L-arjinin- NO sentaz metabolik yolu’dur. Bu metabolik yolağın katalizörleri çoklu bakır oksidaz ve NO oksidazı seruloplazmin’dir ( 71 ).
Oksidatif strese bağlı hastalıklarda serum’da artışı beklenebilir.
8-hidroksi-2-deoksiguanozin ( 8-OHdG ):
Biomoleküllere zarar verebilecek en önemli oksijen dışı serbest radikal hidroksil radikalidir. Çeşitli mekanizmalarla oluşur, en önemlisi hidrojen peroksit ve diğer reaktif oksijen türevlerinden oluştuğu fenton reaksyonudur. Hidroksil radikali, hücresel ve mitokondrial DNA yakınlarında üretildiği zaman DNA sarmallarına saldırıp hasar oluşturur ( 51 ).
Hidroksil radikalinin, guanin gibi DNA’da bulunan nükleobazlarla karşılaşması sonrasında 8-OHdG oluşur. Diğer nükleobazlara göre ek sık görülen DNA lezyonudur. Oluşumu kolay ve promutajeniktir ve transvers mutasyonlarla sonuçlanabilir. DNA hasarını göstermede çok önemli rolü mevcuttur.
8-OHdG’nin vücut sıvılarında ve dokularda ( idrar, organ örnekleri, lökosit DNA’sı ) çeşitli yöntemlerle ( yüksek performans sıvı kromatografisi, gaz kromatografi-kütle spektrometresi, immünohistokimya, elektroforez ) saptanması ve oksidatif stres, yaşlanma ve karsinojenez için biomarker olarak kullanılması mümkündür ( 72 ).
Oksidatif stres ve diğer DNA hasarı oluşturabilecek koşullarda artışı beklenir.
Vitamin E:
E vitamini yağda çözünen bir vitamin olup 8 farklı formda ( alfa, beta, delta ve gama tokoferol, alfa, beta, gama ve delta tokotrienol ) bulunmaktadır. İnsanlardaki en aktif form alfa tokoferoldür.
Alfa tokoferol, peroksil radikalini çoklu doymamış yağ asitleriyle tepkimesinden önce inaktif hidroperoksit radikaline çevirir. Takiben oluşan tokoperoksil radikali tekrar peroksil radikali ile tepkimeye girerek inaktif ürünleri oluştururlar. Bu şekilde yaklaşık lipitlere karşı 1/1000 oranında biyolojik zarlarda bulunan alfa tokoferol, zarları lipid peroksidasyonundan korur ( 73 ).
FKÜ’de yapılmış çalışmalarda, oksidatif stres sonucu kullanımının artışı sebebiyle serum E vitamini düzeylerinin azaldığı bildirilmiştir ( 74, 75 ).
2.7. Fenilketonüri’de oksidatif stres
FKÜ’de oksidatif stres için risk faktörleri iki alt başlıkta incelenebilir. Birincisi enzim bağımlı ve enzim dışı antioksidan savunmayı değiştirebilen diyet kısıtlaması, ikincisi de hastalığın kendisinden veya ilişkili metabolitlerinden kaynaklı reaktif türevlerin aşırı oluşumudur ( Şekil 2.3. ).
2.7.1. Fenilketonüride diyet kısıtlaması
FKÜ tedavisinde ilk defa düşük FA’lı diyetin 1953 yılında tanımlanmasından itibaren diyet tedavisi temel tedavi olarak kullanılmaya başlanmıştır. Geniş bir FA toleransı spektrumuna karşın diyetten et, balık, yumurta, doğal undan ekmek, kuruyemiş, baklagiller ve süt ürünleri çoğunlukla çıkarılmaktadır ( 18 ). Protein
replasmanı nedeniyle vejetaryen diyete eş olmayan FKÜ diyeti, bir takım benzerlikler de taşımaktadır. Sağlıklı olarak atfedilmesine karşın vejetaryen diyetinde demir, çinko, kalsiyum, vitamin D, riboflavin, vitamin B12, vitamin A, doymamış yağ asitleri ve iyot eksikliklerini önlemek zorlu bir uğraşı gerektirmektedir. Bu nedenle, FKÜ hastalarında çeşitli besinsel eksikliklerin olası olduğu bildirilmiştir ( 76, 77 ). Sindirim ve absorbsiyon aşamasında besinsel kompetisyon, biyoyararlanımı azaltabilmekte ve özellikle adolesanlarda düşük diyet uyumu, besinsel eksiklikler için ekstra risk faktörü olmaktadır ( 78, 79 ).
FKÜ hastalarında, diyette selenyum, ubiquinone-10 ( Q10 ) veya L-karnitin eksikliklerinin görülebileceği ve vücudun indirgenmiş durumunun bozulabileceği bildirilmiştir ( 80, 81 ). Her ne kadar eski sıklıkta görülmese de, selenyum eksikliği, FKÜ’nün bildirilmiş en önemli mineral eksikliklerindendir. Azalmış selenyum seviyeleri, eritrosit ve plazma GSHPx aktivitesini bozmakta ve vücudun reaktif türevlerle başa çıkma kapasitesi azalmakta ve oksidatif stres artmaktadır ( 82 ). Elektron transport zincirinde elektron taşıyıcısı olarak görev yapan Q10’un eksikliği, solunum zincirinin aktivitesini bozmakta ve oksidatif stres için yüksek risk yaratmaktadır. Ek olarak Q10’un indirgenmiş formu, hücresel zarları ve plazma lipoproteinlerini serbest radikal bağımlı oksidasyondan koruyarak önemli bir lipofilik antioksidan rol üstlenmektedir ( 74 ). Çinko, süperoksit iyonlarını oluşturan NADPH oksidazların inhibitörü olup, SOD enziminin kofaktörü olarak görev yapmaktadır ( 83 ). Orta düzeyli çinko eksikliğinin, lipoprotein oksidasyonuna sebebiyet verebileceği düşünülmektedir. L-karnitin ise peroksidasyon olaylarını önleyerek önemli antioksidan fonksiyonlar barındırır ( 84 ). Ek olarak L-karnitin, yağ asitlerinin mitokondriye transportunu sağlamakta ve peroksidasyon için yağ asidi bulunabilirliğini azaltmaktadır ( 85 ).
2.7.2. Reaktif türevlerin aşırı oluşumu
Vücudun bozulmuş indirgenmiş durumunun, hastalığın kendisinden kaynaklı serbest radikal ve / veya reaktif türevlerin artışından kaynaklanabileceği gibi, eş zamanlı antioksidan savunmaların azalmasından da etkilendiği bilinmektedir ( 86 ). Bazı çalışmalar FKÜ’daki nörolojik disfonksiyon ile oksidatif stresi ilişkilendirmişlerdir