T.C.
SELÇUK ÜNĐVERSĐTESĐ FEN BĐLĐMLERĐ ENSTĐTÜSÜ
TÜRKĐYE’NĐN SILENE L. CĐNSĐNE AĐT MACRANTHAE (ROHRB.) CHOWDH.
SEKSĐYONU TAKSONLARI
GENOTĐPLERĐNDE RAPD ANALĐZĐ ĐLE GENETĐK TANIMLAMA
Aslı DAĞERĐ YÜKSEK LĐSANS TEZĐ
Biyoloji Anabilim Dalı
Aralık-2010 KONYA Her Hakkı Saklıdır
TEZ BĐLDĐRĐMĐ
Bu tezdeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalışmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Aslı DAĞERĐ Tarih: 15,12,2010
iv ÖZET
YÜKSEK LĐSANS TEZĐ
TÜRKĐYE’NĐN SILENE L. CĐNSĐNE AĐT MACRANTHAE (ROHRB.) CHOWDH. SEKSĐYONU TAKSONLARI GENOTĐPLERĐNDE RAPD ANALĐZĐ
ĐLE GENETĐK TANIMLAMA Aslı DAĞERĐ
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı
Danışman: Doç. Dr. Murad Aydın ŞANDA 2010, 39 Sayfa
Jüri
Prof.Dr. Ahmet DURAN Doç.Dr. Yavuz BAĞCI Doç.Dr. Murad Aydın ŞANDA
Silene cinsi, Macranthae seksiyonuna ait Türkiye’de yayılış gösteren türlerin RAPD-PCR (Rastgele Çoğaltılmış DNA Polimeraz Zincir Reaksiyonu) ile aralarındaki polimorfizm belirlendi. Seksiyona ait S. capillipes Boiss. & Heldr., S. duralii Y. Bağcı ve S. nuncupanda Coode & Cullen türleri ile yakın olduğu düşünülen Silene bayburtensis Hamzaoğlu & Aksoy türü arasındaki genetik uzaklıklar STATISTICA 8 paket programında öklid uzaklığına göre hesaplandı. RAPD analizleri taksonların Türkiye Florası ve orijinal makalelerde belirtilen morfolojik betimleriyle benzerlik gösterdi. Türler arası polimorfizmi belirlemede çalışılan on primer arasında en uygun primerin OPA-16 olduğu belirlendi.
Anahtar Kelimeler: Silene, Caryophyllacea, polimorfizm, RAPD, genetik uzaklık
v ABSTRACT
MS THESIS
THE GENETIC DETERMINATION ON GENOTYPES OF THE SECTION MACRANTHAE (ROHRB.) CHOWDH. TAXA OF THE GENUS SILENE L. OF
TURKEY BY RAPD ANALYSIS Aslı DAĞERĐ
THE GRADUATE SCHOOL OF NATURAL SCIENCES OF SELÇUK UNIVERSITY
THE DEGREE OF MASTER OF SCIENCE IN DEPARTMENT BIOLOGY
Advisor: Associate Prof. Dr. Murad Aydın ŞANDA 2010, 39 Pages
Jury
Prof.Dr. Ahmet DURAN Assoc.Prof.Dr. Yavuz BAĞCI Assoc.Prof.Dr. Murad Aydın ŞANDA
The genetical distance of section of the Macranthae (Rohrb.) Chowdh. taxa of the genus Silene L. from Turkey was detemined by RAPD-PCR. The genetical distance of S. capillipes Boiss. & Heldr., S. duralii Y. Bağcı and S. nuncupanda Coode & Cullen belong to Section Macranthae and S. bayburtensis Hamzaoğlu & Aksoy belong to Section Caespitosae Chowdh. as closely related was calculated as euclidean distance by STATISTICA 8 packet programme. The RAPD analysis of taxa are similar with description of its morphological characters which are reported by Flora of Turkey and original article. OPA 16 primer could prefer for polymorphic identification of Silene genus in used ten primers in study.
vi ÖNSÖZ
Ülkemiz bitki türleri açısından geniş bir yelpazeye sahiptir. Bir çoğu endemik olan, betimlenen yeni türler bilim dünyasına kazandırılmaktadır. Morfolojik karakterlerin bitki türlerinin tanımlanmasında ve ayrımına yeterli olmadığı, çalışmaların genetik açıdan desteklenmiş olmasının gerekliliği bilincinde, genetik varyasyonu DNA düzeyinde belirlemek amacı ile bu çalışma yapıldı.
Bu çalışmamda yardım ve desteğini esirgemeyen danışmanım Doç. Dr. Murad Aydın ŞANDA’ya, laboratuar çalışmalarım için ortam sağlayan Prof. Dr. Hasan ACAR’a, Silene bayburtensis bitkisinin paratip örneğini gönderen Prof. Dr. Ergin HAMZAOĞLU’na, Silene duralii ve Silene capillipes örneğini veren Doç. Dr. Yavuz BAĞCI’ya, Silene nuncupanda örneğini veren Yrd. Doç. Dr. Ahmet SAVRAN’a, moleküler genetik konusunda tecrübelerinden sürekli yararlanma imkanı veren Arş. Gör. Aysel KALAYCI’ya, deneylerin optimizasyonunda katkısı olan ve büyük sabır gösteren ablam Nazan DAĞERĐ DERE’ye, her türlü desteği yanımda hissettiren dostlarım ve sevgili aileme teşekkür ederim.
Aslı DAĞERĐ KONYA-2010
vii ĐÇĐNDEKĐLER ÖZET ... iv ABSTRACT ... v ÖNSÖZ ... vi ĐÇĐNDEKĐLER ... vii
SĐMGELER VE KISALTMALAR ... viii
1. GĐRĐŞ ... 1 1.1. Yayılış Alanları ... 3 1.2. Belirleyiciler(Markırlar) ... 7 1.2.1.RFLP ... 7 1.2.2.PCR ... 8 1.2.2.1. RAPD ... 8 1.2.2.2. AFLP ... 9 1.2.2.3. SSR ... 9 1.2.2.4. SNP ... 9 2. KAYNAK ARAŞTIRMASI ... 11 3. MATERYAL VE METOT ... 15 3.1. Materyal ... 15 3.2. Metot ... 15 3.2.1. DNA izolasyonu ... 15
3.2.2. Kullanılan primerlerin seçimi ... 17
3.2.3. RAPD-PCR amplifikasyonu ve optimizasyonu ... 18
3.2.4. Elektrolit çözeltisi ... 19
3.2.5. Agaroz jelin hazırlanması ... 20
3.2.6. PCR ürünlerinin jel kuyularına yüklenmesi... 20
3.2.7. Jele yüklenen PCR ürünlerinin jelde yürütülmesi ... 20
3.2.8. Jelin boyanması ve RAPD bantlarının elde edilmesi ... 21
3.2.9. Jelin yorumlanması ve veri analizleri ... 22
4. ARAŞTIRMA BULGULARI VE TARTIŞMA ... 23
4.1. DNA Đzolasyon Sonuçları ... 23
4.2. Amplifikasyonlar ... 23
5. SONUÇLAR VE ÖNERĐLER ... 37
KAYNAKLAR ... 37
viii
SĐMGELER VE KISALTMALAR
Simgeler dk: Dakika
g: Gravity force (Yer çekimi gücü) l: Litre
m: Metre M: Molar ml: Mililitre mM: Milimolar
rpm: Rotation per minute (Dakikadaki döngü sayısı) sn: Saniye U: Ünite µl: Mikrolitre ºC: Santigrat derece Kısaltmalar A: Adenin
AFLP: Amplified Fragment Length Polymorphism (Çoğaltılmış Fragman Uzunluk Polimorfizmi)
bç(bp): Baz çifti C: Sitozin
CAPS: Cleaved Amplified Polymorphic Sequences (Kesilmiş Amplifiye Polimorfik Diziler)
DNA: Deoksiribonükleikasit dNTP: Deoksiribonükleotid trifosfat EDTA: Ethylendinitrilotetraaceticacid MgCl2: Magnezyum klorür
Tm: Melting Temperature (Bağlanma Sıcaklığı)
PCR: Polymerase Chain Reaction (Polimeraz Zincir Reaksiyonu)
RAPD: Randomly Amplified Polymorphic DNA (Rastgele Çoğaltılmış Polimorfik DNA)
RFLP: Restriction Fragment Lenght Polymorphism (Restriksiyon Uzunluk Parça Polimorfizmi)
SEM: Scanning Electron Mikroscope (Taramalı Elektron Mikroskobu) SNP: Single Nucleotide Polymorphism (Tek Nükleotid Polimorfizmi) SSR: Simple Sequence Repeats (Basit Tekrar Eden Diziler)
STS: Sequence Tagged Site (Dizisi Etiketlenmiş Alanlar) T: Timin
Taq: Termus Aquaticus TE: Tris-EDTA
1. GĐRĐŞ
Dünyada 44 seksiyonda toplanmış yaklaşık 700 tür içeren Caryophyllaceae familyası, ülkemizde 187’si endemik toplam 465 doğal taksonla (Davis ve ark., 1988) temsil edilir. Akdeniz Bölgesi’nde, Kuzey Yarımküre’nin ılıman ve sıcak bölgelerinde, ayrıca familyanın bazı cinsleri Güney Yarımküre’de ve tropik dağlarda da yayılış gösterir (Baytop, 1984). Caryophyllaceae familyası yıllık veya çok yıllık, genellikle otsu, nadiren çalımsı ya da küçük ağaçsı bitkilerden meydana gelen oldukça geniş bir familyadır. Kurak ortamlardan, çok soguk ortamlara kadar değişik iklim şartlarında ve habitatlarında yaşayabilen kozmopolit türler içerir.
Silene L. cinsi 52’si endemik 129 taksonla Caryophyllaceae familyasının en fazla takson içeren cinsidir. Son yıllarda cinse eklenen taksonlarla bu sayı 135’e çıkmıştır (Coode ve Cullen, 1967; Davis ve ark., 1988; Tan ve Vural, 2000; Bağcı ve ark., 2007; Bağcı 2008).
Silene L. bir, iki veya çok yıllık otlar, genellikle çalı. Kaliks tüpsü, 10-60 damarlı, genellikle 5 kısa dişli. Petal 5, lamina ve klav genellikle belirgin, birleşme yerleri genellikle 2 lateral aurikullu. Koronal pullar genellikle mevcut, değişik
şekillerde. Stamen 10. Stilus 3(-5). Meyve bazal septadan gelişen farklı şekilli bir
kapsül şeklinde veya yok.
Kapsül dişleri stilus sayısını iki katı ve kapsül dişlerden açılır. Petaller, stamenler ve ovaryum uzunca bir internoddan (anthophora) çıkar. Tohumlar farklı
şekillerde. Çok geniş ve polimorfik bir cinstir. Sınıflandırmada infloresens (çiçek
durumu) yapısı ve aşağıdaki aterminolojiler kullanılır:
Dichasium: ± eşit pedisellerden çıkan 3 çiçekli bir kimöz (dikazyum)
Compound dichasium (bileşik dikazyum): Bir dikazyum gibi aynı yapıda fakat daha kompleks bir çiçek durumudur.
Monochasium: ± tek taraflı rasemozdan ortaya çıkan bazı dalların baskılanmasıyla oluşan bir kimoz çiçek durumudur.
Panicle (Bileşik salkım): Yan dallar tekrar dallanmış bir rasemoz.
Çiçek bir dikazyumun iki dalı arasındaki çataldan çıkar. Böyle çiçekler hermafrodit çiçeklerdeki kaliks ve anthophordan daha kısa olan, genellikle fonksiyonel dizi çiçeklerdir. Birçok türde infloresens tek çiçeğe indirgenmiştir.
Alem: Plantae Şube: Magnoliophyta Sınıf: Angiospermae Takım: Caryophyllales Familya: Caryophyllaceae Cins: Silene
Ülkemizde Silene cinsi aşağıdaki seksiyonlara (içerdikleri takson sayısı parantez içinde verilmiştir) ayrılmıştır (Coode & Cullen, 1967);
1 Sect. Siphonomorpha Otth (7) 2 Sect. Lasiostemones Boiss. (7) 3 Sect. Sclerocalycine Boiss. (14) 4 Sect. Chlorantane Rohrb. (2) 5 Sect. Tataricue Chowdh. (2) 6 Sect. Otiles (Adams.) Otth (2) 7 Sect. Spergulifoliae Boiss. (10) 8 Sect. Ampullatae Boiss. (3) 9 Sect. Caespitosae Chowdh. (4) 10 Sect. Corditoliae Chowdh. (1) 11 Sect. Fimbriatae Boiss. (1) 12 Sect. Inflatae Boiss. (4) 13 Sect. Brachypodeae Boiss. (4) 14 Sect. Auriculatae Boiss. (11) 15 Sect. Pinitoliae Chowdh. (4) 16 Sect. Tunicoidae Boiss. (1)
17 Sect. Macranthae (Rohrb.) Chowdh. (2+1) 18 Sect. Compactae Boiss. (3)
19 Sect. Elisonthe (Fenzl) Fenzl (2) 20 Sect. Rigidulae Boiss. (10) 21 Sect. Behenantha Otth. (4) 22 Sect. Lasiocalycine Boiss. (4) 23 Sect. Erecto-refractae Chowdh. (1) 24 Sect. Dichotomae (Rohrb.) Chowdh. (1) 25 Sect. Scorpioidae (Rohrb.) Chowdh (3) 26 Sect. Silene (2)
27 Sect. Diptorespermae (Rohrb.) Chowdh. (2) 28 Sect. Conomorpha Otth. (7)
Çalışma konumuzu içeren Macranthae seksiyonu Türkiye Florasında 78. tür olan Silene nuncupanda ve 79. tür olan S. capillipes türleri ile temsil edilir. Bağcı (2008) tarafından Karaman Ermenek-Kazancı çevresinde bilim dünyası için yeni tanımlanan Silene duralii Y. Bağcı ile seksiyonun takson sayısı üçe çıkmıştır.
1.1. Yayılış Alanları
Bitkilerin betimlenmesi ve akrabalık ilişkilerinin sadece morfolojik olarak değerlendirilmesi yetersiz olduğu için, yapılan tanımlamanın genetik olarak desteklenmesi gerekir. Bu çalışmada Macranthae seksiyonuna ait üç tür ile uzak bir grup olarak Caespitosae seksiyonundan bir tür üzerinde çalışıldı. Bitkilerin yayılış alanları (Şekil 1.1) şöyledir:
Şekil 1.1. Çalışılan türlerin Türkiye’de yayılış durumları
Silene duralii (■), S. capillipes (●), S. nuncupanda (▲) ve S. bayburtensis (♥)
1. Silene nuncupanda Coode & Cullen (endemik) (Şekil 1.2)
Tip: C5 Niğde, Bulgarmadeni çevresi olan bitki 2000-2900 m’lerde kayalık yamaçlarda yayılış gösterir. Çiçeklenme zamanı Haziran-Temmuz aylarıdır.
Diğer yayılış alanları:
B6 Maraş: Göksun, Binboğa Dağı, 2700-2880 m; C5 Niğde: Kızıl Tepe, 2300 m; Adana: Seyhan: Katır Geçidi, Pozantı’nın kuzeybatısı, 2050 m; C6 Maraş: Berit Dağı, 2900 m.
C5 Niğde, Sulucuova, Maden yolu, 1700 m, Savran 741. 2. Silene capillipes Boiss. & Heldr. (endemik) (Şekil 1.3).
Tip : C4 Konya: Ermenek-Mut arası 20. km.
C4 Karaman: Ermenek-Tekeçatı, Kamışdere, kaya çatlakları, 1400 m, 20.08.2004, Bağcı 3085 & Duran (KNYA).
Tip: C4 Karaman: Ermenek-Kazancı, Sarıova Yaylası, Kartal Kaya karşısı, Salur Dağı. 1750-1770 m, 36°28.546’ N, 32°43.904’ E, 16.06.2006, Bağcı 3476. Yavuz Bağcı tarafından 2008 yılında tanımlanan bitki dağ step alanlarında 1750-1770 m arasında yayılış gösterir ve Haziran-Temmuz aylarında çiçeklenir (Şekil 1.4).
4. Silene bayburtensis Hamzaoğlu & Aksoy (endemik)
Tip: A8 Bayburt: Çayıryolu-Kitre köyleri arası, kalkerli steplerde kayalık yamaçlar, 1700 m, 13.06.2007, Hamzaoğlu 4587, Aksoy & Budak (holotype; BOZOK Hb., isotypes; BOZOK Hb., GAZI, ANK, HUB).
Paratip: Bayburt: Demirözü, Gökçedere-Bizgili köyleri arası, 1750 m, kalkerli step, 15.06.2007. Hamzaoğlu 4652, Aksoy & Budak (Şekil 1.5).
Hamzaoğlu ve ark. tarafından 2010 yılında yayınlanan bitki kalkerli steplerde, kayalık dağ yamaçlarında 1700–1750 m arasında yayılış gösterir (Hamzaoğlu & ark. 2010).
a
b
a b
Şekil 1.3. Silene capillipes: a. genel görünüm, b. çiçek durumu (Bağcı 3085 & Duran, KNYA Hb.)
a
b
a b
Şekil 1.5. Silene bayburtensis: a. genel görünüm, b. çiçek durumu (Hamzaoğlu 4652, Aksoy &
Budak, Paratip BOZOK Hb.)
1.2. Belirleyiciler (Markırlar)
Genetik çeşitliliği tanımlamanın en iyi yolu DNA düzeyinde yapılan tanımlamadır. Farklı genotiplere ait DNA diziliş farklılığını çeşitli şekillerde ortaya koyan belirteçlere DNA markırları (DNA belirleyicileri) adı verilmektedir. Bu amaçla çok sayıda DNA markırları geliştirilmiştir. Hibridizasyona dayalı olması açısından Restriksiyon Fragman Uzunluk Polimorfizmi (RFLP) metodu; polimeraz zincir reaksiyonu (PCR) ile DNA çoğaltımına dayalı olan DNA analiz tekniklerinin en önemlileri arasında ise Rastgele Çoğaltılmış Polimorfik DNA (RAPD), Çoğaltılmış Fragman Uzunluk Polimorfizmi (AFLP), Basit Dizi Tekrarları (SSR), Tek Nükleotid Polimorfizmi (SNP), Dizisi Etiketlenmiş Alanlar (STS) ve Kesilmiş Amplifiye Polimorfik Diziler (CAPS) bulunmaktadır.
1.2.1. RFLP
Genetik varyasyonun DNA markırları ile belirlenmesi ilk olarak RFLP (Restriction Fragment Length Polymorphism) metodunun uygulanması ile sağlanmıştır (Griffiths ve ark., 1996). Restriksiyon Parça Uzunluk Polimorfizi olarak bilinen
hibridizasyona dayalı bu metotta, restriksiyon enzimleri DNA’daki nükleit asit dizilişini tanıyarak, DNA’yı bazı bölgelerden keser. Kesim yerlerinin farklılığı ile oluşan çeşitli uzunluklardaki DNA parçalarının agaroz jel elektroforezi yardımı ile ayrılması ve bu parçaların membrana emdirilmesinin (blotlama) gözlenmesi esasına dayanmaktadır. Bu teknikle DNA’da mevcut olan tek bir baz dizilişi farklılığı bile ayırt edilebilmektedir. 1.2.2. PCR
Belirli bir DNA dizisinin veya bir genin in vitro koşullarda çoğaltılma esasına dayanarak bilim adamları 1984 yılında PCR (Polymerase Chain Reaction) metodunu geliştirmişlerdir. Bu metod, basit bir enzimatik reaksiyonda, kompleks bir DNA kalıbından, çok miktarda spesifik bir DNA fragmentini oluşturabilmektedir (Arnheim ve Erlich, 1992).
PCR üç basamaktan oluşur:
1. Ayrılma (Denaturation): Kalıp DNA iplikçiklerinin yüksek sıcaklıkta birbirinden ayrılması aşamasıdır.
2. Bağlanma (Annealing): Primerin, ayrılmış DNA iplikçiklerindeki tamamlayıcısı olduğu bölgelere uygun sıcaklıkta bağlanmasıdır.
3. Uzama (Extension) : Tampon, deoksiribonükleozid trifosfatlar (dNTPs)’ın bulunması ile Taq DNA Polimeraz enziminin aktivasyonu ile primerin yeni çift zincirli DNA’lar oluşturacak şekilde sentez eylemini gerçekleştirmesidir.
“Döngü (siklus)” adı verilen bu üç basamak, uygulanan reaksiyonun optimizasyon koşullarına göre, 30-45 kez ardı ardına uygulanır. Kalıp DNA’dan istenilen DNA zinciri, siklus sayısına göre 2n defa çoğaltılır. Bir siklusun ardından sentezlenen ürünün, bu ardışık reaksiyonda diğer primer için kalıp görevi görmesi, üssel artışın sebebini oluşturur.
Polimeraz zincir reaksiyonu, arzu edilen miktarda kopyalanan DNA’yı elde ettikten sonra sona erdirilir. Oluşan PCR ürünleri molekül ağırlıklarına göre ayrıştırılmak üzere, genellikle agaroz jelde yürütülür. PCR uygulaması moleküler biyoloji, adli tıp, insan genetiği, populasyon genetiği, evrim gibi birçok çalışma alanında uygulanan prosedürleri kolaylaştırmıştır.
1.2.2.1. RAPD
DNA’yı oluşturan bazı bölgeler, genomda aynı nükleotid dizilerinin tekrarlanmasından oluşur. Bu bölgelerde meydana gelen mutasyonlar sonucu genomda yeni varyasyonlar ortaya çıkar. Williams ve ark. (1990) ile Welsh ve McClelland (1990)
adında iki araştırmacı grubu, eş zamanlı olarak farklı laboratuarlarda aynı yılda tür içinde ve türler arasındaki akrabalığı, genetik varyasyonu DNA düzeyinde belirlemek amacı ile RAPD (Random Amplified Polymorphic DNA) metodunu geliştirmişlerdir. Bu metotta, belirli bir türe ait izole edilmiş DNA’nın, random (rastgele) primerleri (9-10 bç) ile, düşük bir bağlanma sıcaklığında, genom içinde komplomenteri olan hedef bölgelere yapışması ve PCR tekniği ile geometrik olarak çoğalması prensibi vardır (Bardakçı, 2001). Amplifiye olan DNA molekülleri agaroz jel ya da ayrım gücü daha yüksek olan poliakrilamid jel elektroforezi kullanılarak, molekül büyüklüklerine göre jelde farklı boyutta RAPD bantları verecek şekilde birbirinden ayrılır. Çeşitli boyalarla boyanarak gözlem sağlanır. Bantların varlığı ya da yokluğuna bağlı olarak, polimorfizmden söz edilir.
1.2.2.2. AFLP
AFLP (Amplified Fragment Lenght Polimorphism) adı verilen bu belirleyici yöntem, restriksiyon enzim kesimi ile elde edilen DNA parçalarının seçici yolla çoğaltılıp üretilmesi temeline dayanır (Vos ve ark., 1995). Genomik DNA EcoRI ve MseI enzimleri tarafından kesilerek oluşan DNA parçalarının kesim enzimlerine özgü adaptörlerle ligasyona girip, daha sonra uygun primerle PCR’da çoğaltılması
şeklindedir. Oluşan ürünler jelde yürütüldükten sonra uygun boyama yöntemleriyle
boyanıp, gözlemlenir. 1.2.2.3. SSR
SSR (Simple Sequence Repeats); basit dizi tekrarları ya da mikrosatellitler olarak bilinen bu teknikte, genom içinde rastgele dağılmış ardışık olarak tekrar eden kısa DNA dizilerine mikrosatellitler denir. Bu dizi tekrarları farklı varyetelerde tekrar eden bölgeleri farklı sayıda amplifiye etmek için primer dizayn etmede kullanılır. Bu primerler polimorfizmde hızlı ve doğru bir kontrol sağlamak için elverişlidir. Ayrıca elde edilen bilgi sekans etiketlemesine dayalı fiziksel haritaların geliştirilmesinde kullanışlı olabilir (Srivastava, 2004).
1.2.2.4. SNP
Baz çiftinde tek nükleotid polimofizmi yardımıyla insersiyon ya da delesyon oluşması, tür ya da bireye bağlı olarak farklı formlardaki polimorfizme sebep olur. Moleküler markırlar bu nedenle belirleyici olarak kullanılmaktadır (Brookes, 1999). SNP’ye (Single Nucleotide Polymorhism) bitkilerde çok fazla rastlanır. SNP için uygun primerler dizayn edilir. Bu primerler, çalışması yapılan benzer genotiplerde amplifikasyon için kullanılır. SNP’deki her bir haploiti (allel=SNP’de haploit denir)
tespit etmek için, her bir fragmentin sekans analizi yapılır ve diğerleri ile kıyaslanır (Brown, 1999).
2. KAYNAK ARAŞTIRMASI
Deniz ve Düşen (2004), tip örneği Güneybatı Anadolu’dan Silene sumbuliana’yı Silene papillosa Boiss. ile ilişkilendirerek bilim dünyasına yeni bir bir tür olarak kaydetmişlerdir.
Yıldız (2005) çalışmalarında, Kuzey Kıbrıs ve Batı Anadolu’da yayılış gösteren Silene (Caryophyllaceae) türleri üzerinde yapılan palinolojik araştırmada Erdtman yöntemi uygulanarak, türlerin çiçeklerinden alınan polenleri preparat haline getirip, polen sayıları bulmuş; polen çapı, por çapı, porlar arası uzaklık ve ekzin değerlerini ölçmüştür. Ayrıca ışık mikroskobunda fotoğraflar çekilmiştir. Silene sipylea, S. fabaria, S. lydia, S. discolor, S. colorata palinolojik olarak sferoidal, tektat, mikroekinat ve mikroperforat iken; S. tenuiflora polenleri diğerlerinden farklı olarak ağsı (retikulat) yapıda gözlenmiştir.
Yıldız (2006), Batı Anadolu ve Kuzey Kıbrıs’ta yayılış gösteren bazı Silene türlerini (Silene sipylea, S. fabaria, S. tenuiflora, S. lydia, S. discolor, S. colorata var. colorata ve S. apetala var. grandiflora) morfolojik olarak karşılaştırmıştır. En geniş kalikse S. sipylea sahipken, en küçük kaliksin S. apetala var. grandiflora’da olduğu gözlenmiştir. S. lydia, S. discolor, S. colorata var. colorata and S. apetala var. grandiflora’da puberulent kaliks, S. sipylea, S. fabaria ve S. tenuiflora’da glabrous kaliks olduğu belirtilmiştir. Kaliksteki anastomotik damarların sayısı şu şekilde bulunmuştur; S. fabaria, S. tenuiflora ve S. apetala var. grandiflora’da 10 adet, S. discolor, S. colorata var. colorata ve S. sipylea’da 10 adet ve S. lydia kaliksinde 25-30 tane olduğu gözlenmiştir. S. sipylea and S. lydia’da oldukça küçük olduğu gözlenen ligulanın, bütün türlerin bazal petal yaprağında bulunduğu teşhis edilmiştir. Ayrıca birçok morfolojik özelliğin daha türlerdeki dağılımından çalışmada bahsedilmiştir.
Bağcı ve ark. (2007), Güney Anadolu’da yayılış gösteren Silene kucukodukii bitkisini betimleyip, türün S. sipylea türü ile karşılatırmışlardır. S. kucukodukii’nin kromozom sayısı 2n=24 olarak rapor edilmiştir.
Bağcı (2008), Kazancı’da (C4 karesi, Karaman) yayılış gösteren Silene duralii’yi, S. capillipes’ten tüylülük, yaprak ve çiçek özellikleri bakımından faklı olduğunu belirterek bilim dünyasına yeni bir olarak tanımlamıştır. S. duralii’nin kromozom sayısı 2n=24 olarak tespit edilmiştir. Diğer türle kıyaslamak maksadı ile SEM’le tohum yüzeyleri incelenmiştir. Ayrıca bu yeni türün ve S. capillipes’in coğrafi dağılımını haritalamıştır.
Tugay ve Ertuğrul (2008), S. caramanica Boiss. & Heldr. var. ilarslanii Aytaç & Dural’a oldukça yakınlık gösteren, Silene bitlisensis O.Tugay & Ertugrul’u yeni bir tür olarak, Sclerocalycinae Boiss. seksiyonuna ait olarak Bitlis ilinden betimlemişlerdir. Bulunduğu doğal ortam, yaprak ve çiçek özellikleri bakımından değerlendirmişlerdir.
Kandemir ve ark. (2009), Doğu Anadolu’da yayılış gösteren Silene dumanii Kandemir, G.Ecevit Genç & I.Genç bitkisini yeni bir tür olarak betimleyip, polen ve tohum yapısını taramalı elektron mikroskobu (SEM) ile incelemişlerdir. Türün Auriculatae seksiyonuna yakın olduğunu belirtseler de, petallerinde aurikulat yapı gözleyemediklerinden, herhangi bir seksiyona yerleştirememişlerdir.
Türkiye’deki Silene cinsine ait yapılan anatomik ve polen karakteri çalışmasında Silene caramanica, S. sipylea, S. montbretiana, S. dianthoides, S. pharnaceifolia, S. odontopetala, S. urvillei ve S. nuncupanda türlerinin internal özelliklerinin taksonomik derecelerini belirlemek amacı ile numerik analizleri değerlendirilip, gruplandırılmıştır (Kılıç, 2009). Bu özelliklerin polen morfolojisi (polen şekli ve por sayısı) ve anatomik karakterler ile yakınlıkları, incelenen taksonda gerekli olan ayrımı yapmak için dikkate değer olduğu bulunmuştur. Bütün karakterlerin en önemli unsurları anatomik ve palinolojik karakterler olarak incelenen takson içindeki toplam varyasyonu açıklamada önemli olduğu belirtilmiştir.
Yıldız ve ark. (2009), Silene cinsinin Türkiye’de yayılış gösteren Lasiostemones seksiyonu türlerinin karyotip çalışmasını yapmışlardır. Elde ettikleri bulgulara göre çalışılan taksonun diploid S. olympica’nın kromozomlar arasında en yüksek asimetri katsayısına sahip olduğu belirtilmiştir. Taksonu kromozom kol özelliklerine göre üç sınıfa ayırmışlardır. S. saxatilis, S. isaurica, S. olympica ve S. lasiantha türleri metasentrik ve submetasentrik kromozolara sahip olarak birinci grubu oluşturmuştur. Metasentrik, submetasentrik ve subtelosentrik kromozomlara sahip olan S. capitellata ve S. manissadjianii türleri ikinci grubu meydana getirirken, S. longipetala ve S. marschallii türleri ise sadece metasentrik kromozomlara sahip olmaları ile birbirlerine yakın ve karyotip olarak simetrik olarak tespit edilmiştir.
Yıldız ve Dadandı (2009), Kuzey Anadolu’dan Silene cirpicii K.Yıldız & Dadandı yeni türünü bilim dünyasına kazandırmışlardır. Silene cirpicii K.Yıldız & Dadandı yeni türü, S. falcata, S. caryophylloides ve S. argaea türleri ile karşılaştırılmıştır.
Hamzaoğlu ve ark. (2010), Bayburt ilinden Silene bayburtensis Hamzaoğlu & Aksoy bilim dünyasına kazandırmışlardır. Morfolojik olarak Silene bayburtensis, Silene pharnaceifolia ile karşılaştırılmıştır.
Yıldız ve Erik (2010), Güney ve Güneybatı Anadolu’da morfolojik olarak Silene caramanica ve Silene doganii ile karşılaştırdıkları, Silene aydosensis K.Yıldız & S.Erik yeni bir tür olarak bilim dünyasına kazandırmışlardır. Tohum ve polen yapısını SEM’le inceleyip, yeni türün kendisine yakın olan türlerden farklılıklarını belirtmişlerdir.
Silene L. cinsi ilgili olarak bazı moleküler çalışmalar da yapılmıştır;
Vellekoop ve ark. (1996), Avrupa’da doğu ve batı bölgelerinde, farklı 16 coğrafyaya dağılan Silene latifolia türlerinde RAPD-PCR metodunu uygulamışlardır. Jaccard’ın benzerlik katsayısını kullanarak, aritmetik ortalamalara göre dendogramlar oluşturmuşlardır. Dendogramlarda iki kümelemendirmeyi temel olarak populasyonlarda doğu-batı ayrımı yapmak için kullanmışlardır.
Microbotryum violaceum fungusunu üzerinde bulunduran Silene latifolia, S. dioica, S. nutans ve S. vulgaris türleri mikrosatellitler yardımıyla çalışılmıştır (Bucheli ve ark., 1997). Bitki türleri üzerinde yaşayan populasyonlar ve bitki türleri arasındaki genetik yapı analizinde mikrosatellitlerin tanımlamada yardımcı olduğuna değinmişlerdir.
Kejnovsky ve ark. (2001), dioik bir bitki olan ve dişisi XX, erkeği XY kromozomu taşıyan Silene latifolia bitkisinin, erkek türde ekprese olan MROS gen bölgesini PCR ile amplifiye edip, restriksiyon enzimleri ile keserek ya da nested primerlerle yeniden amplifiye ederek lokalizasyonunu ve MROS3 geninin polen gelişimi ile bağlantılı olduğunu belirtmişlerdir.
Tero (2005), Silene tatarica’nın metapopulasyonunun genetik yapısını AFLP ve mikrosatellit markırlar vasıtasıyla incelemiştir. Çalışmada Finlandiya’nın iki farklı nehri yakınında yayılış gösteren S. tatarica türleri için, iki nehrin populasyonları arasında bazı genetik farklılıkların olduğunu, ancak bunun nehir regülasyonlarının farklı olması nedeni ile oluştuğu hakkında kesin bir kanıtın olmadığını belirtmiştir.
Hobza ve ark. (2006), dioik bir bitki olan Silene latifolia’da yeni bir tekrar eden dizi olduğunu ve buna TRAYC adını verdiklerini ve Y kromozomunda bulunduğunu belirtmişlerdir. Yapılan çalışmada uygulunan PCR, klonlama, sekans analizleri, southern hibridizasyonu, in situ DNA işaretlemesi metodlarıyla, bu dizinin cinsiyet kromozom evolüsyonunun erken safhasında birikim meydana getirdiğini, TRAYC’nin
varlığının palindromik bir karakter olup, sekonder yapıların oluşmasında satellit evolüsyonda güçlü bir potansiyel etki oluşturduğuna işaret etmişlerdir.
McCauley ve ark. (2007), Silene vulgaris’te kloroplast DNA’sının (cpDNA) kalıtımının tamamen maternal olup olmadığını kanıtlamak için, PCR ve RFLP markırları kullanarak, ana, baba ve döl bireylerinin genotiplerini kıyaslamışlardır. Sonuç olarak, maternal olmayan kalıtımların bulunduğunu da göstermişlerdir.
Martin ve ark. (2008), tarafından Silene behen bitkisinin karyotip çalışması yapılmış ve kromozom sayısı 2n=24 olarak bulunmuştur.
Rautenberg ve ark. (2010) nüklear ribozomun ITS bölgesi ve kloroplast genomundan elde edilen DNA dizi analizini kullanarak, Silene cinsinin Melandrium seksiyonunun beş dioik türünün arasındaki filogenetik ilişkiyi ve hermafrodit akrabalıklarını, türlerin geniş ve coğrafik taksonuna dayalı olarak incelemişlerdir.
3. MATERYAL VE METOT
3.1. Materyal
Türkiye Silene cinsine ait Macranthae seksiyonu taksonlarından Silene capillipes, Silene duralii ve Silene nuncupanda türleri ile ayrı bir grup olarak Caespitosae seksiyonundan S. bayburtensis türüne ait örnekler üzerinde çalışıldı. Çalışılan herbaryum örnekleri şunlardır;
5. Silene nuncupanda Coode & Cullen
C5 Niğde, Sulucuova, Maden yolu, 1700 m, Savran 741 (KNYA) 6. Silene capillipes Boiss. & Heldr.
C4 Karaman: Ermenek-Tekeçatı, Kamışdere, kaya çatlakları, 1400 m, 20.08.2004, Bağcı 3085 & Duran (KNYA)
7. Silene duralii Y. Bağcı
Tip: C4 Karaman: Ermenek-Kazancı, Sarıova Yaylası, Kartal Kaya karşısı, Salur Dağı. 1750-1770 m, 36°28.546’ N, 32°43.904’ E, 16.06.2006, Bağcı 3476. (KNYA)
8. Silene bayburtensis Hamzaoğlu & Aksoy (endemik)
Paratip: Bayburt: Demirözü, Gökçedere-Bizgili köyleri arası, 1750 m, kalkerli step, 15.06.2007. Hamzaoğlu 4652, Aksoy & Budak (BOZOK)
3.2. Metot
3.2.1. DNA izolasyonu
Tohumdan DNA izolasyonu için Roche’un High Pure PCR Template Preparation Kit kullanıldı. Kullanılan DNA izolasyon kitinin içeriği ve resmi aşağıda verilmiştir.
• Lysis Buffer (Lizis Tamponu) • Proteinase K
• Binding Buffer (Bağlama Tamponu) • Đsopropanol
• Inhibitor Removal Buffer (Đnhibitör Çıkarma Tamponu) • Wash Buffer (Yıkama Tamponu)
• Collection Tube (Toplama Tüpü) • High Filter Tube (Yüksek Filtre Tüpü)
Şekil 3.1. DNA izolasyon kiti
Proteinase K, DNA izolasyonunda kullanılana kadar -20º C’de muhafaza edildi. Kitin geri kalan içerikleri ise oda ısısında muhafaza edildi. DNA izolasyonu, kullanılan kitin prosedürüne uygun olacak şekilde, aşağıda sıralanan aşamalara göre yapıldı.
• DNA izolasyonu için gerekli olan tohum materyalleri ezilerek, 25-50 mg arası olacak şekilde, hassas terazide tartılıp, steril mikrosantrifüj tüplerine (eppendorf) konuldu. Ezilen tohumların üzerine 200 µl Lizis Tamponu ve 40 µl Proteinase K eklenip karıştırıldıktan sonra, 37 ºC’de bir gece inkübasyonda bekletildi.
• Đnkübasyon sonrası küçük parçalar hala gözlendiği için, 20 µl Proteinase K daha
eklenip 1-2 saat 55 ºC’de inkübe edildi.
• 200 µl Bağlama Tamponu eklenip, iyice karıştırılıp, 10 dakika 70 ºC’de inkübe edildi.
• 100 µl isopropanol eklenip, 1ml’lik otomatik pipetle iyice karıştırıldı. • Toplama Tüpü’nün içerisine Yüksek Filtre Tüpü yerleştirildi.
• Üstte kalan sıvı faz Yüksek Filtre Tüpü’nün içerisine dikkatlice konuldu ve 8000 g’de 1 dk santrifüj edildi.
• Santrifüjden sonra Filtre Tüpü, Toplama Tüpü’nden çıkarıldı. Toplama Tüpü’nde biriken sıvı ile beraber Toplama Tüpü atıldı.
• Filtre Tüpü ile yeni bir Toplama Tüpü kombine edildi.
• Filtre Tüpü’nün üst haznesine 500 µl Đnhibitor Çıkarma Tamponu eklenip, 8000 g’de 1 dk santrifüj edildi.
• Filtre Tüpü ile yeni bir Toplama Tüpü kombine edildi.
• Filtre Tüpü’n üst haznesine 500µl Yıkama Tamponu eklenip, 8000 g’de 1 dk santrifüj edildi. Toplama Tüpü tekrardan içerisinde kalan sıvı ile birlikte atıldı. Bu işlem iki kez tekrar edildi. Son aşamada, sıvı kısım atıldıktan sonra, Toplama Tüpü atılmadan evvel, maksimum hızda 10 saniye santrifüj edilip, Toplama Tüpü atıldı.
• Elüsyon için, Filtre Tüpü 1.5 ml’lik mikrosantrifüj tüpü içerisine yerleştirildi. Önceden ısıtılmış 200 µl Elüsyon Tamponu, Filtre Tüpü’nün üst haznesine yerleştirilip, 8000 g’de 1 dk santrifüj edildi.
Elde edilen DNA örnekleri -20 ºC’de muhafaza edildi. DNA izolasyonu sonunda tüplerdeki yeterli miktarlarda elde edilip edilmediğini kontrol etmek amacıyla %1’lik agaroz jel elektroforezinde DNA’lar yürütüldü.
3.2.2. Kullanılan primerlerin seçimi
Çalışmada RAPD tekniğine uygun olarak, 10 baz dizilik 20 primer (Operon Technologies) denendi. Ancak aralarında yeterli sayıda bant üretmelerine bağlı olarak en iyi sonuç veren 10 adet primer RAPD veri analizleri için kullanıldı. Bu çalışmada kullanılan primerlerin isimleri, primer uzunluğu, baz dizilişleri, primerlerin Guanin(G) + Sitozin(C) toplamının toplam baz sayısına oranları ve bağlanma sıcaklıkları Çizelge 3.1.’de verildi. Bir primerin amplifikasyonu sağlaması için bağlanma esnasında gerekli olan sıcaklığı aşağıdaki formülle hesaplanır:
Bağlanma Sıcaklığı Tm (ºC) = [(A+T’lerin sayısı)x2 ºC + (G+C’lerin sayısı)x4ºC] RAPD tekniğinde kullanılacak olan primerin Guanin ve Cytosine bazlarının toplam baz dizisine oranının, primerin komplomenteri olan gen bölgesine bağlanmasını kolaylaştırması için %60 ve üzeri olması tercih edilir. Bu çalışmada kullanılan primerlerde G+C toplamının toplam baz sayısına oranı %60 ve %70 değerlerinde, Tm sıcaklığı ise 32-34 ºC değerleri arasındadır.
Çizelge 3.1. Çalışmada kullanılan RAPD primerleri ve özellikleri
Primer Adı
Primer
Uzunluğu Baz Dizilişi (5’→ 3’)
G+C Oranı (%) Bağlanma Sıcaklığı Tm (ºC) OPA-01 10 CAGGCCCTTC 70 34 OPA-02 10 TGCCGAGCTG 70 34 OPA-03 10 AGTCAGCCAC 60 32 OPA-04 10 AATCGGGCTG 60 32 OPA-05 10 AGGGGTCTTG 60 32 OPA-06 10 GGTCCCTGAC 70 34 OPA-15 10 TTCCGAACCC 60 32 OPA-16 10 AGCCAGCGAA 60 32 OPA-17 10 GACCGCTTGT 60 32 OPA-18 10 AGGTGACCGT 60 32
3.2.3. RAPD-PCR amplifikasyonu ve optimizasyonu
Bitkisel materyallerden izole edilen DNA’lar sentetik olarak hazırlanmış primerler ve tüm reaksiyon komponentleri eklenerek PCR cihazına yerleştirildi. Reaksiyon ve PCR koşulları aşağıda belirtilen şekilde gerçekleştirildi:
1X’lik PCR reaksiyon karışımı Miktar (µl)
Steril distile su 11,2 µl 10x Buffer pH: 8.5 (750mM Tris-HCl (pH 8.8, 25 °C), 200mM (NH4) 2SO4, 0.1% Tween 20.) 2,5 µl 25mM MgCl2 1,5 µl dNTPs (2.5 mM her birinden) 2,4 µl Primer 2,4 µl
Taq Polimeraz (Fermentas 5 U/ml) 1 µl
DNA 4 µl
Toplam Reaksiyon Karışımı 25 µl
Hazırlanan karışım RNase ve DNase-free PCR tüpleri içerisinde Techne Thermal Cycler marka PCR cihazına yerleştirildi(Şekil 3.2).
Şekil 3.2. Techne TC-512 Thermal Cycler PCR cihazı
Çalışmada kullanılan reaksiyon koşulları şu şekildedir:
Basamak Sıcaklık Süre Döngü Sayısı Ön Denatürasyon 95 ºC 5 dk 1 Denatürasyon 94 ºC 30 sn Bağlanma 33 ºC 1 dk 40 Uzama 72 ºC 1 dk Son Uzama 72 ºC 3 dk 1 3.2.4. Elektrolit çözeltisi
Agaroz jel elektroforez tankı içerisinde elektrolit çözeltisi olarak TAE (Tris-Acetate-EDTA) kullanıldı. Daha sonraki çalışmalarda zaman kazanmak adına, çözeltinin konsantrasyonu 50X (pH 8.0) yoğunlukta 1 litre suda çözdürülerek, stok olarak hazırlandı;
50X’lik TAE Tampon Çözeltisi Miktar Tris base 242.0 g
Glacial Asetic Asit 57.1 ml EDTA (0.5M, pH 8.0) 100.0 ml
Stok çözeltiden 1X yoğunlukta TAE elektrolit çözeltisi hazırlamak için, 50X TAE’den 20 ml alınıp, distile su yavaşça eklenip toplam hacim 1000 ml’ye tamamlandı. Bu çalışma tamponu, agaroz jel hazırlanmasında ve elektroforez tankında kullanıldı. Her iki tamponun da, aynı çözeltiden kullanılmasına dikkat edildi.
3.2.5. Agaroz jelin hazırlanması
RAPD yöntemi ile amplifiye olan DNA örneklerinin elektoroforetik ayrımının yapılabilmesi için, %2’lik agaroz jel (Trizma Base) kullanıldı. Bir jel hazırlanırken 1X TAE (Trisma Base, Glacial Asetic Asid, EDTA) tamponunda mikrodalga fırın içerisinde 2-3 dk kaynatıldı. Soğutulmaya bırakılan jel eriyiği, üzerinde PCR ürünlerinin yükleneceği kuyuların oluşmasını sağlayacak dişli bir tarağın bulunduğu jel tepsisine hava kabarcığı kalmayacak şekilde dikkatlice döküldü. Jel donduktan sonra taraklar jeli kırmayacak şekilde jelden çıkarıldı. Jel içerisinde TAE çözeltisinin bulunduğu tanka yerleştirildi. TAE elektrolit çözeltisinden jelin üst kısmını kaplayacak kadar döküldü.
3.2.6. PCR ürünlerinin jel kuyularına yüklenmesi
PCR ürünleri agaroz jelde elektrolit çözeltisi ile karışmaması için Loading Dye adı verilen, yükleme tamponuyla karıştırılarak, jel kuyularına yüklenir. 10 µl PCR ürünü, 5 µl’lik yükleme tamponu (%40’lık sükroz, Xylene Cyanol FF ve Bromophenol Blue) ile jele yüklenmeden önce mikropipet yardımı ile karıştırıldı. Ardından jeldeki kuyucuklara yüklendi. Elde edilen RAPD bantlarının moleküler büyüklerinin anlaşılabilmesi için, GeneRuler (50 bp DNA Ladder, Fermentas) ve DNA Ladder (Set of 1 kb DNA Ladder with stain, SibEnzyme) markırlarından 4 µl alınıp, 1µl 6X yükleme tamponu ile karıştırılarak jelin iki tarafına standart olarak yüklendi.
3.2.7. Jele yüklenen PCR ürünlerinin jelde yürütülmesi
PCR ürünleri elektrolit çözeltisi içerisinde akımla birlikte, moleküler büyüklüklerine göre ayrılabilmeleri için, yatay elektroforez cihazında (Şekil 3.3) 100 voltta 2,5 saat yürütüldü. Ürünlerin kaybolmaması adına, jelin bitiş noktasını geçmeden, akımı sonlandırmak için gerekli kontrol aralıklarla yapıldı.
3.2.8. Jelin boyanması ve RAPD bantlarının elde edilmesi
Agaroz jel elektroforezinden alınan jel, RAPD-PCR bantlarının gözlemlenebilmesi için 5µg/ml’lik etidyum bromid solüsyonu içerisinde 30 dk boyandı. Daha sonra UV ışığında (BioRad Chemidoc XRS Gel Documentation System) görüntülendi (Şekil 3.4).
Şekil 3.4. Jel görüntüleme sistemi
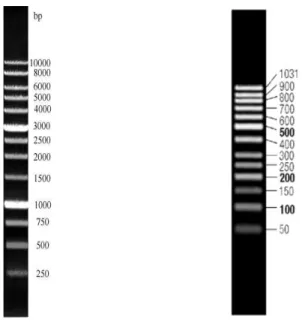
Oluşan bantların büyüklüklerini belirlemek için 13 fragment içeren iki ayrı markır kullanıldı (1000 bç DNA Ladder, SibEnzyme) ve (50 bç Gene Ruler, Fermantas) (Şekil 3.5). Amplifikasyon sonucu oluşan RAPD bantlarının büyüklükleri DNA markırlarındaki bantların büyüklükleri ile kıyaslanarak ölçüldü.
Şekil 3.5. RAPD Bant profillerini belirlemede kullanılan 1000 bç DNA Ladder (SibEnzyme) ve
3.2.9. Jellerin yorumlanması ve veri analizleri
Amplifikasyon sonrasında jel görüntüleme sistemi ile elde edilen fotoğraflar görsel olarak değerlendirildi. Gözlenen bütün bantlar değerlendirilmeye alındı. Bantlar yorumlanırken var/yok esasına göre (1=var; 0=yok olacak şekilde) skorlama yapıldı (Çizelge 3.2). Veriler Statistica 8 programında öklid uzaklıkları baz alınarak kümelendirildi.
Çizelge 3.2. Üç türe ait RAPD bantların skorlama örneği
Lokus Numarası Markır A B C 1 ___ ___ ___ 2 ___ ___ ___ ___ 3 ___ ___ ___ Toplam Bant Sayısı 3 2 2
Yukarıdaki şekilde, örnek açıklamak üzere, RAPD-PCR’ın ardından, agaroz jele yüklenen üç türe ait PCR ürünlerinin jel görüntüleme aşamasından sonra gözlenen RAPD bantlarının skorlaması ve polimorfik/monomorfik bant değerlendirilmesi verilmiştir. Yapılan bu veri matriksi ile türler arasındaki polimorfizm oranı, genetik benzerlik ve genetik uzaklık oranı gisi istatistiksel hesaplamalar yapıldı.
Türler arasındaki genetik uzaklık(D) aşağıdaki formüle göre hesaplanmıştır (Nei, 1987):
Dxy = 1- Nxy/ (Nx + Ny–Nxy )
Dxy : “x” ve “y” türleri arasındaki genetik uzaklık Nxy: “x” ve “y” türleri arasındaki ortak bant sayısı Nx : “x” türüne ait toplam bant sayısı
Ny : “y” türüne ait toplam bant sayısı, formülde ifade edilmektedir.
Türler arasındaki polimorfizm oranını hesaplamak için aşağıdaki formül kullanılmıştır: Polimorfizm oranı: Polimorfik bant sayısı
Toplam bant sayısı
Polimorfik bant Monomorfik bant Polimorfik bant
4. ARAŞTIRMA BULGULARI VE TARTIŞMA
4.1. DNA Đzolasyon Sonuçları
Yapılan DNA izolasyonundan yeterli miktarda DNA elde edilip edilmediğini kontrol etmek amacı ile, DNA örnekleri %1’lik agaroz jele yüklendi (Şekil 4.1).
Şekil 4.1. %1’lik agaroz jelde DNA izolasyonu uygulanan 4 türe ait DNA bantları
4.2.Amplifikasyonlar
Kullanılan 10 adet primerle yapılan amplifikasyon sonucu, 4 türe ait RAPD bantları elde edildi. Her bir primerle kaç adet bant elde edildiği ve bu bantların bulunduğu baz aralıkları Çizelge 4.1.’de verildi.
Farklı baz çifti aralıklarında gözlenen toplam 380 bandın, 79 tanesi S. bayburtensis’e, 102 tanesi S. capillipes’e, 95 tanesi S. duralii’ye ve 104 tanesi S. nuncupanda’ya aittir. Primerlerin sağladığı amplifikasyonlar göz önünde bulundurulduğunda, en fazla bant veren primer 69 adet bantla OPA-01, en az bant veren ise 20 adet bantla OPA-15’dir. Primerlerle amplifiye olan tür DNA’larının lokuslarında yüksek oranda polimorfizm tespit edildi.
Çizelge 4.1. Silene cinsinin dört türünde 10 adet primer ile elde edilen bant sayısı ve aralıkları Primer Adı Silene bayburtensis Silene capillipes Silene duralii Silene nuncupanda Toplam Bant Sayısı Bant Aralığı (bç) OPA-01 20 12 18 19 69 200-2000 OPA-02 12 16 5 16 49 150-1500 OPA-03 6 10 9 9 34 100-1000 OPA-04 0 15 7 13 35 200-1500 OPA-05 0 13 6 6 25 200-1500 OPA-06 10 5 11 12 38 100-1500 OPA-15 3 2 13 2 20 150-1500 OPA-16 15 16 2 18 51 50-1500 OPA-17 9 8 14 1 32 50-1500 OPA-18 4 5 10 8 27 150-1500 Toplam Bant Sayısı 79 102 95 104 380
Toplam 246 lokusun (fragman) 235’inin polimorfik olduğu, 11’inin monomorfik olduğu belirlendi (Çizelge 4.2). Çalışmada elde edilen polimorfizm oranı %95.52 olarak tespit edildi. Ayrıca her bir fragment Var-Yok esasına göre skorlandı. Uygulanan her bir primer için türler arası genetik uzaklık ve genetik benzerlik oranları hesaplandı.
Çizelge 4.2. Amplifikasyon sonucu oluşan bant sayıları, polimorfizm oranları, genetik uzaklık ve genetik benzerlik oranları
Primer Adı Bant Sayısı Polimorfik Bant Sayısı Polimorfizm oranı %
Bant Genetik uzaklık
Genetik benzerlik OPA-1 47 46 97.87 0 1 0,98529412 0,01470588 OPA-2 25 23 92 0 1 0,95744681 0,04255319 OPA-3 21 19 90.47 0 1 0,9375 0,0625 OPA-4 29 29 100 0 1 1,0000 OPA-5 20 20 100 0 1 1,0000 OPA-6 21 19 90.47 0 1 0,94444444 0,05555556 OPA-15 15 14 93.33 0 1 0,94736842 0,05263158 OPA-16 32 32 100 0 1 1,0000 OPA-17 23 22 95.65 0 1 0,96774194 0,03225806 OPA-18 13 11 84.62 0 1 0,875 0,125 Σ 246 235 95.52 0 1
Taksonların 10 adet primere ait agaroz jel görüntüleri ve dendogramları Şekil 4.2 ile Şekil 4.20 arasında verilmiştir.
Şekil 4.2. Çalışmada kullanılan örneklerin OPA-01 primeri ile elde edilen PCR amplifikasyon ürünlerinin
agaroz jel görüntüsü. M: Markır (1000 bç DNA Ladder, SibEnzyme), 1-Silene bayburtensis, 2-Silene
capillipes, 3-Silene duralii, 4-Silene nuncupanda. M: Markır (50 bç DNA Ladder, Fermantas) M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 K
M
ŞŞekil 4.3 Silene cinsi türlerinin OPA-01 primerine göre Statistica 8 programı ile elde edilen dendogramı
1000 bç 500 bç 250 bç 1000 bç 3000 bç S. bayburtensis S. capillipes S. duralii S. nuncupanda
Şekil 4.4. Çalışmada kullanılan örneklerin OPA-02 primeri ile elde edilen PCR amplifikasyon ürünlerinin
agaroz jel üzerindeki görüntüsü. M: Markır (1000 bç DNA Ladder, SibEnzyme), 1-Silene bayburtensis, 2-Silene capillipes, 3-Silene duralii, 4-Silene nuncupanda M: Markır (50 bç DNA Ladder, Fermantas)
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 K M
M 1
Şekil 4.5. Taksonların OPA-02 primerine göre Statistica 8 programı ile elde edilen dendogramı
M M 1000 bç 1000 bç 500 bç 250 bç 3000 bç S. bayburtensis S. duralii S. capillipes S. nuncupanda
Şekil 4.6. Çalışmada kullanılan örneklerin OPA-03 primeri ile elde edilen PCR amplifikasyon ürünlerinin
agaroz jel üzerindeki görüntüsü. M: Markır (50 bç DNA Ladder, Fermantas), 1-Silene bayburtensis,
2-Silene capillipes, 3-2-Silene duralii, 4-2-Silene nuncupanda. M: Markır (1000 bç DNA Ladder, SibEnzyme)
Şekil 4.7. Taksonların OPA-03 primerine göre Statistica 8 programı ile elde edilen dendogramı 50 bç 1 2 3 4 1000bç M M 1000 bç 1000 bç 500 bç 250 bç 500 bç S. bayburtensis S. duralii S. capillipes S. nuncupanda
Şekil 4.8. Çalışmada kullanılan örneklerin OPA-04 primeri ile elde edilen PCR amplifikasyon ürünlerinin
agaroz jel üzerindeki görüntüsü. M: Markır (50 bç DNA Ladder, Fermantas) 1-Silene bayburtensis,
2-Silene capillipes, 3-2-Silene duralii, 4-2-Silene nuncupanda. M: Markır (1000 bç DNA Ladder, SibEnzyme)
ŞŞekil 4.9. Taksonların OPA-04 primerine göre Statistica 8 programı ile elde edilen dendogramı
M M 1000 bç 1000 bç 500 bç 250 bç 500 bç S. bayburtensis S. duralii S. nuncupanda S. capillipes
Şekil 4.10. Çalışmada kullanılan örneklerin OPA-05 primeri ile elde edilen PCR amplifikasyon
ürünlerinin agaroz jel üzerindeki görüntüsü. M: Markır (50 bç DNA Ladder, Fermantas) 1-Silene
bayburtensis, 2-Silene capillipes, 3-Silene duralii, 4-Silene nuncupanda. M: Markır 1000 bç DNA
Ladder, SibEnzyme)
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 117 18 19 20 21 22 K M
ŞŞekil 4.11. Taksonların OPA-05 primerine göre Statistica 8 programı ile elde edilen dendogramı
M M 500 bç 500 bç 250 bç 1000 bç 3000 bç 1000 bç S. bayburtensis S. duralii S. nuncupanda S. capillipes
Şekil 4.12. Çalışmada kullanılan örneklerin OPA-06 primeri ile elde edilen PCR amplifikasyon
ürünlerinin agaroz jel üzerindeki görüntüsü. M: Markır (50 bç DNA Ladder, Fermantas), 1-Silene
bayburtensis, 2-Silene capillipes, 3-Silene duralii, 4-Silene nuncupanda. M: Markır (1000 bç DNA
Ladder, SibEnzyme)
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 K M
Şekil 4.13. Taksonların OPA-06 primerine göre Statistica 8 programı ile elde edilen dendogramı
3000 bç 1000 bç 500 bç 1000 bç 500 bç 250 bç M M S. bayburtensis S. capillipes S. nuncupanda S. duralii
Şekil 4.14. Çalışmada kullanılan örneklerin OPA-15 primeri ile elde edilen PCR amplifikasyon
ürünlerinin agaroz jel üzerindeki görüntüsü. M: Markır (1000 bç DNA Ladder, SibEnzyme), 1-Silene
bayburtensis, 2-Silene capillipes, 3-Silene duralii, 4-Silene nuncupanda. M: Markır ( 50 bç DNA Ladder,
Fermantas) 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 K M
ŞŞekil 4.15. Taksonların OPA-15 primerine göre Statistica 8 programı ile elde edilen dendogramı
M M 1000 bç 1000 bç 500 bç 3000 bç 500 bç 250 bç S. bayburtensis S. capillipes S. nuncupanda S. duralii
Şekil 4.16. Çalışmada kullanılan örneklerin OPA-16 primeri ile elde edilen PCR amplifikasyon
ürünlerinin agaroz jel üzerindeki görüntüsü. M: Markır (50 bç DNA Ladder, Fermantas) 1-Silene
bayburtensis, 2-Silene capillipes, 3-Silene duralii, 4-Silene nuncupanda. M: Markır (1000 bç DNA
Ladder, SibEnzyme),
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 K M
ŞŞekil 4.17. Taksonların OPA-16 primerine göre Statistica 8 programı ile elde edilen dendogramı
M M 3000 bç 1000 bç 1000 bç 500 bç 250 bç 500 bç S. bayburtensis S. nuncupanda S. capillipes S. duralii
Şekil 4.18. Çalışmada kullanılan örneklerin OPA-17 primeri ile elde edilen PCR amplifikasyon
ürünlerinin agaroz jel üzerindeki görüntüsü. M: Markır (50 bç DNA Ladder, Fermantas), 1-Silene
bayburtensis, 2-Silene capillipes, 3-Silene duralii, 4-Silene nuncupanda. M: Markır (1000 bç DNA
Ladder, SibEnzyme)
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 K M
Şekil 4.19 Taksonların OPA-17 primerine göre Statistica 8 programı ile elde edilen dendogramı
50 bç 1 2 3 4 1000 bç M M 3000 bç 1000 bç 1000 bç 500 bç 250 bç 500 bç S. bayburtensis S. capillipes S. nuncupanda S. duralii
Şekil 4.20. Çalışmada kullanılan örneklerin OPA-18 primeri ile elde edilen PCR amplifikasyon
ürünlerinin agaroz jel üzerindeki görüntüsü. M: Markır(50 bç DNA Ladder, Fermantas), 1-Silene
bayburtensis, 2-Silene capillipes, 3-Silene duralii, 4-Silene nuncupanda. M: Markır (1000 bç DNA
Ladder, SibEnzyme)
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 K M
ŞŞekil 4.21. Taksonların OPA-18 primerine göre Statistica 8 programı ile elde edilen dendogramı
50 bç 1 2 3 4 1000bç M 3000 bç 1000 bç 500 bç M 1000 bç 250 bç 500 bç S. bayburtensis S. capillipes S. duralii S. nuncupanda
Şekil 4.22. Dört taksona ait çalışılan primerlere göre Statistica 8 programı ile elde edilen özet dendogramı
Yapılan çalışmada elde edilen verilere ve hazırlanan dendogramlara göre, Şekil 4.22.’deki ortak dendogramda görüldüğü üzere, Silene bayburtensis ve Silene nuncupanda genetik olarak en yakın türler olarak bulundu. Silene duralii, Silene bayburtensis ve Silene nuncupanda’ya S. capillipes’e oranla genetik olarak daha yakın bulundu. Türler arasında genetik uzaklığı en belirgin olan Silene capillipes’tir.
Silene cinsi türleri OPA-01 primeri ile RAPD-PCR yöntemi ile amplifiye edildi (Şekil 4.2). Bu primerle yapılan dendograma göre (Şekil 4.3), farklı olan türler arasında yüksek oranda polimorfizm (% 97,87) görüldü. OPA-01 Silene cinsi türlerinin ayrımı için kullanılması en uygun olan primerlerden biridir.
OPA-02 primeri ile uygulanan RAPD-PCR ile amplifiye olan Silene türlerinin RAPD bantları agaroz jelde gözlendi (Şekil 4.4). Elde edilen Statistica 8 dendogramı ile (Şekil 4.5), türler arasında polimorfizmin ve hesaplanan polimorfizm oranının (% 92) yüksek olduğu görüldü. Bu primer türlerin ayrımı için uygun bulundu.
Şekil 4.6’da OPA-03 primeri ile yapılan RAPD-PCR sonucunda elde edilen
bantlar agaroz jelde görüldü. Buna ilişkin yapılan dendograma göre (Şekil 4.7), tür içinde polimorfizm gözlendi. Ancak polimorfizm oranı, diğer primerlere kıyasla daha düşük hesaplandı (%90,47). OPA-03 primeri bu türlerin ayrımı için kullanılabilir.
OPA-04 ve OPA-05 primerlerine ilişkin RAPD-PCR ile gözlenen bantlar (Şekil 4.8 ve Şekil 4.10), oluşturulan dendogramlara (Şekil 4.9 ve Şekil 4.11) göre türler
S. bayburtensis
S. nuncupanda
S. duralii
arasında polimorfizm oranı yüksek olarak gözlendi. Bu primerler genetik uzaklık belirlemede kullanım için uygundur.
Şekil 4.12’de OPA-06 primeri ile yapılan RAPD-PCR sonucunda elde edilen
bantlar agaroz jelde görüldü. Buna ilişkin yapılan dendograma göre (Şekil 4.13), türler arası polimorfizm yeterince ayırt edici bir gözlemlemeyi sağlayamadı. Ayrıca polimorfizm oranı da diğer primerlere kıyasla daha düşük hesaplandı (%90,47). OPA-06 primeri bu türlerin ayrımı için uygun değildir.
OPA-15 primeri elde edilen ve agaroz jelde gözlenen RAPD bantları (Şekil 4.14) ve elde edilen dendograma göre (Şekil 4.15), bu primer türlerin ayırt ediciliği açısından kullanılabilir niteliktedir. Hesaplanan polimorfizm oranının yüksek olduğu gözlendi (%93,33).
Bu çalışmada kullanılan primerler arasında, monomorfik bant vermemesi durumu ve bütün türlerde amplifiye olması açısından (Şekil 4.16), en yüksek polimorfizmin (%100) gözlendiği primer OPA-16’dır. Ayrıca, yeni bir tür olarak literatüre kaydedilen ve Silene capillipes’e yakın bulunan Silene duralii’nin (Bağcı 2008), Şekil 4.17’de verilen dendogramda bu durumu desteklediği gözlendi. Silene nuncupanda türünün de, ayrı seksiyonda yer alan Silene bayburtensis’e diğer türlere nazaran daha yakın olduğu görüldü. OPA-16 primeri Silene cinsi tür ayrımı için kullanılması gereken en uygun primerdir.
OPA-17 primerine ait RAPD-PCR ile elde edilen bantlar (Şekil 4.18) ve oluşturulan dendograma göre (Şekil 4.19), bu primer bu türlerin ayrımı için oldukça uygundur. Hesaplanan polimorfizm oranı da hayli yüksektir (95,65).
Genel olarak bu çalışmada kullanılan bütün primerler, türler arasında oldukça yüksek polimorfizm göstermiş olmalarına rağmen, OPA-18 primeri ile elde edilen RAPD bant görüntüleri (Şekil 4.20) ve oluşturulan dendograma göre (Şekil 4.21), bu primer, bu türlerin ayrımı için yeterli değildir. En düşük polimorfizmin (%84,62) gözlendiği primer, OPA-18 olmuştur.
5. SONUÇLAR VE ÖNERĐLER
Çalıştığımız taksonların moleküler çalışmalarında kullanılabilecek en iyi primerin OPA-16 olduğu belirlendi. OPA-16 primeri sonuçlarının dendogram analizleri bu takosonların birbirinden ayrı türler olduğunu ve özellikle Bağcı (2008)’in S. duralii’yi tanımlarken ilişkilendirdiği S. capillipes’e yakın bir tür olduğunu desteklemiştir. Ayrıca yakın gruptan S. bayburtensis bu seksiyon taksonlarından ayrı bir dağılım göstermiştir.
RAPD allelleri dominant markırlar olarak ifade edildiği için AFLP, CAPS, ISSR, SSR, SNP ve STS gibi diğer belirleyicilerin bu tür çalışmalarda tamamlayıcı olarak uygulanması gerekmektedir.
Đleride yapılacak çalışmalarda Silene cinsinin bütün taksonlarının filogenetik
6. KAYNAKLAR
Arnheim, N. and Erlich, H., 1992, Polymerase Chain Reaction Strategy. Annual Review of Biochemistry 61, 131 – 56.
Bağcı, Y., Uysal, T., Ertuğrul, K. and Demirelma, H., 2007, Silene kucukodukii sp. nov. (Caryophyllaceae) from South Anatolia, Turkey. Nordic Journal of Botany 25, 306-310.
Bağcı, Y., 2008, A new species of Silene L. (Caryophyllaceae) from South Anatolia, Turkish Journal of Botany, 32,11-15.
Bardakçı, F., 2001, RAPD markers. Turkish Journal of Biology, 25, 185-196
Baytop, T., 1984, Türkiye’ de Bitkilerle Tedavi Đstanbul Üniversitesi, s: 213-214,
Đstanbul.
Brookes, A.J., 1999, The essence of SNPs. Gene, 234, 177–186.
Brown, T.A., 1999, Genomics, 1st edn. Bios Scientific Publishers, Oxford,
Bucheli, E., Gautschi, B. and Shykoff, J. A., 1997, Isolation and characterization of microsatellite loci in the anther smut fungus Microbotryum violaceum. Blackwell Science Ltd, Molecular Ecology, 7, 657–666.
Coode, M.J.E and Cullen, J., 1967, Silene L. In: Davis PH (ed.), Flora of Turkey and the East Aegean Islands, Edinburgh University Press, Edinburgh, Vol. 2, 179-242. Davis, P. H., Mill, R. R. and Tan, K., 1988, Silene L. In: Davis PH, Mill RR, Tan K,
(eds.) Flora of Turkey and the East Aegean Islands, Vol.10 (Supplement), 76-81, Edinburgh University Press, Edinburgh.
Deniz, Đ. G. and Düşen, O. D., 2004. Silene sumbuliana (Caryophyllacea), a new species from SW Anatolia, Turkey. Annales Botanici Fennici, 41, 293-296.
Hamzaoğlu, E., Aksoy, A. and Budak, Ü., 2010, A new species of Silene (Caryophyllaceae) from Turkey. Turkish Journal of Botany, 34, 47-50.
Hobza, R., Lengerova, M., Svoboda, J., Kubekova, H., Kejnovsky, E. and Vyskot, B., 2006, An accumulation of tandem DNA repeats on the Y chromosome in Silene latifolia during early stages of sex chromosome evolution. Chromosoma, 115, 376–382.
Kandemir, A., Genç, G. E. and Genç, Đ., 2009, Silene dumanii (Caryophyllaceae), A new species from East Anatolia, Turkey. Annales Botanici Fennici, 46, 71-74. Kejnovský, E., Vrána, J., Matsunaga, S., Souček, P., Široký, J., Doležel, J. and Vyskot
B., 2001, Localization of Male-Specifically Expressed MROS Genes of Silene latifolia by PCR on Flow-Sorted Sex Chromosomes and Autosomes. Genetics Society of America, 158, 1269–1277.
Kılıç, S., 2009, Anatomical and pollen characters in the genus Silene L. (Caryophylllaceae) from Turkey. Botany Research Journal, 2 (2-4), 34-49.
Martin, E., Duran, A., Dinç M. and Öztürk M., 2008, Karyotype analysis of Silene behen L. (Caryophyllaceae). Journal of Applied Biological Sciences, 2 (1),13-15. McCauley, D. E., Sundby, A. K. , Bailey, M. F. and Welch, M. E., 2007, Inheritance of
Evidence from experimental crosses and natural populations. American Journal of Botany, 94 (8), 1333–1337.
Nei, M., 1987, Molecular Evolutionary Genetics. Columbia University Press, New York.
Rautenberg, A., Hathaway, L., Bengt, O. And Honor, C. P., 2010, Geographic and phylogenetic patterns in Silene section Melandrium (Caryophyllaceae) as inferred from chloroplast and nuclear DNA sequences. Molecular Phylogenetics and Evolution, doi:10.1016/j.ympev.2010.08.003
Srivastava, S., Narula, A., Bhojwani S. S., 2004, Plant Biotechnology and Molecular Markers, Anamaya Publishers, New Delhi, pp. 302-303
Tan, K. and Vural, M., 2000, Silene L. In: Guner A, Ozhatay N, Ekim T, Bafler KHC (eds.) Flora of Turkey and the East Aegean Islands Vol. 11, 50-53 (Supplement), Edinburgh University Press, Edinburgh.
Tero, N., 2005, Genetic Structure at Different Spatial Scales in Metapopulations of Silene tatarica. Oulu University Press, Oulu.
Tugay, O. and Ertuğrul, K., 2008, A new species of Silene (Caryophyllaceae) from east Anatolia, Turkey. Botanical Journal of the Linnean Society, 156, 463–466.
Vellekoop, P., Buntjer, J. B., Maas, J.W. and Brederode, J. V., 1996, Can the spread of agriculture in Europe be followed by tracing the spread of the weed Silene latifolia. A RAPD study. Theoretical and Applied Genetics, 92, 1085-1090.
Vos, P., Hogers, R., Bleeker, M., Reijans, M., Lee, T., Hornes, M., Frijters, A., Pot, J., Peleman, J., Kuiper, M., Zabeau, M., 1995, AFLP: A new technique for DNA fingerprinting. Nucleic Acids Research, 23, 4407–4414.
Welsh, J. and McClelland, M., 1990, Fingerprinting genomes using PCR with arbitrary primers. Nucleic Acids Research, 18, 7213–7218.
Williams, J. G. K., Kubelik, A.R., Livak, K.J., Rafalski, J.A. and Tingey, S.V., 1990, DNA polymorphisms amlified by arbitrary primers are useful as genetic markers. Nucleic Acids Research, 18 (22), 6531–6535.
Yıldız, K., 2005, A palynological investigation on Silene L. (Caryophyllaceae) species distributed in North Cyprus and West Anatolia. C.B.U. Journal of Science, 1 (2), 61-71.
Yıldız, K., 2006, A morphological investigation on Silene L., (Caryophyllaceae) species distributed in west Anatolia and North Cyprus. Pakistan Journal of Botany, 38 (1), 67-83.
Yıldız, K. and Dadandı, M. Y., 2009, Silene cirpicii, a new species from Turkey. Annales Botanici Fennici, 46, 464-468.
Yıldız, K., Minareci, E. and Çırpıcı, A., 2009, Karyotypic study on Silene, section Lasiostemones section from Turkey. Caryologia 62 (2), 134-141.
Yıldız, K. and Erik, S., 2010, Silene aydosensis (Caryophyllaceae), a new species from Anatolia, Turkey. Annales Botanici Fennici, 47, 151-155.
ÖZGEÇMĐŞ
KĐŞĐSEL BĐLGĐLER
Adı Soyadı : Aslı DAĞERĐ
Uyruğu : T.C.
Doğum Yeri ve Tarihi : Adıyaman 1985
Telefon : 0544 5785827
e-mail : aslidageri@gmail.com EĞĐTĐM
Derece Adı, Đlçe, Đl Bitirme Yılı
Lise : Anadolu Lisesi, Merkez, Adıyaman 2003
Üniversite : Selçuk Üniversitesi, Selçuklu, Konya 2008 YABANCI DĐLLER