T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
ÇOCUK SAĞLIĞI VE HASTALIKLARI ANABİLİM DALI
TURNER SENDROMU 45,X0 TANILI OLGULARDA MİKROARRAY ÇALIŞMASI İLE KOPYA SAYISI DEĞİŞİKLİKLERİ SAPTANMASI VE KLİNİK
VARYASYONLAR İLE İLİŞKİLENDİRİLMESİ
DR. EZGİ BÖLÜK
TEZ DANIŞMANI
PROF.DR. M.ÖZGÜR ÇOĞULU
İZMİR 2020
ÖNSÖZ
Bu çalışmanın gerçekleştirilmesinde, her zaman yol göstericim olan danışman hocam Prof.
Dr. Özgür Çoğulu’ya, değerli bilgilerini esirgemeyen Doç.Dr.Samim Özen’e, ilk öğretmenim
herşeyim canım anneme ve desteğini hep hissettiğim eşim Atilla’ya teşekkürlerimi borç bilirim.
Dr. Ezgi Bölük İzmir, 2020
‘Turner Sendromu 45,X0 Tanılı Olgularda Mikroarray Çalışması ile Kopya Sayısı Değişiklikleri Saptanması ve Klinik Varyasyonlar ile İlişkilendirilmesi’ isimli çalışmamız, TGA-2020-20851 proje koduyle Ege Üniversitesi Bilimsel Araştırmalar Proje Koordinatörlüğü tarafından desteklenmiştir.
İÇİNDEKİLER ÖNSÖZ ... 2 İÇİNDEKİLER ... 4 TABLOLAR DİZİNİ ... 6 ŞEKİLLER DİZİNİ ... 8 ÖZET ... 11 ABSTRACT ... 12 GİRİŞ-AMAÇ ... 13 A) GENEL BİLGİLER ... 16
A.1. GENETİK VE GENOM ... 16
A.1.1. Baz ... 18
A.1.2. Nükleotid ... 18
A.1.3. Nükleik Asit ... 18
A.1.4. Deoksiribonükleikasit (DNA) ... 19
A.1.5. Kromatin ve Kromozom ... 19
A.1.6. Transkripsiyon ... 20
A.1.7. Translasyon ... 21
A.1.8. Proteinler ... 21
A.2. GENETİK HASTALIKLARIN OLUŞUMU ... 22
A.2.1.KROMOZOMAL HASTALIKLAR ... 23
A.2.1.1. SAYISAL KROMOZOM ANOMALİLERİ ... 23
A.2.1.2 YAPISAL KROMOZOM ANOMALİLERİ ... 23
A.2.1.2.a. DENGELİ YAPISAL KROMOZOM ANOMALİLERİ ... 24
i. Translokasyon ... 24
ii. İnversiyon ... 24
A.2.1.2.b. DENGESİZ YAPISAL KROMOZOM ANOMALİLERİ ... 25
i. Delesyon ... 25
ii. Duplikasyon ... 25
iii. İnsersiyon ... 25
v. İzokromozom ... 26
vi. Marker kromozom ... 26
A.2.2.TEK GEN KALITIMI VE HASTALIKLARI ... 27
i. Otozomal Dominant Hastalıklar (OD) ... 28
ii. Otozomal Resesif Hastalıklar (OR) ... 28
iii. X’e bağlı Hastalıklar ... 28
A.2.3. MENDELİYEN OLMAYAN KALITIM ŞEKİLLERİ ... 29
i. Multifaktöriyel Kalıtım ... 29
ii. Mitokondrial Kalıtım ... 29
iii. Uniparental Dizomi (UPD) ... 30
iv. Genomik İmprinting ... 30
A.3.2. MOLEKÜLER SİTOGENETİK İNCELEMELER ... 31
A.3.3. MOLEKÜLER GENETİK İNCELEMELER ... 32
i. Polimeraz Zincir Reaksiyonu (PZR) ... 32
ii. Alel özgü oligonükleotid (ASO) ... 32
iii. Mikroarray tekniği ... 33
iv. DNA dizi analizi ... 35
A.4. TURNER SENDROMU (TS) ... 36
A.4.1. TANIM ... 36
A.4.2. İLİŞKİLİ GENLER ... 36
A.4.3. PREVALANS, MORBİDİTE VE MORTALİTE ... 37
A.4.4. KLİNİK VE LABORATUVAR ... 39
A.4.4.1. BOY KISALIĞI ... 39
A.4.4.2. PUBERTAL GELİŞİM VE FERTİLİTE ... 40
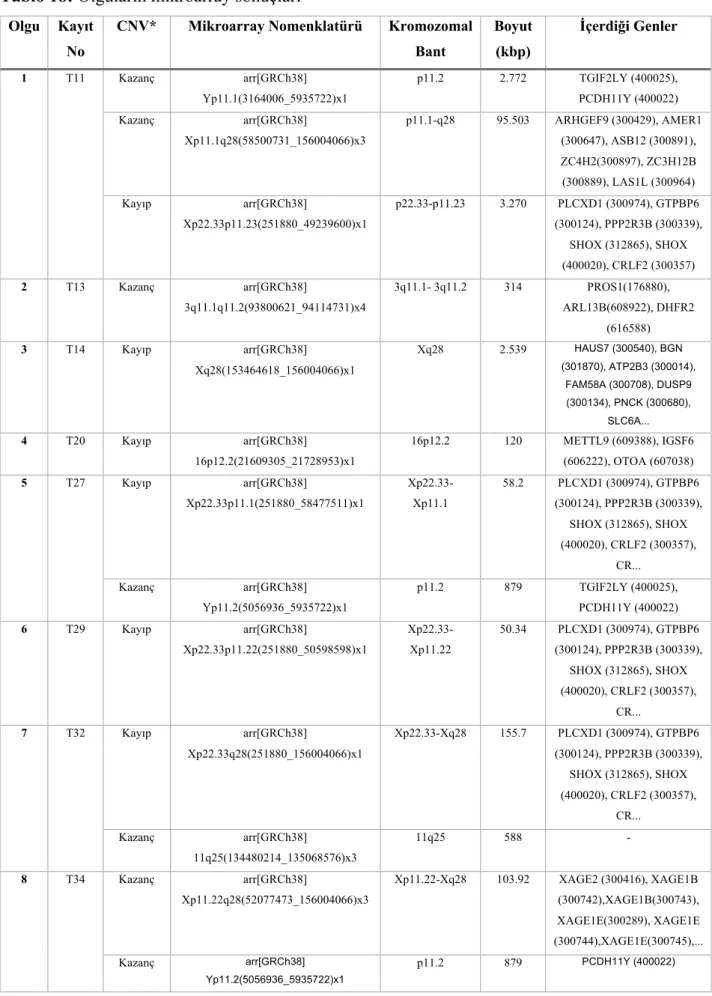
A.4.4.3. METABOLİZMA VE TİP 2 DİYABET ... 41
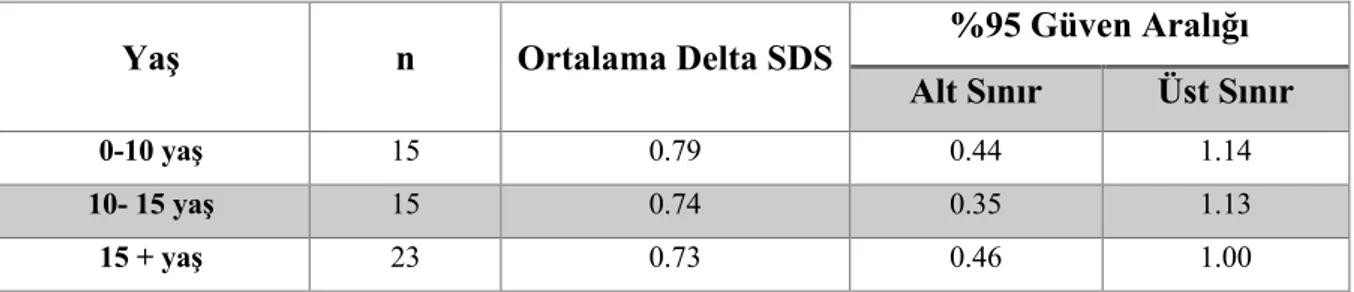
A.4.4.4. KEMİK METABOLİZMASI ... 42
A.4.4.5. OTOİMMÜNİTE ... 42
A.4.4.6. KARACİĞER FONKSİYONLARI ... 43
A.4.4.7. KARDİYOVASKÜLER HASTALIKLAR ... 43
A.4.4.8. ÜRİNER SİSTEM ANOMALİLERİ ... 45
A.4.4.9. NÖROKOGNİTİF GELİŞİM VE YAŞAM KALİTESİ ... 45
A.4.5. MULTİDİSİPLİNER TEDAVİ YAKLAŞIMI ... 48
A.5. KOPYA SAYISI DEĞİŞİKLİKLERİNİN (CNV) ÖNEMİ ... 51
B) GEREÇ VE YÖNTEM ... 52
D) TARTIŞMA ... 76
E) SONUÇ VE ÖNERİLER ... 88
EKLER ... 89
TABLOLAR DİZİNİ
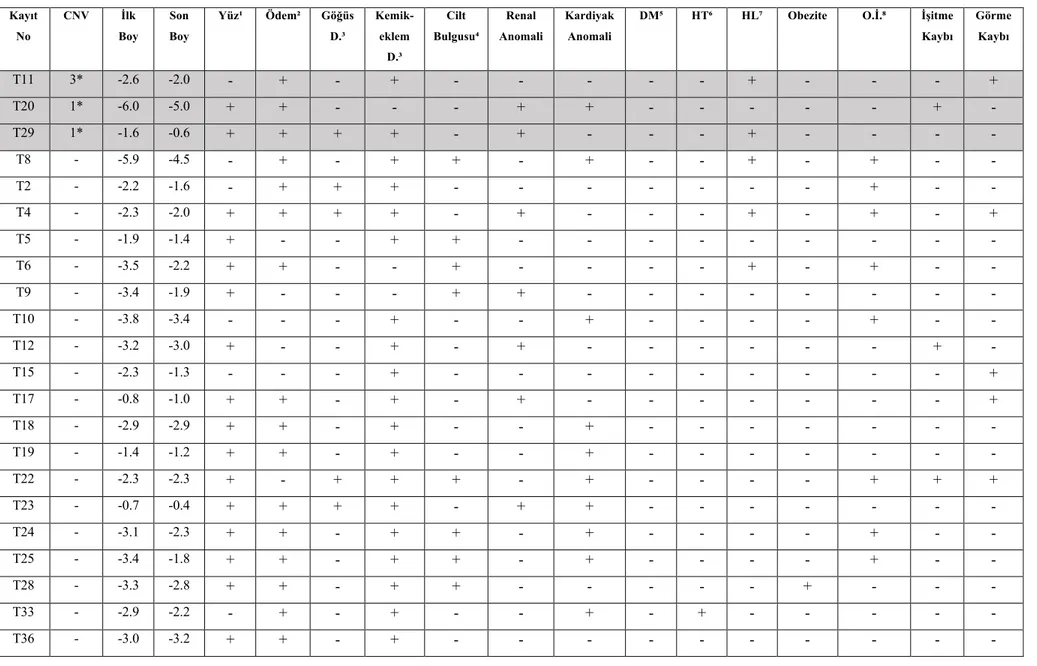
Tablo 1: Yüz ve baş ile ilgili fenotipik karakteristik bulgular ve görülme sıklıkları………..46 Tablo 2: Boyun ve göğüs duvarı ile ilgili fenotipik karakteristik bulgular ve görülme sıklıkları………46 Tablo 3: Cilt, tırnak ve saç ile ilgili fenotipik karakteristik bulgular ve görülme sıklıkları…46 Tablo 4: İskelet yapısı ile ilgili fenotipik karakteristik bulgular ve görülme sıklıkları………47 Tablo 5: Kardiyovasküler sistem ile ilgili fenotipik karakteristik bulgular ve görülme sıklıkları………47 Tablo 6: Üriner sistem ile ilgili fenotipik karakteristik bulgular ve görülme sıklıkları………47 Tablo 7: Nörokognitif ve psikososyal problemler ve görülme sıklıkları……….47 Tablo 8: Olguların başvuru yaşlarına göre, delta SDS değerleri………..57 Tablo 9: Karyotip sonucuna göre, yüz ve baş ile ilgili karakteristik bulgular ve görülme sıklıkları………61 Tablo 10: Karyotip sonucuna göre, boyun ve göğüs duvarı ile ilgili karakteristik bulgular ve görülme sıklıkları………..62 Tablo 11: Karyotip sonucuna göre cilt tırnak ve saçla ilgili karakteristik bulgular ve görülme sıklıkları………62 Tablo 12: Karyotip sonucuna göre, iskelet sistemi ile ilgili karakteristik bulgular ve görülme sıklıkları………62 Tablo 13: Karyotip sonucuna göre, kalple ilgili karakteristik bulgular ve görülme sıklıkları………63 Tablo 14: Karyotip sonucuna göre, renal-üriner sistem ilgili karakteristik bulgular ve görülme
Tablo 15: Karyotip sonucuna göre, alerjik-immünolojik bulgular ve görülme sıklıkları…….63 Tablo 16: Karyotip sonucuna göre, metabolik bulgular ve görülme sıklıkları………..64 Tablo 17: Karyotip sonucu 45,X olan olgular ile, 45,X/46,XX mozaik yapıyı taşıyan olgular ve izokromozom Xq olguları, majör klinik bulguların sıklığı açısından karşılaştırılması…….64 Tablo 18: Olguların mikroarray sonuçları……….66 Tablo 19: Mikroarray çalışması yapılan olguların CNV sayısı, önemli klinik bulgular ve karyotip sonuçları………..72 Tablo 20: CNV saptanan ve saptanmayan, 45,X TS olguları ve klinik özellikleri…………..74 Tablo 21: CNV saptanan ve saptanmayan, 45,X/46,XX mozaik TS olguları ve klinik özellikleri………..75 Tablo 22: CNV saptanan ve saptanmayan, izokromozom X/ mozaik izokromozom Xq olguları ve klinik özellikleri………75
ŞEKİLLER DİZİNİ
Resim 1 : İzokromozom X taşıyan olgunun karyotip görüntüsü, 46,Xi(Xq)………27
Resim 2 : Marker kromozoma sahip olgunun karyotip görüntüsü………27
Resim 3: Polikliniğimizde takipli 9 yaş TS olgusu ………..………...48
Resim 4: %1’lik agoroz jelde DNA kalite kontrolü……….54
Resim 5: Fragmentasyon sonrası %4’lük agaroz jelde 25-125 bp arası görüntü……….54
Resim 6: Amplifikasyon sonrası %2’lik agaroz jelde elektroforez görüntüsü ………55
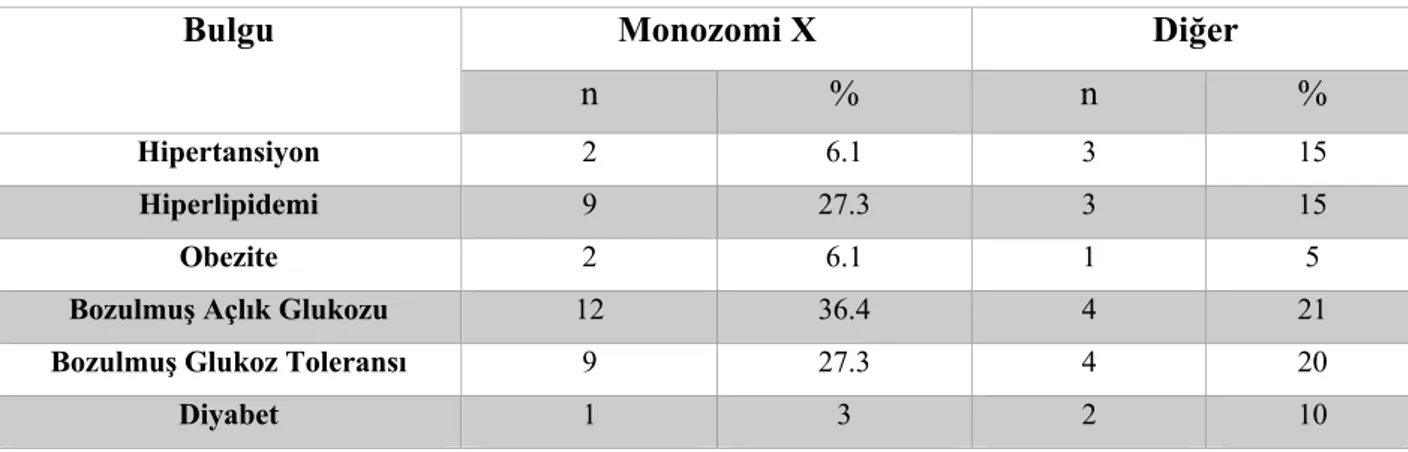
Resim 7: Olguların SDS değişimi ve GH tedavi süreleri arasındaki ilişki………..58
Resim 8: Olguların SDS değişimi ve GH tedavi dozları arasındaki ilişki………58
Resim 9: Olguların karyotip sonucuna göre FSH değerleri……….65
Resim 10: Olgu T8 mikroarray görüntüsü………..…..…69
Resim 11: Olgu T11 mikroarray görüntüsü……….………70
Resim 12: Olgu T14 mikroarray görüntüsü………..70
Resim 13: Olgu T16 mikroarray görüntüsü………..71
KISALTMALAR
TS: Turner Sendromu
SHOX: Short Stature Homebox Gene DNA: Deoksiribonükleik Asit
RNA: Ribonükleik Asit GH: Büyüme Hormonu
CNV: Kopya Sayısı Değişikliği OR: Otomozal Resesif
OD: Otozomal Dominant KF: Kistik Fibrozis
FISH: Floresan İn situ Hibridizasyon UPD: Uniparental Dizomi
PZR: Polimeraz Zincir Reaksiyonu ASO: Alel Özgü Oligonükleotid NGS: Yeni Nesil Sekanslama PAR 1: Psödootozomal Bölge 1 SNP: Singe Nukleotide Polymorphism hCG: İnsan Koryonik Gonadotropin FSH: Folikül Stimüle Edici Hormon LH: Luteinizan Horman
AMH: Antimülleryan Hormon BMI: Beden Kitle Endeksi
TG: Trigliserid
HDL: Yüksek Dansiteli Lipoprotein LDL: Düşük Dansiteli Lipoprotein DM: Diyabetes Mellitus
BMD: Kemik Mineral Dansitometri IL: İnterlökin
MR: Manyetik Rezonans
DKMP: Dilate Kardiyomiyopati DS: Down Sendromu
AVSD: Atriyoventriküler Septal Defekt
ESOTERİX: Endocrinology Expected Values and Conversion Tables ChAS: Chromosome Analysis Suite
SPSS: Statistical Package for the Social Sciences HT: Hipertansiyon
HL: Hiperlipidemi SD: Standart Deviasyon
EDTA: Etilendiamin Tetraasetik Asit
ÖZET
Turner Sendromu (TS), yaklaşık olarak 2500 canlı doğumda bir görülme sıklığı ile, en sık görülen kromozom anomalilerinden birisidir. Boy kısalığı ve primer over yetmezliği TS’nun en önemli iki karakteristik bulgusudur. Yele boyun, düşük ense saç çizgisi, kubitus valgus TS olgularında görülen diğer karakteristik özelliklerdir. Olgular ağır kardiyak ve renal anomaliler taşıyabilir. Otoimmünite ve tip 2 diyabet açısından normal popülasyona göre daha risklidirler. Karyotip monozomi X, mozaik yapı ve X kromozomu yapısal anomalilerini içeren şekillerde çok farklı olabilir. Genotipik ve fenotipik özellikler olgular arasında farklılık göstermektedir. Amaç: Bu çalışma, TS olgularında görülen klinik varyasyonları, mikroarray çalışmasıyla saptanacak olası kopya sayısı değişiklikleri (CNV) ile ilişkilendirmeyi amaçlamıştır.
Gereç ve Yöntem: Aralık 2018-Mayıs 2020 tarihleri arasında, Ege Üniversitesi Çocuk Genetik Hastalıkları ve Pediatrik Endokrinoloji Bilim Dalı’nda takipli 0-18 yaş arasında TS tanılı 53 olgu çalışmaya dahil edildi. Bu olgulardan 36’sından mikroarray çalışması için kan alınarak, mikroarray sonuçları ile olguların klinik özellikleri arasında anlamlı bir ilişki olup olmadığı araştırıldı.
Bulgular: Olguların 33’ü 45,X, 7’si 45,X/46,XX, 6’sı 45,X/46,Xi(Xq), 2’si 46,Xi(Xq), 2’si 45,X/46,r(X), 1’i 45,X/46,Xi(Xp), 1’i 45,X/46,XY, 1’i 45,X/46,X+mar(idicY) karyotip yapısında saptandı. Çalışmamızda TS olgularında en sık görülen klinik bulgu %90 görülme sıklığı ile boy kısalığıydı. Ayrık yerleşimli meme başı bulgusu %71.1 görülme oranı ile ikinci en sık bulguydu. Literatür ile uyumlu olarak, olguların 22’sinde (%41.5) kardiyak anomali saptandı; en sık görülen biküspit aortik kapak anomalisiydi. Olguların 14’ünde (%26.4) renal anomali saptandı; en sık görülen at nalı böbrek anomalisiydi. Literatürden farklı olarak bu iki majör klinik bulgu ile olguların karyotip sonuçları arasında istatistiksel anlamlı bir ilişki bulunmadı. Karyotip grupları ile olguların FSH değerleri arasında anlamlı ilişki bulundu (p=0.034). Monozomi X ve mozaik izokromozom Xq olgularında FSH değeri, 45,X/46,XX mozaik karyotipi taşıyan olgulara göre, belirgin yüksek saptandı. Mikroarray çalışması yapılan 36 olgudan, 8’inde kopya sayısı değişiklikleri saptandı.
Sonuç: Kopya sayısı değişikliği saptanan 8 olguda TS kliniğinde beklenmeyen atipik bulgular saptanmıştır. Klinik varyasyonlar açısından zengin olan TS’da genotip fenotip ilişkilerini açıklamak için, atipik bulguları olan olgularda mikroarray çalışması yapılması önerilir.
ABSTRACT
Turner Syndrome (TS) is one of the most common chromosomal abnormalities, with an incidence of approximately one in 2500 live births. Short stature and primary ovarian incuficiency are the two most important characteristic findings of TS. Webbed neck, low set hairline, cubitus valgus are other characteristic features of TS cases. Cases may have severe cardiac and renal anomalies. And they are more risky in terms of autoimmunity and type 2 diabetes than the normal population. The karyotype can vary that include monosomy X, mosaic structure and X chromosome structural anomalies. Genotypic and phenotypic characteristics differ between cases.
Objective: This study aimed to correlate the clinical variations seen in TS cases with possible copy number changes that can be detected by microarray study.
Materials and methods: Fifty three patients diagnosed with TS, between the ages of 0-18 who were followed up in Ege University Pediatric Genetic Diseases and Pediatric Endocrinology Departments between December 2018 and May 2020 were included in the study. Blood samples were taken from 36 of these cases for microarray study.
Results: Karyotypes were as follows; thirty-three of cases were 45,X, 7 were 45,X/46,XX, 6 were 45,X/46,Xi(Xq), 2 were 46,Xi(Xq), 2 were 45,X/46,r(X), one was 45,X/46,Xi(Xp), one was 45,X/46,XY, and one was 45,X/46,X+mar(idicY) karyotype. İn this study the most common clinical finding in TS cases was short stature with a 90% incidence. İnverted nipple was the second most common finding with an incidence of 71.1%. Consistent with the literature, cardiac anomalies were detected in 22 (41.5%) of cases, and the most common was bicuspit aortic valve anomaly. Renal anomaly was found in 14 (26.4%) of cases, and the most common was horseshoe kidney anomaly. Unlike the literature there was no statistically significant relationship between these two major clinical findings and the karyotype results of the cases. A significant correlation was found between karyotype groups and FSH values of the cases (p=0.034). İn monosomy X and mosaic isochromosome Xq cases, the FSH value was found to be significantly higher than those with 45,X/46,XX mosaic karyotype. Copy number variations were found in 8 out of 36 cases whose microarray study was performed.
Conclusion: Copy number changes were detected in 8 patients with unexpected atipycal findings. In order to explain the genotype-phenotype relationships in TS, which has a wide range of clinical findings, microarray analysis is recommended in cases with atypical findings. Key words: turner syndrome; copy number variations; microarray; clinical variations
GİRİŞ-AMAÇ
Turner Sendromu (TS) en sık görülen kromozom anomalilerinden birisidir. Boy kısalığının ve primer over yetmezliğinin en yaygın nedenleri arasında gösterilmektedir. İlk olarak 1938 yılında Henry Turner tarafından; kısa boy, yele boyun ve kubitus valgus klinik özelliklerini taşıyan 7 kadın olgu üzerinde tanımlanmıştır (1).
Turner Sendromu; Avrupa, Amerika Birleşik Devletleri ve Japonya verileri değerlendirildiğinde 2000-2500 doğumda bir görülme sıklığı ile kadınlarda en sık görülen kromozom anomalisi olarak tanımlanmaktadır (2).
Doğru prevalansı belirlemek zor olmaktadır çünkü; belirgin klinik özellikler taşımayan ve hafif anomaliler ile seyreden olgular oldukça geç tanı almaktadır (3). Prenatal tanısal çalışmalar 45,X karyotipe sahip fetusların en az %10’unun spontan abortus ile sonuçlandığını göstermiştir (4).
Turner Sendromu; X kromozomunun parsiyel veya tamamının kaybına bağlı cinsiyet kromozom anomalisi olarak bilinmektedir. TS ile ilişkilendirilen karyotip 45,X (monozomi X) TS ile doğan olguların %45-50’sini oluşturmaktadır. Olguların yaklaşık %50’si de diğer karyotipleri taşımaktadır; bunların içerisinde mozaik yapıya sahip TS olguları ve mozaik yapı taşımayan 46,X,i(Xq) ya da 46,X,i(Xp), 46,XX,del(q) ya da 46,XX,del(p), 46,X,r(X) gibi varyant TS olguları vardır. Mozaik genetik yapı 45,X/46,XX ,45,X/46,XY, 45,X/47,XXX veya 45,X karyotipi ile birlikte, izo-kromozom X, ring komozom gibi diğer X kromozom yapısal anomalilerinin bulunmasıdır (5). Mozaisizm bir organizmada ya da dokuda, tek bir zigottan kaynaklanan farklı genetik özellikteki hücrelerin bir arada bulunmasıdır. Post-zigotik de-novo mutasyonlar nedeni ile meydana gelmektedir. Mozaikleşme kromozomların ayrılamaması, anafaz gecikmesi ve endo-replikasyon gibi bir çok farklı mekanizmadan kaynaklanabilir. 45,X/46,XX mozaik genetik yapı TS’da %15 sıklıkla görülmekte olup, bu genetik yapıyı taşıyan olguların daha iyi final boya sahip olduğu ve %34’ünün spontan menstruasyona sahip olduğu yapılan çalışmalarda belirtilmiştir (6).
İzokromozom X genetik yapısına sahip olgular, mozaik olanlar dahil, TS olgularının %15-18‘ini oluşturmaktadır. İzokromozom X yapısına sahip olguların tiroidit gibi, daha fazla otoimmün hastalık ile klinik seyir gösterdiği belirlenmiştir. Boy kısalığı 46,X,i(Xq) karyotipini taşıyan olgularda daha sıklıkla gözlenmekte, gonadal yetmezlik ise 46,X,i(Xp) karyotipini taşıyan olgularda daha nadir karşımıza çıkmaktadır (7).
Ring X kromozom yapısına sahip olgular, TS olgularının yaklaşık %6’sını oluşturmaktadır ve genellikle 45,X mozaisizm ile birliktedir (8). Bu olguların tipik TS klinik özellikleri dışında; atipik fasyal bulgular, daha ağır ve erken başlangıçlı büyüme gelişme geriliği, öğrenme güçlükleri ve sindaktili gibi farklı özelliklere sahip olabildikleri belirtilmiştir (9,10). Ayrıca yapılan bir çalışmada bu karyotipi taşıyan olguların metabolik sendrom açısından daha riskli olduğu bildirilmiştir (11).
Delesyon Xp ya da Xq, TS olgularında %2 sıklıkta görülmektedir. Özellikle kısa kol delesyonuna sahip TS olgularında karakteristik bulgular, ağır boy kısalığı ve gonadal yetmezlik sıklığının daha fazla olması şeklindedir (8).
Turner Sendromu tanısı alan olguların %10-12‘sinde Y kromozom yapıları görülmektedir. Bu olgular gonadoblastom açısından artmış risk taşıdığı için ayrıntılı olarak tetkik edilmelidir. 45,X/46,XY genetik yapısı saptanan olgular; TS’nun tipik özelliklerini taşıması yanında, belirsiz genital yapı ile ovotestiküler yetmezliğe, erkek fenotipinde infertil kliniğe kadar çeşitli özelliklerle karşımıza çıkabilir (12).
Turner Sendromu’nda kısa boy kliniğinin ortaya çıkmasından sorumlu olan SHOX (Short stature homebox gene) genidir. Kısa boy TS olgularının hemen hemen tamamında bulunan tek klinik özelliktir, hemen her zaman SHOX kaybı ve 45,X genetik yapısı ile ilişkilidir. Gonadal yetmezlik için X kromozomu kısa kolunda BMP15 geni, X kromozomu uzun kolunda FMR1, FMR2 genleri sorumlu tutulmuştur (13). Ağır kardiyak defektlerin, X kromozomu kısa kolundaki genler ile ilişkili olduğu saptanmıştır. Xp üzerinde bulunan TIMP1 ve TIMP3 genlerinin biküspit aortik kapak anomalisi gelişiminde etkili olduğu belirlenmiştir (14). Kulak anomalileri, işitme kaybı, yele boyun, neonatal lenfödem, kalkan göğüs ve ciddi kardiyak defektlerin ortaya çıkış mekanizması hala tam olarak açıklanamamıştır (15).
Diğer tipik klinik bulgular; yüksek-kubbe damak, kısa-yele boyun, düşük ense saç çizgisi, geniş aralıklı meme uçları, kalkan göğüs, ön kol ve bilekte Madelung deformitesi, kubitus valgus, yenidoğan döneminde el ve ayak sırtında ödem, tırnak displazileri, dördüncü metakarpın veya metatarsın kısalığı olarak görülebilir (Tablo 1, 2, 3). Çocuk Genetik Hastalıkları Polikliniğinde takipli, 9 yaşındaki kız olguda; boy kısalığı, yüzde çok sayıda pigmenter nevüs, antevert yerleşimli kulaklar, sol göz kapağında pitozis, kısa-yele boyun ve düşük ense saç çizgisi bulguları gösterilmiştir (Resim 3). Klinik varyasyonlar nedeni ile silik bulgularla seyreden olgularda tanı gecikebilmektedir. TS tanılı olguların izleminde amaç; büyüme hormonu (GH) tedavisinin zamanında başlanması, olguların final boyuna katkı sağlanması, pubertal indüksiyon tedavisi, düzenli östrojen tedavisi ile mozaik genetik yapı ve hafif klinik taşıyan olguların menarş ve fertilitesinin sağlanması, olguların kardiyovasküler hastalıkların komplikasyonlarından korunması, kemik metabolizma bozukluklarından korunması, mental ve ruhsal sağlıklarının korunarak sosyal bireyler haline getirilmesidir. Bu nedenle klinik varyasyonların tanınarak, erken tanı konması büyük önem oluşturmaktadır.
Çalışmamızda Ege Üniversitesi Çocuk Genetik Hastalıkları ve Çocuk Endokrinoloji Bilim Dalı’nda takipli olan, karyotip incelemesi ile TS tanısı almış olgularda, klinik varyasyonların ve mikroarray çalışması ile kopya sayısı değişikliklerinin saptanması amaçlanmış, kopya sayısı değişiklikleri ile klinik varyasyonlar arasındaki ilişki araştırılmıştır.
A) GENEL BİLGİLER
A.1. GENETİK VE GENOM
Genetik bilimi özellikle son 10 yılda gerek bilim dünyasında gerek medyada önceki yıllara oranla çok daha geniş yer almaya başlamıştır. Özellikle insan genom projesinden elde edilen verilerin bu durumun oluşmasında büyük rolü vardır. İnsan genom projesi ile DNA’nın yaşamımızdaki önemi ve hastalıklar ile ilişkisi daha iyi anlaşılmış, birçok çalışmanın önü açılmıştır. Genetik tarihçesi ile ilgili farklı kaynaklarda gösterilen tarih çizelgelerinde 1866 yılı modern genetiğin başlangıç tarihi olarak kabul edilir. Augustinian friar Gregor Johann
Mendel 1865 yılında bezelyeler üzerinde kalıtım ile ilgili yapmış olduğu çalışmaları iki ayrı
toplantıda sunmuş ve 1866 yılında ’’Versuche über Pflanzenhybriden’’ başlığı ile makale olarak yayınlamıştır. Bezelye tohumları ile kalıtıma ilişkin yapmış olduğu çalışmaları ve düşüncelerini yayınlayan Mendel’in bu makalesinde bulgular dış görünüme dayanan gözlemlere dayanmakla birlikte değerlendirmeleri büyük bir ağırlıkla günümüzde de geçerliliğini korumaktadır (16).
Genom, bireyin ya da bir hücrenin, taşıdığı tüm genetik materyale verilen addır. İnsan genomu embriyogenez, gelişim, büyüme, metabolizma ve üreme ile ilgili bilgileri içeren DNA’dan oluşmaktadır. DNA genetik bilgileri taşıyan, çift heliks yapısında bir nükleik asittir. 3.2 x 10⁹ nükleotid çifti olarak ifade edilir. Nükleer DNA ökaryot hücrelerin çekirdeklerinde bulunan DNA’dır. Nükleer DNA’daki bilgiler her iki ebeveynden aktarılır. İnsan DNA’sının %1.5’inden azı protein kodlayıcı diziler yani ekzonlardan oluşur. Geri kalan büyük kısmı ise tekrar dizilerinden, transpozonlardan, psödogenlerden ve kodlamayan DNA’dan oluşmaktadır. Mitokondrial DNA, sirküler yapıya sahiptir, 16.569 baz çiftinden ve 37 genden oluşmaktadır. Nükleer DNA bir çift bulunabilirken, mitokondrial DNA bir çok sayıda olabilir. Sperm hücresindeki mitokondriler, döllenme sırasında yumurtayla birleşen bölgede bulunmamaktadır, bu nedenle mitokondrial DNA, sonraki nesillere yalnızca anneden aktarılır.
Genetik dizi ya da DNA dizisi, bir DNA molekülünün ya da ipliğinin yapısına karşılık gelen nükleobazların dizisidir. DNA dizisinde bulunan adenin (A), timin (T), guanin (G) ve sitozin (C) bazlarını simgeleyen harfler soldan sağa doğru kesintisiz okunduğunda bir DNA zincirinin 5’-3’ doğrultusunda uzanımına karşılık gelir (5’>>………TTC…….>>3’). Bir DNA
dizisi, protein sentezine yarayan mRNA kopyası ile aynı diziye sahipse anlamlı dizi içermektedir. Aynı diziye, paralel zıt DNA zincirinde ters anlamlı dizi adı verilir.
Lokus genlerin kromozom üzerindeki özgül yerleşim yerleridir. Allel aynı lokustaki alternatif genlerdir. Allel frekansı bir toplumda belli bir alleli taşıyan bireylerin oranıdır.
Polimorfizm bir popülasyonda %1’den daha sık görülen genetik farklılıkları ifade etmektedir. Normalin varyantıdırlar. Bir hastalık nedeni olmadıkları ancak, bazı hastalıklara yatkınlık oluşturdukları kabul edilmektedir. Tek nükleotid polimorfizmleri, insan genomunda en çok görülen polimorfizmlerdir. DNA dizisindeki tek nükleotidin farklı olması ile meydana gelir. Her 1000 bazda bir oluşmaktadır. Çoğu sessiz olmakla birlikte, bazıları protein fonksiyonlarını ve gen aktivitelerini değiştirebilir.
Genetik varyasyon, bir genin dizilimlerinde olan değişimler sebebi ile meydana gelir. Bir popülasyon içerisinde, popülasyonlar arasında, belli bir tür içerisinde veya gen alelleri arasında görülen farklılıklardır.
Kopya sayısı değişiklikleri (CNV), genomda kayıp ya da kazanç gibi kantitatif bir değişiklik oluşturan önemli varyasyonlardır. İnsan genomunda 50 baz çiftinden daha büyük değişiklikleri ifade eder. Genetik çeşitliliğe katkıda bulunurlar. 50 bazdan 10’larca megabaza kadar uzayabilirler, tek nükleotid ya da çok sayıda nükleotidi etkileyebilirler. CNV çoğu zaman belirli bir klinik ile ilişkili bulunmasa da, bazılarının ciddi klinik etkileri vardır. CNV’lerin yer aldığı bölgelerdeki delesyon, duplikasyon ve inversiyon gibi mekanizmaların tümör gelişimi de dahil bir çok hastalık mekanizmasında rol oynadığı düşünülmektedir (17).
Genotip bir organizmanın genetik birleşimi veya bir lokustaki alellerin tümünün ifadesidir. Fenotip ise genotipin morfolojik, biyokimyasal veya moleküler bir özellik olarak ölçülebilen, gözlenebilen ifadesidir; kısaca canlının dış görünüşüdür. Bireyin genotipi fenotipini belirler ancak, sadece fenotipe bakarak genotip belirlemek her zaman doğru olmaz. Genotipin sembolik gösteriminde canlıda görülen bir özellik için bir çift gen yani alel kullanılır. Bir karakteri kontrol eden, her iki ebeveynden gelen alelleri, aynı olan kişi homozigot bireydir (KK,kk). Heterozigot birey bir karakter için, her iki ebeveynden farklı alelleri almış olan bireydir (Kk). Baskın gen hem homozigot hem heterozigot durumda fenotipte kendini gösterir.
azdır. Canlıların dış görünüşünün nasıl şekilleneceğini kalıtım ve çevresel faktörler birlikte belirler. Farklı ortamlarda canlının fenotipi değişebilir, bu durumun nedeni genlerin değişimi sonucu değil, gen işleyişinin değişimi sonucudur.
A.1.1. Baz
DNA ve RNA zincirleri üzerinde bulunan, birbirine hidrojen bağları ile bağlanmış iki nükleobaz, bir baz çiftini oluşturmaktadır. Adenin (A) timin (T) ile, guanin (G), sitozin (C) ile bir baz çifti oluşturur. RNA içerisinde timinin yerini urasil (U) almaktadır. Adenin ve guanin pürin bazları; timin, sitozin ve urasil pirimidin bazları adını alır. Bir genin büyüklüğü baz çifti olarak ifade edilmektedir. Her üç baz çifti kodon olarak adlandırılır. Haploid (23 kromozom) insan genomunun büyüklüğü 3.2 milyar baz çiftidir.
A.1.2. Nükleotid
Nükleotid; pürin bazı, pentoz şeker ve fosfat grubundan oluşur. Azotlu bir baz ile (Pürin/Pirimidin), 5 karbonlu pentoz şekerin bağlanması sonucu ‘Nüklozid’ oluşur. DNA deoksiriboz; RNA riboz şeker içermektedir. Nükleozidler riboz halkasının karbon uçlarından, fosfodiester bağı olarak bilinen, şeker-fosfat bağı ile fosfat grubuna bağlanarak ‘Nükleotid’i oluşturur.
A.1.3. Nükleik Asit
Nükleotidler, ard arda dizi yaparak nükleik asidi ve dolayısıyla DNA’yı oluşturur. En bilinen nükleik asitler Deoksiribonükleik asit (DNA) ve Ribonükleik asittir (RNA). Her bir nükleik asit zincirindeki fosfodiester bağı 5’-3’ olmak üzere spesifik bir polariteye sahiptir. Nükleik asitler tek zincirden oluşabileceği gibi, birbirine sarılmış çift zincirden de oluşabilir. Spirale benzeyen bu yapıya çift sarmal yapı adı verilir. Bu çift zincir hidrojen bağları ile birbirine bağlıdır. DNA, genellikle çift sarmaldır ancak bazı virüslerin tek zincir DNA içerdiği saptanmıştır. RNA genelde tek zincir olmakla birlikte bazı virüslerin çift zincir RNA taşıdığı da saptanmıştır. Nükleik asidin 2 fonksiyonu vardır; bunlar protein sentezi ve genetik bilgilerin bir sonraki nesillere aktarılmasıdır (18).
A.1.4. Deoksiribonükleikasit (DNA)
Tüm organizmalar ve bazı virüslerin canlılık işlevlerinin sürdürülebilmesi için gerekli olan genetik talimatları taşıyan çift heliks yapısında bir nükleik asittir. Genetik bilgileri içeren fonksiyonel DNA parçaları ‘Gen’ olarak adlandırılır. Hücre bölünmesi sırasında DNA çift kopya olur, ökaryot canlılar DNA’larını hücre çekirdeği içinde bulundururken, prokaryot canlılarda DNA, hücre sitoplazması içinde bulunur ve kromozom olarak adlandırılan yapıların içinde yerleşmiştir. DNA uzunluğunun birimi baz çiftidir (bç). Haploid DNA’nın uzunluğu 1m kadar olup 3,2 x 109 bç’dir. Her hücre bölünmesinde DNA replikasyonu gerçekleşir. Bir hücre, yaşam döngüsünü, G1, S, G2 ve mitoz evreleri ile tamamlar. Mitoz bölünmenin gerçekleşmesi için DNA materyalinin S evresinde iki katına çıkması gerekir. Bunun için replikasyon başlangıç noktalarının tayini, DNA çift ipliğinin DNA helikaz yardımı ile hidrojen bağları koparılarak, fermuar şeklinde çözülmesi ve replikasyon çatalının oluşması gereklidir. DNA molekülü birbirine zıt yönde paralel iki zincir içermektedir. Replikasyonun gerçekleştiği DNA birimine replikon adı verilir. Her replikonda bir başlangıç noktası ve bitiş noktası bulunmaktadır. Başlangıç noktaları adenin (A) ve timinden (T) zengin tekrarlayan nükleotid dizilerinden oluşur ve bu bölgeler başlatıcı proteinler tarafından tanınır. Bu proteinlerin başlangıç noktasına bağlanması ile replikasyon başlar. Primaz, DNA sentezinin başlayabilmesi için gerekli olan RNA primerlerini sentezler. DNA zinciri üzerinde 5’ ucu fosfat grubunu, 3’ ucu beş karbonlu şekerin 3. karbon atomunu temsil etmektedir. Kalıp görevi gören ilk DNA zinciri 3’-5’ yönünde uzanmaktadır. DNA polimeraz enzimi, yapısı gereği 3’ serbest ucuna nükleotid ekleyebilmektedir. Bu nedenle replikasyon çatalı üzerinde 3’-5’ yönünde uzanan zincirde başlayan sentez, daima 5’-3’ yönünde kesintisiz olarak ilerlemektedir. Kalıp görevi gören diğer DNA zinciri zıt yönde yani 5’-3’ yönünde uzanmaktadır, bu nedenle bu zincirde 5’-3’ yönündeki sentez kesintili ve okazaki parçaları yardımı ile gerçekleşir. Bu işlem semikonservatifdir. Yani iki yeni DNA molekülü, hem yeni hem eski kollar içerir.
A.1.5. Kromatin ve Kromozom
Kromatin, DNA ve proteinlerden oluşan yapıya verilen addır. Kromozom ise kromatinden oluşmuş, hücre bölünmesi aşamasında görünür hale gelen ipliksi yapıdır. Kromatinin temel birimi nükleozomdur. Nükleozom belirli bir konfigürasyonda, histon proteinlerine sarılmış DNA yapısıdır. Nükleozom yapısı, toplam uzunluğu 2 m’ye yaklaşan
DNA’yı, 5-10 mikrometrelik bir çekirdeğe sığdırır. Kromatini oluşturan DNA’nın yanı sıra 1000’den fazla çeşit protein de bu yapıda yer alır. En önemlisi histon adı verilen çubuk şeklinde proteinlerdir. Kromatin, hücre bölünmesi sırasında 10.000 kat yoğunlaşır. Böylece kromozomlar ışık mikroskobunda incelenebilir hale gelir. Değişik boyalar kullanılarak kromozomlar üzerinde açık ve koyu bantlar elde edilir ve bu bantların paterni her bir kromozom için sabittir. Kromozom hastalığından şüphelenildiğinde kromozomların sayıları ve de boyanarak yapıları değerlendirilir. Kromozom analizi için genellikle periferik kandan elde edilen lenfositler in-vitro ortamda kültüre edilir ve mitojenlerin etkisi altında bölünmeleri uyarılır. Hücreler hızla bölünürken, metafazdaki mitotik bölünme kimyasallar ile durdurulur, hücre döngüsünün bu aşamasında kromozomlar en yoğun halindedir. Bu şekilde bantlama modellerinin kolayca tanınması sağlanır (6). Karyotip incelemesinin temeli buna dayanmaktadır. Diğer tanısal yöntemler ile birlikte bu konu, Bölüm 5‘de detaylı olarak bahsedilecektir.
A.1.6. Transkripsiyon
DNA’yı oluşturan nükleik asit dizisinin, RNA polimeraz enzimi tarafından bir RNA dizisi olarak kopyalanması sürecini tanımlar. Özetle DNA’dan RNA’ya bilgi aktarımıdır, gen ifadesi olarak da tanımlanabilir. Hücre içi genetik bilgi akışının ilk basamağıdır. DNA’nın bir ipliğinin kopyası olan mRNA sentez edilir. RNA’ya yazılan bir DNA parçasına transkripsiyon birimi, DNA’daki bilginin RNA olarak yazılmış şekli transkript olarak adlandırılır. Ribozomların protein sentezi yapmak için okuduğu RNA molekülü mesajcı RNA’dır. Prokaryotlarda RNA polimerazın ürettiği RNA ile ribozomların okuduğu RNA aynı moleküldür. Ökaryotlarda transkript birkaç basamak ile işlendikten sonra olgun mRNA meydana gelir. Bu nedenle işlem görmemiş mRNA’ya pre-mRNA adı verilir. Transkripsiyon başlama, uzama ve sonlanma adımlarından oluşur. Ökaryotlar için başlama RNA polimeraz enziminin, promotor olarak adlandırılan (TATA kutusu) spesifik bölgeye bağlanması ile gerçekleşir, primere ihtiyaç yoktur. RNA polimeraz timini (T) kullanmaz, adenin ile guanini, sitozin ile urasili bağlar. Sentezlenen ilk RNA olgun ökaryotik mRNA’ya dönüşmek için bir dizi basamaktan geçer. mRNA’nın 5’ ucuna şapka yapısı (cap) takılır, bu yapı translasyonun başlamasını kolaylaştıran ve mRNA’nın dayanıklılığını arttıran yapıdır. 3’ ucuna poliA kuyruğu eklenir. Pre-mRNA’nın yapısında proteine dönüşmeyecek bölgeler intronlardır, intronlar çıkartılır ve proteine dönüşecek olan eksonlar birleştirilir. Bu işlem tek bir genden iki polipeptidin sentezlenmesini
sağlar, bu sayede organizmaya daha az gen taşıyabilir. Oluşan bu mRNA sitoplazmaya geçerek ribozomlar aracılığı ile protein sentezini gerçekleştirir.
A.1.7. Translasyon
Transkripsiyon sonucu oluşan mRNA’daki koda uygun olarak, ribozomlarda aminoasit zinciri veya polipeptidlerin oluşturulması işlemidir. Sitoplazmada bulunan iki ribozom alt birimi, translasyon aşamasında mRNA zincirinin 5’ ucuna bağlanır. Ribozomlar, üzerinde bulunan bağlanma bölgelerinde mRNA’daki baz üçlülerini yani kodonları, tRNA’daki tamamlayıcıları olan antikodonlara bağlar. mRNA’daki kodonlara karşılık gelen antikodonu bulunduran tRNA’lar ard arda eklenir ve tRNA’nın 3’ ucuna bağlanmış olan aminoasitler birleşerek polipeptid zincirini oluşturur.
A.1.8. Proteinler
Proteinler, 20 farklı aminoasitten oluşan lineer polimerlerdir. Bir zincirde, aminoasitin karboksil grubunun, bir diğerinin amino grubuna bağlanması ile peptid bağları oluşmaktadır. Her proteinin kendisini kodlayan gendeki, nükleotid dizisi tarafından belirlenen, kendine has aminoasit dizilimi vardır. Aminoasitlerin dizilişi oluşacak olan proteinlerin şekil ve fonksiyonunu belirler. Çoğu protein katlanarak kendine has üç boyutlu bir şekil alır, kendilerini oluşturan aminoasitlerin yapısal yönelimleri ile katlanabilseler de bazıları, proteinlerin doğru zamanda doğru yapıda katlanmasına kılavuzluk eden şaperonlara ihtiyaç duyar. Düz aminoasit dizini proteinlerin birincil yapısını oluşturur. Hidrojen bağları ile kararlı hale getirilen alfa sarmal ve beta yaprağı ikincil yapıyı oluşturur. Bir hidrofobik çekirdeğin oluşması ile veya tuz köprüleri, hidrojen bağları, disülfür bağları ve post-translasyonel modifikasyonlar ile üçüncül yapı oluşur. Birden fazla protein molekülünün etkileşmesi ile dördüncül yapı oluşur (19).
A.2. GENETİK HASTALIKLARIN OLUŞUMU
Canlının genomunda meydana gelen mutasyon olarak adlandırılan değişiklikler sonucu oluşan hastalık grubudur. Bu mutasyonlar, kromozom sayısındaki anomaliler ile oluşan genom mutasyonları, kromozom yapısındaki anomaliler ile oluşan kromozom mutasyonları ve baz dizilerinde meydana gelen anomaliler ile oluşan gen mutasyonları şeklinde sınıflandırılır. Etkilenen genlerin işlevlerinde bozulma meydana gelir. Bu da yaşamsal fonksiyonları düzenleyen proteinlerin kodlanmasını engeller ya da bu proteinlerin yanlış kodlanmasına neden olarak normal işlevlerin bozulmasına yol açar. Mutasyonlar spontan yani doğal olarak veya dış etkenlerle yani indüklenme ile meydana gelebilir. Genom mutasyonları kromozomda kalıcı değişikliklere neden olur; öploidi ve anöploidi olarak gruplandırılır, çok sayıda kromozomun sayı olarak artması ya da azalması ile meydana gelirler. Kromozomal mutasyonlar; translokasyon, delesyon, insersiyon, duplikasyon ve inversiyon olarak gruplandırılır, bir kromozomun bazı parçalarının kaybı ile veya kromozoma parça eklenmesi ile meydana gelir. Gen mutasyonları nokta mutasyonları şeklinde ve yeniden düzenlenme ile meydana gelebilir.
Kendiliğinden meydana gelen mutasyonlar genellikle DNA replikasyonu sırasında ortaya çıkmaktadır. Dış etkenlere bağlı mutasyonların ortaya çıkmasında ultraviyole ışınlar, X ışınları, kozmik ışınlar, radyoaktif maddelerin emisyonları, çevredeki kimyasallar (civa, nitrik asit, formaldehit, peroksitler gibi), virüsler, ani sıcaklık değişimleri ve serbest radikaller etkili olabilmektedir.
Hastalığa neden olan mutasyonlar somatik hücre mutasyonları veya germ hücre mutasyonları olarak meydana gelebilir. Eşey hücrelerinde meydana gelen mutasyonlar, germ hücre mutasyonları, sonraki nesillere aktarılan mutasyonlardır. Bu durumda hastalıklar kalıtsal hastalık olarak isimlendirilir. Üreme ve farklılaşma yeteneği olmayan hücreler somatik hücrelerdir, bu hücrelerde meydana gelen mutasyonlar kişiyi etkiler ancak sonraki nesillere aktarılmaz. Genetik bozukluklar tek gen hastalıkları, kromozomal bozukluklar, multifaktöriyel hastalıklar, mitokondrial hastalıklar gibi bir çok klinik duruma neden olmaktadır.
A.2.1.KROMOZOMAL HASTALIKLAR
İnsan kromozomu diploid yapıda ve 46 adettir. 23 çift kromozomun 22’si otozomal, 1’i de cinsiyet kromozomundan oluşur. Gametler haploid sayıdadır yani 23 kromozom içerirler. Kromozom anormallikleri sayısal anomaliler ve yapısal anormaliler olarak iki ana gruba ayrılır.
A.2.1.1. SAYISAL KROMOZOM ANOMALİLERİ
Sayısal kromozom anomalileri poliploidi ve anöploidi başlıkları altında toplanır. Haploid sayının tam katı olmayan kromozom eksilmesi ya da eklenmesi durumları anöploidi, haploid sayının tam katı olan kromozom eklenmesi durumu ise poliploidi olarak tanımlanır. Haploid sayının üç katı kromozom bulunması triploidi (n:69), dört katı ise tetraploidi (n: 92) olarak ifade edilir. Bu durumda karyotip yapıları; 69,XXX triploidi, 92,XXXX tetraploidi olarak ifade edilir. Tek bir kromozomun kaybı monozomi (n: 45), bir çift kromozom kaybı nullizomi (n: 44), homolog bir kromozom fazlalığı trizomi (n: 47), iki kromozom fazlalığı ise tetrazomi (n: 48) olarak ifade edilir. Otozomal kromozomların mozaik olmayan monozomisi yaşamla bağdaşmaz iken, X kromozomu monozomisi Turner Sendromu 45,X olarak isimlendirilir. En sık görülen trizomi ise, trizomi 21’dir, karyotip yapısı 47,XX+21 veya 47,XY+21 olarak ifade edilir. Cinsiyet kromozomları fazlalığı ise; 47,XXY, 47,XYY veya 47,XXX şeklinde görülebilir. Trizomi ve monozomiler, kromozomların hücre bölünmesi sırasında ayrılamaması sonucu oluşur. Bu ayrılamamanın nedeni tam bilinmemekle birlikte yaşlanma bir neden olarak ileri sürülmektedir. Ayrıca ovulasyon sonrası, fertilizasyonun uzun süre sonra oluşması ve radyasyon, diğer nedenler arasında sayılabilir (20).
A.2.1.2 YAPISAL KROMOZOM ANOMALİLERİ
Yapısal anomaliler kromozomlarda meydana gelen kırıkların değişik şekillerde tekrar kromozomla birleşmesi sonucu oluşur. Dengeli yani materyal kaybının olmadığı, dengesiz yani materyal kaybının veya kazancının olduğu durumlar gözlenebilir. Yapısal kromozom anomalileri aşağıda detaylı olarak anlatılmıştır.
A.2.1.2.a. DENGELİ YAPISAL KROMOZOM ANOMALİLERİ
Dengeli yapısal kromozom anomalilerinde kromozom materyalinde artma ya da azalma olmadan, kopan bölge sadece yer değiştirir ve fenotipte genellikle etkilenme beklenmez ancak dengesiz yapısal kromozom anomalisi olan gamet oluşumuna neden olabilir.
i. Translokasyon
Bir kromozomdan kopan parçanın bir diğerinden kopan parça ile karşılıklı yer değiştirmesidir. Kırılma gösteren kromozomdan birinin kırılan parçası, diğerinin kırılan parçası üzerine yerleşir. Üç ana gruba ayrılır: karşılıklı (resiprokal) translokasyon, sentrik kaynaşma tipi (robertsonian) translokasyon, insersiyonel (transpozisyon) translokasyon. Karşılıklı translokasyon, iki farklı kromozomda kırılma oluşması ve sonrasında kopan parçaların karşılıklı yer değiştirmesi durumudur. Sentrik, kaynaşma tipi translokasyon; homolog veya nonhomolog iki akrosentrik kromozom arasında görülen translokasyon tipidir. İki farklı kromozoma ait uzun kollar ve kısa kollar kendi aralarında kaynaşır. Birleşen kısa kollar genellikle kaybolur. İnsersiyonel translokasyonda, iki kromozomdan birinde iki bölgede, diğerinde tek bölgede kırık oluşur. Çift kırılma olan kromozomdaki parça tek kırılma olan kromozoma yapışır. 46,XY,t(1;6)(p13p21.3) kromozomal kırık bölgeleri 1p13 ve 6p21.3 olan dengeli translokasyona örnek bir karyotiptir.
ii. İnversiyon
İki bölgeden kırılan bir kromozomun kırılan parçasının 180 derece dönerek tekrar yapışması ile oluşur. Ters dönen segment kromozomun bir kolunda oluşuyor ise parasentrik inversiyon, kırılmalar sentromerin iki yanında oluşmuş ise perisentrik inversiyon adını alır. Perisentrik inversiyonlar kromozom morfolojisinde değişikliğe yol açabilmektedir. Genellikle klinik sorunlara yol açmazlar ancak kırık noktaları önemli bir gene zarar verdi ise fonksiyon bozukluğuna yol açabilirler.
A.2.1.2.b. DENGESİZ YAPISAL KROMOZOM ANOMALİLERİ
Genetik materyaldeki kayıp ya da kazanca yol açılan yapısal kromozom anomalileridir. Kaybolan veya kazanılan parçaların içerdiği genlerin fonksiyonuna ve dozaj etkisine bağlı olarak fenotipe yansıması olur.
i. Delesyon
Bir kromozom segmentinin kırılma sonrası kaybedilmesidir. Tek bir kırılma sonucunda terminal parça kaybolabilir, ya da iki kırılma nedeni ile kopan parça aradan çıktıktan sonra kalan iki parça tekrar kaynaşır. Mikrodelesyonlar belirli bir bölgede anormal kopya sayısı değişikliklerine bağlı kayıplar ile ortaya çıkar. 3 Mb‘den küçük, çok sayıda gen bölgesi içeren bu kopya sayısı değişikliklerinde etkilenen genler spesifik klinik bulgulardan sorumlu olur. Mikrodelesyon sendromlarında klinik görünüm geniş yelpaze göstermektedir. Bazılarında belli organ malformasyonları gözlenir örneğin; velokardiyofasial sendromda konotrunkal kalp defekti, Williams-Beuren Sendromunda supravalvuler aortik stenoz ve pulmoner stenoz gözlenebilir.
ii. Duplikasyon
Bir kromozom parçasının fazladan kopyasının oluşmasıdır. Bu bölgenin içindeki genlerin dozajı artmış olur ve fenotipik etkilenme beklenir.
iii. İnsersiyon
Bir DNA dizisine bir veya daha çok baz çiftinin veya kromozom parçasının eklenmesi ile oluşur. Eğer bir genin protein kodlayan bölgesinde meydana gelir ise önemli bir klinik ortaya çıkartabilir. Eklenen nükleotidlerin sayısı 3’e yani bir kodondaki nükleotid sayısına bölünmüyor ise genin okuma çerçevesinde değişim meydana gelir. Buna çerçeve kayma mutasyonu adı verilir. Bu durum mutasyonu izleyen, bu genin kodladığı tüm aminoasitlerde değişikliğe neden olur. İnsersiyon sonucunda okuma zinciri değişmez ise çerçeve içi insersiyon meydana gelmiş olur. Ancak yine de eklenen nükleotidlerin büyüklüğüne bağlı olarak üretilen proteinlerin işlevleri değişebilir. Yabancı bir dizinin DNA’nın kodlayan bölgesine eklenmesi o genin ifadesini bozmaktadır. Gen yapısında değişikliğe neden olacak kadar büyük insersiyonlar
iv. Halka kromozom
Bir kromozomun her iki kolunda kırık oluşması ve bu iki ucun birbiri ile birleşmesi sonucu meydana gelir. 45,X/46,Xr(X), mozaik ve halka kromozom taşıyan TS olgusu karyotipidir.
v. İzokromozom
Bir kromozomda bir kolun kaybı, diğer kolun duplikasyonu şeklinde gözlenir, sebebi ise sentromerin enine değil uzunlamasına bölünmesidir. En sık görülen, X kromozomu uzun kol izokromozomudur. 46,Xi(Xq), X kromozomu uzun kolu izokromozomuna örnek karyotiptir.
vi. Marker kromozom
Küçük yapısal olarak anormal kromozomlar olarak bilinir, konvansiyonel sitogenetik yöntemlerle tespiti zordur. Metafaz safhasındaki 20. kromozoma eşit büyüklükte ya da ondan daha küçüktürler. Klinik önemi, marker kromozomun içerdiği gen miktarına bağlıdır. Kromozomların transkripsiyondan zengin bölgelerinde yer alan marker kromozomlar klinik bulgu gösterir (21).
Bir kişide sayısal ya da yapısal bir kromozom anormalliği varsa, bu anormallik genellikle bireyin tüm hücrelerinde mevcuttur. Ancak bazen kromozom sayısında veya yapısında farklılık gösteren iki ya da daha fazla hücre popülasyonuna sahip bireyler olabilir. Bunlar mozaik veya kimerik olarak adlandırılır. Farklı genetik yapıdaki iki hücre tipi, tek bir zigottan kaynaklanmış olursa birey mozaiktir. Hücre tipleri sonradan kaynaşan iki veya daha fazla zigottan kaynaklanıyor ise birey kimeriktir. Mozaikleşme, kromozomların ayrılamaması, anafaz gecikmesi ve endoreplikasyon olmak üzere bir çok farklı mekanizmadan kaynaklanabilir. Anafazda gecikme ve buna bağlı kromozomal ayrılamama, preimplantasyon aşamasındaki insan embriyosunda mozaikliğin ortaya çıkmasında en yaygın yoldur. Mozaiklik, klasik sitogenetik yöntemler, FISH analizi veya mikroarray yöntemleri ile saptanabilir (22).
Resim 1: İzokromozom X taşıyan olgunun karyotip görüntüsü, 46,Xi(Xq)
Resim 2: Marker kromozoma sahip olgunun karyotip görüntüsü
A.2.2.TEK GEN KALITIMI VE HASTALIKLARI
İnsan genomunda günümüzde bildirilen 19.567 genden sadece birinde meydana gelen DNA değişikliği sonucu ortaya çıkan hastalıklardır. Toplumun yaklaşık %1’ini etkileyen hastalıklardır. Bu hastalık grubu, etkilenen genlerin dominant ya da resesif olmalarına göre; otozomal ya da X kromozomuna bağlı olmalarına göre gruplandırılırlar.
i. Otozomal Dominant Hastalıklar (OD)
Otozomal Dominant özellik heterozigot durumdayken bulgu veren özelliktir. Kalıtımında cinsiyet ayrımı yoktur. Kalıtım şekli vertikal geçiş gösterir ve etkilenmiş birey %50 olasılık ile aynı bozukluğu sonraki nesillere geçirir. Bazı bireylerde mutasyon klinik olarak tespit edilemeyebilir, buna azalmış penetrans adı verilir, bozukluk kuşak atlamıştır. Hastalığın şiddeti nedeniyle çoğalma yeteneğinin olmadığı durumlarda görülen yeni olgular, yeni mutasyonlar nedeni ile ve sporadik olarak meydana gelecektir. Bu durumda ailede ve akrabalarda birden fazla olguya rastlanmayacak ve aile ağacında hastalık izi kısa olacaktır. Bu duruma verilebilecek en güzel örnek Apert Sendromudur. Buna karşın von Willebrand gibi hastalığın çok şiddetli olmadığı durumlarda çoğalma yeteneği kaybolmadan hastalık yeni nesillere geçirilerek aile ağacı uzun olacaktır.
ii. Otozomal Resesif Hastalıklar (OR)
Otozomal Resesif özellik sadece homozigot durumda kendisini ifade eden özelliktir. OR kalıtımda heterozigot bireyler mevcut bozukluğun fenotipini göstermezler ve aile ağacında horizontal geçiş dikkati çeker, yani aynı nesilde birden fazla etkilenmiş birey vardır. Ebeveynler arasında akrabalığın bu grup hastalıkta yüksek olduğu görülür. İki heterozigot birey evlenir ise çocukları %25 homozigot etkilenmiş birey, %50 heterozigot etkilenmemiş birey, %25 homozigot etkilenmemiş birey olarak dünyaya gelir. Bir toplumda sık görülen OR bir hastalıkta, akraba evliliği oranı yüksek bulunmayabilir. Toplumda nadir görülen hastalıklarda ise, OR hastalık büyük olasılıkla akraba evliliği ile ortaya çıkmaktadır. Kistik Fibrozis (KF), Kuzey Batı Avrupa ülkelerinde en sık görülen OR hastalıktır, bu hastalıktan etkilenmiş bireylerin anne babaları arasındaki akrabalık oranı toplumun genel ortalamasına göre çok az yüksektir. Alkaptonüri çok nadir bir metabolik hastalıktır ve olguların ¾’ünden fazlasında anne baba arası akrabalık mevcuttur (23).
iii. X’e bağlı Hastalıklar
X kromozomu üzerinde taşınan genlerin mutasyonları ile oluşan hastalıklardır. Dominant ve Resesif olmak üzere ikiye ayrılırlar. Kadınlar 2 adet X kromozomu taşımaları nedeni ile mutant geni taşıyan X kromozomunun sayısına bağlı olarak, ya heterozigot ya homozigot olacaklardır. Y kromozomu üzerinde taşınan genler ise Y’ye bağlı kalıtım ya da
holandrik kalıtım olarak adlandırılır. X’e bağlı resesif kalıtımda hastalık belirtileri sadece erkeklerde ortaya çıkar. Bu hastalıkta kalıtılan özellik sağlıklı heterozigot kadınlardan erkeklere geçer. Kız çocukları ise taşıyıcı olur. Aile ağacı diagonal geçiş gösterir. X’e bağlı bir hastalık taşıyan annenin %50 olasılıkla tamamen sağlıklı bir erkek çocuk, %50 olasılıkla taşıyıcı bir kız çocuk sahibi olma ihtimali vardır. Örneğin Oküler Albinizmde iris ve oküler fundusta erkeklerde pigment yoktur. Kadınlarda ise iris ve oküler fundusta dikkatli muayenede az bir miktar pigment eksikliği görülür. Bu mozaik görünümün sebebi X inaktivasyonunun rastgele dağılımına bağlanır. X’e bağlı domainant kalıtımda mutant gen heterozigot/hemizigot durumda da kendini gösterir. Hastalık hem kadınlarda hem erkekerde gözlenir. Kalıtım paterni otozomal dominant kalıtıma benzer ancak hastalık erkek bireyden oğluna aktarılmaz. X’e bağlı dominant kalıtılan hastalığa örnek olarak D vitamini dirençli raşitizm verilebilir (24).
A.2.3. MENDELİYEN OLMAYAN KALITIM ŞEKİLLERİ
i. Multifaktöriyel Kalıtım
Oluşumunda genetik ve çevresel faktörlerin birlikte rol aldığı, bilinen herhangi bir Mendeliyen kalıtıma uymaksızın, ailesel özellik gösteren kalıtım paternidir. Mevcut bozukluğun insidansı, bu bozukluğu en ağır şekilde gösteren bireyin akrabalarında en fazladır, örnek olarak bilateral yarık damak-dudak verilebilir. Risk yakın akrabalarda daha fazladır; spina bifida için değerlendirdiğimizde, birinci derece akrabalarda görülme olasılığı %4, üçüncü derece akrabalarda ise görülme olasılığı %0.5 olarak belirlenmiştir. Eğer birden fazla etkilenmiş akraba varsa risk artar. Belirli bir cinsiyette daha sık görülen bir bozukluk var ise, daha az sıklıkta görülen cinsiyetten olan hasta bireyin akrabalarında hastalık görülme oranı daha fazladır; örneğin pilor stenozu erkeklerde kadınlara göre beş kat fazla görülür (16).
ii. Mitokondrial Kalıtım
Mitokondrilerin iç membranında meydana gelen bir dizi biyokimyasal reaksiyon sonucunda oksidatif fosforilasyon ile ADP’den ATP oluşur. ATP molekülü çok önemli bir enerji taşıyıcıdır. Mitokondrilerin kendilerine ait kromozomları vardır ve çift zincirli, sirküler heliks yapısı gösterirler. Hücreden bağımsız olarak replike olurlar. Mitokondri ve dolayısı ile DNA’sı anneden oosit ile kalıtılır. Mitokondrial DNA, nükleer DNA’ya oranla daha fazla
sayıda spontan mutasyona uğrar. Defektif mitokondrilerin oranı tekrarlanan hücre bölünmelerinden sonra çeşitlilik gösterir, bu da mitokondrial hastalıkların farklı klinikler göstermesini açıklar. Yaşlanma ile ortaya çıkan birçok hastalık mitokondriler ile ilişkili bulunmuştur (örneğin Tip 2 Diyabet, parkinson, aterosklerotik kalp hastalığı, alzheimer gibi). Bu tip kalıtım sadece anneden geçer çünkü spermatozoonlar mitokondri taşımaz (25).
iii. Uniparental Dizomi (UPD)
Bir homolog kromozom çiftinin tamamını veya bir parçasının aynı ebeveynden gelmesidir. Mendeliyan kalıtıma uymayan bu durum, homolog kromozomların her ikisi de anneden aktarılmış ise maternal UPD, her ikisi de babadan aktarılmış ise paternal UPD olarak adlandırılır. Fenotipik etkileri birçok kromozom için tanımlanmıştır. En iyi bilinen durumlar; üzerinde imprinting özelliği taşıyan kromozomların UPD’sidir. Aynı genetik içeriğin anneden ya da babadan aktarılmasına bağlı ifadelenme özelliğinin değişiklik göstermesine neden olan imprinting özelliği, UPD sonucu her iki homolog kromozomun da aynı ebeveynden aktarılması ile bozularak fenotipik etkilenme ile sonuçlanır. Prader-Willi Sendromu, Angelman sendromu, Beckwith-Wiedemann Sendromu en güzel örneklerdir (20).
iv. Genomik İmprinting
Her iki ebeveynden alınan alelde, ifade edilebilir bazı genlerin baskılanması ile meydana gelir. Bu bölgedeki gen lokusları ebeveyndeki kökenlerine göre aktivite farkı gösterir. Kromatinde DNA dizisini değiştirmeyen ancak gen ifadelenmesini düzenleyen epigenetik bir olaydır. Gamet oluşumu sırasında bir kromozom üzerindeki belli genlerin metillenmesi ile o gen bölgesi susturulur (yani imprinted gen oluşur). Anneden veya babadan gelen bazı genlerin fenotipte etkisini göstermemesi, gamet oluşumu sırasında genomik imprintinge uğramış olmasındandır. Mutasyondan tamamen farklıdır çünkü yeni nesillerde bu imprinting yeniden düzenlenebilir (26).
A.3. GENETİK TANISAL YÖNTEMLER
A.3.1. SİTOGENETİK İNCELEMELER
Sitogenetik, kromozomların işlev ve morfolojilerini mitotik/mayotik metafaz sürecinde inceleyen bilim dalıdır. Genetik materyalin hücresel düzeyde incelenmesidir. Amaç, kromozomal evreye girmiş olan DNA’da meydana gelen yapısal değişiklikleri (translokasyon, delesyon, insersiyon, inversiyon, duplikasyon gibi) ve köken farklılıklarını (mozaisizm, kimerizm) saptamak, elde edilen sonuç ile fenotipik yapı ve genetik yapı arasındaki ilişkiyi değerlendirmektir (27).
Klasik sitogenetik tanı yöntemlerinde kromozom eldesi için, spontan bölünme hızı yüksek olan hücrelerden sitogenetik çalışma yapılır. Bölünme hızı düşük hücreler ise önce kültüre edilerek yapay uyarıcılar ile mitoz bölünmeye sokulur, çoğaltılır ve daha sonra sitogenetik çalışmalar için kullanılır. Bir fiksatif solüsyon (örneğin formol) içerisinde bulunan dokular kromozom elde etmek için uygun dokular değildir.
Özelleşmiş sitogenetik tanı yöntemleri; spesifik durumlar, bazı kromozomal hastalıkların tanısı veya mutajenite testi için kullanılmak üzere geliştirilmiş özelleşmiş tekniklerdir. Kardeş kromatid değişimi (SCE); metafaz kromozomlarında morfoloji değişmeksizin, özdeş segmentlerin simetrik değişimi sonucu kromatidlerin karşılıklı farklı boyanması ile gerçekleştirilir. Mutajen veya karsinojenlerin oluşturduğu genetik hasarın gösterilmesinde ve kromozom kırığı sendromlarını değerlendirmek amacı ile kullanılır. Mikronükleus tekniği ve frajil bölge tespiti de diğer özelleşmiş sitogenetik yöntemlerdendir (28).
A.3.2. MOLEKÜLER SİTOGENETİK İNCELEMELER
Flow sitometri olarak adlandırılan yöntemle kromozomların analizinde iki lazerli floresan aktive edici hücre sayacı (FACS) kullanılmaktadır. Adenin-timinden zengin bölgeler ve guanin-sitozinden zengin bölgeler ayrı ayrı boyanır, kromozomlar flow sitometrinin ışık demetinden geçirilmek sureti ile analiz edilir (29).
Genomda istenilen DNA bölgesinin floresan veren DNA ve RNA probları ile boyanarak ‘in situ’ olarak gözlenmesine imkan tanıyan moleküler sitogenetik yöntem ise Floresan in situ Hibridizasyondur (FISH). İnterfaz hücre çekirdeğinin ve metafaz kromozomlarının değerlendirilmesini sağlar. Klinikte sayısal ve yapısal anomalilerin, mikrodelesyon sendromları, translokasyonların, marker kromozomların tanınmasını, tümör gelişimi ile ortaya çıkan anomalilerin tanınmasını sağlayan ve gen haritalamada kullanılan bir tekniktir (30).
A.3.3. MOLEKÜLER GENETİK İNCELEMELER
İnsan genom projesi kapsamında yapılan çalışmalar sonucu, insan genomunun yaklaşık olarak 19.567 gene sahip olduğu anlaşılmış ve bunların büyük çoğunluğunun özelliği belirlenmiştir. Günümüzde klinikte konulan hastalık tanıları, moleküler genetik incelemeler ile desteklenmektedir.
i. Polimeraz Zincir Reaksiyonu (PZR)
Hücre içinde kendiliğinden meydana gelen DNA replikasyonunun tüp içinde taklit edilmesiyle istenilen bölgenin çok fazla sayıda çoğaltılmasını sağlayan bir yöntemdir. Onkogenezisin araştırılması, kalıtsal hastalıklarda taşıyıcı ve hastada mutasyonların taranması, prenatal tanı, klinik örneklerde patojen organizmaların saptanması, adli tıpta DNA ve parmak izi araştırması, prob oluşturulması, klonlama, gen ekspresyon araştırmalarında, DNA dizi analizinde büyük miktarda DNA örnekleri oluşturulmasında, in vitro fertilizasyon yapılan tek hücrede, implantasyon öncesi genetik testlerin yapılmasında kullanılır (31).
ii. Alel özgü oligonükleotid (ASO)
Hastalığa sebep olan mutasyon biliniyorsa, hastadan alınan DNA örneğinde bu mutasyonun bulunup bulunmadığı tespit edilir. Biri normal gene özgü, diğeri bilinen bir genetik mutasyona özgü olan sentetik oligonükleotidler prob olarak kullanılır, analiz edilen örnekte bulunabilecek tek bir baz çifti uyuşmazlığı bile duyarlı olarak saptanabilir. Yalnızca sınırlı ve az sayıdaki, farklı mutasyonlar ile karakterize genetik hastalıklar için uygundur (6).
iii. Mikroarray tekniği
Tek bir array üzerinde tüm genomu inceleme yöntemidir. Moleküler biyolojik ve robotik tekniklerin bir arada kullanımı sonucunda, cam matriks üzerinde herbiri spesifik bir geni temsil eden binlerce DNA parçasının yapıştırılması ile elde edilen arrayler ile hücrelerde, gen ekspresyon analizleri ve tek nüklotid polimorfizmlerinin genotiplemelerini yapmak mümkündür. Kullanım alanları; kanser araştırmaları, gen ekspresyon çalışmaları, normal ve patolojik durumlarda gen ekspresyon farklarının incelenmesi, mutasyon ve polimorfizm tespiti, ilaç hedeflerinin tanımlanması, gen haritalanması, DNA dizi analizi, çevresel araştırmalar, hastalık alt tiplerinin araştırılması, epigenetik modifikasyonlara yönelik çalışmalardır.
DNA mikroarray’i cam, plastik veya silikon gibi katı bir yüzeye tutturulup sabitlenen, sıralı şekilde (array) oluşturulmuş, mikroskobik DNA spotlarıdır. Yüzeye tutturulan DNA parçaları prob olarak adlandırılır ve genellikle 20 ila 100 nükleotid uzunluğundadır. Katı yüzeye spesifikliği bilinen DNA veya proteinin sabitlenmesi ile çipler oluşturulur. DNA’yı tutan bu katı yüzey slayt olarak adlandırılır.
Çiplerin hazırlanması iki yöntem ile yapılabilir, birincisi çip üzerinde fotolitografik olarak oligonükleotid sentezidir, bu yöntemle DNA ya da gen parçaları direk cam maddenin üzerinde sentez edilir. İkinci yöntem komplementer DNA’nın direkt olarak yüzeye bırakılmasıdır, bu teknikte genomik DNA parçaları cam yüzeydeki yerlerine çok uçlu mekanik yazıcılar ya da ink-jet yazıcılar aracılığı ile spotlanır. Çiplerin DNA fragmentleri, genlerin PCR amplifikasyonu ile elde edilip, cam film üzerine robotic spotting yöntemi ile yerleştirilir.
Örneklerin hazırlanmasında örnekten elde edilen hedef mRNA’lar, reverse transkriptaz yardımı ile cDNA’ya çevirilir. Elde edilen cDNA’lar floresan belirteçler ile işaretlenmelidir. İşaretleme için siyanin boyaları en sık kullanılanlardır. Amplifikasyonu yapılan örnekler, işaretçi boyalar ile doğrudan birleştirilir.
Etiketlenmiş cDNA’lardan oluşan oluşum, hibridizasyon için mikroarray üzerine inkübe edilir. Örneğimiz içerisinde, mikroarray probları ile komplementer diziler bulunduğunda hibridizasyon gerçekleşir. Hibridizasyon miktarı, ilgili gen için bulunan mRNA miktarına
Yıkama; reaksiyonun doğru değerlendirilmesi için, prob ile bağlanmamış dizinlerin, non-spesifik sinyal odaklarının uzaklaştırılması işlemidir. Daha sonra etiketlerin uyarılması aşamasına geçilir. Bu aşamada amaç, mikroarrayde hibridize olan dizinlerin görülüp değerlendirilmesini sağlamaktır. Verileri işleme ve yorumlama aşamasında, spotlardaki floresan ışık yoğunluğunu ölçen, floresan sinyal dedektörleri kullanılır. Dedektörlerden gelen veriler bilgisayarlarda özel yazılım programları ile analiz edilir.
Az miktarda DNA örneği ile, metafaz plağı gerekli olmadan, DNA üzerindeki tek baz değişikliklerinin de tespitini ve birden fazla genomun karşılaştırılabilmesini sağlayan bir yöntemdir (32).
Oligonükleotid Mikroarray’de problar sekansı bilinen ya da tahmin edilen mRNA’lara uygun olacak şekilde dizayn edilirler. Bu mikroarrayler gen ifadesinin kesin değeri ile ilgili tahminler verir. Array’deki her bir geni temsil etmek üzere genellikle 25-70 nükleotid uzunluğunda oligonükleotidler kullanılır. Daha küçük boyutlarda prob bağlama etkinliği de daha düşük olmaktadır, küçük oligonükleotidlerin özgüllüğü daha fazladır.
Spotlu Mikroarray’lerde problar oligonükleotid, cDNA veya mRNA’lara karşılık gelen PCR ürünlerinin küçük parçalarıdır. Bu tip array’lerde genellikle 2 farklı boya ile işaretlenmiş, karşılaştırılacak 2 örnekten (hasta ve kontrol) gelen cDNA ile hibridize edilmiştir. Örnekler karıştırılıp tek bir mikroarraye hibridize edilebilir. Lazer ile taranması sonucunda kayıplar ve kazançlar görülebilir. Dezavantajı gen ifadesi düzeyini kesin olarak gösterememektedir.
Genotip Mikroarray’ler içerisinde DNA mikroarrayleri belli bir pozisyondaki genom dizisini okumada kullanılır. SNP Mikroarray’ler bireylerde ve popülasyonda genetik varyasyonu belirlemek için kullanılan özel bir DNA arraydir. Ayrıca kansere neden olan somatik mutasyonların, heterozigosite kaybının belirlenmesinde kullanılır (33).
iv. DNA dizi analizi
En yaygın kullanılan yöntem Sanger dizi analizidir. Hem normal hem mutant genlerin analizi için kullanılabilir. Bir zincir sonlandırma tekniği olan Sanger dizi analizi; DNA polimerazı inhibe etmek için nükleotidlerin kimyasal analoglarını kullanır. Sentezlenmekte olan DNA zincirine bağlanan bu analoglar, deoksinükleotidtrifosfatların fosfodiester bağı oluşturmasını engelleyerek DNA zincirinin daha fazla uzamasına engel olur. Spesifik sonlanmalar oluştuktan sonra enzimatik reaksiyon ile ürünler kapiller elektroforezde yürütülerek analiz edilir (34). Yeni nesil dizi analizi (NGS), tüm genom, transkriptom veya daha küçük hedef bölgelerdeki milyonlarca DNA parçasının dizilenebilmesini sağlar. Dizilenecek olan DNA önce parçalara ayrılır. Daha sonra bu parçalanan uçlara adaptör dizileri ve barkod dizileri eklenir. Adaptör dizileri ile yüzeye tutunmuş olan tek zincir DNA parçalarına, işaretli bazlar eklenerek diğer zincirin sentezi gerçekleştirilir. Her yeni bazın eklenmesi ile ortaya çıkan ışık, pH veya iyon dengesinin değişimi sayesinde, kimyasal ve foto sensörler hangi bazın eklendiğini kaydedebilir. Reaksiyon tamamlandığında bilgisayarda kompleks biyoinformatik analizler yapılır. Bu çalışma hem mutasyon analizlerini hem de kromozom sayısındaki artma-azalmaları tespit edebilir. Kalıtsal kanser sendromlarında mutasyonun tespiti, kanser somatik mutasyon analizi, farmakogenetik, mikrobiyolojik çeşitliliğin ortaya konması, nadir hastalıklara neden olan mutasyonların ortaya konması, fenotipik-genotipik heterojenite gösteren hastalıkların tanısının konması, çevre-tarım zararlılarının konak seçimi, atasal DNA ile çevresel kontaminasyonun ayırt edilmesi gibi bir çok konu NGS’nin çalışma alanlarındandır, maliyet açısından avantajlı bir yöntemdir (35).
A.4. TURNER SENDROMU (TS)
A.4.1. TANIM
Turner sendromu olgularda; hipergonadotropik hipogonadizm, infertilite, boy kısalığı, otoimmün hastalıklarda artış, kardiyovasküler hastalıklar gibi spesifik klinik bulgularla tanımlanan bir sendromdur (36). Yaklaşık 100 yıl önce 3 bağımsız klinisyen; Seresevskij, Ullrich ve Turner tarafından, X kromozomunun parsiyel ya da tam kaybı ile ilişkili olduğu tanımlanmıştır (37).
Turner sendromu olguları farklı genetik yapılar ile tanı alabilir. Olguların %45-50’sinde 45,X genetik yapısı saptanmakta, %15-20’sinde 45,X/46,XX, %5-10’unda 45,X/46,XY, %3-4’ünde 45,X/47,XXX mozaik yapıları saptanmaktadır (11). 46,X,i(Xq) karyotipi, X kromozomu yapısal anomalileri içinde en sık görülendir. Görülme sıklığı, mozaisizmle birlikte olsun veya olmasın %15-18 olarak saptanmıştır. 46,X,r(X) karyotipi %6 sıklıkla görülmektedir. Xp delesyonu sıklığı %2 olarak saptanmıştır (7).
A.4.2. İLİŞKİLİ GENLER
Turner sendromu tanılı olgularda boy kısalığından sorumlu olduğu belirlenen SHOX geni (short stature homeobox- containing gene) ilk olarak 1977 yılında tanımlanmıştır (38). Çalışmalar X kromozomu kısa kolu ucundaki delesyonların hemen her zaman, TS’da kısa boy ile ilişkili olduğunu göstermektedir (39). Homeobox; 180 bp’lik bir DNA dizisidir ve 60 aminoasitli DNA bağlayıcı gen bölgesini (homeodomain) kodlar. Genel popülasyonda SHOX geni eksikliğinin insidansı 2000-5000 olguda 1 iken, kısa boylu bireyler arasında insidans 40-150 olguda 1 olarak belirtilmektedir. X kromozomu normal bir kadında inaktivasyona uğradığında; X’in birkaç geni inaktivasyondan kaçar, her iki ebeveynden iki fonksiyonel kopya olarak aktarılan SHOX geni bunlardan birisidir (40). SHOX geni, X ve Y kromozomlarının kısa kolu ucuna yerleşen psödootozomal bölge 1 olarak adlandırılan (PAR1) bölge içerisinde bulunur (41).
SHOX geni, birinci farengeal arkın, distal humerus, radius, el bileği ve bacaklardaki benzer kemiklerin gelişiminde, fetal yaşam sırasında ifade edilen bir homeodomain transkripsiyon faktörünü kodlar. Bu proteinler hipertrofik kondrositlerin büyüme plakasında spesifik olarak