FEN BĐLĐMLERĐ ENSTĐTÜSÜ
SFALERĐTĐN ASĐDĐK POTASYUM DĐKROMATLI (K2CR2O7) ORTAMDA ÇÖZÜNDÜRÜLMESĐ
Đsmail DEDEMLĐ
YÜKSEK LĐSANS TEZĐ
MADEN MÜHENDĐSLĐĞĐ ANABĐLĐM DALI
ÖZET
Yüksek Lisans Tezi
SFALERĐTĐN ASĐDĐK POTASYUM DĐKROMATLI (K2CR2O7) ORTAMDA ÇÖZÜNDÜRÜLMESĐ
ĐSMAĐL DEDEMLĐ
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Maden Mühendisliği Anabilim Dalı Danışman : Doç. Dr. Salih AYDOĞAN
2008, 50 Sayfa
Bu tezde Sivas-Koyulhisar yöresinde bulunan Cu-Pb-Zn kompleks cevherinden flotasyon yoluyla zenginleştirilmiş sfalerit konsantresinin, sülfürik asitli ortamda potasyum dikromat etkisinde liç şartları araştırılmıştır. Araştırmalarda; karıştırma hızı (200-600 rpm), liç sıcaklığı (50-95 0C), sülfirik asit derişimi (0,5 – 4 M), potasyumdikromat derişimi (0,01-0,15 M) ve tane boyutunun (-212 +106, -106 +75, -75 +45, -45 +38 ve -38 µm) sfaleritten çinko çözünmesine olan etkisi incelenmiştir.
Elde edilen sonuçlara göre çinko çözünme hızı; karıştırma hızı, liç sıcaklığı, sülfürik asit ve potasyum dikromat derişimi arttıkça artmaktadır, tane boyutu büyüdükçede azalmaktadır. 400 rpm karıştırıcı hızında, 70 0C sıcaklığında, 2 M H2SO4 derişiminde, 0,1 M K2Cr2O7 derişiminde ve -75 + 45 µm tane boyutunda 150 dakika yapılan liç çalışması sonucu % 99,25 Zn çözünme değerine ulaşılmıştır.
Çözünme mekanizmasının belirlenmesi amacıyla elde edilen çözünme değerlerine küçülen çekirdek modelleri uygulanmış ve çözünme hızının mineral yüzeyinde meydana gelen kimyasal reaksiyonla kontrol edildiği belirlenmiştir. Buradan hareketle aktivasyon enerjisi 56,21 kj/mol olarak hesaplanmıştır. Çözünme
hızının H2SO4 ve K2Cr2O7 derişimlerine bağımlılığı ise sırasıyla 0,49 ([H2SO4]0,49) ve 0,28 ([K2Cr2O7]0,28) olarak belirlenmiştir.
ABSTRACT MSc Thesis
DISSOLUTION OF SPHALERITE IN ACIDIC POTASSIUM DICHROMATE (K2CR2O7) MEDIUM
Selçuk University
Graduate School of Natural and Applied Sciences Department of Mining Engineering
Supervisor : Assoc. Prof. Dr. Salih AYDOĞAN 2008, 50 Pages
In this thesis, the leaching conditions of sphalerite (ZnS) concentrate enriched
through flotation of Sivas-Koyulhisar Cu-Pb-Zn complex ore in sulphuric acid medium under effect of potassium dichromate were investigated. Effects of stirring speed in the range of 200 - 600 rpm, sulphuric acid concentration in the range of 0.5 – 4.0 M, potassium dichromate concentration in the range of 0.01 - 0.15 M, leaching temperature in the range of 50 - 95°C, particle size fractions of -212 +106, -106 +75, -75 +45, -45 +38 and -38 µm on zinc dissolution were investigated.
According to the obtained results, it was determined that the zinc dissolution rate increased with increasing stirring speed, temperature, sulphuric acid and potassium dichromate concentrations. On the other hand, it decreased with increasing particle size. The zinc dissolution of % 99,25 was obtained with following conditions: leaching time of 150 minutes, stirring speed of 400 rpm, sulphuric acid concentration of 2 M, potassium dichromate concentration of 0,1 M, leaching temperature of 70 °C, particle size of -75 + 45 µm.
In order to determine the dissolution mechanism, shrinking core models were applied to the obtained dissolution values and it was determined that dissolution rate was controlled by the chemical reaction occurred on mineral surface. Activation
energy was calculated as 56.21 kJ/mol. Dependence of dissolution rate to H2SO4 and K2Cr2O7 concentrations was found as 0.49 ([H2SO4]0.49) and 0.28 ([K2Cr2O7]0.28) , respectively.
Keywords: Sphalerite, potassium dichromate, sulphuric acid, leaching, leaching kinetics.
TEŞEKKÜR
Bu tez çalışmamın her safhasında bana yardım eden, bilgileriyle bana ışık olan Danışman Hocam Doç. Dr. Salih AYDOĞAN’a sonsuz teşekkürlerimi ve saygılarımı borç bilirim. Maden Mühendisliği Bölüm Başkanı Prof. Dr. M. Kemal GÖKAY’a ve diğer hocalarıma da manevi destekleri için teşekkür ederim. Ayrıca tez çalışmam da benden yardımlarını esirgemeyen Arş. Grv. Ali ARAS, Arş. Grv. Gökhan UÇAR, Arş. Grv. Dr. Tevfik AĞAÇAYAK`a ve Tekniker Đbrahim KÜÇÜK`e çok teşekkür ederim.
ĐÇĐNDEKĐLER ÖZET i ABSTRACT iii TEŞEKKÜR v ĐÇĐNDEKĐLER vi ÇĐZELGELER DĐZĐNĐ viii ŞEKĐLLER DĐZĐNĐ ix 1.GĐRĐŞ 1
1.1. Çinko Hakkında Genel Bilgiler 3
1.2. Çinko Metalinin Kullanım Alanı 4
1.3. Sfaleritin Genel Özellikleri 7
1.4. Dünyada`ki Ve Türkiye`deki Çinko Rezervleri 7
1.5. Çinko Üretim Teknolojisi 11
1.5.1. Kavurma+indirgeme (izabe) 11
1.5.2. Kavurma+liçing+elektrokazanım 12
1.5.3. Liçing Yöntemleri 12
1.5.3.1. Karıştırmalı liç 13
1.5.3.2. Perkolasyon veya tank liçi 14
1.5.3.3. Yığın liçi 14
1.5.3.4. Yerinde liç 16
1.5.4. Yükseltgen olmayan liç prosesleri 17
1.5.5. Yükseltgen liç prosesleri 18
1.5.6. Liç kinetiğinin ortaya konması 20
1.6. Liçing Yöntemiyle Zn Üretimi 24
1.6.1. Ferrik iyonları etkisinde çinko liçi 25
1.6.2. Sfaleritin asit liçi 27
1.6.3. Sfaleritin amonyak liçi 28
2. MATERYAL VE METOT 29
2.1. Materyal 29
3. BULGULAR 32
3.1. Karıştırma Hızının Çinko Çözünmesine Etkisi 33
3.2. Sıcaklığın Çinko Çözünmesine Etkisi 34
3.3. Potasyum Dikromat Derişiminin Çinko Çözünmesine Etkisi 35 3.4. Sülfürik Asit Derişiminin Çinko Çözünmesine Etkisi 36
3.5. Tane Boyutunun Çinko Çözünmesine Etkisi 38
4. TARTIŞMA 40
4.1. Çözünme Kinetikleri 40
4.1.1. Sıcaklığın etkisinin incelenmesi 41
4.1.2. Potasyum dikromat etkisinin incelenmesi 43
4.1.3. Sülfürik asit derişiminin etkisinin incelenmesi 45
5. SONUÇLAR 47
ÇĐZELGELER DĐZĐNĐ
Çizelge 1.1. Saf çinkonun fiziksel özellikleri. 2
Çizelge 1.2. Zn mineralleri 6
Çizelge 1.3. Dünya Metal Çinko Rezervleri 8
Çizelge 1.4. Çinko Rezerv ve Baz Rezervleri Bakımından Önemli Bazı Ülkeler 9 Çizelge 1.5. Çinko Madenlerinin Kıtalara Göre Dağılımı 10
Çizelge 1.6. Hidrometalürjik üretim yöntemleri 13
Çizelge 1.7. Yükseltgeyici ortam gerektiren liç proseslerinde kullanılan yükseltgeyiciler ve proseste etkili olan katodik tepkimeler
18
Çizelge 2.1. Sfalerit konsantresinin her bir fraksiyonuna ait Zn değerleri 29 Çizelge 3.1. Karıştırma hızının çinko çözünmesine etkisi. 32
Çizelge 3.2. Sıcaklığın çinko çözünmesine etkisi. 34
Çizelge 3.3. Potasyum dikromat derişiminin çinko çözünmesine etkisi 35 Çizelge 3.4. Sülfürik asit derişiminin çinko çözünmesine etkisi 37 Çizelge 3.5. Tane boyutunun çinko çözünmesine etkisi. 38 Çizelge 4.1.Zn ekstraksiyonu için belirlenen hız sabitleri ve regrasyon
katsayıları
42
Çizelge 4.2. Potasyum dikromat derişiminin çinko çözünmesine etkisi : Hız sabiti değerleri.
44
Çizelge 4.3. Sülfürik asit derişiminin çinko çözünmesine etkisi: Hız sabiti değerleri
ŞEKĐLLER DĐZĐNĐ
Şekil 1.1. Dünya Çinko Rezervleri(Metal Çinko) 9 Şekil 1.2. Çinko Rezerv ve Baz Rezervleri Bakımından Önemli Bazı Ülkeler 10 Şekil 1.3. Çinko Madenlerinin Kıtalara Göre Dağılımı 10 Şekil 1.4. (a) Dorr ajitatörü, (b) Pachuca tankı, (c) Denver ajitatörü 13
Şekil 1.5. Perkolasyon liç tankı 14
Şekil 1.6. (a) Bir tepe yamacındaki hazırlıksız yığın liçi, (b) Çukur bir alandaki hazırlıksız yığın liçi
15
Şekil 1.7. Đnce taneler içeren malzeme için hazırlanmış bir yığın 16 Şekil 1.8. Uranyum cevheri için yerinde liç 17 Şekil 1.9. Küçülen çekirdek ve küçülen partikül modellerinin şematik
gösterimi
22
Şekil 1.10. 25 °C ve 1 atm basınç altında Fe-H2O-CO2 sistemi için Eh-pH diyagramı
25
Şekil 2.1. Çalışmalarda kullanılan deney düzeneğinin şematik gösterimi 30 Şekil 3.1. Karıştırma hızının çinko çözünmesine etkisi. 33 Şekil 3.2. Sıcaklığın çinko çözünmesine etkisi. 34 Şekil 3.3. Potasyum dikromat derişiminin çinko çözünmesine etkisi 36 Şekil 3.4. Sülfürik asit derişiminin çinko çözünmesine etkisi 37 Şekil 3.5. Tane boyutunu çinko çözünmesine etkisi 39 Şekil 4.1. Sıcaklığın çinko çözünmesine etkisi: Kimyasal reaksiyon modeli. 41
Şekil 4.2. Arrhenius grafiği 43
Şekil 4.3.Potasyum dikromat derişiminin çinko çözünmesine etkisi : Kimyasal model
43
Şekil 4.4. ZnS mineralinden Zn`nın extraksiyonu için 0,01 M-0,15 M potasyum dikromat derişimi aralığında elde edilen ln k-ln [K2Cr2O7] grafiği.
44
Şekil 4.5.H2SO4 derişiminin çinko çözünmesine etkisi : Kimyasal model 45 Şekil 4.6. ZnS mineralinden Zn`nın extraksiyonu için 0,5 M-4 M sülfürik asit derişimi aralığında elde edilen ln k-ln [H2SO4] grafiği.
1. GĐRĐŞ
Çinko ilk olarak M.Ö. 2000 yıllarında Çinliler ve Romalılar tarafından alaşım materyali olarak, prinç yapımında kullanılmıştır. Bilinen en eski çinko arkeolojik kalıntı Romanya Transilvanya’da Doroseh şehrindeki prehistorik Dacian yerleşim merkezinde bulunmuştur. Bu heykel parçası üzerinde yapılan analizler sonucunda, % 87.5 Zn, % 11.5 Pb ve % 1 oranında Fe içerdiği tespit edilmiştir. Hindistan da ise MS 1000-1300 yıllarında çinkonun metal olarak kullanıldığı ve 14. yy.’da ticari amaçla izabesinin yapıldığı bilinmektedir. Çinko metali hakkında ilk bilimsel çalışmalar Paracelsus (1490-1541) tarafından yapılmıştır. Çinkonun Avrupa pazarına girişi 17. ve 18. yy.’a rastlamaktadır. Đlk izabe teknolojisi 1730 yılında Çin’den Đngiltere’ye getirilmiştir. Đlk çinko izabe tesisi de 200 ton/yıl kapasite ile Bristol yakınlarında kurulmuştur. ABD’de ise ilk çinko üretimi Washington DC Arsenal’de yapılmıştır. Çinko endüstrisi ise 1860’lı yıllarda La Salle ve South Bethlehem’de kurulmuştur (DPT,2001).
Günümüzde çinko; çelik, alüminyum ve bakırdan sonra Dünya’da miktar olarak yıllık tüketimi en fazla olan metaldir. Kimyasal yönden aktif olması ve diğer metallerle kolayca alaşım yapabilmesi nedeniyle çinko, endüstride birçok alaşımın ve bileşiğin üretiminde kullanılmaktadır. Kuvvetli elektropozitif özelliğinden dolayı diğer metallerin özellikle demir çelik ürünlerinin aşınmaya karşı korunmasında kullanılmaktadır. Üretilen çinko metalinin ana ürün olarak tüketildiği belli başlı beş alan bulunmaktadır. Bunlar; galvanizleme, pres döküm alaşımları, pirinç ve bronz alaşımları, çinko oksit ve haddelenmiş çinko alaşımlarıdır (DPT,2001).
Çinko, atom ağırlığı 65.39 g/mol ve atom numarası 30 olan gümüş renkli bir metaldir. Önemli fiziksel özellikleri Çizelge 1- 1’de verilmiştir. Düşük kaynama sıcaklığı dikkat çekicidir. Bu değer özellikle pirometalurjik metal üretiminde çok belirleyici bir etmendir. Dökülmüş halde sert ve kırılgandır. 120 0C’de şekillendirilebilir. Elektrokimyasal potansiyel dizisinde demirden daha negatif değerdedir. Böylece çinko anot olarak katodik korozyon korumada önemli bir kullanım alanı bulur. Galvanizleme bu tür uygulamalardan biridir (DPT,2001).
Çizelge 1.1. Saf Çinkonun Fiziksel Özellikleri (DPT,2001). Ergime sıcaklığı Kaynama sıcaklığı Kristal yapısı Kafes parametreleri (%99.99 Zn) Yoğunluk 30 0C sıkıştırılabilirlik katsayısı Elastiklik modülü Burulma modülü Spesifik ısı Isı iletkenliği Lineer genleşme
Spesifik elektrik iletkenliği
Elektrik direncinin sıcaklık katsayısı Süper iletkenliğe geçiş sıcaklığı 200C’de Normal potansiyeli Yüzey gerilimi (%99.99 Zn) 419.470C 9060C Hegzagonal a= 2.66 A, b= 4.936 A, c/a= 1.856 200C’de 7.14 g/cm3, erg.nok.da 6.56 g/cm3 ß= 1.69 x 10-6cm2/kg E=10000 kg/mm2(200C) F=3935 kg/mm2(200C)
0 0C’de 0.381, 20 0C’de 0.385, 100 0C’de 0.398, 200 0C’de 0.414 ve 300 0C’de 0.420 g-1 K-1
00C’de 116, 1000C’de 109, 4000C’de 97, 4600C’de 60 W m-1K-1
29.05 10-3(20-1000C)
00C’de 18.1, 250C’de 16.82, 1000C’de 12.17 m.ohm-1.mm-2
0.00417 0.905 K -0.763 V
4200C’de 750, 5000C’de 790 mN/m.
Metal çinko (Zn) hurda malzemeden üretildiği gibi ihtiyacın büyük bir kısmı sfalerit (ZnS) mineralinden üretilmektedir. Ayrıca, üretim yapılan bir çok mineral bulunmasına rağmen ana mineral ZnS’dir. Üretim yöntemi olarak dünyada hali hazırda prometalürjik ve hidrometalürjik yöntemler kullanılmaktadır. Zn metali üretiminin yaklaşık % 80’i hidrometalürjik yöntemlerle, % 20`si ise pirometalürjik yöntemlerle yapılmaktadır (IZA, 2003).
ZnS mineralinden çinko metalinin üretimi sırasında hidrometalürjik ve pirometalürjik yöntemlerin her ikisinde de ilk aşamada kavurma yapılmaktadır (Bölüm 1.5.1). Kavurma işlemi sırasında mineralde bulunan S oksijen ile tepkimeye girmekte ve SO2 gazını meydana getirmektedir. SO2 gazı hava kirliliğine sebep olmaktadır. Günümüzde SO2 gazından sülfürik asit (H2SO4) üretimi yapılmasına rağmen, bu asidin depolama sorunları ve üretim fazlasının tüketilememesi nedeniyle büyük sorunlar meydana gelmektedir. Bundan dolayı günümüzde kavurma işlemine
gerek duyulmadan hidrometalürjik yöntemlerle ZnS mineralinin çözeltiye alınması amaç edinilmiş ve bu konuda araştırmalara hız verilmiştir.
Bu tezde ZnS konsantresinin asidik potasyum dikromatlı ortamda karıştırma liçi uygulanarak direkt olarak çözündürülebilme koşulları incelenmiştir.
1.1. Çinko Hakkında Genel Bilgiler
Çinko insanların eski çağlardan bu yana çeşitli amaçlarla kullandığı ve günümüzde de sanayinin temel hammaddeleri arasında yer alan önemli metallerden biridir. Endüstride çinkonun önemli rol oynaması ve çeşitli alanlarda kullanılabilmesinin nedeni, çok değişik özelliklere sahip olmasıdır. Çinkonun önemli özellikleri arasında yüksek elektrik ve ısı iletkenliği, tel çekilebilme ve dövülebilme özelliği, korozyon özelliğine sahip oluşu sayılabilir.
Çinko doğada genellikle sülfürlü, oksitli, karbonatlı, silikatlı ve nabit halde bulunur. Çinko, oksidasyondan kolay etkilenir. Oksidasyon zonlarında nabit çinko, kuprit, tenorit, malahit ve azurit mineralleriyle birlikte bulunur (Utine, 1988).
Çinko kullanım açısından demir dışı metaller içerisinde alüminyum ve bakırdan sonra gelen en önemli üç metalden birisidir. Bu üç metal başlıca, demir ve çeliğin korozyona karşı direncinin artırılmasında, döküm sanayinde kullanılan özel alaşımlar ile pirinç alaşımların yapımında kullanılmaktadır. Çinko ayrıca, çinko plakaların yapımında, çatı kaplama malzemelerinde ve lastik sanayinde de (ZnO olarak) kullanım alanı bulmaktadır (DPT,2001).
Çinko alaşımları ve bileşiklerinin kullanım açısından özelliklerinin iyi bilinmesi gerekmektedir. Ticari açıdan çinkonun öneminde herhangi bir gerileme gözlenmemektedir. Bazı uygulama alanlarında, diğer metallerle arasında bir yarış olmasına rağmen, çinkonun önemi hiç azalmamaktadır (DPT,2001).
Toplam çinko tüketiminin hemen hemen %50’si galvanize çelik üretiminde kullanılmakta, %20’si pirinç üretiminde, %15’i döküm, %8’i çinko oksit üretiminde, %7’ si yarı fabrikasyon ürünlerde kullanılmaktadır. Ekotoksik etkisi nedeniyle çinko, bazı alanlarda sınırlı tüketilmektedir (özellikle yapı ve inşaat sektörü gibi). Günümüzde çinko ikame materyali olarak; alüminyum, mağnezyum ve plastikler, özellikle otomotiv sektöründe kullanılmaktadır (DPT,2001).
1995 yılı verilerine göre Dünyanın en büyük rafine çinko tüketicisi 1.2 milyon ton ile ABD’dir. ABD tüketimini 1994 yılına göre %4 oranında artırmıştır. Japonya 752 bin ton’luk tüketim hacmi ile ikinci sırada gelmektedir. Japonya’nın tüketimi geçen yıllara oranla %4.3 oranında artmıştır. Üçüncü sıradaki Çin, tüketimini %2.3 artırarak, 670 bin ton’a ulaşmıştır. Almanya’nın 1995 yılı tüketimi 1994 yılına göre %2.1 oranında artarak 530 bin ton’a ulaşmıştır Güney Kore %13.6 oranında artışla 361 bin ton, Đtalya %3.8 artışla 332 bin ton, Belçika ve Fransa sırasıyla %11 ve %3.7’lik artışlarla 250’şer bin ton, Tayvan %22.9’luk bir artış ile 209 bin ton, Hindistan ise % 4.2’lik bir artışla 200 bin ton rafine çinko tüketmişlerdir (DPT,2001).
Cevher yataklarının oluşumuna paralel olarak, Türkiye’de çinko-kurşun cevher ve konsantreleri oksitli ve sülfürlü olarak bulunmaktadır. Türkiye’nin toplam çinko rezervi, metal çinko olarak, 5,471,338 ton olup, bunun 1,305,688 tonu görünür, 1,238,555 tonu muhtemel, 2,927,095 tonu mümkün rezervdir (ĐMĐB Türkiye Çinko Envanteri, 1998).
Oksitli cevherlerin tamamı yurt içinde ÇĐNKUR tarafından işlenerek elektrolitik külçe çinko elde edilmektedir. Ülkede üretilmekte olan sülfürlü cevherlerin yurt içinde izabe imkanı bulunmadığından, zenginleştirilmiş çinko-kurşun cevherleri veya konsantreleri olarak geçici veya doğrudan ihraç yolu ile yurt dışına satılmaktadır. Ayrıca tuvenan, ayıklanmış konsantre, alsine ürün olarak da çinko ihracatı yapılmaktadır(DPT,2001).
1.2. Çinko Metalinin Kullanım Alanları
Çinko; alüminyum ve bakırdan sonra dünyada tüketimi en fazla olan metaldir. Bazı metallerle (Cu, Al ve Sn gibi) çok kolay alaşım yapabildiği için pirinç (Cu-Zn) ve bronz (Cu-Sn-Zn) yapımında çokça kullanılmaktadır. Çinko, en çok demir ve çeliğin korozyona karşı korunması için galvanizlemede kullanılmaktadır. Toplam çinko tüketiminin hemen hemen %50’si galvanizlemede kullanılmakta, %20’si pirinç ve bronz üretiminde, %15’i döküm alaşımlarında, %8’i çinko oksit üretiminde, %7’ si diğer alanlarda kullanılmaktadır (DPT, 2001). Çinkonun kullanım alanları aşağıda verilmiştir:
1-Galvanizleme : Demir ve çelik, korozyona karşı korunmak üzere çinko ile kaplanmaktadır. Dünya’da üretilen çinkonun büyük bir bölümü bu şekilde tüketilmektedir. Bunun en önemli nedenleri; çinkonun ayrışma olaylarına karşı dirençli olması, demiri koruma özelliği (galvanizasyon) ve ekonomik oluşudur. Demirden daha elektropozitif olduğu için demiri korozyona karşı korumada çinko etkili olmaktadır.
2-Pirinç ve bronz yapımı : Pirinç, % 5-45 Zn içeren bir bakır alaşımıdır. Đçindeki çinko miktarına göre isimler almaktadır. Muntz metal (%59 Cu, %41 Zn), lehim pirinci (%75 Cu, %25 Zn), kırmızı pirinç (%85 Cu, %15 Zn) içermektedir. Mimari, telekomünikasyon, bilgisayar ve televizyon endüstrilerinde, otomobil endüstrisinde, kaynak çubuklarında, civatalarda, radyatör peteklerinde ve borularda, elektrik tellerinde ve bazı mücevherlerde çeşitli pirinç tipleri kullanılmaktadır. Bronz, aslında bir bakır kalay alaşımı olup, % 2-4 oranında çinko ilavesiyle ergimiş bronzun akıcılığı artırılmaktadır.
3-Döküm alaşımları : Bu alaşımlar %3.5-4.5 Al ve %0.1-2.5 Cu içermektedirler. Ergimiş alaşım, basınç altında çelik kaplara dökülür. Basınçlı döküm, karışık şekillerin yapılmasına olanak sağlamaktadır. Bu alaşımlar ile yapılan dökümler, otomobillerin mekanik bölümlerinde, karbüratör yakıt pompalarında, hız ölçerlerde, dişli takımlarında, radyatör ızgaralarında, kapı tokmaklarında vs.de kullanılmaktadır. Döküm alaşımları, ayrıca otomobil ve uçak endüstrisinde kullanılan kalıpların yapımında da yer bulmaktadır.
4-Çinko oksit : Oksit halinde olan çinko, boya ve emaye imalinde kullanılmakta ve lastik yapımında dolgu maddesi olarak önemli rol oynamaktadır.
5-Haddelenmiş çinko : Çinko metali levha ve plaka olarak haddelenebilmekte olup, çatı kaplamaları ve kuru pil muhafazalarında kullanılabilmektedir (DPT, 2001). Dünyada çinko talebi artarak ilerlemektedir. Buna bağlı olarak Zn cevherlerine olan ihtiyaç da artmaktadır. Çinko metalinin üretildiği birincil mineral sfalerit (ZnS)’dir. Sfalerit mineralinin atmosfer şartlarında değişime uğraması ile diğer çinko mineralleri oluşmaktadır. Zn üretimi yapılabilecek cevher mineralleri Çizelge 1.2’de verilmiştir (DPT, 2001).
Çizelge 1.2. Zn mineralleri (DPT, 2001).
Mineral Adı Kimyasal Formülü Yoğunluğu Zn tenörü
Sfalerit ZnS 4 % 67 Wurtzit (Zn,Fe)S 4 %61 Zink-Teallite (Pb, Zn)SnS2 Goslarit ZnSO4.7H2O 2 %23 Zinc-Melanterit (Fe, Zn)SO4.7H2O Zinc-Copper Melanterit (Fe, Zn)SO4.5H2O Simitsonit ZnCO3 4.5 % 52
Hidrozinkit ZnCO3.3Zn(OH)2 3.5 % 60
Zinkokalsit (Ca, Zn)CO3 (Bir kalsit çeşiti) Nicholsonite (Ca, Zn)CO3 (Bir aragonit çeşiti) Aurichalcite 2(Zn, Cu)CO3.3(Zn, Cu) OH2
Hemimorfit H2Zn2SiO5(ZnOH)2SiO3 3.4 % 54
Vilemit Zn2SiO4.2ZnO.SiO2 4.1 %59
Zinkit ZnO 5.5 %80
Zinkspinel ZnO.Al2O3 4.3 %36
Zincdibraunie ZnO.2MnO2.2H2O %22
Hetaerolite ZnO.Mn2O3 4.9 %27
Kreittonite (Zn, Fe, Mg)O.(Al, Fe)2 Dysluite (Zn,Fe,Mg)O.(Al, Fe)2O3 Fanklinit (Zn,Fe,Mn).(Fe,Mn2)O4
Colusit (Cu,Fe,Mo,Sn,Zn).4(S,As,Te,Sb)
Zincaluminit 2ZnSO4.4Zn(OH)26Al(OH)3.5H2O 2.3 %31
1.3. Sfaleritin Genel Özellikleri
Formülü ZnS dir ve teorik olarak %67 Çinko, %33 Kükürt içermektedir. Genellikle FeS ile izomorfdur. Demir oranı bazen %20’ye kadar yükselebilmektedir. Siyah renkli olan bu minerale Marmatit denmektedir. Ayrıca CuS ve MnS de içermektedir.
Çinko blend kübik sistemde kristalleşmekte ve kompakt, yaprağımsı ve ince taneli agrega halinde de bulunmaktadır. Koyu kahverengi, siyahımsı olabildiği gibi, renksiz veya açık sarı renklerde de olabilmektedir. Çizgi rengi sarımsı veya sarı kahverengidir. Kendine özgü blend cilalıdır. Genellikle yarı saydam, safken saydamdır. Dilinimi mükemmeldir. Sertliği 3.5-4 özgül ağırlığı, 3.9-4.2 arasındadır (DPT,2001).
Çinko blend üfleç alevinde çıtırdamakta, kömür üzerinde soda ile ısıtıldığında ise sarı, soğuduktan sonra beyaz bir iz bırakmaktadır. Nitrik asitte kükürt çökeltisi oluşturarak çözünmektedir.
Çinko blend başlıca, hidrotermal olarak ve kalker ile dolomitlerin ornatılması ile oluşmaktadır. Ayrıca magmatojen, sedimanter pnömotojen ve hatta metamorf olarak da oluşabilmektedir.
Çinko blendin bozuşmasından limonit ve çinko sülfatlar, daha sonra ise çinko karbonat (simitsonit) meydana gelmektedir. Çinko karbonat 1020 0C nin üzerinde vurtzite dönüşmektedir. Genellikle galen, kalkopirit, pirit, kuvars, kalsit, flüorit ve barit ile birlikte bulunmaktadır. En büyük sfalerit yatakları Kuzey Amerika, Almanya, Meksika, Avustralya, Kanada, Macaristan ve Türkiye’de bulunmaktadır (DPT,2001).
1.4. Dünya’daki ve Türkiye’deki Çinko Rezervleri
1984 yılı dünya çinko baz rezervleri 290 milyon ton metal çinko civarındadır. 1984-1993 yılları arasında 108.7 milyon ton civarında yeni rezervler bulunmuştur. Aynı yıllar arasında 68.7 milyon ton üretim yapılmış olup, 1994 yılı çinko baz rezervleri 330 milyon ton metal çinko civarındadır. Şu anda Dünya’da bilinen çinko
kaynakları 1.8 milyar ton civarında olup, ekonomik olmayan kaynaklarda dikkate alındığında bu miktar 4.4 milyar tona kadar çıkmaktadır.
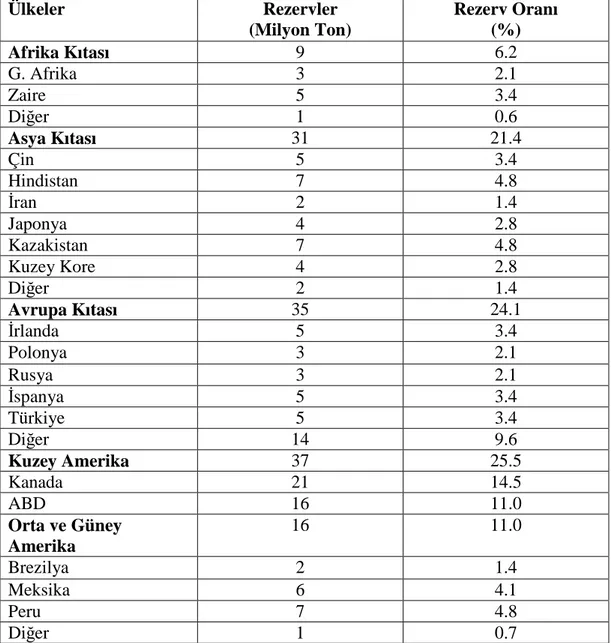
1995 yılı Dünya çinko rezervleri Çizelge 1- 3 ve Şekil 1- 1’de, önemli çinko rezevlerine sahip ülkelerin toplam ve baz rezerv değerleri Çizelge 1 - 4 ve Şekil 1- 2’de, kıtalara göre çinko madenlerinin dağılımı ise, Çizelge 1- 5 ve Şekil 1- 3’de verilmektedir.
Çizelge 1.3. Dünya Metal Çinko Rezervleri (ILZSG. Pocket Guide.1997.).
Ülkeler Rezervler (Milyon Ton) Rezerv Oranı (%) Afrika Kıtası 9 6.2 G. Afrika 3 2.1 Zaire 5 3.4 Diğer 1 0.6 Asya Kıtası 31 21.4 Çin 5 3.4 Hindistan 7 4.8 Đran 2 1.4 Japonya 4 2.8 Kazakistan 7 4.8 Kuzey Kore 4 2.8 Diğer 2 1.4 Avrupa Kıtası 35 24.1 Đrlanda 5 3.4 Polonya 3 2.1 Rusya 3 2.1 Đspanya 5 3.4 Türkiye 5 3.4 Diğer 14 9.6 Kuzey Amerika 37 25.5 Kanada 21 14.5 ABD 16 11.0 Orta ve Güney Amerika 16 11.0 Brezilya 2 1.4 Meksika 6 4.1 Peru 7 4.8 Diğer 1 0.7
Şekil 1.1. Dünya Metal Çinko Rezervleri
Çizelge 1.4. Çinko Rezerv ve Baz Rezervleri Bakımından Önemli Bazı Ülkeler (U.S. Bureau of Mines. Min. Com. Sum. Jan. 1995)
Ülkeler Rezervler1 (x 1000 ton) Baz Rezervleri1 (x 1000 ton) ABD 16,000 50,000 Avustralya 17,000 65,000 Kanada 21,000 56,000 Çin 5,000 9,000 Meksiko 6,000 8,000 Peru 7,000 12,000 Diger Ülkeler 77,000 130,000 Dünya Toplamı 140,000 330,000
Şekil 1.2. Çinko Rezerv ve Baz Rezervleri Bakımından Önemli Bazı Ülkeler.
Çizelge 1.5. Çinko Madenlerinin Kıtalara Göre Dağılımı (ILZSG 1995) Madenlerin Bulunduğu Kıta Maden sayısı
Avrupa 94
Afrika 21
Amerika 158
Asya-Pasifik 65
1.5. Çinko Üretim Teknolojisi
Dünyada çinko metali üretim yöntemlerini iki kısımda gruplandırmak mümkündür. Bunlar;
1- Kavurma + indirgeme (izabe) 2- Kavurma + liçing + elektrokazanım
Dünyada rafine çinko üretim kapasitesi verilirse; % 40.4 Asya – Pasifik, % 34.7 Avrupa, % 22.2 Amerika kıtası ve % 2.7 Afrika sıralaması yapılabilir.
Rafine çinko üretim yöntemleri uygulanma yüzdeleri ise; % 80.6 Elektrolitik, % 13.2 Imperial Smelting, % 3 Düşey retort ve % 3.2 diğer uygulamalar şeklinde sıralanabilir (IZA, 2003).
1.5.1. Kavurma + indirgeme (izabe)
Bu yöntemde ilk önce çinko sülfür konsantrelerine kavurma işlemi yapılarak sülfür bileşiminin oksit bileşimine dönüşmesi sağlanmaktadır. Daha sonra oluşan çinko oksit fırınlarda karbonla indirgenerek metal çinko elde edilmektedir. Meydana gelen reaksiyonlar ve entalpi değerleri aşağıda verilmektedir (Dennis, 1987):
ZnS + 3/2 O2 ZnO + SO2 (Kavurma) ∆ H = -111 Kcal/mol (1.1) ZnO + C Zn + CO (Đzabe) ∆ H = 57 Kcal/mol (1.2) 2C + O2 2CO ∆ H = -52 Kcal/mol (1.3) ZnO + CO Zn + CO2 ∆ H = 18 Kcal/mol (1.4)
Çinko oksitin (ZnO) karbon (C) ile indirgeme reaksiyonu çok kuvvetli ısı alan bir reaksiyondur. Bu reaksiyon 1400-1500 º C’lik bir sıcaklığı gerektirmektedir. Đzabe işlemi yatay ve düşey retort fırınlarda yapılmakta ve bu oluşan çinko buharı yoğunlaştırılıp çinko metali elde edilmektedir (Dennis, 1987).
1.5.2. Kavurma + liçing + elektrokazanım
Bu yöntemde de çinko sülfür konsantresine kavurma işlemi uygulanıp çinko oksit (ZnO) elde edilmektedir (Tepkime 1). Kavurma işlemi ile asit çözeltilerinde çözünmeyen sülfür bileşimi (ZnS), asit çözeltilerinde çözünebilen oksit bileşimine (ZnO) dönüştürülmektedir. Daha sonra çinko oksite (ZnO) liçing işlemi uygulanarak, çinko çözeltiye alınmaktadır. Çözeltide Zn+2 halinde bulunan çinko elektroliz işlemi ile katot çinko elde edilmektedir (IZA, 2003).
ZnO + 2H+ Zn+2 + H2O (Liçing) (1.5) Zn+2 + 2e- Zn0 (Elektrokazanım) (1.6)
H+ iyonu kaynağı olarak ucuz ve mol başına 2H+ iyonu vermesi nedeniyle H2SO4 (sülfürik asit) kullanılmaktadır.
Her iki yöntemde de kavurma işlemi sırasında SO2 gazı açığa çıkmakta, SO2 gazı ise çevre kirliliğine yol açmaktadır. SO2 sülfürik asit üretiminde kullanılabilmektedir (IZA, 2003).
1.5.3. Liçing yöntemleri
Cevherlerden veya yan ürün ve artıklardan metallerin hidrometalurjik proseslerle kazanılması için uygulanan liç prosesleri, işlemin uygulanış biçimine ve liç işlemi sırasında meydana gelen reaksiyonlara göre sınıflandırılabilirler.
Liç proseslerinin uygulanış biçimlerine göre sınıflandırılması Çizelge 1.6’da görülmektedir. Kullanılacak liç yönteminin seçimi, önemli ölçüde cevherin tenörüne bağlı olup, seçilen liç yöntemine göre işlem süresi de büyük farklılıklar arz etmektedir (Canbazoğlu ve Girgin, 2001).
Çizelge 1.6. Hidrometalürjik üretim yöntemleri (Canbazoğlu ve Girgin, 2001).
Liç Yöntemi Tane Büyüklüğü Süre Đşlem Maliyeti
Karıştırmalı pülp
liçi- basınç liçi < 0.5 mm Gün Yüksek
Perkolasyon veya tank liçi
< 10 mm Hafta Yüksek
Hazırlıklı yığın liçi Kırılmış cevher Ay Düşük
Hazırlıksız yığın liçi
Đşlemden geçirilmemiş
Yıl Düşük
Yerinde liç Gerektiğinde patlatma yoluyla
gevşetilmiş yerinde cevher
Yıl (lar) Düşük
1.5.3.1. Karıştırmalı liç
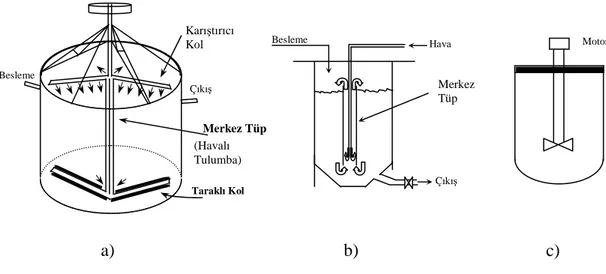
Bu sistemde, besleme malzemesinin genellikle yaş öğütme yoluyla 0.5 mm tane büyüklüğüne indirilmesini takiben uygun bir çözücü ile % 40-70 katı içerecek şekilde hazırlanan karışımlar, yeterince çözünme sağlanana kadar karıştırma işlemine tabi tutulurlar. Karıştırma işlemi mekanik, pnömatik ve mekanik-pnömatik olmak üzere başlıca üç şekilde gerçekleştirilir ve bu amaçla kullanılmakta olan en yaygın liç sistemleri Şekil 1.4’de görüldüğü gibi, sırasıyla Denver ajitatörü, Pachuca tankı ve Dorr ajitatörüdür. Refrakter karakterli ve zor çözünen malzemelerin çözeltiye alınmasında ise genellikle basınç liçi uygulanmaktadır (Canbazoğlu ve Girgin, 2001).
Şekil 1.4. (a) Dorr ajitatörü, (b) Pachuca tankı, (c) Denver ajitatörü
Merkez Tüp (Havalı Tulumba) Besleme Çıkış Karıştırıcı Kol Taraklı Kol a) Çıkış Merkez Tüp Hava Besleme b) Motor c)
1.5.3.2. Perkolasyon veya tank liçi
Bu işlem genellikle düşük tenörlü, iri ve mümkün olduğunca homojen tane boyutunda gözenekli ve geçirgen malzemeler için uygun, bir araya geldiği zaman geçirimsiz bir kütle oluşturan malzemeler için ise uygun değildir. Bu uygulamada, Şekil 1.5’de görüldüğü gibi, malzeme alt kısmında delikli tabla bulunan bir tanka doldurulmakta ve sonra da üstten veya alttan çözücü beslemesi yapılmaktadır (Canbazoğlu ve Girgin, 2001).
1.5.3.3. Yığın liçi
Geçirimsiz bir zemin (asfalt, plastik, beton, kil vb.) üzerinde hazırlanmış bir yığın üzerine boru ağı, çözelti havuzu, fıskiye vb. sistemlerle çözücü gönderilerek değerli bileşenin arazide kazanılmasına yönelik uygulamalardır.
Hazırlıksız yığın liçinde Şekil 1.6’ da görüldüğü gibi, 100.000 ton dolayında malzeme içeren yığınlar hazırlanabilmekte ve daha ziyade artık nitelikli
Şekil 1.6. (a) Bir tepe yamacındaki hazırlıksız yığın liçi, (b) Çukur bir alandaki hazırlıksız yığın liçi (Canbazoğlu ve Girgin, 2001).
malzemelere uygulanmaktadır. Bu yöntemde doygun çözelti kazanma süresi yıl mertebesine çıkabilmekte ve tanelerin en uygun şekilde segregasyona uğraması açısından yığınlardaki eğimin 37° dolaylarında olması tercih edilmektedir (Canbazoğlu ve Girgin, 2001). Hazırlıklı yığın liçi amacıyla Şekil 1.7’ de görüldüğü gibi, 5.000-40.000 ton arasında cevher içeren yığınlar hazırlanabilmekte ve doygun liç çözeltisini kazanma ay mertebesinde olmaktadır.
(a) Çözücü Havuzu Dönüş Çözeltisi Düşük Tenörlü Cevher veya Artık Malzeme Geçirimsiz Tabaka Taze Çözücü Metal Kazanımına Doygun Çözelti Çözücü Çözücü Hava Doygun Çözelti Geçirimsiz Tabaka Düşük Tenörlü Cevher (b)
1.5.3.4. Yerinde liç
Yerinde liç, doğrudan derinde ve yüzeyde oluşmuş düşük tenörlü cevher yataklarında veya terkedilmiş maden ocaklarında gerçekleştirilen bir işlemdir. Yerinde liç uygulaması yapılan yataklarda cevher kütlesinin kil gibi geçirimsiz bir tabaka tarafından çevrelenmiş olması yanında, mineral taneciklerinin çözücü ile iyi ıslanabilmesi için kütlenin yeterince geçirgen olması gerekmektedir. Bu nedenle bir ön hazırlık işlemi olarak çoğu kez klasik veya sıvı patlayıcılar kullanılarak yatakta bir patlatma işlemi yapılarak tane boyutunun küçültülmesi ve kütlenin gevşetilmesi yoluna gidilmektedir. Daha sonra da kütlenin büyüklüğüne göre yeterli sayıda üretim, toplama ve izleme kuyuları açılarak kuyudan kuyuya veya kuyudan madene üretim yöntemleri kullanılarak uygulamaya geçilmektedir. Bu sisteme tipik bir örnek teşkil eden uranyum için kuyudan kuyuya üretim yöntemi Şekil 1.8’de verilmektedir (Canbazoğlu ve Girgin, 2001).
Şekil 1.7. Đnce taneler içeren malzeme için hazırlanmış bir yığın.
Đri Taneli Malzeme Đnce Taneli Malzeme
Çözücü Havuzu
Geçirimsiz Zemin
Enjeksiyon Kuyusu Toplama Kuyusu
Şekil 1.8. Uranyum cevheri için yerinde liç (Canbazoğlu ve Girgin, 2001).
Liç proseslerini, ayrıca yükseltgeyici ortam gerektiren (oksidatif liç prosesleri) ve gerektirmeyen prosesler (non-oksidatif liç prosesleri) olarak iki kısımda incelemek mümkündür (Jackson, 1986). Đki yöntem arasındaki fark, liç edilecek metalin yükseltgen bir reaksiyonla çözeltiye alınıp alınmadığı ile ilgilidir. Bu yöntemleri kısaca inceleyelim.
1.5.4. Yükseltgen olmayan liç prosesleri
Bazı durumlarda malzemeyi çözeltiye alabilmek için yükseltgen koşullar gerekmez. Buna örnek olarak, oksitli bakır cevherlerinin sülfürik asit liçi, boksitin basınç liçi ve mangan dioksitin indirgen liçi verilebilir (Jackson, 1986). Oksitli cevherlerde mangan genellikle +4 değerlikli halde bulunduğu için çözeltiye alınabilmesi için +2 değerlikli hale indirgenmesi gerekmektedir. Liç amacıyla genellikle sülfürik asit kullanımı yoluna gidilmekte ve indirgeyici olarak da SO2 ve Fe(II) tuzları kullanılmaktadır. Bundan başka, özellikle son yıllarda, mangan yanında Cu, Ni, Co, Mo gibi değerli metalleri de içeren derin deniz mangan nodüllerinin NH3, HCl ve H2SO4 kullanılarak değerlendirilmelerine yönelik çok sayıda araştırma yapılmış ve yeni prosesler geliştirilmiştir (Canbazoğlu ve Girgin, 2001).
Uranyum Cevheri
Kumtaşı
Şeyl (Geçirimsiz Tabaka)
Yüzey
Enjeksiyon Kuyusu Enjeksiyon Kuyusu
1.5.5. Yükseltgen liç prosesleri
Oksitleme çoğunlukla ekstraksiyona tabi tutulacak katının reaksiyona giren çözeltiye oranla kararsız duruma getirilmesi için yapılır (Utine, 1988). Yükseltgenme reaksiyonlarında en fazla kullanılan etken oksijen ve demir(III) tuzlarıdır. Bunun yanı sıra, liç proseslerinde kolaylıkla bulunabilen ve pahalı olmayan hava, Cu(II) tuzları, MnO2, Cl2 ve bakteriler gibi maddeler kullanılmaktadır. Çizelge 1.7’de yükseltgeyici ortam gerektiren liç proseslerinde kullanılan yükseltgeyiciler ve proseste etkili olan katodik tepkimeleri verilmektedir.
Çizelge 1.7. Yükseltgeyici ortam gerektiren liç proseslerinde kullanılan yükseltgeyiciler ve proseste etkili olan katodik tepkimeler(Jackson, 1986).
Sistem Katodik Reaksiyon
Oksijenin doğrudan kullanıldığı prosesler
• Altının siyanür liçi
• Bakır ve bakır alaşımlarının liçi
• Uranyum cevherlerinin yerinde ve basınç liçi
• ürlü cevherlerin basınç liçi
O2 + 2H2O + 4 e− 4 OH−
Fe(III) tuzlarının kullanıldığı prosesler
• Uranyum cevherleri
• Fe2(SO4)3 liçi
• FeCl3 kullanılan prosesler
• Bakteri liçi
• Elektro-oksidatif liç
Fe+3 + e− Fe+2
Doğrudan anodik çözünme prosesleri Genellikle metal birikimi CuCl2 kullanılan prosesler Cu+2 + e− Cu+
Klor kullanılan prosesler
Cl2 + 2 e− 2Cl−
Oksijenin doğrudan kullanıldığı proseslerde, normal koşullarda, hava veya oksijen kullanılmaktadır. Bunlara alternatif olarak, çözünmeyi daha da hızlandırmak için, sıcaklık ve basıncın yükseltildiği koşullarda saf oksijen ve hava kullanılır (Jackson, 1986).
Altının siyanürle liçi, altının çözünmesini sağlayan alkali siyanür çözeltileri ile atmosferdeki oksijenin kullanılmasıyla gerçekleştirilen en eski liç proseslerinden biridir. Bu proseste reaksiyon şu şekilde gerçekleşmektedir.
4Au + 8 CN− + O2 + H2O → 4Au(CN)2− + 4OH − (1.7)
Gümüş için de benzer reaksiyon yazılabilir (Jackson, 1986).
Đkincil bakır yataklarında oksijen varlığında sıcak sülfürik asit veya amonyak-amonyum karbonat/oksijen liçi, çoğu kez daha etkili olup, demirin çözünmemesi açısından da daha avantajlıdır. Hava, atmosferik basınçta genellikle 150 g.l-1 (NH4)2CO3 ve 20 g.l-1 NH3 içeren tipik bir çözelti ile kullanılır. Bakır, daha sonra basıncın ve sıcaklığın yükseltildiği bir otoklavda hidrojenle indirgenerek, katı olarak çözeltiden geri kazanılabilir (Jackson, 1986).
Demir(III) tuzlarının kullanıldığı proseslerde; Fe+3 + e → Fe+2 sisteminin standart redoks potansiyeli, + 0.771 V olarak tespit edilmiştir. Bununla birlikte yükseltgenme potansiyeli kompleks olmayan şartlarda ve sıfır iyonik güç için elde edilen teorik bir değerdir (Jackson, 1986).
Bu proseslerde, kullanılan asidin sülfürik veya hidroklorik asit olmasına bağlı olarak, sırasıyla Fe2(SO4)3 ve FeCl3 kullanılmaktadır. Fe+3 iyonlarının yükseltgeyici etkisi yanında kompleks oluşturucu etkisi de bulunmakta ve pek çok mineral, metal ve alaşımlarının çözünmesinde etkili bir görev yapmaktadır. Ancak, ortam pH’sı 2-3 değerlerine yükseldiğinde Fe+3 kolaylıkla hidroliz olduğundan Fe(OH)3 şeklinde çökmesini engellemek için pH’ın denetim altında tutulması gerekmektedir. Halen, asidik Fe2(SO4)3 çözeltileri, liç proseslerinde yaygın bir şekilde kullanılmaktadır.
Yükseltgeyici ortam oluşturmak amacıyla ototrofik aerobik, yani anorganik ve oksijenli ortamda metabolizma olaylarını sürdürebilen bakterilerden de yararlanılmaktadır. Thiobacillus ve ferrobacillus türü bakterilerin, +2 değerlikli demiri +3 değerlikli hale ve sülfürü de sülfata kadar yükseltgeyebilme özellikleri bulunmaktadır. Bu tür mikroorganizmalar metal sülfürlere doğrudan etki ederek çözünmelerini sağlayabildikleri gibi, ortamda mevcut pirit vb. safsızlıklara etki ederek sülfürik asit ve demir(III) sülfat oluşumuna neden olmakta, dolayısı ile de asidik Fe2(SO4)3 liçi koşullarının ortaya çıkmasına neden olmaktadırlar. Bakterilerin üremesi,
sıcaklık ve pH ile çok yakından ilişkilidir. Bakteriyel aktivite için en uygun sıcaklık aralığı 25 - 40 oC olduğu için bakteri liçinden, daha ziyade yığın ve yerinde liç gibi arazide yapılan uygulamalarda yararlanılmaktadır (Biswas ve Dawenport, 1980; Canbazoğlu ve Girgin, 2001).
Liç olayının bir elektrolitik hücrede gerçekleştirilmesi durumunda, yükseltgeyici olarak görev yapan maddenin dışarıdan uygulanan bir potansiyel ile inert bir elektrotta rejenere edilerek tekrar kullanılabilir hale getirilmesine elektro-oksidatif liç denilmektedir. Örneğin, Fe(III) tuzları kullanılan liç proseslerinde, +2 değerlikli hale indirgenen demirin anotta tekrar +3 değerlikli hale yükseltgenmesi bu konuda tipik bir örnek oluşturmakta ve bazı proseslerde bu teknik kısmen uygulanmaktadır. Klor ve hipoklorit gibi bazı yükseltgeyiciler de elektrolitik olarak elde edilerek bazı hidrometalurjik proseslerde kullanılmaktadırlar (Canbazoğlu ve Girgin, 2001).
1.5.6. Liç kinetiğinin ortaya konması
Liç olayı heterojen bir proses olup heterojen faz, sıvı bir liç reaktifi veya reaktif karışımından ve bir katıdan meydana gelir. Liç olayı sırasında katı madde bünyesinde bulunan reaktanların çözünerek sıvı faza taşınması söz konusudur. Bu nedenle, liç prosesleri kinetik açıdan değerlendirilirken, liç işleminde kullanılan katının özelliklerine ve liç şartlarına da bağlı olarak genellikle heterojen faz reaksiyonların değerlendirilmesinde kullanılan kinetik modellere baş vurulur. Burada söz konusu olan katı özelliklerinin başında partikül boyutu ve şekli gelmektedir. Örneğin, çok küçük partiküllerden oluşan bir katının düşük katı/sıvı oranlarında liçi için ortam tamamen homojen bir sıvı gibi kabul edilerek, homojen reaksiyon modellerinin uygulanması mümkündür. Ancak bu durum çoğu zaman aşırı bir basitleştirme olarak kabul edildiğinden, liç prosesleri genellikle heterojen faz reaksiyon modelleriyle açıklanırlar.
Heterojen faz reaksiyonların açıklanması için en yaygın olarak kullanılan iki temel model olup, özellikle liç proseslerinin değerlendirilmesinde bu modellerin kullanımı klasik bir işlem halini almıştır. Söz konusu bu modeller Küçülen Çekirdek Modeli ve Küçülen Partikül Modelleridir. Bazı kaynaklarda bu heterojen faz kinetik modellerden deneysel datanın kolayca uygulanabileceği basit eşitlikler türetilmiştir
(Levensiple, 1974). Akışkan bir reaktan ile katı bir reaktan arasındaki heterojen faz reaksiyon aşağıdaki gibi gösterilebilir.
A(Akışkan) + bB(Katı) → Ürünler (1.8)
Böyle bir reaksiyon meydana gelirken her iki model için zamana bağlı olarak reaksiyonun ilerleme derecesi ve katı partikülün boyutundaki değişmeler Şekil 1.9’da şematize edilmiştir. Şekilden görüldüğü gibi küçülen çekirdek modeli için ilerleyen zamanla, dönüşen reaktan kesri artmakla beraber, partikülün boyutunda bir değişiklik söz konusu değildir. Bu reaksiyon modelinde reaksiyona iştirak eden katı madde bünyesindeki reaktanın yer aldığı çekirdeğin zamanla küçülmesi söz konusuyken, yine katı bünyesinde yer alan reaksiyona girmemiş veya reaksiyon ürünlerinin de yer aldığı bir poroz tabakanın ilerleyen süreyle giderek kalınlaşarak oluşması söz konusudur. Dolayısıyla iki faz arasındaki kütle transferi için iki direncin varlığından söz edilmesi mümkündür. Bunlar dışta oluşan tabaka boyunca akışkan reaktanın difüzyonuna gösterilen direnç ve akışkan ile katı maddedeki reaktanın reaksiyonuna gösterilen dirençtir. Böylece bu iki kademeden en yavaş olarak yürüyeni, reaksiyon kinetiğini belirleyen kademe olacaktır. Bu modelde liçin reaksiyon kontrollü olması durumunda geçerli olan eşitlik:
3 / 1 ) X 1 ( 1 t = − − τ (1.9)
şeklinde olup, burada, t, liç süresi, X ise dönüşüm kesrini (0≤X≤1) veya reaksiyonun ilerleme derecesini gösterir. τ ise dönüşümün tamamlanması için gerekli zamanı temsil etmekte olup aşağıdaki eşitlikle tarif edilmektedir:
Ag s o B C bk R ρ = τ (1.10)
Şekil 1.9. Küçülen çekirdek ve küçülen partikül modellerinin şematik gösterimi (Levensiple, 1974).
Burada da, ρB katı reaktanın molar yoğunluğunu, Ro partikülün başlangıçtaki çapını, b liç reaksiyonu gereği stokiometrik katsayıyı (Eşitlik 1.8), ks reaksiyon hız sabitini ve CAg, akışkan reaktanın ara yüzey konsantrasyonunu göstermektedir.
Küçülen çekirdek modelindeki difüzyon kontrollü durum için önerilen eşitlik ise ) X 1 ( 2 ) X 1 ( 3 1 t = − − 2/3 + − τ (1.11)
şeklinde olup bu durumda τ‘nun değeri,
Akışkan Filmi Partikül Yüzeyi
Reaktanı içeren küçülen çekirdek Kül Tabakası Hareketli Reaksiyon Yüzeyi zaman zaman Küçülen Çekirdek Reaktanı içeren küçülen partikül Akışkan Filmi zaman zaman Küçülen Partikül
Ag e 2 o B C bD 6 R ρ = τ (1.12)
ile verilmektedir. Burada De, etkin difüzyon katsayısını ifade etmektedir.
Şekil 1.9’dan görüldüğü gibi küçülen partikül modelinde ise, ilerleyen reaksiyon zamanına bağlı olarak dönüşen reaktan kesrindeki bir artışın yanında, partikülün boyutunda sürekli olarak bir azalmanın meydana gelmesi söz konusudur. Dolayısıyla buradaki kütle transferi için direnç teşkil edecek iki husus, katı partikülün dış yüzeyinde oluşan akışkan filmi boyunca meydana gelecek difüzyon ve yüzey reaksiyonudur. Burada da liç kinetiğini belirleyen, bu iki kademeden hangisinin daha yavaş olarak yürüdüğüdür. Bu modelde de reaksiyon kontrollü durum için aynı eşitlik geçerli olup, film difüzyonu için geçerli olan eşitlik aşağıdaki gibidir: 3 / 2 ) X 1 ( 1 t = − − τ (1.13)
Burada da τ’nun değeri,
Ag 2 o B bDC 2 R ρ = τ (1.14)
şeklinde ifade edilmektedir. Diğer parametrelerden farklı olarak burada D film difüzyon katsayısını ifade etmektedir. Bu eşitlikleri daha basit hale getirmek için, eşitliklerde yer alan 1/τ ifadeleri yerine, k ile temsil edilen görünür hız sabitleri kullanılmaktadır. Böylece elde edilen deneysel verilerden, liç süresiyle eşitliklerin sağ taraflarının lineer ilişkilerinden faydalanarak hangi modelin daha uygun olduğunun belirlenmesi ve en uygun model için görünür hız sabitlerinin belirlenmesi mümkün olmaktadır. Daha sonra eğer sistem için partikül büyüklüğü, reaksiyon stokiometrisi ve molar yoğunluk gibi parametreler kesin olarak ortaya konulabiliyorsa kullanılan modele göre gerçek hız sabitlerinin veya difüzyon
katsayılarının hesaplanması mümkün olabilmektedir. Ayrıca farklı sıcaklıklarda yapılan liç çalışmalarının sonuçlarının birlikte değerlendirilmesiyle de, liç prosesi için aktivasyon enerjilerinin belirlenmesi de imkan dahilindedir.
Yukarıda bahsedilen heterojen faz reaksiyon modelleri, hidrometalürjik yöntemlerle cevherlerden, konsantrelerden ve artıklardan metallerin ekstraksiyonu amacıyla uygulanan liç çalışmalarına sıklıkla uygulanmıştır. Bu çalışmalar incelendiğinde dikkati çeken en önemli husus yapısında safsızlık içermeyen minerallerin liçi genellikle küçülen partikül modeline uyarken, kompleks yapılı bir cevher, konsantre veya artıkdan seçimli olarak bir mineralin liçinin genellikle küçülen çekirdek modeline uyduğudur. Ayrıca saf minerallerin liçi genellikle yüzey reaksiyonu kontrollü olarak gerçekleşirken, küçülen çekirdek modelinin geçerli olduğu seçimli liç olaylarının ise difüzyon kontrollü olarak gerçekleştiği görülmektedir.
1.6.Liçing Yöntemiyle Zn Üretimi
Eskiden metalik çinko, bakırda olduğu gibi pirometalürjik yöntemlerle üretilirdi. Günümüz dünyasında çoğunlukla kavurma + liçing + elektrokazanım ile üretilmektedir. Yapılan işlemlerde sülfürlü çinko cevherlerinin kavrulması aşamasında SO2 gazı oluşabilmektedir (Eşitlik 1.1). SO2 gazı ileriki aşamalarda sülfürik asit üretiminde kullanılmaktadır. Sülfürik asitin depolama sorunları ve SO2’nin meydana getirdiği çevresel sorunlar nedeniyle bu yönteme alternatif çinko üretim tekniklerinin araştırılmasına hız verilmiştir.
Kavurma işlemine uğramadan direkt olarak liç çalışmaları düşük tenörlü kompleks cevherlere ve konsantrelere kolaylıkla uygulanabilmektedir (Corriou, 1988). Direkt liç ile sülfürlü çinko cevherlerinden (ZnS gibi) çinko çözeltiye alınabilmektedir. Direkt liç yüksek oksijen basıncında veya atmosfer basıncı altında yapılabilmektedir (Takala, 1999).
Çinko üretiminde sülfürlü çinko konsantresinin atmosferik şartlarda direkt liçi yeni bir teknoloji olup çözünme mekanizmaları araştırılmaktadır.
1.6.1. Ferrik iyonları etkisinde çinko liçi
Ferrik iyonları kaynağı olarak ferrik sülfat (Fe2(SO4)3) ve ferrik klorür (FeCl3.6H2O) genellikle kullanılmaktadır. Ferrik iyonların çok kolay bir şekilde hidroliz olmaları nedeniyle çözelti asidik olmalıdır. Şekil 1.10’da Fe+3 iyonlarının Eh- pH diyagramı görülmektedir.
Şekil 1.10. 25 °C ve 1 atm basınç altında Fe-H2O-CO2 sistemi için Eh-pH diyagramı (Pourbaix, 1961).
Şekil 1.10’ dan görüleceği gibi düşük pH’ larda Fe+3 iyon halinde kalabilmekte, yaklaşık pH = 3’den sonra hidrolize uğrayıp Fe(OH)3 oluşturup çözeltide çökmektedir. Bu istenmeyen durumu engelleyebilmek için çözelti güçlü bir şekilde asitlendirilmelidir. Fe+3 varlığında sfalerit aşağıdaki reaksiyon uyarınca çözünmektedir (Au-Yeung ve Bolton, 1986);
Sülfürlerin oksitleyici koşullarda çözünmesi elektrokimyasal süreç olup ferrik iyonları konsantreyi absorblamakta ve yükseltgenme – indirgenme reaksiyonları oluşmaktadır.
Anodik reaksiyon : ZnS Zn+2 + 2e- + So Katodik reaksiyon : 2Fe+3 + 2e- 2Fe+2
0.5O2 + 2H+ + 2e- H2O
Sfalerit liçinde demir, atmosferdeki oksijen ile mineral arasında aracı gibi davranır ve liçing işleminde önemli bir katalizör rolü oynar. Eşitlik (1.15)’e göre oluşan Fe+2 ise aşağıdaki reaksiyon uyarınca tekrar Fe+3’e dönüşmektedir (Holmes, 2000);
4Fe+2 + 4H+ + O2 4Fe+3 + 2H2O (1.16)
Bu reaksiyon hızı sıcaklık ve basınç arttıkça artmaktadır. Reaksiyon hızı [Fe+2]’e göre 2. dereceden, oksijen basıncına göre 1. derecedendir (Verbaan, 1986). Atmosferik şartlarda sfaleritin ferrik iyonları ile liçinde en önemli sorunlardan birisi jarosit adındaki kompleks bileşiklerdir. Sülfatlı ortamda jarosit oluşumu hızlanmaktadır. Oluşan jarosit 90 – 100 °C derecelerde ve pH = 1-2.5 arasında çökelebilmektedir. Çökelme sırasında çözünmüş iyonların bir kısmı jarositle beraber çökebilir. Kayıplar nadiren %3’ü geçmektedir. Çökelme aşamasında metal kaybı sıralaması Fe+3>Cu+2>Zn+2>Co+2>Ni+2>Mn+2>Cd+2 şeklinde verilebilir (Arauco ve Doyle, 1986; Knuutila, 1985).
Jarosit oluşum reaksiyonu aşağıdaki şekilde yazılabilir;
3Fe2(SO4)3 + Me2SO4 + 12H2O = Me2Fe6(SO4)4(OH)12 + 6H2SO4 (1.17) Buradaki Me; Na+, K+, Rb+, Ag+, NH4+, Ti+ ve H3O olabilir veya;
3Fe2(SO4)3 + MeSO4 + 12H2O = MeFe6(SO4)4(OH)12 + 6H2SO4 (1.18) Buradaki Me; Pb+2 ve Hg+2 olabilir.
Liç sonrası jarosit oluşumu çözeltideki demirin bir miktarını ortamdan uzaklaştırması nedeniyle olumlu olarak görülebilir. Aynı zamanda jarosit oluşumunu çinkonun elektrokazanımı sırasında hiçbir olumsuz etkisi olmamaktadır (Fugleberg, 1999).
1.6.2. Sfaleritin asit liçi
Sfalerit liçinde sülfürik (H2SO4), hidroklorik (HCl) ve nitrik asit (HNO3) kullanılabilmektedir. Çeşitli asit ortamlarında sfaleritin çözünme reaksiyonları aşağıdaki gibi verilebilir;
Sülfürik asit (H2SO4) (Forward ve Veltman, 1959; Parker, 1961; Demopoulos ve Baldwin, 1999) :
ZnS + H2SO4 + 1/2O2 ZnSO4 + So + H2O (1.19)
Hidroklorik asit (HCl) (Mizoguchi ve Habashi, 1981; Majima ve ark., 1981) :
ZnS + 2HCl + 1/2O2 ZnCl2 + So + H2O (1.20)
Nitrik asit (HNO3) (Çopur, 2001) :
3ZnS + 8HNO3 3Zn(NO3)2 + 3S° + 2NO + 4H2O (1.21)
Düşük derişimde asit kullanıldığında çözünme hızı yavaş gerçekleşmektedir. Bu nedenle yüksek derişimli asit kullanılması çinko çözünmesini artırmaktadır (Majima ve ark., 1981).
Cevher veya konsantre içinde bir miktar demirin bulunması asit liçinde önemlidir. Sülfürlü cevherlerde demir sülfürlü mineraller bulunabilmektedir. Demir kısmen sfalerit ((Fe,Zn)S) halinde bulunabilirken, aynı zamanda bünyesinde pirit (FeS2) ve pirotin (FeS – Fe7S8) olarak bulunabilmektedir (Knuutila, 1985). Sülfürlü cevherlerden elde edilen çinko konsantreleri bünyesinde yaklaşık %10 demir bulunmaktadır. Bu demirin büyük bir kısmı pirit ve pirotinden geldiği gibi çok az bir kısmı bünyede bulunabilen kalkopirit (CuFeS2)’den kaynaklanmaktadır. 170 ° C’ den küçük sıcaklıklarda oksijen basıncı altında sülfürik asit liçinde pirit kolaylıkla
çözünmezken aynı şartlarda pirotin çok kolay bir şekilde çözünebilmektedir. Eşitlik (1.15) ve (1.16) uyarınca (demir varlığında) asitli ortamda sfaleritin çözünürlüğü artırılabilir (Bobeck ve Su, 1985; Crundwell, 1988).
1.6.3. Sfaleritin amonyak liçi
Amonyaklı ortamda çoğu elementler amonyakla kompleks oluştururlar. Bakır bunlardan en çok bilinenidir. Çinko da, bakırda olduğu gibi amonyakla kompleks oluşturabilmektedir. Amonyak (NH3), sulu ortamda aşağıdaki tepkimeyi verir;
NH3 + H2O NH4+ + OH- K25°C = 1.78x10-5 (1.22)
Eşitlik (1.22)’de görüldüğü gibi amonyak sulu ortamın pH’ ını artırmaktadır. Oksijenin varlığında amonyak, bazı elementleri çözüp kompleks oluşturmaktadır. Amonyaklı ortamda sfalerit oksijen varlığında aşağıdaki reaksiyon uyarınca çözünmektedir;
ZnS + 4NH3 + 2O2 Zn(NH3)4SO4 (1.23)
Buradaki oksijen, ortamda çözünmüş oksijendir.
Amonyak liçinde pH dengesini (tamponunu) sağlamak amacıyla amonyum sülfat veya amonyum karbonatın çözeltiye eklenmesi gerekmektedir.
2. MATERYAL VE METOT
2.1. Materyal
Çalışmalarda Sivas-Koyulhisar yöresinde üretilen Cu-Pb-Zn kompleks cevherlerinden flotasyon yöntemiyle elde edilmiş ZnS konsantresi kullanılmıştır. Yaklaşık olarak 10 kg konsantre Selçuk Üniversitesi Maden Mühendisliği Bölümü laboratuvarına getirilmiştir. Getirilen numune, numune alma kurallarına uygun olarak azaltılmış yaklaşık 1250 g numune çalışmalar için ayrılmıştır.
Ayrılan numune 212, 106, 75, 45, 38 µm’lik eleklerden yaş olarak elenerek fraksiyonlarına ayrılmıştır. Her bir fraksiyonun kimyasal analizleri yapılarak Zn içerikleri belirlenmiştir. Kimyasal analizler yine ilgili bölüm laboratuarında bulunan SensAAModel (GBC), Atomic Absorpsion cihazında yapılmıştır. Her bir fraksiyona ait Zn değerleri Çizelge 2.1`de verilmiştir.
Çizelge 2.1. Sfalerit konsantresinin her bir fraksiyonuna ait Zn değerleri. Element (%) Tane Boyutu (µm) Zn -212 + 106 39,4 -106 + 75 42,1 -75 + 45 41,4 -45 + 38 36,2 -38 42,8 Cevher konsantresi 44,4
2.2. Metot
Çalışmalarda, asidik ortamda (H2SO4), potasyum dikromatın (K2Cr2O7), sfaleritin çözündürülmesine olan etkisi araştırılmıştır. Çalışmalarda kullanılan potasyum dikromat % 99,95 K2Cr2O7 saflığındadır. Yine çalışmalarda kullanılan sülfirik asitin saflığı % 98`dir. Deneyler 1 lt hacimdeki beherlerde 500 ml çözelti kullanılarak, hassasiyeti ±0,2 °C olan sıcak su banyosunda gerçekleştirilmiştir. Karıştırma işlemi için Heidolph RZR 2021 marka karıştırma hızı ayarlanabilen dijital göstergeli bir mekanik karıştırıcı kullanılmıştır. Karıştırma işleminde çözeltinin kontaminasyonunu engellemek için teflon kaplı bir şaft kullanılmıştır. Özellikle sıcaklık deneylerinde çözelti buharlaşmasından kaynaklanan hacim azalmasını engellemek amacı ile içi soğuk su dolu, iç bükey bir yoğunlaştırıcı düzenek kullanılmıştır. Deney düzeneğinin şematik görünümü Şekil 2.1’de verilmiştir.
Şekil 2.1. Çalışmalarda kullanılan deney düzeneğinin şematik gösterimi.
Uygun potasyum dikromat ve sülfürik asit derişimlerinde hazırlanan 500 ml çözelti, uygun sıcaklığa ayarlanmış sıcak su banyosuna konularak deney öncesi çözeltinin çalışma sıcaklığına gelmesi sağlanmıştır. Deneyler kesintisiz olarak
yapılmıştır. Önceden belirlenen süreler sonunda sistem durdurulmuş ve sistemden 1 ml çözelti alınmıştır. Alınan çözelti 100 ml hacmindeki balon jojelere konulmuştur. Balon jojelerin üzeri, saf suyla tamamlanıp hemen AAS`de okunmuştur. Çözünme verimleri sistemdeki hacim azalmasını dikkate alan Papangelakis ve Demopolous (1991) tarafından geliştirilen Eşitlik (2.1) yardımı ile hesaplanmıştır.
100 ) 100 / ( 1 1 , , 1 1 , x c m C v C v V X M i i i M i M i i i i M i
∑
∑
− = − = + − = (2.1) Burada;XM,i : Ortamdan alınan i. numune için Cu verimi (%) V: Çözeltinin başlangıç hacmi (L)
vi : Çözeltiden alınan i. numunenin miktarı (L)
CM,i : Çözeltiden alınan i. numunedeki Cu derişimi (mg/L) m : Liç deneyinde kullanılan konsantre miktarı (mg)
CM : Liç deneyinde kullanılan konsantre içindeki Cu tenörü (%)
Bu tez çalışmasında, karıştırma hızı, sülfürik asit derişimi, potasyum dikromat derişimi, sıcaklık ve tane boyutunun çinko çözünmesine etkisi araştırılmıştır.
3. BULGULAR
3.1. Karıştırma Hızının Çinko Çözünmesine Etkisi
Karıştırma hızının etkisini araştırmak amacıyla deneylerde, 0,5 M H2SO4, 0,1 M K2Cr2O7 derişiminde, 50˚C sıcaklığında, 1/500 g/ml katı/sıvı oranında ve -75 + 45µm tane boyutunda konsantre kullanılmıştır. Deneyler; 200, 400 ve 600 dev/dak karıştırma hızlarında gerçekleştirilmiştir. Elde edilen sonuçlar Çizelge 3.1 de ve Şekil 3.1 de verilmiştir.
Çizelge 3.1. Karıştırma hızının çinko çözünmesine etkisi.
Zn Çözünme Verimi (%) Süre
(dakika) 200 dev/dak 400 dev/dak 600 dev/dak
0 0 0 0 15 4,83 2,41 2,41 30 7,25 12,08 7,25 45 9,66 14,49 9,66 60 14,49 19,32 14,49 90 21,74 28,99 25,23 120 26,57 33,82 31,55 150 33,82 43,48 39,68 180 41,06 48,31 46,91
0 10 20 30 40 50 60 0 50 100 150 200 Süre (dk) Z n Ç ö z ü n m e V e ri m i (% ) 200 rpm 400 rpm 600 rpm
Şekil 3.1. Karıştırma hızının çinko çözünmesine etkisi.
Çizelge 3.1 ve Şekil 3.1`den görüleceği üzere;
Karıştırma hızı 200-400 rpm aralığında arttıkça, çinko çözünme hızı artmıştır. Örneğin 180 dakikalık bir liç işlemi sonucu 200 rpm karıştırma hızında çinko çözünme verimi % 41 iken 400 rpm`de bu deger % 48`lere ulaşmıştır. 400 rpm`den büyük karıştırma hızlarında çinko çözünme hızında 400 rpm`e göre kayda değer bir yükselme görülmemiştir.
Bu nedenle diğer parametrelerin incelenmesinde 400 dev/dak karıştırma hızı seçilmiştir.
3.2. Sıcaklığın Çinko Çözünmesine Etkisi
Sıcaklığın çinko çözünmesine etkisini araştırmak amacı ile 400 dev/dak karıştırma hızında, -75 + 45 µm tane boyutunda, 1 M H2SO4, 0,1 M K2Cr2O7 derişiminde ve 1/500 g/ml katı/sıvı oranında; 50, 60, 70, 80 ve 95 °C sıcaklıklarda deneyler yapılmıştır. Elde edilen sonuçlar Çizelge 3.2 ve Şekil 3.2’de verilmiştir.
Çizelge 3.2. Sıcaklığın çinko çözünmesine etkisi 0 10 20 30 40 50 60 70 80 90 100 0 50 100 150 200 250 Süre (dk) Z n Ç ö z ü n m e V e ri m i (% ) 50 ˚C 60 ˚C 70 ˚C 80 ˚C 95 ˚C
Şekil 3.2. Sıcaklığın çinko çözünmesine etkisi.
Zn Çözünme verimi, (%) Süre (dakika) 50 ˚C 60 ˚C 70 ˚C 80 ˚C 95 °C 0 0 0 0 0 0 15 7,25 9,66 12,08 33,82 68,98 30 16,91 24,15 24,15 55,56 88,21 45 24,15 36,23 33,82 77,30 100 60 21,74 41,06 43,48 89,37 100 90 41,06 62,80 62,80 100 100 120 48,31 70,05 79,71 100 100 150 60,39 75,31 95,68 100 100 180 62,80 88,37 98,78 100 100 210 74,88 94,20 100 100 100 240 80,28 100 100 100 100
Çizelge 3.2 ve Şekil 3.2’den anlaşılacağı üzere sıcaklık arttıkça çinko çözümü verimi de artmaktadır. Örneğin 45 dakikalık bir liç işlemi sonunda 50 ˚C`de çinko çözünme verimi % 24 `ler de iken, 80 ˚C de bu değer % 77`lere ulaşmıştır. 95 ˚C`de 45 dakikanın sonunda çözünme verimi % 100`dür. Sfaleritin çözünme hızını sorunsuz bir şekilde belirleyebilmek için çözünmenin istikrarlı bir şekilde zamana yayıldığı 70 ˚C, diğer parametrelerin incelenmesi için seçilmiştir.
3.3. Potasyum Dikromat Derişiminin Çinko Çözünmesine Etkisi
Potasyum dikromat derişiminin etkisini araştırmak amacı ile 1 M H2SO4 derişiminde, 70 °C sıcaklıkta, -75 + 45 µm tane boyutunda, 400 dev/dak karıştırma hızında ve 1/500 g/ml katı/sıvı oranındaki sabit şartlarda deneyler yapılmıştır. Deneyler, 0,01 M, 0,025 M, 0,05 M, 0,1 M ve 0,15 M K2Cr2O7 derişimlerinde gerçekleştirilmiştir. Elde edilen sonuçlar Çizelge 3.3 ve Şekil 3.3’de verilmiştir.
Çizelge 3.3. Potasyum dikromat derişiminin çinko çözünmesine etkisi.
Zn Çözünme verimi, (%) Süre (dakika) 0,01 M 0,025 M 0,05 M 0,1 M 0,15 M 0 0 0 0 0 0 15 7,44 8,92 8,33 12,08 25,08 30 18,76 22,51 16,10 24,15 43,11 45 28,20 33,84 27,86 33,82 60,68 60 34,97 41,96 41,30 43,48 68,68 90 48,18 57,81 60,39 62,80 85,15 120 60,95 70,13 76,27 79,71 93,48 150 70,38 81,46 87,25 95,68 96,73 180 78,71 88,44 92,25 98,78 99,03 210 83,15 93,25 98,47 100,00 100
0 10 20 30 40 50 60 70 80 90 100 0 50 100 150 200 250 Süre (dk) Z n Ç ö z ü n m e V e ri m i (% ) 0,01 M 0,025 M 0,05 M 0,1 M 0,15 M
Şekil 3.3. Potasyum dikromat derişiminin çinko çözünmesine etkisi
Çizelge 3.3 ve Şekil 3.3 incelendiğinde, potasyum dikromat derişimi arttıkça çinko çözünme hızıda artmaktadır. Örneğin 120 dakikalık bir liç işlemi sonucunda 0,01 M K2Cr2O7 derişiminde ki çinko çözünme verimi % 61 iken, 0,15 M K2Cr2O7 derişiminde bu deger % 100`e ulaşmıştır. Sfaleritin çözünme hızını belirlemek için istikrarlı bir şekilde çözünmenin sürdüğü 0,1 M K2Cr2O7 derişimi diğer parametrelerin incelenmesi için seçilmiştir.
3.4. Sülfürik Asit Derişiminin Çinko Çözünmesine Etkisi
Sülfürik asit derişiminin etkisini araştırmak amacı ile 0,1 M K2Cr2O7 derişiminde, 70 °C sıcaklığında, 1/500 g/ml katı/sıvı oranında, 400 dev/dak karıştırma hızında ve -75 + 45 µm tane boyutunda konsantre kullanılarak deneyler gerçekleştirilmiştir. 0,5 M, 1 M, 2 M ve 4 M H2SO4 derişimlerinde deneyler yapılmıştır. Elde edilen sonuçlar Çizelge 3.4 ve Şekil 3.4`de verilmiştir
Çizelge 3.4. Sülfürik asit derişiminin çinko çözünmesine etkisi 0 10 20 30 40 50 60 70 80 90 100 0 50 100 150 200 250 300 Süre (dk) Z n Ç ö z ü n m e V e ri m i (% ) 0,5 M 1 M 2 M 4 M
Şekil 3.4. Sülfürik asit derişiminin çinko çözünmesine etkisi. Zn Çözünme verimi, (%) Süre (dakika) 0,5 M 1 M 2 M 4 M 0 0 0 0 0 15 13,04 12,08 11,84 33,33 30 23,19 24,15 31,64 59,42 45 35,75 33,82 50,97 76,57 60 45,89 43,48 65,22 92,27 90 62,08 62,80 82,67 99,9 120 73,19 79,71 95,23 100 150 84,78 95,68 99,25 100 180 91,79 98,78 100 100 210 93,48 100,00 100 100 240 99,27 100 100 100
Çizelge 3.4 ve Şekil 3.4 incelendiğinde asit derişimi arttıkça çinko çözünme hızıda artmaktadır. Örneğin 90 dakikalık bir liç işlemi sonucunda 0,5 M H2SO4 derişimi çinko çözünmesi % 62 iken 4 M H2SO4 de bu oran % 100`e ulaşmaktadır. Potasyum dikromatın asitik ortamda yükseltgeme potansiyeli asit derişimi arttıkça artması buna neden olarak söylenebilir. Ancak 0,5 M-1 M H2SO4 derişimi aralığında ilk 90 dakika için belirgin bir fark görülmemektedir. Diğer parametrelerin incelenmesinde 4 M H2SO4 derişimi seçilmiştir.
3.5. Tane Boyutunun Çinko Çözünmesine Etkisi
Tane boyutunun çinko çözünmesine etkisinin incelenmesi amacıyla -212 + 106, -106 + 75, -75 + 45, -45 + 38, -38 µm tane boyut fraksiyonlarında ve fraksiyonlarına ayrılmamış konsantrede, 400 dev/dak karıştırma hızında, 4 M H2SO4 ve 0,1 M K2Cr2O7 derişiminde, 1/500 katı sıvı oranında ve 70 °C sıcaklığında deneyler yapılmıştır. Elde edilen sonuçlar Çizelge 3.5 ve Şekil 3.5 de verilmiştir.
Çizelge 3.5. Tane boyutunun çinko çözünmesine etkisi.
Zn Çözünme Verimi (%) Süre (dakika) -212 + 106 (µm) -106 + 75 (µm) -75 + 45 (µm) -45 + 38 (µm) -38 (µm) Fraksiyonlarına ayrılmamış konsantre 0 0 0 0 0 0 0 15 34,26 31,83 33,33 89,50 100 55,45 30 53,30 55,11 59,42 100 100 65,68 45 68,02 71,97 76,57 100 100 77,5 60 82,23 89,07 92,27 100 100 89,77 90 97,97 100 99,9 100 100 95,0 120 100 100 100 100 100 97,95 150 100 100 100 100 100 99,0 180 100 100 100 100 100 99,0 210 100 100 100 100 100 99,55 240 100 100 100 100 100 100
0 10 20 30 40 50 60 70 80 90 100 0 50 100 150 200 250 300 Süre (dk) Z n Ç ö z ü n m e V e ri m i (% ) -212 + 106 (µm) -106 + 75 (µm) -75 + 45 (µm) -45 + 38 (µm) -38 (µm) Cevher Konsantresi
Şekil 3.5. Tane boyutunun çinko çözünmesine etkisi.
Çizelge 3.5 ve Şekil 3.5 incelendiğinde anlaşılacağı üzere tane boyutuna bağlı olarak çinko çözünmesi ters orantılı olarak artmaktadır. Yani tane boyutu küçüldükçe çinko çözünmesi artmaktadır. -38 µm tane boyutunda çözünme verimi ilk 15 dakika için % 100 lere ulaşmaktadır. Yine aynı süre içinde -45+38 µm tane boyutu da %89 çinko çözünmesine ulaşırken , -212+106 µm tane boyutunda bu değer % 34 civarındadır. Bunun nedeni birim ağırlığa düşen sfalerit yüzey alanının tane boyutu küçüldükçe artmasıdır.
Fraksiyonlarına ayrılmamış konsantre üzerinde yapılan deneylerde liçing süresine bağlı olarak sfalerit çözünmesinde bir artış gözlenmiştir. 150 dakikalık bir liç işlemi sonucunda çözünme verimi %99`lara ulaşmıştır.