KAJU FISTIĞINDAN (Anacardium occidentale) LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE
KARAKTERİZASYONU Gülnur KALKAN Yüksek Lisans Tezi Biyokimya Anabilim Dalı
KAJU FISTIĞINDAN (Anacardium occidentale) LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE KARAKTERİZASYONU
Gülnur KALKAN
Dumlupınar Üniversitesi
Lisansüstü Eğitim Öğretim ve Sınav Yönetmeliği Uyarınca Fen Bilimleri Enstitüsü Biyokimya Anabilim Dalında
YÜKSEK LİSANS TEZİ Olarak Hazırlanmıştır.
Danışman: Prof. Dr. Metin BÜLBÜL
KABUL VE ONAY SAYFASI
Gülnur KALKAN’ın YÜKSEK LİSANS tezi olarak hazırladığı KAJU FISTIĞINDAN (Anacardium occidentale) LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE KARAKTERİZASYONUbaşlıklı bu çalışma, jürimizce Dumlupınar Üniversitesi LisansüstüEğitim Öğretim ve Sınav Yönetmeliğinin ilgili maddeleri uyarınca değerlendirilerek kabuledilmiştir.
29/09/2017
Üye : Prof. Dr. Metin BÜLBÜL (Danışman)
Üye : Yrd. Doç. Dr. Derya Koyuncu Zeybek
Üye : Yrd. Doç. Dr. Zerrin Pat
Fen Bilimleri Enstitüsün Yönetim Kurulu'nun .../…../2016 gün ve ... sayılı kararıyla onaylanmıştır.
Prof. Dr. Hasan GÖÇMEZ Fen Bilimleri Enstitüsü Müdürü
Fen Bilimleri Enstitüsün Yönetim Kurulu'nun .../…../2017 gün ve ... sayılı kararıyla onaylanmıştır.
Prof. Dr. Hasan GÖÇMEZ Fen Bilimleri Enstitüsü Müdürü
ETİK İLKE VE KURALLARA UYGUNLUK BEYANI
Bu tezin hazırlanmasında Akademik kurallara riayet ettiğimizi, özgün bir çalışma olduğunu ve yapılan tez çalışmasının bilimsel etik ilke ve kurallara uygun olduğunu, çalışma kapsamında teze ait olmayan veriler için kaynak gösterildiğini ve kaynaklar dizininde belirtildiğini, Yüksek Öğretim Kurulu tarafından kullanılmak üzere önerilen ve Dumlupınar Üniversitesi tarafından kullanılan İntihal Programı ile tarandığını ve benzerlik oranının %28 çıktığını beyan ederiz. Aykırı bir durum ortaya çıktığı takdirde tüm hukuki sonuçlara razı olduğumuzu taahhüt ederiz.
KAJU FISTIĞINDAN (Anacardium occidentale) LİPAZ ENZİMİNİN SAFLAŞTIRILMASI VE KARAKTERİZASYONU
Gülnur KALKAN
Biyokimya, Yüksek Lisans Tezi, 2017 Tez Danışmanı: Prof. Dr. Metin BÜLBÜL
ÖZET
Lipazlar, su-yağ ara yüzeyinde gerçekleşen trigliseridlerin hidroliz reaksiyonunda katalizör olarak görev alan enzimlerdir. Organik yapıların sentezi, ilaç Ar-Ge departmanlarında, deterjan üretim proseslerinde, peynir üretiminde ve süt ürünleri endüstrisi gibi geniş bir yelpazeye sahip biyoteknolojik uygulamalarda kullanılmaktadır. Bu çalışmada kaju fıstığından lipaz enziminin saf olarak eldesi ve karakterizasyon işlemleri yapılmıştır. Bu çalışmada sanayi alanlarında kullanımı oldukça yaygın olan lipaz enzimi kaynaklarına yeni bir alternatif oluşturacak, kaju fıstığından lipaz enziminin saflaştırılması amaçlanmıştır. Kaju fıstığından lipaz enzimi saflaştırması sırasında ilk basamak olarak; kaju fıstığı proteinlerinin yağsızlaştırılması ile başlanmış, yağsızlaştırma işleminden sonra amonyum sülfat çöktürmesi, enzimi saf olarak elde edebilmek adına jel filtrasyon kromotagrafisi metodları kullanılarak kaju fıstığı lipazının saf olarak eldesi gerçekleştirilmiştir.
Saflaştırma basamaklarında Bradford metodu kullanılarak protein tayini yapılmış ve titrimetrik analiz yöntemi kullanılarak lipaz enziminin aktivite ölçümleri ve spesifik aktivite hesaplamaları yapılmıştır. Yapılan ölçüm ve analizler sonucunda kaju fıstığı lipazının 66,45 kat saflaştırıldığı bulunmuştur. Kaju fıstığı lipazının karakterizasyon işlemleri SDS-PAGE ile yapılmıştır. Enzimin optimum şartları belirlenmiş ve bu şartlar altında enzimin maksimum düzeyde depo kararlılığı belirlenmiştir. Saflaştırılan lipaz enziminin en yüksek aktiviteyi pH 6,8 ve 60°C derece sıcaklıkta gösterdiği tespit edilmiştir. Ayrıca enzimin stabil olarak kaldığı pH ve sıcaklık değeri ölçümlerinde stabil pH’ı 6,8 stabil sıcaklığının 40°C derece olduğu belirlenmiştir. Depo kararlılığını belirlemek amacıyla, on gün süreyle aktivite ölçümleri yapılmıştır. Enzim aktivitesinin on günün sonunda 4°C’de korunduğu gözlenmiştir. Substrat olarak triolein kullanılarak kaju fıstığı lipazının Km ve Vmax değerleri hesaplanmıştır. Yapılan hesaplamalar sonucunda Km= 0,3355 mM ve Vmax= 0,936 U/dk. mg enzim olarak hesaplanmıştır.
PURIFICATION AND CHARACTERIZATION OP LIPASE ENZYME FROM CASHEW NUTS (Anacardium occidentale)
Gülnur KALKAN Biochemistry, M.S. Thesis, 2017 Thesis Supervisor: Prof. Dr. Metin BÜLBÜL
SUMMARY
Lipases are enzymes that act as catalysts in the hydrolysis reaction of triglycerides occurring at the water-oil interface. The synthesis of organic structures is used in biotechnological applications with a wide range of pharmaceutical R&D departments, detergent production processes, cheese production and dairy industry. In this study, pure enzyme and characterization of lipase enzyme were carried out from cashew nuts. The aim of this work is to purify lipase enzyme from cashew nuts, which will be a new alternative to sources of lipase enzymes, which are very common in industrial fields. The purification of the lipase enzyme from the kaju pulp was first initiated by the degumming of the kaju peanut proteins and the purification of the ammonium sulphate after the degreasing was carried out purely by using the gel filtration chromatography methods to obtain the enzyme pure.
Protein determination was carried out using the Bradford method in purification steps and activity measurements of lipase enzyme and specific activity calculations were made using titrimetric analysis method. As a result of the measurements and analyzes made, cashew nuts lipase was found to be purified 66,45 times. Characterization of cashew peanut lipase was performed by SDS-PAGE. The optimum conditions of the enzyme were determined and the maximum storage stability of the enzyme was determined under these conditions.
The purified lipase enzyme has been found to exhibit the highest activity at pH 6.8 and 60 ° C. In addition, pH and temperature of the enzyme were found to be stabilized. Stable pH was 6.8 and stability temperature was 40 ° C. Activity measurements were made for ten days in order to determine warehouse stability. Enzyme activity was observed to be maintained at 4 ° C after ten days' operation. The Km and Vmax values of cashew lipase were calculated using triolein as substrate. As a result of calculations made, Km = 0.3355 mM and Vmax = 0.936 U / min. Mg enzyme.
TEŞEKKÜR
Yüksek lisans eğitimim boyunca bilgi ve tecrübelerinden yararlandığım, tez konumun seçilmesinde, hazırlanmasında ve tüm aşamalarında maddi-manevi büyük ilgi ve desteğini gördüğüm tez danışmanım değerli hocam Sayın Prof. Dr. Metin BÜLBÜL’e,
Çalışmalarım sırasında bilgi ve tecrübelerini esirgemeyen, her konuda sabırla yardımcı olan Dumlupınar Üniversitesi Biyokimya Bölümü Arş. Gör. Ekrem TUNCA’ya,
Laboratuvar çalışmalarım ve geçen 6 sene boyunca her zaman desteğini hissettiğim, bana her konuda yardımcı ve yanımda olan sevgili eşim, hayat arkadaşım Mustafa TIRANCIOĞLU’na,
Tüm hayatım boyunca her türlü maddi ve manevi desteği benden esirgemeyen, her zaman yanımda olan ve olacaklarını bildiğim canım annem Gülfer KALKAN, sevgili kardeşim Öznur KALKAN ve canım babam Namık Kemal KALKAN’a,
İÇİNDEKİLER Sayfa ÖZET ... v SUMMARY ... vi ŞEKİLLER DİZİNİ ... x ÇİZELGELER DİZİNİ ... xi
SİMGELER VE KISALTMALAR DİZİNİ ... xii
1. GİRİŞ ... 1
1.1. Kaju Fıstığı ... 2
2. ENZİMLER ... 3
2.1. Enzimlerde Aktivasyon Enerjisi Tanımı... 4
2.2. Enzimlerde Kinetik Ve Enzim Kinetiğini Etkileyen Durumlar ... 4
2.2.1. Enzimlerde konsantrasyon etkisi... 4
2.2.2. Substrat konsantrasyonunun etkisi ... 5
2.2.3. Sıcaklığın etkisi ... 5
2.2.4. Ortam pH'sındaki değişimler ... 5
2.2.5. Ortamdaki su miktarının etkisi ... 5
2.2.6. İnhibitörlerin tanımı ve etkisi (engelleyiciler) ... 5
2.2.7. Aktivatörlerin etkisi (aktifleştiriciler) ... 6
2.2.8. Km, Vmax değerlerinin hesabı ve önemi ... 6
3. LİPAZLAR ... 8
4. MATERYAL VE METOT ... 10
4.1. Materyal ... 10
4.1.1. Lipaz eldesi sırasında kullanılan kimyasal materyaller... 10
4.1.2. Lipaz eldesi sırasında ihtiyaç duyulan alet ve cihazlar ... 10
4.1.3. Lipaz eldesi sırasında kullanılan çözeltilerin hazırlığı ...11
4.2. Metotlar ... 12
4.2.1. Lipaz aktivitesi ve tayin yöntemleri ... 12
4.2.2. Bradford yöntemi ile kantitatif protein tayininin yapılması ... 12
4.2.3. Homojenatın hazırlanması ... 13
4.2.4. Amonyum sülfat çöktürmesi çalışmaları ... 13
4.2.5. Sephadex® jelin hazırlanması... 14
4.2.6. Saf olarak elde edilen proteinlerin SDS-PAGE karakterizasyonu ... 14
4.2.7. Optimum pH çalışmaları ... 14
İÇİNDEKİLER (devam)
Sayfa
4.2.9. Stabil-pH çalışmaları... 14
4.2.10. Stabil-sıcaklık çalışmaları ... 14
4.2.11. Depo kararlılığı tayini ... 15
4.2.12. Km ile Vmax değerlerinin belirlenmesi ... 15
5. SONUÇ VE TARTIŞMA ... 16
5.1. Sonuç ... 16
5.1.1. Kaju lipazının hidrolitik aktivitesinin belirlenmesi ... 16
5.1.2. Kaju lipazının saflaştırma işlem basamakları ... 16
5.1.3. Kaju fıstığı lipazının optimum pH’nın belirlenmesi ... 17
5.1.4. Kaju fıstığı lipazının optimum sıcaklığın belirlenmesi ... 18
5.1.5. Kaju lipazı için depo kararlılığı değerleri ... 19
5.1.6. Lipaz enzimi için Km ve Vmax değerleri ... 20
5.1.7. Kaju fıstığı lipazının stabil pH aktivitesinin belirlenmesi ... 21
5.1.8. Kaju fıstığı lipazının stabil sıcaklığının belirlenmesi ... 22
5.1.9. SDS-PAGE kullanılarak lipaz enziminin karakterizasyonu ... 23
5.2. Tartışma ... 24
ŞEKİLLER DİZİNİ
Şekil Sayfa
5. 1. pH’ın kaju fıstığı lipazına etkisi. ... 18
5. 2 Sıcaklığın kaju fıstığı lipazına etkisi. ... 19
5. 3. Kaju fıstığı lipazının depo kararlılığı. ... 20
5. 4. Kaju fıstığı lipazının Michaelis-Menten grafği. ... 21
5. 5. Kaju fıstığı lipazının Lineweaver-Burk grafiği. ... 21
5. 6. Kaju fıstığı lipazının stabil pH aktivitesi. ... 22
5. 7. Kaju Fıstığının lipazının stabil sıcaklık aktivitesi. ... 23
ÇİZELGELER DİZİNİ
Çizelge Sayfa
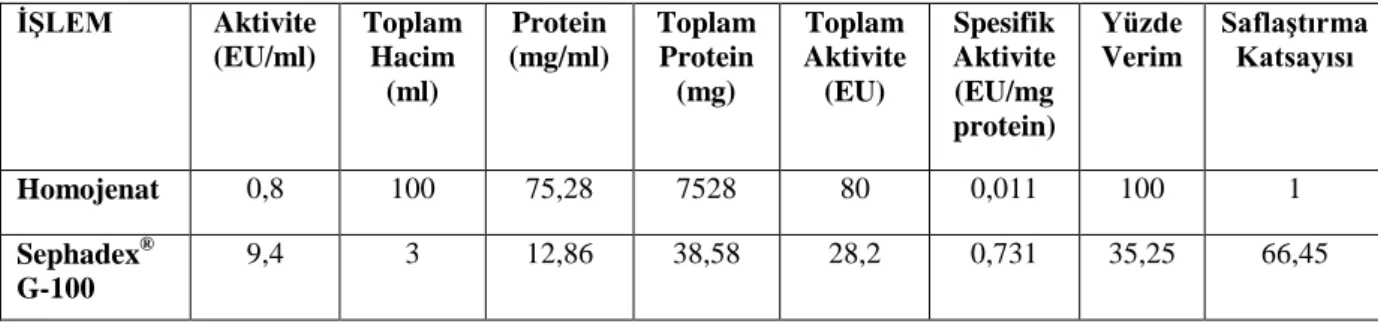
5.1. Kaju lipazının saflaştırma işlemleri sırasında aktivite değişimi. ... 16
5.2. Kaju fıstığı lipazının saflaştırma işlemleri ... 16
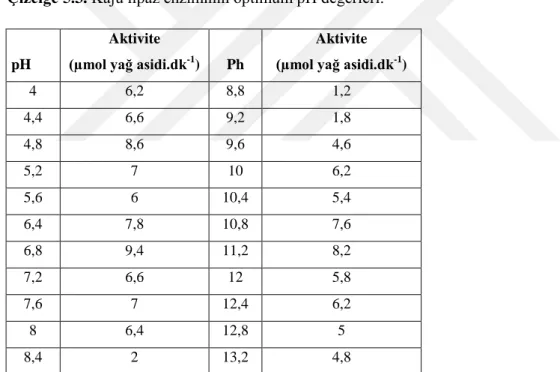
5.3. Kaju lipaz enziminin optimum pH değerleri. ... 17
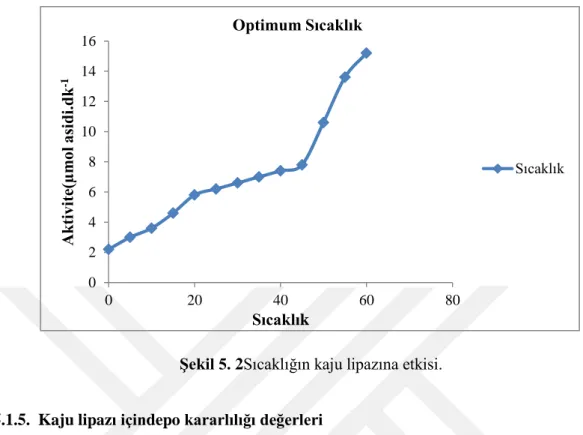
5.4. Kaju lipazının optimum sıcaklık sonuçları... 18
5.5. Kaju lipazı depo kararlılığı... 19
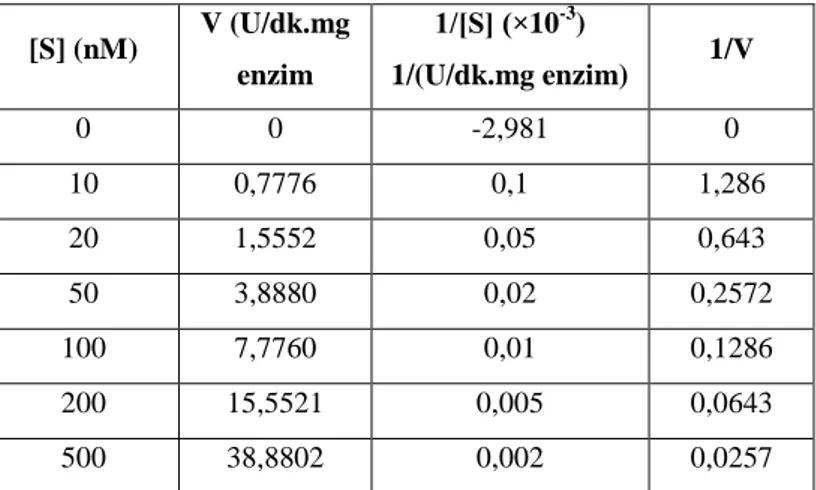
5.6. Kaju lipaz enzimi için değişik substrat konsantrasyonlarında enzim aktiviteleri. ... 20
5.7. Kaju lipazının stabil pH aktivitesi. ... 22
SİMGELER VE KISALTMALAR DİZİNİ
Simgeler Açıklamalar
Km Michealis Menten sabiti
Vmax Doygun substrat konsantrasyonunda enzimin ulaşabileceği max hız
mg miligram mL mililitre mM milimolar nm nanometre dk dakika μg mikrogram
1. GİRİŞ
Enzimler; tanımları incelendiğinde son yıllarda sıklıkla yapıları gereği, biyoaktivitelerin devamını sağlayan, kimyasal olarak yürüyen tepkimelerin reaksiyon hızlarının artmasına yardımcı olan, tepkimede tüketilmeden kalan ve tepkime sonunda incelendiğinde yapısında herhangi bir değişiklik olmayan, reaksiyonlarda birçok defa kullanılabilen biyolojik katalizörler olarak tanımlanmaktadır (Yıldız, 2007). Son yıllarda pek çok sanayi kollarında uygulamaları bulunan enzimlerin, gün geçtikçe yeni kullanım alanları üzerinde yapılan çalışmalar giderek artmaktadır(Telefoncu, 1986). Ticari anlamda birçok alanda kullanılan enzimler,özellikle de mikrobiyal yapılı ve bitkisel kaynaklı olanlar geniş kullanım alanlarından dolayı birçok çalışmada yer almaktadır. Katalizör olarak görev aldıkları reaksiyonlarda enzimler, kimyasal metotlara göre daha düşük maliyetli ve reaksiyon gerçekleşme yönelimi basit tarafta yer almaktadır. Enzimler başlıca beslenme sektörü, eczacılık, deterjan üretimi, tekstil ve kozmetik alanları olmak üzere pek çok sanayi alanında kullanımları yaygınlaşmıştır. Endüstriyel enzim pazarında büyük paya sahip olan hidrolitik enzimler içinde yer alan lipazlar, anahtar enzimler olarak ortaya çıkmakta ve endüstriyel uygulamalarda yüksek oranda kullanılmaktadırlar (Jaeger, vd., 1994; Pandey, vd., 1999).
Hücrelerde çok önemli metabolik görevleri olan enzimler günlük hayata da kullanım ihtiyaçlarından dolayı girmiştirler(Wiseman, 1987). Enzimlerle katalizlenen ve tepkimeye katılan kimyasal moleküller substrat olarak tanımlanır. Bir enzim sadece kendi aktif bölgesinin üç boyutlu yapısına uygun substrat ile tepkimeye girebilir. Bu sebeple her enzim yapısına uygun olan, literatürde anahtar kilit olarak tanımlanan sadece belirli tip substrata etki ederler(Erkaya vd., 2006). Her enzim için aktivite değerinin maksimum olduğu pH değeri bulunmaktadır. Bu pH seviyesinin üzerinde ve altında aktivite değerinde azalma meydana gelir. Bu durum göz önünde bulundurulduğunda bütün enzimlerin pH – aktivite eğrileri benzerlik göstermez(Bhat, 2000).
Enzimler hücrelerin iç yapılarında meydana gelen birçok tepkimenin hızlarını ve spesifikliğini düzenlerler. Hücrenin dış ortamında da etkinliklerini korudukları bilinmektedir. Bakıldığında çok ağır şartlarda gerçekleşebilecek tepkimelerin enzimler sayesinde daha basit ve hızlı gerçekleşmesi sağlanır. Bu zor reaksiyonlara örnek olarak; organik maddelerin yapımı ve yıkımı, sindirim olayı, kas kasılması, hücre solunumu, çeşitli metabolizma reaksiyonları verilebilir.
Bugüne kadar ki çalışmalarda 2000’den fazla enzim çeşidi belirtilmiş ve bunlar arasında yaklaşık 100 çeşidi ticari anlamda kullanılabilir olduğu tespit edilmiştir. Sanayide ise bu sayının
sadece 18 çeşidi endüstriyel amaçlı olarak üretilmektedir (Zeman ve Mccrea, 1985). Sektörel alanda kullanılan enzimlerin %59’unu proteazlar, %28’ini karbohidrazlar, %3’ünü lipazlar ve %10’unu ise diğer enzimler oluşturmaktadır.
1.1.Kaju Fıstığı
Kaju fıstığı; Uzakdoğu Asya kökenli bir çeşit fıstık olup kaju fıstığı, kaju meyvesinin çekirdek kısmını oluşturur. Fıstık sonrasında meyvesinden ayrılarak toplanır. Kaju ağacı Brezilya, Afrika ve Hindistan’da çoğunluk olarak yetiştirilir. Kaju fıstığı lezzetli tadının yanında besleyici, vücüdu güçlendirme ve hastalıklardan koruma özellikleri olan bir çerezdir. İçinde kalsiyum, fosfor, betakaroten, riboflavin gibi vücudumuz için çok yararlı maddeler vardır. En önemlisi de kaju fıstığı yağlar bakımından çok zengin bir meyvedir. İçerisinde bulunan yağların çoğunluğu doymamış yağlardan oluşur.
Kaju fıstığı yüksek miktarda yağ içerir. 100 gr kaju fıstığında 47 gr yağ bulunmaktadır. Yağ oranının yüksek olması lipaz değerleri açısından önem teşkil etmektedir.
2. ENZİMLER
Enzimler yaşayan hücreler tarafından sentezlenen, in vitro olarak da faaliyet gösteren ve biyokimyasal reaksiyonları özgüllükle katalize eden, özel yapılı protein molekülleri olarak bilinmektedirler. Katalitik RNA moleküllerinin birkaçı dışındaki enzimler protein yapısında bulunurlar. Enzimlerin nüfus ettiği madde karışımı substrat olarak tanımlanır. Elde edilen maddeye de ürün adı verilir (McAuliffe vd., 2007).
Canlılık olayları enzimlerin mükemmel uyumlulukları etkisiyle düzenlenmekte ve yaşam bu şekilde sürdürülebilinmektedir. Enzimler fazlasıyla katalitik aktiviteye sahiptirler. Örneğin; karbonik anhidraz enzimi dakikada 36 milyon molekülün yapısında farklılığa neden olmaktadır. Enzimler etki ettiği substratlarına karşı oldukça özgül davranmakta ve bir molekülün yalnızca belirli bir kısmını etkileyerek bu kısımdan bir veya birkaç atomu veya yapıda bulunan fonksiyonel bir grubu almakta veya ilave etmektedir (Yıldız, 2007).
Enzim substrat uyumluluğunun sağlık sektöründe hastalıkların teşhisinde yardımcı rol oynaması, etkilerinin oldukça yüksek olması nedeniyle de reaktif görevi çok değerli yapılar olarak bilinirler. Enzimlerin endüstriyel alanlarda kullanımı da oldukça geniş bir yelpazeye sahiptir. Enzim teknolojisi, sürdürülebilir endüstriyel kalkınmanın önemli bir bileşeni olarak Ekonomik İşbirliği ve Kalkınma Örgütü (OECD) tarafından tanınan, disiplinlerarası bir alandır (Van Beilen ve Li, 2002). Enzimler hücre içi yapılardan ziyade günlük hayatta da etkin olarak kullanılmaktadır. Ekmek, bira yapılması, peynir yapılması vb. besinlerin üretiminden başlayarak, temizlik alanında, biyolojik savaşlarda bile yer almaktadır. Enzimlerin kullanıldığı bu geniş yelpazede yiyecek endüstrisi %32’lik pay ile kullanım alanları pastasında büyük bir dilime sahiptir (McAuliffe vd., 2007). Kullanımı geniş bir yelpazede yer alan enzimlerin son yıllarda önem kazanan üyelerinden birisi de lipaz enzimidir. Lipaz enzimleri hem hayvansal hem de bitkisel kaynaklı yapılardan elde edilebilmektedir. Özellikle bitkisel kaynaklı olan yapılardan elde edilmesi hem kolay hem de ucuz olarak nitelendirilir. Bitkisel kaynaklı lipazların, özellikle yağlı bitkilerde oranca fazla bulunması ve bu durumun elde edilmesini kolaylaştırması, ülkemizde yetişen birçok yağlı bitki tohumlarının da önemini arttırmaktadır. Dünya üzerinde yetiştirilen, birçok bitkinin meyve kısmı ve çoğunlukla tohumlarının değişik oranlarda yağ içerdiği bilinmektedir. Bu bitkilerin başında; soya, ayçiçeği, palm, kolza, kaju fıstığı, pamuk, yerfıstığı, Hindistan cevizi, hardal tohumu ve zeytin gelmektedir. Bu konuya ülkemiz açısından bakıldığında yağlı tohumlu bitkiler grubuna ülkemizde de yetişen yağlık ayçiçeği, soya, susam, yerfıstığı, haşhaş, hardal tohumu, kanola, aspir, keten-kenevir ve pamuk çiğidi girmektedir. Bu bitkilere ait tohum veya meyveler, işlenerek ham yağ elde edilmektedir.
Bu bitkisel kaynaklı yapılardan elde edilen enzimlerin etkinliği, çeşitli şekillerde ölçülen aktivasyon enerjileri buna bağlı olarak hesaplanan kinetik bilgileri ve enzimlerin etkinliklerini etkileyen çeşitli faktörler günümüzde hala bilimsel araştırma konularının çoğunluğunu oluşturmaktadırlar (Van Beilen ve Li, 2009).
2.1.EnzimlerdeAktivasyon Enerjisi Tanımı
Moleküllerin aralarında reaksiyon oluşabilmesi için dışarıdan enerjiye ihtiyaçları bulunmaktadır. Bütün kimyasal olarak gerçekleşen tepkimelerde aktivasyon enerjisi olarak adlandırılan enerji seviyesinin aşılması gerekmektedir. Reaksiyon hızına etki edip hızı belirleyen en önemli faktör aktivasyon enerjisi (E) denilen bu enerji ihtiyacının büyüklüğüdür. Aşınması gereken enerji seviyesi ne kadar yukarda olursa birim zaman içerisinde bu seviyeyi aşan moleküllerin sayısı da o oranda az olacaktır. Reaksiyon hızında olumlu yönde bir gelişme sağlayıp hızın arttırılması için sisteme kimyasal veya biyolojik bir katalizör ilave edilebilir. Bu durumda katalizör substrat ile (ES) kompleks yaparak aktivasyon enerjisini aşağılara çekebilir (Wiseman, 1987).
(ES) kompleksinin oluşması ile daha çok substrat aktivasyon enerji engelini aşabilmekte, reaksiyon hızı artmakta ve birim zamanda oluşan ürün miktarı çoğalmaktadır. Reaksiyon bitiminde serbest kalan enzim ortamdaki diğer substrat molekülleriyle birleşerek onların da aktivasyon enerjilerini düşürecek ve onların da ürüne dönüşümünü hızlandıracaktır. Bu duruma bir genelleme yapıcak olursak aktivasyon enerjisi düşük tepkimelerin hızları yüksek olmaktadır (McAuliffe vd., 2007).
2.2. Enzimlerde Kinetik Ve Enzim Kinetiğini Etkileyen Durumlar
Enzimler tarafından katalize edilen reaksiyonların hızlarını ve bu hızları etkileyen faktörlerin sistematik çalışmasının incelenmesine enzim kinetiği denir. Reaksiyonların hızını etkileyen etmenler arasında pH, ısı, ışık ve diğer fiziksel faktörler, enzim konsatrasyonu, substrat konsantrasyonu, zaman, reaksiyon ürünleri, ortamda çeşitli iyonların varlığı, hormonların ve diğer biyokimyasal faktörlerin etkisi sayılabilir.
2.2.1.Enzimlerde konsantrasyon etkisi
Ortamda yeterli miktarda substrat var ise; reaksiyonun hızı, enzim konsantrasyonu ile doğru orantılı olarak artar.
2.2.2.Substrat konsantrasyonunun etkisi
Ortamda yeterli oranda enzim bulunduğunda, substrat miktarını artırmaya devam ettiğimiz takdirde belirli zaman sonra reaksiyonun hızı sabitleşir. Bunun sebebi ise ortamda bulunan enzimlerin tümü substratlarla reaksiyona girmiş olur (Keha ve Küfrevioğlu, 2000). 2.2.3.Sıcaklığın etkisi
Enzim reaksiyonları incelendiğinde vücut sıcaklığı değerlerine yakın değerlerde hızlıdır. Sıcaklığın azalması reaksiyonun hızını yavaşlatır lakin, enzimlerin yapısına etki etmez. Sıcaklık değerleri arttıkça reaksiyonların hızlarında da artış, sıcaklığın belli bir seviyeyi aşmasından itibaren ise (60-70 0C), enzimlerin yapısını bozulacağından reaksiyon durur. Bu nedenle enzimler yapısı gereği protein yapısında olduğundan yüksek sıcaklıklara büyük bir çoğunluğu dayanamazlar (Nelson ve Cox, 2005).
2.2.4.Ortam pH'sındaki değişimler
Bütün enzimlerin en iyi aktivite verdiği bir pH aralığı vardır. Bu aralık değerleri çoğunlukla nötr'e yakın olan değerlerdir. Ancak asidik olan veya bazik olan ortamlarda aktivite gösteren enzimler de vardır. Örneğin; pepsin enzimi incelenmiş ve en iyi çalıştığı pH 1,2 olarak belirtilmiştir (Nelson ve Cox, 2005). Düşük ve yüksek pH değerleri enzimlerin çalışmasını aktivitelerini göstermelerini engeller.
2.2.5.Ortamdaki su miktarının etkisi
Enzimler sulu ortamda etki gösterip, genellikle su miktarının belli bir miktarın altında olduğu ortamlarda çalışmazlar. Buna reçel ve pekmez oluşumu örnek verilebilir. Bal ve pekmezin sulandırınca ekşimelerinin nedeni enzimlerin aktifleşmesinden ileri gelir (Alan, W., 1991).
2.2.6.İnhibitörlerin tanımı ve etkisi (engelleyiciler)
Enzim reaksiyonlarının hızlarını düşüren veya aktivite göstermelerini engelleyen maddelere inhibitör denir, gerçekleşen bu olayada inhibisyon adı verilir (Keha ve Küfrevioğlu, 2000). Substratlara yapı olarak oldukça benzerlik gösteren bu maddeler enzimlerle yapı olarak bir araya gelip enzimi etkisiz kılarlar. Bazı inhibitörler incelendiği zaman, enzimlerle birleşirler ve enzimin parçalanmasına sebebiyet verirler. Antibiyotiklerin vücuttaki etki mekanizmasına bakıldığı zaman bu düzene göre çalıştıkları gözlenir. Bazı materyaller ise, enzimin substratının yapısını veya aktif maddesinin yapısını bozar. Bunlara örnek olarak bazı ilaçlar(antibiyotikler), çeşitli zehirleri (akrep, arı zehiri, arsenik), zirai ilaçlar ve ağır metaller verilebilir.
2.2.7.Aktivatörlerin etkisi (aktifleştiriciler)
Enzimatik olarak yürüyen reaksiyonların hızlarını arttıran maddelere "aktivatör" denir. Aktivite etkinliğine etki eden; mangan, nikel, klor ve magnezyum iyonları enzimlerin bu etkinliğini yükseltirler. Bazı aktifleştiriciler, enzimin substratı ile bir araya gelmesini kolay hale getirirken, bazıları enzimin aktif yüzeyini güçlendirerek daha fazla aktif hale getirir ve reaksiyon hızını yükseltirler. Yani aktivatörler enzim aktivitesini yükselten inorganik veya organik maddelerdir (H2S,KCN ve sistein gibi)(McAuliffe vd., 2007).
2.2.8.Km, Vmax değerlerinin hesabı ve önemi
Leonor Michaelis ve Maud Menten, enzimli reaksyonların ilk basamağında bir ES kompleksi oluşumundan ve doygunluk özelliğinden hareket ederek bir model geliştirdiler.
Km (Michaelis-Menten Sabiti) : En yüksek hız (Vmax) ,değerinin ½’sine ulaşmak için gereken substrat miktarıdır.
Km değerini net olarak bulabilmek için farklı konsantrasyonlarda substrat kullanılmalıdır.
Km , bir enzime ve substratına özgüldür.
Km’i düşük olan bir enzim, substratına yüksek ilgi (affinite) gösterir.
Km = mol/L birimine sahiptir.
Genellikle enzimler için değerler 10-3 – 10-5 mol/L arasında değişir.
Geri dönüşümlü olarak sabit bir hızla(k1) substratla [S] bir araya gelen enzim [E], ilk olarak enzim-substrat [ES] kompleksini meydana getirir.
[ES] kompleksi daha sonra 2 farklı halde şekillenebilir: 1. Sabit bir hızla (k2) tekrardan E ve S’a dönüşür.
2. Yada k3 sabit hızıyla ürün [Ü] oluşurken enzim de serbestleşir ve ilk yapısına dönüşür. ES oluşum hızı = k1[E][S] ES yıkılım hızı = (k2 +k3) [ES]
k
1k
2k
3 E + S ES E + PReaksiyon hızı ile substrat yoğunluğu arasındaki ilişkiyi tanımlayan Michaelis-Menten denklemi yazılırken aşağıdaki varsayımlar göz önüne alınmıştır:
1.Substrat konsantrasyonu [S], enzim konsantrasyonun [E]’dan çok daha fazladır. Böylece belirli bir zamanda enzime bağlı olan substrat miktarı ihmal edilebilir.
2.Reaksiyonun denge durumunda ES kompleksinin oluşma ve yıkılma hızları biribirine eşittir (Bhat, 2000).
3.LİPAZLAR
Lipazlar, pek çok uygulamada yer alan ve endüstriyel anlamda oldukça önemli seviyelerde potansiyeli olan hidrolitik bir enzimdir. Lipazlar, Uluslararası Biyokimya Birliği Enzim Komitesi’nce belirtilen enzim sınıflandırmasında
Hidrolazlar,
Ester bağları parçalayıcılar,
Karboksilikester hidrolazlar ve
Triaçilgliserol hidrolazlar içinde yer almaktadır (Aydogmus Öztürk, 2006).
Genel olarak lipaz enzimleri triaçilgliserollerin sulu ortamda di ve mono-açilgliserollere, serbest yağ asitlerine ve gliserole hidroliz olmasını sağlayan enzimlerdir. Lipaz enziminin katalizör olarak görev aldığı bu reaksiyonlar genelde tersinirdir (Singh vd., 2012; İşbakan, 2006). Bununla birlikte, lipaz enzimleri esterleşme, transesterleşme, interesterleşme, aminoliz, asidoliz ve alkoliz reaksiyonlarında da katalizör görevi görmektedirler (Sangeetha, vd., 2011).
Lipazlar, yağlar ve yağ asidi esterlerinin su etkisiyle parçalanmasını sağlayan enzimlerdir. Enzim, birbiri içinde çözünmeyen yağ-su geçiş fazında katalizi meydana getirir ve enzim reaksiyonunun hızı, reaksiyon sonunda var olan yüzey alanı ile doğrudan ilişkilidir. Lipaz enzimleri yağ asitlerinin zincir uzunluğu, yağların ve yağ asitlerinin doygunluk derecesi, yağ asidinin duruşsal pozisyonu ve bulunan substrat’ın fiziksel durumuna uygun spesifik özellik gösterir. Yağ asitlerinin zincir uzunluğuna bağlı olarak 4-10 C atomlu yağ asitleri daha uzun C zincirli yapıda olan yağ asitlerinden daha hızlı bir şekilde hidroliz olayına uğrarlar. Yağın yapısından ayrılır ve serbest duruma geçerler (Abbas, vd., 2002). Enzimlerin kullanım alanlarının genişliği bakımından bakıldığında, beslenme endüstrisinde yer alan enzimlerden yağları parçalayan enzimlerin aktivitesi, süt endüstrisinde özellikle çok öneme sahiptir. Yüksek yağ parçalama miktarı çeşitli peynirlerin üretiminde zorunlu bulunmaktadır. Peynir üretiminde kullanılan reninin içinde lipaz enzimleri de mevcuttur. Lipaz enzimleri tereyağına aroma kazandırmada, çikolata endüstrisinde, kremalarda, karamellerde kullanılmaktadır. Lipazlar gıda sektöründe, biyomedikal alanlarda, biyosensörler, deterjan, deri sanayinde, kozmetik ve parfüm sanayinde uygulama olanakları bulmaktadır (Hiol, vd., 2000).
Ayrıca lipaz enzimlerinin, besinlerde çürümeye sebep olan psikotrof organizmaların üzerindeki etkisi ve bunun kontrolünde kullanılabilirliği konusunda birçok araştırma yapılmaktadır (Öztürk, 2002; Pandey, vd., 1999). Son zamanlarda biyoteknoloji açısından
bakıldığında lipaz enzimlerinin kullanımı yüksek oranda olan artış görülmektedir. Kıyafetlerimizin kirlenmesini sağlayan maddelerin başında protein yapılar, yağlar ve nişasta gibi maddeler gelir. Bu kirleri yüksek sıcaklık değerlerinde kimyasal bazlı deterjanlar kullanılarak çıkarmak mümkün olsa da, enzimler kullanılarak düşük sıcaklık değerlerinde ve mekanik anlamda daha az enerji kullanılarak gereken temizliğin yapılmasını sağlar. Ayrıca çimen, kan, süt ve ter tarafından oluşan lekelerin çıkarılmasında da biyolojik olmayan sentetik deterjanlara göre çok daha etkin özellik gösterirler. Deterjan sanayinde kullanılan enzimlerden proteazlar yumurta ve kanın neden olduğu lekelerdeki proteinleri parçalayarak; lipaz enzimleri yağdan oluşan lekeleri, amilaz enzimleri ise nişasta yapılı olan lekeleri çıkartmada etkili olan enzimlerdendir (Topal, Ş., 1985).
4. MATERYAL VE METOT
4.1. Materyal
4.1.1. Lipaz eldesi sırasında kullanılan kimyasal materyaller
Metanol, asetik asit, aseton, amonyum sülfat, gum arabik, sodyumdeoksikolat, NaHCO3 (sodyumhidrojenkarbonat), NaH2PO4.2H2O (sodyumdihidrojenfosfat),Na2HPO4 (sodyumhidrojenfosfat), SDS (sodyumdodesilsülfat), gliserol, Tris (tris(hidroksimetil)aminometan), N,N-metilenbisakrilamit, N,N,Nı,Nı-tetrametiletilendiamin (TEMED), bromfenolblue, glisin, 2-merkaptoetanol, diyaliz torbası (D-95272), Sephadex G-100, Coomassie Brilliant Blue R250, Coomassie Brilliant Blue G250, Sigma-Aldrich, Merck ve Fluka firmalarından tedarik edilmiştir. Çalışmalarda kullanılan kaju fıstığı ve zeytinyağı yerel marketlerden temin edilmiştir.
4.1.2. Lipaz eldesi sırasında ihtiyaç duyulan alet ve cihazlar
Aktivite ölçümlerinin yapılacağı tüplere sabit hacimli enzim çözeltisi almak için kullanılan peristaltik pompa: Ismatec RegloDigital
Aktivite ölçümlerinde kullanılan pH metre: SCHOTT Lab850
Sabit oranda karıştırma yapmak için kullanılan Vortex: Heidolp ReaxTop
Amonyum sülfat çöktürmelerinde çöken proteinleri ayırmak amacıyla kullanılan Soğutmalı Santrifüj: Sigma K30
Aktivite tayinlerinde kullanılan Isıtıcılı Manyetik Karıştırıcı: DAIHAN MSH-20A
Ortam şartlarının sabit tutulması için kullanılan Etüv: BINDER
Tartım işlemlerinde kullanılan analitik Terazi: SHIMADZU ATX220
Protein tayininde kullanılan Spektorofotometre: SHIMADZU UV1700 PharmaSpec
Ortam şartlarını uygun hale getirmek için kullanılan Su Banyosu: DAIHAN WB-11
Karakterizasyon işlemleri için Elektroforez Tankı: HEALTEC MiniGES Elite300, Elektroforez Güç Kaynağı: HEALTEC Elite300
Aktivite işlemlerinde kullanılan Mikropipetler: BIOHIT Proline
Çözeltilerin hazırlanmasında kullanılan Saf Su Cihazı: Merck Millipore
Tohumların homojen hale getirilmesi için kullanılan Öğütücü: IKA A30 ve ortam şartları için kullanılan Buzdolabı: Ev tipi
4.1.3. Lipaz eldesi sırasında kullanılan çözeltilerin hazırlığı
1. 0,1 M pH’ı 7,0 olan fosfat tamponunun hazırlanması için 5,4603 g NaH2PO4.2H2O (sodyumdihidrojenfosfat) tartımı yapıldı, 1,0 M NaOH ile pH 7,0 olarak ayarlandı.
2. 18 g gum arabic tartılarak ve 180 ml deiyonize suda çözüldü. Çözelti üzerine 21 ml zeytinyağı ilave edildi ve manyetik karıştırıcıda karıştırıldı.
3. 0,8 g sodyumdeoksikolat tartımı yapıldı. Tartılan madde 50 ml deiyonize suda manyetik karıştırıcıda karıştırılarak çözüldü.
4. 0,6058 g tris tartılarak pH’ı 1 olan 1M HCl ile pH 7,0 değerine ayarlandı ve 100 ml lik balon joje’ye aktarılarak hacmi tamamlandı.
5. 15,601 g NaH2PO4 tartıldı daha sonra 1,0 M NaOH çözeltisi ile 2000 ml ve pH 7 olarak ayarlandı.
6. pH’ı 8,8 olan 1,0 M Tris HCl’in hazırlanması, 12,114 g tris tartılarak yaklaşık 60 ml suda çözüldü pH’ı 8,8 oluncaya kadar 1,0 M’lık HCl ile son hacim 100 ml olacak şekilde ayarlandı.
7. pH’ı 6,8 olan 1,0 M Tris HCl’in hazırlanması, 12,114 g tris tartılarak yaklaşık 60 ml suda çözüldü pH’ı 8,8 oluncaya kadar 1,0 M’lık HCl ile son hacim 100 ml olacak şekilde ayarlandı. 4°C’de buzdolabında muhafaza edildi.
8. 6X Numune yükleme çözeltisi için; %60 griserol, 300 mM Tris-HCl pH 6,8, 12 mM EDTA, %12 SDS, 864 mmM β-merkaptoetenol ve %0,05 bromofenol blue. 10 ml hazırlamak için; 6 ml griserol, 3 ml1 M Tris-HCl pH 6,8, 0,035 g EDTA 1,2 g SDS, 60 ml β-merkaptoetenol, 0,05 g bromofenol blue karıştırılarak 6X numesi hazırlandı.
9. %40 Akrilamid hazırlanması; son hacmi 50 ml olacak şekilde 19,48 g akrilamid, 0,52 g bis-akrilamid deiyonize suda çözüldü.
10. %10 Amonyum persülfat çözeltisinin hazırlanması; 0,1 g amonyum persülfat, 1 ml deiyonize suda çözüldü.
11. %10’luk SDS; 4 g SDS 40 ml deiyonize suda çözüldü.
12. Renklendirme çözeltisinin hazırlanması için; % 0,1’lik Coomassie Brilliant Blue R250 ve %50’lik metanol ile %10 asetik asit birbiri içine eklendi.
13. Yıkama çözeltisinin hazırlanması için; %10’luk metanol çözeltisi, %7 asetik asit çözeltisi olacak şekilde hazırlanır.
14. 0,1 g NaOH tartıldı, bir miktar suda çözüldükten sonra hacmi 250 ml’ye yükseltildi. 4.2. Metotlar
4.2.1. Lipaz aktivitesi ve tayin yöntemleri
Enzim aktivite tayininde birçok metot kullanılmaktadır. Aktivite ölçümleri yapılırken genellikle ortamda tükenen substrat miktarı ya da ortaya çıkan ürün miktarı tayini yapılarak enzimlerin aktivite ölçümleri yapılır. Enzim aktivite ölçümlerinde tayin metodunu seçerken seçilecek metodun pratik olması ve kısa sürede yapılabilmesi, ayrıca hassas olmasına dikkat edilmelidir (Özata ve Türe, 2009). Serbest yağ asitlerinin oluşumunu araştırmak amacıyla kalitatif olarak jel difüzyon analizleri ve kantitatif olarak titrimetrik analiz, kalorimetrik analiz, floresans, kromatografik prosedürler ve immünolojik metotlar kullanılmaktadır (Reymond, vd., 2009).
Bu çalışmada homojenatla amonyum sülfat çöktürmesi işlemlerinin ardından hazırlanmış olan %10’luk gum arabic çözeltisinden 10 ml, sodyumdesikolat çözeltisinden 2 ml ve TRİS tamponun’dan 4 ml eklenerek manyetik karıştırıcıda karıştırıldı. Reaksiyon ortamı bu şekilde tamamlandıktan sonra sıcaklık 37°C ‘ye sabitlendi ve pH değeri 7,0’ye ayarlandı. Üzerine 1 ml enzim ilave edildikten sonra yağların parçalanması ile oluşan yağ asitleri sayesinde 5 dakika süre ile pH’ın düşmesi beklendi. Sürenin tamamlanmasının ardından 0,01 M NaOH kullanılarak pH 7,0’ye ayarlandı ve kullanılan NaOH miktarı kaydedildi.
4.2.2. Bradford yöntemi ile kantitatif protein tayininin yapılması
Bradfort yöntemi ile jel filtrasyon kromatografısinden yararlanılarak saflaştırılan enzim çözeltisinde ve homojenatta protein tayini yapılmıştır. İzlenen yöntem, Coomassie Brillant Blue G-250'nin fosforik asitli ortamda gerçekleşen reaksiyonu sonucunda proteinlere bağlanması esasına dayanmaktadır. Oluşan kompleks, maksimum değerini 595 nm’de göstermektedir. Proteine boyanın bağlanması yaklaşık 2 dakika gibi kısa bir sürede çok hızlı gelişir ve bu yöntemin hassaslık değeri 1-100 μg arasındadır (Bradford, 1976).
Tayin işlemleri sırasında; 1 mL sinde 1 mg protein bulunduran standart olan sığır albümin çözeltisinden tüplere 10-100 μL arasında sırasıyla onar onar alındı ve saf su kullanılarak tüm tüplerin hacmi 0,1 mL olacak şekilde tamamlandı. 5 mL coomassie brillant blue G-250 reaktifi tüplere eklendi ve vorteks ile karıştırıldı.
10 dakika sonra 595 nm de 3 mL lik küvetlerde köre karşı absorbansı okundu. Kör numune olarak 0,1 mL benzer tampon ve 5 mL Coomassie Brillant Blue G-250 reaktifinden elde edilen karışım kullanıldı. Absorbans sonuçlarına karşılık gelen mikrogram protein standart grafik halinde verildi.
4.2.3. Homojenatın hazırlanması
Bu çalışmayı yaparken kaju fıstığı proteinlerini yağlarından ayrıştırmak amacıyla yağsızlaştırma işlemi uygulandı. Kaju fıstığı için en uygun çözücülerden biri olan aseton yardımı ile yağından arındırıldı. Asetonun kullanılmasında ki en büyük neden ise aktiviteyi en az şekilde etkilemesi, zarar vermemesi ve yağlarından arındırılarak kullanılan materyallerin çalışmaları incelendiğinde bir çok araştırmada da, en iyi çözme özelliği gösteren çözücülerden biri olmasıdır. Kaju fıstığı yağının saflaştırılması için şu işlemler yapılmıştır.
50 gr öğütülmüş kaju fıstığı üzerine 150 ml soğuk aseton (4°C) eklendi ve 40 dakika buz banyosunda karıştırıcı ile karıştırıldı. Daha sonra süzgeç kağıdı ile süzüldü. Homojenat 25°C’ de bir gece bekletildi. Yağsızlaştırılmış kaju fıstığı 0,1 M pH 7,0 olan 350 ml fosfat tamponu (NaH2PO4.2H2O) içinde 1 gece +4°C buzdolabında manyetik karıştırıcı kullanılarak karıştırıldı. Bir gece dolapta bekletilmiş kaju fıstığı süzgeç kağıdı ile süzüldü ve katı kısmı atıldı. Homojenat 20,000 rpm’de santrifüjlenerek, süpernatant olan kısmı amonyum sülfat çöktürmesi yapmak amacı ile ayrıldı.
4.2.4. Amonyum sülfat çöktürmesi çalışmaları
Proteinlerin çöktürülmesi amacıyla yapılan amonyum sülfat çöktürmesi işlemi için ham ekstratın 120 ml’si kullanıldı. Uygun olan doygunluk noktasının tespiti için %0-10, %10-20, %20-30, %30-40, %40-50, %50-60, %60-70, %70-80 ve %80-90 doygunluklarında çöktürme işlemleri uygulanmıştır. Ham ekstrakt içerisine katı amonyum sülfat azar azar küçük miktarlar halinde ve buz banyosu içerisinde ilave edildi. Katı amonyum sülfat, çözelti içerisine eklenirken bir önceki ilave edilen tuzun tamamen çözünmesine dikkat edildi. Tuz ilavesi işlemi yaklaşık 2 saat boyunca sürdü. Her doygunluk basamağından sonra 20,000 rpm’de 4°C’de 15 dakika santrifüj işlemi uygulandı. Her aralık için kullanılacak katı (NH4)2SO4 miktarı hesaplandı. Bütün çöktürme kademelerinde protein ve aktivite tayini işlemleri yapıldı ve hidrolitik spesifik aktivite hesaplamaları gerçekleştirildi. Bu işlemin sonucunda en yüksek hidrolitik spesifik aktivitenin%40 amonyum sülfat doygunluğunda olduğu belirlendi. Elde edilen süpernatant çözeltisi protein ve aktivite tayinlerinde kullanıldı.
4.2.5. Sephadex® jelin hazırlanması
2 g Sephadex G-100 tartımı yapıldı ve 100 ml, 0,1M pH 7,0 fosfat tamponu içerisine yerleştirilerek 24 saat bekletildi tampon içerisindeki jel daha sonra kolona aktarıldı. Aktarılan jelin kolonda iyice dengelenmesi için hazırlanan tampon çözelti, peristaltik pompa yardımıyla kolondan geçirildi. Kolon içerisindeki jelin iyice dengeye geldiğine karar verildikten sonra, enzim çözeltisi kolona yavaşça yüklendi enzim geçirilirken üstten fosfat tamponu ilave edilerek eluatların kolondan 3’erml’lik franksiyonlar olarak tüplere toplanması sağlandı.
4.2.6. Saf olarak elde edilen proteinlerin SDS-PAGE karakterizasyonu
%12’lik ayrıştırma jeli üzerine %3,75’lik yığma jeli ilave edildi. Alınan numune örnekleri kuyuya yüklendi ve 100V’da yaklaşık 2 saat 10 dk yürütüldü. Kuyulardan bir tanesi marker ile dolduruldu. Böylece enzimin molekül ağırlığı belirlendi. Renklendirme için; %0,1 Coomassie Brilliant Blue R250 çözeltisi hazırlandı. Yıkama için; %10’luk metanol ve %7’lik asetik asitin yer aldığı renksizlendirme çözeltisi hazırlandı. Jelin tamamen temizlendiğine karar verilene kadar yıkamalar tekrarlandı.
4.2.7. Optimum pH çalışmaları
Enzimin en iyi aktivite değerlerine sahip pH verilerini tespit etmek amacı ile pH4,0-13,2 arasında aktivite ölçümleri yapıldı ve lipazın en iyi aktivite sonucu verdiği pH tespit edildi. 4.2.8. Optimum sıcaklık çalışmaları
Enzimin en iyi aktivite değerlerine sahip sıcaklığın tespiti için 0, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60°C’lerde 13 ayrı deney yapıldı. Deneylerin sonucunda en iyi hidrolitik aktivitenin gözlendiği sıcaklık belirlendi.
4.2.9. Stabil-pH çalışmaları
Enzimin aktivite değerinin maksimum olduğu stabil pH değerlerini belirlemek amacı ile, pH 5,6-7,6 arasındaki 0,1M sodyumhidrojenfosfat tamponu hazırlanmıştır. Bu tamponların her birinde enzim aktivitesinin ölçümleri yapılarak kaju fıstığı lipazının stabil olarak kaldığı pH belirlendi.
4.2.10. Stabil-sıcaklık çalışmaları
Enzimin en iyi aktivite değerlerine sahip stabil sıcaklığın tespiti için 4, 20, 30, 40, 50, 60°C sıcaklıklarda altı ayrı deneysel inceleme yapıldı. Bu incelemelerin sonucunda en iyi aktivitenin belirlendiği stabil sıcaklık değeri belirlendi.
4.2.11. Depo kararlılığının tayini
Jel filtrasyon kromatografisinden sonra oluşan enzim, on gün boyunca 4°C’de buzdolabında saklandı. Saklanan numunenin her gün aktivite tayini yapıldı. Böylece enzimin aktivitesinin korunduğu süre tespit edildi.
4.2.12. Km ile Vmax değerlerinin belirlenmesi
Enzim kullanılan reaksiyonların hızlarının maximum hızın ½’sine eşit olduğu noktadaki substrat konsantrasyon değerine Km denir ve Km sabit bir değer değildir. Km pH’a,sıcaklığa, substratın yapısına bağlıdır.
Km ile Vmax kinetik sabitlerinin tespit edilmesi amacıyla enzim kaynağı olarak seçilen eluatın sabit hacmine karşı, substrat olarak tercih edilen trioleinin çeşitli konsantrasyonlarında (10, 20, 50, 100, 200, 500 mM) aktivite ölçümleri yapıldı. Hız sonuçları ile substrat konsantrasyonu arasında oluşturulan Michaelis-Menten grafiği sonucunda Km ve Vmax değerleri hesaplandı.
5. SONUÇ VE TARTIŞMA 5.1. Sonuç
5.1.1. Kaju lipazının hidrolitik aktivitesinin belirlenmesi
Enzimin hidrolitik aktivitesini belirlemek amacıyla, lipazın hidrolize ettiği yağ asitlerinin etkisiyle çözelti ortamında düşen pH’ı tekrar nötral hale getirebilmek için, NaOH çözeltisi ile titrasyonuna dayanan titrimetrik bir yöntem şekli izlenmiştir. Titrimetrik olarak izlenen yöntemle lipaz aktiviteleri tespit edilen homojenat ve elüatın enzimatik aktiflik sonuçları Çizelge 5.1’de yer almaktadır.
Çizelge 5.1. Kaju lipazının saflaştırma işlemleri sırasında aktivite değişimi.
Saflaştırma Basamağı Aktivite (EU/ml) Spesifik Aktivite
(EU/mg.protein)
Homojenat 0,8 0,011
Jel fraksiyon 9,4 0,731
Saflaştırma Basamağı, Aktivite (EU/ml) ve Spesifik Aktivite Çizelge 5.1.’de görüldüğü gibidir. Saflaştırma işlemlerinde en iyi hidrolitik spesifik aktiviteyi jel fraksiyon yöntemi vermiştir. Ham olarak kullanılan ekstrakt çözeltisi ile karşılaştırıldığında enzim aktivitesi yaklaşık 66,45 kat yükseldiği tespit edilmiştir.
5.1.2. Kaju lipazının saflaştırma işlem basamakları
Titrimetrik olarak izlenen metotla lipaz aktivite ölçümleri sonucunda aktivite değerleri belirlenen homojenat ve elüat enzimatik olarak tespit edilen aktivite değerleri Çizelge 5.2.’de gösterilmiştir.
Çizelge 5.2. Kaju fıstığı lipazının saflaştırma işlemleri.
İŞLEM Aktivite (EU/ml) Toplam Hacim (ml) Protein (mg/ml) Toplam Protein (mg) Toplam Aktivite (EU) Spesifik Aktivite (EU/mg protein) Yüzde Verim Saflaştırma Katsayısı Homojenat 0,8 100 75,28 7528 80 0,011 100 1 Sephadex® G-100 9,4 3 12,86 38,58 28,2 0,731 35,25 66,45
5.1.3. Kaju fıstığı lipazının optimum pH’nın belirlenmesi
Enzimin en iyi aktivite sonuçlarını gösterdiği pH değerlerini tespit etmek için optimum pH çalışmaları yapılmıştır bunun için;pH 4-4,4-4,8-5,2 ve 5,6’da 0,1 M asetik asit tampon çözeltileri,pH 6,4-6,8-7,2-7,6 ve 8,0’de 0,1M sodyumdihidrojen fosfat tampon çözeltileri, 8,4-8,8 ve 9,2’de tris tampon çözeltileri,pH 9,6-10,0-10,4-10,8 ve 11,2’de 0,1 M sodyumbihidrojenkarbonat tampon çözeltileri pH 11,6-12,0-12,4-12,8 ve 13,2 0,1 M sodyumhidrojenfosfat tampon çözeltileri hazırlandı.
Kaju fıstığı lipazı tayinleri için çeşitli pH’larda hazırlanan tamponlar kullanılarak aktivite tayin işlemleri yapıldı. Yapılan çalışmalar sonucunda enzimin en iyi aktivite değerini verdiği pH değeri 6,8 olarak tespit edilmiştir (Çizelge 5.3 ve Şekil 5.1).
Çizelge 5.3. Kaju lipaz enziminin optimum pH değerleri.
pH
Aktivite
(µmol yağ asidi.dk-1) Ph
Aktivite (µmol yağ asidi.dk-1)
4 6,2 8,8 1,2 4,4 6,6 9,2 1,8 4,8 8,6 9,6 4,6 5,2 7 10 6,2 5,6 6 10,4 5,4 6,4 7,8 10,8 7,6 6,8 9,4 11,2 8,2 7,2 6,6 12 5,8 7,6 7 12,4 6,2 8 6,4 12,8 5 8,4 2 13,2 4,8
Şekil 5. 1. pH’ın kaju fıstığı lipazına etkisi.
5.1.4. Kaju fıstığı lipazının optimum sıcaklığın belirlenmesi
Optimum sıcaklığın bulunması için yapılan çalışmalarında 0 ile 60°C derece sıcaklık değerlerinde pH 7,0’de kaju fıstığı lipazının aktivite ölçümleri gerçekleştirildi ve yapılan ölçümlerin sonucunda en yüksek hidrolitik aktivite sıcaklığının 60°C olduğu tespit edildi (Çizelge 5.4 ve Şekil 5.2).
Çizelge 5.4. Kaju lipazının optimum sıcaklık sonuçları.
Sıcaklık
Aktivite (µmol yağ asidi. dk-1)
0 2,2 5 3 10 3,6 15 4,6 20 5,8 25 6,2 30 6,6 35 7 40 7,4 45 7,8 50 10,6 55 13,6 60 15,2 0 1 2 3 4 5 6 7 8 9 10 0 2 4 6 8 10 12 14 A kti vi te( µm ol asi di.dk -1 pH Optimum pH Optimum pH
Şekil 5. 2Sıcaklığın kaju lipazına etkisi.
5.1.5. Kaju lipazı içindepo kararlılığı değerleri
Kaju lipazının saflaştırılması için jel filtrasyon işlemlerinin ardından elde edilen formu on gün boyunca 4 °C’de muhafaza edildi ve her gün sabit hacimde olacak şekilde numune alınarak standart şartlarda (37 °C, pH 7,0 ve substrat olarak: zeytinyağı) aktivite tayinleri gerçekleşti (Çizelge 5.5.). On gün boyunca aynı şartlar altında saklanan kaju fıstığı lipazının aktivitesinin kaybı yaklaşık %72 olduğu tespit edildi (Şekil 5.3).
Çizelge 5.5. Kaju lipazı depo kararlılığı.
Gün (Zaman) Spesifik Aktivite (U/dk.mg.enzim) 1 13,2 2 13 3 11,2 4 9,6 5 9 6 8 7 7,2 8 6,4 9 5 10 3,6 0 2 4 6 8 10 12 14 16 0 20 40 60 80 A kti vi te( µm ol asi di.dk -1 Sıcaklık Optimum Sıcaklık Sıcaklık
Şekil 5. 3. Kaju fıstığı lipazının depo kararlılığı.
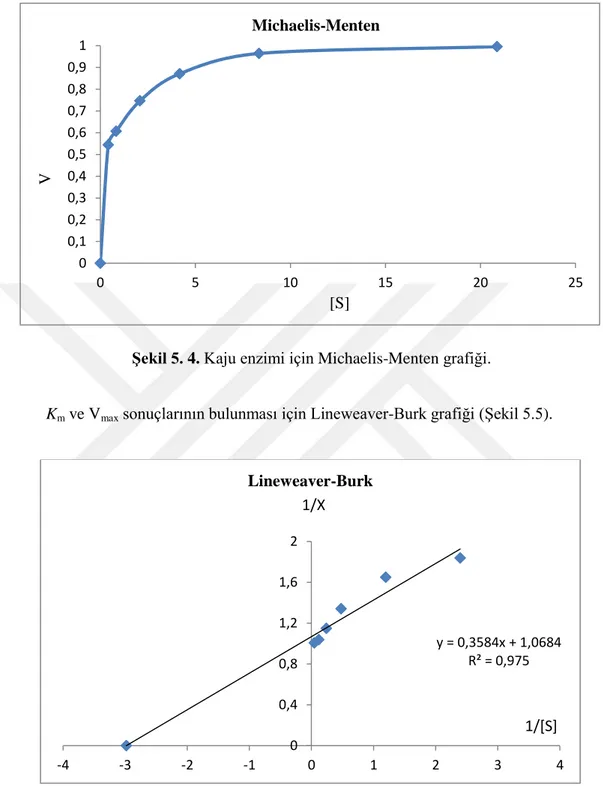
5.1.6. Lipaz enzimi için Km ve Vmaxdeğerleri
Enzimin Km ile Vmax değerlerini belirlemek amacıyla trioleinin kullanılarak çeşitli konsantrasyonlarda(10, 20, 50, 100, 200, 500 mM) aktivite ölçümleri yapıldı (Çizelge 5.6).
Çizelge 5.6. Kaju lipaz enzimi için değişik substrat konsantrasyonlarında enzim aktiviteleri.
[S] (nM) V (U/dk.mg enzim 1/[S] (×10-3) 1/(U/dk.mg enzim) 1/V 0 0 -2,981 0 10 0,7776 0,1 1,286 20 1,5552 0,05 0,643 50 3,8880 0,02 0,2572 100 7,7760 0,01 0,1286 200 15,5521 0,005 0,0643 500 38,8802 0,002 0,0257
Yukarıdaki tablo göz önünde bulundurularak, substrat konsantrasyon değerleri göz önüne alındığında reaksiyon hızları arasında Michaelis-Menten grafiği oluşturuldu (Şekil 5.4).
0 2 4 6 8 10 12 14 0 2 4 6 8 10 12 A kti vi te( µm ol asi di.dk -1 Gün Depo Kararlılığı Depo Kararlılığı
Şekil 5. 4. Kaju enzimi için Michaelis-Menten grafiği.
Km ve Vmax sonuçlarının bulunması için Lineweaver-Burk grafiği (Şekil 5.5).
Şekil 5. 5. Kaju fıstığı lipazının Lineweaver-Burk grafiği.
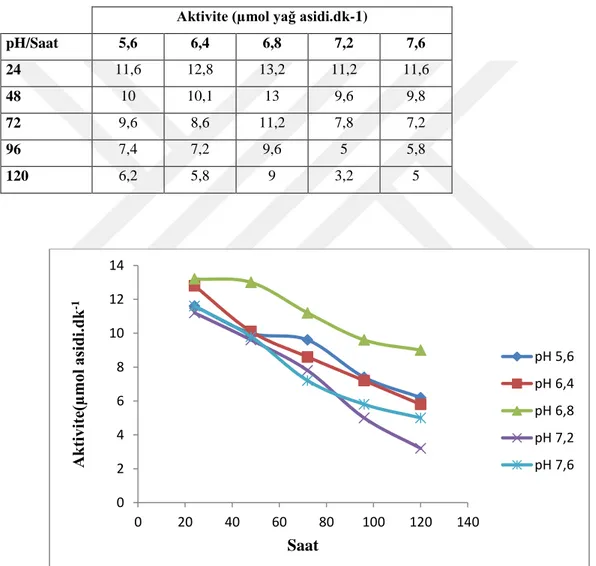
5.1.7. Kaju fıstığı lipazının stabil pH aktivitesinin belirlenmesi
Enzimin stabil pH çalışmaları için;
pH’ı 7,0 olan 0,1M sodyumdihidrojen fosfat tamponu, 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1 0 5 10 15 20 25 Michaelis-Menten
V [S] y = 0,3584x + 1,0684 R² = 0,975 0 0,4 0,8 1,2 1,6 2 -4 -3 -2 -1 0 1 2 3 4 Lineweaver-Burk 1/[S] 1/X
pH 8 - 9olan 0,1M tris tamponları,
pH 10,0 olan 0,1M sodyumhidrojenkarbonat tamponu,
pH’ı 11,0 olan 0,1 M sodyumhidrojenfosfat tamponu hazırlandı.
Hazırlanan bu tampon ortamlarında yapılan aktivite ölçümleri sonucunda enzimin stabil kaldığı pH 6,8 olarak belirlendi.
Çizelge 5.7. Kaju lipazının stabil pH aktivitesi.
Aktivite (µmol yağ asidi.dk-1)
pH/Saat 5,6 6,4 6,8 7,2 7,6 24 11,6 12,8 13,2 11,2 11,6 48 10 10,1 13 9,6 9,8 72 9,6 8,6 11,2 7,8 7,2 96 7,4 7,2 9,6 5 5,8 120 6,2 5,8 9 3,2 5
Şekil 5. 6. Kaju fıstığı lipazının stabil pH aktivitesi.
5.1.8. Kaju fıstığı lipazının stabil sıcaklığının belirlenmesi
Kaju fıstığından saflaştırılan lipaz enziminin en iyi aktivite gösterdiği stabil sıcaklık değerlerinin tespiti için 30, 40, 50, 60, 70, 80°C sıcaklıklarda 6 adet deneysel inceleme
0 2 4 6 8 10 12 14 0 20 40 60 80 100 120 140 A kti vi te( µm ol asi di.dk -1 Saat pH 5,6 pH 6,4 pH 6,8 pH 7,2 pH 7,6
yapılmıştır. İncelemelerin sonucunda maksimum hidrolitik aktivite veren değer, stabil sıcaklık değeridir ve 60°C olarak belirlenmiştir.
Çizelge 5.8. Kaju fıstığı lipazının stabil aktivite gösterdiği sıcaklık.
Aktivite (µmol yağ asidi.dk-1 )
Sıcaklık (°C)/sa 4 20 30 40 50 60 24 13,2 12,8 12,4 13,4 13,2 9,2 48 13 9 8,6 13 10,2 7,2 72 11,2 8 8,2 12,8 9,8 6,8 96 9,6 5,8 6,4 12,2 6,2 6 120 9 5 5,8 11,6 3,6 5,4
Şekil 5. 7. Kaju Fıstığının lipazının stabil sıcaklık aktivitesi.
5.1.9. SDS-PAGE kullanılaraklipazenziminin karakterizasyonu
SDS-PAGE için; hazırladığımız %12’lik ayrıştırma jelinin üzerine hazırlanan %3,75’lik yığma jeli ilave edilip bir miktar karıştırıldı. Numuneler elektroforezin kuyularına yüklendikten sonra 100V’da yaklaşık 2 saat 10 dk boyunca kuyudaki enzim çözeltileri yürütülür. Hazırlanan jeli boyamak amacıyla; %0,1 Coomassie Brilliant Blue R250 kullanıldı. Jelin yıkanması için; hazırlanan %10’luk metanol ve %7’lik asetik asit çözeltisi hazırlandı ve kullanıldı. Bantlar gözle görülecek kadar belirginleştiğinde görüntü kaydedildi.
0 2 4 6 8 10 12 14 16 0 20 40 60 80 100 120 140 A kti vi te( µm ol asi di.dk -1 Saat 4 20 30 40 50 60
Şekil 5. 8. Kaju lipazının SDS-PAGE karakterizasyonu.
Elektroforez ile karakterizasyon sonucuna göre lipaz enzimi, standart ile birlikte değerlendirildi ve enzimlerin saflığı belirlendi.
5.2. Tartışma
Global Dünyada biyoteknoloji alanında kullanılan yöntemlerin geliştirilmesiyle birlikte üretilen, ticari değeri olan ürünlerin başında enzimler yer almaktadır. Enzimler kullanılarak yapılan araştırmalar endüstride bu konuyla alakalı kullanım alanlarının artmasıyla daha fazla önem kazanmış, ekonomik değerinin yüksek olması sebebiyle çok daha fazla ilgi odağı haline gelmiştir.
Yürütülen bu tez çalışmasında kaju fıstığından saf olarak elde edilen lipaz enziminin saflaştırma basamakları, karakterizasyon işlemleri ve biyokimyasal özellikleri belirlenmiştir.
Lipaz enziminin saf olarak elde edilebilmesi için kaju fıstığı ilk olarak homejenizasyon ve kurutma işlemlerine tabi tutulmuştur.Soğuk ekstraksiyon yöntemi basamakları takip edilerek öncelikle proteinler yağlarından uzaklaştırılmıştır.Literatür incelendiğinde yağların uzaklaştırılması işleminde birçok araştırmada aseton (Park vd., 2000; Hird vd., 2000) ve (Olszewki vd., 1998), hekzan (Basha, 1997; Prabhu vd., 1999) gibi farklı çözücüler kullanıldığı belirlenmiştir. Kaju fıstığından elde edilen lipaz proteinlerinin yağsızlaştırılması sırasında Hird ve grubunun fındık ve yer fıstığı deneyinde kullandığı metot ile Park ve grubunun ayçiçeğinden proteazların ayrılması için yapılan yağsızlaştırma işleminde kullandığı metot örnek olarak uygulanmış ve kaju fıstığı lipazını yağsızlaştırmak için aseton çözücü olarak kullanılmıştır.
Daha sonraki basamaklarda amonyum sülfat çöktürmesi ve jel filtrasyonu yöntemleri ile birlikte kaju fıstığından elde edilen lipazın saflaştırma işlemleri gerçekleştirilmiş, bu aşamalar sırasında saflaştırılan enzimin saflık durumu her safhada kontrol edilmiştir.
Kaju fıstığından saflaştırılarak elde edilen lipaz enziminin; enzim aktivite çalışmaları, optimum sıcaklık değerleri ve optimum pH’ı, Km ile Vmax değerleri ve hesaplanması, depo karalılığı tayini, stabil değere sahip olduğu sıcaklık ve pH, UV metoduyla absorbsiyon tayininin yapılması, elektroforez işlemi ve kantitatif protein tayini analizleri yapılmıştır.
Kaju fıstığı yapısında bulunan proteinler, amonyum sülfat çöktürmesi işlemleri uygulanarak yapıdan ayrılmış, kontrolü yapılan bütün fraksiyonlarda aktivite gözlenmiş, % 40 amonyum sülfat doygunluğunda olan tüplerde kaju fıstığından elde edilen lipazın en yüksek hidrolitik aktiviteyi verdiği tespit edilmiştir. Çöktürme işlemleri sonrasında elde edilen süpernatant çözeltisi bir lipaz saflaştırma yöntemleri arasında yer alan jel filtrasyon kromatografisi (Sephadex®G-100 kullanılarak) yöntemi kullanıldığında yaklaşık 65,45 kat saflaştırılmıştır.
Lipaz enziminin saflaştırılması çalışmalarından olan ve tohum olarak Ceviz tohumu kullanılan deneyde sırasıyla amonyum sülfat çöktürmesi, dializ, Sephadex®
G-100 jel filtrasyonu kromotagrafisi yöntemleri uygulanmış ve lipaz enzimi yaklaşık olarak 29 kat saflaştırılmıştır.
Ceviz, pamuk tohumu, buğday tohumu, fındık tohumu gibi farklı bitkisel kaynaklardan lipaz saflaştırma çalışmaları oldukça fazla olup araştırmacıların bitkisel kaynaklı lipazlarını saflaştırma sırasında ki kullandıkları metotlar bizim çalışmamızla benzerlik gösterip destekler nitelik taşımaktadır.
Kaju fıstığından saflaştırılmış lipaz enzimi substrat spesifitesi tespiti amacıyla, zeytinyağı ve triolein substrat olarak kullanılmıştır. En yüksek aktivite gözlemlenen substrat triolein olarak belirlendi. Doğal kaynaklı olarak incelendiğinde ise yağlar arasında ise en yüksek hidrolitik aktiviteyi zeytinyağı göstermektedir. Yapılan çalışmalar sonucunda elde edilen verilere göre kaju fıstığı lipazının substratı triolein olarak belirlenmiştir. Elde ettiğimiz verileri daha önce yapılmış lipaz saflaştırma deneyleriyle karşılaştırdığımızda pirinç kepeğiyle yapılan bir çalışmada da en uygun substratın triolein olduğu belirtilmiştir (Bhardwaj vd., 2001).
Yapılan sıcaklık denemelerinde,kaju fıstığı lipazının optimum sıcaklığı 60°C olarak belirlendi (Şekil 5.2). Ceviz tohumu lipaz saflaştırması deneyinde yapılan optimum sıcaklık çalışmaları 70°C olarak belirlenmiştir. Bitkisel kaynaklı lipazların saflaştırılma çalışmaları
sonucunda bitkisel lipazların optimum olan sıcaklık sonuçlarının 30-80°C arasında değerler aldığı gözlenmiştir (Hiol vd., 2000).
Kaju fıstığı lipazının optimum pH’ı yapılan deneyler sonucunda 6,8 olarak belirlendi (Şekil 5.1). Bhardwaj ve grubunun pirinç kepeği kullanarak yaptığı lipaz saflaştırması çalışması sonucunda, optimum pH 11,0 (Bhardwaj vd., 2001), ceviz için yapılan çalışmada ise lipazın ise optimum pH’ı 9,0 olarak tespit edildiği görülmüştür.
Kaju fıstığından saflaştırılan lipaz enziminin aktivitesinin zamanla değişimini belirlemek amacıyla jel filtrasyonundan sonra elde edilen formu on gün boyunca her gün ölçüldü (Şekil 5.3). Çalışma sonrasında on gün boyunca +4°C’de saklanan enzimin aktivite kaybının yaklaşık % 72 olduğu belirlenmiştir. Ceviz tohumundan saflaştırılan lipaz enzimi -20 °C’de bir yıl boyunca saklanmış ve enzimin aktivite kaybının yaklaşık %15 olduğu tespit edilmiştir.
Saflaştırılan kaju fıstığı lipazının kinetik özelliklerini belirleme çalışmasında, Michaelis-Menten (Şekil 5.4) ve Lineweaver-Burk grafiği (Şekil 5.5) ile triolein kullanılan düzenek için Km sonucu 0,3355 mM ve Vmax sonucu ise yaklaşık 0,936 U/dk.mg enzim olduğu tespit edilmiştir. Diğer bitkisel kaynaklı lipaz deneylerindeki Km ve Vmax sonuçlarına bakıldığında ceviz tohumunda trioleninli düzenekte Km ve Vmax sonuçlar 48mM ve 0,0023 U/dk.mg enzim olarak bulunmuştur.
Kaju fıstığı lipazının en iyi aktivite değeri verdiği stabil sıcaklık denemeleri için altı ayrı deneysel veri incelemesi yapılmıştır. İncelemelerin sonucunda en iyi hidrolitik aktivite sonucunu gösteren stabil sıcaklığın 40°C olduğu bulunmuştur (Şekil 5.7).
Kaju fıstığı lipazının stabil pH’ı 6,8 olarak belirlenmiştir (Şekil 5.6). Elektroforez sonucuna göre lipaz enzimi, standart ile birlikte değerlendirilmiş ve spesifik aktivite ölçümleri ile 66,45 kat saflaştırıldığı tespit edilmiştir.
KAYNAKLAR DİZİNİ
Abbas, H., Hiol, A., Deyris, V., Comeau, L., (2002), Isolation and Characterization of an Extracellular Lipase From Mucor sp Strain Isolated From Palm Fruit. Enzyme and Microbial Techonology, 31, s.968- 975.
Aehle, W., (2007), Enzymes in ındustry production and applications, Willey-VCH. Alan, W., (1991), Understanding Enzymes, 3. Baskı, Ellis Horwood.
Aydogmus Öztürk, F., (2006), Pseudomonas türlerinde lipaz üretim ve bazı kültürel parametrelerin optimizasyonu, Yüksek Lisans Tezi, Muğla Üniversitesi Fen Bilimleri Enstitüsü, Muğla.
Balcao, V.M., Malcata, F.X., (1998), Lipase catalyzed modification of milkfat, Biotechnology advances, 16, s.309-341.
Basha, S.M., (1997), Separation of peanut proteins by capillary electrophoresis. J. Of Arabic. And Food Chem., 45(2), 400-402.
Bhardwaj, K., Raju, A., Rajasekharan, R. (2001), Identification, purification and characterization of a thermally stable from lipase from rice bran. A new member of the (phospho) lipase family. Plant Physiology, 127, 1728-1738.
Bhat, M.K., (2000), Cellulases and related enzymes in biotechnology. Biotechnology Advances, 18, s.355- 383.
Boyce, S., Tifton, FK., (2001), Enzyme Classification and Nomenclature, Encyclopedıa Of Lıfe Scıence.
Bradford, M.M., (1976), A rabid and sensitive method fort he quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem.
Chen, J.P., (1996), Prodoction of ethyl butyrate using gel-entrapped Candida cylindracea lipase, Journal of fermentation and bioengineering, 82, s.404- 407.
Erkaya, E., Çaylıkoca, A.B., Kalınyaprak, F., (2006), Enzimatik kataliz, Kimya Mühendisliği Uygulaması, Konya Selçuk Üniversitesi, s.78.
Fernandes, P., (2010), Enzymes in Food Processing: A Condensed Overview on Strategies for Better Biocatalysts, Enzyme Research, Article ID 862537.
Hiol, A., Jonzo, M.D., Rugani, N., Druet, D., Sadra, L., Comeau, L.C., (2000), Purification and Characterization of an Extracellular Lipase from Thermophilic Rhizopus oryzae strain isolated from Palm Fruit. Enzyme and Microbial Technology. 26, s.421-430.
Hird, H., Pumpery, R., Wilson, P., Sunderland, J. ve Reece, P. (2000), Idetification of peanut and hazelnut allergens by native by two-dimensional gel electrophoresis. Electrophoresis, 21,2678-2683.
KAYNAKLAR DİZİNİ (devam)
İşbakan, N., (2006), Lipaz enzimi biyokatalizörlüğünde enantiyomerik saflıkta 1- fenil-1-propanolün transesterleşme tepkimesiyle kinetik rezolüsyonu, Ankara Üniversitesi Fen Bilimleri Enstitüsü, Yüksek Lisans Tezi.
Jaeger, K.E., Dijkstra, B. W., Reetz, M.T., (1999), Bacterial Biocatalysts: Molecular Biology, Three-Dimensional Structures, and Biotechnological Applications of Lipases, Annu. Rev. Microbiol. 53, s.315- 351.
Jaeger, K-E., Ransac, S., Dijkstra, B. W., Colson, C., Van Heuvel, M., Misset, O., (1994), Bacterial Lipases. FEMS Microbiology Reviews, 15, s.29- 63.
Keha, E., Küfrevioğlu, İ., (2000), Biyokimya, Aktif Kitabevi, Erzurum: s.91-118.
McAuliffe, J.C., Aehle, W., Whited, G.M., Ward, D.E., (2007), Kent and Riegel's Handbook Of Industrıal Chemıstry And Bıotechnology, Springer, New York.
Nelson, D.L., Cox, M.M, (2005), Lehningerbiyokimyanın ilkeleri, (Çev: Nedret, K.), Palme Yayıncılık, Ankara, s.223-224.
Olempska-Beer, Z.S., Merker, R.I., Ditto, M.D., DiNovi, M.J., (2006), Food processing enzymes from recombinant microorganisms-a review, Regulatory Toxicology and Pharmacology, 45, s.144-158.
Olszewski, A., Pons, L., Moutete, F., Aimone-Gastin, I., Kanny, G., Moneret-Vautrin, D.A. ve Gueant, J.L. (1998). Isolation and characterization of proteic allergens in refined peanut oil. Clinical Experimental Allergy, 28,850-859.
Özata, A., Türe, C., (2009), Enzimler ve enzim aktivitelerinin gösterilmesi, Anadolu Üniversitesi yayınları.
Öztürk, B., (2002), Lipaz enzimi: yapısal özellikleri ve uygulama alanları, Gıda Mühendisliği Dergisi.
Pandey, A., Benjamin, S., Soccol, C.R., Nigam, P., Krierger, N., Soccol, V.T., (1999), The realm of microbial lipases in biotechnology, Biotechnology and applied biochemistry, 29, s.119-131.
Park, H., Yamanaka, N., Mikkonen, A., Kusakabe, I., Kobayashi, H. (2000), Purification and characterization of aspartic proteinase from sunflower seeds. Biosci. Biotechnol. Biochem., 64(5),931-939.
Prabhu, V.A., Tambe, S.P., Gandhi, N.N., Sawant, S.B., Joshi, J.B. (1999), Rice Bran Lipase: Extraction, activity and stability. Biotechnol. Prog., 15(6), 1083-1089.
Reymond, J., Fluxa, VS., Maillard, N., (2009), Enzyme assays, The Royal Society of Chemistry, s.34–46, 2009.
KAYNAKLAR DİZİNİ (devam)
Sangeetha, R., Arulpandi, I., Geetha, A., (2011), Bacterial lipases as potential industrial biocatalysts: An overview. Res. J. Microbiol., 6, s.1-24.
Singh, A.K., Mukhopadhyay, M., (2012), Overview of Fungal Lipase: A Review, Applied Biochemistry and Biotechnology, 166, s.486–520.
Telefoncu, A., (1986), Temel ve uygulamalı enzimoloji, Biyokimya Lisansüstü Yaz Okulu, Çeşme, İzmir-Türkiye, 326s.
Topal, Ş., (1985), Enzimler, mikrobiyolojik yolla enzim üretimi ve bu teknoloji de rennin’in yeri, Gıda, 12, s.25-37.
Ulker, S., Ozel, A., Colak, A., Alpay Araoğlu, Ş., (2011), Isolation, production, and characterization of an extracellular lipase from Trichoderma harzianum isolated from soil, Turkısh Journal Of Bıology, 35, s.543-550.
Van Beilen, J. B., Li, Z., (2002), Enzyme Technology: an overview, Current Opinion in Biotechnology, 13, s.338–344.
Wiseman, A., (1987), Handbook of Enzymes Biotechnology, Second Ed. Chapter 3, The Application of Enzymes in Industry, s.274-373.
Yıldız, S., (2007), Enzimler, 1. Baskı, Fakülte Kitabevi.
Yöntem, M., Ünaldı, M., (2011), Biyokimya, 1. Baskı, Aybil Yayınları.
Zeman, N.W., Mccrea, J.M., (1985), Alpha-amylase production using a recombinant DNA organism. Cereal Foods World. 30(1), s.777-780.