T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
LEPTİN RESEPTÖRÜ VE HİPOKSİ-İNDÜKLENEBİLİR
FAKTÖR-1ALFA GENLERİNDEKİ POLİMORFİZMLERİN
OSAHS’LA İLİŞKİSİ
Sümeyra ÇETİNKAYA
YÜKSEK LİSANS TEZİ
TIBBİ BİYOLOJİ ANABİLİM DALI
Danışman
Prof.Dr. Sennur DEMİREL
T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ
LEPTİN RESEPTÖRÜ VE HİPOKSİ-İNDÜKLENEBİLİR
FAKTÖR-1ALFA GENLERİNDEKİ POLİMORFİZMLERİN
OSAHS’LA İLİŞKİSİ
Sümeyra ÇETİNKAYA
YÜKSEK LİSANS TEZİ
TIBBİ BİYOLOJİ ANABİLİM DALI
Danışman
Prof. Dr. Sennur DEMİREL
Bu proje Selçuk Üniversitesi Bilimsel Araştırma Proje Koordinatörlüğü
Tarafından 11202005 proje numarası ile desteklenmiştir
ii
ÖNSÖZ
Yüksek lisans öğrenimim boyunca bilgi ve deneyimlerini benimle paylaşan danışmanım Prof. Dr. Sennur DEMİREL’e ve desteklerini hiçbir zaman eksik etmeyen bölüm öğretim üyelerimiz Yard. Doç. Dr. A.Bülent TURHAN, Yard. Doç. Dr. H.Gül DURSUN’a
Tez aşamasında desteğini esirgemeyen Göğüs Hastalıkları öğretim üyesi ve Uyku Laboratuarı sorumlusu Yard. Doç. Dr. Şebnem YOSUNKAYA’ya,
Araştırma sırasında bizi destekleyen Selçuk Üniversitesi Bilimsel Araştırma Projeleri Koordinatörlüğü’ne,
Bilgi ve deneyimlerini paylaşan Serkan KÜÇÇÜKTÜRK’e
Tezin kontrolleri esnasında zaman ayırıp destekleriyle yanımda olan anatomi bölümü asistanlarından Döndü AKIN ve Didem AYDIN’a ve sevinç ve hüzünleri beraber paylaştığımız İlknur ÇINAR’a,
Eğitim ve tez aşamasında maddi ve manevi desteklerini esirgemeyen sevgili aileme,
iii İÇİNDEKİLER ÖNSÖZ...ii İÇİNDEKİLER...iii SİMGELER VE KISALTMALAR...vi ÇİZELGELER...viii ŞEKİLLER...ix 1. GİRİŞ ...1
1.1. Uykuda Solunum Bozuklukları ... 1
1.2. Uyku Apne Sendromu ... 1
1.2.1. Genel Özellikler ... 2
1.2.2. Epidemiyoloji ... 3
1.2.3. Etiyoloji ... 4
1.2.4. Klinik Özellikler ... 4
1.2.5. Polisomnografi ... 5
1.3. Obezite, Leptin, Leptin Reseptörü ... 5
1.3.1. Obezite ... 5
1.3.2. Leptin ... 6
1.3.3. Leptin Reseptörü (LEPR) ... 8
1.3.4. Leptin Reseptörü Gen Polimorfizmleri...8
1.4. Hipoksi ve Hipoksiyle İndüklenen 1-α (HIF-1α) Geni ... ....9
1.4.1. Hipoksi ve OSAHS İlişkisi ... 9
1.4.2. İntermittent (Aralıklı) Hipoksi ... 9
1.4.3. Kronik İntermittent(Aralıklı) Hipoksi ... 10
1.4.4. Hipoksiyle İndüklenen Faktör 1α (HIF-1α) Geni...10
1.4.5. HIF-1α’nın Hedef Genleri...14
1.5.Obezite, HIF-1α Geni ve Leptin Arasındaki Bağlantılar...15
iv
1.7. Amaç...17
2.GEREÇ ve YÖNTEM ... 19
2.1. Hasta Kabulü ... 19
2.2. Çalışma gruplarının oluşturulması ... 19
2.3. Uyku Çalışması...19
2.4. Hastadan kan alınması ... 20
2.5. Genomik DNA izolasyonu ... 20
2.5.1. İzolasyonda kullanılan çözeltiler ... 21
2.6. Polimeraz Zincir Reaksiyonu (PZR) ... 22
2.7. Agaroz Jelde Görüntüleme ... 24
2.8. Restriksiyon Fragment Uzunluk Polimorfizmi (RFLP) ... 24
2.9. ARMS (Amplifikasyon Refraktör Mutasyon Sistem)...25
2.9.1. Agaroz Jelde Görüntüleme...25
2.10. İstatistiksel değerlendirme ... 25
2.11. Etik Kurul Onayı ... 26
3. BULGULAR ... 27
3.1. Pro582Ser Polimorfizmini İçine Alan Gen Bölgesinin PZR Sonuçları...27
3.2. Lys109Arg Polimorfizmini İçine Alan Gen Bölgesinin PZR Sonuçları... 28
3.3. Lys109Arg Bölgesi PZR Ürünlerinin HaeIII Restriksiyon Enzimi ile Kesimi...28
3.4 Lys656Asn Polimorfizmini İçine Alan Gen Bölgesinin PZR Sonuçları...29
3.5. Lys656Asn Bölgesi PZR Ürünlerinin BstU1 Restriksiyon Enzimi ile Kesimi...29
3.6. Pro582Ser Polimorfizminde Hasta ve Kontrol Gruplarının Karşılaştırılması...30
v 3.7. Lys109Arg Polimorfizminde Hasta ve Kontrol Gruplarının
Karşılaştırılması...34
3.8. Lys656Asn Polimorfizminde Hasta ve Kontrol Gruplarının Karşılaştırılması...36 4. TARTIŞMA ... 40 5. SONUÇ VE ÖNERİLER ... 46 6. ÖZET... 47 7. SUMMARY ... 48 8. KAYNAKLAR ... 49 9. EKLER ... 54
EK-A. ETİK KURUL ONAYI ... 54
EK-B. BİLGİLENDİRİLMİŞ ONAY FORMU...55
vi
SİMGELER VE KISALTMALAR
AHI: Apne/Hipoapne İndeksi ARNT: aryl hydrokarbon reseptör nüklear translokator
ARMS: Amplifikasyon Refraktör Mutasyon Sistem
bç: Baz çifti
bHLH: basic helix loop heliks BMI: Body Mass Index
CBR: CREB bağlanma bölgesi CIH: Kronik İntermittent Hipoksi DNA: Deoksiribonükleik asit DSÖ: Dünya Sağlık Örgütü EDTA: Etilendiamintetraasetikasit EEG: Elektroensefalogram EKG: Elektrokardiyogram EMG: Elektromyogram EOG: Elektrookülogram EPO: Eritropoietin EtBr: Etidyum Bromür
EtOH: Etanol
FIH: Faktör İnhibe edici HIF
HDL: High-Density Lipoprotein HIF-1α: Hipoksiyle İndüklenen Faktör-1α
HRE: Hipoksi Yanıt Elementi
ICSD: Uluslararası Uyku Apne Sendromu Sempozyumu IL-6: İnterlökin 6
IL-12: İnterlökin 12 JAK: Janus-aktive kinaz
LDL: Low-Density Lipoprotein LEPR: Leptin Reseptörü
mRNA: Messenger RNA NaAc: Sodyum Asetat
NHANES: National Health and Nutrition Examination Survey Ob gen: obezite geni
OB-Ra: Kısa reseptör OB-Rb: Uzun reseptör OD: Optik Dansite
ODD: Oksijen Bağlama Bölgesi
OSAHS: Obstructive Sleep Apnes/Hypoapnes Syndrome pmol: pikomol
PO2 : Parsiyel Oksijen Basıncı
PHD: Prolil Hidroksilaz Domain PI3K: Phosphatidylinositol 3-kinase PSG: Polisomnografi
REM: Rapid Eye Movement
RFLP: Restriction Fragment Length Polymorphism
vii ROS: Reaktif Oksijen Ürünleri
SDS: Sodyum Dodesil Sülfat
SNP: Single Nucleotid Polymorphisms
STAT: Sitozolik Transkripsiyon Aktivatörü
SREBP-1: sterol düzenleyici element bağlama protein-1
Tris: Tris (hidroksimetil) aminometan ul: Mikrolitre
USB: Uykuda Solunum Bozuklukları VEGF: Vasküler Endotelyal Growth Faktör
viii
ÇİZELGELER
Çizelge 2.1. PZR reaksiyon bileşenleri ve reaksiyon koşulları (Lys109Arg ve
Lys656Asn için)
Çizelge 2.1. Pro582Ser için PZR reaksiyon bileşenleri ve reaksiyon koşulları
Çizelge 3.1. Tüm SNP’lere hasta ve kontrol gruplarında Yaş, BMI ve PSG
karakteristiklerine ait değerler
Çizelge 3.2. Pro582Ser polimorfizminde hasta ve kontrol grupları arasında birey
sayıları ve genotip dağılım sıklıkları
Çizelge 3.3. Pro582Ser polimorfizminde hasta gruplarında AHI ve BMI’ya göre
ayrılmış alt grupların genetik modellerle karşılaştırılması
Çizelge 3.4. Pro582Ser polimorfizminde hasta grupları içerisinde klinik ve
biyokimyasal parametrelerin kodominant modelde karşılaştırılması
Çizelge 3.5. Pro582Ser polimorfizminde hasta grupları içerisinde klinik ve
biyokimyasal parametrelerin dominant ve resesif modelde karşılaştırılması
Çizelge 3.6. Pro582Ser polimorfizminde hasta ve kontrol grupları arasında birey
sayıları ve genotip dağılım sıklığı değerleri
Çizelge 3.7. Lys109Arg polimorfizminde hasta gruplarında AHI ve BMI’ya göre
ayrılmış alt grupların genetik modellerle karşılaştırılması
Çizelge 3.8. Lys109Arg polimorfizminde hasta grupları içerisinde klinik ve
biyokimyasal parametrelerin kodominant modelde karşılaştırılması
Çizelge 3.9. Lys109Arg polimorfizminde hasta grupları içerisinde klinik ve
biyokimyasal parametrelerin dominant ve resesif modelde karşılaştırılması
Çizelge 3.10. Hasta ve Kontrol grupları arasında birey sayıları ve genotip dağılım
sıklıkları
Çizelge 3.11. Lys656Asn polimorfizminde hasta gruplarında AHI ve BMI’ya göre
ayrılmış alt grupların genetik modellerle karşılaştırılması
Çizelge 3.12. Lys656Asn polimorfizminde hasta grupları içerisinde klinik ve
biyokimyasal parametrelerin kodominant modelde karşılaştırılması
Çizelge 3.13. Lys656Asn polimorfizminde hasta grupları içerisinde klinik ve
biyokimyasal parametrelerin dominant modelde karşılaştırılması.
Çizelge 3.14. Lys656Asn polimorfizminde hasta grupları içerisinde klinik ve
ix
ŞEKİLLER
Şekil 1.1. LEPR geninin şematik görünümü. Şekil 1.2. HIF-1 ‘in yapısı.
Şekil 1.3. HIF-1α geninde görülen varyantlar. Şekil 1.4. HIF-1’in oksijen-bağımlı regülasyonu.
Şekil 1.5. Normoksi ve Hipoksi koşullarında HIF-1α geni
Şekil 1.6. Tamir edilmemiş glukoz homeostazı ve adiposit bozukluğunda HIF-1α’nın
rolü
Şekil 1.7. Leptinin uyardığı sinyal yolakları
Şekil 3.1. Pro582Ser Polimorfizminin ARMS-PZR Sonucu Şekil 3.2. Pro582Ser polimorfizminin dizi analizi sonucu Şekil 3.3. Lys109Arg Polimorfizmininin PZR Sonucu Şekil 3.4. Lys109Asn Polimorfizmininin RFLP Sonucu Şekil 3.5. Lys656Asn Polimorfizmininin PZR Sonucu Şekil 3.6. Lys656Asn Polimorfizmininin RFLP Sonucu
1
1. GİRİŞ
Uyku, hayatımızın üçte birini geçirdiğimiz ve sağlıklı yaşam için vazgeçilmez olan bir olgudur. Kimilerine göre sadece dinlenme olarak görülen uyku Aristo, Hipokrat, Freud gibi pek çok düşünür ve bilim adamı için gizemli bir süreç olarak yorumlanmış ve pek çok çalışmaya konu olmuştur. Bu süreçte uykunun bazı uyaranlar ile geri döndürülebilen bir bilinçsizlik hali olduğu bildirilmiş ve bu konudaki ilk gelişme Luigi Galvini’nin yaptığı hayvan deneylerinde, beyin hücrelerinde elektriksel aktiviteyi göstermesi, bunu takiben Richard Caton tarafından EEG’yi oluşturan potansiyellerin keşfi ile hız kazanmıştır (Köktürk 1998). Teknolojinin de gelişimi ile bu alanda bilgi birikimleri sonucu 1972 yılında ilk Uluslararası Uyku Apne Sendromu Sempozyumu düzenlenmiştir. Bilgi birikimlerinin artmasıyla Uyku Apne Sendromunun günümüzdeki tanımı 1973 yılında Christian Guilleminault tarafından yapılmıştır (Pack 1994). 2005 yılında yeni bir sınıflama hazırlanarak Uyku Bozuklukları Sınıflaması-2 (ICSD-2) yayınlamıştır.
1.1. Uykuda Solunum Bozuklukları
Uyku sırasında solunum paterninde patolojik olarak değerlendirilebilecek düzeydeki değişikliklere bağlı olarak gelişen morbidite ve mortalitenin artmasına yol açan tablolara uykuda solunum bozuklukları (USB) denilmektedir. USB adı altında farklı klinik tablolar yer almakla birlikte, USB denince ilk akla gelen tablo “ Uyku Apne Sendromu ” dur. Uyku apne sendromu içinde en yaygın olan Obstrüktif Uyku Apne/Hipoapne Sendromu (Obstructive Sleep Apnes/Hypoapnes Syndrome- OSAHS ) tüm olguların %90-95’ini içermektedir(Köktürk 1998).
1.2. Uyku Apne Sendromu
Guilleminault ve ark (1973), çalışmalarında apnenin tanımını (süresi ve tipi) ve apne indeksini (AHI-uyku saati başına düşen apne sayısı) ortaya koymuşlardır. Obez olmayan hastalarda bu sendromun ortaya çıkmasının önemini vurgulamak için daha genel anlamda 1976’da Uyku Apne Sendromu olarak ifade edilmiştir. Aynı yıl çocuklarda da bu sendromun varlığı gösterilmiştir. 1977 yılında kardiyovasküler komplikasyonlar için geri döndürülebilir bir tehlike olarak hipersomni-uyku apne sendromu tanımlanmıştır. 1983 yılında OSAHS ile ilişkili kardiak aritmiler ve iletim bozuklukları tanımlanmış, daha sonra obstrüktif uyku apnesinin sebep olduğu gece uyku bölünmeleri ve gün boyu uyuklama arasındaki ilişki gösterilmiştir. Bunları OSAHS’a bağlı kardiak aritmi, hipertansiyon, hipoksi ile ilişkili hastalıklar,
2 miyokardial iskemi ve infeksiyon, serebrovasküler kazalar ve ani ölümlerin incelendiği birçok çalışma takip etmiştir.
1.2.1. Genel Özellikler
Obstruktif uyku apne/hipoapne sendromu (OSAHS) solunumla ilgili uyku bozuklukları içinde incelenen, birçok vücut sistemini ilgilendiren önemli bir sağlık sorunu olup erişkin dönemdeki en yaygın uykusuzluk (insomnia) nedenidir (A report of National Commission on Sleep Disorders Research 1995, Young ve ark 2002). Gerek uyku fizyolojisinin gerekse uyku apnesinin anlaşılmasında son 30-50 yılda önemli gelişmeler kaydedilmiştir. Uykunun bilimsel olarak incelenmesinde önemli dönüm noktaları: 1950’lerde REM (rapid eye movement: hızlı göz hareketi) döneminin tanımlanması; 1960’larda üst havayolunda tıkanma ile uyku bozukluğunun ilişkilendirilmesi; 1970’lerde uyku apne sendromunun tanımlanması, 1980’lerde uyku apne sendromunun tedavisinde çığır açıcı bir gelişme olan basınç tedavisinin keşfedilmesidir (Demir ve Şahin 2004).
OSAHS, uykuda üst havayolunda tekrarlayan tıkanıklıklar nedeniyle oksijen desaturasyonu ve uyanma dönemleri olarak tanımlanmıştır. Uykuda kısa süreli solunum durması (apne) veya solunum azalması (hipopne) tek başına hastalık tanısı için yeterli değildir. Obstruktif uyku apne sendromu tanısı, apne-hipopne indeksinin (AHI: uykuda saat başına düşen toplam apne ve hipopne sayısı) 5 veya üstünde olması ile gündüz uykulu olma veya aşağıda sıralanan şikayetlerden en az ikisinin varlığında konur:
i. uyku sırasında boğulur gibi olma, ii. uykudan sık uyanma,
iii. dinlendirici olmayan uyku, gündüz yorgunluk, konsantrasyon güçlüğü gibi bilişsel bozukluk (The report of an American Academy of Sleep Medicine Task Force 1999).
Apne ve hipopne en az 10 saniye süresince sırasıyla solunumun durması ve azalması olarak tanımlanmıştır. Hastalık tanısı için seçilen eşik apne-hipopne indeksi (AHI) değeri olan 5 rakamı epidemiyolojik araştırmalar sonucunda ortaya çıkmıştır. İzlem araştırmalarında AHI’si 5 ve üstünde olan hastalarda gündüz uykululuk, hipertansiyon ve motorlu araç kaza riskinin artış gösterdiği görülmüştür (Fleetham 2004). Hastalık derecesi sınıflandırılırken de AHI’den yararlanılmıştır. Hastalık şiddetini belirlemede kabul edilen AHI düzeyleri hafif düzey için 5-14, orta düzey için 15-30, ağır düzey için ise >30 şeklindedir (The report of an American Academy
3 of Sleep Medicine Task Force 1999). İlk hastalık tanımlarında apne üzerinde durulurken hipopnenin de apneye benzer şekilde oksijen saturasyonunda düşme (desaturasyon) ve uyanmaya neden olduğu gösterilmiş ve OSAHS tanımına hipopne de eklenmiştir (Meoli ve ark 2001). Literatürde OSAHS’la eşdeğer şekilde kullanılan ‘Obstruktif uyku apne hipopne sendromu’ veya ‘uyku apne hipopne sendromu’ tanımlarına rastlanılabilir. Üst havayolunda direnç artışı sonucu apne-hipopne olmaksızın uyanma oluşması gece boyunca sık uyku kesilmelerine ve klinik olarak OSAHS benzeri sonuçlara yol açabilir (Guilleminault ve ark 1993).
1.2.2. Epidemiyoloji
Prevalans oranları hastalığı tanımlamak için kullanılan ölçütlere göre değişmektedir. Çalışmalarda tanım olarak apne hipopne indeksi (AHI) AHI ≥ 5 alındığında OSAHS prevalansı erkeklerde %24, kadınlarda %9 olarak bildirilmektedir (Young ve ark 1993). Obstrüktif uyku apne/hipoapne sendromu çeşitli yaş gruplarını etkileyebilir. Amerikalı yetişkinlerde OSAHS görülme sıklığı 30-60 yaş arası erkeklerde %4 ve kadınlarda %2 olarak rapor edilmiştir. daha Orta yaş yetişkinlerde erkeklerin %82’sine kadınların %93’üne klinik olarak tanı konulmadığı tahmin edilmektedir (Young ve ark 1993). Köktürk ve ark (1997) tarafından Türkiyede yapılan bir araştırmada ise OSAHS prevalansı %0,9-1,9 olarak saptanmıştır. İleri yaş döneminde (65 yaş ve üstü) hastalık prevalansının arttığı tahmin edilmektedir (Partinen ve ark 1998).
OSAHS’ın maksimum sıklığı 50 ve 70 yaşlar arasında artmaktadır (Guilleminault 2004). Yaş ile OSAHS arasındaki ilişki karmaşıktır. Birkaç çalışmada orta yaşlı bireyler ile yaşlı bireyler karşılaştırıldığında yaşlı bireylerde daha yaygın olduğu rapor edilmiştir. Ayrıca erkekler kadınlardan OSAHS bakımından daha yüksek bir risk taşımaktadır. Sebebi tam olarak açık değildir; fakat hormonal etkiler kısmi bir açıklama sağlayabilir. Kadınlarda menopoz sonrası hastalık riski menopoz öncesinden daha yüksek görülmektedir (Silke ve Sean 2007).
Yaş ve cinsiyetin haricinde obezite, horlama, ırk, ilaçlar, kraniofasial anatomi, nasal obstrüksiyon, ailesel ve genetik faktörler de OSAHS’ın gelişme riskini artırabilir. Avrupalılar ile Maori ve Pasifik adalarında yaşayanlar arasında yapılan bir çalışmada boyun çevresi, vücut kitle indeksi, yaş gibi faktörler alındığında ırkın, uyku apnesinin ciddiyetinde önemli olmadığı gösterilmiştir (Guilleminault 2004). Wisconsin uyku grubunun topladığı bilgiler ışığında hafif dereceli OSAHS’lı hastalarda vücut ağırlığındaki %10’luk bir artışın orta veya ciddi
4 dereceli OSAHS gelişimini 6 kat artırdığı gösterilmiştir (Sean ve ark 2005). Hipertansiyonlu hastalarda yapılan çalışmalarla OSAHS’ın sıklığının % 26-49, kontrol gruplarında ise % 0-12 oranında olduğu belirlenmiştir (Houwelingen 1999).
1.2.3. Etiyoloji
OSAHS çok sayıda gen, çeşitli çevresel faktörler ve gelişimsel faktörler tarafından etkilenen kompleks bir hastalıktır. Bu hastalık tekrar eden üst havayolu tıkanmalarına eğilim gösterir. Bu eğilim üst havayolu boyutu veya fonksiyonunu etkileyen nöromüsküler ve anatomik faktörler tarafından belirlenir. OSAHS için en güçlü risk faktörleri obezite ve erkek cinsiyetidir. Diğer risk faktörleri arasında boyun yapısı, yumuşak damak gelişimi, yaş, ilaçlar, çevresel etkiler ve genetik faktörler sayılabilir.
1.2.4. Klinik Özellikler
OSAHS solunum çabası devam etmesine rağmen tam (apne) veya kısmi (hipoapne) kesilme ile sonuçlanarak uyku süresince farengeal hava yolunda tekrar eden tıkanmalarla karakterizedir. Bunlar aralıklı olarak kan gazı bozulmalarına (hiperkapni ve hipoksemi) ve sempatik aktivasyonunda dalgalanmalara yol açan solunum bozulmalarıdır. Gürültülü horlama OSAHS’ın tipik bir özelliğidir ve birçok durumda bir solunum olayının sonucu kısa bir uyanıklık (arousal) ile sonlanmaktadır. Bu olaylar hastada, uyku ile uyanıklık arasında dalgalanmalar yaptığı için uyku bölünmeleri ve döngüsel bir solunum paterni ile sonuçlanır (Danny ve ark 2008). Bir diğer önemli semptom gün boyu aşırı uyuklamadır. Bu subjektif bir durum olduğu için belirlenmesi zordur. Klinik açıdan gün boyu uyuklamanın diğer sebepleri (metabolik) sorgulanmalıdır. Diğer olası semptomlar tıkanıklık olsun ya da olmasın kısa uyanıklıklar, gece terlemesi, uyku süresince anormal motor aktivitesi, idrar kaçırma, gastroözofagal reflü, başağrısı, göğüs ağrısı, cinsel yetersizlik, konsantrasyon ve hafıza kayıpları, kişilik değişiklikleri ya da depresyon olabilir (Houwelingen 1999).
OSAHS kesin tanısı için altın standart tanı yöntemi olarak uyku laboratuarlarında kullanılan Polisomnografi (PSG) testinin yapılması gerekir (Houwelingen 1999).
5
1.2.5. Polisomnografi (PSG)
Kesin tanısı konulacak hastaya, uyku süresince durumunu gözleyebilmek için bir gece uyku laboratuvarında polisomnografi testi uygulanır. Ayrıca subjektif bir test olan Epworth uykululuk skalası, gündüz aşırı uyku halini ölçmek için kullanılır. 10 puan ve üzeri patolojik olarak değerlendirilir.
Uyku süresince saatteki apne/hipoapne sayısı olan apne/hipoapne indeksi (AHI) tanı kriteri olarak önemlidir. Obstrüktif apne, oksijen saturasyonundaki düşme ve uyanıklığa yol açan, göğüs ve karında bir çaba olmasına rağmen ağız ve burundaki hava akışının en az 10 saniye süre ile kesilmesidir. Hipoapne ise ağız ve burundaki hava akışının %50, oksijen saturasyonunun %3 lük düşmesi ya da hava akışının %30, oksijen saturasyonunun %4 azalması olarak tanımlanır (Kaparianos ve ark 2006). Bu hastalığın ağırlık derecelerine göre sınıflandırılması ise AHI <5 normal, AHI 5-14 arası hafif dereceli, 15-30 arası orta dereceli, 30 ve daha yukarısı ağır dereceli OSAHS olarak tanımlanır (Sousa ve ark 2008).
1.3. Obezite, Leptin, Leptin Reseptörü 1.3.1. Obezite
Obezite, OSAHS için en büyük risk faktörlerinden birisidir (Redline ve Tishler 2000, Hiestand ve ark 2006). Klinikte görülen obez hastaların %50-77’sinde OSAHS saptandığı bildirilmiştir (Vgontzas ve ark 1994). Obstruktif uyku apne sendromlu olguların ise %70’inde obezite görülmektedir (Göçmen ve Karadağ 2007).
Obez ve obez olmayan bireyleri ayırmada; vücut ağırlığının (kg), boy uzunluğunun (m) karesine bölünmesi ile elde edilen vücut kitle indeksi (Body Mass Index: BMI) yaygın olarak kullanılır. BMI; 25,0-29,9 arası olanlar aşırı kilolu 30,0 ve daha yukarı olanlar ise obez olarak tanımlanmıştır (Marik 2000). BMI, OSAHS insidansı ve şiddetiyle direkt olarak ilişkilidir (Lopez 2008).
Obezite, boyun ve özellikle farenks çevresinde adipoz dokunun artmasıyla üst hava yolunu daraltmaktadır (Schwab ve ark 1995). Obezlerde üst hava yolu kapanma eğiliminin arttığı gösterilmiştir (Schwartz ve ark 1991). Özellikle santral obezite ile vital kapasitenin azalması, farenks üzerinde aşağı doğru genişletici kuvveti de azaltarak farenksin kapanabilirliğini arttırmaktadır (Demir 2007). Amerikada yapılan NHANES araştırması 1960’lı yıllardan 2000’li yıllara, 20-74 yaş grubu erişkinlerde BMI’nin ortalama 25 kg/m²’den 28 kg/m²’ye çıktığını göstermiştir (Zhang ve ark
6 2009). Dünya Sağlık Örgütü (DSÖ) verilerine göre ise 2015 yılı içinde dünya nüfusunun yaklaşık %10’unun obez olacağı tahmin edilmektedir (McClean ve ark 2008). Obezite metabolik sendromun bir komponenti olarak kardiyovasküler hastalıklar için bilinen en önemli risk faktörlerinden biridir. OSAHS’da da apneler sırasında kapalı hava yoluna karşı inspirasyon yapılmaya çalışılması sonucu oluşan intratorasik negatif basınç, hipoksemi, hiperkapni ve sık tekrarlayan arousallar ile otonom sinir sisteminin uyarılması, kardiyovasküler komplikasyonlara neden olmaktadır (Guilleminault ve ark 1993, Young ve ark 2002). Amerika Birleşik Devletleri’nde her yıl uykuda solunum bozukluğunun kardiyovasküler komplikasyonları ile 38.000 kişinin öldüğü ve 42 milyon dolarlık hastaneye yatış maliyetinden sorumlu olduğu tahmin edilmektedir.
Ciddi obez hastalar ventilasyon-perfüzyon uyumsuzluğuna sebep olan genişlemiş alveolar-arteriel oksijen değişimi ile sık sık hipoksemiktir. Dahası obezite pulmoner tromboembolizim için büyük bir risktir. Obezitenin etiyolojisi uzun bir periyod boyunca pozitif bir enerji dengesine sebep olacak potansiyele sahip birkaç faktör ile birlikte heterojen bir durum oluşturmaktadır. Bu faktörler yüksek bir yağ diyeti, alışılmış düşük seviyeli bir fiziksel aktivite, belirli bir vücut kitlesi ve kompozisyonu için düşük bir dinlenme metabolik hızı, açlık durumunda (standart koşullar altında lipidlerden daha çok karbonhidrat oksidasyonuna eğilim gibi) daha yüksek bir solunum oranı, muhtemelen yüksek insülin duyarlılığını içerebilir (Marik 2000). Obezite, düşük leptin seviyelerinden daha çok yüksek leptin seviyeleri ile karakterizedir. Bu durum obez insanlarda leptin direncinin olduğunu düşündürmektedir (Considine ve ark 1996). Birçok mekanizma leptin direnci ile ilgili olabilir. Mutant leptin reseptörüne bağlı azalmış leptin reseptör sinyalizasyonu bu durumun açıklamalarından biri olabilir (Schwartz ve ark 2005).
1.3.2. Leptin
Adipoz dokunun sadece lipidlerin depo edildiği bir yer olmadığı, aynı zamanda bir faktör salgılayarak vücut ağırlığını kontrol edebileceği fikri ilk kez 1953 yılında ortaya atılmıştır (Tritos ve Mantzoros 1997). Zhang ve ark (1994) tarafından obezitenin tipik fenotipinden sorumlu obezite geninin (ob/ob) bulunduğu bildirilmiştir. Ob geni sitokinlere benzeyen, 167 aminoasit içeren, 16 kilodalton ağırlığında olan ve adını Yunanca leptos (ince) kelimesinden alan bir protein olan leptin hormununu sentezler (Tritos ve Mantzoros 1997). Obezitenin patogenezinin anlaşılmasındaki başlıca ilerleme leptin hormonunun keşfidir. Leptin yapıca
7 sitokinlere olan benzerlikleri nedeniyle, sitokin olarak da sınıflandırılabilmektedir. Sıçanlarda 6 nolu kromozomda bulunan ob geni (Considine ve Caro 1997) insanlarda 7q31.3’de (7. kromozomun uzun kolunun 31.’ci bölgesi) lokalizedir (Green ve ark 1995). Bu genin iki intron tarafından ayrılmış üç ekzondan oluştuğu, bunlardan iki tanesinin (2. ve 3. ekzon) leptini kodlayan baz dizisini içerdiği gösterilmiştir (Considine ve Caro 1997). Bu baz dizisi 3.5 kb’lik bir mRNA kodlar ve translasyonla N terminalinde 21 aminoasitlik bir sinyal peptidi bulunan 167 aminoasitli prohormon sentezlenir (Brann ve ark 2002). Sirkulasyonda bu sinyal peptidi ayrılır, 146 aminoasitli ve 14-16 kDa ağırlığındaki leptin molekülü oluşur (Sandoval ve Davis 2003). İnsan leptini sıçan leptini ile %83, fare leptini ile %84 homoloji gosterir (Considine ve Caro 1997). Vücutta başlıca adipoz (yağ) dokuda sentezlenen leptinin az miktarda plasenta, gastrik epitelyum, iskelet kası, hipofiz ve meme bezi tarafından da salgılandığı gösterilmiştir (Bado ve ark 1998).
Leptin enerji dengesine oldukça duyarlıdır; diyet ve fiziksel aktivite leptin konsantrasyonunu etkilemektedir. Vücut yağ dokusu miktarı arttıkça leptin miktarı da artar. Obezlerde normale göre yaklaşık iki misli daha fazla leptin düzeyi vardır ve kan leptin miktarı vücut yağ kitlesiyle korelasyon gösterir. Vücut ağırlığındaki küçük değişiklikler serum leptin düzeyinde büyük değişikliklere yol açmaktadır. Obez insanlarda vücut ağırlığında %10’luk bir azalma ile serum leptin düzeyinde %53’lük bir azalma, ve vücut ağırlığında %10’luk bir artış ile ise serum leptin düzeyinde %300’lük bir artış görülür (Considine ve ark 1996).
Leptinin vücuttaki başlıca rolü, gıda alınımı ve enerji metabolizmasını düzenlemek ve obezite gelişmesini engellemektir. Ayrıca, metabolizmanın düzenlenmesi, cinsel gelişim, üreme, hematopoez, immünite, gastrointestinal fonksiyonların düzenlenmesi, sempatik sinir sistemi aktivasyonu, anjiogenez ve osteogeneziste de çok önemli rolleri olduğu saptanmıştır. Leptin eksikliği veya direnç durumları insanda obezite, diyabet ve infertilite ile sonuçlanmaktadır (Hekimoğlu 2006).
Leptin lipid oksidasyonunu arttırması ile birlikte yağ asidi ve trigliserit sentezini azaltarak intraselüler lipid artışını engeller. Lipid metabolizmasına etkisi, yağ asiti sentezinde enzim hızını sınırlayarak, asetil CoA karboksilaz aktivitesini engelleyen bir etki olabilir (Marik 2000). Leptin regülasyonunun incelenmesinde bazal leptin ve plazma leptin düzeyindeki değişikliklere etki eden genetik ve çevresel faktörlerin anlaşılması önem taşır.
8
1.3.3. Leptin Reseptörü (LEPR)
Tartaglia ve ark (1995), leptin reseptörlerinin yapısını ve yerleşimini tanımlamışlardır. Leptin reseptörü, sitozolik transkripsiyon aktivatörü (STAT) proteinlerinin aktivasyonu yoluyla gen transkripsiyonunu uyardığı bilinen gp130 sitokin reseptör ailesinin bir üyesidir (OMIM 2009). Leptin reseptörü OB-Rb (uzun reseptör) ve OB-Ra ( kısa reseptör) olarak 2 alternatif kırpılma (splicing) izoformuna sahiptir (Yiannakouris ve ark 2001). Biyolojik olarak aktif olanlardan birisi Ob-Rb izoformu sinyal transdüksiyonu kapasitesine sahiptir ve hipotalamusta (nükleus arkuatus) bol olarak ifade edilir. OB-Ra ise intraselüler sinyal için gerekli olan segmentlerin tümünü taşımazlar ve bu nedenle sinyal iletiminde rolleri çok az veya yoktur. OB-Ra reseptörlerinin bulunduğu başlıca dokular böbrek, akciğer, pleksus koroideus ve beyin kapillarlarıdır. Son ikisinde OB-Ra reseptörlerin bol bulunması bunların leptinin merkezi sinir sistemine transportunda önemli görevleri olduğunu düşündürmektedir (Aslan 2004).
Leptin reseptör geninin OB-Rb formu 70 kb’ dır ve 20 exon içerir (Şekil 1.1.). LEPR reseptörü protein yapısına göre hücredışı, transmembran ve hücreiçi bölgelerden oluşur. LEPR geninde birkaç fonksiyonel önemli domain vardır. Hücredışı bölgede ligand bağlanmasını sağlayan iki sitokin motifi (GXWSXWS) içerir. Hücreiçi bölge hipotalamusta STAT ve Janus-aktive kinazla (JAK) etkileşen diziler bulundurur (Matsuoka 1997, Yong-Jun ve ark 2003).
1.3.4. Leptin Reseptör Gen Polimorfizmleri
Evrim boyunca seçici baskı altında olan mutasyonların toplumda nadir gözlenen değişiklikler olmasına karşın polimorfizmler toplumda yaygın olarak bulunurlar (%1’in üzerinde). Oluş mekanizmalarına ve bulundukları yere göre farklı tipte polimorfizmler mevcuttur: kısa DNA baz tekrarları (mikrosatellit), uzun DNA baz tekrarları (VNTR), DNA’nın tek bir bazındaki değişiklikler (SNP).
LEPR genine ait OB-Rb gen yapısında 7 varyant bulunur. Bu tek nükleotid polimorfizmleri (SNP’ler) Şekil 1.1.’de verilmiştir.
9
Şekil 1.1. LEPR geninin şematik görünümü. LEPR’deki tek nükleotid
polimorfizmleri; ekzon 4’de 329. nükleotid de AG (Lys109Arg), ekzon 6’da 668. nükleotitte AG (Gln223Arg=Q223R), ekzon 9’da 1029.nükle otitte TC (Ser343Ser), ekzon 11’de 1475. nüklotitte GC (Ser492Thr), ekzon 14’de 1968. nükleotitte GC (Lys656Asn), ekzon 20’de CA (Ala976Asp), GA(Pro1019Pro) transisyon ve transversiyonları görülür (Matsuoka 1997).
1.4. Hipoksi ve Hipoksi İndüklenebilir Faktör-1α (HIF-1α) Geni 1.4.1. Hipoksi ve OSAHS İlişkisi
Hipoksi; oksijen verimi veya oksijen varlığının azalmasına yol açan nedenlerden kaynaklanır. Sürekli veya aralıklı olarak ve zamanla akut ya da kronik olarak ortaya çıkabilir. Kronik sürekli hipoksi fizyolojik ve patolojik durumda meydana gelirken, kronik aralıklı hipoksi yalnızca patolojik durumda meydana gelir (Semenza 2009). Vücut içinde parsiyel oksijen basıncı (PO2) seviyeleri, üst hava
yolunda 150 mm Hg’dan, retinada 5mm Hg’ye kadar düşer (Taylor 2008). Oksijen homeostazının korunması kompleks bir olaydır; hormonal, otokrin ve nöronal mekanizmalar arasındaki ilişkiyi gerektirir. Bu faktörlerde meydana gelecek bir dengesizlik, patolojik süreçleri beraberinde getirir ve hipoksi ile ilişkili hastalıklara yol açar. Günümüzdeki çalışmalar metabolik sorunların OSAHS’la ilişkili hipoksik stresle bağlantılı olduğunu göstermektedir (Jianguo ve ark 2006).
1.4.2. İntermittent (Aralıklı) Hipoksi
İntermittent (Aralıklı) Hipoksi, 15-30 sn’lik kısa süreli hipoksinin ardından, daha uzun süreli (örn 5 dak) yeniden oksijenlenme periyotlarından oluşur. İntermittent hipoksinin bir fare modelinde OSAHS ve metabolik sendrom arasındaki ilişki değerlendirilmiştir (Polotsky ve ark 2003, Li ve ark 2005a, 2005b). 5 gün boyunca intermittent hipoksiye maruz bırakılan farelerde hiperkolesterolemi ve
10 hipertrigliseritemi görülmüştür (Li ve ark 2005a). İntermittent hipoksi, lipid biyosentezinin anahtar bir transkripsiyon faktörü olan sterol düzenleyici element bağlama proteini (SREBP)-1 tarafından karaciğerde trigliserit biyosentezini arttırır (Shimano ve ark 1999, Horton ve ark 2002, Li ve ark 2005). İntermittent hipoksinin, HIF-1’in lipid biyosentezini arttıran SREBP-1 yolağını düzenleyerek uyardığı düşünülmektedir (Cai ve ark 2003, Yuan ve ark 2005).
1.4.3. Kronik İntermittent Hipoksi
Hipoksemiye yol açarak solunumun kesilmesi ve hava yolunu tıkaması ile sonuçlanan, sonrasında soluk alıp verme için bireyin uyarıldığı OSAHS’lı hastalarda görülür. Li ve ark (2006) ‘nın yaptığı bir çalışmada, OSAHS’ın kronik intermittent hipoksiyle tanımlandığını, lipid metabolizması ve aterosklerozun düzensizliği ile ilişkili olduğunu söylemişlerdir. Ayrıca, obezitenin varlığında kronik intermittent hipoksinin hiperkolesterolemi ve lipid peroksidasyonuna yol açtığını ortaya koymuşlardır. Hem hipoksemi (kanın eksik oksijenlenmesi) hem de hiperkapni (kanda karbondioksit fazlalığı) nöronal refleks mekanizmaları aracılığıyla çeşitli kardiyovasküler etkilere sahiptirler (Xie ve ark 2000). Bundan dolayı, hipoksinin uyku apnesinde kardiyovasküler hastalıkların gelişiminde rol oynadığı düşünülmektedir. Kronik intermittent hipoksi ayrıca sistemik hipertansiyonla uyarılır, OSAS’ın sistemik hipertansiyonlu bireylerin %30‘unda arttırıcı etki yaptığı düşünülmektedir (Laughner 2001). Ayrıca, rodentlerde ve insanlarda ROS üretimini ve HIF-1α ekspresyonunu da uyarır (Dyugovskaya ve ark 2002, Peng ve ark 2006, Prabhakar ve ark 2007).
1.4.4.Hipoksi İndüklenebilir Faktör-1 α (HIF-1α) Geni
HIF’in tanımlanması, eritropoietinlerde kronik hipoksinin çarpıcı etki mekanizmalarının araştırılmasına dayanır. Eritropoietin (EPO) geninin 3’enhansır bölgesinde DNA-protein etkileşimlerini kullanarak yalnızca hipoksik koşullar boyunca kısıtlanan bir protein kompleksi keşfedildi. Bu protein kompleksine bağlanarak EPO geninin transkripsiyonunun artmasına ve sonuç olarak EPO üretiminde artışa neden olmuştur. Bu kompleks daha sonraları Hipoksiyle İndüklenen Faktör-1 (HIF-1) olarak isimlendirildi (Semenza ve ark 1991). Hipoksiye hücresel yanıt çok aşamalı bir süreçtir ve transkripsiyonel yanıtların çoğu HIF’ler tarafından düzenlenir. Bu HIF gen ailesinin ana elemanları hipoksi ile indüklenen genlerin ifadelenmesini aktive eden HIF-1α geni ve diğeri HIF-1α proteini ile heterodimer oluşturan aryl hydrokarbon reseptör nüklear translokator (ARNT)
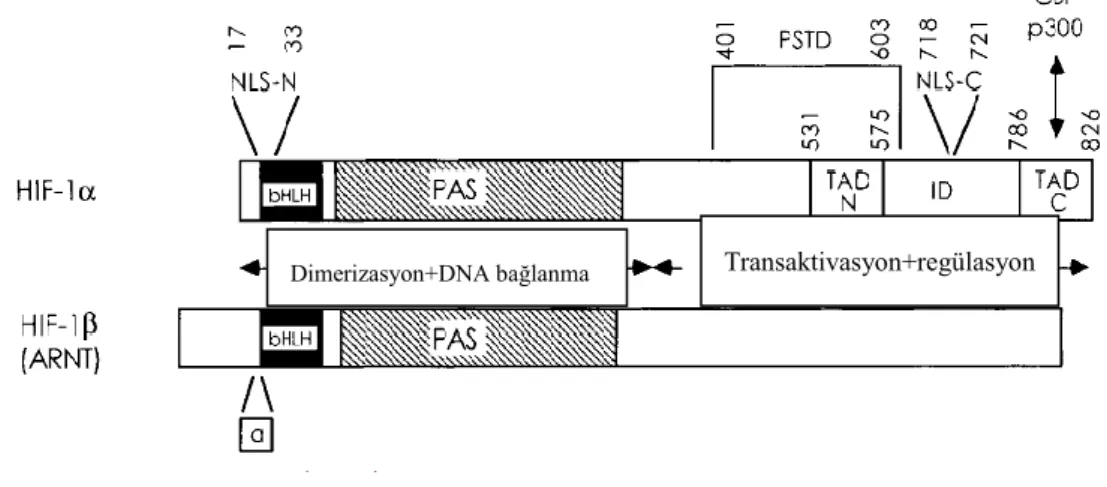
11 proteininin sentezinden sorumlu HIF-1β genidir. Bu heterodimer yapı PAS (Per-Arnt-Sim) ailesinin temel heliks-loop-heliks (bHLH) proteinleridir (Şekil 1.2.). (Kelsey 1993, Park ve ark 2003, Yamada ve ark 2005, Ke ve Costa 2006).
Şekil 1.2. HIF-1 ‘in yapısı (Semenza 2009).
HIF-1α, HIF-1’in varlığını saptadığı ve hipoksi ile indüklenen genleri aktive ettiği için ana proteindir (Yamada ve ark 2005). HIF-1α; kromozom 14q20-24’de bulunan, 15 ekzon ve 14 introndan oluşan bir gendir. Bu gen yapısında 3’ü yaygın 6’sı nadir olmak üzere toplam 9 varyant bulunmaktadır. Bunlardan exon 12’de 85. nükleotitde görülen CT değişikliği, proteinin aminoasit dizisinde prolinin serine dönüşümüyle sonuçlanır (Şekil 1.3.).
Şekil 1.3. HIF1-α geninde görülen varyantlar (Prior ve ark 2003). Dimerizasyon+DNA bağlanma Transaktivasyon+regülasyon
12 HIF-1β, oksijene yanıt oluşturmaz; fakat fonksiyonel HIF kompleksinin oluşumu için gereklidir. HIF α/ β heterodimerleri; 5’-RCGTG-3’ merkezi nükleotid sekansı ile hedef genin güçlendirici ya da promotorunda bir DNA bağlanma motifi olan hipoksi yanıt elementleri (HRE) üzerindeki hedef genlere bağlanır (Semenza 1992). HIF-1 proteinleri hücre ve dokularda düşük oksijen basıncına adaptasyon hücre sağ kalımı ve çoğalması, anjiyogenez, eritropoez, glikoz alınımı ve demir metabolizması gibi proseslere bağlı birçok genin hipoksiye transkripsiyonel aktivasyon cevaplarının anahtar düzenleyicisidir.
HIF-1α normoksik koşullar altında, oksijen bağımlı prolin hidroksilaz proteinleri (PHD) tarafından, oksijen bağımlı degregasyon domaini (ODD) prolin 402 ve 564 bölgesine hidroksillenir. Hidroksillenen HIF-1α alt üniteleri sonraki degradasyonlar için E3 ubikütin ligaz kompleksinin bir parçası olan VHL proteininin hedefidir. Bunun dışında HIF-1α’nın normoksik modifikasyonları onun transkripsiyonel aktivasyonunu da etkileyebilir. HIF-1α’nın C-terminal transaktivasyon domeynine asparajin 803 üzerindeki hidroksilasyon, faktör inhibe edici HIF-1 (FIH) tarafından normokside katalizlenir (Jessica and Karen 2011). Bu hidroksilasyon ile HIF-1α’nın CBR (CREB bağlanma proteini) ve P300 transkripsiyonel ko-aktivatörler ile etkileşimleri FIH tarafından baskılanarak regüle edilir (Hewitson ve ark 2002, Lando ve ark 2002). (Şekil 1.4). FIH sitoplazmada lokalize olmakla birlikte bazı fraksiyonları için çekirdekte de bulunabilir. FIH transkripsiyonu oksijen konsantrasyonundan bağımsızdır ve HIF-1α stabilitesini etkilemez (Metzen ve ark 2003).
13
Şekil 1.4. HIF-1’in oksijen-bağımlı regülasyonu. Normakside (sağ taraf), HIF-1α nın
iki prolin resüdüsü (P402
ve P564) ve asparajin (N803) sırasıyla PHD ve FIH’la O2,
2-OG ve Fe2+ ye bağımlı şekilde hidroksilize edilir. Hidroksillenen HIF-1α VHL proteini için bağlanacak bir yer oluşturur ve bu şekilde HIF-1α’nın ubikuitinasyonu ve proteozom aracılı yıkımı tetiklenir. Hipoksi dumunda (sol taraf) PHD ve FIH aktiviteleri baskılanarak prolin ve asparajinlerin hidroksilasyonu ortadan kalkar, ve VHL bağlanması olmaz. Bu durumda hidroksillenmemiş HIF-1α’nın CBP bağımlı p300 proteinlerine yönlendirilmesine, fosfatlanmasına ve HIF-1α stabilizasyonuna yol açılır. Stabillenen ve biriken HIF-1α proteinleri çekirdeğe transloke olur, HIF-1β’ ya bağlanır. Oluşan heterodimer DNA’nın hipoksi ile regüle olan element (HRE) sekanslarına bağlanır ve hedef genlerin transkripsiyonunu sağlar (Benarroch 2009).
Hipoksik koşullarda ne PHD’ler ne de FIH fonksiyoneldir. HIF-α proteazomal yıkımdan kaçar, sitozolde birikir, stabil hale gelir, fosforillenir ve nükleusa geçerek HIF-β ile heterodimerik bir kompleks oluşturur. Bu kompleks hipoksiyle indüklenebilen genlerin promotor ya da güçlendirici DNA sekanslarına bağlanır. HRE’lere HIF bağlanması sonucu hedef genlerin transkripsiyonu başlar (Lee ve ark 2004, Maynard ve Ohh 2005) (Şekil 1.5.). Hipoksiye ek olarak, TNF-α ve interlökin 1β gibi proinflamatuar sitokinler de HIF ifadesini tetikleyebilir (Rabie ve Marti 2008).
14
Şekil 1.5. Normoksi ve Hipoksi koşullarında HIF-1α geni (Girgis ve ark 2012). 1.4.5. HIF-1α’nın Hedef Genleri
Hücre ve organlar oksijen basıncındaki değişikliklere uyum sağlama ihtiyacındadırlar. HIF-1 hedef genlerinin bulundukları dokuya oksijen sağlanmasındaki değişimlere söz konusu dokuya özel bir şekilde adaptasyon göstermesi sürpriz olmamalıdır. Halen HIF-1’in adaptasyonu ile regüle edilen farklı fonksiyonlu 100 den fazla gen bulunmuştur. HIF-1 güçlendirici ve promotör bölgelerinde lokalize olmuş 50 baz çiftli bir cis-acting HRE bölgesine bağlanarak bu genlerin ifadesini aktive eder (Semenza ve ark 1991). Dahası arteriyal endotel hücrelerinde, insan genlerinin %2’den fazlasının, direkt veya indirekt olarak HIF-1 tarafından regüle edildiği bildirilmiştir (Manola ve ark 2005, Koukourakis ve ark 2006, Semenza 2009).
15
1.5. Obezite, HIF-1α Geni ve Leptin Arasındaki Bağlantılar
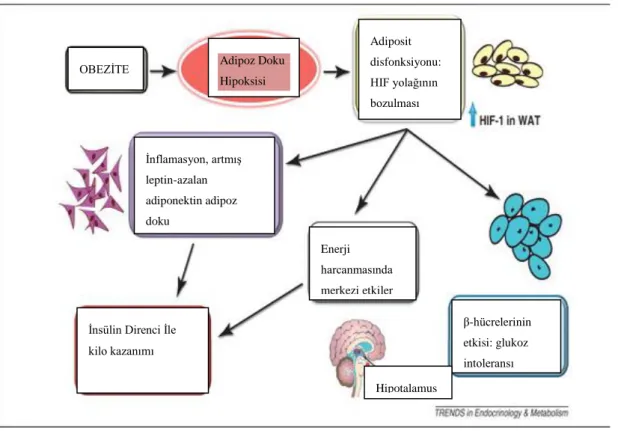
Şekil 1.6. Tamir edilmemiş glukoz homeostazı ve adiposit bozukluğunda HIF-1α’nın
rolü. Obez bireylerdeki, adipoz doku hipoksisi inflamasyon ve makrofaj infiltrasyonunu içeren adipositlerdeki HIF-1α’nın disregülasyonu bir dizi olaylar zincirini başlatır (Girgis ve ark 2012).
Leptin, keşfinden beri adipoz dokunun adipokinleri üreten dinamik bir organı olduğu bilinir. Adipoz doku, enerji dengesinde, glukoz metabolizmasında, inflamasyonda ve bağışıklıkta belirli rollere sahiptir (Trayhurn 2001, Sell 2006). Kültüre edilmiş adiposit ve preadipositlerde, HIF-1α ekspresyonunun; hipoksiye ve kobalt (II) kloride, inflamatuar mediatör olan IL-6’nın artan seviyesine ve monosit göç-inhibitör faktöre maruz kalınması sonucunda, yüksek leptin ve azalan adiponektin seviyeleri tarafından düzenlendiği bilinir (Wang ve ark 2007).
Obez bireylerde, abdominal yağ dokusu içinde azalan oksijen basıncı büyük makrofaj filtrelemesiyle ilişkilidir (Pasarica 2009). Adipoz doku hipoksisinin zararının ve hipoksiye adiposit cevap defektlerinin çeşitli hastalıkların patogenezine katkı sağladığı gösterilmiştir.
1.6. Leptinin Uyardığı Sinyal Yolakları ve HIF-1α Bağlantısı
Leptin, onkogenler, sitokinler ve büyüme faktörleriyle karmaşık bir etkileşim içersindedir. Leptin ile uyarılmış sinyaller birçok sitokin tarafından yaygın olarak çeşitli yolakları tetikler. Bunlardan JAK2/STAT; MAPK/ERK1/2 ve PI3K/AKT1
OBEZİTE Adipoz Doku
Hipoksisi Adiposit disfonksiyonu: HIF yolağının bozulması İnflamasyon, artmış leptin-azalan adiponektin adipoz doku Enerji harcanmasında merkezi etkiler β-hücrelerinin etkisi: glukoz intoleransı Hipotalamus
İnsülin Direnci İle kilo kazanımı
16 sinyal yolaklarını tetiklediği kesinleşmiş olmakla beraber; PKC, JNK ve p38 henüz kesinleşmemiştir. Leptin ile uyarılmış sinyallerin her birinin, besin alımı üzerindeki biyolojik etkilerine, enerji dengesine, adiposite, immun ve endokrin sistemlere ve ayrıca onkogenlere etkisi önemlidir. Leptin reseptör izoformları arasında, yalnızca Ob-Ra, tam bir hücreiçi domain içerir ve ligand bağlanmasında hücreiçi JAK-STAT yolağını aktive eder ve sırasıyla Ob-Ra fosforilleyen JAK’ları kuvvetlendirip konformasyonel değişiklikleri uyarır (Guo ve ark 2012) (şekil 1.7.). Leptin ve HIF-1α arasındaki ilişki çift yönlüdür. HIF’ler çeşitli hücre tiplerinde leptin sinyalini artırabilir. Ayrıca, HIF/p300 kompleksinin leptin transkripsiyonuna karıştığı, majör HIF koaktivatörü olan p300’ün güçlenmesi ve leptin promotoru üzerinde HIF-1α’ya katılmasının aynı anda olduğu gösterilmiştir. Diğer taraftan, leptin de HIF-1α’yı uyarabilir. Leptinin VEGF (vasküler endotelyal growth factor) promotoruna etki ederek HIF-1α’nın DNA bağlanma aktivitesini arttığı gösterilmiştir (Gonzalez ve ark 2010).
17
1.7. Amaç
OSAHS solunum çabası devam etmesine rağmen tam (apne) veya kısmi (hipoapne) kesilmelerle uyku süresince farengeal hava yolunda tekrar eden tıkanmalarla karakterizedir. Obezite ve erkek cinsiyeti, OSAHS için belirlenmiş en yaygın risk faktörleridir. Uyku düzensizliği şikâyeti olmayanların %40’ı, bariatrik cerrahi altındaki bütün adolesanların % 55’i ve morbid obezlerin %71’inden fazlası OSAHS göstermektedir (Sousa ve ark 2008). Leptin adipositlerde üretilen bir hormondur ve hipotalamusta spesifik reseptörüne bağlanarak iştahın azaltılması ve enerji tüketiminin artırılmasından sorumludur. Hem hayvan hem de insan çalışmaları, Leptin ve LEPR’nin obezite mekanizmasında önemli rolü olduğunu göstermiştir. Leptin sinyal kaybı insanda ciddi obeziteye sebep olmaktadır ve dolaşımdaki leptin konsantrasyonu body mass index (BMI-Vücut Kitle İndeksi) ile güçlü ve pozitif bir ilişkiye sahiptir (Hanaoka ve ark 2008).
İnsan genomunda en çok bulunan genetik çeşitlilik tipi, tek nükleotit polimorfizmleridir (SNP). Bu çalışmada ilk önce LEPR’lerinden Ekzon 4’de 326.nükleotidinde (kodon 109) A→G dönüşümü gerçekleşen Lys109Arg polimorfizmi ve Ekzon 14’de 1968. nükleotitinde G→C dönüşümü gerçekleşen Lys656Asn polimorfizminin OSAHS’la ilişkili olup olmadığını RFLP metodu kullanarak Konya populasyonunda değerlendirilmesi amaçlanmıştır.
Kronik intermittent hipoksi, OSAHS’ın sık görülen bir özelliğidir. Kronik intermittent hipoksi ve reoksijenasyona hücresel yanıt, OSAHS’ın patofizyolojik sinyal yolaklarının iç yüzünü anlamamızı sağlayabilir. CIH, oksidatif streste kas duyarlılığını değiştirebilir. Hipoksik koşullar altında oksijen homeostazını düzenleyen transkripsiyon faktörü HIF-1α’dır. Günümüzdeki çalışmalar 100’den fazla genin transkripsiyonunu düzenlediği bilinen HIF-1α geninin leptinle olan ilişkisini ortaya koymuştur (Shanchun ve ark 2012). Çünkü hipoksi leptinin ifadelenmesini artırır. Yapılan bir çalışmada leptinin yeni bir hipoksi-indükleyici gen (HIF) olduğunu, HIF-1’in HRE bölgesi ile etkileşimi yoluyla leptinin uyarıldığını göstermiştir (Grosfeld ve ark 2002). Bu çalışmada HIF-1α’da meydana gelebilecek bir değişikliğin OSAHS’lı bireylerde hipoksi yanıtını değiştirebileceği düşüncesinden yola çıkılarak; HIF-1α’da yaygın olarak görülen Ekzon 12’de 85.nükleotidinde C→T dönüşümü gerçekleşen Pro582Ser polimorfizminin
18 OSAHS’la ilişkisinin olup olmadığı ARMS metodu kullanılarak değerlendirilmesi amaçlanmıştır.
LEPR genindeki Lys109Arg polimorfizminde, G allelinin etkisi dominant (AA ve AG/GG) ve resesif (AA/AG ve GG), Lys656Asn polimorfizminde C allelinin etkisi dominant (GG ve GC/CC) ve resesif (GG/GC ve CC) ve HIF-1α genindeki Pro582Ser polimorfizminde T allelinin etkisi dominant (CC ve CT/TT) ve resesif (CC/CT ve TT) modeller ile gruplar arasında belirlenmeye çalışılmıştır. Gruplar ve genotip modelleri ayrı ayrı değerlendirilerek diğer değişkenler (Yaş, BMI, AHI, Boyun çevresi, Bel çevresi, Kolesterol, Trigliserit, HDL, LDL, Kan basıncı, Oksijen saturasyonu-%-, Epworth uykululuk skalası) arasındaki ilişki çeşitli istatiksel yöntemler kullanılarak açıklanmaya çalışılmıştır.
19
2. GEREÇ ve YÖNTEM 2.1. Hasta Kabulü
Selçuk Üniversitesi Meram Tıp Fakültesi Göğüs Hastalıkları Uyku Laboratuvarına 2011 yılında başvuran erkek bireylerden horlama, tanıklı apne ve gündüz aşırı uyku hali şikâyetlerinin en az biri ya da üçü birlikte olanlar çalışmaya dahil edildi. Boyun ile bel çevresi ve kan basınçları ölçüldü. Gerekli görülenlerin hasta yatışı yapıldı ve rutin biyokimyasal parametreler (hemogram, glukoz, kolesterol, trigliserit, HDL, LDL… gibi) ve diğer tahlilleri (EKG, solunum fonksiyon testi, iki yönlü akciğer grafisi) yaptırmaları için yönlendirildi. Yatışı yapılan hastalar akşam PSG testi için uzman uyku teknisyenleri tarafından hazırlandı. Yaklaşık 1-1,5 saat arasında süren hazırlıklar sonrası, hastanın sabaha kadar uyku durumu sürekli olarak gözlenerek ortalama 6-8 saat süren standart PSG prosedürüne uygun kayıtları alındı. Alınan kayıtlar sabah uzman doktor tarafından değerlendirilerek tanı konuldu ve hastalığın ağırlık derecesi (AHI’ ye göre) belirlendi. Hastane personeli ve yakın çevreden gönüllü olarak çalışmaya katılmayı kabul eden bireyler kontrol grubuna dahil edildi, hastalara uygulanan kabul prosedürü ve PSG uygulandı. PSG testi sonrası AHI <5 ‘in altında olan normal bireyler çalışmaya alındı.
2.2. Çalışma gruplarının oluşturulması
Hasta grupları OSAHS dışında başka bir uyku problemi ve solunum bozukluğu bulunmayan obez ve obez olmayan hastalardan oluşturuldu. Kontrol grubuna ise zayıf ve tamamen sağlıklı -herhangi bir uyku problemi ve ek hastalığı olmayan- bireyler dahil edildi. BMI değeri obez ve aşırı kilolu olanlarda >27, obez olmayanlarda ≤27 olarak kabul edildi. Hasta grubu BMI indeksine göre Obez/Hasta (1) ve Obez olmayan/Hasta (2) olmak üzere 2 alt gruba ayrıldı.
OSAHS’lı hastalar AHI’ye göre istatistiksel değerlendirilme için 3 alt gruba ayrıldı. Buna göre hafif olanlar 5-15, orta dereceli 15-30, ağır dereceli ≥30 olarak belirlendi.
2.3. Uyku Çalışması
Kesin tanısı konulacak hastaya uyku süresince durumunu gözleyebilmek için bir gece uyku laboratuarında polisomnografi testi uygulandı (VIASYS Healthcare GmbH, Hoecberg, Germany). Bu test oronazal hava akımı kayıdı (termistor veya oro-nazal kanül), toraks ve abdomen hareketini kaydetmek için kemer (gerilmeyi ölçmek), 2 kanal EKG (elektrokardiyogram), çene-EMG (submental
20 elektromyogram) ve bacak-EMG (bacak elektromyogram), sağ ve sol EOG (elektrookülogram), 6 kanal EEG (elektroensefalogram C4-A1, C3-A2, O2-A1), oksijen
saturasyon probu (pulse oksimetre), horlama sensörü’ne (mikrofon) ait parametreler kayıt edildi. Ayrıca gündüz aşırı uyku halini ölçmek için kullanılan ve subjektif bir test olan Epworth uykululuk skalasında 10 puan ve üzeri patolojik olarak değerlendirildi. Apne ≥10sn hava akımındaki kesilme, hipoapne ≥10 sn süresince bazal hava akımındaki 50 % azalma ile birlikte 3% ‘lük desaturasyon veya bir uyarılma ile sonlanması olarak tanımlandı.
2.4. Hastadan Kan Alınması
Belirlenen kriterlere uyan hasta ve sağlıklı bireylerden genomik DNA (Deoksiribonükleik asit) izolasyonunda kullanılmak üzere antikoagülan (EDTA-Etilendiamintetraasetikasit) içeren vakumlu tüplere 10 ml periferal kan alındı ve -20 0C’ de depolandı.
2.5. Genomik DNA İzolasyonu
Genomik DNA izolasyonu için klasik yöntem olan SDS ve Proteinaz K yöntemi kullanıldı.
10 ml’lik kanlar 50 ml’ lik falkon tüplere konuldu. Üzerlerine 0,5 ml 0,5 M EDTA (pH 8,0) eklendi. Bunların üzerine 2X Lysis Buffer ilavesi ile 50 ml’ ye tamamlandı. 10 dakika boyunca tüpler alt üst edilerek iyice karıştırıldı. Daha sonra 30 dakika buzun içinde bekletildi. Buzdan alındıktan sonra 3000 rpm de +40C de 10 dakika santrifüj edildi. Santrifüj sonrası tüplerin süpernatant fazı atıldı. Tüplerdeki pellet üzerine 3 ml Salt/EDTA eklenerek iyice vortekslendi. Daha sonra üzerlerine 0,3 ml %10’luk SDS (Sodyum dodesil sülfat) solüsyonu, 150 µl proteinaz K (10 mg/ml) eklenerek örnekler 55 0
C de 3 saat inkübe edildi. Bekleme süresi sonunda tüplerin üzerine 3 ml Fenol (pH 8,0) eklendi. Tüpler 20 saniye oldukça sert bir şekilde çalkalandı ve sonra 5 dakika da yumuşak şekilde ters yüz edildi. Daha sonra tüpler 3000 rpm de +40
C de 10 dakika santrifüj edildi. Santrifüj sonunda tüplerdeki süpernatant kısmı yeni steril falkon tüplere alındı. Her tüpün üzerine 3 ml Fenol: Kloroform: İzoamil Alkol (25:24:1) eklendi. Tüpler 20 saniye oldukça sert bir şekilde çalkalandı ve sonra 5 dakika da yumuşak şekilde ters yüz edildi. Daha sonra tüpler 3000 rpm de +40
C de 10 dakika santrifüj edildi. Santrifüj sonunda tüplerdeki süpernatant kısmı yeni steril falkon tüplere alındı. Süpernatanın 1/10’ u kadar 3M Na Asetat (NaAc) pH=5,2 eklendi. Üzerlerine, alınan süpernatant kısmının 2,5 katı kadar -200C de soğutulmuş %95’lik etanol (EtOH) eklendi. Tüpler sert bir şekilde
21 sallanarak DNA’lar cam çubuk ile alındı ve yeni steril 1,5 ml’ lik ependorf tüplere konuldu. Pelletler kurutuldu ve alkol uzaklaştırıldı. Daha sonra pellet, 0,5 ml 10 mM Tris (pH 8,0) ile sulandırıldı.
Sulandırılan stok DNA’lar -200C’de saklandı. DNA’ ların kalitesi ve miktarını ölçmek için S.Ü. Veteriner Fakültesi Biyokimya Genetik Laboratuarına ait spektrofotometrik ölçüm yapabilen nanodrop cihazı kullanıldı. Kontaminasyonu önlemek için 0,5 ml stok DNA’ dan 0,1 ml’ lik 50-100 ng/ml konsantrasyonda olacak şekilde çalışma stoğu hazırlandı ve tekrar nanodrop cihazında ölçüm yapıldı.
2.5.1. İzolasyonda Kullanılan Çözeltiler
10x Lysis Buffer: 770 mM NH4Cl, 46 mM KHCO3, 10 mM EDTA
10X Lysis Buffer hazırlanışı: Mezür içerisine yukarıdaki konsantrasyonlarda miktarlar tartılarak konuldu. Önce 200–300 ml dH20 içerisinde çözülür. EDTA’ nın
çözülmesi için pH=8 yapıldı. Daha sonra 1 litreye tamamlandı.
Salt Edta: 75 mM NaCl, 25 mM EDTA
Salt EDTA hazırlanışı: Mezür içerisine yukarıdaki konsantrasyonlarda miktarlar tartılarak konuldu. 200-300 ml dH2O içerisinde çözüldü. EDTA’ nın çözülmesi için
pH=8 yapıldı. Daha sonra 1 litreye tamamlandı.
%10 SDS solüsyonu; SDS: 10 gr, dH2O: 100ml
Hazırlanışı: 10 gr SDS tartıldı, 100 ml’ ye tamamlandı. Çözülmesi için 68 0
C de sıcak su banyosunda bekletildi.
10 mM Tris : (Tris MA: 121,4): 50 ml Tris için 0,060 gr tartıldı ve 50 ml ye
tamamlandı.
Sodyum Asetat Çözeltisi: (NaAc MA: 136): 500 ml 3M NaAc çözeltisi için 204 gr
tartıldı ve dH2O ile 500 ml’ ye tamamlandı. HCl ile pH= 5,2 ‘ye ayarlandı. +4 0C’ de
muhafaza edildi.
2.6. Polimeraz Zincir Reaksiyonu (PZR)
Genomik DNA’dan istenilen gen bölgesini çoğaltmak için polimeraz zincir reaksiyonu (PZR) yapıldı.
LEPR genindeki Lys109Arg polimorfizmine (rs1137100) ait primer çifti online (http://frodo.wi.mit.edu/primer3/) Primer3 veritabanında tasarlandı. Aşağıda verilen tüm primerler Metabion (Almanya) firmasına sentezlettirildi.
22 İleri primer (Forward)
5’-AAC CTA TGA CTA CTT CCT TTT GCC-3’ Tm: 62 0C Geri primer (Reverse)
5’- AAA CTA AAG AAT TTA CTG TTG AAA CAA ATG GC-3’ Tm: 65 0C LEPR genindeki Lys656Asn polimorfizmine (rs:8179183) ait primer çifti
Oksanen ve ark’ın (2000) yapmış olduğu çalışmada kullanılan primer çifti seçildi. İleri primer (Forward)
5’- CAA CTT GTC ATT TTG CAG TTC C-3’ Tm: 65 0
C Geri primer (Reverse)
5’- CTT CCAAAGTAAAGTGACATTTTTCGC-3’ Tm: 670C HIF-1α Genine ait C1772T (Pro582Ser) (rs:11549465) polimorfizmi için online (http://primer1.soton.ac.uk/primer1.html) Primer1 veritabanı kullanılarak 2 primer çifti tasarlandı.
İçerden ileri primer (T allele):
5’- TCC AGT TAC GTT CCT TCG ATC AGT TGT AAT -3’ Tm: 680
C İçerden geri primer (C allele):
5’- AGG GCT TGC GGA ACT GCT TTC TAA GGG-3’ Tm: 710
C Dışardan ileri primer (5' - 3'):
5’- GCT GAA GAC ACA GAA GCA AAG AAC CCA T-3’ Tm: 750
C Dışardan geri primer (5' - 3'):
5’-TGT ATG TGG GTA GGA GAT GGA GAT GCA A-3’ Tm: 760
C PZR, her bir örnek için çizelge 2.1 ve 2.2.’ de miktarları ve konsantrasyonları
verilen 20 ul reaksiyon hacminde ve reaksiyon koşullarında çalışıldı. PZR sonrası Lys109Arg için 230bç (baz çifti)’ lik, Lys656Asn için 175bç’lik, Pro582Ser için ise 450bç’lik PZR ürünü oluşturuldu. PZR çalışması için peQLab-primus 96 advanced marka cihaz kullanıldı.
23
Çizelge 2.1. PZR reaksiyon bileşenleri ve reaksiyon koşulları (Lys109Arg ve
Lys656Asn için).
Bileşen Miktar Konsantrasyon 1. basamak 2. basamak 3. basamak
ddH2O 13,22 ul Denatürasyon 94 oC 8 dk. Denatürasyon 94 0C 1dak Son Uzama 72 0C 10dk Buffer 2,5 ul 1X dNTP 1,6 ul 10mM İleri primer 0,14 ul 50 pmol/ul Birleşme 61 0C 1dak Geri primer 0,14 ul 50 pmol/ul Taq Poly. 0,4 ul 2,5 U/ul DNA 2 ul 50-100 ng/ml Uzama 72 0C 90sn Total 20 ul
Çizelge 2.2. Pro582Ser için PZR reaksiyon bileşenleri ve reaksiyon koşulları.
Bileşen Miktar Konsantrasyo
n 1. basamak 2. basamak 3. basamak ddH2O 13,22 ul Denatürasy on 94 oC 8 dk. Denatürasyon 94 0C 1dak Son Uzama 72 0C 8dk Buffer 2,5 ul 1X dNTP 1,6 ul 10mM Geri primer(dışarıdan) 0,14 ul 50 pmol/ul Birleşme 60 0C 1dak İleri primer(dışarıdan) 0,14 ul 50 pmol/ul İleri primer(içerden) 0,14ul 50 pmol/ul Uzama 72 0C 1dak Geri primer (içerden) 0,14ul 50 pmol/ul
Taq Poly. 0,4 ul 2,5 U/ul
DNA 2 ul 50-100 ng/ml
24
2.7. Agaroz Jelde Görüntüleme
PZR sonuçlarını değerlendirmek için % 2’ lik agaroz jel hazırlandı. Her bir örnek için 5 ul PZR ürünü ve 2,5 ul yükleme boyası karıştırılarak kuyucuklara yüklendi. 120 volt akımla 20-30 dakika yatay elektroforezde yürütüldü. Daha sonra jel ultraviyole transilüminatörde görüntülendi ve kaydedildi.
50X TAE (Tris-Asetik asit-EDTA): 1 litre hazırlamak için 242 gr Tris, 100 ml
0,5M EDTA, 57,1 ml Glasiyel asetik asit ve yeteri kadar dH2O eklendi. Hacim 1000
ml ye tamamlanmaya yakın HCl ile pH 7,6-7,8’ e ayarlandı.
% 2’ lik Agaroz jel hazırlama: 100 ml hacim için 2 gr agaroz tartıldı ve 100 ml’ ye
tamamlandı. 1 dakika boyunca yüksek ayarda mikrodalga fırında eritildi. Sonra çeker ocak içinde PZR ürünlerini görünür hale getirmek için 10 ul EtBr (Etidyum Bromür) eklenerek hafifce karıştırıldı. Daha sonra elektroforez kalıbına döküldü. Jel donduktan sonra PZR ürünleri kuyucuklara yükleme tamponu ile yüklendi.
2.8. Restriksiyon Fragment Uzunluk Polimorfizmi (RFLP)
DNA’yı belli baz dizilerinden tanıyıp kesen enzimler DNA kesim enzimleri (Restriction Endonucleases) olarak isimlendirilirler. Bazı kesim enzimlerinin özgül tanıma bölgeleri genellikle 4-6 DNA bazından oluşur. Normalde enzimin tanıma bölgesi olan bu bazlarda bir değişiklik olduğunda enzimin DNA’yı kesme kalıbı değişecektir. Yani genomik DNA’da oluşan dizi değişiklikleri, belirli kesim bölgeleri yaratır veya olanları yok eder. Bu enzim kesim özellikleri polimorfik nitelikteki genetik göstergelerin bir diğer örneği olarak kabul edilebilir. Görülüyor ki altta yatan moleküller değişiklik ne olursa olsun polimorfizm denildiği zaman genetik materyalde bireyleri (hatta aynı bireyin farklı allellerini) birbirinden farklılaştıran ve toplumda yaygın olarak bulunan değişikliklerden söz edilmektedir.
Bu çalışmada 2 SNP’in ( tek nükleotid polimorfizmi) genotiplendirilmesi için uygun şekilde çoğaltılan PZR ürünleri polimorfik bölgeye uygun restriksiyon endonükleaz ile kesildi. Bu aşamada Lys109Arg için GG/CC tanıma bölgesine sahip
HaeIII enzimi (Sibnezyme) kullanıldı.
Her bir reaksiyon için tüplere toplam 20 ul’ lik hacimde olacak şekilde 10 ul PZR ürünü, 1 ul kesim enzimi (10 U/ul), 1 ul 10x enzim buffer ve 8 ul dH2O
25 Lys656Asn için CG/CG tanıma bölgesine sahip BstU1 enzimi (Sibnezyme) kullanıldı. Her bir reaksiyon için tüplere toplam 20 ul’ lik hacimde olacak şekilde 10 ul PZR ürünü, 1 ul kesim enzimi (10 U/ul), 2.5 ul 10x enzim buffer ve 11.5 ul dH2O
konuldu. Enzim aktivitesi için 60 0C’de 1 gece boyunca etüvde bekletildi. 2.9. Amplifikasyon Refraktör Mutasyon Sistem (ARMS)
ARMS-PZR tekniğinde mutant olan ve olmayan nükleotidler, 3' uçları bu nükleotidlerle çakışacak şekilde tasarlanmış primer çiftlerinin kullanıldığı PZR işlemi ile ayırt edilir. Bu primerlerden birinin terminal 3' nükleotidi mutant nükleotide, diğerininki ise mutant olmayan nükleotide spesifiktir. Toplamda 4 primer kullanılır, bunlardan 2 tanesi fasta dizisine uygun ileri ve geri primer olarak en dıştan (outer) tasarlanan ortak primerlerdir. Diğer 2 tanesi fasta dizisine uygun ileri ve geri primer olarak SNP’in değişim bölgesine uygun olarak en içten (inner) tasarlanan primerlerdir. Bir tanesi normal diziye spesifikken diğeri mutant diziye spesifiktir. İçteki primerler SNP’teki biallelik değişme uygun 2. nükleotid bilerek spesifikliği arttırmak için yanlış tasarlanır. Bu çalışmada Pro582Ser polimorfizmi için ARMS-PZR metodu tercih edildi. Dışardan ileri primer ile içerden geri primer çifti normal alleli (270 bç) gösteren PZR ürününü, içerden ileri primer ile dışarıdan geri primer çifti mutant alleli (230 bç) gösteren PZR ürününü oluşturdu. En dıştaki ileri ve geri primerler total PZR ürününü (450 bç) verdi. Bu metod enzim kullanılmasını gerektirmediği için RFLP’ye göre hem daha ucuzdur hem de tek bir PZR yaparak çok daha kısa bir sürede genotipleri elde etmek mümkündür.
2.9.1 Agaroz Jelde Görüntüleme
Jel görüntüsü için %2’ lik agaroz jel hazırlandı. Enzim aktivitesini sonlandırmak ve yükleme yapabilmek için 3 ul yükleme tamponu ve 10 ul RFLP ürünü karıştırılarak jeldeki kuyucuklara yüklendi. 45W akımla 35 dakika yürütüldü. Sonuçları değerlendirmek için jel UV transilüminatörde görüntülendi.
2.10. İstatistiksel Değerlendirme
Tanımsal istatistik klinik ve biyokimyasal parametreler için elde edildi. Hasta ve kontrol gruplarının karşılaştırılmasında bağımsız-t testi uygulandı. Hasta ve kontrol gruplarında genotip dağılımı, allel frekansları ve Hardy-Weinberg değerlendirilmesinde Ki-kare uyum iyiliği (Chi-square goodness fit) testi yapıldı. Analizlerde mutant allellerin etkisini değerlendirmek için kodominant, dominant ve resesif modeller kullanıldı. Dominant modelde homozigot yabanıl tip bireyler diğerleri ile resesif modelde homozigot mutant bireyler diğerleri ile karşılaştırıldı.
26 Analizlerde SPSS versiyon 15 kullanıldı. Sonuçlar istatistiksel olarak P<0,05 düzeyinde anlamlı kabul edildi.
2.11. Etik Kurul Onayı
Yüksek lisans tezi olarak hazırlanan “Leptin Reseptörü ve Hipoksi-indüklenebilir Faktör-1alfa genlerindeki polimorfizmlerin OSAHS’la ilişkisi” başlıklı bu çalışma 31.03.2011 tarihli ve 2011/114 karar sayılı etik kurul onayı almıştır.
27
3. BULGULAR
OSAHS’ lı 154 hasta ve 39 sağlıklı kontrole 1 gece boyunca PSG yapıldı. Bütün hasta ve kontrol grupları önce boy (cm), kilo (kg), BMI (m2/kg), AHI (olay/saat), boyun çevresi (cm), bel çevresi (cm), kolesterol, trigliserit, HDL, LDL, sistolik kan basıncı (mmHg), diastolik kan basıncı (mmHg), %O² Saturasyon, Epworth uykululuk skalası değerleri ile karşılaştırıldı. Daha sonra hasta ve kontrol grupları lipid paneli ve kan basıncı değerleri ile karşılaştırıldı. Gruplar arasında genotip dağılımı ve allel sıklıkları değerlendirildi. Hastalara ait genotip modelleri yukarıda belirtilen tüm parametreler ile karşılaştırıldı.
3.1. Pro582Ser Polimorfizmini İçine Alan Gen Bölgesinin PZR Sonuçları
PZR ürünü %2’lik agaroz jelde yürütüldü. ARMS-PZR metodu ile genotiplendirilmesi yapılan bu SNP’de 450, 270 ve 230 bç uzunluğunda bantlar tespit edildi. Bu bantların yeri moleküler ağırlık belirteci (100 bç’lik) ile karşılaştırıldı (Şekil 3.1.). 1 nolu kuyucukta yabanıl, 4 nolu kuyucukta ise heterozigot genotipe ait bantlar mevcuttur. (M: Molekül ağırlık belirteci 50 bp).
28
Şekil 3.2. Pro582Ser polimorfizminin dizi analizi sonucu.
3.2. Lys109Arg Polimorfizmini İçine Alan Gen Bölgesinin PZR Sonuçları
154 hasta ve 39 kontrole ait PZR ürünleri %2’lik agaroz jelde yürütüldü. 230 baz çifti uzunluğuna karşılık gelen bantlar moleküler ağırlık belirteci (M) (50bç) ile karşılaştırıldı (Şekil 3.3.).
Şekil 3.3. Lys109Arg Polimorfizmininin PZR Sonucu.
3.3.Lys109Arg Bölgesi PZR Ürünlerinin HaeIII Restriksiyon Enzimi ile Kesimi
HaeIII, çift zincirli DNA’ yı GG/CC dizisinden tanıyarak kesim yapar. PZR tepkimesi sonrası 230 bç’lik PZR ürünü HaeIII restriksiyon enzimi ile kesildi. Bu bölgede guanin içeren allel HaeIII kesim noktası taşımaktadır. AA homozigot bireylerde enzimin tanıma bölgesini içermediğinden 230 bç’lik tek bant, heterozigot bireylerde (AG) 230, 210 ve 20 bç’lik üç bant, her iki allelinde değişim görülen
FORWARD
29 bireylerde (GG) 210 ve 20 bç’lik iki bant görüldü. Kesim sonrası ürünler %2’ lik agaroz jelde yürütüldü. HaeIII kesimine ait agaroz jel elektroforezi görüntüsü Şekil 3.4.’ de gösterilmiştir. 1 nolu kuyucukta yabanıl, 7 nolu kuyucukta ise heterezigot genotipe ait bantlar mevcuttur. Moleküler ağırlık belirteci (M) 100 bp’dir.
Şekil 3.4. Lys109Asn Polimorfizminin RFLP Sonucu.
3.4. Lys656Asn Polimorfizmini İçine Alan Gen Bölgesinin PZR Sonuçları
PZR ürünleri %2’lik agaroz jelde yürütüldü. 175 baz çifti uzunluğuna karşılık gelen bantlar moleküler ağırlık belirteci (50 bp’lik) ile karşılaştırıldı (Şekil 3.5.).
Şekil 3.5. Lys656Asn Polimorfizminin PZR Sonucu.
3.5. Lys656Asn Bölgesi PZR Ürünlerinin BstU1 Restriksiyon Enzimi ile Kesimi
BstU1, çift zincirli DNA’ yı CG/CG dizisinden tanıyarak kesim yapar. PZR tepkimesi sonrası 175 bç’lik PZR ürünü BstU1 restriksiyon enzimi ile kesildi. GG homozigot bireylerde enzimin tanıma bölgesini içermediğinden 175 bç’lik tek bant, heterozigot bireylerde (GC) 175, 150 ve 25 bç’lik üç bant, her iki allelinde değişim görülen bireylerde (CC) 150 ve 20 bç’lik iki bant görüldü. Kesim sonrası ürünler %2’ lik agaroz jelde yürütüldü. BstU1 kesimine ait agaroz jel elektroforezi görüntüsü
30 Şekil 3.6.’ da gösterilmiştir. 1 nolu kuyucuk heterezigot, 3 nolu kuyucuk yabanıl, 13 nolu kuyucuk ise mutant genotipe ait bantlar görülmektedir. Moleküler ağırlık belirteci 50 bp’dir.
Şekil 3.6. Lys656Asn Polimorfizminin RFLP Sonucu.
3.6. Pro582Ser Polimorfizminde Hasta ve Kontrol Gruplarının Karşılaştırılması
Bütün hasta ve kontrol gruplarının önce yaş (yıl), boy (cm), kilo (Kg), BMI (m2/kg), AHI (olay/saat), boyun çevresi (cm), bel çevresi (cm), kolesterol, trigliserit, HDL, LDL, sistolik kan basıncı (mmHg), diastolik kan basıncı (mmHg), %O2 Saturasyonu, Epworth uykululuk skalası değerleri Çizelge 3.1.’de gösterildi. Hasta kontrol arasında kilo, BMI, AHI, boyun çevresi, bel çevresi, oksijen saturasyonu (p<0,001) ve yaş, sistolik kan basıncı, Epworth (p<0,05) anlamlı bulundu. Bu parametrelerin değerleri OSAHS’lı hastalarda daha yüksekti ancak, oksijen saturasyonu OSAHS’lılarda daha düşüktü. Diastolik kan basıncı ve lipid profili anlamlı değildi (Çizelge 3.1). Çizelge 3.2.’de kodominant ve dominant modelde anlamlı bir fark vardı, resesif model ve allel dağılımlarında fark gözlenmedi.
Pro582Ser polimorfizminde hasta bireylerde hastalığın ağırlık derecesini (şiddetini) gösteren AHI ve obezite göstergesi olarak kullanılan BMI değerlerine göre ayrılmış gruplar ile genetik modeller arasında fark yoktu (çizelge 3.3.). Çizelge 3.4.’de hasta bireylerde klinik ve biyokimyasal parametreler kodominant modelde karşılaştırılmıştır. Kodominant modelde genotipler arasında değerlendirilen parametreler açısından fark gözlenmedi. Çizelge 3.5.’de hasta bireylerde klinik ve biyokimyasal parametreler dominant ve resesif modelde karşılaştırılmıştır. Dominant ve resefif modelde genotipler arasında değerlendirilen parametreler açısından fark gözlenmedi.