T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
STRONSĠYUM SÜLFAT KONSANTRESĠNDEN LĠÇĠNG
YÖNTEMLERĠYLE AMONYUM SÜLFAT VE STRONSĠYUM KARBONAT ÜRETĠMĠ
Ġbrahim Utku ERMĠġ DOKTORA TEZĠ
Maden Mühendisliği Anabilim Dalını
ġubat-2011 KONYA Her Hakkı Saklıdır
iv ÖZET DOKTORA TEZĠ
STRONSĠYUM SÜLFAT KONSANTRESĠNDEN LĠÇĠNG YÖNTEMLERĠYLE AMONYUM SÜLFAT VE STRONSĠYUM KARBONAT ÜRETĠMĠ
Ġbrahim Utku ERMĠġ
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Maden Mühendisliği Anabilim Dalı DanıĢman: Doç. Dr. Salih AYDOĞAN
2011, 94 Sayfa Jüri
Prof. Dr. Turan BATAR Doç. Dr. Salih AYDOĞAN
Prof. Dr. Alper ÖZKAN Yrd. Doç. Dr. S. Sinan GÜLTEKĠN
Yrd. Doç. Dr. Vildan ÖNEN
Bu tez Barit Maden Türk A.ġ. konsantratöründen temin edilen stronsiyum sülfat (SrSO4) konsantresinin, nitrik asit (HNO3), hidroklorik asit (HCl) ve perklorik asit (HClO4) ortamında liçini ve amonyum karbonat ((HNO4)2CO3) kullanılarak konsantreden amonyum sülfat (HNO4)2SO4 ve stronsiyum karbonat (SrCO3) elde edilmesini kapsamaktadır.
Deneysel çalıĢmaların ilk bölümünde SrSO4’in asitlerle liç çalıĢmaları gerçekleĢtirilmiĢtir.HNO3, HCl ve HClO4 ile gerçekleĢtirilen çalıĢmalarda karıĢtırma hızının, liç sıcaklığının, asit deriĢiminin, katı/sıvı oranının ve tane boyutunun liç iĢlemine etkisi araĢtırılmıĢtır. HNO3 ortamında 400 dev/dk karıĢtırma hızı, 60°C sıcaklık, 1 M asit deriĢimi, 2 g/500 mL katı/sıvı oranı ve -75 µm tane boyutu ile çalıĢılarak %91,35 verimle Sr çözeltiye alınabilmiĢtir. HCl ortamında 400 dev/dk karıĢtırma hızı 60°C sıcaklık, 1 M asit deriĢimi, 2 g/500 mL katı/sıvı oranı ve -106 µm tane boyutu ile çalıĢılarak %99,56 verimle Sr çözeltiye alınabilmiĢtir. HClO4 ortamında 600 devir/dakika karıĢtırma hızı, 80°C sıcaklık, 1 M asit deriĢimi, 2 g/500 mL katı/sıvı oranı ve -75 µm tane boyutu ile çalıĢılarak %93,57 verimle Sr çözeltiye alınabilmiĢtir. Bu aĢamadan sonra deneysel çalıĢmalarla elde edilen Sr yüklü çözeltiye Na2CO3 ilave edilerek %79,7 verimle SrCO3 elde edilmiĢtir.
(NH4)2CO3 ile gerçekleĢtirilen çalıĢmada ön deneylerle, uygun tane boyutu ve katı/sıvı oranı tespit edilmiĢtir. Daha sonra karıĢtırma hızının, liç sıcaklığının, SrSO4/(NH4)2CO3 stokiyometrik oranının ve ortam pH’ının etkileri araĢtırılmıĢtır. 200 dev/dk karıĢtırma hızı, 60°C sıcaklık, 1/1,3 stokiyometrik oran, 5 g/300 mL katı/sıvı oranı ve -50 µm tane boyutu ile çalıĢılarak %79,66 dönüĢüm verimiyle SrCO3 elde edilebilmiĢtir.
Anahtar Kelimeler: Amonyum karbonat ((NH4)2CO3), amonyum sülfat ((NH4)2SO4), liç stronsiyum karbonat (SrCO3), stronsiyum sülfat (SrSO4).
v ABSTRACT Ph.D. THESIS
PRODUCTION OF AMMONIUM SULFATE AND STRONTIUM CARBONATE VIA LEACHING METHODS
FROM STRONTIUM SULFATE CONCENTRATE Ġbrahim Utku ERMĠġ
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
THE DEGREE OF DOCTOR OF PHILOSOPHY IN MINING ENGINEERING
Advisor: Assoc. Prof. Dr. Salih AYDOĞAN 2011, 94 Pages
Jury
Prof. Dr. Turan BATAR Assoc. Prof. Dr. Salih AYDOĞAN
Prof. Dr. Alper ÖZKAN
Assist. Prof. Dr. S. Sinan GÜLTEKĠN Assist. Prof. Dr. Vildan ÖNEN
In this thesis we study the leaching of Strontium sulfate (SrSO4) concentrate, obtained from Barit Maden Türk Aġ. Concentrator, in the presence of nitric acid (HNO3), hydrochloric acid (HCl), and perchloric acid (HClO4); and the production of ammonium sulfate ((HNO4)2SO4) and strontium carbonate (SrCO3) from concentrate by use of ammonium carbonate ((HNO4)2CO3).
In the first step it is studied leaching of SrSO4 by using acides. In the studies that were conducted with HNO3, HCl, and perchloric acid HClO4, we investigated the effects of mixing speed, leaching temperature, acid concentration, solid/liquid ratio, and particle size on the leaching procedure. In the presence of HNO3, Sr was included in the solution with 91,35% efficiency at a stirring speed of 400 rpm, in 60°C, 1 M acid concentration, 2 g/500 mL solid/liquid ratio, and -75 µm particle size. In the presence of HCl, Sr was included in the solution with 99,56% efficiency at a stirring speed of 400 rpm, in 60°C, 1 M acid concentration, 2 g/500 mL solid/liquid ratio, and -106 µm particle size. In the presence of HCl, Sr was included in the solution with 93,57% efficiency at a stirring speed of 600 rpm, in 80°C, 1 M acid concentration, 2 g/500 mL solid/liquid ratio, and -75 µm particle size. After this step Na2CO3 was added to the Sr contained solution that taking leaching experiments to get SrCO3. SrCO3 was included with %79,7 efficiency.
In the studies conducted with (NH4)2CO3, appropriate particle size and solid/liquid ratio have been determined in preliminary experiments. In further studies, the effects of stirring speed, leaching temperature, SrSO4/(NH4)2CO3 stoichiometric ratio, and the pH level of the environment were examined. SrCO3 was obtained with %79,66 efficiency at a mixing speed of 200 rpm, in 60°C, 1/1,3 stoichiometric ratio, 5 g/300 mL solid/liquid ratio, and -50 µm particle size.
Keywords: Ammonium carbonate ((NH4)2CO3), ammonium sulfate ((NH4)2SO4), leaching, strontium carbonate (SrCO3), strontium sulfate (SrSO4).
vi
ÖNSÖZ
Bu tez çalıĢmasının hazırlanması esnasında bilgileriyle beni yönlendiren ve bana yardımcı olan danıĢman hocam sayın Doç. Dr. Salih AYDOĞAN’a,
Maden Mühendisliği Bölümü olanaklarını her an kullanma yardımcı olan bölüm baĢkanı sayın Prof. Dr. Kemal GÖKAY’a,
Deneysel çalıĢmalardan elde edilen verilerin değerlendirilip, toparlanması ve yorumlanması aĢamalarında katkılarını koyan araĢtırma görevlileri sayın Ali ARAS ve sayın Tevfik AĞAÇAYAK’a,
Laboratuar çalıĢmaları esnasında yardımlarını esirgemeyen maden teknikeri sayın Ġbrahim KÜÇÜK’e teĢekkürlerimi sunarım.
.
Ġbrahim Utku ERMĠġ KONYA–2011
vii ĠÇĠNDEKĠLER ÖZET ... iv ABSTRACT ... v ÖNSÖZ………vi ĠÇĠNDEKĠLER………..vii 1. GĠRĠġ ... 1 2. KAYNAK ARAġTIRMASI ... 3
2.1. Stronsiyumun Tanımı ve Genel Özellikleri ... 3
2.2. Stronsiyum Mineralleri ... 4
2.3. Stronsiyum Yataklarının OluĢumu ... 6
2.4. Dünya’da ve Türkiye’de Stronsiyum Madenciliği ... 14
2.4.1. Dünya’da stronsiyum yatakları ve rezervi ... 14
2.4.2. Türkiye’de stronsiyum yatakları ve rezervi ... 16
2.4.3. Üretim ve Tüketim ... 20
2.4.4. Pazar ve Fiyat ... 26
2.5. Stronsiyum ve Amonyum Sülfatın Kullanım Alanları ... 28
2.5.1. Stronsiyumun kullanım alanları ... 28
2.5.2. Amonyum sülfatın kullanım alanları ... 31
2.6. Stronsiyum Karbonat Üretim Teknolojisi ... 33
2.7. Liç ... 34
2.7.1. Liçin tanımı ... 34
2.7.2. Liç aĢamaları ... 35
2.7.3. Liç kinetiği ... 39
3. MATERYAL VE METOD ... 43
3.1. ÇalıĢmalarda Kullanılan Materyal ... 43
3.2. Metod ... 46
4. ARAġTIRMA SONUÇLARI VE TARTIġMA ... 50
4.1. Stronsiyum Sülfat (SrSO4) Konsantresinin Nitrik Asit (HNO3), Hidroklorik Asit (HCl) ve Perklorik Asit (HClO4) Ġle Çözündürülmesi ... 50
4.1.1. HNO3 ile liç çalıĢmaları ... 50
4.1.1.1. HNO3 ortamında karıĢtırma hızının çözünmeye etkisi ... 50
4.1.1.2. HNO3 ortamında sıcaklığın çözünmeye etkisi ... 51
4.1.1.3. HNO3 ortamında asit deriĢiminin çözünmeye etkisi ... 52
4.1.1.4. HNO3 ortamında katı/sıvı oranının çözünmeye etkisi ... 53
4.1.1.5. HNO3 ortamında tane boyutunun çözünmeye etkisi ... 54
4.1.1.6. HNO3 ortamında (NO3)-iyonları deriĢiminin çözünmeye etkisi .... 54
4.1.1.7. HNO3 ortamındaCl-iyonları deriĢiminin çözünmeye etkisi ... 55
4.1.2. HCl ile liç çalıĢmaları ... 56
viii
4.1.2.2. HCl ortamında sıcaklığın çözünmeye etkisi ... 57
4.1.2.3. HCl ortamında asit deriĢiminin çözünmeye etkisi ... 58
4.1.2.4. HCl ortamında katı/sıvı oranının çözünmeye etkisi ... 59
4.1.2.5. HCl ortamında tane boyutunun çözünmeye etkisi ... 59
4.1.3. HClO4 ile liç çalıĢmaları ... 60
4.1.3.1. HClO4 ortamında karıĢtırma hızının çözünmeye etkisi ... 60
4.1.3.2. HClO4 ortamında sıcaklığın çözünmeye etkisi ... 61
4.1.3.3. HClO4 ortamında asit deriĢiminin çözünmeye etkisi ... 62
4.1.2.4. HClO4 ortamında katı/sıvı oranının çözünmeye etkisi ... 63
4.1.3.5. HClO4 ortamında tane boyutunun çözünmeye etkisi ... 64
4.1.4. Stronsiyum Yüklü Çözeltiden Stronsiyum Karbonat (SrCO3) Üretimi 65 4.2. Stronsiyum Sülfat (SrSO4) Konsantresinden Liç Yöntemleriyle Amonyum Sülfat ((NH4)2SO4) ve Stronsiyum Karbonat (SrCO3) Üretimi ... 67
4.2.1. Ön deneyler ... 67
4.2.2. Deneysel çalıĢmalar... 68
4.2.2.1. (NH4)2CO3 ortamında karıĢtırma hızının SrCO3 dönüĢümüne etkisi ... 68
4.2.2.2. (NH4)2CO3 ortamında sıcaklığın SrCO3 dönüĢümüne etkisi ... 69
4.2.2.3. SrSO4 /(NH4)2CO3 stokiyometrik oranının SrCO3 dönüĢümüne etkisi ... 70 4.2.2.4. Ortam pH’ının etkisi ... 71 4.3. TartıĢma ... 72 KAYNAKLAR ... 84 EKLER ... 87 ÖZGEÇMĠġ ... 94
1. GĠRĠġ
Volkanik kayaçların bünyesinde %0,034 oranında bulunan stronsiyum doğada yaygın olarak bulunan toprak alkali bir metaldir. Stronsiyumun doğada en fazla bulunan ve üretiminin yapıldığı mineralleri selestit (SrSO4) ve stronsiyanittir (SrCO3). Bu iki mineralden selestit stronsiyanite göre doğada daha yaygın olarak bulunmakta olup bu yönüyle madencilik faaliyetlerine daha çok konu edilmektedir. Dünya stronsiyum potansiyelinin en çok bulunduğu ülkeler baĢta Türkiye olmak üzere Çin, Meksika, Ġspanya ve Arjantin’dir.
Türkiye önemli bir SrSO4 potansiyeline sahiptir. Tespit edilen bu potansiyelin büyük çoğunluğunu Sivas bölgesindeki yataklar oluĢturmaktadır. Sivas ili sınırları içerisinde yüksek tenörlü SrSO4 üretilebilinen bir konsantratör olmasına rağmen, ülkemizde hala SrCO3 dönüĢtürme ve stronsiyum kimyasallarının üretimi yapılmamaktadır.
Son yıllarda ABD stronsiyumun toplam tüketiminin yarından fazlası piroteknik, sinyalizasyon ve ferro seramik mıknatıs sanayinde gerçekleĢmektedir. (USGS Mineral Commodity and Summaries, 2011).
Stronsiyumun ticari anlamda yaygın Ģekliyle tüketimi SrCO3 formunda olmaktadır. Bunun nedeni SrCO3’ün SrSO4’e göre bozuĢmadan daha uzun süre stoklanabilmesi ve stronsiyum kimyasalları eldesinde temel hammadde girdisi olarak kullanılmasıdır. Doğada oluĢan SrCO3, Ca baĢta olmak üzere bünyesinde çeĢitli emprüteler bulundurması nedeniyle ticari anlamda doğrudan stronsiyum kimyasalları eldesinde kullanılamamaktadır. Ticari anlamda SrCO3 üretimi yaygın olarak SrSO4’ten gerçekleĢtirilmektedir. Günümüzde SrSO4’ten SrCO3 üretmek için Siyah Kül ve Doğrudan DönüĢtürme yöntemleri kullanılmaktadır. Siyah kül yönteminde selestit suda çözünür stronsiyum sülfür (SrS) elde etmek amacıyla kok ile karbotermik olarak kavrulur. Elde edilen SrS suda çözündürülerek çözeltideki sülfür ya CO2 ya da soda külü (Na2CO3) kullanılarak karbonatlaĢtırılır. Çok yaygın olarak kullanılmayan Doğrudan DönüĢtürme yönteminde ise SrSO4 tozu sodyum karbonat (Na2CO3) çözeltisi içerisinde yaklaĢık 90°C sıcaklıkta karıĢtırılarak SrCO3 ve Na2SO4 elde edilir.
Son zamanlarda, yüksek enerjili değirmenlerin kullanıldığı mekanokimyasal süreçlerle SrSO4’in SrCO3’e doğrudan dönüĢümü denenmiĢ olup sürecin yapılabilirliği hala araĢtırılmaktadır. Ayrıca yan ürün olarak ortaya çıkan sodyum sülfat (Na2SO4) ekonomik bir değer taĢımamakta olup çevresel etkileri nedeniyle atılmadan depolanması
gerekmektedir. Sodyum karbonata (Na2CO3) alternatif olarak amonyum karbonatın ((NH4)2CO3) dönüĢtürücü olarak kullanılması, bu çevresel soruna çözüm olabilecektir. (NH4)2CO3 dönüĢtürücü olarak kullanıldığında, kimyasal dönüĢtürme ile SrCO3 ve (NH4)2SO4 gübresi gibi iki ekonomik ürün elde edilmiĢ olacaktır.
(NH4)2SO4 gübresi, amonyak (NH3) veya amonyum karbonatın ((NH4)2CO3) sülfürik asit (H2SO4) ile reaksiyonuyla elde edilmektedir. Bu amaçla kullanılan H2SO4 ise sülfürlü minerallerin özellikle bakır sülfür ve kurĢun sülfürlerin izabesi esnasında yan ürün olarak üretilmektedir. Bunun dıĢında pirit gübre fabrikaları tarafından sülfürik asit üretiminde kullanılmaktadır. Bu Ģekilde üretilen H2SO4 içinde önemli miktarda arsenik bulunmaktadır. Bu arsenikten bir miktarı her zaman (NH4)2SO4 gübresinin bünyesine ve oradan da doğaya karıĢmakta olup çevresel olumsuzluklara neden olmaktadır. Tez kapsamında yapılan kimyasal dönüĢüm ile elde edilen (NH4)2SO4 gübresi bu çevresel olumsuzlukların önüne geçecektir.
Ülkemizde yıllık ortalama 330.000 ton (NH4)2SO4 gübresi tüketilmektedir. Tüketimin büyük çoğunluğunun ithalatla karĢılandığı dikkate alınırsa yapılan çalıĢma sonucunda elde edilecek ürün ülke ekonomisine oldukça önemli bir girdi sağlayacaktır. Bunun yanı sıra SrCO3 üretiminde kimyasal dönüĢüm yöntemiyle enerji yoğun ve CO2 üreten bir süreç olan Siyah Kül yöntemine alternatif bir süreç ortaya konulmuĢ olacaktır.
Tez kapsamında Barit Maden Türk A.ġ. konsantratöründen temin edilen SrSO4 konsantresi ile çalıĢmalar gerçekleĢtirilmiĢtir. Kullanılan konsantrenin SrSO4 içeriği %95,30’dur. Konsantrede bunun yanında az miktarda BaSO4, CaSO4 ve diğer minerallerin varlığı tespit edilmiĢtir. ÇalıĢmaların ilk aĢamasında selestit nitrik asit (HNO3) hidroklorik asit (HCl) ve perklorik asit (HClO4) ile liç iĢlemine tabi tutularak stronsiyum çözeltiye alınmıĢtır. Deneylerde karıĢtırma hızı, liç sıcaklığı, asit deriĢimi, katı/sıvı oranı ve tane boyutunun liç iĢlemine etkileri incelenmiĢtir. Ayrıca HNO3 ile yapılan liç çalıĢmasında ortamda bulunan NO
-3 ve Cl- iyonlarının prosese etkileri incelenmiĢtir. Bu aĢamadan sonra deneysel çalıĢmalarla elde edilen Sr yüklü çözeltiye Na2CO3 ilave edilerek SrCO3 elde edilmiĢtir. ÇalıĢmaların ikinci bölümünde ise SrSO4 konsantresinden, liç yöntemiyle stronsiyum karbonat (SrCO3) ve amonyum sülfat (NH4)2SO4 elde edilmesi konu edilmiĢtir. Bu amaçla kimyasal olarak amonyum karbonat ((NH4)2CO3) kullanılmıĢtır. Yapılan ön deneylerle uygun katı/sıvı oranı ve tane boyutu belirlenmiĢ, daha sonra karıĢtırma hızının, sıcaklığın, SrSO4/(NH4)2CO3 stokiyometrik oranının ve pH’ın liç iĢlemindeki etkileri araĢtırılmıĢtır.
2. KAYNAK ARAġTIRMASI
2.1. Stronsiyumun Tanımı ve Genel Özellikleri
Stronsiyum uzun yıllar boyunca baryum minerali olarak düĢünülmüĢtür. Yeni bir elementin bileĢiği olduğu 1790 yılında Adair Crawford tarafından, Ġskoçya’nın Strontian kasabasında iĢletilen bir kurĢun madeninden alınan mineralleri incelemesiyle, ortaya konulmuĢtur. Metal stronsiyum 1808 yılında Ġngiliz kimyager Davy tarafından elde edilmiĢtir (Murat,1998).
Stronsiyum periyodik cetvelin toprak alkali grubunda yer alan bir metaldir. Saf halde rengi beyaz olup havayla temas ettiği anda SrO’ e dönüĢerek aniden kararır. Ametallerin çoğuyla bileĢik yapar, asitlerle tuz oluĢturur ve bu tuzlarda +2 değerlikli olarak bulunur. Metal stronsiyum, ya SrCl2 tuzunun elektrolizi ile (EĢitlik 2.1) ya da SrO’in Al ile indirgenmesiyle elde edilmektedir (EĢitlik 2.2).
Katot: Sr+2 + 2e- Sr(aq) / Anot: Cl- 1/2Cl2(g) + e- (2.1)
6SrO + 2Al 3Sr + Sr3Al2O6 (2.2)
Stronsiyum bazı elementlerle tepkimeye sokularak çeĢitli bileĢikler elde edilir. Bu bileĢikler; SrH2, SrF2, SrCl2, SrBr2.6H2O, SrBr2, SrI2, SrO, Sr2O, SrS, SrSe’dir. Stronsiyum hava (EĢitlik 2.3, 2.4), su (EĢitlik 2.5), asit (EĢitlik 2.6), ve halojenlerle (EĢitlik 2.7, 2.8, 2.9) çeĢitli reaksiyonlara girerek bileĢikler oluĢturur (Cornelis ve Cornelius, 1985). 2Sr(k) + O2(g) 2SrO(k) (2.3) 3Sr(k) + N2(g) Sr3N2(k) (2.4) Sr(k) + 2H2O(g) Sr(OH)2(ç) + H2(g) (2.5) Sr(k) + 2HCl(aq) Sr2+(ç) + 2Cl-(ç) + H2(g) (2.6) Sr(k) + Cl2(g) SrCl2(k) (2.7) Sr(k) + Br2(g) SrBr2(k) (Reaksiyon 400°C de gerçekleĢir) (2.8) Sr(k) + I2(g) SrI2(k) (2.9)
2.2. Stronsiyum Mineralleri
Stronsiyumun yerkabuğundaki konsantrasyonu periyodik cetvelde kendisiyle aynı grupta yer alan, kalsiyum ve baryumdan daha azdır. Doğada bileĢikler halinde bulunur. BileĢiminde stronsiyum bulunan otuza yakın mineral vardır. Bu mineraller Çizelge 2.1’de verilmiĢtir (Crowell,1973).
Çizelge 2.1. BileĢiminde stronsiyum bulunan mineraller (Crowell,1973)
Bulunduğu Grup Mineral Ġsmi Formül Tuzlar
Jarlit, Metajarlit NaSr2 (AlF6) (AlF5H2O)
Koenenit Na3Mg5CaSrAl3Cl10 (OH)16
Titanatlar-Neobonatlar Loparit (Ce, La, Na, Ca,Sr) (Ti, Nb) O3
Boratlar
Veatchit SrB6O10. 2H2O
Kurgantait (Sr, Ca)2 [B4O8]. H2O
Stronsiyohilgarit (Sr, Ca)2 [(OH)2(Cl)B5O8]
Karbonatlar
Stronsiyumkalsit Stronsiyumaragonnit
Stronsiyanit Sr CO3
Kalsiyumstronsiyanit (Sr, Ca) CO3
Burbankit Na2 (Ca, Sr, Be). (Nadir top.elementleri)6 (CO3)5
Ambatoarinnit Sr (Ce, La, Nd) O(CO3)3
Ankilit Sr3 (Cr, La)4 [(OH)4 (CO3)7]. 3H2O
Sülfatlar
Baritoselestit (Sr, Ba) (SO4)
Selestit (Sölestin) SrSO4
Svanbergit, Hartrit (Sr, Ca) Al3, Al3 [(OH)6 (SO4PO4)]
Fosfatlar
Stronsiyumapatit (Sr, Ca)5 (PO4)3 (OH,F)
Palermoyit (Li, Na)4SrAl9 [(OH)9(PO4)8]
Böggildit Na2 Si2 Al2 (F9PO4)
Humlinit (Goyazit) SrAl3 [(OH)5 (PO4)2].H2O
Arsenitler Fermorit (Sr,Ca)5 [F, (OH) (PO4, AsO4)3]
Vanadatlar
Santafeyit Na2O.3MnO2 6(Mn, Ca, Sr)O 3(V,As)2O5.8H2O
Delriyolit CaO.SrO.V2O5.3H2O veya Ca Sr [(OH)2.V2O6] 2H2O
Lamprofillit Na3Sr2Ti3 [(O, OH, F)(SiO4)2]2
Hancokkit (Ca,Pb,Sr,Mn)2 (Al,Fe,Mn)3 [(O-OH(SiO4)Si2O7]
Brevsterit (Sr, Ba, Ca) (Al2Si6O16). 5H2O
Nordit (Ce, La,..)0.7 (Sr, Mn, Ca, Mg)3 Si8O23
Çizelge 2.1’de verilen stronsiyum minerallerinden ekonomik değer taĢıyan en önemli iki minerali selestit ve stronsiyanittir. Stronsiyanit bünyesinde selestite oranla daha yüksek miktarda stronsiyum içerdiği halde, doğada daha az yayılım göstermesi ve bünyesinde her zaman Ca içermesi nedeniyle ticari anlamda daha az öneme sahiptir (USGS Minerals Yearbook, 1991).
Selestit minerali genellikle kalkerler ve kumtaĢlarının içerisinde, onların boĢluklarını doldurmuĢ halde bulunur. Doğada kalsit, dolomit, jips, halit, florit mineralleri ve kükürt ile beraber oluĢur. Ayrıca kurĢun cevherinin damarlarında gang minerali olarak ve bazen de kolemanitle beraber bulunur (Çubuk, 1991).
Selestit mineralinin bileĢiminde %56,4 SrO, %43,6 SO3 bulunmaktadır. Doğada masif, iri kristalli, iğnemsi ve ince kristalli olarak bulunur. Oldukça kırılgan bir yapısı vardır. Sertliği mohs sertlik cetveline göre 3-3,5, yoğunluğu 3,95 - 3,97 gr/cm3
, rengi beyaz, bazen içinde barındırdığı minerallere göre sarı, açık sarı kırmızı veya mavi olabilmektedir. IĢığı geçirir, yarısaydamdır. Yapısı barit mineraline oldukça benzer. Çizgi rengi beyaz olup baritten yoğunluğu ve alevde verdiği renkle ayrılmaktadır. Ayrıca selestit Na2CO3 ile ergitililince, artık malzeme gümüĢ üzerinde koyu gümüĢ sülfür lekesi bırakır (Cornelis ve Cornelius, 1985).
Selestitin kristal yapısı ortorombik - 2/m 2/m 2/m – olup kristalleri barite çok benzer. Genellikle (001) tabular ya da a veya b eksenlerine paralel uzayan prizma Ģekilleri gösterir. a-kristal eksenine paralel uzayan kristaller genellikle eĢit geliĢme gösteren d(101) ve m(210) yüzleri ile kesilir. Selestit bazen ıĢınsal demetler veya taneli olarak ta görülebilir. Tipik bir selestit kristali ġekil 2.1’de gösterilmiĢtir.
ġekil 2.1. Tipik bir selestit kristali (Çubuk, 1991)
Selestitin kristal açıları b(010) Λ m(210) = 5201', c(001) Λ O(011) = 5203', c(001) Λ d(001) = 39024', c(001) Λ l(102) = 22019' Ģeklinde geliĢmiĢtir. Mineralin
fiziksel özellikleri incelendiğinde dilinimin (001) mükemmel ve /veya (210) iyi olduğu, S=3, 3,5. Y=3,95-3,97 olup parlaklığının inci veya camsı olduğu görülür. Optikçe (+) değerlikli olup α = 1,622, β= 1,624, γ=1,631 2V=50o, X=c, Y=b, r<v’dir (Çubuk,1991).
Stronsiyanit yatakları ya düĢük sıcaklıklı hidrotermal yataklarda barit, selestit ve kalsitle beraber ya da sedimanter ortamlarda kireçtaĢı, marn gibi karbonatlı kayaçların boĢluklarında geliĢir (Çubuk, 1991).
Saf halde stronsiyanit %70,2 SrO ve %29,8 CO2 içermektedir. Ancak doğada oluĢumu esnasında bünyesine her zaman bir miktar Ca almaktadır. Bu miktar bazen toplam kütlenin %5 ine kadar çıkabilmektedir. Doğada stronsiyanit kristalleri sütunsal, lifsel ya da taneli Ģekilde bulunabilir. Sertliği mohs sertlik cetveline göre 3,5, yoğunluğu ise 3,75 gr/ cm3 olarak verilmiĢtir. Parlaklığı camsı olup, ıĢık geçirgenliği saydam ya da yarısaydam olabilmektedir. Rengi beyaz, sarı ya da gri olabilmektedir. HCl de köpürür, H2SO4 ile SrSO4 çökeleği verir. Witerit ve aragonitten alev deneyi ile ayrılır (Cornelis ve Cornelius, 1985).
Stronsiyanitin kristal yapısı ortorombik - 2/m 2/m 2/m – olup kristalleri asiküler olarak ıĢınsal yayılım yapar. (110) üzerinde ikizlenmeler yaparak psödohekzagonal görünüm kazanır. Ayrıca sütunsal lifsel ya da taneli olarak bulunabilir.
Kristal açıları b(010) Λ m(210) = 5804', (001) Λ (111) = 580
14', (010) Λ (021) = 34038', (011) Λ l(011) = 71048' Ģeklinde geliĢmiĢtir. Stronsiyanitin dilinimi (110) iyi olup S= 3,5, 4, Y=3,7’dir. Parlaklığı camsıdır. Rengi ise beyaz, gri veya yeĢil olabilmektedir. IĢık geçirgenliği saydam veya yarı saydamdır. Optikçe α = 1,520, β= 1,667, γ=1.669 2V=7o, X=c, Y=b, r<v’dir (Çubuk,1991).
2.3. Stronsiyum Yataklarının OluĢumu
Selestit mineralini oluĢturan ana element olan stronsiyum yerkabuğunda %0,02 oranında, deniz suyunda ise 13-13,5 mg/L civarında bulunur. Magmatik kayaçlarda ortalama stronsiyum içeriği %0,034’ tür. Stronsiyum, magmatik kayaçlardaki göreceli bolluğuna rağmen, bağımsız bir mineral olarak oluĢmaz. Bağımsız Sr mineralleri genelde sedimanter ortamlarda yığıĢma gösterir. Bu ortamlarda oluĢan evaporasyonla stronsiyum yatakları oluĢur. Evaporitik ortamlarda minerallerin çökelim sırası aĢağıdaki gibidir:
- Kalsit-dolomit - Jips-anhidrid
- Kayatuzu
- Potasyum ve magnezyum tuzlar.
Sedimanter ortamlarda selestit genellikle evaporatik ortamlarda jipsli seriler içerisinde, stronsiyanit kireçtaĢı, dolomit ve de marnlar içerisinde gözlenmektedir. Bu yatakların genel yapısını deniz suyunda kimyasal çökelim oluĢurken Sr+2
zenginleĢmesi oluĢturmaktadır. Selestit çökelimi için Sr+2
ve SO4-2 stronsiyanit çökelimi içinse Sr+2 ve CO3-2 konsantrasyonlarında artıĢ olması ve çökelme koĢullarının ortamda geliĢmesi gerekmektedir. (Çubuk,1991). Gökçe’ye (1988) göre selestit çökelimi ile ilgili jeokimyasal veriler ve çözümlemeleri Çizelge 2.2, stronsiyanit çökelimi ile ilgili jeokimyasal veriler ve çözümlemeleri Çizelge 2.3’te verilmiĢtir.
Çizelge 2.2. Selestit çökelimi ile ilgili jeokimyasal veriler ve çözümlemeleri (Gökçe, 1988)
a. Veriler :
BileĢik Deniz Suyunda Deniz Suyunda Deniz Suyunda Kçç Metal Ġyon Konsant. SO4-2Konsant. CaSO4 1x10-4.5 1x10-2 M 2.7x10-3 M SrSO4 7.6x10-7 9x 10-5 M 2.7x10-3 M b. Metal iyon konsantrasyonu sabit kalıp, SO4
-2
konsantrasyonu artırıldığında çökelim sırası: CaSO4 çökelimi için gerekli SO4
-2
= Kçç / [Ca+2] = 1x10-4.5 / 1x10-2 = 3.16x10-3 SrSO4 çökelimi için gerekli SO4-2 = Kçç / [Sr+2] = 7.6x10-7 / 9x 10-5= 8.44x10-3 Çökelim için gerekli SO4-2 miktarı daha az olduğundan CaSO4 daha önce çökelir.
c. SO4-2 konsantrasyonu sabit kalıp metal iyonları konsantrasyonu artırıldığında çökelim için gerekli iyon konsantrasyonları ve zenginleĢme oranı:
CaSO4 çökelimi için gerekli [Ca+2] = Kçç / [SO4-2] = 1x10-4.5 / 2.7x10-3 = 1.17x10-2 SrSO4 çökelimi için gerekli [Sr+2] = Kçç / [SO4-2] = 7.6x10-7 / 2.7x10-3 = 2.81x10-4 [Ca+2] zenginleĢme oranı= Gerek miktar / Dnz. suy. mik.= 1.17x10-2 / 1x10-2 =1.17 kat. [Sr+2] zenginleĢme oranı= Gerek miktar / Dnz. suy. mikt.= 2.81x10-4 / 9x 10-5=3.12 kat.
d. SrSO4 çökelmeye baĢladığında ve/veya çökelecek kadar SO4-2 zenginleĢtiğinde deniz suyunda oluĢan Ca+2 konsantrasyonu:
[Ca+2] = 1x10-4.5 / 8.44x10-3= 3.75x10-3 (Deniz suyundaki ilk değerin 0.375 katı) e. Olağan deniz suyunda ve SrSO4 çökelimi sırasında [Sr+2] / [Ca+2] oranları Olağan Deniz Suyunda:
[Sr+2] / [Ca+2] = 9x 10-5 / 1x10-2 = 0.009 SrSO4 çökelimi sırasında:
i. [Sr+2] sabit kalıp [SO4
-2] artmıĢsa: [Sr+2
] ] / [Ca+2] = 9x 10-5/ 3.75x10-3 = 0.024 ii. [SO4
-2] sabit kalıp [Sr+2] artmıĢsa: [Sr+2
Çizelge 2.3. Stronsiyanit çökelimi ile ilgili jeokimyasal veriler ve çözümlemeleri (Gökçe, 1988) a. Veriler :
BileĢik Deniz Suyunda Deniz Suyunda Deniz Suyunda Kçç Metal Ġyon Konsant. CO3-2Konsant. CaCO3 3.2x10-7 1x10-2 M 3x10-5 M SrCO3 7x10-8 9x 10-5 M 3x10-5 M
b. Metal iyon konsantrasyonu sabit kalıp, CO3-2 konsantrasyonu artırıldığında çökelim sırası: CaCO3 çökelimi için gerekli CO3-2 = Kçç / [Ca+2] = 3.2x10-7 / 1x10-2 = 3.2x10-5
SrCO3 çökelimi için gerekli CO3-2 = Kçç / [Sr+2] = 7x10-8 / 9x 10-5= 7.77x10-4 Çökelim için gerekli CO3-2 miktarı daha az olduğundan CaCO3 daha önce çökelir.
c. CO3-2 konsantrasyonu sabit kalıp metal iyonları konsantrasyonu artırıldığında çökelim için gerekli iyon konsantrasyonları ve zenginleĢme oranı:
CaCO3 çökelimi için gerekli [Ca+2] = Kçç / [CO3-2] = 3.2x10-7 / 3x10-5 = 1.06x10-2 SrCO3 çökelimi için gerekli [Sr+2] = Kçç / [CO3-2] = 7x10-8 / 3x10-5 = 2.33x10-3
[Ca+2] zenginleĢme oranı= Gerek miktar / Dnz. suy. mik.= 1.06x10-2 / 1x10-2 =1.06 kat. [Sr+2] zenginleĢme oranı= Gerek miktar / Dnz. suy. mikt.= 2.33x10-3 / 9x 10-5=25.88 kat.
d. SrCO3 çökelmeye baĢladığında ve/veya çökelecek kadar CO3-2 zenginleĢtiğinde deniz suyunda oluĢan Ca+2 konsantrasyonu:
[Ca+2] = 3.2x10-7 / 7.77x10-4= 4.12x10-4
e. Olağan deniz suyunda ve SrCO3 çökelimi sırasında [Sr+2] / [Ca+2] oranları Olağan Deniz Suyunda:
[Sr+2] / [Ca+2] = 9x 10-5 / 1x10-2 = 0.009 SrSO4 çökelimi sırasında:
i. [Sr+2] sabit kalıp [CO3
-2] artmıĢsa: [Sr+2
] ] / [Ca+2] = 9x 10-5/ 4.12x10-4 = 0.219 ii. [CO3-2] sabit kalıp [Sr+2] artmıĢsa: [Sr+2] / [Ca+2] = 2.33x10-3/ 4.12x10-4 = 5.65
Çubuk (1991), Çizelge 2.2 ve Çizelge 2.3’ten yola çıkarak yola çıkarak;
- Sulu bir ortamda metal konsantrasyonları sabit kalıp SO4-2 konsantrasyonu artırılırsa CaSO4’ün SrSO4’ten önce çökeleceğini,
- Deniz suyundaki Sr+2 konsantrasyonu ortamda SrSO4 çökelimi için yeterli olmadığını ancak normal konsantrasyonun 3,12 kat artırılmasıyla çökelim gerçekleĢebileceğini, buna karĢın aynı oranda Ca+2
konsantrasyonunda artıĢ olursa SrSO4 çökeliminin gerçekleĢemeyeceğini,
- SrSO4 çoğalımının Sr+2/Ca+2 oranı ile kontrol edildiğini, Sr+2 sabit kalıp SO4–2 artırıldığında SrSO4 çokalımı için olağan deniz suyunda 1/111,1 olan Sri+2/Ca+2 oranının 1/41,67 değerine yükselmesi gerektiğini böylece ortamda Sr+2 ve SO4–2 iyon konsantrasyonları artarken Ca+2 iyon
konsantrasyonunda bir azalma olacağını ve SO4–2 iyon konsantrasyonu ortamda sabit kalır ise Sr+2
iyon konsantrasyonu yükselerek Sr+2/Ca+2 oranının 1/13,3 değerine yükseleceğini
- Ortamda SO4-2 konsantrasyonu artarken Sr+2/Ca+2 oranının1/41,67 değerinden küçük olduğu bir anda jipsin çökeleceğini, bu nedenle evaporitik ortamlarda jips daha yaygın gözlemlenebileceğini, ortamdaki Ca+2 kullanımından dolayı Sr+2/Ca+2 oranın artıp böylece SrSO4 oluĢumu için gerekli Ģartların oluĢacağını, buna bağlı olarak jips ve selestitin ardıĢık seriler halinde bir arada bulunacağını belirtmiĢtir.
- Su içerisinde olağan metal konsantrasyonları sabit tutularak CO3-2 konsantrasyonu artırıldığında CaCO3, SrCO3’ten daha önce çökeleceğini, - SrCO3 çökelimi için deniz suyundaki ortalama konsantrasyonun 25,88 katı
oranında Sr+2 zenginleĢmesine gereksinim olduğunu ve CaCO
3 oluĢumu içinse bu oranın Ca+2
için 1,06 değerinde olduğunu,
- SrCO3 çökeliminin Sr+2/Ca+2 oranınca kontrol edildiğini, ortamda Sr+2 sabit kalıp CO3-2 konsantrasyonu artarsa SrCO3 çökelimi için Sr+2/Ca+2 oranı 1 / 111,1’den 1/4,57’ye yükselmesi gerektiğini, CO3-2
sabit kalıp Sr+2 artmıĢ ise Sr+2
/Ca+2 oranı 1/0,177 olması gerektiğini,
- Ortamda Sr+2 konsantrasyonu sabit iken CO3-2 arttığında Sr+2/Ca+2 oranının 1/4,57’den küçük olduğu bir anda kalsitin çökeleceğini, kalsit çökelimiyle ortamda Ca+2 konsantrasyonunun azalmasına bağlı olarak Sr+2/Ca+2 oranı artarak stronsiyanitin çökelimi için uygun Ģartların geliĢeceğini,
- Kalsit çökelimini sağlayan Ca+2 iyonlarının ortamda azalmasıyla Sr+2/Ca+2 oranı yükselerek ortamda stronsiyanit çökelimine yol açacağını ve bu nedenle stronsiyanit, kireçtaĢı ve marn gibi CaCO3 içeren kayaçlar içerisinde bulunabileceğini belirtmiĢtir.
Stronsiyum minerallerinin oluĢturduğu yataklar yakından incelendiğinde; deniz suyundan kimyasal çökelim gerçekleĢtiği sırada ortamdaki Sr+2
iyonlarında artıĢ olduğu görülmektedir.
Deniz suyu içerisinde Sr+2
zenginleĢmesi aĢağıdaki nedenlerden dolayı olabilir (Çubuk,1991);
a) Akarsular içerisinde çökelmiĢ olarak karalardan getirim. b) Deniz tabanındaki kayaçlardan çözünme.
c) Su altı volkanizmaları.
d) Olağan deniz suyunun buharlaĢmasıyla zenginleĢme.
a ve b tipi kaynaklar özellikle Ca yönünden zengin bazaltik kayaçların yaygın olduğu Pasifik Okyanusu çevresindeki bölgelerde oluĢmaktadır. c tipi kaynaklar da benzer ortamlarda geliĢmektedir. Sbhka (sığ denizel) tipi ortamlarda ise d tipi zenginleĢmeler oluĢmaktadır.
Yukarıda belirtilen olayların geliĢimi esnasında stronsiyum konsantrasyonun artıĢına neden olan olaylar çeĢitli teorilerle açıklanmaktadır. Bu teorilere göre;
i) Yüzey kayaçlarının alterasyonu sonucunda açığa çıkan stronsiyum iyonu çözelti halinde bikarbonat, klorit veya sülfatla beraber yüzey suları, yer altı suları ve sellenmeler aracılığıyla göller ya da açık denizlere taĢınarak konsantre olur. Böylece akarsu, göl ve deniz sularında stronsiyum konsantrasyonu artar (Fraizer, 1975).
ii) Güncel tuzlu havzalarda ilk olarak aragonitler çökelir. Ca’ dan daha fazla atom yarıçapına sahip olan Sr aragonitin kafes yapısında Ca yerine yerleĢir. Duraysız bir mineral olan ve bünyesinde 10.000-12 000 ppm arasında stronsiyum bulunduran aragonit, zamanla duraylı formu olan kalsite dönüĢür. Bu dönüĢüm esnasında kafes yapısından ayrılan stronsiyum, formasyon çerinde dolaĢan mineralize sularda konsantre olur (Decima ve ark., 1987).
iii) Aragonit + kalsit → dolomit ve dolomit → diatomit dönüĢümlerinde açığa çıkan stronsiyum iyonu kayaçlarda zenginleĢmeler gösterirler (Wood ve Shav, 1976).
Gelgit üstü-sabhka, lagün gibi buharlaĢmanın etkisini gösterebileceği sığ denizel ve geçiĢ ortamları selestitin oluĢumuna olanak sağlamaktadır. Cevherin yataklanma tipi genelde mercek ve katman Ģeklinde olup jips, anhidrid veya kaya tuzu tabakalarının içerisinde saçılmıĢ halde gözlemlenebilir (Cornelis ve Cornelius, 1985).
Evaporitik ortamlarda buharlaĢmanın etkisiyle sırasıyla karbonatlar, sülfatlar ve klorürler çökelir. Stronsiyum çökelimi karbonat-sülfat fazı geçiĢinde sülfat fazından gerçekleĢmektedir. Stronsiyum yataklarının karbonatlarla iliĢkisini ortaya koyabilmek için karbonatları daha yakından incelemek gerekmektedir.
Kalsitte; Mg, Mn, Fe, Sr; Ba, aragonitte; Sr, Pb, Ba, Mg, Mn, dolomitte; Fe, Mn, Pb, Ca, Ba en çok rastlanan elementlerdir. Aragonit kafes yapısı Sr, Ba gibi Ca’dan
daha büyük katyonları kapsamaya uygundur. Bu nedenle ortamda Ca’dan büyük ya da küçük çaplı iyon konsantrasyonlarının varlığı aragonit ve de kalsit kristalleĢmesini kararlı kılar. CO2, H2S, HNO3, Cl, SO4, Ca, Mg ve Sr karbonat diyajenezini belirlemede etkin olan elementlerdir (Kaya,1985).
Sr Etkeni:
Sudaki stronsiyumun büyük bölümü hayvan ve bitki iskeletinin oluĢmasında, sindirim ve algı hücrelerinde kullanılır. Bu nedenle kıyı kuĢağı karbonat tortullarında Sr konsantrasyonu (%0.20’den fazla), açık deniz tortullarına (%0.05) göre daha fazladır. Bu çerçevede, kıyıdan açık denize doğru, Sr miktarı, toplam karbonat miktarı ve aragonit/kalsit oranıyla birlikte azalır (Müller, 1967).
Kalsite karĢılık, aragonit kafes yapısı, iyonik çapı kalsiyumdan daha fazla olan stronsiyumu içine alabilecek kapasitededir. SrCO3 asidik koĢullarda çözünür. Sr+2 bolluğu yüksek alkalin ortamda aragonite dönüĢüme yol açar.
Denizel ortamlarda ilk oluĢan aragonit olağanca kalsite dönüĢür. Ancak dönüĢüm ortamda bulunan stronsiyumun frenleyici etkisi altındadır.
Algler stronsiyumu büyük miktarda iskelet yapısına alırlar. Alg iskeletindeki stronsiyum sudakinin 8-9 katına eriĢebilir. Bu özellikleriyle algler kireçli kıyı kumlarının aragonitle çimentolanmasının baĢlıca sorumlusudur.
CO2 Etkeni:
Suda çözünen CO2 içeriği arttıkça suyun serbest hidrojen iyon konsantrasyonu da artar (EĢitlik 2.10).
H2O + CO2 → HCO3-
+ H+ (2.10)
Ortamda CaCO3 var ise artan hidrojen iyonlarıyla beraber H+;Ortamdaki CO3-2 iyonlarıyla birleĢerek HCO3
iyonlarını oluĢturur.
Bu durumda ortam koĢulu asidik bir hal alarak ortamın Ca+2
konsantrasyonunda artıĢa yol açar. Buna karĢın kristalleĢme gerçekleĢmez.
Ġleri aĢamada ortamda CO2 ya da karbonik asit artıĢıyla karbonat kristalleĢmesi oluĢur. Bunun nedeni ise zamanla HCO3
iyonu artıĢıyla H+ iyon konsantrasyonunun düĢmesi ve buna bağlı olarak ortamın asiditesinin giderek azalmasıdır. Bu durum da karbonatın çökelme potansiyelini artırır.
Denizel ortamda kalsit ve aragonitin kristalleĢmesi ya da çözünmesi toplam CO2, pH ve atmosferik basınç koĢullarına bağlıdır. Buna göre;
Aragonit kalsite göre daha alçak basınç koĢullarına duraylıdır.
Sıcaklık sabit kalırsa aragonit kalsite göre daha yüksek pH, daha alçak CO2 konsantrasyon değerlerinde kristalleĢir ya da çözünür.
Güncel CO2 basınç değerlerinde (3.5x10-4atm) sıcaklık değiĢmeden kalırsa aragonit kristalleĢmeye baĢlar.
Mg Etkeni:
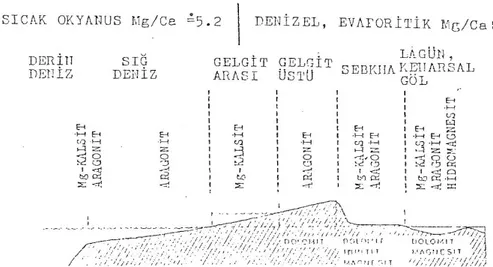
Kalsit veya aragonitin denizde çökelmesi Mg/Ca oranı ile ilgilidir. Mg/Ca<1 ise kalsit, Mg/Ca>1 ise aragonit kristalleĢmesi oluĢur. Dünya denizleri ortalaması 5.26 değerine göre ilk karbonat çökelimi olağan Ģekilde aragonit olacaktır. (Müler, 1967).
Denizel ortamlarda çökelen birincil karbonat mineralleri ve bunların dönüĢüm ürünleri ġekil 2,2’de verilmiĢtir.
ġekil 2.2. Denizel ortamlarda çökelen birincil karbonat mineralleri ve bunların dönüĢüm ürünleri (Müller, 1967)
Göllerde karbonat çökelimini denetleyen Mg/Ca oranları ise Çizege2.4’te verilmiĢtir.
Çizelge 1.4. Göllerde karbonat çökelimini denetleyen Mg/Ca oranları (Müler , 1967)
Mg/Ca oranı OluĢum
<2 Alçak Mg kalsitli
2-12 Yüksek Mg kalsit (+aragonit)
>12 Aragonit
7-15 DolomitleĢme-dolomit
H2S Etkeni:
Ortamda bulunan serbest hidrojen tüketimini izleyerek, sülfat indirgeyen bakteriler hidrojeni tüketmeye baĢlar. Ortaya çıkan alkali ortamla beraber karbonat çökelimi gerçekleĢir (Müler, 1967).
Kaya’ya (1985) göre bütün bu verilerden yola çıkılarak aĢağıdaki sonuçlara ulaĢılabilir;
- Üç ana grupta incelenen karbonat mineralleri Aragonitler sınıfına girmektedir. Aragonitin kafes yapısı stronsiyum katyonunu bünyesine alabilecek durumdadır. Dolaysıyla aragonitlerin içinde stronsiyum bulunma olasılığı oldukça yüksektir. Kalsitse stronsiyumu kafes yapısına alabilecek çapta değildir. Aragonitten kalsite dönüĢüm esnasında stronsiyum katyon konsantrasyonu artacak bu da selestit oluĢumuna yol açacaktır.
- Aragonit ve de stronsiyumun oluĢum Ģartları birbirine benzemektedir. Bu nedenle stronsiyumun kristalleĢebilmesi için ortamın kalsite göre daha yüksek pH ve daha düĢük toplam CO2 konsantrasyon değerlerine sahip olması gerekir. Ayrıca sabit sıcaklıkta güncel CO2 basınç değerlerinin düĢmesi gerekmektedir.
- Suda kullanılan stronsiyumun büyük bölümü hayvan ve de bitkiler tarafından kullanıldığı için, mekanik bir taĢınma söz konusu olmadığı sürece, kıyı kuĢağındaki Sr konsantrasyonu açık denizlere göre daha yüksek değerlerde olacaktır.
Dünya selestit yataklarının oluĢumu üç farklı kökene bağlı olarak geliĢmektedir; i) Sedimanter-senjenetik köken.
ii) Hidrotermal köken.
iii) Genç diyajenetik-epijenetik köken.
Sedimanter-senjenetik kökene bağlı geliĢen selestit yatakları jips, anhidrid, dolomit, dolomitik kireçtaĢları ve kiltaĢları gibi yan kayaçların içerisinde çoğunlukla tabakalı, nadir olarak ta mercek ya da düzensiz kütleler halinde bulunmaktadır. Evaporatik ortamda Sr/Ca oranını sıcaklık, tuzluluk, Eh, pH, organizma faaliyetleri ve yer altı suyu gibi faktörler etkilemektedir (Müler, 1967).
Hidrotermal kökene bağlı olarak geliĢen selestit yataklarının oluĢumunda etkin olan faktörler ısıtıcı bir kayaç varlığı, hidrotermal eriyiklerin aktif dolaĢımı, volkanik aktivitasyon, tektonik faaliyetlerin varlığı ve sıcak su-gaz çıkıĢlarının olması olarak sıralanmaktadır (Brower, 1973).
Genç diyajenetik-epijenetik kökene bağlı olarak geliĢen stronsiyum yataklarının oluĢumunu formasyondaki Sr+2
iyon konsantrasyonun tuzluluğu ve bileĢimi, sülfatlı minerallerin bileĢimi ve yan kayaçların geçirgenliği ile formasyon suyunun infiltrasyonu kontrol etmektedir. (Kushnir,1985).
2.4. Dünya’da ve Türkiye’de Stronsiyum Madenciliği
2.4.1. Dünya’da stronsiyum yatakları ve rezervi
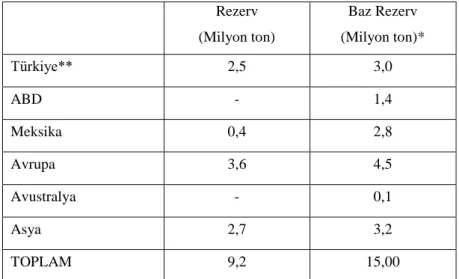
Günümüzde bilinen önemli stronsiyum yatakları baĢta Türkiye olmak üzere Ġspanya, Meksika, Ġngiltere ve Ġran'da bulunmaktadır. Çin, Polonya ve BirleĢik Devletler Topluluğu gibi ülkeler de önemli stronsiyum potansiyeline sahip olsalar da bu ülkelerin kaynaklarıyla ilgili sağlıklı veriler edilememektedir. Bölgeler bazında dünya stronsiyum rezervleri Çizelge 2.5 ve ġekil 2.3’te verilmiĢtir (Roskill, 1989).
Çizelge 2.5. Ülkelere göre stronsiyum rezervleri (Sr bazlı) (Roskill, 1989) Rezerv (Milyon ton) Baz Rezerv (Milyon ton)* Türkiye** 2,5 3,0 ABD - 1,4 Meksika 0,4 2,8 Avrupa 3,6 4,5 Avustralya - 0,1 Asya 2,7 3,2 TOPLAM 9,2 15,00
* :Baz Rezerv: ekonomik rezerv+gelecekte ekonomik olabilecek rezerv ** :Sr SO4 içerikli
Ülkeler
3.000.000
2.800.000
1.400.000 4.500.000
3.200.000 Türkiye (SrSO4bazlı)
Meksika
ABD
Avrupa
Asya
ġekil 2.3. Dünya stronsiyum rezervi (ton) (Sr bazlı) (Roskill, 1989)
ABD’nin New York, Arizona, California, Texas ve Washington eyaletleri önemli stronsiyum yataklarına sahiptir. Texas selestit yatakları tabaka, damar, yumrucuk ya da kütleler halinde kum, çakıl, Ģeyl veya dolomitik kireçtaĢlarının içerisinde geliĢmiĢtir. Washington’da skagit, Whatcom’da selestit stronsiyanitle beraber bulunmaktadır. ABD tüvenan cevher SrSO4 tenörü ortalama %85 civarındadır. ABD hammadde gereksinimini Meksika’dan karĢılamaktadır.
Ġngiltere selestitleri Bristol-Yete bölgesindeki Keuper Marn formasyonunda türeyen kil hamuru içerisinde ve yüzeye yakın seviyelerde yataklanma göstermektedir. 1875 yılından beri yapılan madencilik faaliyetiyle bu bölgede bilinen dünyadaki en eski selestit ocakları iĢletilmiĢtir. Buradan elde edilen ve satıĢa sunulan cevherin SrSO4 tenörü %95 civarındadır. Uzun yıllar boyunca yapılan üretim çalıĢmalarıyla Ġngiltere stronsiyum rezervlerinde önemli azalmalar görülmüĢtür.
Meksika Paile bölgesinde kretase kireçtaĢları ile konkordan olmuĢ mercek tipi yataklardan, selestit üretimi yapılmaktadır. Merceklerin kalınlığı yaklaĢık 2 m’dir.
Ġspanya selestitlerinin büyük çoğunluğu Granada yakınlarındaki Montevive’ de bulunan Aurora madeninden üretilmektedir. Ġspanyol selestitlerinin satılmakta olan cevher SrSO4 tenörü ortalama %92 civarındadır. Ġspanya madencilik bakanlığı Senora bölgesinde %98 SrSO4 tenörlü yeni bir yatağın bulunduğunu açıklamıĢtır. Yatak üzerinde incelemeler sürdürülmektedir.
Ġran selestit yatakları Tahran’ın 200 km kuzeybatısındaki Nakcir kenti yakınlarında bulunmaktadır. Alt miyosen formasyonundaki stratiform selestit yatağı 4 km uzunluğundadır (Çubuk, 1991).
2.4.2. Türkiye’de stronsiyum yatakları ve rezervi
Türkiye’de bilinen en önemli stronsiyum oluĢumları Sivas tersiyer havzasının Oligosen-Miyosen yaĢlı evaporitleri ve Eosen yaĢlı kırıntılı birimleri arasında yer almaktadır. 1975 yılından beri bilinen Sivas-UlaĢ bölgesindeki selestit yatağı önemli miktarda maden potansiyeline sahiptir. Burada geliĢen yataklanma tipi genç diyajenetik-epijenetik kökenlidir. Yatağın oluĢumu esnasında önce jips ve kireçtaĢlarında bulunan killi seviyeler yüzey ve/veya yeraltı sularıyla yıkanarak jips ve killerin içerisinde bulunan stronsiyum serbest hale geçmiĢtir. Sonra bu serbest iyonlar; ya yan kayaçta bulunan selestit kristalleri üzerine çökelmiĢ ya da tek baĢına çökelerek iri kristalli bir cevher yatağının oluĢumuna olanak sağlamıĢtır (Gökçe, 1989).
Türkiye’nin bilinen en önemli selestit yatakları Sivas’ın güney ve güneydoğusundaki Miyosen yaĢlı jipsli çökeller içerisinde geliĢmiĢtir. Bu bölgeyi tipik olarak temsil eden batıda Kavlak Köyü ile doğuda Demirci Köyü arasında kalan sahada gözlenen selestit yatakları çeĢitli çalıĢmalara konu edilerek çeĢitli stratigrafik ve de sedimantolojik verilere ulaĢılmıĢtır. Buradan yola çıkılarak ta Sivas yöresi selestit yatakları hakkında genel bir jeolojik yorum yapılabilmiĢtir.
i) Miyosen yaĢlı jipsli çökellerin stratigrafisi ve sedimantolojisi;
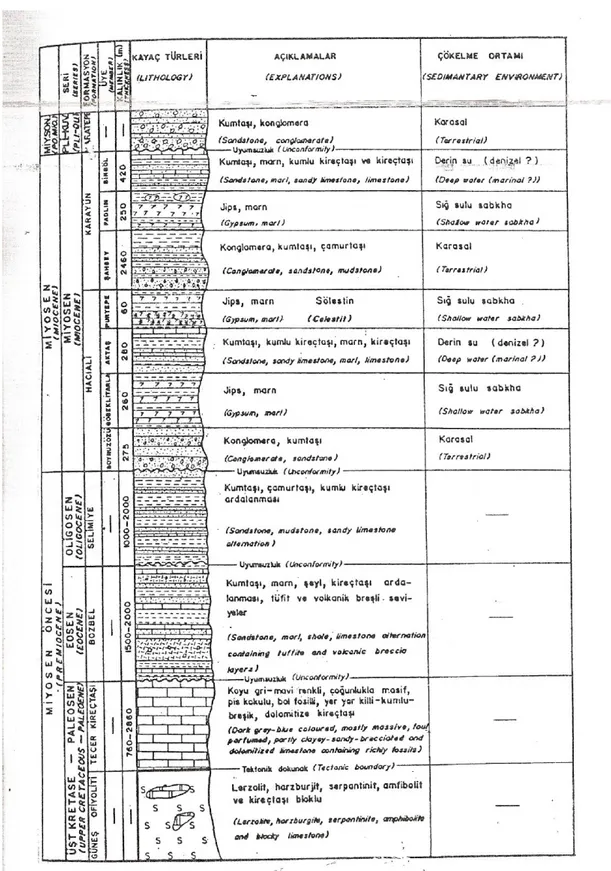
Daha önceki yapılan çalıĢmalar ıĢığında bölgedeki jeolojik birimleri “Miyosen Öncesi, Miyosen YaĢlı ve de Miyosen Sonrası Birimler” olmak üzere üç bölüme ayrılmıĢtır. Bu birimlerin joeolojik olarak yorumlanmasıyla aĢağıdaki bilgiler ortaya konulmuĢtur.
Miyosen Öncesi Birimler; Bu birimlerde yaĢlı ofiyolitler (GüneĢ ofiyoliti) ve Tekelidağ KarmaĢığı; Üst Kretase-Paleosen yaĢlı kireçtaĢları (Tecer KireçtaĢı formasyonu) Eosen yaĢlı ve fliĢ fasiyesi özelliğinde kumtaĢları (Bozbel formasyonu), Oligosen yaĢlı Ģarabi renkli kumtaĢı-kil taĢı-marn ve kireçtaĢı ardalanımı (Selimiye formasyonu) havzanın tabanını ve kenarlarını oluĢturmaktadır.
Miyosen YaĢlı Birimler; Bölgedeki miyosen yaĢlı birimlerin stratigrafisi ile ilgili ilk çalıĢma 1961 yılında Kurtman tarafından yapılmıĢ olup Hafik (karasal ortamda çökelmiĢ birimler) ve Karacaören (denizel ortamda çökelmiĢ birimler) Formasyonları
Ģeklinde adlandırılmıĢtır. Daha sonra Gökçe ve arkadaĢları 1988 yılında aynı bölgede yaptıkları bir çalıĢma ile Hacıali ve Karayün Formasyonu olarak iki yeni formasyon tanımını ortaya koymuĢlardır.
Gökçe’nin belirttiği üzere baĢlangıçta Hacıali formasyonu çökelme ortamının Boyunözü üyesi çökelirken atmosferle oldukça fazla bir temas gerçekleĢmiĢtir. Bu esnada oluĢan fiziksel enerjisi yüksek olup karasal-sığ sulu (akarsu ortamı) bir ortam geliĢmiĢtir. Daha sonra Göbeklitarla üyesi çökelirken fiziksel enerji artıĢı devam etmiĢ, ortam tuzluluğu artmıĢtır. Sığ-sulu sabhka karakterli bir deniz kıyısı ortamı geliĢmiĢtir. AktaĢ üyesinin çökelimi esnasında ise derinliğin artıĢıyla ortam denizel bir karakter kazanmıĢtır. Purtepe üyesinin çökelimi esnasında tekrar ortam sığlaĢarak Sabhka karakterli bir görünüm kazanarak sığ su karakterli ortamların da geliĢimi bu esnada gözlenmiĢtir. Çökelme ortamı derinleĢirken ve sığlaĢırken geliĢen sabhka ortamı koĢullarında Göbeklitarla ve Purtepe Üyelerinin jipsli çökellerinin oluĢtuğu söylenebilir. Purtepe üyesinin çökelimi ile havzada tekrar kinetik enerjisi yüksek, yarı karasal bir ortam geliĢmiĢ ve Purtepe üyesinin üzerine uyumlu olarak Karayün Formasyonun ġahbey Üyesi çökelmeye baĢlamıĢtır. Bu formasyonun yaĢı AktaĢ üyesi içinde saptanan fosillerle Alt-orta miyosen olarak belirlenmiĢ olup kalınlığı 875 m kadardır
Karayün Formasyonunun oluĢumunda baĢlangıçta ġahbey üyesi çökelirken atmosferle teması fazla, fiziksel enerjisi yüksek, karasal sığ sulu (akarsu ortamı) bir ortam geliĢmiĢtir. Daha sonra Faldım üyesi çökelirken ortamın fiziksel enerji azalmıĢ kimyasal enerji ve tuzluluğu artmıĢ, sığ sulu sabhka karakterli bir deniz kıyısı ortamı geliĢmiĢtir. Bingöl üyesi çökelirken ise ortam yavaĢça derinleĢerek tamamen denizel bir özellik kazanmıĢtır. Ortam karasaldan denizele geçerken geliĢen sabhka ortamlarında geliĢen Faldım Üyesi içerisinde jipsli ve kaya tuzlu seviyeler çökelmiĢtir. Bu formasyonun yaĢı Bingöl Üyesi içerisinde gözlenen fosillerden ve Hacıali Formasyonu ile uyumlu olan iliĢkisinden yaralanılarak Orta-Üst Miyosen olarak belirlenmiĢ olup toplam kalınlığı 3.100 m. olarak tespit edilmiĢtir.
Miyosen Sonrası Birimler; Ġnceleme alanı içindeki Miyosen yaĢlı birimler Pliyosen yaĢlı, açık kahverengi-gri renkli, iyi tabakalı, çakıltaĢı ve marnlı seviyelerden oluĢmuĢ, kalınlığı 100-150 m arasında değiĢen Karatepe Formasyonu ve Kızılırmak ile ve bu ırmağa karıĢan küçük akarsu vadilerinde gözlenen pekiĢmemiĢ güncel alüvyonlar tarafından örtülmüĢtür. Ġnceleme alanının Stratigrafik dikme kesiti ġekil2.4’te sunulmuĢtur (Çubuk,1992).
ġekil 2.4. Sivas’ın güney ve güneydoğusundaki stronsiyum yataklarının alanının stratigrafik dikme kesiti (Çubuk,1992)
ii) Bölgede selestit yataklarının oluĢumu;
Ġnceleme alanındaki litostratigrafik birimlerden üç tanesinde jipsler hakim görülmektedir. Bu üyelerden alınan jips örneklerinde selestit kristallerine çok ender olarak rastlanmıĢtır. Bunla beraber jipsli seviyelerin stronsiyum içeriği diğer seviyelere oranla daha yüksektir. En yüksek stronsiyum içeriğine ise Purtepe üyesinden alınan örneklem üzerinde ulaĢılmıĢtır. (98 000 ppm (%10)). Ġnceleme alanına ait stronsiyum litostratigrafik dağılımı Çizelge 2.6’da sunulmuĢtur (Çubuk,1992)
Çizelge 2.6. Sivas’ın güney ve güneydoğusundaki stronsiyum yataklarının litostratigrafik dağılımı (Çubuk,1992)
Litostratigrafik Birim. Kayaç Türü. Örnek Sayısı. Stronsiyum Ġçeriği (ppm.)
Bingöl Üyesi* Jipsli marn 8 1.050-2.600 Faldım Üyesi* Jips 7 2.175-2.900 Jipsli marn 7 1.200-1.650 ġahbey Üyesi* KumtaĢı-çamurtaĢı 10 200-1.050
Purtepe Üyesi** Jips 13 1.900-4.150(x) Jipsli marn 5 1.000-1.650 Marn 8 150-850 AktaĢ Üyesi** KumtaĢı ve
Kumlu kireçtaĢı 8 250-475 Göbeklitarla Üyesi** Jips 7 1.125-2.350 Jipsli marn 4 1.050-1.450 Marn 3 475-700 Boynuzözü Üyesi** KumtaĢı 1 450 Selimiye Formasyonu KumtaĢı 3 350 Bozbel Formasyonu KumtaĢı 10 250-475 * : Karayün Formasyonu
**: Hacıali Formasyonu
Killi seviyelerden alınan stronsiyum içeriğinde ise bu kayaçların olağan seviyesinde bulunan stronsiyum içeriğine göre önemli bir artıĢ olmamıĢtır. Yöredeki selestit yataklarının çoğunluğu Purtepe Üyesi içersindeki jipsler içerisinde geliĢmiĢtir. Haramçamziyareti Yatağı ve Beyaztepe Yatağının bir kısmı ġahbey üyesinin tabanındaki kumtaĢlarının kırık ve çatlakları içerisinde veya çakıltaĢlarının arasındaki boĢluklarda gözlenmektedir.
Jipsler içindeki selestit yataklanması jips serileriyle genellikle uyumsuz, kısmen yarı uyumlu ya da tam uyumlu olarak geliĢmiĢ dolgu tipi yataklanmalar iken, çakıltaĢları ve kumtaĢlarının içerisinde geliĢen ikinci tip yataklanmalarda ise bu kayaçların katmanları ile uyumsuz bir yapı oluĢturmuĢtur. Bu yatakların oluĢumu esnasında herhangi bir tektonizma etkisi geliĢmiĢ olmayıp, Ģekilleri ve dağılımları doğrudan çözünme boĢlukları ya da yerel kırık ve çatlaklar boyunca geliĢmiĢtir. Buradan yola çıkarak selelstit yataklarının yan kayaçlar içerisinde stronsiyumun ikincil olarak yeniden zenginleĢmesiyle oluĢtuğu ve oluĢumlarında epijenetik-endojen bir oluĢum sürecinin etkin olduğu sonucuna ulaĢılabilir.
MTA Genel Müdürlüğü derleme dairesinde bulunan 362 nolu prospeksiyon raporunda Gaziantep dolaylarında selestit zuhurlarının varlığından söz edilmektedir. Ayrıca 5169 nolu prospeksiyon raporunda ise Menderes masifinde, Aydın-Boğazdağ bölgesinde SrCO3 tenörü %46 olan stronsiyanit oluĢumlarından bahsedilmektedir.
MTA projeleri kapsamında 1993 ve 1994 yılları arasında Ereğli-UlukıĢla tersiyer havzasında yapılan çalıĢmalar neticesinde Konya-Ereğli’de önemli bir stronsiyum yatağının varlığı tespit edilmiĢtir (Murat, 1998).
2.4.3. Üretim ve Tüketim
Günümüzde stronsiyum üretimi için gerekli olan hammadde gereksinimi genellikle selestit yataklarından karĢılanmaktadır. Selestit yatakları çoğu zaman Ģehirlerden uzak ve madencilik için elveriĢli sahalarda bulunmaktadır. Bu da selestit madenciliğini kolaylaĢtırmaktadır. Madencilik faaliyetleri genellikle açık ocak iĢletmeciliği Ģeklinde gerçekleĢtirilmektedir.
Ġngiltere uzun yıllar boyunca stronsiyum madenciliğinde söz sahibi ülke konumunda olmuĢtur. II. Dünya savaĢından önce yapılan dünya stronsiyum üretimin %90'dan fazlası ülkenin güneybatısında bulunan yataklardan karĢılanmıĢtır. Ġspanya'nın üretime geçtiği 1968 yılına kadar Meksika, dünya selestit üretiminde dünya ikinciliğini
korumuĢtur. Kanada 1971 ve1975 yılları arasında stronsiyum üretiminde öncü konuma geçmiĢtir. Türkiye 1974 yılından itibaren dünya selestit üretiminde önemli bir konuma gelmiĢtir (USGS Minerals Yearbook, 1995).
Günümüzde Çin Ġspanya ve Meksika en önemli selestit üretici ülkeler konumundadır. Türkiye önemli bir potansiyele sahip olsa da 2009 yılından itibaren üretime ara vermiĢtir. Bunun yanında Arjantin, Fas ve Ġran selestit üretimlerine az miktarda olsa da devam etmektedirler (USGS Minerals Yearbook, 2009). Ülkeler bazında dünya stronsiyum üretimi Çizelge 2.7’de, 2010 yılı selestit üretiminin ülkelere göre dağılımı ġekil 2.5’te verilmiĢtir
Çizelge 2.7. Ülkeler bazında dünya stronsiyum üretimi (USGS Mineral Commodity Summaries) Üretim (ton) Ülke 2004 2005 2006 2007 2008 2009 2100* Arjantin 3.400 6.700 7.500 7.500 5.000 10.000 5.500 Çin 130.000* 140.000* 180.000 190.000 200.000 210.000 200.000 Ġran 2.000 7 000 7.500 7.500 - 2.000 2.000 Meksika 181.000 143.000 125.000 125.000 96.000 37.600 30.000 Fas 2.700 2.700 2.700 2.700 2.700 2.600 2.000 Pakistan 2.000 2.000 1.900 3.500 1.700 1.800 1.700 Ġspanya 160.000 160.000 200.000 200.000 188.000 138.000 180.000 Türkiye 70.000 60.000 60.000 60.000 1.600 - - TOPLAM** 551.000 520.000 585.000 600.000 496.000 402.000 420.000
(Selestit minerali baz alınmıĢtır) (* : tahmini ve **: yuvarlatılmıĢ)
0 50000 100000 150000 200000 250000
Arjantin Çin Meksika Fas Pakistan Ġspanya Ġran
Ülke Ü re ti m (t on )
ġekil 2.5. Önemli üretici ülkelerin 2010 yılı selestit üretimi (USGS Mineral Commodity Summaries, 2011)
Dünya stronsiyum üretiminde, Çin ve Ġspanya yıllık 200.000 ton üretim kapasiteleriyle lider ülke konumundadır. 2007 verilerine göre Çin Qinghai bölgesindeki Qaindam-Basin konsantratöründe yıllık 300.000 ton selestit zenginleĢtirilebilmektedir (Ülke toplam kapasitesinin %80’i). Bu ülkeyi Meksika 127.000 ton/yıl ve Almanya 70.000 ton/yıl üretim kapasiteleriyle takip etmektedir (USGS Mineral Commodity Summaries, 2007).
Solvay Barium-Strontium GmbH (Belçika kökenli Solvay S.A’nın bir yan kuruluĢudur.) Almanya’nın en önemli stronsiyum karbonat üretici Ģirketidir. Firma, Ġspanyadan aldığı hammaddeyi Bad Honningen de bulunan 150.000 ton/yıl kapasiteli tesisinde iĢleyerek stronsiyum ve baryum karbonat üretimi gerçekleĢtirmektedir.
Meksika önemli selestit üretici ülkelerden birisidir. CMV (Cia Minera La Valenciana S.A.C.V) ve Solvey Quimica Minera S.A. iki önemli yerel stronsiyum karbonat üretici firma konumundadır. CMV hammadde ihtiyacını muhtemel 5.000.000 ton bir rezerve sahip Torreon yakınlarındaki San Agustin madeninden karĢılamaktadır. Solvay Ģirketi La Roca bölgesindeki ocağından ürettiği selestiti Monterrey yakınlarındaki yıllık 27.000 ton stronsiyum karbonat üretim kapasiteli tesisinde iĢleyerek değerlendirmektedir. Minas de Celestita S.A. de C.V. (MCS) firması ise bir A.B.D. Ģirketi olan CPC’nin yan kuruluĢu pozisyonunda hammadde üretimini gerçekleĢtirmektedir. MCS Meksiko bölgelerindeki toplam 6.500.000 tonu bulan
kaynakları elinde bulundurmaktadır. MS’nin ürettiği selestitin tümü CPC tarafından alınıp Reynosa eyaletindeki yıllık 50.000 ton stronsiyum karbonat kapasiteli tesislerinde değerlendirilmektedir.
Ġspanya bir diğer önemli stronsiyum üreten ülke konumundadır. Ġspanyanın iki bölgesinde selestit madenciliği yapılmaktadır; Montevive bölgesindeki 8.000.000 ton muhtemel rezervli yatak Centeras Industriales S.L. Ģirketi tarafından, Escuzar bölgesindeki 4.000.000 ton muhtemel rezervli yatak Solvay Minerales S.A. ġirketi tarafından iĢletilmektedir. Qumica del Estrancio S.A. Ģirketinin Kartegena’ daki tesislerinde yıllık 35.000 ton stronsiyum karbonat ve 6.000 ton stronsiyum nitrat üretilmektedir.
Kanada dünya stronsiyum metal üretiminde öncü ülke konumundadır. Ontario’daki Timminco Ltd stronsiyum metali ve stronsiyum-alüminyum alaĢımları üretmektedir. ġirketin üretim kapasitesi 2004 yılı verilerine göre yıllık 500 ton civarındadır (USGS Minerals Yearbooks, 2004).
Yurdumuzda Sivas-UlaĢ yöresinde bulunan selestit yatakları uzun yıllar boyunca açık ocak iĢletmeciliğiyle iĢletilmekte olup, burada üretilen tüvenan cevher Sivas-Kayseri karayolunun 20. km’sinde kapasitesi 700 ton/gün olan bir cevher zenginleĢtirme tesisinde zenginleĢtirme iĢlemine tabi tutulmaktadır. Tesisin ocaklara olan uzaklığı ise 8 km.’dir. Burada iĢlenen cevherin mineralojik bileĢimi %65–70 selestit, %25–30 jips ve %5–10 kilden oluĢmaktadır. Tesiste yapılan zenginleĢtirme iĢlemiyle %94 SrSO4 tenöründe konsantre üretilmektedir. Barit Maden Türk A.ġ. konsantratörüne ait tesis akım Ģeması ġekil 2.6’da verilmiĢtir (Özkan, 1996).
Dünya ölçeğinde stronsiyumun ticaretine bakılacak olursa; kimyasal iĢlemlerle stronsiyumun değerlendirilebilmesi için minimum %90 SrSO4 içeren hammaddeye gereksinim duyulmaktadır. Hammadde üreticileri yıkama, triyaj, gravite-seperasyon, ağır ortam, jig, sallantılı masa, MGS ve flotasyon gibi cevher zenginleĢtirme yöntemlerinin bir ya da birkaçını kullanarak bu talebe kolayca cevap verebilmektedirler. Önemli stronsiyum tüketici ülkelerden ABD, Japonya ve Kanada hammadde ihtiyaçlarını Meksika’dan, Almanya; Ġspanya ve Türkiye’den, Çin ve Ġspanya ise kendi kaynaklarından karĢılamaktadır. Dünya piyasasında üretilen selestitin hemen tamamı stronsiyum karbonata dönüĢtürülerek tüketime sunulmaktadır. Bunun nedeni; stronsiyum karbonatın göreceli olarak diğer stronsiyum bileĢiklerine göre atmosferik koĢullarda uzun süre saklanabilmesi, stronsiyum bileĢiklerinin üretimine en uygun malzeme olması ve üretim maliyetlerinin düĢüklüğüdür.
Stronsiyum karbonat ve nitrat üretmek için talepte bulunan firmaların selestit cevherinde aradıkları özellikler Çizelge 2.8’de verilmiĢtir (Fulton, 1983).
Çizelge 2.8.Ürüne göre selestit mineralinde aranan özellikler (Fulton, 1983)
Ġçerik SrCO3 Ġçin Sr(NO3)2 Ġçin
SrSO4 % >90 >95
CaSO4 % - <1.5
BaSO4 % <2 <2
Fe % <0.1 <2
Boyut cm <15 <15
2007 yılına kadar tv tüplerinin imalatında (%30) önemli bir tüketim alanı bulunan stronsiyum sonraki yıllarda yoğun olarak piroteknik ve ferro seramıik mıknatıs sanayinde (%60) kullanılmaya baĢlanılmıĢtır. Günümüzde, toplam stronsiyum tüketiminin %60’ı bu iki sektörde gerçekleĢtirilmektedir. (USGS Mineral Commodity and Summaries, 2010). Stronsiyum ve bileĢiklerinin tüketiminin sektörlere göre dağılımı Çizelge 2.9 ve ġekil 2.7’de verilmiĢtir.
Çizelge 2.9. Stronsiyum ve bileĢiklerinin tüketim sektörlerine göre dağılımı (USGS Mineral Commodity and Summaries, 2005-2011)
Yıllar 2005 2006 2007 2008 2009 2010
Çinko elektrolizinde 2 4 10 10 10 10
Ferro seramik mıknatıs 13 18 30 30 30 30
Pigment ve dolgu maddesi 3 5 10 10 10 10
Piroteknik ve sinyalizasyon 22 30 30 30 30 30
Televizyon tüpü 50 30 - - - -
AlaĢımlar 6 7 10 10 10 10
Sr-tüketilen sektörler 10% 30% 10% 30% 10% 10% Çinko elektrolizinde Ferro seramik mıknatıs Pigment ve dolgu maddesi Piroteknik ve sinyalizasyon AlaĢımlar Diğer
ġekil 2.7. Stronsiyum ve bileĢiklerinin tüketim sektörlerine göre oransal dağılımı (USGS Mineral Commodity and Summaries, 2011)
2.4.4. Pazar ve Fiyat
Stronsiyum fiyatlarında son yıllarda dünya ölçeğinde bir düĢme eğilimi gözlenmektedir. Buna yol açan en önemli faktör geliĢmiĢ ülkelerdeki CRT televizyonlarının üretimindeki azalma olarak gösterilmektedir. Geçen beĢ yılda ABD’de bu eğilim belirgin olarak ortaya çıkmıĢtır. Bununla beraber Asya ve Güney Amerika pazarı tüplü-renkli televizyonlar ve dolayısıyla stronsiyum karbonat üreticileri için daha uzun yıllar boyunca önemli bir pazar olarak yerini koruyacaktır.
Önemli bir stronsiyum potansiyeline sahip olan Çin’in dünya madencilik piyasasına açılmasıyla beraber stronsiyum pazar fiyatlarında dalgalanmalar görülmüĢtür. Bu da stronsiyum fiyatlarında bir miktar azalmaya neden olmaktadır. Çin’in özellikle Avrasya pazarına girmesiyle bölgedeki selestit ve stronsiyum karbonat pazar fiyatlarında gerilemeler gözlemlenmiĢtir. Buna karĢın Çin selestitlerinin kalitesi diğer önemli kaynaklara sahip olan Meksika, Ġspanya ve Türkiye selestitlerinden daha düĢüktür. Bu da geçmiĢten beri pazarda önemli bir yeri olan bu ülkelerin pazar paylarına bir tehdit oluĢturmamakla beraber geliĢen rekabet Ģartlarından dolayı fiyatsal bazda bir kayba uğramalarına neden olmuĢtur (USGS Mineral Com. Summaries, 2006).
Stronsiyum türevlerinin son yıllardaki satıĢ fiyatları Çizelge 2.10, 2009 yılı pazar fiyatları ise ġekil 2.8’de verilmiĢtir.
Çizelge 2.10. Stronsiyum ve ürünlerinin yıllara göre satıĢ fiyatları (USGS Mineral Commodity and Summaries)
ABD fob ($/ton)
Yıllar 2003 2004 2005 2006 2007 2008 2009 Selestit 58 53 56 64 54 67 47 Stronsiyum karbonat 480 360 390 490 570 670 650 Stronsiyum nitrat 2. 950 1.520 890 870 1.013 1.140 1.000 Metal - 4.940 2.870 2.940 3.150 4.660 8.050 0 1000 2000 3000 4000 5000 6000 7000 8000 9000
Selestit Sr-karbonat Sr-nitrat Sr-metal
Stronsiyum türevleri F iy a t (d o la r/ to n )
ġekil 2.8. Stronsiyum ve ürünlerinin 2009 yılı pazar fiyatları (USGS Minerals Yearbooks, 2009)
Çizelge 1.14 ve ġekil 1.7’de görüldüğü üzere selestitin 2009 yılı satıĢ fiyatı 47 $/ton iken; stronsiyum karbonatın satıĢ fiyatı 650 $/ton, stronsiyum nitratın satıĢ fiyatı 1.000 $/ton ve metal stronsiyumun satıĢ fiyatı ise ise8.000 $/tondur. Özellikle stronsiyum metali baĢta olmak üzere stronsiyum karbonat ve stronsiyum nitrat gibi selestitten elde edilen uç ürünler bu ürünleri pazarlayan ülkeler açısından ekonomik anlamda çok ciddi gelirler yaratmaktadır. Bu anlamda yurdumuzda üretilen selestitin stronsiyum türevleri elde etmek amacıyla herhangi bir iĢleme tabi tutulmadan, doğrudan hammadde olarak uluslararası pazarda satıĢa sunulması ülkemiz açısından ciddi anlamda ekonomik kayıpların oluĢmasına neden olmaktadır.
2.5. Stronsiyum ve Amonyum Sülfatın Kullanım Alanları
2.5.1. Stronsiyumun kullanım alanları
Stronsiyumun çeĢitli sektörlere göre kullanım alanları ve materyalin kullanım özellikleri değiĢmektedir. Genel baĢlıklar altında stronsiyumun kullanım alanları söyle sıralanabilir:
i) Elektrik elektronik sanayi
Stronsiyum karbonat stronsiyumun endüstriyel açıdan en önemli bileĢiğidir. X ıĢınlarını emebilme ve görüntü kalitesini artırma özelliğinden dolayı televizyon tüplerinin imalatında stronsiyum karbonat kullanılmaktadır.
Tüm tüplü teknolojiye sahip renkli televizyonlar CRTs (color-cathode-ray tube) içermektedir. Bu tüplerde oluĢan x-ray emisyonları insan için oldukça zararlıdır. Bunun kontrol altına alınabilmesi için televizyon tüplerinde mutlaka stronsiyumla kaplanmıĢ camlar kullanılmaktadır.
Stronsiyum klorür (SrCl2) ve fosfat floresans ıĢıklandırma sisteminde kullanılmaktadır.
Seramik mıknatıs üretiminde stronsiyum ferritler tercih edilmektedir. Stronsiyum ferro mıknatıslar yüksek manyetik güce, termal ve elektriksel dirence sahip olup kimyasal bakımdan inerttir. Böylece sıcaklık ve elektrik akımlarından etkilenmezler, bir çok kimyasal ile reaksiyona girmezler. Bu yönleriyle demir cevheri seperatörlerinde, fotokopi makinelerinde, otomotiv endüstrisinde; hopörler, elektronik ekipmanlarda, oyuncaklarda ve dekoratif uygulamalarda tercih edilmektedirler.
Stronsiyum titannat, stannat ve zirkonat elektrik kondansatörlerinde dielektrik malzemesi olarak kullanılmaktadır. Elektrik sanayinde kullanılan stronsiyum özellikleri Çizelge 2.11’de verilmiĢtir.
Çizelge 2.11. Elektrik sanayinde kullanılan stronsiyumun özellikleri (Kogel and Trivedi, 1996)
SrCO3 >%96
BaCO3 <%1
CaCO3 -
ii) Cam ve seramik sanayi
Optik cam imalatında stronsiyum titanat yaygın olarak kullanılmaktadır. Günümüzde cam ve seramik kaplamalarında baryum ve kurĢunun yerini stronsiyum bileĢikleri kullanılmakta olup böylece üründe doğabilecek olan toksit sorunları ortadan kaldırılabilmektedir. Cam ve seramik sanayinde kullanılan stronsiyum özellikleri Çizelge 2.12’de verilmiĢtir.
Çizelge 2.12. Cam ve seramik sanayinde kullanılan stronsiyumun özellikleri (Kogel and Trivedi, 1996) Cam Sanayi Seramik Sanayi
SrCO3 >%96 >%96 BaCO3 <%2 <%1 CaCO3 <%0.5 - Toplam S <%0.4 <%0.4 Fe2O3 <%0.01 - Na2CO3 <%1 -
iii) Boya sanayi
Selestit, boya sanayinde dolgu maddesi, parlatıcı ve beyazlatıcı olarak kullanılmaktadır. Stronsiyum kromat (SrCO4); düĢük toksit etkisi yüksek ısı dayanımı ve solmayan sarı rengi ile önemli bir boyadır. Uçaklarda, gemilerde, uzay araçlarında ve önemli parçaların boyanmasında stronsiyum kromat yaygın olarak kullanılmaktadır. Stronsiyum sülfür (SrS); ıĢık veren boyalarda fosferans etkisi yaratmak amacıyla dolgu maddesi olarak kullanılmaktadır. Boya sanayisinde kullanılan stronsiyum kromatın özellikleri Çizelge 2.13’te verilmiĢtir.
Çizelge 2.13. Boya sanayinde kullanılan stronsiyum kromatın özellikleri (Kogel and Trivedi, 1996)
SrO >%48
CrO3 >%45
NO3 olarak nitrat <%0.1
Cl olarak klorit <%0.1
iv) Metalurji
Çinko elektrolizi aĢamasında emprüteleri uzaklaĢtırmak amacıyla stronsiyum kullanılmaktadır. Sülfürik asitte çözünmeyen stronsiyum karbonat ilavesi ile elektrolit içindeki kurĢun içeriği düĢürülmekte ve katotta çinko depolanmaktadır. 1 ton çinkonun katotta biriktirilebilmesi için 0,5-2 kg arasında stronsiyum karbonat sarfiyatı yapılmaktadır. Çelik sanayinde; stronsiyum klorürür (SrCl2), karbürleme ve sertleĢtirme tuz banyolarında kullanılmaktadır. Stronsiyum kromat ise özel krom kaplamalarda uygulama alanı bulmaktadır.
v) Piroteknik
Stronsiyumun önemli kullanım alanlarından birisi de pirotekniktir. Stronsiyum parlak ve kırmızı bir alev vererek yanar. Bu yönüyle yerine baĢka bir malzemenin idamesi mümkün değildir. ÇeĢitli ıĢık aygıtlarında stronsiyumun karbonat, klorat, oksalat ve sülfatlı bileĢikleri kullanılsa da bu alanda en yaygın kullanılan bileĢiği stronsiyum nitrattır. Stronsiyumun askeri piroteknik, uyarı aygıtları ve eğlence sektöründe uygulama alanları çok yaygındır. Stronsiyum metali uzay veya hava durumu istasyonlarındaki çeĢitli donanımlarda kullanılır. Stronsiyum hidroksit Ģekerle çözünmez bir bileĢik oluĢturarak Ģekeri melastan ayırır. Stronsiyum karbonat baryum karbonat ile birlikte vakum tüplerinde bulunan katotlarının imalatında kullanılır. Stronsiyum hidrat stronsiyum yağı ve sabunlarının imalatında kullanılır. Stronsiyum yağları viskoz dirençlerinin iyi olması, yüksek sıcaklıkta okside olmamaları ve suyun çözücü etkisine dayanımlı olmaları nedeniyle, endüstriyel çaptaki fırınlar ve uçak motorlarındaki mil yataklarında yağlayıcı olarak kullanılmaktadır. Stronsiyum silikat kaliteli demir üretiminde kullanılır. Stronsiyum klorür diĢ macununda dolgu maddesi ve parlatıcı etkiyi artırmak amacıyla kullanılır. Tıp alanında bir stronsiyumun izotopu olan Sr85 kemik kanserinin teĢhisinde önemli rol oynamaktadır. Sr90 izotopu ise radyoterapide kullanılmaktadır. Eczacılık sektöründe Stronsiyum bromür bir yatıĢtırıcı ve mide asidi düzenleyicisi olarak kullanılır. Stronsiyum kromat kimyasal belirteçtir. Jeokimyasal yaĢ tespitinde 87
Rb / 87Sr tarihleme yöntemi en çok kullanılan radyokronoloji yöntemlerinden biridir. 87Sr /86Sr oranı izotopik çizici rolünü oynar ve eriyerek kayaçları oluĢturan kabuk ve manto yapısını belirlemeye yarar. Stronsiyum bileĢikleri, formülleri ve kullanım alanları Çizelge 2.14’te sunulmuĢtur (TümaĢ, 1990).