i T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
Prof. Dr. Fehmi AKÇİÇEK
ONKOLOJİ SERVİS VE POLİKLİNİĞİNDE TAKİP EDİLEN
HASTALARDA, TANI ÖNCESİ VE/VEYA SIRASINDAKİ BAZAL
ÜRİK ASİT VE HEMOGRAM PARAMETRELERİNİN ÖLÜM VE
SAĞKALIM ÜZERİNE ETKİSİ
TIPTA UZMANLIK TEZİ
Dr. Kerem ORUÇ
TEZ DANIŞMANI
Prof. Dr. Soner DUMAN
İZMİR-2016
i TEŞEKKÜR
Uzmanlık eğitimim boyunca bilgi ve tecrübelerini her zaman örnek aldığım, sadece mesleki alanda değil, hayatın tüm alanlarında yardımını esirgemeyen, ihtiyacımız olduğunda kimi zaman bir baba, kimi zaman bir ağabey yakınlığını hissettiğimiz, çok kıymetli hocam Anabilim Dalı Başkanı Sayın Prof. Dr. Fehmi Akçicek’e, ayrıca asistanlığım süresince bilgi ve birikimlerinden faydalandığım hocam ve tez danışmanım Prof. Dr. Soner Duman’a ve Doç. Dr. Burçak Karaca’ya saygılarımı ve teşekkürlerimi sunarım. Bu tezin hazırlanmasında verilerin elde edilmesinden yazım aşamasına kadar her kısımda emeği olan Sayın Dr.Ejder Kamil Öztürk’e, tezin hazırlanma aşamasında katkı sağlayan Uzm. Dr. Cenk Gökalp’e, kendileriyle çalışmaktan daima büyük zevk aldığım asistan arkadaşlarıma ve klinik personelimize ayrı ayrı teşekkür ederim.
Ayrıca bugünlere gelmemde en büyük katkısı olan Anneme ve her zaman destek olan ve sıkıntılarımı paylaşan Kardeşime teşekkür ederim.
ii ÖZET
ONKOLOJİ SERVİS VE POLİKLİNİĞİNDE TAKİP EDİLEN HASTALARDA, TANI ÖNCESİ VE/VEYA SIRASINDAKİ BAZAL ÜRİK ASİT VE HEMOGRAM PARAMETRELERİNİN ÖLÜM VE SAĞKALIM ÜZERİNE ETKİSİ
Amaç: Ürik Asit (ÜA) bir çok hastalıkta risk faktörü olarak suçlanmış; yüksekliği gut, hipertansiyon ve kardiyovasküler hastalıklar için risk faktörü olarak değerlendirilmiştir. Bunun yanında Parkinson Hastalığı, Multipl Skleroz ve Alzheimer Hastalığı olanlarda yüksek ÜA seviyesinin protektif olduğu gösterilmiştir. Fakat özellikle malign hastalıklara yol açma veya hastalıkları önleme açısından yapılan çalışmalarda çelişkili sonuçlar ortaya çıkmıştır.
Yöntem: Ocak 2014 tarihinden Ağustos 2015 tarihine kadar Ege Üniversitesi Tıp Fakültesi Hastanesi Onkoloji Bilim Dalına poliklinik ve/veya servise başvuran hastaların tanı sırasında ve/veya en geç 1 ay içerisindeki ÜA sonuçları ile ölüm ve sağ kalım arasında bir ilişki olup olmadığı ve prognoz tayini açısından değerinin olup olmadığı araştırılmıştır.
Bulgular: 997 hastanın 428’inin (%43) ÜA değerlerine ulaşıldı. Ortalama ÜA değerleri tüm hastalar için 4,79 (± 1,82) mg/dl, yaşayan hastaların (260 kişi, %65) 4,57 (± 1,53) mg/dl, ölen hastaların ise (140 kişi, %35) 5,20 (± 2,22) idi (p=0,0006). Erkekler için ÜA referans aralığı 3,5-7,2 mg/dl, kadınlar için 2,6-6 mg/dl olarak alındı. 336 hastanın ÜA’i normal, 62’sinin yüksek ve 30’unun düşük olduğu görüldü. ÜA değerlerini düşük, normal ve yüksek olarak değerlendirdiğimizde 148(428) hastada ortalama sağkalım süresi düşük grupda 18,201 ± 1,426 ay (95% CI 15,407-20,995), normal grupta 70,962 ± 10,244 ay (%95 CI 50,884-91,041) ve yüksek grupda 20,571 ± 2,779 ay (95% CI 15,125-26,017) olarak bulundu. Her 3 grubu karşılaştırdığımızda düşük grupla normal grup arasındaki yaşam süreleri anlamlı (p=0,030), yüksek grupla normal grup arasındaki yaşam süreleri de anlamlı (p=<0,001) olarak bulundu. Düşük grupla yüksek grup karşılaştırıldığında sağkalım açısından bir anlam olmadığı saptandı (p=0,304).
iii Sonuç: ÜA’in hem pro-oksidan hem de anti-oksidan özelliklerinin olduğu; normal değerlerde anti-oksidan, düşük veya yüksek değerlerde ise Pro-oksidan olarak davrandığını görünmektedir.
iv ABSTRACT
THE RELATIONSHIP BETWEEN BASAL AND FOLLOW-UP URIC ACID AND COMPLETE BLOOD COUNT PARAMETERS AND PATIENTS DEATH AND SURVIVAL THAT ARE FOLLOWED AT ONCOLOGY OUTPATIENT AND INPATIENT CLINIC
Object: Uric acid (UA) has been accused of being a risk factor in many diseases and the increase of its level has been evaluated as a risk factor for gout, hypertension and cardiovascular diseases. Besides this, the high level of UA in people having Parkinson’s disease, Multiple Sclerosis and Alzeheimer has been shown as being protective. However, there have been contradictory results especially in the studies made in terms of causing or preventing malign diseases.
Method: It has been researched whether there is a relation between “the UA results during the diagnosis and/or in one month at the latest of the patients who applied to the polyclinic and/or service of Ege University Medical Faculty Hospital, Department of Oncology from January 2014 till August 2015” and “death and survival” and whether it has value in terms of determination of prognosis.
Findings: 428 (%43) patient’s UA values of 997 patients have been reached. Average UA values for all of the patients was 4,79 (± 1,82) mg/dl, for survivors (260 people, %65) 4,57 (± 1,53), for death patients (140 people, %35) 5,20 (± 2,22) (p=0,0006). UA referance rage was taken as 3,5-7,2 mg/dl for men, as 2,6-6 mg/dl for women. It was realized that UA levels of 336 patients were normal, of 62 were high and of 30 were low. When we categorized UA levels into low, normal and high, average survival period of 148 (428) patients was 18,201 ± 1,426 months (95% CI 15,407-20,995) in the low group, 70,962 ± 10,244 months (%95 CI 50,884-91,041) in the normal group and 20,571 ± 2,779 months (95% CI 15,125-26,017) in the high group. When we compared all 3 groups with each other, the lifetime between low and normal groups was found significant (p:=0,030), the lifetime between high and normal groups was also found significant (p=<0,001). When low group was
v compared to high group, it was determined that there was no significance with regard to survival (p=0,304).
Result: It seems that UA has both pro-oxidant and anti-oxidant features. It behaves as anti-oxidant in normal levels or as pro-oxidant in high levels.
vi İçindekiler
TEŞEKKÜR ... i
ÖZET VE ANAHTAR KELİMELER ... ii
ABSTRACT-KEYWORDS ... iv
İÇİNDEKİLER ... v
KISALTMA LİSTESİ ... viii
TABLO VE ŞEKİL LİSTESİ ... x
1. GİRİŞ VE AMAÇ ... 1
2. GENEL BİLGİLER ... 2
2. 1. Kanser Epidemiyolojisi ... 2
2. 2. Ürik Asit ... 5
2.2.1. Ürik Asit Sentez ve Atılımı ... 5
2.2.2. Ürik Asit’in Etkileri ... 8
2.2.3. Ürik Asit, Metabolik Sendrom ve Böbrek Hastalıkları ... 12
2.2.4 Ürik Asit, Diyabet ve Kardiyovasküler Hastalıklar ... 13
2.2.5. Ürik Asit ve Kanser ... 15
2.2.5.1. Ürik Asit, İnflamasyon ve Kanser ... 15
2.2.5.2. Ürik Asit, Adiponektin ve Kanser ... 16
2.2.5.3. Ürik Asit, C-Reaktif Protein ve Kanser... 17
2.2.5.4. Ürik Asit, Leptin ve Kanser ... 18
2.2.5.5 Ürik Asit Transportu ve Kanser ... 19
vii
2.2.5.7 Bir Sinyal Molekülü Olarak Ürik Asit ... 22
3.MATERYAL METOD ... 23
3.1 Çalışma Tasarımı ve Hastalar ... 23
3.2 İstatiksel Analiz Yöntemleri ... 24
3.3 Demografik Özellikler ve Bulgular ... 24
4.TARTIŞMA ... 35
5.SONUÇ VE ÖNERİLER ... 38
viii KISALTMALAR
ÜA: Ürik Asit
KOR: Ksantin Oksidaz/Oksiredüktaz SOR: Serbest Oksijen Reaktifi H2O2: Hidrojen Peroksit
O2-: Süperoksit Radikali
OH-: Hidroksil
ONOO-: Peroksinitrit
NO: Nitrit Oksit
NFKB: Nükleer Faktör Kappa B MAPK: Mitojen Aktive Protein-Kinaz MCP-1: Monosit Kemoatraktan protein-1 COX-2: Siklooksijenaz-2
NOK: NADPH Oksidaz
CINC: Cytokine-İnduced Neutrophil Chemoattractant ÜA.: Ürik Asit Radikali
GSH: Glutatyon
ERK: Extracellular Signal-Regulated Kinase SYA: Serbest Yağ Asitleri
OAT: Organic Anion Transporter URAT: Ürat Transporter
ix SLC13A3: Solute Carrier Family 13 Member 3
SLC5A8: Solute Carrier Family 5 Member 8
SLC5A12: Solute Carrier Family 5 Member 12 MRP 4: Multidrug Resistance-Associated Protein 4
NPT 1: Nicotinate Phosphoribosyltransferase
x TABLOLAR VE ŞEKİLLER
TABLOLAR
Tablo 1. Cilt dışı kanserlerin yaşa göre standardize edilmiş hızları……… 4
Tablo 2. Ölen Hastaların Ortalama Yaşam Süreleri……….. 25
Tablo 3. Yaşayan ve Ölen Hastaların Hemogram, Üre, Kreatinin ve Ürik Asit Değerlerinin Karşılaştırılması……….27
Tablo 4. Ürik Asit Değerlerine göre Üre, Kreatinin ve Hemogram Değerlerinin Karşılaştırılması………. 29
Tablo 5. Değişken Parametrelerin Univariate Cox-Regresyon Analizi………….. 33
Tablo 6. Değişken Parametrelerin Multivariate Cox-Regresyon Analizi……….. 34
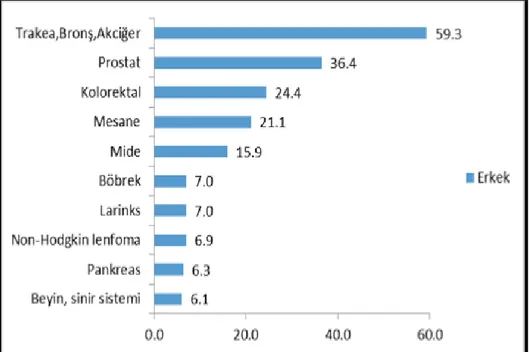
ŞEKİLLER Şekil 1. Erkeklerde sık görülen 10 Kanserin yaşa göre standardize edilmiş hızları………. 3
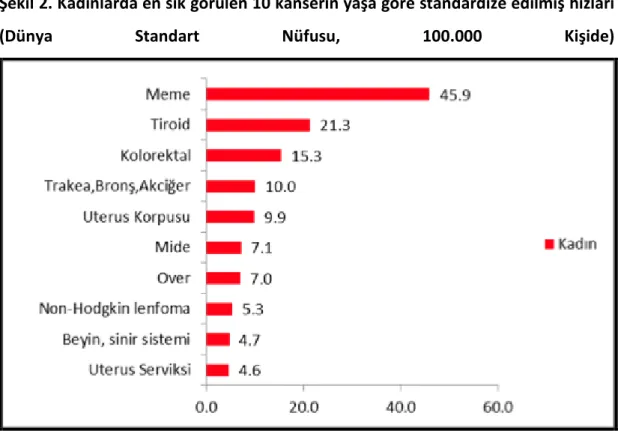
Şekil 2. Kadınlarda sık görülen 10 kanserin yaşa göre standardize edilmiş hızları………. 4
Şekil 3. Ürik Asit Sentezi……….. 6
Şekil 4. Ürik Asit Atılımı………. 7
Şekil 5. Ürik Asit’in Pro ve Antioksidan Mekanizmaları………. 10
Şekil 6. Ürik Asit, Ksantin Oksidaz ve Leptin……… 21
Şekil 7. Ürik Asit ve Sinyal Yolakları……….. 23
xi Şekil 9. Ölen Hastaların Tanıya Göre Sağkalım Eğrileri………. 26 Şekil 10. Düşük, Normal ve Yüksek Ürik Asit Değerlerine sahip Hastaların Sağkalım Karşılaştırması………. 31
Şekil 11. Düşük ve Normal ile Yüksek Ürik Asit Değerlerine sahip Hastaların Sağkalım Karşılaştırması………. 32
1 1. GİRİŞ VE AMAÇ
Kanser, tüm dünyada kardiyovasküler hastalıklardan sonra en sık 2. ölüm nedenidir.
2008 yılında 12,7 milyon yeni kanser vakası olduğu ve 7,6 milyon kişinin kansere bağlı öldüğü tahmin edilmektedir (1). Türkiye’de 2013 yılında yaşa standardize edilmiş kanser hızı erkeklerde 269,9 , kadınlarda ise 186,5’tir (100.000 kişide). Yine 2013 yılı kanser istatistiklerine göre ülkemizde 103.070 erkek ve 71.233 kadının kansere yakalandığı tahmin edilmektedir (2).
Her ne kadar bütün kanser türleri için ayrı prognostik faktörler olsa da çoğu kanser için ortak prognostik faktörler histoloji, grade, tümörün çapı ve lokalizasyonu, evre, yaş, cinsiyet, mevcut tıbbi durum olarak sayabiliriz. Fakat mevcut prognostik faktörlere rağmen, hala prognoz ve survi tayininde yetersizlikler bulunmaktadır. Bu yüzden laboratuar, moleküler veya genetik yöntemlerle yeni prognostik faktörler bulmaya ihtiyaç vardır.
Pürin nükleotidleri adenozin ve guanin, adenozin monofosfat gibi hücresel enerji depolarının bileşenleridir ve DNA, RNA gibi nükleik asitlerde yapıtaşı olarak görev alırlar (3). Nükleer materyalin katabolizması sonuca açığa çıkan pürinlerin yıkım sürecindeki son ürünü yüksek primatlar ve insanlarda ürikaz enzimi eksikliği sonucu oluşan ÜA dir. Ürikaz enzimine sahip olan diğer türlerde ise son ürün allantoindir (4,5). ÜA bir çok hastalıkta risk faktörü olarak suçlanmıştır. ÜA yüksekliği gut, hipertansiyon ve kardiyovasküler hastalıklar için risk faktörü olarak değerlendirilmiştir (6). Bunun yanında Parkinson Hastalığı, Multipl Skleroz ve Alzheimer Hastalığı/Demansı olan hastalarda yüksek ÜA seviyesinin protektif olduğu gösterilmiştir (7). Fakat özellikle malign hastalıklara yol açma veya hastalıkları önleme açısından yapılan deneysel çalışmalar çelişkili sonuçlar doğurmaktadır. Ayrıca prognoz ve survi açısından yapılan birçok çalışmalarda farklılıklar gözlemlenmiştir.
2 kadar Ege Üniversitesi Tıp Fakültesi Hastanesi İç Hastalıkları Anabilim Dalı Onkoloji Bilim Dalı poliklinik ve/veya servise başvuran hastaların tanı sırasında ve/veya tanı sonrası en geç 1 ay içerisindeki ÜA ve hemogram parametreleri (Lökosit (WBC) , Hemoglobin (Hb), Hematokrit (Hct), Nötrofil, Lenfosit, Monosit, Eozinofil, Bazofil, Trombosit (plt), Ortalama eritrosit büyüklüğü (MCV), Her bir eritrosit’in içindeki ortalama hemoglobin yüksekliği (MCH) , Ortalama eritrosit hemoglobin konsantrasyonu (MCHC) , Eritrosit dağılım genişliği (RDW), Ortalama trombosit büyüklüğü (MPV), Kandaki trombosit yüzdesi (PCT) ve trombosit dağılım genişliği (PDW) ile ölüm ve sağ kalım arasında bir ilişki olup olmadığı ve bu değerlerin prognoz tayininde öngördürücü olup olmadığını belirlemektir.
2. GENEL BİLGİLER
2.1. Kanser Epidemiyolojisi
Kanser, günümüzün en önemli sağlık sorunlarından birisidir. Sık görülmesi ve öldürücülüğünün yüksek olması sebebiyle aynı zamanda bir halk sağlığı sorunudur. Tanı olanaklarının gelişmesi ve sağlık kuruluşlarından yararlanma olanaklarının artması ile her yıl daha çok kanser vakası teşhis edilebilmektedir. Ayrıca enfeksiyon hastalıklarının kontrol altına alınması, diğer hastalıklara karşı etkin tedavi yöntemlerinin kullanıma girmesi ve yaşam standardının yükselmesi ile ortalama yaşam süresinin uzaması, dolayısı ile yaşlı nüfusun artması, toplumun bilgi seviyesinin yükselmesi ve kanser tedavisindeki gelişmeler sebebi ile daha çok hastanın hekime başvurması ve gelişen teknoloji ile çevresel karsinojenlere maruziyetin artışı kanser sıklığını arttıran etkenlerdir.
Dünya Sağlık Örgütü (WHO) verilerine göre tüm dünyada ölüm sıralamasında kanser ikinci sırada yer almaktadır. Dünya’da en çok tanı konulan kanserler akciğer (%13), meme (%11,9), kolon (%9,7), prostat (%7,9) ve mide (%6,8) kanserleri iken
3 kanserden ölümlerin ise en çok akciğer (%19,4), karaciğer (%9,1) ve mide kaynaklı (%8,8) kanserlerden olduğu belirtilmiştir (1).
Ülkemizde 1970’li yıllarda sebebi bilinen ölümler sıralamasında 4. sırada yer alan kanser, 2013 verilerine göre kardiyovasküler sistem hastalıklarından sonra 2. sıraya yükselmiştir (2).
Şekil 1. Erkeklerde en sık görülen 10 Kanserin yaşa göre standardize edilmiş hızları (Dünya Standart Nüfusu, 100.000 Kişide)
4 Şekil 2. Kadınlarda en sık görülen 10 kanserin yaşa göre standardize edilmiş hızları
(Dünya Standart Nüfusu, 100.000 Kişide)
Tablo 1. Cilt dışı kanserlerin yaşa göre standardize edilmiş hızları (100.000 kişide)
5 2.2. Ürik Asit
2.2.1. Ürik Asit Sentez ve Atılımı
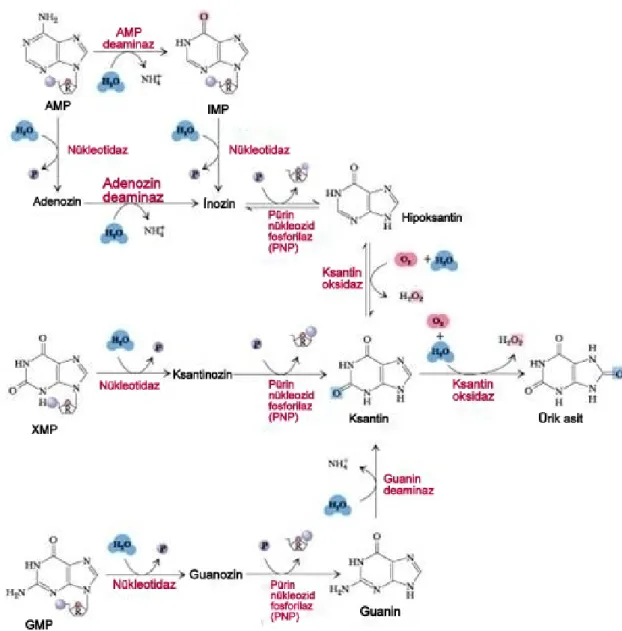
Pürin nükleotidleri adenozin ve guanin, adenozin monofosfat gibi hücresel enerji depolarının bileşenleridir ve DNA, RNA gibi nükleik asitlerde yapıtaşı olarak görev alırlar (8). ÜA, karaciğerde ksantin oksidaz (KOR) enzimi tarafından ksantin ve hipoksantinin oksidasyonu sonucu oluşur (9) (Şekil 3).
ÜA zayıf bir organik asittir (pKA 5.75) ve fizyolojik pH da monosodyum ürat halinde bulunur (6). Sulu ortamlarda çözünürlüğü düşüktür ve serumda uzun süre yüksek kalması, yumuşak dokularda ürat kristalleri şeklinde depolanmasına yol açar (10). Oksidatif stres ortamında ÜA’ler allantoine veya alloksan ve parabanat gibi diğer yıkım ürünlerine de okside olabilirler (11, 12).
İnsanlarda 1. Kromozoma lokalize ürikaz geni, iki sessiz mutasyon sonucu etkisizdir (5).
Bu enzim aktivitesinin eksikliği evrim basamağında geri adım olarak görülse de, diğer canlılara göre yüksek olan ÜA konsantrasyonunun (insanlarda 240-360 μm, diğer memelilerde 30-50 μm) ÜA’nın potansiyel anti-oksidan etkileri gözetilerek, insanlara selektif avantaj sağladığı düşünülmektedir (6).
ÜA’in vücutta depo edilen ortalama miktarı sağlıklı erkeklerde 1200 mg, sağlıklı kadınlarda ise bunun yarısı kadardır. Vücudumuzdaki ÜA, endojen olarak nükleik asitlerin yıkımı ile oluşurken, gıda yoluyla ekzojen kaynaklı da olabilir (13).
ÜA’in kandaki miktarı; diyetle pürinlerin alımı, ÜA biyosentezi ve atılımı arasındaki dengeye bağlıdır (14).
Pürinsiz diyet ile beslenen sağlıklı yetişkin bir erkeğin ÜA atılım hızı ortalama 400 mg/gün’dür. Tipik batı diyeti ile beslenenlerde bu miktar 250-750 mg/gün arasında değişmektedir. ÜA’in 1/3’ü gastrointestinal sistemden, 2/3’ü ise böbrekten
6 idrarla atılmaktadır (15).
Şekil 3. Ürik Asit Sentezi
AMP:Adenozin monofosfat, IMP:İnozin monofosfat XMP:Ksantin monofosfat, GMP:Guanin monofosfast
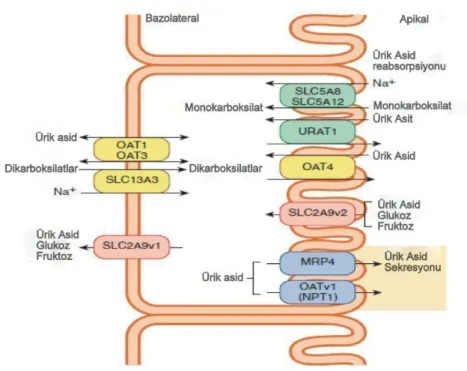
ÜA, kolaylaştırılmış difüzyon yolu ile tübül membranından (proksimal tübül) geçmektedir. Bugüne kadar 10’dan fazla membran transport proteini böbrek
7 proksimal tübül hücrelerinde tanımlanmıştır (6) (Şekil 4). Organik anyon transport proteinleri (OAT): OAT-1, 3, 4, 10, ABCG2, NPT1/4, MRP4, URAT-1 ve GLUT-9 böbrek ve böbrek dışı dokularda ÜA dağılımında rolü olan ve fonksiyonları kısmen anlaşılmış proteinlerden bazılarıdır. Özellikle URAT-1 (SCC22A12)’in tübül lümeninden tübül hücresine ÜA’in transportunda ve GLUT-9 (SLC2A9/URATv1) adlı voltaj duyarlı proteinin proksimal tübül hücresinden dolaşıma ÜA transportunda rolü olduğu gösterilmiştir(16, 17).
Şekil 4. Ürik Asit Atılımı
OAT:Organic Anion Transporter, SLC2A9:Solute carrier family 2 member 9, SLC13A3:Solute carrier family 13 member 3, URAT1:Urat Transporter, MRP4:Multidrug Resistance-Associated Protein4, NPT1:Nicotinaye Phosphoribosyltransferase, SLC5A8:Solute carrier family 5 member 8, SLC5A12:Solute carrier family 5 member 12
8 Östrojenin URAT-1’i baskılama kapasitesi, östrojenin ürikozürik etkilerinde santral bir rol oynar. Bu yüzden normal şartlarda östrojen premenapozal kadınlarda serum ÜA seviyelerini baskılar.
2.2.2. Ürik Asit’in Etkileri
Serbest radikal, eşlenmemiş elektron içeren atom veya moleküldür. Genelde elektronlar atom veya molekülde eşlenik olarak bulunmaları nedeniyle molekül stabildir ve reaktif değildir. Ancak, moleküle bir elektron ilavesi ya da bir elektron kaybı onu reaktif hale getirir (18). Organizma sürekli olarak serbest radikal ataklarıyla karşı karşıyadır. Atmosferin %21’ini teşkil eden oksijenin aerobik organizmanın yaşamı için gerekliliği kaçınılmazdır. Serbest radikaller fizyolojik şartlarda ve dış etkenlere karşı organizmanın savunmasında da belirli oranda oluşur ve içsel mekanizmalarla organizmaya olabilecek zararlı etkileri önlenir. Solunan oksijenin %95’inden fazlası mitokondrilerde ATP şeklinde enerji oluşumunda kullanılırken, yaklaşık %5’i de son yörüngelerinde ortaklanmamış elektron içerir ve bu özellikleri nedeniyle de toksik serbest radikallere dönüşmektedir (19).
Hücrede normal metabolik yollardaki enzimatik reaksiyonlarda enzimlerin aktif yerinde ara ürünler olarak devamlı şekilde serbest radikaller oluşabilir. Bazen bu serbest radikal ara ürünler enzimlerin aktif yerinden sızarlar, moleküler oksijenle kazara etkileşirler ve sonuçta serbest oksijen radikalleri (SOR) oluşur. Endoplazmik retikulum ve nükleer membranda serbest radikal üretimi, membrana bağlı sitokromların oksidasyonundan kaynaklanır. Normalde hücrelerde en büyük SOR kaynağı mitokondriyal elektron transport zincirinden sızıntıdır. Mitokondri iç zarında yerleşmiş oksidatif fosforilasyon zinciri bileşenleri büyük oranda indirgendiği zaman mitokondriyal süperoksit radikal üretimi artar.
Birçok enzimin katalitik döngüsü sırasında da serbest radikaller ortaya çıkar. Bu enzimlerden biri KOR’dur. KOR, hasarlanmamış dokularda bir dehidrojenaz olarak vardır, pürinlerin yıkılım yolunda hipoksantinden ksantin ve ksantinden ÜA
9 oluşumu basamaklarında elektron akseptörü olarak moleküler oksijenden (O2) daha çok NAD+ kullanır. Oksijensizliğe bağlı olarak ADP'nin ATP'ye fosforilasyonunun azaldığı durumlarda (iskemi durumlarında) ADP yıkılır ve pürin bazı, KOR’ın bir oksidaz olarak etkili olmasıyla hipoksantine dönüştürülür. KOR’ın oksidaz olarak aktivite göstermesi durumunda hipoksantin ksantine ve ksantin ÜA’e dönüşürken moleküler oksijen kullanılmakta, moleküler oksijen hidrojen perokside (H2O2) indirgenmektedir. İskemi durumlarında oksijen seviyesi düşük olduğundan önemli hasar olmaz. Ancak oksijen seviyesi reperfüzyon sırasında normale dönünce iskemi yerinde KOR etkisiyle fazla miktarda H2O2 ve süperoksit radikali (O2−) oluşur, bunların etkisiyle de iskemi/reperfüzyon hasarı denen durum ortaya çıkar. KOR’ın özellikle intestinal mukoza hücrelerinde görülen iskemi/reperfüzyon hasarında önemli faktör olduğu düşünülmektedir (20).
ÜA’in bu serbest radikaller üzerinde anti-oksidan görevi olduğu bulunmuştur (21, 22). Özellikle hidroksil(OH-), O2− ve peroksinitrit (ONOO-) radikalleri üzerine etkilidir ve lipit peroksidasyonunu engelleyerek bu anti-oksidan mekanizmasını gerçekleştirir(23). Bu yüzden ürat insan plazmasındaki anti-oksidan mekanizmaların yarısından sorumludur ve anti-oksidan kapasitesi C vitamini kadar güçlüdür (21,24).
Şekil de de görüldüğü gibi, ÜA ONOO-‘in yol açtığı protein nitritlenmesi (25), lipid ve protein peroksidasyonundan koruyucu etkinliği vardır (26). Ayrıca tetrahidrobiopterin (HB4) inaktivasyonu (27) ve Nitrik oksit sentaz (NOS)’a kofaktör olarak da rol oynar. Bir diğer anti-oksidan mekanizması ise LDL’nin Cu+2 ile indüklenen oksidasyonunu engellemesidir (Şekil 5). Bu anti-oksidan mekanizmalar ÜA’in kardiyovasküler hastalıklar, yaşlanma ve kanserden korunmanın temelini oluşturmaktadır (25).
10
ŞEKİL 5.Ürik Asit’in Pro ve Antioksidan Mekanizmaları
SOR:Serbest oksijen radikali, ONOO-:Peroksinitrit, NO ∙ :Nitrik Oksit,
HB4:Tetrahidrobiopterin, O2-.:Süperoksit, ÜA∙:Ürik Asit Radikali, GSH:Glutatyon,
NOS:Nitrit Oksit Sentaz, NF-𝜿B:Nüclear Faktör Kappa B, MAPK:Mitogen-Activated
Protein Kinase, MCP-1:Monocyte Chemoattractant Protein-1,
COX-2:SİKLOOKSİJENAZ-2
In vitro ve hücresel çalışmalar ÜA’in aynı zaman da pro-oksidan gibi de davranabileceğini ortaya koymuştur. Örneğin ÜA LDL partiküllerini Cu+2 ile indüklenen oksidasyona karşı korumasına rağmen, okside lipit peroksidasyon ürünlerini içeren LDL’lerin oksidasyonunu ise arttırmaktadır (28, 29). ÜA’in LDL kolesterolleri üzerindeki ikili etkisi mikro çevrede geçiş metallerinin varlığına göre değişiyormuş gibi gözükmektedir (6). ÜA eğer ONOO- tarafından oksitlenir ise ürat radikalleri meydana gelir. Oluşan bu radikallerin ÜA’in pro-oksidan etkisinden sorumlu olabileceği düşünülmektedir (30). Fakat bu radikallerinin plazmada askorbik asit ile reaksiyona girerek çok hızlı bir şekilde deaktive edildiği de gözlenmiştir (27).
Nitrik Oksit (NO), vazodilatör olarak tanımlanmıştır ve kardiyovasküler sistem için önemli düzenleyici olarak kabul edilir. Düşük NO seviyeleri HT ve insulin rezistansı ile ilişkilidir (31, 32, 33). ÜA aerobik şartlar altında, NO ile doğrudan tepki verebilir, bu tepkime NO’in glutatyon gibi diğer moleküllere transfer olmasına neden olur (34). Aynı şekilde anaerobik koşullarda, mikro çevrede NO varlığında, ÜA kimyasal tepkime sonucu stabil 6-amino urasile dönüştürülür (35). Dolayısıyla artmış plazma ÜA seviyeleri, NO biyoyararlanımını azaltabilir. Ratlarda ürikaz inhibitörü
11 olan oksonik asit verilerek de denemiş ve benzer sonuçlar elde edilmiştir. Plazma ÜA seviyesindeki artış, plazma nitrit ve nitrat seviyesindeki azalma ile ilişkili bulunmuştur. Bir diğer örnek ise ÜA verilen endotel hücrelerinde NO veya vasküler endotelyal büyüme faktörü (VEGF) aracılı NO salınımında hafif bir azalma olur (36) böylece, ÜA doza bağımlı olarak NO biyoyararlanımını azaltabilir. ÜA ve NO arasındaki direk kimyasal reaksiyon plazma nitrit ve nitrat düzeyindeki azalmayı açıklamasına rağmen, in vivo koşullarda ÜA’in NO sentezini azalttığına dair veriler bulunmaktadır. Örneğin pulmoner endotel hücrelerinde ürik asit, NO üretimini azaltır bu etki ÜA’in arjinaz aktivitesini arttırmasına bağlıdır, arjinaz aktivitesinin artması reaksiyonun arginin’den NO üretimine doğru ilerlemesine engel olarak L-argininden üre yönüne kaymasına sebep olur (37).
ÜA’in diğer bir pro-oksidan etkisi adipojenik farklılaşma sırasında 3T3-L1 hücrelerinde (farelerden alde edilen fibroblast benzeri morfolojiye sahip ve uygun koşullarda adipoz doluya farklılaşabilen hücreler) gösterilmiştir. Bu hücreler adipositlere farklılaşmak üzere uyarıldığında ÜA ilavesi, NADPH oksidaz (NOK) aracılığı ile SOR üretimini daha fazla arttırır (38). Adipositlerdeki bu etki inflamasyonun indüksiyonuna ve obezitede gözlenen yağ dokudaki insulin rezistansını açıklamaya katkıda bulunabilir (39).
Vasküler düz kas hücrelerinde, ÜA’in, Nükleer faktör-kappa B (NF-κB), mitojen aktive protein-kinaz (MAPK) ve siklooksijenaz 2 (Cox2) aracılığı ile Monosit Kemoatraktan Protein- 1 (MCP-1) üretimini stimüle ettiği gösterilmiştir (40). MCP-1’ in ise ateroskleroz sürecinde önemli rol aldığı düşünülmektedir (41). Bu bilgilerin ışığında, eldeki veriler göstermektedir ki, ÜA kompleks kimyasal reaksiyonlar ve biyolojik etkilere sahiptir ve mevcut olan pro-oksidan ve NO azaltıcı etkileri, hiperürisemi ile ilişkili hipertansiyon, metabolik sendrom ve kardiyovasküler hastalıkları açıklayabilir (42).
12 2.2.3. Ürik Asit, Metabolik Sendrom ve Böbrek Hastalıkları
Metabolik sendrom; trunkal obezite, insülin rezistansı, yüksek kan basıncı, hipertrigliseridemi ve hiperürisemiyle karakterize bir tanımdır (43-46) ve prevalansı tüm dünyada artma eğilimi göstermektedir. Metabolik sendrom varlığı diyabet (47), hipertansiyon (48), kardiyovasküler hastalıklar (49) ve diğer bütün ölüm nedenleriyle kuvvetle ilişkili görünmektedir (50).
Son zamanlarda yapılan çalışmalarda metabolik sendromun kronik böbrek hastalığı ve mikroalbuminüri ile de ilişkisinin olduğu ortaya konmuştur (51, 52). Bunun hangi mekanizmalarla olduğu tam olarak belli değildir. Muhtemel olasılıklardan biri, obezitenin kronik böbrek hastalığı için bağımsız bir risk faktörü olmasıdır (51, 53) ve obezite tedavisinin renal fonksiyonları stabilize etmesi ve erken evre hemodinamik bozuklukları ve glomerüler disfonksiyonu geri döndürdüğü gösterilmiştir (54, 55). Obezite aynı zamanda diyabet ve hipertansiyon riskini arttırır ve bu da glomerüler hipertansiyon ve hiperfiltrasyona yol açar (56).
Metabolik sendrom, inflamatuar sitokinlerin salınımı, endotelyal disfonksiyon ve oksidatif stres ile ilişkilidir ve bunlar glomeruloskleroz gelişimine katkıda bulunurlar (57). İnsülin rezistansı da sempatik sinir sistemi ve renin-anjiotensin-aldosteron sistemlerinin aktivasyonuna bağlı olarak renal hasara katkıda bulunur. Dislipidemi ise direk toksik veya inflamatuar etkisiyle tübülointerstisyel hasara yol açar (58).
Epidemiyolojik çalışmalar hiperüriseminin normal popülasyonda, hipertansif hastalarda, diyabetli veya kronik böbrek hastalığı olan hastalarda KBY’nin gelişimi ve/veya ilerlemesi açısından bağımsız bir risk faktörü olduğunu göstermektedir (59-62). Ilımlı hiperürisemisi olan normal ratlarda yapılan çalışmada; sistemik hipertansiyon, renal vazokonstrüksiyon, glomerüler hipertansiyon ve hipertrofi ve intrarenal kristal birikiminden bağımsız olarak tübülointerstisyel hasarın meydana geldiği gösterilmiştir (63-65).
13 ÜA’in yol açtığı bu patolojilerin; endotelyal NO biyoyararlanımının azalması, renin-anjiotensin-aldesteron sisteminin aktivasyonu ve endotel hücreleri, endotel düz kas hücreleri üzerine direk etkisinden kaynaklandığı düşünülmektedir (66,67).
Son zamanlarda, deneysel olarak früktoz kullanılarak ÜA’in metabolik sendrom gelişimine doğrudan katkısı olduğu gösterilmiştir (68). Fruktoz; ATP tüketimiyle beraber fruktokinaz aktivasyonu, intraselüler fosfat tüketimi ve AMP deaminaz aktivasyonu sonucu ÜA seviyesini yükseltir (69). Fruktoz alımından sonra ÜA seviyesinin yükselmesi, ÜA’in direk etkisiyle NO’i düşürmesi ve adipositler üzerine etkisiyle oluşan insülin direncinde önemli rolü olduğunu düşündürmektedir.
2.2.4 Ürik Asit, Diyabet ve Kardiyovasküler Hastalıklar
Diyabet, kardiyovasküler hastalık (KVH) ve ateroskleroz gibi makrovasküler; retinopati, nefropati ve nöropati gibi mikrovasküler komplikasyonlara yol açması yönüyle önemli metabolik bir hastalıktır (70, 71). Tüm dünyada diyabetli hastaların %65’inin ölüm nedeni KVH ve inmedir. Çünkü diyabetli kişilerde kalp hastalığı nedeniyle ölüm hızı normal kişilere göre 2-4 kat fazladır (72).
Diyabetik hastalarda artan ürat klirensi nedeniyle serum ÜA değerleri düşüktür (73, 74). Bu hastalarda hipoürisemi; glukozüri (75), hiperfiltrasyon ile ilişkilidir. Bunun yanında hiperürisemi, hiperinsülinemi veya insülin rezistansı olan vakalarda görülebilmektedir (76) ve ÜA taşlarına bağlı nefrolitiyazis tip 2 DM’lu hastalar için bir risk faktörüdür.
Diyabetik nöropati zaman zaman tip 2 DM’de görülen ilk yakınma olabilir (77). Diyabetik periferal nöropati prevalansı ile artmış ÜA seviyeleri arasında anlamlı ilişki bulunduğuna dair yayınlar mevcuttur (78). Tam olarak patofizyolojisi anlaşılamamakla beraber bu komplikasyon için poliol yolu, serbest radikaller, non-enzimatik glikolizasyon, oksidatif radikaller ve inflamasyon suçlanmaktadır. ÜA’in
14 oksidatif stres ve inflamasyonu tetikleyerek veya arttırarak bu komplikasyonun patofizyolojisinde rol oynadığı tahmin edilmektedir.
Diyabetik retinopati, tip 2 DM’lu hastalarda insülin rezistansı ve visseral yağ birikimi sonucu oluşan bir komplikasyondur (79). Eski çalışmalarda herhangi bir korelasyon saptanamazken son zamanlarda yapılan çalışmalarda ÜA seviyeleri ile retinopati şiddeti arasında korelasyon saptanmıştır (80). Dahası, vitröz ÜA ve glukoz konsantrasyonunun proliferatif retinopatili hastalarda non-proliferatif hastalara göre daha fazla olduğu saptanmıştır. Vitröz içi fokal ÜA üretiminin hem patogenezde hem de retinopati progresyonunda etkili olduğu düşünülmektedir.
Yüksek serum ÜA seviyeleri, diyabetik olmayan popülasyonda bile KBY gelişimi açısından bağımsız bir risk faktörüdür (81). Aynı zamanda çalışmalar eşlik eden ve patogenezde rolü olan faktörler düzeltilse bile hiperüriseminin renal disfonksiyon açısından bağımsız risk faktörü olduğu yönündedir.
Aterosklerotik süreçte olduğu gibi organizma oksidatif stres altındayken ÜA düzeyleri artmaktadır (82). Ancak normal düzeylerden 1/3 kat veya daha fazla artacak olursa bir pro-oksidan olarak rol oynadığı rapor edilmektedir (82, 83).
Koroner arter hastalarında serum ÜA değerlerinin anlamlı olarak yüksek olduğu bildirilmiştir (84). Hiperürisemi, LDL’nin oksidasyonu ile lipit peroksidasyonunu arttırması ve endotel disfonksiyonu yapması (85) sonucunda, plateletlerde adezyon artısı ve trombüs oluşturabilir (14) ve meydana gelen trombotik ortam ateroskleroz gelişimine katkıda bulunabilir (14). Ayrıca hiperürisemi durumunda azalan NO’in endotel disfonksiyonuna ve HT’a yol açarak ateroskleroz gelişimine katkıda bulunduğu gösterilmiştir (86).
Ayrıca yüksek ÜA seviyeleri varlığında meydana gelen serbest radikaller, inflamatuar hücrelerden adezyon moleküllerinin salgılanmasına, inflamatuar hücrelerin aktivasyonuna ve endotel hasarı neticesinde endotel aderensinde artışa sebep olabilir (87). Bu duruma ÜA’in düz kas hücrelerindeki proliferasyonu arttırıcı etkisi de (88) eklendiğinde hiperüriseminin koroner arter hastalığına Zemin
15 hazırlayabileceği düşünülmüş ve yapılan bazı çalışmalarda ÜA yüksekliği KAH için bağımsız risk faktörü olarak saptanmıştır (89, 90). Randomize kontrollü bir çalışmada allopurinol’ün kronik stabil anjinalı hastalarda egzersiz kapasitesini arttırdığı gözlemlenmiştir (91). Aynı zamanda allopurinol tedavisinin iskemik reperfüzyon hasarı açısından kalp üzerinde protektif etkisi vardır (92).
Koroner arter hastalığına ÜA’in olası etkisi üzerine yapılan değerlendirme kalp yetersizliği hastalarını da kapsamaktadır. Bozulan endotel disfonksiyonunu ve artmış inflamasyonu destekler şekilde kalp yetersizliği olan hastalarda ÜA yüksekliği ile kronik inflamasyon arasında anlamlı ilişki saptanmıştır (92). Yapılmış çalışmalar kalp yetersizliği ile hiperürisemi arasındaki bağlantıyı göstermiş (93, 94), hiperüriseminin, artmış sol atriyal basınç, azalmış kardiyak indeks gibi kötü hemodinamik parametrelerle ilişkili olduğu tespit edilmiştir (95). Ayrıca bir allopurinol türevi olan oksipurinol’ün sol ventrikül ejeksiyon fraksiyonu düşük KKY’li hastalarda ejeksiyon fraksiyonunu yükselttiği bulunmuştur (96).
2.2.5. Ürik Asit ve Kanser
2.2.5.1. Ürik Asit, İnflamasyon ve Kanser
Obezite, tip 2 DM, insülin rezistansı, metabolik sendromlu hastalara genellikle hiperürisemiyle beraberdir ve artmış kanser riski ve insidansı eşlik eder. Bu hastalarda meme kanseri riski özellikle artmıştır (97-102). Kötü prognoz, artmış rekürrens riski ve kemoterapi direnciyle giden triple negatif meme kanserinin metabolik sendromlularda prevalansı yüksektir (98, 103, 104).
Büyük bir kohort çalışmasında kadın ve erkek gutlu hastalarda kanser insidansının arttığı ve bu artan riskin tanıdan 5 -15 yıllık gözlem sonucunda devam ettiği bildirilmiştir (105).
16 Tip 2 DM’lu hastalarda yapılan 21,5 yıllık gözlem sonunda bütün kanser mortalitelerinde ürik asitin bağımsız bir risk faktörü olduğu görülmüştür (106).
Obezite, tip 2 DM, insülin rezistansı ve metabolik sendromda bir kronik inflamasyon söz konusudur. Bu inflamasyonun oluşmasında ÜA’in pro-inflamatuar özellikleri de rol oynar (107, 98, 108, 109). ÜA inflamasyon oluşumunu monosodyum ürat kristalleri ve çözünebilir formuyla 2 ayrı yoldan sağlar. Monosodyum ürat, toll like reseptör-4 üzerinden (110-112) tehlike sinyali gibi davranarak birçok inflamatuar olaya aracılık eder. Özellikle ölen hücrelerin mikroçevresindeki artan ÜA değerlerinin monosodyum ürat kristallerinin toll like reseptörlerini uyardığı ve lökositlerden proinflamatuar sitokinlerin salınımına yol açtığı bilinmektedir (112, 113). Çözünebilir formu ise hücre içine girerek MAPK (p38 ve ERK)’ı aktifleştirir, NFKB’yi stimüle eder, MCP-1 ve CRP gibi inflamatuar mediatörlerin ekspresyonunu indükler (114-117). Bu etkilere hücre içindeki NOK’ın neden olduğu oksidatif stres aracılık eder (114, 115, 118, 119). Dahası farmakolojik olarak ÜA seviyelerinin düşürülmesi ile hem laboratuar hayvanlarında hem de KBY’li hastalarda inflamasyonun geriletildiği gösterilmiştir (120,121).
2.2.5.2. Ürik Asit, Adiponektin ve Kanser
Adiponektin, bir antiinflamatuar protein olup obezite, tip 2 DM, insülin rezistansı ve metabolik sendromda seviyesi azalmaktadır (122). Azalan adiponektin seviyeleri artmış kanser riski, hipertansiyon ve renal hasarla ilişkilidir (123-125).
Adiponektin değerleri leptin ve CRP değerleriyle ters orantılıdır (126). Obez çocuklarda ve metabolik sendromlu kadınlarda düşük adinopektin seviyeleri yüksek serum ÜA seviyeleriyle ilişkilidir (122,127). Metabolik sendromlu farelerde ÜA tek başına adinopektin seviyesini düşürdüğü bulunmuştur (121).
17 Yüksek serum adiponektin seviyelerinin meme kanseri üzerine olumlu etkileri vardır (128, 98, 129) ve meme kanserli fareler üzerine yapılan çalışmada verilen adinopektinin tümör progresyonunu azalttığı gösterilmiştir (130). Bunun yanında azalmış seviyeleri meme kanseri için bir risk faktörü (131-134) ve rekürrens, metastaz ve artmış mortalite (132) ile ilişkili olduğu gözlemlenmiştir. Bu etkinin adinopektinin tümör anjiogenezisini inhibe edici özelliğinden olduğu tahmin edilmektedir (135). Ayrıca son çalışmalar adinopektinin tümör hücreleri üzerindeki etkilerini WNT sinyalleri, AKT aktivitesi ve tümör süpresör LKB1’in inhibisyonu (130,136) üzerinden, ilave olarak adinopektin azalmasının PI3K/AKT fosforilasyonunu hızlandırdığı ve böylece tümör hücrelerinin proliferasyonunu arttırdığı bulunmuştur (137).
2.2.5.3. Ürik Asit, C-Reaktif Protein ve Kanser
Yüksek ÜA seviyelerinin yüksek CRP, IL-6 ve TNF-alfa ile ilişkili olduğu saptanmıştır(138). Yüksek CRP seviyeleri artmış meme kanseri riski ve kanser ölümleriyle koreledir (98,139). Ayrıca yüksek CRP değerleri kolorektal (140), akciğer (141), mide (142) kanserleri ve Renal hücreli kanser (143) için artmış risk oluşturur. Normal renal fonksiyonlu veya KBY’li hastalarda KOR’ın allopürinolle inhibisyonu hem CRP hem de serum ÜA’i düşürür. ÜA’in bu özelliği vasküler düz kas hücrelerinden ve endotel hücrelerinden CRP ve MCP-1 sekresyonunu uyarmasından kaynaklanmaktadır (114,115). Fakat CRP ve ÜA arasındaki bağa rağmen, CRP kanser nedeninden ziyade yüksek ÜA’nın neden olduğu inflamatuar olayı gösteren bir prognostik biyomarker olarak gözükmektedir (144).
18 2.2.5.4. Ürik Asit, Leptin ve Kanser
Adiposit kaynaklı bir hormon olan leptin, beslenme ve enerji homeostazında önemli bir rol oynamaktadır.
Leptinin fonksiyonal kaybıyla sonuçlanan mutasyonunda insanlar ve farelerde obezite ve tip 2 DM görülmektedir (145, 146). Metabolik sendromlu hastalarda leptin, CRP ve serum ÜA değerleri birbiriyle koreledir (147, 126, 148-150), adinopektin değerleriyle ise ters bir korelasyon vardır (127, 149).
Leptin, direk olarak ÜA’in böbrekten ekskresyonunu bozabilir ve leptin seviyeleri yüksek obezlerde hiperürisemiye neden olabilir (151). Hiperürisemik, leptin reseptör eksikliği olan farelerde aşırı hepatik KOR ekspresyonu gösterilmiştir. Bu da leptin reseptör sinyalinin hepatik KOR ekspresyonunu down-regüle ettiğini düşündürmektedir (152). Bu kanıtlara dayanılarak leptin reseptör sinyalinin kaybı sonucu hiperürisemi meydana gelmesi hiperüriseminin leptin seviyelerindeki artış sonucu olabilirliğini düşündürmektedir.
Diğer açıdan baktığımızda ÜA’in de leptin rezistansında rol oynayabileceğini düşündüren kanıtlar bulunmaktadır. Dahası ÜA seviyelerinin farmakolojik olarak düşürülmesinin metabolik sendrom üzerine olumlu etkileri vardır (153). Güncel bir çalışmada farelerdeki ÜA’in düşürülmesinin viseral yağ dokudan salınan leptin miktarını azalttığı bulunmuştur (154).
Yüksek leptin düzeyleri kanser riskinde artışla da ilişkilidir. Leptinin bu protümörojenik etkisinin kanser hücrelerinde ERK, JNK ve STAT3 yolakları üzerinden proliferasyonu stimüle ederek yaptığı görünmektedir. Diğer bir başka mekanizmanın ise kanser hücrelerindeki KOR’u down-regüle ederek proliferasyon ve tümörogenezise yol açtığı düşünülmektedir.
19 2.2.5.5 Ürik Asit Transportu ve Kanser
ÜA transportunda rol alan ABCG2 veya diğer adıyla meme kanseri rezistans proteini (BCRP), ATP bağımlı bir proteindir. ABCG2 nin ÜA transportunun yanında ksenobiotikleri (kemoterapi ilaçları da dahil) hücre dışına atan önemli bir görevi de vardır. Bu proteinin inhibisyonu veya mutasyonu kanser kemoterapisinde olumlu sonuçlar doğurur (155). Bu proteini kodlayan gende görülen C421A mutasyonu sonucu oluşan polimorfizm (glutamin yerine lizin in gelmesi,Q141K) hem ABCG2 ekspresyonunu azaltır hem de ÜA atılımını bloke eder. Bu özellikle Kafkas, siyahi ırk, japon ve çin popülasyonunda gut ve hiperürisemiye yol açan yaygın bir polimorfizm dir (156-159).
Prospektif analizler C421A polimorfizmin kemoterapi tedavisi almamış popülasyon nonpapiller renal hücreli kanser gelişiminde artmış risk olduğunu (160), diffüz büyük hücreli lenfoma ve akut lösemi için artmış risk ve kötü prognoza neden olduğunu ortaya koymuştur (161,162). Bu bilgiler hiperüriseminin kanser insidansı ve mortalitesinde önemli bir risk faktörü olduğunu göstermektedir.
P53, önemli bir tümör süpresördür ve tüm kanser tiplerinin yaklaşık yarısında mutasyona uğramıştır. P53’ün tümör süpresyonundaki rolü bir çok hedef genin transkripsiyonunu aktifleştirmesi ile olur (163). Son kanıtlar P53’ün hücre metabolizmasında da (oksidatif fosforilasyon, glikoliz; glutamin, serin ve yağ asitlerinin metabolizmalarının ve SOR’in düzenlenmesi) önemli roller oynadığını göstermiştir (164,165). Hücreler kritik hasara uğradıklarında p53 pro-oksidan olarak davranır ve SOR’nin seviyelerini düşürür (166). P53, bu özelliğini oksidatif stresde SLC2A9 (GLUT 9)’u indükleyerek yapar. URAT 1 ve OAT4 ün aksine SLC2A9 sadece böbrek de değil hemen hemen tüm dokularda ÜA transportunda rol oynar (167). Yapılan deneysel çalışmalarda endojen SLC2A9 proteininin ektopik p53 ekspresyonuyla indüklendiğini ve endojen p53 kaybının SLC2A9 seviyelerini anlamlı olarak azalttığını gösterilmiştir.
20 Düşük SLC2A9 ekspresyonu bir çok kanser tipinde görülmektedir ve kötü prognozla ilişkilir. SLC2A9 mRNA ekspresyonu normal hücrelerle karşılaştırıldığında böbrek, adrenal bez, prostat ve testis kanserlerinde anlamlı olarak düşük bulunmuştur.
2.2.5.6 Ürik Asit, Tümör Hücrelerindeki Ksantin Oksidaz ve Kanser
KOR enziminin tümör hücrelerinde azalmış seviyeleri veya hiç olmaması insanlarda agresif seyreden meme (168), mide (169), kolorektal (170), over (171), küçük hücre dışı akciğer kanserlerinde (154) ve farelerdeki karaciğer kanserinde (172, 173) gözlemlenmiştir. Meme, mide, kolorektal, over ve akciğer kanserlerinde azalmış KOR aktivitesi kötü prognozla ilişkilidir.
Pürin katabolizmasının azalması ve salvage yolundaki enzim aktivitesinin artması tümör hücrelerinin proliferasyonuna aracılık eder (172,173). Düşük KOR seviyelerinin meme kanser hücresinin agresifliğini artırması in vitro olarak COX-2 ve MMP-1 seviyelerindeki artış ölçülerek gösterilmiştir (174). Ayrıca KOR’ın inhibitör diferansiasyon proteini olan Id-1 ekspresyonunu düzenlediği ve yüksek Id-1 seviyelerinin meme kanseri hücrelerinin agresifliğini arttırdığı bulunmuştur.
Bu bulgular sistemik olarak KOR inhibisyonunun tümörogenez veya metastazı alevlendirebileceğini göstermektedir.
ÜA, pro-inflamatuar etkisinin dışında da tümörogenez veya metastaza katkıda bulunabilir. Yüksek ÜA seviyeleri gözlenen obezite,tip 2 DM ve metabolik sendromda ÜA tümör hücrelerindeki KOR’ı baskılayabilir ve kanser hücre diferansiasyonuna yol açabilir (174).
Aynı şeklde obezite, tip 2 DM ve metabolik sendromda görülen yüksek leptin düzeyleri tümör hücrelerindeki KOR’u down-regüle edebilir ve ÜA’in etkisine katkıda bulunabilir.
21 ŞEKİL 6.Ürik Asit, Ksantin Oksidaz ve Leptin
LepR:Leptin reseptörü, KOR:Ksantin Oksiredüktaz, SOR:Serbest Oksijen Radikali, Id-1:İnhibitör Diferansiasyon Protein-1, MMPs:Matriks Metalloproteinaz, AA:Araşidonik Asit, PGE2-4:Prostaglandin 2-4
22 2.2.5.7 Bir Sinyal Molekülü Olarak Ürik Asit
Bugüne kadar ÜA’in kanser hücreleri üzerindeki sinyal mekanizmaları hakkında çok az bilgi edinilmiştir.
ÜA’in tavşan proksimal renal tübül hücreleri tarafından alınmasının in vitro olarak hücre proliferasyonunu inhibe ettiği gösterilmiştir (175). Bu inhibisyon ÜA’in geçici olarak MAPK p38, JNK ve ERK1/2 yi aktive etmesiyle olur.
Fare aortundaki vasküler düz kas hücrelerinin proliferasyonunun ÜA tarafından cMYV ve PDGF A-zincir’in aktivasyonu sonucu olduğu gösterilmiştir (176). İlaveten bu proliferasyonda ÜA’in pro-inflamatuar mediatörlerden MCP-1 ve COX-2 yi de aktive ettiği bulunmuştur (177).
Meme kanseri hücresindeki mikroçevrede ÜA’in protümörojenik etkisini gösteren Şekil 7’deki hipoteze göre, ÜA’in tümör ilişkili ve/veya uzak adipositlere ÜA-spesifik transporter yoluyla (ÜRAT1 gibi) girdiği varsayılır ve burda NADPH Oksidazı aktive ederek SOR üretimine aracılık eder. ÜA’in hem normo hem hiperürisemik değerlerinde lökosit kemokin MCP-1 in mRNA ekspresyonunu arttırdığı, antiinflamatuar protein olan adiponektin’in ekspresyonunu ise azalttığı gözlemlenmiştir. İlaveten ÜA’in adipositlerde KOR’un ekspresyonunu azalttığı ve bunun da adipogenez ve adiponektin ekspresyonunun düzenleyicisi olan PPAR-gamma’nın sumalasyonunu (SUMO proteinleri proteinlere bağlanarak degradasyonu engeller) inhibe ettiği saptanmıştır (178, 179).
ÜA’in PPAR-gamma sumolasyonu üzerinden makrofaj antiinflamatuar markerları olan arjinaz-1, CD 36 ve CD206 yı azalttığı ve makrofajların inflamatuar aktivasyonuna yol açtığı düşünülmektedir.
23 ŞEKİL 7. Ürik Asit ve Sinyal Yolakları
MCP-1: Monosit Kemoatraktan protein-1, CINC: Cytokine-İnduced Neutrophil Chemoattractant, KOR: Ksantin Oksidaz/Oksiredüktaz, SOR: Serbest Oksijen Reaktifi ARG1: Arjinaz-1, SYA: Serbest Yağ Asidi, NOK: NADPH Oksidaz, PPAR𝜸:Peroxisome proliferator-activated receptor gamma
3.MATERYAL METOD
3.1 Çalışma Tasarımı ve Hastalar
ÜA’in mortalite ve sağkalım üzerine etkisini retrospektif olarak araştırmak için Ocak 2014-Ağustos 2015 tarihleri arasında Ege Üniversitesi Tıp Fakültesi Onkoloji Bilim Dalı servis ve polikliniğine başvuran, başvuru anında yaşı >18 olan 997 hasta
24 çalışmaya dahil edildi. Hastaların tanı ve tanı tarihleri, tanı yaşı, tanı anında veya en geç 1 ay içerisindeki üre, kreatinin, ürik asit, hemogram (WBC, Nötrofil, Lenfosit, Monosit, Eozinofil, Bazofil, Nötrofil%, Lenfosit%, Monosit%, Eozinofil%, Bazofil%, Hemoglobin, Hemotokrit, MCV, MCH, MCHC, RDW, Plt, MPV, PCT, PDW), Nötrofil/Lenfosit oranı, varsa ölüm tarihi ve ölüm yaşı kaydedildi.
3.2 İstatiksel Analiz Yöntemleri
İstatistiksel analizi için SPSS 20.0 (SPSS Inc, Chichago, IL, USA) programı kullanıldı.Nümerik değerler için 2 yönlü t testi, kategorik değerler için Ki Kare testleri kullanıldı. Kategorik değişkenler sayım-sayı, yüzde (%) olarak özetlenirken devamlı değişkenler de ortalama, ortanca, standart sapma, çeyrekler arası aralık, minimum, maksimum olarak özetlenmiştir.Bağımsız parametrelerin ÜA ve mortalite üzerindeki etkilerini değerlendirmek için Cox orantılı-hazard regresyon modeli ve çok değişkenli regresyon analizi kullanılmıştır.
3.3 Demografik Özellikler ve Bulgular
Hastaların 553’ü (%55) kadın, 444’ü (%45) erkekti. 217 hasta meme (%22), 110 hasta kolon (%11), 76 hasta mide (%8), 65 hasta küçük hücre dışı akciğer (%7), 64 hasta pankreas (%6), 35 hasta rektum (%4), 35 hasta over (%4), 35 hasta malign melanom (%4), 25 hasta primeri bilinmeyen (%3), 24 hasta safra yolları (%2) ve 311 hasta diğer kanser çeşitleriydi (%31) (Şekil 9).
25 ŞEKİL 8. Tanı dağılımları
Tablo 2. Ölen Hastaların Ortalama Yaşam Süreleri
TANI ORT.YAŞAM SÜRESİ (AY)
Meme CA 201,54 Kolon CA 96,03 Mide CA 22,22 Küçük Hücre Dışı Akc. CA 22,83 Pankreas CA 10,66 Rektum CA 59,81 Over CA 91,89 Malign Melanom 64,37 22% 11% 8% 7% 6% 4% 4% 4% 3% 2% 31% 1.Meme CA 2.Kolon CA 3.Mide CA 4.Küçük Hücre Dışı Akciğer CA 5.Pankreas CA 6.Rektum CA 7.Over CA 8.Malign Melanom 9.Primeri Bilinmeyen CA 10.Safra Yolları CA 11.Diğer
26
Primeri Bilinmeyen CA 11,69
Safra Yolları CA 21,07
Diğer 81,30
Şekil 9. Ölen Hastaların Tanıya Göre Sağkalım Eğrileri
Hastaların tanı yaşlarının ortalaması 57,3 (± 14,5) idi. Retrospektif olarak taranan dosyalardan edinilen bilgilerde, 01.08.2015 itibariyle, 628 hastanın (%63) yaşadığı saptandı. Ölen hastaların tanı aldıktan sonraki ortalama yaşam süreleri 16,1 (± 27,13) ay olarak saptandı.
997 hastanın 428’nin (%43) ÜA değerlerine ulaşıldı. Ortalama ÜA değerleri tüm hastalar için 4,79 (± 1,82) mg/dl, yaşayan hastaların (260 kişi,%65) 4,57 (± 1,53) mg/dl, ölen hastaların ise (140 kişi,%35) 5,20 (± 2,22) idi (p=0,0006).
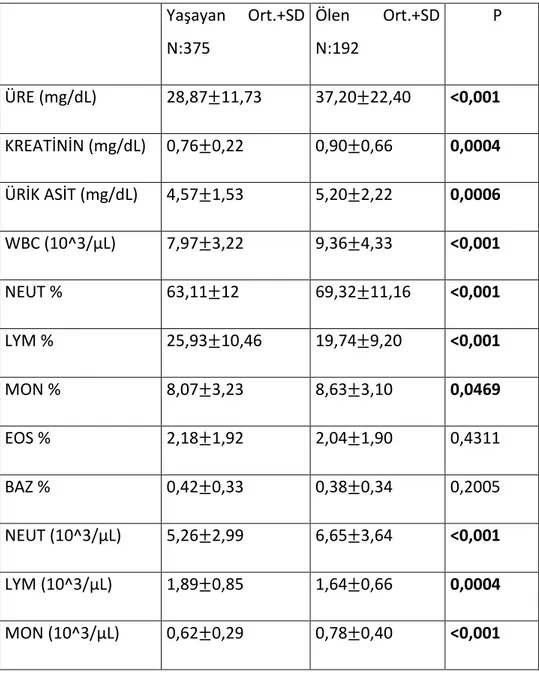
27 997 hastanın 567’sinin (%57) Hemogram, Üre ve Kreatinin değerlerine ulaşıldı. Yaşayan ve ölen 2 grup karşılaştırıldığında; ölen hasta grubunda üre, kreatinin, ÜA, WBC, Nötrofil%, Monosit%, Nötrofil, Monosit, Nötrofil/Lenfosit oranındaki yüksekliğin ve Hct, Lenfosit ve Lenfosit% sindeki düşüklüğün anlamlı olduğu saptandı.
Tablo 3.Yaşayan ve Ölen Hastaların Hemogram, Üre, Kreatinin ve Ürik Asit Değerlerinin Karşılaştırılması. Yaşayan Ort.+SD N:375 Ölen Ort.+SD N:192 P ÜRE (mg/dL) 28,87±11,73 37,20±22,40 <0,001 KREATİNİN (mg/dL) 0,76±0,22 0,90±0,66 0,0004 ÜRİK ASİT (mg/dL) 4,57±1,53 5,20±2,22 0,0006 WBC (10^3/µL) 7,97±3,22 9,36±4,33 <0,001 NEUT % 63,11±12 69,32±11,16 <0,001 LYM % 25,93±10,46 19,74±9,20 <0,001 MON % 8,07±3,23 8,63±3,10 0,0469 EOS % 2,18±1,92 2,04±1,90 0,4311 BAZ % 0,42±0,33 0,38±0,34 0,2005 NEUT (10^3/µL) 5,26±2,99 6,65±3,64 <0,001 LYM (10^3/µL) 1,89±0,85 1,64±0,66 0,0004 MON (10^3/µL) 0,62±0,29 0,78±0,40 <0,001
28 EOS (10^3/µL) 0,15±0,15 0,17±0,17 0,2700 BAZ (10^3/µL) 0,03±0,02 0,03±0,05 0,1489 ERİT. (10^6/µL) 4,48±0,58 4,41±0,63 0,2052 HEMOGLOBİN(g/dL) 12,22±1,83 11,94±1,89 0,0889 HEMATOKRİT (%) 37,25±4,83 36,27±5,11 0,0242 MCV(fL) 83,06±8,08 82,09±9,20 0,1969 MCH(pg) 27,32±3,02 27,13±2,97 0,4724 MCHC(g/dL) 32,73±1,31 32,86±1,30 0,2807 RDW(%) 14,94±2,80 15,16±2,18 0,3273 PLT (10^3/µL) 295,65±103,91 305,46±130,68 0,3304 MPV (fL) 10,55±1,44 10,42±1,19 0,2906 PCT(%) 0,30±0,09 0,32±0,12 0,1367 PDW(%) 17,68±13,68 16,14±9,91 0,6629 NEU/LYM 3,49±3,62 4,88±3,74 <0,001
Erkekler için ÜA referans aralığı 3,5-7,2 mg/dl,kadınlar için 2,6-6 mg/dl olarak alındı.336 hastanın ÜA i normal, 62’sinin yüksek ve 30’unun düşük olduğu görüldü.
ÜA’i yüksek hastalarla ÜA’i normal ve düşük olan hastalar karşılaştırıldığında; ÜA’i yüksek olan grupta Üre, Kreatinin, ÜA, Eritrosit ve Hematokrit değerlerinin anlamlı olarak yüksek olduğu görüldü (tablo 4).
29 Tablo 4.Ürik Asit Değerlerine göre Üre,Kreatinin ve Hemogram Değerlerinin Karşılaştırılması ÜADN Ort.+SD N:366 ÜAY Ort.+SD N:62 P ÜRE(mg/dL) 29,17±12,80 48,29±28,68 <0,001 KREATİNİN(mg/dL) 0,76±0,24 1,01±0,40 <0,001 ÜRİK ASİT(mg/dL) 4,26±1,25 7,88±1,61 <0,001 WBC (10^3/µL) 8,46±4,00 8,42±2,72 0,93 NEUT % 64,90±12,27 66,82±9,46 0,2432 LYM % 24,27±10,76 22,43±9,41 0,2078 MON % 8,21±2,85 8,25±2,54 0,9170 EOS % 2,22±2,03 2,09±1,91 0,6497 BAZ % 0,43±0,37 0,38±0,23 0,3326 NEUT(10^3/µL) 5,72±3,53 5,77±2,42 0,9128 LYM(10^3/µL) 1,82±0,85 1,76±0,63 0,5956 MON(10^3/µL) 0,67±0,35 0,69±0,30 0.7378 EOS(10^3/µL) 0,16±0,16 0,17±0,18 0,9203 BAZ(10^3/µL) 0,03±0,04 0,03±0,01 0,5242 ERİT. (10^6/µL) 4,41±0,62 4,59±0,63 0,0335 HB(g/dL) 11,98±1,89 12,49±1,70 0,0502
30 HCT(%) 36,55±5,10 38,07±4,56 0,0283 MCV(fL) 82,63±9,10 83,20±6,55 0,6386 MCH(pg) 27,23±3,00 27,27±2,54 0,9305 MCHC(g/dL) 32,72±1,28 32,75±1,16 0,8620 RDW(%) 15,18±2,84 15,21±2,20 0,9433 PLT(10^3/µL) 297,75±108,96 285,70±107,01 0,4203 MPV(fL) 10,51±1,50 10,85±1,04 0,0968 PCT(%) 0,31±0,10 0,31±0,09 0,9173 PDW(%) 18,97±14,76 14,2±3,12 0,4393 NEU/LYM 4,02±4,12 3,82±2,42 0,7179
Sağkalım sürelerine bakıldığında 148 (428) hastada ortalama sağkalım süresi düşük ÜA’i olan grupda 18,201± 1,426 ay (95% CI 15,407-20,995), normal grupta 70,962± 10,244 ay (%95 CI 50,884-91,041) ve yüksek grupda 20,571± 2,779 ay (95% CI 15,125-26,017) olarak bulundu.
Her 3 grubu karşılaştırdığımızda normal grubun sağkalım sürelerinin düşük gruba göre anlamlı olarak yüksek olduğu (p=0,030), normal grubun sağkalım sürelerinin yüksek gruba göre anlamlı olarak daha yüksek olduğu bulundu (p=<0,001). Düşük grupla yüksek grup karşılaştırıldığında sağkalım süresi açısından bir anlam olmadığı saptandı (p=0,304) (Şekil 10).
31 ŞEKİL 10. Düşük,Normal ve Yüksek Ürik Asit Değerlerine sahip Hastaların Sağkalım Karşılaştırması.
Ayrıca; düşük ve normal ÜA seviyelerine sahip hastaları beraber değerlendirip (1.grup), yüksek ÜA seviyelerine sahip hastalarla karşılaştırdığımızda (2.grup), ilk grupdaki hastaların sağkalım sürelerinin anlamlı olarak daha yüksek olduğu saptandı (p=<0,001) (Şekil 11).
32 Şekil 11. Düşük ve Normal ile Yüksek Ürik Asit Değerlerine sahip Hastaların Sağkalım Karşılaştırması.
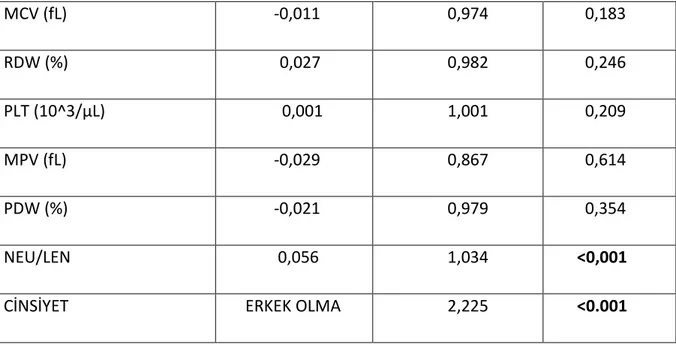
Değişken parametreleri değerlendirdiğimizde ÜA, normalden yüksek ÜA değerlerinde, Kreatinin ,Üre , PMNL, Nötrofil, Monosit ,Tanı yaşı, Nötrofil%, Monosit%, Bazofil% ve Nötrofil/Lenfosit oranlarındaki birim artışların; Lenfosit, Lenfosit%, Hemoglobin ve Hematokrit deki birim azalmaların ise mortaliteyi arttırdığı görülmüştür.Bunun yanında erkek cinsiyetin de tek başına mortaliteyi bağımsız olarak arttırdığı saptanmıştır (p:<0,001) (Tablo 5).
33 Tablo 5.Değişken Parametrelerin Univariate Cox-Regresyon Analizi
DEĞİŞKEN 𝛽 TEHLİKE ORANI
(HAZARD ORANI) P ÜRİK ASİT(mg/dL) 0,157 1,169 0,001 NORMALDEN YÜKSEK ÜRİK ASİT (mg/dL) 0,795 2,215 <0,001 KREATİNİN (mg/dL) 0,405 1,499 <0,001 ÜRE (mg/dL) 0,024 1,024 <0,001 WBC (10^3/µL) 0,082 1,091 <0,001 NEU (10^3/µL) 0,040 1,041 <0,001 LENF (10^3/µL) -0,056 0,946 <0,001 MONO (10^3/µL) 0,037 1,038 0,028 EOS (10^3/µL) -0,049 0,953 0,244 BAZO (10^3/µL) -0,260 0,771 0,294 TANI YAŞI 0,025 1,025 <0,001 NEU % 0,093 1,097 <0,001 LYM % -0,0435 0,647 <0,001 MONO % 1,164 3,204 <0,001 EOS % 0,352 1,422 0,394 BAZO % 5,036 153,831 0,001 HEMOGLOBİN (g/dL) -0,76 0,926 0,037 HEMATOKRİT (%) -0,037 0,963 0,006
34 MCV (fL) -0,011 0,974 0,183 RDW (%) 0,027 0,982 0,246 PLT (10^3/µL) 0,001 1,001 0,209 MPV (fL) -0,029 0,867 0,614 PDW (%) -0,021 0,979 0,354 NEU/LEN 0,056 1,034 <0,001
CİNSİYET ERKEK OLMA 2,225 <0.001
Değişken parametreleri multivariate olarak değerlendirdiğimizde; ÜA’in normalden yüksek olmasının mortaliteyi 2,21 kat arttırdığı saptandı. Cinsiyet,yaş ve nötrofil/lenfosit oranına göre de değerlendirdiğimizde ÜA’in yüksek olması mortaliteyi 2,09 kat arttırdığı saptandı. Bu; ÜA’in yaştan, cinsiyetten ve nötrofil/lenfosit oranından bağımsız bir mortalite öngörücüsü olduğunu gösterdi.
Benzer şekilde Nötrofil/Lenfosit oranının yüksek olmasının da yaş ve cinsiyetten bağımsız şekilde mortaliteyi 1,05 kat arttırdığı saptandı (Tablo 6).
Tablo 6.Değişken Parametrelerin Multivariate Cox-Regresyon Analizi
DEĞİŞKEN 𝛽 TEHLİKE ORANI
(HAZARD ORANI) P ÜA’in YÜKSEK OLMASI 0,739 2,093 <0,001 ERKEK CİNSİYET 1,879 <0,001 TANI YAŞI 0,017 1,017 0,010 NÖTROFİL/LENFOSİT ORANI 0,58 1,059 <0,001
35 4.TARTIŞMA
Kanser günümüzün önde gelen mortalite nedenlerinden biridir.
Birçok kanser için kabul edilen mortalite ve sürvi öngörücüleri hem tedavi hem de takip açısından çok büyük bir öneme sahiptir.Bu yüzden kanser tedavisinde izlenebilecek farklı metodlar için yeni parametreler bulmak kaçınılmazdır.
1982 yılında ÜA’in insanlardaki yüksek seviyeleri, lipid peroksidasyonunu inhibe etmesi ve serbest O2 radikallerini temizlemesine dayanılarak kansere karşı primer defans sağladığı hipotezi ortaya atılmıştır (180). Bununla birlikte özellikle monosodyum üratın kadın ve erkeklerde artan kanser ölümleriyle kuvvetli bir istatiksel ilişkisi olduğu gösterilmiştir (181-183).
Geçen zamanla birlikte ÜA’in gerek hücre içi ve dışına transportundan sorumlu proteinlerin bulunması, gerekse diğer moleküler etkileşimlerinin ortaya konmasından sonra başta kanser ve kardiyovasküler hastalıklar olmak üzere hastalıklarla arasındaki ilişki sorgulanmaya başlanmıştır.Dahası yeni keşfedilen ve gen üzerinden (p53) hücre içi etkileşimleri (166, 167) ÜA’i araştırmalar için daha ilgi çekici hale getirmiştir.
ÜA’in kanserle arasındaki ilişkiyi açıklamak için yapılan çalışmalar sonucu ortaya birçok sonuç ve hipotez çıkmıştır.
ÜA’in hem pro-oksidan hem de anti-oksidan olarak davrandığı ve bunu özellikle SOR üzerinden mekanizmalarla yaptığı kanıtlanmıştır(20,21,22). Ayrıca ÜA’in Adiponektin ve Leptin gibi proteinler üzerinden sinyal yolakları aracılığıyla kansere yol açtığı veya kötü diferansiasyona neden olduğu bulunmuştur(130,154).
DM,Obezite ve Metabolik Sendrom gibi kronik inflamasyonla ve yüksek ÜA değerleriyle birlikte olan hastalıklarda özellikle meme kanseri başta olmak üzere (97-102) birçok kanser riski arttırdığı ve kötü prognoza yol açtığı bulunmuştur.Bu etkisini inflamatuar mediatörlerin ekspresyonunu indükleyerek oksidatif stres üzerinden yaptığı düşünülmektedir.
36 Çalışmamıza baktığımızda Meme ve Kolon kanserleri’nin sıklığı ülkemizdeki verilerle örtüşmektedir.fakat prostat kanseri oranı düşük, Mide kanseri oranı ise yüksek bulunmuştur.
ÜA’in prognostik değerini araştıran diğer çalışmalara baktığımızda, Tanrıverdi ve arkadaşlarının yaptığı 384 küçük hücre dışı evre 3B/4’lü akciğer CA’lı hastalarda takip süresinin 33 ay (4-46 ay) olduğu bir çalışmada hastalar ÜA değerlerine göre 4 gruba ayrılmış (1. grup: <3,08 mg/dl, 2. grup: 3,09-5,91 mg/dl, 3. grup: 5,92-7,48 mg/dl ve 4. grup: >7,49 mg/dl). Grup 4’teki hastaların birçoğu squamöz hücreli kanser tipinde, tanı anında birçoğunun beyin metastazları olduğu ve sağkalım oranlarının diğer gruplara göre anlamlı olarak daha düşük olduğu saptanmıştır (184). Ayrıca çalışmanın univariate sonuçları incelendiğinde bizim çalışmamızla örtüşecek şekilde WBC ve Hemoglobin değerlerinin prognostik değeri olduğu bulunmuş, çalışmamıza örtüşmeyecek şekilde trombosit değerlerinin de prognostik değeri olduğu bulunmuştur.
Stotz ve arkadaşlarının 466 pankreas duktal adenokarsinomlu hastalar üzerinde yaptığı çalışmada ÜA seviyesi >5,1 mg/dl olan hastaların mortalite oranları cinsiyetten bağımsız olarak yüksek bulunmuştur (185).Bu çalışmada da bizim sonuçlarımızdaki gibi cinsiyetten bağımsız olarak ÜA yüksekliğinin risk faktörü olduğu bulunmuştur.
Chen-Yi Wu ve arkadaşlarının, 65 yaş üstü 77.541 kişinin yaklaşık 3,3 ± 1,3 yıl takip edilerek yapılan çalışmalarında, erkekler için serum ÜA değerleri; 1. grup: <5,4 mg/dl, 2. grup 5,4-6,3 mg/dl, 3. grup 6,4-7,3 mg/dl ve 4. grup >7,3 mg/dl olarak, kadınlar için; 1. grup <4,6 mg/dl, 2. grup 4,6-5,3 mg/dl, 3. grup 5,4-6,3 mg/dl ve 4. grup >6,3 mg/dl olarak katagorize edilmiş. Her iki cinsiyette kardiyovasküler mortalitede 4. grup 1. gruba gore anlamlı olarak yüksek bulunmuş. Dahası erkeklerde 2. grubun kardiyovasküler mortalite riski grup 1’e göre daha düşük bulunmuş. Her ne kadar ÜA ve kardiyovasküler mortaliteyle ilgili bir çalışma olsada düşük ÜA seviyelerinin de mortaliteyi arttırması bakımından bizim yaptığımız çalışmayla benzer sonuçlar ortaya konmuş, bu da ÜA’in belli bir seviyeye kadar anti-oksidan, belli bir seviyeden sonra pro-oksidan gibi davrandığının bir kanıtı olduğunu
37 düşündürmektedir. Ayrıca bu çalışmada yüksek keratin düzeylerinin de bizim çalışmamızda olduğu gibi yüksek mortaliteyle ilişkisi olduğunu göstermiştir(186).
Shin ve arkadaşları’nın son dönem kanser hastaları üzerinde yapılan bir çalışmada toplam 118 hasta ÜA değerlerine gore 4 gruba ayrılmış; 1. Grup: <3,2 mg/Dl, 2.grup: 3,2-4,9 mg/Dl, 3.grup: 4,9-7,2 mg/Dl ve 4.grup: >7,2. Grup 4 deki hastaların sürvilerinin diğer gruplara göre anlamlı olarak kısa olduğu saptanmış. Univariate analizlerine baktığımızda normal referans aralığı dışındaki WBC sayısının,trombosit düşüklüğünün ve keratin yüksekliği olan hastaların sürvilerinin anlamlı olarak düşük olduğu görülmüştür(187).
Sağlıklı popülasyonla karşılaştırılarak yapılan çalışmada Lawal ve arkadaşlarının ağız içi kanserli hastalarla yapılan çalışmalarında.Ağız içi kanseri olan hastaların serum ÜA değerleri normal popülasyona göre daha düşük bulunmuştur (188).
Uzun süreli ve sağlıklı gönüllüler üzerinde yağılan bir çalışmada; Taghizadeh ve arkadaşlarının genel popülasyondan 1823 erkek gönüllü ile yapılan ve 38 yıl süren takipli çalışmasında ÜA değerleri 3 gruba ayrılmıştır (1. grup: <5 mg/dl, 2. grup: 5-5,8 mg/dl ve 3. grup: >5-5,8 mg/dl). 3. grupdaki gönüllülerin kansere bağlı mortalite oranları anlamlı olarak düşük bulunmuştur (189). Bizim sonuçlarımızla çelişkili olup metodsal (sağlıklı gönüllü) ve referans aralığı (çalışmada ki yüksek ÜA değerleri bizim çalışmamızda normal olarak referans alınmıştır) açısından çalışmamızdan farklıdır.
Örnek verilen çalışmalarda da gösterildiği üzere günümüzde elde edilen veriler doğrultusunda yüksek ÜA seviyeleri mortalite ve sağkalım üzerine olumsuz etkisi olduğunu göstermektedir fakat klinik olarak uygulanması için (ÜA düzeylerini düşürmek) bütün mekanizmaların tam olarak aydınlatılması gerekmektedir. ÜA düşüklüğünün prediktif değeri için ise daha fazla çalışılma yapılmasına gerek vardır.
38 Yaptığımız çalışmanın sonucunda ÜA değerlerinin düşük veya yüksek olması yüksek mortalite ile ilişkili bulunmuştur.Bu, bizce ÜA’in hem pro-oksidan hem de anti-oksidan gibi davrandığının bir göstergesidir.
5.SONUÇ VE ÖNERİLER
ÜA ve hemogram değerlerinin onkoloji hastalarında sürvi ve mortalite açısından bir ilişkisinin olup olmamasını saptamak amacıyla yaptığımız çalışmayı şu şekilde özetleyebiliriz:
1) 997 hastayı çalışmamıza dahil ettik. Hastaların 553 (%55)’ü kadın, 444 (%45)’ü erkekdi. 01.08.2015 itibariyle, 628 hastanın(%63) ise yaşadığı saptandı.
2) 428 hastanın ÜA değerlerine (%43), 567 hastanın (%57) ise hemogram, üre ve kreatinin değerlerine ulaşıldı.
3) Ortalama ÜA değerleri tüm hastalar için 4,79 (± 1,82) mg/dl, yaşayan hastaların (260 kişi,%65) 4,57 (± 1,53) mg/dl, ölen hastaların ise (140 kişi,%35) 5,20 (± 2,22) idi.
4) Yaşayan ve ölen 2 grup karşılaştırıldığında; ölen hasta grubunda üre, kreatinin, ÜA, PMNL, Nötrofil%, Monosit%, Nötrofil, Monosit, Nötrofil/Lenfosit oranındaki yüksekliğin ve Hematokrit,Lenfosit ve Lenfosit% sindeki düşüklüğün anlamlı olduğu saptandı.
5) ÜA’i yüksek hastalarla ÜA’i normal ve düşük olan hastalar karşılaştırıldığında; ÜA’i yüksek olan grupta Üre, Kreatinin, ÜA, Eritrosit ve Hematokrit değerlerinin anlamlı olarak yüksek olduğu görüldü.
6) Sağkalım sürelerine bakıldığında en düşük sağkalımın düşük ÜA’i olan grupda olduğu (18,201 ± 1,426) , yüksek grupda (20,571 ± 2,779) olduğu ve en yüksek sağkalımın normal grupta (70,962 ± 10,244) olduğu görüldü.
7) Her 3 grubu karşılaştırdığımızda normal grubun sağkalım sürelerinin düşük gruba göre anlamlı olarak yüksek olduğu (p: 0,030), normal grubun sağkalım sürelerinin yüksek gruba göre anlamlı olarak daha yüksek olduğu bulundu
39 (p:<0,001). Düşük grupla yüksek grup karşılaştırıldığında sağkalım süresi açısından bir anlam olmadığı saptandı.
8) Düşük ve normal ÜA seviyelerine sahip hastaları beraber değerlendirip (1.grup), yüksek ÜA seviyelerine sahip hastalarla karşılaştırdığımızda (2.grup) ilk grupdaki hastaların sağkalım sürelerinin anlamlı olarak daha yüksek olduğu saptandı.
9) Değişken parametreleri değerlendirdiğimizde ÜA (p:0,001), normalden yüksek ÜA değerlerinde, Kreatinin ,Üre , PMNL, Nötrofil, Monosit ,Tanı yaşı, Nötrofil%, Monosit%, Bazofil% ve Nötrofil/Lenfosit oranlarındaki birim artışların; Lenfosit, Lenfosit%, Hemoglobin ve Hematokrit deki birim azalmaların ise mortaliteyi arttırdığı görülmüştür. Bunun yanında erkek cinsiyetin de tek başına mortaliteyi bağımsız olarak arttırdığı saptanmıştır. 10) Yapılan analizlerde ÜA’in yaştan, cinsiyetten ve nötrofil/lenfosit oranından
bağımsız bir mortalite öngörücüsü olduğunu; benzer şekilde Nötrofil/Lenfosit oranının yüksek olması da yaş ve cinsiyetten bağımsız şekilde mortalite öngörücüsü olduğunu gösterdi.