T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA (VET) ANABİLİM DALI
SPORCULARDA PLAZMA BÜYÜME HORMONU VE
TESTESTERON DÜZEYLERİYLE MAKSİMAL AĞIRLIK
ANTRENMANLARI ARASINDAKİ İLİŞKİLER
DOKTORA TEZİ
Nazmi SARITAŞ
Danışman Prof. Dr. Behiç SERPEK
T.C.
SELÇUK ÜNİVERSİTESİ SAĞLIK BİLİMLERİ ENSTİTÜSÜ BİYOKİMYA (VET) ANABİLİM DALI
SABE PROJE NO : 2003/016
SPORCULARDA PLAZMA BÜYÜME HORMONU ve
TESTESTERON DÜZEYLERİYLE MAKSİMAL AĞIRLIK
ANTRENMANLARI ARASINDAKİ İLİŞKİLER
DOKTORA TEZİNazmi SARITAŞ
Bu tez aşağıda isimleri yazılı tez jürisi tarafından 13/09/2006 günü sözlü olarak yapılan tez savunma sınavında oy birliği ile kabul edilmiştir (S.B.E.Yön.Kur.Karar tarih ve No:………..)
İmza
Tez Jürisi : Jüri Başkanı Prof.Dr.Behiç SERPEK (Danışman)
Üye : Prof.Dr.Tevfik TEKELİ
Üye : Prof.Dr.Tevhide SEL
Üye : Doç.Dr.Seyfullah HALİLOĞLU Üye : Doç.Dr.Vahdettin ALTINOK
10. TEŞEKKÜR
Çalışmalara gönüllü katılan Selçuk Üniversitesi Beden Eğitimi ve Spor Yüksekokulu öğrencilerine, analizlerin yapılması aşamasında emeği geçen Doç. Dr. Seyfullah HALİLOĞLU’na, Uzman Avni İLİK’e, Erciyes Üniveristesi Veteriner Fakültesi Biyokimya Anabilim Dalı Başkanı Doç. Dr. Fatma UYANIK ve Yrd. Doç. Dr. Meryem EREN’e yardımlarından dolayı teşekkür ederim.
i İÇİNDEKİLER Sayfa No 1. GİRİŞ...1 2. LİTERATÜR BİLGİ ...2 2.1. Büyüme Hormonu...2
2.1.1. Büyüme hormonunun yapısı...2
2.1.2. Büyüme hormonunun biyosentezi...2
2.1.3. Büyüme hormonunun salınımı...3
2.1.4. Büyüme hormonunun kanda taşınması ...6
2.1.5. Büyüme hormonunun etki mekanizması ...6
2.1.6. İnsulin benzeri büyüme faktörleri ...7
2.1.6.1. İnsulin benzeri büyüme faktörü-1 ...8
2.1.6.2. İnsulin benzeri büyüme faktörü-2 ...9
2.1.7. İnsulin benzeri büyüme faktörünü bağlayan proteinler...10
2.1.7.1. İnsulin benzeri büyüme faktörünü bağlayan protein-1...10
2.1.7.2. İnsulin benzeri büyüme faktörünü bağlayan protein-2...10
2.1.7.3. İnsulin benzeri büyüme faktörünü bağlayan protein-3...11
2.1.7.4. İnsulin benzeri büyüme faktörünü bağlayan protein-4...11
2.1.7.5. İnsulin benzeri büyüme faktörünü bağlayan protein-5...11
2.1.7.6. İnsulin benzeri büyüme faktörünü bağlayan protein-6...11
2.1.8. Büyüme hormonunun biyolojik etkileri ...12
2.1.9. Büyüme hormonu yetersizliği...13
2.1.10. Büyüme hormonu fazlalığı ...14
2.1.11. Büyüme hormonu ve spor...14
2.1.12. Büyüme hormonunun illegal kullanımı...16
ii
2.2. Testesteron...17
2.2.1.Testesteron hormonun yapısı ...18
2.2.2. Testesteron hormonunun biyosentezi...20
2.2.3. Testesteron hormonunun salınımı ...22
2.2.4. Testesteron hormonunun kanda taşınması...23
2.2.5. Testesteron hormonunun etki mekanizması ...23
2.2.6. Testesteron hormonunun biyolojik etkileri...23
2.2.6. Testesteron hormonu ve spor...26
2.2.7. Testesteron hormonunun illegal kullanımı ...28
3. MATERYAL ve METOT ...31
3.1. Çalışma Gruplarının Oluşturulması ...31
3.2. Deneklerin Fiziksel Özellikleri...32
3.3. Uygulanan Ağırlık Çalışması ...33
3.4. Kan Örneklerinin Toplanması ...33
3.5. Kan Analizleri...33
3.5.1. Büyüme hormonu analizleri ...33
3.5.1.1. İnsan plazma büyüme hormonu analizi ...33
3.5.1.2. Metodun prensibi ...34
3.5.1.3. Biyotinil hGH tracer’in hazırlanması ...34
3.5.1.4. hGH anti serumu ...35
3.5.1.5. Standartların hazırlanması ...35
3.5.1.6. Keçi IgG-anti tavşan IgG...35
3.5.2. Enzimimmünoassay prosedürü ...35
3.5.2.1. Enzimimmünoassay plaklarının ilk kaplaması ...35
3.5.2.2. Enzimimmünoassay plaklarının ikinci kaplaması...35
3.5.2.3. Enzimimmünoassay plaklarının assay öncesi yıkanması ...36
3.5.2.4. Assay protokolü ...36
3.5.2.5. Substrat reaksiyonu ...37
3.5.3. Testesteron düzeylerinin ölçümü ...37
Sayfa No 3.5.3.1. İnsan plazma testesteron analizi...37
iii
3.5.3.4. Keçi IgG-anti tavşan IgG...37
3.5.4. Enzim İmmünoassay prosedürü ...38
3.5.4.1. Enzimimmünoassay plaklarının ilk kaplaması ...38
3.5.4.2. Enzimimmünoassay plaklarının ikinci kaplaması...38
3.5.4.3. Plazmadan testesteronun ekstraksiyonu ...38
3.5.4.4. Enzimimmünoassay plaklarının assay öncesi yıkanması ...38
3.5.4.5. Assay protokolü ...38
3.5.4.6. Substrat reaksiyonu ...39
3.6. Verilerin Değerlendirilmesi...39
4. BULGULAR...40
4.1. Plazma Büyüme Hormonu Düzeyleri ...40
4.2. Kontrol ve Deneme Gruplarında Plazma Testesteron Düzeyleri...43
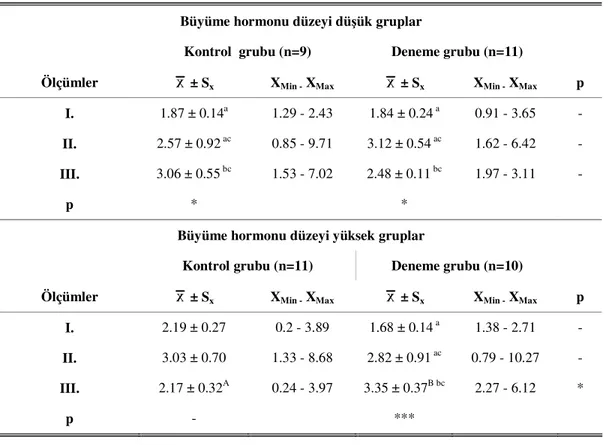
4.3. Büyüme Hormon Düzeyleri Düşük ve Yüksek Deneme Gruplarında Ağırlık Hareketleri ...46 5. TARTIŞMA VE SONUÇ ...55 6. ÖZET...62 7. SUMMARY...64 8. KAYNAKLAR ...66 9. ÖZGEÇMİŞ ...83 10. TEŞEKKÜR ...84 TABLO LİSTESİ Sayfa no Tablo 3.1. Büyüme hormonu düzeylerine göre çalışma gruplarının oluşturulması... 31
iv
Tablo 3.2. Kontrol ve deneme gruplarında çalışma öncesi belirlenen fiziksel özellikler... 32 Tablo 4.1. Kontrol ve deneme gruplarındaki deneklerin plazma büyüme hormonu
düzeyleri ... 41 Tablo 4.2. Büyüme hormonu düzeyi düşük ve yüksek kontrol ve deneme gruplarının
plazma büyüme hormonu düzeyleri... 42 Tablo 4.3. Kontrol ve deneme gruplarında plazma testesteron düzeyleri ... 44 Tablo 4.4. Kontrol ve deneme gruplarında plazma testesteron düzeylerinin
karşılaştırılması... 45 Tablo 4.5. Büyüme hormon düzeyleri düşük ve yüksek deneme gruplarında benç pres (kg) hareketlerinin karşılaştırılması ... 46 Tablo 4.6. Büyüme hormon düzeyleri düşük ve yüksek deneme gruplarında
squat (kg) hareketinin karşılaştırılması ... 48 Tablo 4.7. Büyüme hormon düzeyleri düşük ve yüksek deneme gruplarında
bele çekme (kg) hareketinin karşılaştırılması... 49 Tablo 4.8. Büyüme hormon düzeyleri düşük ve yüksek deneme gruplarında
kol bükme (kg) hareketinin karşılaştırılması... 50 Tablo 4.9. Büyüme hormon düzeyleri düşük ve yüksek deneme gruplarında
omuz pres (kg) hareketinin karşılaştırılması ... 51 Tablo 4.10. Büyüme hormon düzeyleri düşük deneme grubunda GH, testesteron
düzeyleri ve ağırlık arasındaki ilişkileri... 53 Tablo 4.11. Büyüme hormon düzeyleri yüksek deneme grubunda GH, testesteron
düzeyleri ve ağırlık arasındaki ilişkileri... 54
ŞEKİL VE GRAFİK LİSTESİ
Şekil 2.1. Testesteron biyosentezi ... 21 Grafik 4.1. Kontrol ve deneme gruplarındaki deneklerin plazma büyüme
v
Grafik 4.3. Büyüme hormonu düzeyi düşük kontrol ve deneme gruplarının plazma büyüme hormonu düzeyleri (ng/ml) ... 43 Grafik 4.4. Kontrol ve deneme gruplarında plazma testesteron düzeyleri ... 44 Grafik 4.5. Kontrol gruplarının plazma testesteron düzeylerinin karşılaştırılması ... 45 Grafik 4.6. Deneme gruplarının plazma testesteron düzeylerinin karşılaştırılması .... 46 Grafik 4.7. Büyüme hormon düzeyleri düşük ve yüksek deneme gruplarında
benç pres (kg) hareketlerinin karşılaştırılması ... 47 Grafik 4.8. Büyüme hormon düzeyleri düşük ve yüksek deneme gruplarında
squat (kg) hareketinin karşılaştırılması ... 48 Grafik 4.9. Büyüme hormon düzeyleri düşük ve yüksek deneme gruplarında
bele çekme (kg) hareketinin karşılaştırılması... 49 Grafik 4.10. Büyüme hormon düzeyleri düşük ve yüksek deneme gruplarında
kol bükme (kg) hareketinin karşılaştırılması... 50 Grafik 4.11. Büyüme hormon düzeyleri düşük ve yüksek deneme gruplarında
1. GİRİŞ
Büyüme hormonu (growth hormon, GH) hipofiz ön lobunda sentezlenen, büyümenin uyarılmasını ve büyüme için gerekli olan maddelerin özellikle de amino asitlerin protein sentezi için hazır tutulmasını sağlayan bir hormondur. Protein anabolizan etkili olarak tanımlanan bu hormonun etkisinin tam olarak oluşabilmesi ancak testesteron varlığında gerçekleşebilmektedir.
Testislerden salınan androjenler içerisinde en önemli öğeyi oluşturan steroid yapıdaki testesteron, erkeklerde sakalların çıkması, adem elmasının gelişmesi ve sesin kalınlaşması gibi ikincil erkeklik belirtilerinin ortaya çıkmasını sağlamasının yanı sıra kas kitlesinin artışını stimüle edici, bir başka deyişle çok güçlü bir anabolizan etkiye sahiptir. Bu etkisi nedeniyle testesteron güce dayalı spor dallarında doping amacıyla illegal olarak çok sık kullanım alanı bulabilmektedir. Ancak, doping amacıyla testesteron kullanımının kolayca belirlenebilmesi, sporcuları aynı amaçla kullanabilecekleri ve saptanması daha güç maddelere yöneltmektedir.
Son yıllarda rekombinant teknolojisi ile kolayca üretilebilen GH doping amacıyla kullanılan maddelerden birisidir. Bazı spor dallarında GH salınımının ve buna bağlı olarak kas kitlesinin gelişiminin antrenman ve egzersizlerle artırılabildiğinin ortaya çıkarılması, bu hormonunun sporcuların gelişimindeki önemini ortaya koymuştur. Ancak büyüme hormonu fiyatının diğer anabolizanlara göre çok yüksek olması nedeniyle bu hormonun doping amacıyla kullanımı bazı spor dalları ile sınırlı kalmıştır.
Ülkemizde son yıllarda yoğun ilgi duyulan bir spor dalı olan halter gibi güç gerektiren spor dallarında antrenmanların büyüme hormonu ve testesteron düzeylerine etkilerinin bilinmesinin sporcuların çalışmalarının yönlendirilmesi açısından önemli olabileceği düşünülmüş ve Selçuk Üniversitesi Beden Eğitimi ve Spor Yüksekokulu öğrencilerinde normal uygulamalı derslerin yanı sıra özel ağırlık antrenmanlarının büyüme hormonu ve testesteron düzeylerine etkilerinin ortaya konulması amaçlanmıştır.
2. LİTERATÜR BİLGİ
2.1. Büyüme Hormonu
2.1.1. Büyüme hormonunun yapısı
Basit bir protein yapısında olan büyüme hormonu (GH), protein zinciri içinde yer alan sistein amino asitleri arasıda kurulan iki disülfit köprüsüyle belirli bir üçüncül yapıya kavuşan ve hemen tüm canlı türleri için önemli olan türe spesifik bir hormondur (Serpek ve ark 1995, Kopchick ve ark 2002, Bhogavan 2002).
Kanda GH’ un temelde iki ayrı formunun bulunduğu saptanmıştır. Bu formlardan birisi hipofizer GH iken, diğeri sadece gebe kadınlarda varlığı saptanan plasental GH’ dır (De Palo ve ark 2001). Büyüme hormonu hipofizer kökenli somatotrop hücrelerden salgılanan, % 75'i 191 amino asitli, 22 kDa molekül ağırlığında; % 15’nin ise 176 amino asitli, 20 kDa molekül ağırlığındaki formu oluştururken, kalan % 10’luk kısmının ise büyüme hormonu dimerleri gibi diğer büyüme hormonu formlarından meydana geldiği, büyüme hormonunun kolaylıkla dimerleştiği ve dimerlerinin yarılanma ömürlerinin daha uzun olduğu bildirilmiştir (Darcan ve Mir 1998, De Palo ve ark 2001).
2.1.2. Büyüme hormonunun biyosentezi
Büyüme hormonunun biyosentezi ve salınımı hipotalamusun kontrolü altındadır. Hipotalamustan salınan peptit yapısındaki büyüme hormonu salgılatıcı hormon (growth hormon releasing hormon, GHRH, GRF) sinir damar ağı aracılığıyla hipofize ulaştığında adenil siklaz sistemi üzerinden hipofizin somatotrop hücrelerinden büyüme hormonu biyosentezi uyarılırken, GHRH fazını izleyen hipotalamus kökenli somatostatin (Büyüme hormonu releasing-inhibiting hormon, SRIF) salınımıyla da GH biyosentezi durdurulur (De Palo ve ark 2001, Kopchick ve ark 2002). Büyüme hormonunun biyosentez ve salınımını uyaran GHRH ile durduran SRIF arasında bir denge bulunur (Bhogavan 2002).
İnsan hipofiz ön lobunun hücrelerinin yaklaşık % 50’si büyüme hormonu sentezleyen somatotrop hücrelerden oluşur. Kadınlarda büyüme hormonu konsantrasyonu erkeklere göre üç kat fazla olduğu (Müller ve ark 1999), erkeklerde günlük büyüme hormonu üretiminin 0,4-1 mg kadarken, kadınlarda üretilen ve depolanan toplam hormon miktarının 5-10 mg dolayında olduğu bildirilmiştir (Kurdak 1996). İnsanlarda GH’un yarılanma ömrü 20-25 dakikadır (Baumann ve ark 1987). Yaşın ilerlemesiyle azalmaya başlayan büyüme hormonu sentezi (Corpas ve ark 1993) 30’lu yaşlarda % 15 düzeylerinde gerilerken, bu gerileme 60’lı yaşlarda % 75 düzeylerine ulaşmaktadır (Janssen ve ark 1998).
Yaşın ilerlemesiyle GH’nun yanı sıra lütenize edici hormon (LH), folükül stimüle edici hormon (FSH), tiroid stimüle edici hormon (TSH) (Perry 1999) ve gonadal steroidlerin (Huang ve ark 2005) serum konsantrasyonları da gerilemektedir. Büyüme hormonunun azalmasına bağlı olarak vücut yağında artma, kas ve kemik kitlesinde azalma meydana gelmektedir. Yaşlılarda büyüme hormonu tedavisi görenlerde kas kitlesinde ve yağsız vücut kitlesinde atış, vücut yağında azalmalar meydana gelmiş ancak büyüme hormonunun tedavi edici özelliği yanı sıra zararlı yan etkilerinin de olabileceği bildirilmiştir (Huang ve ark 2005).
2.1.3. Büyüme hormonunun salınımı
Hipofiz ön lobunun somatotrop hücrelerinde üretilen büyüme hormonu hücrelerdeki sekret granülalarında depolanır ve salınım için uyarılar hipofiz ön lobuna ulaştığında kan dolaşımına verilir (Le Roith 1997, Kalaycıoğlu ve ark 2000, Bhogavan 2002).
İnsanlarda büyüme hormonu salınımı pulsatildir ve en düşük plazma konsantrasyonu sabahın erken saatlerinde görülmektedir. Yemeklerden 2-4 saat sonra plazma düzeylerinde biraz artışlar meydana gelebilir. Büyüme hormonunun salınımı gece uykusunda en yüksek düzeye ulaşmaktadır (Baumann ve ark 1987). İnsanlarda bazal büyüme hormonu düzeyleri 0.5-3 ng/ml kadardır. Hipotalamustan salınan GHRH’un hipofize ulaşması ile gerçekleşen salınım sırasında yükselen kan düzeyleri 3-5 saatlik bir periyot içerisinde tekrar bazal düzeylere geriler (Janssen ve ark 1998).
Sürekli GHRH etkisinde kalan hipofizden GH salınımı zayıf iken, SRIF etkisinden sonra gelen GHRH uyarımları sonrasında çok daha güçlü bir GH salınımı gözlenmektedir (Müller ve ark 1999). Ayrıca büyüme hormonu salınımı başta stres olmak üzere beslenme şekli, kan büyüme hormonu düzeyleri, kan insülin benzeri büyüme faktörü-1 (IGF-1) düzeyleri gibi bir çok faktör tarafından stimüle ya da inhibe edilebilir (Müller ve ark 1999). Açlık ve strese bağlı olarak büyüme hormonu salınımı artar. Endojen büyüme hormonu salınımının iki günlük açlıktan sonra gençlerde normal düzeylerine göre beş kat arttığı bildirilmiştir (Norrelund 2005).
Karbonhidrat, protein ve yağ gibi besinlerle beslenme GH salınımını etkiler (Farrel ve Barboriak 1981). Yağlı besin tüketilmesi sağlıklı bireylerde GH salınımını düşürür (Farrel ve Barboriak 1981, Alp ve Molvalılar 1987). Büyüme hormonu yağ dokusu hücrelerinde trigliseritlerin yıkılımını artırarak, yağların serbest yağ asitleri halinde kana geçmelerine ve enerji kaynağı olarak kullanılmalarını sağlar. Böylece deri altı yağ dokusu azalırken, kan serbest yağ asiti düzeyleri artar (Sarma ve ark 1999, Yılmaz 1999). Fizyolojik GH yükselmeleri yüksek yağ asidi seviyeleri ile baskılanır (Alp ve Molvalılar 1987).Proteinli beslenme veya intravenöz amino asit (örneğin, arginin) infüzyonunun GH salınımında artışa neden olduğu bildirilmektedir (Farrel ve Barboriak 1981). Diğer yandan Gökdemir ve Palaoğlu (2002) proteince zengin besinlerin tüketiminin büyüme hormonu salınımını azaltabileceğini vurgulamışlardır.
Seksüel steroidler GH sekresyonunun önemli modülatörüdürler. Günlük GH sekresyonu serumdaki testesteron ve östrojen düzeylerine bağlıdır. Toplam GH sekresyonu ile testesteron sekresyonu arasında pozitif bir korelasyon bulunur. Testesteron GH piklerinin yüksekliğini etkilerken, GH frekans sıklığını etkilemez. Testesterona bağlı olarak GH düzeyinde meydana gelen yükselmenin doğrudan testesteronun kendisinden değil bilakis, testesteronun aromatizasyonun sonucu oluşan östradiolden ileri geldiği bildirilmiştir (Müller ve ark 1999). Östrojen ile GH arasında pozitif korelasyon bulunduğu (Li ve Zeng 1990), östrojen verilmesinin GH düzeyini artırdığı bildirilmiştir (Friend ve ark 1996).
Son yıllarda tanımlanmış olan ghrelin hormonu ile büyüme hormonu arasında yakın ilişki olduğu bildirilmektedir. Yiş ve ark (2005) bildirdiğine göre ghrelin, ilk kez 1999 yılında Kojima ve arkadaşları tarafından farelerin midesinden izole edilmiştir.. Ghrelin
midenin oksintik mukozasında yer alan endokrin fonksiyonlara sahip X/A hücreleri tarafından üretilmekte ve 28 amino asit içermektedir. Daha az miktarda bağırsak, böbrek, hipofiz bezi, plasenta ve hipotalamus tarafından da üretilip dolaşıma verilmektedir. Enerji homeostazisi üzerine etkileri, üretim yerinden bağımsız olup merkezi sinir sisteminde hipotalamus düzeyinde ortaya çıkmaktadır. Ghrelin, ya hipofiz ön lobunu etkileyerek doğrudan ya da GHRH salınımını artırarak dolaylı yoldan GH salınımını uyarmaktadır (Anderson ve ark 2004). Ghrelinin büyüme hormonu salgılatıcı etkileri hem in vitro olarak hem de gönüllüler üzerinde yapılan çalışmalarla gösterilmiştir (Wren ve ark 2000, Tolle ve ark 2001). İnsanlara sentetik ghrelin verilmesi sonrasında büyüme hormonu düzeylerinin 30. dakikada tepe noktasına ulaşırken, 180. dakikada da tekrar normal düzeylerine gerilediği bildirilmiştir (Takaya ve ark 2000). Yiş ve ark (2005) bildirdiğine göre, büyüme hormonu salgılatıcı hormon ghrelinin büyüme hormonu üzerine etkisini gösterebilmesi için GHRH salınımı gereklidir. Ghrelin ve GHRH’un birlikte verilmesi sinerjistik olarak büyüme hormonu salınımını arttırmakta, GHRH anti serumu ile beraber ghrelin verildiğinde ise büyüme hormonu düzeylerinde artış gözlenmemektedir. Beyinde hipotalamik nukleusta, hipokampusta, substansia nigrada, ventral segmental bölgede, dorsal ve median rafe çekirdeğinde ghrelin reseptörleri bulunmaktadır (De Ambrogi 2003, Anderson ve ark 2004, Yiş ve ark 2005).
Wren ve ark (2001) tarafından yürütülen bir çalışmada yaşları 21-32 arasında değişen dokuz sağlıklı bireye verilen ghrelin infüzyonunun arttırılması ile büyüme hormonu salınımının da doza bağımlı olarak arttığı gözlenmiştir. Serum fizyolojik infüzyonu yapılan kontrol grubuna göre ghrelin infüzyonu yapılan grupta enerji alımı % 28 oranında artmıştır. Ghrelin infüzyonu yapılan bireylerde kalori alımı kontrol grubuna göre % 9-40 oranında artmıştır. Karbonhidrat, yağ ve proteinden alınan kalori dağılımında ise fark saptanmamıştır. Ayrıca bu bireylerde, günün ilerleyen saatlerinde kompansatuvar olarak kalori alımında azalma gözlenmemiştir.
Ghrelinin, büyüme hormonu ve insülin hattındaki rolü değerlendirildiğinde sadece insülin benzeri büyüme faktörü-1 (IGF-1) ile ghrelin arasında pozitif bir ilişki bulunmuştur (Soriano-Guillen ve ark 2004). Ayrıca ghrelin düzeyleri gibi IGF-1 düzeyleri de erişkin döneme yaklaştıkça azalmakta, büyüme hormonundan bağımsız olarak beslenme durumdan etkilenmektedir (Baker ve ark 1993, LeRoith 1997).
Whatmore ve ark (2003)’nın, 121 sağlıklı çocukta yaptıkları bir çalışmada ghrelin düzeylerinin yaşın ilerlemesiyle azaldığı bulunmuş, ghrelin ile vücut kitle indeksi arasında negatif ilişki bulunmuş ancak, ghrelin ile boy uzaması arasında ilişki saptanamamıştır. Ghrelin için en önemli belirleyicilerin IGF-1 ve insülin benzeri büyüme faktörü bağlayıcı protein-1 (IGFBP-1) olduğu da belirlenmiştir..
2.1.4. Büyüme hormonunun kanda taşınması
Büyüme hormonu kan yoluna verildikten sonra büyüme hormonu bağlayıcı proteine (GHBP) bağlanarak, daha büyük bir moleküler yapıya kavuşur ve bu formda kanda taşınır. Büyüme hormonunun molekül ağırlığı 22.000 dolayında olduğundan kanda serbest halde bulunan GH süratle böbrekler üzerinden kaybedilebilir (De Palo ve ark 1996). Büyüme hormonu bağlayıcı proteinin iki önemli fonksiyonu bulunduğu ve bu fonksiyonlardan ilkini büyüme hormonunun kanda taşınması sırasında aktivite kaybının önlenmesi, ikinci ve daha önemli fonksiyonun ise oluşan büyük moleküler yapı sayesinde böbreklerden büyüme hormonu kaybının önüne geçilmesinin oluşturduğu sanılmaktadır (Leung ve ark 1987, De Palo ve ark 1996, Mullis ve ark 1997, Turyn ve ark 1997).
Büyüme hormonu bağlayıcı proteine bağlı iken, inaktif formda bulunan GH, hedef organ ve dokuların hücrelerine ulaştığında GHBP’den ayrılarak aktif formuna kavuşur, kendine özgü reseptörlerine bağlanarak aktivitesini gösterir (Leung ve ark 1987, Mullis ve ark 1997, Turyn ve ark 1997).
2.1.5. Büyüme hormonunun etki mekanizması
Büyüme hormonu, 250 amino asitten oluşan ekstrasellüler ve 350 amino asitten oluşan intrasellüler bölgeye sahip olan 638 amino asitin oluşturduğu reseptörüne bağlanıp reseptörün dimerleşmesine yol açarak bilginin hücre içine iletilmesini sağlar (Berg ve ark 2002). Peptit hormonlarda hormon-reseptör kompleksinin oluşumu, bir seri reaksiyon zincirinin başlamasına yol açar. Hormon-Reseptör kompleksinin şekillenmesini izleyerek intrasellüler haberciler üzerinden birkaç farklı yoldan hormonal etki ortaya çıkar. Bunlardan biri adenilat siklazın aktive edilmesi ile gelişen yoldur. Hormon-reseptör kompleksi şekillenmesi GTP bağlayıcı proteini aktifleştirir. GTP-bağlayıcı protein de adenilat siklazı aktifleştirir ve ATP'den cAMP oluşumu katalize edilir. cAMP, inaktif protein kinazın aktif protein kinaza dönüşümünü sağlar. Protein kinaz, ikisi regülatör ve
ikisi de katalitik olmak üzere 4 alt üniteden meydana gelir. Enzimin inaktif formunda katalitik ve regülatör üniteler bir arada bulunur. cAMP'nin regülatör ünitelere bağlanıp katalitik ünitelerin serbest hale geçmesini sağlamasıyla enzimin aktif formu şekillenir. Kısaca, serbest haldeki iki katalitik alt üniteye aktif protein kinaz adı verilir. Sonraki aşama aktif protein kinazın, inaktif formdaki fosforilaz kinaz'ı aktif fosforilaz kinaza dönüştürmesidir. Bu aktivasyon defosforile durumdaki inaktif fosforilaz kinazın fosforilasyonu ile gerçekleştirilir. Reaksiyonlar bu aşamada kalmaz ve hormonal etkinin gözleneceği son aşamaya kadar devam eder (Kalaycıoğlu ve ark 2000, Bhogavan 2002).
Büyüme hormonunun etkileri hedef hücrelerdeki GH reseptörleri (GHR) üzerinden hücre içine iletilir. Büyüme hormonu reseptörleri, prolaktin reseptörleri, bazı sitokin reseptörleri, GHBP’in çözünür reseptörleri gibi bir süper reseptör familyasının bir üyesidir (De Palo ve ark 2001, Bhogavan 2002).
Normal büyüme koşullarında büyüme hormonu reseptör (GHR) sayıları dolaşım kanındaki GH ya da GHBP düzeyleriyle doğrudan bağlantılıdır ve reseptör düzeyinde ortaya çıkan ani artışlarda reseptörüne bağlanan GH ya da GHBP düzeyleriyle doğrudan ilişkilidir. Ancak normal hormon etkisinin hücre içine iletilmesi için gereken bu yapısal farklılaşmalar bazı patolojik olgularda da gelişebilir (Eliakim ve ark 1996, Mullis ve ark 1997).
2.1.6. İnsulin benzeri büyüme faktörleri
İnsülin benzeri büyüme faktörleri birçok sistemin hem büyüme hem de metabolik faaliyetlerinde bulunur (Radosavljevic ve ark 2005). İnsülin benzeri büyüme faktörleri (IGF-1 ve IGF-2) dokuların çoğunda üretilmekle birlikte, özellikle karaciğerde üretilmektedirler ve endokrin ve parakrin veya otokrin mekanizma yoluyla hücrelerin proliferasyonunda ve farklılaşmasında rol oynarlar (Binoux 1995).
2.1.6.1. İnsülin benzeri büyüme faktörü-1
İnsülin benzeri büyüme faktörü-1, 70 amino asit içeren, 7500 dalton molekül ağırlığında tek zincirinden oluşan bir polipeptittir. Bu polipeptide, insüline benzer yapısıyla hücre zarlarında bulunan insülin reseptörlerine bağlanabildiğinden, insülin benzeri büyüme faktör-1 (IGF-1) adı verilmiştir. İlk bulunduğu sırada sadece karaciğerde üretildiği sanılan IGF-1’in gerçekte sadece karaciğerde üretilmediği, bilakis karaciğerin yanı sıra yumurtalıklar gibi bir çok perifer dokuda da üretilebildiği ve otokrin ya da parakrin sistem üzerinden etkilerini gösterdiği saptamıştır (Eliakim ve ark 1996).
Kandaki serbest IGF-1, tiroid bezi hormonları ya da steroid hormonlarda olduğu gibi, spesifik bağlanma proteinlerine bağlanmış halde bulunan IGF-1’lerden daha aktiftirler. Ancak kandaki IGF-1’in sadece % 0,5-1 kadarı serbest haldedir ve hedef hücrelerdeki spesifik reseptörlerine bağlanabilir. Büyüme hormonunda olduğu gibi IGF-1 düzeyleri de yaşla birlikte düşmektedir. Fakat IGF-1 düzeyindeki düşmenin doğrudan yaşlanmadan kaynaklanmadığı, yaşla birlikte azalma eğilimine giren GH düzeyine bağımlı olarak meydana geldiği öne sürülmüştür. Kanda IGF-1’in yarılanma ömrü çok kısadır ve sadece birkaç dakika sürmektedir. Halbuki bağlanma proteinlerine bağlanan IGF-1’in yarılanma ömrü birkaç saat sürmektedir ve kandaki düzeyleri doğrudan kan GH düzeylerine bağımlı olarak değişebilmektedir. Keza hayvanın ya da insanın beslenme durumuna göre de kan IGF düzeylerinin değişebildiği de bildirilmektedir (Blum ve ark 1993, Janssen ve ark 1998).
İnselin benzeri büyüme faktörü-1’in üretimi GH tarafından kontrol edilir. Kan yoluna salınan GH temelde karaciğer olan hedef organlarına ulaştıktan sonra, karaciğer hücrelerinin üst yüzeyinde bulunan reseptörlerine bağlanarak etkisi hücre içine iletilir ve IGF-1 üretimi ve salınımı uyarılır. Ancak bu uyarımlar sırasında IGF-1 biyosentezi ve salınımı yanı sıra, IGF-1’i bağlayarak kanda taşıyan, IGFBP üretimi ve salınımı da stimüle edilir. Büyüme hormonunun karaciğerde IGF-1 sentezini stimüle etmesinin en büyük kanıtı olarak kan GH ve IGF-1 düzeyleri arasındaki ilişkiler gösterilmektedir (Blum ve ark 1993, Eliakim ve ark 1996, Janssen ve ark 1998). İnsülin benzeri büyüme faktörü-1’in konsantrasyonunu GH yanı sıra prolaktin, glikokortikoidler ve testesteron etkiler. Yağsız vücut kitlesi ile yaş ve cinsiyet (erkekler>dişiler, genç>yaşlı) serum IGF-1 konsantrasyonunda farklılıklara neden olabilir (Baxter 1995). Ancak IGF-1 biyosentezi üzerinde GH’nın kontrolünün yanı sıra bazı genetik
faktörlerin önemli rol oynayabileceği düşünülmüş ve ikizler üzerinde yürütülen çalışmalarla genetik faktörlerin etkisi ortaya konmuştur (Oscarsson ve ark 1997).
Karaciğer dışı perifer dokularda üretilen IGF-1 endokrin bir etkiye sahip değildir. Bilakis üretildiği hücrelerde (otokrin) ya da komşu hücrelerde (parakrin) bir etkiye sahiptir. Perifer dokularda IGF-1 biyosentezini regüle eden temel faktör GH değildir. Perifer dokulardaki IGF-1 biyosentezi, lökositlerin ve fibroblastların büyüme faktörleri, adrenokortikotropik hormon (ACTH), TSH, FSH ve LH gibi hormonlar tarafından da kontrol edilir (Eliakim ve ark 1996).
Karaciğer ya da perifer dokularda IGF-1 sentezini etkileyen en önemli faktörlerden biri de yaştır. Yaşla birlikte başlayan düşmenin temelde GH düzeylerindeki azalmaya bağlı olduğu ileri sürülmüş ve 30’lu yaşlardan sonra gerilemeye başlayan IGF-1 sentezinin, yaşlılıkta gençlerin değerlerinin % 50’sine kadar düştüğü saptanmıştır. Bu düzeylerin 60-90 yaş gruplarında % 80’lere ulaşan bir gerileme gösterilebileceği de bildirilmektedir (Janssen ve ark 1998).
Kısa süreli açlık hallerinde IGF-1 düzeyleri yükselirken kronik açlık hallerinde GH düzeylerinin düşmesini izleyerek IGF-1 düzeylerinin de düştüğü, eksojen GH uygulamalarının IGF-1 düzeylerini arttırmadığı ve kronik açlık hallerinde gelişen düşmenin karaciğerin hasar görmesinden ileri gelebileceği bildirilmektedir (Oscarsson ve ark 1997). 2.1.6.2. İnsülin benzeri büyüme faktörü-2
İnsülin benzeri büyüme faktörü-2, 67 amino asitten meydana gelen tek zincirli bir polipeptittir. Çoğunlukla karaciğerde üretilen IGF-2, 260.000 molekül ağırlığında, tek bir polipeptit zincirinden oluşan, mannoz-6-fosfat reseptörü ile aynı yapıda olan ya da büyük bir benzerlik gösteren, IGF-1 reseptöründen farklı yapıda bir reseptöre bağlanmaktadır (O’Dell ve Day 2003, Denley ve ark 2005). Embiryonik gelişimde önemli rol oynayan insülin benzeri büyüme faktörü-2, intrauterin yaşamda büyümeden sorumludur ve yaşa bağlı olarak da daha az değişim gösterir (Darcan ve Mir 1998 , Granner 1998).
2.1.7. İnsülin benzeri büyüme faktörünü bağlayıcı proteinler
Karaciğerde insülin benzeri büyüme faktörünü bağlayıcı proteinlerin (IGFBP) biyosentezi GH tarafından kontrol edilmektedir. Bağlayıcı proteinler IGF’lerin biyolojik etkilerinin modülasyonunda etkilidirler. Karaciğerde üretilen IGF-1 serbest olarak kana verilemez, bilakis IGF-1 senteziyle eş zamanlı olarak üretilen IGFBP bağlandıktan sonra kan yoluyla taşınır ve IGF’lerin kanda taşınmasına aracılık etmelerinin yanı sıra IGF-1’in kandaki yarılanma ömrünün uzatılmasını, bir başka deyişle IGF-1’in etkilerinin daha uzun süreli olmasını ve IGF’lerin her zaman biyolojik açıdan aktif halde tutulmasını sağlayan IGFBP’lerin yarılanma ömürlerinin 30-90 dakika olduğu bildirilmiş (Darcan ve Mir 1998, De Palo ve ark 2001) ve 6 farklı formunun varlığı saptanmıştır (De Palo ve ark 2001). 2.1.7.1. İnsülin benzeri büyüme faktörünü bağlayıcı protein-1
Karaciğer ve böbrek gibi organlarda üretilen insülin benzeri büyüme faktörünü bağlayıcı protein-1 (IGFBP-1)’in fizyolojik fonksiyonları hala tam olarak bilinmemesine karşın, IGF-1’in reseptörlerine bağlanmasını inhibe ettiği, bu yoldan IGF-1’in metabolik ve mitojenik etkilerini engellediği bildirilmektedir (Westwood ve ark 1995). Normal bireylerde IGFBP-1 ve IGFBP-2 düzeyleri arasında yakın ilişki bulunması bunların IGF-1 konsantrasyonlarına bağımlı olduklarının göstergesi olarak değerlendirilmektedir (Jorgensen ve ark 1998). İnsülin benzeri büyüme faktörünü bağlayıcı protein-1 düzeylerinin metabolik olaylardan etkilenmesi, IGFBP-1’in, IGF-1’in biyoaktivitesinden sorumlu olduğu kanısını doğurmuştur (Westwood ve ark 1995, De Palo ve ark 2001).
2.1.7.2. İnsülin benzeri büyüme faktörünü bağlayıcı protein-2
İnsülin benzeri büyüme faktörünü bağlayıcı protein-2 (IGFBP-2), kanda IGF-2’yi bağlar ve kan düzeyi oldukça yüksektir. Bağlanma yeteneği IGFBP-1‘den daha güçlüdür. Genelde sinir dokularında üretilen 31 kDa molekül ağırlığına sahip IGFBP-2’nin dolaşım kanındaki düzeyleri ergenlikten sonra yaşla birlikte azalma eğilimindedir, ayrıca erkeklerin düzeyleri bayanlara göre biraz daha yüksektir (Yu ve ark 1999).
2.1.7.3. İnsülin benzeri büyüme faktörünü bağlayıcı protein-3
Dolaşım kanındaki toplam IGFBP’lerin yaklaşık % 95'lik kısmını oluşturan insülin benzeri büyüme faktörünü bağlayıcı protein-3 (IGFBP-3) karaciğerde üretilir ve üretimi GH’ unun kontrolü altındadır. Kan GH düzeylerini etkileyen faktörlerin doğrudan IGFBP-3 düzeylerini de etkilediği gözlenmiştir. Örneğin beslenme yetersizliklerinde, karaciğer bozukluklarında, büyüme hormonu yetersizliklerinde düzeyler azalırken, yüksek GH konsantrasyonlarında ve eksojen GH uygulamalarında düzeylerin yükseldiği saptanmıştır (Johanson ve ark 1996, Janssen ve ark 1998).
Serum IGFBP-3 düzeylerinin yaşa bağlı olarak da değiştiği, ergenlikten sonra düzeylerinin giderek azaldığı gözlenmiştir. Bu proteinin kanda IGF-1’i bağlayarak IGF-1 depo formunu oluşturduğu ve bağladığı IGF-1’i tedricen bırakarak sürekli bir IGF-1 etkisini garanti altına aldığı ileri sürülmektedir. Karaciğerde üretilen ve kana verilen IGF-1’in yaklaşık % 90’ını yapısında bulunan IGFBP-3’ün yarılanma ömrü yaklaşık 30 dakika kadardır (Cuneo ve ark 1995, Holt ve ark 1996, Janssen ve ark 1998).
2.1.7.4. İnsülin benzeri büyüme faktörünü bağlayıcı protein-4
İnsülin benzeri büyüme faktörünü bağlayıcı protein-4 (IGFBP-4) temelde karaciğerde üretilir. İnsülin benzeri büyüme faktörleri tarafından stimüle edilen kemik hücrelerinin proliferasyonunu engeller (Karasik ve ark 2002).
2.1.7.5. İnsülin benzeri büyüme faktörünü bağlayıcı protein-5
Bir çok dokuda yaygın olarak bulunan, ancak kan konsantrasyonları düşük olan insülin benzeri büyüme faktörünü bağlayıcı protein-5’in (IGFBP-5), IGF-1’in otokrin ya da parakrin fonksiyonlarını regüle etmesi olasıdır (Karasik ve ark 2002).
2.1.7.6. İnsulin benzeri büyüme faktörünü bağlayıcı protein-6
İnsülin benzeri büyüme faktörünü bağlayıcı protein-6 (IGFBP-6), IGF-2’ye karşı IGF-1’den daha güçlü bir duyarlılığa sahiptir. Ancak fonksiyonu henüz kesin olarak açıklığa kavuşturulamamıştır. Van Doorn ve ark (1999) dolaşım kanındaki konsantrasyonları farklı koşullar altında incelemişler ve kan konsantrasyonu ile glomerular filtrasyon oranı arasında ters bir ilişkisinin olduğunu, ayrıca orta dereceli bir diurnal
varyasyon (sabah erken–öğleden sonra-akşam) bulunduğunu gözlemişlerdir. Ergenliğe kadar tedricen yükselen, ergenlik döneminden sonra yaşa bağlı olarak düşme eğilimi gösteren dolaşım kanı IGFBP-6 konsantrasyonunun erkeklerde kadınlardan daha yüksek olduğu saptanmıştır (Yu ve ark 1999).
2.1.8. Büyüme hormonunun biyolojik etkileri
Büyüme hormonu organizmanın büyüme ve gelişmesinde önemli rol oynamaktadır. Büyüme hormonunun etkileri belirli hedef organlar üzerindeki hızlı gelişen ancak kısa süreli direkt etkileri ve karaciğerdeki hedef hücrelerinde IGF-1 salınımının uyarılması üzerinden gerekleştirilen, geç gelişen ancak uzun süren endirekt etkileri olmak üzere ikiye ayrılarak incelenebilir (De Palo ve ark 2001, Bhogavan 2002).
Büyüme hormonunun akut metabolik etkileri insülin etkisine benzerlik gösterir. Bu akut etkiler arasında; öncelikle barsaklardan amino asitlerin emilimi ile karaciğer ve kaslarda protein sentezinde kullanılması, yağ ve kas dokusuna glikoz alımının uyarılması, adipoz doku hücreleri olan adipositlerdeki beta-adrenerjik reseptörlerin uyarılması üzerinden lipoliz stimüle edilmesi, immun fonksiyonların uyarılması, kanda amino asit taşınması, preadipositlerin adipositlere dönüşümü ve yağ depolarının parçalanması sonucu açığa çıkan yağ asitlerinin kaslardaki protein biyosentezinde kullanılması, abdominal bölgede toplanan yağların perifere taşınması, hepatik düşük dansiteli lipoprotein (LDL) reseptörlerinin regülasyonu üzerinden kan kolesterol düzeylerinin düşürülmesi, glikoz atılımı ve metabolizmasının stimülasyonu, gonadal IGF-1 üretiminin uyarılması, gonodotropinler üzerinden lüteal progesteron sentezinin uyarılması ve parathormonla birlikte gerçekleştirdiği kemikler üzerindeki etkileri sayılabilir (Samra ve ark 1999, Norrelund ve ark 2002, Moller ve ark 2003).
İnsanlarda, açlık sonucu hormonal ve metabolik süreçlerde önemli değişiklikler meydana gelir. İki-üç haftalık açlıktan sonra vücut proteinlerinin yıkılımının azalmasını izleyerek idrarla azot atılımı da azalır, alanin düzeyleri düşerken, dallanmış karbon zincirine sahip amino asitlerin düzeyleri yükselir. Açlığın ilk gününde idrar azot atılımında ya hiç değişiklik görülmez ya da hafif bir artış görülürken, üç günlük açlıktan sonra vücut proteinlerinin yıkılımı hızlanırken, büyüme hormonunun serum konsantrasyonlarının da artışlar görülmektedir (Norrelund ve ark 2001, Norrelund 2005) .
Büyüme hormonunun geç dönemde gelişen etkileri arasında, karaciğerde ve diğer dokulardaki reseptörlerine bağlandıktan sonra hücre içinde IGF-1 ve IGF-1’in bağlanarak taşınmasına hizmet eden IGFBP'lerin biyosentezinin stimülasyonu yer alır. Üretilen ve kan yoluna verilen IGF-1 kan yolunda serbest olarak bulunmaz, bilakis taşıyıcı proteinlerine bağlanarak inaktif bir formda taşınır. Ayrıca bu formda yaklaşık 7500 molekül ağırlığındaki IGF-1’in böbreklerden kaybı da önlenmiş olur. Büyüme hormonunun endirekt etkileri genelde IGF-1 üzerinden gerçekleştirilir ve büyüme hormonu özellikle karaciğerde IGF-1 sentezini stimüle eder, ancak bu biyosentez pulsatil değildir ve 24 saat aynı düzeyde sürdürülür. IGF-1 aracılığı ile ortaya çıkan endirekt etkileri arasında da kondrojenez, iskeletin büyümesi, protein kitlesinin artışı, ovaryumlarda androjen üretimi gibi etkiler sayılabilir (Rodrigez-Arnao ve ark 1999, Ottoson ve ark 2000, De Palo ve ark 2001).
Son yıllarda rekombinant teknolojisi ile üretilen rekombinant insan büyüme hormonunun (rhGH) insanlarda dwarfizim, kistik fibrozis, lösemi, büyümenin gecikmesi, kronik kalp hastalıkları, yaşlılık gibi pek çok olguda sağaltımda kullanılması , bu hallerdeki büyüme hormonunun etkilerine işaret ederken (Suman ve ark 2003), şiddetli travmalarda ve cerrahi operasyonlarda veya diğer birçok stres faktörleri karşısında büyüme hormonu düzeylerinin yükselmesi, streslerdeki büyüme hormonunun önemini gösterirken, büyüme hormonunun kan şeker düzeylerinin regülasyonuna da katıldığı bildirilmektedir (Johnston ve ark 1996).
Büyüme hormonu ve büyüme hormonu etkisine aracılık eden IGF-1 hücreye amino asit alınımı ve hücreye alınan amino asitlerin protein sentezinde kullanılmasının stimülasyonu üzerinden kaslarda anabolik amino etki gösterirler. Bu olgu büyüme hormonu enjeksiyonuyla kaslarda amino asit alımı ve protein sentezinin, bir başka deyişle kas kitlesinin artışıyla kanıtlanmıştır (Öğe 2004, Woodhouse ve ark 2006).
2.1.9. Büyüme hormonu yetersizliği
Çocukluk çağlarındaki büyüme hormonu yetersizliğinde dwarfizim adı verilen cücelik hali meydana gelir (Johnston ve ark 1996, Suman ve ark 2003). Organlarının boyları birbirlerine karşı oranları değişmeksizin küçülen ve boyutları ancak 8-10 yaşlarındaki bir çocuğun organlarının boyutlarında olan bu tip cüceliklerde çoğunlukla diğer vücut fonksiyonları normaldir ve zekada ya da seksüel aktivitede bir yetersizlik görülmez (Bingöl
Gençlerde oluşan GH yetersizliklerinde kas kitlesinin azalması, kasların zayıflaması, vücut yağlarının artması (adipozitoz), hiperlipidemi, hiperkolesterinemi, hipertrigliseritemi, insülin tarafından indüklenen hipoglisemi, hipertoni (kan basıncının yükselmesi), vücut veriminin düşmesi, mineral içeriğinin azalmasına bağlı olarak kemiklerin yoğunluğunda azalma (omurgalarda ve radius’ta), osteokalsinin serum düzeylerinin düşmesi, omurga kırıkları, sindirim organlarının küçülmesi, albümin sekresyonunun ve protein sentezinin azalması, sellüler immünitenin düşmesi, renal plazma akımının ve glomerular filtrasyon oranının gerilemesi, sperm kalitesinin düşmesi, uykunun bozulması, uyku derinliği ve sürekliliğinin bozulması, yorgunluk-bitkinlik, yaşam kalitesinde düşme ve kardiovasküler bozukluklara bağlı olarak yaşam süresinin azaldığı görülür, ancak tümör oluşumu sıklığı da azalmaktadır. Ergenlik çağındaki gençlerde görülen tüm bu bulgular GH tedavisi ile geriletilebilir ya da tamamen iyileştirilebilir (Kurdak 1996, De Palo ve ark 2001).
2.1.10. Büyüme hormonu fazlalığı
Bir çok organ ve sistemi etkileyen GH karbonhidrat, protein ve lipid metabolizmaları üzerinden büyümeyi etkileyen en önemli hormondur. Genellikle hipofiz tümörlerine bağlı olarak büyüme hormonunun aşırı salınımı sonucu gigantizim veya akromegali meydana gelir (Ayuk ve Sheppard 2006). Tümörler genç yaşlarda gelişirse, sağlıklı bireylere oranla büyüme çok hızlıdır ve tüm vücut organlarındaki büyümeler birbirleriyle uyumludur Boyları 2-2.5 metreye kadar ulaşabilen gençlerin vücutlarında herhangi bir anatomik bozukluk görülmez (Yılmaz 1999, Kalaycıoğlu ve ark 2000).
Hipofiz tümörleri gençlerin aksine, erginlerde ortaya çıkarsa daha çok alın, burun, elmacık kemikleri, eller ve ayaklar gibi organlarda ileri derecede genişleme ve büyümelerle karakterize akromegali ortaya çıkar (Kalaycıoğlu ve ark 2000, Kopchick ve ark 2002, Ayuk ve Sheppard 2006).
2.1.11. Büyüme hormonu ve spor
Güçlü bir anabolizan olan büyüme hormonu vücudun tüm sistemlerini etkiler ve kasların gelişmesinde de önemli bir rolü vardır. Hipofizden GH salınımını uyku, egzersiz, stres gibi faktörlerin yanı sıra çeşitli amino asitler ve ilaç uygulamaları da arttırır (Macintyre 1987, Jenkins 1999). Serum GH düzeyini yaş, cinsiyet, vücut kompozisyonu ve antrenman durumu etkilemektedir. Hayvan deneyleriyle cerrahi olarak oluşturulan artrofi
ve zayıflıklıklarında da, büyüme hormonu enjeksiyonlarının kas hipertrofisi meydana getirdiği gösterilmiştir. Ancak, meydana gelen hipertrofinin kas kuvvetini etkilemediği bildirilmiştir (Macintyre 1987, Jenkins 1999). Egzersizin hemostatik sistemlerin tamamını etkilemesi, egzersizin endokrin sistem üzerindeki etkilerinin de incelenmesine ilgiyi artırmaktadır. Sporcular kas gelişiminin stimülasyonunu özellikle egzersizlerle sağlamaya çalışırlar. Kas gelişimi için bir başka deyişle protein biyosentezi için de yeterli miktarlarda amino asitlerin hazır tutulması zorunludur. Canlı vücudunda protein sentezi ve canlının büyümesi temelde somatotrop hat adı verilen GHRF, GH, IGF gibi hormonlardan oluşan hatta gerçekleştiğinden egzersizin bu hatta yer alan hormonlar üzerindeki etkileri daha da ilgi çekici bir hale gelmiştir (Galbo 1985, Flanagan ve ark 1997).
Triatloncularda 1 saatlik yorucu bisiklet ergometresi testinde, dolaşım kanında GH düzeylerinin yükselmesi, bisiklet sporu yapan sporcularda idrarla atılan GH ve IGF düzeylerinin yükselmesi, egzersizlerin somatotrop hat üzerindeki etkilerinin göstergesi olarak kabul edilmiştir. Ancak, bu etkilerin tam olarak ortaya konulabilmesi için yapılan egzersizlerin tipi, yoğunluğu, süresi ve sporcuların daha önceki antrenman durumları gibi bazı kriterin standardize edilmesinin zorunlu olduğu, ayrıca ön hazırlık evresi geçirmeden egzersizlere başlayan bireylerde gelişen strese bağımlı olarak kan büyüme hormonu düzeyinde ortaya çıkan ileri dereceli salınımlar nedeniyle ön hazırlık evrelerinin gerekli olduğu öne sürülmektedir (Galbo1985, Flanagan ve ark 1997). Doğal olarak bu yöndeki ilk çalışmalar da somatotrop hattın temel üyesi GH üzerinde yürütülmüş, egzersizlerden sonra GH düzeylerinin yükselmesini, idrarla atılan GH miktarının artışının izlediği saptanmıştır. Ancak, bu olgunun doğrudan egzersiz etkisinden köken alamayabileceği de vurgulanmıştır (Flanagan ve ark 1997, De Palo ve ark 1998).
Nguayen ve ark (1998) kan GH, IGF-1 ve IGFBP düzeyleri üzerine egzersiz tipinin de etkili olabileceğini düşünmüşler ve en büyük etkilerin sporcuyu iyice yoracak şekilde yürütülen bisiklet ergometresi antrenmanları sırasında ortaya çıkarken, kayakçılarda ve futbolcularda yaptırılan antrenmanların düzeyleri üzerinde fazla etkili olmadığını bulmuşlardır (Nguayen ve ark 1998). Keza egzersizlerin akut etkileri olarak GH ve GHBP düzeyleri yükselirken, IGF-1 ve IGFBP düzeylerinde akut bir değişim gözlenememiş ve bu etkilerin incelenebilmesi için uzun süreli araştırmaların gerektiği vurgulanmıştır (Zancanato ve ark 1994, Willis ve ark 1997).
Wideman ve ark (1999) egzersizlerin somatotrop hat üzerindeki etkilerinin cinsiyete göre değişimlerini incelemişler ve aerobik egzersiz sırasında maksimal kan GH düzeylerine ulaşılabilmesi için gereken sürenin erkeklerde kadınlardan daha uzun olduğunu (erkeklerde 32 dakika, kadınlarda 24 dakika), ancak erişilen maksimal GH konsantrasyonu yönünden kadınlarla erkekler arasında fark olmadığını saptamışlardır. Uzun süreli egzersizlerin somatotrop hat üzerindeki etkilerini daha detaylı bir şekilde inceleyen Wallace ve ark (1999) kandaki total GH, GHBP, IGF-1, IGFBP-3 düzeyleri artarken, serbest IGF-1 konsantrasyonlarında bir değişim görülmediğini, IGFBP-1 düzeylerinin bireysel değişkenlik gösterdiğini, özellikle tüm parametrelerin egzersizlerden sonra yükseldiğini saptamışlardır.
2.1.12. Büyüme hormonunun illegal kullanımı
Dünya Anti Doping Ajansına (WADA) göre 1989 yılından bu yana yasaklanan maddeler içerisinde peptit hormonlar da bulunmaktadır. Bu hormonların kullanımı doping kontrolünde çok ağır bir problem oluşturmaktadır. Gen teknolojisi ile üretilen protein hormonların amino asit sekansları ve konformasyonları endojen üretilen hormonla aynı olduğundan, bu tür hormonların eksojen kullanımının belirlenmesinde büyük güçlüklerle karşılaşılabilmektedir. Doping amacıyla kullanılan protein hormonların en önemlilerini GH, eritropoetin ve IGF-1 oluşturmaktadır (Fryburg ve ark 1995).
Eksojen GH, karaciğerde IGF ve IGFBP biyosentezinin stimülasyonu üzerinden bir yandan protein biyosentezini aktive ederken, diğer yandan yağ depolarından yağların hidroliziyle serbest yağ asitleri halinde kana verilmesiyle serbest yağ asitlerinin enerji üretiminde kullanımının stimüle ederek, kas gelişiminin hızlandırması, ovaryum ve testis aktivitesinin yükseltilmesi ve yaşlanmanın geciktirilmesini sağladığından, GH ve GH’nın endirekt etkilerine aracılık eden IGF-1’in sporcularda performansın yükselmesi amacıyla kullanımını aktüel hale getirmiştir. Ayrıca diğer doping maddelerinin kullanıldığı hallerde kullanımların saptanması için yöntemlerin geliştirilmiş olmasına karşın, endojen hormonla aynı yapıya sahip olan eksojen protein hormonların vücut sıvılarında birbirlerinden ayrımlanamaması, bu tür hormonların doping amacıyla kullanımında daha çekici hale getirmektedir (Kicman ve ark 1997, Hashimoto ve ark 2000).
Günümüzde GH ve IGF-1, rekombinant teknolojisi ile çok miktarda ve çok daha ucuz bir maliyetle üretilebildiğinden, bunların farklı amaçlarla kullanılmaları cazip hale gelmiş olmakla birlikte dünya şampiyonalarında yarışan atletlerce yüksek dozda kullanmaları ya da spor hekimlerinin aşırı doz uygulamaları sonucu bir çok yan etkiler de ortaya çıkabilmektedir. Örneğin vücut geliştirme sporu yapanlarda ölümlerle karşılaşılabilmektedir. Büyüme hormonu kullanılması hallerinde gelişen en önemli yan etkilerden birisi kasların yanı sıra iç organlarda da büyümelerin görülmesidir. Büyüme hormonu kullanan sporcularda burun ve çenede büyüme, alında şişme ve kulaklarda büyüme görülebilir. Ayrıca iç organların büyümesi, kalp damar hastalıklarının oluşma riskini de artırmaktadır (Kurdak 1996). Keza büyüme hormonun fazla salınımının kalp duvarında bozukluklara yol açtığı bilinmektedir (Bondanelli ve ark 2005). Bir başka önemli tehlike de insan beyninden kazanılan büyüme hormonunun kullanımı ile Creutzfeld-Jacob hastalığının bulaşma riskidir (Croes ve ark 2002).
Büyüme hormonunun doping amacıyla kullanımına verilebilecek en iyi örneği 100 metre engelli koşucusu Alman bayan atlet Birigit Wolf-Homman’ın 1996 Atlanta olimpiyatları öncesi kendisine bilgi verilmeksizin bir somatotropin preparatı ile tedavi edilmesi oluşturmaktadır (Berlin Morgenpost 1997).
2.2. Testesteron
Erkeklerin yapı ve davranışları üzerine etkiyen androjenler isminden erkeklik oluşumunda görev alan tüm hormonlar anlaşılır. Steroid yapıdaki androjenlerden testislerin leydighücrelerinde üretilen testesteronun yanı sıra androsteron ve dehidroizoandrosteron önemlidir. Testislerin sertoli hücrelerinde üretilen protein yapısındaki inhibin ise steroid yapıda olmayan bir başka androjendir (Litwork ve Schmit 2002, Bagatell ve Bremner 2003). Testesteronun temel karbon iskeletini oluşturan siklopentano perhidro fenantren (steran) halkası A, B, C, ile gösterilen üç benzol halkası ile D ile gösterilen siklopentan halkasına sahiptir. Steran halkalarına keto ve alkil grupları ile H atomu eklenerek ya da çift bağların oluşturulmasıyla çeşitli steroid hormonlar sentezlenebilmektedir. Bunlardan birisi de testesterondur (Yılmaz 1999, Yesalis ve ark 2000).
Başlıca üretim yerlerini testislerin oluşturduğu steroid yapıdaki androjenler böbrek üstü bezi kabuğu, ovaryumlar ve plasentada da az miktarda da üretilmektedir Testesteron’un % 95’i testisin leydig (intertisyel) hücrelerinde, % 5’i ise adrenal kortekste sentezlenir. Kadınlarda ise testesteron büyük oranda adrenal kortekste, daha az olmak üzere overlerde ve plasentada sentezlenir. Vücutta testesteron ana kaynağını dolaşımdaki plazma lipoproteinlerinin oluşturduğu (LDL), ancak tüm vücut hücrelerinde de sentezlenebilen kolesterolden sentezlenir (Kraemer ve ark 2001, Zitzmann ve Nieschlag 2001, Sevin ve ark 2005, Gümüşel ve Kandilci 2005).
2.2.1.Testesteronun yapısı
Steroid hormonlar içerisinde yer alan androjenlerden (testesteron ve 5α-dihidrotestesteron) testesteron sistematik ismi 17,β-hidroksi-4-androsten-3-on olarak verilir. Dolaşım kanındaki temel androjen olan testesteron gelişimini tamamlamış testis hacminin yaklaşık % 5’ini oluşturan intertisyel kompartman içinde yerleşik sayıları 500 milyona kadar ulaşan leydig hücrelerinde bir dizi enzimatik reaksiyonla kolesterolden sentezlenir (Sevin ve ark 2005).
İnsan fetal testisinde gebeliğin altıncı haftasında başlayan erken dönem testesteron biyosentezi ve testesteron biyosentezi için leydig hücrelerinin farklılaşması LH’den bağımsızdır (El-Gehani ve ark 1998, O’Shaughnessy ve ark 1998). Testis gelişimi sırasındaki testesteron üretimi hipofiz tarafından üretilen Luteinize edici hormon (LH)’nin etkisi altına girer. Luteinize edici hormonun sentez ve salınımı gonadotropin salgılatıcı hormon (GnRH) aracılığı ile hipotalamusun kontrolü altındadır ve testesteron tarafından bir negatif geri besleme (feedback) mekanizması ile inhibe edilir. Kolesterolden testesteron biyosentezi, birbirini izleyen birkaç aşamada gerçekleştirilir. Bu aşamaların ilkini kolesterolün steroidojenik akut regülatör protein tarafından dış mitokondrium membranından iç mitokondrium membranına transferi ve P450scc enzimi tarafından gerçekleştirilen kolesteroldeki yan zincirin koparılarak pregnenolon’un sentezlenmesidir. Pregnenolon sentezi ile sonuçlanan bu dönüşüm testesteron biyosentezinde hız belirleyici aşamayı oluşturur. İzleyen aşamalarda 3 β-hidroksi steroid dehidrogenaz, 17 α-hidroksilaz, C 17,20-liyaz ve 17 β-hidroksi steroid dehidrogenaz gibi bazı enzimler görev yapar. Kadında da esas androjen testesteron olup adrenal korteks ve korpus luteumda benzer yolla sentezlenir. Testesteron’un öncül maddeleri olan androstenedion ve dehidroepiandrosteron
zayıf androjenlerdir. Tüm yaşam boyunca erkekte salıverilen testesteron miktarı kadındakinden daha fazladır (Bagatell ve Bremner 2003, Sevin ve ark 2005).
Uterusta gelişmekte olan fetusun testisleri ilk trimesterde (gebeliğin altıncı haftasında) erkeğin cinsel farklılaşmasında esas faktör olan testesteron salınımına başlar. Puberte sırasında, 12-17 yaşları arasında erkekte serum testesteron konsantrasyonları kadına göre çok daha fazla artar. Ergenliğin başlarında erkeklerde 5-7 ng/ml düzeyinde bulunan serum testesteron konsantrasyonları, kadınlarda sadece 0.3-0.5 ng/ml kadardır. Erkekte testesteron konsantrasyonunun yüksek olması pubertede erkeği kadından ayıran bilinen bazı özelliklerin gelişmesini sağlar. Yaş ilerledikçe erkekte serum testesteron konsantrasyonu kademeli olarak azalır. Bu azalma erkekte yaşlanma ile ilgili diğer etkilere katkıda bulunur. Erkekte günde yaklaşık 8 mg testesteron üretilir. Testislerde androjenik etkinliği zayıf androstenedion ve dehidroepiandrosteron’un yanı sıra, güçlü bir androjen olan dihidrotestesteronu da düşük miktarlarda sentezlenirken, biyosentez ara ürünlerinden pregnenolon, progesteron ve bunların hidroksillenmiş türevlerinin küçük miktarları kana ulaşabilir. Testesteron plazma proteinlerine bağlanarak taşındığından, kan konsantrasyonları sudaki çözünürlüğünden daha fazladır. Kana verilen testesteron büyük oranda seks hormonu bağlayıcı globüline (SHBG), diğer adıyla testesteron bağlayıcı globüline (TeBG) bağlanarak taşınır. SHBG bir tek androjen bağlanma yeri olan 95 kD’luk dimerik bir glikoproteindir ve testisteki androjen bağlayıcı proteine özdeştir. Seks hormonu bağlayıcı globülin karaciğer tarafından salgılandığından dolaşımdaki düzeyleri seks steroidleri dahil oral yolla alınan ilaçların karaciğerdeki ilk geçişlerinden etkilenir (Bagatell ve Bremner 1996, Griffin ve Wilson 1998).
Dolaşımdaki TeBG konsantrasyonları ve buna bağlı olarak testesteron konsantrasyonları, oral yolla verilen ve yüksek dozda parenteral uygulanan hormonların yaptığı gibi, karaciğerdeki suprafizyolojik hormon konsantrasyonları tarafından karakteristik olarak azaltılır (androjenler, glukokortikoidler) veya artırılır (estrojenler, tiroksin). Aksine, endojen seks steroidleri veya fizyolojik hormon konsantrasyonunu sürdürmek üzere yapılan parenteral ve diğer uygulamalar (transdermal, depo implantlar) TeBG düzeylerini çok az etkilerler. Dolaşımdaki SHBG düzeylerini etkileyen diğer faktörler arasında TeBG düzeylerini yükselten akut veya kronik karaciğer hastalığı ve androjen eksikliği, düşürücü yönde etki eden obezite, protein kaybı ve genetik TeBG
kalan büyük bölümü ise düşük afinite ile albümin, α-1-asit glikoprotein ve transkortin taşıyıcı proteinlere bağlanır, Sadece % 1-2’lik bir bölümü serbest halde bulunur. Serbest hormon hipotezi uyarınca, proteine bağlı olmayan serbest testesteron fraksiyonu, biyolojik yararlanımı daha fazla olan gevşek bağlı fraksiyon ile birlikte en yüksek biyolojik aktiviteyi gösterir. Ancak, serbest ve/veya biyolojik yararlanımı yüksek fraksiyonlar sadece biyoaktiviteyi gösterecekleri yerlere değil, yıkılıma uğrayacakları yerlere daha fazla girerler (Sevin ve ark 2005).
Dolaşımdaki testesteron düzeyleri saatlik veya diurnal (gün içi) değişimler gösterir. Genç erkeklerde gün içi testesteron düzeyi sabahları maksimal düzeye çıkarken, öğleden sonra en düşük düzeye iner. Bu gün içi salgılanma düzeni bazı yaşlı erkeklerde dolaşımdaki TeBG düzeylerinin artması, testesteron salgısının azalması ve/veya nöroendokrin bozukluklar nedeniyle değişikliğe uğrar (Veldhuis 2000).
2.2.2. Testesteronun biyosentezi
Hipofiz’den salgılanan Luteinize edici hormon (LH) ya da insan koryonik gonadotropini (hCG) leydig hücrelerinin proliferasyonunu, farklılaşmasını ve testesteron üretimini düzenler. Plazma LH düzeyleri de pulsatil bir şekilde gün içi ritim gösterir. Leydig hücrelerinde sentezlenen testesteron, seminifer tubüllerin içine ve dolaşıma salgılanır. Dolaşımdaki testesteron feed-back mekanizması üzerinden hipotalamus’dan gonadotropin salgılatıcı hormon’un (GnRH) salgılanma sıklığını azaltır; bir başka deyişle gonadotropinlerin salınımı engellenir (Litwork ve Schmit 2002, Gümüşel ve Kandilci 2005).
Testisteki leydig hücrelerinin özel zar reseptörlerine LH’nun bağlanması testesteron biyosentezinin stimülasyonuna yol açar. Diğer steroid hormon üreten hücrelerde olduğu gibi, leydig hücreleri de çok büyük miktarda endoplazmik retikulum, sayısız yağ damlacığı ve çok sayıda mitokondrium içerirler. Bir protein kinaz üzerinden aktarılan bir etki ile kolesterolün pregnenolona dönüşümü ve bunu izleyerek iki yol üzerinden oluşan androjen sentezi stimüle edilir. Pregnolondan androjenlerin üretimi amacıyla bir C17, 20 lize sayesinde yan zincir koparılır. Enzim 17-α-hidroksi pregnenolon üzerinden dehidroepiandrosteron (DHA) ya da 17-α-hidroksi progesteron üzerinden androstendion oluşturur. Androstendionun 17 keto grubunun redüksiyonu ile de testesteron sentezlenir. Dehidroepiandrosteron (DHA) 5 androstendiole dehidre edilir ve
bunu izleyen dehidrogenaz-izomeraz kompleksinin etkisiyle testesterona dönüştürülür. Böbrek üstü bezinde de hemen hemen benzer bir enzim donanımı bulunduğundan böbrek üstü bezinde de androjenler sentezlenebilir. Böbrek üstü bezi kabuğunda sentezlenen dehidroepiandrosteron sülfatize edilir, plazmaya verilir ve testislere ulaştıktan sonra burada testesteron ön maddesi olarak kullanılır (Löffler ve Petrides 1988, Serpek 2002, Bhogavan 2002) (Şekil 2.1).
Şekil 2.1. Testesteron biyosentezi (Löffler ve Petrides 1988).
Aromataz içeren dokularda testesteron östradiole dönüştürülerek doku içinde etkisini gösterir ya da kan yoluyla hedef organ ve hücrelerine ulaşır. Androjenik steroidlerin aksine östrojenin inaktivasyon yeri karaciğer olduğundan karaciğere transfer olana kadar
testesteronun yaklaşık % 50’si karaciğere alınarak 17 keto steroidlere (etiocholone, androsteron ve epiandrosteron) dönüştürüldükten sonra glukouronitler şeklinde atılır (Kierszenbaum 1994).
Testesteronun bir epimeri epitestesteron (17α-hidroksi testesteron) testislerde üretilir, üretilen epitestesteron miktarı idrarla atılan testesteron miktarına eşittir (testesteron: epitestesteron ~ 1:1) dir. Epitestesteron biyolojik olarak inaktiftir. Fakat bir metabolit değildir. Sadece gonadlar tarafından üretildiğine inanılır. Bu yüzden gonadal steroid markeri olarak kullanılır. Bayanlarda testesteron:epitestesteron oranı 1:1’dir. Üriner testesteron:epitestesteron oranı 1:1 olduğu için sporcular tarafından doping kontrolünde bu oranlar kullanılır (Wilson 1988, Bagatell ve Bremner 1996)
2.2.3. Testesteronun salınımı
Yetişkin bir erkekte 4-12 mg (ortalama 7 mg) günlük testesteron üretilirken, böbrek üstü bezindeki oluşumu 0.2 mg/gün kadardır. Testesteron salınımı ritmik değil, bilakis aralıklarla gerçekleştirilir (Löffler ve Petrides 1988, Serpek 2002).
Erkeklerde puberta ani ve uzun süreli testesteron üretimi ile başlar. Bu olay, henüz tam olarak anlaşılmamış bir dizi hormonal değişikliği başlatırken, hipotalamus ile hipofiz bezinin bu aşamalarda önemli bir rol oynadığı düşünülmektedir. Hipotalamustan salınan GnRH, hipofizer gonadotropinlerden olan FSH ve LH üretimini ve salınımını artırır. Hipofizden kana verilen FSH ve LH testis ve seminifer tüpler üzerine etki ederek, spermatogenez ile testesteron yapımı ve salınımını uyarırlar. Puberta öncesinde günlük 0.25 mg/gün düzeyindeki testesteron üretimi pubertada 11 mg/gün’e kadar yükselir. Belirli bir plazma konsantrasyonuna ulaşıldığında da testesteronun feedback etkisiyle gonadotropinlerin salınımı baskılanır (Yesalis 1993, Griffin ve Wilson 1998).
Serum testesteronun sirkadiyanem ritminin belirlenmesi amacıyla tükürükte yürütülen çalışmalarda testesteronun konsantrasyonun en yüksek sabah, en düşük akşam olduğu gözlenirken (Kraemer ve ark 2001) alınan gıdalarında plazma konsantrasyonlarını etkilediği, fazla yağlı yiyeceklerden sonra total testesteron ve serbest testesteron seviyelerinde önemli düşüşler meydana gelirken (Volek ve ark 2001), bir haftalık bir periyotta yetersiz karbonhidratla beslenmenin düzeyler üzerinde etkili olmadığı saptanmıştır (Volek ve ark 2002).
2.2.4. Testesteronun kanda taşınması
Testesteron plazmada ya TeBG bağlı (% 44) ya serbest testesterona (% 2) ya da esas olarak albümin olmak üzere plazma proteinlerine bağlı (% 54) olarak bulunur. Yetişkin bir erkekteki testesteron bağlı globülinin düzeyi ~ 25 nM, normal testesteron seviyesi ~22nM kadardır ve testesteron bağlayıcı globülin düzeylerindeki azalış dokuların kullanabileceği testesteron düzeylerini artırırken, artış dokuların kullanımına sunulan testesteron düzeylerini azaltmaktadır (Griffin ve Wilson 1998, Bagatell ve Bremner 1996).
2.2.5. Testesteronun etki mekanizması
Androjenlerin etkisinin temel mekanizması transkripsiyon üzerindedir ve kan yoluyla hedef hücreye ulaşan androjenler apolar yapıda molekül olduklarından hücre zarını doğrudan geçerek hedef hücrelerin (testis, iskelet kası, karaciğer gibi) sitoplazmalarında bulunan, steroid reseptörleri süper familyasından, suda çözünen androjen reseptörüne bağlanır ve reseptör-hormon kompleksinde oluşan bir yapısal değişimle bir transkripsiyon faktörü olarak fonksiyon yapması sağlanır. Hormon-reseptör kompleksinin şekillenmesini izleyerek aktive olan reseptör-hormon nükleusa taşınıp, kromatin üzerindeki belirli bir bölgeye bağlanır. Bağlandığı bölgenin seçimi ve etkinin gösterilmesi, spesifik reseptörü ile ilişkilidir. Hayatın değişik safhalarında bir hormonun farklı etkiler ortaya çıkartabilmesi veya farklı hücrelerde farklı etkilere sahip olabilmesinin, hormon-reseptör kompleksinin farklı programlanabilmesinden kaynaklandığı sanılmaktadır (Kalaycıoğlu ve ark 2000, Bhogavan 2002, Gümüşel ve Kandilci 2005).
2.2.6. Testesteronun biyolojik etkileri
Androjen hormonların biyolojik etkileri reprodüktif ve reprodüktif olmayan anabolik etkiler olmak üzere ikiye ayrılabilir (Potteiger ve Stilger 1994). Androjenler, plazma TeBG düzeyini azaltarak dokular tarafından kullanılamayan TeBG’ye bağlı testesteron düzeyinin düşmesiyle sirkülasyondaki testesteronun dokulara geçişini hızlandırırlar. Ayrıca androjenler, hepatik proteinlerden fibrinojen ve transferin sentezini baskılarken, haptoglobin, α-1 antitripsinin ve hepatik trigliserit lipaz sentezini uyarırlar. Anabolik steroidler etkilerini sitozolik androjen reseptörlerine bağlanarak gösterirler. Anabolik steroidlere yanıt olarak nöro endokrin sistemin LH ve FSH salınımını azaltması sonucu leydig ve sertoli hücrelerinin fonksiyonlarının gerilemesini izleyerek gerileyen endojen
testesteron sentezindeki düşme spermatogenezisi de yavaşlatır. Aşırı anabolik steroid uygulamaları, testislerde artrofi ve sperm sayısında azalma ile sonuçlanmaktadır. Oral yolla alınan androjenik steroidlerin çoğu, steroidlerin karaciğerde inaktivasyonunu engelleyen bir 17 α-akil grubu içerirler. Bu tip steroidlerin uzun süreli kullanımı, karaciğer fonksiyon testlerinde bozukluklardan hepatik karsinoma kadar ilerleyebilen bozukluklara yol açar (Muscatelli ve ark 1994, Bagatell ve Bremner 2003).
Hedef dokular 5-α-redüktaz içermiyorsa testesteron doğrudan androjen reseptörlerine bağlanarak testesteron reseptör kompleksini oluşur ve oluşan kompleksin belirli DNA bölgelerine yerleşerek androjene bağımlı genlerin transkripsiyonunu uyarmasıyla androjen yanıtı gelişir. Testesteron karaciğerde modifiye olarak hormonal aktivitede önemli olan 17 β hidroksil grubunun oksidasyonu ile 17 keto türevine, A halkasındaki ∆4 ün doyurulması ile androsteron türevi ve 3 keto grubu indirgenerek 3 α-hidroksilat türevine dönüştürülür. Beş α-redüktaz enzimi içeren hedef dokularda testesteron etkisi testesterondan daha güçlü dihidrotestesterona (DHT) dönüştürülür. DHT’de androjenik bir yanıtı gerçekleştiren androjen reseptörü-androjen yanıt etmeni mekanizması sistemini aktive eder. Androjen görevini tamamladıktan sonra reseptöründen ayrılır, hidroksilat metabolitleri olan 3 α-andrositendiol ya da 3 β androstendiole indirgendikten sonra glukuronik asitle konjuge edilerek renal yoldan atılır (Griffin ve Wilson 1998, Bhogavan 2002).
Testesteronun ve dihidrotestesteronun 17α-hidroksil grubu androjenik aktivite için gereklidir. Testesteron enanthate ve fluoxymsteron’a 17α-hidroksil grubu korunarak A halkasındaki subtutisyon, steroidlerin androjenik gücünü azaltırken anabolik gücünü arttırırlar (Khovidhunkit ve Shoback 1999).
Tüm iskelet kasları, yüksek konsantrasyonda androjen reseptörleri içermelerine karşın, 5-α-redüktaz enzimi içermezler. Androjen reseptör içerikleri yüksek olduğundan insanlarda androjenlere en iyi yanıt verebilen iskelet kasları pektoral ve omuz bölgesindeki kaslardır. Anabolik steroidlerin iskelet kaslarındaki etkinliğini anabolik steroid-reseptör kompleksinin sayısı belirler. Yetişkin erkeklerde, dokuların çoğundaki androjen, reseptörlerine bağlı olduğundan plazma androjen düzeyinin yükseltilmesinin kas gelişimine herhangi bir etkisinin olmadığı bildirilmiştir (Horwîtz 1992, Jameson ve Hollenberg 1993, Bagatell ve Bremner 2003).
Erkeklerin birincil ve ikincil seksüel karakterinin gelişmesini stimüle eden, anabolik etkileri ile karakterize testesteron (Potteiger ve Stilger 1994) ve dihidrotestesteron aynı androjen reseptörleri ile birleşebildiklerinden her ikisi de aynı etkiyi gösterebilmektedirler. Ancak fizyolojik koşullarda dokulardaki 5α-redüktaz enziminin varlığında testesteronun dihidroksitestesterona dönüşebildiğinden, dokularda testesteron aktivitesinin ortaya çıkışı bu enzimce kontrol edilir. Tedavi amacıyla her hangi bir steroid canlı vücuduna verildiğinde anabolik ve androjenik yanıtlarda ortaya çıkacaktır (Wilson 1988, Wilson ve ark 1993, Swain ve ark 1998).
Testesteron, nefronların proksimal tubullerini etkileyerek K+, Na+, Cl-, geri emiliminde, eritropoeziste ve kan hacminin artışında da rol oynar. Sporcularda sentetik androjen uygulaması sonucu ortaya çıkan ağırlık kazancının kan hacminin artışından ileri geldiği bildirilmiştir. Androjenler eritropoetin sentezini artırır. Hemotokrit düzeyini yükseltir, abdominal bölgede yağ depolanmasını ve vücudun üst kısmında yağlanmayı arttırır (Griffin ve Wilson 1998, Bagatell ve Bremner 2003).
Androjenler büyüme hormonu salınımını etkileyerek dolaylı yoldan iskelet gelişimini ve olgunlaşmasını sağlarlar. Ergenlik döneminde androjen düzeylerinde meydana gelen artış GH salınımını uyararak uzun kemiklerin epifizlerinin gelişimini hızlandırır ve boy uzamasını maksimal düzeye çıkarır. Androjenler aynı zamanda ossifikasyon ve kemik kitlesinin artışını da hızlandırırlar (Yesalis 2000).
Testesteron sentezinin yokluğuna hipoganodizm denir. Bu olay buluğ çağından önce görülecek olursa ikincil cinsiyet karakterleri gelişmez ve olay erişkin dönemde görülecek olursa bu karakterlerin çoğu geriler. Birincil hipogonadizm testisi farklı etkileyen olaylara bağlıdır ve testis yetmezliğine neden olurken ikincil hipoganodizm gonadotropinlerin kusurlu salgılanmasına bağlıdır ve testesteron biyosentezinde karşılaşılan en az 5 ayrı kalıtımsal kusurun varlığı da kanıtlanmıştır (Granner 1998).
Androjenler pubertesi gecikmiş erkek çocuklarda büyümeyi uyarmak amacıyla kullanılırlar. Dikkatli kullanıldıklarında çocukların boyları normal erişkinlerin boylarına ulaşır. Ancak uygulanan tedavide aşırıya kaçılırsa, büyümenin aşırı hızlanmasına bağlı olarak kemik epifizleri erken kapandığından normal boylara ulaşılamaz (Sevin ve ark 2005).