T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ PATOLOJİ ANABİLİM DALI
EŞ ZAMANLI HPV YAPILAN SMEAR
ÖRNEKLERİNDE HPV POZİTİFLİĞİNİN
SİTOMORFOLOJİK YANSIMALARI
DR. BERAT SOYLU TIPTA UZMANLIK TEZİ
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ PATOLOJİ ANABİLİM DALI
EŞ ZAMANLI HPV YAPILAN SMEAR
ÖRNEKLERİNDE HPV POZİTİFLİĞİNİN
SİTOMORFOLOJİK YANSIMALARI
DR. BERAT SOYLU TIPTA UZMANLIK TEZİ
TEZ YÖNETİCİSİ Yrd. Doç. Dr. GÜL TÜRKCÜ
ÖNSÖZ
Asistanlık eğitimim süresince yardım ve desteklerini esirgemeyen, bilimsel ve mesleki deneyimleri başta olmak üzere her konuda yol gösterici olan başta tez danışman hocam Yrd. Doç. Dr. Gül TÜRKCÜ’ye, diğer hocalarım Prof. Dr. Hüseyin BÜYÜKBAYRAM, Doç. Dr. Uğur FIRAT, Doç. Dr. Selver ÖZŞENER ÖZEKİNCİ, Yrd. Doç. Dr. Ayşenur KELEŞ, Yrd. Doç. Dr. Ulaş ALABALIK, Yrd. Doç. Dr. İbrahim İBİLOĞLU, Yrd. Doç. Dr. Gülay AYDOĞDU, Yrd. Doç. Dr. Engin Deniz YILMAZ’a,
İstatistiksel değerlendirmede yardımcı olan Yrd. Doç. Dr. Yılmaz PALANCI’ya,
Beraber çalışmaktan ve tanışmaktan mutluluk duyduğum arkadaşlarım Uz. Dr. Gülseren ÖZEL, Uz. Dr.Songül YERLİKAYA KAVAK, Uz. Dr. Yılmaz YILDIZ, Uz. Dr. Yahya AVCI, Uz. Dr. Şeyhmus KAYA, Uz. Dr. Arif HAMİDİ, Arş. Gör. Dr. Mansur ALA, Arş. Gör. Dr. Fatma Şule KUTLAR DURSUN, Dr. Nursel COŞKUNSEL, Arş. Gör. Dr. Gülden YILDIZ, Arş. Gör. Dr. Mustafa NACİR’e,
Çalışmamın moleküler kısmına yardımcı olan arkadaşım biyolog Osman AKAMAN olmak üzere bölümümüzde çalışan tüm arkadaşlarıma,
Bu zorlu süreçte varlığıyla güç bulduğum ve yardımlarını esirgemeyen değerli eşim Hikmet SOYLU’ya
Bugünlere gelmemde büyük katkıları olan, hayatımın her aşamasında sevgisini ve desteğini esirgemeyen anneme, babama, abim Zülküf EVSAN’a ve tüm aileme teşekkürlerimi sunuyorum.
ÖZET
Pap smear taraması servikal epitelde meydana gelen değişiklikleri belirleyerek premalign ve malign lezyonları saptamada önemlidir. Özellikle tarama programlarının iyi olduğu ülkelerde servikal kanser insindansını ve servikal kanser kaynaklı mortaliteyi düşürmede faydalı olduğu bulunmuştur
HPV testi ile kolaylıkla daha yüksek oranda HPV saptanması nedeniyle servikal kanser önlenmesinde primer tarama testi olarak önerilmektedir. Günlük pratikte HPV testi önemi belirsiz atipik skuamöz hücreler (ASCUS) tanısı alan hastalarda ve 30 yaşını geçmiş kadınlarda sitoloji ile kombine olarak kullanılır. Çoğu durumda yalnızca yüksek riskli HPV testleri kullanılır.
HPV enfeksiyonun farklı evrelerinde farklı sitolojik değişiklikler olduğu bilinmektedir. HPV enfeksiyonunun karakteristik hücresi koilositoz olmasına rağmen, diskeratoz ve multinükleasyon gibi değişikliklere de sıklıkla rastlanır. Bu çalışmamızda ASCUS tanısı alan olgularda HPV pozitifliği ve sitolojik değişiklikler arasındaki ilişkiyi ortaya koymayı ve ayrıca bölgemizdeki yüksek riskli HPV enfeksiyonunun sıklığını tespit etmeyi amaçladık.
Çalışmamızda 1500 hasta değerlendirildi. 1500 olgumuzun 151 tanesinde yüksek riskli HPV pozitifliği tespit edilmiştir. Tespit edilen yüksek riskli HPV pozitif olguların 36 tanesinde (%2.4) HPV 16, 14 tanesinde (%0.9) HPV 18, 101 tanesinde (%6.7) ise diğer yüksek riskli HPV subtipleri saptandı. Ayrıca 32 ASCUS tanısı almış ve eş zamanlı yüksek riskli HPV DNA pozitifliği olan (HPV 16 subtipi =2 + Diğer yüksek riskli HPV subtip=3) toplamda 5 hastamızı bu hücresel değişiklikler açısından inceledik. Olgularımızın 3 tanesinde perinükleer halosu olan hücre, 2 tanesinde sitoplazmik kavitasyon, 4 tanesinde multinükleasyon, 4 tanesinde parakeratoz, 1 tanesinde minimal nükleer hiperkromazi saptadık. Minimal nükleer hiperkromazi ASCUS tanılı olgularımızda sadece HPV 16 subtipinde izlenmiştir. HPV DNA subtip tayini yapılamayan durumlarda sitomorfolojik olarak izlenen minimal nükleer hiperkromazi bulgusu HPV 16 subtipini işaret edebileceğini düşündürmüştür. Ancak bu genel yaklaşımı bizim çalışmamızdaki kısıtlı sayıdaki ASCUS tanılı olgularla vermek mümkün değildir. Daha geniş vaka serileriyle yapılacak çalışmalar ile HPV subtiplerindeki sitomorfolojik değişiklikleri daha sağlıklı ortaya konulabileceğini düşünmekteyiz.
ABSTRACT
Pap smear screen is important for the detection of premalignant and malignant lesions by identifying the changes in the cervical epithelium. İt has been found usefull to reduce cervical cancer incidance and mortality related to cervical cancer particularly in countries where screening programs are widely used.
HPV test is recommended as primary screening test for the detection of HPV to prevent cervical cancer due to its high sensivity and specifity. In Daily practice; the HPV test is used in combination with cytology in patients older than 30 years of age and patients with atypical squamous cells of unkonown significance (ASCUS). In most cases, only high risk HPV test is used.
İt is known that different cytological changes ocur at different stages of HPV infection. Although coilositosis is the characteristic sign of HPV infection, changes such as dyskeratosis and multinucleation are also frequently seen. İn our study, we aimed to detect relationship between HPV seropositivity and cytological changes in patients diagnosed as ASCUS and to detect the frequency of high risk HPV infection in our region.
1500 patients were evaluated in our study. We detect high risk HPV seropositivity in 151 patients. HPV 16, HPV 18 and other high risk HPV subtypes were detected respectively 36 (2.4%), 14 (0.9%) and 101 (6.7%) of patients. 5 patients with ASCUS and high risk hpv infection were evaluated. We detected cell with perinuclear halo in 3 of these patients, cytoplasmic cavitation in 2 of them, multinucleation in 4 of them, parakeratosis in 4 of them and minimal nuclear hyperchromasia in 1 of them. Minimal nuclear hyperchromasia was detected only HPV 16 subtype in patients diagnosed as ASCUS. We think that minimal nuclear hyperchromasia finding can suggest HPV 16 subtype in situations which HPV subtype analyses can not be made. But it is not possible to adopt this common approach to all patients due to limited number of our patients. We think that more comprehensive studies must be conducted to detect cytomorphological changes more healthy in HPV subtypes.
SİMGELER VE KISALTMALAR
ALTS: Skuamöz İntraepitelyal Lezyon Triaj Çalışması ASC: Atipik Skuamöz Hücreler
ASC-H: Atipik Skuamöz Hücreler - yüksek dereceli skuamöz intraepitelyal lezyon dışlanamıyor
ASC-US: Önemi Belirsiz Atipik Skuamöz Hücreler CIN: Servikal intraepitelyal Neoplazi
DNA: Deoksiribo Nükleik asit
HIV: Human Immunodeficiency Virus HPV: Human Papilloma Virus
HPV – DNA: Human Papillomavirus DNA
HGSIL: Yüksek Dereceli Skuamöz İntraepitelyal Lezyon LGSIL: Düşük Dereceli Skuamöz İntraepitelyal Lezyon
NILM: İntraepitelyal Lezyon veya Malignite Yönünden Negatif ORF: Open Reading Grame
PAP: Papanicolaou
SCC: Skuamöz Hücreli Karsinom SJC: Skuamokolumnar junction
İçindekiler Tablosu
ÖNSÖZ...i ÖZET...ii ABSTRACT...ii SİMGELER VE KISALTMALAR...iv 1-GİRİŞ ve AMAÇ...1 2.1. Serviks Anatomisi...2 2.2. Serviks Histolojisi...22.3. Serviks Kanseri ve Servikal İntraepitelyal Neoplazi(CIN)...3
2.3.1. Düşük Dereceli Skuamöz İntraepitelyal Lezyon (LGSIL):...4
2.3.2. Yüksek Dereceli Skuamöz İntraepitelyal Lezyon (HGSIL):...4
2.3.3. Serviks Kanseri Ve Öncü Lezyonlar İçin Risk Faktörleri...5
2.4. Human Papilloma Virüs (HPV)...5
2.4.1. HPV’nin Penetrasyon Ve Enfeksiyon Mekanizmaları...8
2.4.2.HPV’nin İndüklediği Hücre Transformasyonu...9
2.4.2.HPV Genomu...9
2.4.3.HPV’nin Konak Hücre Genomu İle Birleşmesi...9
2.4.4.Hücrelerin Neoplastik Transformasyonunda E6 Proteinin Etkisi...10
2.4.5.Hücre Malign Transformasyonunda E7 Proteinin Rolü...11
2.5. PAP Smear...12
2.6. Sıvı Bazlı Sitoloji...13
2.7.PAP Smear ve BETHESDA Sistemi...14
2.7.1. Atipik Skuamöz Hücreler...17
2.7.2.Önemi Belirsiz Atipik Skuamöz Hücreler (ASC-US)...18
2.7.3.Yüksek Grade Skuamöz İntraepitelyal Lezyonu Dışlayamayan Atipik Skuamöz Hücreler (ASC-H)...19
2.7.4 Low Grade Skuamöz İntraepitelyal Lezyonlar (LGSIL...20
2.7.5. Yüksek Grade Skuamöz İntraepitelyal Lezyonlar (HGSIL)...21
3. GEREÇ VE YÖNTEM...23
4. İSTATİKSEL YÖNTEM...26
5. BULGULAR...27
6. TARTIŞMA VE SONUÇ...36
1-GİRİŞ ve AMAÇ
Serviks kanseri kadınlarda görülen tüm kanserlerin %12’sini oluşturmaktadır[1]. Yapılan çalışmalarda Papanicolaou (PAP) smear testinin etkin kullanılmaya başlanmasından sonra serviks kanserinin insidansında ve mortalitesinde kayda değer bir düşüş gözlendiği tespit edilmiştir[2].
Human Papilloma Virüs (HPV) cinsel yolla bulaşan hastalıklardan en yaygın olanlarından biridir. HPV’ye maruz kalan kadınlarda enfeksiyon çoğunlukla kendini sınırlar. Daha az sayıda kadında ise servikal prekanseröz veya kanseröz lezyonlar gelişmeye devam eder[3]. Servikal kanserlerin oluşumunda %70 oranında HPV 16 ve 18 subtiplerin sorumlu olduğu düşünülmektedir[4].
Serviks kanseri tarama yöntemleri, insidans ve mortalite azaltması yönünden etkinliği kanıtlanmış az sayıda tarama yöntemlerinden biridir. Risk altındaki hastaları saptayabilmek amacıyla uygun zaman aralıklarında bu tarama testinin uygulanması büyük önem arz etmektedir. Böylelikle servikal lezyonlar erken yakalanıp uygun şekilde yapılacak tedaviyle insidans ve mortalitede azalma sağlanabilir[5].
Biz bu çalışmamızda, eş zamanlı sıvı bazlı PAP smear ve yüksek riskli HPV testi uygulanan olgularda, önemi belirsiz atipik skuamöz hücreler (ASCUS) tanısı almış ve HPV testi pozitif sonuç veren hastalarda, yüksek riskli HPV’nin sıvı bazlı PAP smeardeki sitomorfolojik değişikliklerini saptamaya çalıştık. Ayrıca bölgemizdeki yüksek riskli HPV prevalansını belirlemeyi amaçladık.
2- GENEL BİLGİLER 2.1. Serviks Anatomisi
Serviks, endoservikal kanal ile vagina ve uterusu birbirine bağlayan, vagina içine doğru yerleşim gösteren, uterusun alt bölümüdür. Serviks iki bölümden oluşmaktadır[6]. Vagina içine çıkıntı yapan kısmı (portio vaginalis) ve vaginal kaf üzerine doğru uzanan kısmı (portio supravaginalis). Portio vaginalis ise ektoserviks ve endoserviksten oluşmaktadır. Endoserviks endoservikal kanal ile ilişkili olan kısımdır. Endoservikal kanal uterus kavitesine internal os ile açılır. Vaginadan görülen kısım ise eksternal osdur[7].
2.2. Serviks Histolojisi
Serviks; kolumnar epitel ile örtülü endoserviks ve çok katlı yassı epitel ile örtülü ekzoserviks olmak üzere iki tip epitel ile örtülüdür[8]. Skuamöz epitel üç tabakaya ayrılır.
1-Bazal/Parabazal hücreler: Bazal hücreler oval, dar sitoplazmalı ve koyu kromatinli hücrelerdir. Parabazal hücreler bazal hücrelerin üstünde orta tabakanın altındadır. Bazal hücrelere göre sitoplazmaları artmış nükleusları daha az yoğun kromatin içerir.
2- Orta Tabaka: İntermedier hücrelerden oluşur. Bu hücreler geniş sitoplazmalı küçük veziküler nükleusludur. Sahip oldukları bol glikojenden dolayı sitoplazmaları şeffaftır.
3- Süperfisyel Tabaka: Süperfisyel hücreler küçük yuvarlak nükleuslu geniş ve şeffaf sitoplazmalı hücrelerdir. Süperfisyel ve intermedier hücrelerin her ikisinde de keratinizasyon izlenebilir, bu da epitelde düz ve tabakalı bir görünüm oluşturur. Postmenapozal kadınlarda ekzoserviks epiteli bazal ve parabazal hücrelerden oluşup sitoplazmik glikojen çok azdır ya da yoktur[9].
Endoserviks, müsin sekresyonu yapan tek sıralı prizmatik epitelle örtülüdür. Nükleusları küçük elonge ve bazal yerleşimli olup sitoplazmaları müsin içermektedir. Endoservikal epitelde silyalı hücreler, subkolumnar rezerv hücreler ve endokrin hücre olmak üzere farklı tipte hücreler mevcuttur[8].
Eksternal os seviyesinde tek katlı prizmatik epitelden skuamöz epitele ani bir değişim olur. Bu değişimin olduğu alana SJC (skuamokolumnar junction) denir. Doğal (orjinal) ekzoserviks epiteli ile endoserviks epitelinin birleştiği nokta orjinal SJC olarak isimlendirilmiştir. İlerleyen yaşlarda skuamöz metaplazi gelişimi ile orijinal SJC endoservikse doğru yer değiştirir, metaplastik hücrelerin kolumnar endoservikal epitel hücreleri ile birleştiği bu yeni noktaya fonksiyonel SJC denir[9].Yeni ve orjinal SJC arasındaki bu skuamöz metaplazi alanına transformasyon zonu denir. Transformasyon zonunun önemi serviksin preinvaziv ve invaziv neoplastik lezyonlarının en sık bu bölgeden gelişmesidir[8, 10].
2.3. Serviks Kanseri ve Servikal İntraepitelyal Neoplazi(CIN)
Serviks kanseri, meme, akciğer ve kolorektal kanserden sonra insidans ve mortalite olarak 4. sırada yer almaktadır. Dünyada her yıl 500.000 yeni serviks kanseri vakası görülmektir. Bu vakaların 250.000’den fazlasında ise hastalar serviks kanseri nedeniyle hayatlarını kaybetmektedir. Serviks kanseri nedeniyle ölümlerin büyük bir çoğunluğu az gelişmiş ülkelerde görülmektedir[1]. Türkiyede ise tüm kanserlerin % 2,7’sini oluşturmaktadır. 25-49 yaş arasındaki kadınlarda meme, tiroid, kolorektal ve over kanserinden sonra en sık görülen 5. kanserdir[11].
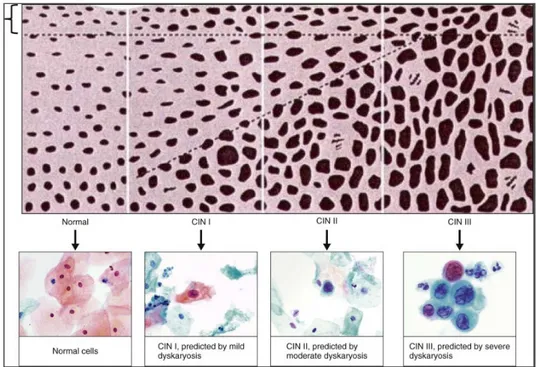
Servikal intraepitelyal lezyonlar, serviksin yassı hücreli karsinomunun prekürsör lezyonlarıdır. Preinvaziv servikal intraepitelyal lezyonları tanımlamada çeşitli sınıflamalar kullanılmış olup, en eskisi displazi-karsinoma insitu sınıflamasıdır. Displazi değişikliklerin şiddetine bağlı olarak hafif, orta ve şiddetli olmak üzere 3 gruba ayrılmıştır[12]. Başka bir sınıflama ise CIN sınıflamasıdır. Bu sınıflamada CIN I; hafif displazi, CIN II; orta derecede displazi, CIN III; şiddetli displazi/karsinoma in- situya karşılık gelmekte olup, bu sınıflama displazi/karsinoma in-situ sınıflamasının yerini almıştır. Bir diğer yeni sınıflama ise sitolojik değerlendirmede de kullanılan Bethesda sınıflamasıdır. Bethesda sisteminde, lezyonlar düşük dereceli skuamöz intraepitelyal lezyon (LGSIL) ve yüksek dereceli
skuamöz intraepitelyal lezyon (HGSIL) şeklinde sınıflanmıştır. LGSIL CIN I’e, HGSIL ise CIN II ve III’e karşılık gelmektedir [13].
2.3.1. Düşük Dereceli Skuamöz İntraepitelyal Lezyon (LGSIL):
Servikal intraepitelyal lezyonlarının tanısında temel kriterler nükleer atipinin varlığı, mitotik aktivite ve normal skuamöz maturasyonun kaybıdır. LGSIL’de epitelin üst 2/3’de maturasyon mevcuttur. LGSIL’daki değişiklikler epitelin alt 1/3 kısmındaki bazal tabakadadır[14]. Koilositik değişikliklere ek olarak hücrelerde binükleer veya multinükleer nükleuslar, keratinizasyon (diskeratozis) ve büyüme görülür. Bazal tabakada mitotik figürler görülür ancak atipik mitoz yoktur. Yoğun glikojenize skuamöz epitel ve inflamasyona reaktif epitel, gerçek koilositozla karışabilir[13]. Koilositoz ile birlikte düzensiz nükleer konturlar binükleasyon/multinükleasyon, hiperkromazi ve/veya sellüler pleomorfizm LGSIL tanısı koymada yardımcı olur. HPV etkisindeki servikste yaygın olarak hücresel düzeyde koilositotik atipi denilen değişiklikler meydana gelir. Bu değişiklikler; düzgün sınırlı geniş perinükleer halo, hafif derecede nükleer hiperkromazi, artmış nükleo/sitoplazmik oran ve nükleer membranda düzensizliktir[10]. Koilositoz varlığı HPV enfeksiyonuna işaret etmektedir. Bethesda sınıflamasına göre koilositik değişiklikler LGSIL lezyonları kapsamında değerlendirilmiş olup, smear taramalarında görülen en yaygın hücresel anormalliklerdir[13].
2.3.2. Yüksek Dereceli Skuamöz İntraepitelyal Lezyon (HGSIL):
CIN II ve CIN III lezyonları HGSIL olarak değerlendirilmektedir. Epitelde maturasyon ya hiç yoktur ya da epitelin üst yarısında sınırlıdır[12]. Nükleer anormallikler ise epitelin tamamı boyunca izlenir ve daha belirgindir. Nükleo/sitoplazmik oran artışı, nükleer sınırlarda düzensizleşme ve kromatinde kabalaşma izlenir[14]. Epitel daha koyu görünümde olup, hücreler arasında pleomorfizm dikkat çeker. Mitotik figürler çok sayıda ve epitelin tamamında izlenebilir ve atipik mitoz görülebilir. Koilositik atipili ya da maturasyonun korunduğu lezyonlar CIN II, maturasyonun seçilemediği lezyonlar CIN III olarak değerlendirilmektedir[13].
2.3.3. Serviks Kanseri Ve Öncü Lezyonlar İçin Risk Faktörleri [15]. 1) Demografik Faktörler:
İleri yaş
Irk (siyah, hispanik)
Asya, Afrika ve Latin Amerika yerleşimi Düşük sosyoekonomik durum
Düşük eğitim durumu
2) Davranış ve Seksüel Faktörler:
Fazla sayıda seksüel partner (kendisinin veya eşinin) Erken ilk koitus yaşı
Sigara
Uzun süreli oral kontraseptif kullanımı Folat, karoten ve vitamin C’den fakir diyet
3) Medikal/Jinekolojik Faktörler: Multiparite
Erken ilk gebelik yaşı
Cinsel yolla bulaşan hastalık anamnezi (özellikle Herpes ve HPV) Spesifik tip HPV enfeksiyonu
HIV enfeksiyonu
İntrauterin dönemde DES (dietilbesterol) ile karşılaşma Rutin sitolojik tarama olmaması
İmmun yetmezlik
2.4. Human Papilloma Virüs (HPV)
HPV, kadınlarda ve erkeklerde en sık cinsel yolla bulaşan hastalıklardan birini oluşturmaktadır. Gerçek prevalansı ve insidansı bildirimi zorunlu hastalıklar grubunda olmadığından bilinmemektedir[16, 17]. Serviks kanseri gelişmekte olan
ülkelerde en yaygın kanser olup, kadınlarda dünyada meme kanserinden sonra ikinci ölüm nedenidir[18].
Human Papilloma Virüsler Papovaviridae ailesindendir ve bir DNA tümör virüsüdür. Papilloma virüsler 8000 baz çifti uzunluğunda sıkı sarmallanmış çift sarmal DNA molekülü içerirler. DNA çekirdeği tam virion merkezindedir ve çevresinde protein kapsid mevcut olup kapsid ikozahedral şekildedir [19]. Sınıflamada tipler, subtipler ve varyantlar vardır. Late gen (L 1 gen) nükleotid dizilimlerindeki > % 10 dan fazla olmasına göre tipler belirlenirken, aynı gen bölgesindeki nükleotid dizilimlerindeki farklılığın %2-10 olmasına göre subtipler belirlenir. L 1 gen bölgesindeki nükleotid dizilimi farklılığı < %2 olmasına göre de varyantlar belirlenir[20].
Günümüzde cildi, mukozal veya genital bölgeleri enfekte edebilen 100’ün üzerinde HPV tipi saptanmıştır. Servikal ve anal kanserle ilişkili [21] onkojenik HPV tipleri 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 76, 82 dir[22]. Prototipleri HPV 6 ve 11 olan çoğu HPV tipleri onkojenik değildir ve bunların cildi veya mukozayı enfekte etmesi sonucu siğiller oluşur[23, 24]. Normal populasyonda (histolojik olarak normal kadınlarda) HPV tipleri coğrafik değişiklikler gösterir. HPV 16, en sık rastlanılan onkojenik tiptir, persistan HPV enfeksiyonu yapma ve servikal kansere ilerleme potansiyeli en yüksek olan tiptir[25]. Kanserin histolojik tipine göre tiplerin dağılımı değişir. Skuamöz hücreli karsinom (SCC)’da HPV 16 subtipi daha fazla sorumlu tutulmakla birlikte, bunu 18, 45, 31 ve 33 subtipler takip etmektedir. Adenokarsinomda ise HPV 18 subtipi daha fazla tespit edilmekle beraber , subtip 16 ve 45 eşit sıklıkta veya biraz daha az tespit edilmektedir[26, 27].
HPV tiplerinin varyantları saptandıkça biyolojik davranışlarındaki farklılıklar ve bunların klinik önemleri daha iyi anlaşılmaktadır. HPV 16‘nın non-european varyantları, european varyantlarına göre daha yüksek servikal kanser geliştirme potansiyeline sahiptirler [28, 29]. Daha az bilgi olmasına rağmen HPV tip 18 ve 45’inde non-european varyantlarında servikal kanser riski daha yüksektir [28].
Epidemiyolojik çalışmalar HPV’yi servikal kansere yol açma açısından düşük ve yüksek riskli diye kategorize eder. Benign lezyonlar düşük riskli tipler ile ilişkili iken invaziv kanserlerin de dahil olduğu displastik lezyonlar yüksek riskli tiplerle meydana gelir[30, 31].
Tablo 1. Genital lezyonlarla ilişkili HPV tiplerinin sınıflandırılması Onkojenik olmayanlar 6, 11, 40, 42, 54, 55, 57, 84 Onkojenik olanlar 16,18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 76, 82 Muhtemel onkojenik olanlar 26, 53, 66, 70
HPV enfeksiyonu hem histomorfolojik hemde sitomorfolojik olarak ayırt edilebilen sitoplazmik halo ile çevrili, anormal bir nükleus olarak görünüme neden olan, koilisitik atipi olarak adlandırılan sitopatik etkilere neden olur. Karakteristik olarak perinükleer halolar geniştirler ve keskin bir şekilde sınırlanan köşelere sahiptirler. Koilositlerin nükleusları hafif genişleme, düzensiz kontürler, hiperkromazi, düzensiz kromatin ayrılması ve kromatin kümeleşmesi gösterebilir. Diğer bulgular; binükleasyon, multinükleasyon, hiperkeratoz ve parakeratozdur. Süperfisial hücrelerdeki koilositiklere ek olarak, esas olarak epitelin alt 3 de birini işgal eden, doku kesitlerinde sıklıkla immatür, bazen nükleo/sitoplazmik oranının arttığı mitolojik olarak aktif ve atipik nükleuslar görülebilir[32].
2.4.1. HPV’nin Penetrasyon Ve Enfeksiyon Mekanizmaları
HPV daima seksüel yolla bulaşır. Mikro hasarlar sonucu bazal tabakanın ortaya çıkmasıyla enfeksiyon oluşur[33]. Bazal tabakanın ortaya çıkmasını takiben virüs epidermal growth faktör reseptörleri, integrin alfa-6 ve başka reseptörler aracılığıyla daha derin tabakalara penetre olur. Daha derin epitel tabakalarının penetrasyonunu 3 haftadan 8 aya kadar değişen inkübasyon periyodu takip eder ve viral partiküller eksprese edilirler[34]. Başlangıçta bazal ve parabazal tabakalarda erken proteinler
eksprese edilirler[35]. Bunu takiben daha yüksek tabakalarda yapısal proteinler eksprese edilirler. Yüzeyel tabakadan olan uzaklık azaldıkça geç proteinler artar. Bu aşamada yapısal proteinler oluşur ve matür viral partiküller üretilir[34, 36].
Yüksek riskli HPV ile enfeksiyon, patolojik lezyonun serviks kanserine ilerlemesinde en önemli faktördür[37, 38]. Ancak HPV enfeksiyonlarının ve HPV’ye bağlı lezyonların çok azı malign transformasyona uğrar. Bu da malign servikal dönüşümde başka faktörlerinde rol oynadığını düşündürmektedir (eşlik eden başka enfeksiyonlar, immünsüpresif tedavi, immün sistem bozukluğu gibi )[38].
2.4.2.HPV’nin İndüklediği Hücre Transformasyonu
Yüksek riskli HPV enfeksiyonu neoplastik hücreye dönüşümü için belirleyici olsa da tek başında malign dönüşüm için yeterli değildir[34, 39, 40]. Diğer önemli faktörler hastanın yaşı, sağlık durumu, sigara içmesi, enfeksiyonun süresidir[41].
2.4.2.HPV Genomu
HPV genomu 8 open reading frame (ORF) içeren 3 kodlayıcı bölge içerir. ORF’lar DNA replikasyonu ve zarfsız virionun kapsidini ikozohedral kapsidini oluşturan proteinlerin sentezi için gereklidir. Özellikle viral siklisun erken (E) dönem ve geç (L) dönemdeki fonksiyonlar için gerekli iki bölge vardır. 6 tane erken ORF (E1, E2, E4, E5, E6, E7 ) viral gen ekspresyonunu regüle ederler. Erken dönemde görevli ORF’lar; transkripsiyon, DNA replikasyonu, konakçı hücrenin transformasyonu ve bu amaçlar için konakçı hücrenin enzim sisteminin kullanılması için gerekli proteinleri kodlarlar. Geç bölgeler iki geç ORF’u (L, L2) içerir bu geç ORF bölgelerinde yapısal proteinler kodlanır. 1000 baz çiftinden oluşan; non-coding region (NCR), uzun kontrol bölgesi (long control region) veya upstrem regulatuar region (URR) da denen 3. bir bölge RNA sentezinden, sentezin başlamasından ve zincirin uzamasında sorumludur. Böylece ORF’ların ekspresyonu regüle olur[10].
2.4.3.HPV’nin Konak Hücre Genomu İle Birleşmesi
Yüksek riskli HPV ile ilişkili neoplastik dönüşüm süreci ancak konakçı hücre DNA ile entegre virüsler tarafından başlatılabilir. Yüksek riskli virüslerin E6 ve E7 proteinleri konakçı hücrenin siklusunun regülasyonunu bozar, apoptozisi engeller,
G1/S ve G2/M arasında geçiş sağlar, hücre bölünme kontrol noktalarından kaçırır ve telomeraz aktivitesini artırır [42].
HPV’nin konak hücre DNA’sı ile entegrasyonu sonrası viral DNA’nın E1 ve E2 bölgelerinde bozulma olur, E2 komşu bölgelerde (E4, E5) ve L2 nin bir parçasında kayıp oluşur. Ancak E6 ve E7 entegrasyon sürecinde sağlam kalır[43]. E1 ve / veya E2 deki bozulmalar gen ekspresyonunu inhibe eder [34]. E6 ve E7 proteinlerinin ekspresyonları LCR bölgesindeki sekanslar yoluyla olduğundan, HPV ilişkili malign transformasyonda E2 regülatuar proteinin kaybı büyük öneme sahiptir. E2 proteininin baskılayıcı etkisi olmayınca E6 ve E7 gibi onkojenik proteinlerinin üretimi artar [34, 43]. Onko proteinler p53 ve pRb proteinlerine bağlanırlar ve bu anti onkojenik proteinleri degrade ederler [40]. Bu şekilde konak hücrenin DNA tamir süreci bozulur, proliferasyon, büyüme ve terminal diferansiasyonda gecikme olur[36]. Erken proteinler bazal tabakalarda eksprese olur, E6 ve E7 proteinleri daha yüzeyel tabakalarda eksprese olur ve konak hücrede DNA replikasyonunu stimüle eder ve viral DNA replikasyonuna izin verir [34, 44].
Enfeksiyonun başlangıç aşamasında bazal tabakadaki hücreler episomal viral DNA içerirler. E6 proteinin varlığı konakçı genoma entegrasyonu düzenler [45]. Transforme hücreler büyük miktarda viral DNA içerirler, sadece E6 ve E7 eksprese ederler , L1 ve L2 kapsid proteinleri saptanamaz [46].
2.4.4.Hücrelerin Neoplastik Transformasyonunda E6 Proteinin Etkisi
Normal hücrelerde p53 proteini normal hücre siklisunda DNA tamirinde ve apopitoziste görev alan bir proteindir. Normal hücrelerde düşük seviyededir ancak DNA hasarı olunca artar [34].
E6 proteini p53 proteinine bağlanarak ubikitinasyon yoluyla proteolizisine neden olur[35]. E6 proteini nedeniyle azalan p53 aktivitesi sonucu hücre bölünme siklusu bozulur, hücre proliferasyonu ve spontan mutasyonlar artar. Bu durumda HPV enfekte hücrelerde kromozomal instabiliteye neden olur[34]. Normal hücrelerde p53 proteinin ubikitinasyon ile yıkımında mdm2 ligaz da yer alır [47]. HPV DNA’sı olan hücrelerde tamamen E6 HPV’ye bağlıdır ve E6AP ligazın katılımıyla
gerçekleşir[48]. E6 ve E6AP ligaz bir kompleks oluşturur ve bu kompleks p53 proteinine bağlanarak onu degrade eder[49] .
Efektif degredasyon enfekte hücrelerdeki HPV tipine bağlıdır. E6 proteini hem düşük hemde yüksek riskli HPV ile enfekte hücrelerde p53 proteinine bağlanır ancak sadece yüksek riskli HPV ile enfekte olan hücrelerde etkili bir p53 degredasyonu oluşur. Bu durumda yüksek riskli HPV’nin E6 proteinin E6AP ligaz ile daha güçlü kompleks oluşturma özelliğini ve farklı bir p53 domainine bağlandığını yansıtır. HPV tip 16’nın E6 proteini, tip 18’e göre E6AP ligaza göre daha yüksek afinite ile bağlanır ve degredasyon daha etkili olur. HPV 11’in E6 proteini ligaza çok zayıf bağlanır [50, 51].
HPV Ubikitinasyon yoluyla degredasyondan başka mekanizmalar da geliştirmiştir. Bunlardan biriside programlanmış hücre ölümünden kaçıştır. Bu yolla hasara uğramış DNA’ları olan hücrelerin yaşaması ve proliferasyonu, hücre genomunda mutasyonların biriktirilmesi sağlanır. Tüm bunların sonucunda HPV DNA ile entegre olmuş konakçı hücresinde neoplastik dönüşüm gerçekleşir. HPV’nin E6 proteini p53 proteininden başka Bak proteini gibi proapopitotik proteinlerinde E6AP ligaz ile birleşerek ubikitinasyon yoluyla proteolizisine neden olur. Bak proteini daha üst tabakalarda bulunur, E6 proteini bunu inhibe ederek Bak bağımlı apopitozisi engeller [52]. E6-E6AP ligaz kompleksi aynı zamanda FADD (fas assosiated death domain ) protenini de indirger. Bu protein Fas reseptörünün DD (death domain )’sine bağlanır, bu bağlanma ile caspas 8 aktive olur ve apopitotik yola girer. Procaspas 8 de indirgenir ve böylece aktif caspas 8 oluşumu engellenir [53].
E6 proteini ayrıca transkripsiyon faktörü NF-kβ yi aktive eder buda apoptozis 2 protein inhibitörünün ekspresyonunu artırır. Böylece programlanmış hücre ölümünden kurtulmuş olur[54].
2.4.5.Hücre Malign Transformasyonunda E7 Proteinin Rolü
E7 proteini retinoblastoma ailesinden pRb ve homologları p107, p130 gibi proteinlerle etkileşir. E7 proteini pRb’ye bağlanınca transkripsiyon faktörü E2F pRb kompleksinden ayrılır; böylece hücre proliferasyonunu kontrol eden genler aktive olur, DNA sentezinde görevli proteinler eksprese olur ve hücre S fazına girer[55] .
E7 proteinin histon diasetilaz enzimleri ile de etkileşir. Histon diasetilazlar gen traskripsiyonunda ko-repressör faktör olarak etki eden enzimlerdir. Bunların E2F ile birleşmesi hücre proliferasyonunda görevli proteinleri üreten birkaç genin aktivasyonunu engeller. E7 ile E2F bağlanınca bu baskılayıcı etki ortadan kalkar ve genlerin traskripsiyonu gerçekleşir [56].
E7 proteini ayrıca Cyclin A/CDK2 ve Cyclin E/CDK2 kompleksine bağlanır. Böylece hücrenin S fazına girmesinde görevli genlerin transkripsiyonuna ve pRb proteinin fosforilasyonuna neden olan kinazlar aktive olur [57, 58]. Başka bir yolda E7 proteininin p21 ve p27 gibi proteinlerle bağlanarak hücre siklusunun G1 fazından S fazına geçmesinde görevli kontrol noktasının bypass edilmesidir[59, 60].
E7 proteini interlökin 6 ve proapopitotik faktör MLC-1 in üretimini artırarak HPV DNA ile entegre olan hücrelerin apopitozisten kaçmasına neden olabilir [61].
2.5. PAP Smear
Pap smear sitolojik bir tarama testi olup dökülen servikal hücrelerin toplanıp incelenmesidir. Böylelikle preinvaziv ve erken invaziv lezyonların saptanmasına olanak sağlanır ve serviks kanserine bağlı mortalite ve morbitide de azaltılmış olunur. İlk kez Papanicolaou tarafından tanımlandığı için Pap Smear olarak adlandırılır[62].
Pap smearda yetersizlik; örnek alınımında hatalar, laboratuvar hatası ve laboratuvar kalite denetimindeki yetersizlikten kaynaklıdır[63, 64]. Smearda hücre bulunmaması örnekleme ve hazırlama hatalarından dolayı gerçekleşir. Pap smearın yayılmasına dek geçen sürede hücrelerin %80’e kadar miktarı kaybedilebilir. Cama yayılabilen hücreler arasında anormal hücreler saptandığında, ortamda bulunabilen kan, mukus, inflamatuar debris gibi kontaminasyonlar veya yaymanın kalın yapılmış olması ile havada kurumaya bağlı artefaktlar smearda yanlış yorumlanmaya neden olabilir[65].
American College of Obstetricians and Gynecologists (ACOG) smear tarama kriterleri (2003)[66]
1-Hayatı boyunca herhangi bir dönemde veya halen seksüel aktif olan veya 21 yaşına gelmiş olan tüm kadınlar yıllık pelvik muayene ve Pap testi yaptırmalıdır.
2- >30 yaş ve > 3 kez ardışık yıllık normal pelvik muayene ve Pap testi sonrasında, düşük risk gurubu kadınlarda (HIV pozitifliği, intrauterin DES ile karşılaşma ve immün yetmezlik olmaması) hekimin değerlendirmesi uyarınca kontroller daha uzun aralarla yapılabilir
a) HIV pozitifliği varsa ilk yıl 6 ayda bir, daha sonra yılda 1 kez
b) Geçmişte CIN 2 veya 3 nedeniyle tedavi veya servikal kanser varsa yılda 1 kez c) Daha önceki smear sonuçları negatif olan hastanın şimdiki smear testinde
endoservikal hücreler görülememiş veya kan hücreleri ile kontamine olmuş ise yılda bir kez taramaya devam edilmelidir.
3-Total histerektomi geçirmiş ve HGSIL anamnezi olmayan kadınlar taramadan çıkartılabilir.
a.Histerektomi geçirmiş, ancak HGSIL anamnezi olan kadınlar, 3 kez yıllık smear sonucu negatif olarak saptandıktan sonra taramadan çıkartılabilir b.Histerektomi geçirmiş ve daha öncesinde HGSIL nedeniyle tedavi alıp, 3 kez yıllık smear sonucu negatif olarak saptanmış olan kadınlar taramadan çıkartılabilir
2.6. Sıvı Bazlı Sitoloji
Alınan örnek lam üzerine yayılmak yerine tamponlanmış alkol içeren bir şişe içerisine karıştırılır. Elde edilen bu hücre süspansiyonu özel bir filtre sisteminden geçirilerek kan, mukus ve diğer ölü hücreler ayrıştırılır. Geride kalan hücreler lam üzerine yayılır ve bu sayede diğer hücreler tarafından görülmesi engellenen servikse ait hücreler daha kolay görülüp incelenebilir. Thin Prep tekniği ile alınan smear testinde hatalı negatif oranı %4 civarındadır[19].
Birçok çalışmada sıvı bazlı sitoloji sayesinde tanısal servikal hücrenin daha çok toplandığı ve örnekten hazırlanan preparatlarda hücre kümeleşmesi, kan ve yangısal değişikliklere bağlı artefaktların daha az olduğu, sıvı bazlı sitoloji ile yetersiz
örnekleme oranı azalmakla birlikte, LGSIL ve HGSIL olgularında da daha yüksek sensitivitelere ulaşıldığı düşünülmektedir[67].
2.7.PAP Smear ve BETHESDA Sistemi
İlk Bethesda sistemi 1988 yılında servikal ve sitolojik tanıların bildirilmesi için düzenli bir terminoloji oluşturulması ile tanısal raporları standartize hale getirmek amacıyla oluşturulmuştur. 1991 ve 2001 yılında gözden geçirilmiş[68] olup, son halini 2014 yılında almıştır.
Pap smear, en sık ve yaygın kullanılan servikal tarama testi olup invaziv serviks kanserinin insidans ve mortalitesinde dünya çapında görülen azalmasının nedenidir. Fakat Pap smear testinin belirli dezavantajları da mevcuttur. Testin öznel nitelikte olması, yetişmiş eleman ve laboratuvar ihtiyacı, çoğu rutin uygulamada duyarlılığının düşük oluşu bunlardan en önemlileridir. Pap smearın rutin uygulamalarda CIN II ve üstü lezyonları tespit etmedeki duyarlılığı %47-62 arasında değişirken özgüllüğü %60-95 arasında bildirilmiştir. Gelişmekte olan ülkelerde Pap testinin duyarlılığı %31-78, özgüllüğü %91-96 aralığında bildirilmiştir[2].
BETHESDA 2014[69] ÖRNEK/SPESMEN TÜRÜ Konvansiyonel Pap Smear Diğer ÖRNEK/SPESMENİN YETERLİLİĞİ
-Değerlendirme için yeterli
Endoservikal veya transformasyon zonunun varlığı veya yokluğu ya da kısmi kan veya inflamasyon varlığı
-Örnek reddedildi veya işleme alınmadı (nedenini belirtiniz)
-Örnek işleme alındı ve değerlendirildi fakat epiteliyal anormalliklerin değerlendirilebilmesi için yeterli bulunmadı
GENEL SINIFLAMA (isteğe bağlı)
-İntraepitelyal Lezyon veya Malignite için Negatif
-Epitelyal hücre anomalisi (Yorum/sonuca Bakınız)
-Diğer (Yorum/sonuca Bakınız)
YORUM/SONUÇ
-İntraepitelyal Lezyon veya Malignite Negatif
-Non-neoplastik Bulgular
Non-neoplastik hücresel değişiklikler Skuamöz metaplazi
Keratotik değişiklikler Tubal metaplazi Atrofi
Gebelikle ilgili değişiklikler Reaktif hücresel değişiklikler
İnflamasyon (tipik onarım dahil) Lenfosittik (foliküler) servisit Radyasyon
Rahim içi kontraseptif araç (RİA) Histerektomi sonrası glandüler hücreler
-Organizmalar
Trichomonas Vaginalis
Morfolojik olarak Candida ile uyumlu fungal organizma Bakteriyel Vaginozisi düşündüren flora değişikliği
Herpes Simpleks virüsü ile uyumlu hücresel değişiklikler Cytomegalovirüs ile uyumlu hücresel değişiklikler
-Diğer
Endometrial hücreler (45 yaşında bir kadında)
(“skuamöz intraepitelyal lezyon negatif” varsa ayrıca belirtin)
-Epitel Hücre Anomalileri Skuamöz Hücre
Atipik skuamöz hücreler
Önemi belirlenemeyen (ASC-US) HGSIL göz ardı edilemez (ASC-H)
Düşük Dereceli Skuamöz İntraepitelyal Lezyon (LGSIL) (HPV/Hafif Displazi/CIN I)
Yüksek dereceli skuamoz intraepitelyal lezyon (HGSIL) (Orta ve şiddetli displazi CIS/CIN II/CIN III)
Skuamöz hücreli karsinom Glandüler hücre Atipik Endoservikal hücreler Endometrial hücreler Glandüler hücreler Atipik
Endoservikal hücreler, daha çok neoplazi lehine Glandüler hücreler,daha çok neoplazi lehine
Endoservikal insitu adenokarsinom Adenokarsinom
Endoservikal Endometrial Ekstrauterin
Spesifiye edilemeyen (NOS) Diğer Malign tümörler
BİRLEŞİK TEST
Test yöntem(leri) için kısa bir açıklama ve klinisyen tarafından kolayca anlaşılabilecek şekilde bir sonuç raporu sağlanması
SERVİKAL SİTOLOJİDE BİLGİSAYAR DESTEKLİ YORUM
Vaka otomatik cihaz tarafından incelenmiş ise, cihazı ve sonucu belirtin
SİTOLOJİ RAPORLARINA EKLENEN EĞİTİM NOTLARI VE YORUMLAR
Öneriler öz olmalı ve profesyonel kuruluşlar tarafından yayınlanan klinik takip klavuzları ile uyumlu olmalı (ilgili yayınlara referanslar dahil edilebilir)
2.7.1. Atipik Skuamöz Hücreler (ASC)
ASCUS ifadesi başlangıç olarak Bethesda sisteminin ilk versiyonlarında borderline sitolojik değişikliklerin sınıflandırılmasında ışık mikroskopunun sınırlılıklarını yansıtmak için kullanılmıştır. ASCUS ifadesinin yerine başka türlü sınıflandırılmamış (NOS), muhtemelen reaktif, muhtemelen SIL/displazi gibi terimler kullanılmıştır ve 1996’ ya kadar tüm servikal sitolojik raporların %5.2 sini ASCUS yorumu oluşturmuştur [70].
HPV enfeksiyonun biyolojisinin anlaşılmasındaki ilerlemelerle ve Skuamöz İntraepitelyal Lezyon Triaj Çalışması (ALTS) [71] yanısıra değişik doğal gözlem çalışmalarından [72] elde edilen verilerle servikal kanser taraması her CIN’ı saptama ve tedavisinden, yüksek grade CIN vakalarının tedavisine doğru kaymıştır. Bu konsepte göre TBS 2001 de ASCUS terimi yerine ASC terimi kullanılmıştır. ASC daha dar ve sadece iki bileşeni vardır. Bunlar; önemi belirsiz atipik skuamöz hücreler (ASC-US) ve HGSIL’ı dışlayamayan ASC-H’dir[73]. Bu alt sınıflamanın amacı HGSIL için şüpheli bulguları olanları daha net bir şekilde ayırarak diğer ASC tiplerinden ayırt etmede daha fazla klinik fayda sağlamaktır. Genel bir kural olarak ASC-US %90-95, ASC-H %5-10 olmalıdır [73, 74].
ASC tek bir yorumsal yada biyolojik antite değildir. Bir veya başka nedenle kesin olarak kategorize edilemeyen hücresel değişiklikler spektrumunu kapsar. Özellikle kesin olarak SIL yorumu için kalitatif veya kantitatif yetersiz hücresel değişiklikler için kullanılmalıdır. Bir hücrenin ASC olarak sınıflandırılabilmesi için bu hücrenin skuamöz diferansiasyon, nükleo/sitoplazmik oranda artış ve minimal nükleer değişiklikler göstermelidir[74].
2.7.2.Önemi Belirsiz Atipik Skuamöz Hücreler (ASC-US)
ASC-US çoğunlukla matür, süperfisial/intermediate tip sitoplazmalı skuamöz hücrelerin non inflamatuvar değişikliklerini içerir. Normal skuamöz hücrelere göre yaklaşık 2.5-3 kat kadar nükleer genişlemeye sahiptirler. Ancak nükleer kromatin hiperkromazi yapmaksızın dağınık haldedir. Nükleer sınırlar düz ve regülerdir. Nükleer boyutlarda değişiklik olabilir. Ayırıcı tanı genellikle reaktif değişiklikler ile LGSIL arasındadır ama LGSIL yorumu için kalitatif ve kantitatif değişiklikler yetersizdir. Geniş metaplastik veya küçük intermediate hücrelere benzeyen yuvarlak veya oval hücreler de ASC-US olarak değerlendirilebilir. Sıvı bazlı preparatlarda konvansiyonel smearlara göre hücreler daha küçük ve daha yuvarlak görünebilir. İncelenen hücreler aynı preparattaki normal görünümlü intermediate hücrelerle karşılaştırılmalıdır. Reaktif değişiklikleri ayırt etmede soluk nükleus ve hatta kromatin dağılımı gösteren hücreler ACS’dan daha ziyade NILM olarak yorumlanır [75].
Amerika birleşik devletlerinde her yıl 2 milyondan fazla kadın ASCUS tanısı almaktadır[76].
Bethesda ASC-US Kriterleri[69]
1. Çekirdeklerin kapladığı alan normal intermediate skuamöz hücre çekirdeğine göre 2,5 – 3 kat daha fazla
3. Minimal nükleer hiperkromazi ve kromatin dağılımında veya çekirdek şeklinde düzensizlik
4. Dens oranjofilik sitoplazma (“atipik parakeratoz”) ile ilişkili nükleer anormallikler
Dens oranjofilik veya eozinofilik sitoplazmaya ve küçük piknotik çekirdeğe sahip küçük poligonal skuamoz hücrelerin (“parakeratoz”) çekirdekleri normal görünümdeyse NILM olarak sınıflandırılmalıdır. Ancak, çekirdekleri genişlemiş, hiperkromatik hale gelmiş, sınırları düzensizleşmiş veya hücreler üç boyutlu kümelenme gösteriyorsa, anomalinin derecesine bağlı olarak ASC-US, ASC-H veya SIL tanıları akla getirilmelidir[77].
2.7.3.Yüksek Grade Skuamöz İntraepitelyal Lezyonu Dışlayamayan Atipik Skuamöz Hücreler (ASC-H)
Bu kategoride HGSIL’ ı destekleyen ancak kesin HGSIL yorumu yapmak için yeterli olmayan hücreler bulunur. Bu kategoride;
1- Nükleo/sitoplazmik oranı yüksek veya atipik (immatür) metaplazili hücreler. Anormal şekil, hiperkromazi, benign metaplazi üzerine HGSIL’ı destekleyen kromatin düzensizliği gibi nükleer düzensizlikler.
2- Kalabalık tabaka paterni veya hiperkromatik hücre grupları olarak adlandırılanlar. Yoğun sitoplazma, poligonal hücre şekilleri, endoservikal hücrelere kıyasla skuamözü destekleyen belirgin hücre sınırları. Bu hücre paterni normal değişikliklerden (atrofi, endometrial hücreler) neoplastik değişikliklere kadar ( endoservikal adenokarsinom, HGSIL veya gland içeren HGSIL) geniş bir yelpazeyi barındırır.
3- Atrofi durumundaki atipik hücreler, radyasyon terapisini takiben gelişen atipi, kötü korunmuş endometrial hücreler veya histiyositler ve intrauterin araç kullananlar HGSIL tanısından ayırt etmede zor hücresel değişiklik gösterirler. Böyle durumlarda ASC-H olarak değerlendirme yapmak uygundur [75].
Bethesda ASC-H Kriterleri[69]
1. Tek hücreler ya da 10 hücreden gruplar şeklinde
2. Metaplastik hücre boyutunda hücreler
3. Nükleusları normalden 1.5-2.5 kat büyük
4. Nükleo/sitoplazmik oran HGSIL’ daki gibi
5. Hiperkromazi, kromatinde düzensizlik, anormal nükleer şekil HGSIL lehinedir.
2.7.4 Low Grade Skuamöz İntraepitelyal Lezyonlar (LGSIL)
Vulva, vagina ve serviksin asetik asitle “asetovayt” siğilimsi veya düz lezyonları olarak bulunabilirler. Histolojik olarak Koilositik değişiklikleri ve hafif displazi içerir [78].
LGSIL Kriterleri[69]
1. Tek ya da tabakalar halinde hücreler
2. Normal intermedier hücre nükleusundan 3 kat büyük nükleus
3. Nükleo/sitoplazmik oranı hafif derecede artmış, nükleer hiperkromazi, irileşme, nükleus sayısı ve şekilleri değişken
4. Binükleasyon, multinükleasyon sıktır
5. Kromatin üniform dağılmış, kaba granüler, kümelenmiş ya da opak görünümdedir.
6. Nükleol yok ya da belirsiz
7. Nükleer konturlar düzgün ya da hafif düzensiz 8. Sitoplazmik sınırlar belirgin
2.7.5. Yüksek Grade Skuamöz İntraepitelyal Lezyonlar (HGSIL)
Vulva, vagina ve serviksin kolposkopide mozaism ve punktat hipervaskülariteli kabarık veya düz ekskorye lezyonları olarak görülebilir. Histolojik olarak CIN 2 ve 3 lezyonları içerir [78].
HGSIL Kriterleri [69]
LGSIL’a göre daha küçük ve matür hücreleri etkiler
1. Tek hücreler, tabakalar ya da sinsityal benzeri agregatlar 2. Hiperkromatik kümeler
3. Nükleuus boyutu ve şekilleri değişkendir
4. Nükleer hiperkromazi nükleo/sitoplazmik oran artmıştır.
Şekil 2: NILM Serviks, CIN I, CIN II, CIN III displazisine sahip serviksin, servikal smeardeki hücresel değişiklikleri
2.7.6.Keratinize Skuamöz Hücreli Karsinom
Klinik olarak düzensiz kanaması olan, vulva, vagina veya serviksinde büyük fungatif lezyonu olan, klinik hikayesinde SIL lezyonu olan, HIV pozitifliği olan ve düzenli pap smear taraması yaptırmayan hastalardır[78].
Sitolojik olarak değişik boyutlarda ve şekillerde iğnemsi ve kuyruklu tek tek dağılan portakal rengi boyanan hücreleri içeren belirgin bir nükleolusları olmayan belirgin akut inflamasyon ve tümör diastazı görülebilen değişken boyutlarda nükleusları olabilen ama genellikle yoğun ve hiperkromatik veya yoğun bir şekilde paketlenmiş piknotik nükleusu olan hücreler izlenir [79].
2.7.7.Non keratinize Skuamöz Hücreli Karsinom
Klinik olarak hikayesinde SIL olup daha ileri tetkik yapılmayan veya takibe gelmeyen, HIV pozitifliği olan, düzenli pap smear tarama testini yaptırmayan, klinik olarak irregüler kanaması olan, vulva vagina ve serviksinde funtatif lezyonları olabilen kadınlardır[78].
Sitolojik özellikleri: çoğunlukla sellüler agregatlar veya sinsitya içinde dizilen hücreler, belirgin nükleolus olmadan hiperkromatik granüler kromatini olan nükleuslar, çoğunlukla HGSIL lezyonlarla ilişkili hücreler ve tümör diastazı görülür[79].
3. GEREÇ VE YÖNTEM
Dicle üniversitesi Tıp Fakültesi Etik komitesinden izin aldıktan sonra çalışmamız Dicle Üniversitesi Tıp fakültesi Patoloji Anabilim Dalında, 2015 ile 2016 tarihleri arasındaki eş zamanlı alınan 1500 HPV testi ve Pap Smear vakalarını içermektedir. Laboratuvarımızda yüksek riskli HPV tipleri Cobas X4800 cihazı ile bakıldı. Bu vakalara ait Pap smear preparatları bir patolog tarafından tekrar ışık mikroskobunda (nikon-eclipse 50i) değerlendirilmiş olup, yüksek riskli HPV pozitif ASCUS’lu vakalarda; periferik halolu hücreler, sitoplazmik kavitasyon, multinükleasyon, diskeratoz, parakeratoz, minimal nükleer hiperkromazi, opak sitoplazma aranarak HPV ile bu özellikler arasındaki ilişki değerlendirildi.
Sıvı Bazlı Yayma Yöntemi Numunenin alınışı:
Jinekolojik örnek spatula veya fırça yardımı ile alınır. Spatula/fırça hücreleri bozulmadan taşımak üzere hazırlanmış olan içerisinde solüsyonu hazır şişede (örnek kabı) 10 kez çalkalanır ve spatula/fırça atılır. Örnek kabının ağzı kapatılır, etiketlenir ve labaratuvara gönderilir.
Pap Smear Boyama:
Laboratuvarda örnek kabı Tripath İmaging cihaza bağlanır. Bu işlem negatif basınçla hücre dışı elemanları süzerek tanısal, hücresel materyali tek ve ince bir tabaka halinde filtre üzerine toplar. Daha sonra daha hızlı bir santrifüj ile toplanan hücre sayısı artırılır. Hücreler buradan lama aktarılır ve tespit edilir. Lam Prepstain slid procesor Tripath İmaging ile PAP boyanır.
HPV-DNA EKSTRAKSİYONU VE RT-PCR İLE GENOTİPLENDİRME BASAMAKLARI
1- Numuneler 11 mm’lik tüplere 2 ml’lik olacak şekilde aktarılır.
2- 22 hastanın isim ve protokol numaraları radlara dizilmek üzere sıra ile not edilir
3- Bilgisayarda CobasX4800 günlük ve haftalık bakım tuşlarına basılarak bakımı yapılır.
4- Radlara dizilen 22 hasta Cobas X4800’e okutulmak üzere cihaza yerleştirilir. 5- Cihaz hasta numunelerinin bulunduğu tüpleri okuduktan sonra radlara pipet
uçları eklenir. AD-Plate ve Ekstration Plate 1,6 ml rada dizilip okutulur. 6- Hastalara ait numunelerden HPV-DNA ekstrakte etmek için solüsyonlar
okutularak yükleme yapılır.
7- Cobas 4800 system wash Buffer kitinin öncelikli olarak rezervuarı okutulup rada yerleştirilir. Sonra Cobas 4800 system wash buffer kit okutulup rezervuara aktarılır.
8- Cobas 4800 system sample preparation kit ve Cobas 4800 system liquid cytology preparation kit içindeki; SDS (Tris-HCl Buffer, %0.09 Sodyum Azide), LYS (Tris-HCl Buffer, %37 Guanidine HCl,%5Polydocanol), EB (Elution Buffer), MGP (Magnetic GlassParticks) solüsyonları okutulmadan önce 4 tane rezervuar tek tek okutulup sonra solüsyon okutulup rezervuara aktarılıp rada dizilir. (Önce SDS okutulur sonra rezervuar daha sonra SDS soluüsyonu rezervuara aktarılıp rada dizilir.Tüm solüsyonlar CYSEB aynı şekilde yapılır. En sonunda ise MGP iyice karıştırıldıktan sonra aynı şekilde okutulup rada dizilir.)
9- Cobas 4800 HPV kontrols kitindeki pozitif ve negatif kit oluşturulup rada dizilir.
10- Cobas 4800 HPV Amplification Detection kitindeki HPV MMX ve HPV Mg/Mn okutulup rada dizilir.
11- Cobas 4800 system liquid cytology preparation kit içindeki PK okutulup rada dizilir.
12- Cihaz başlatılır.
13- Yaklaşık 1 saat 30 dakika sonra Cobas X4800 ile ekstrakte edilen Mikro-plate (AD-Mikro-plate) numuneler Mikro-Mikro-plate Sealing Film ile kaplanır.
14- HPV genotiplendirmek için tam otomatik RT-PCR cihazı Cobas-2480’e aktarılıp cihaz çalıştırılır.
15- 2 saat sonra sonuçlanır. (HPV var ya da yok; varsa genotip verilir.)
Örnek Rapor
HPV DNA GENOTİPLENDİRME SONUÇLARI: -HPV DNA Genotip 16: POZİTİF
-HPV DNA Genotip 18: SAPTANMADI
-HPV DNA HR (Yüksek Risk)* Genotipleri: POZİTİF
*HPV DNA HR (Yüksek Risk) Genotipleri: HPV DNA Genotip 31,33,35,39,45,51,52,56,58,59,66 ve 68'i kapsamaktadır.
**HPV DNA Genotiplendirme çalışması Cobas 4800 sisteminde, Cobas 4800 HPV Test kullanılarak Real Time PCR yöntemiyle çalışılmıştır. Cobas 4800 HPV genotipleme testi, 600 kopya/ml düzeyi ve üzerindeki HPV DNA genotiplerini saptamaktadır. Bu test hastanın tedavi ve takibini etkilemektedir.
4. İSTATİKSEL YÖNTEM
Elde edilen veriler SPSS for Windows 18.0 (SPSS inç Chicago) istatistik paket programı ile değerlendirildi. Değişkenlerin sıklığı ve numerik verilerin ortalama ve standart sapmaları bulundu.
5. BULGULAR
Diyarbakır Dicle Üniversitesi Tıp Fakültesi Patoloji Anabilim dalında 2015-2016 yılları arasında eş zamanlı servikal smear preparatları ve yüksek riskli HPV raporları 1500 vakada incelendi. 1500 hastanın yaş ortalaması 42,6±11,85 tespit edilmiştir. En küçük hastamızın yaşı 16, en yaşlı hastamızın yaşı ise 102’dir. Hasta/yaş grubu-hasta sayısı yüzde oranları grafik 1’ de gösterilmiştir.
Grafik 1: hasta yaş gruplarına göre hasta yüzdeleri
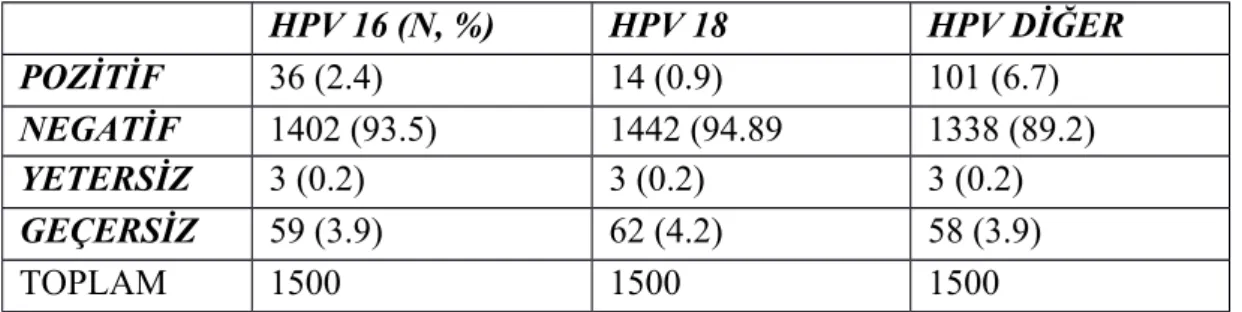
Bin beşyüz olgumuzun 151 tanesinde yüksek riskli HPV pozitifliği tespit edilmiştir. Tespit edilen yüksek riskli HPV pozitif olguların 36 tanesinde (%2.4) HPV 16 , 14 tanesinde (%0.9) HPV 18, 101 tanesinde (%6.7) ise diğer yüksek riskli HPV subtipleri saptandı. Tablo 2’de yüksek riskli HPV testi sonuçları gösterilmiştir.
HPV 16 (N, %) HPV 18 HPV DİĞER POZİTİF 36 (2.4) 14 (0.9) 101 (6.7) NEGATİF 1402 (93.5) 1442 (94.89 1338 (89.2) YETERSİZ 3 (0.2) 3 (0.2) 3 (0.2) GEÇERSİZ 59 (3.9) 62 (4.2) 58 (3.9) TOPLAM 1500 1500 1500
Tablo 2: Yüksek riskli HPV test sonuçları
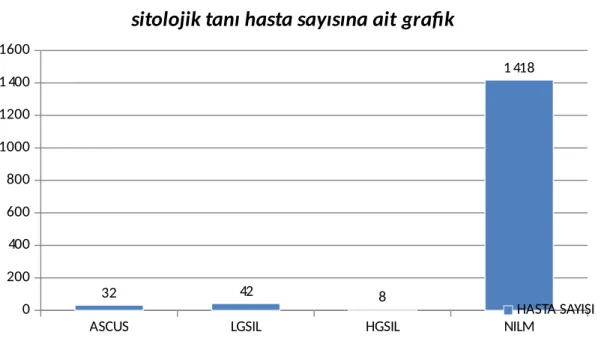
Binbeşyüz olgumuzun Bethesda sınıflamasına göre sitolojik tanıları verilmiştir. Değerlendirilen olguların 32 tanesi ASCUS, 42 tanesi LGSIL, 8 tanesi HGSIL ve 1418 tanesi ise NILM olarak raporlanmıştır. Tablo 3’te ve grafik 2’de olguların tanıları, sayı ve yüzde oranları gösterilmiştir.
SAYI YÜZDE % ASCUS
32
2.1
LGSIL 42 2.8 HGSIL 8 0.5 NILM 1418 94,5 TOPLAM 1500 100Grafik 2: Sitolojik tanıların grafik ile gösterilmesi
Sitolojik olarak ASCUS tanısı almış 32 hastanın 2 tanesinde HPV tip 16 pozitif, 3 tanesinde diğer yüksek riskli HPV tipleri pozitif saptandı. HPV tip 18 ise saptanmadı. 42 LGSIL hastanın 1 tanesinde HPV tip 16, 3 tanesinde diğer yüksek riskli HPV tipleri saptanırken HPV tip 18 ise hiç saptanmadı. 8 HGSIL olgusunun bir tanesinde HPV tip 16, 3 tanesinde diğer yüksek riskli HPV pozitifliği saptandı. HGSIL olanlarda HPV tip 18 ise negatif saptandı. 1418 NILM tanılı hastanın 32 tanesinde HPV tip 16, 14 tanesinde HPV tip 18, 92 tanesinde ise diğer yüksek riskli HPV tipleri pozitif olarak saptandı. Bunlara ait veriler tablo 4 ‘de verilmiştir.
SİTOLOJİK TANI HPV 16 (N=36) HPV 18 (N=14) HPV diğerleri TOTAL HPV POZİTİF ASCUS (N=32) 2 0 3 5 LSIL (N=42) 1 0 3 4 HSIL (N=8) 1 0 3 4 NILM (N=1418) 32 14 92 138 TOPLAM (N=1500) 36 14 101 151
Tablo 4. Sitolojik tanılara göre yüksek riskli HPV tiplerinin dağılımı
ASCUS LGSIL HGSIL NILM
0 200 400 600 800 1000 1200 1400 1600 32 42 8 1418
sitolojik tanı hasta sayısına ait grafik
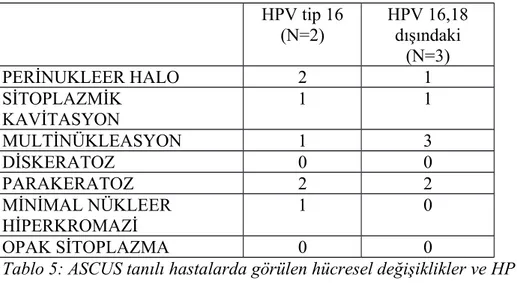
Sitolojik olarak ASCUS tanısı almış 32 hastamızın sadece 5 tanesinde yüksek riskli HPV pozitifliği mevcut iken, HPV tip 18 pozitifliğine hiç rastlamadık. HPV tipleri ve bunlarda görülen hücresel değişiklikler tablo 5’te verilmiştir.
HPV tip 16 (N=2) HPV 16,18 dışındaki (N=3) PERİNUKLEER HALO 2 1 SİTOPLAZMİK KAVİTASYON 1 1 MULTİNÜKLEASYON 1 3 DİSKERATOZ 0 0 PARAKERATOZ 2 2 MİNİMAL NÜKLEER HİPERKROMAZİ 1 0 OPAK SİTOPLAZMA 0 0
Tablo 5: ASCUS tanılı hastalarda görülen hücresel değişiklikler ve HPV tipleri ile ilişkileri
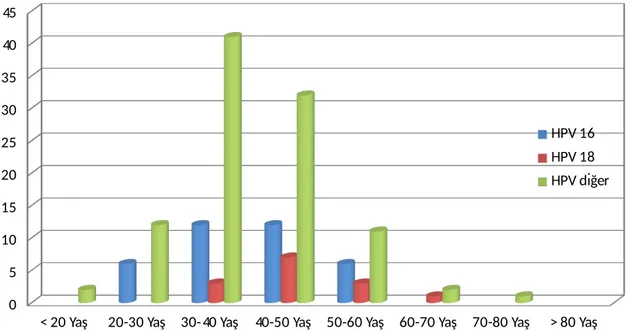
Çalışmamızda HPV16 pozitifliği gösteren olguların yaş aralığı daha çok 20-60 aralığında, HPV18 pozitifliği gösteren olguların yaş aralığı daha çok 30-70 aralığında, diğer yüksek risk HPV pozitifliği gösteren olguların yaş aralığı daha çok 20-80 aralığında olduğu tespit edilmiştir. Kısaca yüksek riskli HPV pozitifliği her yaşta görülebilmesiyle beraber, 20-60 yaş arasında sıklığı daha da artmaktadır. Ayrıca grafik 3’te de gösterildiği gibi yaş aralıkları incelendiğinde her yaş grubu aralığında HPV 16 ve 18 subtipler dışındaki yüksek risk taşıyan HPV subtipi daha sık tespit edilmiştir.
< 20 Yaş 20-30 Yaş 30-40 Yaş 40-50 Yaş 50-60 Yaş 60-70 Yaş 70-80 Yaş > 80 Yaş 0 5 10 15 20 25 30 35 40 45 HPV 16 HPV 18 HPV diğer
Grafik 3: Hasta yaş gruplarına göre HPV subtipleri
Olguların belli yaş gruplarında Bethesta Sistemine göre olguların tanı spektrumu grafik 4 te gösterilmiştir.
< 20 Yaş 20-30 Yaş 30-40 Yaş 40-50 Yaş 50-60 Yaş 60-70 Yaş 70-80 Yaş > 80 Yaş 0 50 100 150 200 250 300 350 400 450 ASCUS LGSIL HGSIL NOR MAL
OLGULARIMIZA AİT SIVI BAZLI YAYMALARIN SİTOMORFOLOJİK GÖRÜNTÜLERİ
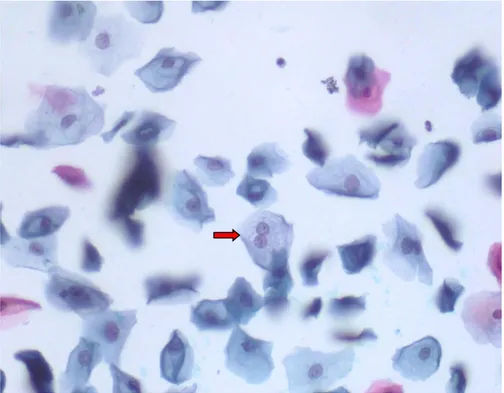
Şekil 3: Normal nükleus kontürlerine ve normal nükleus büyüklüğüne sahip skuamöz hücrede sitoplazmik kavitasyon(kırmızı ok), x400
Şekil 4:Normal nükleus kontür ve nükleus büyüklüğüne sahip skuamöz hücrede
Şekil 5: Normal nükleus kontür ve nükleus büyüklüğüne sahip skuamöz hücrede
binükleasyon(kırmızı ok), x400
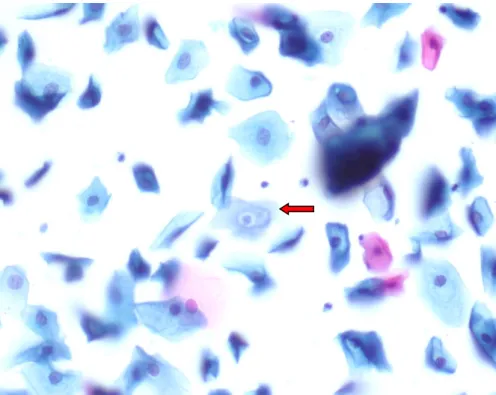
Şekil 6: Nükleer hiperkromazi içeren multinükleasyon gösteren skuamöz
Şekil 7: Normal nükleus boyutuna sahip skuamöz hücrede perinükleer halo(kırmızı ok), x400
Şekil9: Parakeratoz özelliği gösteren hücre topluluğu(kırmızı ok),, x400
Şekil10: Multinükleasyon ve hafif nükleer hiperkromazi gösteren atipik
6. TARTIŞMA VE SONUÇ
Servikal kanser tüm dünyada kadınlarda önemli bir sağlık sorunudur ve tarama programları ile erken tanısının konulması büyük önem taşımaktadır. Amerikada 2016 yılında 12990 yeni uterin serviks kanseri vakasının saptanacağı ve 4120 kadının bu kanserden dolayı hayatını kaybedeceği tahmin edilmektedir [80]. Yine Amerikada, 2012 yılında 20-39 yaşları arasında 446 kadın uterin serviks karsinomu nedeniyle hayatını kaybetmiştir[80]. 1930’dan 2012’ye kadar ki sürede uterin kanserden ölüm oranı yaklaşık %80 oranında azalmıştır. Bu durum servikal kanserden korunma ve erken tanı için tarama testlerinin rutin hayata girmesiyle sağlanmıştır. Servikal lezyonları tespit etmek için, tarama testi olarak Papanicolaou (PAP) kullanılmıştır[80]. PAP testi 1940 yılında klinik kullanıma George Papanicolaou tarafından sunulmuştur. Park ve arkadaşlarının 2001 yılında yaptıkları çalışmada konvansiyonel PAP smear ile prekanseröz lezyonları yakalama sensitivitesinin %50’den az olduğu saptanmıştır. Konvansiyonel PAP smear testinin; hücrelerin lama yeterince aktarılamaması, gizli kanama olması, anormal hücrelerinin yayılımında sıkıntıların olabilmesi, inflamasyon ve epitel hücrelerin üst üste gelmesi gibi sınırlamaları mevcuttur. Konvansiyonel PAP smear testinin bu sınırlamaları ortadan kaldırmak için sıvı bazlı ince tabaka teknolojisi ve benzeri metod ve teknikler geliştirilmiştir[81].
Sherwani ve arkadaşlarının konvansiyonel smear ile sıvı bazlı ince tabaka teknolojisini karşılaştırdıkları bir çalışmada, sıvı bazlı ince tabaka teknolojisi ile LGSIL olgularını yakalama oranı %10.6’dan %18.1’ye yükseldiği, HGSIL yakalama oranının da % 0.6’dan %4.3’e yükseldiği tespit edilmiştir[67]. Aynı çalışmada sıvı bazlı PAP smearin sensivitesi %97,6 iken, konvansiyonel PAP smear ile %53.7 olarak bulunmuştur ve spesifite ise her ikisinde %50 olarak tespit edilmiştir. Biz de çalışmamızda sıvı bazlı ince tabaka metodunu kullandık.
Genç kadınlarda Human papilloma virüsü servikal epiteli sıklıkla enfekte ederler, ancak her zaman hastalık oluşturmaz[82]. Human papilloma virüsünü saptamada PAP testi, moleküler HPV testine göre daha az sensitif [83] olsada, servikal hücrelerde hastalık işareti olabilecek sitomorfolojik değişikler ile klinisyene hasta tedavisinde daha uygun bir yaklaşım sağlamada yardımcı olmaktadır. HPV DNA
testi sadece HGSIL ve daha ileri lezyonları saptamada PAP smearden daha sensitiftir[84]. Çalışmamızdaki tüm olgularımızın sıvı bazlı yaymaları ile eş zamanlı yüksek risk taşıyan HPV subtip belirlenmesi REEL TİME PCR yöntemiyle gerçekleştirilmiştir.
Amerika’da 30 yaş üzerinde ASCUS tanısı almış hastaların yüksek riskli HPV için test yaptırması önerilmektedir[85]. Veijalainen ve arkadaşlarının 2004-2012 yılları arasındaki 127 ASCUS, 118 LGSIL hastayı değerlendirdikleri bir çalışmada, ASCUS grubunda yüksek riskli HPV pozitifliğini % 40.9, LGSIL grubunda % 68.6 olarak saptamışlardır. Biz çalışmamızda 32 ASCUS hastamızın 5 tanesinde (% 15,6), 42 LGSIL hastasının da 4 tanesinde (%9,5) yüksek riskli HPV DNA’sı saptadık. Literatürdeki LGSIL ve ASCUS tanısı almış hastaların yüksek riskli HPV pozitiflik oranının bizim sonuçlarımıza göre daha yüksek çıkmasının nedenini, çalışmamızdaki vaka sayısının az olmasına bağlamaktayız.
Agarostos ve arkadaşlarının 3993 hastada yaptığı çalışmada yüksek riskli HPV pozitifliğini %12.7 , HPV tip 16 pozitifliğini % 2.7, HPV tip 18 pozitifliğini % 1.4 olarak saptanmış. Loawahutanont ve arkadaşlarının 2987 hastada retrospektif olarak yaptıkları çalışmada toplam yüksek riskli HPV sıklığını % 9.3, HPV tip 16 sıklığını % 1.6, HPV tip 18 sıklığını % 0.4 olarak saptamıştır. HPV pozitif hastalarında %17.4’ü HPV tip 16, % 4.4’ü HPV tip 18, % 78.1’i de tip 16 ve 18 dışındaki yüksek riskli HPV tipleri olarak rapor edilmiş olup, HPV sıklığını 31-40 yaş grubunda daha sık saptamışlardır. Biz çalışmamızda 1500 olguda HPV tip 16 ‘yı % 2.4, HPV tip 18’i % 0.9, diğer yüksek riskli HPV tiplerini de % 6.7 sıklığında saptadık. Toplam yüksek riskli HPV sıklığını ise % 9.4 olarak saptadık. Yaş gruplarına göre HPV tiplerinin sıklığına baktığımızda 30-50 yaş gruplarında HPV sıklığının daha fazla olduğunu bulduk. Çalışmamızda yüksek riskli HPV pozitifliğini literatür değerleri ile uyumlu bulduk.
Loawahutanont ve arkadaşlarının çalışmasında ASCUS’lu hastaların %8.6 sında, LGSIL tanılı hastaların % 6.4 ünde, HGSIL tanılı hastaların % 12’sinde HPV tip 18 DNA pozitifliği saptanmıştır. Çalışmamızda 32 ASCUS tanısı almış hastanın 2 tanesinde (%6) HPV tip 16 pozitifliği, 3 tanesinde(%9) tip 16 ve 18 dışındaki yüksek riskli HPV pozitifliği saptadık. 42 LGSIL tanılı ve 8 HGSIL tanılı olgumuzun 1’er
tanesinde HPV tip 16 pozitifliği, 3’er tanesinde de tip 16 ve tip 18 dışındaki yüksek riskli HPV pozitifliği tespit edildi..
Wong ve arkadaşlarının 2008 yılında retrospektif olarak 1012 hastada yaptıkları çalışmada, hücrelerde multinükleasyon, nükleer hiperkromazi ve atipik metaplazik hücre değişikliklerini yüksek riskli HPV grubunda, düşük riskli HPV grubuna göre 6-12 kat daha fazla olduğunu saptamışlardır. Yine aynı çalışmada ASC/LGSIL hasta grubunda yüksek riskli HPV pozitifliği olan 60 hastanın %23.3’ünde klasik koilosit, %50’sinde perinükleer halolu atipik hücre, %16.7’sinde sitoplazmik kavitasyon, %46.7’sinde multinükleasyon, %18.3’ünde diskeratoz, %35’inde parakeratoz, %43.3’ünde nükleer hiperkromazi, %83.3’ünde minimal nükleer hiperkromazi, %25’inde opak sitoplazma, %35’inde atipik metaplazik hücre saptanmıştır. Bizim çalışmamızda 32 ASCUS tanısı almış ve eş zamanlı yüksek riskli HPV DNA değişikliği olan(HPV 16 subtipi =2 + Diğer yüksek riskli HPV subtip=3)toplamda 5 olguyu bu hücresel değişiklikler açısından inceledik. 3 tanesinde perinükleer halosu olan hücre, 2 tanesinde sitoplazmik kavitasyon, 4 tanesinde multinükleasyon, 4 tanesinde parakeratoz, 1 tanesinde minimal nükleer hiperkromazi bulgularını saptadık. Bu değerlendirmeye göre sitomorfolojik olarak görülen perinükleer halo, multinükleasyon, parakeratoz HPV pozitif olgularda izlenmiştir. Diskeratoz, opak sitoplazma sitomorfolojik olarak HPV pozitif ASCUS tanılı vakalarda gözlenmemiştir. Minimal nükleer hiperkromazi ASCUS tanılı olgularımızda sadece HPV 16 subtipinde izlenmiştir. HPV DNA subtip tayini yapılamayan durumlarda sitomorfolojik olarak izlenen minimal nükleer hiperkromazi bulgusu HPV 16 subtipini işaret edebileceğini düşündürmüştür. Ancak bu genel yaklaşımı bizim çalışmamızdaki kısıtlı sayıdaki ASCUS tanılı olgularla vermek mümkün değildir. Daha geniş vaka serileriyle yapılacak çalışmalar ile HPV subtiplerindeki sitomorfolojik değişiklikleri daha sağlıklı ortaya koyabileceğini düşünmekteyiz. Sonuç olarak; Tarama yöntemi olarak kullanılan servikal smear ve HPV subtip tayini yapan moleküler testler hasta yönetiminde çok önemli bir yer tutmaktadır. HPV subtip tayini mümkün olmayan durumlarda klinisyeni yönlendirmek için sitomorfolojik değişiklikler önem kazanmaktadır. Bethesta sınıflamasında yer alan tanılarda izlenen sitomorfolojik değişikliklerin, HPV subtiplerde izlenen
değişikliklerle kıyaslanması sitomorfolojik değerlendirmeyi ve tanı doğruluğunu artıracağı ve böylece hasta tedavisi yönetiminde ve ülke ekonomisinde bu hastalarda ilgili giderlerde iyleşmeler sağlanabileceği düşünülmektedir.
7. ŞEKİLLER VE TABLO DİZİNİ
Şekil1: https://tr.wikipedia.org/wiki/%C4%B0nsan_papilloma_vir%C3%BCs %C3%BC
Şekil2:
Gabrijela Kocjan, Winifred Gray, Diagnostik Cytopathology Essentials. 2013: p.26
Tablo1:
Stanley J. Robboy, G.L.M., Robboy's Pathology of the Female Reproductive Tract. 2009: p. 173
8. KAYNAKLAR
1. S. I. Ferlay J, E.M., Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM,, B. Forman D, Available, and f. http://globocan.iarc.fr., F. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer;. 2013 [cited 2014 06/05/2014]. 2. P. Boyle, B.L., editors, Screening for Cervical Cancer. World Cancer Report.Lyon:
International Agency for Research on Cancer, 2008: p. 288-296.
3. .Walboomers JM, J.M., Manos MM et al., Human Papillomavirüs is a necessary cause of invazive cervical cancer worldwide.J.pathol. 1999: p. 189:12-19.
4. Bosch, F.X. and S. de Sanjose, Chapter 1: Human papillomavirus and cervical cancer--burden and assessment of causality. J Natl Cancer Inst Monogr, 2003(31): p. 3-13.
5. Ulusal Kanser Danışma Kurulu, E.T.v.T.A.K.R., Türkiye.
6. J. Rosai. Rosai and Ackerman's Surgical Pathology. 10th ed. New York, U. and M. Elsevier, 2011.
7. Demir, V.P.E.ç.e.P.D.R., 2008(onuncu baskı): p. 401-402.
8. WK Ovale, P.N., Netter Temel Histoloji. Müftüoğlu S, Kaymaz F, Atilla 2009.: p. 399-425
9. Hendrıckson MR, A.K., Kempson RL, Ed: Mılls and SE., Uterus and fallopian tubes. Hıstology for Pathologısts. , Lippincot Williams &Wilkins, philadelphia, 2007: p. 1011-1062.
10. Stanley J. Robboy, G.L.M., Robboy's Pathology of the Female Reproductive Tract. 2009: p. 173-224.
11. M. Gültekin, G.B., editors Türkiye Kanser İstatistikleri. 2014: p. 55.
12. Kumar V, A.A., Female genital tract. In: Robbins and Cotran Pathologic Basis of Disease, and 7th ed. Philadelphia, Elsevier Saunders, pp.1059-1117.
13. J., R., Female reproductive system In Rosai and Ackerman’s Surgical Pathology. 2004: p. 1523-1549.
14. Mills, S.E., Sternberg's Diagnostik Surgıcal Pathology Cerviks, 2015. 2(6 edition): p. 2388-2437.
15. MA., Q., Screening and prevention of gynaecolgical cancer. Rew Gynaecol Prac. 2003. 3: p. 148-155.
16. Burd, E.M., Human papillomavirus and cervical cancer. Clin Microbiol Rev, 2003. 16(1): p. 1-17.
17. Cates, W., Jr., Estimates of the incidence and prevalence of sexually transmitted diseases in the United States. American Social Health Association Panel. Sex Transm Dis, 1999. 26(4 Suppl): p. S2-7.