T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
KRONİK DELTA ve B HEPATİTLİ HASTALARDA
SERUM DEMİR İNDEKSLERİ
UZMANLIK TEZİ
Dr. Bahar İŞKARA AYDOĞDU
TEZ DANIŞMANI
Prof. Dr. Kendal YALÇIN
Önsöz
Bilimsel düşünme ve çalışmayı bizlere öğreten, engin bilgi ve birikimlerini bizimle paylaşan; bugünlere gelmemizde büyük emeği olan, hekimliği bizlere öğreten değerli hocamız Prof. Dr. Ekrem MÜFTÜOĞLU’ na başta olmak üzere, İç Hastalıkları A.B.D. Başkanımız Prof. Dr. M.Emin YILMAZ’a yetişmemde büyük emekleri olan bütün değerli öğretim üyeleri; Prof. Dr. Vedat GÖRAL, Prof. Dr. Orhan AYYILDIZ. Prof. Dr. Abdurrahman IŞIKDOĞAN , Prof. Dr. Alpaslan Kemal TUZCU, Prof. Dr. Muhsin KAYA, Doç. Dr. Ali Kemal KADİROĞLU, teşekkürlerimi sunarım.
Tezimi oluşturmamda büyük emeği geçen tez danışmanım İç Hastalıkları öğretim üyelerinden Prof. Dr. Kendal YALÇIN hocama teşekkürlerimi sunarım.
Tezimi hazırlarken destekleri ile bana yardımcı olan Uzman Dr. Nazım EKİN, Uzman Dr. Ebubekir ŞENATEŞ ve tüm Gastroenteroloji bölümüne teşekkürlerimi sunarım.
Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.B.D., Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D., Göğüs Hastalıkları ve Tüberküloz A.B.D. ve Radyoloji A.B.D. başkanlarına ve değerli öğretim üyelerine,
Birlikte çalışmaktan büyük mutluluk ve onur duyduğum tüm asistan arkadaşlarıma ve İç Hastalıkları A.B.D. çalışanlarına teşekkürlerimi sunarım.
Ayrıca bu günlere gelmemde büyük pay sahibi olan ve desteklerini hiçbir zaman benden esirgemeyen annem, babam ve kardeşlerim’e, beni hiçbir zaman yalnız bırakmayan, ihtisas süremde bütün sıkıntılarıma katlanan sevgili eşim’e ve aramıza katıldığı günden beri mutluluğumuzu katlayan biricik kızım Zerya Arin’ime sonsuz teşekkürlerimi sunuyorum.
İÇİNDEKİLER
TEŞEKKÜR
………
2
İÇİNDEKİLER……….3
TABLO LİSTESİ………..5
ŞEKİL LİSTESİ………....5
SİMGELER VE KISALTMALAR LİSTESİ………..….6
ÖZET VE ANAHTAR SÖZCÜKLER……….…..8
ABSTRACT- KEYWORDS………..10
1-GİRİŞ VE AMAÇ………12
2-GENEL BİLGİLER……….14
2.1-Hepatit Delta Virus
………14
2.1.1-
Tanımlama………..14
2.1.2-Virusun Yapısı Ve Yaşam Siklusu………..………14
2.1.3-Seroepidemiyoloji……….15
2.1.4- Coğrafi Dağılım Ve Genotip………16
2.1.5-Klinik Seyir ve Tanı……….……….17
2.1.6-Patogenez………..………...19
2.1.7-Patoloji……….……….20
2.2- Hepatit B Virus………..……….20
2.2.1-Akut Enfeksiyon……….………..21
2.2.2-Kronik Enfeksiyon………..………..21
2.3- Demir Metabolizması……….…….24
2.3.1- Demir Emilimi Ve Organizmada Demir Dağılımı………25
2.3.2- Diyetteki Demir Emilimini Etkileyen Faktörler………...26
2.3.2.1-Hem Demir Emilimi………..………..26
2.3.2.2-Hem Dışı (İnorganik) Demirin Emilimi..………26
2.3.2.3-Demirin Hücreler Tarafından Alınması……….….27
2.3.3-Organizmada Demir Dengesi………..………28
2.3.3.1-Hücre İçi Demir Dengesi………..…………28
2.3.3.2-Organizmanın Sistemik Demir Dengesi…………..………29
2-3-3-3. Demir Yüklenmesinin Etkileri………33
2-3-3-4. Demir ve Oksidatif Stres……….34
3-MATERYAL VE METOD………36
4-BULGULAR………...39
5-TARTIŞMA VE SONUÇ………..42
6-TABLOLAR ve ŞEKİLLER………..46
TABLO LİSTESİ
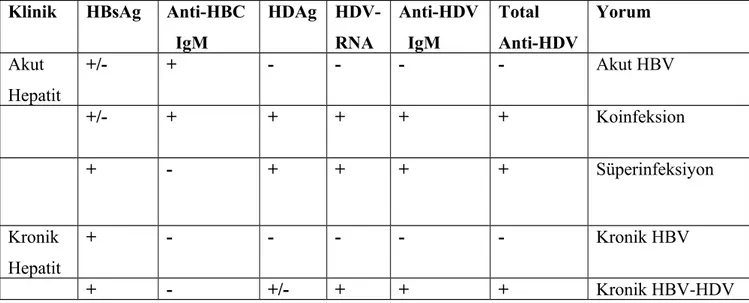
Tablo 1. HDV infeksiyonunda doğal seyir. Tablo 2. HDV infeksiyonunda serolojik tanı Tablo 3. Delta ko ve süperinfeksiyonu
Tablo 4. Kronik HBV enfeksiyonunun evreleri
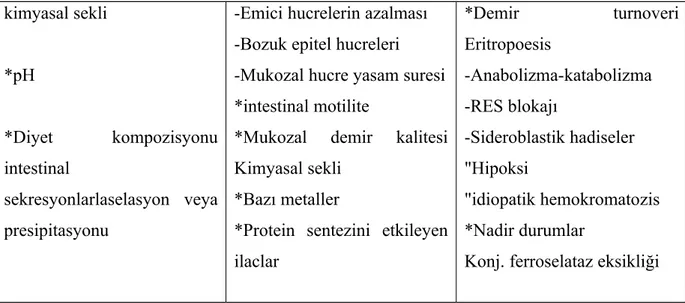
Tablo 5. Diyetteki demir emilimini etkileyen faktörler
Tablo 6. Spesifik dokularda demir birikimi ve ilişkili hastalıklar
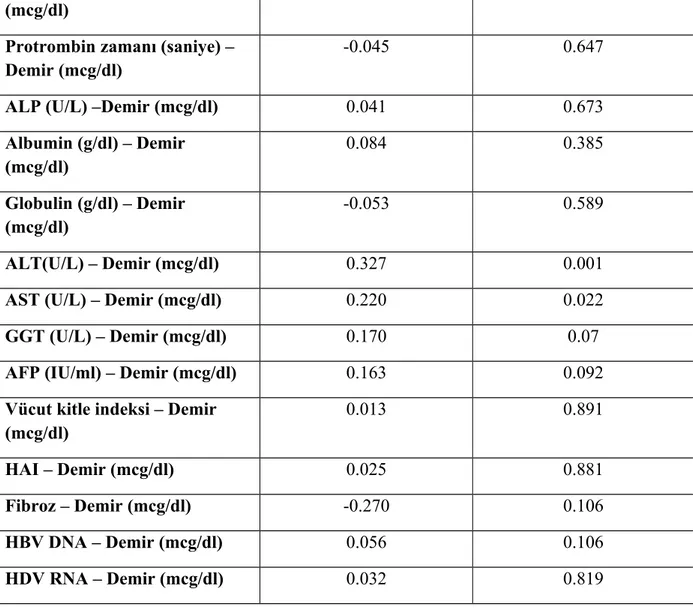
Tablo 7. Çalışma hastalarının klinik, laboratuar ve histolojik verilerinin karşılaştırılması Tablo 8. Fe ile diğer parametrelerin korelasyonu
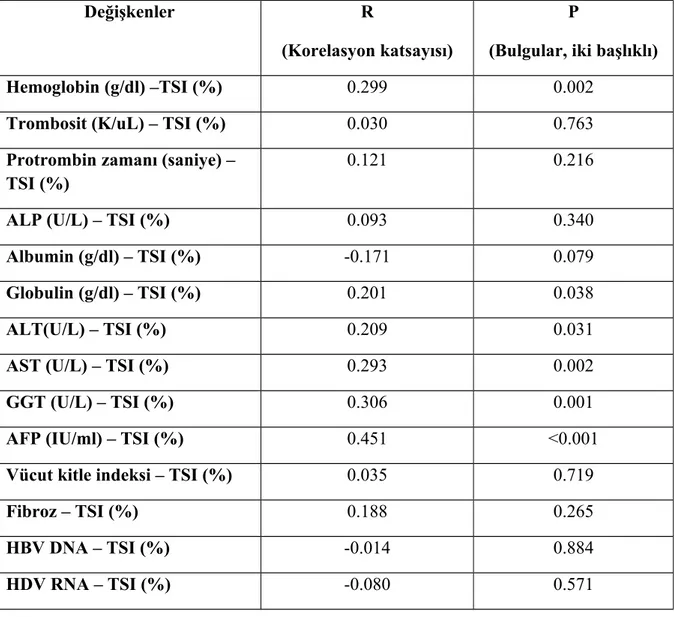
Tablo 9. TSI ile diğer parametrelerin korelasyonu Tablo 10. Ferritin ile diğer parametrelerin korelasyonu
ŞEKİL LİSTESİ
Şekil 1. Kontrol ve çalışma grubu arasındaki demir parametrelerinin ortalamaları
Şekil 2. Kronik Delta Hepatitli ve Kronik Hepatit B li hastalarda histolojik aktivite indeksi ve fibroz
SİMGELER VE KISALTMALAR LİSTESİ
Alb: AlbuminAKŞ: Açlık kan şekeri ALT: Alanin amino transferaz ALP: Alkalen fosfataz
ALA-S: Aminolevulinik asit sentetaz AST: Aspartat amino transferaz CRP: C-Reaktif Protein
ELISA: Enzyme-Linked Immuno Sorbent Assay GGT: Gamaglutamil transferaz
Glb: Globulin
HBsAG: Hepatit B yüzey antijeni HBeAG: Hepatit B e antijeni HBV: Hepatit B virüs
HCC: Hepatocellular carcinoma HCV: Hepatit C virüs
HDV: Hepatit D virüs
INR: Uluslararası normalleştirme oranı (International Normalized Ratio) IRP: Iron regulatör protein
IRE: Iron responsiver element IL-1: İnterlökin-1
LDH: Laktat Dehidrogenaz NO: Nitrik oksit
PCR: Polimeraz Zincir Reaksiyonu PTZ: Protrombin zamanı
TfR: Transferrin reseptörü
TNF-alfa: Tümör nekroz faktör alfa USG: Ultrasonografi
ÖZET
Amaç: Diğer viral hepatitlere göre daha şiddetli seyreden kronik delta hepatitli ve kronik hepatit B li hastalarda serum demir indekslerinin değerlendirilmesi.
Gereç ve Yöntem: Çalışmaya Dicle Üniversitesi Tıp Fakültesi Gastroenteroloji Polikliniğine Ocak 2011 ile Ekim 2012 tarihleri arasında başvuran, ilk tanısı konularak ileri tetkikler yapılan ve polikliniklerde daha önce tanısı konulmuş kronik delta hepatit ve kronik hepatit B nedeni ile Gastroenteroloji Polikliniği tarafından takip edilen hastalar dahil edildi. 63’ü erkek, 46’sı kadın toplam 109 hasta çalışmaya alındı. Tedavi almamış veya son 6 aydır tedavi almayan hastalar çalışmaya dahil edildi. Çalışmaya Kronik Delta Hepatit (n=52) ve HBeAg(+) ve HBeAg(–) Kronik Hepatit B (n=57) olmak üzere iki hasta grubu alındı. Herhangi bir antiviral tedavi alan hastalar ayrıca demir eksikliği anemisi (FEA) tanısı konan ya da demir (Fe) replasman tedavisi alan hastalar ile son dönem karaciğer yetmezliği olan hastalar çalışma dışı bırakılmıştır. Diğer kronik hepatit nedenleri olan HCV koenfeksiyonu, Wilson hastalığı, hemokromotozis, otoimmun hepatit, alkolik hepatit, toksik hepatit ile hepatosellüler kanseri (HCC) olan ve ciddi sistemik hastalığı olan hastalar çalışmaya alınmamıştır.
Çalışılan parametreler; yaş, cinsiyet, chronic delta hepatitis (n = 52) and HBeAg (+) and HBeAg (-) chronic hepatitis B boy, kilo, BMI, serum demir, demir bağlama kapasitesi, transferin saturasyon indeksi, ferritin, hemolobin, lökosit, platelet, PTZ(INR), ALT, AST, ALP, GGT, total billirubin, albumin, globulin, LDH, HBV DNA, HBsAg, HBeAg, anti-HBe, anti-HBs, anti-HDV total, HDV RNA, AFP ve CRP, ayrıca biyopside HAI ve fibrozis stage. Transferin saturasyon indeksi (Fe/TDBK)x100 formulü ile yüzde olarak hesaplandı. Karaciğer biyopsisi yapılmış olan hastalarda histolojik aktivite indeksi Ishak Modifiye Knodell Skorlama sistemi kullanıldı(72).
Çalışmada elde edilen verilerin istatistiki değerlendirilmesinde SPSS (Startistical Package for Social Scienses) for Windows 17 paket programı kullanıldı. İstatistiksel olarak aritmetik ortalama, standart sapma, standart hata, minimum, maksimum değerler gibi belirtici istatistikler hesaplandı. Oran ve yüzdeler belirlendi. Frekans dağılımları oluşturuldu. HBsAg pozitif ve Anti-delta pozitif ölçümlerinin çapraz karşılaştırılmasında Khi-Kare testi uygulandı, ikili karşılaştırılmalarında ise Student-t testi kullanıldı. Pearson korelasyon analizi yapıldı. Anlamlılık düzeyi p<0.05 olarak alındı.
Bulgular: Hastaların 63’ü (%68) erkek,46 ‘sı (%32) kadın, yaş ortalamaları 42,3 ± 9,6 yıl idi. Gruplar ele alındığında yaş, globulin, PTZ, INR ve GGT düzeylerinde anlamlı fark saptanmıştır. Kronik delta hepatit ve kronik hepatit B grupları arasında vücut demir yükü göstergelerinden olan demir, demir bağlama kapasitesi, ferritin ve transferrin saturasyon indeksi parametreleri açısından istatistiksel olarak anlamlı fark saptanmadı. Ancak ferritin düzeyi ile transferin saturasyon indeksi kronik delta hepatit grubunda kronik hepatit B grubuna göre daha yüksek saptandı .
Kronik hepatit B grubu ile delta hepatitli hasta grubu arasında transferin saturasyonu, demir, ferritin düzeyleri ile karaciğer fonksiyon testlerinden AST, ALT, total Bilirubin, ALP, GGT, albümin ve globülin, AFP, CRP, hemoglobin, trombosit, PTZ, BMI, HBV DNA ve HDV RNA arasındaki ilişki araştırıldı.
Demir ile hemoglobin arasında ve ALT ile AST arasında istatistiksel olarak anlamlı pozitif korelasyon saptandı. TSI ile hemoglobin arasında, TSI ile ALT arasında, TSI ile AST arasında, TSI ile globülin arasında, TSI ile GGT arasında, ve TSI ile AFP arasında istatistiksel olarak anlamlı pozitif korelasyon saptandı. Ferritin ile hemoglobin arasında, ferritin ile ALP arasında, ferritin ile AST arasında, ferritin ile GGT arasında, ve ferritin ile BMI arasında pozitif korelasyon saptandı ve bunlar istatistiksel olarak anlamlıydı.
Sonuç: Bu çalışma kronik delta hepatitli ve kronik hepatit B’ li hastaların serum demir indeksleri yönünden karakterize edilmesi konusunda bilgiler sağlamıştır. Bu sonuç kronik hepatit B ve deltalı hastaların takip ve yönetiminde yararlı olabilir.
Anahtar sözcükler: kronik delta hepatit, kronik hepatit B, demir, ferritin, transferin saturasyon indeksi
ABSTRACT
Aim: It has been aimed to determine the level of serum iron parameters in chronic delta hepatitis patients which is more severe when compared with other viral hepatitis and chronic hepatitis B.
Method and Matterial: The patients who applied to Dicle University Faculty of Medicine, Gastroenterology Clinic between January 2011 and October 2012 and whose first diagnosis were made and needed further investigations and the ones who were followed by Gastroenterology Clinic due to chronic delta hepatitis and chronic hepatitis B were included in the study. 63 male, 46 female, a total of 109 patients were enrolled. Patients who had not been treated or who had’t been treated in the last 6 months were included. Two patient groups as chronic delta hepatitis (n = 52) and HBeAg (+) and HBeAg (-) chronic hepatitis B (n = 57) were included in the study. Any patients receiving antiviral treatment of iron deficiency anemia as well (FEA) diagnosed patients or patients receiving iron (Fe) replacement therapy or patients with end-stage liver failure were excluded. Other patients with chronic HCV coinfection hepatitis reasons, Wilson's disease, hemokromotozis, autoimmune hepatitis, alcoholic hepatitis, toxic hepatitis and hepatocellular carcinoma (HCC) and in patients with severe systemic disease were excluded.
The parameters studied were: age, gender, height, weight, BMI, serum iron, iron binding capacity, transferrin saturation index, ferritin, hemolobin, leukocytes, platelets, PTZ (INR), ALT, AST, ALP, GGT, total billirubin, albumin, globulin, LDH, HBV DNA, HBsAg, HBeAg, anti-HBe, anti-HBs, anti-HDV total, HDV RNA, AFP and CRP, as well as HAI and fibrosis on biopsy stage. Transferin saturation index (Fe / TIBC) was calculated as (Fe/TDBK)x100 index. Ishak’s modified Knodell histological activity index scoring system was used for the Patients who underwent liver biopsy.
In the statistical evaluation of the data obtained in this study (Startistical Package for Social Scienses) for Windows 17 package program was used. Rate and percentages were determined. Frequency distributions were created. Chi-square test was used in cross comparison of the measurements of HBsAg Positive and anti-delta positive, whearas the Student's t test was used in binary comparisons. Pearson correlation analysis was performed. The level of significance was taken as p <0.05. Linear regression analysis was performed for factors predictive of Iron, ferritin and TSI.
Findings: 63 patients (68%) were male and 46 patients (32%) were female, mean age was 42.3 ± 9.6 years, respectively. Considering the groups, age, globulin, PTZ, INR, and
GGT levels were significantly different.. There was no statistically significant difference between the groups of chronic delta hepatitis and chronic hepatitis B, in terms of iron, iron binding capacity, ferritin and transferrin saturation index, the parameters which are indicators of body iron overload. However, the level of ferritin and transferrin saturation index in chronic delta hepatitis were significantly higher than those of chronic hepatitis B group
The relationship of transferrin saturation, iron and ferritin levels and liver function tests, AST, ALT, total bilirubin, ALP, GGT, albumin and globulin, AFP, CRP, hemoglobin, platelets, PTZ, BMI, HBV DNA was investigated in HDV RNAchronic hepatitis B Group and the group of patients with delta hepatitis. A statistically significant positive correlation was found between iron and hemoglobin, and between ALT and AST. A statistically significant between TSI and hemoglobin, TSI and ALT, TSI and AST, TSI and globülin, TSI and GGT, and TSI and AFP. Positive correlation was found between Ferritin and hemoglobin, ferritin and ALP, ferritin and AST, ferritin and GGT, and ferritin and BMI and these were statistically significant.
Conclusion: This study gives information about comparison of serum iron index in patirnts with chronic hepatitis B and delta. These results can be useful in management and follow up of patients with chronic hepatitis B and delta.
Keywords
:
chronic delta hepatitis, chronic hepatitis B, iron, ferritin, transferrin saturation index1- GİRİŞ VE AMAÇ
Karaciğer demirin depo edildiği en önemli merkez olup, ferritin, transferrin ve diğer demir bağlama proteinlerinin sentezleme yeridir (1). İnfeksiyon veya inflamatuar durumlarda, inflamatuar cevabın en önemli mediatörü olan intelökin-1’in etkilerine bağlı olarak serum demir konsantrasyonu azalır. Ancak demir depo proteini olan ferritinin büyük bir kısmı karaciğerde depolandığından, karaciğer hastalıkları serum ferritin değerlerini yukarıdaki durumdan bağımsız olarak etkilemektedir( 2,3).
Demir oksijen radikallerinin üretimi yoluyla hepatosit nekrozunu stimüle ederken, karaciğer hücrelerindeki hasarda aminotransferazlarla beraber hepatocelüler depolardan demir ve ferritin salınımını arttırmaktadır( 4,5) Uzun süreden beri demirin bütün organizmaların replikasyonu için esansiyel bir element olduğu bilinmektedir. Bu durum virulan mikroorganizmalar için de geçerlidir. Hastalığın seyri üzerine demirin potansiyel etkisini açıklamak için serbest oksijen radikallerinin artması, hepatik stellate hücrelerin aktivasyonu yoluyla fibrogenesisin artması, immun cevabın bozulması gibi çeşitli mekanizmalar öne sürülmüştür (6,7).
Demir ve hepatit B arasındaki ilişki ilk olarak Blumberg ve arkadaşları tarafından tanımlanmıştır. Blumberg ve arkadaşları kronik hepatit gelişmiş hastalarda serum demir indekslerinin virusun elimine edildiği hastalara göre daha yüksek olduğunu bulmuşlardır (11). Prieto ve arkadasları, kronik karaciğer hastalarında ferritin ve aspartat transaminaz (AST) değerleri arasında güçlü bir bağ olduğunu göstermişlerdir (12). Di Bisceglie ve arkadaşları, kronik viral hepatitli hastalarda, serum demir ve hepatik demir düzeyleri hesaplanan iki gruptan anormal serum demir düzeyleri olan yaklasık %35-40 lık hasta grubunda hepatik demir düzeylerini normal olarak bulmuşlardır. Bu calışmalar sonucunda yüksek demir yükünün kronik hepatiti olan hastalarda nekroinflamatuar değişiklikleri tetiklediği ve hepatositlerden salınan demir veya ferritin ya da herikisininde dolaşıma katıldığı anlaşılmaktadır (5).
Cao ve arkadaşları kronik hepatit B infeksiyonu olan 103 eriskin hastada yaptıkları çalışmada hepatosit hasarı ne kadar şiddetliyse serum ferritin ve serum demir düzeyinin o kadar yüksek; hemoglobin, transferin ve total demir bağlama kapasitesinin o kadar düşük olduğunu gözlemlemişlerdir. Demir yüklenmesinin kronik HBV infeksiyonuna bağlı hepatosit hasarını arttırdığını bildirmişlerdir. Bu nedenle demir metabolizmasının serum belirteçlerinin
HBV infeksiyonunun prognozunu değerlendirmede yardımcı olabileceğini belirtmişlerdir (13). Yapılan bazı çalışmalarda yüksek serum ferritin ve karaciğer demir düzeyleri antiviral tedaviye yanıtın azalması ile ilişkilendirmiştir (6,15).
Martinelli ve arkadaşları 81 hepatit B enfeksiyonlu hastada karaciğerde demir birikimini ve serum demir indekslerindeki anormalliğin prevelansını değerlendirmiş, ve olguların %48.7 nde karaciğerde demir birikimini, %27.1 inde yükselmiş transferin saturasyonunu saptamışlardır(14). Ohkoshi ve arkadaşları Lamuvidin ile başarılı bir tedavide kronik hepatit B li hastalarda serum ferritin düzeylerinin azaltılabileceğini ileri sürmüştür, bu durumda kronik hepatit B de karaciğer demiri patogenezde rol alabilir(10).
Yakın zamanlarda intestinal mukozada demir emiliminin, makrofajlarda demir döngüsünün, karaciğerden demir mobilizasyonunun düzenleyicisi olan hepsidinin kronik hepatitli hastalarda azaldığı gösterilmiştir(8,9)
Kronik hepatit B ve delta hepatitli hastalarda serum demir parametreleri ile ilgili çok az sayıda çalışma vardır. Bu sayı delta hepatitli hastalarda çok daha azdır. Bu çalışmamızın amacı daha önce tedavi almamış veya son 6 aydır tedavi almayan kronik hepatit B’li ve delta hepatitli hastalarda karşılaştırmalı olarak serum demir indekslerini, bunların karaciğer fonksiyon testleri ile (ALT, AST, ALP, GGT, LDH, Total bilirubin ve albumin) ilişkisini ve iki hastalığın klinik seyri üzerine etkisini araştırmaktır. Bulunacak sonuç kronik B ve D hepatitinin klinik seyrinin öngörülmesine katkıda bulunacaktır.
2-GENEL BİLGİLER
2.1- Hepatit delta virus (HDV)
Hepatit delta virus (HDV) ilk olarak 1977 yılında Rizzetto ve arkadaşları tarafından gösterilmiş, enfeksiyon yapabilmesi için hepatit B virusuna ihtiyaç duyan defektif bir virustur (16,18). HBsAg (Hepatit B yüzey antijeni) taşıyıcılarının %5’inin HDV ile koenfekte olduğu düşünülmektedir. Bu da dünyada yaklaşık 15-18 milyon insanın HDV ile enfekte olduğu anlamına gelmektedir (17).HDV akut enfeksiyonu koenfeksiyon ve süperenfeksiyon olmak üzere 2 şekilde meydana gelir. Koenfeksiyon sonrası kronikleşme oranı %10’un altında iken, süperenfeksiyon sonrası bu oran %70-90’lara ulaşmaktadır. Kronik hepatit D (KHD) vakalarının da %30-70’i siroza ilerler (18). HDV enfeksiyonu, tüm dünyadaki HBV ( hepatit B virus) aşılama programlarına bağlı olarak HBV ve HDV insidansındaki azalmaya rağmen, ülkemizde ve dünyada hala önemli bir sağlık problemi olarak kalmaktadır (19,20). Bizim ülkemizde de HBV’nin %5 gibi yüksek bir oranda görülmesine bağlı olarak, HDV sıklığı da yüksek oranda olup önemli bir sağlık sorunu olarak karşımıza çıkmaktadır.
2.1.1- Tanımlama
HDV ilk olarak 1977 yılında Rizzetto ve arkadaşları tarafından keşfedilmiş, enfeksiyon yapabilmesi için HBV’ye ihtiyaç gösteren defektif bir RNA virusudur (16,18). Rizzetto ve arkadaşları önce HBV ile enfekte hastaların bazılarının diğerlerine göre daha ağır seyrettiklerini görmüşler ve ağır seyreden grupta HBsAg ile birlikte başka bir antijenin varlığını saptamışlardır(16). Bu antijen ilk olarak delta antijen olarak adlandırılmış, daha sonra bunun başka bir enfeksiyöz ajan olduğu görülmüş ve HDV olarak tanımlanmıştır (21).
2.1.2- Virusun yapısı ve yaşam siklusu
HDV elektron mikroskobunda 36nm büyüklüğünde 1700 nükleotidden oluşan ve bir RNA genomu içeren, zarflı ve sferik bir şekilde görülen bir virustur (16,21). HDV virionları HBsAg proteinleri ve konakçı lipidlerinin oluşturduğu bir dış zarf içinde yerleşen hepatit delta antijen (HDAg) ve viral RNA genomundan oluşur. HDAg 27 KDa olan (214 aminoasit) L-HDAg ve 24 kDa olan (195 aminoasit) S-L-HDAg adlı 2 parçadan oluşur. L-L-HDAg ayrıca 19 aminoasitlik bir C-terminus’a sahiptir. Her iki parçada ORF’dan kodlanır (22).
Virusun replikasyon siklusu virusun hepatosit membranına bağlanmasıyla başlar ve enfekte hücreden salınmasıyla son bulur. Hücresel reseptörlere HBsAg yardımıyla bağlanarak
hepatosit içine penetre olur. HDAg üzerindeki sinyal parçasının nükleer yerleşimi genomun replikasyonunu yaptığı yer olan nükleusa yönelmesini sağlar (23). Virus replikasyonu sırasında enfekte hepatositlerde genomik RNA (negatif polariteli), antigenomik RNA (pozitif polariteli) ve HDAg sentezi için gerekli olan ORF’u içeren messenger RNA olarak da bilinen antigenomik polariteli poliadenilat RNA olmak üzere 3 türde RNA meydana gelir (22). Bu 3 RNA ile HDAg posttranslasyonel modifiye edilir. Bu modifikasyonlar prenilasyon, fosforilasyon, asetilasyon ve metilasyondur. Bu modifikasyonlarla olu_an L-HDAg viral replikasyonu baskılarken, S-HDAg viral replikasyonu uyarır. L-HDAg’nin C-terminusunda sistein rezidülerinin prenilasyonu daha lipofilik bir yapı oluşturur. Bu yolla HDV RNA ve HBsAg viral paketlenme ve salınım için membranla birleşebilir. HDAg’nin fosforilasyonu daha etkili bir replikasyon için gereklidir. Asetilasyon işlemi HDAg’nin subsellüler yerleşimi ve virus replikasyonu için, metilasyon işlemide replikasyon için gerekli modifikasyonlardır. Yeni yapılan çalışmalarda virüs-yaşam siklusunda bu posttranslasyonel modifikasyonları inhibe eden yeni ilaçlar, örneğin HDAg izoprenilasyonunu inhibe edenler, HDV tedavisinde yeni ajanlar olarak araştırılmaktadır (24,25).
2.1.3- Seroepidemiyoloji
Delta virusunun en önemli bulaşma şekli parenteral ve seksüel yoldur. Yenidoğana anneden vertikal yolla da bulaş nadir olarak görülebilir. Hastalık özellikle IV ilaç kullananlarda, hayat kadını ve homoseksüellerde daha sık olarak görülmektedir (18). Tüm dünyada HBsAg taşıyıcılarının %5’inin HDV ile enfekte olduğu tahmin edilmektedir. Bu da dünyada 15-18 milyon HDV’li insan olduğu anlamına gelmektedir (17).
Yapılmış olan çok merkezli çalışmalarda HBsAg taşıyıcılarında Anti-HDV pozitiflik oranı 1987’lerde %23 oranında görülürken, 1992’de %14 olarak görülmüştür. Gaeto ve arkadaşları 2000 yılında 834 İtalyan hastada yaptıkları çalışmada bu oranı %8,3 olarak bulmuşlardır (20). En yüksek oranı sirozlularda saptamışlar ve bu oran sirozlularda %11.7 olarak görülmüştür. Oysa 1987 yılında bu oran sirozlularda %40 olarak bulunmuştur. Bu çalışmadan çıkan diğer bir sonuçta, HDV daha önceleri 50 yaşın üzerinde görülürken 1997’den sonra hastalığın daha çok 30–50 yaş arasında görülmesi olmuştur.
1987’den 1997’ye kadar bakıldığında HDV prevalansının yılda ortalama %1.5 olarak düştüğü görülür. Bu şekilde benzer düşüş Türkiye, İspanya ve Tayvan’da da görülmüştür. Bu düşüşün nedeni HBV aşılama programlarının yaygınlaştırılması, sosyoekonomik koşullardaki düzelme, risk gruplarında taramaların yapılmasıdır. Hastalıktaki bu düşüş nedeni ile hastalığın
yakın gelecekte kontrol altına alınabileceği düşünülebilir. Ancak hastalığın prevalansındaki bu düşüş daha sonra durmuş ve HDV hala dünyada önemli bir sağlık sorunu olmaya devam etmiştir. Düşüşteki bu durmanın sebebi ise endemik alanlardan olan göçler, seksüel olarak çok eşlilik, homoseksüellik, intravenöz ilaç kullanımı gibi nedenlerledir (26). Tayvanlılarda yapılmış olan 203 HBV’li hastadan 34 tanesinde (%16.7) Anti-HDV pozitif olarak bulunmuştur. İlginç olarak bu 34 hastanın 30’u erkek olup, bu 30 erkeğin 27’sinde (%90) son üç ayda bir hayat kadını ile cinsel ilişki öyküsü mevcut olduğu görülmüş (27). Yine Tayvan’da yapılmış bir çalışmada HBV’ye bağlı kronik karaciğer hastalığı olan ve parenteral ilaç kötü kullanımı olan 14 hastadan 13’ünde (%93) anti-HDV pozitif olarak bulunmuştur (28). Bizim ülkemizde de Doğu veGüneydoğu Anadolu Bölgesi’nde daha yaygın olarak görülen bu hastalıkla ilgili 6734 hasta (5231 hasta kronik hepatitli ve 1503 hasta sirozlu) ile yapılan bir çalışmada, kronik hepatit B li ve hepatit B nin neden olduğu sirozlu hastalarda anti-HDV pozitifliğini sırasıyla %27 ve %46 olarak bulmuşlar. Bu oran ülkenin batısında daha düşük, güneydoğuda ise daha yüksek bulunmuştur (29).
2.1.4- Coğrafi dağılım ve genotip
HDV enfeksiyonunun coğrafi dağılımının HBV’nin coğrafi dağılımı ile paralel olabileceği düşünülse de, gerçekte durum öyle değildir (30). Örneğin HDV Orta Doğu’da endemik iken, bu durum HBV için geçerli değildir. HDV’nin yüksek prevalansta görüldüğü bazı yerler mevcuttur. Bu yerler; başta İtalya olmak üzere Doğu Avrupa ve Akdeniz bölgesi, Tayvan, Venezuella, Kolombiya, Ekvator, bazı Pasifik adaları, Pakistan, İran, Türkiye ve Doğu Asya ülkeleridir (31,32). Ayrıca Japonya’da Okinava adası, Hindistan, Çin, Güney Arnavutluk yeni enfeksiyon odaklarıdır (33,34) HDV’nin 8 farklı genotipi tanımlanmıştır (35, 36). Genotiplere göre hastalığın klinik seyri ve coğrafi dağılımı önemli ölçüde değişmektedir.
Dünyada en yaygın görülen genotip tipi genotip 1’dir. Batı dünyasında daha sık görülür. Subtipleri olan genotip 1A daha çok Asya’da, genotip 1B daha çok Amerika’da görülür. Her iki subtipte Akdeniz ülkelerinde sıkça görülür (18, 37). Akut HDV akut HBV’ye göre genotip 1’de daha çok fulminan seyretme eğilimindedir. Genotip 1 HDV ve genotip C HBV daha çok siroz, hepatosellüler karsinom (HCC) ve hepatik yetmezliğe bağlı mortalite ile ilişkilidir (38). Siroz gelişimi hastalık ortaya çıktıktan sonraki ilk dönemlerde daha belirgindir. İtalya’da yapılmış bir çalışmada 5 ve 10 yıllık siroz gelişim oranları, transplantasyon oranlarından bağımsız olarak %49 ve %40 olarak saptanmıştır (39). Yine 2000 yılında yapılmış olan 200 HBV sirozlu hastada %20 oranında HDV saptanmış ve bu
hastalarda HCC gelişim riski 3 kat, mortalite oranı 2 kat yüksek bulunmuştur (40). Genotip 2 daha çok Tayvan ve Japonya gibi Uzakdoğu ülkelerinde görülen genotiptir. Genotip 1’e göre daha ılımlı seyredip, fulminan seyir, siroz ve HCC gelişimi daha az oranda görülür (41).
Genotip 3 Kolombiya, Venezuella, Peru gibi Güney Amerika ülkelerinde görülen ve fulminan seyirli ağır salgınlara yol açan bir tiptir. HBV genotip F ile daha sık birlikte görülme eğilimindedir (18, 36). Daha önceleri genotip 1b olarak bilinse de, daha sonra genotip 4 olarak adlandırılan ve daha az aydınlatılabilmiş ve Afrikalılarda görülen genotip 5,6,7,8 gibi genotiplerde tanımlanmıştır (18,36,42).
2.1.5- Klinik seyir ve tanı
Akut HDV enfeksiyonu 2 türlü olabilir. Birincisi HBV enfeksiyonu ile eşzamanlı olarak gelişerek koenfeksiyon şeklinde, ya da daha önceki HBV enfeksiyonu üzerine gelişerek süperenfeksiyon şeklinde gelişir.
Akut HDV koenfeksiyonu bifazik şekilde aminotransferaz yükselmesi şeklinde ortaya çıkar. Bu dönemde histolojik olarak akut HBV enfeksiyonundan ayırt edilemez. Koenfeksiyon klinik olarak ılımlı bir tablodan ağır fulminan hepatite kadar farklı bir spektrumda görülebilir. Genellikle akut koenfeksiyonu kendini sınırlar. Kronikleşme oranı %10’un altındadır ve akut HBV enfeksiyonunun kronikleşme oranı ile hemen hemen aynıdır.
Akut delta hepatiti 3-7 haftalık bir inkübasyon periyodundan sonra pre-ikterik faz ile başlar. Bu evrede 3-7 gün süren halsizlik, laterji, iştahsızlık ve bulantı gibi nonspesifik klinik semptomlar vardır. Pre-ikterik faz boyunca serum ALT ve AST aktivitesi gibi hepatite ait biyokimyasal göstergeler bozulmaya başlar. Bu fazda genellikle viral replikasyon azalmaktadır. İkterik fazın başlangıcı sarılık oluşumu ile karakterizedir. Halsizlik ve bulantı genellikle sebat eder ve billirubin düzeyleri yükselmeye başlar. Bununla birlikte hastada, karaciğerin billirubini konjuge ve ekskrete etme yeteneğinin bozulmasına bağlı olarak kil renginde bir dışkı ve idrar renginde koyulaşma gelişir. Klinik olarak hastalığın en şiddetli dönemi, viral replikasyona ait parametrelerin düzeylerinin azalmasıyla beraber olabilir. Akut ancak kendini sınırlayan infeksiyonu olan hastalarda iyileşme dönemi klinik semptomların kaybolması ile başlar. İştahsızlık ve bulantı görece olarak daha erken kaybolur ancak halsizlik ve laterji haftalar veya aylarca sürebilir. Ancak hastada akut enfeksiyon tablosu 2-10 hafta içinde kendiliğinden kaybolur. Akut delta hepatitinde mortalite %5-20 arasında değişir.
HDV süperenfeksiyonu 3 fazda seyreder. Akut fazda HBV’nin süpresyonu ve aktif HDV replikasyonu, yüksek ALT düzeyleri, kronik fazda HDV azalması ve HBV’nin reaktivasyonu, orta derecede ALT yüksekliği, geç fazda siroz gelişimi ve HCC gelişimi izlenir (18). Akut HDV koenfeksiyonu %10’un altında kronikleşirken, HDV süperenfeksiyonunda bu oran %70-90’lara ulaşır. Ayrıca HDV süperenfeksiyonu daha fazla fulminan hepatik yetmezliğe yol açma eğilimindedir (43). HDV süperenfeksiyonuna bağlı gelişen kronik delta hepatiti tüm kronik hepatit formları içerisinde en şiddetli seyredenidir. Kronik delta hepatitine özgü spesifik bulgu yoktur. Hastalarda sık görülen yakınmalar halsizlik, yorgunluk, eklem ağrısı ve sağ hipokondriumda saptanan karın ağrısıdır. Klinik hastalığın şiddeti HDV ‘nin genotipleriyle ilişkili olabilir.
İtalya’da yapılmış olan bir çalışmada hızlı siroz gelişen 22 HBV hastasından 20’sinde HDV enfeksiyonu saptamışlardır. Yine bu çalışmada siroz gelişen hastaların %70’inin süperenfeksiyon şeklinde geliştiği ve yaklaşık %15’inin hastalık başladıktan 1–2 yıl içinde siroz geliğtiği görülmüştür (44). Liaw ve arkadaşları ise yaptıkları bir çalışmada akut HDV süperenfeksiyonunda siroz gelişme oranını %20 olarak bulmuşlardır (45). Açıkçası HBV enfeksiyonunun kendisi kronik olduğu için, HDV süperenfeksiyonu kroniktir diyebiliriz.
HCC gelişimi açısından bakıldığında, HDV’ye bağlı gelişen HCC ile HBV’ye bağlı gelişen HCC arasında hasta yaşı olarak önemli bir fark yoktur. Romeo ve arkadaşları İtalya’da 28 yıl gibi uzun bir süre 299 KHB hastasını izlemişlerdir. Onlar yaptıkları bu izlem boyunca KHB hastalarında yıllık siroz gelişim oranını %4 ve HCC gelişim oranını %2.8 olarak göstermişlerdir (46). Yine bu çalışmada karaciğer hastalığıyla ilişkili mortalitenin tek belirleyicisinin HDV replikasyonu olduğunu göstermişlerdir.
Delta hepatiti diğer viral hepatit türlerine göre fulminan hepatit, erken siroz gelişimi, terminal karaciğer yetmazliğine ilerleyiş ve yüksek hepatocelüler karsinom gelişim riski ile karakterize şiddetli bir hastalık formuna neden olabilmektedir ancak bunun yanında infeksiyonun hafif hastalık formlarının da olabileceği gösterilmiştir(17) (Tablo 1).
HDV enfeksiyonunun teşhisinde akut ve kronik enfeksiyonlu hastaları ayırmak önemlidir. Akut enfeksiyonlu hastalar arasında, delta koenfeksiyonlu hastaları deltasüperenfeksiyonlu hastalardan ayırmak ta benzer şekilde önemlidir( Tablo-3). Çünkü klinik seyir her iki tabloda çok farklı olmaktadır. Akut HDV infeksiyonu koenfeksiyon durumunda akut hepatit B den doruk aminotransferaz yüksekliğinin bifazik olması ile ayırt edilebilir. Ancak koenfeksiyonda görülen bifazik seyir süperenfeksiyonda görülmez. Akut HBV-HDV koenfeksiyonda HBsAg’ nin kaybolması halinde tanı anti-HBc IgM pozitfliği ile konur. Benzer şekilde süperenfeksiyonu koenfeksiyondan ayırtetmede anti-HDV IgM testinin yararı yoktur, buna karşılık anti-HBc IgM bu amaçla kullanılabilir(Tablo-2).
Akut HDV koenfeksiyonu ile süperenfeksiyonu sırasındaki serolojik göstergeler özetlenecek olursa; HDV koenfeksiyonunda HBsAg ve Anti-HBc IgM pozitiftir. HDAg erken ve kısa süreli, HDV RNA erken ve geçici olarak, Anti-HDV geç akut fazda ve düşük titreli olarak, anti-HDV IgM geçici olarak pozitiftir. HDV süperenfeksiyonunda HBsAg pozitif iken, Anti-HBc IgM negatiftir. HDAg erken ve geçici olarak pozitifken, geç evrede negatiftir. HDV RNA erken ve sürekli olarak, Anti-HDV ve Anti-HDVIgM ise hızlıca ve yüksek titrede pozitif olur (18). Kronikleşmeye doğru progresyon, serumda anti-delta IgM ve anti-delta IgG antikor titrelerinin artarak devam etmesi ile karakterizedir.
Persistan HDV replikasyonu sırasında genellikle HBV replikasyonu süprese olur. Bu yüzden bu hastaların serumunda HBsAg pozitfken, HBeAg genellikle negatiftir. Ancak HDV RNA düşmesi durumunda HBV DNA tekrar ortaya çıkıp, KHD’li hastalarda karaciğer hastalığının ilerlediği, Tayvan’da yapılmış bir çalışmada gösterilmiştir (43). Akut HDV enfeksiyonu sırasında serum HDV RNA semptomatik fazda %90 oranında pozitif olarak saptanırken, klinik düzelme ile ortadan kaybolur. Bu dönemde HDAg ve Anti HDV IgM pozitif olarak saptanır. Kronik HBV enfek siyonunda klinik tablo nonspesifiktir. Klinik görünüm diğer etiyolojilere bağlı kronik hepatitleri ile ayırt edilemez
2.1.6- Patogenez
HDV’nun karaciğerde hasar yapma mekanizması tam olarak bilinmemektedir. Patogenezi günümüzde hala tartışmalıdır. Akut HDV enfeksiyonu sırasında HDAg veya HDV RNA’nın direk sitopatik etkisi ile hücre hasarının meydana geldiği düşünülmektedir. Mikroveziküler steatoz ile seyreden fulminan delta hepatit vakaları Güney Amerika’nın kuzey bölümünden bildirilmiştir ve bu vakalarda dikkati çeken bir diğer özellik inflamatuar infiltrasyonun yokluğudur. Bu durum hepatit delta virüsünün direkt sitopatik olduğu
konusundaki görüşleri desteklemektedir. Burada L-HDAg’den ziyade S-HDAg büyük miktarlarda salındığında hepatositlere karşı sitotoksiktirler. Daha sık olarak delta hepatit enfeksiyonuna nekroinflamasyon eşlik etmektedir; bu durum da delta hepatit’e bağlı hepatit gelişiminde immün sistemin rolünü düşündürmektedir. Kronik enfeksiyon sırasında inflamatuvar hücreler enfekte hepatositin etrafını sarar. Daha sonra çeşitli antikorlar bu bölgede yoğunlaşır ve dolayısıyla kronik safhada immün aracılı hasarlanma ön plandadır (47). Kronik hepatit delta enfeksiyonuna çeşitli otoantikorlar eşlik edebilmektedir, bunlardan en spesifiği üridin difosfat glukuroniltransferaza karşı ‘liver-kidney’ mikrozomal antikorlarının (LKM antikoru, tip 3) eşlik ettiği kronik delta hepatit’lerdir. LKM ve diğer otoantikorların kronik delta hepatit’indeki patogenetik rolleri ise bilinmemektedir.
2.1.7- Patoloji
Karaciğer histopatolojisi de kronik HDV infeksiyonunda spesifik bir özellik göstermez. HBV ve HDV viruslannın ikisini de taşıyan hastalar klinik ve patolojik olarak, tek başına HBV içerenlere göre daha şiddetli karaciğer hastalığına sahiptir. Ancak immünohistokimyasal boyamalarda hepatositlerde delta antijeninin gösterilmesi diyagnostiktir. Bunun yanında kronik infeksiyona sahip hastalarda apoptozisten ayrı olarak eozinofilik dejenerasyon görülmesi de ayırtettirici olabilir.
2.2- Hepatit B virus(HBV)
HBV’nin plazma yarı ömrü 24 saat olup günlük virion üretimi 10¹¹ kadardır. Prodüktif infeksiyon kısıtlı sayıda hücrede gerçekleşir, HBV’nin tek kanıtlanmış infeksiyon bölgesi hepatositlerdir. Safra kanalı epitelyum hücreleri, böbrek ve lenfoid dokuda replikasyon bölgesi olabilir fakat hepatosit dışındaki replikasyon bölgelerinin viral patogenezde rolü olmadığı düşünülmektedir. Lenfositlerdeki replikasyon viral persistans için ikincil bir rezervuar olabilir (48). HBV temel olarak parenteral yolla, infekte kan ve sıvılarla perkutan ve mukozal temas, infekte kişiyle cinsel ilişki ve perinatal yolla bulaşmaktadır.
Hepatit B virüsü (HBV) kronik hepatit, siroz ve hepatoselüler karsinomun en önemli nedeni olup ciddi bir sağlık sorunudur. Tüm dünyada yaklaşık 2 milyara yakın insanın hepatit B virüsü ile karşılaştığı serolojik bulgulardan anlaşılmaktadır. Kronik HBV taşıyıcılarının sayısı günümüzde 350 milyonu geçmiş olup her yıl tahminen 500.000 ile 1,2 milyon arasında insan HBV infeksiyonundan ölmektedir(49,50).
2.2.1- Akut Enfeksiyon:
İnkübasyon dönemi alınan virüs miktarı ve kişinin immunite durumuna bağlı olarak 45-180 gün olarak belirlenmiştir. Akut infeksiyon, asemptomatik infeksiyon, kolestatik hepatit nadiren de fulminan hepatit olarak farklı klinik tablolarda görülebilir. Fulminan seyreden infeksiyonda hepatik ensefalopati, hepatorenal sendrom ve kanama diyatezi ile akut karaciğer yetmezliği gelişebilir.
Fulminan hepatitte mortalite riski %75’in üzerindedir ve yaşla birlikte artar. Akut HBV infeksiyonu geçirenlerin %10-20’sinde antijen antikor komplekslerine bağlı olarak ekstrahepatik belirtiler görülür (serum hastalığı benzeri sendrom, poliarteritis nodoza (PAN), membranoproliferatif glomerulonefrit (MPGN) ve çocuklarda papüler akrodermatitistir).
2.2.2- Kronik Enfeksiyon: (54)
Kronik HBV enfeksiyonu: Altı aydan uzun süre devam eden bütün HBV enfeksiyonları kronik HBV enfeksiyonu olarak tanımlanır.
İnaktif HBsAg taşıyıcılığı: Hepatit B virüsünü taşımakla birlikte karaciğerde nekroz ve inflamasyon bulunmadığı ve viral replikasyonun sonlandığı veya belirli limitlerin altında kaldığı hastaların durumu inaktif taşıyıcılık olarak tanımlanır. Bu tanım için gereken kriterler: o HBsAg (+) 6 aydan uzun süreli
o HBeAg (-) / Anti HBeAg (+)
o HBV DNA < 2000 IU/ ml (10^4 kopya/ml) o ALT ve AST düzeyi sürekli olarak normal
o Karaciğer biyopsisinde hepatite özgü bulguların görülmemesi.
İnaktif taşıyıcılık selim bir klinik seyre sahip olmasına rağmen bu kişilerin bazılarında zaman içerisinde hastalığın aktifleştiği görülebilir. Bazı hastalarda ise zamanla HBsAg de kaybolup enfeksiyon tamamen sonlanabilir. İnaktif HBsAg taşıyıcıları için eskiden sağlıklı taşıyıcı veya asemptomatik taşıyıcı gibi ifadeler kullanılmaktaydı. Yanlış anlaşılmalara yol açabilen bu kavramlar günümüzde terk edilmiştir.
Kronik hepatit: Aktif viral replikasyon bulguları (HBeAg ve / veya HBV DNA pozitifliği) ile birlikte karaciğerde belirgin bir inflamatuvar aktivitenin mevcut olduğu olgulardır. Kronik hepatitin HBeAg nin pozitif veya negatif olmasına göre iki farklı formu mevcuttur.
HBeAg (+)kronik hepatit HBsAg (+), 6 aydan uzun süreli HBeAg (+)
HBV DNA > 20 000 IU/ml (10^5 kopya/ml) Kalıcı veya aralıklı ALT / AST yüksekliği
Karaciğer biyopsisi: Belirgin inflamatuvar aktivite HBeAg (-)kronik hepatit
HBsAg (+), 6 aydan uzun süreli HBeAg (-)/ Anti HBe (+)
HBV DNA > 2 000 IU/ml (10^4 kopya/ml) Kalıcı veya aralıklı ALT / AST yüksekliği
Karaciğer biyopsisi: Belirgin inflamatuvar aktivite
Kronik hepatitin akut alevlenmesi: ALT seviyesinin öncesine göre en az iki kat artması ve normalin üst limitinin 10 kat üzerinde bulunması.
Reaktivasyon: İnaktif HBsAg taşıyıcısı veya iyileşmiş hepatiti olanlarda karaciğerdeki nekroinflamasyonun yeniden başlaması
HBeAg serokonversiyonu: Hepatit B li hastada HBeAg nin negatifleşip, anti HBe nin pozitifleşmesi. Sadece HBeAg negatifleşip, anti HBe oluşmamışsa bu durum
seronkonversiyon olarak adlandırılmamalıdır.
Occult(gizli) Hepatit B enfeksiyonu: HBsAg (–) bir olguda HBV DNA nın pozitif bulunmasıdır. Bu olguların bir kısmında anti HBs ve anti HBc pozitifliği veya sadece anti HBc pozitifliği de görülebilir (55).
2.2.3- Kronik HBV enfeksiyonunun patogenezi ve doğal seyri (Tablo-4):
Kronik HBV enfeksiyonu birbirini izleyen dört farklı dönem içerisinde gelişir (51,52):İmmun tolerans dönemi: Özellikle hastalığın perinatal bulaşma ile başladığı olgularda belirgin şekilde gözlenen bir evredir. Organizmanın virüse karşı gösterdiği immun tolerans viral replikasyonun ve vücuttaki viral yükün oldukça yüksek düzeylerde bulunmasına olanak sağlar, buna karşılık immun yanıt mekanizması üzerinden ortaya çıkacak olan karaciğer hasarı gelişmediğinden hastalığın biyokimyasal bulguları (ALT, AST) ve karaciğer biyopsisi normal sınırlarda bulunur.
İmmun temizlik (yanıt) dönemi: Önceki evrenin yıllar-on yıllar sonrasında, virüse karşı gösterilen tolerans kırılmaya başlar. Bu evrede viral replikasyon hızı ve hastadaki viral yük önceki döneme göre azalmaya başlar. Oluşan immun yanıtın neticesinde karaciğer hücre hasarı, bununla ilişkili biyokimyasal bulgular (ALT, AST yüksekliği) ve karaciğer biyopsisinde aktif inflamasyon bulguları ortaya çıkar. Bu dönemin klinikteki ifadesi HBeAg (+) kronik B hepatitidir. Bu evrenin devamı durumunda karaciğerdeki inflamasyon ve fibrotik süreç devam ederek hastalık karaciğer sirozuna kadar ilerleyebilir (HBeAg + karaciğer sirozları).
İnaktif dönem: İmmun yanıt döneminin sona ermesi ile hastalar inaktif döneme geçerler. Bu dönemde HBV DNA (–) veya düşük düzeylerde pozitif bulunur. Bazı olgularda bu dönemden sonra bir daha aktif enfeksiyon formları gelişmez ve eğer immun yanıt döneminde çok ağır bir karaciğer hasarı meydana gelmemişse virolojik aktivitenin sonlanmasını takiben histopatolojik düzelme ve ALT seviyesinin de normale dönmesi ile tipik bir inaktif taşıyıcı örneği oluşur. İnaktif taşıyıcılarda zamanla HBsAg nin negatifleşmesi ve anti HBs pozitifliği gözlenebileceği gibi hastalığın yeniden aktif formlara geçmesi de mümkündür.
Reaktivasyonu dönemi: İnaktif döneme geçen hastaların büyük bir kısmı ömür boyu inaktif taşıyıcı olarak kalırken, diğerlerinde viral replikasyonun yeniden başlamasıyla HBeAg negatif kronik B hepatiti gelişir. Bu evrede HBV DNA düzeyleri genelde önceki iki dönemden (immun tolerans fazı ve immun klirens fazı) daha düşüktür. Bazı olgulara ise belirgin bir inaktif dönem ayırt edilmeksizin doğrudan HBeAg (+) kronik hepatitinden HBeAg (-) kronik hepatite geçiş söz konusu olabilir. Bu durumun devam etmesi ile HBeAg (-) karaciğer sirozları oluşur. Bu dönemin önemli bir özelliği de ALT düzeylerinin dalgalanma göstermesidir. Bu nedenle zaman zaman normal ALT düzeylerinin gözlenmesi olasıdır. HBeAg (–) kronik B hepatiti gelişmesinde olgularının büyük çoğunluğunda viral genomun precore veya core promoter bölgesinde oluşan mutasyonlar sorumludur.
HCC ise sıklıkla (>%80) siroz zemininde, seyrek olarak normal karaciğere sahip inaktif taşıyıcıda ortaya çıkar. HBV infeksiyonunun edinildiği yaş, bulaşım şekli, erkek cinsiyet, viral genotip ve immunosuresif durumlar hastalığın seyrini etkiler.
2-3. DEMİR METABOLİZMASI
Demir organizmada esas olarak enerji metabolizmasında yer alır. Dokulara oksijen transportu, elektron transferi, DNA sentezi ve pekçok yaşamsal önemi olan enzimin yapı ve fonksiyonu için gereklidir. Kolaylıkla ferroz (Fe++) ve ferrik (Fe+++) seklinde değişebilen redoks kimyası ile insan varlığı demire bağımlıdır ve demir metabolizmasındaki değişiklikler insan sağlığını önemli şekilde etkilemektedir. Demir eksikliğinin en önemli nedeni, diyetle alınan demir ile büyüme ve metabolik fonksiyonlar için gerekli demir ihtiyacı arasındaki dengesizliktir. Erişkinlerde eritrosit yapımı icin gereken demirin %95'i yaşlı eritrositlerin yıkımından sağlanırken çocuklarda hızlı büyüme nedeniyle yıkılan eritrositlerden sağlanan demir miktarı, sadece %70'dir. Bu dönemde eritropoez ve diğer yaşamsal fonksiyonlar için gereken demirin %30'u diyetle alınması gerektiğinden, diyet eksiklikleri daha kolaylıkla demir eksikliğine neden olabilmektedir (53,56,57).
Çocukluk yaş grubunda demir eksikliğinin en onemli sonuçlarından biri de, sonradan eksiklik giderilse bile, yıllarca devam edecek hatta erişkin yaşama yansıyacak mental defektlerin oluşudur (57,58). Erişkin yaşamda demir eksikliği iş performansında azalma üretim gücünde düşme ile ekonomik kayıplara neden olmaktadır. Erken gebelik döneminde demir eksikliği prematurite ve düşük doğum ağırlıklı bebeklerin doğmasına yol açar.
Gelişmekte olan ülkelerde düşük proteinli diyetteki inorganik demirin iyi emilmemesine bağlı yüksek sıklıkta demir eksikliği görülürken gelişmiş ülkelerde etle beslenme oranının yüksek oluşu etle alınan hem proteinin çok daha yüksek oranda emilimi nedeniyle demir eksikliği görülme oranı çok azalmaktadır. Bu ülkelerde artan vücut demirinin zararlı etkileri tartışılmaya başlanmıstır.
Demir fizyolojik olarak esansiyel fakat biyokimyasal olarak tehlikelidir. Diyetle alınan demirin %10'u emilmekte fakat fazla demir organizmadan fazla atılamamaktadır. Organizmada eğer kayıp yoksa, ilerleyen yaşla birlikte demir depoları artar. Eskiden ne kadar olursa o kadar iyi denilirken, bugün sağlıklı bir kişide fazla demir deposuna ihtiyaç olmadığı bilinmektedir (57,58).
Enfeksiyon hastalıkları, inflamatuar hadiseler, iskemi ve reperfüzyon yapacak çok geniş spektrumlu patolojik olaylarda biyolojik olarak superoksit oluşumu olur. Bir serbest
radikal olan superoksit ve hidrojen peroksit demirin serbest hale gelmesine yol açar. Demirin bunlarla reaksiyonu ile de çok daha güçlü serbest radikal olan hidroksil radikal ortaya çıkar (Fenton reaksiyonu). Bu hidroksil radikal tüm biyolojik makromolekülleri etkiler. Polisakkaritleri depolimerize eder, DNA kırıklarına yol açar, enzimleri inaktive eder ve lipid peroksidasyonunu başlatır. Lipid peroksidasyonu, serbest demirle geometrik olarak çoğalır ve çok önemli patolojik durumlara neden olur.
İskemik kalp hastalıkları, maligniteler, nörodejeneratif hastalıklar (Parkinson, Alzheimer) ile organizmada serbest demirin yol açtığı oksijen radikalleri arasında yakın ilgi olduğunu gösterir çalışmalar vardır. Özellikle demirden zengin beslenilen ülkelerde hemokromatozis gen sıklığının da %10-13 gibi beklenmeyen şekilde yüksek bulunuşu hemokromatozisli olguların semptomatik hale gelme riskini artırdığı düşüncesini gündeme getirmiştir (Amerika ve Avrupa'da çok görülürken, Asya'da daha nadir).
Demirden fakir beslenen ülkelerdeki insanlar ve vejeteryanlarda hemakromatozisin az görülmesi belki de geni taşıyan kişilerde koruyucu olmaktadır. Hemakromatozislerin %80'inde C282Y mutasyonu bulunmaktadır (59,60).
Demir, yaşayan canlılar için eksikliği de fazlalığı da önemli sorunlara yol acan esansiyel bir elementtir. Son yıllarda demir emiliminin moleküler kontrolü, demir transportu ve hücresel demir alımı ile ilgili çok geniş araştırmalar ve buluşlar olmakla birlikte halen tam bilinmeyen bazı noktalar bulunmaktadır.
2-3-1.Demir emilimi ve organizmada demir dağılımı
Vücut demir depoları, diyetle alınan ve gastrointestinal, üriner sistem ve derideki hücrelerin yıkımı ile atılan demir arasında sabit bir denge sağlar. Hergün ortalama 1 mg demir atılmakta ve bu diyetle sağlanmaktadır. Hızlı büyüme dönemlerinde vücut kitlesinde artış nedeniyle bu miktar yeterli olmaz. Demiri organizmadan günde 1 mg'dan fazla atacak bir sistem yoktur ve vücut demir depolarının dengesi esas olarak demir emilimindeki düzenle sağlanmaktadır.
Demir insolubilitesi ve serbest halde iken potansiyel toksisitesi nedeniyle, solubl halde tutacak, tehlikesizce bağlayıp taşıyacak ve depolayacak özgul mekanizmalar ve proteinler vardır. Emilim yeri duodenum ve üst jejunum olan demirin organizmada, farklı fonksiyonlara yönelen farklı formlarının hücrelere giriş için seçtiği yolların da farklı olduğu gösterilmiştir (61).
2-3-2.Diyetteki demir emilimini etkileyen faktörler
1-Barsak lümenindeki faktörler, demirin daha çok veya daha az emilebilir hale gelişini sağlarlar.
2- Mukozal faktörler demirin hücre içine yeterli miktarda geçişine izin verirler.
3- Vücut faktörleri, emici hücreye, demirin mukozal transferini artırma veya azaltma sinyali verirler.
Diyette demir hemoglobin ve miyoglobinden kaynaklanan organik hem demiri ve et dışı kaynaklardan alınan inorganik demir olmak üzere iki şekilde bulunur. Hem demiri ve et dısı kaynaklardan alınan inorganik demirin emilim yolları birbirinden tamamen farklıdır.
2-3-2-1.Hem demir emilimi;
Et ile beslenenlerde vücut depo demirini sağlamada hem demir emiliminin çok önemli bir yeri vardır. Kuzey Amerika ve Avrupalıların diyetlerinin 1/3’u hem demiri olmasına rağmen, günlük demir gereksiniminin 2/3’ünü sağlar şekildedir. Ağızdan alınan hemin %50’si organizmaya girmektedir Bu ülkelerde demir eksikliği görülme oranı da düşüktür. Ette bulunan hemoglobin barsakta intestinal enzimlerle hem ve globuline ayrılmakta globulin yıkım ürünleri hemi ve inorganik demiri solubul halde tutarak absorbsiyonu kolaylaştırmaktadır. Hem demiri emilimi için inorganik demirde gereken duedenal düşük pH ve emilimi kolaylaştıran askorbik asit, sitrik asit gibi faktörlere gereksinim yoktur. Besinlerde bulunan demir bağlayıcılardan da etkilenmez. Sadece kalsiyumun emilimi olumsuz olarak etkilediği gösterilmiştir.
Hem demiri ferröz (FeII) formda olup, demir eksikliği olduğunda emilimi 2-3 kat artmaktadır. Hem, duodenal enterosite eskiden hem vesikulu denilen simdi ise yeni tanımlanan hem taşıyıcı protein 1 denilen özel bir taşıyıcı ile girer. Enterositten plazmaya çıkarken inorganik demirle aynı yolu kullanır.
2-3-2-2.Hem dısı (inorganik) demirin emilimi;
Besinlerle alınan hem dışı demirin çoğu ferrik (FeIII) demir şeklinde olup, solubilitesi ve lümenden duedenal villusta enterosite alımı için lümen içi pH’ı düşüren mide asiditesine
gereksinimi vardır. İnorganik demirin emilimi çok kompleks ve moleküler olarak çok sıkı kontrol gerektiren bir sistem içinde düzenlenmektedir.
Emilimde ilk basamak bu ferrik demirin membrana bağlı bir redüktaz olan ve askorbat bağımlı duodenal sitokrom b (DCytb) tarafından ferröz şekle (FeII) redukte edilmesidir (53,61). Son çalışmalarda başka redüktazların varlığı da gösterilmiştir. Fe II olgun enterositin lümene bakan yüzeyinde bulunan divalan metal transportır 1( DMT 1) ile enterosit içine alınır. DMT1 non hem demir alımını sağlayan en önemli proteindir. Gerek DCytb’ in gerekse DMT1’ in sentezi demir eksikliğinde artmaktadır. Bunların sentezi de IRP/IRE sistemi ile düzenlenmektedir. Enterosite alınan demirin bir kısmı ferritin şeklinde depolanır ve duedenal eksfoliasyon ile atılır. Organizmaya demir alınacaksa, gereksinim varsa, absorbe edildikten sonra enterositin bazolateral tarafına taşınır ve oradan insanda bilinen tek demir atıcısı olan ferroportin ile plazmadaki transferine yüklenir. Fakat önce seruloplazmin homoloğu ve bir transmembran proteinini olan hefastin ile FeII, FeIII haline okside edilmelidir.
2-3-2-3.Demirin hücreler tarafından alınması;
Demir, plazmada karaciğerden oldukça fazlaca sentezlenen ve glukoprotein yapısında olan transferrin tarafından taşınır. Enterositin bazolateral tarafından ferroportin ile dışarı verilen ve hefastin ile okside edilerek ferrik (FeIII) hale getirtildikten sonra transferine yüklenen demir, portal dolaşımdan çoğu kemik iliğinde eritrosit öncü hücreleri olmak üzere hücrelere taşınır. Her transferrin molekülü iki tane Fe III’u güçlü bir şekilde bağlar. Hefastin eksikliğinde duedenal enterositlerde demir fazlalığı ve demir emilim bozukluğuna bağlı hipokrom mikrositer anemi olduğu gosterilmiştir.
Hücreler tipine göre demiri farklı yollardan alırlar. Diyet demiri enterosit tarafından apikal tarafta bulunan DMT1 ile alınırken, makrofajlar önce fagosite ettikleri sirkule eden yaşlı eritrositlerdeki hemoglobinden demir alırlar. Eritrosit lizisi ile açığa çıkan hemoglobinden hemoksijenaz ve biliverdin redüktaz ile demir ve bilirubin oluşur.
Makrofajların vakuolar membranlarından demir transportu gene DMT1 ile olmaktadır. Makrofajlarda acığa çıkan, demir ya tekrar organizmada dolaşan demir olması icin makrofaj ferroportini ile plazmaya verilmekte ya da makrofaj içinde ferritin şeklinde depolanmaktadır. Ferroportin enterositte olduğu gibi hücrenin tek demir atıcısıdır.
Makrofajdan demir plazmaya verilirken transferine yüklenebilmesi için gene FeIII şekline getirilmeli ve okside edilmelidir. Bu oksidasyon ve transferrine yüklenme işinde
plazmada bakıra bağlı ferrioksidaz olan ve karaciğerde sentezlenen serüloplazmin rol almaktadır. Hepatositlerin demir alımı TfR1 ve TfR2 ile olur. Hepatositler portal dolaşımdan aldıkları demiri depolarlar ve gerektiğinde ferroportin yolu ile tekrar dolaşıma verirler. Bunlar dışında tüm hücreler demiri yüzeylerinde bulunan transferin reseptörlerini kullanarak plazma transferrininden almaktadırlar. Normal şartlarda transferin demirle saturasyonu (TS) % 30 orandadır. Transferinin demir bağlama kapasitesi tamamen dolduğunda plazmada serbest transferine bağlı olmayan demir oluşur. Bu demir özellikle karaciğer ve kalp hücrelerine kolaylıkla girebilir ve hucresel düzeyde hasar oluşturabilir. Plazmadaki diferrik transferin (holotransferrin), hücrenin membranında, hücre içi demir ihtiyacına göre miktarı belirlenen düzeyde sentezlenmiş ve hücre yüzeyine yerleşmiş transferrin reseptörune (TfR) bağlanır. Tf-TfR1 kompleksi içselleştirilir ve bir endozom oluşur. Endozom içi pH düşürülerek, transferrin demirden ayrılır, demir FeII şekline redükte edilir. Endozomal membrandan demirin stoplazmaya geçişi DMT1 ile olur. Stoplazmada demir ya mitokondiride hem sentezine ya ferritin şeklinde depolanmaya ya da diğer metabolik islerde kullanılmaya gider. Demirini bırakmış transferrin yani apotransferrin-Tf-reseptor kompleksi tekrar hücre yüzeyine gönderilir ve transferrin tekrar kullanılmak üzere plazmaya salınır (66,67).
Transferrin reseptörü disulfid bağları ile bağlı iki subunitten oluşmuştur. iki ayrı genle kodlanan TfR1 ve TfR2 şeklinde, iki farklı TfR’u vardır. TfR1 enterosit kript bazolateral kısımda ve demiri transferinden alan tüm hücrelerde milyonlarcası da kemik iliği eritrosit öncülerinde bulunurken, TfR2; TfR1’in tersine tüm hücrelerde değil, en çok karaciğerde, kan hücrelerinde, duodenal kript hücrelerinde bulunur. TfR2 TfR1’in homoloğu buna da diferrik transferrin bağlanır. TfR2 karaciğere demir depoları sinyallerini iletmede önemlidir. TfR2 gen mutasyonunun herediter hemakromatosise yol açması, hepsidin ile ilişkisi belirlenmiştir. Transferin reseptörünün ekstrasellüler parçası serumda bulunur. Serum transferin reseptör (sTfR) düzeyi ölçümü direkt olarak organizmanın demire olan ihtiyacını göstermektedir. Ayrıca serum TfR’nin kaynağı olgunlaşan eritroid hücrelerden dökülen TfR olduğu için de serumda sTfR ölçümü, plazma demir döngüsü (PIT) gibi ve ondan çok daha kolay şekilde eritropoetik aktivite düzeyini tahmin etmek amacıyla kullanılabilir.
2-3-3.Organizmada demir dengesi
2-3-3-1.Hücre içi demir dengesi
Hücresel düzeyde demirin moleküler kontrolü; demirin taşınması, depolanması, kullanımı ile ilgili tüm ana proteinlerin sentezi posttranskripsiyonel düzeyde hücre içi demirle düzenlenmektedir. Bu duzenlenme stoplazmada bulunan ve hücre içinde demiri hisseden, hücresel demir sensör proteinleri olan ‘iron regulatuar proteinler’ IRP’ler ile, demir proteinlerinin mRNA’ ları üzerinde 30 nukleotidlik bölgeyi içeren ve ‘iron responsive elementler denilen IRE’ ler arasındaki ilişkiye bağlıdır. Ferritin, ferroportin ve delta aminolevulinik asit sentetazdaki (eALA-S) IRE motifleri 5’ non coding bölgesindedir. Transferin reseptör 1 ve DMT1 gibi demir transportunda yer alan proteinlerin IRE bölgeleri onları kodlayan mRNA’ların 3’ bölgesinde bulunurlar. Bu iki farklı yerlerden bağlanma tamamen farklı etkilere neden olur. Hücre içinde demir eksikliği olduğunda IRP’lerle IRE’ ler bağlanırlar. Bu bağlanma transferin reseptörü (TfR) ve DMT1’ in degredasyonunu azaltıp, translasyonunu artırırken, ferritin, ferroportin ve eALA-S’ ın sentezlerini durdurur. Hücre dışı demir konsantrasyonu normal sınırlarda iken hücresel demir dengesi IRP/IRE sistemi ile düzeyleri ayarlanan proteinlerle düzenlenmekte, sitoplazmik demir miktarına göre gereğinde demir alımı gereğinde depolama yapılmaktadır. Hücresel demir fazlalığında ise IRP yapısal olarak değişip IRE’ lere bağlanamayacağı icin TfR mRNA stabilizasyonu bozulup, degredasyonu artıp hücre demir alımı dururken, ferritin sentezi artarak ortalıkta bulunan demir de depolanır. IRP1 ve IRP2 şeklinde iki farklı moleküler formda IRP vardır ve her ikisi de IRE’ lere yüksek bağlanma afinitesine sahiptir.
2-3-3-2.Organizmanın sistemik demir dengesi
Intestinal demir emiliminde rol alan proteinlerin IRP/IRE sistemi gene hücrelere lokal olarak calışmaktadır. Demirin sistemik regülasyonunu açıklayan eski kriptle programlanmış, kript içi demir miktarı ile düzenlenen emilime göre, duodenal olgun enterositlerin ne kadar demir alacakları apikal DMT1 düzeyine bağlıdır ve bu düzey bazolateral taraftan HFE ile sinyal alan kript hücresindeki demir miktarının etkilediği IRP/IRE sistemi tarafından ayarlanır. Kript HFE’si plazmadaki TfR1 ile fizyolojik ilişkisi ile organizma demir durumunu hissederek kript içi demir miktarını belirler. HFE b2 mikroglobulinle hücre yüzeyine gelip demirle doymuş transferrinle temas edip kripte demir alınmasını sağlar. Kript içinde demir miktarı ayarlanır. HFE eksikliğinde kript içinde demir eksikliği olusur ve 2-3 gün sonra kript olgun enterosit olunca eksik demire göre yanlış programlandığı için fazla sentezlenmis DMT1 de fazlaca demir alınmasına ve enterosit içinde demir birikimine neden olur. Barsak hücresi içinde demir fazlalığı oluşacağı için IRP/IRE bağlanması olamayacak ve ferroportin sentezi artarak absorbe edilen demir plazmaya verilecektir. Bu kript hücre hipotezi HFE eksikliği
oluşturulmuş sıçan deneylerinde kripte demir alımının bozulduğu ve demir transport genlerinin ve proteinlerinin arttığı gösterilmistir. Otozomal resesif kalıtılan HFE gen mutasyonu sonucu HFE eksikliği erişkin tipi olan ve en çok görülen hemokromatozise yol açmaktadır. Tüm yapılan çalışmalar sonucunda organizma demir dengesini iki regülatörün kontrol ettiği anlaşılmıstır: Eritropoetik regulator ve depo regulatorleri. Eritropoetik regulator, kemik iliğinden gelen sinyallerle çalışmaktadır. Eğer eritropoetik aktivite çok artmış ise kemik iliğinde eritropoezin demir ihtiyacını karşılamak için depolar dolu olsa da intestinal demir emilimi olmaktadır. Depo regulatoru, karaciğer, iskelet kası ve dolaşan kandaki demir miktarı azaldığında bunu hissederek emilimi artıran bir regulatordur. Eritropoetik regulator depo regulatorune göre 20 kat fazla aktif demir emilimi sağlamaktadır. Bu nedenle talasemi intermediada organizma demir fazlalığı olduğu halde intestinal demir emilimi fazladır. Enterosit tarafından absorbe edilen demir miktarı depolar ve eritropoez hızı dışında, hipoksi, inflamasyon ve gebelik gibi çesitli faktörlerden de etkilenmektedir. Bu faktörler enterositin major transport molekülleri olan DMT1, Dcytb, ferroportin’i hem mRNA, hem protein düzeyinde etkileyerek değişiklikleri oluşturmaktadırlar.
Hepsidinin keşfinden sonra organizmada demir dengesinin karaciğerde hepatositlerde sentezlenen bir antimikrobial protein olan hepsidin ile olduğu anlaşılmıstır. Hepsidin demir metabolizmasını düzenleyen bir hormondur. Duodenal demir emilimini ve makrofaj demirinin salınımını engelleyerek organizmada demiri azaltarak demir dengesini düzenlemektedir. Demir dengesinin ayarlanmasının hepsidin yoluyla olduğu belirlendikten sonra demir kript yolu, HFE ve transferin saturasyonu ve tüm bunlarla hepsidinin ilgisi, makrofaj kaynaklı demirin dolaşıma verilmesi yoğun bir şekilde tekrar calışılmaya başlanılmış ve bu konuda gene pek cok bilinmeyenin olduğu anlaşılmıştır (65).
Tüm memelilerde demire belli bir miktar gereksinim vardır. Hem hücresel demir eksikliği, hem demir fazlalığı patolojik ve zararlıdır. Bu nedenle biyolojik sıvılardaki demirin yoğunluğu gerektiği zaman kullanılmak ve toksisitesinden sakınmak icin çok sıkı bir şekilde kontrol edilmektedir.
Memelilerde demir dengesi başlıca intestinal emilim düzeyinde denetlenerek sağlanmaktadır. Hepsidin esas olarak karaciğerden sentezlenen, dolaşımda bulunan idrarla atılan bir peptid hormon olup sistemik demir dengesinin ana düzenleyicisidir. Son olarak bakteriyel patojenlere karşı miyeloid hücrelerde de sentezlendiği gösterilmiştir.
Hepsidin ince barsaktan demir emilimini azaltır, makrofajlar tarafından yaşlı eritrositlerden çıkarılan ve tekrar plazmaya verilen demirin makrofaj çıkısını ve plazmaya verilmesini ve hepatik depolardan mobilizasyonunu engeller. Eritropoetik aktivite artışı, hipoksi, organizma demir depolarının azalması durumlarında hepatik hepsidin sentezi azalır. Organizmaya demir yüklenmesi, inflamasyon ise hepsidin sentezini artırır. Enflamasyon ister akut isterse kronik olsun hipoferrinemi ile sonuçlanır. Buna neden olan faktörlerden en önemlisi de akut faz proteini olarak artan hepsidindir (65).
Hepsidinin demir metabolizmasına negatif etkisi ve hipoferrinemi oluşturması yanında in vitro olarak eritroid öncü hücrelerin proliferasyonlarını ve yaşam sürelerini de azalttığı, eritropoezi bozduğu da gösterilmiştir. Hepsidinin reseptörü bir bazolateral transmembran proteini olan ferroportindir. Ferroportin demirin hücreden plazmaya atılmasını ve bir ferrioksidaz olan hefastinin yardımı ile plazma transferinine yüklenerek taşınmasını sağlar. Ferroportin plesentada, barsakta, retikuloendotelial makrofajlarda ve hepatositlerde bulunur.
Hepsidinin ferroportine bağlanması, onun internalizasyonuna ve lizozomal degredasyonuna sonuç olarak ta ferroportinin membrandan kaybına yol açmaktadır. Ferroportinin hücre yüzeyinden kaybı demirin plazmaya geçişini engeller. Bunun sonucunda intestinal demir emilimi azalır, makrofajlarda ve enterositlerde demir birikimi artar, plazmaya daha az demir çıkar, transferrin saturasyonunda azalma olur eritropoeze giden demir miktarı azalır (64). Hepsidin/ ferroportin sistemi patojenlerin demiri almalarını engelleyerek konakçı savunmasına katkı sağlamaktadır. Sow ve arkadaşları tarafından hepsidinin M.Tuberkulosiste yapısal hasar oluşturarak çoğalmasını engellediği gösterilmiştir. Bu invitro çalışma hepsidinin mikroorganizmaların kullanacağı demiri azaltarak antimikrobial özelliği yanında, direkt antimikrobial özelliğini de kanıtlamaktadır.
Hepsidin ayrıca diyetle fazla demir alındığında duodenal enterositlerden plazmaya fazla demir çıkışını da kısıtlamaktadır. Anemi ve hipokside ise tersine hepsidin sentezi azalır, hücre yüzeyinde ferroportin artar. Bunun sonucunda demir emilimi ve makrofajlardan dolaşıma tekrar verilen demir miktarı artar. Enfeksiyon enflamasyon anemisinde oluşan hipoferrinemi hastanın savunma mekanizmalarından biridir. Bu durumdan sorumlu hormon da hepsidindir. Organizmada (Fe+++) demir depolayan, demir depo proteini ferritindir. Ferritin, en az iki subunitten yapılmıştır (H ve L subunitleri) ve holoferritin halinde iken 4500 atom ferik (Fe+++) demir depolayabilir. H ve L subunitlerinin yeri ve fonksiyonları farklıdır. Bu iki subunitin, farklı oranlarda oluşu, her dokunun ferrtininin farklı olmasına neden olur.
Ferritin (ferritine giren ferroz demirdir) ferrooksidaz aktivitesi vardır ve ferröz demiri ferrik demir haline cevirir. Demir fazlalığında, ferritin lizozomlar tarafından alınır ve degrade edilerek hemosiderin denilen insoluble hale getirilir.
Ferritinde depolanan ferrik demirin; küçük moleküler ağırlıklı şelatorlerce ayrılabildiği (sitrat, desferrioksamin) bu olayın ferritin degredasyonu ile oluştuğu ileri sürülmektedir. Ayrıca eritroid hücrelere sadece transferrinle demir verilirken, hepatositlerin ferritinden de demir aldığı, membranlarnında ferritin reseptörü olduğu gösterilmiştir (56).
Ferritin ağır ve hafif (H ve L) zincirlerinin genleri tamamen klonlanmıştır. Sırasıyla 11. ve 19. kromozomlarda olduğu gösterilmiştir. Demir eksikliğinde IRP'ler ferritin 5' UTR'sinde bulunan IRE'lere bağlanarak ferritin sentezini önlerler. Tumor nekrosis faktor (TNF-a) H ferritin yapımının, kas ve adipoz dokuda artırdığının gösterilmesi ile inflamatuar hadiselerde demirin makfajlarda anormal olarak neden biriktiği de belki anlaşılabilir. Demir dışında hidrojen peroksit (H2O2) ve NO'nun da IRP-IRE bağlanmasını artırarak ferritin sentezini inhibe ettiği gösterilmiştir. Son olarak ta tiroid hormonunun fazla demirle olan IRP-IRE bağlanmasını azalttığı ve ferritin sentezini artırdığı gösterilerek, hipertroidide artmış ferritin düzeyi konusuna açıklık getirilmiştir. Kronik inflamatuar hastalıklarda retikuloendotelial makrofajlardan demir salınımı azalır. Bunun nedeni ferritin sentezinin artmasıdır. Ayrıca IL-1 ve IL-6'nın da ferritin sentezini artırdığı gösterilmiştir. IL-4 ve IL-13 de NO ile yönlendirilen IRP aktivasyonuna ters etki ile ferritin sentezini aktive makrofajlarda artırmakta ve ayrıca IRP'den bağımsız olarakta transferrin reseptor mRNA'sının ekspresyonunu artırmaktadır. Böylece makrofajlarda hem demir alınımı, hem depolanması artar (69).
Hücre icinde fonksiyonu olmayan demiri depolayan ve intraselluler olarak detoksifiye eden ferritinin bir kısmı da plazmada bulunur. Kabaca her mikrogram plazma ferritini 8 mg depo demiri ile koreledir (56). Ayrıca plazma ferritini cinsiyete ve yaşa göre de değişmektedir, inflamatuar hastalıklarda, akut ve kronik karaciğer hastalıklarında, lösemi, hepatoma, meme kanseri gibi bazı kanserlerde, demir durumundan bağımsız olarak ferritin sentezinin artması, akut faz reaktanı olarak görülmesine ve organizmanın demir durumunu göstermede değerini azaltmıştır. IL-1 ve TNFa'nın hepatoma hücrelerinde ferritin mRNA sentezini artırdığı dolayısıyla ferritin sentezini artırdığı görülmüştür (57). Son yıllarda serum feritin yüksekliği ve katarakt ile genetik bir hastalık tanımlanmıştır. Bu sendrom L ferritin