T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
SEPSİSLİ HASTALARDA ERİTROSİT DAĞILIM
GENİŞLİĞİNİN AKUT BÖBREK HASARI
ÜZERİNE ETKİSİNİN DEĞERLENDİRİLMESİ
UZMANLIK TEZİ Dr. Sema TANRIKULU
T.C.
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ
İÇ HASTALIKLARI ANABİLİM DALI
SEPSİSLİ HASTALARDA ERİTROSİT DAĞILIM
GENİŞİLİĞİNİN AKUT BÖBREK HASARI
ÜZERİNE ETKİSİNİN DEĞERLENDİRİLMESİ
UZMANLIK TEZİ Dr. Sema TANRIKULU
TEZ DANIŞMANI
Prof. Dr. Ali Kemal KADİROĞLU
TEŞEKKÜR
Bilimsel düşünme ve çalışmayı bizlere öğreten, engin bilgi ve birikimlerini bizimle paylaşan, bugünlere gelmemizde büyük emeği olan, hekimliği bizlere öğreten değerli hocamız Prof. Dr. Ekrem MÜFTÜOĞLU’ na başta olmak üzere, İç Hastalıkları A.D. Başkanımız Prof. Dr. M.Emin YILMAZ’a yetişmemde büyük emekleri olan bütün değerli öğretim üyelerimiz; Prof. Dr. Vedat GÖRAL, Prof. Dr.
Orhan AYYILDIZ, Prof. Dr. Abdurrahman IŞIKDOĞAN, Prof. Dr. Kendal YALÇIN, Prof. Dr. Alpaslan Kemal TUZCU, Prof.Dr. Muhsin KAYA, Prof. Dr. Ali Kemal KADİROĞLU, Doç.Dr. Ebubekir ŞENATEŞ, Doç. Dr. M.Ali KAPLAN, Doç. Dr. Mehmet KÜÇÜKÖNER, Doç. Dr. Ali İNAL, Yrd. Doç.Dr.Zülfikar YILMAZ, Yrd. Doç. Dr. Yaşar YILDIRIM, Yrd. Doç. Dr. Sinan DAL, Yrd. Doç. Dr. Faruk KILIÇ, Yrd. Doç. Dr.Zuhat URAKÇI, Uzman Dr. Nazım EKİN, Uzman Dr. Coşkun BEYAZ, Uzman Dr Zafer PEKKOLAY, Uzman Dr.Abdullah KARAKUŞ ve Uzman Dr. Zeynep ORUÇ’a teşekkürlerimi
sunuyorum.
Tezimin her aşamasında büyük emeği olan, yardımlarını esirgemeyen sayın
Prof. Dr. Ali Kemal KADİROĞLU’na, Yrd. Doç. Dr. Yaşar YILDIRIM’a ve Yrd. Doç. Dr.Zülfikar YILMAZ’a ayrıca teşekkürlerimi sunuyorum.
Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.D. , Enfeksiyon Hastalıkları ve Mikrobiyoloji A.D. , Göğüs Hastalıkları ve Tüberküloz A.D. ve Radyoloji A.D. başkanlarına ve değerli öğretim üyelerine,
Birlikte çalışmaktan her zaman büyük mutluluk ve onur duyduğum tüm asistan arkadaşlarıma ve İç Hastalıkları A.D. çalışanlarına teşekkürlerimi sunuyorum. Güçlerini her zaman arkamda hissettiğim onlardan çaldığım zamanları mütevazilikle kabullenen özel insanlara; sevgili eşime ve yaşama sevincim olan oğluma ,sevgili annem, babam ve kardeşlerim’e sonsuz teşekkürlerimle….
İÇİNDEKİLER
TEŞEKKÜR... ii TABLOLAR... vii 1.GİRİŞ VE AMAÇ...1 2. GENEL BİLGİLER...3 2.1.SEPSİS... 32.2.AKUT BÖBREK YETMEZLİĞİ...21
2.3.Kırmızı Küre Dağılım Genişliği (RDW)...64
3. MATERYAL VE METOD...69
4. BULGULAR...71
SONUÇ... 82
SİMGELER VE KISALTMALAR
ABD : Amerika Birleşik DevletleriABH: Akut Böbrek Hasarı ABH: Akut Böbrek Yetmezliği
ACCP: American College of Chest Physicians ACTH: Adrenokortikotropik Hormon
AKIN: Acute Kidney Injury Network ALI: Akut akciğer hasarı
APACHE: Acute Physiology and Chronic Health Evaluation APC: Aktive Protein C
aPTT: Aktive Parsiyel Tromboplastin Zamanı ATN: Akut Tübüler Nekroz
ATİN: Akut Tübülointerstisyel Nefrit CD11b: Cluster Of Differantiation 11b CD14: Cluster Of Differantiation 14 CD18: Cluster Of Differantiation 18 CCr: Creatinine Clearence
CRP: C Reaktif Protein
CRRT: Sürekli Renal Replasman Tedavisi CVP: Santral Venöz Basınç
DİK : Dissemine İntravasküler Koagülopati DNA: Deoksiribonükleik Asit
EKO: Ekokardiyografi
FENa: Fraksiyonel Sodyum Ekskresyonu GBM: Glomerüler Bazal Membran GFH: Glomerüler Filtrasyon Hızı GFR: Glomerular Filtration Rate GİS: Gastrointestinal Sistem HDL: High Density Lipoprotein HGB: Hemoglobin
HRS: Hepatorenal Sendrom İGF-1: İnsülin like Growth Faktör 1 IL-1: İnterlökin 1 IL-4: İnterlökin 4 IL-6: İnterlökin 6 IL-8: İnterlökin 8 IL-10: İnterlökin 10 IL-12: İnterlökin 12
KAH: Koroner Arter Hastalığı KBH: Kronik Böbrek Hastalığı
K/DOQI: Kidney Disease Outcomes Quality İnitative KDIGO: Kidney Disease Improving Global Outcomes KOAH: Kronik Obstrüktif Akciğer Hastalığı
LDL: Low Density Lipoprotein
LPB: Lipopolisakkarid Bağlayıcı Proteine LPS: Lipopolisakkarid
MAPK: Mitojen Aktive Protein Kinaz MCV: Mean Corpusculer Volume MIP: Makrofaj Enflamatuvar Protein MODS: Çoklu Organ Yetmezliği Sendromu MOF: Multiorgan Yetmezliği
MSR: Macrophage Scavencer Receptor NF-kB: Nükleer Faktör Kappa
NO: Nitrik Oksit
NOD-1: Nucleotide-Binding Oligomerization Domain 1 NOD-2: Nucleotide-Binding Oligomerization Domain 2 NSAİİ: Non Steroid Anti-İnflamatuar İlaç
OAB: Ortalama Arter Basıncı PAF: Platelet Activated Factor
PAI 1: Plazminojen Aktivatör Inhibitörü 1
PIRO: P:predisposition, I:infection, R:response, O:organ dysfunction PTH: Paratiroid Hormon
RAAS: Renin Anjiotensin Aldosteron Sistemi RNA: Ribonükleik Asit
RBC: Red Blood Cell
RDW: Red Cell Distribution Width
RİFLE: Risc, Injury,Failure ,Loss ,End Stage Renal Failure RRT: Renal Raplasman Tedavisi
SCCM: Society of Critical Care Medicine ScVO2: Santral Venöz O2 Satürasyonu
SIRS: Sistemik İnflamatuvar Yanıt Sendromu SOFA: Sequential Organ Failue Score
TAFI: Trombin Aktive Fibrinoliz Inhibitörü TLR: Toll Like Reseptör
TNF- α: Tümör Nekroz Faktör Alfa WBC: Lökosit
ŞEKİLLER VE GRAFİKLER
Şekil 1: LPS’nin Hücre Yüzeyini Tanımasının Şekilsel Anlatımı Şekil 2: Sepsiste SitokinlerŞekil 3: Böbreklerin Anatomik Yapısı Şekil 4: Nefronun Yapısı
Grafik 1: Grupların RDW ve ABH durumuna göre dağılımları Grafik 2: Gruplardaki exitus ve taburcu oranlarının dağılımı
TABLOLAR
Tablo 1: Sepsis TanımlarıTablo 2: Sepsiste Etkenler
Tablo3: Ampirik Antibiyotik Tedavisi
Tablo 4: Genel Popülasyonda Akut Böbrek Yetmezliğinin İnsidans Ve Mortalitesi Tablo 5: Prerenal ABH Sebepleri
Tablo 6: Renal ABH nedenleri
Tablo 7: ATN’ ye Yol Açabilen Edojen ve Eksojen Toxinler
Tablo 8: Prerenal ABH ile Renal ABH Ayrımında kullanılan kan- idrar tetkikleri Tablo 9: RIFLE sınıflaması
Tablo 10: AKIN sınıflaması
Tablo 11: KDIGO klavuzuna göre akut böbrek hasarının evreleri
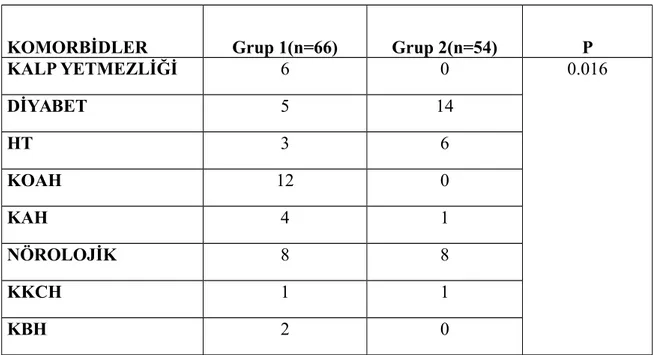
Tablo 12: KDIGO’nun önerdiği akut böbrek hasarının evre temelli yönetilmesi Tablo 13: RDW’ye göre Etyolojik Dağılım
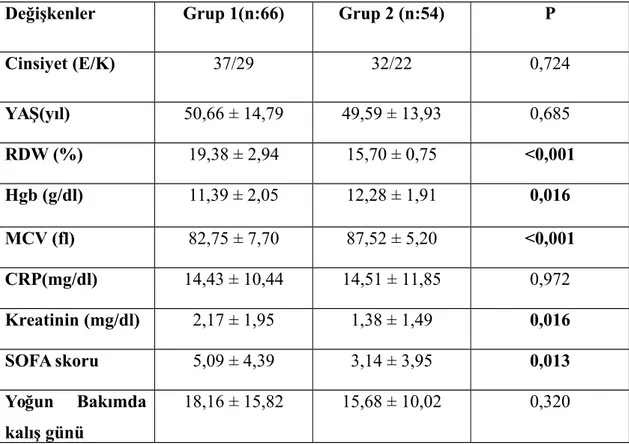
Tablo 14: Komorbid Durumlar Tablo 15: Student T Testi Tablo 16: Odds Ratio
ÖZET
Giriş ve Amaç: Yoğun bakım ünitesindeki(YBÜ) hastalarda gelişen akut
böbrek hasarı(ABH) morbidite ve mortaliteyi arttırır. Bu nedenle ABH’nın erken tanısı oldukça önemlidir. ABH dahil bir çok akut klinik durumda anemiden bağımsız olarak eritrosit dağılım genişliğinin (RDW) arttığı bildirilmektedir. YBÜ’de, ABH’nın etyolojisindeki en önemli nedenlerinden birinin sepsis olmasından dolayı bu çalışmada amacımız sepsisli hastalarda RDW’nin ABH üzerine etkisini değerlendirmektir.
Gereç ve Yöntem: Bu çalışmaya 2009-2013 tarihleri arasında Dicle
Üniversitesi Tıp Fakültesi Araştırma ve Uygulama hastanesi dahili yoğun bakım ünitelerinde sepsis tanılı 120 hasta dahil edildi. Hastaların demografik özellikleri, etyoloji ve komorbid durumları hasta dosyalarından alındı. Hastaların yoğun bakıma kabul ediliş anındaki veya 48 saat sonraki RDW, Hgb, Hct, MCV, CRP, kreatinin, SOFA Skoru, Ph, HCO3, Laktat, SO2, PaO2, PaCO2, yoğun bakımda kalış süresi ve sonuçları kaydedildi. Hastalar RDW değeri > % 16,8 (grup 1) ve ≤ % 16,8(grup 2) olarak 2 gruba ayrıldı. Sonra, ABH durumuna göre dört alt gruba ayrıldı.
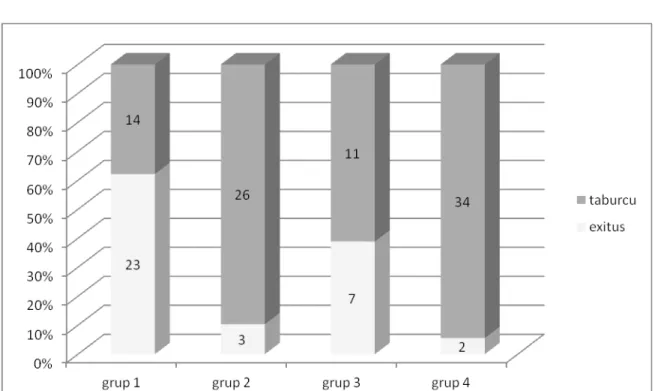
Bulgular: 120 hastanın 69’u erkek, 51’i kadındı. Yaş 50,18 ± 14,36 idi. Grup
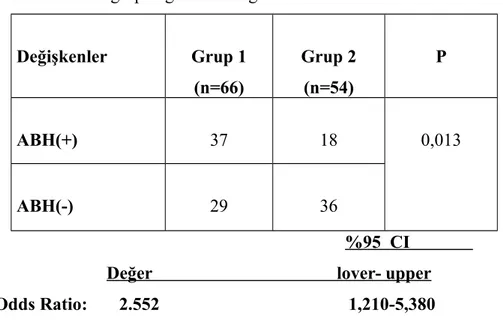
1’de 66 hasta, grup 2’de ise 54 hasta vardı. Grup 1’de RDW %19,38 ± 2,94 , HGB 11,39 ± 2,05 g/dl, MCV 82,75 ± 7,70 fL, CRP 14,43 ± 10,44, SOFA skoru 5,09 ± 4,39, kreatinin 2,17 ±1,95 idi. Grup 2’de RDW % 15,70 ± 0,75, HGB 12,28 ± 1,91 g/dl, MCV 87,52 ± 5,20 fL, CRP 14,51 ± 11,85, SOFA skoru 3,14 ± 3,95, kreatinin 1,38 ± 1,49 idi. RDW, HGB, MCV, SOFA skoru ve kreatinin açısından istatistiksel anlamlı fark görüldü(p<0.05). Grup 1’de hastaların 37’sinde ABH(+), 29 hastada ABH(-)idi. Grup 2’de hastaların ise 18’inde ABH(+), 36’sında ABH(-) (p=0,013)idi. Odds ratio 2,552 olarak saptandı. Grup 1’de ölüm oranı daha yüksek bulundu(p=0,006). Odds ratio 3,250 idi.
Sonuç: RDW’si yüksek olan sepsisli hastalarda ABH riski 2.5 kat artmakta ve
mortalite de yaklaşık 3.2 kat artmaktadır. RDW yoğun bakımda yatan sepsisli hastalarda ABH gelişimini öngören önemli bir parametre olabilir. Bu konuda geniş ölçekli çalışmalara gereksinim vardır.
ABSTRACT
Aim: Acute kidney injury (AKI) increases the morbidity and mortality in
patients in the Intensive care units (ICU). So, early diagnosis of AKI is very important. It has been suggested that red cell distribution width (RDW) is increased independently of anemia in many acute clinical conditions including AKI. Because the one of the most important causes in the etiology of AKI is sepsis, we aimed to evaluate the effect of RDW on AKI in patients with sepsis in the ICU, in this study.
Materials and Methods : 120 patients who were diagnosed with sepsis in
the intensive care unit of Dicle University Faculty of Medicine Research and Training Hospital were included in this study between 2009-2013. Patients’ demographics, comorbid conditions and sepsis etiology were taken from patient registries . RDW, HGB, HTC, MCV, CRP, creatinin, SOFA score, Ph, HCO3, laktat, SO2, PaO2, PaCO2, length of stay in intensive care unit and clinical outcomes of patients were recorded at the time of admission or 48 hours later. The patients were divided into two groups as group 1 (RDW >16.8%) and group 2 (RDW ≤16.8%). Then, they were divided into four subgroups acording to presence or absense of AKI.
Results: 69 of the 120 patients were male(% 57,5), 51 of them were
female(% 42,5). The mean age was 50,18 ± 14,36 years. In group 1; the mean RDW was 19,38 ± 2,94% , HGB was 11,39 ± 2,05 g/dl , MCV was 82,75 ± 7,70 fL , CRP was 14,43 ± 10,44 mg/dl, SOFA score was 5,09 ± 4,39 , creatinine 2,17 ±1,95 mg/dl. In group 2; the mean RDW was 15,70 ± 0,75 %, HGB was 12,28 ± 1,91 g/dl , MCV was 87,52 ± 5,20 fL, CRP was 14,51 ± 11,85 mg/dl , SOFA score was 3,14 ± 3,95 , creatinine was 1,38 ± 1,49 mg/dl. There were statistically significant difference between two groups in terms of RDW, HGB, MCV, SOFA score and creatinine(p<0,05). In group 1, 37 patients AKI(+) and 29 of them AKI(-). In group 2, 18 patients AKI(+) and 36 of them AKI(-) (p=0,013). The Odds ratio was 2,552. In group 1, the mortality rate was found higher than group 2(p=0,006). Odds ratio was 3,250.
Conclusion: The risk of AKI is increased approximately 2.5 times in patients
with sepsis who have high RDW and mortality is also increased approximately 3,2 times in this patients. RDW may be an important parameter which predict the development of AKI in patients with sepsis in ICU. Large-scale studies on this subject are needed.
1. GİRİŞ VE AMAÇ
Sepsis mortal seyretmesi nedeni ile yoğun bakım ünitelerinde ve acil serviste çok erken dönemde müdahale edilmesi gereken bir klinik tablodur. Akut böbrek yetmezliği (ABY) de bu tabloda morbidite ve mortaliteyi belirleyen en önemli faktörlerden biridir (1).
Yakın zamanda hücre biyolojisinde gerçekleşen ilerlemeler sayesinde sepsisin patofizyolojisi daha iyi anlaşılabilir hale gelmiş ve patofizyolojisinde rol alan mediyatörler ve sitokinler tanımlanarak bunların etki mekanizmaları ve vücutta gelişen metabolik değişimler belirlenmiştir (2,3). Bu mediyatörlerin salınımının düzenlenmesi, normal homeostaz ve vücut direnci için kritik önem taşır. Öte yandan bu mediyatörlerin gereğinden fazla veya az salgılanması, bazı organların hasarına, multiple organ yetmezliğine ve ölüme neden olur (4).
Sepsis ve özellikle septik şok ABH’nin en önemli sebeplerindendir. Sepsis tablosunda gelişen ABH multiorgan yetmezliğinin bir parçasıdır ve mortalite üzerinde belirgin bir etkisi vardır.(5)
ABY kavramı oldukça geniş kapsamlı bir tanımlamadır. Bunun yerine, yetmezlik öncesinde görülen süreçlerin klinik olarak daha iyi anlaşılması bakımından Akut Böbrek Hasarı (ABH) kavramının kullanımı tercih edilmektedir.
ABH’nin hastaneye yatan hastaların %5’inde, yoğun bakıma yatırılan hastaların ise %30’unda geliştiği ve bununda önemli bir oranda çoklu organ yetmezliğinin bir bileşeni olarak karşımıza çıktığı bilinmektedir. Son 30 yılda RRT teknolojilerinde gerçekleştirilen başarılı gelişmelere rağmen mortalite oranının halen %50 ve üzerinde olması, böbrek hasarının tedavisi konusunda halen alınacak çok yolun olduğunu göstermektedir.(138)
Tam kan sayımında bakılan eritrosit dağılım genişliği (RDW) dolaşımdaki eritrositlerin büyüklüklerinin dağılımını gösteren bir indekstir. RDW aneminin teşhisinde kullanılmakta olup yükselmesi hemolizde ve eritrositlerin yapım bozukluklarında gözlenmektedir (180). RDW sadece hematolojik hastalıklarda değil aynı zamanda pulmoner emboli (181), akut böbrek yetmezliği (182), pulmoner
arteriyel hipertansiyon(183), periferik arter hastalığı (184) ve inmede (185) de yükselmektedir.
Çalışmamızda Dicle Üniversitesi Tıp Fakültesi Dahili Yoğun Bakım ünitelerinde 2009 ile 2013 yılları arasında takip ve tedavi edilmiş 565 hastanın dosyası retrospektif olarak taranmıştır. Çalışma kriterlerimize uygun 18-70 yaş arası sepsis tanılı 120 hastada RDW nin ( eritrosit dağılım genişiliği) akut böbrek hasarı üzerine etkisinin değerlendirilmesi amaçlanmıştır
2. GENEL BİLGİLER
2.1.SEPSİS2.1.1. Sepsis, Tanım
Sepsis, birçok sistemi tutan, hemodinamik değişikliklere yol açan organ fonksiyon bozukluğu, organ yetmezliği ve şoka kadar gidebilen ölümcül bir enfeksiyon hastalığıdır (6). Çağımızdaki tüm gelişmelere rağmen enfeksiyon, sepsis, sistemik enflamatuvar yanıt sendromu (Systemic Inflammatory Response Syndrome, SIRS) ve ağır sepsis tanımları için 1991 yılında American College of Chest Physicians (ACCP) ve Society of Critical Care Medicine (SCCM) cemiyetlerinin ortak düzenledikleri uzlaşı konferansındaki tanımlar kullanılmaktadır (7). Bu tanımlar yapılırken amaçlanan mortalitesi yüksek olan bu klinik tablonun tanımlanmasında söz birliği olması, organ yetmezliklerinin erken tanınması, erken tedaviye başlanılması ve mortalitenin azaltılması, ayrıca yapılan çalışmaların standardizasyonunun sağlanabilmesidir.
Bu uzlaşı konferansında, uzlaşılan tanımlardan biri de SIRS’ dır. Adından da anlaşılabileceği gibi bu sendrom organizmanın tehditlere karşı verdiği sistemik nörohümoral, endokrin ve kardiyovasküler bir cevaptır. SIRS tanısı için hastada şu şartlardan en az ikisi olmalıdır:
Ateş (vücut ısısı > 38.0 ºC) veya hipotermi (vücut ısısı < 36.0 ºC), Taşikardi (kalp hızı > 90/dakika),
Takipne (solunum sayısı > 20/dakika) veya hipokarbi (pCO2 < 32 mm/Hg), Lökositoz (lökosit sayısı > 12.000/mm3) veya lökopeni (lökosit sayısı <
4.000/mm3) veya lökosit formülünde genç formların %10’ un üzerinde olması. SIRS enfeksiyonlara ya da enfeksiyon dışı olaylara bağlı (yanıklar, travma, pankreatit, pulmoner emboli vb.) gelişebilir. Bu uzlaşı konferansında enfeksiyona bağlı gelişen SIRS tablosu sepsis olarak tanımlanmıştır. SIRS tanımı; özgül olmaması, SIRS kriterlerini sağlamayan hastalarda da benzeri mortalite oranlarının görülebilmesi, sağlanan kriter sayısının artmasının mortalite üzerinde etkisinin olmaması nedenleriyle eleştirildi (8,9). Fakat tanım eksikliğinin olmaması, yatak
başında klinisyen tarafından kolaylıkla kriterlerin kullanılabilmesi ve alternatif yöntemlerin olmaması nedeniyle halen geçerliliğini korumaktadır (10,11).
Daha önceleri sepsis tanısında enfeksiyonun mikrobiyolojik olarak kanıtlanması hatta bakteriyemi şart koşulurken sepsis tanısı için mikrobiyolojik kanıtın gerekli olmadığı belirtilmiştir (12). Anlaşılmıştır ki mikrobiyolojik bulgular, klinik bulgularla eş zamanlı olarak ortaya çıkmamakta, mikrobiyolojik bulgular ile tedaviye başlamak önemli zaman kaybına neden olmakta ve çeşitli nedenlerle çok sayıda enfeksiyonda mikrobiyolojik kanıta ulaşılamamaktadır. Fakat yine de sepsis hastalarında mikrobiyolojik tanı birçok yönden önem taşımaktadır ve vazgeçilmezdir. Sepsise hipotansiyon veya laktat yüksekliği veya organ yetmezliği eşlik ederse klinik tablonun adı Ağır Sepsis’ tir. Ağır sepsiste hipotansiyon sıvı tedavisi ile düzeltilemiyorsa klinik tablo septik şok, hastanın tansiyonunu sağlamak için bir saatten uzun damar büzücü (vazopressör) tedavi gereksinimi varsa tanım refrakter
Tablo 1: Sepsis Tanımları Sistemik Enflamatuvar Yanıt Sendromu (SIRS)
Aşağıdakilerden en az 2’ sinin olması 1. Ateş > 38 ºC ya da < 36 ºC
2. Solunum sayısı > 20/dak ya da hipokarbi (pCO2 < 32mm/Hg)
3. Taşikardi (Kalp vurusu > 90/dak)
4. Lökositoz (lökosit sayısı > 12.000/mm3) veya lökopeni (lökosit sayısı < 4.000/mm3) veya lökosit formülünde genç formların %10’ un üzerinde olması
Sepsis SIRS varlığında kanıtlanmış enfeksiyon ya da ciddi enfeksiyon Şüphesi
Ağır Sepsis Sepsis ve aşağıdakilerden en az birinin olması: 1. Kapiller geri dolum zamanı > 3 sn
2. Cutis marmaratus
3. İdrar çıkışı < 0.5 ml/kg (en az bir saat) ya da renal replasman tedavisi ihtiyacı ya da kreatinin değerinin > 0.5 mg/dl artışı
4. Laktat > 2 mmol/L
5. Mental durumda bozulma ya da anormal elektroensefalogram
6. Trombosit < 100.000/mm3 ya da Dissemine İntravasküler Koagülopati (DİK)
7. Akut akciğer hasarı (ALI) (PaO2/FiO2 < 300) 8. Kardiyak disfonksiyon
9. İleus
10. Hiperbilirübinemi (total bilüribin > 4 mg/dl)
Septik Şok Ağır sepsis ve
1. Ortalama arter basıncı (OAB) < 60 mm-Hg (20- 30 ml/kg kolloid sıvıya ya da 40- 60 ml/kg kristalloid’e rağmen ya da ölçülen pulmoner kapiller kama basıncı 12- 20 mm-Hg iken) 2. Hipertansif hastalarda OAB < 80 mm-Hg ya da bilinen sistolik tansiyon değerinde 40 mm-Hg düşüş olması
3. Tansiyonu sağlamak için dopamin > 5 μg/kg/dak ya da norepinefrin < 0.25 μg/kg/dak ihtiyacı
Refrakter Septik Şok
OAB > 60 mm-Hg (hipertansiflerde > 80 mm-Hg) sağlamak için dopamin > 15 μg/kg/dak ya da norepinefrin > 0.25 μg/kg/dak olması
2.1.2. Epidemiyoloji
A.B.D’ nde sepsis insidansı 1979 yılında 87/100 000 iken, 2000’ de 240/100 000 kişidir. 2000 yılında A.B.D’ de sepsisten 120 491 kişi ölmüştür (100 000 de 43.7). A.B.D’ de sepsis insidansı her yıl %7–8 oranında artmaktadır [13]. Yeni tahminlere göre yılda 700 000 yeni sepsis olgusunun görüldüğü ve bunun da yaklaşık 200 000 ölümle sonuçlandığı düşünülmektedir. A.B.D’ nde Ulusal Sağlık İstatistikleri Merkezi (National Center for Health Statistics) verilerine göre sepsis, koroner dışı yoğun bakım ünitelerinde en sık ölüm sebebi olarak rapor edilmiştir. Bu artışın muhtemel sebebleri her geçen gün kronik hastalığı olan hasta sayısının artması, insan immün yetmezlik virüsü (HIV) epidemisi, kanser sıklığının artması, kemik iliği ve organ nakli hastalarının sayısının artması, bu hastaların daha agresif tedaviler alması olabilir.
1997-1998 yılları arasında sekiz ülkede ve 28 yoğun bakım ünitesinde (YBÜ) toplam 14364 hastada yapılan çalışmada 3034 hastada enfeksiyon saptanmıştır. Enfeksiyon saptanan hastalarda %28 sepsis, %24 ağır sepsis, %30 septik şok tanımlanırken, mortalite enfekte olmayan hastalarda %16.9 oranında iken hastane enfeksiyonu olan hastalarda %53.6 olarak gözlenmiştir (14).
Yapılan bir çalışmada hastaneye yatan tüm hastaların üçte biri ve yoğun bakıma kabul edilen hastaların %50’ si sepsis tanısı aldığı ve bu hastaların yarıdan fazlasında ağır sepsis, dörtte birinde septik şok geliştiği bildirilmiştir (15).
2006’ da yayınlanan bir çalışmada İngiltere’ de yoğun bakım ünitelerine kabul edilen hastaların %27’ sini ağır sepsis tanılı hastalar oluşturmaktadır (16). Kesin veriler olmamakla beraber Türkiye’de YBÜ’ deki hastane kaynaklı bakteriyemi/sepsis insidansı %7.6- 15.8 arasında bildirilmektedir (17,18).
Ağır sepsisin %80’ i halihazırda hastanede başka sebeplerden ötürü yatan hastalarda gözükmektedir (19).
2.1.3. Etiyoloji
Sepsis tablosu en sık bakteriler, bunları takiben sırasıyla mantarlar, virüsler ve parazitlerle meydana gelmektedir (20). Antibiyotikler öncesi dönemde bakteriyel enfeksiyonlar içerisinde gram pozitif bakteriler ağırlıkta iken, antibiyotikler sonrası dönemde gram negatif bakterilerin sıklığı artmıştır. Son 10 yılda ise yeniden gram
pozitif bakteriler daha sık görülmeye başlanmıştır (14,19). Bu konudaki en güncel veriler aşağıdaki tabloda görülebilir (Tablo 2).
Sepsis tanılı hastalarda %30–50 oranında etiyolojik etken saptanamamaktadır(21,22). Saptanan mikroorganizmaların önemli bir kısmını kommensal bakteriler oluşturmaktadır. Polimikrobiyal üremeler de nadir değildir.
Tablo 2: Sepsis Etkenler
Hesaplanan sıklık Gram pozitif bakteriler % 30-50
Metisilin duyarlı S. aureus % 14-24 Metisilin dirençli S. Aureus % 5-11 Diğer Staphylococcus spp. % 1-3 S. pneumoniae % 9-12 Diğer Streptococcus spp. % 6-11 Enterococcus spp % 3-13 Anaerop bakteriler % 1-2 Diğer gram pozitif bakteriler % 1-5
Gram negatif bakteriler % 25-30
Escherichia coli % 9-27 Pseudomonas aereginosa % 8-15 Klebsiella pneumoniae % 2-7 Diğer Enterobacter spp. % 6-16 Haemophilus influenza % 2-10 Anaeroplar % 3-7 Diğer gram negatif bakteriler % 3-12
Mantarlar Candida albicans % 1-3 Diğer candida spp. % 1-2 Parazitler % 1-3 Virüsler % 2-4 2.1.4. Patogenez
Sepsis etken mikroorganizma ile konağın immün, inflamatuvar ve koagülasyon cevabının etkileşmesi sonucu oluşmaktadır; yani hem etken mikroorganizma hem de
konağın cevabı sepsisten sorumludur (23). Enfeksiyona karşı konağı koruyan savunma mekanizmalarının bozulması, lokal veya sistemik enfeksiyonlara zemin hazırlar. Sözü geçen konak savunma mekanizmalarını üç kategoride toplayabiliriz;
anatomik bariyer, hücresel defans (fagositik hücreler, lenfositler vb), spesifik ve nonspesifik hümoral defans (18). Bakteriyel enfeksiyonlara karşı organizmayı
koruyan en önemli defans sistemi anatomik bariyerdir. Sağlam deri ve mukozalar mikroorganizmaların daha derin dokuya girmelerini engeller. Travma, yanık veya perkütan damariçi kateterler bu bariyeri kıran etmenlerdir. Gastrointestinal mukoza ve diğer mukozalar sitotoksik ilaçlar ve radyasyon tedavisinden zarar görürler. Diğer önemli bir savunma mekanizması ise vücut sekresyon ve ekskresyonlarının normal akımıdır. Bu bölgelerin obstrüksiyonu, o anatomik bölgede doku basıncının artmasına, kan akımının azalmasına ve bakteriyel çoğalmaya neden olur (örn: safra yolları enfeksiyonları, postobstrüktif pnömoniler ve bazı üriner sistem enfeksiyonları) (24,25).
Ağır sepsis hastalarının önemli bir kısmı hastanede başka bir sebepten ötürü yatmakta olan hastalardan oluşmaktadır, bu grup hastalarda patogenezdeki önemli noktalardan biri konak savunma sisteminde, anatomik bariyerde olan zaafiyettir. Hastane dışında gelişen sepsislerde en sık giriş kapısını solunum sistemi ve üriner sistem oluşturur iken, hastane kökenli sepsislerde damariçi kateter ve üriner kateter enfeksiyonları oluşturmaktadır. Yoğun bakım ünitelerinde ise hastane kökenli ve mekanik ventilatör ilişkili pnömoniler ön plana çıkmaktadır (26,27).
Mikroorganizmalar deri ve mukozalarda oluşan bariyeri geçtiklerinde doğal bağışıklık sisteminin üyeleri olan makrofajlar, mast hücreleri ve dendritik hücreler ile karşılaşırlar. Dokularda bulunan bu hücreler gelişmiş reseptörleri sayesinde bakterilere ait lipopolisakkarid (LPS), teikoik asit, lipoteikoik asit, peptidoglikan, dış membran proteinleri, deoksiribonükleik asit (DNA), ribonükleik asit (RNA), ısı şok proteinleri, lipopeptid, flajella, fimbria gibi yapıları tanırlar (28). Gram negatif bakterilerde hücre duvar komponentleri olan LPS yapısındaki endotoksinler, sepsisi tetikleyen moleküllerin başında gelir. LPS, lipopolisakkarid bağlayıcı proteine (LBP) bağlanarak CD14 (cluster of differantiation 14) vasıtasıyla makrofaj yüzeyinde bulunan Toll-like reseptör-4’ ü (TLR-4) uyarır. TLR monosit ve makrofaj yüzeyinde bulunan mitojen aktive protein kinaz (MAPK), nükleer faktör kappa-B (NF-kB) ve
bir dizi transformasyon genini uyarabilen bir reseptör ailesidir (29,30). Günümüze kadar insanlarda TLR ailesinin 10 üyesi tanımlanmıştır, TLR-4 ilk tanımlanan ve LPS bağlayan reseptördür (31). LPS CD-14 aracılığı ile makrofaj yüzeyinde bulunan TLR-4’ e bağlandığında hücre içinde tümör nekroz faktör alfa (TNF-α) gibi pek çok sitokin (IL–1, IL–12), kemokin (IL–8, makrophage inflammatory protein [MIP]-1α), lipit mediyatörleri (prostoglandinler, lökotrienler) sentezleyecek kaskatları ve T hücre alt gruplarının farklılaşmasını tetikler (32). LPS immün hücre yüzeyinde bulunan MSR (Macrophage scavencer receptor), CD11b, CD18 ve iyon kanallarına bağlanarak da etki göstermektedir. Ayrıca genetik mutasyonu olanlarda NOD-1 ve NOD-2 (nucleotide-binding oligomerization domain) reseptörleri aracılığıyla da bağlanma olabilmektedir (şekil 1) .
Şekil: 1 (23 no’ lu referanstan alınmıştır.)
Gram negatif bakteri enfeksiyonlarında ana mediyatör yanıt TNF-α ‘dır (33). Bu sitokinin düşük dozlarda etkileri lokaldir, ana etkilerini lökosit ve endotel hücreleri üzerine yapar; bakteri öldürülmesi ve endotel geçirgenliğinde artış meydana
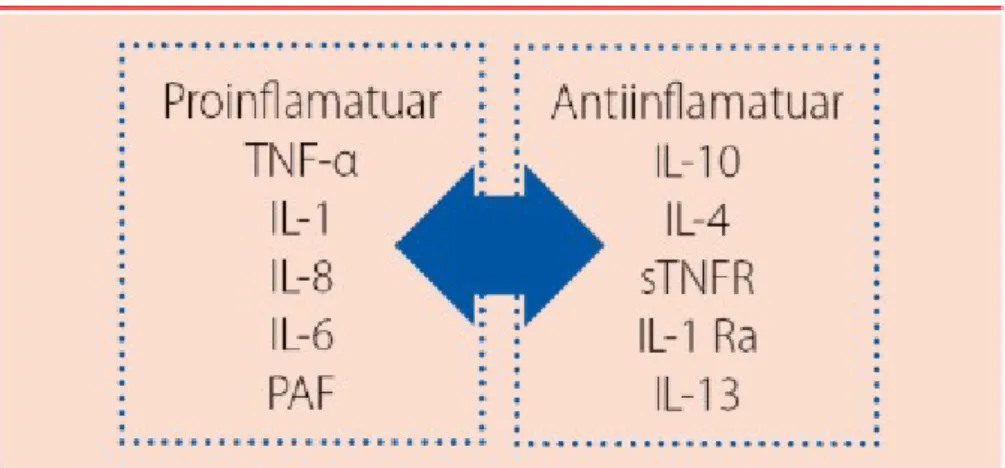
gelir. TNF-α aynı zamanda IL-1 ve IL-6 üretimini arttırır, bu sitokinlerin artışı sonucu koagülasyon kaskadını başlatan faktör VII üretimi artar. TNF-α ayrıca karaciğerden akut faz proteinlerinin (örn: C reaktif protein, serum protein A vb.) üretim ve salınımını arttırır. Enfeksiyona sistemik cevap bu salınan mediyatörler tarafından oluşturulur. Bu mediyatörlerin bir kısmı enflamasyonu arttırıcı (TNF-α, IL-1, IL-6 vb) ve bir kısmı ise enflamasyonu önleyici (IL-4, IL-10) özelliğe sahiptir (şekil 2). Normalde sitokin cevabı belli bir denge içerisinde düzenlenir. Bu düzenin bozulmasını proenflamatuvar reaksiyon veya kompensatuvar antienflamatuvar reaksiyon takip eder. Bu reaksiyonların sonucu olarak sepsis klinik tablosu ortaya çıkar (34,35).
Şekil 2: sepsiste sitokinler
Antienflamatuvar etki ile yangı dışı bölgede lökosit-endotel etkileşimi (adezyon yapışma) baskılanır, yangı bölgesinden sızan kimyasal medyatörleri etkisizleştirecek maddeler salgılanır. Pankreatitli hastalarda yapılan bir çalışmada assit sıvısında enflamatuvar sitokinler baskın iken, lenf nodlarında ve plazmada anti-enflamatuvar sitokinlerin baskın olduğu saptanması buna örnektir (36). Gözlenen bu sistemik antienflamatuvar yanıt hastalarda immün baskılanmaya ve ikinci enfeksiyon ataklarına sebep olabilir.
2.1.5. Organ Yetmezlik Gelişimi
Lokal mikrobiyolojik tehdide verilen immün yanıt, mikroorganizmanın yok edilememesi ve uzak organlarda gelişen bozuklukların kesin nedeni tam olarak
kendileri ya da toksinlerinin etkisi ile sistemik etkilerde bulunabilirler (örn: Staphylococcus aureus toksik şok toksini vb.) (37). Enfeksiyona bağlı sistemik bulguların ortaya çıkmasında birincil sorumlu mikroorganizmanın kendisi değil enfeksiyon bölgesi ve mikroorganizma giriş kapısında sınırlandırılamazsa, sistemik dolaşıma katılan sitokinlerdir (38). Bakteriyemi uzak organlardaki etkilerin oluşması için şart değildir ama bir enfeksiyon sırasında bakteriyeminin olması enfeksiyonun sınırlandırılamadığının göstergesi olduğu için önemlidir.
2.1.5.1. Endotel Hücrelerinin Rolü
Sepsiste hedef organ damar endotelidir ve hemen hemen bütün mediyatörler damarlar üzerine etkilidir. Endotoksin, TNF-α, IL-1, Platelet Activated Factor (PAF), lökotrienler, tromboksan A2 ve nitrik oksit (NO) endotel permeabilitesini artırır. Kompleman sisteminin aktivasyonu doğrudan veya nötrofilleri aktive ederek dolaylı olarak damar geçirgenliğini bozar. Ayrıca degranülasyon esnasında nötrofillerden açığa çıkan toksik oksijen radikalleri ve lizozomal enzimlerde endotel permeabilitesini arttırır. Endotel hücreleri, hem pıhtılaşmayı hem de enflamasyonu düzenleyen önemli moleküller salgılar. Normal koşullarda, endotel baskın olarak antikoagülan ve antitrombotik özellikler taşır. Bunu doku faktörü inhibitörleri, trombomodulin, nitrik oksit ve prostasiklin ekspresyonu ile sağlar (39). Bir anatomik yerde yeterli endotel hasarı oluşunca, orada organ perfüzyonu bozulur ve organ yetmezliği gelişir. Enflamasyon kontrol altından çıktığı zaman birçok yerde endotel hasarı oluşur ise multiorgan yetmezliği ile sonuçlanır. Yine de sepsiste şok, pek çok sebebe bağlı olarak gelişebilir (distrübitif, hipovolemik, kardiyojenik, sitotoksik)(40).
2.1.5.2. Hipovolemi
Sepsiste ortaya çıkan mediyatörlere bağlı olarak venöz göllenme, kapiller geçirgenlik artışı ile damar içi efektif volümde kayıp gözlenir. Eğer hastalar bu dönemde iyi tedavi edilmezlerse vazokonstrüksiyonun ve düşük kardiyak atımın hakim olduğu soğuk şok tablosu gelişir. Eksik volüm yerine konursa vazodilatasyon
oluşur ve sistemik vasküler direnç düşer. Vazodilatasyonun egemen olduğu yüksek kardiyak atımlı şok tablosundan sorumlu durumlar (11):
Katekolaminlere karşı gelişen taşiflaksi ve vasküler düz kas hücrelerinde katekolaminlerin damar büzücü etkisine direnç gelişimi (41),
Adrenerjik reseptörlerin regülasyonunu sağlayan glukokortikoidlerin, üretiminin yetersiz olması, kortikoid direnci,
Nitrik oksit salınımı (enfekte dokudan ve enfekte dokuya uzak endotelden) (42) ,
Barorefleks mekanizmaların bozulması ve nörohipofizer vazopressin depolarının boşalması sebebiyle azalan vazopressin düzeyleri (43),
PAF salınımı,
Bradikinin salınımı (44),
Hipoksinin ve laktatın aktive ettiği damar düz kas hücrelerindeki K ATP kanalları (45).
Kanda dolaşan yüksek düzeyde damar büzücü hormonlara (norepinefrin, epinefrin, endotelin-1 anjiotensin-II) rağmen enflamasyonun tetiklediği vazodilatasyon baskın hale gelir.
2.1.5.3. Kardiyovasküler Disfonksiyon
Septik hastalarda kalp kası kasılması bozulmuş ve ejeksiyon fraksiyonu düşmüştür. Düşük ejeksiyon fraksiyonunu kompanze etmek için hastalarda ventriküler dilatasyon gözlenir (46). Kalp işlevi bozukluğundan TNF-α ve nitrik oksit salınımı da sorumludur. NO hücre içi kalsiyum metabolizmasını bozarak, süperoksit oluşumunu arttırarak ve vazodilatasyon sonucu kardiyak kontraktiliteyi bozarak etki eder (47). Kalp işlev bozukluğunun bir diğer mekanizması da mikrovasküler dolaşım bozukluğuna bağlı hipoksidir.
2.1.5.4. Yaygın Damar İçi Pıhtılaşma
Sepsiste önemli bir konu da prokoagulan faktörlerde artış ve antikoagulan faktörlerde azalma ile birlikte prokoagulan-antikoagulan dengesindeki değişikliktir.
Sepsiste doku faktörünün tetiklediği koagülasyon kaskadı nedeniyle faktör 7 (ekstrensek yolak) üzerinden trombin oluşumu gözlenir (48). Trombin’ in kendisi faktör 8’ i ve faktör 11’ i tetikleyerek intrensek yolu da aktive eder, dolaşımda mikrotrombüsler oluşur. Kontrolsüz devam eden pıhtılaşmalar sonrası tüketime bağlı kanamalar olabilir. Diğer yandan sepsiste tüketime bağlı ve azalmış senteze bağlı olarak protein-C, protein-S, antitrombin III ve doku faktör yolu inhibitörü düzeyleri azalmıştır. Bu azalış pıhtılaşmaya yatkınlığı daha da arttırır (23).
2.1.5.5. Mikrovasküler Dolaşım Yetersizliği
Ağır sepsis ve septik şokta spektrofotometrik görüntüleme ile yapılan ölçümlerde mikrovasküler dolaşımda şantlar saptanmıştır (49). Bu şantlar mikrotrombüslere, hasarlanan endotel hücrelerinin şişerek mikrovasküler lümeni tıkamasına, aktive lökositlerin endotele yapışmasına bağlı olarak akışkanlığı bozmasına, eritrosit duvarının elastikiyetinin bozulmasına bağlı olarak mikrovasküler dolaşımı bozmasına bağlı olabilir (50). Oluşan şantlara bağlı olarak pompalanan kanın dağılımında da bozukluk vardır. Serebral dolaşım korunmaya çalışılırken, mezenterik kan akımı azalır (51). Ağır sepsis ve septik şokta görülen laktat yüksekliği ve metabolik asidoz doku hipoksisini ve mikrovasküler dolaşım bozukluğunun göstergesidir.
2.1.5.6. Apopitozis
Ağır sepsis/septik şok patogenezinde, apopitoz yoluyla hücre ölümünün önemli rol oynadığına dair bulgular giderek artmaktadır. Deneysel sepsis modellerinde, LPS ve TNF-α gibi pek çok proenflamatuvar mediyatörün, endotel ve diğer çeşitli hücre tiplerinde apopitoza neden olduğu gösterilmiştir (52). Septik şoktan ötürü ölen hastalarda yapılan otopsi çalışmalarında hastaların organlarında organ yetmezliğini açıklayacak derecede nekroz saptanmaması, organ yetmezliği gelişen hastaların iyileştiklerinde kardiyak ve renal fonksiyonlarının normale dönmesi bu görüşü desteklemektedir (53). Lenfositlerde, dendritik hücrelerde, dalak ve lenfoid dokuda gösterilen apopitozisin, sitokinlerin selüler kaspaz 8’ i ve kaspaz 3’ ü aktive
etmesiyle meydana gelmektedir (54). Ağır sepsiste bir sonraki tedavi hedefi bu yolaklardır.
2.1.6. Klinik Bulgular
Sepsis enfeksiyona karşı gelişen sistemik inflamatuvar yanıt sendromu olarak tanımlanır. Klinikte SIRS bulguları önemli olmasına rağmen her hastada SIRS bulgularının olmayabileceği, sepsisin son derece silik bulgularla seyredebileceği, hastanelerde her türlü klinik bozuklukta sepsisin hatırlanması ve aktif bir tedavi uygulaması başlanması önerildiği görülmektedir (55).
Sepsis tanımlarının çeşitli sorunları nedeniyle ileride kullanıma girebilecek başka tanımlama sistemleri de ortaya atılmıştır. PIRO (P:predisposition, I:infection, R:response, O:organ dysfunction) bir evrelendirme sistemi olarak sepsisi tanımlayan ve klinik kullanımı için zaman gereken bir öneri sistemidir (56).
Her enfeksiyon hastalığında olduğu gibi ayrıntılı öykü ve fizik muayene önem taşır. Fizik muayenede enfeksiyon odağına ait bulgular saptanabilir; yakın dönemde geçirilmiş cerrahiler, hasta üzerinde takılı olan yapay cihazlar (port kateteri, protez, kalp pili vs) sorgulanmalı ve muayene edilmelidir. Tüm pansumanlar açılıp yara yerleri dikkatlice kontrol edilmelidir. İmmobil hastalarda bası yerleri mutlaka dikkatlice muayene edilmelidir. Göz dibi bakısında kandida endoftalmiti yakalanabilir. Fakat tüm detaylı incelemelere rağmen enfeksiyon odağı saptanamayabilir.
Daha önceleri sepsis tanısında enfeksiyonun mikrobiyolojik olarak kanıtlanması hatta bakteriyemi şart koşulurken günümüzde sepsis tanısı için mikrobiyolojik kanıt gerekli değildir (57). Anlaşılmıştır ki mikrobiyolojik bulgular, klinik bulgularla eş zamanlı olarak ortaya çıkmamakta, mikrobiyolojik bulgular ile tedaviye başlamak önemli zaman kaybına neden olmakta ve çeşitli nedenlerle çok sayıda enfeksiyonda mikrobiyolojik kanıta ulaşılamamaktadır.
Fakat yine de sepsis hastalarında mikrobiyolojik tanı birçok yönden önem taşımaktadır ve vazgeçilmezdir. Periferik kan sayımında nötrofil hakimiyetinde lökositoz saptanabilir. Nötrofil yanıtının ayırıcı tanıda işe yaramadığı fakat tedavi etkinliğinin takibi yönünden faydalı olabileceği öne sürülmektedir. Lenfopeni nötrofili gibi bakteriyemi belirleyicilerinden olabileceği belirtilmiştir (58). Bunun
nedeninin lenfosit yüzeyinde sepsis patogenezinin başlıca mediyatörü olan TNF-α bağlayabilen çok sayıda reseptör olduğu ve TNF-α ile uyarım sonucu lenfositlerin apopitozise uğradığı belirtilmiştir (59). Trombositopeni de görülebilmektedir, trombositopeni öncelikle yaygın damar içi koagülasyonunu düşündürmelidir, ancak enfeksiyona bağlı kemik iliği baskılanması ve immün yıkım unutulmamalıdır. Serum trigliserid düzeyleri, serbest yağ asitleri artar (60), azalmış lesitin kolesterol açil transferaz aktivitesine bağlı olarak düşük ağırlıklı lipoprotein (LDL) ve yüksek ağırlıklı lipoprotein (HDL) düzeyleri azalır (61). Sepsiste artan insülin direncine bağlı hiperglisemi görülebilir (62). Hipogliseminin olması akla adrenal yetmezliği getirmelidir. Böbrek yetmezliğine bağlı üre kreatinin yüksekliği saptanabilir. Akut akciğer hasarına bağlı hipoksi (PO2/FiO2 < 300 mm-Hg) görülebilir. Şoka bağlı gelişen şantlar nedeniyle mezenterik dolaşım bozulur, gastrointestinal sistemde hipoperfüzyona bağlı ileus gelişebilir, gastrointestinal duvar geçirgenliğinin artması bakteriyel translokasyona yol açabilir. Karaciğer enzimlerinde kolestatik tarzda yükselme olabilir. Hipofizer hormonların pulsatil salınımı bozulur (63). Adrenokortikotropik hormon (ACTH) uyarısına yetersiz kortizol yanıtı ile karakterize rölatif adrenal yetmezlik gelişebilir (64). Serum laktat düzeyleri artmış olabilir, yüksek laktat düzeyleri bozulmuş dolaşımı ve doku hipoksisini gösterebileceği gibi, artan glikolize bağlı artan pürivat düzeyi ile ve azalmış hepatik klirens nedeniyle de olabilir (65). CRP; TNF-α, IL-1 ve IL-6 uyarısıyla başlıca karaciğerden sentezlenen, bir akut faz proteinidir. Uyarımdan ortalama 4-6 saat sonra salgılanması başlar ve pik değerine 36-50 saatte ulaşır. Sepsis tanısında duyarlılığı %68-98.5 arasında, özgüllüğü %40- 78 arasında bulunmuştur (66). CRP değerinin günlük ölçümü hızlı, ucuz ve tekrarlanabilir olması nedeniyle sepsis tanısı ve tedaviye yanıt değerlendirmesinde önerilmektedir (67).
Prokalsitonin TNF-α ve interlökinlerin uyarısı ile enflamasyonun erken dönemlerinde saptanabilir, ancak travma veya SIRS gibi değişik enflamatuar durumlarda yüksek seyrettiği için sepsisi ayırt etmede yetersiz kalmaktadır (68). Hastalardan kan kültürleri ve enfeksiyon odağı şüphenilen bölgelerden kültürler alınmalıdır. Örnekler doğrudan mikroskopik bakı, gram boyama ile incelenmelidir. Hala hazırda durumu kritik hastada bakteriyel enfeksiyon olup olmadığını gösterecek
dolayısı ile antibiyotik başlanıp başlanmayacağını saptayabilecek genel kullanımda bir biyokimyasal parametre yoktur.
2.1.7. Tedavi
2.1.7.1. Antimikrobiyal Tedavi
Sepsis tedavisinin esasını antimikrobiyal tedavi ve destek tedavisi oluşturur. Pek çok çalışmada erken başlanan uygun antimikrobiyal tedavinin sağkalımı arttırdığı gözlenmiştir. Kültürlerin alınması ardından destek tedavisi ve olası mikrobiyal ajana yönelik ampirik antibiyotik tedavisinin hemen başlanması, kültür-antibiyogram sonuçlarında pozitiflik saptanması halinde gerekli ise antibiyoterapinin yeniden düzenlenmesi önerilmektedir (69). Seçilen antibiyotik bakterisit etkili olmalı ve damar yolundan verilmelidir. İkili antibiyotik tedavisinin tekli tedaviye üstünlüğü gösterilememiştir.
Sistemlere göre ampirik antibiyotik önerileri tablo 3’ te verilmiştir
Tablo 3: Ampirik Antibiyotik Tedavisi
Şüphenilen Enfeksiyon Bölgesi Antibiyotik Rejimi Pnömoni
Toplum kökenli İkinci ya da üçüncü kuşak sefalosporin + Makrolid
/Karbapenem + Aminoglikozid
Üriner sistem
Toplum kökenli Sulbaktam-ampisilin / üçüncü kuşak sefalosporin
+ Aminoglikozid
Hastane kökenli Antipsödomonal betalaktam +
Aminoglikozid
Deri ve yumuşak doku
Toplum kökenli Penisilin G +
Antistafilokokkal betalaktam Hastane kökenli Antipsödomonal betalaktam / üçüncü kuşak sefalosporin
+ Aminoglikozid
İntra-abdominal ve bilier sistem
Toplum kökenli Metronidazol/klindamisin +
Kinolon / üçüncü kuşak sefalosporin Hastane kökenli Karbapenem + Antifungal ?
Nötropenik Antipsödomonal betalaktam /
Sefepim +
Aminoglikozid (11-18-34) no’ lu referanslardan uyarlanmıştır
Apsesi olan ya da içi boş organlarda obstrüksiyon neticesinde oluşan enfeksiyonu olan hastalarda uygun olan girişimsel müdahaleler yapılmalı, hastane kökenli sepsislerde tüm damar içi kateterler ve üriner kateterler değiştirilmelidir. Odağı belirlenemeyen toplum kökenli hastalarda muhtemel odak akciğerler ya da üriner sistemdir. Yine de enfeksiyon odağı aşikar olmayan hastalarda endokardit, septik artrit, osteomyelit, karın içi sebepler araştırılmalıdır.
2.1.7.2. Destek Tedavisi
Septik şokun ana özelliği azalmış periferik direnç ve buna ikincil dağılımsal bozukluklardır. Erken dönemde venodilatasyon ve mikrovasküler yapılardan sıvı kaçağı sonucu oluşan volüm kaybı ve kardiyak ön yük azalması yeterli sıvı tedavisi ile geri dönüştürülebilmektedir. Mortaliteyi ve organ yetmezliği gelişimini azaltmak
için hastalara tanı konur konmaz uygun antibiyotik tedavisi ile beraber uygun sıvı tedavisi de başlanmalıdır. Uygun sıvı tedavisi için hedefler (70);
Ortalama arter basıncı > 65 mm-Hg İdrar çıkışı > 0.5 ml/kg/saat
Santral venöz basınç (CVP) : 8–12 mm-Hg Santral venöz O2 satürasyonu: (ScVO2) > %70
Ağır sepsis, septik şok tablosunda olan hastalara hem sıvı tedavisi miktarına kılavuzluk etmesi için hem de vazoaktif ilaçların ve diğer tedavilerinin aksatılmadan verilebilmesi için en kısa zamanda santral venöz kateter takılmalıdır. Hastalara verilecek sıvının kesin miktarı yoktur. Akciğer ödemi oluşmaması için santral venöz basınç takip edilmelidir. Akciğer ödemi bir basınç problemidir ve pulmoner yatakta hidrostatik basınç > 18 mmHg olduktan sonra başlar. Kolloid sıvılar ve kristaloidler arasında birbirlerine üstünlük yoktur (71). Hücre dışı bölgelerde dağılım açısından farkları olduğu için aynı etkiyi sağlamak için kolloid sıvıya oranla yaklaşık 3 kat daha fazla kristaloid sıvı verilmesi gereklidir. Kristaloidler damar içi yataktan doku arasına dağıldığı için daha çok ödeme yol açabilirler. Albümin de kristaloidler kadar güvenlidir, fakat maliyetlidir.
Hedef hemoglobin değeri 7-9 gr/dl olacak şekilde eritrosit transfüzyonu yapılmalıdır. Eğer hedef ScVO2 değeri sağlanamıyor ise hastalara dobutamin infüzyonu başlanmalıdır. Verilen sıvı tedavisine rağmen hedef basınçlar sağlanamıyorsa damar büzücü tedaviler başlanmalıdır, tedavi seçenekleri olan dopamin ve norepinefrinin birbirlerine gösterilmiş üstünlüğü yoktur. Norepinefrinin inotropik ve kronotropik etkisi dopamine kıyasla daha azdır ancak ilk tercih edilecek damar büzücü ilaç dopamindir (70). Renal dozda dopamin tedavisinin yeri yoktur. Hastalara verilen sıvı, inotrop, damar büzücü tedavilere rağmen ScVO2 hedefi tutturulamıyorsa hastalar mekanik ventilatöre bağlanıp sedatize edilerek oksijen sunumu ve tüketimi optimuma getirilmelidir.
2.1.7.3. Steroid Tedavisi
Stres durumunda hipotalamik-hipofizer-adrenal aksın sitokinler, hipotansiyon, doku zedelenmesi gibi etkenlerle uyarılmasıyla kortikotropin ve dolayısıyla kortizol salınımı artmaktadır. Stres durumunda normal adrenal cevabın
kortizol seviyesini 18-20 μg/dl’ nin üzerine çıkartması beklenmektedir. Sepsisli hastalarda herhangi bir zamanda bakılan serum kortizol seviyesinin 10 μg/dl’ nin altında veya serum kortizol seviyesi 10-34 μg/dl arasında olup da kortikotropin uyarı testine 9 μg/dl’ nin altında yanıt olması hastalarda adrenal yetmezliğin olduğunu desteklemektedir. Kanıtlanmış veya şüpheli adrenal yetmezlikli ağır sepsis/septik şoktaki hastalara 50 mg hidrokortizonun her altı saatte bir (300 mg/gün) damardan, yedi gün süre ile verilmesi önerilmektedir (72).
2.1.7.4. Yoğun İnsülin Tedavisi
Ciddi hastalık halinde diyabet olmasa dahi insülin direncine ve insülin karşıtı hormonların artışına bağlı hiperglisemi görülmektedir. Hipergliseminin bakteri fagositozu üzerinde olumsuz etkileri, insülinin de anti-apopitotik etkileri gibi immün sistem üzerine etkileri olduğu bilinmektedir. Kan şekerinin 80-110 mg/dl arasında tutulmasının mortaliteyi %34 oranında azalttığı aynı zamanda bakteriyemi insidansını, akut böbrek yetmezliği gelişimini ve polinöropati görülme sıklığını azalttığı belirtilmektedir (73). 2008 de yayınlanan sepsis kılavuzunda hedef kan şekeri 150 mg/dl altı olarak belirlenmiştir (70). Saygılı f. Ve ark’nın yaptığı bir çalışmada sıkı kan şekeri kontrolü ile mortalite kazancı olmamakla birlikte benzer morbidite kazancı elde edildiği saptanmıştır (74).
2.1.7.5. Aktive Protein C (APC) Tedavisi
Trombin oluşumunu kontrol eden ana sistem ve enflamatuvar yanıtı sınırlandıran sistem APC üzerinde kesişmektedir. APC Faktör Va ve VIIIa’ yı geri dönüşümsüz olarak inhibe ederek aPTT’ yi uzatır, plazminojen aktivatör inhibitörü 1’ i (PAI 1) ve trombin aktive fibrinoliz inhibitörü’ nü (TAFI) inhibe ederek fibrinolitik sistemi etkiler. Bunun yanında endotelde bulunan protein C reseptörlerine bağlanarak nükleer-κβ’ yı inhibe ederek sitokin salınımını engeller. Prowess çalışmasında drotrecogin alfa (rekombinant aktive protein C) tedavisinin mortaliteyi %30.8’ den %24.7’ye düşürdüğü saptanmıştır (75).
2.1.7.6. Organ Yetmezlik Tedavisi
Sepsis tanısı ile izlenen hastalarda gelişen akut böbrek yetmezliğinin mortalite artışı ile ilişkili olduğu bilinmektedir. Sepsis ilişkili akut böbrek yetmezliğinde (ABH) böbrek yerine koyma tedavisi ihtiyacı %58-70 arasındadır. Konvansiyonel diyaliz ile düşük akımlı kesintisiz diyaliz tedavilerinin mortaliteye etki açısından birbirlerine üstünlükleri yoktur (76). İlerleyici hipoksemi, hiperkapni veya solunum kaslarında zaafiyet durumlarında hastalara mekanik ventilatör desteği sağlanmalıdır. Mekanik ventilatör ihtiyacı olan hastalara sedoanaljezik ilaçlar uygulanarak etkin sedoanaljezi sağlanmalıdır. Mekanik ventilatöre bağlı hastalara stres ülseri gelişimi açısından risk altında olduklarından ülser profilaksisi verilmelidir. Aktif kanaması ve koagülopatisi olmayan tüm ağır sepsis ve septik şoklu hastalara derin ven trombozu oluşumunu önleyici tedaviler (heparin, düşük molekül ağırlıklı heparin) verilmeli, kompresyon çorapları giydirilmelidir.
2.1.8. Prognoz
Sepsis tedavisinde yeni gelişmelere rağmen ölüm oranı hala yüksektir. Değişik çalışmalarda ölüm oranları %20-80 arasında bildirilmektedir. Takip eden 6 ay içinde enfeksiyonun zayıf kontrolü, immün baskılanma, yoğun bakıma ait komplikasyonlar, organ yetmezlikleri ve altta yatan hastalıklara bağlı olarak ölüm riski normal popülasyona oranla yüksek seyretmektedir. Hangi hastalarda sepsis seyrinin daha ağır olacağı agresif tedavilerin erken başlaması açısından önem taşımaktadır. Bu nedenle hastalık ağırlığını öngören skorlama sistemleri geliştirilmiştir.
APACHE skoru: Acute Physiology And Chronic Health Evaluation II Knaus
ve ark. tarafından ilk olarak 1981 yılında geliştirilen APACHE skorunun, revize edilmiş ve basitleştirilmiş bir versiyonu olup hastalık şiddetinin genel bir ölçüsünü sağlamak üzere rutin olarak ölçülen 12 fizyolojik parametre, yaş ve önceki sağlık durumu bilgisine dayalı bir skorlama kullanmaktadır. Kayıt edilen parametreler hastanın yoğun bakıma kabul edildikten sonraki ilk 24 saat içerisindeki en kötü değerleridir. Mümkün olabilen maksimum APACHE II skoru 71 olup, yüksek skorlar mortalite ile çok iyi bir ilişki göstermektedir.
SOFA skoru: Sequential Organ Failure Assesment skoru ağır sepsis
hastalarında gelişen organ yetmezliğini değerlendirmek için geliştirilmiş 6 organ sisteminin (solunum, koagülasyon, karaciğer, kardiyovasküler sistem, börekler, santral sinir sistemi) değerlendirildiği bir skordur. Ağır sepsis hastalarının gidişatının günlük olarak değerlendirilmesini sağlar. Skorda kötüleşme artan mortalite ile ilişkilidir. Tüm bu skorlama sistemlerine rağmen hastalığın tanısı ve takibinde ağırlığını gösteren ucuz, tekrarlanabilir, pratik biyokimyasal belirteçlerin yokluğu bir sıkıntıdır. Bu amaçla yapılan çalışmalar lökosit formülü, CRP, prokalsitonin ve TNF-α üzerinde yoğunlaşmaktadır ancak bu ölçümlerin tanı anındaki değerlerinin hastalığın mortalitesi üzerinde belirleyiciliği konusunda farklı görüşler bulunmaktadır.
2.2.AKUT BÖBREK YETMEZLİĞİ 2.2.1. Böbreklerin Anatomisi
Böbrekler retroperitoneal boşlukta yer alan organlar olup, T12 düzeyinden L3 düzeyine uzanırlar. Karaciğerin pozisyonundan dolayı sağ böbrek sola göre biraz aşağıdadır. Böbreğin yetişkin bir insandaki boyutları kişinin vücut yüzey alanıyla değişmekle birlikte yaklaşık olarak: uzunluğu 12-13 cm, eni 6-7 cm ve derinliği 3 cm’dir. Ortalama ağırlığı 115-170 g’dır(77,78).
Şekil:3 Böbreklerin anatomik yapısı (77)
Böbreklerin konkav olan iç yüzünde böbrek hilusu bulunmaktadır.Böbrek hilusunda böbreğin damarları, lenfatikler, sinirler ve renal pelvis yer alır. Renal pelvis ilk önce majör kalikse, majör kaliksler de 8 veya daha fazla minör kalikse bölünür. Böbreğin sagittal kesitinde medulla ve korteks olmak üzere 2 ayrı bölge vardır. Böbrek medullası genellikle 12-18 konik yapılı piramitten oluşmaktadır. Her bir piramitin tabanı kortikomedüller sınıra dayalı olup tepeleri böbrek pelvisi içine doğru uzanır. Papillalar minör kalikslerin içine doğru çıkıntı yapar. Her bir papillaya 15 veya daha fazla terminal kollektör kanal (Bellini) açılır. Yaklaşık 1 cm kalınlığındaki böbrek korteksi, piramidlerin tabanını örter ve piramidler arasından içeriye doğru ilerler (Bertinin böbrek kolonları)(77,78).
Her bir böbrek, genellikle birinci lomber vertebra hizasında aortadan çıkan tek bir arter ile kanlanır. Bu arterler dallanarak sırasıyla segmental, interlobar, arcuat, interlobular, afferent ve efferent arteriollere kadar uzanır ve venöz sistem yoluyla inferior vena kavaya dökülür(77,78).
Böbreğin en küçük anatomik ve fonksiyonel ünitesi nefrondur. Her bir böbrekte yaklaşık 1 milyon-1 milyon 200 bin nefron bulunur. Her bir nefron 5 bölüm içermektedir:
Şekil:4 Nefronun yapısı (79) 1; Glomerül Ve Bowman Kapsülü 2; Proksimal
Kıvrımlı Tübül 3; Proksimal Düz Tübül(Pars Rekta) 4;İnce İnen Kol 5;İnce Çıkan Kol 6;Kalın Çıkan Kol 7;Makula Densa 8;Distal Kıvrımlı Tübül 9;Bağlayıcı Tübül 10;Kortikal Toplayıcı Kanal 11;Dış Medüller Toplayıcı Kanal 12; İç Medüller Toplayıcı Kanal
1-Glomerül: Bowman kapsülü olarak bilinen renal tübülün genişlemiş son
bölümü tarafından çevrelenmiş kapiller yumaklardır. Kapiller yumak ve mezenşiyum, podosit denen epitelyal hücrelerce sarılmıştır. Bowman kapsülünün katları arasında yer alan ve tübüler alana açılan bölge ise idrar boşluğudur.
1.a Glomerülüs: Glomerülüsün yapısı 3 ana hücre (endotelyal, mezenşiyal,
epitelyal hücreler) ve filtrasyon fonksiyonu olan iki ekstraselüler bölgeden (GBM ve mezenşiyal matriks) oluşmaktadır.
1.a.1 Endotelyal Hücreler: Glomerüler kapillerler, fenastrasyonlu endotel ile
döşelidir. Nükleusları mezenşiyuma bitişik olan endotel hücreleri, insanlardaki çapı 70-100 nm olan porlar fenastrasyonlara sahiptir. Bu yapısal özelliği dolayısıyla
büyük moleküllerin geçişine karşı önemli bir engel oluşturmazlar. Endotel yüzeyi polianyonik glikoproteinler nedeniyle negatif yüklüdür.
1.a.2 Epitelyal Hücreler: İki tip epitelyal hücre vardır. Biri pariyetal epitel
hücresi olup bowman kapsülünün dış kısmındadır. Bowman kapsülü denince de bu tabaka anlaşılır ve proksimal tübülüs hücresi ile devam eder. Diğeri visseral epitelyum hücreleri podosit denilen ayaksı uzantılarla bazal membrana dayanırlar. Ayaksı uzantılar arasındaki boşluklar slit diyaframlarla kapatılmıştır. Ayaksı uzantıların ve slit diyafragmaların yüzeyi siyaloproteinlerden zengin glikoproteinlerle örtülüdür. Bunlar özellikle albümin gibi negatif yüklü makromolekülleri iterek filtrasyona engel olurlar.
1.a.3 Mezenşiyal Hücreler: Mezenşiyumda fagositik yeteneği olan ve
olmayan iki tip hücre bulunur. Fagositik olmayan hücreler çoğunlukta olup düz kas hücreleri gibi davranır ve özellikle AT-2 veya vazopressinle kontraksiyon yaparlar. Ayrıca çeşitli tipte kollagen sentezlerler. İkinci tip mezenşiyum hücreleri fagositer fonksiyona sahip makrofajlardır .
2- Proksimal Tübül: Kortekste lokalizedir.
3- Henle Lupu: Kortikomedüller birleşim yerine lokalizedir. 4- Distal Tübül: Kortekstedir.
5-Toplayıcı Kanal: İki veya daha fazla distal tübülden oluşmuştur. Korteks
ve medulladan geçerek idrarı drene ederler (şekil 4)
Kortikal nefronların glomerülleri korteksin dış kısmındadır. Sadece Henle kıvrımı dış medullaya kadar iner. Efferent arteriolü tübüller etrafında peritübüler kapiller ağ oluşturur. Jukstamedüller nefronların glomerülleri korteks ile medulla arasındadır. Henle kıvrımı medullanın derinliklerine kadar iner. Efferent arteriolü henle kıvrımı ile yan yana seyreden ve medullanın derinliklerine kadar inen farklı bir kapiller ağ oluşturur. Bu organizasyon idrarın yoğunlaştırılmasında önemlidir(79).
Böbrekler kanı süzerek idrarı oluştururlar. İdrar üreterler aracılığı ile mesanede toplanır, üretrayla dışarı atılır. İdrar ile üre ve ürik asit gibi nitrojen içeren metabolizma ürünleri atılır. Nitrojen atıklarının en önemli kaynağı proteinler ve pürin bazlarıdır. Pürin bazlarının yıkım ürünü ürik asit, proteinlerin yıkımıyla oluşan ürün ise amonyaktır. Amonyak hücreler için oldukça toksik bir madde olduğundan karaciğerde üre haline dönüştürülür ve üre böbrek tarafından atılır(80).
2.2.2. İdrar Oluşumu
3 aşaması vardır: 1) Filtrasyon
2) Geri Emilme (Reabsorbsiyon) 3) Salgılama (Ekskresyon)
1.Filtrasyon: Afferent arteriol ile glomerüler kapiller yumağa ulaşan kanın
proteinleri ve hücreleri dışındaki tüm elemanları bowman kapsülü içine süzülür ve içeriği proteinler dışında plazmanın yapısı ile eş değer sayılabilir.
Glomerül kapillerlerindeki filtrasyon hızı (GFH), birim zamanda süzülen plazma miktarı olarak tanımlanır (normal değeri 125 ml/dk). Normalde böbrekler bir dakikada 125 ml yani günde 180 litre plazmayı filtre eder. Böbreklerde filtre edilen plazma miktarı bu kadar yüksekken, günde çıkarılan idrar miktarı ortalama 1-1.5 litre kadardır. GFH çeşitli faktörlere bağlı olarak değişebilir. Glomerül kapilleri içindeki kanın hidrostatik basıncının azalması filtrasyonu azaltır, yükselmesi arttırır. Kapillerdeki hidrostatik basınç, afferent arteriol daralmasında, böbreğe gelen kan miktarının azalmasında (arteriyel kan basıncının düşmesi ve kan kayıpları gibi koşullarda) azalır. Buna karşı efferent arteriol daralması, basıncı yükseltir. Glomerül kapillerindeki geçirgenlik artışları GFH’yi arttırır. Bowman kapsülü içindeki sıvının basıncının artması filtrasyonu azaltır.
2. Geri Emilim (Reabsorbsiyon): Filtrat içindeki su ve maddeler basit
diffüzyon ve aktif taşınma ile önce tübülüs hücrelerine, buradan da kana geri emilirler. Maddelerin geri emilimleri organizmanın gereksinimi doğrultusunda düzenlenmektedir. Geri emilimin % 90’ı proksimal tübülüs bölgesinde yapılmaktadır. Bu bölgede geri emilen maddeler, neden oldukları ozmotik güç ile bir miktar suyun da geri emilimini sağlarlar. Tübülüslerde geri emilemeyen madde miktarının artması suyun geri emilimini azaltarak diüreze neden olur. Diüretik ilaçlar, bazı maddelerin geri emilimini engelleyerek, mannitol ise tübülüslerden reabsorbe olamadığı için diüreze neden olmaktadır(80).
Aldosteron distal tübülüs bölgesine etki ederek Na+ iyonunun geri emilimini arttırırken K+ iyonunun idrar ile atılmasını hızlandırır. ADH ise toplayıcı kanalların suya olan geçirgenliğini kontrol etmektedir. ADH varlığında toplayıcı kanallarda suyun geri emilimi artar ve konsantre idrar çıkarılır. ADH yokluğunda idrar ile
çıkarılan su miktarının artması ile idrar dilüe olur. Tübülüslerden aktif taşınma ile geri emilen maddeler için bir eşik değer söz konusudur. Bu duruma en iyi örnek glukoz taşınmasıdır. Kan glukoz konsantrasyonu normal olduğu zaman glomerüllerden filtre olan glukozun hepsi proksimal tübülüs bölgesinde aktif taşınma ile geri emilir ve idrara hiç glukoz çıkmaz. Kan glukoz konsantrasyonu normalden yüksek olduğu zaman glukozun fazlası geri emilemez ve glukoz idrara çıkar. Geri emilemeyip tübülüs sıvısı içinde kalan glukoz fazlası, ozmotik güç oluşturarak suyu da beraberinde sürükler ve poliüri meydana gelir(80,81).
3.Salgılama (Ekskresyon): İdrar oluşması sırasında bazı maddeler doğrudan
tübülüs epitelyum hücreleri tarafından tübülüsler içine salgılanmaktadır. Penisilin bu tip maddelere iyi bir örnektir. Bazı maddeler ise hem glomerül filtrasyonu yoluyla hem de ekskresyon ile idrara çıkmaktadır. Bu tip maddeye en iyi örnek ise kreatinindir(80,81) .
2.2.3. Renal Sistemin Asit-Baz Dengesi Üzerine Etkileri
Böbrekler organizmanın asit-baz dengesinin düzenlenmesinde önemli paya sahip organlardır. Vücut sıvılarındaki H+ iyonu arttığında (asidozda) böbrekler idrar ile H+ iyonu atılmasını hızlandırıp, kanda bikarbonat (HCOз) iyonunun konsantrasyonunu yükseltmek için bikarbonatın reabsorbsiyonunu arttırırlar. Alkalozda ise idrar ile bikarbonat atılımını hızlandırırlar. Vücut sıvılarının pH’sı çok dar sınırlar içinde sabit tutulmaya çalışılırken idrarın pH’sı 4.5 ile 8 arasında değişim gösterir(82,83).
2.2.4. Böbrek Fonksiyonlarının Değerlendirilmesi
Böbrek fonksiyonunu değerlendirmede renal plazma ve kan akımı, glomerüler filtrasyon hızı (GFH) ve filtrasyon fraksiyonu gibi yöntemler kullanılabilir. Ancak en uygun yol GFH’nin değerlendirilmesidir. Renal plazma ve kan akımı daha çok klinik ve deneysel çalışmalarda kullanılmaktadır. Her iki böbreğin toplam ağırlığı yaklaşık 300 g olmakla birlikte kardiyak debinin dörtte birini alırlar. Renal kan akımı 1200 ml/dk, renal plazma akımı 600 ml/dk’dır. Bu
akımın yaklaşık % 20’si ultrafiltrata geçer ve GFH normal bir erişkinde 125 ml/dk/1.73 m²’dir. Bu da günlük 180 litrelik bir ultrafiltratı oluşturur(82,83).
Klinik pratikte böbreklerin fonksiyonlarının değerlendirilmesi GFH’nin hesaplanması ya da daha basit testlere dayalı olarak GFH’nin tahmini ile yapılır. Bunun için ideal olan maddenin kana sabit bir hızla girmesi (endojen ya da ekzojen), hücre dışı sıvıda serbestçe dağılması, proteine bağlanmaması, glomerüllerden serbestçe filtre olması, renal metabolizmasının olmaması, tübüler reabsorbsiyonunun ve sekresyonunun olmaması ve böbrek dışı eliminasyonunun olmaması gereklidir. Bu özellikleri taşıyan maddenin ayrıca klinik pratikte kullanılabilmesi için yöntemin ucuz, güvenilir, kesin olması, kandaki diğer bileşiklerle etkileşime girmemesi ve kendisinin GFH üzerinde herhangi bir etkisinin olmaması gereklidir. Bu değerlendirme basitten karmaşığa doğru serum üre ve kreatinin değerleri, yaşa göre hesaplanmış kreatinin klirensi, sintigrafik yöntemler ve inülin klirensi ile yapılabilir(82-84) .
2.2.5. ÜRE
Üre molekül ağırlığı 60 olan ve karaciğer tarafından protein metabolizması sonucunda ortaya çıkan amonyaktan sentezlenen bir maddedir. Birçok laboratuar üre içindeki nitrojeni ölçerek BUN sonucunu vermektedir. Üre ve BUN arasındaki ilişki; üre: BUN x 2.14 olarak formüle edilebilir. Kan BUN düzeyleri laboratuvardan laboratuvara değişmekle birlikte 10- 21 mg/dl’dir. Karaciğerde sentezlendiği ve tübüler reabsorbsiyonu da olduğu için renal fonksiyon bozukluğu olmadan da kan BUN düzeylerinde değişimler olabilmektedir. Artmış protein alımı, aminoasit infüzyonu, GİS kanaması, her türlü katabolik durumlar ile kortikosteroid veya tetrasiklin kullanımı artmış BUN düzeylerine yol açabilmektedir. Protein eksikliği (ciddi malnütrisyon, çölyak, nefrotik sendrom), akut ya da kronik ağır karaciğer hastalığı gibi durumlarda kan BUN düzeyleri düşük çıkabilmektedir(83,84).
2.2.6. KREATİNİN
Kreatinin kas metabolizması sonucunda kreatinden oluşur ve yapım oranı kas kitlesi ile yakından ilgilidir. Sağlıklı bir insanda kreatininin tübüler sekresyonu % 10-15’tir, ilerlemiş böbrek yetmezliğinde bu oran % 40’lara kadar çıkabilir. Bu nedenle 24 saatlik idrar toplanarak yapılan kreatinin klirens hesaplaması, gerçek GFH’den bu durumlarda daha yüksek çıkacaktır. Pratikte serum kreatinin düzeyi renal fonksiyonları değerlendirmede üreye göre daha değerlidir. Ağır egzersiz ya da travma gibi kaslardan artmış kreatinin salınımında, kreatinin düzeyi renal fonksiyon bozukluğu olmadan da yüksek olabilir. Oral kreatin kullanan sporcularda da kreatinin düzeyi geçici olarak yüksek bulunabilir. GFH’si düşük olan hastalarda tübüler sekresyonu inhibe eden trimetoprim, simetidin, amilorid gibi ilaçların kullanılması durumunda kreatinin daha yüksek olabilir. Kas kitlesi aşırı miktarda azalmış malnütrisyonlu hastada azalmış kreatinin yapımı sonucunda kreatinin düşük bulunabilir. Gebeliğin ikinci trimesterinde ve diyabetik nefropatinin ilk evresi olan hiperfiltrasyon evresinde artmış kan akımı ve GFH’ye bağlı olarak kreatinin düzeyi düşük olabilir(83-85).
Serum kreatinin düzeyi rutin taramalar ve seri izlemler için yararlı bir testtir. Serum kreatinin düzeyi ile GFH arasında ters lineer bir ilişki bulunmaktadır. Normal kreatinin değerleri ortalama olarak 0.3-1.2 mg/dl’dir. Pratik değerlendirmede normal limitler içerisinde bile kreatinin değişimlerinin renal fonksiyonda önemli oranda azalmaya işaret edebileceği akılda tutulmalıdır. Örneğin kan kreatinin düzeyinin 0.6 mg’dan 1.2 mg’a çıkması her iki değer de normal olsa bile renal fonksiyon ve GFH’de % 50’lik bir kaybın olduğunun göstergesidir. Ayrıca değerlendirmede dikkat edilmesi gereken bir başka nokta yaşla birlikte GFH’de düşme olmasıdır. 40 yaşından sonra bir hastalığı olmayan sağlıklı insanlarda GFH’de yıllık ortalama 1 ml/dk’lık azalma olur. İlerlemiş yaşla birlikte kas kitlesindeki azalma daha düşük kreatinin düzeylerine neden olur. Yaşlılarda normal kreatinin düzeylerine rağmen GFH’de önemli düşüşler olabilmektedir(83-85).
2.2.7. Klirens Kavramı ve Kreatinin Klirensi
Böbreklerde kan plazması belli maddelerden temizlenmektedir. Klirens kavramı birim zamanda ilgili maddeden temizlenen plazma volümünü ifade eder.
Klirens= (İdrar Konsantrasyonu x İdrar Volümü) / (Plazma Konsantrasyonu x Zaman)
Plazma Klirensi = Maddenin İdrardaki Konsantrasyonu (mg/ml) x İdrar Hacmi (ml/dk) / Maddenin Plazmadaki Konsantrasyonu (mg/ml)
Kreatinin klirensi hesaplanmasında zorluk olmasına rağmen tarama testleri dışında GFH’yi belirlemede pratikte en fazla kullanılan yöntemdir. Normal değeri 90-120 ml/dk’dır. Daha önceden belirtilen kreatinin sekresyonu nedeni ile klirensin hesaplanması sonucunda elde edilen değer gerçek GFH’nin üzerindedir ve hastanın böbrek yetmezliği arttıkça bu fark daha da artar. Genelde kullanılan 24 saatlik kreatinin klirensi yönteminde de idrar toplamada sorunlar ortaya çıkabilir. Az idrar toplanmış olması düşük sonuca, daha fazla idrar toplanması da yüksek kreatinin klirensi sonucu elde edilmesine neden olur. Sağlıklı bir insanda kreatinin yapımı ve atılımı sabit orandadır. Ortalama olarak kadınlar 15-20 mg/kg, erkekler ise 20-25 mg/kg miktarında kreatinin atarlar. Beklenenden daha farklı sonuçlar ortaya çıktığında 24 saatlik kreatinin atılım miktarı ile hastanın uygun idrar toplayıp toplamadığı kontrol edilmelidir(84,85).
Yaşa, cinse ve kiloya göre hesaplanan kreatinin klirensi tek başına kreatinin düzeyine göre GFH’yi tahmin etmede daha başarılıdır. Yöntemin avantajı idrar toplanmasına ihtiyaç göstermemesidir(84,85).
GFH= (140-Yaş) x Vücut Ağırlığı / Serum Kreatinin x 72 x [0.85(Kadınlarda)]
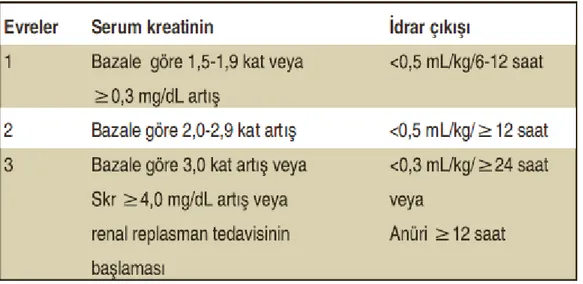
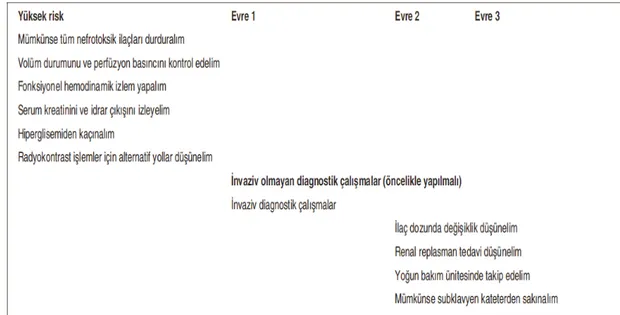
2.2.8 Akut Böbrek Yetmezliğinin Tanımı
Böbrek fonksiyonlarının akut kaybı olarak olarak tanımlanan akut böbrek yetmezliği; renal fonksiyonların saatler ve günler içerisinde gerilemesi ve kaybı, böbrek hasarı nedeni ile nitrojenli artıkların atılımının gerçekleşememesi, vücut sıvı ve elektrolit dengesinin korunamaması gibi belirtilerle birçok organ ve sistemi etkileyen bir hastalıktır(80,86).