T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ GENETİK ANABİLİM DALI
Türk Toplumunda AZF Mikrodelesyonu Saptanan Olgularda
Genotip-Fenotip İlişkisinin Araştırılması
DR. ELİF UZAY
DANIŞMAN
DOÇ. DR. MEHMET BURAK DURMAZ
İZMİR - 2019
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ GENETİK ANABİLİM DALI
Türk Toplumunda AZF Mikrodelesyonu Saptanan Olgularda
Genotip-Fenotip İ”lişkisinin Araştırılması
DR. ELİF UZAY
DANIŞMAN
DOÇ. DR. MEHMET BURAK DURMAZ
ÖNSÖZ
Uzmanlık eğitimim süresince bilgi ve deneyimlerini büyük bir içtenlikle paylaşan ve desteği hiç eksilmeyen, birlikte çalışmaktan onur duyduğum değerli tez hocam Doç. Dr. Mehmet Burak Durmaz’a emek ve katkıları için,
Uzmanlık eğitimim boyunca her zaman desteklerini hissettiğim, bilgi ve tecrübelerinden yararlandığım değerli hocalarım Prof. Dr. Ferda Özkınay, Prof. Dr. Özgür Çoğulu, Prof. Dr. Haluk Akın, Prof. Dr. Hüseyin Onay, Doç. Dr. Emin Karaca, Doç. Dr. Asude Durmaz, Doç. Dr. Ayça Aykut ve Doç. Dr. Tahir Atik’e,
Tezime olan katkılarından dolayı Ege Üniversitesi Tıp Fakültesi Üroloji AD.’ndan Prof. Dr. Barış Altay’a, Ege Üniversitesi Aile Planlaması ve Kısırlık (İnfertilite) Uygulama ve Araştırma Merkezi’nden Prof. Dr. Erol Tavmergen ve Prof. Dr. Ege Nazan Tavmergen Göker’e, Ege Üniversitesi Tıp Fakültesi Biyoistatistik ve Tıbbi Bilişim AD’ndan Prof. Dr. Mehmet N. Orman’a,
Bu süreçte tecrübeleriyle her zaman yanımda olan Uzm. Dr. Erhan Parıltay, Uzm. Dr. Aslı Ece Solmaz ve Uzm. Dr. Esra Işık’a,
Asistanlık eğitimim ve tez sürecimde her zaman yanımda olan ve desteğini hiçbir koşulda esirgemeyen, O’nu tanımaktan mutluluk duyduğum Dr. Bilçağ Akgün’e ve birlikte çalışmaktan büyük keyif aldığım hekim arkadaşlarım Uzm. Dr. Hilmi Bolat, Uzm. Dr. Emine İpek Ceylan, Dr. Zehra Cengisiz, Dr. Semih Aşıkovalı, Dr. Gizem Kök, Dr. Duygu Arıcan ve Dr. Anıl Kalyoncu’ya,
Eğitim sürecimde işin mutfağını öğrenmemde yardımcı olan tüm biyolog, teknisyen, sekreter ve personel arkadaşlara,
En içten teşekkür, sevgi ve saygılarımı sunarım.
Dr. Elif Uzay İzmir, 2019
II ÖZET
Türk toplumunda AZF mikrodelesyonu saptanan olgularda genotip-fenotip ilişkisinin araştırılması
Amaç: İnfertilite, herhangi bir korunma yöntemi kullanılmadan 1 yıl içinde gebe
kalınamaması durumu olarak tanımlanmaktadır. Popülasyonun yaklaşık %10-15’ini etkilemekle birlikte %35-50’si, kısmen veya tamamen erkek faktöründen kaynaklanmaktadır. Ejakülatta spermin hiç bulunmaması durumu olan azospermi, erkek infertilite vakalarının %10-20'sini oluşturur ve genel erkek popülasyonun %2'sini etkilemektedir. Genetik nedenli azospermi öncelikle kromozomal anomaliler, monogenik bozukluklar, multifaktöriyel hastalıklar ve epigenetik faktörler gibi bir dizi genetik bozukluktan kaynaklanabilir. Çalışmamızda, Türk toplumunda AZF mikrodelesyonu saptanan olguların delesyon tipi ile klinik bilgileri arasındaki ilişkinin aydınlatılması amaçlanmıştır.
Gereç ve Yöntem: Azospermi tanısı ile Ocak 2009 ve Mart 2019 tarihleri arasında Ege
Üniversitesi Tıp Fakültesi Üroloji AD. ve Ege Üniversitesi Aile Planlaması ve Kısırlık (İnfertilite) Uygulama ve Araştırma Merkezi’ne başvuran olgularda karyotip analizi normal ve AZF mikrodelesyonu saptanan olguların, hormon profili, demografik özellikleri ve TESE sonuçlarını içeren dosyaları incelenerek retrospektif olarak veriler toplanarak analiz edilmiştir.
Bulgular: 46,XY karyotipine sahip 42 olgunun yapılan AZF mikrodelesyon testleri
sonucunda 3 olguda AZFa, 2 olguda AZFb, 31 olguda AZFc, 4 olguda AZFb+AZFc ve 2 olguda AZFa+AZFb+AZFc mikrodelesyonu saptanmıştır. Uygulanan mikro-TESE sonucunda AZFc mikrodelesyonuna sahip 16 olguda sperm elde edilmiştir. Sperm elde edilen 2 olguda gebelik sağlanmıştır. Delesyon tipi ile yaş, boy, kilo, vücut kitle indeksi, hormon profili ve testis hacmi arasında istatistiksel olarak anlamlı bir fark bulunmamıştır.
Sonuç: Çalışmamızda, AZF mikrodelesyonu bulunan toplam 42 olguda mikro-TESE
sonuçlarını, hormonal ve demografik verilerini bütünüyle değerlendirmiş olan Türk toplumundaki en fazla olgu sayısına ulaşılmıştır. Aynı zamanda, genotip-fenotip korelasyonu literatür ile uyumlu bulunmuş olup; özellikle AZFc delesyonu saptanan olguların gebelik elde etme şanslarının bulunduğu gösterilmiştir.
III ABSTRACT
Investigation of genotype-phenotype correlation in patients with AZF microdeletion in Turkish population
Objective: Infertility is defined as the inability to conceive within 1 year period without
using any prevention method. Although it affects approximately 10-15% of the population, 35-50% is due to male factor partially or completely. Azoospermia, which is the absence of sperm in the ejaculate accounts for 10-20% of male infertility cases and affects 2% of the male population. Genetic causes of azoospermia include a range of genetic disorders, such as chromosomal abnormalities, monogenic disorders, multifactorial diseases and epigenetic factors. In this study, we aimed to elucidate the relationship between AZF deletion type and clinical information of patients with AZF microdeletion in Turkish population.
Materials and Methods: Patients with azoospermia who referred to Ege University,
Faculty of Medicine Department of Urology and Ege University, Family Planning and Infertility Research and Application Center between January 2009 and March 2019 were enrolled to the study. Among these patients, cases with normal karyotype and with AZF microdeletion were analyzed retrospectively by collecting clinical data including hormone profile, demographic characteristics and micro-TESE results.
Results: As a result of the AZF microdeletion tests of 42 cases with 46, XY karyotype,
AZFa deletion in 3 cases, AZFb deletion in 2 cases, AZFc deletion in 31 cases, AZFb + AZFc deletion in 4 cases and AZFa + AZFb + AZFc deletion in 2 cases were detected. After micro-TESE, sperm was obtained in 16 cases with AZFc microdeletion. Pregnancy was achieved in 2 cases. There was no statistically significant difference between the type of deletion and age, height, weight, body mass index, hormone profile and testicular volume.
Conclusion: In our study, the highest number of patients in the Turkish population,
which fully evaluated the micro-TESE results, hormonal and demographic data was reached in 42 patients with AZF microdeletions and with normal karyotype. Also, genotype-phenotype correlation was found to be consistent with the literature; particularly patients having AZFc deletions were found to have a chance for pregnancy.
IV İÇİNDEKİLER ÖNSÖZ ... I ÖZET ... II ABSTRACT ... III İÇİNDEKİLER ... IV TABLOLAR LİSTESİ ... VI ŞEKİLLER LİSTESİ ... VII KISALTMA LİSTESİ ... VIII
1. GİRİŞ ... 1
2. GENEL BİLGİLER ... 3
2.1. Spermatogenez ... 3
2.2. İnfertilite Nedir? ... 5
2.2.1. Erkek İnfertilitesi ... 5
2.2.2. Erkek İnfertilitesinin Değerlendirilmesi ... 7
2.3. Azospermi ... 12
2.3.1. Obstrüktif Azospermi ... 13
2.3.2. Non-obstrüktif Azospermi ... 14
2.4. Erkek İnfertilitesine Yol Açan Genetik Nedenler ... 15
2.4.1. Kromozomal Anomaliler ... 15
2.4.1.1. Cinsiyet Kromozomu Anomalileri ... 16
2.4.1.2. Otozomal Kromozom Anomalileri ... 17
2.4.1.3. Spermin Kromozomal Anomalileri ... 18
2.4.2. X'e Bağlı Genetik Bozukluklar ve Erkek İnfertilitesi ... 18
2.4.2.1. Kallmann Sendromu ... 18
2.4.2.2. Hafif Androjen İnsensivite Sendromu ... 18
2.4.3. Y Kromozomu ve Erkek İnfertilitesi ... 19
2.4.3.1. Y Kromozomu Mikrodelesyonlarının Klinik Önemi ... 19
2.4.4. Monogenik Erkek İnfertilitesini Etkileyen Faktörler ... 21
2.4.4.1. Konjenital Bilateral Vas-Deferens Yokluğu (CBAVD) ... 22
2.5. Erkek İnfertilitesine Yol Açan Genetik Olmayan Nedenler ... 22
3. GEREÇ VE YÖNTEM ... 23
3.1. Olgu Seçimi ... 23
3.1.1. Çalışmaya Dahil Olma Kriterleri ... 23
V
3.2. Çalışma Düzeni ... 23
3.2.1. Fizik Muayene ... 23
3.2.2. Karyotip Analizi ... 24
3.2.3. Y Mikrodelesyon Analizi ... 25
3.2.3.1. Örneklerin Toplanması ve DNA İzolasyonu ... 25
3.2.3.2. Moleküler Analiz ... 26 3.2.4. Mikro-TESE İşlemi ... 30 3.2.5. İstatiksel Analiz ... 31 4. BULGULAR ... 32 5. TARTIŞMA ... 44 6. SONUÇ VE ÖNERİLER ... 53 7. KAYNAKLAR ... 54 EKLER ... 63
VI TABLOLAR LİSTESİ
Tablo 1. Erkek infertilitesine neden olan faktörler ve oranları (18) ... 6
Tablo 2. Dünya Sağlık Örgütü (WHO) 2010 sınıflamasına göre semen analizi değerleri (23) . 9 Tablo 3. Semen kalitesine ilişkin terminoloji (23) ... 10
Tablo 4. Çeşitli klinik durumlarda bazal hormon seviyeleri (19)... 11
Tablo 5. Genitoüriner sistemde tıkanıklığa yol açan nedenler (33) ... 14
Tablo 6. ChromoQuant AZF PCR kitinin bileşenleri ... 26
Tablo 7. ChromoQuant AZF PCR kitinde kullanılan kimyasallar ve miktarları ... 26
Tablo 8. ChromoQuant AZF PCR kiti için uygulanan PCR protokolünün aşamaları ... 27
Tablo 9. Kapiller elektroforez protokolü ... 28
Tablo 10. Y kromozomu üzerinde amplifiye edilen bölgeler, boyut ve lokasyonları ... 29
Tablo 11. Olguların yaş standart dağılımı verileri ... 33
Tablo 12. Olgulara ait Y mikrodelesyonu tipine göre yaş ortalamaları ... 33
Tablo 13. Olguların boy standart dağılımı verileri ... 34
Tablo 14. Olgulara ait Y mikrodelesyonu tipine göre boy ortalamaları ... 34
Tablo 15. Olguların kilo standart dağılımı verileri ... 35
Tablo 16. Mikrodelesyon tipine göre kilo ortalaması ... 36
Tablo 17. Mikrodelesyon tipine göre VKİ ortalaması ... 36
Tablo 18. Olguların prolaktin standart dağılımı verileri... 37
Tablo 19. Olguların testosteron standart dağılımı verileri ... 38
Tablo 20. Olguların FSH standart dağılımı verileri ... 39
Tablo 21. Olguların LH standart dağılımı verileri ... 40
Tablo 22. Mikrodelesyon tipine göre hormon profili dağılımı ... 41
Tablo 23. AZF mikrodelesyon tipine göre olgulardaki testis hacim ortalama değerleri ... 41
Tablo 24. Olguların delesyon tipine göre TESE’de sperm eldesi istatistiksel verileri ... 42
Tablo 25. Üç farklı mikrodelesyon tipine göre TESE’de sperm eldesi istatistiksel verileri .... 43
VII ŞEKİLLER LİSTESİ
Şekil 1. İnsan spermatogenezinin aşamaları (11) ... 4
Şekil 2. Y kromozomunun şematik gösterimi ve mevcut mikrodelesyon modeli (89) ... 30
Şekil 3. Olguların AZF mikrodelesyon tipine göre dağılımı ... 32
Şekil 4. Olguların yaş standart dağılımı grafiği ... 33
Şekil 5. Olguların boy standart dağılımı grafiği ... 34
Şekil 6. Olguların kilo standart dağılımı grafiği ... 35
Şekil 7. Olguların vücut kitle indeksi standart dağılımı grafiği ... 36
Şekil 8. Olguların prolaktin standart dağılımı grafiği... 37
Şekil 9. Olguların testosteron standart dağılımı grafiği ... 38
Şekil 10. Olguların FSH standart dağılımı verileri ... 39
Şekil 11. Olguların LH standart dağılımı grafiği ... 40
Şekil 12. AZF taraması için göstergeli akış şeması (Temel Analiz) (89)... 47
VIII KISALTMA LİSTESİ
AR: Androjen ReseptörüAZF: Azospermi faktör BÇ: Baz Çifti
CBAVD: Konjenital bilateral vas deferens yokluğu CNV: Kopya Sayısı Varyasyonları
DNA: Deoksiribonükleik asit EAA: Avrupa Androloji Akademisi EDTA: Etilendiamin tetraasetik asit
EMQN: Avrupa Moleküler Genetik Kalite Ağı FISH: Floresan in situ hibridizasyon
FSH: Follikül stimüle edici hormon
HEPES: 4-(2-hidroksietil)-1-piperazineetansulfonik asit HPG: Hipotalamik-pitüiter-gonadal
HTF: Human Tubal Fluid
ICSI: İntra sitoplazmik sperm enjeksiyonu
ISCN: International System for Human Cytogenetic Nomenclature IVF: In vitro fertizilasyon
KS: Klinefelter Sendromu LH: Luteneize edici Hormon MGPs: Magnetic Glass Particles MSY: Erkek spesifik Y bölgesi mtDNA: Mitokondriyal DNA NGS: Yeni Nesil Dizileme
IX
NOA: Non-obstrüktif azospermi OA: Obstrüktif azospermi PAR: Pseudo otozomal bölge PRL: Prolaktin
RNA: Ribonükleik asit SCO: Sertolli Cell Only SD: Standart sapma
SNV: Tek Nükleotid Varyasyonları SSC: Salin Sodyum Sitrat
T: Testosteron
TESE: Testiküler sperm ekstraksiyonu VKİ: Vücut kitle indeksi
1 1. GİRİŞ
İnfertilite, herhangi bir korunma yöntemi kullanılmadan 1 yıl içinde gebe kalınamaması durumu olarak tanımlanmaktadır. İnfertilite vakalarının %35-50’si, kısmen veya tamamen erkek faktöründen kaynaklanmaktadır (1). Erkek fertilitesinin azalması, doğumsal ve edinsel nedenli ürogenital anomaliler, erkek sekretuar bezlerin enfeksiyonları, skrotal sıcaklığın artması, endokrin bozukluklar, genetik anomaliler ve immünolojik faktörler gibi çeşitli olayların sonucunda gerçekleşebilir (2). Literatüre göre, üreme çağındaki her 13 erkekten birinin çocuk sahibi olabilmek için yardımcı üreme tekniklerine başvurduğu bildirilmiştir. Azospermi, ejakulatta hiç sperm bulunmaması durumudur ve azospermik semen örnekleri, yetişkin erkek nüfusunda yaklaşık %2, infertilite problemi olan erkek bireylerde ise %10-20 oranında bulunmakta olup, bu bireylerin 2/3’ünde erkek infertilitesinin en şiddetli problemi olarak tanımlanan, spermatojenik yetersizlik bulunmaktadır (3). Bahsi geçen durum, tedavi edilemeyen testiküler bozukluk ile ilişkilidir. Sperm üretimindeki sorunlar ve ilgili kanallardaki tıkanıklıklar nedeniyle, ejakülatta hiç sperm olmasa da, sperm elde etme teknikleri ile azospermik bireyler çocuk sahibi olabilmektedir. Genetik faktörler azoosperminin %21-29'unu açıklamaktadır (4). Ancak olguların yaklaşık %50’sinde etiyoloji hala bilinmemektedir ve bu durum “idiyopatik infertilite” olarak adlandırılmaktadır. İdiyopatik erkek infertilitesi olan hastalarda yapılacak ilk genetik testlerden biri karyotip analizidir. Ayrıca Yq mikrodelesyonlarının erkek infertilitesi ile ilişkili olduğu da iyi bilinmektedir. İnfertil erkeklerde Yq'daki delesyonların varlığı, spermatogenezden sorumlu bir lokus olan, azospermi faktör (AZF) varlığını gösterir. AZF lokusu 3 bölgeye ayrılır; AZFa, AZFb ve AZFc. Bu üç bölgede meydana gelen delesyonlar spermatogenezin farklı evrelerine etki ederek infertiliteye neden olabilmektedir (5). Özellikle AZFa ve AZFb mikrodelesyonu bulunan hastalarda intrastoplazmik sperm enjeksiyon yöntemi (ICSI) için testiküler sperm ekstraksiyonu (TESE) ile sperm eldesinin mümkün olmadığını gösteren çalışmalar bulunmaktadır (6). Fakat AZFc mikrodelesyonuna sahip olgularda TESE ile sperm eldesi sonucunda bebek sahibi olma şansları bulunmaktadır. Fakat bu olgularda, infertilite tedavisinde uygulanan ICSI nedeni ile Y kromozomu mikrodelesyonları, doğacak olan erkek çocuklarına da geçmektedir. Dolayısıyla Y kromozomu mikrodelesyonuna sahip erkeklerin olası erkek çocuklarında da aynı mikrodelesyon olacağından, bu konuyla ilgili yapılan çalışmalarda, bu çocuklara puberteden itibaren androlojik incelemelerin yapılması gerektiğini belirterek bu çocuklarda delesyon sonucunda spermatogenezin durması ihtimaline karşı spermlerinin dondurularak saklanması gerektiği vurgulanmıştır (7). Bunun yanısıra, AZFa ve AZFb mikrodelesyonuna sahip olgularda gereksiz cerrahi ve medikal tedaviden kaçınılması gerektiği önerilmektedir. AZF
2
mikrodelesyonuna sahip olgulardaki yaş, boy, kilo, horman profili, sperm sayısı ve morfolojisi gibi parametrelerin infertiliteye olan etkileri hakkında bilgiler sınırlıdır. Bu parametrelerden herhangi biri veya birkaçının var olan mikrodelesyonla anlamlı bir ilişkisi olduğunun gözlenmesi durumunda, klinik takip ve tedavi protokolleri açısından yarar sağlayacağı düşünülmektedir (8).
Çalışmamızda, Türk toplumunda, AZF mikrodelesyonu saptanan olguların delesyon tipi ile klinik verileri arasındaki ilişkinin aydınlatılması amaçlanmıştır. Bu amaç doğrultusunda, retrospektif olarak bu klinik parametreler ile mikrodelesyon tipi arasındaki olası ilişkiler araştırılmıştır. Çalışmamız sonucunda ortaya çıkan veriler, erkek infertilitesinin önemli bir sebebi olan Y kromozomu mikrodelesyonlarının etiyopatogenezini aydınlatmada yardımcı olacak olup, tedavide yol gösterici basamakların değerlendirilmesine katkıları olacaktır. Ayrıca literatürde Türk popülasyonunda AZF mikrodelesyonları açısından kapsamlı bir çalışma bulunmamasından dolayı, bu çalışma ülkemizde yapılan öncü bir çalışma niteliğindedir. Bununla birlikte, geniş kapsamlı ileri çalışmalar için de bir referans teşkil edecektir.
3 2. GENEL BİLGİLER
2.1. Spermatogenez
Spermatogenez, testistlerin seminifer tübüllerinde ön hipofizden salgılanan gonadotropik hormonların uyarması sonucu öncül multipotent kök hücre olan spermatogonyaların, haploid olgun spermatozoalara dönüşmesi sürecidir. Puberte ile başlar, hızı azalarak ömür boyu devam eder ve 74 gün süren bu süreç üç fazdan oluşmaktadır. Bunlar proliferasyon, bölünme ve farklılaşma fazlarını içermektedir (9).
Proliferasyon fazı, spermatositogenez olarak da adlandırılan mitoz evresidir. Bu evrede, mültipotent kök hücre olan tip A spermatogonyum, farklılaşarak ve çoğalarak tip B spermatagonyuma dönüşür. Spermatogonyumlar küresel veya oval çekirdeklere sahip bazal membran üzerinde bulunurlar (10).
Bölünme fazı, mayoz aşamasıdır. İlk mayotik bölünme fazındaki hücreler primer spermatosittir. Kromozomların yoğunlaşması ve bir araya gelmesi sonucu çekirdek koyu görülür ve seminifer epitelde orta hatta yer alırlar. Primer spermatositler birinci mayoz bölünmeyi tamamlayarak sekonder spermatosit oluşur. Hücreler bu aşamada hızla ilerlerler ve ikinci mayozu tamamlarlar. Bu fazda mayoz ile spermatogonyumlardaki diploid kromozom sayısı, matür spermatozoada haploid kromozom sayısına indirgenir. İkinci mayoz bölünmenin sonucunda spermatidler oluşur (9).
Farklılaşma fazı aynı zamanda spermiyogenez olarak adlandırılır. Haploid küre şeklindeki spermatidler maturasyon sürecini tamamlayarak matür yassılaşmış spermatozoaya dönüşürler. Spermiyogenez aşamasında akrozom ve flagella oluşur, sitoplazmanın büyük kısmı ayrılarak Sertoli hücrelerinde kalır. Spermatozoa, seminifer tüpün lümenine salınır (10). Şekil 1’de insan spermatogenezinin evreleri yer almaktadır.
4
Şekil 1. İnsan spermatogenezinin aşamaları (11)
Üreme, hipotalamik-pitüiter-gonadal (HPG) aksta yer alan hormonlar tarafından kontrol edilir. Erkeklerde spermatogenez ve testiküler testosteron (T), iki hipofiz gonadotropini olan
5
luteinize edici hormon (LH) ve follikül stimüle edici hormon (FSH) tarafından regüle edilir. LH'nin testis hedef hücreleri, interstisyel boşlukta bulunan Leydig hücreleri iken, FSH seminifer tübüldeki Sertoli hücrelerini uyarır. LH, Leydig hücrelerinden T salınımını uyarırken, FSH Sertoli hücrelerinden spermatogenez için gerekli olan düzenleyici moleküller ve besin öğelerini T ile sinerjistik biçimde uyarır. Dolayısıyla, hem T hem de FSH, Sertoli hücreleri aracılığıyla dolaylı olarak spermatogenezi düzenler (12).
Spermatogenezin herhangi bir basamağında oluşan defekt sonucunda sperm oluşumu bozulabilir; daha ağır vakalarda azospermi ile sonuçlanabilir. Azospermi klinik olarak, obstrüktif azospermi (OA) ve non-obstrüktif azospermi (NOA) olmak üzere iki ana gruba ayrılmıştır. Obstrüktif azospermide genellikle normal testis büyüklüğü, normal FSH düzeyi ve normal spermatogenez görülür. Non-obstrüktif azospermi, testiküler ve merkezi NOA olarak ikiye ayrılır. Testiküler NOA’da FSH düzeyi artmıştır buna rağmen, merkezi NOA’da düşük gonadotropin ve düşük/normal T düzeyleri göze çarpar (13). Azospermi, infertiliteye yol açan en önemli sebepler arasında yer almaktadır (14).
2.2. İnfertilite Nedir?
İnfertilite, Dünya Sağlık Örgütü’ne göre, 1 yıl süreyle herhangi bir korunma yöntemi kullanmaksızın, cinsel olarak aktif çiftlerin spontan gebelik elde edememesi olarak tanımlanmaktadır (15).
Çiftelerin yaklaşık %15’i infertilite sebebiyle sağlık kuruluşlarına başvurmaktadır. Her sekiz çiftten biri ilk çocuğa gebelik için; her altı çiftten biri ise ikinci çocuğa gebelik sırasında sorun yaşamaktadır. Kadınların %3’ü hayatları boyunca çocuk sahibi olamazken, kadınların %6’sı istediği sayıda çocuk sahibi olamamaktadır (16). İnfertilite kadın veya erkek kaynaklı olabilmektedir ve yapılan testler sonucunda çiftlerin yaklaşık %20’sinin infertilite sebebinin kadın veya erkek kaynaklı olabileceği görülmüştür. Buna ek olarak çiftlerin %30’unda, tek başına önemli bir etken olarak erkek faktörü bulunmaktadır. Bunun sonucu olarak tüm infertil çiftlerin %50’si erkek faktörü kaynaklı olduğu bilinmektedir (17).
2.2.1. Erkek İnfertilitesi
Erkekte infertiliteye yol açan nedenlerin arasında, konjenital veya edinilmiş ürogenital anomaliler, maligniteler, ürogenital sistem enfeksiyonları, artmış ürogenital sıcaklık (varikosel vb.), endokrin sebepler, genetik anomaliler veya immünolojik faktörler sayılabilir (18). Avrupa
6
Üroloji Derneği’nin 2015 yılında yayınlamış olduğu kılavuzda erkek infertilitesinin nedenleri Tablo 1’de verilmiştir.
Tablo 1. Erkek infertilitesine neden olan faktörler ve oranları (18)
TANI ORAN (%)
İnfertilitenin Bilinen Sebepleri 42.6
İnmemiş Testis 8.4 Varikosel 14.8 İmmünolojik Nedenler 3.9 Diğer 5.0 İdiyopatik İnfertilite 30 Hipogonadizm 10.1
Klinefelter Sendromu (47,XXY) 2.6
46,XX Erkek Sendromu 0.1
Primer Hipogonadizm 2.3
Sekonder Hipogonadizm 1.6
Kallmann Sendromu 0.3
İdiyopatik Hipogonadotropik Hipogonadizm 0.4
Geç Başlangıçlı Hipogonadizm 2.2
Gecikmiş Puberte 1.4 Diğer 0.8 Sistemik Hastalıklar 2.2 Maligniteler 7.8 Testis Kanseri 5.0 Lösemi / Lenfoma 2.2 Sarkoma 0.6
Ereksiyon / Ejakülasyon Bozukluğu 2.4
Obstrüksiyon 2.2
Vazektomi 0.9
7
Amerikan Üreme Tıbbı Derneği’nin 2015 kılavuzuna göre infertilite nedeniyle sağlık kuruluşuna başvurmuş çiftlerin anamnezi alınırken öncelikli olarak koital sıklık ve zamanlama, infertilite süresi ve önceki fertilite durumu, çocuklukta geçirilmiş hastalık ve gelişim durumu, sistemik hastalık varlığı (diabetus mellitus vb.), geçirilmiş cerrahi operasyonlar, alınan ilaçlar veya alerji varlığı, cinsel geçmiş (cinsel yolla bulaşan hastalık varlığı vb.), gonadotoksinlere maruziyet (çevresel veya kimyasal toksinler, ısı vb.) sorulmalıdır. Bunun dışında infertilite nedeniyle başvuran tüm erkek olgulara fizik muayene ve semen analizi yapılmalıdır (19).
2.2.2. Erkek İnfertilitesinin Değerlendirilmesi
İnfertilite değerlendirmesi, ≥12 aylık düzenli korunmasız cinsel ilişkiden sonra gebelik elde edemeyen çiftler için endikedir. İnfertil erkek olgunun ilk tarama değerlendirmesi, üreme öyküsü ve en az bir semen numunesinin analizini içermelidir (19). İlk değerlendirme sonucu anormal bir veri saptandığında semen analizi 15 gün ara ile 2 kez tekrarlanarak birlikte değerlendirilmelidir.
Öykü
Olguların üreme öyküsü alınırken aşağıdaki sorular cevaplanmalıdır. 1. Koitus sıklığı ve zamanı
2. İnfertilite süresi ve önceki fertilite durumu
3. Çocuklukta geçirilmiş hastalıklar ve gelişim süreci
4. Sistemik hastalık varlığı (diyabetes mellitus, üst solunum yolu hastalıkları vb.) 5. Geçirilmiş cerrahi operasyonlar
6. Alınan ilaçlar veya alerji varlığı
7. Cinsel geçmiş (cinsel yolla bulaşan hastalık varlığı)
8. Gonadotoksinlere maruziyet (çevresel veya kimyasal toksinler, ısı vb.)
Önceki fertilite öyküsü, edinilmiş veya sekonder erkek infertilite faktörlerini ekarte ettirmez. Değerlendirme, primer infertilitede (hiç gebelik oluşmamış) ve sekonder infertilitede (önceden gebelik öyküsü) aynıdır (19).
8
Tıbbi Geçmiş
Olgunun detaylı tıbbi geçmişi erkek infertilitesi üzerinde önemli etki yaratabilecek risk faktörleri/davranışlar ve yaşam tarzı etkilerini belirleyebilir. Tüm bu üreme geçmişiyle sorulacak soruların yanı sıra tıbbi öykü genişletilmiş olarak aşağıdakileri içermelidir:
1. Tüm sistemlerin eksiksiz incelemesi, 2. Ailevi üreme öyküsü ve
3. Geçmişte ya da şu anda kullanılan; anabolik steroid, keyif verici maddeler, sigara ve alkol kullanımı
gibi detaylı sosyal öykü alınmalıdır.
Fizik Muayene
Genel bir fizik muayene, infertil erkek değerlendirmesinin ayrılmaz bir parçasıdır. Özellikle genitoüriner sistem muayenesine dikkat edilerek;
1. Üretral meatusun yerini belirleyerek penisin muayenesi 2. Testislerin palpasyonu ve ölçümü
3. Vas deferens ve epididimisin varlığı ve değerlendirilmesi 4. Varikosel varlığının değerlendirilmesi
5. Vücut yapısı, kıllanma dağılımı ve meme gelişimi gibi sekonder cinsiyet özelliklerinin değerlendirilmesi
6. Rektal muayene yapılmalıdır.
Konjenital bilateral vas deferens yokluğu (CBAVD) teşhisi fizik muayene ile konur ve skrotal araştırma gereksizdir (19).
Semen Analizi
Semen analizi, infertil erkeklerde laboratuvar değerlendirmesinin temel taşıdır ve erkek faktörünün önemini tanımlamaya yardımcı olur. Semen analizi öncesinde 2-5 gün cinsel perhiz uygulanmalıdır. Her ne kadar standart bir cinsel perhiz süresi semen parametrelerinin değerlendirilmesi için önemli olsa da, şiddetli oligozoospermisi olan bazı erkekler, kısa süreli
9
(saatlik) bir perhiz süresi ile eşit veya daha iyi sperm konsantrasyonuna sahip olabilir; bu da yardımcı üreme tekniği kullanılan tedavi döngüleri sırasında çoklu semen analizlerinin potansiyel kullanımını desteklemektedir (20,21). İdeal şartlarda semen numunesi laboratuvarda toplanmalıdır. Laboratuvar dışında toplanmış ise en az bir saat içinde laboratuvara ulaştırılmalıdır.
Semen analizi, semen hacminin yanı sıra sperm konsantrasyonu, motilitesi ve morfolojisi hakkında bilgi sağlar (22). Semen analizi parametrelerini içeren Dünya Sağlık Örgütü sınıflandırması Tablo 2’de ve semen kalitesini değerlendirmede kullanılan terimler Tablo 3’te verilmiştir.
Tablo 2. Dünya Sağlık Örgütü (WHO) 2010 sınıflamasına göre semen analizi değerleri (23)
Parametreler Alt limit değerleri
Semen hacmi (mL) 1.5 (1.4-1.7)
Toplam sperm sayısı (106/ejakülat) 39 (33-46)
Sperm konsantrasyonu (106/mL) 15 (12-16)
Toplam motilite (%) 40 (38-42)
İleri hareketli (%) 32 (31-34)
Vitalite (canlı spermatozoa, %) 58 (55-63)
Sperm morfolojisi (normal formlar, %) 4 (3-4)
Diğer parametreler
pH >7.2
Peroksidaz-pozitif lökosit (106/ml) <1
Opsiyonel incelemeler
Karışık antiglobülin reaksiyon testi (%) <50
İmmunobead test (%) <50
Seminal çinko (μmol/ejakülat) ≥2.4
Seminal fruktoz (μmol/ejakülat) ≥13
10
Tablo 3. Semen kalitesine ilişkin terminoloji (23)
Aspermi Semen yok (retrograd ejakülasyon var veya yok)
Astenozoospermi İleri hareketli spermlerin yüzdesi alt referans limitin altında Astenoteratozoospermi Hem ileri hareketli spermlerin hem de morfolojik olarak normal
spermlerin yüzdesi alt refereans limitlerinden düşük Azospermi Ejakülatta hiç sperm yok (uygulanan değerlendirme yönteminin
kantitatif analiz limitine göre)
Kriptozoospermi Taze preparatlarda sperm olmamasına rağmen santrifüjlenmiş pellette gözlenir
Hemospermi Ejakülatta eritrositlerin varlığı
Lökospermi (lökosito-spermi,
piyospermi) Ejakülatta eşik değer üstünde lökosit varlığı
Nekrozoospermi Ejakülatta düşük yüzdede canlı ve yüksek yüzdede cansız spermler
Normozoospermi
Alt referans limitlerine eşit veya yüksek toplam sperm sayısı (veya raporlanan sonuca göre, konsantrasyonu) ileriye doğru
hareketli ve morfolojik olarak normal spermatozoa yüzdeleri
Oligoastenozoospermi
Alt referans limitlerinden düşük toplam sperm sayısı (veya raporlanan sonuca göre, konsantrasyonu) ve ileri hareketli
spermazoa yüzdesi
Oligoastenoteratozoospermi
Alt referans limitlerinden düşük toplam sperm sayısı (veya raporlanan sonuca göre, konsantrasyonu) hem ileri hareketli
hem de morfolojik olarak normal spermlerin yüzdeleri
Oligoteratozoospermi
Alt referans limitlerinden düşük toplam sperm sayısı (veya raporlanan sonuca göre, konsantrasyonu) ve morfolojik olarak
normal spermlerin yüzdesi
Oligozoospermi Alt referans limitinden düşük toplam sperm sayısı (veya raporlanan sonuca göre konsantrasyonu)
Teratozoospermi Alt referans limitinden düşük yüzdede morfolojik olarak normal spermler
11 Hormonal Değerledirme
Hipotalamus-hipofiz-testis aksının hormonal anormallikleri kolayca tespit edilebilmektedir fakat nadir olarak erkek infertilitesine neden olurlar. Normal semen parametrelerine sahip erkeklerde endokrin bozukluklar oldukça nadir görülür.
Hormonal değerlendirme endikasyonları arasında;
1. Anormal semen parametreleri, özellikle sperm konsantrasyonu <10 milyon/mL olması 2. Cinsel fonksiyon bozukluğu olması
3. Spesifik endokrinopati göstergesi olan diğer klinik bulguların varlığı bulunmaktadır.
Minimum başlangıç hormonal değerlendirmesi, serum FSH ve toplam testosteron (T) konsantrasyonlarının ölçümünü içermelidir. Toplam testosteron seviyesi düşük olduğunda (<300 ng/mL) daha kapsamlı bir değerlendirme gerekmektedir ve ikincil olarak sabah erken T ölçümü, serumsuz testosteron ölçümü, LH ve prolaktin (PRL) ölçümlerinin yapılması gerekmektedir. Serum testosteronu, LH, FSH ve PRL konsantrasyonları arasındaki ilişki, anormal toplam testosteron seviyesinin kaynağının anlaşılmasına yardımcı olur (24,25). Çeşitli klinik durumlarda gözlenen bazal hormon seviyelerinin durumu Tablo 4’te özetlenmiştir.
Tablo 4. Çeşitli klinik durumlarda bazal hormon seviyeleri (19)
Tanı FSH LH Testosteron PRL
Normal spermatogenez Normal Normal Normal Normal
Hipogonadotropik
hipogonadizm Düşük Düşük Düşük Normal
Anormal spermatogenez Yüksek/Normal Normal Normal Normal
Komplet testiküler yetmezlik/
Hipergonadotropik hipogonadizm
Yüksek Yüksek Normal/Düşük Normal
PRL-salgılayan hipofiz
12
Serum İnhibin B konsantrasyonu, spermatogenez için bir belirteç olarak gösterilmektedir. İnhibin B düzeyleri infertil erkeklerde fertil erkeklere göre anlamlı derecede düşüktür ve sperm parametreleriyle FSH düzeylerinden daha iyi korelasyon göstermektedir. Rutin olarak infertil erkeklerde ilk basamak hormonal değerlendirmede istenmesi tartışmalı olmakla birlikte gerekli görülen durumlarda istenmesi uygun bulunmaktadır (26).
Diğer Testler
Post-ejakülatör İdrar Tahlili
Düşük hacimli veya antegrad boşalma olmaması, inkomplet semen toplanması, retrograd boşalma, boşalma kanalı tıkanıklığı, hipogonadizm veya CBAVD göstergesi olabilir. Retrograd ejakülasyonu dışlamak için, hipogonadizm veya CBAVD tanısı olanlar hariç, boşalma hacmi <1.0 mL olan erkeklerde, boşalma sonrası idrar tahlili yapılmalıdır. Azospermi veya aspermisi olan erkeklerde, ejakülasyon sonrası idrar tahlilinde herhangi bir spermin varlığı, retrograd ejakülasyonu düşündürür (27).
Ultrasonografi
Transrektal Ultrasonografi
Normal seminal veziküller anteroposterior çapta genellikle <1.5 cm'dir. Dilate seminal vezikülleri veya ejakülatör kanalları, orta hat kistik prostatik yapıları ortaya çıkaran transrektal ultrasonografi, tam veya kısmi ejakülatör kanal tıkanıklığının teşhisini düşündürebilir fakat tanı koydurucu değildir (28).
Skrotal Ultrasonografi
Skrotal ultrasonografi palpe edilemeyen okült varikülleri tanımlayabilir, ancak bu lezyonların klinik önemi henüz belirsizdir (29).
2.3. Azospermi
Azospermi, en az iki farklı ejakülat örneğinde sperm bulunmaması olarak tanımlanır (30). Tüm erkeklerde görülme sıklığı %2 iken; infertil erkeklerde bu oran %20’leri bulabilmektedir (31). Azospermi, etiyolojik olarak pre-testiküler, testiküler ve post-testiküler olmak üzere üç ana gruba ayrılır.
13
Pretestiküler azospermi, düşük seks steroid düzeyi ve anormal gonadotropin düzeyine bağlı endokrin nedenlerden kaynaklanabilir. Bu nedenler konjenital (Kallmann sendromu vb.), edinilmiş (hipotalamik veya pitüiter bozukluklar vb.) veya ikincil (ilaç kullanımı vb.) sebeplere bağlı olabilir.
Testiküler azospermide, spermatojenik yetmezliğe yol açan konjenital, edinilmiş veya idiyopatik bozukluklar görülür. Konjenital testiküler azospermi nedenleri arasında, anorşi, testis disgenezisi (kriptorşidizm), genetik anomaliler (Y kromozomu delesyonları vb.), germ hücresi aplazisi (Sertolli cell-only sendromu) ve spermatojenik arrest (maturasyon arresti) sayılabilir. Edinilmiş testiküler azospermiye, travma, torsiyon, enfeksiyon (kabakulak vb.), testiküler tümörler, ilaçlar, radyasyon, geçirilmiş cerrahi (testis vaskülerizasyonunu etkileyen), sistemik hastalıklar (siroz, böbrek yetmezliği vb.) ve varikosel yol açabilir (32).
Spermatozoanın testise taşınmasını engelleyen, ejakülasyon bozuklukları ve obstrüksiyonlar post-testiküler azospermiye yol açar. Bu obstrüksiyonlar bilateral vas deferens yokluğuna bağlı olarak konjenital veya enfeksiyon, geçirilmiş cerrahiye (vazektomi vb.) bağlı olarak da edinilmiş olabilir (32).
2.3.1. Obstrüktif Azospermi
Tüm azospermi vakalarının %40’ını oluşturan obstrüktif azospermi (OA), dış kanal tıkanıklığı nedeniyle meydana gelir. Erkek üreme sistemi boyunca herhangi bir yerde ortaya çıkabilen eksternal duktal tıkanmalar (rete testis, efferent kanallar, epididim, vaz deferens ve ejakülatör kanal) klasik olarak normal spermatogenez ile karakterizedir. Çoğu obstrüktif azospermi vakasında, testiste normal veya normale yakın sperm üretimi devam etmektedir (33). Obstrüktif azospermi nedenleri Tablo 5’te verilmiştir.
14
Tablo 5. Genitoüriner sistemde tıkanıklığa yol açan nedenler (33)
Epididimis
Enfeksiyonlar (akut/kronik epididimit)
Sperm aspirasyon/biyopsisi için önceden yapılmış insizyon Geçirilmiş skrotal cerrahi (hidroselektomi vb.)
Konjenital (parsiyel veya komplet epididimis yokluğu) Young Sendromu
Vas Deferens
Vazektomi İyatrojenik CBAVD
Yanlış teknik kullanılarak yapılan vazotomi/vazografi
Ejakülatör Kanal
Kistler (Müllerien, prostatik, seminal veziküler) Travmatik
İyatrojenik (postoperatif) Enfeksiyon (prostatit)
2.3.2. Non-obstrüktif Azospermi
Non-obstrüktif azospermi, en sık primer testiküler yetmezlik sonucu spermatogenezin bozulmasından kaynaklanır. Bununla beraber hipotalamus veya hipofiz aksındaki bozukluklar nedeniyle de oluşabilir. Yüksek FSH ve normal ejekülat hacmi nedeniyle non-obstrüktif azospermi şüphesi olan erkekler için tanısal testis biyopsisi genellikle endike değildir. Primer veya sekonder testiküler yetmezliğe sahip olgularda bilateral testiküler atrofi görülebilir ancak maturasyon arrestine sahip bazı olgularda normal testis hacmi ve normal FSH değerleri gözlenebilmektedir. Düşük semen hacmi düşük serum testosteron ile ilişkili olabilir (13).
Endokrinolojik değerlendirme primer ve sekonder testiküler yetmezliği ayırmada yardımcı olabilir. Bilateral testiküler atrofiye sahip, artmış serum FSH değeri (>7.6 mIU/mL) ve normal/düşük serum T seviyesi bulunan olgular primer testiküler yetmezliğe sahiptirler. Bu bulgulara sahip erkeklere kromozomal anomaliler ve Y kromozom mikrodelesyonlarını dışlamak için genetik test önerilmelidir (34).
15
Düşük gonadotropin seviyesi ve bilateral testiküler atrofiye sahip olgularda hipogonadotropik hipogonadizm düşünülmelidir. Şiddetli hipogonadotropik hipogonadizm olgularında, Kallmann sendromu gibi hipotalamik bozukluklar veya saptanamayacak kadar düşük seviyedeki gonadotropinlerle ilişkili olabilecek hem fonksiyonel hem de fonksiyonel olmayan tümörler dahil olmak üzere konjenital veya edinilmiş hipofiz bozuklukları akla gelmelidir (13).
Ek olarak, hipotalamik-hipofiz gonadal aksının baskılanması sonucu çok düşük veya saptanamayan gonadotropin seviyesi nedeniyle testis stimülasyonunun bulunmaması, ekzojen T veya illegal anabolik androjenik steroid kullanımına sekonder feedback yoluyla olduğu düşünülmektedir (35).
2.4. Erkek İnfertilitesine Yol Açan Genetik Nedenler
Erkek infertilitesinin genetik nedenlerinin incelenmesi karmaşıktır çünkü bağlantı analizleri, aile çalışmaları ve karmaşık soy ağacı analizi gibi genetik analiz araçlarının çoğu durumun doğası gereği yararsızdır. Açıklanamayan oligospermi ve azospermi saptanan olgularda, sayısal ve yapısal kromozomal anomalileri de dahil olmak üzere birçok genetik anomali tanımlanmıştır (36). Erkek infertilitesinde yer alan genetik faktörler arasında kromozomal bozukluklar, mitokondriyal DNA (mtDNA) mutasyonları, monogenik hastalıklar, çok faktörlü bozukluklar ve genetik kaynaklı endokrin bozukluklar sayılabilir (37).
2.4.1. Kromozomal Anomaliler
Vücudumuzdaki hemen hemen her hücrede toplam 46 kromozom için 23 çift kromozom bulunur. İlk 22 çift otozomal kromozomlar olarak adlandırılır. Son çift cinsiyet kromozomları olan, X ve Y'den oluşur. Kadınlar iki X kromozomuna sahiptir ve erkeklerde her hücrede genellikle bir X ve bir Y kromozomu vardır. Aslında birçok tip kromozomal anomali vardır, fakat bunlar sayısal veya yapısal olarak kategorize edilebilir. Normal çiftten eksik veya fazla kromozom bulunması halinde sayısal kromozom anomalileri meydana gelir. Yapısal kromozom anomalilerinde ise kromozomun yapısında meydana gelen eksiklik, fazlalık ya da yer değiştirme söz konusudur (38).
Toplam 9.766 infertil erkek de dahil olmak üzere on bir yayından toplanmış veri anketinde, kromozomal anomali görülme sıklığı %5.8 olarak bildirilmiştir (39). Bunlardan cinsiyet kromozom anomalileri %4.2, otozomal anomaliler %1.5 oranında saptanmıştır.
16
Kontrol grubu olarak, iki seriden elde edilen verilerde anomali görülme sıklığı %0.38 olarak bulunmuş olup, bunlardan 131'i (%0.14) cinsiyet kromozomu anomalileri ve 232'si (%0.25) otozomal anomaliler olmak üzere toplam 94.465 yenidoğan erkek taranmıştır (40). Testiküler yetmezlik daha ciddi hale geldikçe kromozomal anomali sıklığının arttığı; spermatozoa sayısı <5 milyon/mL olduğu takdirde, genel popülasyona kıyasla, otozomal yapısal anomalilerin on kat daha yüksek (%4) insidans gösterdiği bildirilmiştir (39,40). Sperm konsantrasyonunun farklı olduğu hastalarda kromozomal aberasyonların sıklığına göre, azospermi veya oligozoospermisi olan erkeklerde (spermatozoa <10 milyon / mL) karyotip analizi endikedir (40). Bu geniş seçim kriterleri görece düşük özgüllük anlamına gelmektedir.
2.4.1.1. Cinsiyet Kromozomu Anomalileri Klinefelter Sendromu
Klinefelter Sendromu (KS) (47,XXY) erkeklerde 1:600 görülme sıklığı ile en sık saptanan kromozomal anomalidir ve azosperminin en sık görülen genetik nedenidir (41). KS'nin geniş bir klinik spektrumu vardır ancak tüm erkeklerde atrofik testisler (testis volümü 8–10 cm3) ve FSH/LH seviyelerinde belirgin bir artış görülmektedir. Ek olarak, KS'li erkeklerin yaklaşık %10-20'si 47,XXY ve 46,XY karyotipleri veya diğer mozaik bileşimlerini gösteren hücre yapısına sahiptirler (42). Mozaik olmayan KS olgularında spermatogenez ciddi şekilde etkilemiştir ve genellikle azospermi görülür. Bununla birlikte, non-mozaik KS'li erkeklerin %8.4'ünde ejakülatlarında sperm vardır. Anormal spermatogenezise cevap olarak FSH artar. Testosteron seviyesinden bağımsız olarak, LH verimsiz bir şekilde androjen üreten Leydig hücrelerinin maksimum stimülasyonunun bir sonucu olarak artar (43). Fazladan bir X kromozomunun bulunması spermatojenik ve androjenik yetmezliğe yol açmasının yanı sıra, jinekomasti, konuşma güçlüğü, meme kanseri (%57.8) ve non-hodgkin lenfoma (%3.5) nedeniyle artmış mortalite, prostat kanseri riskinde azalma ve ekstra gonadal germ hücre tümörlerinde artmış riske neden olması sebebiyle karyotip analizinin önemini arttırmaktadır (44,45). Peri/pre-pubertal KS olgularında spermatogonyal kök hücrelerin kriyoprezervasyonu için yapılan TESE işlemi, deneysel olarak kabul edilip sadece araştırma protokolü dahilinde yapılmalıdır (46).
46,XX Erkek Sendromu
46,XX testiküler cinsiyet gelişimi bozukluğu (46,XX erkek sendromu) 1:20.000 canlı erkek doğumda görülür ve fenotipik olarak infertil erkeklerde nadirdir (47). Cinsiyet belirleyici
17
bölge (SRY) normalde Y kromozomunda bulunur ve testis gelişimi, testosteron üretimi ve erkek fenotipini oluşturan kilit genetik bir bileşendir. Bu 46,XX erkeklerin %90’ı, normalde Y kromozomunun kısa kolunun distal kısmında (Yp) bulunan SRY'ye, X kromozomunda veya herhangi bir otozomda sahiptirler (48). 46,XX sendromuna sahip erkekler fenotipik olarak erkek gibi görünseler de; küçük testislere, kısa boya sahiptirler ve Y kromozomu bulunmadığı için normal spermatogenezde gerekli olan AZF genleri bulunmadığından dolayı infertildirler (49). Bu nedenle, karyotip bu hastalarda prognostiktir ve hasta mikro-TESE veya testis biyopsisi için aday değildir (50).
47,XYY Sendromu
47,XYY erkeklerlede fertilite oldukça değişkendir. Sperm sayısı normozoospermiden azospermiye kadar geniş bir yelpazede çeşitlilik gösterir (51). Bu bireylerde davranış bozukluğu ve nöropsikiyatrik hastalıklar görülebilir (52).
2.4.1.2. Otozomal Kromozom Anomalileri
Erkek partnerde otozomal kromozom anomalisi varlığında fertilite tedavisi almak isteyen tüm çiftlere (IVF/ICSI dahil) genetik danışmanlık verilmelidir. En sık görülen otozomal kromozom anomalileri, robertsonian translokasyonlar, resiprokal translokasyonlar, parasentrik inversiyonlar ve marker kromozomlardır. İnfertil erkeklerde normal popülasyona göre yapısal kromozom anomalisi görülme oranı %2 arttığı bildirilmiştir (53).
Robertsonian Translokasyonlar
Robertsonian translokasyonlar, iki akrosantrik kromozomun (13, 14, 15, 21 ve 22) sentromerlerinden kaynaşması durumunda ortaya çıkar (54). Robertsonian translokasyonlarının görülme sıklığı genel popülasyonda %0.1, tekrarlayan düşükleri bulunanan hastalarda %1.1 ve infertil erkeklerde %3'tür (55,56).
Resiprokal Translokasyonlar
Resiprokal translokasyonlar, homolog olmayan iki kromozom arasında parça değişimi sonucu meydana gelmektedir. Bu translokasyonlar sonucunda genetik materyal kaybı veya kazancı olmaması ve kırılma noktaları protein sentezini engellemeycek şekilde oluşması durumunda hastalar fenotipik olarak normal görünümdedir. Bununla beraber resiprokal translokasyon taşıyıcıları infertilite ve terkrarlayan gebelik kayıpları açısından risk altındadır. Çoğu üreme başarısızlığı dengesiz gametlerin üretilmesinden kaynaklanıyor olsa da, ek
18
mekanizmalar translokasyon taşıyıcılarının infertilitesini önemli ölçüde etkileyebilir. Örneğin, X kromozomunu içeren resiprokal tranlokasyon taşıyıcı erkeklerde, X inaktivasonuna bağlı olarak tamamıyla durmuş spermatogenez görülebilmektedir (57,58).
Marker Kromozom
Marker kromozomlar, konvansiyonel sitogenetik tekniklerle tamamen karakterize edilemeyen yapısal olarak anormal kromozom fragmanlarıdır. Bu sentrik kromozomlar, 24 kromozomun herhangi birinden kaynaklanabilir ve genel popülasyondaki sıklıklarının yaklaşık %0.04 olduğu tahmin edilmektedir (59). Ancak, infertil çiftlerde görülme sıklığı üç kat artmıştır ve erkeklerde daha sık görülür (60).
2.4.1.3. Spermin Kromozomal Anomalileri
Sperm, hem normal karyotipli hem de anomalili olan erkeklerde FISH yöntemi kullanılarak kromozomal yapıları incelenebilir. Spermdeki anöploidi, özellikle cinsiyet kromozom anöploidileri, spermatogenezde ciddi hasar ile ilişkilidir. Spermatozoanın FISH analizi sadece belirli androlojik koşullarda endikedir (61).
2.4.2. X'e Bağlı Genetik Bozukluklar ve Erkek İnfertilitesi
Her erkekte sadece bir X kromozomu bulunur ve X kromozomu üzerindeki genler açısından hemizigot durumundadır ve dolayısıyla X'e bağlı resesif kalıtılan hastalıklar primer olarak erkeklerde görülür. Bununla birlikte, hastalığa sahip erkekler bu defekti oğullarına aktarmazlar (62).
2.4.2.1. Kallmann Sendromu
Kallmann sendromlu hastalarda hipogonadotropik hipogonadizm ve anosmi vardır, fakat aynı zamanda yüz asimetrisi, yarık damak, renk körlüğü, sağırlık, inmemiş testis ve tek taraflı böbrek aplazisi gibi diğer klinik özellikler de görülebilir. Bu sendrom KAL1 genindeki (X kromozomunda) veya diğer bazı otozomal genlerdeki mutasyona bağlı olabilir ve şüphelenilen durumlarda test edilmelidir (61,63).
2.4.2.2. Hafif Androjen İnsensivite Sendromu
Androjen Reseptörü (AR) geni, X kromozomunun uzun kolunda bulunur ve bu gendeki mutasyonlar hafif ve komplet androjen duyarsızlığına neden olabilir. Parsiyel androjen duyarsızlık sendromunda fenotipler, kadın fenotipinden ambigus genitalyaya, erkek
19
fenotipinde mikropenis, perineal hipospadias ve kriptorşidizme kadar değişiklik gösterebilir (64).
2.4.3. Y Kromozomu ve Erkek İnfertilitesi
Y kromozomu, diğer kromozomlardan büyüklüğü, genomik yapısı, içeriği ve evrimsel temeli bakımından belirgin bir şekilde farklılık gösterir (65). PAR1 ve PAR2 olmak üzere iki pseudootozomal bölgeden ve MSY (erkek spesifik Y bölgesi) akrosentrik Y kromozomunun %95’ini oluşturur. PAR bölgeleri, X-Y homolog bloğuna karşılık gelir ve çeşitli biyolojik fonksiyonlarla ilgili proteinleri kodlayan 27 gen içerir ve buna bağlı olarak değişken ekspresyon paternine sahiptirler (66). PAR1 bölgesi, erkek mayozu için gerekli olan mayotik eşleşmeye katılmaktadır (67). MSY bölgesi X kromozomu ile rekombinasyona uğramaz ve X-transloke (%99 X kromozomuna özdeş), X-dejenere (X’e bağlı genlerin homologları ve tek gen kopyaları) ve amplikon sekanslarından oluşur (68). Y kromozomunun uzun kolundaki üç farklı bölgede üç mikrodelesyon haritalandırılmıştır. Bu bölgeler azospermi faktörü (AZF) a, AZFb ve AZFc olarak adlandırılır ve sırasıyla Yq11'de proksimal, santral ve distal olarak gözlenir (69). Bu bölgelerde birden fazla gen bulunmaktadır ve çoğunun spermatogenezde rol oynadığı düşünülmekle birlikte görevleri tam anlamıyla henüz anlaşılamamıştır (37).
2.4.3.1. Y Kromozomu Mikrodelesyonlarının Klinik Önemi
Yq mikrodelesyonlarının klinik önemi aşağıdaki gibi özetlenebilir:
Normoozospermik erkeklerde görülmez bu da Y mikrodelesyonları ve spermatogenez bozukluklukları arasında bir bağ olduğunun göstergesidir (5).
En yüksek Y mikrodelesyon sıklığı azospermik erkeklerde (%8-12), ardından oligozoospermik (% 3-7) erkeklerde gözlenmektedir.
Delesyonlar >5 milyon/mL'lik (~%0,7) sperm konsantrasyonunda son derece nadirdir. AZFc delesyonları en yaygın olanıdır (%65-70), ardından AZFb ve AZFb + c veya
AZFa + b + c bölgelerinin (% 25-30) mikrodelesyonları gelmektedir.
AZFa bölgesinin komplet delesyonu, ciddi testiküler fenotip (Sertoli-cell only sendromu) ile, AZFb bölgesinin komplet delesyonu, spermatojenik arrest ile ilişkilidir.
20
AZFc bölgesinin komplet delesyonu, azospermiden oligozoospermiye kadar değişen bir fenotipe neden olur.
Klasik (komplet) AZF delesyonları kriptorşidizm veya testis kanseri için risk oluşturmaz (70).
Yukarıda bildirilen genotip/fenotip korelasyonunun özgünlüğü, Y mikrodelesyon analizinin testiküler sperm aranması için hem tanısal hem de prognostik değere sahip olduğu anlamına gelmektedir (70).
AZFa Mikrodelesyonu
AZFa lokusu yaklaşık 792 kb uzunluğundadır ve USP9Y (ubikitin spesifik peptidaz 9’u kodlar), DDX3Y (önceden DBY olarak da bilinen, DEAD [Asp-Glu-Ala-Asp] polipeptid kutusunu kodlayan) gibi yaygın olarak eksprese edilen iki fonksiyonel geni barındırır (71). Her iki gen de erkek infertilitesi için aday genlerdir, ancak AZFa bölgesindeki kesin rolleri büyük ölçüde bilinmemektedir. AZFa bölgesinin komplet delesyonu nispeten nadirdir (<% 2), genellikle Sertoli-cell only sendromu veya azospermi kliniği ile ilişkilidir (72). Erkek infertilitesindeki AZFa mikrodelesyonlarında sY84 ve sY86 belirteçlerinin kullanımı önerilmektedir. sY84 ve sY86, sırasıyla USP9Y ve DDX3Y genlerinin upstream bölgesinde bulunur. Bu belirteçler AZFa mikrodelesyonlarının teşhisinde yaygın olarak kullanılmaktadır (71).
AZFb Mikrodelesyonu
AZFb'nin komplet delesyonu azospermi ile ilişkilidir ve testiste spermatozoa odakları yoktur (5). AZFb lokusu Yq11'in santral bölgesinde yer almaktadır ve 3,2 Mb'lik bir alana yayılmıştır ve bunun 1,5 Mb'si AZFc ile örtüşür. AZFb bölgesi karmaşık bir genomik yapıya sahiptir. Üçlü tekrar bölgesi, Y kromozomuna spesifik DNA tekrar ailesi (DYZ) ve 14 amplikondan oluşmaktadır. Spermatogenez ile ilişkili bu bölgedeki bilinen protein kodlayan genler, X dejenere ökromatin'de bulunan EIF1AY, RPS4Y2 ve SMCY ve amplikonik bölgelerde bulunan HSFY, XKRY, PRY ve RBMY'dir. AZFb delesyonundan sorumlu olarak önerilen ilk gen, RBMY’dir (69). RBMY gen ailesi, sadece germ hücrelerinde eksprese edilen testise özgü RNA bağlayıcı proteinleri kodlar (73). HSFY geni yeni keşfedilmiş ısı-şok protein ailesinin bir üyesidir. HSFY proteini Sertoli hücreleri ve spermatojenik hücrelerde eksprese edilir ve memeli testisterinde, ısı-şok proteinlerinin spermatogenezde rolü olduğu gösterilmiştir (74). Araştırmacıların üzerinde durduğu diğer bir gen olan EIF1AY, translasyon başlatma faktörüdür. (75).
21 AZFc Mikrodelesyonu
AZFc, 4.5 Mb'lik ökromatin bölgede yer alır ve komplet delesyonu, erkek kısırlığının en sık nedenlerinden biridir (76). AZFc'nin kısmi delesyonu sık görülen başka bir paterndir. AZFc mikrodelesyonu olan erkeklerin %50'sinde ejakülatta veya testis dokusunda spermatozoa bulunabilir (77). Nadir de olsa AZFc delesyonuna sahip olup birden fazla çocuğu olan erkekler vardır fakat erkek çocuklarının tümü infertildir (78,79). AZFc, BPY2, CDY, DAZ, CSPG4LY, GOLGAZLY, TTY3.1, TTY4.1 ve TTY7.1 olmak üzere 8 gen ailesi içerir. AZFc'de bulunan ilk gen DAZ (deleted in azoospermia), 1995 yılında Reijo ve arkadaşları tarafından tanımlanmıştır (80). Bu gen, sadece germ hücrelerinde eksprese edilen RNA bağlayıcı proteinleri kodlar. Bu genler 2 küme, DAZ1/DAZ2 ve DAZ3/DAZ4 halinde bulunur (5). DAZ kümelerinden her birinin delesyonu farklı kliniklere yol açabilir (81). CDY1 (chromodomain Y geni), DNA remodellenmesinde yer alan proteini kodlar (82).
AZFd Mikrodelesyonu
1999 yılında, Kent-First ve arkadaşları, AZFb ve AZFc arasında dördüncü bir AZF bölgesini tarif edip ve hafif oligospermi veya anormal sperm morfolojisi ile ilişkili olabileceği düşünülen bu bölgeye, AZFd adını vermişlerdir (83). Sertoli cell only (SCO) sendromlu hastalarda AZFd'de bir lokusun delesyonu ve bir AZFc delesyonu kaydedilmiştir. Bu lokus (SY152), AZFc'ye ve DAZ kopyalarından birine yakın konumlanmıştır. Bu keşifle duyulan ilk heyecana rağmen, AZFd bölgesinin varlığı ciddi bir şekilde sorgulanmaktadır. Noordam ve arkadaşları, bu bölgedeki delesyonların hastalık yapıcı mutasyon yerine polimorfizm olabileceğini tartışmaya açmışlardır (84). Mevcut durumda, AZFd'nin, ilk raporlamanın teknik kusurların sonucu ortaya çıktığı yönündedir ve günümüzde AZFd lokusu klinik uygulamalarda dikkate alınmamaktadır (85).
2.4.4. Monogenik Erkek İnfertilitesini Etkileyen Faktörler
Monogenik genetik bozukluklar, tek bir genin kusurlu olmasının doğrudan bir sonucu olarak ortaya çıkar. Bu tür bozukluklar Mendel yasalarına göre kalıtım gösterirler. Erkek infertilitesine bağlı 50'den fazla monogenik bozukluk vardır ve bunlardan sadece birkaçı primer infertilite nedeni olarak değerlendirilmiştir (14).
22 2.4.4.1. Konjenital Bilateral Vas-Deferens Yokluğu (CBAVD)
CBVAD, CFTR gen mutasyonları ile ilişkilidir ve OA'lı erkeklerin ~% 2'sinde bulunur (86). Vas deferens eksikliğinin klinik teşhisinin kaçırılması kolaydır ve azospermili tüm erkekler CBAVD'yi, özellikle semen hacmi <1,5 mL ve pH <7,0 olanları dışlamak için çok dikkatli bir şekilde incelenmelidir. En sık bulunan mutasyonlar delta F508, R117H ve W1282X'tir, fakat bunların sıklığı ve diğer mutasyonların varlığı büyük ölçüde hastanın etnik kökenine bağlıdır (87). Rutin testler genellikle bir mutasyon panelinin analizi yoluyla belirli bir topluluktaki en yaygın mutasyonlarla sınırlıdır. Rutin panelde ikinci bir mutasyon bulunmazsa, bunun resesif bir hastalık olduğu göz önüne alınarak, tüm gen dizilimini içeren ikinci bir analiz önerilir (88).
2.5. Erkek İnfertilitesine Yol Açan Genetik Olmayan Nedenler
Genetik olmayan fakat infertiliteye neden olan faktörler aşağıdaki gibi sıralanabilir; Hormonal Nedenler
Hipogonadotropik hipogonadizm İmpotans
Geçirilmiş skrotal veya inguinal cerrahi Varikosel
Kriptorşidizm
Kimyasallara maruziyet Çevresel faktörler İmmünolojik faktörler
23 3. GEREÇ VE YÖNTEM
Bu çalışmaya, Ege Üniversitesi Tıp Fakültesi Hastanesi Tıbbi Genetik Anabilim Dalı’na azospermi nedeniyle Ocak 2009 ve Mart 2019 tarihleri arasında, Y mikrodelesyonu testi için başvuran olgular dahil edildi ve bu olguların dosyaları retrospektif olarak incelendi. Çalışmamız, Ege Üniversitesi Tıp Fakültesi Tıbbi Araştırmlar Etik Kurulu’nun 15.05.2019 tarih ve 19-5.1T/36 numaralı onayı doğrultusunda yürütülmüştür.
3.1. Olgu Seçimi
3.1.1. Çalışmaya Dahil Olma Kriterleri
İnfertilite nedeniyle Ege Üniversitesi Tıp Fakültesi Üroloji AD. ve Ege Üniversitesi Aile Planlaması ve Kısırlık (İnfertilite) Uygulama ve Araştırma Merkezi’ne başvurmuş, azospermi tanısı almış (en az bir spermiyogramda 5 milyon/mL altında sperm sayısı tespit edilmiş) olgular içinden karyotip analizi normal bulunmuş olup Y mikrodelesyonu testinde AZF mikrodelesyonu saptanan Türk popülasyonundan olan bireyler dahil edilmiştir. Çalışmaya katılmak isteyen tüm olgular, Ege Üniversitesi Tıp Fakültesi Tıbbi Araştırmlar Etik Kurulu tarafından onaylanan Gönüllü Olur Formu’nu imzalamışlardır.
3.1.2. Çalışma Dışı Bırakılma Kriterleri
Karyotip analizinde anomali saptanan olgular AZF mikrodelesyonu bulunmayan olgular Verilerine ulaşılamayan olgular
Çalışmaya katılmak istemeyen ve Gönüllü Olur Formu’nu imzalamayan olgular
3.2. Çalışma Düzeni
Arşiv kayıtlarından olguların, yaş, boy, kilo, hormon değerleri (PRL, T, FSH, LH), testis hacmi, fizik muayene bulguları, mikro-TESE sonuçları, karyotip analizleri, AZF mikrodelesyon sonuçları ve gebelik durumları kaydedildi.
3.2.1. Fizik Muayene
Ege Üniversitesi Tıp Fakültesi Üroloji AD.’da tüm olgulara detaylı genital fizik muayene yapılmıştır. Her iki testin hacmi ölçülmüş olup hormon profilleri (PRL, T, FSH, LH) belirlenmiştir.
24 3.2.2. Karyotip Analizi
Tüm olgular Ege Üniversitesi Tıp Fakültesi Hastanesi Tıbbi Genetik AD.’da değerlendirilmiştir. Öncelikli olarak heparinli tüplerde gelen kanlar; tüpün sağlamlığı, içerisinde pıhtı olması, barkod bilgilerinin doğruluğu açısından kontrol edilmiştir. Karyotip analizi altı aşamadan oluşmaktadır. Bunlar; ekim, yayma, bantlama, inceleme, kontrol ve raporlama aşamalarıdır.
Ekim
Sterilite sebebiyle laminer akım cihazı altında oda sıcaklığına getirilmiş besiyerine kan ekimi gerçekleştirilmiştir. Sonrasında 72 saaat etüvde bekletilecek olan örneklere, yüksek rezolüsyonlu bantlama yapılacağı için 48. saatte %1’lik timidin eklenerek tekrar etüve konulmuştur. Etüven alınan örnekler 1100 rpm’de 10 dakika santrifüj edildikten sonra üstündeki süpernatan kısım atılmıştır. Timidini uzaklaştırmak için 5-6 ml serumsuz besiyeri ile yıkanmıştır ve 1100 rpm’de 10 dakika santrifüj edilikten sonra süpernatan kısım tekrar atılmıştır. 5 ml serumlu besiyeri ve 1 diziyem fitohemaglutinin eklenerek örnekler 3 saaat 45 dakika etüvde bekletildikten sonra 1 damla kolsemid eklenmiştir. 15 dakika sonrasında örnekler 1100 rpm’de 10 dakika santrifüj edildikten sonra süpernatan kısmı atılmıştır. %5’lik KCI (hipotonik) 10 ml eklenerek, 25 dakika etüvde bekletildikten sonra 1100 rpm’de 10 dakika santrifüj edilip süpernatan kısmı atılmıştır. 3/1 oranında hazırlanmış olan metanol/asetik asit solüsyonu ile örnekler fikse edilmiştir.
Yayma
En az 3 kez fiksatif solüsyonundan geçirilen örnekler, etiketlenmiş ve soğutulmuş lamların üzerine 3 damla olacak şekilde yayma işlemi gerçekleştirilmiştir. Yayılan preparatlar 90˚C’de 90 dakika yaşlandırılmıştır. Yaşlandırma işleminden sonra preparatlar, sıcak su banyosunda 65˚C’de 10 dakika 2xSCC solüsyonu ile muamele edildikten sonra saf su ile yıkanmıştır.
Bantlama
Preparatlar kurutulduktan sonra, yaklaşık 10-14 ˚C’de olan tripsin solüsyonunda 10-11 saniye muamele edildikten sonra tampon solüsyonundan geçirilmişlerdir. Sonraki aşama olan gimza boyama işlemi tamamlandıktan sonra preparatlar distile su ile yıkanmıştır.
25
İnceleme
En az 20 metafaz plağı incelenmiştir. Herhangi bir şüphe durumunda incelenen metafaz sayısı arttırılmıştır.
Kontrol
Görüntü analiz sistemine aktarılan metafazlar sitogenetik uzmanı tarafından kontrol edilmiştir.
Raporlama
Raporlama ISCN kriterlerine göre yazılmıştır.
3.2.3. Y Mikrodelesyon Analizi
Azospermi nedeniyle başvuran tüm olgular, Y mikrodelesyon analizi için çalışmaya alınmıştır. Bu amaçla öncelikle periferik kandan DNA izolasyonu yapılmış olup Y mikrodelesyonu analizi için ChromoQuant AZF PCR (Solna, İsveç) kiti kullanılmıştır.
3.2.3.1. Örneklerin Toplanması ve DNA İzolasyonu
Olgulardan EDTA’lı tüpe 2cc venöz kan örneği alınmıştır. Kan lenfosit hücrelerinden protokole uygun olarak, aşağıda yazılı adımlar izlenerek QIAcube AllPrep DNA/RNA FFPE (Qiagen, Hilden, Almanya) kiti kullanılarak QIAcube Robotik DNA (Qiagen, Hilden, Almanya) ile DNA izolasyonları yapılmıştır:
1. 200 μl kan, örnek kartuşu içine aktarılmıştır.
2. Örnek, QIAcube Robotik DNA izolasyon cihazındaki örnek kartuşu bölgesine yerleştirilmiştir.
3. Kaç adet DNA izolasyonu yapılacağına bağlı olarak diğer süspansiyonlardan ne kadar ekleneceği sistem tarafından belirlenerek tavsiye edilen miktarda Magnetic Glass Particles (MGPs) süspansiyonu, Proteinaz K, Elution Buffer, Wash Buffer 1 ve Wash Buffer 2 solüsyonları programda gösterildiği gibi uygun kartuşlarına yüklenerek cihazdaki uygun yerlerine yerleştirilmiştir.
4. Örnekler ve kullanılan diğer kimyasallar yerleştirildikten sonra sistemin kullanacağı steril pipet uçları programda belirtilen yerlerine yerleştirilmiştir.
5. Uygun program çalıştırıldıktan sonra tüm işlemler cihaz tarafından otomatik olarak gerçekleştirilmiştir.
26
6. Elde edilen 100 μl DNA’lar DNA saklama kutularına konularak -20° C’de saklanmıştır.
İzolasyon sonrası her örnekten 100 mikrolitre, ortalama konsantrasyonları 30 ng/μl, saflıkları (A260/280 değeri) ortalama 1.8’in üzerinde olan DNA’lar elde edilmiştir.
3.2.3.2. Moleküler Analiz
AZF mikrodelesyonu moleküler analizinde kullanılan ChromoQuant AZF PCR (Solna, İsveç) kitin bileşenleri Tablo 6’da, kitte kullanılan kimyasallar ve miktarları da Tablo 7’de verilmiştir.
Tablo 6. ChromoQuant AZF PCR kitinin bileşenleri
Bileşen Tüp Sayısı Kapak Rengi
Reaksiyon karışımı:Primer AZFabc 1 MAVİ
Reaksiyon karışımı: Ekstansiyon AZFa 1 SARI
Reaksiyon karışımı: Ekstansiyon AZFb 1 YEŞİL
Aktivatör Karışımı 1 RENKSİZ
Tablo 7. ChromoQuant AZF PCR kitinde kullanılan kimyasallar ve miktarları Ürün Taq polimeraz içeren karışım
hacim (µL) DNA(aq) (µL) Final Hacim (µL) AZF primer karışımı 6 (4,8 Reaksiyon karışımı + 1,2 Aktivatör karışımı) 4 10
AZF a karışımı 6 (4,8 Reaksiyon karışımı + 1,2 Aktivatör karışımı)
4 10
AZF b karışımı 6 (4,8 Reaksiyon karışımı + 1,2 Aktivatör karışımı
27
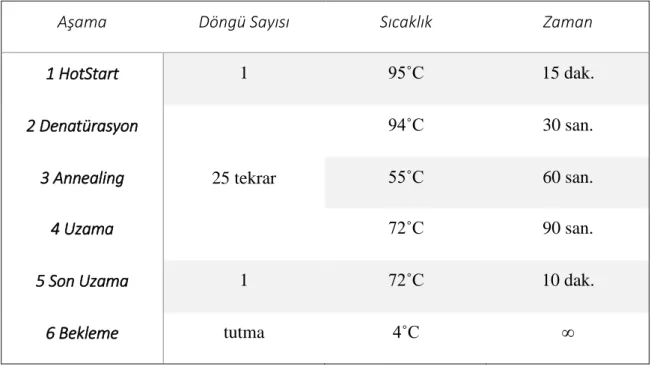
ChromoQuant AZF PCR (Solna, İsveç) kitinin önerdiği şekilde polimeraz zincir reaksiyonu (PCR) işlemi uygulanmıştır:
Kullanılacak tüpler buz kalıbı üzerine yerleştirilmiştir.
4 µL dilüe edilmiş (3,0-5,0 ng/µL) DNA eklenip pipetaj ile son hacmi 10 µL olacak şekilde karıştırılmıştır.
Mikro santrifüj yapılarak ürünlerin tüpün dibinde toplanması sağlanmıştır. PCR cihazında Tablo 8’de belirtilen protokol uygulanmıştır.
Tablo 8. ChromoQuant AZF PCR kiti için uygulanan PCR protokolünün aşamaları
Aşama Döngü Sayısı Sıcaklık Zaman
1 HotStart 1 95˚C 15 dak. 2 Denatürasyon 25 tekrar 94˚C 30 san. 3 Annealing 55˚C 60 san. 4 Uzama 72˚C 90 san.
5 Son Uzama 1 72˚C 10 dak.
6 Bekleme tutma 4˚C ∞
PCR basamağı sonrasında amplifiye edilen DNA bölgeleri ABI Prism 3100 genetik analizör (Foster City, ABD) cihazında Tablo 9’daki protokol kullanılarak kapiller elektroforez işlemi yapılmıştır.
28
Tablo 9. Kapiller elektroforez protokolü
Enjeksiyon voltajı 1.2 KV Enjeksiyon zamanı 15-23 san.
Run voltajı 15kV
Filtre seti 4 boya filtresi
Run zamanı 60 dak.
Polimer POP4
Spektral kalibrasyon için matriks
DS-30 (ABI) ile ROX500
Yükleme miksi 12 ml HiDi formaldehit + 0.3 ml ROX500 + 0.5 - 1.0 ml PCR ürünü
PCR işleminde, Y kromozomu üzerinde amplifiye edilen bölgeler, boyut ve lokasyonları Tablo 10’da verilmiştir. Ayrıca Şekil 2’de Y kromozomunun şematik gösterimi ve mevcut mikrodelesyon modeli yer almaktadır.
29
Tablo 10. Y kromozomu üzerinde amplifiye edilen bölgeler, boyut ve lokasyonları
Markır
Kodu Kimlik Bölge
Boyut (baz çifti) Genomik lokus Klasik/Komplet Delesyondaki Durum Renk A1 sY86 AZFa 318 13117503-13117820 Yok Mavi A2 sY84 AZFa 326 13299428-13299753 Yok Mavi B1 sY127 AZFb 274 22570359– 22570742 Yok Mavi B2 sY134 AZFb 301 23555947– 23556406 Yok Mavi C1 sY255 AZFc 123 26999443– 26999566b Yok Mavi C2 sY254 AZFc 380 25316193– 25316572b Yok Mavi HC sY160 heterokromatin AZFc 236 58911807– 58912042b Mavi
Y SRY Kontrol 472 Yp 11.3 Var, erkek
spesifik Mavi
XY ZFX/Y Kontrol 495 Yp11.31
Xp 21.3
Var, PCR
30
Şekil 2. Y kromozomunun şematik gösterimi ve mevcut mikrodelesyon modeli (89)
Y kromozomu delesyon analizi kitin içeriğine göre analiz edilmiş olup yorumlama EAA/EMQN kılavuzuna göre yapılmışır (89).
3.2.4. Mikro-TESE İşlemi
Ege Üniversitesi Tıp Fakültesi Üroloji AD.’da mikro-TESE işlemi anestezi altında ve steril ameliyathane koşullarında uygulanmıştır. Skrotum orta hattında 3-4 cm uzunluğunda insizyon açılarak tunica vajinalis ile pariyetal ve viseral yapraklar açılmıştır. Tunica albuginea üzerinde avasküler alan seçilerek ekvatoral inzisyon yapılmıştır. Yüksek çözünürlüklü mikroskop altında 25 kez büyütülerek daha dilate ve beyaz görünümdeki seminilüfer tübüllerden mikropenset yardımıyla görülebilen örnekler alınmıştır. Bu örnekler HEPES besiyerindeki petri kaplarına konulmuştur. Tunika albuginea ile, tunika vaginalis yaprakları suture edilmiştir. Alınan örnekler Ege Üniversitesi Aile Planlaması ve Kısırlık (İnfertilite) Uygulama ve Araştırma Merkezi’nde embriyologlar tarafından inceleme için HTF (Human Tubal Fluid) besiyerine alınıp insülin enjektörleri ile mekanik diseksiyonu takiben, düz petrilere yayma işlemi yapıldıktan sonra mikromanipülatörlerde 10’luk oküler büyütmede değerlendirilmiştir. Spermatozoa saptanan olguların örnekleri kriyoprezervasyon ile dondurulmuştur.
31 3.2.5. İstatiksel Analiz
İstatistiksel analiz SPSS version 18,0 (Statistical Package for Social Science, Chicago, ABD) yazılımı ile yapıldı. Sonuçlar ortalama, standart sapma (SD) ve ortanca olarak gösterildi. Sürekli değişkenler için ikili grup karşılaştırmalarında bağımsız gruplarda Mann-Whitney testine başvuruldu. Kesikli değişkenlerin karşılaştırılmasında ki-kare testi uygulandı. İki sürekli değişkenin karşılaştırılmasında korelasyon analizi yapılarak aralarındaki ilişki incelendi. İki yönlü p değerinin <0,05 olması ve Pearson ki kare değerinin 0.002 olması anlamlı kabul edildi.
32 4. BULGULAR
Çalışmamıza Ocak 2009- Mart 2019 tarihleri arasında Ege Üniversitesi Tıp Fakültesi Hastanesi Tıbbi Genetik AD.’na azospermi tanısı ile başvurmuş olgular dahil edilmiştir. Bu tarihler arasında infertilite nedeniyle başvuran 2431 kişiden, azospermi tanısı bulunan 106 olguda AZF geninde mikrodelesyon saptanmıştır. Bu 106 olgunun 42 tanesinin detaylı bilgilerini içeren dosyalarına ulaşılabildiğinden çalışmamıza 42 olgu dahil edilmiştir.
Yapılan AZF mikrodelesyon analizleri sonucunda; 3 olguda AZFa (%7), 2 olguda AZFb (%5), 31 olguda AZFc (%74), 4 olguda AZFb+AZFc (%9) ve 2 olguda AZFa+AZFb+AZFc (%5) mikrodelesyonu saptanmıştır. Bu bulgular Şekil 3’te grafik halinde verilmiştir.
Şekil 3. Olguların AZF mikrodelesyon tipine göre dağılımı
Yaşları 25 ile 55 arasında değişen olguların, ortalama yaşı 35,077.05 olarak saptanmıştır. Tablo 11’de yaş standart dağılımı verileri, Şekil 4’te yaş standart dağılımı grafiği gösterilmektedir. AZFa 7% AZFb 5% AZFc 74% AZFb+AZFc 9% AZFa+AZFb+AZFc 5%