T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
HEMOFİLİ A VE B HASTALARININ KIZ KARDEŞLERİNDE
KANAMA SEMPTOMLARI VE KANAMAYA YÖNELİK
LABORATUVAR PARAMETRELERİNİN
DEĞERLENDİRİLMESİ
Dr. Nadiye AKDENİZ UZMANLIK TEZİ
TEZ DANIŞMANI
Prof. Dr. Mehmet Orhan AYYILDIZ
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
HEMOFİLİ A VE B HASTALARININ KIZ KARDEŞLERİNDE
KANAMA SEMPTOMLARI VE KANAMAYA YÖNELİK
LABORATUVAR PARAMETRELERİNİN
DEĞERLENDİRİLMESİ
Dr. Nadiye AKDENİZ UZMANLIK TEZİ
TEZ DANIŞMANI
Prof. Dr. Mehmet Orhan AYYILDIZ
ÖNSÖZ
Bilimsel düşünme ve çalışmayı bizlere öğreten, engin bilgi ve birikimlerini bizimle paylaşan, bugünlere gelmemizde büyük emeği olan, hekimliği bizlere öğreten değerli hocamız Prof.Dr. Ekrem MÜFTÜOĞLU ’na başta olmak üzere, İç Hastalıkları A.B.D. Başkanımız Prof. Dr. M. Emin YILMAZ ’a yetişmemde büyük emekleri olan bütün değerli öğretim üyeleri; Prof. Dr. M. Orhan AYYILDIZ, Prof. Dr. Vedat GÖRAL, Prof. Dr. Abdurrahman IŞIKDOĞAN, Prof. Dr. Kendal YALÇIN, Prof. Dr. Alpaslan TUZCU, Prof. Dr. Muhsin KAYA, Prof. Dr. Ali Kemal KADİROĞLU, Doç. Dr. Ebubekir ŞENATEŞ, Doç. Dr. M.Ali KAPLAN, Doç. Dr. Mehmet KÜÇÜKÖNER, Doç. Dr. Zülfikar YILMAZ, Yrd. Doç. Dr. Ali İnal, Yrd.Doç. Dr. Yaşar YILDIRIM, Yrd. Doç. Dr. Feyzullah UÇMAK, Yrd. Doç. Dr.Sinan DAL, Yrd. Doç. Dr. Faruk KILINÇ, Yrd Doç. Dr.Zuhat URAKÇI, Uz. Dr.Nazım EKİN, Uz.Dr.Mazhar Müslüm TUNA, Uz.Dr.Zafer PEKKOLAY, Uz.Dr. Abdullah KARAKUŞ, Uzm.Dr. Ali Veysel KARA, Uzm.Dr. Elif Tuğba TUNCEL’e teşekkürlerimi sunuyorum.
Tezimin her aşamasında yardımlarını esirgemeyen sayın Prof. Dr. Orhan Ayyıldız, Hematoloji Laboratuvarı çalışanları ve Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.B.D. , Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D , Göğüs Hastalıkları ve Tüberküloz A.B.D., Radyoloji A.B.D. başkanlarına ve değerli öğretim üyelerine, birlikte çalışmaktan her zaman büyük mutluluk ve onur duyduğum tüm asistan arkadaşlarıma ve İç Hastalıkları A.B.D. çalışanlarına teşekkür ederim.
Asistanlık süresi boyunca desteklerini esirgemeyen sevgili aileme ve sevgili dostlarıma teşekkürlerimi sunuyorum.
İÇİNDEKİLER
Sayfa No ÖNSÖZ...i SİMGELER ve KISALTMALAR... ıv TABLOLAR ve ŞEKİLLER... vı ÖZET...vıı İNGİLİZCE ÖZET (ABSTRACT)...x1.GİRİŞ ve AMAÇ...1 2.GENEL BİLGİLER...3 2.1.Hemostaz...3 2.1.1.Primer Hemostaz...5 2.1.1.1.Vasküler Endotel...6 2.1.1.2.Trombositler...7 2.1.2.Sekonder Hemostaz...8 2.1.2.1.Koagülasyon Sistemi...11
2.1.2.2.Pıhtılaşma Sistemi Aktivasyonu...16
2.1.2.3.Koagülasyon Kaskadı(Klasik anlayış)...16
2.1.2.4.Pıhtı İnhibisyonu ve Erimesi...22
2.2.Pıhtılaşma Fonksiyon Testleri...24
2.2.1.Trombositler...25
2.2.2.Kanama Zamanı...27
2.2.3.Protrombin Zamanı...27
2.2.4.Aktive Parsiyel Tromboplastin Zamanı...28
2.2.5.Trombin Zamanı...28
2.2.6.International Normalized Ratio(INR)...28
2.3.Hemofililer...32
2.3.1.Tanım ve Genel Özellikler...32
2.3.2.Genetik...32
2.3.3.Tanı...34
2.3.4.Laboratuvar...34
2.3.5.Klinik Bulgular...35
2.3.6.1.Koagülasyon Faktörü Konsantreleriyle
Yerine Koyma Tedavisi...36
2.3.6.2.Faktör Konsantreleri Dışındaki Tedavi Seçenekleri...39
2.3.7.Komplikasyonlar...42
2.3.7.1.Deformiteler/Sekeller...42
2.3.7.2.Psikososyal Sorunlar...42
2.3.7.3.Enfeksiyonlar...42
2.3.7.4.İnhibitör Gelişimi ve Tedavisi ...44
2.3.8.Profilaksi...49
2.3.9.Hasta İzlemi ve Değerlendirilmesi...50
2.4.Hemofili Taşıyıcılığı...50
2.4.1.Giriş...50
2..4.2.Genetik Danışmanlık ve Taşıyıcıların Belirlenmesi...50
3.MATERYAL METOD...53
4.BULGULAR...56
5.TARTIŞMA ...64
6.SONUÇ...70
SİMGELER VE KISALTMALAR
ADP : Adenozin difosfat APC: Aktive protein C
aPCC: Aktifleşmiş protrombin kompleks konsantresi aPTT: Aktive parsiyel tromboplastin zamanı
AT-III: Antitrombin III ATP: Adenozin trifosfat BU: Bethesda ünitesi Ca++: Kalsiyum
CJD: Creutz Feld -Jakob hastalığı CRM: Çapraz reaksiyon gösteren ürün DDAVP: 1-deamino-8-d arjinin vazopressin DIC: Yaygın damar içi pıhtılaşma DNA: Deoksiribo nükleik asit EDTA: Etilen diamin tetraasetik asit HBV: Hepatit B virüsü
HCV: Hepatit C virüsü
HIV: İnsan immün yetmezlik virüsü HMWK: Yüksek molekül ağırlıklı kininojen GPIa/IIa: Glikoprotein Ia/IIa
GPVI: Glikoprotein VI GPIb/IX: Glikoprotein Ib/IX GPIIb/IIIa: Glikoprotein IIb/IIIa
INR: Uluslararası normalize edilmiş oran ISI: Uluslararası duyarlılık indeksi IL-1: İnterlökin -1
KZ: Kanama zamanı MSS: Merkezi sinir sistemi NO: Nitrik oksit
PAF: Platelet aktivatör faktör
PA-I 1 : Plazminojen aktivatör inhibitörü 1 PC : Protein C
PGE2: Prostoglandin E2 PGI2: Prostoglandin I2 PS: Protein S
PFA: Platelet function analyzer PK: Prekallikrein
PRP: Plateletten zengin plazma PT: Protrombin zamanı
PTT: Parsiyel tromboplastin zamanı rFVIIa: Rekombinant aktive faktör VII
TAFI: Trombin tarafından aktive edilen fibrinolizis inhibitörü TDP: Taze donmuş plazma
TF: Doku faktörü
TFPI: Doku faktör yolağı inhibitörü t-PA: Doku plazminojen aktivatörü TZ: Trombin zamanı
TXA2: Tromboksan A2
VWD: Von Willebrand Hastalığı VWF: Von Willebrand faktör WHO: Dünya Sağlık Örgütü dk: dakika
g/dl: gram/desilitre
IU/dL: uluslararası ünite/desilitre IU/ml: uluslararası ünite/mililitre mm3: milimetre küp
µg: Mikrogram kb: kilobayt
TABLOLAR VE ŞEKİLLER
Tablolar
Tablo 1. Kan koagülasyon proteinlerinin adlandırılması ve özellikleri Tablo 2. Pıhtılaşma işlevi
Tablo 3. Kanamayı değerlendirmeye yönelik rutin pıhtılaşma testleri
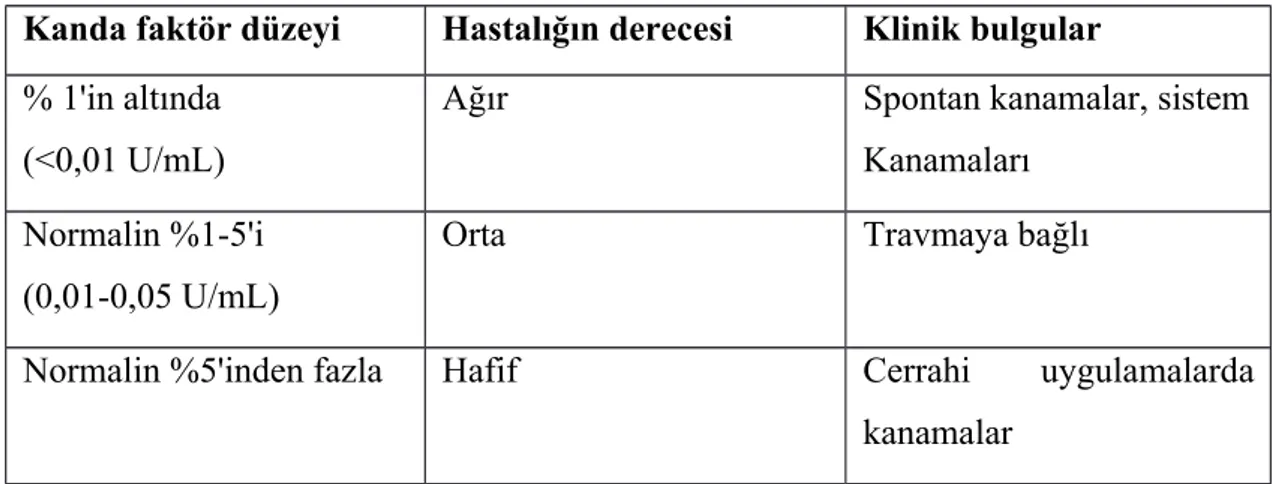
Tablo 4. Bazı özel durumların PT, aPTT, KZ ve trombositlerle olan ilişkileri Tablo 5. Hemofilili hastaların plazma faktör düzeylerine göre sınıflandırılması Tablo 6. Ürün dozu
Tablo 7. Remisyonda olan edinsel hemofili A olgusunda immunosupresif tedavi kesilmesi sonrası izlem
Tablo 8. Çalışmada kullanılan parametreler ve normal değerleri Tablo 9. Gruplar arası yaş ve medeni durum dağılımı
Tablo 10. Kız kardeşlerde ailedeki hemofili alt grubu ve hemofili şiddetinin dağılımı Tablo 11. Grupların laboratuvar değerleri
Tablo12. Gruplarda kanamaya ilişkin semptomların dağılımı
Şekiller
Şekil 1. Vasküler faz ve primer hemostaz Şekil 2. Hemostaz
Şekil 3. Pıhtılaşma mekanizmasını başlatan intrensek yol Şekil 4. Pıhtılaşma mekanizmasını başlatan ektrensek yol Şekil 5. Yeni anlayışa göre koagülasyon kaskadı
Şekil 6. Fibrinolitik yolların aktivasyonu ve inhibisyonu Şekil 7. Hemofilide herediter geçiş
Şekil 8. Kız kardeşlerde faktör düzeylerine göre gruplama Şekil 9. Gruplarda kanama semptom yüzdeleri
ÖZET
Hemofili A ve B Hastalarının Kız Kardeşlerinde Kanama Semptomları ve Kanamaya Yönelik Laboratuvar Parametrelerinin Değerlendirilmesi
Giriş ve amaç: Hemofili A (faktör 8 eksikliği ) ve B (faktör 9 eksikliği) genetik olarak X'e bağlı resesif geçiş gösterir ve erkekleri etkiler. Ancak bu kişilerin anneleri ve kızları genetik bozukluğun taşıyıcılarıdır. Hemofililer erkeklerde kanama eğilimi açısından çok iyi bilinmesine rağmen bayan taşıyıcılarda nadiren farkına varılmaktadır. Oysaki bayan taşıyıcılar karşımıza sadece artmış kanama eğilimi ile değil bazen sık ve aşırı kanama ile de gelebilmektedir. Çalışmadaki amacımız hemofilili hastaların kız kardeşlerindeki faktör düzeylerini ve kanama riskini belirleyip, müdahaleler öncesi profilaktik uygulamalar ve uzamış kanamalar açısından ailelerin ve hekimlerin dikkatini bu yöne çekmektir.
Materyal ve metod: Hemofili hastalarının kız kardeşlerinde laboratuvar ve klinik kanama eğilimlerini belirlemek için çalışma dizaynı yapıldı. Çalışmaya ailesinde en az bir hemofili A veya B hastası olan, menarş gören 46 kız kardeş dahil edildi. Sağlıklı, hemofili A veya B taşıyıcısı olmadığı bilinen 43 kadın kontrol grubu olarak seçildi. Bu amaçla kız kardeşlerde laboratuvar olarak aPTT, tam kan, VWF, kanama zamanı ve erkek kardeşi hemofili A hastası olanlarda faktör 8, hemofili B hastası olanlarda faktör 9 düzeyleri çalışıldı. Kontrol grubu ile karşılaştırıldı. Kız kardeşlerin kişisel karakteristikleri, etkilenmiş olan aile bireylerinde hemofilinin karakteristikleri, zorunlu taşıyıcılarda hemofilili çocuk sayısı, spontan ve uyarılmış kanamalarda uzamış kanama eğilimlerine ilişkin detaylı öyküleri anket formu düzenlenerek sorgulandı. Aynı sorgulama kontrol grubunda da yapıldı.
Bulgular: Kız kardeşlerin ailelerinde hemofili A olanların sayısı 39 (%84,8), hemofili B olanların sayısı 7 (%15,2) idi. Ailede hafif hemofilili hasta olan kız kardeş sayısı 6 (%13), orta hemofilili olan 4 (%8,7), ağır hemofilili olan 36 (%78,3) kişiydi. Hemofilili hastaların kız kardeşlerinin laboratuvar bulguları kontrol grubu ile karşılaştırıldığında ortalama faktör düzeyleri anlamlı olarak kız kardeşlerde düşük bulundu (sırasıyla 60,13±37,91%, 80,04±23,35 % , p: 0,004). Faktör 8 ve 9 ayrı ayrı değerlendirildiğinde kız kardeşlerde faktör 8 düzeyi kontrol grubuna göre anlamlı
9 düzeyleri arasında anlamlı farklılık saptanmadı (sırasıyla 90,36±50,41%, 110,71±15,02%, p:0,361). Kız kardeşlerin aPTT değerleri kontrol grubu ile karşılaştırıldığında kız kardeşlerde aPTT 'nin anlamlı olarak uzadığı görüldü (sırasıyla 30,5±4,08 sn, 27,2±3,13 sn, p: 0,000).
Spontan burun kanaması ve ayrıca spontan deri morarmaları sorgulandığında kız kardeşlerden 13 'ünde (%28,3) tanımlanmış olup kontrol grubunda 7 'sinde (%16,3) spontan burun kanaması ve 8 'inde (18,6) spontan deri morarmaları tarif edilmiştir. Kız kardeşlerden 7 'sinde (%15,2) küçük yaralanmalar sonrası kanama 10 dakikadan uzun sürmüşken kontrol grubunda küçük yaralanmalar sonrası kanama 10 dakikadan kısa sürmüştür. Kız kardeşlerden diş çekimi yapılan 27 kişiden 12'sinde (%44,4), kontrol grubunda 31 kişiden 2 'sinde (%6,5) diş çekimi sonrası uzamış kanama nedeni ile ilave tedavi gerekmiştir. Kız kardeşlerden cerrahi yapılan 17 kişiden 6 'sının (%35,1) kontrol grubundan 22 kişiden 2 'sinin (%9,1) cerrahi sonrası uzamış kanama nedeni ile tedavi gereksinimi olmuştur. Doğum yapan 12 kız kardeşten 3 'ünün (%25) doğum sonrası kanaması 6 haftadan uzun sürmüştür. Kız kardeşlerden 15 'inde (%32,6) mensturasyon kanaması 7 günden uzun sürmekteyken kontrol grubunda bir kişi 7 günden uzun süren mensturasyon kanaması tarif etmiştir. Kırk altı kız kardeşten 21 'inin (%45,7) faktör düzeyi %5-40 arasında, 7 'sinin ( %15,2) faktör düzeyi %41-60 arasında ve 18 'inin (%39,1) faktör düzeyi %61 ve üzerinde bulundu. Pıhtılaşma faktör düşüklüğü ile spontan burun kanaması, ağız içi ve diş eti kanamaları arasında ilişki saptandı (p<0,05).
Hemofili hastalarının kız kardeşleri, pıhtılaşma faktör düzeylerinden bağımsız olarak sağlıklı gruba göre daha fazla küçük yaralanmalar sonrası uzamış kanama, artmış yaralanma sıklığı, diş çekimi sonrası uzamış kanama nedeni ile ilave tedavi gereksinimi, uzamış menstural periyod kanaması ve doğum sonrası uzamış kanama tarif etmektedirler (p<0,05). Spontan burun kanaması (p:0,176), spontan deri morarmaları (p:0,284), operasyon sonrası uzamış kanamalarda (p:0,260) iki grup arasında anlamlı farklılık görülmedi.
Ailedeki hemofili şiddeti ile faktör düzeyleri arasında istatiksel olarak anlamlı farklılık bulunmadı (p:0,398,). Ailedeki hemofili şiddeti ile spontan burun kanaması dışında kanamaya yatkınlık saptanmamıştır.
Sonuç olarak; Hemofili hastalarının kız kardeşlerinde faktör düzeyleri daha düşük ve kontrol grubuna göre daha fazla küçük yaralanmalar sonrası uzamış kanama, artmış yaralanma sıklığı, diş çekimi sonrası uzamış kanama nedeni ile ilave tedavi gereksinimi, uzamış menstural periyod kanaması ve doğum sonrası uzamış kanamaları olmaktadır. Bu nedenle zorunlu ve olası taşıyıcılarda faktör düzeylerinin belirlenmesi medikal işlemler ve uzamış kanamalar açısından önemlidir.
Anahtar sözcükler; Hemofili, hemofili hastalarının kız kardeşleri, pıhtılaşma faktörleri, kanama eğilimi, ailedeki hemofili şiddeti
ABSTRACT
Evaluation of bleeding symptoms and laboratory parameters in sisters of patients with hemophilia A and B
Intraduction and purpose: Hemophilia is an X chromosome linked hereditary bleeding disorder, inherited recessively, caused by deficiency of factor 8 or factor 9 and mostly men are affected. However, mothers and sisters of affected men are heterozygous carriers of hemophilia. Hemophilia is a well known bleeding disorder in men, but it is seldom recognized in female carriers of hemophilia. Whereas female carriers might not only have an increased tendency of bleeding , but bleeding symptoms may be frequent and severe. The aim of this study is evaluation of clotting factor levels and determination tendency of bleeding in sisters and engage attention of phsysicians and families to prevent prolonged bleeding especially before medical interventions and implementation of prophylactic therapy.
Materials and Methods: This study is designed to determine labrotory and clinical tendency of bleeding in sisters. Forty six female who have menstural cycles and have at least one hemophilia A or B patients in their family were included in the study. Forty three female who were healthy and have no hemophilia A and B patients in their family were choosen for control group. For these purpose laboratory parameters aPTT, complete blood count , vwf, bleeding time and factor 8 were studied in sisters of patients with hemophilia A patients , factor 9 for sisters of patients with hemophilia B were analyzed and compared with control group. Demographic features of sisters of patients with hemophilia, characteristics and severity of the disease in the affected family and number of children obligatory carriers have , spontaneous and induced prolonged bleeding tendency interrogated by a detailed questionnaire. This interrogation was also applyed to control group. Results: Forty six sisters of patients with hemophilia were included the study. Thirty nine (%84,8) of them were sisters of patients with hemophilia A and 7 (%15,2) of them were sisters of patients with hemophilia B. Six (%13) of them have a mild hemophilia, 4 (%8,7) of them have moderate hemophilia and 36 (%78,3) of them have severe hemophilia in their family. Laboratory results of sisters of a
hemophilia patient were compared with the control group. The mean clotting factor levels were significantly decreased in sisters of patients with hemophilia ( 60,13±37,91%, 80,04±23,35 % respectively , p:0,004). Factor 8 levels were significantly decreased ( 53,77±32,07 %,75 and ,06±20,55 % respectively , p:0,001) in sisters of patients with hemophilia compared with control group. There was no significant difference between two group of factor 9 levels (respectively 90,36±50,41%, 110,71±15,02%, p:0,361). aPTT was found significantly prolonged in sisters of patients with hemophilia compared with control group. (respectively 30,5±4,08 sn, 27,2±3,13 sn, p: 0,000).
Spontaneous nose bleedings were defined in 13 (%28,3) sisters of patients with hemophilia and in 7 (%16,3) of controle group. Spontaneous cutaneous bruising was defined in 13 (%28,3) of sisters of patients with hemophilia and 8 (%18,6) of controle group. Prolonged bleeding longer than 10 minutes after minor traumas was stated by 7 (% 15,2) of sisters of patients with hemophilia versus none of controle group . Requirement of additional medical treatment for prolonged bleeding after tooth extraction was noted in 12 (% 44,4) of sisters of patients with hemophilia who have experienced tooth extraction compared with 2 (%6,5) of 31 who have experienced tooth extraction of controle group. Requirement of additional medical treatment for prolonged bleeding after surgery was encountered in 6 (%35,1) of 17 sisters of patients with hemophilia who have experienced surgery compared with 2 (%9,1) of 22 who have experienced surgery of controle group. Postpartum bleeding longer than 6 weeks was stated by 3 (% 25) of 12 who gave birth of sisters of patients with hemophilia. Menorrhagia longer than 7 days was reported by 15 (%32,6) of sisters of a hemophilia patient whereas one of controle group.
Clotting factor levels was measured between % 5-40 in 21 (% 45,7) , % 41-60 of 7 and above % 61 in 18 of 46 sisters of patients with hemophilia. There was significant correlation between clotting factor levels and spontaneous nose bleeding, oral mucosal bleeding and gum bleeding (p<0.05) .
Sisters of patients with hemophilia experienced more bleeding after minor traumas, requirement of additional medical treatment for prolonged bleeding after tooth extraction, menorrhagia and prolonged postpartum bleeding with respect to
bleeding (p:0,176), cutaneous bruising ( p:0,284) and prolonged bleeding after surgery (p:0,260 ) was found no significance between two groups.
Association between severity of hemophilia in the family and clotting factor levels was found no significance (p:0,398). There were no relationship between severity of hemophilia in the family and bleeding tendency except spontaneous nose bleeding.
In the conclusion ; clotting factor levels were decreased in the sisters of patients with hemophilia and they experience more frequently prolonged bleeding after minor traumas and requirement of additional medical treatment for prolonged bleeding after tooth extraction menorragia and prolonged postpartum bleeding .Therefore measurement of clotting factor levels and implementation of medical interventions is considarable to prevent prolonged bleeding for obligate and possible carriers of hemophilia .
Key words; Hemophilia, sisters of patients with hemophilia, clotting factor, bleeding tendency, severity of hemophilia in the family
1. GİRİŞ VE AMAÇ
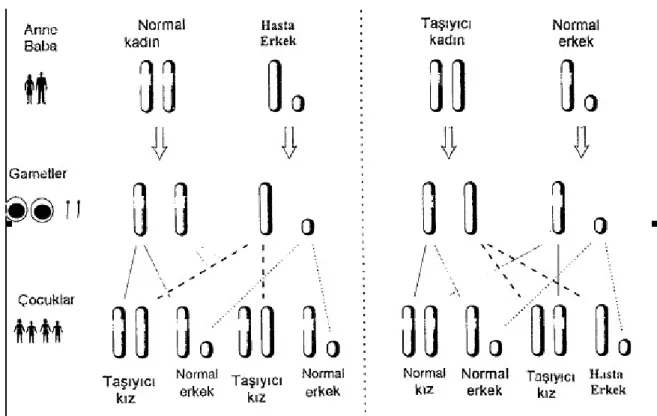
Hemofili, X 'e bağlı genetik geçiş gösteren faktör 8 ( hemofili A ) ve faktör 9 (hemofili B) eksikliğine yol açan kalıtımsal kanama bozukluğudur. X 'e bağlı resesif kalıtım paterni gösterdiğinden çoğunlukla erkekleri etkiler, kadınlar heterozigot mutasyona sahip olduğundan taşıyıcı olurlar. Bayan taşıyıcılarda aşırı lyonizasyon düşük faktör düzeylerine yol açmaktadır (1). Bayan taşıyıcılarda faktör 8 ve 9 plazma düzeyleri sağlıklı bireylerin %50 'si düzeylerindedir (2).
ABO kan grubu, stres, gebelik de faktör 8 seviyesini ve karaciğer fonksiyonları faktör 9 seviyesini etkileyen diğer faktörlerdir (3,4). Bazı taşıyıcılarda faktör 8 veya 9 düzeyi düşük olabilir ve bunlarda kanamaya yatkınlık beklenebilir. Pıhtılaşma faktör seviyesi normalin %50 'sinin altında olan taşıyıcılarda artmış kanamaya yatkınlık olabilir. Semptomların meydana gelişi plazma faktör 8 veya 9 düzeyi ile yakından ilişkilidir, düşük faktör seviyesi kanama olasılığını arttırmaktadır. Çoğu vakada klinik semptomlar hafif hemofili ile örtüşmektedir (5,6).
Bir aile içerisinde hemofilili bir hasta tanımlandığında ailedeki kadınların çoğu taşıyıcı olma riski taşımaktadır. Annede taşıyıcılık durumunun belirlenmesi gebelik ve prenatal değerlendirme öncesi önemlidir (7). Genetik danışmanlığın amacı potansiyel taşıyıcıya, ebeveyn ve partnerine taşıyıcılık testi ve prenatal tanı konusunda karara varmak için doğru bilgi sağlamak ve süreç boyunca destek sağlamaktır (8).
Bu çalışma ile hemofilili bireylerin kız kardeşlerini taşıyıcı olmayan kadınlar ile kanama eğilimleri açısından semptom ve laboratuvar parametreleri ile karşılaştırdık. Hemofilili hastaların kız kardeşlerindeki faktör düzeyleri ve kanamaya ilişkin semptomları irdeledik. Çalışmadaki amacımız zorunlu ve olası taşıyıcılarda kanama riskini belirleyip, müdahaleler öncesi profilaktik uygulamalar açısından ailelerin ve hekimlerin dikkatini bu yöne çekmek, taşıyıcı anne ve anne adaylarında hemofilili erkek çocuk doğurma açısından riskin farkındalığını oluşturmaktır. Böylece hemofili açısından zorunlu ve olası taşıyıcılığı olan bayanlarda faktör düzeylerinin belirlenmesinin medikal işlemler ve uzamış kanamalar açısından
önemini vurgulayıp doğacak çocuklar için de genetik prenatal danışmanlık desteğinin sağlanması için farkındalık oluşturulmuş olacaktır.
2. GENEL BİLGİLER
Kan, organizmada gerçekte kapalı bir kanallar sistemi içinde dolaşan bir dokudur. Dolaşım kanı, plazma adı verilen sıvı bir ortam içinde süspansiyon halinde bulunan şekilli elemanlardan oluşmaktadır. Metabolizma, gaz transportu, hormonlar yoluyla hücresel iletişim ve immün savunma dahil pek çok fizyolojik olayda kilit rol oynar. Ortalama bir kişinin kilogram başına yaklaşık 70 ml (70ml/kg) kanı vardır (9,10).
Kan hacminin neredeyse %50-60 ’ı sıvı, geri kalanı ise hücrelerden oluşmaktadır. Plazma adı verilen sıvı bileşenin yaklaşık %90 ’ı su; geri kalan %10 ’luk kısmı ise glukoz, aminoasitler ve diğer metabolitler, iyonlar, çeşitli protein ve hormonlar tarafından oluşturulur. Serum; plazmanın, koagülasyon faktörleri ve fibrinojenin uzaklaştırılmasından sonra geriye kalan kısmıdır (10,11).
Kan, görev aldığı fizyolojik olayları yerine getirebilmek için damar sisteminde non koagüle kalıp akışkan olmalıdır. Buna katkıda bulunan etkenler; damar sisteminin kasılabilir olması, göğüs boşluğundaki negatif basınç (emici güç), kalbin pompalama gücü ve venöz damarlarda kanın geri dönmesini engelleyen kapakçıklar olarak sayılabilir. Kan damar duvarında bulunan elastin; damarın esnekliğini, bedenin hareketleri ve kalbin pompalama kuvvetiyle uyumu sağlar, düz kaslar uyarıya göre kasılırlar (vazokonstriksiyon). Damarın iç yüzeyinde, endotel hücrelerinin oluşturduğu kaygan yüzey de kanın sıvı halde akmasında önemli bir etkendir (10,12,13).
2.1.HEMOSTAZ
Hemostaz, kanın dolaşımda sıvı halde kalmasını sağlayıp sağlıklı bir şekilde akmasına neden olan mekanizmadır. Bu mekanizma kan damarlarında herhangi bir travma sonucu oluşan kanamayı durdurması ve daha sonra aynı damarın fonksiyonunu devam ettirmesi için damarın pıhtıdan temizlenmesi durumlarını da içerir (12,14). Koagülasyon hemostazın bir fazıdır. Yaralanmayı takiben vasküler
endotel, dolaşan trombositler ve koagülasyon faktörleri arasındaki etkileşimler ile koagülasyon sağlanır.
Damarın zedelenmesi sonucu oluşabilecek kan kaybını önleyen hemostaz sisteminin iki önemli özelliği vardır. İlki; yüzey bağımlılığı yani hasarlanmış bölgede açığa çıkan fosfolipidler aracılığı ile hemostazın başlaması, olayın belli bir bölgede sınırlı kalmasını sağlar. Trombosit yüzeyindeki fosfolipidler koagülasyon için primer pıhtılaşma alanı oluşturur. İkinci özelliği ise çok sayıda negatif geri besleme yolları (feedback loop) bulunmasıdır. Hemostazda görev alan her sistem, karşıt işlev gören bir inhibitör sistemle dengelenmiştir. Hatta çoğu kez bir sistem uyarıldığında karşıt sistemini kendi devreye sokar; bu sayede her sistem, karşıt sistemi ile eş zamanlı faaliyete geçmiş olur. Dolayısıyla kanın pıhtılaşması (hemostaz) ve pıhtının erimesi (fibrinoliz) süreçleri birbiri ile yakından ilişkilidir ve etkileşim halindedir (10,11,12).
Damarlarda bir hasar oluştuğunda üç olay peşpeşe meydana gelir (12);
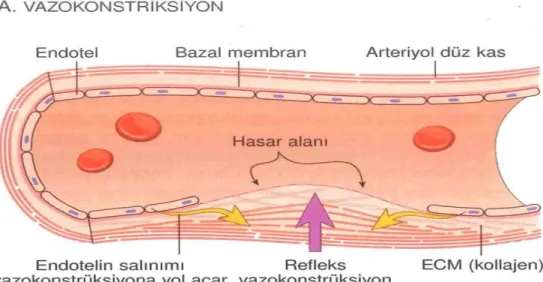
1- Damarda, başlangıç zararının ardından büyük ölçüde refleks nörojen mekanizmalara bağlı olan ve endotelin (güçlü vazokonstriktör) gibi faktörlerin lokal salınımı ile artan kısa süreli vazokonstriksiyon olur (vasküler faz).
2- Endotel zararı aynı zamanda, yüksek trombojenik etkiye sahip olan subendotelyal hücre dışı matriksi (ECM) de açığa çıkarır. Bu da trombositlerin yapışmasına, aktive olmasına yani şekil değişikliğine uğraması ve salgı granüllerinin serbestleşmesine olanak sağlar. Serbestleşen bu maddeler daha fazla trombositleri bir araya toplayarak (agregasyon) hemostatik tıkacı oluşturur (Trombosit fazı). Bu primer hemostaz işlemidir.(Şekil 1)
3- Zarar bölgesinden açığa çıkan doku faktörü, trombositlerden salınan faktörlerle birlikte etki ederek pıhtılaşma sistemini uyarır. Sonuçta fibrin birikimi olur. Pıhtılaşma zincirinde aktive olan trombin de daha fazla trombositin toplanmasına ve granüllerin serbestleşmesine yol açar (Plazma fazı). Sekonder hemostaz denilen bu dönem, başlangıçtaki trombosit tıkacının oluşmasından daha uzun sürer.
Kısaca damar hasarının olduğu bölgede trombositlerin tıkaç oluşturmasına primer hemostaz, bunu takiben koagülasyon sisteminin aktif hale gelerek fibrin pıhtısını oluşturmasına sekonder hemostaz adı verilir.
2.1.1.Primer hemostaz
Primer hemostaz sisteminin başlıca bileşenleri vasküler endotel ve trombositlerdir. Trombositler hasarlı bölgeye gelerek, yapışma (adezyon), granül içeriklerini ortama salgılama (sekresyon) ve kümeleşme (agregasyon) fonksiyonlarını yerine getirirler (15,16).
2.1.1.1.Vasküler endotel
Kan damarlarının duvarı, endotel hücrelerinin ince bir tabakasından oluşmuştur. Endotel hücreleri; kan damarlarının iç yüzeyinin uzun ekseni boyunca sıralanarak tek katlı bir tabaka oluşturan poligonal hücrelerdir. Bu yapı; öncellikle trombositler ile yüksek trombojenik özellik gösteren subendotelial bağ dokusu arasında bir bariyer görevi görür. Normal koşullarda sağlam endotel yüzeyi ve kanın sirkülasyonu, koagülasyon sisteminin ve trombositlerin kendiliğinden aktive olmalarını engeller. Fakat travma ve bazı damar hastalıklarında bu yüzeyin bozulmasıyla birlikte koagülasyon sistemi ve trombositleri aktive eden değişiklikler gözlenmektedir (14,18).
Sağlam endotel hücreleri, sentezlediği veya saldığı ya da yüzeylerinde belirlediği faktörler aracılığı ile hemostaz üzerine güçlü bir inhibitör etki gösterir. Bu faktörlerden prostaglandin I2 (prostasiklin) ve nitrik oksitin (NO) güçlü bir vazodilatatör etkisi vardır. Bu sayede kan akımı yavaşlatılır (19).
Endotel hücrelerinin yüzeyinde bulunan trombomodulin ve heparan sülfatın trombini inhibe edici etkileriyle, fibrin pıhtısının damar içi yayılması sınırlanır (20). Trombomodulin membran reseptörüdür ve trombinle etkileşerek kuvvetli bir pıhtılaşma inhibitörü olan protein C ’nin aktivasyonunu hızlandırır. Aktif protein C; FV ve FVIII’i inaktive ederek plazminojen aktivatörlerinin konsantrasyonunu arttırır. Böylece trombozu kontrol altına alır (21).
Endotel hücreleri, damar bütünlüğünün bozulduğu bölgelerde trombosit adezyonunun önemli bir kofaktörü olarak görev yapan Von Willebrand Faktörünün de (vWF) başlıca kaynağıdır. Ayrıca zedelenen yüzeyden subendotelyal doku ile trombositlerin etkileşiminde önemli olan kollajen tip IV gibi moleküller açığa çıkar (14,22).
vWF büyük bir glikoprotein olup, endotel hücreleri ve megakaryositlerden sentezlenir. Prokoagülan özelliği vardır. Salınımını uyaran başlıca etkenler; trombin, IL-1 ve bazı hormonlardır (adrenalin, vazopressin ve insülin). Şiddetli egzersiz ve damar tıkanması da etkili uyarıcılardır. Ayrıca kan damarlarını ve karaciğeri etkileyen birçok hastalıkta da kanda vWF düzeyleri artar. vWF, trombositlerin alfa granüllerinde depolanmıştır ve aktivasyonu halinde plazmaya salınır. Plazmada vWF ve FVIII birlikte bulunurlar. Bu şekilde FVIII, aktive protein C (APC), trombin ve
diğer plazma proteazları tarafından yapılan hızlı proteolizden korunur. Aktif
trombositlerin membranı üzerinde özgün bir reseptörle etkileşerek, bunların subendotel bileşenlerine ve kollajene adezyonunu kolaylaştıran vWF hemostazda kritik rol oynar (18,14,23).
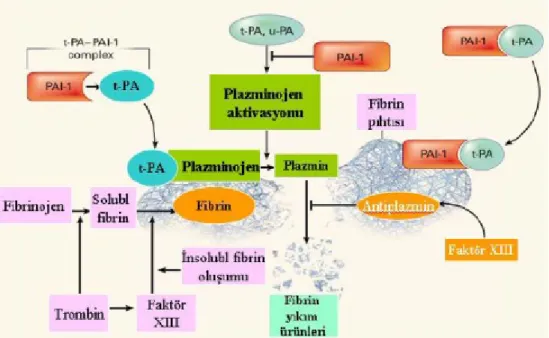
Endotel hücrelerinden sentezlenen protein S ’de APC ’nin antikoagülan aktivitesinde kofaktör olarak görev alır (18,10). Ayrıca APC, damar endotelini uyararak ''Doku plazminojen aktivatörünün (t-PA)'' salgılanmasını sağlar. T-PA, plazminojenin plazmine dönüşmesinde önemli bir maddedir. Plazmin ise fibrinin parçalanmasından sorumlu olan proteolitik bir enzimdir. Plazminojenin plazmine dönüşümünde gerekli olan diğer bir aktivatör ise, endotel hücreleri ve böbrek hücrelerinde sentezlenen ürokinazdır. T-PA ’nın inaktivasyonu ise, yine endotel hücrelerinde sentezlenen ve ürokinazı da nötralize eden plazminojen aktivatör inhibitörü–1 (PAI–1) tarafından gerçekleştirilir (14,24,25).
2.1.1.2.Trombositler
Trombositler kemik iliği veya diğer hematopoietik yerlerde megakaryositlerin stoplazmasının parçalanması ile oluşur. Çekirdekleri olmamasına rağmen, sitoplazmalarında aerobik metabolizmayı sağlayan mitokondriler, anaerobik glikoliz için glikojen depoları ve içerikleri pıhtılaşma açısından önem taşıyan spesifik granüller bulunur. Kandaki normal sayıları 150.000–350.000/mm³ ‘tür (26,27).
Trombosit membranı glikokaliksle kaplı, çift katlı lipid tabakasından oluşur. İki bakımdan trombosit plazma zarı önemlidir. İlki, bir çok spesifik glikoprotein reseptörlerini bulundurur ve bunlar aracılığıyla agregasyon yapıcı etkenlerle, inhibitörlerle, pıhtılaşma faktörleri ile diğer trombositlerle ve damar duvarı ile etkileşir. İkincisi ise plazma zarının fosfolipidleri içermesidir. Bu fosfolipidler prostaglandin sentezi, hücre içi kalsiyum hareketi ve prokoagülan aktivitenin trombositin dış yüzeyinde oluşması ve yerleşmesi bakımından önemlidir (27,28). Trombositlerde; lizozimler, α-granüller ve yoğun cisimcikler olmak üzere üç tip salgı granülü bulunur. Lizozimlerde asit hidrolazlar; α-granüllerde ise heparini nötralize eden trombosit faktör 4 (PF4), beta-tromboglobulin (β-TG), trombospondin, fibrinojen, fibronektin, PAİ–1, α2-antiplazmin, FV, FVIII, vWF ve çeşitli büyüme
trombositlerin metabolizmasıyla ilişkili ADP, adenozin trifosfat (ATP ), 5-hidroksitriptamin (5-HT), pirofosfat ve Ca++ iyonları bulunur. Normalde insan trombositi kanda yaklaşık 9–10 gün dolaşır ve sonra “Retikülo Endotelyal Sistem (RES)” tarafından parçalanır.
Dolaşımdaki trombositler hücre temelli bir hemostaz (Primer hemostaz) ortamı sağlarlar. Dolaşımdaki trombositler hasar görmüş bir damardaki subendoteliyal dokuya temas ettikleri zaman, integrin reseptörü GPIa/IIa ve GPVI aracılığıyla açığa çıkmış olan kollajene ve ikinci bir reseptör GPIb/IX-V (önceki adıyla GPIb–IX, CD sisteminde CD 42 olarak adlandırılır) aracılığı ile kollajene bağlı vWF’a tutunurlar. Trombositler vWF ’ye bağlandıktan sonra, hasar görmüş yüzey üzerinde yuvarlanmaya, kaymaya başlarlar ve psödopod uzantıları geliştirerek biçim değiştirirler. Bu durum trombositlerin birbirlerinin çok yakınında kalmasına yardım eder. Onların birbirlerine tutunmasını ve aktivasyonunu artırır. GPIb/IX-V’nin vWF’e bağlanması GPIIb/IIIa reseptöründe (CD sisteminde adı CD 41/ CD 61 olarak belirlenmiştir) de bir yapı değişikliğine neden olur, bu da vWF’ye daha sağlam tutunulması ile sonuçlanır. Ayrıca GPIIb/IIIa aracılığıyla fibrinojen köprüsü ile agregasyon yaparlar (23,29,30).
Travmayı takiben (endotel hasarı); trombosit adezyon, aktivasyon ve agregasyon olayı başlar. Oluşan trombosit ya da hemostatik tıkaç kanamanın mekanik olarak durmasını sağlar ve koagülasyon faktörlerinin fibrin oluşturmak için etkileşeceği yüzeye destek verir. Damardaki küçük hasarlanmalar da ise, trombosit tıkacı tek başına kan kaybını tamamen durdurabilir; geniş ise trombosit tıkacına ek olarak kan pıhtısı da gereklidir (14,31,23,27).
2.1.2. Sekonder Hemostaz
Sekonder hemostaz sisteminin başlıca bileşenleri koagülasyon ve fibrinolitik sistemlerdir. Koagülasyonda sıvı halde akışkan kanın katılaşıp akamaz hale gelmesi ile oluşur. Bu olaylar değişik plazma proteinleri ile düzenlenir. 1964 yılında öne sürülen kaskad hipotezine göre Faktör XII aktivasyonu ile başlayan kontakt (intrensek) yol ve subendotelyal bölgeden açığa çıkan TF ile başlayan doku faktörü (ekstrensek) yolundaki reaksiyon dizileri sonucunda iki yolun son ürünleri Faktör X
’un aktivasyonunu sağlar ve bundan sonra ortak olarak devam eden yol, trombin ve fibrin oluşumu ile biter (32).
2.1.2.1.Koagülasyon sistemi
Koagülasyon faktörlerinin sırayla aktivasyonu sonucu fibrinojenin fibrine, takiben fibrin polimerizasyonu ile fibrin tıkacının oluşması olayına koagülasyon kaskadı denilmektedir (12). Pıhtılaşma mekanizmaları 1964 yılında iki farklı araştırma grubu tarafından ortaya atılan kaskad hipotezi ile tanımlanmıştır. Pıhtılaşma faktörleri merkezde protein bir kor ve çevresinde sialik asit rezidüleri içeren yan zincirlerden oluşmuş glikoproteinlerdir. Koagülasyon faktörlerinin çoğunluğu serin proteaz yapısında ve dolaşımda inaktif öncüller (zimojenler) olarak dolaşırlar. Proteazlar tarafından parçalanarak aktif hale getirirler. Aktifleştikleri zaman FXII, FXI, FIX, FX ve protrombin (serin proteazlar) proteolitik enzim özelliği kazanırken FVIII ve FV bu proteoliz reaksiyonlarından bazılarını katalize eden kofaktörlere dönüşürler. Sonuçta bir faktör aktifleşmeden önce bir reaksiyonda substrat iken, aktifleştikten sonra başka bir reaksiyonun enzimi haline gelir. Her aktif enzim bir sonraki faktörün birden çok molekülünü aktifleştirdiğinden; aktive olmuş faktör moleküllerinin sayısı bir anda geometrik olarak artar. Koagülasyon proteinleri de kaskadın sonunda bir çığ etkisi yaratacak kadar çoğalmış olurlar. Koagülasyon sisteminde birbirini aktifleyen proteinler olduğu gibi inhibe eden proteinlerde mevcuttur. Böylelikle kanın akışkanlığı sağlanmış olur.
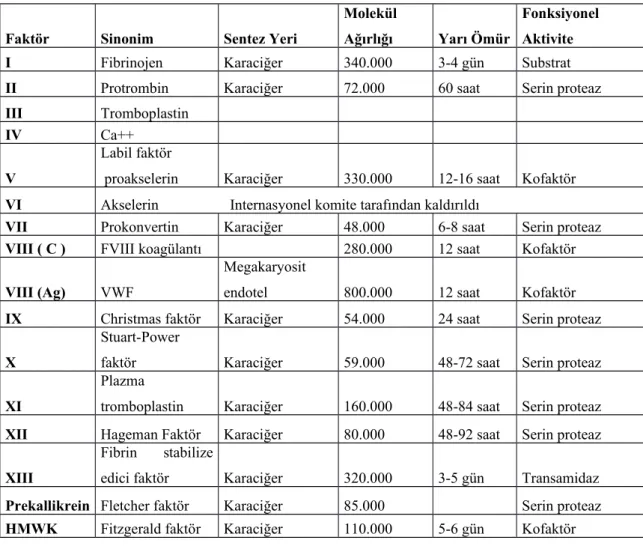
Pıhtılaşma faktörleri romen rakamları ile numaralandırılmıştır. Faktörlerin numaraları bulunuş sıralarına göre verilmiştir. Romen rakamları ile numaralandırılmamış başka koagülasyon proteinleri de vardır: yüksek molekül ağırlıklı kininojen (high moleküler weight kininojen, HMWK, Fitzgerald faktörü) ve prekallikrein (PK, Fletcher faktörü). FV ve VIII enzim değil kofaktördür. FVIIIa, FIXa ’nın FX ’u aktive edebilmesi için gereklidir. FVa ise FXa ’nın protrombini trombine çevirmesi için gerekli kofaktördür. FV ve FVIII ’i, FVa ve FVIIIa şekline, trombin çevirir (34). Daha önce FVI olarak numaralandırılan faktör, FV ‘in aktif şekli olduğundan listeden çıkarılmıştır.
Dolaşımda normalde bulunmayan tek faktör doku faktörüdür (Tissue factor, TF). Aktifleşmesi gerekmez, endotel hasarını takiben subendotelyal dokulardan çıktığı anda aktiftir. TF ’de FVIIa ve FVa gibi proteolitik enzim değil enzim
kofaktörüdür. FIII bir doku faktörüdür ve plazmada bulunmaz. FIV, Ca++ iyonudur. Diğer faktörler protein yapısındadır (Tablo 1).
Koagülasyon proteinlerinin çoğunun, koagülasyonun fizyolojik inhibitörlerinin birkaçının ve fibrinolitik sistemin ana komponentlerinin sentez yeri karaciğer parankim hücreleridir. Aynı zamanda karaciğer, aktive pıhtılaşma faktörlerini ve plazminojen aktivatörlerini sistemik dolaşımdan temizleyerek hem hemostazı hem de fibrinolizi düzenler (35,36). FVIII kompleks bir moleküldür, yalnız pıhtılaşma aktivitesi gösteren ve FVIII: koagülan protein (VIII: C) olarak adlandırılan parçası karaciğerde yapıldığı, diğer parçasını oluşturan ve multimerik yapıda bir glikoprotein olan vWf ’nün ise başlıca endotel hücrelerinde ayrıca megakaryositlerde sentez edildiği gösterilmiştir. vWf multimerleri FVIII ’in stabilizasyonunu ve dolaşımda taşınmasını sağlar ve trombositlerin endotel altı dokuya adezyonuna yardım eder. FII, FVII, FIX, FX karaciğerde sentezleri sırasında K vitaminine kofaktör olarak ihtiyaç gösteren proteinlerdir. Bu proteinlerdeki glutamik asit rezidülerinin karboksilasyonunu ( Epoksit redüktaz enzimi aracılığı ile) K vitamini sağlar. Böylece bu faktörler Ca++ aracılığıyla fosfolipid yüzeylere tutunabilme yeteneği kazanırlar (37).
Plazmatik faktörler dışında pıhtılaşma reaksiyonları için gerekli fosfolipid yüzeyleri intrensek pıhtılaşma yolunda trombosit faktör 3, ekstrensek pıhtılaşma yolunda ise doku faktörü III (TFIII) tarafından sağlanır. TF, hücre membranlarının hemen tamamında bulunan glikoprotein-fosfolipid kompleksidir. Plazmayla temas eden kan hücrelerinin ve endotelin yüzeyinde bulunmaz. Monosit ve endotel hücrelerinin inflamatuar sitokinlerle uyarılması bu hücrelerde TF ’nin indüklenmesine yol açar (36,37) (Tablo 2).
Tablo 1: Kan koagülasyon proteinlerinin adlandırılması ve özellikleri (33)
Faktör Sinonim Sentez Yeri
Molekül
Ağırlığı Yarı Ömür
Fonksiyonel Aktivite I Fibrinojen Karaciğer 340.000 3-4 gün Substrat
II Protrombin Karaciğer 72.000 60 saat Serin proteaz
III Tromboplastin
IV Ca++
V
Labil faktör
proakselerin Karaciğer 330.000 12-16 saat Kofaktör
VI Akselerin Internasyonel komite tarafından kaldırıldı
VII Prokonvertin Karaciğer 48.000 6-8 saat Serin proteaz
VIII ( C ) FVIII koagülantı 280.000 12 saat Kofaktör
VIII (Ag) VWF
Megakaryosit
endotel 800.000 12 saat Kofaktör
IX Christmas faktör Karaciğer 54.000 24 saat Serin proteaz
X
Stuart-Power
faktör Karaciğer 59.000 48-72 saat Serin proteaz
XI
Plazma
tromboplastin Karaciğer 160.000 48-84 saat Serin proteaz
XII Hageman Faktör Karaciğer 80.000 48-92 saat Serin proteaz
XIII
Fibrin stabilize
edici faktör Karaciğer 320.000 3-5 gün Transamidaz
Prekallikrein Fletcher faktör Karaciğer 85.000 Serin proteaz
Tablo 2: Pıhtılaşma işlevi (36)
Pıhtılaşma başlatıcılar: Protrombotik Prokoagülanlar ve platelet aktivatörleri- TF, PA-I, vWF, Fibrinojen, Kollajen, IL-1, Adezyon molekülleri, Trombin, Serotonin, Epinefrin, Vazopressin, İmmün kompleksler, TXA2, PAF, FXIIa, plazmin
Pıhtılaşmayı sağlayıcılar (Faktörler): Protrombin, FIX, FX, FXI, FXII, FV, Ca++, fosfolipidler, fibrinojen
Pıhtılaşmayı önleyiciler:
Doğal prokoagülanlar
Protein C ( K vitaminine bağımlı) (Karaciğerde) Protein S ( K vitaminine bağımlı) (Karaciğerde) Antitrombin III (Karaciğerde)
TFPI ( Tissue factor pathway inhibitor)(Endotelde) α2-Makroglobin
Heparin Kofaktör II
Trombomodulin (Endotelde)
Platelet aktivasyon inhibitörleri: NO, PGE2, PGI2, ADPase, ATP, Difosfohidrolaz
Fibrinlitik sistem: Plazminojen, Plazmin, t-PA, Ürokinaz
Pıhtılaşma faktörlerinin sınıflandırılması A- K vitaminine bağımlı faktörler.
3. Faktör IX
4. Faktör X
5. Protein C 6. Protein S
B-Trombine duyarlı faktörler: 1. Faktör I (fibrinojen) 2. Faktör V 3. Faktör VIII 4. Faktör XIII C-Kontakt faktörleri 1. Faktör XII 2. Faktör XI 3. HMWK 4. Prekallikrein D-Fosfolipidler ve kalsiyum iyonları E-Koagülasyon inhibitörleri (38,39)
2.1.2.2. Pıhtılaşma sistemi aktivasyonu
Pıhtılaşma proteinleri aktifleşmemiş proenzim ve zimojen şeklinde çok miktarda dolaşımda bulunurlar. Koagülasyon faktörleri serin proteazlar veya enzimatik aktivitesi olan fosfolipid/protein komplekslerinin etkisi ile trombin oluşuma sebep olan reaksiyonlara katılırlar. Daha sonra trombin de lifsel proteini fibrine dönüştürür.
Pıhtılaşma zincirindeki her reaksiyon bir enzim (aktive olmuş pıhtılaşma faktörü), bir substrat (pıhtılaşma faktörünün proenzim hali) ve bir kofaktör (reaksiyon hızlandırıcı) topluluğunun birleşmesinden ortaya çıkar. Enzim-substrat-kofaktör kompleksi fosfolipid üzerinde toplanır ve kalsiyum iyonları ile birlikte tutulurlar. Böylece, pıhtılaşma bu komplekslerin bulunduğu yerlerde, örneğin aktive olmuş trombositlerin yüzeyinde, sınırlı kalır. Bu reaksiyonlardan biri faktör X’un, Faktör Xa’ya dönüşümüdür (40).
2.1.2.3. Koagülasyon kaskadı 2.1.2.3.1.Klasik anlayış
Klasik anlayış, koagülasyon kaskadında birbirinden bağımsız iki farklı yol olarak tanımlar; intrensek yol ve ekstrensek yol. Bu iki yol FX ’un aktiflenmesi noktasında birleşir; FX ’dan fibrin oluşumuna dek devam eden olaylar bütününe de ortak yol adı verilir. Günümüzde artık tek bir koagülasyon yolu olduğu bilinmektedir. Ancak koagülasyon kaskadı incelenirken kullanılan iki temel testi (PT, PTT) daha iyi anlayabilmek ve yorumlayabilmek için bu iki yolu bilmek gereklidir (10)
1. İntrensek pıhtılaşma sistemi
İnterensek yol diğer adı ile kontakt aktivasyon yoludur. İntrensek yol kontakt aktivasyon faktörlerinin; PK, FXI, FXII ve HMWK ’nin görev aldığı pıhtılaşma yoludur. Kontakt aktivasyon yolu vasküler travma sonrası ortaya çıkan uyarılar ile oluşur. Konnektif doku elementlerinin (kollajen) bozulması ve açığa çıkması ile oluşan negatif yüklü yüzeye temas eden inaktif FXII, aktive edilmiş FXII ( FXIIa) denen proteolitik bir enzime dönüsür. Bu reaksiyonda PK ve HMWK denilen iki protein gereklidir, Ca++ görev almaz. Bundan sonraki reaksiyonlar ise Ca++
bağımlıdır. FXII aktivasyonu ile koagülasyon sisteminde birçok değişiklik yaşanır. Aktive FXII; enzimatik etkisi ile FXI ’in inaktif zimojenini, HMWK ve PK varlığında, aktif serin proteaz olan FXIa ’ya dönüştürür. FXIa ’da, inaktif FIX zimojenini, aktif FIXa ’ya dönüştürür. Aktif FIX; iyonize kalsiyum, fosfolipidler ve aktiflenmiş FVIII ile beraber protrombin aktivatör kompleks oluşumunda anahtar bir başlatıcı olan FX ’u FXa ’ya dönüştürür. FX koagülasyon kaskadının ortak yoludur ve oluşan reaksiyonlar sonucunda fibrinojenin fibrine dönüşümü meydana gelir (12,13,27) (Şekil 3).
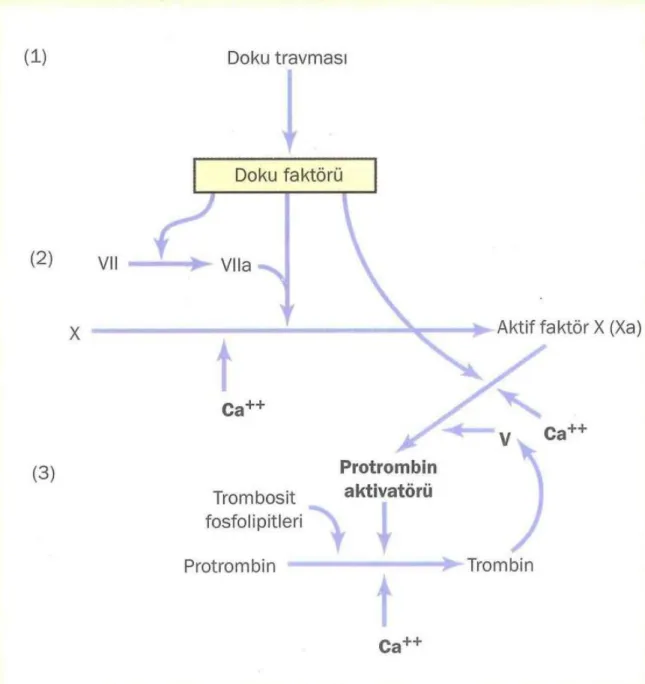
2. Ekstrensek pıhtılaşma sistemi
Ekstrinsik yol; diğer adıyla doku faktörü yolu, endotel hücre bariyeri bozulduğunda, subendotelial dokudaki açığa çıkan doku tromboplastinin dolaşıma girmesiyle başlar. Doku tromboplastini (TF), diğer koagülasyon faktörleriyle karşılaştırıldığında farklıdır. Bu madde dolaşım sistemi haricinde beyin, böbrek, dalak ve vasküler endotel hücrelerinde de mevcuttur. TF ayrıca sepsis sırasında endotoksin uyarısına bağlı olarak dolaşımdaki monositlerin yüzeyinde de eksprese edilebilir. Protein ve lipid elementlerine sahiptir. TF fizyolojik pıhtılaşmanın başlatıcısıdır. Bu TF ’ün protein kısmı çeşitli fosfolipidlerle etkileşme yeteneğindedir. TF, dolaşımda bazal trombin aktivitesi tarafından aktifleştirildiği düşünülen az miktardaki aktif FVII ’ye bağlanır. Aktif FVII-TF kompleksi de; iyonize olmuş Ca varlığında, FX ’u FXa ’ya dönüştürür. Bu FVIIa-TF kompleksi sürekli olarak aktif değildir. FVIIa-TF-FX ile üçlü kompleks oluşturarak enzimleri etkisiz hale getiren TFPI tarafından hızlıca inaktive edilir. FXa, serbest fosfolipid (TF ’ün parçası ) ve FV ile protrombin aktivatörü kompleksini olusturur. Son protrombin aktivatör kompleksinde; aktive edilmiş FX, gerçek bir proteaz olarak protrombini trombine parçalar ve aktiflenmiş trombin, fibrinojenin fibrine dönüşümünü katalizler (12,13,25,27) (Şekil 4).
Şekil 4. Pıhtılaşma Mekanizmasını Başlatan Ekstrensek Yol(41) 3. Ortak yol
Koagülasyon sisteminde; hem intrensek hem de ekstrensek kaskadın ortak aktive ettiği faktör FX ’dur. Faktör IXa ve VIIa yüksek aktiviteli serin protezlardır. Ortak yol faktörleri olan FX ve FV ’in aktivasyonuna neden olurlar. Bu şekilde, FX ’un FXa ’ya dönüşümüyle intrensek ve ekstrensek sistemler ortak yolda birleşirler. FXa, FII, FV, Ca++ iyonları ve trombosit fosfolipidleri gibi prokoagülanlarla birleşerek protrombinaz kompleksini oluşturur. Oluşan bu molekül grubu kompleksi, protrombinin (FII) trombine (FIIa) dönüşümünü katalizler. Dolaşımdaki protrombin
miktarının diğer faktörlere oranla fazla olması trombin oluşumunun son adımını ve fibrinojenden fibrin monomerlerinin oluşmasını kolaylaştırırlar. Trombin, FV ve FX aktifleşmesi için ek membran yüzeyi oluşturan trombositleri aktifleştirir. FVIII ’i aktifleştirirerek FVIIIa oluşturur daha sonra FXI ve FXIII ’ü aktifleştirirek pıhtılaşmaya katkı sağlar. FXIII (fibrin stabilize edici faktör) Ca++ iyonları varlığında, jel benzeri fibrin monomerlerini çözünmeyen bir fibrin polimer pıhtısına dönüştüren aktif bir transamidazdır (18,12,13,27).
2.1.2.3.2. Koagülasyon kaskadı (Yeni anlayış)
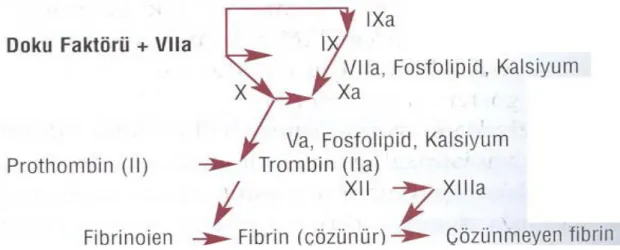
Yeni anlayışa göre koagülasyon kaskadını başlatan ilk adım vasküler endotel hücrelerinin zedelenmesini takiben subendotelial dokudan doku faktörünün (TF) ’nin dolaşıma geçerek FVIIa ile kompleks oluşturmasıdır. TF-FVIIa kompleksi daha sonra enzimatik olarak FX ’u FXa ’ya, FIX ’u FIXa ’ya ve FXI ’i FXIa’ ya çevirir. FX ’nun FXa ’ya dönüşmesi koagülasyon kaskadının başlamasında önemli bir basamaktır. Vasküler endotelden salınan TFPI hızla TF-VIIa-Xa kompleksini inaktive eder. TF-VIIa kompleksinin invivo olarak başlıca görevi FIX ’un FIX ’a aktive edilmesidir; FIXa daha sonra FX’ u, FXa’ ya çevirir (10).
Koagülasyon kaskadında FX ’nun ve protrombinin aktivasyonu klasik yoldaki gibi anahtar role sahiptir, çünkü hem FXa ’nın hemde trombinin önceki basamaklar üzerine etkisi vardır. FXa, FVII ’yi aktive eder ve dolaşıma TF ile birlikte kompleks oluşturmak üzere daha fazla FVIIa verilmesini sağlar. Trombin FV ’i, FVa ’ya ve FVIII ’i, FVIIIa ’ya çevirir. Aynı zamanda FXI ’in, FXIa ’ya ve FXIII ’ün, FXIIIa ’ya dönüşümünü de kolaylaştırır. Trombin ayrıca güçlü bir trombosit agonistidir. FX, FIXa-FVIIIa-fosfolipid ve kalsiyumdan oluşan bir kompleks tarafından aktive edilir. Protrombin ise FXa, FVa, fosfolipid ve kalsiyumun oluşturduğu bir kompleks tarafından aktive olur.
Trombin kaskadın sonunda fibrinojenden iki küçük peptid ayırarak (fibrinopeptid A ve B) fibrinojeni fibrin monomerlerine çevirir. Fibrin monomerleri kendiliğinden polimerize olarak çözünür fibrin polimerlerine dönüşür. FXIIIa, fibrin polimerlerini çapraz bağlarla stabilize eder ve sıkı fibrin tıkacının oluşumunu tamamlar (10)
Şekil 5: Yeni anlayışa göre koagülasyon kaskadı
2.1.2.4. Pıhtı inhibisyonu ve erimesi
Çeşitli pıhtılaşma inhibitörleri ve fibrinilotik sistem oluşan pıhtının boyutunu ve stabilitesini kontrol eder. Pıhtılaşma yolunun direkt inhibitörleri PC, PS ve TPFI’ dür. Bunlar genel olarak trombin oluşumunun azaltılması ve trombüs oluşumunun kontrolü açısından zorunludur.
Trombin endotel yüzeyindeki trombomodulin reseptörüne bağlanır, dolaşımdaki PC’yi aktifleştirir. APC, FVa ve FVIIIa ’yı enzimatik olarak parçalar ve fazla trombin oluşumu engellenir. PC ’nin antikoagülan etkisi ile beraber antienflamatuvar ve antiapopitotik etkileri sitoprotektif etkiyi sağlar. PS, APC ’nin kofaktörü olarak görev yapar. APC ’nin aksine trombin-trombomodulin kompleksi, trombin tarafından aktifleştrilen fibrinoliz inhibitörünü (thrombin activted fibrinolysis inhibitor-TAFI) indükleyerek pıhtı oluşumunu arttırabilir. TAFI plazmin aktivitesini engeller (19).
ATIII; serin proteaz olup trombin, FXa, FIXa ve FXIa ’ya karşı etkilidir. Endotelyal hücreden salınan heparan sülfat ve eksojen heparin etkinliğini arttırır. TFPI plazmada ve damar endoteli yüzeyine bağlı olarak bulunur. TFPI, FXa ve FVIIa-TF ile kompleks grup oluşturarak FX ’nun VII-TF tarafından daha fazla aktive edilmesini önler.
Fibrinolitik sistem trombüsün hasarlı bölgesinde sınırlı kalmasını ve daha sonra kan akımının sağlanması için pıhtının erimesi açısından etkin rol alır. Trombus oluşunca dolaşımdaki plazmonijeni içine alır ve fibrine bağlanır. Komşu sağlam
endotelden salgılanan tPA, pıhtıdaki plazminojeni plazmine çevirir. En az 4 fibrinoliz inhibitörü mevcuttur.
PAI-1 ’in tPA ’ya affinitesi yüksektir ve dolaşımdaki miktarıda tPA ’dan fazla olduğundan bütün tPA ’ya bağlanır. Ayrıca plazmaya kaçan plazmin, α2-antiplazmin tarafından bağlanarak etkisiz hale getirilir, bu reaksiyon hızlı ilerlediğinden jeneralize fibrinoliz engellenir. FXI ve FXIII aktivasyonu pıhtıyı daha sağlam bir hale getirir. FXIIIa fibrin zincirleriyle çapraz bağlanır ve α2-plazmini de fibrine bağlayarak fibrinolizi engeller.
Kollajen teması ve TF salınması sonucunda oluşan trombin, trombosit-fibrin pıhtısının teşekkülünde ve idamesinde rol alır. Prokoagülan özelliğide olan trombin, FIX, FV ve FVIII ’i etkinleştirir, ek trombin oluşturur ve trombositlerin yaralanma bölgesinde toplanmasına yardım eder. Trombin fibrin oluşumunu başlatır ve ADAMTS13 ’ü etkisiz hale getirirerek vWF multimerlerinin yıkımını önler. FXIII ’ü fibrin moleküllerine çapraz bağlanmak üzere etkinleştirerek fibrin pıhtısını stabilize eder. Trombin; trombomodulin ve komşu sağlam endotel hücrelerinden salgılanan heparan sülfatlarla birlikte trombosit tıkacının kontrolsüz bir şekilde büyümesini önler. Doğal trombin inhibitörü ATIII genel dolaşımdaki trombini temizler, böylece yaygın damar içi pıhtılaşmasının önler.
Fibrinolizin sonunda ortaya çıkan spesifik fibrin parçacıkları laboratuvar testi olarak kullanılır. Klinik olarak en özgün ve en sık kullanılanı, iki farklı fibrin molekülünden köken alan iki çapraz bağlanmış D kısımdan meydana gelen D-dimer parçacığıdır. Dolaşımdaki D-dimer parçacığının bulunması aktif pıhtı döngüsünün olduğunun göstergesidir. Saptanmaması ise venöz tromboli ekartasyonu açısından kullanılır (42).
Şekil 6: Fibrinolitik yolların aktivasyonu ve inhibisyonu
2.2. PIHTILAŞMA FONKSİYON TESTLERİ
Öyküsünde ve fizik muayenesinde kanama yönünden anormallik bulunan hastalarda, koagülasyon testlerinin bozuk olarak saptanması büyük bir olasılıktır. Ancak laboratuvar yanılgısını önlemek amacıyla anormal olarak saptanan koagülasyon testlerinin tekrarı da zorunludur. Anormal olarak saptanan bazı testler, klinikte her zaman bir anlam içermeyebilir. Örneğin; Faktör XII, Prekalikrein (PK) ve yüksek molekül ağırlıklı kininojen (HMWK) eksikliği olan hastalarda bu faktörlerin eksiklikleri, aPTT ’de uzamaya neden olmasına karşın, klinik olarak herhangi bir kanama görülmez ve bu durum sadece biyokimyasal bir bozukluk olarak nitelendirilir (43-45).
Koagülasyon tarama testleri; dolaşan trombositler ve koagülasyon yolları gibi hemostazın değişik bileşenlerini incelemede yardımcı olur. En önemli tarama testleri arasında, trombosit sayımı, protrombin zamanı (PT), aktive parsiyel tromboplastin zamanı (aPTT) ve Trombin zamanı vardır (46). Eğer bu testlerde herhangi bir anormallik varsa, daha spesifik testlere geçilerek, bozukluğun nerede olduğunu saptamak gerekir.
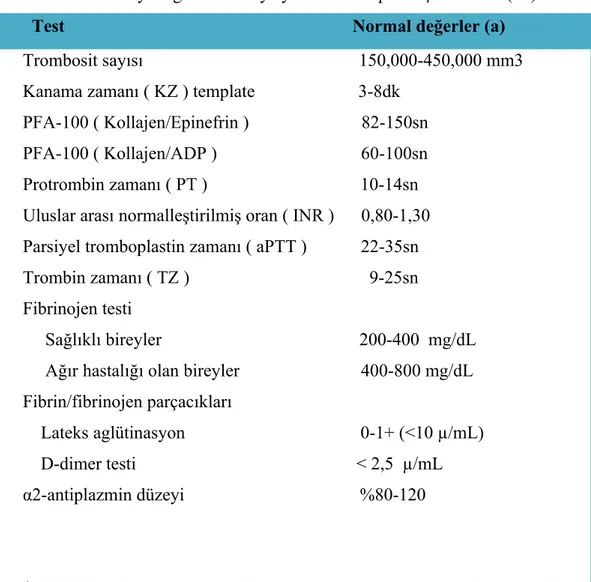
Tablo 3 : Kanamayı değerlendirmeye yönelik rutin pıhtılaşma testleri(47)
Test Normal değerler (a)
Trombosit sayısı 150,000-450,000 mm3 Kanama zamanı ( KZ ) template 3-8dk
PFA-100 ( Kollajen/Epinefrin ) 82-150sn PFA-100 ( Kollajen/ADP ) 60-100sn Protrombin zamanı ( PT ) 10-14sn Uluslar arası normalleştirilmiş oran ( INR ) 0,80-1,30 Parsiyel tromboplastin zamanı ( aPTT ) 22-35sn Trombin zamanı ( TZ ) 9-25sn Fibrinojen testi
Sağlıklı bireyler 200-400 mg/dL Ağır hastalığı olan bireyler 400-800 mg/dL Fibrin/fibrinojen parçacıkları
Lateks aglütinasyon 0-1+ (<10 µ/mL) D-dimer testi < 2,5 µ/mL α2-antiplazmin düzeyi %80-120
(a)Tablodaki referans aralıklarının üretici ya da tek bir kurum tarafından tayin edilmiş olduğuna dikkat ediniz.tüm laboratuvarlar kendi referans aralıklarını oluşturmalıdır.
2.2.1. Trombositler
Sayıları normalde 150.000-450.000/mm3 ’tür (47). Sayılarının 150.000 altına düşmesine trombositopeni, 450.000 üzerine çıkmasına ise trombositoz denir (48). Trombosit sayımı otomatik kan sayım cihazları ile yapılmaktadır. Tam otomatik sayım yöntemlerinde EDTA ile antikoagüle edilen kandaki eritrositler hemolize uğratıldıktan sonra kalan trombositler optik sayıcı ile sayılır.
2.2.1.1.Trombosit fonksiyon testleri
Temel bir fizyolojik süreç olan trombosit agregasyonu, optik dansiteli veya empedans agregometrisi kullanılarak vücut dışında ölçülebilir. Bu testte hastadan alınan kan örneği sitrat gibi uygun antikoagülan ile karıştırılır. Deney tam kan kullanılarak yapılabildiği gibi, santrifuj kullanılarak trombositten zengin plazma (PRP) veya trombositten fakir plazma (PPP) ile de yapılabilir. Genellikle çözünür formda aktive edici bir bileşen veya agonist plazmaya eklenir. Amaç bir trombosit yüzey reseptörünün (yani GPIIb- IIIa veya integrin αIIbβ3) bir plazma proteini ile (yani fibrinojen) etkileşimini destekleyip bunun düzeyini ölçmektir. Tipik olarak kollajen, epinefrin, ATP ve arasidonik asit şeklinde bir dizi agonist PRP ’ye iki veya üç ayrı konsantrasyonda eklenir ve zamana karşı yanıt izlenir. Yanıt şekli daha sonra tipik bazı özel defektlerle karşılaştırılır. Örneğin, Glanzmann trombastenisi olan hastalardaki trombositler ristosetin hariç tüm diğer agonistlere karşı genel bir yanıt eksikliği gösterirler. Von Willebrand hastalığı veya Bernard-Soulier sendromu olan hastalar ise, sadece ristosetine karşı yanıt eksiliği içerirler. Aspirinin etkileri arasidonik asit ve kollajen tarafından indüklenen agregasyon üzerinde belirgindir. Epinefrin veya adenozin difosfatın uyardığı aggregasyonda sekonder agregasyon dalgası bulunmayan hastalarda bir sinyalleme defekti veya depolama havuzu defekti olabilir (49-52).
Platelet Function Analyzer (PFA-100), kanama zamanına göre trombosit fonksiyonlarını çok daha duyarlı ve tekrarlanabilir olarak değerlendirebilmektedir. Trombosit fonksiyon tarama testi olarak, kanama zamanının yerine kullanılmaya başlanmıştır. İki adet kullan-at kartuş kullanılarak çalışma yapılır. Kartuşların membranı agonist (kollajen-epinefrin veya kollajen-ADP) ile kaplıdır. Bu membranın ortasında ise bir delik bulunur. Trombositler bu delikten yüksek akım hızı ile geçerler. Cihaz trombositlerin bu membrana yapışıp, agrege olup ve daha sonra da açıklığın tıkanması için gecen kapanma zamanını ölçer. Bu cihaz antikoagülan ilaç kullanımına bağlı durumlar ile daha ağır fonksiyon bozukluklarının ayrımını yapabilmektedir. Normal sonuç daha pahalı olan trombosit fonksiyon testlerinin yapılmasına olan gereksinimi ortadan kaldırmaktadır. Ancak PFA-100, in vivo bir test olan kanama zamanı gibi vasküler fonksiyonu değerlendirememektedir.
PFA-100 standart agregasyon ile karşılaştırıldığında ilaçlara bağlı durumlar, von willebrand hastalığı ve glanzmann trombastenisi tanısında hassasiyeti yüksektir (53).
2.2.2. Kanama zamanı
Primer hemostazın değerlendirilmesinde kullanılan bir testtir. İlk kez 1910 yılında kulak memesi veya parmak ucunun delinmesine dayanan, Duke yöntemi ile uygulanmaya başlanmıştır. Bu testle kanama zamanının trombositopeni varlığında uzadığı fakat hemofili hastalarında normal değerlerinde olduğu bildirilmiştir (54). Kanama zamanının tayininde en yaygın ''Ivy''yöntemi kullanılır. Bu test yapılırken kol tansiyon aletiyle 40 mmHg ’lik bir basınç altında tutulur ve ön kolun ön yüzünde damarsız bir alanda 1cm uzunluğunda küçük bir kesi yapılır. Bu yöntemin yerini de zaman içinde Mielke kanama zamanı (template, simplate) almıştır. Ticari olarak sağlanan cihazlar belirli bir kalıp içinde yer alan kesicilerden oluşur. Kolda 40 mmHg ’lik sabit basınç sağlandıktan sonra kalıptaki bir yarık aracılığıyla cihaz içindeki sustalı kesicilerle ön kol derisinde derinliği ve boyu standart (2,5mm) bir kesi oluşturulur ve kanamanın devamı 30 sn ’lik aralarla izlenir. Testin referans aralığı 1-9dk’dır. Trombositopenilerde, kalitatif trombosit hastalıklarında ve Von Willebrand hastalığında (VWD), Glanzman trombastenisi, Bernard Soulier sendromu, aspirin, NSAİİ gibi ilaçların kullanımında kanama zamanı uzundur (53,55,56).
2.2.3. Protrombin zamanı (PT)
Koagülasyon mekanizmasındaki ekstrensik ve ana yolda gelişebilen bozuklukların göstergesidir. PT; kalsiyum, doku tromboplastini ve sitratlanmış plazmanın etkileşimi ile koagülasyonun gerçekleşmesi arasındaki zamanı ifade eder ve normal değeri 10-15sn ’dir (57-60). Faktörlerden üçü (faktör VII, X ve protrombin) K vitamine bağımlı faktörlerdir ve kumadin benzeri ilaçlarla baskılanabilirler. Böylece PT testi kumadin benzeri ilaçların yaptığı antikoagülasyonun düzeyini değerlendirmek için kullanılır (61,62).
Test, tek aşamalı Quick Metodu ile sitrat içeren plazma örneklerine tam doku tromboplastini (akciğer, beyin veya plasenta kaynaklı doku tromboplastini),
fosfolipid (ekstraktı) ve kalsiyum eklenmesinden sonra, fibrin pıhtı oluşum süresinin ölçülmesi esasına dayanmaktadır (58-60).
2.2.4 Aktive parsiyel tromboplastin zamanı (aPTT)
Aktive parsiyel tromboplastin zamanı kalıtsal veya edinsel FVIII, FIX ve FXI eksiklikleri veya inhibitörlerini taramak için kullanılan bir testtir. Bu test sırasında plazmaya fosfolipid, kalsiyum ve bir aktivatör eklenerek intrensek yoldan pıhtı oluşumuna kadar geçen zaman ölçülür. Özellikle FIX ve FVIII eksikliklerinde daha duyarlı olmakla birlikte, intrensek ve ortak yolda fibrin oluşumuna kadar olan reaksiyonlarda yer alan tüm faktörlerin eksikliklerinde (FV, FX, protrombin ve fibrinojen) aPTT uzayabilir. Heparin tedavisinin monitorizasyonunda aPTT kullanılır (54). Ayrıca hemofili A ve B tanı ve tedavi takibinde kullanır. aPTT ’nin normal sınırları genelde 28-34 saniye arasında değişmektedir. aPTT yöntemleri, INR ’de olduğu gibi standardize edilmediğinden değişik reaktif ve aletler kullanıldığında test sonuçlarında farklılıklar görülebilir (63).
2.2.5. Trombin zamanı
Fibrinojenin, trombin tarafından fibrine çevrilme reaksiyonunu yansıtan bir testtir. Bu testte sitratlı plazma örneğine trombin ilave edilerek pıhtı oluşma zamanı ölçülür. Referans aralığı kullanılan trombinin konsantrasyonuna göre 15-20 sn, 20-25 sn olabilir. Trombin zamanının uzadığı durumlar, hipofibrinojenemi (plazma fibrinojen düzeyi <100 mg/dL), heparin tedavisi, kanda fibrinojen/fibrin yıkım ürünlerinin varlığı, disfibrinojenemi ve paraproteinemi ile birlikte olan hastalıklardır (53).
2.2.6. International normalızed ratıo (INR)
1982 yılında Dünya Sağlık Örgütü (WHO) uluslararası normalize değeri tanımlamıştır. INR; hemostatik sistemin veya trombotik durumların başlangıç değerlendirilmesi için kullanılmaktadır. En önemli avantajı, bütün laboratuvarlar arasında standart ve bütünlük sağlayarak hastalara daha iyi bir antikoagulan tedavisi uygulamasını sağlamasıdır. Normal INR değeri 1 ’dir (53,62). INR hastanın
protrombin zamanının, kontrol protrombin zamanına bölündükten sonra, ISI değer kuvvetine yükseltilmesiyle bulunur.
[ INR= (PT hasta / PT normal) ISI ]. ISI, uluslararası duyarlılık indeksi [international sensitivity index (ISI)] olarak bilinir. Her üretici firma, ürettiği doku tromboplastinini (faktörünü) dünya sağlık örgütüne (WHO) yollayarak oradan bir ISI değeri almak zorundadır veya diğer bir deyişle yeni üretilen bu doku tromboplastini, uluslararası olarak standardize edilen plazma örneklerinde kullanılan WHO ’daki doku faktörü (genelde tavşan tromboplastini) ile kıyaslanmaktadır (64,65). Warfarin alan hastaların değişik laboratuvarlarda ölçülen protrombin zamanları böylelikle standardize edilmiş olmaktadır (66).
Anormal pıhtılaşma zamanlarının incelenmesi:
Yukarıda kısaca tartışılan pıhtılaşma zamanları, kanama diyatezi olan bir hastaya yaklaşımda yardımcı olabileceği gibi, heparin ve warfarin tedavisinin monitöründe de büyük fayda sağlar. Bunları üç ayrı bölümde incelemek mümkündür.
Sadece protrombin zamanının (INR) uzadığı durumlar:
Bu durum genelde problemin ektrensek yolda olduğunu gösterir. Protrombin zamanının uzadığı durumlar ise aşağıdaki gibi özetlenebilir:
Faktör VII eksikliği (doğumsal, varfarin kullanımı, karaciğer hastalığı, K vitamini eksikliği)
Faktör VII inhibitörleri (nadir)
Sadece aktive parsiyel tromboplastin zamanının uzadığı durumlar:
Bu durum genelde problemin intrensek yolda olduğunu gösterir. aPTT ’nin uzadığı durumlar ise aşağıdaki gibi özetlenebilir:
Faktör VIII, IX, XI eksiklikleri (doğumsal veya edinsel) Faktör VIII, IX, XI inhibitörleri
Faktör XII, Prekalikrein, HMWK eksiklikleri (klinikte kanama görülmez) Heparin kullanımı
Lupus antikoagülan ve/veya antifosfolipid antikorların varlığı
Hem aktive parsiyel tromboplastin zamanının ve hem de protrombin zamanının (INR) birlikte uzadığı durumlar:
Faktör II (protrombin), V ve X eksiklikleri (doğumsal, karaciğer hastalığı, DIC, aşırı antikoagülasyon)
Faktör II (protrombin), V ve X antikorları
Eğer PT ve aPTT ’nin yanı sıra TZ de uzamışsa, trombin zamanı altında yukarıda anlatılan bozuklukları düşünmek gerekir.
PT ve aPTT ’si normal fakat klinikte belirgin kanaması olanlarda ise aşağıdaki durumlar düşünülmelidir:
Trombositopeni
İşlevsel trombosit bozuklukları Hafif von Willebrand hastalığı Vasküler bozukluklar
Faktör XIII eksikliği
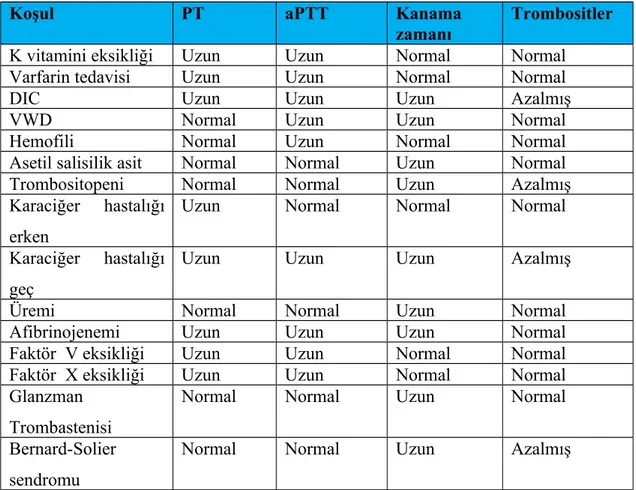
Bazı özel durumların; PT, aPTT, kanama zamanı ve trombositlerle olan ilişkileri Tablo 4’te özetlenmiştir (67).
Tablo 4:Bazı özel durumların, PT, aPTT, Kanama Zamanı ve trombositlerle olan ilişkileri
Koşul PT aPTT Kanama
zamanı
Trombositler
K vitamini eksikliği Uzun Uzun Normal Normal
Varfarin tedavisi Uzun Uzun Normal Normal
DIC Uzun Uzun Uzun Azalmış
VWD Normal Uzun Uzun Normal
Hemofili Normal Uzun Normal Normal
Asetil salisilik asit Normal Normal Uzun Normal
Trombositopeni Normal Normal Uzun Azalmış
Karaciğer hastalığı erken
Uzun Normal Normal Normal
Karaciğer hastalığı geç
Uzun Uzun Uzun Azalmış
Üremi Normal Normal Uzun Normal
Afibrinojenemi Uzun Uzun Uzun Normal
Faktör V eksikliği Uzun Uzun Normal Normal
Faktör X eksikliği Uzun Uzun Normal Normal
Glanzman Trombastenisi
Normal Normal Uzun Normal
Bernard-Solier sendromu
Normal Normal Uzun Azalmış
Tarama testlerinde alınan normal sonuçlar birçok kanama diatezinin ekarte edilmesinde yardımcı olur. Ancak, unutmamak gerekir ki, tarama sürecinde bazı kural dışı nedenler de olabilir. Bunların arasında; Faktör XIII eksikliğini, hafif von Willebrand hastalığını, hafif Faktör XI eksikliğini (hastanın genelde kanaması yok ancak cerrahi girişimlerden sonra görülen kanamalar) ve ender görülen fibrinolitik sistemi kontrol eden faktör eksikliklerini sayabiliriz. PT ve aPTT ’de uzama olması için koagülasyon faktörlerinde % 70 azalma olması gerektiğinden eğer hastanın kanama öyküsü pozitif ise, PT ve aPTT ’nin normal olmasına karşın bazı koagülasyon faktör aktivitelerinin direkt olarak ölçülmesinde büyük yarar vardır (68).