T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
ONOBRYCHIS ARMENA BOISS. & HUET
(FABACEAE) ‘NIN ANTĠOKSĠDAN ÖZELLĠKLERĠ ĠLE UÇUCU VE SABĠT YAĞ
BĠLEġĠMĠNĠN ARAġTIRILMASI ġükrü KARATAġ
YÜKSEK LĠSANS TEZĠ BĠYOLOJĠ ANABĠLĠM DALI
Haziran - 2013 KONYA Her Hakkı Saklıdır
TEZ BĠLDĠRĠMĠ
Bu tezdeki bütün bilgilerin etik davranış ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalışmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Şükrü KARATAŞ 04.06.2013
ÖZET
YÜKSEK LĠSANS TEZĠ
ONOBRYCHIS ARMENA BOISS. & HUET (FABACEAE)’NIN ANTĠOKSĠDAN
ÖZELLĠKLERĠ ĠLE UÇUCU VE SABĠT YAĞ BĠLEġĠMĠNĠN ARAġTIRILMASI ġükrü KARATAġ
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Biyoloji Anabilim Dalı
DanıĢman: Prof. Dr. Abdurrahman AKTÜMSEK 2013, 54 Sayfa
Jüri
Prof. Dr. Abdurrahman AKTÜMSEK Prof. Dr. Hüseyin DURAL
Prof. Dr. Muhsin KONUK
Bu çalışmada Onobrcyhis armena uçucu bileşenleri, yağ asitleri ve antioksidan özellikleri incelendi. Farklı ekstrakların (etilasetat, metanol ve su) antioksidan özellikleri fosfomolibdat, serbest radikal süpürme testi, β-karoten/linoleik asit testi, demir ve bakır indirgeme gücü testleri ile ölçüldü. Ayrıca, toplam fenolik ve flavonoid içerikler de hesaplandı. Çalışılan ekstraklar arasında, metanol ekstraktı antioksidan kapasite test sistemlerinde (β-karoten/linoleik asit testi hariç) en güçlü aktiviteyi sergilemiştir. Yağ asidi komposizyonu GC ile araştırıldı ve 25 farklı yağ asidi belirlendi. GC analizlerinde major yağ asitleri palmitik (%22.67) ve linoleik (%15.09) asittir. Doymamış yağ asitleri seviyesi doymuş yağ asitlerinden daha yüksektir. Uçucu yağlar GC-MS ile analiz edildi ve 22 bileşen tanımlandı. Tanımlananan major bileşenler n-hekzadekonik asit, 9-12 oktadekanoik asit, tetradekanoik asit ve hekzahidro farnesil asetondur. Bu çalışmanın sonuçları O. armena‟nın kolay elde edilebilen doğal antioksidanların ve doymamış yağ asitlerinin bir kaynağı olarak gıda ve farmasötik endüstrilerinde kullanılabileceğini göstermektedir.
ABSTRACT
MS THESIS
INVESTIGATION OF ANTIOXIDANT PROPERTIES, ESSENTIAL OIL AND FATTY ACID COMPOSITION OF ONOBRYCHIS ARMENA BOISS. & HUET
(FABACEAE)
ġükrü KARATAġ
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELCUK UNIVERSITY
Supervisor: Prof. Dr. Abdurrahman AKTÜMSEK 2013, 54 Pages
Jury
Supervisor: Prof. Dr. Abdurrahman AKTÜMSEK Prof. Dr. Hüseyin DURAL
Prof. Dr. Muhsin KONUK
In this study, Onobrcyhis armena was screened for its antioxidant potential, fatty acids and volatile compounds. Antioxidant activities of different extracts (ethylacetate, methanol and water) were measured using the phosphomolybdenum assay, free radical scavenging assay, β-carotene/linoleic acid method, ferric and cupric reducing power assay. Total phenolic and flavonoid contents were also calculated spectrophotometrically. Among studied extracts, the methanolic extract exhibited the strongest antioxidant capacity in the test systems (except for, β-carotene/linoleic acid method). Fatty acid composition of O. armena was analyzed by using GC and twenty-five fatty acids were determined in its oil. GC analysis revealed that the oil was dominated by palmitic (22.67%), linoleic (15.09%) acids. Unsaturated acids levels were higher than saturated fatty acids. The essential oil was analyzed by GC-MS system and twenty-two volatile compounds were identified. The identified major components were n – hexadecanoic acid, 9-12 octadecanoic acid, tetradecanoic acid and hexahydro farnesyl acetone. The results of this study show that O. armena can be used as an easily accessible source of natural antioxidants and unsaturated fatty acids in food and pharmaceutical industries.
ÖNSÖZ
Selçuk Üniversitesi Fen Fakültesi, Biyoloji Bölümü Fizyoloji-Biyokimya Araştırma Laboratuarı‟nda yürütülmüş olan bu tez çalışmasında, Türkiye florası için oldukça önemli bir tür olan Onobrychis armena‟nın antioksidan kapasitesi, sabit ve uçucu yağ bileşimleri belirlenmiştir.
Bu tez konusu belirleyen ve her aşamasında desteklerini esirgemeyen danışman hocam Sayın Prof. Dr. Abdurrahman AKTÜMSEK‟e çok teşekkür ederim. Bitki analizlerin yapılmasında ve sonuçların yorumlanmasında yardımlarını gördüğüm, Arş. Gör. Gökhan ZENGİN‟e çok teşekkür ederim. Yine bitkinin taksonomik olarak teşhisini gerçekleştiren Doç. Dr. Murad Aydın ŞANDA‟ya da teşekkürü borç bilirim. Ayrıca laboratuvar çalışmaları sırasında desteklerini gördüğüm çalışma arkadaşım Şengül UYSAL‟ a teşekkür ederim.
Bu Yüksek Lisans Tez çalışmasını, 12201059 nolu proje ile maddi olarak destekleyen Selçuk Üniversitesi Bilimsel Araştırma Proje Koordinatörlüğüne (BAP) teşekkür ederim.
Şükrü KARATAŞ
ĠÇĠNDEKĠLER ABSTRACT ... ii ÖNSÖZ ... iii ĠÇĠNDEKĠLER ... iv 1. GĠRĠġ ... 1 2. KAYNAK ARAġTIRMASI ... 4
2.1. Serbest Radikaller ve Antioksidanlar ... 4
2.2. Fenolik Bileşikler ... 6
2.3. Bitkisel Yağlar ... 8
2.4. Uçucu Yağlar ... 11
2.5. Fabaceae Familyası ve Onobrychis Cinsi ... 12
3. MATERYAL VE YÖNTEM ... 14
3.1. Çalışmada Kullanılan Onobrcyhis armena taksonu ... 14
3.2. Bitkisel Ekstrakların Hazırlanması ... 15
3.3. Antioksidan Kapasite Tayin Testleri ... 16
3.3.1. Toplam Fenolik Madde Tayini (Folin Yöntemi) ... 16
3.3.2. Toplam Flavonoid Madde Tayini ... 16
3.3.3. Toplam Antioksidan Kapasitenin Belirlenmesi ... 16
3.3.4. β-karoten/Linoleik Asit Emülsiyon Sistemi ... 17
3.3.5. DPPH Süpürme Etkinliği ... 18
3.3.6. Demir İndirgeme Gücü ... 18
3.3.7. Cuprac Metodu ... 19
3.4. Bitkilerin Yağ Asidi Komposizyonlarının Belirlenmesi ... 19
3.4.1. Bitkilerden Yağın Ekstrakte Edilmesi ... 19
3.4.2. Yağ Asitlerinin Metil Esterlerinin Hazırlanması ... 19
3.4.3. Numunelerin Gaz Kromatografi Cihazında Yağ Asidi Analiz Koşulları ... 20
3.4.4. Bitkilerden Uçucu Yağın Ekstrakte Edilmesi ve Analiz Şartları ... 21
4. ARAġTIRMA SONUÇLARI VE TARTIġMA ... 22
5. SONUÇLAR VE ÖNERĠLER ... 38
5.1. Sonuçlar ... 38
5.2. Öneriler ... 38
KAYNAKLAR ... 39
1. GĠRĠġ
Bitkiler tarih öncesi devirlerden beri yiyecek, barınma gibi çok çeşitli amaçlarla kullanılmalarının yanı sıra şifa kaynağı olarak da oldukça önemlidirler. Son yıllarda özellikle üretilen sentetik ilaçların yan etkilerinin fazla olması, bu alana duyulan ilginin ve bilimsel araştırmalar üzerine yapılan çalışmaların artmasına neden olmuştur. Sentetik ilaçların yerine bitkisel kökenli ham maddelerin bulunmasına yönelik biyolojik aktivite ve farmakolojik araştırmalarda birçok yeni bitkisel kaynak belirlenmiştir (Baytop, 1999).
Bitkisel ürünlerin ilaç endüstrisinde şifa kaynağı olarak kullanılmasının temeli bünyelerinde sekonder metabolitler olarak adlandırılan bileşikleri bulundurmalarıdır. Yapılan birçok araştırmada bitki sekonder metabolitlerin antimikrobiyal, antioksidan ve antimutagenik etki başta olmak üzere birçok biyolojik etkinliğe sahip oldukları belirtilmiştir.
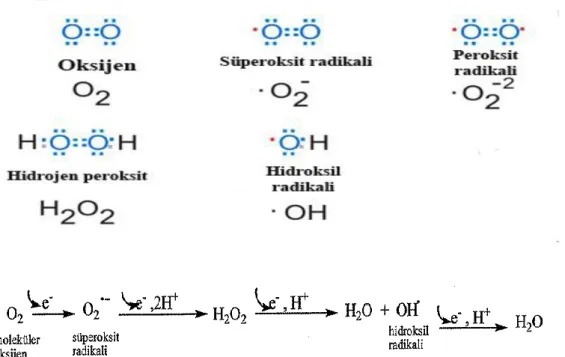
Radikal terimi yapılarında eşlenmemiş elektron içeren atomik veya moleküler olan radikaller, bu eşlenmemiş elektrondan dolayı oldukça reaktif moleküller olup birçok molekül ile reaksiyona girerek bunları da radikal formuna dönüştürürler (Valko ve ark., 2007). Canlılık için oldukça önemli olan oksijenin tam indirgenememesi organizmada serbest radikallerin ana kaynağını oluşturmaktadır. Organizmada bu oluşan radikaller genellikle serbest oksijen radikalleri veya reaktif oksijen türleri olarak adlandırılmaktadır. Reaktif oksijen türleri olarak süperoksit, hidrojen peroksit ve hidroksil radikalleri sayılabilir. Oksijen türlerinin yanı sıra azot ve sülfür türevli radikaller de meydana gelebilir (Evans ve Halliwell, 2001). Elektron transport zincirinin son elektron alıcısı olan oksijenin bir elektron alarak indirgenmesi ile süperoksit, iki elektron alarak indirgenmesi ile hidrojen peroksit, üç elektron alarak indirgenmesi ile hidroksil radikali meydana gelmektedir. Meydana gelen bu radikaller başta lipidler olmak üzere makromoleküllerde hasara sebep olmakta ve aterosklerozdan kansere kadar birçok hastalığın patolojisinde rol oynamaktadır (Peterhans, 1997). Serbest oksijen radikalleri organizmada bulunan endojen enzimatik sistemler ile ortadan kaldırılarak meydana gelen olumsuz etkiler bertaraf edilmektedir. Ancak UV, kirlilik, sigara ve radyasyon gibi çeşitli etmenlerle radikal üretimi enzimatik sistemin kapasitesini aşmakta ve zararlı etkiler meydana gelmektedir (Robinson ve ark., 1997). Bu durumda antioksidanlar olarak isimlendirilen ve düşük konsantrasyonlarda bile serbest
radikallerin etkisini ortadan kaldıran bileşiklerin diyetle alımı büyük önem kazanır. Antioksidanlar bu önemlerinden dolayı sentetik olarak üretilmiş ve özellikle yağ içeriği yüksek gıdaların raf ömrünün uzatılmasında kullanılmaktadır. Ancak son yıllarda yapılan araştırmalar sentetik antioksidanların başta karsinojenik etkileri olmak üzere insan sağlığı üzerine birçok olumsuz etkilere sahip oldukları rapor edilmiş ve bu sebepten dolayı sentetik antioksidanların yerine sağlık açısından güvenli doğal antioksidan kaynakları büyük önem taşımaktadır (Ito ve ark., 1986).
Diyette tüketilen yağ asitleri kardiovasküler hastalıklar, kanser, diabet ve dejeneratif hastalıkların gelişimine katkıda bulunan önemli bir faktör olabilmektedir (Connor, 2000; Tapiero ve ark., 2002). Bitkilerin yağ asidi bileşimi hayvansal yağlarda yüksek oranlarda bulunan doymuş yağlara nazaran daha yüksek oranda, tekli ve çoklu doymamış yağ asidi içermelerinden dolayı genellikle sağlıklı olarak kabul edilir. Özellikle, bitkisel kaynaklı yağların bileşiminde bol miktarda bulunan aşırı doymamış yağ asitleri ve bunların içerdiği ω3 ve ω6 yağ asitleri pek çok hastalığa neden olan olumsuz etkileri, önemli ölçüde önleyen ve sağlık üzerine olumlu etkilere sahip olan yağ asitleridir. ω6 yağ asitlerinin ana kaynağı özellikle linoleik asit içeren mısır ve soya fasulyesi yağları gibi bitkisel yağlardır (Kirshenbauer, 1960). Bu duruma bağlı olarak özellikle bitkilerin yağ asidi komposizyonun tespiti ve bu yağ asitlerinin yeni kaynaklarının belirlenmesine yönelik çalışmalar oldukça hız kazanmıştır.
Uçucu yağlar, aromatik bitkiler tarafından üretilen güçlü bir kokuyla karakterize olan doğal ve kompleks uçucu bileşenlerdir. Uçucu yağların tıbbi özelliklere ve güzel kokulu bileşenlere sahip olduğu bilinmektedir. Bütün bu özellikler sayesinde bitkiler doğada zararlılardan korunmayı, canlıları cezp etmeyi ve bu sayede polen ve tohumlarını yayarak nesillerinin devamlılığı konusunda tahmin edilenin de üstünde bir başarı sağlamaktadırlar (Bakkali ve ark., 2008). Bitki uçucu yağları antibakterial, antiviral, antifungal, anti-inflamatuvar ve antioksidan özellik gibi önemli biyolojik etkilere sahip olmalarından dolayı farmakolojik açıdan da önem taşımaktadırlar.
Fabaceae familyası ılıman, subtropik ve tropik bölgelerde geniş yayılış göstermektedir. Bu familyada yaklaşık 730 cins ve 19.400 tür bulunur ve çiçekli bitkilerin üçüncü büyük familyasıdır (Wojciechowski ve ark., 2004). Onobrychis tek yıllık veya çok yıllık, çoğunlukla otsu, bazen çalımsı bitkileri kapsar. Ülkemizde korunga bitkisi olarak bilinen Onobrychis önemli yem bitkilerindendir (Elçi 2005).
Onobrychis türleri Akdeniz Bölgesinden başlayıp Kafkasya ve Zagros Dağları hattı
rapor edilmiştir. Ülkemizde 42 türü bulunmakta olup özellikle, Orta ve Doğu Anadolu Bölgeleri ile geçit bölgelerinde yayılım göstermektedir (Aktoklu, 1995, Yıldız ve ark. 1999, Emre ve ark. 2007).
Bu Yüksek Lisans Tez çalışmasında, dünyada ve ülkemizde önemli bir bitki türü olan Onobrychis armena türünün yağ asidi kompozisyonu, uçucu yağ bileşimi ve antioksidan kapasitesi araştırılarak; gıda ve farmakoloji endüstrisi açısından bir hammadde kaynağı olup olmayacağının değerlendirilmesi amaçlanmıştır.
2. KAYNAK ARAġTIRMASI
2.1. Serbest Radikaller ve Antioksidanlar
Radikal terimi atomik veya moleküler yapıda eşlenmemiş elektron çiftlerini içeren moleküller veya atomlar olarak tanımlanmaktadır (Halliwell ve Gutteridge, 1999). Eşlenmemiş bu elektron çiftleri molekül veya atomun reaktif hale gelmesine neden olmaktadır. Canlı organizmalarda oksijenden türevlenen radikaller en önemli grubu oluştururlar. Solunum zincirinde son elektron alıcısı olan oksijenin tam indirgenememesi radikallerin esas kaynağını oluşturur (Miller ve ark., 1990). Oksijenin bir elektron alarak indirgenmesi ile süperoksit, iki elektron alarak indirgenmesi ile hidrojen peroksit, üç elektron alarak indirgenmesi ile hidroksil radikali meydana gelmektedir.
Şekil 2.1. Serbest oksijen radikalleri ve oluşumları
Serbest radikaller yüksek konsantrasyonlarda nükleik asitler, lipidler ve proteinlerde hasar meydana gelmesinde rol oynarlar (Valko ve ark., 2006). Örneğin, hidroksil radikali DNA ile etkileşmekte ve pürin, pirimidin bazlarının hasarı ile deoksiriboz iskelette zararlar meydana getirir. Oksidatif stres olarak tanımlanan bu durumda radikallerin aşırı üretimi kanser, kardiovasküler hastalıklar, yaşlanma gibi birçok kronik ve dejeneratif hastalığın gelişimine katkıda bulunmaktadır (Halliwell and Gutteridge, 1999).
Özellikle makromoleküller içerisinde bünyesinde aşırı doymamış yağ asitlerini içeren lipitler serbest radikallere karşı en hassas olan molekül grubudur (Siems ve ark., 1995). Lipid peroksidasyonun son ürünü olarak malondialdehit (MDA) meydana gelmektedir. Lipid peroksidasyonu sırasında meydana gelen major aldehit 4-hidroksinonenal meydana gelmektedir. MDA memeli hücrelerinde mutajenik ve karsinojenik etki göstermektedir.
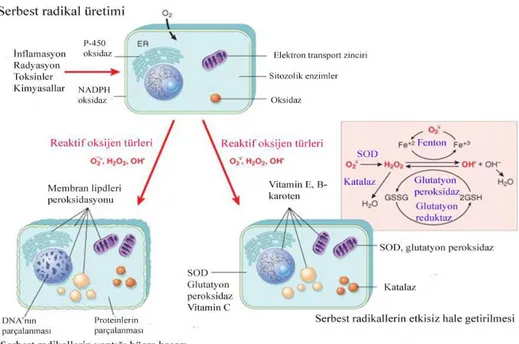
Serbest radikallerin meydana getirdiği bu zararlı etkilerinin ortadan kaldırılması için organizmada bir savunma sistemi gelişmiştir (Cadenas, 1997). Enzimlerin oluşturduğu bu sistemi süperoksit dismutaz (SOD), glutatyon peroksidaz (GPx) ve katalaz (CAT) meydana getirmektedir. Normal koşullarda bu enzimler ve serbest radikal üretimi arasındaki denge sağlıklı bir yaşamın sürdürülmesi açısından çok büyük öneme sahiptir. Ancak dış faktörlerin örneğin UV ışınlara maruz kalma, kirlilik ve sigara gibi çevresel faktörler ile radikal üretimi bu savunma sisteminin kapasitesini aşarsa bu durumda dietle antioksidanların alımı büyük önem kazanır (Valko ve ark., 2007).
Şekil 2.2. Radikallerin meydana getirdiği zarar ve etkisiz hale getirilmesi
Antioksidan moleküller serbest radikallere kıyasla düşük konstrasyonda bile serbest radikalleri etkisiz hale getirmektedirler (Halliwell ve ark., 1995; Huang ve ark.,
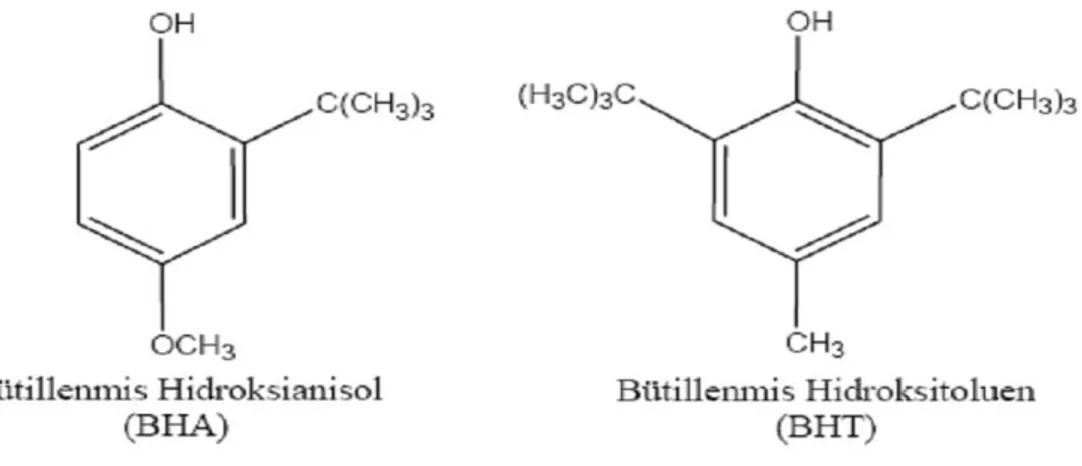
2005). Ayrıca antioksidan maddeler aşırı doymamış yağ asitlerinin oksidasyonunu engelledikleri için yağlı gıdaların raf ömrünün uzatılmasında sıklıkla kullanılmaktadır. Bu etkilerden ötürü gıdaların işlenmesi sırasında kullanılan birçok sentetik antioksidanlar üretilmiştir. Bunlardan en önemlileri BHA, BHT, PG ve TBHQ „dür.
Şekil 2.3. Sentetik antioksidanlar
Ancak yapılan birçok çalışmalar bu sentetik antioksidanların kullanımını şüpheli hale getirmektedir. Örneğin, bu antioksidanların kullanımlarının karsinojenik ve mutajenik olmak üzere sağlık üzerine olumsuz etkileri rapor edilmiştir (Ito ve ark., 1986). Bu nedenle sentetik antioksidanların yerine daha güvenli doğal antioksidanların kullanımı önemli hale gelmiştir ve bu nedenle doğal antioksidanların kaynaklarının belirlenmesi son zamanların en ilgi çekici konuları arasındadır. Doğal antioksidanların en önemli grubunu bitkisel fenolik bileşikler oluşturmaktadır. Yapılan araştırmalar fenolik bileşikler açısından zengin bitkilerin serbest radikallerin zararlı etkilerinin ortadan kaldırılmasında oldukça etkili oldukları belirtilmektedir.
2.2. Fenolik BileĢikler
Bitkisel sekonder metabolitleri içinde fenolik bileşikler çok sayıda biyolojik etkinliğe sahip olmalarından dolayı oldukça ilgi çekicidir. Bitkilerin bünyelerinde bilinen yaklaşık 5000 fenolik bileşik vardır. Fenolik bileşikler bir veya daha fazla hidroksil grubu içeren aromatik bir halkadan meydana gelmiştir (Balasundram ve ark., 2006). Fenolik bileşiklerin antioksidan özellikleri genellikle hidroksil radikalinin sayısı ve konumundan ayrıca yapılarındaki çift bağlardan kaynaklanmaktadır (Rice-Evans ve Miller, 1998). Bu bileşikler indirgeme ajanları, hidrojen verici, singlet oksijen süpürücüleri ve metal şelatlayıcıları olarak faaliyet gösterirler (Rice-Evans ve ark., 1995).
Fenolik bileşiklerin içinde esas grubu düşük molekül ağırlıklı flavonoidler meydana getirirler. Flavonoidler; flavonlar, flavonollar, flavononlar, isoflavonlar, flavanollar ve antosiyaninler olmak üzere altı gruba ayrılmaktadır (Stewart ve ark., 2000).
Şekil 2.4. Flavonoid grupları
Fenolik maddeler günümüzde insan için esansiyel olmayan bileşikler olmakla birlikte sağlık üzerine çok sayıda olumlu etkileri bilinmektedir. Yapılan birçok çalışmalarda flavonoidlerin anti-inflamatuvar, antiallerjik, antimikrobial, hepatoprotektif, antiviral, antimutajenik, antikarsinojenik özellikleri başta olmak üzere çok sayıda özellikleri rapor edilmiştir. Yapılan çalışmalarda flavonoidlerin güçlü hidroksil ve peroksil süpürücü özellikleri rapor edilmiştir. Epidemiyolojik çalışmalar fenolik antioksidanların tüketimi ile kardiovasküler hastalıklara ve kansere yakalanma riskinin azalması arasında bir korrelasyonu göstermektedir. Özellikle flavonoidler LDL oksidasyonun güçlü bir inhibitörüdür. Buna ilaveten antitrombotik, vazoprotektif ve hypolipidemik etkiler sergilemektedir (Fuhrman ve ark., 1995).
Polifenollerin farklı tipleri aynı zamanda antikarsinojenik etkilere sahiptir. Polifenoller kötü huylu tümorlerin gelişiminde çeşitli aşamalarına katılarak, oksidatif hasardan DNA‟yı korur, karsinojenleri inaktif hale getirir ve mutant genlerin ekspresyonunu inhibe eder. Aynı çalışmada, 24 farklı enzim veya enzim sisteminde flavon ve flavonollerin inhibe edici etkisini araştırmıştır. Bu enzimlerden bazıları hücre çoğalması, plak agregasyon, iltihaplanma ve bağışıklığı düzenleyen önemli metabolik
yollara katılmaktadır. Bu nedenle de flavonoidlerin etkilerinin, bağışıklık sisteminde, kanserin farklı basamaklarında, hücre sisteminde bulunması şaşırtıcı değildir. Bu durumla bağlantılı olarak diette günlük 1 g flavonoid karışımının bulunması sağlık açısından faydalı kabul edilir (Kandaswami ve Middleton, 1994). Flavonoidlerin in vitro çalışmalarda memelilerde hücre bölünmesi, detoksifikasyon ve inflamatuvar cevapta rol oynayan enzimleri stimule ettiği bu nedenle flavonoidlerin kanser gelişimi, hemostaz ve immun sisteme olan etkilerinin beklenen bir durum olduğu belirtilmiştir (Nijveldt ve ark., 2001).
Şekil 2.5. Gıdalarda yaygın olarak bulunan fenolik bileşikler
2.3. Bitkisel Yağlar
Canlının hayatını sürdürebilmesi için, karbohidrat, protein ve yağlar organizmada yapının teşekkülü ile enerji eldesinde kullanılan biyomoleküllerdir. Yağlar
doğal olarak meydana gelen ve lipit adı verilen bir gruba ait bir organik bileşiktir. Bunlar suda çözünmezler ancak eter, kloroform, benzen gibi organik çözücülerde çözünürler (Fox ve Cameron 1984).
Yağı meydana getiren temel öğeler, gliserol (gliserin) ve yağ asitleridir. Bu öğelerden gliserol her zaman aynı özellikte olduğu için, bir yağın özellikleri yağ asitlerine bağlı olarak değişiklik gösterir. Yağ asidi, karboksil grubu (-COOH) ihtiva eden düz bir hidrokarbon zincirinden meydana gelmiştir. Yağ asitleri hidrokarbon zincirini meydana getiren karbon atomların sayılarına, karbon atomları arasında doymamış bağ bulunup bulunmamasına, doymamış bağ varsa yeri ve sayısı gibi özellikler açısından birbirlerinden farklıdırlar.
Yağ asitleri genel olarak doymuş ve doymamış yağ asitleri olmak üzere iki şekilde gruplandırılmaktadır (Şekil 2.7).
DoymuĢ yağ asitleri: Karbon atomları arasında tek bağdan oluşan hidrokarbon
zincirine sahiptirler ve genellikle bunlar, katı yağ asitleridir. Bitkisel yağların önemli doymuş yağ asitleri Laurik asit (C 12:0), miristik asit (C 14:0), palmitik asit (C 16:0) ve stearik asit (C 18:0)‟ tir.
DoymamıĢ yağ asitleri: Hidrokarbon zinciri üzerinde karbon atomları arasında
bir veya daha fazla sayıda çift bağ içeren yağ asitleridir. Bu yağ asitleri yapısında bulunan çift bağın sayısına bağlı olarak ikiye ayrılır. Yapılarında bir çift bağ içeren doymamış yağ asitlerine tekli doymamış yağ asitleri veya monoenoik yağ asitleri adı verilir. Zeytin, kolza, kabuklu yemişlerin yağları tekli doymamış yağ asitlerince zengindir. Yapısında birden fazla sayıda çift bağ ihtiva eden doymamış yağ asitleri ise çoklu doymamış yağ asitleri veya polienoik yağ asitleri şeklinde adlandırılmaktadır. Bu gruba giren linoleik asit (C 18:2 ω6), linolenik asit (C 18:3 ω3), araşidonik asit (C 20:4 ω6) esansiyel yağ asitleri şeklinde nitelendirilmekte ve insanlar tarafından sentezlenmediği için mutlaka dışarıdan gıdalar ile alınması gerekmektedir.
Şekil 2.6. Doymuş ve doymamış yağ asitlerinin yapıları
Lipid molekülündeki yağ asitlerinin tipi ve miktarı, bu yağ asitlerinin dağılımı ve pozisyonu onun fiziksel, kimyasal ve fonksiyonel özelliklerini belirler. Bu nedenle yağ asidi kompozisyonunun bilinmesi yeni fonskiyonel gıdaların geliştirilmesine yardımcı olabilecektir.
Bugün klinik ve epidemiyolojik çalışmalar birçok kronik hastalığın diyetteki yağ asidi tipine bağlı olduğunu göstermiştir (WHO 2003). Örneğin ω3 yağ asitlerinin alınımının kanser, kalp hastalıkları, hipertansiyon gibi birçok sağlık probleminin önlenmesine yardımcı bir unsur olarak kabul edilmektedir. ω3 yağ asitleri balık yağlarının karakteristik yağ asitleri olup büyüme ve gelişmede, beyin gelişiminde, kardiovasküler hastalıkların önlenmesinde büyük öneme sahiptirler. Balıklar ve diğer deniz ürünleri bu yağ asitlerinin önemli kaynakları olmasına rağmen diğer kaynakların bulunması da oldukça dikkat çekicidir (Friedmann ve ark. 2006). Yine bitkisel yağların bünyesinde fazla oranda bulunan doymamış yağ asitlerinin tüketiminin artışı ile doymuş yağ asitlerin azaltılması ile sağlık arasında pozitif bir bağıntı vardır (Lemaitre ve ark. 2006). Bu durumdan ötürü bitkisel yağlar veya bitkilerin yağ asidi komposizyonları sağlıklı olarak kabul edilir (Stoll 1999). Son zamanlarda özellikle bitkilerin yağ asidi komposizyonun tespitine yönelik çalışmalar oldukça hız kazanmıştır. Bitkilerinin yağ asitleri kompozisyonunun da sabit olmayıp; genetik, ekolojik, morfolojik, fizyolojik ve
kültürel faktörlere bağlı olarak değiştiği yapılan çalışmalarla ortaya konulmuştur (Baydar 2000). Bitkilerdeki yağ asitlerindeki çeşitlilik besinsel, endüstriyel ve farmakolojik amaçlarla kullanılmasına ek olarak taksonomik ve filogenetik çalışmalarda kullanışlı bir araç haline gelmiştir (Vickery, 1971).
2.4. Uçucu Yağlar
Uçucu yağlar bitkilerden elde edilen sıvı ve kolayca buharlaşabilen, karakteristik kokulu, aromatik, keskin veya acı lezzetli karışımlardır Açıkta bırakıldıklarında oda sıcaklığında bile buharlaşabildiklerinden „uçucu yağ‟, „eterik yağ‟ veya „esans‟ olarak da adlandırılırlar. Uçucu yağlar, özellikle yaprak, çiçek ve meyvelerde bulunan, pek çok hücre grubu ve özel hücrelerde oluşan, bitkilerin ikincil metabolizma ürünleridir. Uçucu yağlar sahip oldukları biyolojik özellikleri birçok alanda ilgi odağı olan doğal bitkisel ürünlerdir. Bugüne kadar uçucu yağlarda 2000‟den fazla kimyasal bileşenlerin bulunduğu gösterilmiştir ki, bunların en önemlileri temelde monoterpenoidler, seskiterpenoidler, benzoidler ve fenilpropanoidlerin karışımı şeklindedir. Bitki uçucu yağları bitkiler içinde oldukça önemli rollere sahiptir. Bu roller yaralanmalara karşı antiseptik özellik sergileme, böceklere karşı koruyucu veya cezbedici etkisiyle tozlaşmaya yardımcı olmak gibi sıralanabilir.
Bitki uçucu yağları uzun yıllardan beri değişik amaçlara yönelik, özellikle bilimsel ve ticari olarak birçok alanda kullanılmaktadır. Bu kullanım alanlarının başında kozmetik, ilaç, gıda sanayi, aromaterapi ve fitoterapi gelmektedir. Uçucu yağlar geniş bir kullanım alanına sahip olduğu için son zamanlarda birçok bilim adamının ilgisini çekmiş ve bu uçucu yağların kimyasal yapıları incelenmiş biyolojik aktiviteleri merak konusu olmuştur. Bitkiler açısından oldukça önemli rollere sahip olan uçucu yağların farmakolojik olarak da etkin rollere sahip olduğu belirtilmektedir. Bu özellikleri başında antikanser, antimikrobial, antioksidan ve antiinflamatuvar etkileri rapor edilmiştir. Yapılan birçok çalışmada bitkilerden çeşitli şekillerde elde edilen uçucu yağların sentetik antioksidanlardan daha yüksek antioksidan kapasiteye sahip oldukları ve doğal antioksidanların bir kaynağı olabilecekleri belirtilmiştir. Bununla ilişkili olarak bazı uçucu yağlarının tedavi edici etkilerinin olduğu tespit edilmiştir (Dorman ve Deans, 2000). Bu nedenle uçucu yağlar fitoterapinin temel elemanları olarak kabul edilmektedir. Özellikle Thymus ve Salvia türleri başta olmak üzere özellikle Lamiaceae türleri uçucu yağ bakımından zengindirler.
Şekil 2.7. Uçucu yağların bileşiminde bulunan temel terpenler
Uçucu yağ buharlaşmaya karşı koruma özelliğinden dolayı uçucu yağ bitkileri başta tropik ve subtropik bölgelerde lokalize olmuştur. Ülkemizde ise iklim özelliklerinden dolayı Akdeniz fitocoğrafik bölgesi uçucu yağ bitkilerini bünyesinde fazla oranda ihtiva etmektedir. Ülkemiz bünyesinde bulundurduğu uçucu yağ bitkileri ile oldukça ilgi çeken bir cazibe merkezi konumundadır. Bu durum yeni uçucu yağ bitkilerinin belirlenmesi, uçucu yağ bileşenlerinin ortaya çıkarılması başta tıp ve gıda endüstrisi olmak üzere birçok alan için yeni hammaddelerin ortaya çıkarılmasını sağlayacaktır.
2.5.Fabaceae Familyası ve Onobrychis Cinsi
Fabaceae, (Leguminosae: Baklagiller) çiçekli bitkilerin üçüncü büyük familyasıdır. Fabaceae familyası tüm dünyada 269 cinse ait 5100 tür ile geniş yayılış gösteren bir familyadır (Mabberley, 1997). Bu familya Türkiye Florasında, 69 cins ve 1000‟den fazla türle temsil edilmektedir (Davis ve ark., 1988; Seçmen ve ark., 1989).
Fabaceae familyasının biyoçeşitliliğinin yanında insan ve hayvan beslenmesi, süs ve tıbbi özelliğe sahip çeşitli türleri bünyesinde bulundurması bakımından da oldukça önemlidir. Bu familyanın önemli bir cinsi olan Onobrychis dünyada 342, Türkiyede ise 42 türle temsil edilmektedir (Aktoklu, 1995, Avcı ve ark., 2010). Onobrychis cinsinin geçerli adı ilk kez Miller tarafından verilmiştir. Bu tarihten önce Linne (1753) bu cinse ait türleri Hedysarum cinsi içerisinde vermiştir. Sonradan bu türler Onobrychis cinsine aktarılmıştır. Türkiye türleri ile ilgili ilk ayrıntılı çalışma ve toplu bilgiler, birçok türü de bizzat kendisi tanımlayan Boissier‟in (1872) Flora Orientalis adlı eserinde yer almıştır. Bu eser, Davis‟in editörlüğünü yaptığı Türkiye Florası‟nın tamamlanmasına kadar Türkiye bitkileri için en kapsamlı Flora ve en önemli kaynak olarak yer almıştır.
Onobrychis cinsi tek yıllık veya çok yıllık otsu yapıda olmakla birlikte, nadiren
de dikenli yarı çalılardır. Genellikle tabanda odunlaşmış veya kalın toprakaltı gövdelidir. Gövdesi genellikle kıvrık ve belirgin açık yeşil çizgili ve basit tüylü ya da tüysüzdür. Stipülleri (kulakçıklar) serbest veya birleşik olup, genellikle tabandakiler uzun saplı, üsttekiler ise kısa saplı veya nadiren sapsızdır (Akçelik, 2009).
Onobrychis, kireçli ve kurak toprakların değerlendirilmesi için önemli bir yem
bitkisidir. Suyun problem olduğu birçok iklim ve toprak şartlarında yetişebildiği için ekim nöbeti planlamasında önemli bir yeri vardır. En önemli toprak ıslahı bitkilerinden birisidir. Soğuğa çok dayanıklıdır (Elçi 2005, Tan ve Sancak 2009). Ayrıca bol miktarda bal özü ve çiçek tozu verdiğinden aynı zamanda iyi bir arı merasıdır (Dubbs 1968).
3. MATERYAL VE YÖNTEM
3.1. ÇalıĢmada Kullanılan Onobrcyhis armena taksonu
Çalışma materyali olan O. armena Konya ili sınırları içinde bulunan Yükselen ve Kestel köyleri arasındaki lokaliteden çiçeklenme döneminde toplanmıştır. Bitkiye ait fotoğraflar ve bitkinin Türkiye‟deki yayılışı Şekil 3.1 ve 3.2‟de verilmiştir.
Tablo 3.1. O. armena hakkında bilgiler
Ömür Çok yıllık
Yapı Ot
Çiçeklenme Mayıs-Ağustos
Habitat Kayalık, bilhassa kireçtaşı, yamaçlar, yolkenarları, maki, meşe çalılık
Yükseklik 100-2000 m
Endemik Endemik değil
Türkiye dağılımı Güney Doğu Anadolu hariç tüm Türkiye
Şekil 3.2. O. armena‟nın Türkiye‟deki yayılışı
3.2. Bitkisel Ekstrakların Hazırlanması
Bitki örnekleri toplanıp gölgede kurutulduktan sonra değirmende iyice toz haline getirildi. Toz haline gelen örneklerden yaklaşık 15 g tartılıp sokslet aparatında 6-8 saat süreyle etilaseat ve metanol ile ayrı ayrı ekstraksiyona tabii tutuldu. Bu süre sonunda ele geçen karışım Whatman kağıdı ile süzüldü. Daha sonra rotary evaporatorde 40°C‟de çözücüler tamamen buharlaştırıldı. Ele geçen kuru özütler analiz edilinceye kadar +4°C‟de saklandı. Su özütü elde etmek için 15 gr kuru bitki materyali 250 ml suyla 30 dakika boyunca kaynatıldı. Su özütü de aynı şekilde süzüldükten sonra donduruldu ve suyunun tamamen uzaklaştırılması için liyofilize edildi. Liyofilize edilmiş kuru bitkisel drog analize kadar +4°C‟de saklandı.
3.3. Antioksidan Kapasite Tayin Testleri
3.3.1. Toplam Fenolik Madde Tayini (Folin Yöntemi)
Bitki ekstraktlarının konsantrasyonu 2 mg/ml olacak şekilde hazırlandı. Bitkisel drogların her bir konsantrasyonundan 200 µl ayrı deney tüplerine alındı. Daha sonra her bir tüpe 1.5 ml su ve 100 µl Folin-Ciocalteu reaktifi ilave edildi. Ardından her bir tüpe 500 µl %2‟lik Na2CO3 çözeltisinden eklendi. Karışımlar oda sıcaklığında karanlıkta 2 saat bekletildikten sonra 765 nm‟de absorbansları ölçüldü. Tüm antioksidan kapasite tayin testlerinde spektrofotometrik ölçümler Shimadzu UV-1800 spektrofotometre cihazı kullanılarak gerçekleştirildi. Aynı işlemler standart olarak kullanılan gallik asit için de tekrarlandı. Bitkilerin fenolik madde içeriği gallik asit eş değeri (mg GAE/g) olarak verildi (Singleton ve Rossi, 1965).
3.3.2. Toplam Flavonoid Madde Tayini
Bitki ekstraktlarındaki toplam flavonoid içeriği spektrofotometrik olarak belirlenmiştir. Buna göre %2‟lik AlCl3‟ün metanolik çözeltisinden 1 ml alınarak aynı hacimde ve 2 mg/ml konsantrasyondaki bitki ekstraktı ile karıştırıldı. 10 dakika bekledikten sonra 415 nm‟de karışımın köre karşı absorbansı belirlendi. Aynı işlemler standart flavonoid olan rutin için de yapılarak rutine ait kalibrasyon eğrisi çizildi. Sonuçta ekstraktların toplam flavonoid madde içerikleri rutin eş değer (mg RE/g) olarak verildi.
3.3.3. Toplam Antioksidan Kapasitenin Belirlenmesi
Metodun esası Mo(VI)‟nın Mo(V)‟e indirgenmesi ve asidik ortamda yeşil renkli fosfat/Mo(V) kompleksinin oluşumuna dayanır. Metotta öncelikle bitki ekstraktlarının konsantrasyonları 2 mg/ml olacak şekilde çözeltileri hazırlandı. Metotta kullanılacak reaktif çözeltisi aşağıdaki gibi hazırlandı:
0.6 M H2SO4 çözeltisi: 0.83175 ml H2SO4 alınır ve 24.18825 ml saf su üzerine sızdırılarak ilave edildi.
28 mM Na2HPO4.12H2O çözeltisi: 0.025 gr Na2HPO4.12H2O tartılıp hacmi saf su ile 25 ml‟ye tamamlandı.
4 mM Amonyum molibdat çözeltisi: 0.123585 gr amonyum molibdat tartılıp
hacmi saf su ile 25 ml‟ye tamamlandı.
Bu şekilde hazırlanan çözeltiler bir mezürde karıştırılarak reaktif çözeltisi hazırlandı. 1 mg/ml konsantrasyonunda bitkisel çözeltilerden 0.3 ml bir tüpe alındı ve bunun üzerine reaktif çözeltisinden 3 ml eklendi. Tüpler kuvvetlice karıştırılıp 95 °C‟de 90 dakika inkübe edildi. İnkübasyon sonunda çözeltilerin absorbansı 695 nm‟de okundu. Aynı işlemler standart antioksidan olarak kullanılan askorbik asit için de yapıldı. Antioksidan aktivite askorbik asit eşdeğeri (mg AE/g) olarak hesaplandı (Prieto ve ark., 1999).
3.3.4. β-karoten/Linoleik Asit Emülsiyon Sistemi
Metotta öncelikle emülsiyon çözeltisi hazırlandı. Bunun için 1 mg β-karoten 2 ml kloroformda çözüldü. Bu karışıma 50 µl linoleik asit ve 200 mg Tween 40 eklendi. Karışım iyice karıştırıldı. Kloroform rotary evaporatörde 40 °C‟de iyice uçuruldu. Kalan kısım üzerine 200 ml saf su eklendi. Böylece emülsiyon çözeltisi hazırlanmış oldu.
2 mg/ml konsantrasyonundaki bitkisel droglar ve standart maddelerden 350 µl alındı ve bunların üzerine 2.5 ml emülsiyon çözeltisinden ilave edildi. Emülsiyon çözeltisi eklenir eklenmez absorbansları 490 nm‟de okundu. Daha sonra tüpler 50 °C‟de 120 dakika inkübe edildi. Ayrıca bitkisel materyalin yerine 350 µl metanol eklenip bunun üzerine de 2.5 ml emülsiyon çözeltisi ilave edilerek kontrol çözeltisi hazırlandı. Kontrol çözeltisinin absorbansı da emülsiyon çözeltisi eklenir eklenmez okundu ve aynı şekilde 50 °C‟de 120 dakika inkübe edildi (Sokmen ve ark., 2004).
R= ln(A/B)/t A: Başlangıç absorbansı
B: 120 dakika sonundaki absorbansı t: 120 dakika
Bu eşitlikten inhibisyon değeri yani antioksidan aktivite hesaplandı. İnhibisyon değeri= ((Rkontrol-Rörnek)/ Rkontrol)x100
3.3.5. DPPH Süpürme Etkinliği
Bitkisel drogların farklı konsantrasyonlarda (0.125-1 mg/ml) çözeltileri hazırlandı. DPPH çözeltisi ise 0.4 mM konsantrasyonda hazırlandı. Farklı konsantrasyonlardaki bu bitkisel çözeltilerden 1 ml alınıp bunun üzerine DPPH çözeltisinden 1 ml ilave edildi. Tüpler ağızları kapatılıp kuvvetlice karıştırıldıktan sonra oda sıcaklığında karanlıkta 30 dakika bekletildi. Bu süre sonunda absorbanslar 517 nm‟de okundu (Sarikurkcu ve ark., 2009).
Bitkisel çözeltilerin ve standart maddelerin inhibisyonu aşağıdaki denklemden hesaplandı:
İnhibisyon(%)=((Akontrol-Aörnek)/Akontrol)x100
3.3.6. Demir Ġndirgeme Gücü
Bu metotta bitkisel ekstraktların 0.2 ile 2 mg/ml konsantrasyonları kullanıldı. Farklı konsantrasyonlardaki bitkisel çözeltilerden 2.5 ml alındı. Bunun üzerine 0.2 M pH 6.6 2.5 ml fosfat tamponu ve %1‟lik 2.5 ml potasyum ferrisiyanür eklendi. Tüpler 50 °C‟de 20 dakika inkübasyona bırakıldı. İnkübasyon sonrası tüplerin üzerine 2.5 ml %10‟luk TCA ilave edildi. Tüpler iyice karıştırıldıktan sonra üst kısımlarından 2.5 ml başka bir tüpe aktarıldı. Bu tüpün üzerine de 2.5 ml saf su ve 0.5 ml %0.1‟lik FeCl3 çözeltisi eklendi. Çözeltilerin absorbansları 700 nm‟de okundu (Oyaizu, 1986). Absorbans arttıkça indirgeme gücü de artış göstermektedir.
3.3.7. Cuprac Metodu
10-2 M Cu(II) klorür çözeltisi: CuCl2.2H2O‟den 0.4262 g tartılarak su ile 250 ml‟ye tamamlanarak hazırlandı.
Amonyum asetat tamponu: 1 M (pH=7). NH4Ac‟dan 19.27 g tartılarak su ile
250 ml‟ye tamamlanarak hazırlandı.
Neokuproin çözeltisi: 7.5x10-3
M, Neokuproin (2,9 dimethyl 1-10 phenantroline)‟den 0.039 g tartılarak %96‟lık etil alkolle 25 ml‟ye tamamlanarak hazırlandı.
Bitki ekstraktlarının 0.2 ile 2 mg/ml arasındaki farklı konsantrasyonları kullanıldı. Metotta öncelikle her bir deney tüpüne 1 ml CuCl2.2H2O, 1 ml amonyum asetat, 1 ml neokuproin çözeltileri ile 0.6 ml saf su eklenir. Daha sonra her bir tüpe bitkisel çözeltilerden 0.5 ml eklenip iyice karıştırıldı. Tüpler ağızları kapalı bir biçimde oda sıcaklığında karanlıkta 30 dakika bekletildi. Bu süre sonunda absorbansları 450 nm‟de okundu (Apak ve ark., 2006).
3.4. Bitkilerin Yağ Asidi Komposizyonlarının Belirlenmesi
3.4.1. Bitkilerden Yağın Ekstrakte Edilmesi
Öğütülmüş ve toz haline getirilmiş 10 g bitkisel materyal öncelikle sokslet aparatında 6-8 saat petrol eteri ile ekstraksiyona tabii tutuldu. Ekstraksiyon sonunda çözücünün evaporatörde uçurulmasından sonra kalan kısım yağ asidi analizlerinde kullanıldı.
3.4.2. Yağ Asitlerinin Metil Esterlerinin Hazırlanması
Yağ örneklerinden 0.1-0.2 g kadar balonlara aktarıldı. Yağ örneklerinin üzerlerine 4 ml %2‟lik NaOH çözeltisinden eklenerek sabunlaşmanın gerçekleşmesi için 10 dakika kaynatıldı. Sabunlaşma tamamlandıktan sonra 5 ml %14 BF3-metanol kompleksi eklendi ve 5 dakika kaynatıldı. Daha sonra karışım üzerine 2 ml n-heptan eklendi ve bir dakika kaynamaya bırakıldı. Kaynama tamamlandıktan sonra 4 ml doymuş NaCl çözeltisinden eklendi. Balonlar iyice karıştırıldıktan sonra faz ayrımı için
ayırma hunilerine aktarıldı ve 5-10 dakika beklendi. Bu süre sonunda alttaki sulu kısım atıldıktan sonra üstteki sarı renkli faz viallere aktarılarak analiz edilinceye kadar -20 °C‟de saklandı (IUPAC, 1979).
3.4.3. Numunelerin Gaz Kromatografi Cihazında Yağ Asidi Analiz KoĢulları
Gaz kromatografik analizler HP (Hewlett Packard) Agilent marka 6890 N model FID (Flame Ionization Detector: Alev iyonlaştırma dedektörü) dedektörlü ve otomatik injektörlü gaz kromatograf ile gerçekleştirildi. Analizlerde 100 metrelik HP-88 kapiller kolon kullanıldı. Gaz kromatografta injektör bloğu sıcaklığı 240 °C, dedektör bloğu sıcaklığı ise 250 °C olarak ayarlandı. Kolona sıcaklık programı uygulandı. Kolonun başlangıç sıcaklığı 60 °C olarak ayarlandı. Bu sıcaklıkta 1 dakika bekletildi daha sonra dakikada 20 °C artarak 190 °C„ye ulaşıldı. Bu sıcaklıkta 60 dakika bekletildi ve daha sonra dakikada 1 °C artarak 220 °C „ye ulaşıldı ve bu sıcaklıkta 10 dakika bekletildi. Sonuçta analizler 107 dakikada tamamlandı. Gaz kromatografın gaz akış hızları hidrojen: 30 ml/dk, kuru hava: 300 ml/dk ve taşıyıcı gaz olarak kullanılan helyum: 1 ml/dk olarak ayarlandı.
Yağ asiti metil esterleri standartları Alltech ve Accu firmalarından elde edildi. Standartların bağıl alıkonma zamanları (relative retantion time) gaz kromatografi cihazında aynı koşullarda analizlenerek belirlendi. Böylece elde edilen standartların bağıl alıkonma zamanları yardımı ile kromatogramlardaki piklere karşılık gelen yağ asitleri belirlendi. Üç tekrarlı olarak elde edilen kromatogramlardaki piklerin yüzde alanlarının aritmetik ortalamaları ve standart sapmaları hesaplanarak verildi.
Ayrıca yağın besinsel kalitesini değerlendirmek amacıyla Aterojenik indeks (AI) ve trombojenik indeks (TI) değerleri aşağıda verilen eşitliklerle hesaplandı (Ulbricht ve Southgate, 1991).
AI = [12:0+(4 x14:0)+16:0]/[(ω6+ω3) PUFA+18:1+diğer MUFA]
TI = [14:0+16:0+18:0]/[0.5x18:1+0.5xdiğer MUFA+0.5xω6 PUFA+3xω3 PUFA+(ω3 PUFA/ω6 PUFA)].
3.4.4. Bitkilerden Uçucu Yağın Ekstrakte Edilmesi ve Analiz ġartları
Uçucu yağ incelemesi yapılacak örnekler kaba bir şekilde öğütülerek clevenger aparatı ile su distilasyonuna tabi tutuldu. Elde edilen ekstraktlar HP Agilent 7890A Gaz Kromatografisinde Agilent 5975C MS dedektörü ve HP Innowax kolonu kullanılarak yapıldı. Uçucu yağ bileşenlerinin tanımlanmasında Wiley ve Nist kütüphaneleri kullanıldı. Uçucu yağ bileşimi analizlerinde kolona sıcaklık programı uygulandı.
Analizlerde taşıyıcı gaz olarak He kullanıldı ve akış hızı 1.2 ml/dk olarak ayarlandı. Kolonun başlangıç sıcaklığı 60 °C olarak belirlendi ve bu sıcaklıkta 10 dakika bekletildi. Daha sonra dakikada 4 °C artırılarak 220 °C‟ye ulaşıldı. Bu sıcaklıkta 10 dakika bekletildikten sonra dakikada 1 °C artırılarak 240 °C‟ye ulaşıldı. Son olarak bu sıcaklıkta 30 dakika tutuldu. Böylece toplam analiz süresi 110 dakika olarak belirlendi. Enjektör bloğunun sıcaklığı 240 °C olarak ayarlandı. Kütle spektroları 70 eV‟da kaydedildi.
4. ARAġTIRMA SONUÇLARI VE TARTIġMA 4.1. Toplam Fenolik ve Flavonoid Ġçeriği
Fenolik bileşiklerin sağlık üzerine olan çok sayıdaki olumlu etkileri son zamanlarda bilim dünyasının bu bileşiklere yönelmesine yol açmıştır. Bitkilerin toplam fenolik içeriklerinin belirlenmesinde gallik asit veya pirokatekol gibi bir standart fenolik madde kullanılmaktadır. Fenolik içeriğin belirlenmesinde basitliği ve özel bir ekipman gerektirmemesinden dolayı Folin Yöntemi yaygın olarak kullanılmaktadır. Onobrychis
armena ekstraklarının fenolik içerikleri gallik asit standart kullanılarak hesaplandı. Bu
amaçla gallik asidin çeşitli konsantrasyonlarına karşılık gelen absorbanları içeren bir kalibrasyon eğrisi çizildi (Şekil 4.1). Onobrychis armena‟nın etilasetat, metanol ve su özütlerinin toplam fenolik ve flavonoid içerikleri Tablo 1‟de verilmiştir. Özütler arasında fenolik içerik en fazla metanol özütünde gözlenmiştir. Metanol özütününde 62.199 mgGAE/g fenolik madde bulunmuştur. Metanol özütünü içerik bakımından su ve etilasetat takip etmektedir. Godevac ve ark (2008)‟de dokuz Fabaceae üyesinin antioksidan özelliklerini araştırdıkları çalışmada O. scardica metanol özütünde fenolik içeriği O. armena‟dan daha yüksek (115.23 mgGAE/g) olarak belirlemişlerdir. Bununla birlikte, Astragalus glycyphyllos (44.6 mgGAE/g) ve Coronilla emerus (38 mgGAE/g) ekstakları ise O. armena‟dan daha düşük fenolik içeriğe sahiplerdir. Aynı çalışmada en yüksek fenolik içerik Lathryus binatus ekstaktında 180.88 mgGAE/g olarak rapor edilmiştir. Genista vuralii ve G. sandrasica‟nın antioksidan özellikleri üzerine yapılan çalışmada Genista türlerinin fenolik içeriklerinin (G. vuralii: 212.24 mgGAE/g; G.
sandrasica: 166.94 mgGAE/g) oldukça yüksek olduğu belirtilmiştir (Orhan et al.,
2011). Benzer şekilde Fabaceae üyesi olan Vicia sativa ssp. nigra var. nigra‟nın toplam fenolik içeriği O. armena‟ya kıyasla daha yüksek 97.8 mgGAE/g olarak rapor edilmiştir (Orhan ve ark., 2009). Flavonoidler, fenolik bileşiklerin en geniş ve önemli grubunu oluşturmaktadırlar. O. armena‟nın flavonoid içerikleri rutin eş değer olarak hesaplandı (Şekil 4.2). Flavonoid içerik bakımından da en zengin ekstrakt 32.589 mgRE/g içerik ile metanol ekstraktıdır. Genista türlerinin toplam flavonoid içeriği G.vuralii‟de 203.82 mgQE/g ve G. sandrasica‟da 158.06 mgQE/g olarak O. armena‟dan daha yüksek seviyelerdedir. Hayet ve ark. (2008) Fabaceae üyesi olan Retama raetam‟ın biyolojik aktiviteleri üzerine yaptıkları çalışmada etilasetat ve metanol ekstraklarının flavonoid içeriklerini sırasıyla 53.81 ve 41.58 mgCAE/g olarak tespit etmişlerdir.
Şekil 4.1. Gallik asidin kalibrasyon eğrisi
Şekil 4.2. Rutinin kalibrasyon eğrisi
4.2. Toplam Antioksidan Kapasite (Fosfomolibdat Testi)
Fosfomolibdat testi, asidik ortamda antioksidan bileşiklerin Mo(VI)‟yi, Mo(V)‟ e indirgemesine ve oluşan fosfat/Mo(V) kompleksinin spektrofotometrik olarak ölçümüne dayanmaktadır. Çeşitli çalışmalarda metodun sonuçları ile fenolik içerik arasında herhangi korelasyon olmadığı rapor edilmesine rağmen metot basitliği ve kullanılan reaktiflerinin ucuzluğundan dolayı antioksidan kapasitenin değerlendirilmesinde son yıllarda sıklıkla kullanılan metotlardan biri konumundadır.
Metodun sonuçları standart bir antioksidan ve genellikle de askorbik asit kullanılarak verilmektedir. Bu amaç için askorbik asidin konsantrasyon ve absorbans değerlerini içeren bir kalibrasyon eğrisi çizildi (Şekil 4.3). Bu testin sonuçlarına göre metanol ekstraktı en yüksek etkinliğe sahiptir (103.118 mgAE/g). Bu ekstraktı sırasıyla etilasetat (38.933 mgAE/g) ve su (35.562 mgAE/g) özütleri takip etmektedir (Tablo 1).
Şekil 4.3. Askorbik asidin kalibrasyon eğrisi
Tablo 4.1. O. armena ekstraklarının toplam fenolik, flavonoid içerikleri ve toplam antioksidan kapasitesi
Etilasetat Metanol Su
Toplam Fenolik (mgGAE/g) 18.323±0.852 62.199±0.001 34.689±1.136
Toplam Flavonoid (mgRE/g) 16.846±0.061 32.589±0.465 20.046±0.141
Toplam Antioksidan (mgAE/g) 38.933±0.596 103.118±0.795 35.562±1.390
Şekil 4.4. O. armena ekstraklarının fenolik, flavonoid ve toplam antioksidan içeriklerinin karşılaştırılması
4.3. DPPH Serbest Radikal Giderim Yöntemi
Kararlı bir radikal olan DPPH antioksidan kapasite tayininde en sık kullanılan radikaldir. DPPH antioksidanlarla reaksiyonu sonucunda antioksidanlardan elektron alırlar ve renk açılması meydana geldiği için absorbansda düşmeler meydana gelir. Absorbansın düşük olması karışımın radikal giderim aktivitesinin yüksekliğini göstermektedir. O. armena ekstraklarının serbest radikal giderim aktivitesinin derişime bağlı olarak değişimi Tablo 4.2‟de sunulmuştur. Bu sonuçlara göre ekstraklar içinde radikal süpürme etkinliği en yüksek olan metanolik özüttür. Su ve metanol özütleri nispeten benzer etkinlik sergilemesine rağmen etilasetat özütünün aktivitesi çok düşüktür (Şekil 4.5). Bununla birlikte sentetik antioksidanlar olan BHA ve BHT‟nin serbest radikal süpürme etkinlikleri düşük konsantrasyonlarda olmalarına rağmen özütlerden oldukça yüksektir.
Vicia sativa ssp. nigra var. nigra‟nın DPPH süpürme aktivitesi 0.5 mg/ml ve 1
mg/ml konsantrasyonda sırasıyla %8.7 ve %15.4 olarak belirlenmiştir (Orhan ve ark., 2009). Bu rapor edilen değerler O. armena ile kıyaslandığında oldukça düşük seviyededir. O. armena‟nın en zayıf ekstraktı olan etilasetat ekstraktında bile radikal süpürücü etki daha güçlü olarak rapor edilmiştir. Genista vuralii ve G. sandrasica‟nın metanolik ekstrakları 1000 µg/ml konsantrasyonda %50.70 ve %46.16 oranında radikal süpürücü etkinlik göstermiştir. Bununla birlikte aynı bitkilerin su özütlerinde bu inhibisyon oranları %86.12 ve %87.18 düzeylerine ulaşmıştır. Bizim çalışmamızda kullanılan O. armena‟nın 1 mg/ml konsantrasyonunda metanolik ekstraktın aktivitesi su özütüne kıyasla daha yüksek seviyededir. Çalışılan diğer konsantrasyonlarda ise su ve metanol özütlerinin aktiviteleri nispeten birbirlerine yakın olarak belirlenmiştir.
Tablo 4.2. O. armena ekstrakları ve sentetik antioksidanların serbest radikal süpürme etkinlikleri 0.125 mg/ml 0.25 mg/ml 0.5 mg/ml 1 mg/ml Etilasetat 6.540±0.001 11.958±1.368 16.796±0.274 26.529±2.764 Metanol 10.700±0.958 23.084±0.629 44.021±0.520 80.611±0.930 Su 14.222±1.450 23.491±1.806 44.621±2.080 76.645±0.137 BHA 95.627±0.328 - - - BHT 62.481±0.301 - - -
Şekil 4.5. O. armena ekstraklarının farklı konsantrasyonlardaki DPPH yakalama yeteneklerinin karşılaştırılması
4.4. Demir Ġndirgeme Gücü
İndirgeme gücü veya potansiyeli antioksidan kapasitenin en önemli belirteçlerinden biridir. Bu potansiyel antioksidan aktivitesi araştırılan bileşikler veya özütlerin elektron verme yeteneğini göstermektedir. Dolayısıyla indirgeme gücünün yüksek olması antioksidan etkinliğin yüksek olması anlamına gelmektedir. Bu amaçla
O. armena ekstraklarının demir ve bakır indirgeme güçleri araştırıldı. Demir indirgeme
gücü antioksidan moleküllerin Fe+3
- Fe+2 dönüştürme yeteneğinin araştırılmasına ve ortaya çıkan Prusya Mavisi rengin spektrofotometrik olarak tayinine dayanır. Absorbansın yüksek olması indirgeme gücünün yüksekliğini gösterir. Çalışılan O.
armena ekstraklarının derişimlerine bağlı olarak demir indirgeme gücü sonuçları Tablo
4.3 ve Şekil 4.6‟da gösterilmiştir. Ekstraklar arasında en iyi indirgeme gücü metanolik ekstrakta aittir ve 1 mg/ml derişimdeki demir indirgeme gücü 1.457±0.047‟dir. Bununla birlikte sentetik antioksidanlar 10 kat daha seyreltik derişimde olmalarında rağmen tüm ekstraklardan daha güçlü indirgeme potansiyeline sahiptir. Fabaceae üyesi olan Vicia
sativa ssp. nigra var. nigra‟nın 1 mg/ml‟lik konsantrasyonu 700 nm‟de 0.230±0.1
olarak belirlenmiştir (Orhan ve ark., 2009). Bu değer O. armena ile kıyaslandığında oldukça düşüktür. Aynı şekilde bir Fabaceae üyesi olan Bauhinia variegata‟nın antioksidan ve DNA koruyucu etkilerinin araştırıldığı çalışmada indirgeme gücü en yüksek metanol özütünde rapor edilmiştir (Sharma ve ark., 2001). Benzer şekilde O.
armena‟nın metanol özütü de suya kıyasla daha güçlü etkinlik sergilemiştir. Fabaceae
üyelerinin besinsel özellikleri üzerine yapılan başka bir çalışmada ise tohum ve meyve ekstraklarının demir indirgeme güçlerinin, O. armena‟ya kıyasla oldukça zayıf oldukları görülmektedir (Chanda ve ark., 2010). Genista türlerinden G. vuralii‟de ise su özütünün demir indirgeme gücü metanole kıyasla daha güçlü olarak rapor edilmiştir (Orhan ve ark., 2011).
Tablo 4.3. O. armena ekstrakları ve sentetik antioksidanların 700 nm‟deki absorbansları 0.2 mg/ml 0.5 mg/ml 1 mg/ml 2 mg/ml Etilasetat - 0.062±0.008 0.209±0.037 0.441±0.023 Metanol 0.072±0.025 0.307±0.017 0.710±0.023 1.457±0.047 Su 0.036±0.001 0.229±0.032 0.458±0.010 0.843±0.001 BHA 2.685±0.028 - - - BHT 1.810±0.028 - - -
Şekil 4.6. O. armena ekstaklarının demir indirgeme güçlerinin karşılaştırılması
4.5. CUPRAC Testi
Demir indirgeme gücünde olduğu gibi CUPRAC testide bitkisel özütlerin bakır iyonlarını indirgeme yeteneklerini ortaya koymaktadır. Metot Cu(II)/neocuproine kompleksinin antioksidan bileşikler tarafından Cu(I)/neocuproine kompleksine indirgenmesine ve oluşan bu yeni kompleksin spektrofotometrik olarak incelenmesine dayanır. Demir indirgeme gücünde olduğu gibi ekstrakların bakır indirgme güçleri konsantrasyonla birlikte artış göstermektedir. O. armena ekstraklarının konsantrasyona bağlı bakır indirgeme yetenekleri Tablo 4.4‟de gösterilmiştir. Demir indirgeme gücüne benzer olarak en yüksek bakır indirgeme kapasitesi O. armena’nın metanol ekstraktında bulunmuştur (Şekil 4.7). Benzer şekilde birçok çalışmada demir ve bakır indirgeme güçleri arasında güçlü bir korelasyon olduğu rapor edilmiştir. Çalışılan ekstraklar ile
sentetik antioksidanlar bakır indirgeme etkinlikleri açısından şu şekilde sıralanabilir: BHA>BHT>Metanol>Su>Etilasetat. Çeşitli çalışmalarda da benzer şekilde metanol özütlerinin su özütlerine kıyasla daha güçlü bakır indirgeme gücüne sahip oldukları belirtilmektedir (Zahin ve ark., 2010). CUPRAC testi hızlı, basit ve özellikle hidrofilik antioksidanlara oldukça uygun olmasından ötürü son zamanlarda oldukça tercih edilen antioksidan metotlardandır.
Tablo 4.4. O. armena ekstrakları ve sentetik antioksidanların bakır indirgeme güçleri
0.2 mg/ml 0.5 mg/ml 1 mg/ml 2 mg/ml Etilasetat 0.115±0.021 0.328±0.01 0.629±0.022 1.374±0.004 Metanol 0.395±0.094 0.820±0.069 1.557±0.020 3.045±0.007 Su 0.170±0.008 0.453±0.025 0.942±0.005 1.731±0.020 BHA 3.678±0.081 - - - BHT 3.435±0.046 - - -
Şekil 4.8. O. armena ekstraklarının bakır ve demir indirgeme güçlerinin karşılaştırılması
4.6. β-karoten/linoleik Asit Test Sistemi
Fosfomolibat yöntemi gibi toplam antioksidan kapasite metodu olarak bilinen β karoten/linoleik asit yöntemi lipidoksidasyonu sonucu oluşan peroksil radikallerinin ortadan kaldırılma yeteneğini belirlemesi bakımından çok önemlidir. Bu metotta linoleikasitin oksidasyonu sonucu oluşan peroksil radikalleri β karotenin renginde açılmalara neden olmaktadır. Ortama ilave edilen antioksidan moleküller peroksil radikallerini ortadan kaldırarak β karotenin renginin korunmasını sağlarlar. Dolayısıyla test sonucunda absorbansı en yüksek olan örnekler en güçlü aktiviteyi sergilemektedir.
O. armena ekstrakları ve sentetik antioksidanların β karoten/linoleik asit test
sistemindeki % inhibisyon değerleri Tablo 4.5‟de verilmiştir. Diğer metotların tersine bu metotta en yüksek inhibisyon oranı (%84.437) etilasetat ekstraktında gözlenmiştir. Metanol ekstraktı %58.557, su ekstraktı ise %33.649 inhibisyon sergilemiştir (Şekil 4.9). Bu test sisteminde gözlenen sonuçlar etilasetat özütünde linoleik asit oksidasyonu önleyecek fenolik bileşikler dışında antioksidan etkinlik gösteren diğer antioksidan bileşiklerin daha fazla bulunmasından kaynaklanabilir. Metotta sadece fenolik bileşikler etkin rol almayıp, antioksidan özellik gösteren diğer moleküller de rol almaktadır. Çeşitli çalışmalarda da bu metot için benzer durumlar rapor edilmiştir (Mishra ve ark., 2009; Baghiani ve ark., 2012). O. armena gibi Fabaceae üyesi olan Sesbania sesban’ın metanolik ekstraktı linoleik asit oksidasyonunu %49.80 oranında inhibe etmiştir. Bu değer O. armena ile kıyaslandığında düşük görünmesine rağmen S. sesban özütünün
1mg/ml konsantrasyonda olduğu düşünülürse doğrudan kıyaslama yapmak doğru olmamaktadır. 15 Lathryus türü üzerine yapılan çalışmada ise β karoten/linoleik asit testinde inhibisyon değerleri %28.47 ile %57.83 arasında değişim göstermektedir (Pastor-Cavada ve ark., 2009).
Tablo 4.5. O. armena ekstrakların ve sentetik antioksidanların linoleik asit oksidasyonunu inhibe etme yüzdeleri (%)
% Ġnhibisyon Etilasetat 84.437±4.657 Metanol 58.557±0.540 Su 33.649±0.618 BHT 94.395±0.052 BHA 95.735±0.052
Şekil 4.9. O. armena ekstrakların ve sentetik antioksidanların linoleik asit oksidasyonunu inhibe etme yüzdeleri (%)
4.7. Yağ Asidi Analizlerine Ait Sonuçlar
Onobrychis armena‟nın yağının gaz kromatografik analizi sonucunda yağ asidi
komposizyonunu 25 farklı yağ asidinin oluşturduğu belirlenmiştir (Tablo 4.6).Bu yağ asitlerinin karbon sayıları 8 ile 22 arasında değişmektedir. Yağ asidi komposizyonu incelendiğinde major yağ asidinin C 16:0, palmitik asit olduğu tespit edilmiştir (Tablo
4.7). Palmitik asidi sırasıyla %15.09 ile C 18:2 ω6, linoleik asit ve %12.03 ile C 20:3 ω6, (cis-8-11-14 eikosatrienoik asit) izlemektedir. Onobrychis gibi Fabaceae familyasına ait Teramnus labialis‟in yağ asidi komposizyonunda benzer şekilde palmitik (%34.92) ve linoleik asit (%25.91) en yüksek yüzdeye sahip yağ asitleri olarak belirlenmiştir (Wiswanathan ve ark., 1999). Benzer şekilde Fabaceae üyesi olan
Neonotonia wightii‟nin yağ asidi komposizyonunda da palmitik ve linoleik asit major
yağ asitleridir (Wiswanathan ve ark., 2001). Thangadurai ve ark (2001) Galactia
longifolia‟nın besinsel özelliklerini araştırdıkları çalışmada yağ asidi komposizyonun
beş yağ asidinden oluştuğunu ve bu yağ asitleri içinde en yüksek yüzdeye sahip olanının ise palmitik asit olduğunu belirlemişlerdir. Bagci ve ark (2004)‟de bazı Fabaceae üyelerinin yağ asidi komposiyonları üzerine yaptıkları çalışmada Onobrcyhis cinsine ait dört türün yağ asidi komposizyonlarını belirlemişler ve bu türlerde major yağ asitlerini sırasıyla linoleik, oleik ve palmitik asit olarak tespit etmişlerdir. Aynı çalışmada O.
major’da linoleik asit yüzdesi %51.8 düzeyine kadar çıkmıştır.
O. armena‟nın yağ asidi komposizyonuda tekli doymamış yağ asitleri (MUFA)
içeriğini büyük oranda (%4.47) C 18:1 ω9 oleik asidin oluşturduğu gözlenmiştir. Oleik asit toplam tekli doymamış yağ asitleri içeriğinin yaklaşık %50‟sini oluşturmaktadır. Bu yağ asidini sırasıyla C 16:1 ω7 palmitoleik asit (%1.51), C 15:1 ω5 pentadekanoik asit (% 1.37) ve C 14:1 ω5, miristoleik asit (%1.22) izlemektedir. Tekli doymamış yağ asitlerinden diğerleri ise oldukça düşük seviyelerdedir. Fabaceae üyelerinin yağ asidi komposizyonları üzerine yapılan birçok çalışmada da benzer şekilde oleik asidin MUFA içeriğine en büyük katkı sağlayan yağ asidi olduğu rapor edilmiştir (Ayaz ve ark., 2009: Thangadurai, 2001; Mao ve ark., 2012; Uzun ve ark., 2007 )
Araştırılan O.armena yağının doymuş (SFA), tekli (MUFA) ve çoklu doymamış (PUFA) yağ asidi içeriklerine bakıldığında çoklu doymamış yağ asitleri doymuş ve tekli doymamış yağ asitlerine kıyasla daha yüksek düzeydir (Şekil 4.10). O. armena‟da PUFA, SFA, ve MUFA içerikleri sırasıyla %56.62, %33.84 ve %9.54 olarak belirlenmiştir. Bu durum Onobrychis ve birçok Fabaceae üyelerinde benzer şekilde rapor edilmiştir. O.armena‟nın çoklu doymamış yağ asitleri (PUFA) içeriğini büyük oranda C 18:2 ω6 ve C 20:3 ω6 teşkil etmektedir. Linoleik asit ve linoleik asit insanlar tarafından sentezlenemeyip diyetle mutlaka dışarıdan alınması gerektiği için “esansiyel yağ asitleri” olarak nitelendirilmektedir. O. armena’da esansiyel yağ asitlerinin yüzdesi %26.96 düzeyindedir. Esansiyel yağ asitlerinin bu yüksek düzeyi O. armena yağını
esansiyel yağ asitlerinin önemli bir kaynağı olarak düşünebileceğini göstermektedir. Ayrıca çoklu doymamış yağ asitlerinin sağlık üzerine olumlu etkileri ve O. armena yağındaki çoklu doymamış yağ asitlerinin oldukça yüksek düzeylerde bulunması bu yağın sağlık üzerine önemini artırmaktadır.
ω3/ω6, aterojenik index (AI) ve trombojenik index (TI) gibi çeşitli değerler son zamanlarda yağın besinsel kalitesinin değerlendirilmesinde sıklıkla kullanılmaktadır. ω3/ω6 oranının yüksek, AI ve TI değerlerinin ise düşük olması yağın besinsel kalitesinde arzu edilen bir durumdur. Çalışmada kullanılan O. armena yağının ω3 /ω6 oranı, AI ve TI değerleri sırasıyla şu şekilde tespit edilmiştir: 0.65, 0.47 ve 0.42 (Şekil 4.11). Çeşitli bitkisel yağlardan örneğin kakao yağının AI değeri 13-20 arasında, palm yağında ise bu değerin 7 civarında olduğu rapor edilmiştir. Bu durumdan, belirtilen indekslerin özellikle doymuş yağ asidi içeriğinin artışına bağlı olarak artış gösterdiği tersine doymamış yağ asitlerinin artışının ise bu değerlerin düşmesine katkı sağladığı sonucuna varılabilir. Dolayısıyla, O.armena yağının yüksek doymamış yağ asidi içeriği bu yağın besinsel olarak da değerli olabileceğinin en önemli göstergesidir.
Tablo 4.6. O. armena‟nın yağ asidi bileşiminde bulunan yağ asitleri
Karbon Sayısı Yaygın ve Sistematik Adı
C 8:0 Kaprilik asit (Oktanoik asit) C 10:0 Kaprik asit (Dekanoik asit) C 11:0 Andesilik asit (Andekanoik asit) C 12:0 Laurik asit (Dodekanoik asit) C 13:0 Tridesilik asit (Tridekanoik asit) C 14:0 Miristik asit (Tetradekanoik asit)
C 14:1 ω5 Miristoleik asit (cis-9-Tetradekanoik asit) C 15:0 Pentadesilik asit (Pentadekanoik asit)
C 15:1 ω5 Pentadekanoik asit (cis-10-Pentadekanoik asit) C 16:0 Palmitik asit (Hekzadekanoik asit)
C 16:1 ω7 Palmitoleik asit (cis-9-Hekzadekanoik asit) C 17:0 Margarik asit (Heptadekanoik asit)
C 17:1 ω8 Margaroleik asit (cis 10-Heptadekanoik asit) C 18:0 Stearik asit (Oktadekanoik asit)
C 18:1 ω9 Oleik asit (cis-9-Oktadekanoik asit) C 18:1 ω7 cis-vaksenik asit (cis-11-Oktadekanoik asit) C 18:2 ω6 Linoleik asit ( cis-9-12-Oktadekadienoik asit) C 18:3 ω6 γ-Linolenik asit (cis-6-9-12- Oktadekatrienoik asit)
C 18:3 ω3 Linolenik asit (α-linoleik asit.ALA)(cis-9-12-15- Oktadekatrienoik asit ) C 20:0 Arakidik asit (Eikosanoik asit)
C 20:1 ω9 Gadoleik asit (cis -11 Eikosenoik asit) C 20:3 ω3 cis-11,14,17- Eikosatrienoik asit C 20:3 ω6 cis-8-11-14 Eikosatrienoik asit C 22:1 ω9 Erusik asit (cis-13 Dokosanoik asit)
Tablo 4.7. O. armena yağ asidi komposizyonu(%)
Karbon Sayısı O. armena
C 8:0 0.05±0.01* C 10:0 0.10±0.01 C 11:0 0.04±0.01 C 12:0 0.45±0.01 C 13:0 0.84±0.01 C 14:0 1.97±0.01 C 15:0 1.09±0.01 C 16:0 22.67±0.07 C 17:0 0.64±0.03 C 18:0 5.87±0.01 C 20:0 0.12±0.02 ΣSFA* 33.84±0.01 C 14:1 ω5 1.22±0.01 C 15:1 ω5 1.37±0.20 C 16:1 ω7 1.51±0.10 C 17:1 ω8 0.33±0.01 C 18:1 ω9 4.47±0.01 C 18:1 ω11 0.46±0.01 C 20:1 ω9 0.04±0.01 C 22:1 ω9 0.14±0.05 ΣMUFA* 9.54±0.27 C 18:2 ω6 15.09±0.01 C 18:3 ω6 11.81±0.07 C 18:3 ω3 11.87±0.01 C 20:3 ω6 12.03±0.03 C 20:3 ω3 0.11±0.01 C 22:6 ω3 5.71±0.35 ΣPUFA** 56.62±0.26 ΣUFA** 66.16±0.01 ΣEFA** 26.96±0.01 PUFA/SFA 1.67±0.01 ω3 17.69±0.35 ω6 27.17±0.02 ω3/ ω6 0.65±0.01 ω6/ ω3 1.54±0.03 AI** 0.47±0.01 TI** 0.42±0.01
*Aritmetik ortalama ± Standard sapma
**SFA: Doymuş yağ asitleri, MUFA: Tekli doymamış yağ asitleri, PUFA: Çoklu doymamış yağ asitleri, UFA: Doymamış yağ asitleri, EFA: Esansiyel yağ asitleri, AI:Aterogenik index, TI: Trombogenik index.
Şekil 4.10. O. armena SFA, MUFA, PUFA ve EFA değerlerinin karşılaştırılması (%)
Şekil 4.11. O. armena ω3/ω6, ω6/ω3, AI ve TI değerlerinin karşılaştırılması
4.8. Uçucu Yağ BileĢimine Ait Sonuçlar
Onobrcyis armena çiçeklenme döneminde, araziden toplanıp toprak üstü
kısımlarının su distilasyonu yöntemiyle uçucu yağları elde edilerek, bu uçucu yağların kompozisyonları GC-MS ile araştırılmıştır. Bu bitkilere ait analiz sonuçları Tablo 4.8‟de verilmiştir. İncelenen O. armena uçucu yağında toplamda ise 22 farklı uçucu yağ bileşeni belirlenmiştir. Uçucu yağın bileşenleri %96.957 oranında tanımlanmıştır. Uçucu yağın major bileşeni olarak n-hekzadekanoik asit belirlenmiştir. Bu bileşen toplam uçucu yağ içeriğinin %56.609‟unu oluşturmaktadır. Benzer şekilde Fabaceae üyesi olan Glycyrrhiza
cinsine ait G. echinata türünün toprak üstü ve kök kısımlarının uçucu yağ bileşiminde de aynı bileşen en yüksek düzeydedir. G. echinata‟nın toprak üstü kısmında bu oran %72.946 olarak tespit edilmiştir. G.echinata‟da n-hekzadekanoik asitten sonra en yüksek düzeyde belirlenen hekzahidroksil farnesil aseton (Çakmak ve ark., 2012), O. armena uçucu yağında ise % 5.222 düzeyinde belirlenmiştir. Samanae saman uçucu yağında da aynı şekilde n-hekzadekanoik asit major bileşen olarak tespit edilmiştir (Ogunwande ve ark., 2006). Fabaceae üyesi olan Rhynchosia minima uçucu yağında 8 bileşen tanımlanmış ve bu bileşenlerden en yüksek düzeyde olarak isopropil toluen rapor edilmiştir (Gundidza ve ark., 2009). Astragalus compactus uçucu yağ bileşimi üzerine yapılan bir çalışmada ise bitkisel steroller da dahil olmak üzere toplam 26 bileşen belirlenmiş ve bitkinin gelişme dönemlerine bağlı olarak major bileşenlerin değiştiği örneğin çiçeklenme döneminde major bileşen fitol iken vejetatif dönemde ise gamma-sitosterol major komponent olarak belirlenmiştir (Naghiloo, ve ark., 2012). Aynı şekilde
Astragalus cinsine ait A. sahendi‟nin uçucu yağında ise major bileşen olarak α-terpinolen
(%19.64) ve hekzahidro farnesil aseton (%10.82) belirlenmiştir (Movafeghi ve ark., 2010). Yapılan çalışmalarda uçucu yağ bileşiminin iklim şartları, mevsim ve yükseklik gibi çeşitli faktörlere bağlı olarak değişiklik gösterdiği rapor edilmiştir (Daferera ve ark., 2000; Grosso ve ark., 2007).
Bu tez kapsamında araştırılan O. armena‟nın uçucu yağ bileşiminde n- hekzadekanoik asitten sonra major bileşenler şu şekilde sıralanabilir: 9-12 Oktadekanoik asit (%8.985), tetradekanoik asit (%6.783), hekzahidro farnesil aseton (%5.222), 15-tetrakosenoik asit (%3.567) ve dodekanoik asit (%3.153) (Şekil 4.12). Fabaceae familyası üyesi olan Retama raetam uçucu yağında O.varmena uçucu yağından oldukça farklı olarak 12 bileşen belirlenmiş ve major bileşen olarak β-linalool (%50.9) rapor edilmiştir. Aynı familyaya mensup olan Cassia alata‟nın uçucu yağının bileşiminde de farklı olarak 1,8-sineol (%39.8) major bileşen olarak belirlenmiştir.Rhynchosia heynei yapraklarının
uçucu yağ bileşiminde ise 1-pentanol major bileşendir (Bhakshu ve ark., 2009). Kicel ve ark (2010)‟da yaptıkları çalışmadan Trifolium repens‟in uçucu yağ bileşiminde hekzahidro farnesil aseton‟u çalışmamıza yakın şekilde %6.2 oranında tanımlamışlardır.
O. armena‟da %1.538 gibi nispeten düşük düzeyde bulunan fitol aynı familya üyesi olan Prosopis farcta yapraklarının uçucu yağında major bileşendir.