T.C
DİCLE ÜNİVERSİTESİ TIP FAKÜLTESİ NÖROLOJİ ANABİLİM DALI
ACE GEN POLİMORFİZMİ VE MTHFR PARAMETRESİNİN MİGREN ÜZERİNE ETKİLERİ
DR. FATMA UNAN EKİNCİ
UZMANLIK TEZİ
TEZ YÖNETİCİSİ
PROF. DR. MEHMET UFUK ALUÇLU
DİYARBAKIR 2013
İÇİNDEKİLER
Sayfalar Önsöz...V Simgeler ve kısaltmalar...VI-VII Tablolar dizini ………...VIII Şekiller dizini………IX Grafikler dizini...X. Türkçe özet………...XI İngilizce özet (Abstract)………..XII 1.GİRİŞ VE AMAÇ…...1-4 2.GENEL BİLGİLER……...5-33 2.1.Migren tanımı……….5 2.2 Migrenin tarihçesi………...5-6 2.3 Migrenin epidemiolojisi………..6-7 2.4.Migren dönemleri………...7-8 2.4.1.Prodrom dönemi………...7 2.4.2.Aura dönemi:………...8 2.4.3.Ağrı dönemi:………8 2.4.4.Postrom dönemi: ………...………..8 2.5.Migrenin tetikleyicileri………...8-9 2.6.Migrenin sınıflandırılması………...10
2.7. Migrende Tanı Ölçütleri………..11
2.7.1.Aurasız Migren……….………11-12 2.7.2.Auralı Migren……….13
2.7.2.1.Özgün Auralı, Migrene Benzemeyen Baş Ağrısı………...14
2.7.2.2.Baş Ağrısız Özgün Aura……….14 2.7.2.3.Familya Hemiplejik Migren………..14-15
2.7.2.4. Sporadik Hemiplejik Migren……….15
2.7.2.5 .Baziler Tip Migren……….16
2.7.3.Retinal Migren………..16
2.7.4.Sıklıkla Migren Öncülü Çocukluk Çağı Periyodik Sendromları………17
2.7.5.Migren Komplikasyonları………...17
2.8 Migren Genetiği ve Patofizyolojisi………...17-21 2.8.1.Migren Genetiği………17-18 2.8.2.Migren Fizyopatolojisi………..18-21 2.9 Etyopatogenez……… ………. 21-25 2.9.1.Vasküler Teori………..21-22 2.9.2. Nöral Teoriler………..22-23 2.9.3.Hipoksik Teori………..23-24 2.9.4.Trigeminovasküler Teori………..24 2.9.5.Endoteliyopati………...24-25 2.9.6. Otonomik Teori……….25
2.10 Migren ve Gen Polimorfizmi………..25
2.10.1.Polimorfizmin Tanımı: ………...25-26 2.10.2.Polimorfizmin Tipleri ve Tıpta Kullanımı……….. ……….………26
2.11 ACE (anjiotensin converting enzim)………...26-27 2.11.1.ACE geni……….28
2.11.2.ACE I/ D polimorfizminin hastalıklar ile ilişkisi……….28
2.12 MTHFR Enziminin Görevi ve Yapısı ……….28-29 2.13 MTHFR Geninin Yapısı ve Özellikleri………...29-30 2.13.1.Hiperhomosisteinemi ve MTHFR gen mutasyonları………..30-31 2.13.2.Metilentetrahidrofolat Redüktaz Gen Mutasyonları………....31
2.13.2.1.Metilentetrahidrofolat redüktaz C677T mutasyonu………...31
2.13.2.2.Metilentetrahidrofolat redüktaz A1298C Mutasyonu……….32
2.13.2.3.MTHFR A1298C ve C677T Mutasyonlarının Kombinasyonu………...33
3.GEREÇ VE YÖNTEM...34-37 3.1 ACE Genotipinin Belirlenmesi...34-25 3.2.MTHFR Mutasyonu İçin Materyal Metod...36
3.3.İstatistiksel analiz……….37 4. BULGULAR...38-46 4.1.Auralı migren aurasız migren ve kontrol gruplarının ACE gen polimorfizmi kar şılaştırılması……….41-42 4.2.Migren ve kontrol grubunda MTHFR 677C gen mutasyonu………42-44 4.3.Migren ve kontrol grubunda MTHFR 1298 gen mutasyonu……….44-46 4.4.Migren ve kontrol grubunda MTHFR 677TT ACE II ilişkisi………....46 4.5.Migren ve kontrol grubunda MTHFR 677T mutasyonu-ACE DD ilişkisi……….46 5. TARTIŞMA...48-52 6. SONUÇ……….53 7. KAYNAKLAR...54-63
ÖNSÖZ
Dicle Üniversitesi Tıp Fakültesi Nöroloji Anabilim Dalı’ındaki uzmanlık eğitimim süresince her konuda yardımlarını esirgemeyen saygıdeğer tez danışmanı hocam sayın Prof. Dr. Mehmet Ufuk Aluçlu’ya en derin saygılarımı sunar eğitimimdeki emeği için teşekkür ederim.
Asistanlık eğitimimde her zaman yardımlarını gördüğüm tecrübelerinden faydalandığım Anabilim Dalımız Öğretim üyeleri Prof. Dr. Nebahat Taşdemir, Doç. Dr. Yusuf Tamam, Doç. Dr. Ertuğrul Uzar, Yrd. Doç. Adalet Arıkanoğlu, Yrd. Doç. Dr. Abdullah Acar, Yrd. Doç. Dr. Sefer Varol, Yrd. Doç. Dr. Uğur Çevik, Yrd. Doç. Dr. Yavuz Yücel ve Yrd. Doç. Eşref Akıl’a teşekkürlerimi sunarım.
Tezin hazırlık aşamasında istatiksel analizler için yardımını esigemeyen Dicle Üniversitesi Tıp Fakültesi Bioistatistik Bölümü öğretim üyesi Prof. Dr. Zeki Akkuş’a, Genetik Bölümü Öğretim üyesi Yrd. Doç. Selahattin Tekeş’e teşekkürü borç bilirim.
Beraber çalışmaktan gurur duyduğum tüm asistan arkadaşlarıma, hemşire arkadaşlarıma ve personel arkadaşlarıma şükranlarımı sunarım.
Öğrencilikten asistanlığa uzanan bu zahmetli ve uzun yolda her zaman destek olan benim bugünlere gelmemi sağlayan aileme, tezimin yazım aşamasında ve zorlu ihtisas sürecimde bana anlayış gösteren ve hep yanımda olan sevgili eşim Mensur Hasan Ekinci’ ye sonsuz teşekkürlerimi sunarım.
.
SİMGELER VE KISALTMALAR ACE: Anjiotensin converting enzyme
M.Ö: Milattan önce M.S: Milattan sonra
IHS: International headeche society (Uluslararası baş ağrısı derneği) ICHD: International classification of headache disorders
ICHD-II: International classification of headache disorders 2004 DCP: Dipeptidil karboksipeptidaz
MTHFR: Metilentedrahidrofolat redüktaz I: İnsersiyon
D: Delesyon
FHM: Familyal hemiplejik migren CGRP: Calcitonin gene realeted peptide NO: Nitrikoksid
MELAS: Mitochondrial encephalomyopathy, lactic acidosis and stroce 5-HT: Serotonin
SNP: Single nukleotid polymorphism PCR: Polimeraz zincir reaksiyonu PET: Pozisyon emisyon tomografisi MA: Auralı migren
MO: Aurasız migren MS: Metiyonin sentetaz
CS: Sistatyonin β sentetaz CL: Sistatyonin γ liyaz
BHMT: Betain homosistein metil transferaz MT: Metil transferaz SAM: S-adenozilmetiyonin SAH: S-adenozilhomosistein THF: Tetrahidrofolat DMG: Dimetilglisin
TABLOLAR
TABLO I: Migrende potansiyel tetikleyici etkenler
TABLO II: Baş ağrısı bozukluklarının uluslararası sınıflaması TABLO III: Aurasız migren tanı kriterleri
TABLO IV: Auralı migren tanı kriterleri
TABLO V: Çalışma ve kontrol gruplarının cinsiyet dağılımları
TABLO VI: Çalışma populasyonunda ACE gen polimorfizmi genotip dağılımı.
TABLO VII: Çalışma populasyonunda MTHFR 677C gen mutasyon dağılımı.
TABLO VIII: Çalışma populasyonunda MTHFR 1298C gen mutasyon dağılımı
TABLO IX: Çalışmaya katılan migrenli hastaların demografik özellikleri
ŞEKİLLER ŞEKİL I: ACE oluşum şeması
ŞEKİL II: Homosistein’in transsülfürasyon ve remetilasyon metabolize yolları
ŞEKİL III: MTHFR (Metilentetrahidrofolat redüktaz) 677C\T polimorfizmi
ŞEKİL IV: ACE D/I polimorfizminin PCR amplifikasyon bantları
ŞEKİL V: MTHFR mutasyon bantları
GRAFİKLER
GRAFİK I : Migren ve kontrol grubu karşılaştırmasında ACE gen alelleri GRAFİK II: Auralı ve aurasız migrende ACE gen alelleri
GRAFİK III : Migren ve kontrol grubu MTHFR677C mutasyon karşılaştırması GRAFİK IV: Auralı ve aurasız migrende MTHFR677 mutasyon karşılaştırması GRAFİK V: Migren ve kontrol grubu MTHFR 1298C karşılaştırması
GRAFİK VI: Aurasız ve auralı migrende MTHFR1298C mutasyon karşılaştırması GRAFİK VII: Auralı migrende hastaların cinsiyet dağılımları
Son zamanlarda yapılan çalışmalarda anjiyotensin converting enzim (ACE) geninin DD/ID/II polimorfizmi, metiltetrahidrofolat redüktaz (MTHFR) gen mutasyonu ve migren arasında ilişki olduğu ile ilgili bazı kanıtlar gösterilmiştir. Bu çalışmanın amacı; ACE gen polimorfizmini, MTHFR gen mutasyonlarını migren ve kontrol grubunda karşılaştırmak ve arasındaki ilişkiyi ortaya çıkarmaktır.
Bu çalışmaya Eylül 2012-Ocak 2013 tarihleri arasında Dicle Üniversitesi Tıp Fakültesi Hastanesi’nde Nöroloji polikliniğine başvuran 119 migrenli (yaş ortalaması:39,4 -/+ 10.8) 101’ i (yaş ortalaması: 35,5-/+11.6) kontrol olmak üzere 220 kişi çalışmaya dahil edilmiştir. ACE genotiplerini ayırmada polimeraz zincir reaksiyonu, MTHFR gen mutasyonu ise real time pcr tekniği kullanılmıştır.
Hasta grubunda DD/ID/II genotip sıklığı sırasıyla %33.0, %61.5, %5.2 iken, konrol grubunda %53.6, %43.6, %2.6’dır. Hasta grubunda ID genotipi de istatistiksel olarak anlamlı düzeyde yüksek bulundu. ACE geninin DD/ID/II polimorfizmi ve MTHFR mutasyonları arasında hem auralı hem de aurasız migren riski açısından fark tespit edilmedi (p> 0.05). Çalışmada migren (auralı ve aurasız) grubunda ID genotipi sıktır. ACE geninin DD/ID/II polimorfizmi auralı ve aurasız migren arasında korelasyon saptanmadı. MTHFR mutasyonları auralı ve aurasız migren arasında ilişkisizdi. ACE geninin D alleli, MTHFR mutasyonu bulunması çalışma populasyonunda migren riskinde anlamlı artışa neden olmamaktadır.
Anahtar Kelimeler: Anjiotensin converting enzim, metiltetrahidrofolat redüktaz, migren, gen polimorfizm, D aleli, mutasyon
ABSTRACT
Recently; there have been some proofs between angiotensin converting enzyme (ACE) , methylenetetrahydrofolate reductase (MTHFR) gene mutation and migraine. The aim of this study; to compare between ACE, MTHFR with migraine control group s and to reveal its connection.
This study was managed between September 2012 and January 2013 in the department of neurology at Dicle University Medical Hospital. This study consisted of 219 people those 119 (mean age 39,4 -/+ 10,8) were migraine patient and the rest 100 (mean age 35,5-/+11,6) were controls group. The polimeraz chain reaction (PCR) was used for the evaluation of ACE genotype, but the real time PCR technique was used.
While in the patient group DD/ID/II genotype frequency is %33.0, %61.5, %5.2, control group’ s is %53.6, %43.6, %2.6. It has been statistically found out that the ID genotype in the patient group highly meaningful than control groups. No risk difference has been witnessed both with aura and without aura in migraine group compared to ACE gene DD/ID/II polymorfizm and MTHFR mutations.
In this study the ID genotype in the migraine (with aura and without aura) has been frequent. No correlation has been detected between both aura and without aura compared to ACE gene DD/ID/II polymorfizm and MTHFR mutations. It hasn’ t caused a meaningful increase in the D allele in ACE gene and T mutation in MTHFR in our study population. Key Words: Angiotensin converting enzyme, methylenetetrahydrofolate reductase enzyme, migraine, gene, polymorfizm, D allel, mutation
1.Giriş ve Amaç
Başağrılarının %l5-20'si migren ağrısıdır. Tek taraflı yerlesim gösteren (%75), zonklayıcı özellikte, kisinin günlük yasam aktivitelerini engelleyecek derecede şiddetli ve başın hareketleri ile artan baş ağrısı atakları olarak kabul edilmektedir. Bu ağrılar sırasında kişinin bulantı ve kusması olabilmekte, ışık, ses ve koku gibi uyaranlardan rahatsız olduğundan çoğu zaman loş ve sessiz bir odada uzanmayı tercih etmektedir (1). Kadınlarda erkeklere göre 3 kat fazla görülmektedir. Daha çok 2. ve 3. dekatta başlar ve orta yaştan sonra azalma gösterir. Tipik olarak ağrı 4-72 saat arasında sürer ve fiziksel egzersiz ile artar (2). Migren patofizyolojisi henüz tam olarak anlaşılamamış olmasına rağmen genetik ve çevresel faktörlerin etkili olduğu primer bir baş ağrısıdır ve oldukça yaygındır (1, 3).
Migreni genel populasyonda yaşam boyu prevalansı %16 olarak bildirilmektedir. Erkeklerde yaşam boyu prevalansı %8 iken kadınlarda %25 bulunmuştur. Migrenin bir yıllık prevalansı ise erkeklerde %6, kadınlarda %15 olarak bulunmuştur (4). Migren atakları kişinin sağlığını, okul başarısını, iş verimliliğini ve aile mutluluğunu etkileyerek yaşam kalitesini bozmaktadır (5, 6).
Migren tanısında dikkatli bir öykü alınması çok önemlidir. Fizik muayene temel olarak normaldir ve bugün için doğrulayıcı hiçbir tanı testi veya tetkiki yoktur (7). Migren genel olarak iki alt tipe ayrılır: Auralı ve aurasız migren.
Aura, baş ağrısı döneminden önce ortaya çıkan ya da ona eşlik eden, genellikle bir saatten kısa süren, görsel, duyusal ve motor bozuklukların eşlik ettiği bir dönemdir. Hastaların %10-30’unda auralı migren bulunmaktadır (8). Migren baş ağrılarının yaklaşık %15' ine aura adını verdiğimiz dakikalar içinde gelişen ve 1 saatten az süren nörolojik semptomlar öncülük eder. Sıklıkla aura, yavaş olarak görme alanının ortasından dışa doğru yayılan görsel bozukluk olarak seyreder (9).
Migren sıklığı çocuklukta ve ileri yaşlarda cinsiyet farkı gözetmezken, puberteden sonra kızlarda erkeklerdekinin iki katına çıkar ve kadınların doğurgan olduğu yaşlar boyunca görülme sıklığı erkeklerden yüksektir. Çoğu zaman migren atağını tetikleyen faktörler mevcuttur (1, 3, 10).
Migren, birçok genin sorumlu olduğu insidansı yaşla birlikte artan kompleks multifaktöriyel bozukluktur. Son 10 yılda, migren patogenezinde etkili olabileceği düşünülen farklı protrombotik gen mutasyonlarının incelendiği birçok çalışma yapılmıştır. Sıklıkla
çalışmalar ACE gen polimorfizmi, Faktör V (leiden mutasyonu) geni, G1691A mutasyonu, protrombin geni G20210A mutasyonu ve metilentedrahidrofolat redüktaz (MTHFR) geni C677T mutasyonu üzerinde yoğunlaşmıştır (11). Endotel disfonksiyonunun eşlik ettiği birçok hastalıkta hiperhomosisteinemi ve ACE enzim aktivitesindeki artış birlikte gösterilmektedir. Migrenin etyopatogenezine yönelik çalışmalarda genetik yatkınlık olduğu bildirilmiş. ACE I/D polimorfizmi ve MTHFR gen mutasyonu ile migren arasındaki bağlantının önemli olabileceği düşünülmüştür (12).
Anjiyotensin I dönüştürücü enzimi (kininaz II) (OMIM 106180), anjiyotensin I’i vazokonstriktör etkisi olan anjiyotensin II’ye çeviren ve kuvvetli bir vazodilatatör olan bradikinini de inaktive ederek kan basıncının dengelenmesi ve sıvı-elektrolit düzeylerinin dengesinde önemli rol oynayan bir dipeptidil karboksipeptidazdır (DCP1). ACE’nin fonksiyonları daha çok kan basıncının düzenlenmesi yönünde araştırılmış olup diğer fizyolojik bazı rolleri de bulunmaktadır (13). ACE genini 2 izoenzim kodlamaktadır. Somatik ACE izoenzimi, vasküler endotelyal hücreler, böbrek epitelyal hücreleri ve testiküler leydig hücrelerinin dahil olduğu birçok dokuda eksprese olurken “Germinal(testiküler) ACE” ise sadece spermde eksprese olmaktadır. Testiküler ACE’nin cDNA’ sı 1989’ da Ehlers MRW ve arkadaşları tarafından tanımlanmış olup tahmini protein yapısının endotelyal ACE dizisinin karboksi ucunun yarısı ile idantik olduğunu bulmuştur (732 aa ve MW= 80.073) (14). ACE’nin homeostazis üzerindeki rolü çok iyi incelenmiştir. Vasküler endotelyal hücrelerin yüzeyinde hücre membranına bağlı bir enzim olarak bulunmasının yanında plazmada serbest olarak da dolaşmaktadır. Plazma ACE seviyeleri kişiler arasında 5 kata kadar varan değişiklikler gösterebilmektedir (15). ACE geni klonlandıktan sonra kişiler arasında plazma konsantrasyonları yönünden bulunan farklılıkların 16. intronda 287 baz çifti uzunluğundaki bir Alu tekrar dizisinin varlığı (insersiyon, I) veya yokluğu (delesyon, D) tipindeki polimorfizm sonucu oluştuğu bulunmuştur. Bu durum ACE/ID polimorfizmi olarak adlandırılmaktadır. Buradaki Alu tekrar dizisi diğer insana özel olan Alu elemanlarına çok yakın bir benzerlik taşımaktadır ve bu sebepten delesyondan daha çok bir insersiyon olarak ele alınmaktadır (16). Soubrier F ve arkadaşları (17) ACE genini klonladıktan sonra Tiret L ve arkadaşları bu majör genin etkisininin insersiyon (I)/ delesyon (D) polimorfizmi ile olduğunu göstermişlerdir. D/D taşıyanlarda plazma ACE enzimi seviyesi I/I taşıyanlara göre iki kat yüksek bulunmaktadır, I/D taşıyanlar ise arada bir seviyeye sahiptirler (18). Dünya genelinde yapılan çalışmalar toplu olarak değerlendirildiğinde ACE/DD sıklığı yaklaşık olarak 0.27 bulunmaktadır (14, 18).
Migren patogenezinde ACE/ID polimorfizminin rolü birçok araştırmacı tarafından incelemeye alınmış, bazı çalışmalarda korelasyon bulunurken bazı çalışmalarda böyle bir ilişkinin varlığı gösterilememiştir.
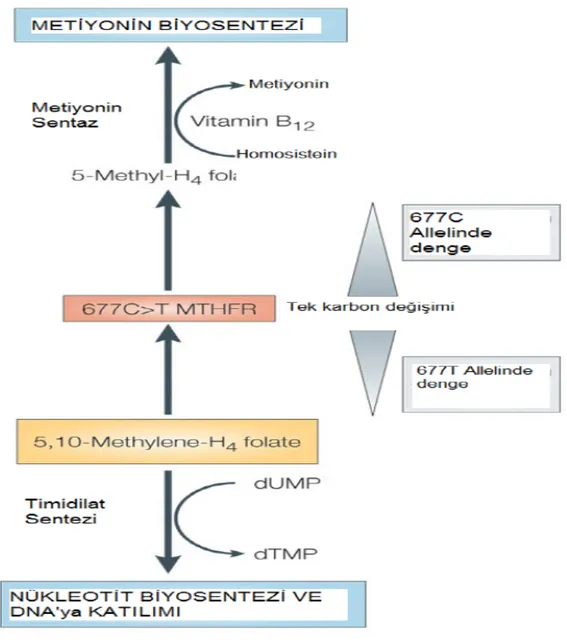
Folat döngüsü içerisinde yer alan 5, 10 Metilen Tetrahidrofolat (MTHF), Metilen tetrahidrofolatredüktaz (MTHFR) enziminin katalizörlüğü ile 5-Metil Tetrahidrofolat (THF)’ a dönüşür. Aynı zamanda 5 Metil THF, homosisteinin metiyonine remetilasyonu sırasında majör karbon vericisi olarak görev yapar. Burada görev yapan enzim metiyonin sentaz (MS)’ dır. Metiyonin de genel metil vericisi olarak görev yapan S-Adenozil Metiyonin (SAM )’ e dönüştürülür. Döngüde bundan sonraki aşamada S-Adenozil Homosistein ( SAH ) oluşur ve daha sonra da homosistein hidrolaz enziminin katalize ettiği reaksiyon sonucunda homosistein meydana gelir (19).
MTHFR polimorfizmi, kardiyovasküler hastalıklar ve nöral tüp defektleri için bir risk faktörüdür. Ayrıca preeklampsi ve spontan abortus gibi gebelik komplikasyonları için de risk oluşturduğu gösterilmiştir. Son zamanlarda yapılan çalışmalar neticesinde yarık damaklılık, Down sendromu, konjenital kalp defektlerinde ve migrende bu polimorfizmin rol oynadığı görülmüştür (20).
MTHFR 677 CT polimorfizmi, folat miktarı da yeterli olduğu zaman kolon kanseri, çocukluk ve yetişkinlik dönemi lösemilerde koruyucu etki gösterebilmektedir. Burada MTHFR enzimi eksikliği olduğu zaman 5,10 MTHF, 5 Metil THF’ye tamamen dönüşemeyerek birikir. 5,10 MTHF’nin, timidin sentezinde kullanılması sonucunda DNA sentezi ve DNA tamiri için yeterli nükleotid sağlanır. Sonuç olarak DNA’daki urasil eşleşmeleri azalır. Bu da, kırık taşımayan sağlam kromozom sentezi anlamına gelmektedir ve sonuç olarak kansere karşı koruyucu bir etki oluşmaktadır (21). Homosisteinin metiyonine dönüşümü, pürin-primidin sentezi (DNA ve RNA biyosentezi) ve metilasyon reaksiyonlarının içerisinde bulunan MTHFR enzimi, önemli bir kavşak noktasında görev yapmaktadır. Bu yüzden MTHFR enzim aktivitesinin azalması sonucunda çeşitli metabolik problemler meydana gelmektedir. Bunlardan bir tanesi hücre içerisinde homosistein birikimidir ve hücre için toksik olan bu madde endotel disfonksiyonuna yol açarak kardiyovasküler, serebrovasküler birçok hastalığa yol açmaktadır (22)
Migrenin ise patofizyolojisi henüz tam olarak açıklanamamıştır. Migrende, dura materin perivasküler aksonlarından vazoaktif nörotransmitterlerin salınımı ya da serebral kan damarlarının ağrılı vazodilatasyonu gerçekleşir. Hiperhomosisteinemi; serotonin, norepinefrin
ve dopamin gibi nörotransmitterlerin sentezini arttırır. C677T mutasyonu sonucu MTHFR aktivitesindeki azalma, homosistein ve nörotransmitterlerin seviyelerinde artmaya neden olur. Bu nedenle homozigot C677T mutasyonun migren için bir risk faktörü olduğu ileri sürülmektedir (23).
Migren patofizyolojisi hala tartışmalıdır ve etyopatogenetik faktörlerin tespit edilmesi çok önemlidir. Migren etyopatogenezinin bilinmesi, migren tedavisi (profilaksi ve atak) için gereklidir. Bu konuda sınırlı sayıda literatür kaynağı mevcuttur. Son yıllarda çoğu hastalıkta olduğu gibi migren patogenezinde de genetik polimorfizmin önemi araştırılmaktadır. Bu konuda yapılmış çalışmaların sonuçları, migren hastalarında genetik polimorfizmlerin ve gen mutasyonlarının önemini desteklemektedir.
Bu tez çalışmasında; migren hastalarında, çeşitli metotlarla ACE gen polimorfizmi ve MTHFR gen mutasyonlarının sağlıklı kontrol grubu ile karşılaştırılması planlandı. Amacımız, ACE ve MTHFR genotip farklılığınının migren patogenezindeki rollerini araştırmaktır. Ayrıca migrenli hastalar ile sağlıklı kontrol gruplarında bu polimorfizmin populasyonundaki insidansını bulmayı amaçladık. Böylece migrenli hastalarda ACE gen polimorfizminin ve MTHFR mutasyonlarının genotipik insidansı araştırılacak; migren görülme riski ve prognozuna etkili olup olmadığına bakılacaktır.
Biz çalışmamızın; ACE, MTHFR moleküler genetik boyutunun migren patogenezinin aydınlatılmasına bilimsel katkı sağlayacağını düşünmekteyiz.
2.Genel Bilgiler 2.1.Migren Tanımı
İnsanları etkileyen ağrılı durumlardan en yaygın olanı başağrısıdır ve hekime başvuru nedeni olarak en sık görülen semptomlardan birisidir (24). Migren, nörolojik, gastrointestinal ve otonom değişikliklerin çeşitli kombinasyonlarda eşlik ettiği, primer epizodik bir başağrısı bozukluğudur. Migren aynı zamanda ‘genetik olarak yatkın bireylerde, santral sinir sistemindeki döngüsel değişimlerin veya bir takım uyarılara bağlı nörovasküler reaksiyonların ürünü olarak aralıklarla gelen baş ağrısıdır’ şeklinde de tanımlanabilir (25).
Migren baş ağrısı; herediter özellik gösteren, epizodik ataklarla seyreden, sıklıkla unilateral, zonklayıcı vasıfta, ortalama 4-72 saat süren, ataklara sıklıkla bulantı, kusma, ışık ve/veya sese hassasiyetin de eşlik edebildiği bir primer baş ağrısı bozukluğudur. Ataklara bulantı, kusma, fotofobi, fonofobi ve halsizlik eşlik eder. ( 26 )
2.2 Migrenin Tarihçesi
Baş ağrıları ilk uygarlıklardan beri insanoğlunu en çok tedirgin eden hastalıkların başında gelmiştir. Milattan önce (M.Ö) 7000 yılından kalan neolitik insan kafataslarında, baş ağrısında tedaviye yönelik, bir cihaz ile kafatasının delindiği trepenasyon denen bir işlemin uygulandığına dair bulgular mevcuttur. Yıllar boyunca, tıbbi ve güncel diğer yayınlarda baş ağrısı tetikleyicileri, rahatlatan etkenler, migren bileşenlerini oluşturan baş ağrısı, aura, bulantı veya kusma gibi belirtiler ve ailevi eğilim tanımlanmıştır (27).
Baş ağrısına dair kaynaklar M.Ö. 3000 yılına kadar uzanmaktadır. Yayınlanmış en eski kaynak “hasta baş ağrısını” tanımlayan bir Sümer epik şiiridir. M.Ö. 1200’ den kalma eski bir Mısır baş ağrısı reçetesi olan ve M.Ö. 2500’ den kalma belgelere dayandığı söylenen “Ebers Papirüsü” migren, nevralji ve saplanıcı baş ağrılarını tanımlamaktadır. M.Ö. 400 yılında Hipokrat migren baş ağrısına öncülük edebilecek ve kusma ile rahatlayan görsel aura’yı tanımlamıştır. Hipokrat, bu ağrıyı genellikle sağ gözde ışık parlamasının ardından şakaklarda başlayan daha sonra tüm başa ve boyuna yayılan şiddetli ağrı olarak tanımlamıştır. ( 28 ) Kapadokya’da milattan sonra (MS) 2.yüzyılda yaşayan Aretaeus, sıklıkla başın bir tarafında hissedilen, bulantı ile birlikte olan ve ağrısız dönemlerin takip ettiği bir baş ağrısı tanımlamıştır. Bu klasik tanımla Aretaeus migrenin kaşifi olarak kabul edilmektedir (29). Migren terimi ilk kez Galen’in (MS 2.yy.) kullandığı Yunanca “hemicrania” kelimesinden türetilmiştir. Migrenin diğer sık görülen baş ağrılarından ayırımı ilk olarak 1783 yılında Tisso tarafından yapılmıştır ve migreni supraorbital nevralji olarak isimlendirmiştir. Takip eden
yüzyılda DuBois Reymond, Mollendorf ve de Eulenburg migren için farklı vasküler teoriler öne sürmüşlerdir. Liveing 1873’de migren hakkında “ Megrim, Hasta Edici Baş Ağrısı ve İlişkili Bozukluklar Üzerine: Sinir Fırtınalarının Patolojisine Bir Katkı ” başlıklı ilk monografı yazmış ve migrenin nöral teorisini ortaya koymuştur. Sorunu“sinir fırtınaları” olarak adlandırdığı otonom sinir sistemindeki bozukluklara bağlamıştır (30).
1930 yılında John Graham ve Harold Wolff vasküler teoriyi tanımlamışlardır. Bu teoriye göre, aura belirtileri intrakraniyal arterlerde vazokonstriksiyona; baş ağrısı ise eksternal ve internal karotis arterinin dallarında aşırı genişlemeye bağlı olarak oluşmaktadır. John Graham ve Harold Wolff, ergotamin ilacının kan damarlarını daraltarak etki ettiğini göstermiş ve bunu migrenin vasküler teorisi için bir kanıt olarak kullanmışlardır. Leao 1944 yılında ve geçen dekadda Olesen ile Lauritzen tarafından nörojenik teori öne sürülmüştür. Aura döneminde rafe nükleusunda ve lokus seruleusda başlayan deşarjların bölgesel bir kan akımı azalması yaptığını, nöronal depresyonun öne doğru yayıldığını ve bunun da yayılan depresyon (spreading depresyon) dalgasını oluşturduğunu bildirmişlerdir (31).
Baş ağrıları ile ilgili özgül bilimsel çalışmalar 19. yüzyıldan sonra hız kazanmıştır. Son yıllarda ailevi hemiplejik migrenin geni bulunmuş; migren ve küme baş ağrısında sorumlu olabilecek beyin sapı merkezleri belirlenmiştir. Bununla birlikte yüzyıllarca araştırılmış olmasına rağmen birincil baş ağrılarının tanı ölçütlerine son yirmi yıl içinde açıklık getirilmiş ve farklı sınıflamalar yapılmıştır (32).
2.3 Migrenin Epidemiolojisi
Migren, bireyin hayat kalitesi ve iş gücünü düşüren prevalans ve insidansı yüksek olan bir hastalıktır. Batı ülkelerinde son yapılan çalışmalarda standart tanısal kriterlere göre migrenin yıllık prevalansı yaklaşık % 10-12 civarındadır. Gelişmiş ülkelerde yapılan migren prevalans çalışmaları bu tür baş ağrısının erişkin kadınlarda %12-24, erkeklerde ise %5-12 oranlarında görüldüğünü göstermektedir (33).
Migren prevalansı yaş ve cinsiyete bağlıdır. Migren başlangıç yaşı erkek çocuklarda kızlardan öncedir. İlk migren atağının başlangıcı 5-8 yaşlarında olabilse de sıklıkla 10-20 yaşlarında başlar. Ancak başlangıç herhangi bir yaşta da olabilmektedir (33, 34). Her iki cinste pik prevalans değerleri orta yaşlarda görülür. Puberteye kadar kız ve erkek çocuklarında prevalans aynıdır. Ergenlik yaklaştıkça kızlardaki prevalansı erkeklere oranla artar. 25-55 yaşlar arasında kadınlarda en yüksek prevalansa ulaşmaktadır. Kadınlarda erkeklere göre 2-3 kat daha sıktır. Kadınlarda daha sık görülmesinin nedeni kesin olarak
bilinmemesine rağmen, kadın cinsiyet hormonlarının olayla ilişkili olduğu düşünülmektedir. Beyaz ırkta, siyah ve sarı ırka oranla prevalansı daha yüksektir (33, 34, 35).
Rasmussen ve arkadaşlarının prevalans çalışmasında erkek/kadın oranı auralı migren için 1: 2, aurasız migren için 1: 7 oranında verilmektedir (36). Türkiye’ de yapılan bir çalışmada migren prevalansı %16,4, aurasız migren oranı %12,9, auralı migren oranı ise % 3,5 olarak bulunmuştur. Sosyoekonomik düzeyi yüksek entelektüel kişilerde daha sık görüldüğü yapılan bazı çalışmalarda bildirilmiştir. Ancak okul çocuklarında migren sıklığı ile zeka düzeyi arasında bir ilişki bulunmamıştır (37).
2.4. Migren Dönemleri:
Bir migren atağı başlıca dört dönemden oluşmaktadır:
2.4.1.Prodrom dönemi: Hastaların % 20-60’ında baş ağrısından önceki saatler ve günlerde prodrom belirtileri görülmektedir. Migren baş ağrısında görülen prodrom belirtileri; nörolojik, otonom ve sistemik belirtiler olup, bunların başında depresif ruh hali, öforik davranışlar, tepkisellik, durgunluk, konsantrasyonun ve dikkatin azalması gibi nöropsikolojik belirtiler gelmektedir. Ayrıca fonofobi, fotofobi, hiperosmi gibi nörolojik belirtiler ve iştah değişiklikleri, halsizlik, sık idrara gitme gibi sistemik belirtiler de prodrom belirtileri içinde sayılabilir. En sık gözlenen belirtiler, yorgunluk hissi (atakların %72’ sinde), konsantrasyon güçlüğü (%51), ense sertliği (%50) dir (38).
2.4.2.Aura dönemi: Aura migren atağının hemen öncesinde veya migren baş ağrısının başlangıcında ortaya çıkan fokal nörolojik (görsel ve/veya duyusal ve/veya konuşma) belirtilerin karışımıdır. Sıklıkla 5-20 dakika içinde gelişip 60 dakikadan kısa sürer. Aura döneminde beyin kan akımı, klinikle ilişkili etkilenmiş korteks alanında azalma gösterir. Auralar içinde en sık gözlenen görsel auralar; skotomlar, basit ışık çakmaları veya görme alanın hemianopik olarak etkilendiği görme bulanıklığı şeklinde ortaya çıkmaktadır. İkinci bir aura şekli olan duyusal aurada ise, paresteziler veya uyuşukluk-hissizlik şeklinde belirtiler mevcuttur. Hastaların %18'inde motor belirtiler görülür ve genellikle duyusal belirtilerle birliktedir. Ayrıca hastaların %17-20’sinde afazik auralar (konuşma bozuklukları) bildirilmiştir (39).
2.4.3.Ağrı dönemi: Tipik migren baş ağrısı zonklayıcı, orta- ağır şiddette, tek taraflı ve fiziksel aktivite ile şiddetlenir. Ağrı enseden, başın arkasından, başın bir tarafından başlar, iki taraflı olabilir (hastaların % 40’ında) ya da tek taraflı başlayıp jeneralize hale gelebilir. Ağrı başlangıçtan sonraki 2-12 saat içinde şiddetlenerek atağa dönüşür. Migren atağının süresi erişkinlerde 4-72 saat, çocuklarda ise 1- 48 saat arasında değişebilmektedir. Ağrıya hastaların
%90’ında bulantı eşlik eder, ancak üçte birinde kusma görülür. Ayrıca fotofobi, fonofobi ve osmofobi şeklinde duyarlılıkta artış görülür. Baş ağrısı sırasında iştahsızlık, diyare, tenezm, solukluk, terleme ve poliüri gibi sistemik belirtiler de görülebilir (40).
2.4.4.Postdrom dönemi: Düzelme fazında ağrı azalır ve kaybolur. Hastaların bazısı kendilerini oldukça iyi hissedebilir, yenilenmişlik hissi, öfori olabilir. Bazıları da yorgun, tükenmiş ve depresif hissedebilir (40).
2.5.Migrenin Tetikleyicileri
Migrenli kişiler bazen nedensiz olarak baş ağrısı ataklarının ortaya çıktığını ifade ederler. Bununla birlikte atağı davet eden çoğunlukla iç (hormonal değişimler gibi) veya dış (koku, hava değişimi gibi) bir veya birkaç tetikleyici neden bulunur (41). Her migrenli, tetikleyicilere aynı derecede duyarlı olmayabilir. Bazı migrenlilerde tek bir tetikleyiciyle migren atağı başlayabilirken bazılarında birkaçının birlikte bulunmasıyla ancak atak oluşabilir. Örneğin tek başına alkol almak atağa neden olmayabilirken alkol alımı, geç yatmak ve ertesi sabah kahvaltıyı geciktirmek bu kez atağı tetikleyebilir. Migreni en sık olarak tetikleyenler stres, menstürasyon, az veya fazla uyku, öğün atlamak, yorgunluk, hava değişikliği (basınç, nem, rüzgar), alkol (özellikle şarap, bira), koku (parfüm veya keskin kokulu kimyasal maddeler), parlak ışık, sigara dumanı, yüksek rakım, öksürük ve bazı gıdalardır. Bununla birlikte bu tetikleyicilerin çoğu migren dışı baş ağrılarında da (gerilim tipi baş ağrısı) benzer tetikleyici özelliğe sahip olup, migrene özgü tetikleyiciler olarak “koku”, “sigara dumanı”, “hava değişikliği” ve “parlak ışık” sayılabilir. Gıdalar migrenlilerin küçük bir kısmında tetikleyicidirler ve bunlar içinde peynir, alkol (özellikle kırmızı şarap), nitratlı besinler sayılabilir. Az sayıda hastaya özgü başka gıdalar da bildirilmiştir (42).
1-Hormonal: - Menarş - Gebelik - Doğum
- Doğum kontrol ilaçları - Menopoz
- Östrojen replasman tedavisi 2- Diyetle ilişkili:
- Tiramin içeren yiyecekler - Nitrit içeren yiyecekler - Turunçgiller
- Alkol
- Monosodyum glutamat - Aspartam
- Öğünlerin atlanması ya da geciktirilmesi - Çikolata 3-Psikolojik: - Stres - Depresyon - Anksiyete 4- Fiziksel-çevresel: - Parlak ışıklar - Floresan ışığı - İklim değişimleri - Basınç değişiklikleri 5- Uyku :
- Uykusuzluk ya da aşırı uyuma 6- İlaçlar:
- Nitrogliserin
- Histamin, Reserpin, Hidralazin
Baş ağrısıyla uğraşan hekimler arasında ortak bir dil oluşturmak fikri ilk olarak M.S. ikinci yüzyılda yaşamış olan Kapadokyalı Areteus tarafından ortaya atılmıştır (29). Günümüzde migren tanısı, her ülkede ve her hekim tarafından Uluslararası Baş ağrısı Derneği (International Headache Society–IHS) tarafından yayınlanan belirli tanısal kılavuzlar dikkate alınarak konulmaktadır. 1988 yılında Olesen’ in başkanlığında oluşturulan “Uluslararası Baş ağrısı Derneği’ nin Baş ağrısı Sınıflama Komitesi” tarafından tüm baş ağrılarını içeren sınıflandırma ve tanı ölçütleri yayınlanmıştır (44).
IHS-1988 sınıflaması bazı baş ağrılarını tanımlamada yetersiz kaldığından zaman içerisinde yenileme ihtiyacı doğmuş ve en son 2004 yılında hem klinik pratikte hem de bilimsel araştırmalarda baş ağrısı bozukluklarının sınıflandırılmasını iyileştirmek için geniş bir grup baş ağrısı bozukluğu tanı kriterleri yayınlanmıştır. Bu sınıflamaya göre 6 alt tipe ayrılmış olan migren, toplumda daha sık görülmeleri nedeniyle temel olarak auralı ve aurasız migren olmak üzere 2 alt gruba ayrılabilir. Aurasız migren, auralı migrene göre daha sıktır ve hastaların yaklaşık %90’ı aurasız migren şeklinde görülmektedir (45). Migren hastalarının yaklaşık %10 kadarında görülen ve görsel, duyusal, motor veya diğer fokal serebral veya beyin sapı semptomlarından oluşan aura, prodrom safhasının sonunda ortaya çıkar. Aura dönemi yaklaşık 5- 20 dakika içinde gelişir ve genellikle süre 60 dakikayı geçmemektedir. Bizim çalışmamızda migrene yönelik duyarlılık ve seçiciliği daha yüksek olan Baş Ağrısı Bozukluklarının Uluslararası Sınıflaması (International Classification of Headache Disorders ICHD-II (2004) ölçütleri kullanılmıştır. (Tablo 2 ) (46).
Classification of Headache Disorders-ICHD-II ) 2004 ( 46 ) 1.Aurasız Migren
2.Auralı Migren
2.1. Migren baş ağrılı özgün aura 2.2. Migren baş ağrısız özgün aura 2.3. Baş ağrısız özgün aura
2.4. Familyal hemiplejik migren (FHM) 2.5. Sporadik hemiplejik migren
2.6. Baziller tip migren
3.Sıklıkla migren öncülü olan çocukluk çağı periyodik sendromları 3.1. Döngüsel kusmalar
3.2. Abdominal migren
3.3. Çocukluk çağının iyi huylu paroksismal vertigosu 4.Retinal migren
5.Migren komplikasyonları 5.1. Kronik migren
5.2. Status migrenozus 5.3. İnfarktsız ısrarlı aura 5.4. Migrenöz infarkt
5.5. Migrenin tetiklediği nöbet 6.Olası migren
6.1. Olası aurasız migren 6.2. Olası auralı migren 6.3. Olası kronik migren
2.7. Migrende Tanı Ölçütleri 2.7.1.Aurasız migren
ICHD-II’ ye göre aurasız migren tanısı koymak için, her biri 4–72 saat süren ve dört ağrı özelliğinden en az ikisini, ilişkili özelliklerinden ise en az birini gösteren 5 atak gerekmektedir. Dört ağrı özelliği içerisinde tek taraflılık, zonklayıcı nitelik, orta-ağır şiddet ve ağrının rutin fizik aktivite ile artması yer almaktadır. Ataklara bulantı ve/veya kusma ya da
fotofobi ve fonofobiden en az biri eşlik etmeli ve yineleyici epizodik atakların bildirilmiş olması gerekmektedir. Fotofobi, fonofobi ve rutin fizik aktivite ile artan zonklayıcı nitelikte ağrısı bulunan bir hasta bu kriterleri karşılamaktadır; aynı şekilde bulantının eşlik ettiği tipik tek taraflı zonklayıcı ağrı da uygundur. Ancak migrenin diğer nedenleri dışlanmalıdır. Ölçütler içerisinde yer alan en az beş atak geçirmiş olma zorunluluğu, beyin tümörlerinden sinüzite ve glokoma kadar pek çok organik hastalığın migreni taklit eden başağrılarına yol açabilmesinden kaynaklanmaktadır (47).
Tablo 3. Aurasız Migren Tanı Kriterleri ( 47 )
A) B-D’yi karşılayan en az 5 atak
B) 4-72 saat süren baş ağrısı atakları (tedavi edilmemiş veya tedavi başarısız) C) Baş ağrısı aşağıdaki özelliklerden en az 2’sine sahiptir:
1. Tek taraflı yerleşim 2. Zonklayıcı nitelik 3. Orta veya şiddetli ağrı
4. Günlük fiziksel aktivite ile artış ya da onlardan kaçınmaya neden olma
D) Baş ağrısı sırasında aşağıdakilerden en az biri olamalı: 1. Bulantı ve/veya kusma
2. Fotofobi ve fonofobi
E) Aşağıdakilerden en az biri olmalı:
1. Öykü ve/veya fizik muayene ve/veya nörolojik muayene sekonder bir baş ağrısını düşündürmemeli
2. Öykü ve/veya fizik muayene ve/veya nörolojik muayene sekonder bir baş ağrısını düşündürür fakat uygun incelemelerle böyle bir olasılık dışlanmış olmalı
3. Baş ağrısının böyle bir nedeni olsa dahi migren atağının bu nedenden önce ortaya çıkmış olması/ikisi arasında zamansal ilişki kurulamaması
2.7.2.Auralı migren
Bugün artık klasik migren yerine kabul edilmiş bir terim olan auralı migren tanısı için ICD-II’ye göre aşağıdaki dört özellikten en az üçünü içeren en az iki atak olması gerekli görülmektedir. Tamamen düzelen bir veya daha fazla nörolojik belirti, auranın 4 dakikadan uzun süre içinde gelişmesi, auranın 60 dakikadan kısa sürmesi ve auranın ardından başarısının başlamasına kadar geçen belirtisiz dönemin 60 dakikadan kısa sürmesi şeklinde kriterleri belirtilmektedir. Auralı migrende görülen baş ağrısı ve ilişkili diğer belirtiler aurasız migrendekine çok benzemektedir. Auralı migreni olan hastaların pek çoğunda aurasız migren atakları da görülebilir. Aura sıklıkla 20–30 dakika sürer ve tipik olarak başağrısından önce olur, nadiren sadece baş ağrısı sırasında görülebilmektedir. Geçici iskemik atağın tersine, migren aurası yavaş yavaş ortaya çıkar ve hem pozitif (örneğin ışık parlamaları ve karıncalanmalar gibi) hem de negatif (örneğin skotom ve uyuşma gibi) belirtiler gösterir. Aura tipik ve hep aynı özellikleri gösteriyorsa, arkadan gelen başağrısı yukarıda tanımlanan migrenöz özellikleri göstermese de auralı migren tanısı kesin olarak konulabilir. Tipik migren aurası, küme başağrısı gibi diğer başağrısı tipleri ile birlikte de görülebilir. Auranın fokal belirti ve bulguları baş ağrısı fazının sonrasında devam edebilir (47).
Tablo 4: Auralı Migren Tanı Kriterleri ( 47 )
A) B ölçütünü karşılayan en az 2 atak olmalı B) Aşağıdaki özelliklerden en az 3’ü olmalıdır
1. Bir veya daha fazla sayıda, tümüyle geri dönebilen ve fokal serebral kortikal ve/veya beyin sapı fonksiyon bozukluğuna işaret eden aura belirtilerinin olması
2. Dört dakikadan daha uzun sürede yavaş yavaş gelişen en az bir aura belirtisi ya da 2 veya daha fazla sayıda birbiri ardı sıra gelişen belirtiler
3. Aura belirtileri en fazla 60 dakika sürmeli
4. Baş ağrısı aurayı takiben 60 dakika içinde başlamalı (ağrı aura olmadan önce veya aura ile birlikte başlayabilir).
C) Baş ağrısı başka bir bozukluğa bağlanamaz
Tanımı: Özgün aura, görsel ve/veya duysal ve/veya konuşma ile ilgili belirtilerden oluşur. Baş ağrısı aurasız migren tanı ölçütlerini taşımaz.
Tanı Ölçütleri
A. B-D ölçütlerini tamamen dolduran en az iki atak olmalı
B. Kas gücü kaybı olmaksızın aura aşağıdaki özelliklerden en az birini taşımalı:
1. Tamamen geri dönüşümlü pozitif belirtileri (ışık titremeleri, noktalar ya da çizgiler) ve/veya negatif belirtileri (görme kaybı ) içeren görsel belirtiler
2. Tamamen geri dönüşümlü pozitif özellikleri (toplu iğne ve iğne) ve/veya negatif özellikleri (uyuşukluk) kapsayan duysal belirtiler
3. Tamamen geri dönüşümlü disfazik konuşma bozukluğu C. Aşağıdakilerden en az iki tanesi olmalı:
1. Homonim görsel belirtiler ve/veya tek yanlı duysal belirtiler
2. Beş dakika veya daha fazla sürede gelişen en az bir aura belirtisi ve/veya 5 dakika veya daha fazla sürede ard arda gelişen farklı aura belirtileri
3. Her belirti 5-60 dakika sürmeli
D. Aura sırasında veya aurayı izleyen 60 dakika içinde aurasız migren için olan tüm B-D ölçütlerini taşımayan baş ağrısı
E. Başka bir organik hastalık işareti olmamalı 2.7.2.2.Baş Ağrısız Özgün Aura
Tanım: Burada baş ağrısı hiç gelişmez ya da auradan sonra 60 dakika içinde başlamaz. 40 yaşından sonra, negatif görsel belirtiler, çok uzun veya çok kısa sürüyorsa önce diğer nedenleri araştırmak gereklidir.
2.7.2.3.Familyal Hemiplejik Migren (FHM)
Tanım: Kas gücü kaybı şeklinde aurası olan migren baş ağrısıdır. En az bir tane birinci veya ikinci derece yakınlarında motor güçsüzlük şeklinde aurası olan migren baş ağrısının bulunması bu tanıyı düşündürmelidir. AHM’ de ataklarda bilinç bozukluğu, konfüzyon, ateş BOS’ta pleositoz bulunabilir. Hafif bir kafa travmasıyla tetiklenebilir. %50’sinde ilerleyici serebellar ataksi migren ataklarından bağımsız olarak görülebilir.
Tanı Ölçütleri:
A. B-C’ yi karşılayan en az 2 atak
B. Aura olarak tamamen düzelen motor güçsüzlüğün ve aşağıdakilerden en az birinin olması 1. Tamamen geri dönüşümlü görsel bulgular
3. Tamamen geri dönüşümlü disfazik konuşma bozukluğu C. Aşağıdakilerden en az 2’ si:
1. En az bir aura belirtisinin ≥5 dakikadan uzun sürede gelişmesi ve/veya farklı aura belirtilerinin ≥5 dakikada gelişmesi
2. Her bir aura belirtisi ≥5 dakika ile < 24 saat içinde sonlanır
3. Aurasız migren ölçütlerini karşılayan baş ağrısının aura sırasında ya da auradan sonraki 60 dakika içinde başlaması
D. 1. veya 2. derece yakınlarda en az bir tane A-E ölçütlerine uyan birinin bulunması E. Diğer bir hastalıkla ilişkili olmaması
2.7.2.4. Sporadik Hemiplejik Migren
Tanım: Hastada kas gücü kaybı ile birlikte olan auralı migren atağı görülürken; birinci derece ya da ikinci derece akrabalarında kas gücü kaybıyla giden auralı migren hikayesi bulunmamalıdır.
Tanı Ölçütleri
A. B-C ölçütlerini tamamen dolduran en az iki atak olmalı
B. Aura, tamamen geri dönüşümlü kas gücü kaybı ile aşağıdaki özelliklerden en az birini taşımalı:
1. Tamamen geri dönüşümlü pozitif belirtileri (ışık titremeleri, noktalar ya da çizgiler) ve/veya negatif belirtileri (görme kaybı) içeren görsel belirtiler
2. Tamamen geri dönüşümlü pozitif özellikleri (toplu iğne ve iğne) ve/veya negatif özellikleri (uyuşukluk) kapsayan duysal belirtiler
3. Tamamen geri dönüşümlü disfazik konuşma bozukluğu C. Aşağıdakilerden en az iki tanesi olmalı:
1. Beş dakika veya daha fazla sürede gelişen en az bir aura belirtisi ve/veya 5 dakika veya daha fazla sürede ard arda gelişen farklı aura belirtileri
2. Her belirti 5 dakikadan uzun, 24 saatten kısa sürmeli
3. Aura sırasında veya aurayı izleyen 60 dakika içinde aurasız migren için olan tüm B-D ölçütlerini taşıyan baş ağrısı
D. Birinci ya da ikinci derece akrabalarda A-E ölçütlerinin tamamını taşıyan ataklar olmamalı E. Başka bir organik hastalık işareti olmamalı
Tanımı: Baziler migren diyebilmek için, motor zaaf olmaksızın her iki oksipital hemisferden ve/veya beyin sapından kaynaklanan aura belirtilerini içeren migren atağı olmalıdır.
Tanı Ölçütleri
A. B-D ölçütlerini tamamen dolduran en az iki atak olmalı
B. Kas gücü kaybı olmaksızın aura aşağıdaki tamamen geri dönüşümlü belirtilerin en az iki tanesini içermeli: 1. Dizartri 2. Vertigo 3. Tinnitus 4. İşitme kaybı 5. Diplopi
6. Her iki gözde temporal ve nazal görme alanlarını içeren görsel belirtiler 7. Ataksi
8. Bilinç düzeyinde bozulma 9. Eş zamanlı iki yanlı paresteziler
C. Aşağıdakilerden en az bir tanesi olmalı:
1. Beş dakika veya daha fazla sürede gelişen en az bir aura belirtisi ve/veya 5 dakika veya daha fazla sürede ard arda gelişen farklı aura belirtileri
2. Her belirti 5-60 dakika sürmeli
D. Aura sırasında veya aurayı izleyen 60 dakika içinde aurasız migren için olan tüm B-D ölçütlerini taşıyan baş ağrısı
E. Başka bir organik hastalık işareti olmamalı 2.7.3.Retinal Migren
Tanım: Tekrarlayan ataklar şeklinde monooküler görsel bozukluk (skotom, körlük) ve eşlik eden migren baş ağrısı vardır.
Tanı Ölçütleri:
A. B ve D’ yi karşılayan en az iki atak,
B. Atak sırasında tamamen geri dönüşümlü olan monooküler görsel olayların (sintilasyonlar, skotomlar, körlük vb) olması (muayene veya hastanın atak sırasında mevcut durumu çizmesi ile doğrulanan),
C. Aurasız migren ölçütlerini karşılayan baş ağrısının aura sırasında ya da 60 dk içinde başlaması,
D. Normal oftalmolojik muayene, E. Başka bir hastalığa bağlı değildir (48).
2.7.4.Sıklıkla Migren Öncülü Çocukluk Çağı Periyodik Sendromları
Her üç sendromun da özelliği ataklar arası dönemin tamamı ile normal olduğu stereotipik olarak tekrarlayan kusma, abdominal ağrı veya vertigo ile karakterizedir. Ataklara diğer vazomotor semptomlar eşlik edebilir (49).
2.7.5.Migren Komplikasyonları
Kronik migren; ilaç aşırı kullanımı olmaksızın ayda 15 ya da daha fazla gün olan ve toplam üç aydan fazla olan migren başağrısıdır.
Status migrenosus; 72 saatten uzun süren ve disabiliteye yol açan migren atağının olması olarak tanımlanmaktadır.
İnfarktsız ısrarlı aura; bir haftadan uzun süren aura belirtilerinin olması şeklinde belirtilmektedir.
Migrenöz infarkt; bir ya da daha fazla migren aurası ve iskemik beyin lezyonu ile ilişkili görüntülemede ilgili bölgede infarkt alanı tespit edilmesine dayanmaktadır. 60 dakikanın üzerinde seyreden auralı tek atak dışında tüm ağrıları auralı migrene uymaktadır.
Migrenin uyardığı epileptik nöbet; migren aurası tarafından tetiklenen migren aurası sırasında ya da sonraki bir saat içinde gelişen nöbet için bu tanımlama yapılmaktadır (50).
2.8.Migren Genetiği ve Patofizyolojisi
Migren santral sinir sisteminin değişik uyaranlara verdiği bir santral yanıt olarak düşünülebilir. Hastaların bu ataklar için düşük bir eşiği vardır. Bu eşik genetik olarak belirlenmektedir. Ayrıca birçok faktör bu eşik üzerinde etkilidir. Örneğin dış uyaranlar, hormonlar, ilaçlar gibi. Bu başlık altında, bu süreç içersinde önemli rol oynayan migren genetiğinden ve atak sırasında ortaya çıkan patofizyolojik değişikliklerden bahsedilecektir.
2.8.1.Migren genetiği:
Uzun yıllardır pek çok çalışma ile migrenin ailesel geçiş özellikleri, ikizler arasında migren birlikteliği ve migrenin ilgili kromozom bölgelerine bağlantı gösterip göstermediği incelenmiştir (51). Kontrollü çalışmalar migrenli bireylerin akrabaları arasında ailesel migren riskinin artmış olduğunu göstermektedir. Eski çalışmalarda rölatif risk 1.5 ila 19.3 arasında bildirilmiştir (52). Yakın tarihli topluma dayalı migren aile çalışmasında; Russell ve Olesen IHS (1988) kriterlerini kullanmışlar ve auralı migrenli bireylerin birinci dereceden akrabalarında auralı migren riskinin dört kat, aurasız migreni bulunan bireylerin (probandlar) birinci dereceden akrabalarında ise aurasız migren bulunma riskinin 1. 9 kat daha yüksek olduğunu göstermişlerdir (53). Ailesel migren çalışmaları da migrenin ailesel kümelenmesini
kuvvetle desteklemektedir. Tutarsız sonuçlar migrenin genetik çeşitliliğinin bir göstergesi olarak kabul edilebilir. Bazı aileler bariz otozomal dominant geçiş gösterirken, bazıları inkomplet penetranslı otozomal resesif geçiş göstermektedir. Bunun yanında klinik temelli ikiz çalışmaları tutarlı bir biçimde monozigot ikizlerde migren birlikteliğinin dizigot ikizlere oranla daha sık görüldüğünü ortaya koymuştur; bu da genetik faktörlerin etyolojik rolünü desteklemektedir. (51, 54).
Çalışmaların çoğunda migren prevalansında gözlenen değişkenliğin yaklaşık yarısının genetik faktörlerin pozitif etkisine bağlanabileceği düşünülmüştür; bu bulgu topluma dayalı ailesel kümelenme çalışmalarından hesaplanan rakamlarla da benzerlik göstermektedir. İkiz çalışmaları migrende hem genetik faktörlerin hem de risk faktörlerinin önemini desteklemektedir. Auranın bir parçası olarak hemiplejinin görüldüğü nadir otozomal dominant bir hastalık olan familyal hemiplejik migren (FHM) de bağlantılı analiz çalşmaları yapılmış ve FHM1’ in kromozom 19’ da CACNA1A geninde anormal mutasyonları ve FHM2’ nin kromozom 1q21–23’ te ATP1A2 geninde mutasyon varlığı gösterilmiştir. FHM1’ deki CACNA1A anormal mutasyonu P/Q kalsiyum kanalındadır. CACNA1Ageninin mutasyonları ayrıca serebellar vermian atrofiyle birlikte görülen epizodik ataksi tip 2 ve tip 6 spinoserebellar ataksi ile ilişkilendirilmiştir. Bu otozomal dominant geçişli ve görece stereotipik bozuklukta bile gözlenen genetik heterojenite, daha sık görülen migren tiplerinin de olası heterojenitesi hakkında fikir yürütmeyi zorlaştırmaktadır (54 , 55).
2.8.2.Migren Fizyopatolojisi
Migren atağı patofizyolojik temelde başlangıç, atak ve düzelme üç ana bileşenden oluşmaktadır.
Birinci evrede; hastaların yaklaşık %25’i başağrısının öncesindeki 24 saat içinde keyiflilik hali, huzursuzluk, depresyon, açlık veya susama hissi ya da uykuya eğilim şeklinde prodromal belirtiler tanımlamaktadır. Bu bulgular hipotalamus kaynaklı gibi görünmektedir ( 56). Hipotalamusun suprakiazmatik nükleusu sirkadiyen ritmleri düzenleyen iki ana merkezden biridir ve migrenin çok önemli bir özelliği olan periyodikliğinden sorumlu olduğu düşünülmektedir (57, 58).
İkinci evrede; migren aurasının başlamasıyla ortaya çıkmaktadır. Klinik gözlemler, nörogörüntüleme çalışmaları ve kan akım ölçümleri migren aurasının açıkça serebral korteksten kaynaklandığını göstermektedir. Bunun yanında hastaların çoğu hiçbir zaman aura yaşamazlar. Işıldayan skotom (görme alanını kat eden ışık çakmaları) gibi görsel bozukluklar, paresteziler veya diğer fokal nörolojik bulgular gözlenebilmektedir. Migren aurası korteks
boyunca yaklaşık 2–3 mm/dak hızla ilerleyen beyin kan akımı azalması (oligemi) ile ilişkilidir. Kan akımındaki değişiklikler genellikle oksipital bölgeden başlar, ancak sıklıkla oksipital lobün biraz önündedir. Ardından beyin kan akımındaki azalma alanı genişleyerek bütün hemisferi dahi içine alabilir. Yayılan oligemi damarsal alanlarla bir ilişki göstermez ve vazokonstriksiyona bağlı olması pek muhtemel değildir (59). Migren skotomunun ve yayılan depresyonun ilerleme hızları benzerdir; bu da bu olayların ilişkili olabileceğini düşündürmektedir. Auralı migren, glutamat ve muhtemelen aspartat gibi eksitatör aminoasitleri içine alan bir nöronal hipereksitabilite hali ile ilişkilendirilmektedir (60). Beyin magnezyum konsantrasyonunda azalma hem yayılan depresyondan hem de nöronal aşırı duyarlılaşmadan sorumlu olabilecek N-metil-D-aspartat (NMDA) reseptörünün cevaplılığını arttırabilir (61). Başağrısı henüz kortikal kan akımı hala azken başlayabilir ve iki yanlı akım değişiklikleri ortaya çıkarabilir; bu da ağrının vasküler değişiklikten kaynaklanabilmesi olasılığını çok azaltmaktadır.
Klinisyenlerin pek çoğu migren aurasının iskemiye değil de nöronal işlev bozukluğuna bağlı olduğunu ve aura sırasında iskemi olsa bile bunun çok nadiren görüldüğünü düşünmektedir. Migren aurasının biyolojik temelinin yayılan depresyon veya bunun insandaki karşılığının olması muhtemeldir (62).
Büyük serebral arterleri, pial damarları, geniş venöz sinüsleri ve dura materi çevreleyen kafa içindeki ağrı oluşturan yapıların trigeminal innervasyonu, başlıca trigeminal gangliondan ve arka çukurda üst servikal dorsal köklerden kaynaklanan miyelinsiz liflerden oluşan bir pleksus tarafından sağlanır (63, 64). Yapılan çalışmalarda serebral damarları innerve eden liflerin trigeminal ganglionun içinde ‘substance P’ ve kalsitonin geni ile ilişkili peptid (CGRP) içeren nöronlardan kaynaklandığını göstermiştir (65).
Pek çok dolaylı kanıt serotonin ve migren arasında bir ilişki bulunduğunu düşündürmektedir. 30 yıldan uzun süreden bu yana migren atağının başlangıcında trombositlerdeki serotonin düzeyinin hızla düştüğü ve idrarda serotoninin başlıca metaboliti olan 5-hidroksiindolasetikasit atılımının arttığı bilinmektedir (66). Ayrıca 5-HT düzeyinin azalması migren atağını başlatabilirken, intravenöz 5-HT ile akut migren atağı sonlandırılabilmektedir. (67). 5-HT reseptörleri en az üç değişik moleküler yapı şeklinden oluşmaktadır. En az yedi değişik HT reseptör sınıfı bilinmektedir (67, 68). İnsanlarda 5-HT1 reseptörünün en az beş alt tipi vardır ve çeşitli triptanlar bu reseptör alt tiplerinin bazılarında etkilidir. 5-HT1B ve 5 HT1D reseptörlerine agonist etkileri, triptanların etkileri ile en fazla ilişkili gibi görünendir.
Moskowitz ve Cutrer bir dizi deney sonucunda migren aurısının bir tür steril nörolojik inflamasyon olduğunu düşündüren sonuçlar elde etmiştir (69). Trigeminal duysal C-lifleri ‘substance P’ ile CGRP ve nörokinin A da dâhil olmak üzere bazı nöropeptidler içermektedir. Trigeminal sinirin antidromik uyarımı duysal C-liflerinden ‘substance P’, CGRP ve nörokinin A salınmasına yol açar, bu da inflamasyonla sonuçlanır (70). Salınan bu nöropeptidler kan damarı duvarı ile etkileşime girerek dilatasyona, plazmanın ekstravazasyonuna ve steril bir inflamasyona yol açmaktadır. Bu kan damarlarının iç kısımlarının elektron mikrografisi trombosit aktivasyonunu göstermektedir (71). Böylece, migren sırasında görülen trombosit aktivasyonu, bu nörojenik inflamasyon sırasında oluşmuş bir epifenomen olarak kabul edilebilir. Gerek sumatriptan, gerek dihidroergotamin ve gerekse de yeni geliştirilen triptan türevlerinin kullanılması ile ortaya çıkan bu albumin sızıntısı önlenebilmektedir. Migren atağı sırasında eksternal juguler ven kanında CGRP miktarı artarken substance P miktarı artmamaktadır. Bu veriler auralı ve aurasız migrende trigeminovasküler nöronların aktivasyonunu açıkça göstermektedir. İnsanlarda başağrısı sırasında sumatriptan verilmesi ile ağrılarının gerilemesine paralel olarak CGRP düzeyleri azalmaktadır; deney hayvanlarında da trigeminal ganglion stimulasyonu sırasında da benzer gözlemler elde edilmiştir 72, 73, 74). Migren patogenezinde beyin sapı mekanizmalarının önemi her zaman için vurgulanmaktadır. Yapılan PET çalışmalarında migren ağrısı sırasında kortikal yapılar ve beyin sapında bölgesel kan akımında artış saptanmıştır. Sumatriptan başağrısını ve ilişkili belirtileri giderirken beyindeki bölgesel kan akımı artışını da azaltmış, ancak beyin sapındaki bölgesel kan akımı artışının devam ettiği gözlenmiştir. Baş ağrısının geçmesine rağmen beyin sapındaki bölgesel kan akımı artışının devam etmesi, bu aktivasyonun endojen antinosiseptif sistemdeki aktivite artışının dışında veya en azından ona ek olarak başka faktörlere de bağlı olabileceğini ve beyin sapındaki merkezin migren atağının bütünlüğünü sağlıyor olabileceğini düşündürmektedir (75). Ayrıca aktivasyonun sürmesi sumatriptan ile belirtilerin giderilmesine rağmen, neden baş ağrısının tekrarladığını açıklamaktadır.
Auranın incelendiği bir klinik çalışmanın sonuçları, migrende kan beyin bariyerinin bozulabileceğini ortaya koymaktadır (76). Auralı migreni olan hastalar üzerinde yürütülmüş bir başka çalışmada ise sumatriptanın aura üzerine etkileri incelenmiştir (77). Bu çalışma sonucuna göre sumatriptan ve plasebonun aura üzerine etkisi karşılaştırılmış, aura süresini değiştirmediği, aura sırasında verildiğinde sumatriptan’ ın baş ağrısı üzerinde plasebodan daha etkili olmadığı görülmüştür. Bu gözlem, aura sırasında kullanılan oral sumatriptanın baş ağrısı üzerine etkisinin düşük olduğunu, aksine hafif başağrısı sırasında verilen triptanın etkili olduğunu göstermiştir (76, 77). Ayrıca bu çalışmalar sonunda ponsta yer alan ve merkezi
sinir sisteminin başlıca noradrenalin içeren nukleusu olan lokus seruleus hücre grubunun uyarılması beyin kan akımını ve kan beyin bariyerinin geçirgenliğini etkileyebileceği sonucuna varılmıştır. Fizyolojideki bu değişikliklerin tedavi üzerine 15 etkilerinin ortaya çıkarılması için, atak sırasında beyin sapı değişikliklerinin daha ayrıntılı görüntüleme çalışmaları ve kan beyin bariyeri incelemeleri ile desteklenmesi gerekmektedir (78).
2.9.Etyopatogenez
Bugüne kadar yapılan sayısız çalışmaya rağmen migren etiopatogenezini tek bir teoriyle açıklamak mümkün değildir. Migren internal ve external evredeki ani değişikliklere karşı gelişen nörovasküler bir reaksiyondur. Her birey, sinir sisteminin çeşitli seviyelerindeki eksitasyon ve inhibisyon arasındaki dengeye dayanan yatkınlık derecesiyle herediter bir migren eşiğine sahiptir. Geçerli teoriler; vasküler, nörojenik, hipoksik ve trigeminovasküler teoriler olup endoteliyopati son zamanlarda ortaya atılan, otonomik teori ise uzun yıllardır dikkat çeken teorilerdir (79).
2.9.1.Vasküler Teori
En eski migren teorisidir. Sacks’ ın bildirdiğine göre ilk defa Thomas Willis tarafından ortaya atılmıştır (80). Graham ve Wolf tarafından süperfisiyel temporal arterin frontal dalının pulsasyonunun amplütüdü ve migren baş ağrısının şiddeti arasındaki pozitif ilişkinin gösterilmesi, ekstrakraniyal vasküler teorinin temelini oluşturur. Migren, kraniyal damarları tutan vasküler bir kontrol bozukluğu olarak kabul edilmektedir. Migren prodromunda veya aura döneminde temel fizyopatoloji, intrakraniyal arteryel bir daralma, yani intrakraniyal vazokonstrüksiyondur. Bu durum genellikle unilateraldir. Vazokonstriksiyon serebral kan akışında bölgesel bir azalmayı da birlikte getirir. Bunu takiben beyinde meydana gelen iskemi aura fazındaki fokal nörolojik belirtileri açıklar. İskemi beyinde CO2 birikimini arttırır, bunun sonucunda arteriollerde genişlemeyle birlikte prodrom dönemi sonlanır ve eşlik eden nörolojik belirtiler kaybolur. İntrakraniyal vazodilatasyonun başlamasıyla beraber ekstrakraniyal vazodilatasyon da gelişir ve ağrı dönemine girilmiş olur. Bu dönemin başlamasından hemen önce ekstrakraniyal arteriollerde de kısa süreeli bir vazokonstriksiyon olur. Arterioler vasokonstriksiyon sonucunda, derinin kan akımında azalma ve sonucunda doku iskemisi gelişir. Diğer taraftan, deriden daha derin dokularda arteriyovenöz (A-V) şantların oluştuğu ve bunun ekstrakraniyal kan akımını hızlandırdığı düşünülmektedir. Daha sonra, deri ve deri altı dokuda kısa süreli iskemi meydana gelir. Böylece doku iskemisiyle birlikte dokudan ve damardan dışarıya ağrı eşiğini düşüren ağrıya neden olan maddeler serbest hale gelir. Ağrıya neden olan maddeler ve arterler daralmanın yarattığı mekanik
tıkanma, daha geniş arter ve arteriollerde vasodilatasyona neden olur. Gerilme ve vasodilatasyon ağrı oluşturur ve ağrıya neden olan maddeler de ya ağrı oluşturur ya da ağrı olayını arttırır. Sonuç olarak serbest kalan maddeler damarlarda ve damar etrafında ödem ve yangı meydana getirmiş olur. Her arter atımı ile damar içi kan basıncı değişimleri ağrıyı şiddetlendirir ve ağrıya zonklayıcı bir nitelik kazandırır ve yangı meydana getirmiş olur (81). Migren atağı sırasında arteriografi ve serebral kan akımı ölçümü gibi tekniklerle yapılan çalışmalar, migren aurası esnasında internal karotid arter sistem çapında ölçülebilir bir progresif azalma olduğu gösterilmiştir. Serebral kan akımı ölçümü ve serebrovasküler cevaplılık aynı zamanda vasküler bir patogenez için destek sağlamıştır. Başağrısı esnasında bir veya daha fazla ekstrakraniyal damarları etkilenen hastalarda, sıkıntı esnasında ve egzersizden sonra süperfisiyal temporal arterin frontal dalı çok kolay genişler. Böyle hastalarda migren başağrısı epizodları esnasında lokalize bir nörovasküler hiperaktivite vardır. Fakat bu nörovasküler hiperaktivite tek başına ağrı oluşumu için yeterli değildir. Migrenin ağrılı fazının başlıca trigeminovasküler sistemle iletilen ve perivasküler sinir lifleri yoluyla gelen, santral nosiseptif uyarıya bağlı olduğu düşünülmektedir (82).
2.9.2. Nöral Teoriler
Bu teoriler, beyinin migren nöbetlerinden sorumlu primer organ olduğunu iddia eder (81). Migren, primer bir beyin işlev fonksiyonunun bozukluğuyla oluşur. Serebral kan akımı auralı migren esnasında azalır, fakat aurasız migrende değişmez. Aura gelişirken kan akımı oksipital korteksden başlayan ve öne doğru 2-3 mm/dk hızla ilerleyen bir ‘yayılan oligemi’ dalgası olarak progresif bir şekilde azalır (83). ‘Yayılan depresyon’, 3 mm/dk hızla yayılan, vasküler alanlara uymayan, anormal ve deprese kortikal elektrik deşarjlarıdır. Migrene eşlik eden görsel kayıpların da aynı hızla yayıldığı bulunmuştur. Hayvanlarda yapılan araştırmalarda ‘yayılan depresyon’ un korteksle sınırlı kalmadığı, beyin sapı ve hipotalamik yapılara da yayıldığı gösterilmiştir. Yayılan oligemi, yayılan depresyon ve görsel bulguların muhtemelen aynı reaksiyonlar olduğu düşünülmektedir. Migrenin nörolojik semptomları ve ‘yayılan depresyon’ arasındaki bir ilişkinin varlığı klinik gözlem ve serebral kan akımları ölçümü temelinde gösterilmiştir (84).
İntrakarotid Xenon- 131 ile yapılan anjiografide, auralı migrende majör arteryel alanlara uymayan, oksipital korteksden başlayan ve 2 mm/dk hızla yayılan bir oligemi dalgası bulunmuştur. Bu teoriye göre, migren aurasının ana damarların vasokonstriksiyonuna ait olduğu şeklindeki geleneksel görüş kabul edilemez. Yayılan depresyon, auralı migrenin
altında yatan sebeptir. Primer nöronal olay, yayılan depresyon ve sekonder olarak vasküler değişikliklerle sonuçlanır. Baş ağrısı fazı, beynin primer bozukluğunun bir göstergesidir (84). Ağrı yollarının ve nörovasküler reflekslerin, başağrısının olmadığı dönemlerde de değişikliğe uğrayabileceği iddiası; yayılan depresyonun, beyin sapı otonomik merkezlerindeki etkisiyle uyumludur (84). Lokus seruleus, ponsta yer alır ve üzerinde noradrenerjik ağrı kontrol sistemi bulunur. Lokus seruleustan serebral kortekse yayılan projeksiyonlar kortikal oligemiyi ve muhtemelen yayılan depresyonu başlatabilir. Bu sistemdeki aktivite, baş ağrısından tamamen bağımsız olabilen migren aurasından sorumlu tutulabilir (84).
Lance’ a göre lokus seruleusdan kaynaklanan beyin sapı noradrenerjik nöronları ve rafe nükleusundan kaynaklanan serotonerjik bir sistem, kortekse yayılır ve bu sistem migrenöz olaylar için en önemli merkezdir. Hem adrenerjik hem de serotonerjik sistemler, fasiyal sinirin süperfisiyal petrosal majör dalıyla iletilen reflekslerin aktivasyonuyla ekstrakraniyal skalp kan akımını arttırır. Bu refleksler, parasempatik iletimin sfenopalatin gangliona, skalpa ve fasiyal yapılara geçen bölümüdür ve vasodilatasyona neden olur (81). Bu görüşte beyin sapı, monoaminerjik nöronların ve yollarının veya trigeminal sinirin spinal nükleusunun episodik ve aşırı bir deşarjının migren ağrısının temelinde yattığı ileri sürülür. Bu deşarj, parasempatik aktivasyon yoluyla ekstrakraniyal vasodilatasyona neden olan trigeminal nöronal deşarjları arttırarak varsayılan ağrı kapısını açar (85).
Migren patogenezi ile ilgili nörojenik bir hipotezin bir varyantı da ‘bozuk santral inhibisyon hipotezi’ dir. İlk defa 1975 yılında ortaya atılmıştır. Bu teori, serotoninin (5-HT) beyinde önemli bir fonksiyonel rolünün bulunduğunun ve bazı nörolojik hastalıklarda önemli 5-HT metabolizma anormalliklerinin varlığının saptanmasına dayanır. Beyinde 5-HT dönüşümünü azaltan ilaçların rafe sistemi nöronlarının ateşleme hızını azalttığı bulunmuştur. Bozuk santral inhibisyon hipotezi, migrene yatkınlığın rafe nöronlarının ateşleme hızlarının inhibe edilemeyen artışlarının bir sonucu olduğunu öne sürer. Bozulmuş inhibisyon aynı zamanda, migrenli hastalarda klinik olarak bulunan ve onların ağrı nöbetlerine olan yatkınlığına katkıda bulunan hiperaljeziden de sorumlu tutulabilir (82).
2.9.3.Hipoksik Teori
Bu teori, serebral hipoksinin bir migren atağını başlatan sebep olduğunu ileri sürer. Nöronların enerji gereksinimini ve tüketimi arasındaki dengesizlik nöronların hipoksisine yol açabilir ve bu dengesizlik aynı zamanda nörotoksinlerin etkisinin sonucu da olabilir. Bu teoriye göre migren nöbetlerini tetikleyici mekanizmalar, oksijen veya glikoz gereksiniminin karşılanmasındaki bir yetersizlik sonucu beyin metabolizmasındaki bir bozuklukla ilgili
olabilir. Bu yetersizliğe, beyine oksijen ve glikoz getiren kan akımındaki azalma veya biyokimyasal anormalliklerle sonuçlanan metabolik işlemler neden olabilir. Sonuç olarak hipoksik teori, oksijen veya glikoz azalmasıyla aktive olan mekanizmaların beyin disfonksiyonuna neden olduğunu kabul eder (82).
Migreni olmayan kişilerde hipoksik durumlar, migren atağındaki fokal değişikliklere yol açabilir. Beyin hipoksisi, migren atağı esnasında veya sonrasında auralı migrende bulunmuş fakat aurasız migrende bulunamamıştır. Eğer periferik vasokonstriksiyon, migren nöbetlerinde serebral dolaşımda meydana gelen primer olay olarak kabul edilirse, perivasküler otonomik inervasyon, hipoksiyi ve migren nöbetlerini başlatmada önemli olabilir. Fakat yapılan çalışmalarda, nöronların ve beynin bir bölümünün gerçek hipoksisi gösterilememiş ve oksijen tedavisi migren atağında yarar sağlamamıştır (82).
2.9.4.Trigeminovasküler Teori
Trigeminal sinir, insanlardaki baş ağrısı iletiminin başlıca afferent yoludur. Trigeminal gangliyonlar ve serebral damarlar arasındaki sinir bağlantıları trigeminovasküler sistem olarak adlandırılmıştır. Trigeminal sinir ve serebral kan damarları arasında nöral bağlantıların olduğu gösterilmiştir. Trigeminal sensoriyal C-lifleri substance P içerir. Substance P ağrı transmitteridir (86). Trigeminal sinirin antidromik stimülasyonu sensoriyal C-liflerinden substance P, CGRP ve diğer nöropeptidleri açığa çıkarır. Açığa çıkan nöropeptidler damar duvarında dilatasyon, plazma ekstravazasyonu ve steril inflamasyona neden olur. Bu da trombositlerin aktive olmasına yol açar (86). Migrenli bir hastada uyaranların tetiklediği kortikal, talamik ve hipotalamik inen yollar, beyin sapındaki dorsal rafe nukleusunda ve lokus seruleusun aktivitelerinde değişikliğe neden olur. Bu nukleusların serotonerjik ve adrenerjik santral uzantıları, kraniyal dolaşımdaki arterler ve arteriyo-venöz anastamozlarda dilatasyona neden olurlar. Arterlerdeki vasodilatasyon, trigeminal sinirin perivasküler liflerini stimüle ederek ağrıya ve vasoaktif nöropeptidlerin açığa çıkmasına neden olur. Bunun sonucu ise steril nörojenik inflamatuar cevaptır ve bu durumda ağrı daha da artar (86). Trigeminovasküler liflerin vasküler baş ağrısının patogeneziyle ilişkisinin saptanması, migren ve başka baş ağrısı ve inflamasyonla birlikte olan diğer santral sinir sistemi bozukluklarının muhtemel mekanizmalarının anlaşılmasına ışık tutmuştur (86).
2.9.5.Endoteliyopati
Damarsal yapılarda otonom sinir sistemde transmitter rollere sahip, otonomik sinir stimülasyonuyla seviyeleri değişen ve dolaşımdaki pek çok vazoaktif substans ile etkileşen