T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
DENEYSEL İSKEMİ/REPERFÜZYON
OLUŞTURULAN SIÇANLARDA ELLAGİC ASİT’İN
BÖBREK DOKUSU ve OKSİDATİF STRES
PARAMETRELERİ ÜZERİNE ETKİSİNİN
DEĞERLENDİRİLMESİ
Dr. Özlem ABA ADIYAMAN
TIPTA UZMANLIK TEZİ
T.C.
DİCLE ÜNİVERSİTESİ
TIP FAKÜLTESİ İÇ HASTALIKLARI ANABİLİM DALI
DENEYSEL İSKEMİ/REPERFÜZYON
OLUŞTURULAN SIÇANLARDA ELLAGİC ASİT’İN
BÖBREK DOKUSU ve OKSİDATİF STRES
PARAMETRELERİ ÜZERİNE ETKİSİNİN
DEĞERLENDİRİLMESİ
Dr. Özlem ABA ADIYAMAN
TIPTA UZMANLIK TEZİ
Prof.Dr. Ali Kemal KADİROĞLU
TEZ DANIŞMANI
TEŞEKKÜR
İç Hastalıkları İhtisas Eğitimim süresince üzerimde büyük emekleri olan, engin bilgi ve tecrübelerinden faydalandığım, kendileriyle çalışmaktan kıvanç duyduğum ve her zaman örnek aldığım saygıdeğer hocalarım, başta değerli hocamız Prof.Dr. Ekrem MÜFTÜOĞLU olmak üzere, İç Hastalıkları A.B.D. Başkanımız Prof.Dr. M.Emin YILMAZ’a, Prof.Dr. Vedat GÖRAL’a, Prof.Dr. Orhan AYYILDIZ’a, Prof.Dr. Kendal YALÇIN’a, Prof.Dr. Alpaslan TUZCU’ya, Prof.Dr. Muhsin KAYA’ya, Prof.Dr. Abdurrahman IŞIKDOĞAN’a, Doç.Dr. Ebubekir ŞENATEŞ'e, Doç.Dr.Mehmet Ali KAPLAN , Yrd.Doç.Dr. Faruk KILINÇ'a, Yrd. Doç. Dr. Yaşar YILDIRIM'a,Yrd. Doç. Dr. M.Sinan DAL'a, Yrd Doç. Dr. Zülfikar YILMAZ'a, Yrd.Doç.Dr. Mehmet KÜÇÜKÖNER'e teşekkür eder, saygılarımı sunarım.
Tezimin her aşamasında büyük emeği olan ve ihtisasım süresince desteklerini esirgemeyen değerli hocam Pof.Dr. Ali Kemal KADİROĞLU’na teşekkür eder, saygılarımı sunarım. Tezimin her aşamasında büyük katkıları olan değerli hocalarım Prof.Dr. Aydın KETANİ’ye, Prof. Dr. Leyla ÇOLPAN’a, Yrd.Doç.Dr. Mesut GÜL’e teşekkür eder, saygılarımı sunarım. Rotasyon eğitimim sırasında bilgilerini benden esirgemeyen Kardiyoloji A.B.D. ,Enfeksiyon Hastalıkları ve Mikrobiyoloji A.B.D.,Göğüs Hastalıkları ve Tüberküloz A.B.D.ve Radyoloji A.B.D. değerli öğretim üyelerine teşekkürlerimi sunarım. Birlikte çalışmaktan büyük onur ve zevk duyduğum Dr. M. Önder EKMEN, Dr. Elif ANIK ve tüm asistan arkadaşlarıma ve İç Hastalıkları A.B.D. çalışanlarına teşekkür ederim.
Hayatımın her döneminde destekçilerim olan sevgili aileme; tezimin düzenlenmesinde yardımcı olan ağabeyim Murat ABA değerli eşim Uz. Dr M.Şahin ADIYAMAN 'a ve canım oğlum Daran’ a sevgilerimi sunuyorum.
İÇİNDEKİLER
Sayfa no:TEŞEKKÜR...ii
İÇİNDEKİLER...iii
KISALTMALAR...vii
TABLOLAR ...viii
RESİMLER...ix
ÖZET...x
SUMMARY...xii
1. GİRİŞ ve AMAÇ...1
2. GENEL BİLGİLER...3
2.1-Böbreğin Anatomisi ve Fonksiyonları...3
2.2.İskemik Hasar...5
2.2.1. Geri Dönüşümlü Hasar:...5
2.2.2. Geri Dönüşümsüz Hasar:...6
2.2.2.1. Geri Dönüşümsüz Hasarın Mekanizmaları:...6
2.3. Reperfüzyon Hasarı...8
2.4. Oksidatif Stres, Antioksidan Savunma Sistemleri ve Böbrek Üzerine Etkileri...9
2.4.1. Oksidatif Stres...9
2.4.2. Serbest Radikaller ve Oksidanlar...10
2.4.3. Serbest Radikal Reaksiyonları...10
2.4.4. Serbest Oksijen Radikalleri...11
2.4.4.1. Süperoksit Radikalleri (O2-)...12
2.4.4.2. Hidroksil Radikalleri (OH-)...13
2.4.4.3. Hidrojen Peroksit (H2O2)...14
2.4.4.4. Hipoklorik Asit (HOCl)...14
2.4.4.5. Singlet O2 (O/4)...14
2.4.4.6. Ozon (O³)...15
2.4.5. Reaktif Nitrojen Türleri (NO, NO2, NO+, NO-)...15
2.4.6.1. Endojen Serbest Radikal Üretim Kaynakları...16
2.4.6.1.1. Mitokondriyal Elektron Transport Sistemi (METS)...16
2.4.6.1.2. Endoplazmik Retikulum (ER)...16
2.4.6.1.3. Redoks Döngüsü...17
2.4.6.1.4. Araşidonik Asit Metabolizması...17
2.4.6.1.5. Fagositoz...18
2.4.6.1.6. Otooksidasyon...18
2.4.6.1.7. Oksidan Enzim Reaksiyonları...19
2.4.6.2. Ekzojen Serbest Radikal Üretim Kaynakları...19
2.4.7. Serbest Radikallerin Vücuttaki Etkileri ...19
2.4.7.1.Serbest Radikallerin Lipitlere Etkileri...19
2.4.7.2. Serbest Radikallerin Proteinlere Etkileri...20
2.4.7.3. Serbest Radikallerin Karbonhidratlara Etkileri...21
2.4.7.4. Serbest Radikallerin DNA'ya Etkileri...21
2.5. Antioksidan Savunma Sistemleri...22
2.5.1. Enzimatik Antioksidanlar...23
2.5.1.1. Süperoksit Dismutaz (SOD)...23
2.5.1.2. Katalaz (CAT)...23
2.5.1.3. Glutatyon Peroksidaz (GSH-Px)...23
2.5.1.4. Glutation-S-Transferazlar (GST)...24
2.5.1.5. Mitokondrial Sitokrom Oksidaz...25
2.5.1.6. Tiyoller (SH)...25
2.5.2. Enzimatik Olmayan Antioksidanlar...28
2.5.2.1.Askorbik Asit...28
2.5.2.2. ß-Karoten (Vitamin A ön maddesi)...28
2.5.2.3. Vitamin E (α -Tokoferol)...28 2.5.2.4. Polifenoller...29 2.5.2.5. Transferin ve Laktoferrin...29 2.5.2.6. Seruloplazmin...29 2.5.2.7. Albümin...29 2.5.2.8. Ürik Asit...30 2.5.2.9. Bilirubin...30
2.6. Oksidatif Stres ve Antioksidan Enzimlerin Böbrek Üzerine Etkileri...30
2.7. İskemik Akut Böbrek Hasarı...32
2.7.1.ABH Tanımı, Sıklığı ve Sınıflaması ...32
2.7.2. İskemik ABH...32
2.7.2.1. İskemik ABH'nın Fizyopatolojisi...33
2.7.2.1.1. Hemodinamik Faktörler...33
2.7.2.1.2. Tübüler Yapı...34
2.7.2.1.3. Adezyon Molekülleri ve Lökosit İnfiltrasyonu...35
2.7.2.1.4. T Lenfositleri, B Lenfositleri, Monosit ve Makrofajlar...36
2.7.2.2. İskemik ABH’nın Patolojisi...37
2.8. Ellagik Asit...37
3-MATERYAL VE METOD ...39
3.1. Deney Grupları:...39
3.2. Cerrahi İşlem ...40
3.3.Serum Üre ve Kreatinin Ölçümleri...40
3.4 Paraoksonaz ölçümü: ... 40
3.5. Total oksidan seviye ölçümü (TOS): ...41
3.6. Total antioksidan Kapasite(TAK) ölçümü: ...41
3.7. Malondialdehit Ölçümü...41
3.8. Nitrik Oksit Ölçümü...41
3.9. Böbrek Dokularının Histopatolojik İncelemesi...42
3.10. İstatistiksel Analizler...42
4. BULGULAR...44
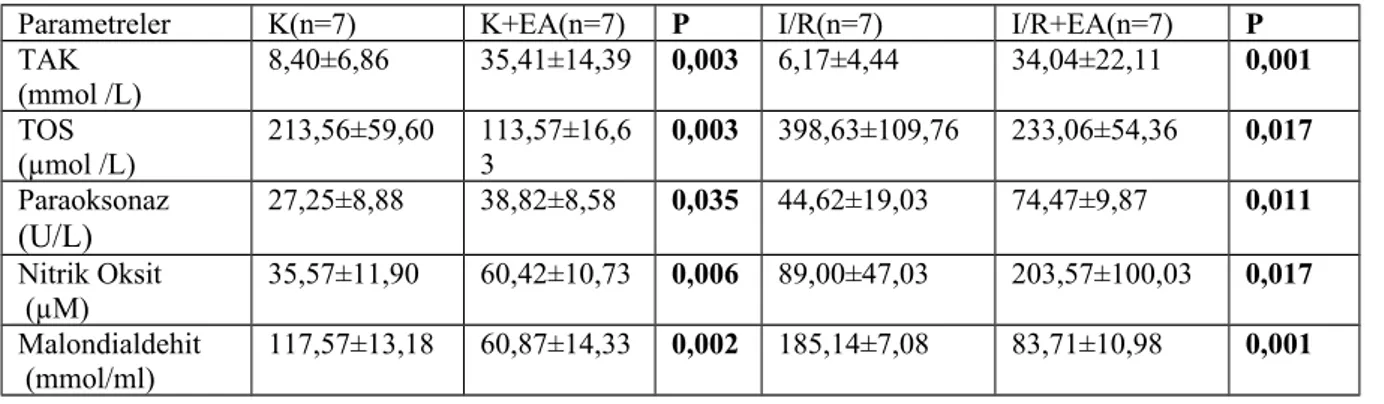
4.1.TAK Seviyeleri:...44
4.2.TOS Seviyeleri:...44
4.3.Paraoksanaz Seviyeleri:...44
4.4.Nitrik Oksit Seviyeleri:...44
4.5.Malondialdehit Seviyeleri:...45
4.6.Üre Seviyeleri:...45
4.7.Kreatinin Seviyeleri:...45
4.8.1.GrupI ( kontrol) :...47
4.8.2.Grup-II ( Kontrol+Ellagic Asit): ...48
4.8.3.Grup III ( İskemi + reperfüzyon):...50
4.8.4.Grup-IV (IR+Ellagic Asit): ...51
5-TARTIŞMA ve SONUÇ ...53
6. KAYNAKLAR...61
ABH : Akut böbrek hasarı
ACE : Anjiotensin konverting enzim
AMP : Adenozin monofosfat
ATP : Adenozin trifosfat ATN : Akut tübüler nekroz DANN : Deoksiribo nükleik asit EA : Ellagic asit
ER : Endoplazmik retikulum
GFR : Glomerüler filtrasyon hızı GSHPx : Glutatyon Peroksidaz H2O2 : Hidrojen Peroksit
HOCl : Hipoklorik asit I/R : İskemi/reperfüzyon
ICAM-1 :İntersellüler adezyon molekülü-1
CAT : Katalaz
MDA : Malondialdehit
METS : Mitokondrial elektron transport sistemi
NO : Nitrik oksit
OS : Oksidatif stres
OH- : Hidroksil Radikalleri
PMNL : Polimorf nüveli lökositler PON : Paraoksanaz
RNA : Ribonükleik asit
ROT : Reaktif oksijen türleri SOD : Süperoksit dismutaz SOR : Serbest oksijen radikalleri TAK : Total antioksidan kapasite
TOS : Total oksidatif stres
XOD : Xsantin oksidaz
Tablo 1: Oksijen türevi bileşikler
Tablo 2: Fagositlerin ürettiği reaktif oksidan ürünler
Tablo 3:Reaktif oksijen partiküllerinin patogenezinde rol oynadığı düşünülen böbrek hastalıkları
Tablo 4: Histopatolojik skorlama
Tablo 5: Rat gruplarında serum oksidan - antioksidan parametrelerinin karşılaştırılması Tablo 6: Rat gruplarında doku oksidan- antioksidan parametrelerinin karşılaştırılması Tablo 7: Deney gruplarının serum üre ve kreatinin değerlerinin karşılaştırılması Tablo 8: Deney gruplarının doku üre ve kreatinin değerlerinin karşılaştırılması
RESİMLER
Resim 1.1 : Deney için hayvanın hazırlanmasıResim 1.2 : Nativ Böbrek
Resim 1.3 : İskemik böbreğin dıştan görünümü Resim 1.4 : Reperfüzyon böbreğin dıştan görünümü Resim-2: Grup-I’e ait böbreğin görünümü
Resim-3: Grup-I’e ait böbreğin görünümü Resim-4: Grup-I’e ait böbreğin görünümü
Resim-5: Grup-II’ye ait böbreğin mikroskobik görünümü Resim-6: Grup-II’ye ait böbreğin mikroskobik görünümü Resim-7: Grup-II’ye ait böbreğin mikroskobik görünümü Resim-8: Grup-III’e ait böbreğin görünümü
Resim-9: Grup-III’e ait böbreğin görünümü Resim-10: Grup-III’e ait böbreğin görünümü
Resim-11: Grup-IV’e ait böbreğin mikroskobik görünümü Resim-12: Grup-IV’e ait böbreğin mikroskobik görünümü Resim-13: Grup-IV’e ait böbreğin mikroskobik görünümü
Giriş: Akut Böbrek Hasarı (ABH), saatler veya günler içerisinde, ani olarak böbrek
fonksiyonlarının bozulması ve buna bağlı olarak azotlu maddelerin vücutta birikmesi olarak tanımlanmaktadır. ABH morbidite ve mortalite nedenleri arasında önemli bir yer tutmaktadır. ABH patogenezinin kısmen daha iyi aydınlatılmasına rağmen, mortalite oranlarında yeterli azalma sağlanamamıştır. İskemi/Reperfüzyon (I/R) hasarından en fazla etkilenen organlar böbreklerdir. Serbest oksidatif radikaller, I/R hasarına yol açan önemli faktörlerdir. Ellagic Asit (EA) antioksidan, antiinflamatuvar, antihiperlipidemik ve antikarsinojenik etkileri hem in vitro hem de in vivo olarak gösterilmiş fenolik bir bileşiktir.
Amaç: Çalışmamızda, deneysel iskemi reperfüzyon oluşturulan sıçanlarda Ellagic
Asitin böbrek dokusu ve oksidatif stres parametreleri üzerine etkilerini değerlendirmektir.
Materyal Metod: Çalışma toplam 28 adet erişkin erkek 250-280 gram ağırlığında olan Sprague Dawley türü erkek sıçan ile yapıldı. Denekler Grup 1 (Kontrol), Grup 2 (Kontrol+Ellagic Asit), Grup 3(İskemi/Reperfüzyon) ve Grup 4 (İskemi/Reperfüzyon + Ellagic Asit) olmak üzere dört gruba ayrıldı. Cerrahi işlem olarak her iki böbrek pedikülü ortaya konulduktan sonra, sağ böbrek çıkarıldı, sol böbrek pedinkülü etrafında 360 derece döndürüldü. 45 dk iskemi uygulandı, renk değişikliği gözlendi ve 1 saat reperfüzyon uygulandıktan sonra böbrek çıkarıldı ve intra kardiyak kan örneği alındı. Ellagic Asit olarak Ellagic Active 30mg-30 tb (Source Naturals, Santa Cruz,USA) kullanıldı.
Bulgular: Renal I/R sonrası yapılan serum ve doku analizlerinde kontrol grubuna göre
İ/R grubunda oksidatif stres parametrelerinde artış izlendi. Yine aynı şekilde histopatolojik olarak glomerül yapılarında bozulma, atrofik yapı, proksimal ve distal tubullerde diffuz hidropik dejenerasyon izlendi (skor 3). İ/R+Ellagic Asit grubunda, hem doku hem de serum analizlerinde TOS ve Malondialdehit düzeyleri daha düşük bulundu (p:0,017-p:0,001); TAK, Paraoksanaz ve Nitrik Oksit seviyeleri daha yüksek olup istatiksel açıdan anlamlı fark izlendi (p:0,001-p:0,011-p:0,017). Histopatolojik olarak da İ/R+Ellagic Asit grubunda, İ/R grubuna göre daha az oranda glomerül yapılarında bozulma, atrofik yapı, proksimal ve distal tubullerde diffuz hidropik dejenerasyon izlendi( Skor 2 ).
Sonuç: Elimizdeki verilere göre EA’in renal I/R hasarına karşı kemoprotektif etkisi
olabilmektedir. Bu etkisini, serbest radikalleri temizlemesine ve antioksidan sistemi destekleyerek oksidatif stres oluşturan elementlerin üretimini azaltmasına bağlamaktayız
Ellagic asidin ABH lı hastalarda kullanımının umut verici olabileceğini düşünmekteyiz fakat daha geniş kapsamlı deney hayvanı ve insan çalışmalarına ihtiyaç duyulmaktadır.
Anahtar Kelimeler: Böbrek, iskemi/reperfüzyon, ellagic asit, oksidatif stres
Aim:Sudden deterioration of renal function and according to the renal dysfunction
nitrogenous substances accumulate in the body within hours or days,This is defined as acute kidney injury (AKI).AKI is one of the important cause of morbidity and mortality. Although the pathogenesis of AKI has been illuminated partially , ıt has not been achieved lower mortality rates of AKI. The kidney is the most affected organ from Ischemia / reperfusion (I / R) injury. Free oxidative radicals, are major factors that cause I / R injury. Ellagic acid (EA), is a phenolic compound, that antioxidants, anti-inflammatory, anticarcinogenic, antihyperlipidemic effects has shown both in vitro and in vivo In our study, is to detect the effects of Ellagic Acid on experimental ischemia-reperfusion on renal tissues and oxidative stress parameters in rats.
Material and Metods: A total of 28 adult male Sprague-Dawley rats which weighs
250-280 g, were used in the study. The subjects were divided into four groups: Group 1 (Control), Group 2 (Control + Ellagic Acidrgical procedure was performed in the following way. First we exposed both of renal pedicl), Group 3 (Ischemia / Reperfusion) and Group 4 (Ischemia / Reperfusion + Ellagic Acid) .Su es the right kidney was removed, after that the left kidney was rotated 360 degrees around the peduncle. 45 min ischemia was administered and discoloration was observed. After 1 hour reperfusion administration, the kidneys were removed and intra cardiac blood sample was taken. Ellagic Acid as ellagic 30mg Active TB-30 (Source Naturals, Santa Cruz, USA) was used.
Results: Analysis of serum and tissue, We compared to the control and comparison
group. An increase was observed in oxidative stress parameters in ıschemia / reperfusion group. In the same way, deterioration of glomerular structure, atrophic structure, diffuse hydropic degeneration in the proximal and distal tubules was observed histopathologically (score 3) İn both tissue and serum analysis TAC, paraoxanase and Nitric Oxide levels were higher in. I / R + Ellagic acid groups. and the difference were statistically significant (p: 0.001 :0,011-p-p: 0.017). Histopathologically, I / R group were compared with I / R + Ellagic Acid group.İn I / R + Ellagic Acid group, deterioration of glomerular structure, atrophic structure, diffuse hydropic degeneration in the proximal and distal tubules were considerably less than those observed in I / R group (score 2).
Conclusion: Ellagic acid may have chemoprotective effect on the renal I / R injury.
oxidative stress by supporting antioxidant system .We think that EA is useful for preventing from AKI; but we need more experimental animal and comprehensive human studies in this topic.
1- GİRİŞ VE AMAÇ
Herhangi bir organa gelen kan akımının çeşitli nedenlerle (cerrahi işlemler, tromboz, hipovolemi, transplantasyon gibi) yetersiz hale gelmesine veya durmasına iskemi denir. Bu durum organizmada hipoksik doku hasarına yol açar. Uzun iskemi süresi hücre bütünlüğünün kaybına, devam etmesi halinde hücresel ölüm ile sonuçlanır. Reperfüzyon, hipoksik dokunun kanlanması ve oksijenlenmesinin yeniden başlamasıdır. Reperfüzyonla, iskemi sırasında özellikle dokuya gelip yerleşen polimorfonükleer (PMN) hücrelerce salınan medyatörler ve serbest oksijen radikalleri (SOR) aracılığıyla dokudaki yıkımın artışına da reperfüzyona bağlı doku hasar denir (1-3).
İskemi reperfüzyon (I/R) hasarından en fazla etkilenen organlar böbreklerdir. Akut böbrek hasarı (ABH) morbidite ve mortalite nedenleri arasında önemli bir yer tutmaktadır. Normal popülasyonda % 1’in altında olan ABH sıklığı, hastaneye başvuran hastalarda % 5, yoğun bakım ünitelerinde yatan hastalarda % 30, kardiyopulmoner cerrahi geçiren hastalarda % 15 düzeyindedir. Hemodiyalizin yapılmaya başlanmasından sonra mortalite oranları günümüzde % 50’ye kadar düşmüştür. ABH patogenezinin kısmen daha iyi aydınlatılmasına rağmen, mortalite oranlarında yeterli azalma sağlanamamıştır. Mortalite yoğun bakım hastaları ve multiorgan yetmezliği olan hastalarda daha da artarak % 80-90 lara ulaşmaktadır (4-8).
ABH, saatler veya günler içerisinde, ani olarak böbrek fonksiyonlarının bozulması ve buna bağlı olarak azotlu maddelerin vücutta birikmesi olarak tanımlanmaktadır. Böbrek hasarının ağırlığına ve süresine bağlı olmakla birlikte, asidoz, sıvı-elektrolit denge bozuklukları gibi metabolik bozukluklar da tabloya eklenebilir. Bu hastaların % 20-60’ında diyaliz ihtiyacı olmaktadır (7-9). ABH’da patogenezin aydınlatılması, koruyucu önlemlerin ve daha etkin tedavi yöntemlerinin geliştirilmesi, morbidite ve mortalitenin azaltılması açısından önemli olmaktadır.
İskemik ABH, ister prerenal nedenlere ister intrarenal vasküler patolojilere bağlı gelişsin; renal kan akımındaki bozulma nedeniyle meydana gelir ve uygun tedavi yapılmadığında kronik böbrek hastalığı, son dönem böbrek hastalığı veya ölümle sonuçlanabilir (8-11). İskemik ABH çoğunlukla büyük kardiyovasküler ameliyatlardan sonra, çeşitli ürolojik girişimlerde, travma, sepsis, ağır volüm kaybı ile giden durumlarda ve böbrek transplantasyonunda görülür (5,11). Böbrek transplantasyonu sırasında donör organın I/R hasarına maruz kalması, postoperatif dönemde greft fonksiyonlarının gecikmesine, hatta greft
kaybına neden olabilmektedir. I/R hasarının önlenmesine yönelik girişimlerin greft fonksiyonları ve greft yaşam süresi üzerine olumlu etkilerinin bulunduğu bilinmektedir(12,13). Bu nedenle böbreği, özellikle büyük ameliyatlar ve renal transplantasyon sırasında oluşan akut renal I/R hasarından korumak için koruyucu tedavilerin bulunması ve uygulanması gereklidir. İnflamatuar hücre infiltrasyonu ve oksidatif stres, I/R hasarının ortaya çıkmasında önemli mekanizmalardır (14-16). Serbest oksijen radikallerinin potansiyel zararlarına karşılık koruyucu antioksidan sistemler ile radikal hasar önlenmeye çalışılır. Vücuttaki oksidan ve antioksidan sistemler arasında bir denge söz konusudur (3). Antioksidanlar, hücre içinde oksijenin metabolize edildiği her durumda, serbest radikallerin zararlı etkilerini azaltmak için çalışırlar. Antioksidan savunmada öncelikle etkili sistemler enzimatik antioksidanlardır. Son dönemlerde yapılan çalışmaların çoğunluğu, I/R hasarını engelleyecek veya hafifletecek eksojen ajanlar üzerine yoğunlaşmıştır. Bu çalışmada amacımız, antioksidan olan Ellagic Asit’in İ/R hasarı yapılan sıçanların böbrek dokusu ve oksidatif stres üzerine etkilerini değerlendirmektir.
2. GENEL BİLGİLER
2.1-Böbreğin Anatomisi ve FonksiyonlarıBöbrekler, retroperitoneal boşlukta, paravertebral lokalizayonda, 12. torakal vertebra ile 3. lomber vertebra arasında yerleşmişlerdir. Sağ böbrek, karaciğer ile komşuluğundan dolayı sola göre 1-2 cm daha aşağıdadır. Her biri 150-200 gr ağırlığında, 12-13 cm uzunluğunda, 6-7 cm eninde ve 2,5-3 cm derinliğindedir. Sağ böbrek üstte sürrenal, üst ve önde karaciğer, hilus seviyesinde duodenum, altta ve lateral kenarda kolon ile sınırlı iken; sol böbrek ise üstte sürrenal bez, önde mide, dalak, pankreas, jejunum, ve desendan kolon ile sınırlandırılmıştır. Her iki böbrek arkada diafragma, kuadratus lumborum ve psoas kaslarına dayanır. Böbrekler içten dışa doğru; fibröz kapsül, perirenal yağ dokusu, Gerota fasyası ve pararenal yağ dokusu ile sarılmıştır. Her bir böbreğin ön ve arka yüzeyleri, iç ve dış kenarları, üst ve alt polleri vardır ve üst polleri alt pole göre orta hatta 1 cm daha yakındır. Dış kenar konkav, iç kenar ise konveks şeklindedir. İç kesimde renal hilus denilen ve içinden renal arter, renal ven, renal pelvis, üreter, lenfatiklerin ve sinirlerin geçtiği bir yarık bulunur. Renal hilus böbrek içinde, 2.5 cm derinliğinde olan ve içinde renal pelvis, renal kaliks, renal damarlar ve sinirler ile değişik miktarlarda yağ dokusunun bulunduğu renal sinüs olarak devam eder (17,18).
Her bir böbrek, lomber 2. vertebra düzeylerinde aortadan köken alan renal arterler ile kanlanır. Renal arter hilustan böbreğe girdikten sonra önce interlobar daha sonra arkuat arterlere ayrılır. Arkuat arterlerden dik olarak interlobüler arterler çıkar. Bu arterlerden glomerüle giden afferent arterioller köken alır. Glomerülü oluşturan kapillerler birleşerek efferent arteriolleri oluşturur. Efferent arterioller daha sonra dallanarak tübülüsleri saran, böbrekteki 2. kapiller ağ sistemi olan peritübüler kapiller ağı oluşturur. Peritübüler kapillerlerden gelen kan venöz sisteme dökülür. Oradan sırası ile arteryel sistemle paralel olarak interlobüler ven, arkuat ven, interlobar ven ve renal veni takip eder. Renal venler ise inferior vena kavaya drene olurlar (18,19).
Üreterin üst kısmının genişlemesi ile oluşan renal pelvis ilk önce 3 majör kalikse, majör kaliksler de veya daha fazla minör kalikse bölünür. Böbrek sagital olarak kesildiğinde dışta korteks, içte medulla olmak üzere 2 kısımdan oluşur. Medulla, medüller piramit ismi verilen 10-18 adet piramidal yapıdan oluşur. Piramitlerin tabanları kortikomedüller bölgede bulunurken, tepe kısımları kaliks içine kadar uzanır. Kaliks içine açılan bu kısımlara papilla
ismi verilir. Korteks böbreğin dış kısmının yanı sıra medüller piramitler arasında da yer alır ve bu kısma Bertini'nin böbrek kolonları denir (17,20).
Böbrekte idrar oluşumunu sağlayan en küçük yapısal ve anatomik birim nefrondur. Her bir böbrekte, her birinin idrar yapabilme fonksiyonu olan yaklaşık 1 milyon nefron bulunur. Böbrek yeni nefron rejenere edemez. Dolayısıyla renal bir hasar, hastalık veya normal yaşlanma ile nefron sayısında kademeli bir azalma olur. Her bir nefronun iki kısmı vardır: 1) Glomerül; sıvının kandan filtre edildiği ham, 2) Tübülüsler; filtre edilen sıvının idrara dönüştüğü proksimal ve distal tübülüsler, Henle Kulpu ile toplayıcı kanallardan oluşan kısımdır. Glomerüller, proksimal ve distal tübülüsler ve dış korteksteki nefronlann Henle kulpları kortekste; toplayıcı kanallar, Henle kulpları ve vasa rectalar medüllada bulunur. Nefronlar böbrek dokusunda ilerledikleri derinliğe göre, kortikal ve jukstaglomerüler olmak üzere 2 tiptir. Glomerül, dallanan ve anastomozlar yapan ve epitelyal hücreler ile kaplı kapiller bir yumaktır. Bowman kapsülü denen bir yapı içinde bulunur. Glomerülden filtre edilen sıvı sırasıyla proksimal tübül, henle kulpu, distal tübül ve toplayıcı kanallardan geçer, renal papillalann içinden renal kalikse açılır. Oradan da renal pelvise ve üretere geçer. Distal tübülüsün başlangıcı her nefronda afferent ve efferent arteriyoller ile temas halindedir ve bu üç yapı jukstaglomerüler aparatus denen yapıyı oluşturur. Bu aparatusun görevi renin salgılayarak kan basıncı üzerinde etkili olmak, glomerüler filtrasyon ve renal kan akımını düzenlemektir. Jukstaglomerüler aparatusun distal tübülüsteki değişiklik gösteren hücrelerine maküla densa ismi verilir ve distal tübülüsteki sıvının birleşimine göre jukstaglomerüler aparatusun aktivitesini ayarlar (18,19)
Nefronların temel işlevi istenmeyen maddeleri plazmadan temizlemektir. Bu işlem için kullanılan mekanizmalar şunlardır (18,19) :
1) Glomerüler Filtrasyon: Glomerüldeki kanın plazmasının bir bölümü (yaklaşık 1/5'i) glomerüler membrandan filtre edilir.
2) Tübüler Reabsorpsiyon: Filtre edilen av, tübüllerde ilerlerken su ve diğer gerekli maddeler reabsorbe edilir. İstenmeyen maddeler geri emilmez ve idrar oluşumuna katkıda bulunur.
3) Tübüler Sekresyon: Plazmadaki bazı maddeler tübülleri döşeyen epitel hücrelerince doğrudan tübüler sıvı içine sekrete edilir.
Böbreğin temel fonksiyonları şöyle sıralanabilir (18,19):
1) Vücut su ve elektrolit dengesinin korunması: Su, sodyum, potasyum, hidrojen, bikarbonat, kalsiyum, fosfor, magnezyum dengesi gibi.
2) Metabolik atıkların atılımı: Üre, ürik asit, kreatinin gibi
3) İlaçlar, toksik maddeler ve metabolitlerin detoksifikasyonu ve atılımı.
4) Ekstrasellüler sıvı hacminin ve kan basıncının hormonal düzenlenmesi: Renin-anjiotensin sistemi, Renal prostaglandinler, Renal kallikrein-kinin sistemi.
5) Hormon üretimi ve metabolizması: Eritropoietin, D vitamini gibi
6) Peptit yapılı hormonların yıkımı: İnsülin, glukagon, parathormon, kalsitonin, büyüme hormonu vb.
7) Küçük molekül ağırlıklı proteinlerin yıkımı ve atılımı: Hafif zincirler, beta2-mikroglobülin gibi
8)Metabolik etki: Glukoneogenez, lipid metabolizması gibi
2.2.İskemik Hasar
İskemi; dokunun ihtiyaç duyduğu oksijen ve diğer metabolitlerin sağlanması ve oluşan atık ürünlerin ise uzaklaştırılması için gerekli ve yeterli dolaşımın sağlanamamasıdır. İskemi, akut veya kronik olabilir. İskemik hasarın derecesi, hipoksinin derinliğine ve süresine bağlıdır. Sonuçta iskemi hücresel enerji depolarının boşalması ve toksik metabolitlerin birikmesi ile hücre ölümüne yol açmaktadır (21,22).
2.2.1. Geri Dönüşümlü Hasar:
Normal koşullarda 3-4 dakikalık iskemi, yüksek enerjili fosfat olan fosfokreatinin ile adenozin trifosfat (ATP) depolarının boşalmasına ve enerji bağımlı membran iyon pompalarının normal iyon gradiyentini gerçekleştirememelerine yol açar (23). Aerobik solunum yani mitokondrilerdeki oksidatif fosforilasyon, hipoksinin hücrede ilk etkilediği işlemdir. O2 basıncının azalmasıyla hücre içi ATP depolarındaki azalma, birçok sistem
üzerinde etkili olur. Plazma membranlarında bulunan ATP bağımlı sodyum (Na+) pompasının aktivitesi azalır. Bunu, Na+'un hücre içinde birikimi ve potasyumun (K+) hücre dışına çıkışı takib
eder. Na+ konsantrasyonundaki artış, suyun izoozmotik artışına ve akut hücresel şişmeye neden olur. Bu şişme, inorganik fosfatlar, laktik asit ve pürin nükleozitleri gibi diğer metabolitlerin birikimi ile artan hücre içi ozmotik yükle daha da ilerler (24).
Hücresel ATP de azalma ile birlikte adenozin monofosfat (AMP) artışı fosfofrüktokinaz enzimini aktive ederek anaerobik glikolizi artırır. Anaerobik glikolizde, aerobik glikolizle elde edilen ATP'nin ancak % 7si elde edilebilmektedir (25). Sonuçta; glikojen hızla tükenir, artan glikoliz ise fosfat esterlerinin hidrolizi ile laktik asit ve inorganik fosfatların birikimiyle hücrede asidoza neden olur. Ribozomların granüllü endoplazmik retikulumdan (GER) ayrılması ve polizomlardan monozomların olusumu ile protein sentezinde azalma bunu takip eder. Hipoksinin devam etmesi ile mitokondrial fonksiyonun daha da kötüleşmesi ve membran geçirgenliğinin artışı sonucunda morfolojik hasar artar. Hücrenin ana hatları, mikrovillus gibi ultrastrüktürel özelliklerin kaybı ve hücre yüzeyinde kabarcıkların oluşumu ile bozulur. Mitokondri, endoplazmik retikulum ve tüm hücreler ozmotik regülasyonun bozulmasından dolayı şişmişlerdir. İskemi düzeltilir ve O2 düzeyleri normale
dönerse tüm bu bozulmalar geri dönebilir, ancak iskemi ve hipoksi devam ederse geri dönüşümsüz hasar meydana gelir (26).
2.2.2. Geri Dönüşümsüz Hasar:
Morfolojik olarak geri dönüşümsüz hasarda mitokondrilerin şiddetli vakuolizasyonu ve mitokondri matriksinde şekilsiz, kalsiyumdan (Ca2+) zengin depozitlerin birikimi görülür. Bununla
birlikte, plazma membranlarında büyük ölçülü hasar ve lizozomlarda şişme eşlik eder. Özellikle iskemik alanın reperfüzyonu hücre içine masif Ca2+ akışına ve Ca2+ 'a bağlı değişikliklere yol açar.
Geçirgenliği bozulan membranlardan proteinlerin, esansiyel koenzimlerin ve ribonükleik asitlerin kaybı devam eder. Membranlardan ATP sentezi için gerekli olan metabolitler de kaybedileceğinden, hücre içi yüksek enerjili fosfat bileşikleri daha da azalır. Lizozomal membranların hasan, lizozomal enzimlerin sitoplazmaya kaçmasına neden olur. Asit hidrolazlar, iskemik hücrenin asidik pH'sında aktif hale geçip sitoplazmik ve nükleer elemanları yıkıma uğratır. Lizozomal hidrolazlar, hücre ölümü gerçekleştikten sonra da, hücresel elemanları sindirmeye devam ederler (1).
2.2.2.1. Geri Dönüşümsüz Hasarın Mekanizmaları:
Geri dönüşümsüz hücre hasarının iki özelliği vardır; birincisi mitokondriyal fonksiyon kaybının kan akımı ve/veya oksijenlenmenin düzelmesinden sonra dahi geri dönmemesi, ikincisi ise hücre membran fonksiyonlarının ileri düzeyde bozulmasıdır (27).
Geri dönüşümsüz hücre hasarının patogenezinde hücre membran hasarının kilit nokta olduğunu destekleyen çok kanıt vardır. Hacim regülasyonunun kaybı, hücre dışı moleküllere karşı permeabilite artışı ve ultrastrüktürel olarak gösterilebilen plazma membran defektleri geri dönüşümsüz hasarın erken evrelerinde dahi görülmektedir (28).
1- Membran fosfolipidlerinin progresif kaybı; İskemik karaciğerde, geri dönüşümsüz hasarda membran fosfolipidlerinde belirgin azalma mevcuttur. İskemiye bağlı sitoplazmik Ca2+ artışı ile endojen fosfolipazların aktivasyonu, artan parçalanmaya bir
açıklama olabilir. Ayrıca progresif fosfolipid kaybı, ATP bağımlı reaçilasyonun veya fosfolipid sentezinin azalmasına ikincil olarak da gelişebilir.
2- Hücre iskelet anormallikleri; Hücre içi Ca2+ artışıyla aktive olan proteazlar hücre
çatısını hasara uğratabilir. Hücresel şişmede, bazı medyatörler hücre membranının hücre iskeletinden ayrılmasına neden olarak membranı gerilmeye ve yırtılmaya duyarlı kılabilir.
3- Serbest oksijen radikalleri (SOR).
4- Lipid yıkım ürünleri; Fosfolipid parçalanması sonucu iskemik hücrelerde biriken bu katabolik ürünler membranlar üzerinde deterjan etkisi yaparak zararlı etkilere neden olabilirler.
Membran hasarının mekanizmaları ne olursa olsun sonuç aşırı miktarda Ca2+'un hücre içine
girmesidir. Hücre içi Ca2+ artışı hücreye potansiyel zararlı etkilere sahip fosfolipazlar (membran
hasarına yol açar), proteazlar (membran ve sitoiskeletal proteinleri parçalar), ATP azlar (ATP tüketilmesini hızlandırırlar) ve endonükleazlar (kromatinin parçalanmasını sağlar) gibi çok sayıda enzimi aktifler (29). Hücre hasarında 4 ana sistem etkilenir:
1- Hücre membran bütünlüğü, hücre ve organellerinin iyonik ve osmotik dengesi 2- Aerobik solunum, mitokondrial oksidatif fosforilasyon ve ATP oluşumu 3- Protein sentezi
4- Hücrenin genetik aparatı
Hücresel fonksiyonlar hücre ölümünden önce kaybolur ve hücre hasarının morfolojik değişiklikleri hücrede bazı kritik biyokimyasal sistemlerin bozulmasından sonra aşikar olarak ortaya çıkar. Öldürücü hasarın morfolojik bulgularının ortaya çıkması, geri dönüşümlü hasarın gelişmesinden daha uzun zamana ihtiyaç duyar. Hücresel şişme geri dönüşümlü bir hasar olup dakikalar içinde ortaya çıkabilir. Hücre ölümünün ışık mikroskobik bulguları miyokardta tam iskemiden 10-12 saat sonrasına kadar görülmezken, geri dönüşümsüz hasar 20- 60 dakika içinde ortaya çıkabilmektedir. Geri dönüşümsüz hasar, morfololojik olarak hücrelerde şiddetli şişme, plazma membranında aşırı hasar ve lizozomda şişme ile karakterizedir. Mitokondrial matrikste büyük, kümelenmiş amorf dansiteler meydana gelir. Membranlardan protein, enzim, koenzim ve ribonükleik asitlerin kaybı ile birlikte ATP sentezi için ihtiyaç duyulan metabolitlerin kaybı da vardır. Yüksek enerjili fosfat depoları azalır. Bu dönemde lizozomal membranlarda ortaya çıkan hasarla birlikte lizozomal enzimler sitoplazmaya sızar. Hücresel komponentler enzimatik sindirime uğrar. Ölümden sonra hücre
komponentleri ilerleyici olarak parçalanarak fagositoza uğrar veya yağ asitlerine indirgenir. Yağ asitlerinin kalsifikasyonu ile de Ca2+ sabunları oluşabilir (30).
Geri dönüşümsüz hasarın temelinde iki olay vardır; birincisi belirgin enerji azalmasının neden olduğu olayları geri döndürmede yetersizlik, ikincisi membran fonksiyonlarının ileri düzeyde kaybıdır (31).
2.3. Reperfüzyon Hasarı
Reperfüzyon, iskemide kalan dokuya kan akımının ve bununla birlikte O2'nin tekrar
gelmesidir, yani dolaşımın düzeltilmesidir. Eğer hücrede geri dönüşümsüz hasar oluşmamış ise enerji depoları ve hücresel homeostaz geri kazanılır. Reperfüzyon sağlanırken iskemik hücreler geri dönüşümsüz hasara uğrayabilirler (32). Hatta reperfüzyon sonucunda ortaya çıkan hasar iskeminin tek başına oluşturduğu hasardan daha ağır olabilir (33).
İskemi sonucunda hücre içindeki yüksek enerjili adenin bileşikleri olan ATP ve ADP, AMP'ye indirgenir ve hücre içi AMP düzeyleri yükselir. Artmış AMP'den adenozin ayrılarak sırayla inozin ve hipoksantine dönüştürülür. ATP azalması membranların iyon gradiyentini koruyamamasına ve hücre içine Ca2+ girişine yol açar (34). Hücre içine giren Ca2+,
proteazlan aktifleyerek ksantin dehidrogenazdan ksantin oksidaz oluşumuna yol açar ve ksantin oksidaz aracılığı ile de sırasıyla hipoksantinden ksantin ve ürik asit oluşur. Reperfüzyon sırasında dokuya gelen bol miktarda O2 molekülünden, bu reaksiyonlar sırasında
serbest oksijen radikalleri, süperoksit ve hidrojen peroksit (O2--, H2O2) meydana gelir.
Hücredeki iskemi eğer hipoksantin yıkılmaya başlamadan önce düzeltilip yeterli oksijen sağlanırsa, hipoksantin ve diğer bileşiklerden tekrar ATP oluşur (35,36).
İskemi sonrası dokudaki diğer önemli bir SOR kaynağı da nötrofillerdir. Nötrofillerin membranlarında bulunan NADPH bağımlı oksidaz sistemleri SOR oluşumunun en önemli kaynaklarından biridir. Bu enzim sistemi normalde inaktif olup, bakteriler, mitojenler yada sitokinlerce aktive edildiklerinde O2'nin H2O2'e ve O2'e dönüşmesini sağlarlar. O2-.
oluşumunda nötrofil kemotaksisinin de önemi büyüktür. Ca2+ da fosfolipaz A2 aktivitesini
sağlayarak, lökotrienlerin aktive ettiği polimorfonükleer (PMN) hücreler üzerinden O2-.
oluşumunu gerçekleştirir. PMN kaynaklı reperfüzyon hasarı mikrovasküler alana kemotaktik birikimi ve mikrovasküler endotele adezyonla karakterizedir (37). I/R etkisinin dokuda nötrofil birikimi ile doğrudan ilişkili olduğu ve bu birikimin normal homeostazla kıyaslandığında iskemik dönemde 5 kat ve reperfüzyon döneminde ise 18 kat daha fazla olduğu gösterilmiştir (38). Nötrofil
bağımlı reperfüzyon hasarında nötrofil adezyonu en önemli basamak olup, nötrofil membran molekülü olan CD18, nötrofillerin mikrovaskuler endotele adezyonunda en önemli rolü üstlenen glikoprotein yapılı moleküldür. CD18 reseptörleri, monoklonal antikorlar ile inhibe edilerek nötrofillerin kapiller endotele kemotaksi, agregasyon ve adezyon etkileri baskılanır (39).
Ksantin oksidaza bağımlı SOR oluşumu ve etkinliği çok kısa sürmekte ve hipoksantinin tükenmesiyle tamamen durmaktadır. Ancak, nötrofil aktivasyonu devam ettiği ve ortamda oksijen bulunduğu sürece NADPH bağımlı SOR üretimi devam edecektir.
2.4. Oksidatif Stres, Antioksidan Savunma Sistemleri ve Böbrek Üzerine Etkileri 2.4.1. Oksidatif Stres
Oksidatif stres; herhangi bir nedenle oksidan üretiminde artış ve antioksidan savunma mekanizmasında yetersizlik nedeniyle aradaki dengenin bozulması sonucunda oluşan doku hasarı olarak tanımlamaktadır (40).
Oksidatif stres insandaki birçok patolojik durumun meydana gelmesinde, ilerlemesinde ve komplikasyonlarının ortaya çıkmasında önemli yere sahiptir. Bu konuyla ilgili yapılan çalışmalar çoğunlukla oksijenin indirgenmesiyle oluşan serbest radikallerin organizmadaki biyolojik ve kimyasal özelliklerine aittir. Oksijen, serbest radikallerin ana kaynaklarından birisi olup genel görüş, serbest radikallerin oksidan özelliğinin yapısındaki oksijenden kaynaklandığı yönündedir.
Gerçekte oksijen radikallerinin üretimi normal biyolojik fonksiyonların ayrılmaz bir parçasıdır. Serbest radikaller her zaman oksidan aktivite göstermez ve sadece oksidatif stresten sorumlu değildirler. Serbest radikaller ve oksidasyon organizmada birçok biyokimyasal reaksiyon ve hücre iletim sisteminde rol almaktadırlar. Bazal koşullarda tüm aerobik hücrelerde; solunum, fagositoz, araşidonik asit metabolizması gibi reaksiyonlarda bir miktar serbest oksijen radikali oluşur ve bunlar sağlıklı bir organizmada antioksidan savunma mekanizmaları tarafından hızla ortadan kaldırılır (41,42).
Oksidatif stres, tüm hücrelerde yapısal ve fonksiyonel değişiklikler oluşturarak hasara neden olabilir. Oksidatif stresin hücredeki başlıca bilinen hedefleri çoklu doymamış yağlar, şekerler, proteinler ve nükleik asittir. Oksidatif stres, iyon dengesi hücre redoks sistemini, hücre içi haberleşmeyi ve gen transkripsiyonunu etkiler, sonuç olarak, hücre döngüsünü etkileyerek hücrenin ölümüne neden olur (43).
2.4.2. Serbest Radikaller ve Oksidanlar
Serbest radikaller; paylaşılmamış bir veya birden fazla elektrona sahip molekül veya atomlar olup, paylaşılmamış elektronun üzerinde olduğu oksijen molekülleridirler (44). Ortamda bulunan kimyasal veya fiziksel enerji kaynaklarının, kovalent bağlarında hemolize sebep olarak iki farklı türde paylaşılmamış olan elektron oluşturması serbest radikal oluşumuna neden olur. Bir diğer radikal oluşturma yöntemi de redoks reaksiyonudur. Bu reaksiyonlarda bir elektronun kaybı veya kazanılması söz konusudur.
A ---► e- + A + (Oksidasyon) B + e- ---► B- (Redüksiyon-İndüksiyon)
Her oksidasyon bir redüksiyonla birliktedir. Böylece kütle kuralına göre oksidatif streste her iki reaksiyon da yer alır. Serbest radikallerin aktiviteleri farklılık gösterir. Hidroksil (HO-) gibi bazı
radikaller yüksek aktiviteye sahipken, E vitamininin oksidasyon ürünü olan tokoferoksil gibi bazı bileşiklerin aktiviteleri çok önemli değildir. Serbest radikallerin hedef molekülle kompleks oluşturma reaksiyonları; başlangıç, ilerleme ve sonlanma olmak üzere üç aşamada meydana gelir. Serbest radikalin etkinliği substrata ve bulunduğu fiziksel şartlara göre farklılık gösterir. Aynı serbest radikal, aynı maddeyi oksidant veya redüktant olarak kullanabilir. Reaksiyonun oluşma hızı; ortamın ısısına, pH'sına ve ortamdaki katalizörlere bağlıdır (45).
2.4.3. Serbest Radikal Reaksiyonları
Oksijen radikalleri içinde, süperoksit anyonu (O2-), oksijenin bir elektron almasıyla
oluşan ilk ürün olup, en kolay ve en fazla oluşan serbest radikaldir. Canlılarda diğer radikallerin oluşumu sıklıkla O2- nin birikimine bağlıdır. O2- radikalinin ana kaynağı ise
moleküler oksijenin metabolize edildiği, mitokondriyal elektron transport zinciridir. Elektron transport zincirinde moleküler oksijenin biyolojik oksidasyonu, organizmaya enerji kazandıran ve yaşamın devamını sağlayan bir süreç olup, bu zincirin ara basamaklarında O2
-oluşur ve normal şartlarda oluşan O2- ler organizmadan dismutasyon denilen bir dizi reaksiyon
vasıtasıyla uzaklaştırılır (44).
Bu reaksiyonlar hidrojen peroksit (H2O2) ve perhidroksi (OH2-) radikallerinin meydana
gelmesi ile sonuçlanır. Bu dismutasyon reaksiyonları kendiliğinden meydana gelebileceği gibi süperoksid dismutaz (SOD) tarafından da katalizlenebilir.
Oluşan H2O2, SOD gibi antioksidan enzim sistemlerinden olan katalaz (CAT) ve
Oksijen radikalleri içinde en fazla reaktif olan hidroksil (OH-) radikalidir ve hemen her
molekül ile reaksiyona girebilme özelliğine sahip olup invivo oluşumu için Haber Weis reaksiyonuna gereksinim vardır. Bu tepkimede O2- ve H2O2 etkileşir ve sonuçta OH- radikali
meydana gelir.
O2 +H2O2 ---► OH- + OH- +O2
İskemi oluştuğunda ve de özellikle reperfüzyon ile dokuların oksijenasyonu ile oluşan bu reaksiyonu demir gibi metaloproteinler, askorbik asit ve NADPH katalize edebilir.
Fe+3 + O
2- ► Fe+2 + O2
Fe+2 +H
2O2 ► Fe+3 +OH- + OH
-Organizmada OH- radikaline karşı SOD, KAT, GPx gibi bir antioksidan savunma
mekanizmaları yoktur (46).
2.4.4. Serbest Oksijen Radikalleri
Oksijen 8 atom numaralı kararsız bir element olup doğada dioksijen (O2) halinde
bulunur. Bu durum, enerji düzeylerindeki elektronlarının yapısıyla ilişkilidir (47).
Oksijen molekülündeki aynı yöne dönen iki elektrona sahip 2P son orbitali önemlidir ve bu orbitallerden herhangi birindeki elektron, bir orbitali bırakıp diğerine geçtiğinde veya farklı yönde döndüğünde "singlet oksijen˝ oluşur. Orbitallerden birine ters dönüşlü iki elektron veya ikisine ters dönüşlü iki elektron daha eklenirse "oksijen radikale " meydana gelir (Tablo 1).
Serbest oksijen radikalleri, biyoaktif lipitler örneğin araşidonik asitler, lipit oksidasyonunun alt ürünleri, aldehitler-alkenaller, hücre içi enzimler ve metalleri lokal ve sistemik olarak etkileyerek doku hasarı meydana getirirler (48).
Tablo 1: Oksijen türevi bileşikler
Radikal olanlar Radikal Olmayanlar
Hidroksil (HO-) Hidrojen Peroksit (H2O2)
Alkoksil (RO-) Singlet Oksijen (O2N )
Peroksil (ROO-) Ozon(O3)
Superoksit (O2-) Hipoklorid (HOCl)
Nitrik oksit (NO-) Lipid hidroperoksit(LOOH)
Oluşan radikal eşleşmemiş tek elektronu nedeniyle dengesiz olup hızla ortamdan kaybolur. Bu yüzden bu radikaller tek elektronlarını bir başka moleküle verebilir (redüksiyon) ya da bir başka molekülden elektron alarak elektron çifti oluşturabilirler (oksidasyon). Sonuçta radikal olmayan yapıyı radikal şekle dönüştürebilirler (47).
2.4.4.1. Süperoksit Radikalleri (O2-)
Süperoksit radikalleri (O2-), hücrelerde redükte elektron taşıyıcılarının otooksidasyonu
ile oluşmaktadırlar. O2- oluşumu; elektron taşıyıcısının redoks durumuna ve ortamdaki oksijen
derişimine bağlıdır.
Zayıf bir oksidan olan O2- kendi başına önemli hücre hasarına yol açması olağan değildir,
ancak oksidatif strese yol açabilen bir dizi reaksiyonu tetikleyebilir (49). Bu reaksiyonların en önemlilerinden biri Haber-Weiss reaksiyonu olup, O2- ve H2O2 demir varlığında etkileşerek oldukça
reaktif olan HO radikalini oluştururlar.
O2-+ e- ---˃ O2ˉ
H2O2+ O2---► HO- + OH- + O2
-Üretilen bu OH- oldukça reaktif olup DNA gibi önemli yapılarla reaksiyona girerek önemli
hasarlar oluşturabilmektedirler (50).
O2-, hücre içi demir depolarından demiri serbestleştirir ve serbest haldeki demir iyonu
Haber-Weiss gibi reaksiyonlarda veya diğer serbest radikal aracılıklı hücre hasarında rol alabilir. Superoksit radikalleri çok kısa bir yarı ömre sahip olup dismutasyon ile H2O2 ve oksijen oluştururlar.
Dismutasyon reaksiyonu spontan olarak meydana gelir ve SOD enzimi ile katalizlenir.
O2-O2-+ 2H+ SOD H2O2+ O2
-2.4.4.2. Hidroksil Radikalleri (OH-)
Hidroksil radikali (OH-), biyolojik sistemlerdeki en potent serbest radikaldir. Dokular
radyasyona maruz kaldıklarında, enerjinin çoğu hücre içindeki su tarafından absorblanır ve radyasyon oksijen-hidrojen arasında kovalent bağa neden olur. Sonuçta biri hidrojen (H-), diğeri OH- olan iki
radikal meydana gelir.
H - O - H --->H- + OH
-Hidrojen peroksitin (H2O2) Fe+2 veya Cu+2 ile reaksiyona girmesiyle de OH radikali
meydana gelmektedir. H2O2 toksisitesinin büyük çoğunluğunun temelinde oluşan OH radikali olduğu
düşünülmektedir. Bu reaksiyon ilk defa 1894 yılında Fenton tarafından gözlenmiş ve günümüzde de Fenton reaksiyonu olarak bilinmektedir.
Fe+2 + H2O2 ---> Fe+3 + OH- + OH
-Cu+ + H2O2---> Cu+2 + OH- + OH
-OH-, başta lipid, protein ve nükleik asitler olmak üzere hemen hemen bütün hücresel
moleküllerle reaksiyona girebilmektedirler. OH-, DNA da bulunan deoksiriboz molekülüne
etki ederek çeşitli ürünler oluşturur ve bu oluşan ürünlerin bazıları mutajeniktir. Yine OH
-aromatik halkaya katılma özelliğine sahip olduklarından DNA ve RNA'da bulunan pürin ve pirimidin bazlarına katılarak radikal oluşumuna yol açarlar. Böyle bir dizi reaksiyona katılabilen OH-, DNA'nın baz ve şekerlerinde ciddi hasarlar oluşturarak DNA'da iplik kalmaları
meydana getirir, ancak büyük hasarlar hücresel koruyucu sistemler tarafından onarılamayabilir ve bunun sonucunda mutasyonlar ve hücre ölümleri görülür (49,50).
OH-, DNA'nın pürin ve pirimidin bazları ile etkileşmenin yanısıra tiol grubu içeren biyolojik
moleküllerden H atomu da koparabilme özelliğindedir. Sonuçta oluşan sülfür radikallerinin ilginç kimyasal özellikleri olup, O2 ile kombine olabilir ve oksi-sülfür radikallerini meydana getirir. RSO2- ve
RSO- gibi bunların birçoğu da biyolojik moleküllerde hasar oluştururlar. OH'ın sebep olduğu en iyi
bilinen biyolojik hasar lipid peroksidasyonudur. OH-, özellikle araşidonik asit gibi doymamış yağ asit
yan zincirlerinden -C atomunun birinden H atomunun çıkartılması ve su oluşumu ile sonuçlandığı reaksiyonlarda olduğu gibi membran fosfolipitlerinin doymamış yağ asit yan zincirlerine hücum eder.
- C - + OH- ---> - C - + H2O
Bu reaksiyon sonunda membranda kalan - C - radikali oksijen ile kombine olarak peroksil radikalini oluşturur.
Peroksil radikalleri aktif olup yakınındaki doymamış yağ asitlerinin yan zincirlerine saldırır; böylece birçok yağ asidinin yan zincirlerini lipit hidroperoksitlere dönüştürür ve membranda lipit hidroperoksitlerinin birikimi de membran fonksiyonunda bozulmaya neden olur. Peroksil radikalleri ve sitotoksik aldehitler, membran proteinlerinde ciddi hasar oluştururlar ve membrana bağlı bazı enzim ve reseptörleri inaktive ederler (3,51,52).
2.4.4.3. Hidrojen Peroksit (H2O2)
Hidrojen peroksit (H2O2) eşleşmemiş elektronu bulunmadığından aslında bir radikal değildir.
Süperoksit anyonunun (O2-) hidrojenle yaptığı reaksiyona dismutasyon reaksiyonu denir ve reaksiyon
hızı asidik pH değerlerinde fazladır (52).
-Bazı enzimler ile tekli (NADPH oksidaz) ya da çiftli (Glukoz oksidaz) elektron eklenmesi katalize edilerek O2- veya H2O2 oluşması sağlanır.
NADPH + 2O2- ---> 2NADP + 2 O2
-R - CH2OH + O2- ---> R - CHO - H2O2
2.4.4.4. Hipoklorik Asit (HOCl)
Hipoklorik asit (HOCl), radikal olmamasına rağmen reaktif oksijen türleri (ROT) içinde sınıflandırılır. Bakterilerin fagositik hücreler tarafından öldürülmesinde rol oynar. Radikal üretiminin fagositik hücrelerde bakteri öldürülmesinde önemi büyüktür. Aktive olan nötrofiller, monositler, makrofajlar ve eozinofiller tarafından süperoksit radikalleri (O2-) üretilir ve özellikle nötrofillerde
miyeloperoksidaz enzimi aracılığıyla önce O2- oluşturulur ve daha sonra bunun dismutasyonuyla
oluşan H2O2 klorür iyonuyla birleştirilerek potent bir antibakteriyel olan HOCl meydana getirilir.
H2O2+ HCI ---> HOCI + H2O
2.4.4.5. Singlet O2 (O/4)
Bu molekül de yapısında eşleşmemiş elektron bulundurmadığından serbest radikal değil fakat serbest radikal reaksiyonlarını başlattığından serbest radikal olarak kabul edilmiştir. O2 , oksijen elektronlarından birinin dışarıdan enerji alması sonucu kendi dönüŞ
yönünün tersi yönünde bir yörüngeye yer değiştirmesi ile oluşabileceği gibi O2'nin
dismutasyonu ve H2O2'nin hipoklorit ile reaksiyonu sonucunda da meydana gelebilir. Deri ve retina
gibi gün ışığına maruz kalan bölgelerde sıkça oluştuğu saptanmıştır.
Serbest oksijen radikallerinin etkisiyle peroksil (ROO-), alkoksil (RO-), tiol radikalleri (RS-)
veya karbon merkezli radikaller (R-) meydana gelebilir. Bu radikallerin tekrar oksijenle reaksiyonu
sonucu yeni serbest radikaller ortaya çıkabilir (53).
2.4.4.6. Ozon (O³)
Ozon, güneş ışınlarına karşı önemli bir stratosferik koruyucudur, ancak yeryüzünde toksik ve istenmeyen, oksidan bir ajandır. Bazı bilimsel cihazlarla, fotokopi makinelerinde kullanılan ışık kaynaklan tarafından oluşturulur ve kirli şehir havasında bulunur. Akciğerlere zararlı olup, DNA, lipid ve proteinleri kolayca okside etme yeteneğine sahiptir (54).
2.4.5. Reaktif Nitrojen Türleri (NO, NO2, NO+, NO-)
Nitrik Oksit (NO), Lipofilik özellikte ve oksijensiz ortamda oldukça kararlıdır Düşük konsantrasyonlarda iken, ortamda oksijen varlığında dahi kararlılığını koruyabilen NO, biyoaktif memeli hücresinin bilinen en düşük molekül ağırlıklı ürünüdür (55-57). Diğer radikallerden farklı olarak düşük dozlarda toksik olmayıp, hatta fizyolojik olarak çok önemli fonksiyonlan vardır (55). NO-; bir atom azot ile bir atom oksijenin çiftleşmemiş elektron
vererek birleşmesinden oluştuğundan radikal tanımına uyar (58). Vasküler endotel hücrelerinde, birçok izoformu tanımlanmış olan, Nitrik Oksid Sentaz (NOS) enzimi aracılığıyla L-arjininden sentezlenir. NO-'in yarı ömrü 10-20 saniye gibi çok kısa bir
zamandır. Kolayca düz kas hücresine girerek Guanilat Siklaz (GC) enziminin "hem" demirine bağlanır ve cGMP sentezini uyararak vazodilatasyonu sağlar. NO, aynı zamanda tiyol gruplarını S-nitrozilasyona uğratarak protein ve reseptör fonksiyonlarını da etkiler. Fe-S kümelerine afinite gösterdiği için bu gruplan içeren ve hücre içi demir trafiğini kontrol eden akonitaz enzimine de bağlanır ve bu enzime mRNA bağlanmasını artırarak enzimin aktivitesini inhibe eder.
NO-, moleküler oksijen ile bağlanıp nitrojen dioksit (NO
2) oluşturarak metabolize olur:
2 NO + O2 ---► 2 NO2
NO' in reaktif oksijen türevleri (ROT) ile reaksiyona girerek güçlü bir oksidan olan peroksinitriti (ONOOH) oluşturduğu ve bunun da ileri dekompozisyonla OH radikalinin oluşumunu sağladığı belirtilmektedir:
NO + O2 ˉ ► ONOOˉ
ONOOˉ + H+ - ► ONOOH ONOOH ► NO2+ OHˉ
Oluşan OHˉ ise biyolojik olarak yıkıcı bir moleküldür. Ayrıca, peroksinitrit de tirozin gibi fenolik aminoasitleri nitrolayarak toksik nitro türevlerini (nitrotirozin) meydana getirmektedir. Sonuçta NO, endotel hücre disfonksiyonu ve bununla ilişkili olan DM, hipertansiyon, ateroskleroz gibi bazı önemli hastalıklarda etkili olabilmektedir.
2.4.6. Başlıca Serbest Radikal Üretim Kaynakları
Serbest radikaller organizmada normal hücre metabolizması sırasında meydana gelen oksidasyon ve redüksiyon reaksiyonları sırasında oluşabildiği gibi çeşitli dış kaynaklı nedenlerle de oluşabilir. Hücre organellerinin her birinde farklı miktarda radikal oluşur. Bununla birlikte stres, radyasyon ve ksenobiyotikler aktive olmuş fagositlerde serbest radikal üretimini arttırabilirler. Mitokondrial elektron transport sistemi (METS), sitokrom P-450, sitokrom b-5, ksantin oksidaz, triptofan dioksijenaz, lipooksijenaz, prostoglandin sentetaz, hemoglobin, flavoproteinler, lipid peroksidasyonu, iskemi, travma ve entoksikasyon gibi durumlar, moleküler otooksidasyon yapan tiol, hidrokinon, katekolamin ve antibiyotik gibi moleküllerin hepsi hücresel serbest radikalleri oluşturabilirler (53,59). Serbest radikal oluşturan kaynaklar endojen ve ekzojen olmak üzere iki gruba ayrılabilir.
2.4.6.1. Endojen Serbest Radikal Üretim Kaynakları
Normal şartlar altında metabolizmada, birçok biyokimyasal reaksiyonun çeşitli basamaklarında serbest radikaller oluşmaktadır. Bu serbest radikal yapısına sahip maddelerin organizmaya zarar verme potansiyelleri varsa da, bazı metabolik olayların ilerleyebilmesi için oluşmaları kaçınılmazdır.
2.4.6.1.1. Mitokondriyal Elektron Transport Sistemi (METS)
Mitokondrideki enerji metabolizması sırasında oksijen kullanılır ve tüketilen oksijenin % 1-5 kadarı süperoksit ile sonlanır. METS deki radikal oluşumunun nedeni NADH dehidrogenaz ve koenzim Q gibi elektron taşıyıcılardan oksijene olan elektron kaçağıdır. Fizyolojik koşullarda reaktif oksijen türlerinin temel kaynağı normal oksijen metabolizmasıdır. Dolayısıyla normal koşullar altında METS serbest radikal üretiminin en önemli kaynağıdır (60).
2.4.6.1.2. Endoplazmik Retikulum (ER)
ER da bulunan sitokrum P-450 sistemi moleküler oksijeni kullanarak birçok substratı oksitler. Oksijen molekülünün bir atomu substrata bağlanırken, diğer atomu su oluşturur. Bu reaksiyon monooksijenaz veya karışık fonksiyonlu oksidaz reaksiyonu olarak isimlendirilir.
Kimyasal ajanların serbest radikal oluşturmadaki en önemli mekanizmaları, mikrozomal sitokrum P-450 sistemi aktivasyonudur ve bu sistemde moleküller ya indirgenerek ya da oksitlenerek serbest radikal oluşturulur. Son durumda bir elektron eksikliği mevcuttur ve elektrofilik bir bileşik oluşur ve bu bileşik de bir nükleofil ile reaksiyona girer. Bu elektrofilik bileşiği çeken en önemli
molekül sistein kalıntıları üzerindeki tiyol (-SH) grubudur. -SH grubu ise bir çok endojen makromolekülde (DNA, RNA, enzimler, vb) bulunduğu için reaktif ara ürünler bu moleküllerle kovalent bağlanarak toksik etki gösterebilirler (61).
2.4.6.1.3. Redoks Döngüsü
Ksenobiyotiklerden serbest radikal oluşumu sadece mikrozomal reaksiyonlarla olmayıp, menadion, parakuat, dikuat, nitrofurantoin, gibi ilave bir çiftlenmemiş elektron kazanma eğilimindeki bileşikler alternatif bir redoks siklusu oluştururlar. Bu ajanlardan oluşan radikaller, tekrar ana bileşiğe dönüşmek için oksijenle kolayca oksitlenir ve süperoksit radikalini meydana getirirler (62).
Oluşan ksenobiyotik ve süperoksit radikalleri hücreiçi ferritin depolarından demiri serbestleştirir ve sitozole salınan demir, Fenton reaksiyonunda katalitik rol alarak reaktif bir serbest radikal olan hidroksil radikali gibi ikincil radikallerin oluşumunu sağlar (49).
2.4.6.1.4. Araşidonik Asit Metabolizması
Hücre membranlarındaki prostaglandin için en önemli doymamış yağ asidi kaynağı araşidonik asittir. Fagositik hücrelerin uyarılması, fosfolipaz ve protein kinazın aktivasyonu, plazma membranlarında araşidonik asidin salınımına neden olur ve araşidonik asidin siklooksijenaz ile katalizlenen oksidasyonu sonucu prostaglandinler, lipooksijenaz ile katalizlenen oksidasyonu ile de lökotrienler oluşur ve bu tepkimeler sırasında serbest radikaller meydana gelir (63).
Siklooksijenaz ve lipooksijenaz enzimlerinin ikisi de aktiviteleri için peroksitlere gereksinim duyarlar. Siklooksijenaz aktivitesi daha sonra prostaglandinlerin sentezi içinde gerekli olan endoperoksitlerin oluşumuyla sonuçlanırken, lipooksijenaz lipit peroksitler üzerinden lökotrienlerin oluşumunu katalizler. Ayrıca bu sırada bazı ksenobiyotiklerden oluşan reaktif ara ürünler hedef moleküllerle etkileşerek toksisite gösterirler (63).
2.4.6.1.5. Fagositoz
Aktive fagositler intrasellüler radikal oluşumuna neden olurlar (Tablo 2) ve bu serbest radikaller patojenlerle savaşta önemlidirler. Ksenobiyotikler, radyasyon ve stres aktive olmuş fagositlerde serbest radikal üretimini arttırırlar.
Tablo 2: Fagositlerin ürettiği reaktif oksidan ürünler
Trombositler H2O2, O2ˉ, OHˉ
Nötrofiller H2O2, O2ˉ, OHˉ, HOCl
Eozinofiller H2O2, O2ˉ, OHˉ, HOCl,
Makrofajlar H2O2, O2ˉ, OHˉ, HOCl, NOˉ
Doku makrofajları (kupffer hücreleri, alveolar makrofajlar), kan monositleri gibi fagositik hücreler ve nötrofiller, eozinofiller, bazofiller gibi granülositler immunolojik veya özel bir uyarıyla uyarıldıklarında lizozomlarını dışarı vermeye başlarlar. Reaktif oksijen oluşumunun yanısıra, mitokondri dışındaki oksijen üretiminde bir patlama (solunumsal patlama; respiratory brust) görülür. Fagosite edilmiş, patojenler oksidan ajanlarca öldürülür ve bu oksidanlar solunumsal patlama ile sağlanır. Oluşan oksidan ajanlar patojenleri öldürmenin yanısıra myeloperoksidaz sistemi üzerine de etkilidir. H2O2 ve hipoklorit kombinasyonu myeloperoksidaz sistemine de etkiyerek güçlü bir
antimikrobiyal etkinlik göstermektedir. Bu radikaller memeli bakteri ve parazitlerine karşı sitotoksik etkiye sahip oksidanlardır. Membran peroksidasyonu, membran proteinlerinin dekarboksilasyonu ve/veya oksidasyonuna yol açıp membranın bütünlüğünü bozabilir ve DNA'yı okside ederek parçalayabilir. Fagositik kaynaklı oksidanlar; ototoksik, immunosupresif ve mutajenik etki gösterebilirler (63).
2.4.6.1.6. Otooksidasyon
Doku bileşenlerinin çoğu moleküler oksijenin varlığında kimyasal olarak stabil olmayıp, normal şartlar altında metabolizmada az ya da çok otooksidasyona uğrarlar. Kolayca otookside olabilen bu bileşenler doku ve hücrelerin son derece önemli bileşenleridirler. Hemoglobin gibi metalloproteinler, hormonlar, tiyoller, doymamış membran lipitleri bunlara örnek olarak gösterilebilirler (64-66).
Bütün otooksidasyonlar sırasında serbest radikal intermediyerleri kadar aktive oksijen türleri de üretilerek vücudun radikal kaynaklarına katkı sağlanmış olur.
2.4.6.1.7. Oksidan Enzim Reaksiyonları
Aerobik organizmalarda oksijenin katıldığı birçok reaksiyonda oksijenin tek değerlikli indirgenmesiyle süperoksid anyonu oluşabilir. Glikojen oksidaz, ksantin oksidaz, NADPH oksidaz, NADH oksidaz, diamin oksidaz, ürat oksidaz gibi enzimler bunlardan bazılarıdır.
Üzerinde en çok çalışılan enzim olan ksantin oksidaz (XOD) aslında ksantin dehidrogenaz (XDH) olarak sentezlenir ve dokularda bu şekilde bulunmaktadır ve elektronlarını moleküler oksijene değil NAD'ye verir ve süperoksit anyon radikali oluşturmaz. Fakat XOD sülfidril oksidasyonu ya da sınırlı proteolizis ile dehidrogenaz formunda oksidaz formuna dönüşebilir. XOD moleküler oksijeni kullanarak H2O2 ve O2- oluşturmaktadır (67).
2.4.6.2. Ekzojen Serbest Radikal Üretim Kaynakları
Serbest radikaller, eksojen nedenlerle de oluşabilir. Radyasyon, sigara dumanı, zehirli gazlar, ilaçlar, kanserojen maddeler ve pestisitler bilinen en önemli ekzojen serbest radikal üretim kaynaklarıdır (68).
2.4.7. Serbest Radikallerin Vücuttaki Etkileri 2.4.7.1.Serbest Radikallerin Lipitlere Etkileri
Serbest radikallerin en önemli etkisi lipit peroksidasyonu olarak adlandırılan lipitler üzerindeki etkileridir (69,70). Lipit peroksidasyonu doymamış yağ asitlerinin serbest radikallerle reaksiyonu ile yağ asidindeki metilen grubundan bir hidrojen atomunun uzaklaştırılması ile başlamaktadır. Biyolojik sistemlerde bu radikalin süperoksit anyon radikali ile hidroksil radikali olduğu kabul edilmektedir ve süperoksit anyon radikali hidroksil radikaline dönüşmektedir. Benzer şekilde hidrojen peroksidin de hidroksil radikaline dönüştüğü bilinmektedir. Bu nedenle lipit peroksidasyonu hidroksil radikali tarafından başlatılmaktadır (69).
Hidrojen atomunun uzaklaşmasıyla meydana gelen serbest yağ asidi radikali moleküler oksijen ile reaksiyona girerek peroksit radikalini oluşturur, oluşan peroksit radikali yüksek reaksiyon yeteneğine sahip olup başka bir yağ asidi molekülü ile yeni bir hidroperoksit ve yeni bir yağ asidi radikali oluşturur ve bu yağ asidi radikali yeniden oksijen ile etkileşerek RH'dan yeniden bir hidrojen atomunun ayrılmasını sağlar. Bu zincir reaksiyon oluşan yeni radikallerin de etkisiyle devamlı olarak artan bir hızla devam eder (69).Bu şekilde oluşan lipit peroksit birçok reaksiyonda RO- ve OH- verecek şekilde parçalanır ve bu oluşan
-Radikallerini meydana getirirler, ve bu şekilde oluşan bir radikal sürekli olarak yeni radikallerin oluşmasına yol açar (70).
Malondialdehit (MDA) kanda ve idrarda ortaya çıkar, yağ asidi oksidasyonunun spesifik ya da kantitatif bir indikatörü olmamakla beraber lipid peroksidasyonunun derecesiyle iyi korelasyon gösterir. Bu nedenle biyolojik materyalde malondialdehit (MDA) ölçülmesi lipid peroksit seviyelerinin indikatörü olarak kullanılır.
Lipit peroksitleri hücre zarlarının önemli bir bileşeni olup Fe, Cu gibi geçiş metallerinin varlığında alkoksi ve peroksi radikallerini oluştururlar. Bu nedenle Fe veya Cu tuzları lipit peroksidasyonunu hızlandırırlar. Sonuçta hücre zarının akışkanlığını ve geçirgenliğini bozarak membran bütünlüğünün bozulmasına yol açarlar. Lizozomal membranlarda oluşan hasar hidrolitik enzimlerin salınmasına ve hücre içi sindirime yol açar. Biriken hidroperoksitler direkt olarak toksik etki göstermenin yanısıra duyarlı aminoasit kalıntılarını da (sistein, histin, methionin, lizin) okside edebilir veya zincir polimerizasyon reaksiyonlarıyla enzimleri inaktive edebilirler (63,71).
Paraoksonaz lipid peroksitlerini, kolesterol linoleatları, hidroperoksitleri ve hidrojen peroksitlerle olan LDL-K oksidasyonunu inhibe eder (72). HDL-K metabolizması ve revers kolesterol transportunu etkileyen en onemli faktorler HDL-K ile iliskili enzimler olan paraoksonaz (PON) ve lesitin kolesterol acil transferaz (LCAT) enzimleridir. Yani PON HDL-K’nun oksidasyonunu da onler ve HDL-K’nun revers kolesterol transport kapasitesinin korunmasına yardımcı olur.
2.4.7.2. Serbest Radikallerin Proteinlere Etkileri
Bu etki proteinlerin aminoasit içeriğine göre değişir. Protein molekülleri üzerindeki sülfhidril veya amino gruplarıyla serbest radikallerin etkileşmesi sonucu proteinlerde üç çeşit yapısal değişiklik görülür; 1) Aminoasitlerin modifikasyonu, 2) Proteinlerin fragmantasyonu, 3) Proteinlerin agregasyonu veya çapraz bağlanmaları (73).
Aromatik aminoasitler (fenilalanin, tirozin, triptofan), doymamış yapılarından dolayı oksidatif etkiye çok hassastırlar. Sülfürlü amino asitler (sistein ve sistin) de serbest radikal etkisine hassas amino asitlerdendirler. Proteinin temel yapısındaki değişme, antijenitesinde değişikliğe ve proteolize duyarlı hale gelmesine neden olabilir. Radikaller, membran proteinleri ile reaksiyona girebilir ve enzim, nörotransmitter ve reseptör proteinlerinin fonksiyonlarında bozulmaya yol açabilirler (74).
Serbest radikallerin etkisiyle IgG ve albümin gibi fazla sayıda disülfit bağı bulunduran proteinlerin üç boyutlu yapıları zarar görür ve normal fonksiyonlarını yerine getiremezler. Hem
proteinleri de serbest radikallerden önemli oranda zarar gören proteinlerden olup, özellikle oksihemoglobin O2- veya H2O2 ile reaksiyona girerek methemoglobin oluşturur (75).
2.4.7.3. Serbest Radikallerin Karbonhidratlara Etkileri
Monosakkaritlerin otooksidasyonu ile hidrojen peroksid, peroksitler ve okzoaldehitler meydana gelirler. Bunlar diyabet ve sigara içimi ile ilişkili kronik hastalıklar gibi patolojik süreçlerde önemlidirler. İnflamatuar eklem hastalıklarında synovial sıvıya geçen PML'lerden extrasellüler sıvıya salınan H2O2 ve O2- buradaki hyalüranoik asidi parçalarlar, ayrıca gözün vitröz
sıvısındaki hyalüronik asitin oksidatif hasarı da katarakt oluşumuna katkıda bulunur (74).
2.4.7.4. Serbest Radikallerin DNA'ya Etkileri
Serbest radikallerin, DNA'ya etkileri mutasyonlara ve hücre ölümlerine yol açmaktadır. Hidroksil radikali bazlarla ve deoksiribozlarla kolayca reaksiyona girerken hidrojen peroksit ise membranlardan kolayca geçebildiğinden hücre çekirdeğindeki DNA'ya ulaşarak hücrede disfonksiyona hatta ölüme yol açabilir. Bundan dolayı DNA kolay etkilenen bir moleküldür.
ROS ve RNT ile oluşan DNA hasarlarının çok az bir kısmı doğal olarak oluşmaktadır (76) Oksidasyon, metilasyon, depürinasyon ve deaminasyon reaksiyonları DNA hasarlarının oluşumunda yer alan endojen reaksiyonlardır. Nitrik oksid veya nitrojen dioksid (NO2),
peroksinitrit (ONOO-), dinitrojen trioksid (N2O3) ve nitrik asid (HNO3) gibi reaktif ürünler
nitrozasyon ve deaminasyon reaksiyonları ile mutajenik aktivite gösterebilirler. Farklı ROT'leri farklı yollardan DNA hasarlarına neden olurlar (77). Örneğin O2- ve H2O2 hiçbir
zaman bazlarla reaksiyona girmez, ancak OH-, DNA'daki dört bazdan herhangi birine
bağlanarak farklı reaktif ürünlerin oluşmasına yol açabilmektedir (78). Singlet oksijen ise guanine spesifik bağlanarak hasar oluşturur (79).
Hidroksil radikali pürin bazları ile C4, C5 ve C8 pozisyonlarından reaksiyona girerek sırasıyla C4-OH-, , ve C8-OH- pürin radikallerini oluşturur ve C4-OH- ve C5-OH-pürin radikalleri dehidrasyona uğrayarak okside C5-OH-pürin radikallerini oluştururlar. C8-OH-C5-OH-pürin radikallerinin bir elektronlarının oksidasyonu ve bir elektronlarının redüksiyonu ile sırasıyla 8-hidroksipürinler (7,8-dihidroksi-8-oxo-pürünler) ve formamidopirimidinler oluşur (79). İndirgeyici ajanlar formamidopirimidinlerin oluşumunu arttırırken 8-OH-pirimidinlerin
oluşması için oksijenli ortam gerekmektedir. 8-OH-guanin çok yaygın olarak meydana gelen bir baz hasar ürünü olduğundan oksidatif DNA hasarlarının ölçülmesinde hasar indeksi olarak kullanılmaktadır. Çoğunlukla 8-hidroksideoksiguanozin (8-OH-dGua) nükleoziti şeklinde ölçülmektedir (80).
Timinin alil radikalinin oksidasyonu ile 5-hidroksimetilurasil ve 5-furmilurasil meydana gelmektedir. Dehidrasyon ve deaminasyon reaksiyonlarına yalnızca sitozin katılabilmekte ve böylece sitozin; glikol dehidrasyonla urasil, glikol deaminasyon ile 5-hidroksi urasil (5-OH-Ura), dehidrasyon ve deaminasyon ile de 5-5-hidroksisitozini (5-OH-Cyt) meydana getirmektedir (47).
Hidroksil radikalinin DNA'daki şeker grubu ile etkileşmesi, beş karbon atomunun herhangi birinden bir H atomunun çıkarılmasıyla olmaktadır (68). Şeker radikalleri birçok farklı reaksiyonla oluşmaktadır. Oksijensiz sistemlerde C4 ' merkezli radikaller parçalanmaya uğrar ve DNA zincirleri kırılarak sağlam baz ve değişikliğe uğramış şeker serbest kalır. Cl merkezli radikallerin oksidasyonu ile de şeker laktonu oluşumu ve sağlam bazın salınımı gerçekleşir. Oksijen yokluğunda, baz radikalleri kendilerine komşu olan şeker grubundan H atomu alarak şeker radikallerini oluştururlar ve sonuçta zincir kırılmalarına neden olurken, oksijenli ortamda karbon merkezli şeker radikaline moleküler oksijenin eklenmesi sonucu peroksil radikalleri oluşur ve şeker peroksil radikallerinin en karakteristik özelliği de karbon-karbon bağını kırarak alkali bölge oluşturmalarıdır. C5’ merkezli peroksil radikali oksil radikaline dönüştürülerek parçalanma ile DNA zincirinin kırılmasına, sağlam bazın ve değişmiş şekerin serbest kalmasına yol açmaktadır (81). DNA'daki değişikliğe uğramış şeker grupları zincirden ayrılabilir ya da fosfat bağlarıyla DNA'ya bağlı kalabilir.
Baz ve şeker radikallerinin reaksiyonları sonucunda değişik modifiye baz ve şekerler, kontrolsüz baz dizilimi, zincir kırılmaları ve DNA-protein çapraz bağları meydana gelirler.
Oksidatif DNA hasarı denilen bu tip hasarlar sonucu yaşlanma, mutasyonlar ve kanserler ortaya çıkabilir (82).
2.5. Antioksidan Savunma Sistemleri
SOR'nin oluşumunu ve bunların meydana getirdiği hasarı önlemek için vücut "antioksidan savunma sistemi" adı verilen birçok savunma mekanizmasına sahiptir. Bütün hücrelerin oksidatif strese karşı güçlü savunma sistemleri vardır. Bu savunma sistemlerini serbest radikal tutucular ve bazı enzimler oluşturmaktadır. Savunma sisteminde öncelikle enzim sistemi etkilidir (82).