Ankara Bölgesi’ndeki tavukçuluk işletmelerinden Salmonella spp.
izolasyonu
*Zafer ATA, Nejat AYDIN
Ankara Üniversitesi, Veteriner Fakültesi, Mikrobiyoloji Anabilim Dalı, Ankara.
Özet: Bu çalışmada, tavukların dışkı ve yumurtalarında Salmonella etkenlerinin klasik yöntemlerle ve PCR ile tanısı amaçlanmıştır. Salmonella izolasyonu amacıyla Ankara’ da yer alan 50 ticari yumurtacı kümes ziyaret edilerek her kümesten 20’şer adet olmak üzere kloakal svap ve yine aynı kümeslerden 10’ar adet yumurta örneği toplandı. Her kümesten alınan 20 kloakal svap 2 gruba ayrılıp 10 adedi 1 örnek kabul edilerek değerlendirilmeye alındı. Toplam 500 yumurta 10’arlı gruplar halinde 50 örnek olarak kabul edilip Salmonella varlığı yönünden incelendi. Çalışmanın sonucunda, kloakal svap alınan 50 kümesin 6 (%12)’sında ve örnek bazında da 100 örneğin 6 (%6)’sından selektif zenginleştirmeden sonra yapılan PCR ve klasik kültür metodu ile Salmonella’nın cins düzeyinde varlığı tespit edildi. Yumurta örneklerinden ise her iki metotla da Salmonella belirlenemedi. Bu çalışmada, tavuk dışkılarından Salmonella etkenlerinin PCR yöntemi ile tanısı yapılabileceği ortaya konuldu ve rutin teşhis amacıyla uygulanabilirliği belirlendi.
Anahtar sözcükler: Dışkı, izolasyon, PCR, Salmonella, yumurta
Isolation of Salmonella spp. from poultry enterprises in Ankara region
Summary: In this study, the aim was to diagnose the Salmonellae in chicken faeces and eggs with both classical techniques and PCR.For this aim, 50 commercial layer poultry flocks in Ankara were visited and 20 cloacal swabs and 10 egg samples were taken from each flock. Twenty cloacal swaps taken from each flock were divided into two groups in which 10 of them were accepted and evaluated as one sample. A total of 500 eggs was accepted as 50 samples and evaluated by means of the presence of Salmonellae.At the end of the study, PCR and classical culture methods carried out after selective enrichment revealed that Salmonellae were identified on the genus level from 6 (12 %) out of 50 layer poultry flocks and from 6 (6 %) individual cloacal swabs out of 100 samples.In this study, it has been shown that Salmonellae could be diagnosed with PCR method and this method could be used in routine diagnosis.
Key words: Egg, faeces, isolation, PCR, Salmonella.
* Bu çalışma aynı isimli yüksek lisans tez çalışmasından özetlenmiştir.
Giriş
Salmonella’lar, Dünya’da ve Türkiye’de önemli
bakteriyel patojenler arasındadır (9,12). Salmonella infeksiyonlarını önlemek, hem gıda endüstrisi, hem de kanatlı hayvanların sağlığı açısından önemlidir. İnfeksiyondan korunma ancak iyi gözlem ve kontrol programları ile başarılabilir (17). Kanatlı hayvanlar, gıda zinciri vasıtasıyla insanlara bulaşabilen Salmonella’ların en önemli rezervuarlarından birisi olduğundan dolayı (12,29) resmi yetkililerce Salmonellozis gıda kaynaklı hastalığın önlenmesinde kanatlı üreticileri için öncelikli hastalık olmaktadır (22). Son yıllarda insanlarda görülen gıda orijinli Salmonella Enteritidis salgınlarından bazılarının, kontamine yumurta içeren gıdalar veya kontamine yumurta tüketiminden kaynaklandığı düşünülmektedir. Buna rağmen yumurtanın Salmonella ile kontaminasyon seviyesinin oldukça düşük ve albümin
kısmının yumurta sarısından daha sıklıkla Salmonella yönünden pozitif olduğu bildirilmiştir (6).
Kanatlılarda Salmonellozis, üç hastalık içerisinde klasifiye edilir: Salmonella Pullorum’un neden olduğu pullorom hastalığı, Salmonella Gallinarum’un neden olduğu tavuk tifosu (12,28) ve insanlarda gıda kaynaklı hastalıklarla ilişkili olan farklı grupların serovarları tarafından oluşturulan paratifo infeksiyonlarıdır (18,22). Tavuk ürünlerine bulaşan ve insanlarda gıda zehirlenmesi olgularından en çok izole edilen serovarlar Salmonella Typhimurium ve S. Enteritidis’dir. 1940’lı yıllardan beri, insan ve hayvanlardan spesifik konakçısı olmayan
Salmonella serovarlarının izolasyonunda hızlı bir artış
bulunmaktadır ve bu serovarlar genç tavuklarda önemli kayıplara neden olmaya devam etmektedir (22). Dünya çapında, paratifoid Salmonella’lar gıda kaynaklı hastalık ajanlarının en yaygın olanları arasındadır ve WHO’nun
raporuna göre, Amerika, Avrupa ve Afrika sağlık ajansları yumurta ve tavuk tüketimiyle ilgili olan bu tür hastalıklarda benzer bir artış olduğunu bildirmişlerdir (26). Ayrıca, geçtiğimiz 20 yılda S. Enteritidis Avrupa’nın bir çok ülkesinde (25) ve Amerika’da (20) gıda kaynaklı zehirlenmelerin en yaygın nedenlerinden biridir. Bu gıdaların çoğunu tavuk ve yumurtalar oluşturmaktadır (15,20,30).
Salmonella serovarlarını standart laboratuvar
metotları ile izole ve identifiye etmek hem güç olmakta, hem de uzun süre almaktadır (19,21,29,33). Polymerase chain reaction (PCR) teşhis yöntemi olarak spesifite, hız ve sensivitesinin yüksek olması nedeniyle büyük bir avantaj sunmaktadır ve birçok klinik örnek ile yiyecek materyallerinden bakteriyel identifikasyon için gittikçe artan bir şekilde kullanılmaktadır (23,29,31). PCR’ın diğer bir avantajı ise, antijenlerin ekspresyonuna veya bir substratın kullanımına bağımlı olmamasıdır ve antijenlerin biyokimyasal ve fenotipik varyasyonlarına rağmen mikroorganizmaları teşhis edebilmesidir (16). PCR’la kombine edilen selektif veya selektif olmayan zenginleş-tirme ve PCR inhibitör maddelerin azaltılması ile sensivite arttırılabilmekte ve böylece birçok bakteri varlığının belirlenmesinde PCR uygulanabilmektedir (7,10,27)
Bu çalışmada, tavukların dışkı ve yumurtalarında
Salmonella etkenlerinin klasik yöntemlerle ve PCR ile
tanısı amaçlanmıştır.
Materyal ve Metot
Kloakal svap ve yumurta örnekleri: Materyal olarak
kullanılan kloaka svap ve yumurta örneklerinin dağılımı Tablo 1’de gösterildiği gibidir.
Tablo 1. Toplam 50 yumurtacı kümesten alınan örnek sayısı Table 1. The number of samples collected from fifty hatcheries
Kümes başına toplanan kloakal svap ve yumurta sayısı Toplam kloakal svap ve yumurta sayısı Örnek sayısı Svap 20 1000 100 Yumurta 10 500 50 Toplam 30 1500 150
Standart suş: İzolasyon, identifikasyon ve PCR
çalışmaları aşamalarında Ankara Ünversitesi Veteriner Fakültesi Mikrobiyoloji Anabilim Dalı kültür koleksi-yonundan sağlanan Salmonella laboratuvar suşları (S. Typhimurium, S. Enteritidis, S. Gallinarum, S. Pullorum) kontrol olarak kullanıldı.
Antiserum: İzole edilen etkenlerin cins olarak
doğrulanmasında Salmonella Polivalan “O” Antiserumu (Statens Serum Enstitüsü, Danimarka) kullanıldı.
Kloakal svap ve yumurta içeriğinden Salmonella izolasyon çalışmaları: Yumurtacı tavuklara ait kloakal
svap ve yumurta örneklerinden Salmonella izolasyonu amacıyla ön zenginleştirme, selektif zenginleştirme, selektif–diferansiyel besiyerlerine ekim aşamaları gerçekleştirildi (12).Laboratuvara getirilen svaplardan her 10 adeti 1 adet steril erlen içerisinde yer alan 100 ml Tamponlanmış peptonlu su (TPS) solüsyonun içerisine bırakıldı. Kloakal svaplı TPS’ler 37°C’de 24 saat inkubasyona bırakılarak ön zenginleştirme işlemi yapıldı (14,11).Yumurtaların 10 adeti steril şartlarda kırılarak içerikleri steril seramik kaba aktarıldı. Yumurta içeriği steril şartlarda homojenize edildikten sonra 25 gr alınıp 225 ml TPS bulunan erlenmayerlere aktarıldı. Yumurta içeriği geçilen TPS’ler 37°C’de 24 saat inkubasyona bırakılarak ön zenginleştirme işlemi yapıldı (1,6,12).Ön zenginleştirmeye tabi tutulduktan sonra vortekslenen ekim yapılmış TPS’lardan 1’er ml alınarak selektif zenginleştirme amacıyla 1:10 oranlarında Tetratiyonat buyyon (TTB)’a ekimler yapıldı. TTB’ler 41°C’ye kaldırılarak 24 saat inkübe edildi (9,11). İnkübasyondan sonra PCR için 1 ml TTB steril ependorf tüplerine alınarak–20°C’de saklandı. TTB’lerden bir öze dolusu alınarak XLT4 agara tek koloni düşürecek tarzda ekimler yapıldı. Petriler 37°C’de 24 saatlik inkubasyona bırakıldı (9). Oluşan koloniler, Gram boyama yöntemi ile boyanarak mikroskopta incelendi. Ayrıca lam-lamel arası hareket muayenesi uygulandı (3). Selektif agarlarda karakteristik görünümleri ile üreyen Salmonella şüpheli koloniler cins identifikasyonunun doğrulanması için Triple Sugar Iron Agar ve lysine iron agara ekimler
yapıldı (12). Bu besiyerleri 37oC’de 24 saatlik
inkübasyona bırakıldı. TSI agar da üstte kırmızı renk dipte sarı renk ve siyahlaşma gösteren suşlar ile LI agarda dip ve yatıkta mor renk oluşturarak üreyen suşlar
Salmonella pozitif olarak kabul edildi (2,5,12,24). Her
ikisi negatif ise Salmonella olumsuz ve biri negatif diğeri pozitif ise diğer biyokimyasal testler yapıldı (2).
Biyokimyasal testler: İdentifikasyon amacıyla; üre
agar ve Simons sitrat agar gibi katı besiyerleri ile indol testi için Tripticase Soy Broth (TSB)’a ve MR/VP için besiyerlerine ekimler yapıldı. İndol testinde sarı halka, üre agarda sarı renk, VP testinde rengin değişmemesi negatif olarak, MR testinde kırmızı renk oluşumu, sitrat testinde Prusya mavisi renk oluşumu pozitif olarak değerlendirildi (5).
PCR analizleri ile tetrathionate buyyon’dan Salmonella spp. belirlenmesi: İnkübasyon sonrası PCR
için alınmış olan 150 adet 1 ml TTB kültürleri DNAse free ependorf tüplerine alınarak 4600 rfc(5200 rpm)’de 4 dakika santrifüj edildi. Süpernatant atılarak pelet %0.85’lik FTS ile yıkandı ve santrifüjlenerek peletlendi. Pelet 20 µl’lik distile su ile süspanse edildi. Bu bakteri süspansiyonu 10 dakika kaynatıldıktan sonra 3 dakika
18000 rcf(10400 rpm)’de santrifüj yapıldı. Supernatantın 5 µl’si PCR’de template DNA olarak kullanıldı (9). IroB geninin 606 bp’lik segmentini spesifik olarak amplifiye eden primerler Tablo 2’de gösterilmiştir (4).
Tablo 2. PCR için kullanılan IroB genini amplifiye eden primerler
Table 2. The primers amplifying IroB gene used for PCR Primer Sekans
Primer 1 5’-TGCGTATTCTGTTTGTCGGTCC-3’ Primer 2 5’-TACGTTCCCACCATTCTTCCC-3’
PCR 50 µl’lik karışım haciminde, 0.5 µl Taq polymerase (Taq polimeraz, Fermentas, Litvanya), 5 µl
10xPCR buffer, 1 µl deoxynucleoside trihosphate
(dNTP) karışımı, 0.1’er µl Primer F ve Primer R (thermo
Hybaid Inc., Almanya), 2 µl template DNA, 6 µl
magnesium chloride, 35.3 µl distile su olacak şekilde eklenerek PCR karışımı hazırlandı. PCR amplifikasyonu, 94°C’de 40 saniye denaturasyon, 55°C’de 1 dakika primer bağlanması ve 72°C’de 40 saniye ekstensiyon aşamasını içeren 30 siklustan oluştu (4).Örnekler 20 cm’lik %2’lik agaroz (Prona, EU) jelde, 180 Volt’ta 60 dakika elektroforez edildi.
Bulgular
İzolasyon ve identifikasyon bulguları: Çalışma
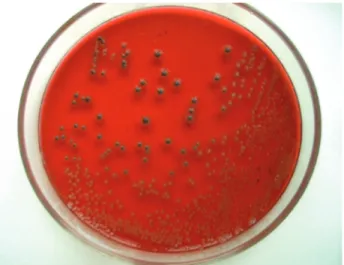
sonucunda toplam 1000 kloakal svap alınan 50 kümesten 6 (%12)’sından ve örnek bazında da 100 örneğin 6 (%6)’sından Salmonella spp. izole edildi. Aynı kümeslerden toplanan ve 50 yumurta örneğini temsil eden 500 adet yumurtada ise Salmonella cinsi bakterilere rastlanmadı. İzole edilen Salmonella suşlarının hareketsiz olup aynı biyokimyasal özellikleri gösterdikleri belirlendi. İzole edilen Salmonella suşlarının XLT4 agarda görünümleri Şekil 1’de biyokimyasal özellikleri Tablo 3’de gösterilmiştir.
Tablo 3. İzole edilen Salmonella spp’nin özellikleri Table 3. Features of isolated Salmonella spp
Test Özellik
Gram Boyama Gram negatif
Oksidaz -
Katalaz +
Hareket -
O/F Testi Fermentatif
TSI Laktoz - Sukroz - Glukoz + H2S + Gaz + İndol - Üre - Lizin Dekarboksilaz + Sitrat + Metil Red + Voges-Proskauer -
PCR bulguları: Çalışmada kloakal svap alınan 50
kümesin 6 (%12)’sı Salmonella spp. yönünden pozitif bulundu (Şekil 2.). Her kümesten alınan 20 örnekte iki grup halinde incelenen materyallerden bazı kümeslerde her iki grupta da (6 kümes) pozitif sonuç alınırken bazı kümeslerde ise tek bir gruptan pozitif sonuç elde edildi. PCR ile pozitif bulunan tüm örneklerin; aynı zamanda
Salmonella spp. izolasyonu yapılan örnekler olduğu
belirlendi. İncelenen yumurta örneklerinden gerçekleş-tirilen PCR çalışması sonrasında, tüm örnekler
Salmonella spp. yönünden negatif bulundu.
Şekil 1. XLT4 agarda Salmonella kolonilerinin görünümü Figure 1. The view of Salmonella colonies on the XLT4 agar
Şekil 2. M: marker, (-): Negatif Kontrol, (+): Pozitif Kontrol, 1, 2, 3, 10, 11 ve 12: Salmonella pozitif örnekler; 4, 5, 6, 7, 9, 13, 14, 15, 16: Salmonella negatif örnekler
Figure 2. M: marker, (-): Negative Control, (+): Pozitive Control, 1, 2, 3, 10, 11 and 12: Salmonella pozitive samples; 4, 5, 6, 7, 9, 13, 14, 15, 16: Salmonella negative samples
Tartışma ve Sonuç
Bu araştırmada materyal alınan 50 yumurtacı kümesin 6 (%12)’sına ait kloakal svap örneklerinden
Salmonella spp. izolasyonu yapıldı. Bu kümeslere ait
yumurta örneklerinden ise Salmonella spp. izolasyonu yapılamadı. İzolasyon çalışmaları ile ilgili diğer araştırı-cıların bulguları farklılık göstermektedir (8,22,23,32). Tavuk dışkı, iç organ ve karkaslarında Salmonella türlerinin hem PCR hem de standart kültür metodu ile identifikasyonu ve belirlenmesinin araştırıldığı bir çalışmada, Oliveria ve ark. (2002), 64 drag svap örneğini,
Salmonella spp. yönünden standart kültür metodu ile
incelemişler ve 16 adet drag svap örneğinden (% 25) etkeni izole etmişlerdir. Oliveria ve ark. (2003), 49 drag svap örneğinden 3 (% 6.12)’ünde standart kültür metodu ile Salmonella spp. izole ettiklerini bildirmişlerdir.
Çakıroğlu (2005), toplam 882 yumurta numunesin-den standart kültür metodu ile Salmonella spp. izolasyonu yönünden yaptığı çalışmada, yumurta içeriklerinden Salmonella spp. izolasyonu gerçekleştire-mediğini bildirmiştir. Tuchili ve ark. (1996), 450 adeti kabuk altı ölüm meydana gelmiş, 210 adeti infertil ve 210 adeti yemeklik yumurta olmak üzere toplam 870 adet yumurta incelemişler ve bunlardan kabuk altı ölüm meydana gelmiş yumurtaların 6 (%13.3)’sından, infertil yumurtaların 2 (%9.5)’sinde standart kültür metodu ile
Salmonella spp. izolasyonu yapmalarına karşılık, sofralık
yumurtalardan Salmonella spp izolasyonu gerçekleştire-memişlerdir. Araştırmacıların tavuk dışkılarından ve sofralık yumurta içeriklerinden standart kültür metodu ile elde ettikleri sonuçlarla bu çalışmada elde edilen izolasyon bulguları birbirine paraleldir. Ancak Tuchili ve ark. (1996) kuluçkalık yumurtalarda da Salmonella izolasyonu yapmıştır. Bu çalışmada ise, bu tür yumurtalar incelenmediğinden herhangi bir karşılaştırma yapılamamıştır.
Yapılan bu çalışmada, klasik kültür metoduyla hedeflenen izolasyon ve identifikasyon kloakal svap örneklerinden başarıyla yapıldı ve aynı örneklerden PCR testi ile pozitif sonuç alındı. Bu iki yöntemle elde edilen bulgular uyumlu bulundu. Bäumler ve ark.(1997),
Salmonella cins spesifik iroB genleriyle yaptıkları PCR
çalışmalarında Salmonella etkenlerini hızlı ve güvenilir olarak tespit ettiklerini bildirmişlerdir. Bu çalışmada, kullanılan iroB genleriyle elde edilen PCR bulguları araştırıcının elde ettikleri ile aynıdır. Çarlı ve ark. (2001), selektif zenginleştirme sonrası hem deneysel olarak hem de klinik örneklerden PCR testiyle Salmonella belirlediklerini bildirmişlerdir. Bu araştırmada selektif zenginleştirme sonrası yapılan PCR testiyle, Çarlı ve ark. (2001) gibi Salmonella tespit edilmiş böylece hızlı teşhisin uygulanabilir olduğu ortaya konulmuştur.
Bäumler ve ark.(1997), iroB geninin PCR amplifikasyonuyla, deneysel infekte edilmiş yumurta içeriklerinden zenginleştirme aşamasından sonra
Salmonella’nın hızlı ve hassas bir şekilde belirlediklerini
bildirmişlerdir. Yumurta içeriklerinden PCR ile
Salmonella belirlenmesi için yapılmış olan bu çalışmada
negatif bulgular elde edilmiştir. Bu örneklerde kültür metodu ile izolasyon gerçekleştirilememesi, bu çalışmada kullanılan yumurtalarda Salmonella kontaminasyonu bulunmadığını göstermektedir. Elde edilen literatür bilgilerine göre Salmonella’ların yumurtayı horizontal ve vertikal olarak infekte edebildikleri bilinmektedir (12). Özelliklede paratifoid Salmonella etkenlerinden olan S. Enteritidis’in yüksek invazyon yeteneği ile yumurtlama öncesi yumurta içeriğine geçebildiği bildirilmektedir (13). Yapılan bu çalışmadaki svap örneklerinde, hem PCR hem de klasik kültür metoduyla Salmonella etkenleri belirlenmesine rağmen, Salmonella pozitif kümeslere ait yumurta örneklerinde PCR ve kültür metoduyla bu bakterilere rastlanmamıştır.
Burkhalter ve ark.(1995), Salmonella seropozitif buldukları sürülerden, birkaç gün sonra topladıkları yumurta örneklerini ön zenginleştirme, selektif zenginleştirme ve PCR ile Salmonella spp. yönünden incelemişler ancak bu sürülerden elde edilen yumurtaları incelediklerinde izolasyon ve PCR pozitifliğinin oldukça düşük olduğunu belirlemişlerdir. Araştırıcılar, Salmonella pozitif kümeslerden elde edilen yumurtalarda bu durumun dikkate alınması gerektiğini bildirmişlerdir. Bu çalışmada elde edilen bulgular. Burkhalter ve ark. (1995), elde ettikleri bulguları destekler niteliktedir. Bu çalışmada pozitif olarak saptanan 6 kümesin yumurtaları-nın hiçbirinde izolasyon ve PCR tekniği kullanılarak
Salmonella pozitifliği belirlenememiştir. Bu durum bu
çalışmada alınan yumurta örnekleme sayısının yetersiz olması ve sürünün serolojik ve/veya kloakal svap pozitifliği olsa bile etkenin yumurtaya geçişinin çok düşük düzeylerde olması ile açıklanabilir.
Burkhalter ve ark. (1995), yumurta örnekleri üzerine yaptıkları çalışmada, teşhis açısından PCR testi ile klasik kültür metodunu karşılaştırmışlardır ve araştırıcılar PCR’ın daha güvenilir bir şekilde Salmonella teşhisini gerçekleştirdiğini bildirmişlerdir. Ancak yapılan bu çalışmada svap örneklerinden klasik kültür metodu ile
Salmonella pozitif bulunan örnekler PCR ile de pozitif
bulunmuştur. Bu bulgular Salmonella saptanmasında, bu yöntemler arasında farklılığın olmadığını göstermektedir. Sonuç olarak bu çalışmada, kloakal svap alınan 50 kümesin 6’sında (%12) örnek bazında da 100 örneğin 6’sından (%6) selektif zenginleştirmeden sonra yapılan PCR ve kültür metodu ile Salmonella’nın cins düzeyinde varlığı tespit edildi. Yumurta örneklerinden ise her iki metotla da Salmonella belirlenemedi. Bu çalışmada,
tavuk dışkılarından Salmonella etkenlerinin PCR yöntemi ile tanısının yapılabileceği ortaya konulmuş olup, rutin teşhis amacıyla uygulanabilirliği belirlenmiştir. Bu nedenle Salmonella varlığını ortaya koymak için daha hızlı bir yöntem olan PCR metodunun alt yapısı uygun laboratuarlarda kullanımı düşünülmeli ve pozitif olan PCR bulguları altın standart olan klasik Salmonella zenginleştirme metoduyla doğrulanmalıdır.
Kaynaklar
1. Anon (2003): Salmonella. US Food and Drug Administration Bacteriolgical Analytical Manual. Chapter 5.
2. Anonim (1998): Kuluçkahane ve Damızlık İşletmelerin Sağlık Kontrol Yönetmeliği ve Talimatı. Tarım ve Köyişleri Bakanlığı.
3. Arda M, Esendal ÖM, Akay Ö, Keskin O, İzgür M (1995): Tavuk Salmonellosis’ inin teşhisinde Propylene Glycol’ lü yeni bir besiyerinin kullanılması. Ankara Üniv Vet Fak Derg, 42, 91-96.
4. Bäumler AJ, Heffron F, Reıssbrodt R (1997): Rapid detection of Salmonella enterica with primers specific for iroB. J Clin Microbiol, 35, 1224-1230.
5. Bilgehan H (2004): Klinik Mikrobiyolojik Tanı. Barış Yayınları, İzmir.
6. Burkhalter PW, Müller C, Lüty J, Candıran U (1995): Detection of Salmonella spp. in eggs: DNA analyses, culture, techniques ve serology. J AOAC Int, 78, 1531-1537.
7. Candrıan U (1995): Polymerase chain reaction in food microbiology. J Microbiol Meth, 23, 89–103.
8. Çakıroğlu HS (2005): Ankara Garnizonunda Tüketime Sunulan Tavuk Yumurtalarının Salmonella spp. Yönünden Analizi. Yüksek Lisans Tezi Erciyes Üniversitesi Sağlık Bilimleri Enstitüsü.
9. Çarlı KT, Ünal CB, Caner V, Eyigör A (2001): Detection of chicken feces by a combination of Tetrathionate Broth Enrichment, Capillary PCR, and Capillary Gel electrophhoresis. J Clin Microbiol, 39, 1871-1876.
10. Fluit AC, Wıdjojoatmodjo MN, Box ATA, Torensma R, Verhoef J (1993): Rapid detection of Salmonellae in poultry with the magnetic immuno-polymerase chain reaction. Appl Environ Microbiol, 59, 1342–1346.
11. Fricker CR (1987): The isolation of Salmonellas and Campylobacters. J Appl Bacteriol, 63, 99-116.
12. Gast RK (2003): Salmonella Infections. 567-613. In: Diseases of Poultry.YM Saif (Ed), Iowa State Press, Iowa. 13. Gast RK, Beard CW (1990): Production of Salmonella
enteritidis-contaminated eggs by experimentally infected hens. Avian Dis, 34, 438-446.
14. Gırwood AWR, Frıcker CR, Mundo D (1985): The incidence and significance of salmonella carriage by gulls in Scotland. J Hyg Camb, 95, 229-241.
15. Hargıs BM, Caldwell DJ, Brewer RL, Corrıer DE, Deloach JR (1995): Evaluation of the chicken crop as a source of Salmonella contamination for broiler carcasses. Poult Sci, 74, 1548–1552.
16. Hoorfar J, Baggesen DL, Portıng PH (1999): A PCR-based strategy for simple and rapid identification of rough presumptive Salmonella isolates. J Microbiol Meth, 35, 7– 84.
17. Humbert F, Carraminana JJ, Lalande F, Salvat G (1997): Bacteriological monitoring of Salmonella enteritidis carrier birds after decontaminatio using enrofloxacin, competitive exclusion and movement of birds. Vet Rec, 141, 297–299.
18. İzgür M (2002): Salmonella İnfeksiyonları. 41-53. In: Kanatlı Hayvan Hastalıkları. M İzgür, M Akan (Ed), Medisan Yayınevi, Ankara.
19. Medici DD, Pezzotti G, Marfoglia C, Caciolo D, Foschi G, Orefice L (1998): Comparison between ICS-Vidas, MSRV and standard cultural method for Salmonella recovery in poultry meat. Int J Food Microbiol, 45, 205-210.
20. Medici DD, Luciana C, Delibato E, Pasquale SD, Filetici E, Toti L (2003): Evaluation of DNA Extraction Methods for use in Combination with YBR Green I Real-Time PCR To Detect Salmonella enterica Serotype Enteritidis in poultry. Appl Environ Microbiol, 69, 3456-3461.
21. Meer RR, Park, DL (1995): Immunochemical detection methods for Salmonella spp, Escherichia coli O157:H7, and Listeria monocytogenes in foods. Rev Environ Contam Toxicol, 142, 1–12.
22. Oliveira SD, Santosa LR, Schucha DMT, Silvaa AB, Sallea CTP, Canala CW (2002): Detection and identification of salmonellas from poultry-related samples by PCR. Vet Microbiol, 87, 25-35.
23. Oliveira SD, Rodenbusch CR, Cé MC, Rocha SLS, Canal CW (2003): Evaluation of selective and non-selective enrichment PCR procedures for Salmonella detection. Lett Appl Microbiol, 36, 217-221.
24. Quinn PJ, Markey BK, Carter ME, Donnelly WJ, Leonard FC (2004): Veterinary Microbiology and Microbial Disease. India Replica Press Ptv. Ltd, Kundli. 25. Rabsch W, Tschape H, Ba¨umler AJ (2001):
Non-typhoidal salmonellosis: emerging problems. Microbes Infect, 3, 237–247.
26. Rodrigue DC, Tauxe RV, Rowe B (1990): International increase in Salmonella enteritidis: a new pandemic? Epidemiol Infect, 105, 21–27.
27. Schrank IS, Mores MAZ, Costa JLA, Frazzon APG, Soncini R, Schrank A, Vainstein MH, Silva SC (2001): Influence of enrichment media and application of a PCR based method to detect Salmonella in poultry industry products and clinical samples. Vet Microbiol, 82, 45–53. 28. Shivaprasad HL (2003): Salmonella Infections. 568-582.
In: Diseases of Poultry YM Saif (Ed),. Iowa State Press, Iowa.
29. Stone GG, Oberst RD, Hays MP, Mcvey S, Chengappa MM (1994): Detection of Salmonella serovars from clinical samples by enrichment broth cultivation-PCR procedure. J Clin Microbiol, 32, 1742– 1749. 30. Suzuky S (1994): Pathogenicity of Salmonella enteritidis
in poultry. J Food Microbiol, 21, 89–105.
31. Tuchili LM, Kodama H, Izumoto Y, Mukamoto M, Fukata T, Baba T (1995): Detection of Salmonella
gallinarum and S. typhimurium DNA in experimentally infected chicks by polymerase chain reaction. J Vet Med Sci, 57, 59–63.
32. Tuchili LM, Kodama H, Sharma RN, Takatori I, Pandey GS, Kabilika S, Mukamoto M, Tsuji S, Baba T (1996): Detection of Salmonella DNA chicken embryos and environmental samples by PCR. J Vet Med Sci, 58, 881-884.
33. Wawerla M, Stolle A, Schalch B, Eisgruber H (1999): Impedancemicrobiology: applications in food hygiene. J Food Protect, 62, 1488–1496.
Geliş tarihi: 22.06.2007 / Kabul tarihi: 30.11.2008 Yazışma adresi
Uzm. Vet. Hekim Zafer Ata Ankara Üniversitesi Veteriner Fakültesi Mikrobiyoloji ABD Dışkapı/Ankara