TİYOL FONKSİYONEL GRUP KAPLI MANYETİK KÜRELER ARACILIĞIYLA ELMA SULARININ
PATULİNDEN ARINDIRILMASI
Gülnur CAMIZCI Yüksek Lisans Tezi Biyomühendislik Anabilim Dalı
Biyomühendislik Programı Dr. Öğr. Üyesi Ceren BAYRAÇ
T.C.
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
TİYOL FONKSİYONEL GRUP KAPLI MANYETİK KÜRELER ARACILIĞIYLA ELMA SULARININ PATULİNDEN ARINDIRILMASI
YÜKSEK LİSANS TEZİ Gülnur CAMIZCI
Ana Bilim Dalı: Biyomühendislik
Tez Danışmanı: Dr. Öğr. Üyesi Ceren BAYRAÇ
TEZ BİLDİRİMİ
Yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
i ÖZET Yüksek Lisans Tezi
TİYOL FONKSİYONEL GRUP KAPLI MANYETİK KÜRELER ARACILIĞIYLA ELMA SULARININ PATULİNDEN ARINDIRILMASI
Gülnur CAMIZCI
Karamanoğlu Mehmetbey Üniversitesi Fen Bilimleri Enstitüsü
Biyomühendislik Ana Bilim Dalı Danışman: Dr. Öğr. Üyesi Ceren BAYRAÇ
Ocak, 2019, 70 sayfa
Bu tez, sülfidril grup kaplı manyetik küreler aracılığıyla elma sularının patulinden arındırılması çalışmalarını içermektedir. Çalışma kapsamında, yüzeyi sülfidril grup kaplı demir oksit küreler aracılığıyla çözeltiden patulinin arındırılması için optimizasyon çalışmaları gerçekleştirilmiştir. Yüksek verimde patulinden arındırma işlemi için sülfidril grup kaplı manyetik küre miktarı, inkübasyon süresi, sıcaklığı ve pH parametreleri optimize edilmiş, patulin miktarının ve sülfidril grup kaplı manyetik kürelerin tekrar kullanımının arındırma verimine etkisi değerlendirilmiştir. Patulinin sülfidril kaplı manyetik kürelere adsorpsiyonu farklı adsorpsiyon izoterm ve kinetik modelleri ile test edilmiş ve termodinamik açıdan adsorpsiyon karakterize edilmiştir. Çalışmanın son basamağında ise önceden belirlenen koşullarda gerçek elma suyu örneklerinden patulin arındırma işlemleri gerçekleştirilmiş ve arındırma işleminin elma suyu kalite parametrelerine etkisi değerlendirilmiştir.
Anahtar Kelimeler: Patulin, Sülfidril grup kaplı manyetik küre, Elma suyu, Adsorpsiyon
ii ABSTRACT
Ms Thesis
REMOVAL OF PATULIN FROM APPLE JUICES BY MAGNETIC BEADS COATED WİTH THIOL FUNCTIONAL GROUPS
Gülnur CAMIZCI
Karamanoğlu Mehmetbey University Graduate School of Natural and Applied Sciences
Department of Bioengineering
Supervisor: Assist.Prof.Dr. Ceren BAYRAÇ January, 2019, 70 pages
This thesis includes studies on the removal of patulin from apple juices by sulfhydryl terminated-magnetic beads. Within the scope of this study, certain optimization studies were carried out for the removal of patulin from aqueous solution. The amount of sulfhydryl terminated-magnetic beads, incubation time, temperature and pH were optimized to have highest patulin removal efficiency and the effect of patulin amount and reuse cycle of these magnetic beads on the patulin removal efficiency was evaluated. Adsorption of patulin onto sulfhydryl terminated-magnetic beads was tested with different adsorption isotherm and kinetic models. Moreover, the adsorption process was characterized in terms of thermodynamic parameters. Finally, patulin removal process was appled on apple juice samples under predetermined conditions and the effects of removal process on the quality parameters of apple juice was evaluated in order to find its potential for the industrial uses.
iii ÖNSÖZ
Öncelikle, kendisinin öğrencisi olmamı hayattaki en büyük şanslarımdan saydığım, hem özel hayatımda hem de okul hayatımda desteğini ve yardımını benden hiçbir zaman esirgemeyen, bu çalışmamın her evresini büyük bir titizlik ve özveriyle takip edip değerli deneyimleriyle beni yönlendiren, zorlu hayat şartları sebebiyle zaman zaman tükenen çalışma azmimi sakinlik ve olgunlukla karşılayarak bana yol gösteren ve çalışkanlığı, karakteri, hayata karşı duruşu ile idolüm haline gelmiş olan çok sevgili ve benim için çok değerli danışman hocam Sayın Dr. Öğr. Üyesi Ceren BAYRAÇ’a teşekkürü borç bilirim.
Çalışma ortamımızda ekip olarak bizi bir arada birlik içinde tutmak için çabalayan, hep daha çok çalışıp bir şeyler başarmamızı isteyen çok değerli hocamız Sayın Dr. Öğr. Üyesi A. Tahir BAYRAÇ’a bana verdiği emeklerinden, tecrübelerinden, nasihatlerinden duyduğum minnetle teşekkürlerimi sunarım.
Çalışmalarımda yardımlarını ve desteklerini eksik etmeyen, HPLC analizlerimi gerçekleştiren Sayın Öğr. Gör. Hacer Sibel KARAPINAR’a teşekkürlerimi sunarım. Yüksek lisans öğrenim hayatıma renk katan, birlikte çok güzel vakit geçirdiğim, mutlu anılar biriktirdiğim, Karaman’ın bana kazandırdığı, Biyomühendislik bölümü laboratuvarı arkadaşlarıma teşekkürlerimi sunarım.
Beni koşulsuz seven, maddi manevi desteklerini benden hiçbir zaman esirgemeyen, hep daha iyisini yapabileceğime inanan, varlıklarını benim için dünyanın en büyük servetlerinden bile değerli saydığım çok değerli ailem; başta babam ve annem Musa CAMIZCI ve Şerife CAMIZCI’ya, kardeşlerim Mustafa Enes CAMIZCI ve Ebubekir CAMIZCI’ya, babaannem Ferhata CAMIZCI’ya, aramızdan erken ayrılan ve özlemini hep içimde taşıdığım büyükbabam Mustafa CAMIZCI’ya teşekkürlerimi sunarım. Çalışma için 33-M-16 numaralı proje kapsamında mali destek sağlayan Karamanoğlu Mehmetbey Üniversitesi Bilimsel Araştırma Projeleri Komisyonu’na teşekkürlerimi sunarım.
Gülnur CAMIZCI Ocak, 2019
iv İÇİNDEKİLER Sayfa ÖZET ... i ABSTRACT ... ii ÖNSÖZ ... iii İÇİNDEKİLER ... iv ÇİZELGELER DİZİNİ ... vii ŞEKİLLER DİZİNİ ... viii SİMGELER VE KISALTMALAR DİZİNİ ... ix 1. GİRİŞ ... 1
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI ... 3
2.1. Patulin ... 3
2.2. Patulin Biyosentezi ... 4
2.3. Patulinin İnsan ve Hayvan Sağlığı Üzerine Etkileri ... 5
2.4. Patulin İçeren Gıda Maddeleri ... 7
2.5. Patulinin Dünyada ve Türkiye’deki Güvenlik Limitleri ... 7
2.6. Patulin Tayin Yöntemleri ... 10
2.6.1. Yüksek Performanslı Sıvı Kromatografisi (HPLC) ... 14
2.6.2. İnce Tabaka Kromatogragisi (TLC) ... 15
2.6.3. Gaz Kromatografisi (GC) ... 16
2.7. Patulinden Arındırma Yöntemleri ... 17
2.7.1. Elma Suyu Üretim Prosesi Öncesi Patulinden Arındırma Yöntemleri ... 18
2.7.1.1. Fungusitler ve İnsektisitler Kullanılarak Patulinden Arındırma ... 18
2.7.1.2. Isıl İşlem Uygulanarak Patulinden Arındırma ... 18
2.7.1.3. Bakteriler Kullanılarak Patulinden Arındırma ... 19
2.7.1.4. Meyvenin Çürük ya da Kontamine Kısmının Uzaklaştırılması ... 20
2.7.2. Elma Suyu Üretim Prosesi Sonrası Patulin Arındırma Yöntemleri ... 21
2.7.2.1. Askorbik Asit ve Sülfür Dioksit İlavesinin Etkisi ... 21
2.7.2.2. Aktif Karbon İlavesinin Etkisi ... 22
3. MATERYAL ve METOT ... 24
3.1 Çalışmada Kullanılan Materyaller ... 24
v
3.2.1 Yüzey gruplarının karakterizasyonu ... 24
3.2.2 Yüzey gruplarının indirgenmesi ... 25
3.3. Patulin Standart Çözeltilerinin Hazırlanması ... 25
3.4. Patulin Standart Çözeltilerinin Spektrofotometre Analizi ... 25
3.5. HPLC Analizi ... 26
3.6. Manyetik Küreler ile Patulin Temizleme İşlemine ait Optimizasyon Çalışmaları .. 26
3.6.1. Manyetik Küre Miktarı Optimizasyonu ... 27
3.6.2. İnkübasyon Süresi Optimizasyonu ... 28
3.7. Başlangıç Patulin Miktarının Temizleme Verimine Etkisi ... 29
3.8. Manyetik Kürenin Yüzey Gruplarının Temizleme Verimine Etkisi ... 29
3.9. Sıcaklığın Temizleme Verimi Üzerine Etkisi ... 29
3.10. pH’ın Temizleme Verimi Üzerine Etkisi ... 30
3.11. Adsorpsiyon İzoterm Modellerin Test Edilmesi ... 30
3.12. Adsorpsiyon Kinetiği Modellerin Test Edilmesi ve Termodinamik Parametrelerin Analizi ... 32
3.13. Manyetik Kürelerin Tekrar Kullanılabilirliğinin Test Edilmesi ... 33
3.14. Gerçek Elma Suyu ile Hazırlanan Örneklerde Patulin Temizleme İşlemi ... 34
3.15. Temizlenen Elma Sularına ait Son Ürün Kalite Parametrelerinin Değerlendirilmesi ... 34
3.16. İstatiksel Analizler ... 35
4. BULGULAR ve TARTIŞMA ... 36
4.1. Manyetik Kürenin Yüzey Karakterizasyonu ... 36
4.2.Patulinin Spektral Analizi ... 38
4.3.Patulinin HPLC Analizi ... 39
4.4. Optimizasyon Deneyleri ... 42
4.4.1 Manyetik Küre Miktarı Optimizasyonu ... 43
4.4.2. İnkübasyon Süresi Optimizasyonu ... 44
4.5 Başlangıç patulin miktarının temizleme verimine etkisi ... 45
4.6. Manyetik Kürenin Yüzey Gruplarının Temizleme Verimine Etkisi ... 47
4.7. Sıcaklığın Temizleme Verimine Etkisi ... 48
4.8. pH’ın Temizleme Verimine Etkisi ... 49
4.9 Adsorpsiyon İzoterm Modellemesi ... 51
vi
4.11 Kürelerin Tekrar Kullanılmasının Temizleme Verimi Üzerine Etkisi ... 55
4.12 Elma Suyunu Patulinden Arındırma Deneyleri ... 56
4.13 Temizleme sisteminin son ürün kalitesi üzerine etkisi ... 60
5. SONUÇ ... 62
KAYNAKLAR ... 63
vii
ÇİZELGELER DİZİNİ
Çizelge Sayfa
Çizelge 2-1 Elma ürünlerindeki patulin miktarı ... 9
Çizelge 2-2 Türk Gıda Kodeksine Göre Gıdalarda Patulin İçin Belirtilen En Yüksek Sınırlar ... 10
Çizelge 4-1 Patulin Miktar Tayini için HPLC Analizi Koşulları ... 40
Çizelge 4-2 Manyetik küre miktarı optimizasyonuna ait HPLC verileri ve manyetik kürelerin adsorpsiyon kapasite ve % temizlik verimi değerleri ... 43
Çizelge 4-3 1 µg/mL patulinine ait inkübasyon süresinin temizleme verimine etkisi ... 44
Çizelge 4-4 Farklı miktarda patulin içeren çözeltilerin farklı sürelerde HPLC verileri ve % temizleme verimi değerleri ... 45
Çizelge 4-5 DTT ile yüzey gruplarını indirgeme işleminin temizleme verimine etkisi 47 Çizelge 4-6 1 µg/mL patulinin farklı sıcaklıklarda inkübasyon sonrası HPLC verileri . 48 Çizelge 4-7 Farklı pH değerlerinde hazırlanan 1 µg/mL patulinin HPLC verileriyle hesaplanan değerler ... 50
Çizelge 4-8 Bu çalışmada test edilen adsorpsiyon izoterm modelleri ... 53
Çizelge 4-9 Adsorpsiyon izoterm modellerine ait parametreler ... 54
Çizelge 4-10 Adsorpsiyon kinetik modellerine ait parametreler ... 54
Çizelge 4-11 Tekrar kullanılan kürelerin HPLC verileri ve hesaplanan değerler ... 55
Çizelge 4-12 Farklı tarihlerde HPLC ile analiz edilen elma sularındaki patulin miktarları ... 57
Çizelge 4-13 Patulinin temizlenmesi için literatürde yapılan çalışmalara örnekler ... 58
viii
ŞEKİLLER DİZİNİ
Şekil Sayfa
Şekil 2-1 Patulinin moleküler yapısı ... 4
Şekil 2-2 Patulin biyosentezi ... 5
Şekil 2-3 Pektinin moleküler yapısı ... 12
Şekil 2-4 Sıvı sıvı ekstraksiyon ... 13
Şekil 2-5 Katı faz ekstraksiyonu ... 14
Şekil 2-6 HPLC aşamalarının şematik gösterimi ... 15
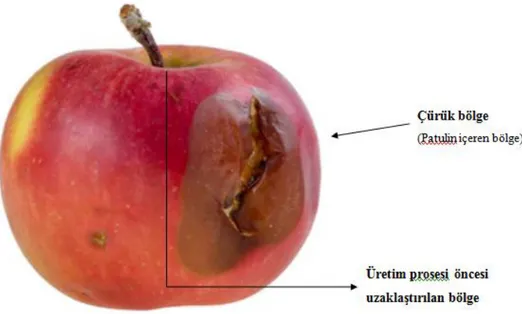
Şekil 2-7 Elmanın patulin barındıran çürük kısmı ... 20
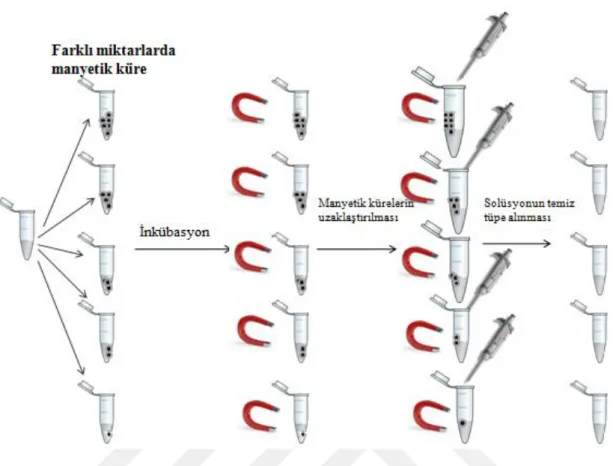
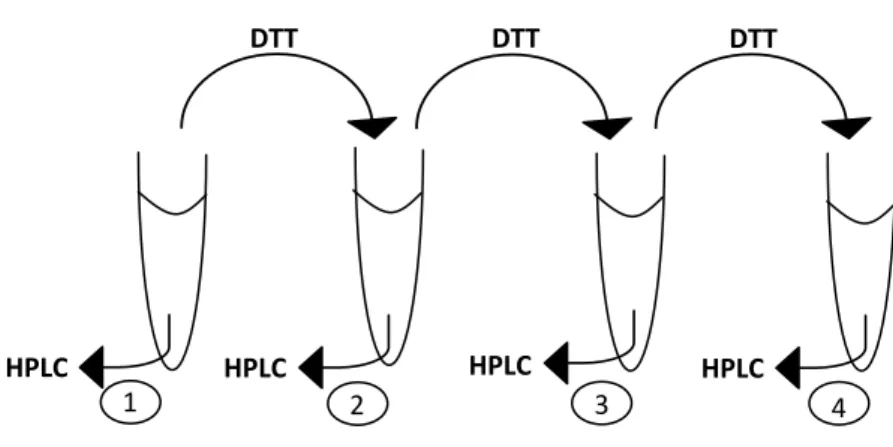
Şekil 3-1 Manyetik kürelerin miktar optimizasyon çalışmasına ait işlem basamakları . 28 Şekil 3-2 Kürelerin tekrar kullanılması deneyinin şematik gösterimi ... 33
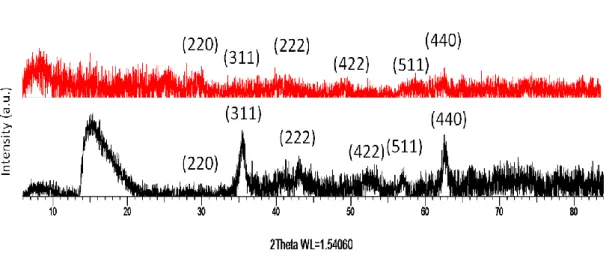
Şekil 4-1 Demir oksit kürelerin X ışını kırım desenleri ... 37
Şekil 4-2 Demir oksit kürelere ait FTIR spektrum analizi ... 38
Şekil 4-3 Patuline ait spektrum taraması sonucu; 25 µg/mL konsantrasyonunda fosfat tampon çözeltisi (1X, pH 7,2) içerisindeki patuline ait 200-400 nm dalga boyları arasındaki spektrum taraması ... 39
Şekil 4-4 Farklı konsantrasyonlardaki patulinin HPLC ile ölçülen değerler ... 41
Şekil 4-5 HPLC ile belirlenen patulin standart eğrisi ... 41
Şekil 4-6 HPLC ile Patulin miktar tayininde lineerlik değerlendirmesi ... 42
Şekil 4-7 Manyetik küre miktarının % etkinlik verimine etkisi ... 43
Şekil 4-8 1 µg/mL patulin için inkübasyon süresinin temizleme verimine etkisi ... 45
Şekil 4-9 Farklı miktarda patulin içeren çözeltilerin farklı sürelerdeki % temizleme verimi değerleri ... 46
Şekil 4-10 Sıcaklığın % temizlik verimi üzerine etkisi ... 49
Şekil 4-11 pH’ın patuline ait % temizleme verimi üzerine etkisi ... 51
ix
SİMGELER VE KISALTMALAR DİZİNİ
Simgeler Açıklama
AT Temkin izoterm bağlanma sabiti (L/g)
µg Mikrogram (10-6 gram) µm Mikrometre (10-6 metre)
B Adorpsiyon ısısıyla alakalı sabit
bT Temkin izoterm sabiti
C0 Başlangıç patulin miktarı (mg/L)
Ce Denge durumundaki patulin konsantrasyonu (mg/L) Cf Adsorpsiyon sonrası kalan patulin miktarı (mg/L) dak Dakika
GGibbs serbest enerjisindeki değişim
Entalpi değişimi
SEntropi değişimi g Gram
k1 1. derece hız sabiti (g/mg.dk) k2 2. derece hız sabiti (g/mg.dk)
kAV Avrami hız sabiti (L/dak)
kDa Kilodalton
KF Freundlich adsorpsiyon kapasitesi sabiti (L/g)
Kg Liu izoterm sabiti (L/mg)
kg Kilogram
KH Hill izoterm sabiti (mg/L)nH
KL Langmuir adsorpsiyon sabiti (L/mg) L Litre
m Adsorban kütlesi (Miligram)
M Molarite (mol/litre)
mg Miligram mm Milimetre
n Deney sayısı
nAV Avrami kinetik düzeyi
nf Freundlich katsayısı
nH Hill izoterm katsayısı
nL Liu izoterm sabiti
nm Nanometre
p İzoterm modeline uygunluğu için bağımsız değişken sayısı q Manyetik kürelerin adsorpsiyon kapasitesi (µg/mg)
x
qe Denge durumundaki adsorpsiyon kapasitesi (mg/g)
qi,exp Her bir deneysel q değeri
qi,model Modelin tahmin ettiği teorik q değeri
Qmax Langmuir maksimum adsorpsiyon kapasitesi (mg/g)
qt t anında manyetik küreye adsorplanan patulin miktarı (mg/g)
R Gaz sabiti (8,314 J/mol.K)
R2 Regrasyon katsayısı
Radj2 Düzeltilmiş regrasyon katsayısı
RL Langmuir izotermine ait ayırma faktörü s Saniye
SD Standart sapma
T Kelvin biriminde sıcaklık
t Manyetik küre ve patulinin inkübasyon süresi
V Hacim (Litre)
Kısaltmalar Açıklama
AOAC Association of Official Agricultural Chemists
DAD Diode Array Detector
DTT Dithiothreitol
FAO Food and Agriculture Organization
FDA Food and Drug Administration
FT-IR Fourier Transform Infrared Spectroscopy
GC Gas Chromatography
HPLC High Pressure Liquid Chromatography HTST High Temperature Short Time
LD50 Lethal Dose 50
LLE Liquid-Liquid Extraction
LOD Level of Detection
MS Mass Spectrometry
PBS Phosphate Buffered Saline
SPE Solid Phase Extraction
TLC Thin Layer Chromatography
1 1. GİRİŞ
Birçok meyve ve özellikle elma üzerinde mayaların üretmesi sonucu oluşan patulinin meyve suyu ve meyve içerikli katı ürünlerde bulunması tüm dünyada sorun olarak nitelendirilmektedir. İnsan ve hayvan sağlığı üzerindeki olumsuz etkileri nedeniyle birçok ülke patulin oluşumu için uygun gıda maddelerinde patulin miktarı için çeşitli miktar sınırlandırmaları koymuşlardır. Codex Alimentarius ile Gıda ve İlaç Dairesi (FDA) elma suları ve elma içerikli diğer gıda ürünleri için izin verilen en yüksek düzeyi 50 μg/kg olarak belirlemiştir. Avrupa Birliği de bu üst sınırı elma suyu ürünlerinde 50 μg/kg, katı elma ürünlerinde 25 μg/kg ve bebek mamalarında 10 μg/kg olarak belirlenmiştir (Şahin ve ark., 2011). Ülkemizde ise 2008 yılında 26879 sayılı resmi gazetede “Türk Gıda Kodeksi Gıda Maddelerindeki Bulaşanların Maksimum Limitleri Hakkında Tebliğ” yayınlanmış ve 2011 yılında 28157 sayılı resmi gazetede yayınlanan “Türk Gıda Kodeksi Bulaşanlar Yönetmeliği” ile Avrupa Birliği’nin belirtmiş olduğu limitler ülkemiz için maksimum limitler olarak belirtilmiştir (Türk Gıda Kodeksi, Tebliğ No: 2008 / 26, 2008; Türk Gıda Kodeksi Bulaşanlar Yönetmeliği, Sayı 28157, 2011).
Ülkemiz meyve suyu üretiminde ve ihracatında önemli ülkeler arasında yer almaktadır ve dolayısıyla standartlara uygun meyve ve meyve suyunun üretimi ve üretim sonrası kontrolü büyük önem taşımaktadır. Bugüne kadar ülkemizde yapılan bazı çalışmalarda elma suyu ve konsantresinde patulin varlığı gözlemlenmiş ve miktar tayininden sonra patulin seviyesinin uluslararası standartlardan yüksek olduğu belirtilmiştir. 1994 yılında yapılan bir çalışmada bir firmanın farklı tarihlerde ürettiği 215 adet elma suyu numunesinin 98 tanesinde standartlarda belirlenen sınırın üzerinde patulin miktarı saptanmıştır (Acar ve Gökmen, 1998). 2001 yılında yapılan başka bir çalışmada ise, piyasadan temin edilen 45 elma suyu numunesinin 42’sinde 50 μg/L düzeyinin üzerinde patulin bulunduğu tespit edilmiştir (Yurdun ve ark., 2001). Dolayısıyla elma suyu ve konsantresi başta olmak üzere çeşitli ürünlerde patulin varlığı hem ülkemiz hem de dünyanın değişik ülkeleri için sorun teşkil etmektedir.
Günümüzde elma sularından patulini arındırmak amacıyla pek çok yöntem kullanılmaktadır. Bu yöntemlerin hem yeteri miktarda patulin temizlenmesine yol
2
açmadığı hem de son ürün kalitesini değiştirdiği bilindiğinden farklı dekontaminasyon yöntemlerine ihtiyaç duyulmaktadır. Yapılan çalışmada, manyetik küre tabanlı patulin yakalama sisteminin oluşturulmuştur. Patulinin sülfidril gruplarına karşı gösterdiği yüksek afiniteden yararlanarak, yüzeyi -SH gruplarla kaplı manyetik kürelerle patulinin ortamdan uzaklaştırılması için optimizasyon çalışmaları gerçekleştirilmiş ve yeni, ucuz, hızlı, pratik bir dekontaminasyon yöntemi geliştirilmiştir.
3
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI
2.1. Patulin
Patulin, özellikle Aspergillus, Penicillum, Paecilomyces ve Byssochlamys mantarlarının çeşitli türleri tarafından üretilen ve toksik olarak nitelendirilen bir metabolittir (Puel ve ark., 2010). Toksik karakterli olan ve mikotoksin olarak adlandırılan bu metabolitler insan sağlığı açısından risk taşımaktadır (Kadakal ve Nas, 2000). Mikotoksinler, sekonder metabolitlerdir ve küf bulaşısı bulunan ortamlarda vejetatif gelişimlerini tamamlarlar. Daha sonra idiofaz safhasına girdiklerinde oluşurlar (Topal, 1996). Patulin üretebilen Aspergillus ve Penicillum türleri, A. clavatus, A. giganteus, A. longivesica, P. carneum, P. clavigerum, P. concentricum, P. coprobium, P. dipodomyicola, P. expansum, P. glandicola, P. gladioli, P. griseofulvum, P. marinum, P. paneum, P. sclerotigenum, P. vulpinum olarak sıralanabilir (Frisvad ve ark., 2004; Varga ve ark., 2007).
Fleming’in penisilin keşfini takiben yeni fungal moleküllerin arayışı artmış ve bunun neticesinde patulin ilk olarak 1943 yılında Birkinshaw ve arkadaşları tarafından Penicillum griseofulvum ve Penicillum expansum’dan izole edilmiştir. Paracelce’nin “Von der besucht” tanımlamasında belirttiği “Her madde bir zehirdir; yalnızca uygun doz ilacı zehirden ayırır.” ifadesini takiben İngiliz bir firmanın “tercinin” markası altında yaptığı klinik çalışmalarla bu maddenin insan ve hayvan üzerinde toksik etkisi olduğu saptanmış ve potansiyel antibiyotiklere olan ilgi kısa sürede azalmıştır. Günümüzde ise patulin, dünya çapında pek çok ülkede gıdalarda bulunma miktarı denetlenen ve aflatoksinler, okratoksin A, zearalenon, fumonisinler, trikotesenler gibi mikotoksinler grubu arasında yer almaktadır (Birkinshaw ve ark., 1943; Puel ve ark., 2010).
Patulin, 4-hidroksi- 4H-furo [3, 2- C] piran-2 (6H)-on olarak da bilinir. Kapalı formülü C7H6O4, molekül ağırlığı 154,12 g/mol ve yoğunluğu 1,52 g/cm3’tür. Su, etil alkol,
aseton, etil asetat ve kloroformda çok iyi çözündüğü bilinmektedir (Kadakal ve Nas, 2000).
4
Şekil 2-1 Patulinin moleküler yapısı (Song ve ark., 2014)
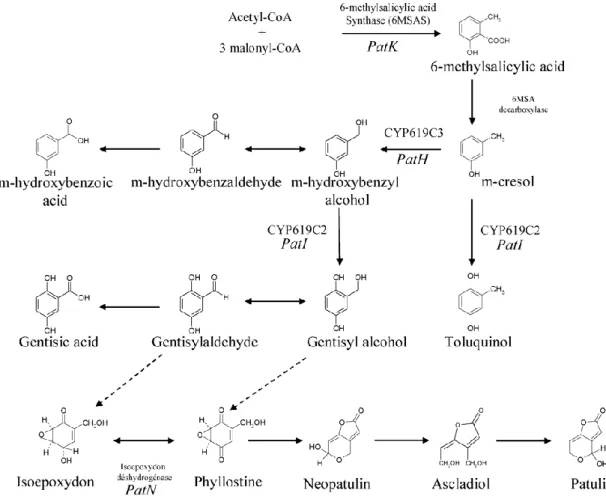
2.2. Patulin Biyosentezi
Pek çok mikroorganizma tarafından sentezlenen patulinin biyosentezinin gerçekleşebilmesi için bazı ortam koşullarının uygunluğu önem taşımaktadır. Bunlar; ortamın sıcaklığı, pH, süre, ortamdaki besin maddeleri ve ozmotik basınçtır. Ayrıca su aktivitesi değeri de patulin sentezi açısından oldukça önemli bir faktördür. Yapılan araştırmalar sonucunda, su aktivitesinin 0,77’den az olması halinde patulin sentezinin gerçekleşemeyeceği belirtilmiştir. Meyve, sebze, meyve suları ve ev yapımı marmelatlar, sahip oldukları su aktivitesi bakımından küf gelişimi ve dolayısıyla patulin sentezi açısından oldukça uygundur. Optimum ortam şartları sağlandığında, yüksek düzeyde toksin oluşumu için 14-15 günün yeterli olduğu belirtilmiştir (Acar ve Gökmen, 1998).
Aflatoksin, fumonisin, okratoksin, trikotesen, sitrinin, sterigmatoksin, zaeralenon gibi önemli mikotoksinler arasında yer alan patulin, poliketid bir sekonder metabolittir. Doymamış bir lakton ve poliasetat türevi ikincil metabolit olan patulinin biyosentezi, asetil koenzim A (asetil CoA) ve 3 malonil koenzim A (3 malonil CoA)’nın kondenzasyon reaksiyonu ile 6-metilsalisilik asit sentaz (6-MSA sentaz) enzimi tarafından 6-metisalisilik aside (6-MSA) dönüştürülmesi ile başlar. Bu enzim aynı zamanda açil taşıyıcı protein özelliğine sahiptir ve 4 tane 176 kDa polipeptidik zinciri bulunmaktadır. 6-MSA, 6- MSA dekarboksilaz enzimi aracılığıyla m-krezole dönüştürülür ve m-krezolün metil grubu oksidize olarak aldehit grubuna dönüşür. Bu adımdan sonra gerçekleşen hidroksilasyon reaksiyonu ile gentisaldehit oluşur. Daha sonra öncül patulin olarak adlandırılan izoepoksidon, phyllostine, neopatulin, ascladiol metabolitlerinin oluşmasına neden olan dehidrojenijasyon tepkimeleri
5
gerçekleşir ve sonuç olarak patulin meydana gelir (Puel ve ark., 2010). Yaklaşık 10 basamaktan oluşan bu biyosentez yolağı 15 enzim tarafından kontrol edilmektedir.
Şekil 2-2 Patulin biyosentezi (Puel ve ark., 2010)
2.3. Patulinin İnsan ve Hayvan Sağlığı Üzerine Etkileri
Patulin, elma, elma suyu, elma şarabı, komposto ve çocuklar için yapılmış elma içerikli yiyecek maddeleri gibi elma türevli gıdalar içerisinde bulunan en yaygın mikotoksin çeşididir. Sülfidril gruplarına karşı yüksek bağlanma afinitesine sahip olması sayesinde pek çok enzime bağlanıp inhibe ederek fonksiyonlarının değişmesine ve metabolizma açısından önemli reaksiyonların gerçekleşememesine neden olmaktadır. Dolayısıyla patuline belirli bir seviyeden fazla maruz kalmak, immunolojik, nörolojik, karsinojenik ve gastrointestinal pek çok sağlık problemine neden olmaktadır. Bu nedenle, patulin
6
tüketimine bağlı sağlık risklerinin değerlendirilmesi sonucunda birçok ülkede patulin içeren gıda maddelerindeki patulin miktarının sınırlandırılması için düzenlemeler yapılmıştır (Appell ve ark., 2009; Puel ve ark., 2010).
Kemirgenlerde patulinin oral LD50 değeri 26-55 mg/kg vücut ağırlığı olarak belirlenmiştir (McKinley ve Carlton, 1980; McKinley ve ark., 1982). Kümes hayvanlarında ise bu değer, 170 mg/kg vücut ağırlığıdır. Ayrıca inrtavenöz, intraperitoneal ve subkütan yollarla patulin alımı gerçekleştiğinde, 3-6 kat daha toksik olduğu görülmüştür. Toksik belirtilerin başında ajitasyon olmakla birlikte bazı vakalarda, havale, nefes darlığı, akciğer tıkanması, ödem, ülserleşme, kan toplanması ve gastro intestinal bölgede şişkinlik görülmüştür (WHO, 1998).
Bazı bileşikler patulin toksisitesini tolere edebilirler. Örneğin, proadifen (SKF 525A) gibi sitokrom P450 inhibitörleri bu mikotoksin toksisitesini önemli ölçüde artırırken, P450 indüktörleri toksisitesini değiştirmez (Hayes ve ark., 1979). Benzer şekilde, 150 mg/kg vücut ağırlığı seviyesinde patulin / sistein bileşiği farelere intraperitoneal uygulandığında, akut toksisite gözlemlenmemiştir (Ciegler ve ark., 1976).
Patulin subakut olarak ele alındığında ağırlıklı olarak sıçanlarda kilo kaybı, gastrit, intestinal ve böbrek fonksiyonlarda değişiklikler oluşturduğu görülmüştür. Patulin uygulamasının devam etmesi halinde nörotoksisiteye neden olurken aynı zamanda bağırsakta ve beyinde bulunan ATPaz gibi bazı enzimlerin inhibisyonuna neden olduğu saptanmıştır. Aynı klinik bulgular fare, hamster ve tavuklarda da gözlemlenmiştir (Speijers ve ark., 1985; Speijers ve ark., 1986; Devaraj ve ark., 1986; Devaraj ve ark., 1987).
Selmanoğlu ve Koçkaya, günlük oral yolla 0,1 mg/kg vücut ağırlığı patulin uygulandığında 60-90 gün sonra sıçanlarda sperm sayısında azalma olduğunu belirtmiştir (Selmanoğlu ve Koçkaya, 2004).
Patulin esasen ülserasyon, şişme, kanama, gastrointestinal bozukluklara yol açarken, alımının devam etmesi halinde böbrek fonksiyonlarında bozulmalara neden olduğu düşünülmektedir (Puel ve ark., 2010). Ayrıca pek çok çalışmada patulinin memeli hücrelerinde klastojenik etki gösterdiği belirtilmiştir. Örneğin, Çin hamsterı akciğer fibroblast (V79) hücrelerinde, kromozomların sentromerlerinde özelleşmiş bir bölge
7
olan ve hücre döngüsü sırasında bölünmenin doğru bir şekilde gerçekleşmesini sağlayan, nükleusta bulunan kinetekor adı verilen yapıların oluşumunu engelleyerek kromozomda yapısal ve dolayısıyla fonksiyonel anomalilerin meydana geldiği gözlemlenmiştir (Thust ve ark., 1982; Pfeiffer ve ark., 1998; Alves ve ark., 2000). Yapılan bazı çalışmalarda patulinin DNA sentezini bozduğunu ve bu durumun sülfidril gruplarıyla reaksiyona girmesi sonucu oksidatif hasara neden olmasıyla ilişkilendirildiği söylenmektedir (Riley ve Showker, 1991; Liu ve ark., 2007). Diğer mikotoksinler gibi patulin de konakçı organizmanın makrofaj fonksiyonlarını inhibe ederek immün yanıtı değiştirebilir (Puel ve ark., 2010).
2.4. Patulin İçeren Gıda Maddeleri
Patulin, başta elma olmak üzere armut, şeftali, kayısı, domates, hurma, üzüm, kiraz, karadut, betaz dut, çilek, kayısı, nektarin, ahududu, erik, muz, yaban mersini, siyah kuş üzümü gibi meyve ve badem, ceviz, yer fıstığı, fındık gibi pek çok gıda maddesinde bulunmaktadır. Lahana, turp, kereviz, soğan, portakal ve portakal suyunda ise patulinin sentezlenemediği görülmüştür. Bunun nedeninin, bu besinlerde patulin sentezi esnasında –SH gruplarında değişimlere neden olduğu ve stabilitesinin bozulduğu sebebiyle olduğu düşünülmektedir. Ayrıca sucuk, salam gibi işlenmiş et ürünlerinde de patulin oluşmasına rağmen –SH grupları nedeniyle stabilitesinin bu gıdalarda bozulduğu görülmüştür (Kadakal ve Nas 2000).
2.5. Patulinin Dünyada ve Türkiye’deki Güvenlik Limitleri
Patulinin akut ve kronik toksisiteye neden olduğu bilinmektedir (Rocha ve ark., 2014). Patulin tüketimine bağlı olarak meydana gelen akut semptomlar ajitasyon, konvülsiyon, dispne, pulmoner tıkanıklık, gastrointestinal problemler ve böbrek hasarıdır. Kronik sağlık riskleri ise, genotoksik, nörotoksik ve karsinojenik etkileri içermektedir (Li ve ark., 2017). Patulinin sağlık açısından olumsuz etkileri hücresel seviyede, plazma membranı bozulmasını, protein sentezinin inhibisyonunu, Na+
ile bağlanmış amino asit transportunun inhibisyonunu, transkripsiyon ve translasyonun bozulmasını, DNA sentezinin inhibisyonunu ve interferon- üreten T-yardımcı tip 1 hücrelerin inhibisyonu olarak sıralanabilmektedir (Moake ve ark., 2005).
8
Tüm bu olumsuz etkilerinden dolayı dünya çapında patulin alımına kısıtlamalar getirilmiştir (Çizelge 2-1). Dünya Sağlık Örgütü (WHO) ile Gıda ve Tarım Örgütü (FAO), patulinin üreme toksisitesi, uzun süreli toksisite ve karsinojenisite etkisini ratlarla yapılan çalışmaları göz önünde bulundurarak patulinin maksimum tolere edilebilir günlük alım miktarını 0,4 μg/ kg vücut ağırlığı/gün olarak geçici bir süre için belirlemiştir (Leggott ve Shephard, 2001). Daha sonra, Codex Alimentarius ile Gıda ve İlaç Dairesi (FDA) yiyecek ve içecek maddelerinde bulunabilecek en yüksek patulin miktarını 50 µg/kg olarak sınırlandırmıştır (Şahin ve ark., 2011).
Avrupa ülkelerinde çeşitli gıda maddelerinde izin verilen maximum patulin miktarı; meyve suları ve alkollü içeceklerde 50 μg/L, katı elma ürünlerinde 25 μg/L ve bebek mamalarında 10 μg/L olarak belirlemiştir (EU Commission Regulation, 2006).
FDA, elma suyunda veya elma içeren besinlerde patulin konsantrasyonunu maximum seviyesinin 50 μg/L olarak belirlemiştir (U.S. Food and Drug Administration, 2001). Çin, dünyanın en büyük elma suyu konsantresi üreticisi ve ihracatçısıdır. Ulusal Gıda Güvenliği Standardı GB 2761–2011'de (Ministry of Health of the People’s Repuclic of China, 2011) patulin konsantrasyonu meyve, meyve suyu ve elma ya da alıç içeren şaraplar için 50 μg/kg ile sınırlandırmıştır.
Yapılan araştırmalar sonucunda, dünya çapındaki çoğu ülkede yiyecek ve içecek maddelerinde bulunan patulin miktarları, Codex Alimentarius sınırlarının altındadır. Fakat Avustralya, Türkiye ve İran’da bulunan patulin miktarlarının, Avrupa ülkeleri ile kıyaslandığında %30- %40 oranla daha fazla olduğu tespit edilmiştir (Li ve ark., 2007; Murillo-Arbizu ve ark., 2009; Şahin ve ark., 2011).
9
Çizelge 2-1 Elma ürünlerindeki patulin miktarı (Marin ve ark., 2011; Şahin ve ark., 2011)
Elma ürünü Ülke Patulin saptanan/ toplam örnek sayısı Saptanan en düşük düzey (LOD) Aralık (µg/L veya µg/kg) Elma suyu, açık ve kapalı meyve suları ve nektarlar Güney Afrika İsveç Türkiye
Avrupa Birliği Ülkeleri İtalya Japonya İran İtalya İspanya İtalya Brezilya Yunanistan İspanya İspanya Portekiz İran 4/17 5/39 27/45 35/43 3/8 15/76 13/42 16/33 5/17 19/32 4/100 66/66 66/100 30/71 ?/49 150/150 5 2 5 0,67 5 1 15 0,5 0,3 1,57 3 0,23 0,7 2,08 1,2 3 5-45 2-50 19,1-732,8 2,5-38,8 5,8-56,4 1,4-45,6 15-285,3 0,5-53,4 1,5-50,9 1,57-44,89 3-7 0,9-36,8 0,7-110,7 2,08-15,0 1,2-42 6,0-106,0 Organik elma suyu, organik açık ve kapalı meyve suyu İtalya İtalya İtalya Portekiz 6/21 3/7 12/24 ?/19 1,57 5 0,5 1,2 1,57-47,91 30,4-33,2 0,5-69,3 0,5-9,2 Elma püresi İtalya Italya Arjantin İspanya İspanya 2/4 0/4 4/8 6/18 4/77 5 0,5 3,8 0,3 2,08 25,9-16,7 22-221 7,7-28,4 2,08-17,6 Organik elma püresi İtalya İtalya 1/2 7/13 5 0,5 74,2 >0,5 Bebek maması Güney Afrika İtalya İtalya İspanya Portekiz 6/17 0/6 1/11 42/124 ?/70 5 5 0,5 2,08 1,2 5-20 0,7 2,08-9,6 1,2-5,7 Organik bebek maması İtalya İtalya Portekiz 2/4 2/12 ?/70 5 0,5 1,2 13,1-17,7 >0,5 Marmelat Arjantin 6/26 2,8 17-39
Elma şarabı Güney Afrika
Avrupa Birliği 2/8 3/7 5 0,67 5-10 2,8-6,1
Türkiye’de, 1996 yılında üretilen elma sularından alınan 215 numunenin tamamında patulin olduğu ve bunların 117 tanesinde patulin miktarının 50 µg/L’den az iken, 98 tanesinde 50 µg/L’den fazla olduğu tespit edilmiştir. Aynı yılda, üç farklı ticari firmadan alınan örnekler incelendiğinde en yüksek patulin miktarlarının 130, 341 ve
10
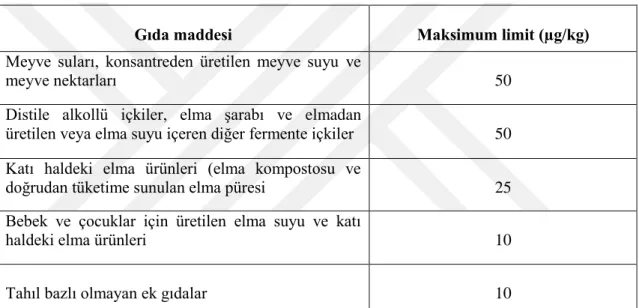
376 µg/L olduğu görülmüştür (Acar ve Gökmen, 1998). O tarihten bu yana gıda maddelerinde patulin saptanması için pek çok çalışma yapılmış ve tüm dünyada olduğu gibi patulin miktarları azaltılarak belli bir seviyenin altında tutulması gerektiğine karar verilmiştir. Dolayısıyla, Türk Gıda Kodeksi tarafından patulin tüketiminin sınırlandırılması amacıyla maksimum patulin miktarını, meyve sularında 50 µg/kg, katı meyve pürelerinde 25 µg/kg, bebekler ve çocuklar için üretilen meyve suları ve pürelerinde ise 10 µg/kg olarak belirlenmiştir (Çizelge 2-2)
Çizelge 2-2 “Türk Gıda Kodeksi Gıda Maddelerindeki Bulaşanların Maksimum Limitleri Hakkında Tebliğ”’nde belirtilen maksimum patulin limitleri (Türk Gıda Kodeksi, Tebliğ No: 2008 / 26, 2008)
Gıda maddesi Maksimum limit (µg/kg)
Meyve suları, konsantreden üretilen meyve suyu ve
meyve nektarları 50
Distile alkollü içkiler, elma şarabı ve elmadan
üretilen veya elma suyu içeren diğer fermente içkiler 50 Katı haldeki elma ürünleri (elma kompostosu ve
doğrudan tüketime sunulan elma püresi 25
Bebek ve çocuklar için üretilen elma suyu ve katı
haldeki elma ürünleri 10
Tahıl bazlı olmayan ek gıdalar 10
2.6. Patulin Tayin Yöntemleri
Toksik bir metabolit olan patulinin gıda maddelerinden uzaklaştırması ve kontrolünün sağlanması için çeşitli tayin yöntemleriyle patulin varlığı ve miktarının tespit edilmesi gerekmektedir. Bunun için kullanılan başlıca yöntemler, yüksek performanslı sıvı kromatografisi (HPLC), ince tabaka kromatografisi (TLC) ve gaz kromatografisi (GC) olarak sıralanabilir.
Patulin suda ve metanol, etanol, aseton, etil asetat gibi çeşitli organik çözücülerde çözünebilen düşük molekül ağırlıklı bir metabolittir. Sıcaklıkla herhangi bir deformasyona uğramaz ve asit ortamlarda stabilken, alkali ortamlarda stabil değildir (Li
11
ve ark., 2017). Yapılan stabilite çalışmalarında patulinin bulunduğu ortamda pH 3,5- 5,5 aralığındayken sıcaklık 125C’ye kadar çıkarıldığında yapısında bozulmalar meydana gelmemektedir (Harrison, 1988). Elektrofilik karakterinden dolayı patulin, nükleofillerle, sistein, glutatyon gibi amino gruplarıyla ve özellikle de sülfhidril gruplarıyla reaksiyona girdiği gösterilmiştir (Rychlik ve ark., 2004).
Yapılan çalışmalar sonucunda piyasadan alınan vişne, kayısı, şeftali, elma sularında ve nektarlarından ince tabaka kromatografisi ile patulin tayini sonucu, patuline rastlanamazken; elma suyu ile sıvı kromatografi yöntemiyle yapılan analizlerde numunelerin %10’unda patulin miktarının 50 µg/L’den fazla olduğu tespit edilmiştir (Acar ve Gökmen, 1998).
Elma suyu, içeriğinde şeker, sorbitol, organik asit, amino asit, fenolik bileşikler, fruktoz, sükroz, glikoz gibi pek çok madde barındıran bir besin ürünüdür (Markowski ve ark., 2015). Bu sebeple, elma suyu içinde bulunan patulini ayırt etmek için kullanılan analitik yöntemlerin patuline karşı çok özgün olması ve analiz öncesi olabildiğince elma suyu içerisindeki madde bileşiminin azaltılması gerekmektedir. Ayrıca, fenolik bileşikler ve 5-hidroksimetilfurfural (5-HMF)’ın, patulin ile benzer kromatografik davranışlar gösterdiği bilindiğinden, kullanılacak analitik tayin yönteminde bu durumun göz önüne alınarak dikkat edilmesi oldukça önem taşımaktadır (Li ve ark., 2017).
Elma püresi, posalı elma suyu ve berrak elma sularında pektin bulunmaktadır. Pektin, bitkilerin hücre duvarında bulunan bir çeşit polisakkarit olup yapısında D-galaktronik asit, D-galaktoz, L-arabinoz gibi çeşitli şekerler bulunmaktadır. Saf haliyle suda çok iyi çözünebilen pektin, jel oluşturma özelliği sayesinde gıda endüstrisinde çok yaygın bir şekilde kullanılmaktadır. Elma posalarında bulunan pektin oranı yaklaşık olarak %12- %15 civarındadır.
Meyve suları içerisinde bulunan pektin, hem meyve suyunun berraklığını olumsuz etkilediğinden hem de patulini absorbe edebileceğinden dolayı, patulin tayininde istenmeyen bir durumdur. Yapılan çalışmalarda, posalı elma sularında bulunan patulinin %20’den fazlasının pektin ile bağlandığını ve bundan dolayı organik çözücülerle patulinin ekstrakte edilemediği belirtilmektedir (Baert ve ark., 2007). Li ve arkadaşları (2017), pektinaz enzimleri, pektin ve nişastayı hidroliz ettiğinden bu olumsuz etkinin
12
giderilmesinde önemli rol oynayabileceğini söylemişlerdir. Pektinaz enzimleri, bitki dokularında kompleks polisakkaritleri, galaktronik asitler gibi basit moleküllere ayırabilmektedir. Pektinaz enzimi uygulaması sadece interferansı ortadan kaldırmaz aynı zamanda, patulinin serbest kalmasını sağlayarak ekstraksiyon verimini de arttırmaktadır. Asidik pektinazların, meyve sularının bulanıklılığını ve acılığını azaltmada oldukça önemli bir role sahip olduğu ve bu amaçla yaygın bir şekilde kullanıldığı bilinmektedir (Kashyap ve ark., 2001).
Şekil 2-3 Pektinin moleküler yapısı (Hamman, 2010)
Enzim uygulamalarının yanısıra patulin tayin yöntemleri öncesinde kullanılacak ekstraksiyon prosedürü, meyve suyu içerisindeki diğer bileşenlerin elimine edilip patulinin serbest halde kalması ve kantitatif analizi için oldukça önem taşımaktadır. Bu amaçla, etil asetat ile yapılan sıvı-sıvı ekstraksiyon (LLE) (Macdonald ve ark., 2000), QuEChERS ekstraksiyon (Marsol-Vall ve ark., 2014), katı faz ekstraksiyonu (SPE) (Zief ve Kakodkar, 1994) en yaygın kullanılan ekstraksiyon yöntemleridir.
Elma suyu ve elma püresinden patulin analizi çalışmalarında etil asetat ile gerçekleştirilen sıvı-sıvı ekstraksiyon ile oldukça verimli sonuçlar elde edilmektedir. Dolayısıyla 2000 yılında Analitik Kimyagerler Derneği (AOAC International) tarafından resmi bir yöntem olarak kabul edilmiştir. Sıvı-sıvı ekstraksiyon, etil asetat ekstraksiyonu, sodyum karbonat (Na2C03) nötrleştirme ve sodyum sülfat (Na2S04)
kurutma olmak üzere başlıca üç aşamadan meydana gelmektedir. Na2C03
nötralizasyonu, elma suyu matrislerindeki fenolik bileşiklerin etkileşimini azaltmak için kullanılır. Na2S04 kurutma ise reaksiyon sırasındaki nemi gidermek için kullanılır.
13
alıcı bir prosedüre sahip olması dışında meyve suyunda patulin tayini için en önemli dezavantajı, patulinin alkali Na2C03 solüsyonunda stabil olmamasıdır. Bu yüzden,
nötralizasyon aşamasının kayıpları önlemek amacıyla mümkün olduğunca çabuk gerçekleştirilmesi gerekmektedir (Yavuz ve Aksoy, 2006; Li ve ark., 2017).
Şekil 2-4 Sıvı sıvı ekstraksiyon (LLE)
QuEChERS ekstraksiyon yöntemi, bir katı faz ekstraksiyonu türüdür ve klasik ekstraksiyon yöntemine dayanmaktadır. Örnekler asetonitril ile ekstrakte edilir, QuEChERS tuzları (sodyum sitrat, sodyum klorür (NaCl) ve Mg2S04 karışımı) ile
ayrıştırılır ve Mg2S04 ve primer sekonder amin sorbenti ile karıştırılmış dispersif SPE
kullanılarak temizlenir.
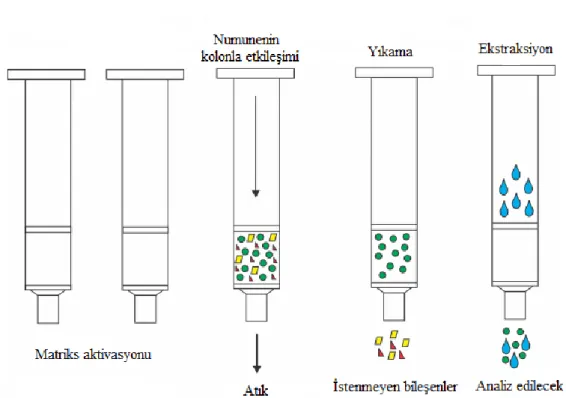
Geleneksel katı faz ekstraksiyonunda (SPE) ise örnek, içerisinde çeşitli dolgu materyalleri bulunan kolonlardan geçirilerek analiz öncesi istenmeyen materyallerden arındırılır. Sıvı örneğin kolondan geçirilebilmesi yerçekimi vasıtasıyla ya da vakum manifoldları yardımıyla gerçekleştirilmektedir. Örnek çözeltinin kolondan geçirilmesi iki farklı yolla meydana gelmektedir. Birinci yöntemde, analizi yapılacak numune kolondan çekirilirken kolon içerisindeki maddeye bağlanırken, çözelti ve istenmeyen bileşikler kolondan yıkanarak uzaklaştırılır. Daha sonra uygun çözeltilerle kolonda tutulan numune çözülerek alınır ve analizi gerçekleştirilir. İkinci yöntemde ise, kolon içerisindeki dolgu materyali ile numune içerisindeki istenmeyen bileşenler etkileşime
14
girerek kolonda tutunur. Analizi yapılacak madde ise kolon dolgu materyali ile hiç etkileşime girmeyeceğinden uygun çözeltiler yardımıyla toplanır. Katı faz ekstraksiyonunda birinci yöntem daha yaygın bir şekilde kullanılmaktadır (Yavuz ve Aksoy, 2006).
Şekil 2-5 Katı faz ekstraksiyonu (SPE) (Abo ve ark., 2016)
2.6.1. Yüksek Performanslı Sıvı Kromatografisi (HPLC)
Patulin tayini amacıyla kullanılan en yaygın saptama yöntemi ultraviyole (UV) ya da fotodiyotlarla (DAD) birleştirilen yüksek performaslı sıvı kromatografisi (HPLC) yöntemidir. Bu yöntem, uygulaması kolay, güvenilir, kantitatif ve ayrıca patulinin karakteristik absorpsiyon spekturumu aracılığıyla ölçüm yaptığından dolayı özgün olması nedeniyle oldukça tercih edilmektedir. Aynı zamanda Analitik Kimyagerler Derneği (AOAC), elma sularında patulin tayini için HPLC-UV yöntemini resmi bir yöntem olarak kabul etmiştir (Resmi metod 995.10).
HPLC, çözücü ile içerisinde analiz edilecek örnek bulunan çözelti arasındaki karakteristik değişikliklerin dedektör yardımıyla ölçülmesi prensibine dayanır. Analiz
15
edilecek örnek sabit bir akış hızıyla enjektör yardımıyla kolona itilir. Kolon, analiz edilecek maddeyi çözeltideki diğer maddelerden ayırmak amacıyla içerisinde silikon boncuklar bulundurur ve paslanmaz çelikten yapılmıştır. Dedektör sayesinde de kolondan geçen malzemeler optik bir sensörle belirlenir ve meydana gelen diyagram monitörde görüntülenmektedir (Şekil 2-6).
HPLC metodu uygulanmadan önceki örnek hazırlama metodunda genellikle sıvı-sıvı ekstraksiyon yöntemi kullanılmaktadır. AOAC metoduna göre HPLC, içinde 12-25 nm arasında değişen gözenek büyüklüğü ve 5 μm partikül çapına sahip dolgu malzemesi ile kaplı ters fazlı C18 kolonu kullanılarak 1 mL/dak izokratik akış hızıyla gerçekleştirilmektedir. Analizi yapılacak örnek, asetonitril, su ve asetik asit içeren mobil faz eşliğinde kolona enjekte edildiğinde elde edilen LOD (level of detail, ayrıntı düzeyi) değeri 5 μg/L’dir. Bu değer diğer analiz yöntemlerine kıyasla oldukça düşüktür (Moake ve ark., 2005 ve Pires ve ark., 2012).
Şekil 2-6 HPLC aşamalarının şematik gösterimi (Töppner ve ark., 2014)
2.6.2. İnce Tabaka Kromatogragisi (TLC)
İnce tabaka kromatografisi, üzeri adsorban bir malzeme ile kaplanmış katı yüzeyden, içerisinde analiz edilecek malzeme bulunan çözeltinin kılcallık etkisiyle yer çekimine ters yönde ilerleyişi ile gerçekleştirilmektedir. Katı yüzey olarak genellikle cam ya da plastik kullanılmaktadır ve seçilen katı yüzeyin üzerine belirli kalınlıkta silika jel ya da
16
alumina ile kaplanarak üzerinde gözenekler bulunan aktif bir yüzey haline getirilir. Yüzey kaplama işleminde kullanılacak olan kaplama malzemesi, kullanılacak mekanizmaya ve analiz edilecek numuneye göre belirlenmektedir. Genellikle asidik karakterli malzemeler için silika jel gibi asidik adsorplayıcılar, bazik karakterli malzemeler için ise alüminyum oksit, talk gibi bazik adsorplayıcılar kullanılmaktadır. İnce tabaka kromatografisinde kullanılan adsorplayıcı malzemenin oldukça çok miktarda malzeme tutabilmesi, katı yüzeye adsorbe olmuş malzemenin uygun çözülerle kolaylıkla alınabilmesi, kullanılan çözücüler ve malzemeler arasında istenmeyen reaksiyonların gerçekleşmemesi, yapısının çözücünün rahatlıkla geçmesi için elverişli olması dikkat edilmesi gereken en önemli hususların başında gelmektedir. İnce tabaka kromatografisi, hem nitel hem de nicel analizlerde kullanılabilmektedir.
İnce tabaka kromatografisi, meyve sularında patulin tayini için uygulama kolaylığı ve düşük maliyet avantajları nedeniyle kullanılan, AOAC tarafından kabul gören tayin yöntemlerinden biridir. 1974 yılında AOAC mikotoksin tayini amacıyla, önce örnek hazırlama prosedürü olarak silika jel kolon kromatografisi ve ardından ince tabaka kromatografisini kullandıklarında saptama sınırı değerini (LOD) 20 μg/L olarak belirlemişlerdir. Daha sonra ters faz ince tabaka kromatografisi de aynı amaçla kullanılmış fakat, çok fazla çözücüyle patulin elüsyonuna rağmen yeterli saptama oranı sağlanamadığında tercih edilmemiştir (Shephard ve Leggott, 2000; Pires ve ark., 2012). 2.6.3. Gaz Kromatografisi (GC)
Gaz kromatografisi, özellikle kimya alanında gazların ve uçucu maddelerin analizinde yaygın olarak kullanılan bir kromatografi türüdür. Biyokimya, biyoteknoloji, petrokimya, farmakoloji, genetik ve gıda alanındaki çalışmalarda da kullanılabilmektedir. Temel olarak, analiz edilecek numunenin buharlaştırılıp kromatografi kolonuna enjekte edildiği ve hareketli gaz fazı ile taşınması prensibine dayanmaktadır. Gaz kromatografisi için sabit faz olarak katı destek maddesi üzerinde emdirilmiş sıvı bulunan bir kolon kullanılır. Hareketli faz olarak ise He (Helyum) veya N2 (Nitrojen) gibi gazlar kullanılmaktadır. Taşıyıcı gazın saflığının yüksek olması
dedektör hassasiyetini de arttırmaktadır. Hem nitel hem de nicel analizlerde kullanılabilmektedir. Az miktarda numune ile güvenilir, hızlı analiz ve yüksek ayrışım sağlayabilmek gibi avantajlarının yanı sıra, kullanımının uçucu maddeler ile sınır
17
olması, termal olarak kararsız bileşikler için uygulanamaması, örneklerin hazırlanmasının nispeten pahalı olabilmesi, örneklerin çözünürlüğünün iyi olmasını gerektirmesi, piklerin doğrulanması için kütle spektrometresi (MS) ya da Fourier dönüşümlü infrared spektrofotometre (FT-IR) gibi ek spektroskopik cihazlar gerektirebilmesi gibi dezavantajları bulunmaktadır.
Patulin, düşük molekül ağırlıklı, polar bir moleküldür ve uçuculuğunun az olması nedeniyle gaz kromatografisi ile analizi sınırlıdır. Aynı zamanda seçiciliğini ve duyarlılığını arttırmak amacıyla kütle spektrometresi ile desteklenmediği takdirde verimli sonuçlar elde edilemediğinden patulin analizi için tercih edilmemektedir (Li ve ark., 2017).
2.7. Patulinden Arındırma Yöntemleri
Patulin, ısıya karşı direnç gösterebilmesi ve suda çözünebilmesi sebebiyle elma sularından patulini arındırma işleminde zorluklar yaşanmaktadır. Elma suyu ve konsantresi üretim proseslerinde patulinden arındırma işlemi için elmaların çürük kısımlarının atılması ve basınçlı sıcak su ile yıkama oldukça yaygın kullanılan yöntemlerdir. Bu yöntemler patulinden arındırmayı sağladığı gibi son ürün kalitesini de olumlu açıdan etkilemektedir. Buna ek olarak, elma suyuna suyuna aktif karbon, askorbik asit, sülhidril bileşikleri veya çeşitli gıda bileşenlerinin eklenmesi (tarçın yağı, potasyum sorbet vb.) eklenmesi, düşük dozda radyasyon uygulaması, modifiye atmosfere maruz bırakılması gibi yöntemler de patulin arındırma işlemlerinde etkili sonuçlar vermektedir (Kadakal ve Nas, 2000).
Pek çok meyve ve sebzenin yanı sıra elma, patulin oluşumu için çok elverişli bir gıdadır. Gıdalardaki küflerin üremesiyle oluşan patulinin difüzyonu değişkenlik göstermektedir. Örneğin elmalarda, patulin sadece küfün meydana geldiği bölge ve çevresinde bulunduğundan, bu kısın atıldığında elmanın geri kalanında patulinin gözlenmediği belirtilmiştir. Bunun sebebinin elmadaki hücreler arasında bulunan gazın patulinin difüzyonuna engel olduğu görüşüyle açıklanmaktadır. Meyve suyu endüstrisi açısından bu durum oldukça önemlidir (Acar ve Gökmen, 1998).
18
2.7.1. Elma Suyu Üretim Prosesi Öncesi Patulinden Arındırma Yöntemleri 2.7.1.1. Fungusitler ve İnsektisitler Kullanılarak Patulinden Arındırma
Meyvelerin fungal bozulmasına karşı birincil kontrol yöntemi fungusit kullanımı olmasına rağmen toksikolojik riskler nedeniyle birçoğu piyasadan kaldırılmıştır (Trias ve ark., 2008). İngiltere’de, çevre kirliliğine neden olduğu ve proses öncesi meyvelerden tam olarak uzaklaştırılamadığı endişesiyle patulin arındırma işlemi için fungusit kullanımına artık izin verilmemektedir. Bu nedenle Penicillum expansum kontaminasyonuna karşı gıda güvenliğini ve kalitesini arttırmak amacıyla yeni proses öncesi arındırma yöntemlerinin varlığına ihtiyaç duyulmaktadır (Hawar ve ark., 2013). Ayrıca fungusit kullanımına bağlı olarak fungal patojenlerde direnç oluşması sebebiyle yeni kimyasal maddelerin geliştirilmesinin oldukça maliyetli olması da alternatif bir yöntem bulunması gerektiğini desteklemektedir (Trias ve ark., 2008).
2.7.1.2. Isıl İşlem Uygulanarak Patulinden Arındırma
Patulinden arındırmak amacıyla elma suları pastörizatörden geçirilerek 85-95°C’ye kadar ısıtılarak pastörize edilir ve daha sonra 20°C’ye soğutularak depolanır. Isıl işlem uygulamasının amacı hem mikroorganizmlardan arındırmak hem de elma suyunun kalitesinin korunabilmesi ve besin değerindeki kayıpların minimum düzeyde tutulmasıdır. Buna rağmen bu uygulamalar gıdalarda, vitaminlerin parçalanması, tat değişiklikleri ve renk bozulmaları gibi olumsuz değişimler meydana getirebilmektedir. Aynı zamanda, meyve sularından patulinin uzaklaştırmak amacıyla ısıl işlem uygulansa da, bu yöntemin tam anlamıyla etkin bir yöntem olmadığı düşünülmektedir. Genel olarak pastörizasyon, ısıl işlem uygulamalarının yetersiz olduğu belirtilmiştir (Scott ve Kennedy, 1973; Acar ve Arsan, 1989; Artık ve ark., 1995; Mutlu ve ark., 1997; Kadakal ve Nas, 2000).
Özçelik (1979), ısıl işlemin patulinden arındırmaya etkisini incelemek amacıyla Erzincan elmalarından üretilmiş olan elma sularını Penicillum expansum (CBS 486,75) ile inkübe etmiş ve bu numuneleri iki gruba ayırmıştır. Birinci grubu kontrol grubu olarak seçmiş ve herhangi bir ısıl işlem uygulamamıştır. İkinci gruba ise 70, 80, 90 ve 100C’de 20 dakika periyotla ısıl işlem uygulamış ve iki grubun patulin miktarlarını değerlendirmiştir. Sonuç olarak, iki grup arasında patulin miktarları bakımından önemli ölçüde bir fark gözlemlenemediğini belirtmiştir.
19
Woller ve Majerus (1982), elma suyuna 1 mg/L patulin eklemiş ve 72-90C’de 5-20 dakika boyunca ısıl işlem uygulaması gerçekleştirdikten sonra patulin miktarını ölçtüklerinde kayda değer bir azalma olmadığını gözlemlemişlerdir.
Wheeler ve ark. (1987) Gürcistan’da üretilen elma sularını incelemişler ve patulin içeriklerinin 244-3993 µg/mL olduğunu bulmuşlardır. Bu pastörize elma sularıyla yaptıkları çalışmada yüksek sıcaklık- kısa zaman (HTST) (60, 70, 80, 90C’de 10 s; 90C’de 20, 40, 80 ve 160 s) ve kesikli pastörizasyon (90C’de 10 dak.) yöntemlerini kullanarak patulinin stabilitesini incelemişlerdir. Çalışma sonucunda, 90C’de 10s (HTST) ısıl işlem uygulamasının patulin miktarında %18,8 azalma sağladığını fakat ısıl işlem uygulama süresinin patulin arındırma işlemi için bir etkisi olmadığını gözlemlemişlerdir. Isıl işlemin, patulinden arındırma için belli bir seviyede etkisinin olduğunu fakat bu etkinin yeterli olmadığı sonucuna varmışlardır (Kadakal ve Nas, 2000).
2.7.1.3. Bakteriler Kullanılarak Patulinden Arındırma
Gıda maddelerinde üretim prosesi öncesi uzun süreli depolama esnasında oluşabilecek toksinlerden arındırmak amacıyla laktik asit bakterileri (LAB) gibi yönlendirilmiş biyokontrol ajanların kullanılması oldukça etkili ve yaygın bir yöntemdir. Laktik asit bakteriler ve kontaminasyona neden olan mikroorganizmalar arasında meydana gelen etkileşim, hidrojen peroksit, etanol ve bakteriyosin üretimine neden olur (Stoyanova ve ark., 2012; Hawar ve ark., 2013). Biyokontrol ajanı olarak kullanılan bakteriler arasında Pantoea suşları (Bonaterra ve ark., 2003; Frances ve ark., 2006), Bacillus suşları (Obagwu ve Korsten, 2003; Lisboa ve ark., 2006), Pseudomonas suşları (Janisiewicz ve Jeffers, 1997; Cabrefiga ve ark., 2007) uygun biyokontrol ajanları olarak tanımlanmaktadır (Andrews ve Harris, 2000; Trias ve ark., 2008).
2008 yılında Trias ve arkadaşlarının yaptıkları çalışmada, taze meyve ve sebzeden izole ettikleri laktik asit bakterilerinin, fitopatojenik, çürümeye neden olan bakteri ve mantarlara karşı biyokontrol ajanı olarak etkinliğini değerlendirmişlerdir. 496 tane LAB suşu kullanan araştırmacılar bu suşların dört tanesinin (TC97, AC318, TM319 ve FF441) kontamine olmuş elmadaki çürük bölgenin çapını %20 oranında azaltırken, Weissella cibaria (TM128) suşunun ise %50 oranında azalttığını gözlemlemişlerdir.
20
Çalışma sonucunda da hasat sonrası çürümeye karşı biyokontrol ajanı olarak laktik asit bakterilerinin kullanılabileceğini belirtmişlerdir (Trias ve ark., 2008).
2.7.1.4. Meyvenin Çürük ya da Kontamine Kısmının Uzaklaştırılması
Elma suyu üretim prosesi öncesinde, elmanın patulin sentezlenmiş bölgesinin uzaklaştırılması durumunda geri kalan kısmının patulin içermediği bilinmektedir. Bunun sebebi, elma dokusundaki hücreler arası boşluğun ve bu boşlukta bulunan gazın patulinin difüzyonuna engel olduğu görüşüyle açıklanmaktadır (Artık ve ark., 1995; Kadakal ve Nas, 2000). Fakat buna rağmen, çok olgunlaşmış meyvelerde hücreler arası boşluklar fazla miktarda su barındırdığından dolayı, patulinin dokular arası difüzyonu mümkün olabilmektedir (Özçelik, 1979).
Patulinin bulunduğu küflü elmalardan meyve suyu üretiminin gerçekleşmesi durumunda patulin meyve suyuna geçmektedir ve ısıl işlem uygunlansa bile tam olarak inaktif edilememektedir. Aynı zamanda meyveler ve meyve suyu konsantreleri, üretim prosesi öncesi depolanırken gerekli önlemler alınmadığı takdirde, patulin sentezi gerçekleşmekte ve suda çözünebilme kabiliyetine sahip olan patulin, küflü kısım uzaklaştırılsa bile üretim sonrası elde edilen üründe bulunabilmektedir (Acar ve Gökmen, 1998).
21
2.7.2. Elma Suyu Üretim Prosesi Sonrası Patulin Arındırma Yöntemleri 2.7.2.1. Askorbik Asit ve Sülfür Dioksit İlavesinin Etkisi
Elma suyu üretim prosesi sonrasında ilave edilen bileşenler, patulin miktarını etkileyebilmektedir. Brackett ve Marth 1979’da yaptıkları çalışmada, askorbik asit ve askorbat karışımına karşı patulinin instabilitesini göstermek amacıyla 25C’de %2 ‘lik hazırladıkları bu karışımdan mikotoksin içeren fosfat tampon çözeltiye eklediklerinde patulinin hızlı bir şekilde kaybolduğunu belirtmişlerdir. Aynı sıcaklıkta, farklı konsantrasyonlarda (0, % 0,15, % 0,5, % 1,0 ve % 3,0) askorbik asit ilave ettiklerinde ise askorbik asit miktarı arttıkça patulin miktarındaki azalmanın da arttığını gözlemlemişlerdir (Brackett ve Marth, 1979). Askorbik aside ek olarak tiamin hidroklorür, piridoksin hidroklorür ve kalsiyum pantotenat gibi B kompleks vitaminlerinin eklenmesi de elma suyundaki patulin seviyesi önemli ölçüde azalttığı belirtilmektedir fakat bu bileşenlerin eklenmesi maliyeti oldukça arttırmaktadır (Yazıcı ve Velioğlu, 2002).
Pohland ve Allen (1970), sulu bir çözelti içerisindeki patuline sülfür dioksit eklediklerinde patulinin kararsız olduğunu ve bu nedenle elma suyu üretim prosesi sonrasında sülfür dioksit ilavesinin bir dekontaminasyon yöntemi olarak kullanılabileceğini söylemişlerdir. 1977 yılında yaptığı çalışmada Burroughs, içerisinde patulin bulunan meyve sularına 200 ppm sülfür dioksit ekledikten sonra 24 ve 48 saat sonra patulin miktarında sırasıyla %12 ve %90 azalma olduğunu kaydetmiştir. Aytaç ve Acar (1994), litre başına 100 mg sülfür dioksit eklediklerinde patulin seviyesinde %42’lik bir azalma olduğunu belirtmişlerdir.
Drusch ve ark. (2007) yaptıkları çalışmada içerisinde patulin bulunan tampon çözeltiye askorbik asit ilave etmişler ve 34 günün sonunda patulin seviyesinin %30 oranında azalttığını gözlemlemişlerdir. Fakat aynı tampon çözeltilere askorbik asit ilavesi yapmadıklarında ise patulin mikarındaki azalmanın %68-71 olduğunu gözlemlemişler ve ışık, sıcaklık, oksijen ve metal iyonlarının varlığı gibi depolama koşullarının patulin stabilitesi üzerinde oldukça etkili olduğunu belirtmişlerdir. Ayrıca, patulin bozunması askorbik asit veya dehidroaskorbik asitlerin oksidasyonu sonucu oluşan serbest radikaller vasıtasıyla gerçekleştiği için, askorbik asidin tamamının oksitlenmiş olması durumunda ortamda askorbik asit bulunamadığından patulin
22
bozunması da meydana gelmemektedir. Bu nedenle araştırmacılar, meyve suyu ambalajlarının üst boşluğunda bulunan düşük oksijen seviyesi sebebiyle askorbik asidin oksitleneceğinden dolayı patulinden arındırma işlemi için etkisiz olacağını askorbik asit ilave edilmiş olmasının etkili bir dekantaminasyon yöntemi olmadığı sonucuna varmışlardır (De Souza Sant’ana ve ark., 2008).
2.7.2.2. Aktif Karbon İlavesinin Etkisi
Meyve suyu ve konsantrelerinden patulinin arındırılması için kullanılan bir diğer yöntem üretim sonrası oluşan ürüne aktif karbon ilavesi gerçekleştirilerek patulin arındırma yöntemidir. Aktif karbon, başta su olmak üzere çeşitli meyve sularında mikrobiyal kontaminasyonu azaltmak ve renk, tat ve koku parametrelerini düzenlemek amacıyla kullanılan bir malzemedir. Aktif karbonlar fizikokimyasal arıtma gerçekleştiren malzemelerdir. Aktifleştirme işlemi sayesinde yüzey alanı 100 kat artan karbon mineralleri adsorpsiyon yoluyla istenmeyen organik maddeleri tutarak arındırma işlemi gerçekleştirir. Granül aktif karbon (Granular Activated Carbon, GAC) ve toz aktif karbon (Powdered Activated Carbon, PAC) olmak üzere yaygın olarak kullanılan iki çeşidi mevcuttur. Aktif karbon, hindistan cevizi kabuğu, fındık kabuğu, pirinç kabuğu, kömür, odun ve yağ gibi ürünlerden elde edilen karbon minerallerinin aktifleştirilmesiyle oluşumaktadır.
Aktif karbon kullanımının en önemli dezavantajlarından biri, adsorbe ettiği organik malzemeler nedeniyle bakteri üremesine çok elverişli bir ortam hazırlamasıdır. Proses sonrası arındırma işlemleri için kullanılan aktif karbonların 6- 12 ayda bir değiştirilmesi gerekmektedir.
Leggott ve ark. (2001), üç çeşit aktif karbon (NORIT SA 4, NORIT SX 4, NORIT CA 1) kullanarak yaptıkları çalışmada, farklı Briks değeri ve sıcaklıklardaki elma sularında bulunan patulinin arındırma işlemini gerçekleştirmişlerdir. 1 g/L uygulanan NORIT SA 4, NORIT SX 4 karbonun, 55C’de 12 Briks derecesinde elma sularında %70- %80 verimle patulini arındırırken, NORIT CA 1 karbonu %45 oranında patulinden arındırma yapmıştır. Briks derecesi 20 iken arındırma verimleri %45 civarındadır. Araştırmacılar, Briks derecesinin patulin arındırma işleminde önemli bir faktör olduğunu ve yüksek karbon miktarının yüksek Briks derecesi ile arındırma işleminde daha verimli sonuçlar ortaya koyduğunu belirtmişlerdir.
23
Sands ve ark. (1976), aktif karbonun patulin arındırmaya etkisini araştırmak için elma sularına önce 30 µg/mL patulin ilave ettikten sonra 20 µg/mL aktif karbon ilave ederek patulin miktarındaki değişimi incelemişler ve patulinin tamamının arındırıldığını belirtmişlerdir. Aktif karbon miktarını 5 µg/mL olarak değiştirdiklerinde ise patulinin % 91,36 verimle temizlendiğini kaydetmişlerdir. Araştırmacılar daha sonra yine aynı miktarda patulin ilave edilen elma sularını aktif karbon ile hazırlanmış kolondan geçirmişler ve patulinin neredeyse tamamının temizlendiğini belirtmişlerdir.
24 3. MATERYAL ve METOT
3.1. Çalışmada Kullanılan Materyaller
Sülfidril kaplı manyetik küreler Bioclone Inc. (Kaliforniya, ABD) firmasından temin edildi. Patulin %98 saflıkta, toz halde Sigma-Aldrich (St Louis, MO, ABD) firmasından temin edildi. Kürelerin hazırlanması, elma suyundan patulin ekstraksiyonu ve HPLC analizlerinde kullanılan dithiothreitol (DTT), etil asetat, sodium karbonat, asetik asit, asetonitril ve tampon çözelti hazırlanmasında kullanılan tuzlar (NaCl, KCl, Na2HPO4,
KH2PO4) yine Sigma-Aldrich (St Louis, MO, ABD) firmasından temin edildi.
Çalışmada kullanılan elma suyu örnekleri Karaman marketlerinden temin edilen %99,5 elma suyu konsantresinden üretilmiş organik elma suyu (11,35 °Bx) örnekleridir.
3.2. Manyetik Kürelerin Hazırlanması 3.2.1 Yüzey gruplarının karakterizasyonu
Yüzeyinde sulfidril grupları bulunan silika kaplı demir oksit (Fe3O4) süperparamanyetik
küreler ile yüzeyi kaplı olmayan Fe3O4 küreler farklı tekniklerle analiz edildi. Manyetik
kürelerin kristal özelliği, fazların miktarları, atom pozisyonları ve yüzey kaplama işlemi sonucu yapısal değişimlerini incelemek için X- ışını difraktometresi (XRD) (Bruker D8 DAVINCI) kullanıldı. Yüzeyi kaplı ve kapsız manyetik kürelere ait difratogramlar 2θ =10-80° aralığında 40 mA akım altında Cu-Kα radyasyonu (λ=1.5406 Å) kullanılarak analiz edildi.
Ayrıca, manyetik kürelerin yüzeyindeki fonksiyonel grupların analizi için kızılötesi spektroskopisi (FTIR) (Bruker Vertex 70 FTIR) kullanıldı. Atomlar arasındaki bağların titreşimiyle oluşan frekanslara karşılık gelen absorbans pikleri 4000–400 cm−1 arasında ölçüldü.
25 3.2.2 Yüzey gruplarının indirgenmesi
Çalışmada kullanılan manyetik küreler yüzeyleri sülfidril (-SS) grup kaplı, 1µm çapında, silika kaplı Fe3O4 süperparamanyetik kürelerdir. Bu küreler ana stok
konsantrasyonu 30 mg/mL olacak şekilde 5 mL 0,01 M PBS (phosphate buffered saline) içinde çözüldükten sonra +4C’de muhafaza edildi. Her deney öncesi tampon çözelti içerisindeki küreler homojen dağılım gösterene kadar karıştırıldı. Manyetik kürelerin yüzeyinde bulunan sülfidril gruplarının tiyol (–SH) gruplarına indirgenme işlemi gerçekleştirildi. Bunun için öncelikle manyetik küreler 500 µL 0,01 M PBS ile yıkandı, sonrasında 500 µL 3 mg/mL DTT ile 25°C’de 15 dakika manyetik karıştırıcıda inkübasyona bırakıldı. İnkübasyon sonrası deney tüpleri manyetik standa yerleştirildi ve 5 dakika beklendikten sonra sıvı kısım atıldı. Bu işlemden sonra küreler 0,01 M PBS ile iki kere yıkandı.
3.3. Patulin Standart Çözeltilerinin Hazırlanması
Patulin çözeltisinin hazırlanması için öncelikle tampon çözelti hazırlandı. 0,1 M fosfat tampon çözeltisi (ğPBS) için 40 g NaCl, 1 g KCl, 7,2 g Na2HPO4 ve 1,2 g KH2PO4
tartılıp toplam hacim 500 mL olacak şekilde distile suda çözüldü. Çözeltilerin pH’ı 7,4’e ayarlandıktan sonra 0,45 µm’lik filtreden geçirilip otoklavlandı. Tampon çözelti ile yapılan tüm deneylerde hazırlanan 0,1 PBS çözeltisi, 0,01’e seyreltilerek kullanıldı.
Stok patulin çözelti 5 mg/mL konsantrasyonda olacak şekilde 0,01 M fosfat tampon çözeltisi (pH 7,4) kullanılarak hazırlandı. Hazırlanan stok çözelti tampon çözelti kullanılarak seyretildi ve 1 mg/mL, 50 µg/mL ve 10 µg/mL konsantrasyonlarında olacak şekilde patulin ara standart çözeltiler hazırlandı. Hazırlanan çözeltiler -20C’de saklandı.
3.4. Patulin Standart Çözeltilerinin Spektrofotometre Analizi
Farklı konsantrasyonlarda 0,01 M PBS içerisinde hazırlanan patulin çözeltilerinin UV-Vis spektrofotometre (Shimadzu UV-1800) ile 200-400 nm dalga boyu aralığında ölçümü yapıldı. Ölçüm sonucunda en yüksek absorbans değeri elde edilen dalga boyu sonraki deneylerde ölçüm yapmak için kullanıldı.
26 3.5. HPLC Analizi
HPLC analizleri, Agilent Technologies 1260 Infinity HPLC kullanılarak yapıldı. Analizlerde, 150 mm x 4,6 mm çapında, 5 µm partikül boyunda C18 kolonu kullanıldı. Analiz koşulları akış hızı 1 ml/dak ve sıcaklık 25C olacak şekilde ayarlandı. Enjeksiyon hacmi 20 µl olup DAD dedektör ile 276 nm’de 3 enjeksiyon olacak şekilde analiz gerçekleştirildi. Mobil faz olarak %0,1 asetik asit içeren asetonitril:su (10:90) kullanıldı. Bunun için her 5 litrelik mobil faza 2,25 mL asetik asit, 2247,5 mL dH2O ve
250 ml HPLC gradiyent asetonitril eklenerek hazırlandı. Mobil faz içerisindeki malzemeler uçucu olduğundan 5 litrelik şişeler hazırlanıp kullanıldıktan sonra tekrar hazırlanıp bekletilmeden tüketildi.
Patuline ait kalibrasyon eğrisinin oluşturulması için farklı konsantrasyonlarda patulin çözeltileri hazırlanarak yukarıda belirtilen HPLC koşullarında analizler gerçekleştirildi. Cihaza yüklemeden önce tüm örnekler 0,45 µm filtreden geçirilerek HPLC viallerine aktarıldı. Her standart çözelti için üç tekrarlı okumalar yapılmış ortalaması alınarak patuline ait kalibrasyon eğrisi oluşturuldu. Sonuçlar ortalama ± standart sapma olarak verildi.
3.6. Manyetik Küreler ile Patulin Temizleme İşlemine ait Optimizasyon Çalışmaları
Manyetik kürelerin adsorpsiyon kapasitesini değerlendirmek ve en uygun koşulları bulmak amacıyla optimizasyon çalışmaları gerçekleştirildi. Adsorpsiyon öncesi ve sonrası patulin çözeltileri HPLC ile analiz edildi, kalibrasyon eğrisi kullanılarak patulin miktarları hesaplandı. Bu verilerle aşağıda belirtilen denklemler kullanılarak manyetik kürelerin adsorpsiyon kapasitesi (q, µg/mg) ve patulin temizleme verimi (%) hesaplandı.
Manyetik kürelerin adsorpsiyon kapasitesi (q);