T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ PATOLOJİ ANABİLİM DALI Prof. Dr. Mine HEKİMGİL
MEME KARSİNOMU OLGULARINDA
HER2/NEU DURUMUNUN BELİRLENMESİNDE KULLANILAN İMMUNOHİSTOKİMYA VE İN SİTU HİBRİDİZASYON
YÖNTEMLERİNİN
[FLUORESAN İN SİTU HİBRİDİZASYON (FISH) VE SILVER ENHANCED İN SİTU HİBRİDİZASYON (SISH)]
GÜVENİLİRLİĞİNİN KARŞILAŞTIRILMASI
UZMANLIK TEZİ Tez Danışmanı
Prof. Dr. Necmettin ÖZDEMİR
Dr. Burçin PEHLİVANOĞLU İZMİR 2014
T.C.
EGE ÜNİVERSİTESİ TIP FAKÜLTESİ
TIBBİ PATOLOJİ ANABİLİM DALI Prof. Dr. Mine HEKİMGİL
MEME KARSİNOMU OLGULARINDA
HER2/NEU DURUMUNUN BELİRLENMESİNDE KULLANILAN İMMUNOHİSTOKİMYA VE İN SİTU HİBRİDİZASYON
YÖNTEMLERİNİN
[FLUORESAN İN SİTU HİBRİDİZASYON (FISH) VE SILVER ENHANCED İN SİTU HİBRİDİZASYON (SISH)]
GÜVENİLİRLİĞİNİN KARŞILAŞTIRILMASI
UZMANLIK TEZİ Tez Danışmanı
Prof. Dr. Necmettin ÖZDEMİR
Dr. Burçin PEHLİVANOĞLU İZMİR 2014
i Önsöz
Başta anabilim dalı başkanımız Prof. Dr. Mine Hekimgil, pratik yaklaşımları ve engin deneyimiyle bana yol gösteren, desteğini daima hissettiren danışman hocam Prof. Dr. Necmettin Özdemir olmak üzere, öğrencilik yıllarımdan beri tanıdığım tüm “büyük hocalarıma” ve asistanlık döneminin başlamasıyla tanıdığım, “abla” ve “abi” olarak benimsediğim genç hocalarıma bana öğrettikleri her şey için teşekkür ederim.
Hekimlik mesleğine adım attığım bu fakülteden uzman olmanın sevincini ve hüznünü bir arada yaşarken, son dört yılda acısıyla tatlısıyla “gerçek hayat”ı birlikte deneyimlediğim tüm asistan arkadaşlarıma, birlikte çalışmaktan ve tanımaktan mutluluk duyduğum Ege Patoloji ailesinin tüm kıymetli çalışanlarına, tez dönemimde emeği geçen herkese, istatistiksel hesapların içinde kaybolmamı engelleyen Yard. Doç. Dr. Timur Köse’ye teşekkür ederim.
Birlikte sayısız mutlu anı paylaştığım ve mutsuz anlarımda da daima yanımda olan aileme, benim için aileden olan tüm dostlarıma ve elbette, “Can dostum”, “Yol arkadaşım” Dr. Biray Ertürk’e hayatımda olduğu için teşekkür ederim.
Dr. Burçin Pehlivanoğlu
ii İÇİNDEKİLER Sayfa ÖNSÖZ i KISALTMALAR iv ŞEKİL DİZİNİ vi TABLO DİZİNİ vi RESİM DİZİNİ vii ÖZET viii ABSTRACT ix 1. GİRİŞ 1 2. GENEL BİLGİLER 5
2.1. Memenin Gelişimi ve Anatomisi 5
2.2. Meme Kanseri Epidemiyolojisi 9
2.3. Meme Kanseri Etiyolojisi 10
2.4. Klinik Özellikler 12
2.5. Meme Kanserinde Erken Tanı ve Tarama Yöntemleri 13
2.6. Görüntüleme Yöntemleri 14
2.7. Evreleme 15
2.8. Meme Kanserinde Moleküler Sınıflama 18
2.9. Meme Kanserinde Prognostik Faktörler 20
2.9.1. Aksiller Lenf Nodu Tutulumu 20
2.9.2. Tümör Boyutu 22
2.9.3. Tümör Derecesi 22
2.9.4. Histolojik Tip 23
2.9.5. Lenfovasküler İnvazyon (LVİ) 2.9.6. Östrojen ve progesteron reseptörleri (ER ve PR) 24
2.9.7. P53 25
2.9.8. Proliferasyon İndeksi 25
2.9.9. HER2 25
3. GEREÇ-YÖNTEM 31
3.1. Olgu Seçim Kriterleri 31
3.2. Etik Kurul Onayı 31
3.3. Klinik Verilerin Toplanması 31
3.4. Histopatolojik İnceleme 32
3.4.1. Histolojik Tip ve Derece 32
3.4.2. Diğer histopatolojik Değerlendirme Ölçütleri 32
3.4.2.1.İmmünohistokimyasal İnceleme 32
3.4.2.2.İmmünohistokimyasal Boyama Yöntemi 32
3.4.2.3.İmmünohistokimyasal İncelemede Değerlendirme Ölçütleri 33
3.4.2.4.FISH Boyama Yöntemi 33
3.4.2.5.FISH Değerlendirme Ölçütleri 35
iii
3.4.2.7.SISH Değerlendirme Ölçütleri 36
3.5. İstatistiksel Analiz 36
4. BULGULAR 37
5. TARTIŞMA 51
6. SONUÇLAR 57
iv KISALTMALAR
AJCC: Amerikan Kanser Komitesi (American Joint Committee on Cancer) ALNM: Aksiller lenf nodu metastazı
AR: Androjen reseptörü
ASCO/CAP: Amerikan Klinik Onkoloji Derneği ve Amerikan Patologlar Derneği (American Society of Clinical Oncology and College of American Pathologists)
BI-RADS: Meme görüntüleme, raporlama ve veri sistemi (Breast Imaging-Reporting and Data System)
BRCA1: Breast cancer 1, early onset geni BRCA2: Breast cancer 2, early onset geni CISH: Kromojenik in situ hibridizasyon DKİS: Duktal karsinoma in situ
DSÖ: Dünya Sağlık Örgütü
EGFR: Epidermal büyüme faktörü reseptörü ER: Östrojen reseptörü
FISH: Fluoresan in situ hibridizasyon HD: Histolojik derece
HE: Hematoksilen-eozin
HER2: İnsan epidermal büyüme faktörü reseptörü 2 (Human epidermal growth factor receptor 2)
HRT: Hormon replasman tedavisi
İDK, NOS: İnvaziv duktal karsinom, başka türlü sınıflandırılamayan İHK: İmmunohistokimya
v
KETEM: Kanser Erken Teşhis, Tarama ve Eğitim Merkezleri LN: Lenf nodu
LVİ: Lenfovasküler invazyon
MBRD: Modifiye Bloom Richardson derecesi MMG: Mamografi
OKS: Oral kontraseptifler PNİ: Perinöral invazyon PR: Progesteron reseptörü
SISH: Silver enhanced (gümüşlemeli) in situ hibridizasyon SLN: Sentinel lenf nodu
SLNB: Sentinel lenf nodu biyopsisi TDLU: Terminal duktal lobüler ünite USG: Ultrasonografi
vi Şekil Dizini
Şekil 1. Memenin anatomik yapısı………..5
Şekil 2. Daha önce doğum yapmamış ve doğum yapmış kadınlarda meme lobül tipleri ve bu tipler arasındaki döngü………7
Şekil 3. TDLU’nun yapısı………...8
Şekil 4. TDLU’yu oluşturan yapıların şematik görünümü ve bu yapıların histolojik karşılığı………9
Şekil 5. Meme kanserinde en sık karşılaşılan belirtiler……….13
Şekil 6. HER2 proteininin yapısı………...26
Şekil 7. Olguların cinsiyete göre dağılımı……….37
Şekil 8. Olguların yaş dağılımı………..38
Şekil 9. Serimizde izlenen tümör tipleri ve bu tiplerin grup içindeki dağılımları……….42
Tablo Dizini Tablo 1. Meme tümörleri için TNM sınıflaması………...16-17 Tablo 2. Meme kanserinde evreleme……….17
Tablo 3. Meme kanserinde moleküler sınıflama………....20
Tablo 4. Modifiye Bloom Richardson Derecesi (MBRD) değerlendirilirken dikkate alınan parametreler ve puanlama şeması. ……….23
Tablo 5. ASCO/CAP kriterlerine göre İHK incelemede HER2 skorlaması……28
Tablo 6. Olguların başvuru yakınmaları……….39
Tablo 7. Olguların demografik verileri………..40
Tablo 8. Kadranlara göre tümör görülme sıklıkları………41
Tablo 9. Olgulara göre ER ve PR pozitifliği dağılımı……….43
vii Resim Dizini
Resim 1. SISH ile amplifikasyon saptanmayan bir olgu (Olgu 18). Tümör hücrelerinin HE’de genel görünümü ve meme epitel hücrelerinde ve neoplastik
hücrelerde HER2 gen kopyaları (siyah sinyal) ve Kromozom 17 kopyaları
(kırmızı sinyal)………..44
Resim 2. SISH ile amplifiye, FISH ile non-amplifiye
saptanan olgu (Olgu 4) ……….45
Resim 3. Olgu 8; tümör hücrelerinin genel görünümü ve dual SISH ile HER2
amplifikasyonu………..46
Resim 4. Olgu 14; tümör hücrelerinin genel görünümü, İHK ile HER2 (2+)’liği
ve dual SISH ile HER2 amplifikasyonu………47
Resim 5. Olgu 33; tümör hücrelerinin genel görünümü ve dual SISH ile düşük düzeyde HER2 amplifikasyonu……….48
Resim 6: Olgu 28; tümör hücrelerinin genel görünümü ve dual SISH ile HER2
viii ÖZET
HER2 amplifikasyonu invaziv meme karsinomlarının %15 ila %25’inde gösterilmiş olup immunohistokimyasal olarak ve in situ hibridizasyon yöntemleriyle değerlendirilebilir. Bu çalışmada, immünohistokimyasal olarak HER2 (2+) saptanmış meme karsinomlarında dual SISH’in FISH ile uyumu karşılaştırılmış ve günlük pratikte dual SISH yönteminin uygulanabilirliği değerlendirilmiştir.
Ocak 2009 ile Şubat 2013 tarihleri arasında merkezimizde tanı almış ve FISH uygulanmış 60 ardışık HER2 (2+) tümör rezeksiyon materyali çalışmaya alınmıştır. Demografik, histolojik ve immunohistokimyasal özellikler ile FISH sonuçları hasta dosyalarından toplanarak kaydedilmiş ve bu bulgular dual SISH sonuçları ile karşılaştırılmıştır.
Rezeksiyon materyallerinden 9’u (%15) değerlendirilebilir SISH sinyali elde edilemediği için istatistiksel analiz dışında bırakılmıştır. HER2 boyanma yüzdeleri %20-80 arasında değişkenlik göstermektedir. HER2 amplifikasyonu FISH ve SISH yöntemleriyle, sırasıyla, 7 (%13,7) ve 8 (%15,7) olguda saptanmıştır. FISH ve SISH yöntemleri arasında çok iyi uyum izlenmiştir (kappa değeri 0,92). HER2 boyanma yüzdesi ile FISH pozitifliği arasında anlamlı korelasyon izlenirken, HER2 yüzdesi ile SISH pozitifliği arasında anlamlı ilişki saptanmamıştır (p=0,012’ye karşı p= 0,069).
Bulgularımız literatürle uyumlu olup HER2 durumunun belirlenmesinde dual SISH’in kullanılabileceğini göstermektedir. Ancak preanalitik ve analitik sorunların değerlendirilebilir sinyal elde edilmesini engellediği durumlarda sonuçları yorumlamak mümkün olmayabilir. Bu nedenle bulgularımız, standardizasyon ve kalite kontrol programlarının önemini bir kez daha vurgulamaktadır.
ix
ABSTRACT
HER2 amplification has been demonstrated in 15-25% of invasive breast carcinomas and can be assessed using immunohistochemical and in situ hybridization methods. Here, we compared the accuracy of dual SISH to FISH in HER2 (2+) breast carcinoma and evaluated the feasibility of dual SISH method in routine practice.
Sixty HER2 (2+) consecutive tumor samples diagnosed between January 2009 and February 2013 were selected. Demographic, histological and immunohistochemical features and FISH results were recruited from patient records and compared to dual SISH results.
Nine (15%) of the 60 tumor samples were excluded from statistical analysis due to lack of interpretable SISH signals. HER2 staining percentages differed between 20-80%. HER2 amplification was shown in 7 (13,7%) and 8 (15,7%) patients by FISH and SISH, respectively. Very good agreement was observed between FISH and SISH methods (kappa value: 0,92). Significant correlation was found between HER2 staining percentage and FISH positivity, in contrast to SISH positivity (p=0,012 vs. p= 0,069).
Our results are consistent with previously reported literature, indicating SISH can be used to determine HER2 status. However, preanalytical and analytical problems may cause inadequate or uncountable signals, making interpretation impossible for the pathologist and highlighting the importance of standardization and quality control programs.
1
1. Giriş
Meme kanseri, genellikle duktuslardan (süt kanallarından) ya da lobüler adacıklardan köken alan ve metastaz yapma eğilimi yüksek tümör hücrelerinin oluşturduğu bir kanser tipidir. Tüm dünyada kadınlarda en sık görülen kanserdir ve görülme sıklığı giderek artmaktadır (1).
Dünya Sağlık Örgütü (DSÖ) verilerine göre, meme kanseri yeni tanı alan kanserlerin %23’ünü oluşturmaktadır (1). Meme kanserli hastalarda tüm evrelere göre 5 yıllık sağ kalım oranı, gelişmiş ülkelerde %83 iken, gelişmekte olan ülkelerde %53 olarak bildirilmekte olup aradaki bu önemli fark, gelişmiş ülkelerde tarama programları sayesinde erken tanı oranının daha yüksek olması ve daha iyi tedavi olanaklarına atfedilmektedir (2). Kanserle Savaş Dairesi Başkanlığı Türkiye’de 2008 yılı meme kanseri insidansını 41,6/100.000 olarak bildirmiştir (3).
Meme kanseri gelişiminde pek çok risk faktörü mevcuttur. Çeşitli gen mutasyonları, ailede meme kanseri öyküsü gibi bazı faktörler meme kanserine yatkınlığı arttırmaktadır, bununla birlikte; vakaların çoğunda kanser gelişiminde birden fazla faktör rol oynamaktadır. Olguların %70’i memede kitle yakınması ile başvurur.
Tümör boyutu, tümör derecesi, lenfovasküler ve perinöral invazyon (LVİ ve PNİ) ve aksiller lenf nodu metastazı (ALNM) konvansiyonel morfolojik yöntemle değerlendirilebilen prognostik faktörlerdir. Bunların yanı sıra farklı boyama teknikleriyle değerlendirilebilen östrojen ve progesteron reseptörleri (ER ve PR), Ki67 (MIB 1) ile değerlendirilen proliferatif aktivite, p53 pozitifliği ve insan epidermal büyüme faktörü reseptörü 2 (“Human epidermal growth factor receptor 2”, HER2) durumu da prognostik faktörler olarak kabul edilmektedir. ER ve PR pozitif olgular hormonal tedaviye daha iyi yanıt vermekte; bu da prognozu olumlu etkilemektedir (4). P53 bir tümör supresör gen olup mutasyonu nedeniyle pek çok kanser gelişebilmektedir. Meme karsinomlarında P53 pozitifliği bazal tip meme karsinomu gibi kötü prognozlu
2
tipler ile ilişkilendirilmektedir (5). Bununla birlikte; prognostik değeri tartışmalıdır. Ki67 tümörün mitotik aktivitesi hakkında fikir vermekte, proliferasyon aktivitesini göstermek için kullanılmaktadır. Erken evre meme kanserinde önemli bir prognostik parametre olarak kabul edilmektedir (6). ER, PR, P53 ve Ki67 rutin uygulamada immunohistokimya (İHK) yöntemiyle değerlendirilir.
HER2, 17q12’de yerleşmiş ERBB2 geni tarafından kodlanır. Epidermal büyüme faktörü reseptörüne (EGFR) benzer yapısal özellik göstermekte olup tirozin kinaz aktivitesine sahiptir ve reseptörleri hücre membranında yerleşmiştir. HER2 normal hücre gelişim ve proliferasyonunda görevlidir ve pek çok epitel hücresinde düşük düzeyde eksprese edilir. İntraduktal karsinomların (duktal karsinoma in situ, DKİS) %20-40’ında; invaziv meme kanserlerinin yaklaşık %20’sinde aşırı ekspresyonu gösterilmiştir (7-10). HER2 protein aşırı ekspresyonu olguların %90’ında gen amplifikasyonu nedeniyle olurken (11), daha az sıklıkla, kromozom 17 polizomisine bağlı gelişebilir. HER2’nin prognozla ilişkisi pek çok çalışmaya konu olmuştur (12-16). Ayrıca, kemoterapi rejimlerine ya da endokrin tedavilere direnci öngörmede kullanılabileceği iddia edilmiştir (17,18).
HER2 reseptörünü hedef alan transtuzumab adlı monoklonal antikorun geliştirilmesi ve tedavide kullanılmaya başlanması ile HER2 durumunun belirlenmesi ayrı bir önem kazanmıştır. HER2 protein aşırı ekspresyonu İHK ya da moleküler yöntemle ortaya konabilir. İHK sonuç değerlendirmesi Amerikan Klinik Onkoloji Derneği ve Amerikan Patologlar Derneği (“American Society of Clinical Oncology and College of American Pathologists”; ASCO/CAP) önerileri doğrultusunda membranöz boyanma skorlanarak yapılmaktadır (19). Bu skorlamada olgular 0, 1(+), 2(+) ve 3(+) olarak puanlanmaktadır. (3+) olarak skorlanan olgular monoklonal antikor tedavisi almaktadır. (2+) olarak raporlanan olguların bir kısmı yanlış pozitif olduğundan bu olgularda yine ASCO/CAP önerileri doğrultusunda fluoresan in situ hibridizasyon (FISH) yöntemiyle amplifikasyon değerlendirilerek doğrulama testi yapılmaktadır.
3
Bununla birlikte; literatürde, HER2 amplifikasyonunun kromojenik in situ hibridizasyon (CISH) ve “silver enhanced” (gümüşlemeli) in situ hibridizasyon (SISH) ile değerlendirildiği çalışmalar mevcuttur. Mevcut prosedür (İHK+FISH) ile CISH’in karşılaştırıldığı çalışmalarda yöntemler arasında %90’ın üstünde korelasyon olduğu bildirilmiştir (20-22). SISH, diğer iki hibridizasyon yönteminden daha sonra geliştirilmekle birlikte yapılan çalışmalarda SISH ve FISH sonuçları karşılaştırılmış ve konkordans oranları %97, %96 ve %87 olarak bildirilmiştir (23-25).
Arnould ve arkadaşlarının yaptığı (26), 260 meme tümörünün incelendiği çok merkezli bir çalışmada, SISH ve CISH yöntemlerinin FISH ile konkordansı sırasıyla 0,96 ve 0,94 olarak saptanmıştır. Yazarlar, FISH yapılamadığı durumlarda SISH ve CISH’in HER2 durumunun belirlenmesinde ve İHK sonuçlarının doğrulanmasında alternatif yöntem olarak önerilebileceği sonucuna varmışlardır.
FISH, CISH ve SISH HER2 amplifikasyonunun saptanmasında kullanılan duyarlı yöntemlerdir. Her üç yöntem de formalin tespiti yapılmış parafin bloklara gömülmüş materyalde çalışılabilir. CISH ve SISH yöntemleri, FISH ile kıyaslandığında, konvansiyonel mikroskopi ile kolayca değerlendirilebilen, otomatik cihazlar yardımıyla yapılışı daha kolay olan yöntemlerdir. Preparatlar, İHK preparatlarına benzer şekilde, uzun süre muhafaza edilebilir ve arşivlenebilir. Materyalin histopatolojik özellikleri eş zamanlı olarak değerlendirilebilir. Ayrıca, SISH ile dual-prob kullanılarak polizomi 17'nin de yakalanabileceği belirtilmektedir. Ancak bu iki yöntem konusunda deneyimin az olduğu da bir gerçektir. FISH teknolojisi ise daha pahalıdır, değerlendirme için fluoresan mikroskopi gereklidir ve preparatlar zamanla solacağından dijital fotoğraflama yapmak gerekmektedir, bununla birlikte; zahmetli olsa da dijital fotoğraflama ile arşiv oluşturmak mümkündür. Ayrıca, yöntemi uygulayan kişinin deneyimine bağlı olarak invaziv tümör alanlarını saptamak zor olabilir.
Bu çalışmada, merkezimizde meme karsinomu tanısı almış, HER2 (c-erbB-2) durumu (2+) olarak raporlanarak bu nedenle FISH uygulanmış 59 hastaya ait toplam 60 meme tümöründe HER2 (c-erbB-2) onkogen amplifikasyonunu ve
4
protein ekspresyonunu saptamak için kullanılan bir İHK kiti ve iki ayrı in situ hibridizasyon tekniği sonuçlarının karşılaştırmalı olarak yorumlanması amaçlanmaktadır. Hasta yararı ve patoloji rapor standardizasyonu için, halen kullanımımızda olan İHK kitinin, altın standart FISH ve kullanımı daha pratik olan SISH yöntemleriyle güvenilirlik ve maliyet-etkinlik açısından karşılaştırılabileceği, elde edilen sonuçlara göre ülkemizde kullanılabilecek doğru seçeneğin öngörülebileceği düşünülmektedir.
5 2. Genel Bilgiler
2.1. Memenin Gelişimi ve Anatomisi
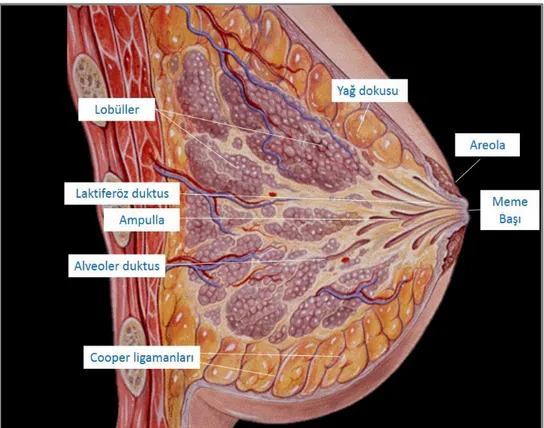
Meme dokusu, lobülleri oluşturan ektodermal kökenli meme bezleri ile bu bezlerin etrafını saran bağ doku ve damardan zengin stromayı oluşturan mezenkimal dokudan meydana gelir. Erişkinlerde 2. ve 7. kostalar arasında olup tubüloalveoler tipte glandüler yapılar barındıran 15 ila 20 lobdan oluşmaktadır. Fibröz bağ dokusu lobları birbirine bağlar. Dermisle yüzeyel fasyanın derin tabakası arasında memenin iskeletini oluşturan fibröz bantlar uzanır (Cooper ligamanı) (Şekil 1). Her lob 20-40 lobüle ayrılır. Lobüllerin arasında çok miktarda yağ dokusu yer alır (Resim 1).
6
Resim 1: Normal meme dokusunda yağ doku ve fibröz doku ile birbirinden ayrılan tubülolobüler adacıklar (HE, x100).
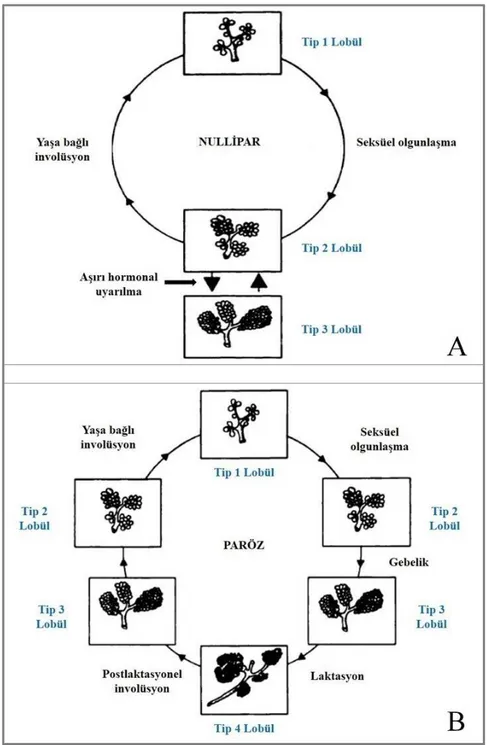
Memenin olgunlaşma süreci dış görünüş bakımından Tanner evrelemesine göre beş faza ayrılmaktadır. Evre 1 prepubertal dönemi, evre 2,3 ve 4 puberte dönemindeki değişiklikleri ve evre 5 erişkin memesini temsil eder (28). Meme dokusunda gelişim tamamlandıktan sonra bile farklılaşma devam etmektedir. Doğumda 10 ila 12 duktus yapısı barındıran meme dokusunda puberte başlangıcı ile hormonal uyarının etkisi sonucu duktusların dallanması, gelişimi ve lobül oluşumu hız kazanır. Pubertede duktusların dallanması ve büyümesi ile terminal uç tomurcukları oluşturulur. Terminal uç tomurcukları alveoler tomurcuklara, alveoler tomurcuklar ise daha küçük ve çok sayıdaki duktüllere dönüşürler. Menstrüel siklusun farklı zamanlarında değişen östrojen ve progesteron etkisi nedeniyle lobül yapıları farklı morfolojiler sergileyebilirler. Temel olarak memede dört tip lobül yapısından bahsedilmektedir (29): Tip 1 lobülde alveoler tomurcukların sayısı 11 civarında iken bu sayı tip 2 lobülde yaklaşık 47’ye, tip
7
3 lobülde yaklaşık 80’e çıkmaktadır (Şekil 2). Lobüllerdeki tomurcuk sayısı arttıkça tomurcukların boyutu küçülmektedir. Tip 4 lobül ise gebelikte ve laktasyonda izlenen lobül tipidir. Yüksek proliferatif aktiviteye ve östrojen reseptörüne sahip tip 1 lobüllerin malignite gelişiminde önemli olduğu öne sürülmüştür (30).
Şekil 2: Daha önce doğum yapmamış (A) ve doğum yapmış (B) kadınlarda meme lobül tipleri ve bu tipler arasındaki döngü (29).
8
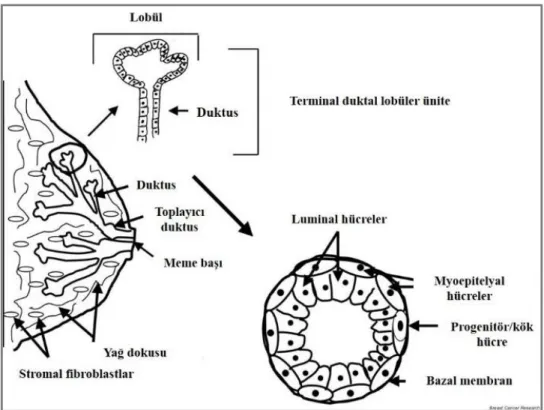
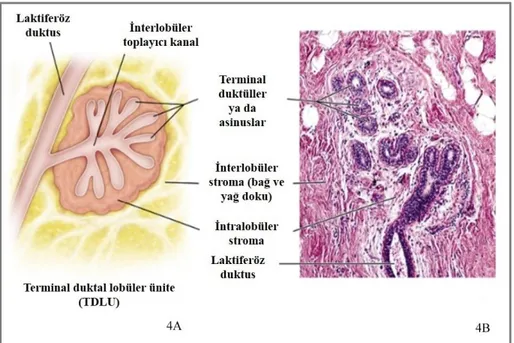
Dallanan duktusların son ucu ve bu uçla ilişkili asiner yapılara “terminal duktal lobüler ünite” (TDLU) adı verilmektedir. TDLU’nun önemi, meme kanserlerinin çoğunun bu yapıdan köken alıyor olmasıdır (31). TDLU’nun histolojik yapısı incelendiğinde dış tarafta yerleşmiş myoepitelyal hücreler ile içteki sekretuar luminal hücrelerden oluştuğu görülür (Şekil 3 ve 4). TDLU hücreleri immunohistokimyasal fenotip farklılıkları gösterirler ve bu farklar prognozu da etkilemektedir.
Şekil 3: TDLU’nun yapısı (31). İç kısımda luminal hücreler bulunurken dış kısımda myoepitelyal hücreler yer alır. Ayrıca myoepitelyal hücreler arasında yer yer kök hücreler yerleşmiştir. Meme karsinomları köken aldıkları bu hücre tiplerine göre farklı fenotipik özellikler gösterir.
9
Şekil 4: TDLU’yu oluşturan yapıların şematik görünümü (A) ve bu yapıların histolojik karşılığı (B) (32).
Memenin kanlanması başlıca internal mammaryan arter ve lateral torasik arterler yoluyla sağlanır. Lenfatik damarları %75 oranında ipsilateral aksiller lenf nodlarına, daha az oranda ise parasternal ve abdominal lenf nodlarına açılır.
2.2. Meme Kanseri Epidemiyolojisi
Meme kanseri tüm dünyada kadınlarda en sık görülen kanserdir ve görülme sıklığı giderek artmaktadır. Ayrıca, nadiren de olsa erkeklerde de karşımıza çıkmaktadır. DSÖ tümör sınıflandırmasına göre “meme kanseri” terimi farklı histopatolojik özellikler sergileyen, tüm alt tipleriyle birlikte sayısı 20’yi geçen geniş bir tümör grubunu temsil etmektedir (1).
Meme kanseri yeni tanı alan kanserlerin %23’ünü oluşturmaktadır ve her yıl 1,1 milyondan fazla kadın meme kanseri tanısı almaktadır (1). Olguların yaklaşık yarısının ve meme kanserine bağlı ölümlerin %60’ının gelişmekte olan
10
ülkelerde olduğu bildirilmiştir (33). Meme kanserli hastalarda tüm evrelere göre 5 yıllık sağ kalım oranı, gelişmiş ülkelerde %83 iken, gelişmekte olan ülkelerde %53 olarak bildirilmektedir. Aradaki bu önemli fark, gelişmiş ülkelerde tarama programları sayesinde erken tanı oranının daha yüksek olması ve daha iyi tedavi olanaklarına atfedilmektedir (2). Kanserle Savaş Dairesi Başkanlığı Türkiye’de 2008 yılı meme kanseri insidansını 41,6/100.000 olarak bildirmiş olmakla birlikte bu sayı 2011 yılı için 45,1/100.000 olarak tahmin edilmektedir (3). Ülkemizde meme kanserinin en sık görüldüğü yaş grubu 55-59 olarak bildirilmiştir (34).
2.3. Meme Kanseri Etiyolojisi
Meme kanseri gelişiminde pek çok risk faktörü mevcuttur. Ailede meme kanseri öyküsü gibi bazı faktörler meme kanserine yatkınlığı artırmaktadır, bununla birlikte; meme kanserinin multifaktöriyel bir hastalık olduğu ve olguların çoğunda kanser gelişiminde birden fazla faktörün rol oynadığı unutulmamalıdır.
Cinsiyet: Meme kanserlerinin yaklaşık %99’u kadınlarda ortaya çıkmaktadır (35).
Yaş: Meme kanseri sıklığı yaşla artmaktadır.
Diyetle ilişkili risk faktörleri: Obezite, batı tarzı yeme alışkanlığı, lif içeriği düşük diyetle beslenme, alkol meme kanseri riskini arttırır. Obezitede kanser gelişiminin insülin, insülin benzeri büyüme faktörü-1 (IGF-1), seks hormonları ve adipokinler üzerinden gerçekleştiği düşünülmekle birlikte bu mekanizmalar üzerine çalışmalar devam etmektedir (36). Beslenme alışkanlığının meme kanseri gelişimindeki rolü net değildir. Bu konudaki çalışmaların sonuçları tartışmalıdır. Bununla birlikte; obezite ve yağlı diyetten kaçınarak sağlıklı bir beslenme ve yaşam alışkanlığının meme kanserinde koruyucu etkisi olacağı düşünülmektedir (37, 38).
11
Hormonlar ve reprodüktif faktörler: Erken menarş (<12 yaş), düzenli ve ovulatuar adet siklusları, geç doğum yapma (>30 yaş), hiç doğum yapmamış olma, geç yaşta menopoz (>55 yaş) ve oral kontraseptifler (OKS) meme kanseri riskini arttırır. Özmen ve arkadaşlarının yaptığı bir çalışmada (39), yaş, indüklenmiş abortus, ilk doğum yapma yaşının 35'in üstünde olması, vücut kitle indeksinin 25 ve üstünde olması ve ailede meme kanseri öyküsü meme kanseri riskini arttıran faktörler olarak bulunmuştur. İlginç olarak; aynı çalışmada, OKS kullanımının hem tek değişkenli hem de çok değişkenli analizlerde meme kanseri riskinde azalma ile ilişkili olduğu, hormon replasman tedavisinin (HRT) ise sadece tek değişkenli analizlerde azalmış meme kanseri riski ile ilişkili olduğu bildirilmiştir. Ancak çalışmada elde edilen bulgular doz ve kullanım süresinden bağımsız olarak elde edilmiştir. Anothaisintawee ve arkadaşlarının 2013 yılında yaptıkları meta-analizde ise (40) OKS, HRT ve diabetes mellitus artmış meme kanseri riskiyle, emzirme meme kanseri riskinde azalma ile ilişkili saptanmıştır.
İyonizan radyasyon: Tüm kanser tiplerinde olduğu gibi, meme kanseri riskini de arttırır.
Ailede meme kanseri öyküsü: Ailede meme kanseri öyküsü olması, BRCA-1 ve BRCA-2 genlerinde ve P53 geninde mutasyon olması meme kanseri riskini artırmaktadır. Bu genlerin dışında meme kanseri ile ilişkili olduğu bildirilen 15’ten fazla gen bulunmaktadır (1). Tüm meme kanserlerinin sadece %10-15'i kalıtsaldır. Anne, kız kardeş ya da teyzede meme kanseri öyküsü durumunda da meme kanseri gelişimi açısından risk artışı olduğu uzun yıllardır bilinmektedir.
Daha önceden benign meme hastalığı öyküsü: Bir memede kanser varlığı diğer memede kanser riskini 2-6 kat; atipik hiperplazi ise 4-5 kat arttırmaktadır (41).
Türkiye’de evliliklerin daha genç yaşta yapılması ve dolayısıyla ilk doğumun daha erken olması, hem toplumsal bakış açısı hem de sağlık politikası gereği
12
emzirmenin özendirilmesi, sosyal nedenlerden ötürü kadınlar arasında alkol tüketiminin az olması meme kanserinden koruyucu durumlardır. Bununla birlikte; yeme alışkanlığı da dahil olmak üzere Batılı yaşam tarzının giderek yaygınlaşması ve fiziksel aktivitenin azlığı ülkemizde meme kanseri etiyolojisinde ön plana çıkan çevresel risk faktörleri arasındadır. Tüm dünyada olduğu gibi, Türkiye’de de yaşam süresi gittikçe uzamaktadır, bu da yaşla insidansı artan meme kanserinin gelecekte daha sık görüleceğinin bir göstergesidir.
İzmir’de yürütülen bir vaka kontrol çalışmasında, tütün kullanımı, ilk gebelik yaşı, birinci derece akrabalarda meme kanseri öyküsü ve margarinden zengin beslenme meme kanseri grubunda, kontrol grubuna göre daha yüksek oranda saptanmıştır (42). Sezer ve arkadaşlarının yaptığı bir çalışmada, ilk doğum yapma yaşının <30 olması ve multiparite meme kanserinden koruyucu faktörler olarak bulunmuştur. Buna ek olarak, ailede meme kanseri öyküsü, tütün kullanımı, yüksek eğitim düzeyi ve postmenopozal dönemde HRT meme kanseri için önemli risk faktörleri olarak tanımlanmıştır (43).
2.4. Klinik Özellikler
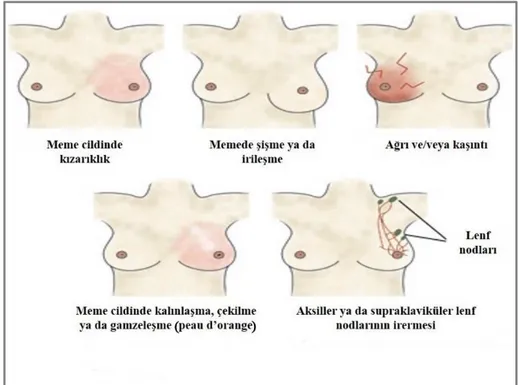
Olguların %70’i memede kitle yakınması ile başvurur. Daha az sıklıkla kızarıklık, ağrı-hassasiyet, meme derisinde portakal kabuğu görünümü, meme başının içe çekilmesi gibi belirtiler görülebilir. Tümörlerin yaklaşık yarısı üst dış kadran yerleşimlidir. İleri evre olgularda metastaz gelişen organlara bağlı olarak klinik özellikler değişiklik gösterebilir. Özellikle erken meme kanserinde ortaya çıkabilecek belirtiler Şekil 5’te gösterilmiştir.
13
Şekil 5: Meme kanserinde en sık karşılaşılan belirtiler (44).
2.5. Meme Kanserinde Erken Tanı ve Tarama Yöntemleri
Erken evrede tanı alan kanserlerde sağ kalım oranlarının daha yüksek olduğu bilinen bir gerçektir. Gökçe ve arkadaşlarının meme kanserli olgularla yaptığı bir çalışmada, toplam sağ kalım ve hastalıksız sağ kalım süreleri erken evre olgularda anlamlı düzeyde daha yüksek bulunmuştur (45).
Önlenebilir ve/veya klinik, biyokimyasal ve radyolojik yöntemlerle kolay saptanabilir kanserler için tüm dünyada tarama programları uygulanmaktadır. Ülkemizde, 2008 yılında, toplum tabanlı tarama çalışmaları kapsamında Sağlık Bakanlığı ve Avrupa Birliği MEDA işbirliğiyle Kanser Erken Teşhis, Tarama ve Eğitim Merkezleri (KETEM) kurulmuştur. KETEM’ ler tarafından uygulanmakta olan ulusal meme kanseri tarama standartlarımıza göre(46);
• 50-69 yaş arası tüm kadınlara, her iki yılda bir, her iki meme için, birisi medyolateral oblik, diğeri ise kraniokaudal olmak üzere ikişer poz mamografi filmi çekilir.
14
• Mamografi filmleri iki radyoloji uzmanı tarafından ve birbirlerinden bağımsız olarak değerlendirilmelidir.
• Asıl tarama metodu mamografi olmakla beraber, taramaya katılan her kadın hekim tarafından da muayene edilir.
Türkiye’nin batı bölgelerinde meme kanseri insidansı daha fazladır. Ancak, çok merkezli bir çalışmada, merkezlerin çoğunda olguların yaklaşık %75’inin evre 0, I ve II gibi erken evre meme kanseri olguları olduğu, fakat Doğu Anadolu ve İç Anadolu Bölgesi’nde olguların yaklaşık %40’ının evre III ve IV meme kanseri olguları olduğu bildirilmiştir (47). Bu durum, toplumun farkındalığının Türkiye’nin orta ve doğu bölgelerinde daha az olduğunun bir göstergesidir.
Kadınların meme kanseri ve kendi kendine meme muayenesi hakkında bilgilerini ölçmek için yapılan çalışmalar kapsamında, katılımcılara konuyla ilgili eğitim verilmesi planlanmış; eğitim öncesi ve sonrası bilgi düzeyleri karşılaştırılmıştır. Verilen eğitim sonrasında katılımcıların farkındalıklarının anlamlı düzeyde arttığı tespit edilmiştir (48, 49). Kendi kendine meme muayenesi her kadının yapabileceği kolay, zararsız, maliyetsiz bir yöntemidir. Bu yöntem yaygınlaştıkça ve meme hastalıkları hakkında farkındalık arttıkça meme dokusundaki değişiklikler daha erken dönemde yakalanacak ve mevcut tarama protokollerinin etkinliği artacaktır.
2.6. Görüntüleme Yöntemleri
Meme kanserinin erken tanısında düzenli aralıklarla yapılacak görüntüleme yöntemlerinin önemi büyüktür. Meme kanseri taramaları ve erken tanısında en çok kullanılan ve güven duyulan yöntem mamografidir (MMG). Memede kuşkulu kitleler MMG’ye düzensiz sınırlı, mikrokalsifikasyonlar içeren görüntüler şeklinde yansımaktadır. Bulgular BI-RADS (Breast Imaging-Reporting and Data System) skorlaması yapılarak raporlanmaktadır: 0= yetersiz, 1= negatif, 2= benign, 3= muhtemelen benign, 4=kuşkulu, 5= malignite lehine ve 6= bilinen biyopsi-kanıtlanmış malignite anlamına gelmektedir (50).
15
Kırk yaşından genç kadınlarda ise meme görüntülemesinde ultrasonografi (USG) önerilmektedir. Premenopozal dönemde meme yoğunluğu fazla olduğundan kitlenin büyüklüğü ve sınırlarını belirlemek için MMG ile birlikte kullanılabilir (51).
MMG ve USG meme görüntülemesinde en çok başvurulan yöntemlerdir. Bunun dışında manyetik rezonans görüntüleme, bilgisayarlı tomografi gibi yöntemler de özel klinik durumlarda ya da sistemik hastalık taramalarında kullanılabilmektedir.
2.7. Evreleme
Meme kanseri evrelemesinde Amerikan Kanser Komitesi’nin (AJCC) önerdiği TNM sistemi kullanılmaktadır. TNM sisteminin en son güncellemesi 2009 yılında yayınlanmıştır (52). Doğru evreleme, hastanın prognozunu öngörmede ve hasta için en uygun tedavi stratejisinin planlanması için büyük önem taşımaktadır. Meme kanserli hastalarda doğru evreleme için multidisipliner yaklaşım çok değerlidir.
AJCC tarafından önerilen TNM evrelemesi Tablo 1 ve 2’de özetlenmiştir. Buna ek olarak; neoadjuvan tedavi almış olgularda, evrelemenin klinik bulgularla ya da patolojik değerlendirme sonrasında yapılmasına göre TNM evresi başına “yc” ya da “yp” getirilerek yazılmalıdır (ypT, ypN1 vb.).
16
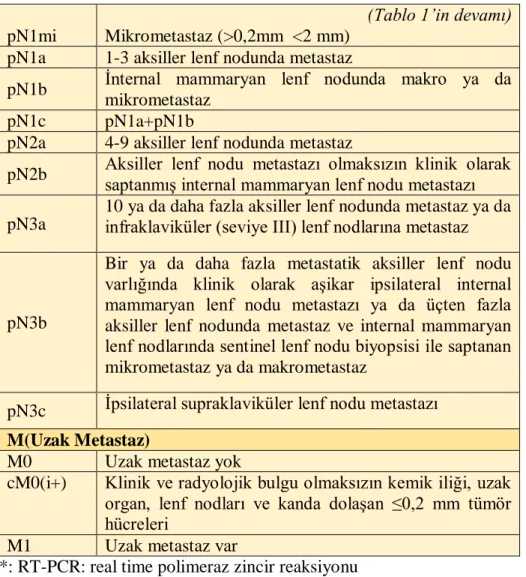
Tablo 1: Meme tümörleri için TNM sınıflaması (52). T (Tümör)
TX Primer tümör değerlendirilemiyor T0 Primer tümör bulgusu yok
Tis (DCIS) Duktal karsinoma in situ Tis (LCIS) Lobüler karsinoma in situ
Tis (Paget) Meme başının Paget Hastalığı +/- invaziv/in situ karsinom T1mi ≤1 mm (mikroinvazyon) T1a >1 mm ≤5 mm T1b >5 mm ≤10 mm T1c >10 mm ≤20mm T2 >20 mm ≤50 mm T3 >50 mm
T4a Göğüs duvarına invazyon (Sadece pektoral kas invazyonu yeterli değil) T4b Ülserasyon ve/veya satellit nodül ve/veya ödem
T4c T4a+T4b
T4d İnflamatuar karsinom N (Bölgesel Lenf Nodları) (Klinik)
NX Bölgesel lenf nodları değerlendirilemiyor N0 Bölgesel lenf nodu metastazı yok
N1 İpsilateral seviye I, II metastazı (fikse değil)
N2a Fikse ya da grup oluşturmuş ipsilateral aksiller lenf nodlarında metastaz
N2b
Klinik olarak aşikar aksiller lenf nodu metastazı olmadığı durumlarda klinik olarak saptanmış ipsilateral internal mammaryan nodu metastazı
N3a İpsilateral infraklavikuler lenf nodu metastazı
N3b İpsilateral aksiller ve internal mammaryan lenf nodu metastazı N3c İpsilateral supraklavikuler lenf nodu metastazı
N (Bölgesel Lenf Nodları) (Patolojik)
pNX Bölgesel lenf nodları değerlendirilemiyor
pN0(i-) Histolojik ve immunohistokimyasal olarak negatif
pN0(i+) Histolojik ve immunohistokimyasal olarak saptanmış izole tümör hücreleri pN0(mol−) Histolojik olarak metastaz yok, moleküler bulgu
(RT-PCR*) yok
pN0(mol+)
Pozitif moleküler bulgular (RT-PCR*) var, histolojik ya da immunohistokimyasal bulgusu yok
17 pN1mi
(Tablo 1’in devamı) Mikrometastaz (>0,2mm <2 mm)
pN1a 1-3 aksiller lenf nodunda metastaz
pN1b İnternal mammaryan lenf nodunda makro ya da mikrometastaz
pN1c pN1a+pN1b
pN2a 4-9 aksiller lenf nodunda metastaz
pN2b Aksiller lenf nodu metastazı olmaksızın klinik olarak saptanmış internal mammaryan lenf nodu metastazı
pN3a
10 ya da daha fazla aksiller lenf nodunda metastaz ya da infraklaviküler (seviye III) lenf nodlarına metastaz
pN3b
Bir ya da daha fazla metastatik aksiller lenf nodu varlığında klinik olarak aşikar ipsilateral internal mammaryan lenf nodu metastazı ya da üçten fazla aksiller lenf nodunda metastaz ve internal mammaryan lenf nodlarında sentinel lenf nodu biyopsisi ile saptanan mikrometastaz ya da makrometastaz
pN3c İpsilateral supraklaviküler lenf nodu metastazı M(Uzak Metastaz)
M0 Uzak metastaz yok
cM0(i+) Klinik ve radyolojik bulgu olmaksızın kemik iliği, uzak organ, lenf nodları ve kanda dolaşan ≤0,2 mm tümör hücreleri
M1 Uzak metastaz var
*: RT-PCR: real time polimeraz zincir reaksiyonu
Tablo 2: Meme kanserinde evreleme.
Evre 0 Tis N0 M0 Evre 1A T1 N0 M0 Evre 1B T0, T1 Nmi M0 Evre 2A T0, T1 T2 N1 N0 M0 M0 Evre 2B T2 T3 N1 N0 M0 M0 Evre 3A T0, T1, T2 T3 N2 N1, N2 M0 M0 Evre 3B T4 N0, N1, N2 M0
Evre 3C Herhangi bir T N3 M0
18 2.8. Meme Kanserinde Moleküler Sınıflama
Meme karsinomlarının heterojen klinik davranışa sahip olduğu ve tedaviye farklı yanıtlar gösterdiği uzun süredir bilinmektedir. Perou ve Sorlie (53), 2000 yılında bu bilgi ışığında meme karsinomlu olgularda gen ekspresyon profillerini analiz ederek bu profillerin farklı olduğunu göstermişlerdir. Bunu izleyen çalışmalarda meme karsinomlarında gen ekspresyon profilleri ayrıntılı olarak analiz edilmeye başlanmıştır. TDLU’yu oluşturan hücrelerin farklılaşma düzeylerine göre farklı karsinom alt tiplerine öncülük ettiği öne sürülmüştür (54), ancak bu konudaki veriler henüz kesin değildir. Mevcut bilgiler ışığında; meme karsinomları moleküler olarak dört ana başlıkta sınıflandırılmaktadır (luminal A ve B, HER2 amplifiye, bazal benzeri) ancak aşağıda değinileceği gibi gen ekspresyon profillerine göre moleküler alt tipler ayrılmaya çalışılmaktadır. Meme karsinomlarında güncel moleküler sınıflama Tablo 3’te özetlenmiştir.
Luminal A ve B (ER pozitif); Memenin luminal epiteline benzerlik gösterirler. ER pozitif kanserlerin çoğu bu gruptadır ve ER, PR ve ER ilişkili diğer genlerin aktivasyonu sonucu gelişir. Luminal A, ER ekspresyonu yüksek, HER2 genelde negatif grup olup tüm meme kanserlerinin yaklaşık %40’ını oluşturur. En sık alt tiptir, genelde düşük dereceli tümörlerdir. Tüm meme kanseri tipleri içerisinde en iyi prognoza sahip gruptur (5, 55-58). Luminal B, ER (+) olan ancak Luminal A’ya göre proliferatif aktivitesi daha yüksek tümörlerdir, Ki67 proliferasyon indeksi %14’ün üstünde beklenmektedir (59, 60). Tüm meme kanserlerinin %20’sini oluşturur. Luminal A’ya göre görece düşük ER ekspresyonu, HER2 gen kümesinde değişken düzeyde ekspresyon ve proliferasyon gen kümelerinde daha yüksek ekspresyon söz konusudur. Dolayısıyla prognozu Luminal A’ya göre daha kötüdür (59).
HER2 amplifiye; HER2 pozitif, nadiren ER, PR pozitif tip olup meme kanserlerinin %10-15’ini oluşturur. HER2 ve proliferasyon gen kümelerinin yüksek ekspresyonu ve luminal ve bazal gen kümelerinin düşük ekspresyonu ile karakterizedir (53).
19
Luminal negatif alt tipler üçlü negatif ve/veya bazal sitokeratin(ler) pozitif tümörlerdir. Bu grup içerisinde de farklı gen ekspresyonları tanımlanmıştır:
Bazal benzeri; Normal meme dokusundaki bazal hücrelere benzer gen ekspresyonuna sahiptir. Genellikle üçlü negatiftir. Proliferasyon genlerinde aşırı ekspresyon ve EGFR ekspresyonu sonucu hücre proliferasyonu gerçekleşir (61, 62). Hemen daima yüksek dereceli tümörlerdir. Erken dönemde bile genomik instabilite mevcut olup >%50’sinde P53 mutanttır (63). BRCA1 mutant olgularda gelişen meme tümörlerinin %80’i bazal benzeri karsinomlardır (64). Fakat bazal benzeri meme karsinomlarının çoğunun sporadik olduğu ve BRCA1 mutasyonuna bağlı gelişmediği akılda tutulmalıdır. Siyahi ırkta premenopozal dönemde bazal benzeri karsinomlar sık görülmektedir (65).
Klaudin-düşük; Üçlü negatif ve meme kök hücrelerine benzer tümör hücreleri ile karakterizedir (66). Meme karsinomlarının %5-10’unu temsil eder. Hücreler arası adezyon molekülleri olan klaudin 3, 4 ve e-cadherin ile luminal yüzey belirteçlerinin düşük ekspresyonu görülür (67). Bazal benzeri tümörlere göre daha yavaş büyür. Yine bazal benzeri karsinomlardan farklı olarak immun yanıtla ilişkili 40 farklı gen eksprese eder (68, 69). Metaplastik ve medüller karsinomlar genellikle klaudin-düşük tip ile örtüşmektedir. Proliferasyon genleri düşük düzeyde eksprese olmasına rağmen prognoz kötüdür (67, 69).
İnterferon-zengin; Üçlü negatiftir ancak prognoz diğer üçlü negatif meme karsinomlarına göre daha iyidir (70). Kompleman ve immun yanıt yolak genlerinin yüksek ekspresyonu ile karakterizedir (71).
Androjen reseptörü (AR) kaynaklı (moleküler apokrin); AR eksprese ederler.
Normal benzeri; Normal meme dokusu ile aynı gen ekspresyonuna sahiptir. Bu lezyonların ayrı bir grup mu oluşturduğu yoksa incelenen örnekte tümör dokusunun az olmasına bağlı bir sonuç mu olduğu tartışmalıdır (71).
Pahalı olduğu için henüz yaygın olarak kullanıma girmemiş olsa da meme kanserli hastalarda gen profilini ortaya koyan çeşitli testler piyasaya
20
sürülmüştür. Bu testlerle hastalar için uzun dönem risk düzeyleri saptanarak tedavi ve izlemin modifiye edilebileceği düşünülmektedir.
Tablo 3: Meme kanserinde moleküler sınıflama.
Luminal A Luminal B HER2
Amplifiye Bazal benzeri Eksprese olan genler ER ve PR ilişkili genler aktive ER ve PR ilişkili genler aktive HER2 aşırı ekspresyonu Proliferasyon genleri aşırı eksprese Reseptör profili ER ve PR (+) HER2 genellikle (-) Ki 67≤ %14 ER ve PR (+) HER2 (-/+) Ki 67 >%14 HER2 (+) ER ve PR (-/+) Genellikle ER, PR ve HER2 (-)
2.9. Meme Kanserinde Prognostik Faktörler
2.9.1. Aksiller Lenf Nodu Tutulumu
Hastalığın seyrini belirleyen en önemli prognostik faktör olarak kabul edilmektedir. Hastalıksız ve toplam sağ kalım süreleriyle doğrudan ilişkilidir. Meme kanseri tanısı alınan özellikle ilk 5 yıl içerisinde lenf nodu tutulumu olmayan, 1-3 metastatik lenf nodu olan ve 4’ten fazla metastatik lenf nodu olan olgularda sağ kalım oranları açısından anlamlı fark saptanmıştır (72). Aksiller lenf nodu metastazının 5 yıllık toplam sağ kalımı %40’a varan oranlarda azaltabildiği gösterilmiştir (73-75). Atahan ve arkadaşları, 957 hasta ile yaptıkları çalışmada, primer tümör boyutunun ve metastatik lenf nodlarının diseke edilen toplam lenf nodu sayısına oranının yüksek olmasının postoperatif
21
radyokemoterapi alan meme kanserli olgularda beyin metastazı riskini arttırdığını bildirmişlerdir (76).
Aksilladan diseke edilmesi gereken lenf nodu sayısı AJCC tarafından minimum 6 olarak tanımlanmıştır, bununla birlikte daha fazla sayıda lenf nodu örneklenmesi gerektiğini savunan çalışmalar mevcuttur (77-79). Ayrıca metastatik lenf nodlarının diseke edilen tüm lenf nodu sayısına oranının önemli bir prognostik faktör olduğunu bildiren çalışmalar da son dönemde hız kazanmıştır (80-82).
Aksiller lenf nodlarının makroskobik ve mikroskobik incelemesi kritik önem taşımaktadır. Günümüzde morbiditeyi azaltmak için aksiller lenf nodları mümkün olduğunca korunmaya çalışılmaktadır. Bu nedenle de sentinel lenf nodu biyopsisi (SLNB) yapılmakta ve sonucuna göre aksiller diseksiyon kararı verilmektedir. Sentinel lenf nodu (SLN) tümörün drene olduğu ilk lenf nodudur. SLN işaretlemelerinde radyoaktif izotoplar ya da mavi boya kullanılmaktadır.
Aksiller lenf nodlarında 0,2 mm’den küçük metastazlar “izole tümör hücreleri” ya da “submikrometastaz”; 0,2 mm ile 2 mm arasındaki lezyonlar “mikrometastaz” ve 2 mm’den büyük odaklar “makrometastaz” olarak tanımlanmaktadır. Bugüne kadar, yalnızca makrometastazların prognozla ilişkisi net olarak gösterilebilmiştir. Submikrometastazlar ve mikrometastazların prognoza etkisi ise belirsizliğini korumaktadır.
Evrelemenin doğru yapılabilmesi ve prognozun doğru bir şekilde belirlenebilmesi için patoloji raporlarında aksiller lenf nodu incelemeleriyle ilgili olarak aşağıdaki özellikler mutlaka bulunmalıdır:
Sentinel lenf nodu sayısı Toplam lenf nodu sayısı
Makrometastaz izlenen lenf nodu sayısı Mikrometastaz saptanan lenf nodu sayısı
İzole tümör hücresi saptanan lenf nodlarının sayısı En büyük metastatik odağın çapı
22 2.9.2. Tümör Boyutu
Tümör çapı ve özellikle invaziv komponentin büyüklüğü, aksiller lenf nodu tutulumunu öngören önemli bir prognostik faktördür (83). Evre 1 meme kanserli olgularda tümör çapı, yaş (<35) ve PR negatifliği mortaliteyi arttırıcı bağımsız faktörler olarak bildirilmiştir (84). Tümör çapı arttıkça sağ kalım süresi azalmakta ve aksiller lenf nodu tutulumu olasılığı artmaktadır (85). Çapı 1,5 cm’den küçük tümörlerin daha iyi prognoza sahip olduğu kabul edilmektedir (86).
Meme tümörleri sıklıkla düzensiz sınırlı, çevreye doğru iğsi çıkıntılar yapan tümörlerdir. Bu nedenle tümör çapı ölçümlerinde dikkatli olunmalıdır. Makroskopik incelemede birden fazla tümör saptandığında bu tümörlerin her birinin boyutları ayrı ayrı ölçülmelidir. Ayrıca, daha önce insizyonel biyopsi ve/veya tru-cut biyopsi uygulanmış olgularda tümör çapının doğru değerlendirilmesi için histopatolojik, radyolojik ve klinik veriler birlikte değerlendirilmelidir.
2.9.3. Tümör Derecesi
Tümör hücrelerinin köken aldıkları dokuya ne kadar benzediği yani diferansiasyon derecesi histolojik derece (HD) ile ifade edilmektedir. HD’nin prognostik önemi çok değişkenli analizlerle daha önce gösterilmiş olup daha yüksek dereceli tümörler lenf nodu tutulumu, büyük tümör boyutu, LVİ, ER negatifliği, HER2 ve p53 pozitifliği ile ilişkilendirilmiştir (87).
Tümör hücrelerinin nükleer özellikleri, tubül oluşumu (yani HD) ve mitoz sayısının değerlendirildiği Modifiye Bloom Richardson derecesi (MBRD) günümüzde meme kanserinin derecesini belirtmede kullanılmaktadır (Tablo 4). MBRD’ye göre 3, 4 ve 5 olarak skorlanan olgular derece 1; 6 ve 7 olarak
23
skorlanan olgular derece 2; 8 ve 9 olarak skorlanan olgular derece 3 tümörlerdir. Kötü diferansiye tümörlerde sağ kalım beklentisi daha düşüktür (88).
Tablo 4: Modifiye Bloom Richardson Derecesi (MBRD) değerlendirilirken dikkate alınan parametreler ve puanlama şeması.
Puan
Tubül Oluşumu
>%75 %10-75 Minimal veya hiç yok (<10)
1 2 3
Nükleus özellikleri
Küçük nükleus, düzgün sınırlar, üniform kromatin paterni Normalden büyük, veziküler nükleuslu, nükleolü seçilebilen, ılımlı boyut ve şekil farkı gösteren hücreler Veziküler nükleus, belirgin nükleol, belirgin boyut ve şekil farkı gösteren hücreler
1 2
3
Mitoz sayısı (x25, alan çap› 0.59 mm-10 alan)
0-9 10-19 >20 1 2 3 2.9.4. Histolojik Tip
Olguların %60-70’i invaziv duktal karsinom (İDK), başka türlü sınıflandırılamayan (NOS) morfolojisinde olup ikinci sıklıkta invaziv lobüler karsinom (İLK) (%8-10) görülmektedir. İDK, NOS ve İLK olgularının prognozunda diğer histolojik prognostik faktörlerin önemli etkisi bulunmaktadır. İnvaziv kribriform, tubüler, tubülolobüler ve müsinöz karsinom gibi daha düşük dereceli tümörlerde ise sağ kalım beklentisi daha yüksek olup 10 yıllık sağ kalım %80’in üzerindedir (89).
24 2.9.5. Lenfovasküler İnvazyon (LVİ)
Tümörün gerek aksiller lenf nodlarına gerekse uzak organlara yayılma eğilimi açısından ipucu veren önemli bir prognostik bulgudur. LVİ’nin lenf nodu tutulumu oranını arttırdığı gösterilmiştir (90). LVİ 3 kat fazla rekürrens riski ile ilişkilendirilmiştir (90). Chairat ve arkadaşlarının (91), 829 meme kanseri hastasıyla yaptıkları çalışmada LVİ ve aksillada 3’ten fazla metastatik LN olmasının bölgesel rekürrens riskini arttırdığı bildirilmiştir.
2.9.6. Östrojen ve Progesteron Reseptörleri (ER ve PR)
Östrojen kadınlardaki primer seks hormonudur, steroid yapıda olup 18 karbon atomu içermektedir. Üç hormonal formu vardır, en etkili olanı ise overlerde sentez edilen 17 β-östradioldür. Progesteron ise temel sentez yeri korpus luteum olan, steroid yapıda ve 21 karbon atomu içeren bir hormondur.
Östrojen ve progesteron, özgün reseptörlerine bağlanarak hücre nükleusunda transkripsiyon kaskadı üzerinden etki gösterirler. Bu hormonların meme kanseri oluşumunda mutajenik etki yaptıkları bilinmektedir. ER ve PR pozitif olguların hormonal tedaviye daha iyi yanıt verdiği bildirilmiştir (4). ER’nin ERα ve Erβ olmak üzere iki formu bulunmaktadır. ERα normal meme gelişiminde daha önemli olmakla birlikte Erβ tamoksifene daha iyi yanıt ile ilişkilendirilmiştir (92). PR’nin ise, intakt ER sinyal yolağı göstergesi olduğu ve tamoksifene yanıtı öngördürebileceği düşünülmektedir. PR(-) olgularda aromataz inhibitörlerine yanıt azalmaktadır.
ER ve PR, rutin uygulamada İHK yöntemiyle değerlendirilir ve nükleer boyanma pozitif kabul edilir. Boyanma yüzdesi ve şiddeti dikkate alınmaktadır. Şiddet (1+), (2+) ve (3+) olarak ifade edilmektedir. Değerlendirme için mutlaka
25
internal kontrol bulunmalı ve tümör hücrelerinin ≥%1’i immun reaksiyon göstermelidir.
2.9.7. P53
P53 bir tümör supresör gen olup mutasyonu nedeniyle pek çok kanser gelişebilmektedir. Meme karsinomlarında p53 pozitifliği kötü prognoz ile ilişkilendirilmektedir (5). Bununla birlikte; P53 mutasyonlarının sporadik olgulardan ziyade ailesel sendromlarda karşımıza çıkması beklenmektedir. P53 durumu, rutin patoloji uygulamasında İHK ile değerlendirilir. Bu yöntem %33 oranında yanlış pozitif ve %30 oranında yanlış negatif sonuç vermektedir (93). Bu nedenle; İHK ile P53 değerlendirmesinin güvenilirliği sınırlıdır.
2.9.8. Proliferasyon İndeksi
Ki67 (MIB 1): Hücre siklusunun G1, S ve G2 fazlarında eksprese edilir. Mitotik fazda tepe noktasına ulaşır. Bu nedenle tümörün mitotik aktivitesi hakkında fikir vermekte, proliferasyon aktivitesini göstermek için kullanılmaktadır. İHK yöntemle nükleer boyanma yüzdesi hesaplanarak belirlenmektedir. Erken evre meme kanserinde önemli bir prognostik parametre olarak kabul edilmektedir (6).
2.9.9. HER2 (Human epidermal growth factor receptor 2)
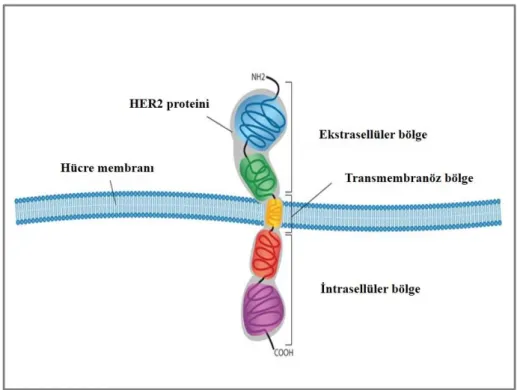
HER2, 17q12’de yerleşmiş ERBB2 geni tarafından kodlanır, 185 kD ağırlığında olup tirozin kinaz aktivitesi göstermektedir (Şekil 6). HER2 normal
26
hücre gelişim ve proliferasyonunda görevlidir ve pek çok epitel hücresinde düşük düzeyde eksprese edilir. Bu protein membranöz yerleşimli olup hücre membranının dış kısmında, transmembranöz ve hücre membranının iç kısmında yerleşmiş üç parçadan oluşur.
Şekil 6: HER2 proteininin yapısı (94).
DKİS’lerin %20-40’ında; invaziv meme kanserlerinin yaklaşık %20’sinde HER2 aşırı ekspresyonu gösterilmiştir (7-10). HER2 protein aşırı ekspresyonu olguların %90’ında gen amplifikasyonu nedeniyle olur (11). Daha az sıklıkla, kromozom 17 polizomisine bağlı olarak HER2 aşırı ekspresyonu olabilmektedir. Lenf nodu metastazı olan meme kanseri olgularında kötü prognoz için bağımsız bir faktör olduğu gösterilmiştir (12). HER-2 durumu ve tümör derecesi arasında doğru orantı, hormon reseptörleri ile ters orantı bulunmuştur (13). Erken evre invaziv duktal karsinom olgularında HER2 sinyalinin, LVİ, yaygın intraduktal komponent, düzensiz gelişim paterni ve aksiller metastaz ile artış gösterdiği bildirilmiştir (14). Bununla birlikte; bazı çalışmalarda, ER, PR, p53, yaş, tümör çapı, LVİ, metastaz durumu gibi prognostik belirteçler ile HER2 arasında istatistiksel olarak anlamlı ilişki saptanmadığı için, HER2 bağımsız bir
27
prognostik faktör olarak kabul edilmiştir (15, 16). HER2’nin farklı kemoterapi rejimlerine yanıtı öngörmede kullanılabileceği belirtilmektedir (17). HER2 pozitifliği, endokrin tedavilere direnç ile de ilişkilendirilmektedir (18). HER2 reseptörünü hedef alan monoklonal antikorun geliştirilmesi ve tedavide kullanılmaya başlanması ile HER2 durumunun belirlenmesi ayrı bir önem kazanmış olup HER2 durumu İHK ya da moleküler yöntemle ortaya konabilir.
İHK, hücre içerisindeki proteinlerin antijen olarak kabul edilerek üretilen özel antikorların doku ve/veya sıvı örneklerine uygulandığı ve oluşan antijen-antikor kompleksinin konvansiyonel mikroskopi ile görünecek şekilde boyanmasına dayanan bir tekniktir. İHK analizde en sık peroksidaz-antiperoksidaz, avidin-biotin peroksidaz, alkali fosfataz ve immungold enzim teknikleri kullanılmaktadır (95). Patoloji laboratuvarlarında daha ucuz ve kolay olması nedeniyle rutin uygulamada İHK kullanılmaktadır. HerceptTest (Dako, Glostrup, Denmark) ve HER2/neu (4B5) rabbit monoclonal primary antibody (Ventana Medical Systems, Inc, Tucson, Arizona), Amerikan Gıda ve İlaç Dairesi (FDA) tarafından onaylanmış İHK kitleridir, bununla birlikte; pahalı olmaları nedeniyle ülkemizde kısıtlı sayıda patoloji laboratuvarı tarafından rutin uygulamada kullanılmaktadır.
İHK sonuç değerlendirmesi ASCO/CAP önerileri doğrultusunda membranöz boyanma skorlanarak yapılmaktadır (19) (Tablo 5). (2+) olarak raporlanan olguların bir kısmı yanlış pozitif olduğundan bu olgularda yine ASCO/CAP önerileri doğrultusunda FISH yöntemiyle amplifikasyon değerlendirilerek doğrulama testi yapılmaktadır.
İHK için %20 oranında bir hata oranı verilmektedir (96). Dokunun fiksasyon yöntemi ve süresi başta olmak üzere, kullanılan İHK yöntemi, değerlendiricinin deneyimi gibi faktörler İHK sonuçlarını etkilemektedir. FDA onaylı kitler dışındaki İHK kitlerinin hata oranını yükseltebileceği belirtilse de literatürde (2+) olgularda HercepTest (Dako, Glostrup, Denmark) yanlış pozitiflik oranının yüksek olduğunu bildiren çalışmalar da mevcuttur (97, 98) ve bu konuda net bir görüş birliği mevcut değildir.
28
Tablo 5: ASCO/CAP kriterlerine göre İHK incelemede HER2 skorlaması. İnvaziv tümör hücrelerinin >%10’unda üniform, yoğun komplet
membranöz boyanma 3+
Tümör hücrelerinin ≥%10’unda aşikâr sirkumferansiyel dağılım gösteren non-üniform ya da zayıf komplet membranöz boyanma 2+
Zayıf, inkomplet membranöz boyanma 1+
Tümör hücrelerinde boyanma olmaması 0
Kullanılan in situ hibridizasyon tekniklerinde, ilgili genomik sekanslardan tamamlayıcı DNA probları üretilir, çeşitli yöntemlerle etiketlenir ve hibridize edilir. FISH yönteminde fluoresanlı işaretleme yapılır ve sonuçlar karanlık ortamda ve fluoresan mikroskopi ile değerlendirilir. CISH yönteminde işaretleme kromojen madde ile indirekt olarak yapılır ve sonuçlar rutin olarak kullanılan konvansiyonel mikroskoplarda değerlendirilir. SISH hibridizasyon teknikleri arasında en son geliştirilendir. İşaretleme dinitrofenol yardımıyla yapılır. Sonuçlar, CISH’e benzer şekilde, rutin olarak kullanılan konvansiyonel mikroskoplarda değerlendirilir. Bunlara ek olarak; literatürde kantitatif polimeraz zincir reaksiyonu (PCR) ile HER2 durumunu değerlendiren çalışmalar mevcuttur (98-100).
Kuşkulu İHK sonuçlarının doğrulanmasında kullanılan FISH yöntemi ile İHK arasında çeşitli nedenlerle uyumsuzluk ortaya çıkabilir. Literatürde, bazı olgularda İHK yöntemle (3+)’lik saptanmasına rağmen FISH ile amplifikasyon gösterilemeyen olgular mevcuttur (101-102). Bu durumdan birkaç olasılık sorumlu olabilir: kromozom 17’de polizomi, çok düşük düzeyde amplifikasyon, yanlış pozitif İHK ve yanlış negatif FISH. Ayrıca, tümör içerisindeki genetik heterojenitenin, FISH sonuçlarını etkileyebileceği bildirilmiştir (103). İHK (3+) FISH (-) olgularda kromozom 17 polizomisi olabileceği gösterilmiştir (104,105). Bu olguların prognozu konusunda veriler tartışmalıdır. Sentromerik amplifikasyon ya da monozomi kuşkusu olduğunda FISH bulgularının dikkatle yorumlanması gerektiği ve bu olgularda karyotip analizinin yararlı olabileceği
29
öne sürülmektedir (106). Ayrıca, 17p13.1’de yerleşmiş p53 pozitifliğinin de polizomi açısından ipucu olarak kullanılabileceği bildirilmektedir (107).
Arnould ve arkadaşlarının yaptığı çok merkezli çalışmada (26), 260 meme tümörü incelenmiştir. SISH ve CISH yöntemlerinin FISH ile konkordansı için κ değerleri sırasıyla 0,96 ve 0,94 olarak saptanmıştır. Yazarlar, FISH yapılamadığı durumlarda SISH ve CISH’in HER2 durumunun belirlenmesinde ve İHK sonuçlarının doğrulanmasında alternatif yöntem olarak önerilebileceği sonucuna varmışlardır.
Yukarıda bahsedilen yöntemlerin birbirlerine göre bazı avantajları ve dezavantajları mevcuttur:
İHK kolay ve ucuzdur, sonuçlar konvansiyonel mikroskopi ile değerlendirilebilir ve preparatların korunarak arşivlenmesi imkanı vardır. Bununla birlikte; immunohistokimyasal değerlendirme sübjektiftir, gözlemciler arası değişkenlik söz konusudur ve sonuçların standardizasyonu ve doğrulanması gerekmektedir.
FISH, CISH ve SISH HER2 amplifikasyonunun saptanmasında kullanılan sensitif yöntemlerdir. Her üç yöntem de formalin fiksasyonu yapılmış parafin bloklara gömülmüş materyalde çalışılabilir. CISH ve SISH yöntemleri, FISH ile kıyaslandığında, konvansiyonel mikroskopi ile kolayca değerlendirilebilen, otomatik cihazlar yardımıyla yapılışı daha kolay olan yöntemlerdir. Ayrıca CISH ve SISH ile, İHK preparatlarına benzer şekilde, uzun süre muhafaza edilebilen ve arşivlenebilen sonuçlar sağlanabilir ve materyalin histopatolojik özellikleri eş zamanlı olarak değerlendirilebilir. SISH ve CISH, gözlemciler arası uyum oranı yüksek olan yöntemlerdir; bu özelliği yöntemin kolay yorumlanabilirliğini ve güvenilirliğini desteklemektedir (22). Ancak bu iki yöntem konusunda deneyimin az olduğu da bir gerçektir. FISH teknolojisi ise göreceli olarak daha pahalıdır, değerlendirme için fluoresan mikroskopi gereklidir ve preparatlar zamanla solacağından dijital fotoğraflama yapmak gerekmektedir, bununla birlikte; zahmetli olsa da dijital fotoğraflama ile arşiv
30
oluşturmak mümkündür. Ayrıca, yöntemi uygulayan kişinin deneyimine bağlı olarak invaziv tümör alanlarını saptamak zor olabilir.
DNA’nın proteinden daha stabil olduğu düşünülürse in situ hibridizasyon yöntemlerinin, İHK’ye göre daha doğru bilgi sağlayacağı sonucuna varılabilir fakat in situ hibridizasyon için kullanılan probun özelliğine bağlı olarak bazı moleküler değişikliklerin atlanabileceği akılda tutulmalıdır.
Sonuç olarak, bu çalışmada, merkezimizde meme karsinomu tanısı almış, HER2 (c-erbB-2) durumu (2+) olarak raporlanarak FISH uygulanmış 59 hastaya ait toplam 60 meme tümöründe HER2 onkogen amplifikasyonunu ve protein ekspresyonunu saptamak için kullanılan bir İHK kiti ve iki ayrı in situ hibridizasyon tekniği sonuçlarının karşılaştırmalı olarak yorumlanması amaçlanmaktadır. Hasta yararı ve patoloji rapor standardizasyonu için, halen kullanımımızda olan İHK kitinin, altın standart FISH ve kullanımı daha pratik olan SISH yöntemleriyle güvenilirlik ve maliyet-etkinlik açısından karşılaştırılabileceği, elde edilen sonuçlara göre ülkemizde kullanılabilecek doğru seçeneğin öngörülebileceği düşünülmektedir.
31 3. Gereç ve Yöntem
3.1. Olgu Seçim Kriterleri
Çalışmaya Ocak 2009 ve Şubat 2013 tarihleri arasında parsiyel ve/veya radikal mastektomi materyalleri Ege Üniversitesi Tıp Fakültesi Tıbbi Patoloji Anabilim Dalı’nda ‘Meme Karsinomu’ tanısı almış, HER2 (c-erbB-2) durumu (2+) olarak raporlanan ve doğrulama amacıyla ardışık olarak FISH çalışılmış toplam 59 hasta dahil edildi. Olgulara ait toplam 60 ameliyat materyali değerlendirmeye alındı.
3.2. Etik Kurul Onayı
Çalışmamıza Ege Üniversitesi Tıp Fakültesi Klinik Araştırmalar Etik Kurulu’ndan 13-3/34 karar numarası ile etik kurul onayı alındı.
3.3. Klinik Verilerin Toplanması
Olguların genel bilgileri ve laboratuvar sonuçlarına Ege Üniversitesi Tıp Fakültesi Hastanesi Genel Cerrahi Anabilim Dalı hasta dosya kayıtlarından ve meme konseyi hasta kartlarından ulaşıldı. Hasta bilgileri, patoloji rapor verileri, klinik bilgiler Microsoft Excel 2013 programına kaydedildi.
32 3.4. Histopatolojik İnceleme
3.4.1. Histolojik Tip ve Derece
Ocak 2009 ve Şubat 2013 tarihleri arasında Ege Üniversitesi Tıp Fakültesi Tıbbi Patoloji Anabilim Dalı’nda parsiyel ve/veya radikal mastektomi materyalleri “Meme karsinomu” tanısı almış ve HER2 (c-erbB-2) durumu (2+) olarak raporlanan toplam 59 olguya ait hematoksilen-eozin (HE) boyalı preperatlar arşivden çıkarılarak yeniden değerlendirildi. Tümörün histolojik tipi için DSÖ 2003 ölçütleri, derecesi için ise MBRD sistemi temel alındı.
3.4.2. Diğer Histopatolojik Değerlendirme Ölçütleri
3.4.2.1. İmmünohistokimyasal İnceleme
Arşivde yer alan preparatlarda meme karsinomu olgularının rutin histopatolojik incelemesinde kullanılan ER (Estrogen Receptor, Clone SP1, Rabbit Monoclonal Antibody, Thermo Scientific), PR (Monoclonal Mouse Anti-Human Progesterone Receptor, Clone PgR 636, Dako), HER2 (C-erbB-2/ HER2/ neu oncoprotein Ab-17,Clone= e2-4001 + 3B5, Mouse Monoclonal Antibody, 1 ml, 200 μg/ml, NeoMarkers) ve Ki67 (Monoclonal Mouse Anti-Human Ki-67 Antigen, Clone MIB-1, Dako) İHK sonuçları kaydedildi.
3.4.2.2. İmmünohistokimyasal Boyama Yöntemi
İmmünohistokimyasal boyama yöntemi olarak biyotinsiz, HRP multimer bazlı, hidrojen peroksit substrat ve 3, 3’ diaminabenzidin tetrahidroklorit (DAB) kromojeni içeren hazır kit (ultraViewTM Universal DAB Detection Kit, Catalog
33
number 760-500, Ventana) ve tam otomatik immunohistokimyasal boyama cihazı (Ventana BenchMark XT, Ventana Medical Systems, Inc) kullanıldı. Doku kesitleri elektrostatik yüklü lamlara (ISOTERM, ca.75x25mm/ 3x1 inch, positive charged, LOT: 20110601) alınıp, 60°C’de en az iki saat tutuldu. Deparafinizasyon ve antijen açığa çıkarma işlemleri de dâhil olmak üzere tüm immunohistokimyasal boyama süreci BenchMark XT (Ventana Medical Systems, Inc) tam otomatik immunohistokimyasal boyama cihazında gerçekleştirildi. Cihazda zıt boyaması hematoksilen ve mavileştirici solüsyon ile tamamlanan kesitlerin dehidratasyonu ve ksilen ile şeffaflandırılması elle; lamel kapatılması aşaması ise otomatik olarak (Dako CoverStainer, CS100-10073) yapılarak işlem sonlandırıldı.
3.4.2.3. İmmünohistokimyasal İncelemede Değerlendirme Ölçütleri
Merkezimizde rutin olarak uygulanmakta olan ve halihazırda kurulu ve çalışmakta olan BenchMark XT (Ventana Medical Systems, Inc) markalı immunohistokimya/ in situ hibridizasyon cihazında otomatik olarak boyanan HER2 (C-erb B2/ HER2/ neu oncoprotein Ab-17,Clone= e2-4001 + 3B5, Mouse Monoclonal Antibody, 1 ml, 200 μg/ml, NeoMarkers) İHK antikoruyla elde edilen sonuçlar ASCO/CAP 2007 önerileri doğrultusunda membranöz boyanma değerlendirilerek kaydedildi.
3.4.2.4. FISH Boyama Yöntemi
FISH kılavuz önerileri doğrultusunda manuel olarak çalışıldı (Her2 / sent 17, amplifikasyon / kontrol – 2 renkli, Miksish, Medimiks). Boyama protokolü (oda sıcaklığında) iki günde tamamlandı.
Birinci gün; parafin bloklardan 5 mikronluk kesitler polizinli lam üzerine alındı. Beşer lamlık lam kutusuna 5 lam için 15 cc distile su ve 150 ml MHcl karıştırıldı. Bu lam kutusu distile su bulunan beherin içinde 37oC’ye kaldırıldı.
34
Deparafinizasyon ön yıkama solüsyonu 80oC’lik su banyosuna konuldu. Solüsyonlar istenilen sıcaklığa geldiğinde hibridizasyon cihazındaki (StatSpin® ThermoBrite Denaturation and Hybridization System, IRIS International, Inc, USA) lamlar 3 adet ksilolde 10’ar dakika bekletildi. Ksilolden çıkan lamlar 2 defa 5’er dakika süreyle etanolde bekletildi. Daha sonra da oda sıcaklığında kurutuldu. Kuruyan lamlar 80oC’deki deparafinizasyon ön yıkama solüsyonunda 45 dk bekletildi. Pipet yardımıyla lamlar distile su ile yıkandı. Enzim reaktifi 150 ml distile su ile sulandırılıp 37oC’de ısınmış olan distile su ve 1 MHcl karışımına eklendi ve distile sudan çıkan lamlar bu solüsyonun içinde 45 dk bekletildi. Süre sonunda lamlar distile suda 10-15 sn çalkalandı. Lamlar oda ısısında 2 defa 3’er dakika 2xSSC’de (salin sodyum sitrat) bekletildi. Üçer dakika sırasıyla %70, %85 ve %100 alkol uygulandı. Alkol uygulama aşamasında prob hazırlandı. -20oC’deki prob tüpü ve doku hibridizasyon tamponu oda ısısına getirildi ve vortekslendi. Ependorf tüpüne her hasta için 2 ml prob ve 8 ml doku hibridizasyon tamponu konuldu. Mikrosantrifüj uygulandıktan sonra tekrar vortekslendi. Alkolden çıkan lamlar oda sıcaklığında kurutuldu. Doku üzerine prob pipetlendi. Üzeri lamelle kapatılıp kenarları kauçuk solüsyon (“rubber cement”) ile çevrelendi. 85oC’de 5 dk denatürasyon uygulandı. Lamlar hibridizasyon cihazında (StatSpin® ThermoBrite Denaturation and Hybridization System, IRIS International, Inc, USA) 37oC’de 1 gece bekletildi.
İkinci gün; 10 ml 20xSSC (salin sodyum sitrat) ve 90 ml distile su karıştırıldı. Bu karışım 50 cc olarak 2 şaleye bölündü. Her bir şaleye 150 ml NP 40 eklendi. Şalelerden bir tanesi su banyosuna kondu ve sıcaklık 73oC’ye ayarlandı. Yıkama solüsyonunun sıcaklığı 73oC’ye ulaştığında lamlar hibridizasyon cihazından (StatSpin® ThermoBrite Denaturation and Hybridization System, IRIS International, Inc, USA) çıkarıldı ve üzerlerindeki lameller kaldırıldı. Fazlalık kauçuk solüsyonlar temizlendi. Lamlar oda sıcaklığındaki yıkama solüsyonunda tek tek çalkalandı. Lamlar ısınmış olan yıkama solüsyonunda 5 dk bekletildi ve süre sonunda distile suda iyice çalkalanarak oda sıcaklığında kurumaya bırakıldı. Kuruyan lamların üzerine 10 ml DAPI damlatıldı. Üzerleri lamelle kapatılan
35
preparatlar -20oC’de 20 dk bekletildi. Daha sonra üzerleri kapalı şekilde +4oC’ye alındı.
3.4.2.5. FISH Değerlendirme Ölçütleri
HER2/CEP17 oranı >2,2 olan olgular amplifiye (FISH pozitif), HER2/CEP17 oranı 1,8-2,2 arasında olanlar kuşkulu pozitif, HER2/CEP17 oranı <1,8 olanlar ise nonamplifiye (FISH negatif) kabul edildi.
3.4.2.6. SISH Boyama Yöntemi
Olgulara ait hematoksilen-eozin (HE) boyalı preparatlar arşivden çıkarılarak SISH çalışılacak parafin bloklar seçildi. Bloklar arşivden çıkarılarak boş kesit ve HE boyalı kesitler hazırlandı. Parafin bloklardan elde edilen 4 mikron kalınlığındaki kesitlerde ise hâlihazırda kurulu ve çalışmakta olan Benchmark XT (Ventana Medical Systems, Inc) markalı immunohistokimya / in situ hibridizasyon cihazında otomatik olarak “silver enhanced” in situ hibridizasyon (SISH) (INFORM HER2 Dual ISH assay, Ventana Medical Systems, Inc) yapılarak amplifikasyon durumu değerlendirildi. İşlem aşağıdaki esaslara uygun olarak cihaz tarafından otomatik olarak gerçekleştirildi.
Parafin bloklardan 4 mikronluk kesitler polizinli lam üzerine alındı. Deparafinizasyon yapıldı. Cihaz, aşağıdaki basamaklardan devam etti:
Sitratlı solüsyon inkübasyonu (37oC’de 4 dakika)
Proteaz uygulaması (ISH proteaz 3 uygulaması ve 20 dakika inkübasyon) Üç damla HYB RDY SOL uygulaması ve 4 dakika inkübasyon
İki damla HER2DNP CHR17DIG (C-probu) uygulaması ve 4 dakika inkübasyon