ASPERGILLUS terreus KSİLANOLİTİK SİSTEMİNİN BATIK VE KATI KÜLTÜRDE HÜCRE DIŞI PROTEİNLERİNİN KARŞILAŞTIRILMALI PROTEOMİK ANALİZİ
İbrahim SAVRAN Yüksek Lisans Tezi Biyoloji Anabilim Dalı Yrd.Doç.Dr. Aytaç KOCABAŞ
T.C
KARAMANOĞLU MEHMETBEY ÜNİVERSİTESİ FEN BİLİMLERİ ENSTİTÜSÜ
ASPERGILLUS terreus KSİLANOLİTİK SİSTEMİNİN BATIK VE KATI KÜLTÜRDE HÜCRE DIŞI PROTEİNLERİNİN KARŞILAŞTIRILMALI PROTEOMİK ANALİZİ
YÜKSEK LİSANS TEZİ İbrahim SAVRAN
Anabilim Dalı: BİYOLOJİ
Programı : TEMEL VE ENDÜSTRİYEL MİKROBİYOLOJİ
Tez Danışmanı: Yrd. Doç. Dr. Aytaç KOCABAŞ
TEZ BİLDİRİMİ
Yazım kurallarına uygun olarak hazırlanan bu tezin yazılmasında bilimsel ahlak kurallarına uyulduğunu, başkalarının eserlerinden yararlanılması durumunda bilimsel normlara uygun olarak atıfta bulunulduğunu, tezin içerdiği yenilik ve sonuçların başka bir yerden alınmadığını, kullanılan verilerde herhangi bir tahrifat yapılmadığını, tezin herhangi bir kısmının bu üniversite veya başka bir üniversitedeki başka bir tez çalışması olarak sunulmadığını beyan ederim.
i ÖZET Yüksek Lisans Tezi
ASPERGILLUS terreus KSİLANOLİTİK SİSTEMİNİN BATIK VE KATI KÜLTÜRDE HÜCRE DIŞI PROTEİNLERİNİN KARŞILAŞTIRILMALI PROTEOMİK ANALİZİ
İbrahim SAVRAN
Karamanoğlu Mehmetbey Üniversitesi Fen Bilimleri Enstitüsü
Biyoloji Anabilim Dalı
Danışman: Yrd. Doç. Dr. Aytaç KOCABAŞ February, 2018, 61 sayfa
Ksilanaz ve ksilanolitik enzim sisteminde yer alan diğer enzimler özellikle lignoselülozik biyokütlenin hidroliz edilerek alternatif karbon kaynağı olarak kulllanılabilmesine olanak sağlamaktadır. Dolayısıyla bu enzim sistemi, sürdürülebilir enerji kaynaklarını kullanarak biyoyakıt ve değerli kimyasalların üretimini hedefleyen biyorafineri sistemlerinin en önemli bileşenlerinden birini oluşturmaktadır. Optimize edilen kültür ortamlarının proteom analizleri nanoHPLC-ESI-MS/MS tekniğiyle gerçekleştirilmiştir. Proteom analizleri sonucunda elde edilen veriler, katı kültür ortamında üretilen toplam protein miktarının batık kültürde üretilen miktarın iki katına karşılık geldiğini göstermiştir. Katı kültürde lignoselülozik materyallerin parçalanmasında görev alan yardımcı enzimlerin çeşitliliği batık kültüre kıyasla daha fazladır. Bunun yanında batık kültürde enzimlerin bireysel miktarları daha yüksek bulunmuştur.
Anahtar Kelimeler: Aspergillus terreus, batık kültür, katı kültür, ksilanolitik sistem, ksilanaz, proteomik analiz,
ii ABSTRACT Yüksek Lisans Tezi
COMPARATIVE PROTEOMICS ANALYSIS OF EXTRACELLULAR PROTEINS OF ASPERGILLUS terreus XYLANOLYTIC SYSTEM IN SUBMERGED AND SOLID-STATE
CULTURES İbrahim SAVRAN
Karamanoglu Mehmetbey University Natural Sciences Instutute
Biology Department
Advisor: Asst.Prof.Dr. Aytaç KOCABAŞ February, 2018, 61 pages
The xylanase and other enzymes involved in the xylanolytic enzyme systems allow the lignocellulosic biomass to be hydrolyzed and used as an alternative carbon source. Therefore, this enzyme system constitutes one of the most important components of the biorefinery systems targeting the production of biofuels and valuable chemicals using sustainable energy sources. Proteom analysis of optimized culture media was performed by nanoHPLC-ESI-MS/MS technique. The data obtained from proteom analysis showed that amount of the total protein produced in solid state culture correspond to 2-fold of the total protein produced in submerged culture. Diversity of accessorize enzymes in solid state culture responsible for degradation of lignocellulosic materials was found to be higher than the accessorise enzymes in submerged culture. Besides, the individual amount of enzymes was higher in submerged culture.
Key Words: Aspergillus terreus, submerged culture, solid state culture, xylanolytic system, xylanase, proteomic analysis
iii ÖNSÖZ
Eğitimim boyunca desteğini sürekli hissettiğim, çalışmalarımda tüm bilgi ve becerileri ile yanımda olan danışman hocam sayın Yrd. Doç. Dr. Aytaç KOCABAŞ’a sonsuz teşekkür ederim.
Ayrıca bu çalışma için 212T143 nolu proje kapsamında destek veren TÜBİTAK’a teşekkürü borç bilirim.
Araştırma çalışmalarımda destek ve önerileri ile yanımda olan Karamanoğlu Mehmetbey Üniversitesi Biyoloji Bölümü değerli hocalarına, tüm Kamil Özdağ Fen Fakültesi ailesine saygılarımı iletiyorum.
Lisans ve yüksek lisansa başlamamı sağlayan sevgili anneme, kız kardeşlerime, Melehat ve Sebahat KARATAŞ’a teşekkür ediyorum.
Mikrobiyoloji laboratuvar çalışma arkadaşlarım Serap GÖNEK, Yasemin BAŞKAYA, Nermin GÜMÜŞTAŞ ve Ümmühan ÜNLÜ hocama ve diğer laboratuvar çalışanlarına gösterdikleri destek ve anlayıştan dolayı teşekkür ederim.
İbrahim SAVRAN Şubat, 2018
iv İÇİNDEKİLER Sayfa ÖZET ... i ABSTRACT ... ii ÖNSÖZ ... iii ŞEKİLLER DİZİNİ ... vii
SİMGELER VE KISALTMALAR DİZİNİ ... viii
1. GİRİŞ ... 1
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI ... 5
2.1 Lignoselülozik Biyokütle ... 5
2.2 Ksilanolitik Sistem ... 6
2.3 Türkiye’de Lignoselülozik Biyokütle ... 8
2.4 Filamentli Küfler ve Ticari Önemleri ... 9
2.5 Proteomik ve Aspergillus cinsine ait çalışmalar ... 11
3. MATERYAL VE METOD ... 15
3.1 Gereç ... 15
3.2. Mikroorganizmalar ve Kültürleri ... 15
3.2.1. Mikroorganizma Kültürü ve Spor Toplama ... 15
3.2.2. Mikroorganizma Ön ve Ana Kültür ... 15
3.2.3. Ksilanaz Enzim Aktivitesinin Belirlenmesi ... 15
3.2.4. Protein Konsantrasyonu Tayini ... 16
3.3. Proteom Analizi ... 16
3.3.1. Protein örneklerinin hazırlanması ... 16
3.3.2. Protein Çöktürme ve Konsantre Etme Yöntemleri ... 16
3.3.2.1. Aseton Çöktürme ... 16
3.3.2.2. TCA Çöktürme ... 17
3.3.2.3. TCA-Aseton Çöktürme... 17
3.3.2.4. Amonyum Sülfat Çöktürme ... 17
v
3.3.4. 2-D Jel Elektroforezi ... 18
3.3.4.1. Elektroforez ile Ayırma ... 18
3.3.4.2. İki Boyutlu Elektroforez (2DE) ... 19
3.3.5. Kütle Spektrofotometri Analizi ... 19
4. BULGULAR VE TARTIŞMA ... 20
4.1. Proteom Analizleri ... 20
KAYNAKLAR ... 38
EKLER ... 42
EK 1 ... 42
Araştırmada kullanılan kimyasal ve biyokimyasal maddeler ve özellikleri ... 42
EK 2 ... 44
Protein Standart Grafiğinin Elde Edilmesi ... 44
EK 3 ... 45
Glukoz Standart Eğrisinin Elde Edilmesi ... 45
EK 4 ... 46
SDS-PAGE İçin Kullanılan Reaktifler ve Jellerin Hazırlanması (Laemmlı, 1970) ... 46
EK 5 ... 48
Commassie Boyama Yöntemi ... 48
vi
ÇİZELGELER DİZİNİ
Tablo Sayfa
Tablo 2.1. Heteroarabinoksilanın hidrolizi için gerekli enzimler ... 7
Tablo 2.2 .Türkiye’ de toplam ekin üretimleri ve atık miktarları ... 9
Tablo 4.1. Batık kültür ortamından tanımlanan proteinler ... 23
Tablo 4.2. Katı kültür ortamından tanımlanan proteinler ... 26
Tablo 4.3. Batık ve katı kültürde ortak lignoselülozik enzimler ... 35
vii
ŞEKİLLER DİZİNİ
Şekil Sayfa
Şekil 2.1. Aspergillus türleri üzerine yapılan proteomik çalışmalarının zaman çizelgesi ... 13
Şekil 4.1. Farklı kültür ortamlarından ham ve çöktürme uygulanan örneklerin SDS-PAGE görüntüleri ... 20
Şekil 4.2. 2D elektroforez görüntüleri ... 22
Şekil 4.3. İki farklı kültüre ve farklı karbon kaynağındaki örneğin 2-DE görüntüsü ... 22
viii
SİMGELER VE KISALTMALAR DİZİNİ
Simgeler Açıklamalar
G Yerçekimi ivmesi
Rcf Rölatif santrifüj kuvveti
pH Hidrojen Gücü (ölçü birimi)
L Litre (ölçü birimi)
µL Mikrolitre (hacim ölçü birimi)
M Molarite (madde konsantrasyonu)
W Watt (güç birimi)
1 1. GİRİŞ
Günümüzde teknolojinin de hızla gelişmesiyle birlikte “-omiks” çalışmaları hızla artmakta ve bu çalışmaların genel ağırlığı genomikse odaklanmaktadır. İnsanın ve diğer birçok canlının genom projeleri hızla yürütülmekte ve her geçen gün tam genomu açıklanmış canlı sayısı artmaktadır. Yalnız sadece canlının tam genomunun ortaya çıkarılması yeterli olmamaktadır. Bunun yanında “fonksiyonel genomiks” olarak adlandıran genom üzerinde fonksiyonel ve aktif genlerin belirlenmesi üzerine çalışmalar da gittikçe artan sayıda bilimsel yayını ortaya çıkarmaktadır. Proteomiks ve proteom analizi bu konuda yapılması gereken çalışmalar içerisinde en fazla öneme sahip konulardandır çünkü her ne kadar şu an için bilimselliğini yitirmiş olsa da “bir gen bir protein” dogmasından hareketle genlerin canlı içerisinde ifadesinin genel olarak proteinler aracılığıyla olduğu bilinmektedir. Farklı koşullar altında farklı genlerin aktif olduğunu, aktif olan genler aracılığıyla farklı proteinlerin sentezlendiğini bilmekteyiz. Bu sebeple proteomiks çalışmaları organizmanın farklı koşullar altında alt-proteom analizleri yapılarak devam etmektedir.
Filamentli küfler endüstriyel öneme sahip organizmalardır. Küflerin endüstriyel önemi, geniş bir yelpazede ürün eldesinde kullanılabilmelerinden kaynaklanmaktadır. Bu ürünler; insan tedavisinde kullanılan ilaçlardan organik asitlere kadar birçok ticari kimyasalları içermektedir. Örneğin kolesterol düşürücü ilaçlarda kullanılan kimyasallar filamentli küfler tarafından doğal olarak üretilmektedir ve bunların Amerika’da yıllık piyasa payı 15 milyar dolardır. Bunlardan lovastatin genel olarak Aspergillus terreus tarafından üretilmektedir. Ayrıca ilaç endüstrisinde, polimer kimyada ve tarımda kullanılan ve dünya çapında “Top 12” temel yapı moleküllerinden birisi olarak kabul edilen itakonik asit de ticari olarak Aspergillus terreus tarafından üretilmektedir. Küflerin tam genom sekanslamalarındaki artış küflerin önemini gösteren bir başka örnektir. Proteom analizlerinin bu çalışmalara eklenmesi, ticari koşullarda kullanılan küflerde protein ifade yollarının daha iyi anlaşılmasını sağlayacak ve bunun yanında küflerin biyolojisi de daha net ortaya konacaktır. Bu vasıtayla hem patojeniteleri hem de antibiyotik dirençlilikleri hakkında bilgiler edinilecektir (Han ve ark., 2010).
2
Proteom analizlerinin karşılaştırmalı olarak gerçekleştirilebilmesi için öncelikle kültür ortamlarının net olarak tanımlanmış olması gerekmektedir. Bu amaç doğrultusunda, bu çalışmada hem batık hem de katı kültür optimizasyonları istatistiksel metodlarla ve yenilenebilir tarımsal atıklar kullanılarak yapılmıştır. Endüstride tarımsal atıkların kullanımı pek yaygın değildir. Fakat son yıllarda yenilenebilir kaynakların kullanımıyla ilgili çalışmaların sayısı artmış durumdadır çünkü tarımsal atıklar gibi yenilenebilir kaynakların kullanılması hem çevre kirliliğini önlemekte hem de endüstriyel ürünler için ucuz ve sürekli bir kaynak sunmaktadır.
Lignoselülozik maddeler selüloz, hemiselüloz ve lignin olarak adlandırılan üç temel bileşene sahiptir. Selüloz, glukoz zinciri yapısında olup oldukça düzenli bir yapıya sahiptir. Buna karşılık hemiselülozlar selülozlara oranla çok daha heterojen bir yapıya sahiptir. Ksilanın bu karmaşık yapısının etkin şekilde parçalanabilmesi için mikroorganizmaların genellikle birden fazla tipte ksilanaz ürettikleri de bilinmektedir (Michelin ve ark., 2014). Enzimlerin sinerjik çalışması sonucunda, heterojen yapıdaki lignoselülozik ağ verimli şekilde parçalanmakta, böylece ksilan fraksiyonuna ulaşılması daha kolay hale gelerek hidroliz verimi artmaktadır.
Ekonomik değeri düşük olan lignoselülozik maddelerin günümüzde fermantasyon ortamlarında sıklıkla kullanılan şekerlere alternatif olarak kullanılması, gün geçtikçe daha çok dikkat çeken bir konudur. Bunun sebebi, şekerin gıda olarak kullanılabilme potansiyeline karşın lignoselülozik maddelerin büyük kısmının atık olarak değerlendirilmesidir. Lignoselülozik biyokütlenin endüstriyel fermantasyonda kullanılabilmesi için öncelikle polimer yapısının parçalanarak fermente edilebilir şekerlerin elde edilmesi gerekmektedir. Ksilanın enzimatik olarak parçalanması ve fermente edilebilir şekere dönüştürülmesinde en büyük rolü oynayan enzim ksilanazdır (Kulkarni ve ark., 1999). Dolayısıyla, endüstriyel koşullarda aktif olan ksilanazın üretimi lignoselülozik biyokütlenin kullanılabilir hale getirilmesi için büyük önem taşımaktadır (Collins ve ark., 2005).
Ksilanaz (E.C.3.2.1.8) endüstriyel önemi fazla olan enzimlerden birisidir. Ksilanaz, kâğıt endüstrisinden gıda endüstrisine, tekstil endüstrisinden yem endüstrisine kadar birçok alanda ticari olarak kullanılmaktadır (Collins ve ark., 2005). Ksilanaz, lignoselülozik
3
yapıdaki biyokütlelerin (bitki ve tarımsal atıklar) parçalanmasında selülazdan sonra ikinci en önemli enzimdir çünkü lignoselülozik yapıdaki kütlelerde selülozdan sonra en çok bulunan ikinci yapı ksilandır. Ksilan genel olarak kompleks bir yapıya sahip olup tam olarak parçalanabilmesi için bir çok enzimin sinerjik aktivitesi gereklidir. Ksilanın parçalanmasında rol alan ana enzim ksilanazdır ve ksilan temel zincirinin ksiloz şekerine parçalanmasından sorumludur. Dolayısıyla optimizasyon çalışmaları genel olarak ksilanaz üzerine yapılmıştır. Optimizasyon çalışmalarında istatiksel yöntem kullanılmıştır çünkü klasik yöntem olan ”bir defada bir değişken değiştirme” hem çok zaman alan bir yöntemdir hem de değişkenlerin birbirleriyle olan ilişkilerinin ortaya konmasında net bir bilgi sunmamaktadır. Katı kültür optimizasyonu küfün doğal koşullardaki ortamına benzer bir ortam sağlamakta, buna karşılık batık kültür ise genel olarak endüstriyel üretimde kullanılmaktadır. Dolayısıyla ksilanolitik sistemin proteom analizinde bu kültür ortamları seçilmiştir. Bu şekilde hem ksilanolitik sistem analizi daha iyi yapılacak hem de endüstriyel uygulamalarda iyileştirmelerin nasıl yapılabileceği noktasında bir yol haritası çizilebilecektir.
Proteinlerin üçüncül yapılarının bilinmesi biyoloji, biyokimya ve biyoteknoloji alanları için yüksek öneme sahiptir. En başta, yeni ilaçların ve farmasötik ürünlerin geliştirilmesi, ilgili proteinlerin yapılarının bilinmesine bağlı olup, birçok biyoteknoloji ve farmasötik alanında faaliyet gösteren şirket proteinlerin yapısının çözümlenmesiyle ilgilenmektedir. Bunun nedeni, metabolik yolaklarda görev alan enzimlerin aktif bölgelerinin yapıları bilindiği takdir de, bu enzimleri inhibe edecek kimyasalların (ilaçların) tasarlanabileceği gerçeğidir. Makromoleküllerin üç boyutlu yapısına en az biyoteknoloji sektörü kadar ihtiyaç duyan ikinci teknoloji ise genetik mühendisliğidir. X-ışını kristalografisiyle yapı çözümü, aminoasit diziliminde genetik mühendisliği teknikleriyle yapılan değişimlerin proteinde neden olduğu kimyasal ve fiziksel değişimlerin tespiti için yapısal bir rehber niteliği taşımaktadır (McPherson, 2004).
Proteinlerin yapı çözümleri için günümüzde en sık kullanılan iki deneysel yöntem, nükleer manyetik rezonans (NMR) ve X-ışını difraksiyon teknikleridir. Günümüzde (Mayıs, 2016) Protein Veri Bankası’na (PDB) 119.000’in üzerinde yapısal veri girişi yapılmıştır ve bu verilerin %89,4’ü X-ışını difraksiyon tekniğiyle elde edilmişken, sadece %9,6’lık kısmı
4
NMR yöntemiyle elde edilmiştir. Başarılı bir yapı çözümleme süreci için, difraksiyon kalitesinde, yani tekrarlanabilir şekilde üretimi yapılabilen, tüm kristal eksenlerinde düzenli şekilde dizilime sahip ve en az 3,5 Å çözünürlüğünde difraksiyon yapabilen kristaller üretilmelidir (Goreec, 2014). İstenen kalitede kristallerin eldesi, çok sayıda deneme içeren optimizasyon süreci sonunda mümkün olmaktadır. Protein kristalizasyonu, içerdiği birçok farklı basamak nedeniyle, problemlere açık bir süreçtir. Bu nedenle, istatistiklere göre, keşfedilmiş her 100 proteinden sadece ikisinin yapısı çözümlenmiştir. Bu nedenle protein kristalleri günümüzde halen deneme ve yanılma yöntemleriyle elde edilmektedir (Camara-Artigas ve Gavira, 2016)
5
2. KURAMSAL TEMELLER VE KAYNAK ARAŞTIRMASI
2.1 Lignoselülozik Biyokütle
Lignoselülozik ham maddeler ve bunların parçalanmasına yardımcı olan enzimlerin üretiminin optimizasyonu son yıllarda sürdürülebilir enerji ve kimyasal sağlayacak uygun biyorafineri üniteleri kurabilmek adına bilimsel çalışmaların odak noktası haline gelmiştir. Çalışmaların çoğu bu ham maddelerin fermente edilebilir karbonhidrat kaynağı olması noktasında yoğunlaşmıştır (Peters, 2007). Sürdürülebilir ve çevre dostu enerji kaynağı olarak lignoselülozlardan hidrokarbon yakıtı ve biyoethanol üretimi umut vaad edici bir çözüm olarak görülmektedir. Bunun yanında endüstriyel fermentasyonlarda genelde basit şekerler (glikoz, sükroz) veya bitki kaynaklı karbonhidratlar (nişasta) gibi aslında besinsel değerleri sebebiyle gıda ürünlerinde kullanılan ve gelecekte fosil kaynaklarının yerini tutamayacak nitelikteki karbon kaynakları kullanılmaktadır (Teter ve ark., 2006). Dolayısıyla bu kaynakların fiyatları gıda endüstrisiyle rekabet içinde olmakta ve fiyatı yükselmektedir. Ayrıca sürdürülebilir bir kaynak olmamaları da ilerisi için sorun teşkil etmektedir. Bunun sebebi fotosentezle çok büyük miktarda enerjinin, kimyasal ve yapısal olarak kompleks bitki hücre duvarı içerisinde biriktirilmesidir ve bu miktar yaklaşık olarak 1011 ila 1012 ton kadardır (Teter ve ark., 2006; Wei ve ark., 2009).
Bu lignoselülozik biyokütle kimyasal ve biyolojik işlemler sonucunda basit şekerlere ve sıvı yakıta dönüştürülebilir. Bu sebeplerden ötürü lignoselülozik biyokütleler muhtemel kaynaklar olarak görülmektedir çünkü bu karbon kaynakları doğada bol miktarda bulunmaları, yenilenebilir kaynak olmaları ve fiyatlarının düşüklüğü nedeniyle tercih edilmelidir. Yalnız, lignoselülozik maddelerin kullanılabilir şekerlere dönüşümündeki zorluk endüstriyel kullanımda fiyatı artırmaktadır (Neureiter ve ark., 2004). Günümüz teknolojisiyle bu işlemler sıralı adımlarla yapılmaktadır fakat bu işlem süreci pahalıdır ve kritik nokta, bitki hücre duvarlarının basit şekerlere yıkımıdır. Bu problem ya kimyasal önişlem sırasında basit şeker üretim miktarının artırılmasıyla ya da enzim verimliliğinin artırılması ve/veya üretim fiyatının düşürülmesiyle mümkün olabilir (Wei ve ark., 2009). Bunu başarmanın yolu ise kullanılan lignoselülozik ham madde miktarı ve çeşitliliğini
6
artırıp, kaynaktaki bütün elde edilebilir şekerlerin kullanılmasıyla mümkündür çünkü mevcut durumda çoğunlukla selüloz içerisinde glikozun eldesi ve kullanılması verimli bir şekilde yapılmaktadır. Fakat bunun yanında lignoselülozik yapının ikinci çok bulunan yapısal maddesi hemiselülozun parçalanmasıyla elde edilen ksilozun kullanımı çok az olmaktadır (Danner ve Braun, 1999). Buna ek olarak bitki biyokütlesinde bulunan selüloz ve hemiselülozun fermente şekerlere dönüştürülmesi için gerekli ticari enzimlerin fiyatlarının yüksek olması biyorafineri sistemlerinin kurulmasını zorlaştırmaktadır. Bitki biyokütlesinin dönüştürülmesi selülaz, ksilanaz ve diğer hemiselülotik enzimlerin sinerjistik aktivitelerini gerektirmektedir (Hansen ve ark., 2015; Farinas, 2015; Uday ve ark., 2016).
2.2 Ksilanolitik Sistem
Ksilan selülozdan sonra lignoselülozik biyokütle içerisinde ikinci en çok bulunan polisakkarittir ve bitkinin kuru ağırlığının %20-30’unu oluşturmaktadır (Senthilkumar ve ark., 2005; Dobrev ve ark., 2007; Saha, 2003; Bakir, 2004). Ksilanın hidrolizi için ksilanaz (endo-1,4-β-D-ksilanaz EC 3.2.1.8) ve β-D-ksilosidaz (EC 3.2.1.37) ana enzimler olmak üzere α-L-arabinofuranosidaz (EC 3.2.1.55), α-L-glukuronosidaz (EC 3.2.1.139), asetilksilan esteraz (EC 3.1.1.72), ferulik asit esteraz (EC 3.1.1.73) ve ρ-kumarik asit esteraz (EC 3.1.1.-) yardımcı enzimler olarak ksilanolitik sistemi oluştururlar (Tablo 2.1). Orman ve tarımsal atıklar gibi biyokütlenin etanol, metan ve hatta son yıllarda hidrojene verimli şekilde dönüştürülmesi, çevre dostu yenilenebilir enerji üretimi için dünyanın en önemli konularından biri olmuştur (Hendricks ve Zeeman, 2009). Bunun başarılabilmesi için ise gerekli enzimleri üretebilmekten ziyade enzimlerin sinerjik çalışmalarının sağlanması gerekmektedir.
7
Tablo2.1. Heteroarabinoksilanın hidrolizi için gerekli enzimler (Saha, 2003)
Enzim EC
Numarası
Aktivitesi
Endo-Ksilanaz 3.2.1.8 Ksilan ana zincirinde β-1,4-ksiloz bağlarının hidrolizi β-Ksilosidaz 3.2.1.
7
Ksilobioz ve kısa zincirli ksilooligosakkaritlerden ksilozun ayrılması
α-Arabinofuranosidaz 3.2.1. 5
Arabinoksilandan uçtaki indirgen olmayan α-arabinofuranozun hidrolizi
α-Glukuronidaz 3.2.1.139 Glucuronoksilandan glikuronik asit ayrımı Asetilksilan esteraz 3.1.1.72 Asetilksilanlardan asetilester bağlarının hidrolizi Ferulik asit esteraz 3.2.1.73 Ksilanlarda feruloilester bağlarının hidrolizi ρ-Kumarik asit esteraz 3.2.1.73 Ksilandan ρ–kumaril ester bağlarının hidrolizi
Ksilanazın çeşitli endüstriyel işlemlerde kullanılmak üzere çok geniş bir aralıkta potansiyel biyoteknolojik uygulaması vardır. Bunlar arasında tahıla dayalı besinlerin modifikasyonunu ve yemlerin sindirim kalitesinin artırılmasını sayabiliriz. Bunlara ek olarak tekstil ve gıda endüstrisinde, ilaç sanayinde ve son günlerde daha çok önem kazanan kağıt endüstrisinde kağıt hamurlarından çevre dostu yöntemlerle ligninin uzaklaştırılmasında ve lignosellülozun basit şeker, etanol gibi yararlı maddelere biyodönüşümünde görev almaktadır. Bu şekilde geniş bir endüstriyel uygulama alanı olması farklı türlerden ve farklı özelliklere sahip yeni ksilanazların tanımlanması ve eldesi için itici bir kuvvet olmaktadır (Kulkarni ve ark., 1999). Yenilenebilir kaynakların (lignoselülozik kaynakların) daha verimli bir şekilde biyoetanol, biyoenerji ve diğer önemli kimyasalların eldesi için kullanılmaları ve bu konuda hemiselülozun hidrolizi, ksilanaz üzerine olan çalışmaların son zamanlarda odak noktası olmuştur.
Biyokütle 3 ana sebepten dolayı hammadde olarak önem kazanmıştır. Bunlardan birincisi, biyokütlenin yenilenebilir bir kaynak olmasıdır ve sürdürülebilirliği gelecekte daha da
8
geliştirilebilir. İkinci olarak, biyokütle pozitif önemli bir çevresel özelliğe sahiptir ki uygun şekilde kullanılmasıyla sera gazlarının yayılımını düşürebilir. Son olarak, önemli ekonomik potansiyele sahiptir çünkü gelecekte fosil yakıtlarının rezervi azalacak ve fiyatı gittikçe artacaktır (Demirbaş, 2008; Wahlström ve ark, 2015)
2.3 Türkiye’de Lignoselülozik Biyokütle
Türkiye’de yaklaşık olarak 26.350 milyon hektarlık tarım alanı mevcuttur (Öztürk ve Başçetinçelik, 2006). Tarım, Türkiye’de en yüksek ulusal geliri paylaşan önemli aktivitedir ve tarımsal aktivitelerin çoğu endüstriyel bitkilerin üretimine odaklanmıştır. Bu üretimlerin sonucunda ortaya büyük miktarda tarımsal atık çıkmaktadır ve bunların çoğu hasat sezonunda alanlarda bırakılmaktadır (Kar ve Tekeli, 2008). Türkiye’de üretilen toplam ekin üretimi ve atık miktarları Tablo 2’ de gösterilmiştir. Bu verilere göre en fazla atık buğday ve arpa sapıdır ve bunları mısır ve pamuk atıkları izlemektedir. Fakat mısır ve pamuk atıklarının yenilenebilir olarak kullanılabilirliği buğday ve arpa atıklarına nazaran 4 kat daha fazladır çünkü buğday ve arpa atıkları hayvan yemi olarak da kullanılmaktadır (Öztürk ve Başçetinçelik, 2006). Benzer bir şekilde, dünya geneline bakıldığında da mısırın en fazla üretilen tarımsal ürün olduğu görülmektedir (785 milyon ton) (Özcan, 2009).
9
Tablo 2.2Türkiye’ de toplam ekin üretimleri ve atık miktarları (Öztürk ve Başçetinçelik, 2006)
Ekin Atık Tipi
Üretim
(ton)
Toplam Atık (ton) Kullanılabilir Atık (ton) Kullanılabilirli k (%) Teorik Gerçekleşen Buğday Saman 22.439.042 29.170.755 23.429.907 3.514.486 15 Arpa Saman 8.327.457 9.992.98 8.963.012 1.344.452 15 Mısır Sap 2.209.601 5.911.902 4.970.259 2.982.155 60 Koçan 596.592 1.907.307 1.144.384 60 Pamuk Sap 2.292.988 6,317,181 2.520.281 1.512.169 60 Ayçiçeği Sap 836.2 9 2.341.554 2.259.121 1.355.472 60
Türkiye’de ve dünyada geniş ölçüde mevcut olan mısır doğrudan ya da dolaylı olarak 4000’den fazla farklı ürünün eldesinde kullanılmaktadır. Gelişmekte olan ülkelerde mısır genelde gıda olarak kullanılırken, gelişmiş ülkelerde ana kullanım alanı yem endüstrisi, endüstriyel üretim hammaddesi ve etanol üretimidir. Dünyada mısırın en çok üretildiği ülke olan Amerika’da 2007 yılında üretilen mısırın %23’ü etanol üretiminde kullanılmıştır ve bu kullanım miktarının gittikçe artması beklenmektedir (Özcan, 2009).
2.4 Filamentli Küfler ve Ticari Önemleri
Ksilanazın önceleri bitki patojeni olan organizmalar tarafından üretildiği keşfedilmiş, daha sonra endüstriyel öneminin de fazla olması nedeniyle artan araştırmalar sonucunda çok geniş organizma grupları tarafından da üretildiği bulunmuştur. Bu geniş gruba sadece mikroorganizmalar değil, algler, böcekler ve karasal bitkilerin tohumları da dahildir (Sunna ve Antranikian, 1997; Bakır, 2004).
10
Ksilanaz, selülaz ve diğer hemiselülotik enzimlerin ticari olanları genel olarak asklı mantarlar tarafından üretilmektedir. Bunlara ek olarak asklı mantarların endüstriyel olarak çok geniş ürün kataloğuna sahip olmaları bu canlıların önemini artırmaktadır. Filamentli organizmaların ürün yelpazesi insan tedavisinde kullanılan ilaçlardan (antibakteriyel ve antifungal ilaçlar gibi) özel kimyasallara kadar (enzimler ve organik asitler gibi) çok geniştir ve tamamının Amerika yıllık satış miktarı milyar dolarlarla ifade edilmektedir (Kim ve ark., 2007; Han ve ark., 2010).
Üretim aşamasında belirlenen besi yeri ve fermentasyon koşulları istenilen ürünün özelliklerinin ve veriminin uygun koşullarda olması noktasında büyük önem taşımaktadır. Ticari mikrobiyal enzim üretimlerinin çoğu batık kültür (submerged fermentation) yöntemiyle üretilmektedir. Son zamanlarda gerçekleştirilen çalışmalarla katı kültür yöntemiyle (solid state fermentation) özellikle lignoselülozik materyaller kullanılarak daha düşük maliyetle yüksek verimde ürünlerin elde edilebileceği gösterilmiştir. Dolayısıyla ticari üretimlerde kullanımı hızla artmaya başlamıştır (Hansen ve ark., 2015). Katı kültür ortamı katı substratın yeterince nemlenmesi ile gerçekleştirilebilmektedir. Bu özellikle filamentli küfler için doğal bir ortam olarak görülmektedir (Farinas, 2015).
Hem filamentli hem de asklı küflerden olan A.terreus’un endüstriyel kullanım alanı çok geniştir. Kolesterol düşürücü ürünlerden olan lovastatin temel olarak bu organizma tarafından üretilmektedir. Bunun yanında yine dünya çapında “Top 12” temel yapı molekülü olarak kabul edilen ve polimer endüstrisinden ilaç endüstrisine kadar bir çok alanda kullanılan itakonik asitin ticari olarak üretiminde kullanılan organizmadır (Kim ve ark., 2008; Han ve ark., 2010). Günümüzde yaklaşık olarak 11 Aspergillus cinsine ait “tam genom sekans” projesi yapılmıştır (Andersen ve Nielsen, 2009). Devam eden projelere
11 2.5 Proteomik ve Aspergillus cinsine ait çalışmalar
Tamamlanan genom projelerinin sayısının artması ve gelişen teknolojiyle birlikte araştırmaların odağı tek bir genin sekanslanmasından tüm genoma dönmüştür. Benzer bir gelişme protein analiz alanında da gerçekleşmektedir. Diğer bir deyişle bir proteini detaylıca incelemek yerine bir hücredeki tüm proteinlerin (proteom) analizi ön plana çıkmaya başlamıştır (Wilke ve ark. 2003). Proteomik bir organizmadaki tüm proteinlerin sekans, lokalizasyon, miktar, post translasyonel modifikasyonlar ve biyomoleküler etkileşimleri yönünden sistemsel olarak karakterizasyonudur. Bu çok karmaşık ve uzun bir süreçtir çünkü, örnek olarak bir insan genomu yaklaşık olarak 20000 protein kodlayan genden oluşmaktadır. Somatik DNA tekrar düzenlenmesi ve post translasyonel modifikasyonlarla 10 milyon farklı protein formu oluşmaktadır (Kall ve Vitek, 2011). Bu karmaşıklığı açmak için proteomik çalışmaları proteom seviyelerinde yapılmaktadır. Proteom, belirtilen zaman ve biyolojik şartlarda bir hücrenin ifade ettiği proteinlerin tamamıdır (Kim ve ark., 2007, Wilke ve ark, 2003). Dolayısıyla genom sabit bir yapıyı ifade ederken proteom dinamik bir yapıyı ifade etmektedir çünkü değişen şartlar proteomu değiştirmektedir.
Proteomik çalışmalarda en çok kullanılan yöntemler proteinlerin ayrıştırılması için iki boyutlu poliakrilamit jel elektroforez (2D-PAGE) ve proteinlerin tanımlanması için kütle spektrometre (MS) analizidir. Değişen koşullara bağlı protein ifadelerindeki değişiklik 2D-PAGE yöntemiyle değerlendirilebilir. Dolayısıyla proteomik analiz teknikleri kullanılarak farklı çevresel faktörlere maruz kalmış belirli organizmaya yönelik farklı protein ifade şekilleri karşılaştırılabilir (Melin, 2004). Genel olarak bir proteom deneyi 4 aşamadan oluşur. Birinci aşama biyolojik örnekten protein izolasyonudur. Bu aşamada protein karışımı üretim ortamından ayrılır. Ayırma işlemleri temel santrifigasyon ve çökertme işlemleridir. İkinci aşama proteinlerin ayrıştırılmasıdır. Bu aşamada çoğunlukla 2D-PAGE işlemi gerçekleştirilir. Buna ek olarak yüksek basınçlı sıvı kromotografiside (HPLC) kullanılabilir. Üçüncü aşama, MS analizini içermektedir. İlgilenilen elektroforez protein noktaları veya HPLC fraksiyonları MS ile analiz edilir. Analiz öncesi proteinler peptitlerine parçalanırlar. Bu peptitler MS analizi sırasında ya matriks yardımlı lazer iyonizasyonu
12
(MALDI-Matrix-assisted laser desorption/ionisation) ile ya da elektro püskürtme iyonizasyon (ESI- elektro spray ionisation) metodlarıyla iyonlaştırılıp ya uçma zamanı (TOF-Time of flight) ya da iyon yakalama (ion trap) kütle spektrumları elde edilir. Dördüncü aşamada elde edilen bu spektrumlar biyoinformatik araçlar kullanılarak analiz edilir ve proteinler tespit edilmiş olur (Wilke ve ark., 2003).
Gelişen teknolojiyle birlikte proteom analizleride daha hızlı gerçekleştirilmektedir. Hatta örnekler direkt olarak MS analizine gönderilerek hem karşılaştırmalı analizleri hem de kuantifikasyonları yapılabilmektedir. Bu aşamada ya işaretsiz (Label free) ya da işaretli (Label-based) analizler gerçekleştirilmektedir. İşaretsiz MS analizlerinde (LC-MS/MS) örneğin peptitlerine ait MS tepelerinin yoğunluğu peptit miktarıyla orantılanmaktadır ve kuantifikasyon bunun üzerinden yapılmaktadır. İşaretli kuantifikasyonda iki farklı yöntem kullanılabilmektedir. SILAC (Stable Isotope Labeling by Amino acids in Cell Culture) yönteminde kararlı izotop hücre kültürü sırasında ortamda kullanılmakta ve direct olarak metabolik işaretleme yapmaktadır. iTRAQ (Isobaric tags for relative and absolute quantitation) yönteminde ise farklı örnekler farklı işaretçilerle işaretlenip birleştirilerek tek bir MS analizi sonucunda ayırımları yapılabilmektedir (Kall ve Vitek, 2011).
Filamentli küfler üzerine yapılan bilimsel çalışmalar diğer organizmalarla kıyaslandığında çok azdır. Filamentli küfler için genomik dönemin başlaması 2001 yılı şubat ayı olarak kabul edilmektedir ve bunun yanında proteomik çalışmaları diğer çalışmalara nazaran daha da azdır (Andersen ve Nielsen, 2009). Şekil 1’de görüldüğü gibi Aspergillus türleri üzerine proteomik çalışmalarının sayısı 2001 ile 2008 yılları arasında 10 kadardır ve buna 2010 yılında Han ve arkadaşlarının yayınladıkları A. terreus’un sükroz, glikoz ve nişasta olmak üzere 3 farklı karbon kaynağı kullanılarak kültüre edilen ortamda hücre dışı proteom çalışması ve Braaksma ve arkadaşlarının A. niger üzerine yaptığı çalışma olmak üzere 2 çalışma daha eklenmiştir (Andersen ve Nielsen, 2009; Han ve ark., 2010; Braaksma ve ark., 2010).
13
Şekil 2.1. Aspergillus türleri üzerine yapılan proteomik çalışmalarının zaman çizelgesi [Ayrılan peptit sayısı/tanımlanmış peptit sayısı]. NA: bilgi mevcut değil (Andersen ve Nielsen, 2009). Genom sekansının fenotipik bilgilerle ilişkilendirilmesi, proteomik çalışmaları tarafından sağlanan hücre tarafından ifade edilen bütün proteinlerin bilgisinin sistemsel bir yöntemle ele alınmasıyla olacaktır. Bu noktadan hareketle proteomiksin fonksiyonel genomiksin merkezinde yer aldığını söyleyebiliriz ve proteomiks çalışmalarında deney tasarımından sonra en önemli adım protein spotlarının tayinidir ki çalışmada ki başarı da buna bağlıdır. Pozitif protein tanımlaması ise mevcut olan veritabanlarına bağlıdır. Hatta veritabanlarındaki küf sekans verilerindeki eksiklik protein tanımlamalarında birçok hataya sebep olmaktadır. Fakat küf genomiks sekans veritabanı verilerindeki artışa rağmen bu organizmalara ait proteomiks analizlerine ilişkin yayınların sayısı çok azdır (Garrido ve ark., 2010). A.terreus “tam genom sekans”ı tamamlanmış organizmalardan biri olup bu organizma üzerine yapılan proteomiks çalışması 2010 yılında Han ve arkadaşlarının yaptığı çalışmadır. Bu çalışmada kültür ortamında besi yerinin diğer bileşenleri değiştirilmeden 3 farklı karbon kaynağı kullanılmıştır. Bunlar glikoz, sükroz ve nişastadır. Bu kültür ortamında organizmanın hücre dışına ifade ettiği proteinlerin analizi yapılmıştır. İki boyutlu elektroforez yöntemiyle analizlerinde toplamda 82 protein spotu tayin edilmiş ve bunlardan 39 tanesinin kültüre özel olduğu tespit edilmiştir. Protein spotlarından 16 tanesi sükroz, 3 tanesi glikoz, 8 tanesi nişastaya ve 12 tanesi en az iki karbon kaynağının bulunduğu kültüre aittir (Han ve ark., 2010). Bunun yanında batık ile katı kültürlerinin karşılaştırılmasına ilişkin bir çalışma A. oryzae kullanılarak Oda ve arkadaşları tarafından (2006) buğday küspesi üzerinde yapılmış ve yine hücre dışında ifade edilen proteom analiz edilmiştir. Çalışma sonucunda katı kültürde 85 ve batık kültürde 110 protein spotu belirlenmiş, bunlardan 29’u tanımlanmıştır. Bu çalışma filamentli küflerin katı ile batık kültürlerinin ilk
14
proteomik karşılaştırılmasının yapıldığı çalışmadır ve kültür ortamının hücre dışına salgılanan proteinleri etkilediğini kanıtlamıştır (Oda ve ark., 2006).
Bir diğer çalışma Changyou ve arkadaşları tarafından (2016) Aspergillus niger kullanılarak katı kültür ortamında fermente kolza yemi ve kolza yemini üzerinde yapılmış ve hücre dışı enzimleri analiz edilmiştir. Fermente kolza yeminde CICC41258 hücre yaşamı ilk kez açıklanmıştır. Çalışma sonucunda 40 protein spotu tespit edilmiştir. Bu proteinlerin çoğunu hücre duvarı polimerlerinin parçalanmasını sağlayan hidroliz enzimleri olduğu görülmüştür (4 tanesi nişastayı sindiren enzimleri, 3 tanesi fosfatazlar). Çalışma sonunda kolza yeminde zararlı maddeleri azaltarak, peptid parçacıkları sayısını arttırarak protein moleküler ağırlığı azalttığı görülmüştür. Buna bağlı olarak Aspergillus niger ın birçok hücre dışı enzim ürettiği tespit edilmiştir (Changyou ve ark. 2016).
15 3. MATERYAL VE METOD
3.1 Gereç
Araştırmada kullanılan kimyasallar analitik derecede olup Sigma (ABD), Merck (Almanya), Bio-Rad (ABD), Thermo Fisher Scientific (ABD) firmalarından temin edilmiştir. Mısır koçanları yerli üreticilerden elde edilmiştir.
3.2. Mikroorganizmalar ve Kültürleri
3.2.1. Mikroorganizma Kültürü ve Spor Toplama
Saboraund Dextrose agara, % 0,9 lik NaCl çözeltisi ile seyreltilen Aspergillus terreus 100 ml alınarak yayma ekim yapılır. 3 gün 35 ℃ de inkübasyona bırakılır. Süre sonunda buzdolabına +4 ℃ alınarak, daha fazla strese girerek spor üretimi arttırılır. % 0,9 luk NaCl çözeltisi ile sporlar toplanır. +4 ℃ de saklanır.
3.2.2. Mikroorganizma Ön ve Ana Kültür
50 ml saf su da, Glikoz 1,25 g , MgSO4 0,25 g, NaCl 0,020, ZnSO4.H2O stoktan 50 µl, KH2PO4 0,005, CSL1 damla (0,1 g), NH4NO3 0,1 g çözdürülerek ön kültür hazırlanır. 121 ℃ 20 dk otoklavlanıktan sonra stok olarak hazırlanan sporlardan ön kültüre ekim yapılır. Gelişmesi için 24 saat 35 ℃ de çalkalamalı inkübatörde bırakılır.
Standart bir 200 ml’lik ana kültür için; Mısır koçanı 4 gr , NaCl 0,08 g, ZnSO4.H2O 20 µl stoktan, KH2PO4 0,1 g, CSL 3 damla (0,3 g), NH4NO3 0,6 g, MgSO4 1 g, CaCl2.2H2O 0,2 g, CuSO4.5H2O 0,012 g, mısır koçanı hariç hepsi çözdürüldükten sonra erlendeki mısır koçanının üzerine dökülerek, ana kültür hazırlanır. Ön kültür de büyütülmüş olan Aspergillus terreus dan ana kültüre aşılama yapılır ve 35 ℃ ye büyümeye bırakılır.
3.2.3. Ksilanaz Enzim Aktivitesinin Belirlenmesi
Ana kültür den alınan enzim 5000 G de, 5 dk, +4 ℃ santrifüj edilir. Süpernatant kısmı başka bir ependorfa alınır. Su banyosu, DNS, ksilan kullanılır. 900 µl ksilan üzerine 40 ℃
16
de 100 µl enzim eklenir. Belirlediğimiz süre sonunda da 1,5 ml DNS eklenerek aktivite durdurulur. Bu işlemden sonra hazırlanan materyal 5 dk kaynatılır. Aktivitesi için elde edilecek olan absorbanslar mikro plakalara 200 µl yüklenerek, spektrofotometre de 540 nm de ölçüm yapılarak bulunur (Miller, 1959).
3.2.4. Protein Konsantrasyonu Tayini
Hazırlanan ekstratın, BSA, %2’lik CuSO4.5H2O, %2’lik Na-K tartarat, 0,1 N NaOH, %2’LİK Na2CO3, Folin reaktifi kimyasalları ile lowry metodu kullanılarak protein derişimi hesaplanır. Bilinmeyen örneklerin derişimin belirlenmesi için derişimi bilinen BSA dan 0,02-0,05-0,1-0,15-0,2-0,5-0,75 derişiminde örnekler hazırlanır. Örneklerimizi 1/50-1/100-1/200-1/300-1/400/1/500 seyreltme yapılarak BSA ve örneklerimizi 40 µl mikroplakaya yüklenir. Üzerine 200 µl ACR reaktifi eklenerek karanlıkta 3 dk bekletilir. 20 µl folin reaktifi de eklenir ve pipetajlanıp, 30 dk karanlık bir ortamda bekletilir. Süre sonunda 660 nm de ölçüm yapılır. Derişimi bilinen BSA dan grafiği çizdirilerek denklem çıkartılır. X in katsayısının yerine örneklerimizin absorbansı koyularak derişim hesaplanır.
3.3. Proteom Analizi
3.3.1. Protein örneklerinin hazırlanması
Katı kültür için besi yeri ortamına 20 mL 50 mM pH 7,0 fosfat tamponu eklenmiş ve 15 dakika boyunca hafif çalkalanmıştır. Batık kültürden ise örnek alımı direkt olarak yapılmıştır. Besi yerinden alınan örnekler 5000 g`de 4-6°C’de 5 dakika santrifüj edilerek hücreler ve besi yerindeki çözünmeyen parçacıklar ayrılmıştır. Temizlenen bu besi yeri çözeltisi ham protein kaynağı olarak kullanılmıştır.
3.3.2. Protein Çöktürme ve Konsantre Etme Yöntemleri
3.3.2.1. Aseton Çöktürme
Örnek üzerine -20°C’de soğutulmuş asetondan örnek miktarının 4 katı kadar eklenmiştir. Karıştırıldıktan sonra -20°C’de 3 saat bekletilmiş ve sonrasında 10 dakika 14000 rpm’de
17
santrifüj edilmiştir. Süpernatant uzaklaştırıldıktan sonra çökelti içerisindeki asetonun uçması amacıyla kurutulmuştur. Kurutulan örnekler SDS örnek veya 2D rehidrasyon tamponu ile çözdürülerek kullanılmıştır.
3.3.2.2. TCA Çöktürme
Örnek üzerine ¼’ü kadar %100(a/h) Trikloroasetik asit (TCA) eklenmiş ve sonrasında 3 saat boyunca 4°C’de bekletilmiştir. 14000 rpm’de 15 dakika santrifüj edilmiş ve süpernatant uzaklaştırılmıştır. Çökelti 2-3 defa 200 µL soğuk aseton ile yıkanmış ve 14000 rpm’de santrifüj edilmiştir. Elde edilen çökeltinin asetonu uçurulduktan sonra SDS örnek veya 2D rehidrasyon tamponunda çözdürülmüştür.
3.3.2.3. TCA-Aseton Çöktürme
Aseton içerisinde %20 (a/h) TCA çözeltisi hazırlandıktan sonra örnek üzerine -20°C’de soğutulmuş bu çözeltiden örnek miktarının 4 katı kadar eklenmiştir. Sonrasında -20°C’de 3 saat bekletilmiş ve 10 dakika 13000xg’de santrifüj edilmiştir. Süpernatant uzaklaştırıldıktan sonra 2 defa aseton ile yıkanmış ve elde edilen çökelti kurutulup SDS örnek veya 2D rehidrasyon tamponunda çözdürülmüştür.
3.3.2.4. Amonyum Sülfat Çöktürme
Örnek, amonyum sülfat ile %90’lik doygunluğa getirilmiştir. Çözelti 1 saat karıştırılarak 4°C’de bekletilmiş ve sonrasında 5000rpm’de 15 dakika santrifüj edilmiştir. Süpernatant uzaklaştırıldıktan sonra 2 defa aseton ile yıkanmış ve elde edilen çökelti kurutulup SDS örnek veya 2D rehidrasyon tamponunda çözdürülmüştür.
3.3.3. SDS-PAGE Yüklemesi
Tris, Acrylamid/Bis acrylamid, %10’luk SDS, Glisin, %10’luk Amonyum persülfat, kimyasallarından elektorforez taponu, buffer, alt ve üst jel hazırlanır. 3,8 ml alt jel dökülür, üzerini saf su ile tamamlayıp 40 dk kadar donması beklenir. Donduktan sonra su dökülerek üst jel dökülür, hemen (hava kabarcığı oluşmayacak şekilde) tarak takılır. Donduktan sonra
18
tarak çıkarılır. Hemen kullanılmayacak olan jel birkaç gün tampon içinde +4 ℃ de saklanır. Tarakların 15’lik-10’luuk boturlarına göre yükleme miktarı 20 ile 30 µl arası değişmektedir. Kuyucuklara yükleme yapılır. 100 volt da 1,5 saat yürütülür. Süre sonunda Commansie Brillant Blue G250, asetik asit, metanol ile hazırlanmış boya çözeltisinde 1-1,5 saat arasında bekletilir. %30’luk metanol, %7’lik asetik asit ve saf su karışımı ile yıkanır, boyanın çıkması için 1 gece karışımda bekletilir. Görüntüleme cihazı ile jel fotoğrafları çekilir (Laemmli, 1970)
3.3.4. 2-D Jel Elektroforezi
6 M Üre, %2’lik SDS, 0.375 M Tris-HCL, %20’LİK Gliserol ve %2’lik DTT kullanılarak eqeilibration 1 bufferı hazırlanır. DTT hariç diğer kimyasallar ile Equilibration 2 bufferı hazırlanır. Strip pH:4 – 7 arasında, mineral yağ, blotting filter papers, yıkama solüsyonu ( %40 lık metanol, %10’luk asetik asit), saf su. Protein ekstratı buffer ile muamele edildikten sonra plaka içine dökülerek üzerine strip konulur. Mineral yağı ile hava teması engellenerek protein ekstratını stripin emmesi sağlanır. Bufferlar uygulandıktan sonra 12 saatlik izoelektrik focuslamaya bırakılır. Cihazdan çıkarıldıktan sonra strip hazırlanmış olan SDS-PAGE jeline strip takılır. ( üst jel dökülmez ) 1,5 saatlik 100 volt da yürümeden sonra Commansie Brillant Blue R-250 ile 1 saat boyanmaya bırakılır. Bu işlemden sonra yıkama solüsyonu ile yıkanır, görüntülemeye alınır.
3.3.4.1. Elektroforez ile Ayırma
Sodyum dodesil sülfat-poliakrilamit jel elektroforezi (SDS-PAGE) (Laemmli, 1970) ve iki boyutlu elektroforez (2DE) tekniği kullanılmıştır. Çalışma, Mini Protean Tetra Cell ve Protean XL Cell (Biorad, ABD) sisteminde gerçekleştirilmiştir. Molekül ağırlığı 3-100 kDa aralığında olan marker proteinler (Thermo Fisher Scientific, ABD) kullanılmıştır. Elektroforez işlemi 150 V sabit voltaj altında gerçekleştirilmiş ve protein bantları Coomassie Blue ya da gümüş boyama tekniğiyle tespit edilmiştir (Blum ve ark., 1987).
19 3.3.4.2. İki Boyutlu Elektroforez (2DE)
200µL örnek 3-10 IPG şeritlere yüklenerek gece boyunca pasif veya aktif rehidrasyon yapılmıştır. İzoelektrik odaklama (IEF) Protean(R) i12(tm) IEF sistemi (Bio-Rad) ile 250V, 20 dakika lineer atlama; 8000V, 150 dakika lineer atlama ve toplamda 20000Vsa için 8000V olarak gerçekleştirilmiştir. Odaklama bittikten sonra şerit 20 dakika dengeleme tamponu1’de ve 30 dakikada dengeleme tamponu2’de bekletilmiştir. Daha sonra 150V’ta dikey elektroforez gerçekleştirilmiştir. Boyama işlemleri Coomassie Blue ya da gümüş boyama tekniğiyle gerçekleştirilmiştir (Blum ve ark., 1987).
3.3.5. Kütle Spektrofotometri Analizi
Kütle spektrofotometri analizi için örnekler %20 TCA-aseton çökeltmesi yöntemiyle çöktürülüp analiz için gönderilmiştir. Analizler nanoHPLC-ESI-MS/MS kütle spektrofotometrisi yöntemiyle analiz edilmiştir (Pal, 2006). Elde edilen veriler Mascot arama motoru (http://www.matrixscience.com) ve NCBI (National Center for Biotechnology Information) veri bankası kullanılarak protein tahminleri yapılmıştır. LFQ (Label Free Quantification-işaretlemesiz kuantifikasyon) analizi MaxQuant yazılımı (http://maxquant.org/) kullanılarak gerçekleştirilmiştir.
20 4. BULGULAR VE TARTIŞMA
Çalışmada Aspergillus terreus dan elde edilen hücre dışı protein özütleri kullanılmıştır. bu özütlere derişimini belirlemek için protein miktar tayini yapılmıştır. SDS-PAGE de yürütülerek görüntüler elde edilmiştir. Görülen sonuçlar neticesinde farklı çöktürme metodları uygulanmış ve SDS-PAGE de elde edilen sonuçlara göre iki boyutlu jel elektroforezi yapılmıştır.
4.1. Proteom Analizleri
Aspergillus terreus’un, hücre dışı proteinlerinin ham özütleri elde edilmiş. Ve bu özütlere farklı çöktürme metodları uygulanarak bant ve görüntü kalitesi kıyaslamaları yapılmıştır (Şekil 4.1’de).
Batık ve katı kültürlerden elde edilen protein örneklerinin derişimlerinin çok düşük olması sebebiyle ham örneklerin SDS-PAGE üzerinde yürütülüp Coomassie mavisiyle boyanması Şekil 4.1. Farklı kültür ortamlarından ham ve çöktürme uygulanan örneklerin SDS-PAGE görüntüleri a=2-ksilan, 3-glikoz, 4-mısır koçanı, 6-ksilan A.S.Ç, 7-glikoz A.S.Ç, 8-mısır koçanı A.S.Ç, 10-marker (A.S.Ç= amonyum sülfat çöktürme) b =2-ksilan TCA, 3-glikoz TCA, 4-mısır koçanı TCA, 6-ksilan aseton, 7-glikoz aseton, 8-mısır koçanı aseton, 10-marker (aseton ve tca çöktürme)
21
sonucunda jel üzerinde bant gözlemlenememiştir. Dolayısıyla protein ve proteomik çalışmalarında en çok kullanılan protein çöktürme/derişim yöntemleri denenmiştir. Bunlar aseton çöktürme, trikloraasetik asit (TCA) çöktürme, TCA-aseton çöktürme, amonyum sülfat çöktürme ve membran filtrasyon metodlarıdır. Bu yöntemler kütle spektrometri (MS) analizlerinde sorun oluşturmadıkları bilinen protokollerdir. Bunlar arasında proteinin (özellikle enzim çalışılıyorsa) aktivitesini muhafaza etmesi isteniyorsa amonyum sülfat çöktürme yöntemi tercih edilmekte, diğerleri ise özellikle proteomiks çalışmalarında kullanılan metodlar olarak karşımıza çıkmaktadır. Bu sebeple, öncelikle bu metodlar elde edilen değişik örnekler üzerinde uygulanmış ve ilk aşamada SDS-PAGE üzerinde daha hassas bir boyama metodu olan gümüş boyama yöntemi ile gözlemlenmiştir (Şekil 4.1).
Şekil 4.1. ‘de 2, 3 ve 4. kuyucuklarda sırasıyla ksilan, glikoz ve mısır koçanının batık kültür ham proteinlerine ait bantlar gözlemlenmektedir. Aynı şeklin 6,7 ve 8. kuyucuklarında aynı örneklere ait amonyum sülfat çöktürmesi sonunda elde edilen örnekler yürütülmüştür. Şekil 2.’de ise 2, 3 ve 4. kuyucuklarda TCA, 6, 7 ve 8. kuyucuklarda ise aseton çöktürmesine ait örnekler gösterilmektedir. Jel boyama işlemleri gümüş boyama metoduyla gerçekleştirilmiştir. Gözlemlendiği gibi aseton ve TCA çöktürme metodları protein çöktürme aşamasında amonyum sülfat çöktürmeden daha iyi sonuç vermiştir. Bunun yanında aseton çöktürme sonucu elde edilen bantlar daha net olmakla birlikte, TCA çöktürme sonucu daha fazla ve daha yoğun bantlar gözlemlenmiştir. Bunlara ek olarak glikoz, ksilan ve batık kültür ortamlarının SDS-PAGE protein profilleri farklılıklar göstermektedir. Ksilan ve batık kültür ortamlarına ait bant profillerinin glikoz ortamına ait profile kıyasla daha fazla benzerlik içerdiği de yine tespit edilmiştir.
Bu çalışmalar üzerine yürütülen 2D elektroforez jellerinde gümüş boyama sonrası istenilen netlikte noktalar (spot) elde edilememiştir (Şekil 4.2 ve 4.3).
22
2D elektroforez sonrası glikozlu ortamda ve batık kültür ortamında protein noktaları belirgin olsa da, katı kültür ortamında protein noktaları gözlemlenmemiştir. Bu yüzden proteom analizleri dogrudan nanoHPLC-ESI-MS/MS analizi ile gerçekleştirilmiştir. Bu yöntem tüm proteomun tek seferde analizinin gerçekleştirilmesini sağlamanın yanında, analizler sonrasında bağıl kantitaf analizlerin gerçekleştirilmesine olanak sağlamaktadır. Bu sayede üretilen proteinlerin miktar kıyaslamasına da olanak sunmaktadır.
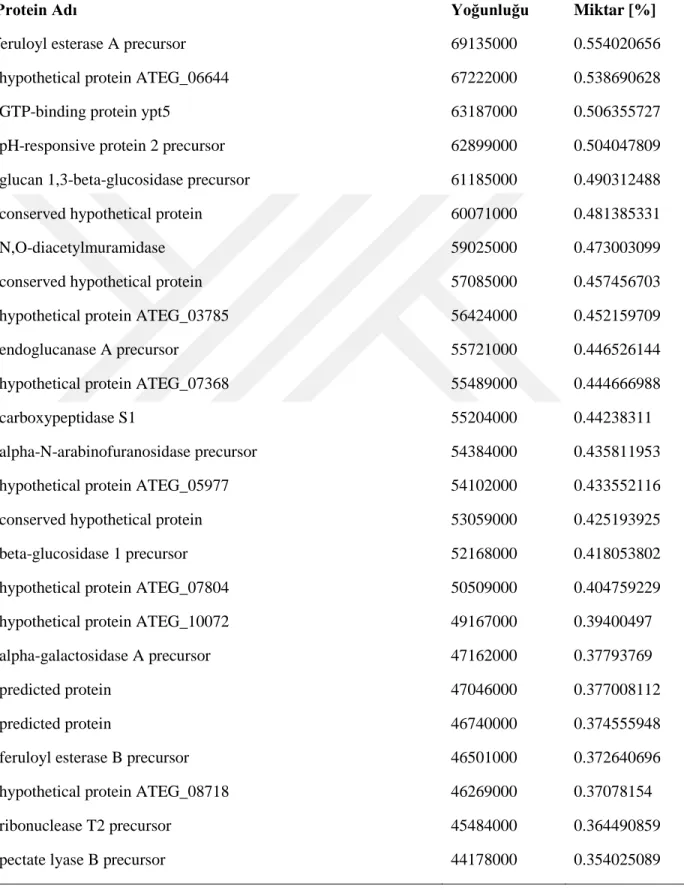
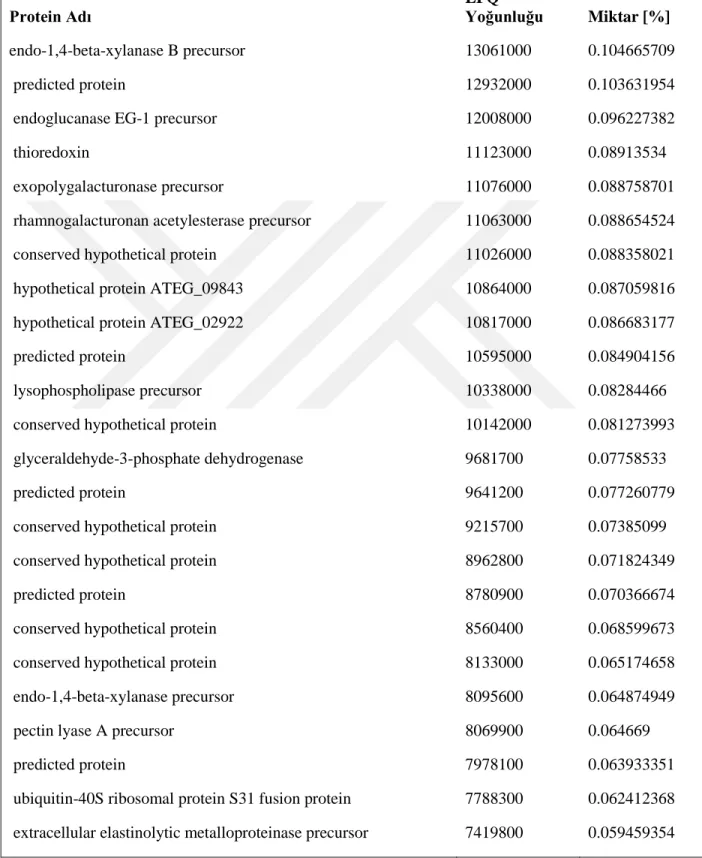
Kütle spektrofotometri analizleri sonrası elde edilen verilerin Mascot arama motorunda analizleri NCBI veri bankası Aspergillus terreus NIH2624 genom sekansı ve annotasyonları kullanılarak gerçekleştirilmiştir. Batık kültür ortamına ait toplam da 53 protein (Tablo 4, 4.1.1 ve 4.1.2) ve katı kültür ortamına ait 190 protein (Tablo 4.2, 4.2.1, 4.2.2, 4.2.3, 4.2.4, 4.2.5, 4.2.6 ve 4.2.7) tespit edilmiştir.
Şekil 4.2. 2D elektroforez görüntüleri (a) ksilanlı kültür (b) batık kültür
Şekil 4.3. İki farklı kültüre ve farklı karbon kaynağındaki örneğin 2-DE görüntüsü ( Sırasıyla glikoz ve mısır koçanlı batık kültür-mısır koçanı katı kültür)
23 Tablo 4.1. Batık kültür ortamından tanımlanan proteinler Protein Adı
LFQ
Yoğunluğu Miktar [%]
endoglucanase I precursor 2399800000 41.71
hypothetical protein ATEG_00302 640760000 11.14
allergen Asp f 15 precursor 470830000 8.18
predicted protein 274340000 4.77
protein EPD1 precursor 271570000 4.72
acetylxylan esterase precursor 247660000 4.30
alpha-N-arabinofuranosidase precursor 174480000 3.03
glucoamylase precursor 160710000 2.79
conserved hypothetical protein 132830000 2.31
carboxypeptidase S1 124350000 2.16
lysophospholipase precursor 109270000 1.90
transcriptional repressor rco-1 98126000 1.71
polygalacturonase-4 precursor 96793000 1.68
hypothetical protein ATEG_00024 74308000 1.29
hypothetical protein ATEG_02150 72667000 1.26
N,O-diacetylmuramidase 60466000 1.05
endo-1,4-beta-xylanase B precursor 59278000 1.03
24
Tablo 4.1. Batık kültür ortamından tanımlanan proteinler (Devam)
Protein Adı
LFQ
Yoğunluğu Miktar [%]
endo-1,4-beta-xylanase A precursor 29275000 0.51
exoglucanase 1 precursor 25681000 0.45
serine-type carboxypeptidase F precursor 24656000 0.43
conserved hypothetical protein 17934000 0.31
conserved hypothetical protein 16549000 0.29
hypothetical protein ATEG_07125 15656000 0.27
mitochondrial 2-methylisocitrate lyase 14920000 0.26
hypothetical protein ATEG_04781 12306000 0.21
guanyl-specific ribonuclease T1 precursor 10798000 0.19
hypothetical protein ATEG_09830 9907400 0.17
conserved hypothetical protein 6414400 0.11
aspergillopepsin F precursor 6099000 0.11
hypothetical protein ATEG_09389 5285100 0.09
hypothetical protein ATEG_02202 4320800 0.08
predicted protein 4105700 0.07
hypothetical protein ATEG_05628 3255100 0.06
25
Tablo 4.1. Batık kültür ortamından tanımlanan proteinler (Devam)
Protein Adı
LFQ
Yoğunluğu Miktar [%]
predicted protein 3191700 0.06
hypothetical protein ATEG_10320 3119200 0.05
conserved hypothetical protein 3016700 0.05
predicted protein 2567100 0.04
predicted protein 2555200 0.04
endo-1,4-beta-xylanase A precursor 2423400 0.04
conserved hypothetical protein 2412300 0.04
eukaryotic translation initiation factor 2 gamma
subunit 2208600 0.04
predicted protein 1182400 0.02
conserved hypothetical protein 1061400 0.02
predicted protein 1021700 0.02
conserved hypothetical protein 0 0.00
uricase 0 0.00
predicted protein 0 0.00
glycolipid-anchored surface protein 5 precursor 0 0.00
predicted protein 0 0.00
predicted protein 0 0.00
26 Tablo 1.2 . Katı kültür ortamından tanımlanan proteinler
Protein Adı LFQ Yoğunluğu Miktar [%]
hypothetical protein ATEG_00302 1482700000 11.88177373
24 kDa metalloproteinase precursor 818690000 6.560659159
conserved hypothetical protein 616150000 4.937583385
catalase B precursor 480530000 3.850778128
hypothetical protein ATEG_04781 436810000 3.500423271
hypothetical protein ATEG_00024 429410000 3.441122586
hypothetical protein ATEG_02150 401130000 3.214497806
serine-type carboxypeptidase F precursor 282870000 2.266808751
conserved hypothetical protein 270350000 2.166478403
conserved hypothetical protein 260450000 2.087143703
alpha-L-arabinofuranosidase precursor 256970000 2.059256354 exoglucanase 1 precursor 232830000 1.865807903 oryzin precursor 231540000 1.855470351 endoglucanase I precursor 187020000 1.498704609 exoglucanase 1 precursor 169240000 1.356222693 endochitinase 1 precursor 149380000 1.197072476 dipeptidyl-peptidase 5 precursor 147460000 1.181686352
conserved hypothetical protein 136360000 1.092735325
endo-1,4-beta-xylanase A precursor 134310000 1.076307432 mannosyl-oligosaccharide alpha-1,2-mannosidase precursor 128820000 1.032312735
predicted protein 122710000 0.983349602
27
Tablo 4.2. Katı kültür ortamından tanımlanan proteinler (Devam)
Protein Adı
LFQ
Yoğunluğu Miktar [%]
predicted protein 113760000 0.911627827
conserved hypothetical protein 113640000 0.910666195
allergen Asp f 15 precursor 112500000 0.901530684
hypothetical protein ATEG_05106 107880000 0.864507824
arabinan endo-1,5-alpha-L-arabinosidase A precursor 104070000 0.833975984
aspergillopepsin F precursor 100420000 0.804726322
hypothetical protein ATEG_09343 100140000 0.802482513
conserved hypothetical protein 99361000 0.796239913
superoxide dismutase 99273000 0.795534716
conserved hypothetical protein 94852000 0.760106564
predicted protein 91257000 0.73129765
beta-galactosidase precursor 90076000 0.721833581
endochitinase 1 precursor 89848000 0.720006479
hypothetical protein ATEG_05185 89665000 0.718539989
acetylxylan esterase precursor 87888000 0.704299811
endo-1,4-beta-xylanase 82995000 0.665089236
exoglucanase 2 precursor 82973000 0.664912937
endoglucanase I precursor 80425000 0.644494269
endochitinase 1 precursor 78729000 0.630903193
predicted protein 75885000 0.608112497
conserved hypothetical protein 74211000 0.594697721
hypothetical protein ATEG_00646 69775000 0.559149364
28
Tablo 4.2. Katı kültür ortamından tanımlanan proteinler (Devam)
Protein Adı
LFQ
Yoğunluğu Miktar [%]
feruloyl esterase A precursor 69135000 0.554020656
hypothetical protein ATEG_06644 67222000 0.538690628
GTP-binding protein ypt5 63187000 0.506355727
pH-responsive protein 2 precursor 62899000 0.504047809
glucan 1,3-beta-glucosidase precursor 61185000 0.490312488
conserved hypothetical protein 60071000 0.481385331
N,O-diacetylmuramidase 59025000 0.473003099
conserved hypothetical protein 57085000 0.457456703
hypothetical protein ATEG_03785 56424000 0.452159709
endoglucanase A precursor 55721000 0.446526144
hypothetical protein ATEG_07368 55489000 0.444666988
carboxypeptidase S1 55204000 0.44238311
alpha-N-arabinofuranosidase precursor 54384000 0.435811953
hypothetical protein ATEG_05977 54102000 0.433552116
conserved hypothetical protein 53059000 0.425193925
beta-glucosidase 1 precursor 52168000 0.418053802
hypothetical protein ATEG_07804 50509000 0.404759229
hypothetical protein ATEG_10072 49167000 0.39400497
alpha-galactosidase A precursor 47162000 0.37793769
predicted protein 47046000 0.377008112
predicted protein 46740000 0.374555948
feruloyl esterase B precursor 46501000 0.372640696
hypothetical protein ATEG_08718 46269000 0.37078154
ribonuclease T2 precursor 45484000 0.364490859
29
Tablo 4.2. Katı kültür ortamından tanımlanan proteinler (Devam)
Protein Adı
LFQ
Yoğunluğu Miktar [%]
pectin lyase A precursor 41776000 0.334776407
predicted protein 41487000 0.332460475
conserved hypothetical protein 38849000 0.311320583
predicted protein 35171000 0.281846539
hypothetical protein ATEG_07222 34766000 0.278601029
conserved hypothetical protein 32349000 0.259232143
exoglucanase 2 precursor 31406000 0.251675312
predicted protein 30887000 0.247516251
endoglucanase 3 precursor 30813000 0.246923244
rhamnogalacturonase B precursor 30430000 0.243854033
predicted protein 30264000 0.242523774
conserved hypothetical protein 29228000 0.234221678
cerevisin precursor 28343000 0.227129637
predicted protein 26675000 0.213762942
predicted protein 26016000 0.208481976
conserved hypothetical protein 25344000 0.203096832
glucoamylase precursor 25343000 0.203088819
protein ycaC 24313000 0.194834805
conserved hypothetical protein 23883000 0.191388954
predicted protein 22712000 0.182005021
predicted protein 22279000 0.17853513
hypothetical protein ATEG_02590 21130000 0.169327496
hypothetical protein ATEG_04708 20868000 0.167227932
hypothetical protein ATEG_02657 20767000 0.166418557
30
Tablo 4.2. Katı kültür ortamından tanımlanan proteinler (Devam)
Protein Adı
LFQ
Yoğunluğu Miktar [%]
conserved hypothetical protein 20215000 0.161995047
endoglucanase EG-1 precursor 19478000 0.156089019
hypothetical protein ATEG_05472 19272000 0.154438216
3-isopropylmalate dehydrogenase B 19255000 0.154301985
conserved hypothetical protein 18845000 0.151016407
hypothetical protein ATEG_09406 18647000 0.149429713
hypothetical protein ATEG_09993 18511000 0.148339862
conserved hypothetical protein 17868000 0.143187113
beta-glucosidase 17635000 0.141319943
mitochondrial 2-methylisocitrate lyase 17276000 0.138443059
hypothetical protein ATEG_09990 17013000 0.13633548
vacuolar protease A precursor 16972000 0.136006922
hypothetical protein ATEG_01756 16501000 0.132232514
conserved hypothetical protein 15687000 0.125709439
aryl-alcohol dehydrogenase 15192000 0.121742704
conserved hypothetical protein 15190000 0.121726676
glycolipid-anchored surface protein 5 precursor 15071000 0.120773057 peptidyl-prolyl cis-trans isomerase, mitochondrial precursor 14333000 0.114859016
endoglucanase IV precursor 14134000 0.113264308
alpha-L-arabinofuranosidase precursor 13293000 0.106524866
protein EPD1 precursor 13240000 0.106100144
hypothetical protein ATEG_07125 13200000 0.1057796
31
Tablo 4.2. Katı kültür ortamından tanımlanan proteinler (Devam)
Protein Adı
LFQ
Yoğunluğu Miktar [%]
endo-1,4-beta-xylanase B precursor 13061000 0.104665709
predicted protein 12932000 0.103631954
endoglucanase EG-1 precursor 12008000 0.096227382
thioredoxin 11123000 0.08913534
exopolygalacturonase precursor 11076000 0.088758701
rhamnogalacturonan acetylesterase precursor 11063000 0.088654524
conserved hypothetical protein 11026000 0.088358021
hypothetical protein ATEG_09843 10864000 0.087059816
hypothetical protein ATEG_02922 10817000 0.086683177
predicted protein 10595000 0.084904156
lysophospholipase precursor 10338000 0.08284466
conserved hypothetical protein 10142000 0.081273993
glyceraldehyde-3-phosphate dehydrogenase 9681700 0.07758533
predicted protein 9641200 0.077260779
conserved hypothetical protein 9215700 0.07385099
conserved hypothetical protein 8962800 0.071824349
predicted protein 8780900 0.070366674
conserved hypothetical protein 8560400 0.068599673
conserved hypothetical protein 8133000 0.065174658
endo-1,4-beta-xylanase precursor 8095600 0.064874949
pectin lyase A precursor 8069900 0.064669
predicted protein 7978100 0.063933351
ubiquitin-40S ribosomal protein S31 fusion protein 7788300 0.062412368 extracellular elastinolytic metalloproteinase precursor 7419800 0.059459354
32
Tablo 4.2. Katı kültür ortamından tanımlanan proteinler (Devam)
Protein Adı
LFQ
Yoğunluğu Miktar [%]
conserved hypothetical protein 7145200 0.057258818
hypothetical protein ATEG_09389 7083400 0.056763577
conserved hypothetical protein 6983500 0.055963018
conserved hypothetical protein 6333300 0.050752571
predicted protein 6280500 0.050329453
predicted protein 6165100 0.049404683
microsomal dipeptidase precursor 5956700 0.047734647
conserved hypothetical protein 5776700 0.046292198
transketolase 1 5679900 0.045516481
guanyl-specific ribonuclease T1 precursor 5619400 0.045031658
hypothetical protein ATEG_00713 5466700 0.04380798
predicted protein 5283600 0.042340689
conserved hypothetical protein 4644000 0.037215187
predicted protein 4594000 0.036814506
nucleoside diphosphate kinase 4245200 0.034019361
hypothetical protein ATEG_08058 4203600 0.033685995
conserved hypothetical protein 4027700 0.032276401
malate synthase 3938200 0.031559183
conserved hypothetical protein 3793000 0.030395608
predicted protein 3768900 0.03020248
alpha-glucosidase precursor 3554200 0.028481959
conserved hypothetical protein 3551000 0.028456315
arabinan endo-1,5-alpha-L-arabinosidase A precursor 3496600 0.028020375
33
Tablo 4.2. Katı kültür ortamından tanımlanan proteinler (Devam)
Protein Adı
LFQ
Yoğunluğu Miktar [%]
predicted protein 3461900 0.027742303
hypothetical protein ATEG_09393 3430300 0.027489073
predicted protein 3415500 0.027370472
40S ribosomal protein S2 3408700 0.027315979
elongation factor 1-beta 3406300 0.027296746
hypothetical protein ATEG_10320 3320800 0.026611583
conserved hypothetical protein 3188200 0.025548979
conserved hypothetical protein 3142700 0.02518436
hypothetical protein ATEG_09079 3110600 0.024927123
hypothetical protein ATEG_10371 2939900 0.023559201
predicted protein 2915300 0.023362066
conserved hypothetical protein 2875400 0.023042323
nitrite reductase 2875000 0.023039117
conserved hypothetical protein 2567600 0.020575735
acid trehalase precursor 2537900 0.020337731
predicted protein 2452500 0.019653369
conserved hypothetical protein 2234500 0.017906403
hypothetical protein ATEG_03427 2015200 0.016149019
endoglucanase 3 precursor 1983300 0.015893385
conserved hypothetical protein 1920400 0.015389329
conserved hypothetical protein 1754900 0.014063077
predicted protein 1402400 0.011238281
hypothetical protein ATEG_04996 1378900 0.011049961
conserved hypothetical protein 1349000 0.010810355
34
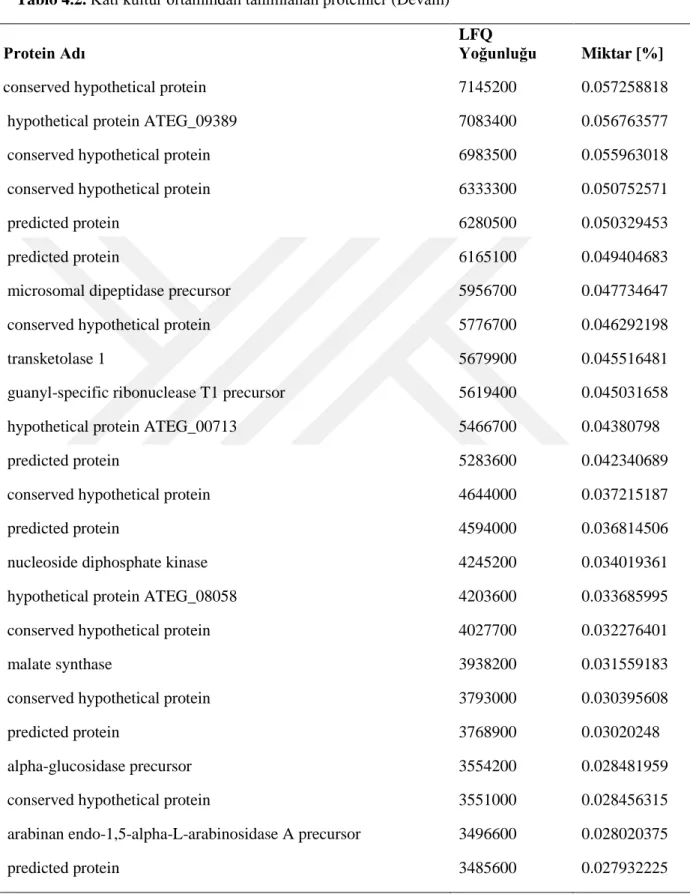
Lignoselülozik enzim dağılımlarını karşılaştırdığımızda, her iki kültür ortamında olan enzimler bağıl miktarlarıyla Tablo 5’de verilmiştir. Endoglukanaz üretimi batık kültürde toplam miktarın yaklaşık %40’ına denk gelmektedir. Bunun sebebi batık kültür ortamında hem ısı hem de çalkalama nedeniyle karbon kaynağının (lignoselülozik materyal) çözünmesi ve ortama daha fazla glikoz oligomerlerinin çıkması olabilir. Katı ortamda bu enzimin oranının çok düşük olması da bunun bir göstergesidir. Endoglukanazı hariç tuttuğumuzda batık kültür ortamına ait diğer lignoselülozik enzimlerin yüzdesi 13.48 olmaktadır. Katı kültürde bu oran %6’dır. Ancak burda kültürlerden elde edilen toplam yoğunlukları karşılaştırdığımızda, katı kültür örneklerindeki toplam yoğunluğun (12478776600) batık kültür örneklerindeki toplam yoğunluğun (5753736500) yaklaşık 2 katı olduğunu gözlemiş oluruz. Dolayısyla endoglukanazı hariç tuttuğumuzda diğer enzim miktarları toplamda birbirlerine yakındır. Ancak katı kültür örneklerinin analizinden elde edilen ve batık kültürde gözlemlenmemiş olan diğer proteinlere baktığımızda (Tablo 6), katı kültür ortamında lignoselülozik materyalleri parçalamaya yönelik daha fazla yardımcı enzimlerin üretildiğini gözlemlemekteyiz. Dolayısyla üretim amacına göre batık ve katı kültür ortam kullanmanın avantajları değişmektedir. Elde edilen sonuçlar katı kültürün küf için doğal bir ortam oluşturma noktasında daha uygun olduğunu göstermektedir. Dolayısıyla lignoselülozik materyallerin tamamen hidrolizine dayanan sistemlerde katı kültür ortamı daha uygun gözükmektedir. Ancak özel bir protein ya da belirli bir grup proteine yönelik üretimlerde batık kültür özellikle optimizasyon sonrasında daha fazla avantaj sağlayacaktır.
![Şekil 2.1. Aspergillus türleri üzerine yapılan proteomik çalışmalarının zaman çizelgesi [Ayrılan peptit sayısı/tanımlanmış peptit sayısı]](https://thumb-eu.123doks.com/thumbv2/9libnet/4585674.84506/24.918.159.716.137.313/aspergillus-türleri-üzerine-proteomik-çalışmalarının-çizelgesi-ayrılan-tanımlanmış.webp)