T.C.
SELÇUK ÜNĠVERSĠTESĠ FEN BĠLĠMLERĠ ENSTĠTÜSÜ
LĠPAZ ENZĠMĠNĠN AKTĠVĠTESĠ ÜZERĠNE
BAZI YÜZEY AKTĠF MADDELERĠNĠN ETKĠLERĠ
Filiz ESKĠ YÜKSEK LĠSANS Kimya Anabilim Dalı
Temmuz-2019 KONYA Her Hakkı Saklıdır
TEZ KABUL VE ONAYI
Filiz ESKĠ tarafından hazırlanan “Lipaz enziminin aktivitesi üzerine bazı yüzey aktif maddelerinin etkileri” adlı tez çalıĢması 05/08/2019 tarihinde aĢağıdaki jüri tarafından oy birliği ile Selçuk Üniversitesi Fen Bilimleri Enstitüsü Kimya Anabilim Dalı’nda YÜKSEK LĠSANS TEZĠ olarak kabul edilmiĢtir.
Jüri Üyeleri Ġmza
BaĢkan
Doç.Dr. Nuriye KOÇAK ………
DanıĢman
Prof. Dr. Elif ÖZYILMAZ ………...
Üye
Doç. Dr. Nuriye KOÇAK ………
Üye
Doç. Dr. Mustafa ġAHĠN ……….
Yukarıdaki sonucu onaylarım.
Prof. Dr. Mustafa YILMAZ FBE Müdürü
Bu tez çalıĢması Selçuk Üniversitesi Bilimsel AraĢtırma Projeleri Koordinatörlüğü tarafından 19201030 nolu proje ile desteklenmiĢtir.
TEZ BĠLDĠRĠMĠ
Bu tezdeki bütün bilgilerin etik davranıĢ ve akademik kurallar çerçevesinde elde edildiğini ve tez yazım kurallarına uygun olarak hazırlanan bu çalıĢmada bana ait olmayan her türlü ifade ve bilginin kaynağına eksiksiz atıf yapıldığını bildiririm.
DECLARATION PAGE
I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work.
Filiz ESKĠ
06.08.2019
iv
ÖZET YÜKSEK LĠSANS
LĠPAZ ENZĠMĠNĠN AKTĠVĠTESĠ ÜZERĠNE BAZI YÜZEY AKTĠF MADDELERĠNĠN ETKĠLERĠ
Filiz ESKĠ
Selçuk Üniversitesi Fen Bilimleri Enstitüsü Kimya Anabilim Dalı
DanıĢman: Prof. Dr. Elif ÖZYILMAZ 2019, 76 Sayfa
Jüri
Prof. Dr. Elif ÖZYILMAZ Doç. Dr. Nuriye KOÇAK Doç. Dr. Mustafa ġAHĠN
Yüzey aktif maddelerinin varlığı maksimum lipaz üretimi için önemli bir ön koĢuldur. Lipazların katalitik aktivitesi ara yüzey aktivasyonu ile yönetilmektedir. Ara yüzey aktivasyonu, lipit substratının bir emülsiyon halini almasıyla baĢlayan ve böylece enzimin iĢlev görmesi için ara yüzey sunan bir özelliktir. Yüzey aktif maddesinin ilavesi, reaksiyon ortamında bulunan organik ve sulu faz arasındaki yüzey gerilimini azaltmakta ve emülsifikasyon oranını arttırmaktadır.
Bu çalıĢmada, Candida rugosa lipazın hidrolitik aktivitesine katyonik, anyonik, zwitter iyonik, nötral ve halkalı, halkasız yüzey aktif maddelerin (Sodyum dodesil sülfat (SDS), sülfo kaliks[4]aren, p-sülfokaliks[8]aren, tetrabütil amonyumbromür (tBABr), kaliks[4]L-Prolin, L-Prolin, beta-Siklodekstrin (β-CD)) etkisi araĢtırıldı. En iyi sonuçlar p-sülfo kaliks[8]aren ve kaliks[4]L-Prolin yüzey aktif maddeleri ilavesinde bulundu.
v
ABSTRACT
MS THESIS
EFFECTS OF SOME SURFACTANTS ON THE ACTIVITY OF LIPASE
Filiz ESKĠ
THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCE OF SELÇUK UNIVERSITY
Advisor: Prof. Dr. Elif ÖZYILMAZ
2019, 76 Pages
Jury
Prof. Dr. Elif ÖZYILMAZ Doç. Dr. Nuriye KOÇAK Doç. Dr. Mustafa ġAHĠN
The presence of surfactants is an important prerequisite for maximum lipase production. The catalytic activity of lipases is mediated by interface activation. The interfacial activation is a feature that begins with an emulsion of the lipid substrate and thus provides an interface for the enzyme to function. Addition of surfactant reduces the surface tension between the organic and aqueous phase in the reaction medium and increases the emulsification rate.
In this study, the effect of cationic, anionic, zwitter ionic, neutral and cyclic, non-ring surfactants (Sodium dodecyl sulfate (SDS), p-sulfocalix[4]arene, p-sulfocalix[8]arene, tetrabutylammonium bromide (tBABr), calix[4] L-Proline, L-Proline, beta-Cyclodextrin (β-CD)) on the hydrolytic activity of Candida
rugosa lipase was investigated. The best results were found with the addition of p-sulfo calix[8]arene and
calix[4] L-Proline surfactants.
vi
ÖNSÖZ
Bu çalıĢma, Selçuk Üniversitesi Fen Fakültesi Biyokimya Bölümü öğretim üyelerinden Prof. Dr. Elif ÖZYILMAZ danıĢmanlığında yapılarak, Selçuk Üniversitesi Fen Bilimleri Enstitüsü’ne Yüksek Lisans Tezi olarak sunulmuĢtur.
Bu çalıĢma, Selçuk Üniversitesi Bilimsel AraĢtırma Projeleri koordinatörlüğü tarafından BAP 19201030 nolu Yüksek Lisans tez projesi olarak desteklenmiĢtir.
Ġlk olarak, tez konumun seçiminde, hazırlanmasında ve yürütülmesinde bana destek veren, beni yönlendirip yardımlarını eksik etmeyen saygı değer hocam Sayın Prof. Dr. Elif ÖZYILMAZ ve Prof. Dr. Mustafa YILMAZ’a teĢekkürlerimi sunarım.
ÇalıĢmalarım esnasında yardımlarını esirgemeyen laboratuvar arkadaĢlarım Doktora öğrencisi Özge ÇAĞLAR’a ve Yüksek lisans öğrencilerinden Ahmed Ibrahim ALHĠLALĠ, Sebahat AġÇIOĞLU, Muhammet Sami BĠLTEKĠN’e çok teĢekkür ederim.
Ayrıca bazı yüzey aktif maddelerimin sentezinde bana yardımcı olan Doktora öğrencisi Mehmet OĞUZ, Yüksek lisans öğrencilerinden AyĢe YILDIRIM ve Anise AZĠMĠ’ye çok teĢekkür ederim.
Tez çalıĢmam boyunca manevi desteğini esirgemeyen ve beni yetiĢtiren babam Hüseyin AĞDAġ’a, annem Hava AĞDAġ’a ve kardeĢlerime sonsuz teĢekkürlerimi sunarım. Son olarak hep yanımda olan ve beni destekleyen eĢim Burak ESKĠ’ye teĢekkür ederim.
Filiz ESKĠ KONYA-2019
vii
ĠÇĠNDEKĠLER
TEZ KABUL VE ONAYI ... v
TEZ BĠLDĠRĠMĠ ... vi ÖZET ... iv ABSTRACT ... v ÖNSÖZ ... vi ĠÇĠNDEKĠLER ... vii 1. GĠRĠġ………..1
1.1.Enzimler ve Genel Özellikleri………..……….1
1.1.1. Enzimlerin Adlandırılması ve Sınıflandırılması………...2
Oksidoredüktazlar ………...2 Dehidrojenazlar……….……....2 Oksidazlar………...2 Tranferazlar……….2 Hidrolazlar………..2 Liyazlar………...3 Ġzomerazlar………..3 Ligazlar………....3 1.1.2.Lipazlar………...…....3 1.1.2.1.Lipazların Özellikleri………...5 Optimum pH……….……...5
Optimum sıcaklık ve termal kararlılık……….5
Lipazın aktivasyon ve inhibisyonu………..5
Ġzoelektrik nokta (pI)……….………..6
Molekül kütlesi………....7
Enzim konsantrasyonu………...7
Substrat konsantrasyonu………...7
Aktivite………....8
Ara yüzey aktivasyonu……….8
Yüzey aktif maddelerin etkisi……….…...10
viii
Candida rugosa Lipaz (CRL)……… ………...11
1.1.2.3. Lipazların Endüstriyel Kullanım Alanları……….…...………12
Gıda endüstrisinde lipazlar………..………...14
Deterjan endüstrisinde lipazlar………...14
Ġlaç endüstrisinde lipazlar………..15
Kağıt hamuru ve kağıt endüstrisinde lipazlar………....15
Biyosensörler kullanımında lipazlar………..15
Tekstil endüstrisinde lipaz………..….…..16
1.2. Suda Çözünen Kaliksarenler……….……….……...16
2. KAYNAK ARAġTIRMASI………18
3. MATERYAL VE YÖNTEM………..……….…26
3.1. Enstrümental Teknikler………..….26
3.2. Farklı yapıdaki yüzey aktif maddelerin hazırlanıĢı………...26
3.3. Yüzey aktif maddelerin hazırlanıĢı………...28
3.4. Lipaz aktivitesine yüzey aktif maddelerin etkisinin hazırlanıĢı ve ölçümü……...29
3.5. Lipaz aktivitesinin tayini………..…..30
3.6. Enzim kinetiği……….……….…..30
4. ARAġTIRMA SONUÇLARI VE TARTIġMA……….31
4.1. Halkalı ve Halkalı Yapıda Olmayan Anyonik Yüzey Aktif Maddelerin Enzim Aktivitesine Etkisi………...31
4.1.1. Halkalı yapıda olmayan yüzey aktif madde (SDS) ……….…....32
4.1.2. Halkalı yapıda olan yüzey aktif madde (p-sulfo kaliks[4]aren)………….………..35
4.1.3. Halkalı yapıda olan yüzey aktif madde (p-sulfo kaliks[8]aren)………...39
4.2. Katyonik Yüzey Aktif Maddenin Sonuçları………….………..44
4.2.1. Tetra-bütil amonyum bromür (tBABr) ……….……….……….…..……..44
4.3. Zwitter iyonik Yüzey Aktif Maddelerin Sonuçları………...48
4.3.1. L-Prolin yüzey aktif maddesi………...48
4.3.2. Kaliks[4] L-Prolin türevinin etkisi………...50
4.4. Nötral Yüzey Aktif Maddenin Sonuçları………54
4.4.1. Beta-siklodekstrin (β-CD)………54
4.5. Enzim kinetiği çalıĢması………...55
5. SONUÇLAR VE ÖNERĠLER………....58
ix
x SĠMGELER VE KISALTMALAR Simgeler: g Gram mg Miligram n Mol M Molarite MA Molekül ağırlığı mL Mililitre mmol Milimol o Derece % Yüzde iĢareti kin Ġnaktivasyon sabiti t1/2 Yarılanma süresi Da Dalton kDa Kilodalton Kısaltmalar:
CRL Candida Rugosa lipaz
SDS Sodyum dodesil sülfonat PVA Poli vinil alkol
tBABr Tetra-bütil amonyum bromür
β-CD Beta siklodekstrin p-NPP p-nitrofenil palmitat
EN Erime noktası
IR Kızıl ötesi
UV Ultraviole visible spektroskopisi
KM Michaelis sabiti
VMak Maksimum hız
1. GĠRĠġ
1.1. Enzimler ve Genel Özellikleri
Enzimler, canlı sistemlerinde yer alan protein yapılı biyolojik katalizörlerdir. Kimyasal katalizörlerin aksine, prosesin enerji gereksinimi azaltarak düĢük sıcaklık ve basınçta (genellikle 20-40o
C, 1 atm), sulu çözeltilerde reaksiyonları katalizleme özelliğine sahiptirler. Optimum pH aralıkları genellikle 5-8’dir. Kimyasal katalizörlerde karĢılaĢılan bozulma, izomerizasyon, rasemizasyon ve yeniden düzenlenme gibi yan reaksiyonlar gözlenmemektedir. Biyokatalizörler, tepkimeleri kimyasal katalizörlere göre 108
-1010 kat daha hızlı katalizlerler. Kimyasal katalizörler genellikle % 0,1–10 deriĢim aralığında kullanılırken, biyokatalizörler aynı katalitik etkiyi 10-3
-10-4 deriĢiminde gösterebilirler (Tiryaki, 1993; Kennedy, 1995; Faber 2000; Bakkal, 2006).
Enzimler hem in vivo hem de in vitro Ģartlar altında etkinlik gösterebildiklerinden enzimlerin birçok alanda kullanımı sağlanmıĢtır. Ortalama son otuz yılda birçok sanayi dalında uygulama alanı bulan enzimler, günümüzde yeni kullanım alanlarının ortaya çıkmasıyla giderek önemi artmaktadır (Telefoncu, 1986). Enzimler baĢta gıda, eczacılık, deterjan, kozmetik ve tekstil olmak üzere birçok endüstri alanında yaygın olarak kullanılmaktadır (Jaeger, 1994; Jaeger, 1999; Pandey, 1999).
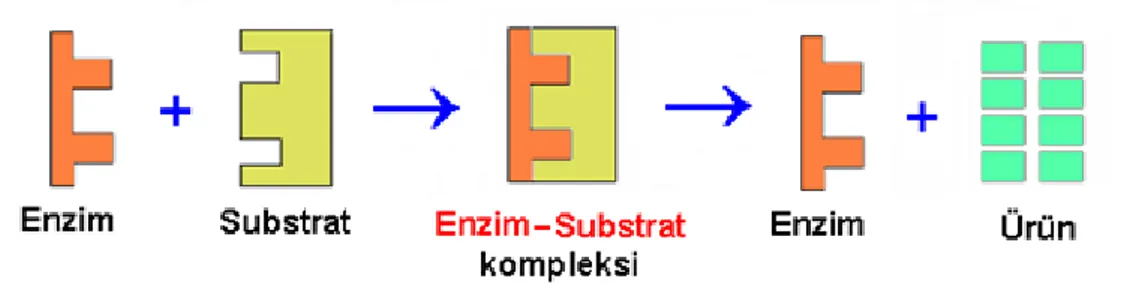
Enzimlerin etki ettiği maddeye substrat denir. Enzimin substratla bağlanan kısmına protein kısmı denir. Enzim ile substrat arasında anahtar-kilit yüzey uyumu vardır. Böylece enzimler tüm substratlara değil, sadece belirli substratlara etki ederler. Enzim substrata geçici olarak aktif merkezden bağlanarak enzim substrat kompleksi oluĢur. En son olarak ise substrat ürüne dönüĢürken, enzim serbest kalmaktadır (ġekil 1.1).
1.1.1. Enzimlerin Adlandırılması ve Sınıflandırılması
Günümüze kadar bilinen enzimlerin sayısı 4000’den fazladır. Enzimler aktif veya inaktif farklılıklarına göre isimlendirilir. Enzim aktif durumda ise substratın sonuna “ase=az” sözcüğü eklenerek ve katalizlediği reaksiyonun çeĢidine göre isimlendirilir. Örneğin, selülozu hidroliz eden enzim selülaz olarak isimlendirilir. Enzimlerin sayısının çok hızlı bir Ģekilde artması nedeniyle, enzimlerin sistematik adlandırılması ve sınıflandırılmasına gerek duyulmuĢtur. Günümüzde de kabul edilen adlandırma ve sınıflandırma sistemi Uluslararası Biyokimya Birliği (International Union of Biochemistry) tarafından 1964 yılında kabul edilmiĢtir. Her enzime adlandırma yanında bir de sistamatik kod numarası verilmiĢtir. Bu numara E.C. (Enzyme Code) harflerinden sonra gelen 4 rakamdan ibarettir (E.C.a.b.c.d).
a: enzim ana sınıfını (1-6) b: enzim 1. alt sınıfını c: enzim 2. alt sınıfını
d: enzimin 2. alt sınıf sıra numarasını göstermektedir.
Sonuç olarak enzimler 6 ana sınıfa ayrılır.
Oksidoredüktazlar
Redoks reaksiyonlarını yani oksidasyon-redüksiyon reaksiyonlarını katalize eden enzimlerdir. Bu tepkimeleri düzenleyen enzimler, iki gruba ayrılırlar;
Dehidrogenaz: Hidrojen taĢıyan ve aktaran enzimlerdir. Oksidazlar: Elektron kaybeden ve aktaran enzimlerdir.
Transferazlar
Hidrojen dıĢında bir atomun veya atom grubunun bir molekülden diğerine aktarılmasını sağlar. Örneğin, transaminaz, fosforilaz vb.
Hidrolazlar
Reaksiyona bir molekül su sokmak suretiyle moleküllerin yıkılmasını sağlayan enzimlerdir. Hidrolazlar ester, peptit, asitanhidrit ve glikozidik gibi bağlara etki etmektedir. Bu enzimler genellikle iki gruba C-N ve C-O bağlarına etki etmektedirler. C-N bağlarına etki eden enzimler proteazlar (proteolitik enzimler), C-O bağlarına etki eden enzimlerse esterazlar ve karbohidrazlar olarak isimlendirilir. Örneğin, lipazlar vb.
Liyazlar
Liyazlar, oksidasyon yapmadan ve su molekülü çıkarmadan, molekülleri
yıkan enzimlerdir. C-C, C-O, C-N ve C-S bağlarını kıran enzimlerdir. Örneğin, aldolazlar ve dekarboksilazlar gibi.
Ġzomerazlar
Ġzomerazlar molekül içinde değiĢiklik yaparak onun uzaysal yapısını değiĢtiren enzimlerdir. Örnek olarak, rasemaz, epimeraz gibi.
Ligazlar
Substrat moleküllerinin enerji kullanarak birbirine bağlanmasını sağlayan enzimlerdir. Örnek olarak; ATP: glukoz fosfotransferaz gibi.
1.1.2. Lipazlar
Lipazlar (E.C.3.1.1.3), trigliseritleri su-yağ arayüzlerinde hidroliz etme kabiliyetine sahip olan bir enzim türüdür. Bu tepkime tersinir olduğundan, lipazlar aynı zamanda gliserol ve serbest yağ asitlerinden açilgliserollerin oluĢumunu da katalizler (Alloue ve ark., 2007). Lipazlar bitkilerde, hayvanlarda ve mikroorganizmalarda bulunurlar (Candenas ve ark., 2001; Villeneuve ve ark., 2000; Aksoy, 2003). Lipazların
çoğu suda çözünür ve suda çözünmeyen substratlar üzerinde rol oynarlar (Beisson ve ark., 2000).
Lipazın yapısındaki en önemli pentapeptit GXSXG’dir. G: glisin, S: serin, X: herhangi bir aminoasiti gösterir. Bu sıra bütün lipazlarda bulunur. Diğer ortak özellik serin, aspartik asit ve histidin amino asitlerinin varlığında yaklaĢık 50 ayrı aminoasit ucu bulunur. Bu üçlüde serin pentapeptid bulunur (Brady ve ark., 1990; Svendsen, 1994). Aktif bölgelerine göre serin hidrolazlar olarak sınıflandırılırlar (Antonian, 1988).
Lipazlar çok çeĢitli reaksiyon ortamlarına dayanıklı olduklarından hem endüstride hem de biyoteknolojide en çok kullanılan biyokatalizörlerdir. Lipazlar organik çözücüler, iyonik sıvılar ve süperkritik akıĢkanlara uygulanabilirler. Esterlerin hidrolizi, esterleĢme ve transesterleĢme gibi birçok farklı tepkimeyi katalizleyen lipazlar, perhidroliz ve karbon-karbon bağı oluĢumu gibi daha karıĢık tepkimeleri de katalizleyebilirler (Garcia-Galan ve ark., 2014).
Lipazlara, biyoteknoloji araĢtırmalarında çok amaçlı kullanılabilirlikleri, çok çeĢitli substratları kullanabilme yeteneğine sahip olmaları, çok yüksek pH ve sıcaklık değerlerinde kararlılıkları, yan reaksiyonları önlemeleri, organik çözücülere karĢı yüksek kararlılık göstermeleri gibi birçok özellikleri nedeniyle her geçen gün talep artmaktadır. (Karaca, 2006; Paiva ve ark., 2000; Hung ve ark., 2003; Zaitsev ve ark., 2003; Villeneuve ve ark., 2000; AkkuĢ, 2006).
Bu enzimlerin geniĢ substrat özgüllüğü, enantiyo ve bölgesel seçiciliği gibi özellikleri lipazların enzim endüstrisinde büyümesinde etkili olmuĢtur. Ayrıca lipazların en önemli özelliklerinden biri de sulu ve susuz ara yüzeylerde reaksiyon göstermeleridir ve bu özellikleriyle de esterazlardan ayrılırlar.
BaĢta hidroliz olmak üzere esterifikasyon, transesterifikasyon, aminoliz ve asidoliz gibi birçok reaksiyonu katalizlerler ve spesifik reaksiyonlara seçicilik gösterirler (Zaitsev, 2003; Karaca, 2006) (ġekil 1.2).
1.1.2.1. Lipazların Özellikleri
Optimum pH
Enzimlerin en yüksek verimle çalıĢtığı pH değerine “Optimum pH” denir. Genellikle yüksek pH’ larda enzimler etkinliğini kaybederler. pH değiĢiklikleri ile amino asit zincirinin iyonik özelliği değiĢtiği için enzim denatürasyona uğrar ve katalitik aktivitesi kaybolur. Pepsin ve arginaz gibi istisnai enzimler dıĢında çoğu enzimlerin optimum pH değeri 4,5-8,5 aralığındadır. Yüksek pH’larda enzimlerin yapısında bulunan proteinlerin bozulmasından dolayı, enzim etkinliği geri dönüĢü olmaksızın düĢer (Fennema, 1985; Yilmaz, 2010). Çoğu lipazlar için optimum pH değeri 7,0 ile 8,0 arasında değiĢir. Mikrobiyolojik kaynaklı lipazlar ise pH 6,0-7,5 arasında yüksek kararlılığa sahiptirler (Fadıloglu, 1996; Yilmaz, 2010).
Optimum sıcaklık ve Termal kararlılık
Genellikle lipazların en yüksek aktivite gösterdiği sıcaklık değeri 30-40oC’dir.
Mantar ve bakteri gibi mikrobiyal lipazlar, hayvan ve bitki lipazlarına göre daha fazla kararlılık gösterirler (Fadıloglu, 1996).
Enzimler belirli bir sıcaklık derecesinde % 100 verimle çalıĢırlar. Her enzim için bu sıcaklık noktası farklılık göstermektedir. Enzimlerin maksimum aktivite gösterdiği sıcaklığa optimum sıcaklık denir.
Enzimler protein yapısında oldukları için optimum sıcaklığın üzerinde denatürasyona uğramaktadırlar. Bu da enzimin molekül yapısını etkiler ve enzimin aktif merkezi de etkilenerek, reaksiyonun tepkime hızını düĢürür.
Lipazın aktivasyon ve inhibisyonu
Lipaz aktivitesine, reaktiflerin ve iyonların etkileri incelenmesi sonucu, ağır metal iyonlarının lipaz aktivitesini inhibe ettiği, alkali metal iyonlarının ise artırdığı görülmüĢtür. Ca+2
iyonunun lipaz aktivitesine en etkili iyon olduğu görülmüĢtür (Öztürk, 2001; Yilmaz, 2010).
Co2+, Ni2+, Hg2+, Sn2+ nin bazı tuzları, boronik asitler ve
dietil-p-dinitrofenilfosfat gibi maddelerin, lipaz aktivitesini inhibe ettiği bulunmuĢtur (Akoh ve Min, 1998; Yilmaz, 2010).
Ġzoelektrik nokta (pI)
Ġzoelektrik nokta net yükü sıfır olan noktadır. Ġzoelektrik noktaya yakın proteinler suda daha az çözünürken, izoelektrik noktadan uzaklaĢtıkça suda daha fazla çözünürler. Bunun nedeni ise izoelektrik noktadan uzaklaĢıldıkça iyonlaĢmıĢ grupların sayısının artmasıdır. Ġzoelektrik nokta, proteinlerin çözünürlüğünü etkilediği enzim aktivitesi için çok önemlidir (Whellcuright, 1991; Yilmaz, 2010) (Çizelge 1.1).
Çizelge 1.1. Önemli aminoasitlerin izoelektrik noktaları (pI) Amino asit pKa1 pKa2 pKa3 pI
Glisin 2,34 9,60 ---- 5,97 Analin 2,34 9,69 ---- 6,00 Valin 2,32 9,62 ---- 5,96 Lösin 2,36 9,60 ---- 5,98 Ġsolösin 2,36 9,60 ---- 6,02 Prolin 1,99 10,60 ---- 6,30 Glutamin 2,17 9,13 ---- 5,65 Serin 2,21 9,15 ---- 5,68 Tirosin 2,20 9,11 ---- 5,66 Aspartik asit 1,88 9,60 3,65 2,77 Glutamik asit 2,19 9,67 4,25 3,22 Lisin 2,18 8,95 10,53 9,74 Histidin 1,82 9,17 6,00 7,59 Arginin 2,17 9,04 12,48 10,76
Molekül kütlesi
Farklı kaynaklardan elde edilen lipazların molekül kütleleri de farklılık gösterir. Bu lipazların molekül ağırlıkları genellikle 20,000 ile 60,000 Da arasında değiĢir. Pek çok enzim 30-40 kDa arasında molekül kütlesine sahip iken, Candida rugosa (CRL) ve Geotrichum candidum (GCL) gibi lipazlar yaklaĢık 60 kDa gibi yüksek molekül kütlesine sahiptir. Bazılarının molekül kütlesi ise çok yüksektir, bunun nedeni düĢük molekül kütleli protein moleküllerinin kendi kendisiyle birleĢmesi ile açıklanabilir. Bu tip lipazlara Candida cylindraceae örnek gösterilebilir. Candida cylindraceae’ın molekül kütlesi 120,000 Da’dır.
Enzim konsantrasyonu
Enzim substrat reaksiyonunun hızı, enzimin substrata doygun olduğu koĢullarda enzim konsantrasyonuna bağlı olarak doğrusal bir Ģekilde artar. Ortamda ne kadar çok enzim varsa yeterli substrat olduğu sürece reaksiyon da sürecektir.
Substrat konsantrasyonu
Enzim konsantrasyonu sabit tutularak substrat konsantrasyonuna bağlı olarak ulaĢılan maksimum hız noktası Vmak denir.
ġekil 1.3. Michaelis-Menten Grafiği
Grafikten Vmak/2’ye karĢılık gelen substrat konsantrasyonundan Km değeri
bulunur. Km değeri, aktif merkezin yarısını doldurmak için gerekli substrat
konsantrasyonudur ve her enzim için farklıdır.
Her enzimin Km’si kendine özgüdür. Bir enzimin Km değeri substratına bağlı
olabildiği gibi, ısı, pH, ortamdaki iyonların etkileri gibi çevre Ģartlarına da bağlıdır. Enzim için substrat konsantrasyonu çok önemlidir.
Ortamda çok fazla miktarda substrat bulunması, substrat moleküllerinin enzime bağlanmasını zorlaĢtırır. Enzimin aktivitesini azaltacağından analizlerde substrat konsantrasyon miktarına dikkat edilmelidir.
Aktivite
Birim zamanda dönüĢtürülen substratın mol sayısına enzim aktivitesi denir. Bir mikromol (1 µmol) substratı optimum Ģartlarda bir dakika süre ile ürüne çeviren enzim miktarıdır. Enzim birimi Unit = 1 µmol/dak.
Ara Yüzey Aktivasyonu
Lipazların doğal substratları su içerisinde çözünmez ve reaksiyon su-lipit ara yüzeyinde gerçekleĢir. Lipazların çoğunun katalitik etkinlik mekanizması X-ıĢını yapı araĢtırmaları ile “ara yüzeysel aktivasyon” olarak bilinir. Enzimin aktif bölgesi,
polipeptit zincirinin sarmal bölümü ile oluĢan bir “kapak” ile polar çözücülerden izole edildiği için, homojen ve sulu ortamda bu enzimler kapalı formda bulunurlar (Secundo ve ark., 2006; Mingarro ve ark., 1995). Bu kapağın iç tarafı aktif tarafın hidrofobik bölgesine karĢılık gelen apolar aminoasitlerden meydan gelmiĢtir.
Ancak, ikinci bir lipidik faz varlığında, lipaz ara yüzeyde adsorplanır. Kapak, konformasyonel değiĢikliğe uğrar ve bu durum enzimin hidrofobik kısmını açığa çıkarır. Böylece enzim substratla, non-polar çözücü ile etkileĢebilecek hale gelir (Palomo ve ark., 2005; Gonzalez-Navarro ve ark., 2001; Uyanık, 2011).
Lipazların katalitik merkezi (Ser-His-Asp/Glu) üçlü hidrofobik aminoasitlerden oluĢmuĢtur. Bu hidrofobik birimlerin çoğu lipazların lipid-su arayüzeyine tutunabilmelerini sağlarlar. Böylece lipid yüzeyinin hidrofobik kısmına enzimin nüfuz etmesini sağlarlar. Bir aktivasyon olduğunda enzimin kapağı kapalı formdan açık forma dönüĢür ve böylece aktif bölge substratın etkileĢebileceği bir hale gelir (Tekiner, 2011). Katalitik serin kalıntısı bir klasik pentapeptittir. Diğer klasik yapısal element amit NH gruplarından oluĢmuĢ oksianyon boĢluğudur. Bu boĢluk substrata yapılan nükleofilik saldırı sırasında oluĢan negatif yükleri kararlı kılan elektrofilik bir çevre sağlamaktadır (ġekil 1.4).
Yüzey Aktif Maddelerin Etkisi
Suda veya sulu bir çözeltide çözündüğünde yüzey gerilimini etkileyen (çoğunlukla azaltan) kimyasal bileĢiklerdir. Aynı zamanda yüzey aktif maddeler iki sıvı arasındaki yüzeyler arası gerilimi de etkiler. Su içerisinde yüzey aktif maddelerin en önemli özelliği polar gruplara ve uzun hidrokarbon zincirlerine sahip olmalarıdır.
Yüzey aktif maddeler, su tarafından çekilen (hidrofil) ve su tarafından itilen (hidrofob) olmak üzere iki grup molekülden meydana gelir. Yüzey aktif maddeler dört çeĢittir. Bunlar; anyonik, katyonik, nötral (noniyonik) ve zwitter (amfoterik) yüzey aktif maddelerdir.
Yüzey aktif maddelerin etkisi üzerine son literatürlerin çoğu enzim aktivitesi üzerinde, ara yüzlerde çalıĢan enzimlerle çalıĢılmaktadır (Rubingh, 1996). Yüzey aktif maddeler enzimlerin aktivitesini etkileyebilir ve enzime bağlanarak, esas yapısı olan sekonder, tersiyer yapısını, esnekliğini etkileyebilir ve böylece bir katalizör olarak çalıĢma kabiliyetini sürdürür.
Lipazlar ve fosfolipazlar bu durumunda, doğal substratlarda çözünmez ve arayüzeylerde iĢlev görürler. Yüzey aktif maddeler, aktif bölgeye yarıĢmalı bağlanma gibi spesifik enzim-yüzey aktif madde etkileĢimleri veya substratın bulunduğu ara yüze adsorpsiyon yoluyla aktiviteyi etkileyebilirler. CRL gibi bir kapağı olan lipazlar, ara yüzey aktivasyonunu gösterir. Yüzey aktif maddeler, kapağı açan ve CRL' ye eriĢim sağlayan enzimdeki konformasyonel değiĢiklikleri uyarırlar. Diğer taraftan, yüzey aktif maddeler enzimle etkileĢime girebilir ve bu etkileĢimler sonucu enzimin uçlarına bağlanarak kapalı formdaki durumlarını açık forma dönüĢtürmeleri sonucu aktivitesini maksimum düzeye çıkarabilirler.
Literatürde yüzey aktif madde kullanılarak yapılan enzim aktivite çalıĢmalarına çok az rastlanmıĢtır.
1.1.2.2. Lipazların Kaynakları
Lipaz kaynakları 5 gruba ayrılabilir. Bunlar; bakteriler, mantarlar, bitkiler, hayvanlar ve alglerdir. Mikrobiyal lipazlar ticari olarak diğer kaynaklardan daha önemlidir. Bunun sebebi mikrobiyal lipazların üretim maliyetlerinin ucuz ve yüksek kararlılığının olmasıdır. Bakteriyel lipazlar ise, hayvansal ve bitkisel kaynaklardan elde
edilen lipazlarla kıyaslandığında daha fazla çalıĢıldığı görülmüĢtür. ġekil 1.5’de endüstride kullanılan lipazların dağılımı verilmiĢtir (Öztürk, 2001).
ġekil 1.5. Endüstride kullanılan lipazların biyoçeĢitliliği
Candida rugosa Lipaz (CRL)
CRL, 31 aminoasitten oluĢan, Serin, Glutamin ve Histidin (Ser- His-Glu) katalitik üçlüye sahip bir kapağı olan aktif bölgeye sahiptir (Paiva ve ark., 2000; Bakkal, 2006; Benjamin ve Pandey, 1998). Bu kapak aktif bölgeyi temsil eder. Kapağın aktif bölgeye bakan yüzeyi hidrofobik, diğer yüzeyi ise hidrofiliktir (Tejo ve ark., 2004). Kapak açık ve kapalı olmak üzere iki farklı konformasyonda bulunabilir. Kapak kapalıyken 90° hareket ettiğinde açık forma gelir. Kapağın görevi enzimin aktif konumuna substrat giriĢini sağlamaktır (Secundo ve ark., 2003). Enzim kapalı konumda inaktif, açık konumda ise aktiftir.
Yaygın uygulama alanlarından dolayı CRL, yağ hidrolizinde, esterifikasyonda, transesterleĢmede ve enantiyoseçimli biyodönüĢümlerde çok önemli bir enzimdir (Santos ve Castro, 2006; Bezbradica ve ark., 2006; Ting ve ark., 2006). DüĢük maliyeti ve yüksek aktivitesinden dolayı sanayide en çok kullanılan enzimlerden biridir (Vakhlu ve ark., 2006; Bezbradica ve ark., 2006; Santos ve ark., 2008) (ġekil 1.6).
ġekil 1.6. Candida Rugosa Lipaz
1.1.2.3. Lipazların Endüstriyel Kullanım Alanları
Lipazların endüstride pek çok alanda kullanıldıklarından dolayı gün geçtikçe önemi artmaktadır. Günümüzde yaklaĢık olarak 4000 enzim bilinmekte olup, bunlardan 200’ü ticari olarak kullanılmaktadır (Sharma ve ark., 2001). Bu ticari enzimler içerisinde % 3 pazar payına sahip olan (Telefoncu, 1997) lipazlar, biyokatalizörler içerisinde önemli bir yer almakta ve biyoteknolojik uygulamalarda yüksek oranda kullanılmaktadırlar (Ghosh ve ark., 1996; Benjamin ve Pandey, 1998). Bakteriyel lipazların keĢfedilmesine kadar, ticari uygulamalarda mantarların, lipazların eldesinde en uygun aday oldukları düĢünülüyordu. Pek çok mikrobiyal lipaz, Novozyme (Danimarka), Amano Enzim ġirketi (Japonya), Biocatalysts (Ukrayna), Unilever (Hollanda) ve Genencor (ABD) gibi dünyadaki popüler enzim üreticileri tarafından ticarete dökülmektedir.
Lipazlar çeĢitli uygulamaları olan önemli biyokatalizörlerdir. Lipazlar, hem sulu hem de susuz çözücü ortamlarında aktivite gösterdikleri için (Gupta ve ark., 2004; Nie ve ark., 2006), tıp ve endüstride çok önemlidirler (Bjokling ve ark., 1991). Bu enzimlerin lipit içeren atık suların enzimatik degradasyonu, deterjan formülasyonu, organik sentez, oleokimyasal endüstri, kağıt yapımı, biyosurfektanların sentezi, süt endüstrisi, besin, kozmetik, kimyasal analiz ve ilaç prosesinde çok sayıda uygulama alanları vardır (Sharma ve ark., 2001; Ghosh ve ark., 1996) (Çizelge 1.2).
Çizelge 1.2. Mikrobiyal lipazların endüstriyel uygulamaları
ENDÜSTRĠ ALANI REAKSĠYON ÜRÜN UYGULAMA
ALANI
Süt Süt, yağ ve peynir hidrolizi
Peynir ve tereyağı aroması
Ġçecekler Aroma arttırıcı Alkollü içkiler Sağlıklı Yiyecekler Transesterifikasyon Sağlıklı Yiyecekler
Et ve balık Aroma arttırıcı Yağı uzaklaĢtırılmıĢ et ve balık ürünleri Katı ve sıvı yağlar Transesterifikasyon
Hidroliz
Kakao yağı, margarin Gliserol, mono ve
digliseritler Kozmetik Esterifikasyon Deri ve güneĢ kremleri,
güneĢ yağları Temizlik Biyoparçalayıcı suĢları
azaltmada
Giyeceklerin temizliği
Zirai Kimyasallar Esterifikasyon Herbisitler
Farmasötikler Alkollerin hidrolizi Ġlaç yapımında kullanılan ara ürünlerin üretimi Petrol Endüstrisi Transesterifikasyon Biyodizel üretimi Kirlilik kontrolü Hidroliz ve yağların
transesterifikasyonu Zararlı suĢların uzaklaĢtırılması ve atık yağların hidrolizi
Gıda endüstrisinde lipazlar
Lipazlar gıda endüstrisinde birçok kullanıma sahiptirler. Mandıra ürünlerinde güzel koku oluĢturmasında, tereyağına aroma kazandırma iĢleminde (Yılmaz, 2010), Ġtalyan peynirlerinde iĢlenmiĢ küflü peynirde tat iyileĢtirme ve tat oluĢturma gibi iĢlemlerde, içki sanayinde de katkı maddesi, et ve balık ürünlerinden yağların uzaklaĢtırılması gibi iĢlemlerde yardımcı olarak (Kazlauskas ve ark., 1998; Kumar ve ark., 2005), kullanılmaktadır.
Lipazlar, gliseritde ki yağ asidi zincirlerinin konumunu değiĢtirerek lipidlerin özelliklerinin değiĢtirilmesine izin vermektedir. Bu Ģekilde, daha ucuz ve daha yüksek değerde bir yağa dönüĢtürülebilmektedir (Colman ve Macrae, 1980; Pabai ve ark., 1995 a,b; Undurraga ve ark., 2001).
Kakao yağı, palmitik ve stearik asitleri içerir; erime noktası yaklaĢık 37 °C’dir. Kakao yağının ağızda erimesi çikolata gibi ürünlerde istenen bir özelliktir. Hidroliz ve sentez reaksiyonlarını içeren lipaza-dayalı teknoloji, kakao yağına geliĢtirmek için kullanılmaktadır (Colman ve Macrae, 1980; Undurraga ve ark., 2001).
Deterjan endüstrisinde lipazlar
Kıyafetlerimizi kirleten unsurların en önemli nedenleri yağlar, proteinler ve niĢastadır. Bu lekeleri yüksek sıcaklıkta kimyasal deterjanlar ile gidermek mümkündür. Fakat enzimler sayesinde enerji minumum seviyeye indirebilir. Ayrıca çimen, kan ve süt lekerini çıkarmada biyolojik olmayan deterjanlar ile karĢılaĢtırıldığında çok daha etkili olduğu bulunmuĢtur (Kıran ve ark., 2006). Deterjan yapımında enzim kullanımı, endüstriyel alanda artmıĢtır. YaklaĢık 1000 ton lipaz her yıl 13 milyon ton deterjan üretiminde kullanılmaktadır (Sharma ve ark., 2002).
Lipazların, yağları hidrolizleme yeteneklerinden dolayı, endüstriyel çamaĢırhane ve ev deterjanlarında katkı maddesi olarak önemli bir kullanıma sahiptir. Deterjanlarda lipazlar özellikle aĢağıdaki Ģartları sağladıkları için seçilmektedir:
1. DüĢük bir substrat spesifitesi yani yağları çeĢitli bileĢimlerinden
hidroliz edebilme yetenekleri;
3. Çoğu deterjan formülasyonunda önemli bileĢenler olan bozucu yüzey
aktif maddelerine ve enzimlere (örneğin, lineer alkil benzen sülfonatlar (LAS) ve proteazlar) dayanabilme yetenekleridir.
Gerritse ve ark. (1998), Pseudomonas alcaligenes M–1 tarafından üretilen alkalen lipazın modern bir yıkama makinesinin Ģartları altında yağlı lekeleri çıkarmada uygun olduğunu bildirmiĢtir. Patent literatürü birçok mikrobiyal lipazın deterjanlarda kullanıma uygun olduğunu söyleyen örnekler içermektedir (Sharma ve ark., 2001).
Ġlaç endüstrisinde lipazlar
Ġlaç endüstrisinin en büyük amaçlarından biri biyoaktif bileĢikler yapmaktır. Candida rugosa lipazlar çok önemli ilaçların üretiminde sentetik reaksiyonları katalizleme yeteneğine de sahiptirler (Benjamin ve Pandey, 1998). Antibiyotikler, ilaç ara ürünleri, biyokimyasal inhibitörler, sekonder alkoller ve alkoloidlerin enantiyoseçimli sentezi için ve optik olarak aktif steroidal olmayan anti-inflammatör ilaçların hazırlanmasında lipazlardan faydalanılır.
Kağıt hamuru ve kağıt endüstrisinde lipazlar
Kağıt yapımında ziftin hamurdan uzaklaĢtırılması için lipaz enzimi kullanılmaktadır. Japonlar kâğıt üretiminde odun triaçilgliserolllerin % 90’dan fazlasını hidroliz etmek için Candida rugosa lipaz kullanmıĢlardır (Jeager, 1998; Sharma ve ark., 2001). Katran, kağıt hamuru ve kağıt üretiminde ciddi sorunlara sebep olduğu için kağıt hamurundan katranı ayırmakta lipaz kullanılır.
Lipazların biyosensörler olarak kullanımı
Doğada yağ bağlayıcı proteinlerin analitik ölçümlerini, kimyasal veya biyokimyasal olabilen biyosensörler tarafından mümkündür hatta, bakteriyel lipazlar biyosensör olarak kullanılmaktadır. Bu tür biyosensörler, klinik örnekler ve gıdalardaki trigliseridleri belirlemek için, pestisit kontaminasyonu gibi kirlilik analizlerinde ve ilaç endüstrisinde kullanılmaktadır (Pandey ve ark., 1999). Huang ve ark. (2001),
cam-elektrotlu lipaz bağlı bir biyosensör üretmek için lipazı mikro-emülsiyon yapılı bir jele immobilize etmiĢtir. Setzu ve ark. (2007), orta gözenekli bir silika matrisin üzerine immobilize ettikleri lipazı kullanarak potansiyometrik bir biyosensör üretmiĢtir.
Tekstil endüstrisinde lipaz
Tekstil endüstrisinde, kumaĢların boyanırken parlak olması için istenmeyen maddelerin uzaklaĢtırılmasında lipaz, proteaz, amilaz ve selülaz gibi enzimler kullanılır.
Polietilen terftalat (PET) dokumaları, sağlam ve buruĢmaya dayanıklı olmalarıyla bilinmektedir. Hidrofobik karakterlerinden dolayı boyanabilirliklerinin olmayıĢı istenmeyen özelliğidir. Islaklık toplama özelliğinin arttırılmasına yönelik yapılacak bir giriĢim PET dokumalarını daha popüler yapacaktır. Kim ve Song (2006), Pseudomonas cepacia ve Pseudomonas fluorescens’den elde ettikleri lipaz enzimlerini kullanarak PET dokumalarının ıslaklık toplama özelliğini geliĢtirdikleri çevre dostu bir yöntem bulmuĢlardır (Sangeetha ve ark., 2011).
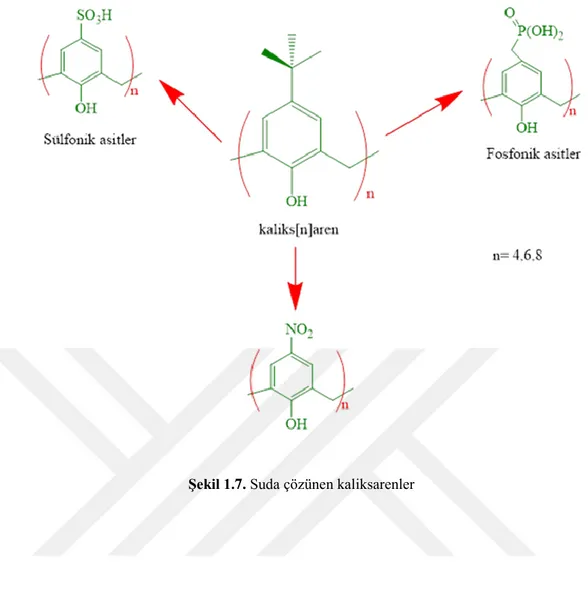
1.2. Suda Çözünen Kaliksarenler
Fenol formaldehitin uygun koĢullarda etkileĢtirilmesi ile sentezlenen kaliksarenler, halkalı yapıda olup, fenolik-O üzerinden ve fenolik birimlerin para kısmından sınırsız olarak fonksiyonlandırılabildiğinden oldukça çok sayıda araĢtırma sahası bulmuĢtur (Gutsche, 1990).
Kaliksaren moleküllerinin fenolik-O üzerinden veya fenolik birimlerin para konumundan primer amin grupları veya tetraalkilamonyum grupları gibi pozitif, fosfonat, karboksilat veya sülfonat grupları gibi negatif, polioksoetilen veya Ģeker gibi yüksek hidrofilik gruplara sahip nötral yapılarla fonksiyonlandırılmasıyla sudaki çözünürlüğünün artırılmaya çalıĢılmıĢtır.
Literatürlerden SO3-2, COO-, PO3-, SO2N(CH2CH2-OH)2, N+Me3 ya da
polietilenoksi zincirleri gibi hidrofilik grup içeren kaliksarenlerin suda çözündüğü bilinmektedir (Shinkai, 1984; Almi, 1989; Gutsche, 1988) (ġekil 1.7).
2. KAYNAK ARAġTIRMASI
Sulu çözeltilerinde lipaz enziminin katalitik özelliklerine, yüzey aktif maddelerin etkisiyle ilgili çok az çalıĢma bulunmaktadır.
Hoh ve arkadaĢları (1963), yaptıkları çalıĢmada deterjan ve köpük stabilizatörleri optimum koĢullarda denemiĢlerdir. ÇeĢitli hidrojen peroksit türevli sistemler amin oksidasyonunu araĢtırmıĢlardır. Bunlar sulu ve susuz ortamda hidrojen peroksit içerirler. Asidimetrik ve gaz kromatografisi yöntemleri kullanılmıĢtır. Tercih edilen reaksiyon oksidan olarak hidrojen peroksit kullanmıĢlar ve reaksiyon ortamı olarak su kullanmıĢlardır. Ürün reaksiyonu % 30-40' lık bir amin çözeltisidir.
Mosmuller ve Franssen (1993), polimerize edilebilir yüzey aktif maddelerden oluĢan veziküllere Candida cylindracea tutuklama yöntemiyle immobilize etmiĢlerdir. Lipaz-vezikül sistemi, aktivite ve stabilite açısından karakterize edilmiĢtir. Serbest enzim aktivitesine karĢı üç farklı trigliserit karĢılaĢtırılmıĢtır. Ayrıca, veziküllerin tripsin tarafından proteoliz için koruyucu etkisini ve yüzey aktif katkı maddeleri ile denatürasyonunu araĢtırmıĢlardır.
BaĢka bir çalıĢmada; Calvo ve arkadaĢları (1996), yaptıkları çalıĢmada sodyum dodesil sülfat (SDS) ve Triton X-100' ün Candida rugosa' dan elde edilen A ve B lipazlarının hidrolitik aktivitesi üzerindeki etkisi incelenmiĢtir. Lipaz B, her iki yüzey aktif maddenin var olması ile lipaz A' dan önemli ölçüde daha fazla etkilenir; Triton X-100, her iki izoenzim ile SDS' den daha zararlı bir etkisi vardır. Ayrıca, farklı konsantrasyonlarda SDS varlığında lipaz A ve B'nin kararlılığını araĢtırmıĢlardır. Lipaz A, izoform B'den daha kararlı bulunmuĢtur. Her iki izoenzim, amino gruplarının, oktanoil klorid veya aktive edilmiĢ polietilen glikol (PEG, mol.wt. 5000) ile reaksiyonu ile kimyasal olarak modifiye edilmiĢtir. Her durumda modifikasyon SDS ile denatürasyona karĢı koruyucu bir etki yaratmıĢtır. Özellikle, PEG5000-lipases A ve B önemli ölçüde daha kararlı bulunmuĢtur (Çizelge 2.1; 2.2).
Çizelge 2.1. SDS' nin Lipaz A' ya Etkisi Lipaz % 0,2 SDS % 0,5 SDS kin (h-1) t1/2(min) kin (h-1) t1/2(min) Lipaz A 2,70 15 4,55 9,0 C8- Lipaz A 2,30 18 2,45 17 PeG5000-Lipaz A 1,00 60 1,70 25
Çizelge 2.2. SDS' nin Lipaz B' ye Etkisi
Lipaz % 0,04 SDS % 0,2 SDS kin (h-1) t1/2(min) kin (h-1) t1/2(min) Lipaz B 2,60 16 >9,0 >5 C8- Lipaz B 1,55 27 >9,0 >5 PeG5000-Lipaz B 1,00 41 1,85 22
Diğer bir çalıĢmada; Brinchi ve arkadaĢları (1999), amin oksit yüzey aktif maddelerin bromit ve hidroksit iyonlarının metilnaftalin-2-sülfonat ile reaksiyonları üzerindeki etkilerini incelemiĢlerdir. Br2' nin metilnaftalin-2-sülfonat (MeONs) ile su
içindeki SN2 reaksiyonu, tetradesildialkil amin oksit (alkil 5 metil, n-propil) miselleri ile
hızlandırdığını bulmuĢlardır. Yüzey aktif maddelerin ve anyonik–katyonik iyonların etkisiyle pH ve kinetik parametrelerini ölçmüĢlerdir.
SDS ile yapılan farklı bir çalıĢmada Savelli ve arkadaĢları (2000) yaptıkları çalıĢmada, sodyum dodesil sülfat (SDS) yüzey aktif maddesi kullanılarak amfifilik enzim aktivitesi ve stabilite kontrolü ve sulu çözeltilerde kendi kendini organize eden sistemleri araĢtırmıĢlardır. SDS denatüre edici yüzey aktif madde olsa da bağlanma ve açılma kabiliyetine dayanmıĢtır ve pH değiĢimi, kinetik parametreleri incelenmiĢtir. Katyonik yüzey aktif madde kalıntıları olduğunda lizozim ile enzim arasında elektrostatik çekim olmuĢtur (pH 3,2 ile 9 arasında). Asidik kalıntıların iyonlaĢması ile negatif yük, enzimi kimyasal olarak denatüre etmiĢtir. Pepsinin çok yüksek negatif yükü SDS`ye bağlanmasını önleyebilir, diğer yandan pepsinojen SDS` yi kolaylıkla bağlanabildiğini bulmuĢtur.
SDS ile yapılan baĢka bir çalıĢmada; Baysal ve ark. (2005), Bacillus coagulans bakterisinden lipaz enzimini katı-faz fermantasyon tekniği ile üretip kavun
kabuğunu substrat olarak kullanmıĢlardır ve çeĢitli karektarizasyon çalıĢmaları yapmıĢlardır. % 2 oranında zeytinyağı, sodyum dodesil sülfat (SDS), niĢasta, amonyum nitrat, ve maltozun enzim üretimini arttırdığını bulmuĢlardır. Mn2+
, Ni2+ metal iyonları enzimi % 32 ve % 26 oranında inhibe ettiğini, Ca2+’nin ise % 105 oranında arttırdığını
araĢtırmıĢlardır.
Otero ve arkadaĢları (2005) yaptıkları çalıĢmada; polietilen glikol (PEG) ortamında Candida rugosa' dan koenzimin (lip1 ve lip3) aktivasyonunu araĢtırılmıĢlardır. Sulu PEG 8000 ve 20,000 çözeltileri, Candida rugosa 'dan lip3'ü etkinleĢtirdiği ancak lip1'i etkinleĢtirmediği ölçülmüĢtür. PEG 8000 ile (% 4, w/v). PEG, açık ve kapalı lip3 formları arasındaki dengeyi aktif konformasyona doğru kaydırır gibi göründüğünü bulmuĢlardır. Ġnhibisyon deneyleri, ligandların hem varlığında hem de lip1 aktif bölgeye kıyasla lip3 aktif bölgesine daha kolay eriĢebildiğini göstermiĢlerdir.
Yüzey aktif madde ile ilgili baĢka bir çalıĢmada Goracci ve arkadaĢları (2007), amin oksit yüzey aktif maddesini, hava/su ara yüzündeki moleküler yapı ve davranıĢ arasındaki iliĢkiyi araĢtırmak üzere kullanmıĢlardır. Bu çalıĢmada, suda çözünür bir yüzey aktif maddenin mono tabakalarının sıkıĢtırılıp sıkıĢtırılamayacağını belirleyen faktörler belirlemiĢlerdir ve pH' ın etkisi incelemiĢlerdir (ġekil 2.1).
ġekil 2.1. Kullanılan yüzey aktif maddeler
Biasutti ve arkadaĢları (2008), yaptıkları çalıĢmada sürfaktanların suda yağ içinde mikroemülsiyonlar (hidratlanmıĢ ters miseller) ve sulu çözeltilerin enzimatik prosesler üzerindeki etkisi, sürfaktanın iĢlemin kinetik parametreleri üzerindeki etkisine özel önem verilerek gözden geçirmiĢlerdir.
Dutta ve Ray (2009), yaptıkları çalıĢmada bozulmuĢ hindistan cevizinden izole ettikleri bakteriyel türü Bacillus cereus olarak tanımlamıĢ ve bu türün ısıya-dayanıklı alkalen hücre dıĢı lipaz üretmede yeterli olduğunu tespit etmiĢlerdir. Enzim substrat reaksiyonu için optimum sıcaklık 60°C, zaman 10 dakika, ve pH 8,0 olarak bulmuĢlardır. Triton X-100 ve setiltrimetilamonyum bromür hariç diğer yüzey aktif maddeleri, enzim aktivitesi üzerine bir etki göstermemiĢ ya da çok az etki gösterdiğini bulmuĢlardır.
BaĢka bir çalıĢmada Kanjanavas ve ark. (2010), ısıya dayanıklı Bacillus sp. türü RN2 (Lip-SBRN2) bakterisinden rekombinant lipaz enzimini izole ederek organik
çözücüler ve deterjanlara karĢı dayanıklılık özelliklerini karakterize etmeyi amaçlamıĢlardır. SaflaĢtırılan enzimin molekül kütlesi, SDS-PAGE ve jel filtrasyon kromatografisi sonucu 19 kDa olarak tespit edilmiĢtir. Lip-SBRN2 enziminin 9–11 pH
değerlerinde ve 45–60°C sıcaklıklarda kararlı olduğu belirlemiĢlerdir. Ayrıca, metalo olmayan monomerik bir protein yapısına sahip olduğu; pNP-kaprilat (C8), pNP-laurat
(C12) ve hindistan cevizi yağına karĢı aktif olduğunu gözlemlemiĢlerdir. Bunlara ek
olarak; %108 benzen, %102,4 dietileter ve %112 SDS varlığında Lip-SBRN2 yüksek
aktivite değerleri gösterdiğini bulmuĢlardır. Bacillus sp. türü RN2 tarafından salgılanan
organik çözücü ve deterjanlara dayanıklı enzimin, organik çözücüler ve deterjanlar varlığında gerçekleĢen reaksiyonlarda katalizör olarak kullanılabileceği bulmuĢlardır.
Sintra ve arkadaĢları (2014) yaptıkları çalıĢmada; süperaksiyon indüktörleri ve süper aktivite ile Ģimdiye kadar araĢtırılan enzimler ve reaksiyonlar olarak literatürde bildirilen yüzey aktif maddelerin etkileĢimlerini incelemiĢlerdir. Bu konunun anlaĢılmasına yardımcı olmak için farklı alanlardaki bilimsel toplulukları bir araya getirerek bu alandaki multidisipliner bir yaklaĢımın gerekliliğini vurgulamak ve bununla ilgili olarak geliĢtirilebilecek ve iyileĢtirilmesi gereken tepki ve süreçlerin türünü tanımlamıĢlardır. Potansiyel uygulamasını endüstriyel düzeyde hesaplamıĢlardır. Bu çalıĢma, misel sistemleri tarafından indüklenen enzim süper aktivitesine genel bir bakıĢ
sunduğu savunmuĢlar ve bu çalıĢmada çeĢitli koĢullar ve yapısal özellikler, yani farklı enzimler yüzey aktif cisimleri (sadece sentetik değil, aynı zamanda rhamnolipitler gibi biyolojik yüzey aktif maddeler) ve reaksiyonlar da ele alınmıĢtır (ġekil 2.2; ġekil 2.3; ġekil 2.4).
Hidrofobik Kuyruk Hidrofilik Uç
Anyonik (A) AOT Katyonik(B) CTAB Zwitter iyonik (C) MDAPS Ġyonik olmayan (D) Triton X-100
ġekil 2.2. Kullanılan yüzey aktif maddeler
ġekil 2.3. Yüzey aktif maddelerin moleküler etkileĢimi
Holmberg ve arkadaĢları (2018), yaptıkları çalıĢmada yüzey aktif maddelerinin enzimler için substrat olduğu enzim katalizli reaksiyonları araĢtırmıĢlardır. Ġncelemenin geri kalanı, yüzey aktif madde ve hidrolitik enzimler arasındaki, yüzey aktif madde reaksiyonda bir substrat olmaksızın, birleĢmesini bulmuĢturlar. Ġncelemede, yüzey aktif maddeler tarafından uygulanan etkinin farklı tipte enzimler arasında farklılık gösterdiğini belirtmiĢlerdir. Bununla birlikte, genel bir kural olarak, noniyonik sürfaktanlar, bir enzime anyonik ve katyonik sürfaktanlardan daha iyi sonuç verdiğini bulmuĢlardır. Ġyonik olmayan bir yüzey aktif madde, yalnızca hidrofobik etkileĢimler yoluyla enzime bağlanırken, iyonik bir yüzey aktif madde, elektrostatik çekim ve hidrofobik etkileĢimin bir kombinasyonu ile bağlandığını görmüĢlerdir. Bu ikinci bağlanma tipi kuvvetli olabilir ve genellikle kritik misel konsantrasyonunun çok altında, çok düĢük sürfaktan konsantrasyonlarında bile konformasyonel değiĢikliklere yol açtığını bulmuĢlardır.
Gabriele ve ark. (2018), Candida rugosa lipazın (CRL), hidrolitik aktivitesine iyonik (SDS, CTABr) ve zwitter iyonik (CB1-12, SB3-12, AOMe-12, AOMe-14, AOMe-16, pDoAO) yüzey aktif maddelerin etkisini incelemiĢlerdir. N-oksit yüzey akif maddeler CRL’ın katalitik özelliklerine etkisini ve moleküler yapısı arasındaki yapıları çalıĢmıĢlardır. Anyonik yüzey aktif maddelerin etkisiyle katyonik yüzey aktif maddeleri kıyaslamıĢ ve anyonik yüzey aktif maddelerin CRL aktivitesini daha çok artırdığı gözlemlemiĢtir. Zwitter iyonik yüzey aktif maddeleri kendi aralarında kıyaslamıĢtır. Anyonik yüzey aktif maddelerin enzim aktivitesine çok iyi etki ettiği bulunmuĢtur. SDS ' nin uzun alkil zincirinin olması enzimin amino asit uçlarıyla miselleĢme yaparak, CRL' yi açık forma dönüĢtürdüğü ve aktivitesini artırdığından bahsetmiĢtir. Yapılan litaratür çalıĢmasında anyonik ve zwitter iyonik yüzey aktif maddelerin enzim aktivitesinde iyi sonuçlar verdiğini göstermiĢtir (ġekil 2.5).
ġekil 2.5. Kullanılan yüzey aktif maddeler
Bu çalıĢmada; Gabriele ve arkadaĢlarının 2018 yılında yaptığı çalıĢma referans alınarak farklı yapıda katyonik, anyonik, zwitter iyonik, nötral ve halkalı halkasız yüzey aktif maddelerin lipaz enzim aktivitesi üzerine etkiler araĢtırılmıĢtır.
3. MATERYAL VE YÖNTEM
3.1. Enstrümental Teknikler
UV-Visible spektrofotometre (Shimadzu 1700) FTIR spektrometresi (Perkin ELMER 100) Soğutmalı santifüj (Sigma)
Soğutmalı inkübatör (Zhicheng) pH metre (Thermo)
Liyofilizatör (Labconco) Vakumlu etüv (Binder)
3.2. Farklı yapıdaki yüzey aktif maddelerin hazırlanıĢı
Bu çalıĢmada kullanılan yüzey aktif maddelerden kaliks[n]aren türevli bileĢikler (1-3) literatüre uygun olarak sentezlendi (Shinkai, 1987; Becker ve ark., 2008). Sentezlenen 1-3 numaralı bileĢikler ve satın alınan bileĢikler sırasıyla aĢağıda gösterilmiĢtir.
Sodyum dodesil sülfonat (SDS)
p-sulfo kaliks[4]aren (1)
ANYONĠK ANYONĠK
p-sulfo kaliks[8]aren (2)
tetrabütil amonyum bromür (tBABr)
L-prolin
Kaliks[4] L-prolinin karboksilik asit türevi (3)
ANYONĠK
KATYONĠK
ZWITTER
beta siklodekstrin (β-CD)
ġekil. 3.1. ÇalıĢmada kullanılan yüzey aktif maddeler
3.3. Yüzey aktif maddelerin hazırlanıĢı
Yüzey aktif maddeler 2 Ģekilde hazırlandı.
Yöntem 1. Stok çözelti olarak konsantrasyonu 10 mM olarak suda hazırlanıp pH 7’ ye
ayarlanır (zayıf bir asit ve baz ile) ve bu çözeltiden gerekli seyreltmeler yapılıp farklı konsantrasyonlarda (0,625 mM, 2,25 mM, 2,5 mM ve 5 mM) yüzey aktif madde çözeltisi elde edilir.
Yöntem 2. 10 mM konsantrasyonu olacak Ģekilde yüzey aktif madde hazırlanır ve CRL
ilave edilir. Böylece enzim yüzey aktif maddede çözülüp hazırlanmıĢ olunur.
3.4. Lipaz aktivitesine yüzey aktif maddelerin etkisinin hazırlanıĢı ve ölçümü
Bu çalıĢmada kullandığımız yüzey aktif maddelerin konstrasyonlarını 10 mM olarak hazırlayıp pH’ ları 7’ye ayarlanır (zayıf bir asit ve baz ile). 7 tane özdeĢ erlen alınarak numaralandırılır. Erlenlere sırasıyla 2' Ģer mL (1mg/1mL) 50 mM sodyum fosfat tamponunda hazırlanmıĢ CRL çözeltisi eklenir. 0. (Ģahit) erlene yüzey aktif madde eklenmeyip, diğerlerine sırasıyla 1, 2, 3, 4, 5, 6' Ģar mL hazırlanan yüzey aktif maddelerden eklenir. Toplam hacim 10 mL olacak Ģekilde saf su ilave edilir. Beherler 30°C' de 15 dk inkübatörde karıĢtırılır. Daha sonra tüplere 1' er mL alınır ve 3.5.’deki kısma göre lipaz aktivitesi ölçümleri yapılır.
3.5. Lipaz aktivitesinin tayini
1 mL, pH 7,0 fosfat tampon çözeltisi içerisinde bulunan serbest lipaz karıĢımına 14,4 mM’ lik p-NPP çözeltisinden 1 mL ilave edilerek oda sıcaklığında 5 dk karıĢtırılır. Daha sonra reaksiyonu durdurmak için 2 mL Na2CO3 (0,5 N) ilave edilir. KarıĢım 5 dk
santrifüj edilerek, açığa çıkan p-NPP’ nin 405 nm dalga boyundaki absorbansındaki enzimatik aktivite bulunur. ġekil 3.2’ deki kalibrasyon grafiğinden yerine konarak hesaplanır. 1 Unit (U), 1 dakikada 1 µmol p-NPP hidroliz etmek için gerekli olan lipaz miktarına denir (Hung ve ark., 2003; Chiou ve Wu, 2004).
ġekil 3.2. Standart p-NP (p-nitrofenol)- absorbans grafiği
3.6. Enzim Kinetiği
Aynı deney koĢulları altında, farklı p-NPP konsantrasyonlarında (5,0; 2,5; 1,25; 1,0; 0,5 ve 0,25 mM) serbest lipazın hidrolitik aktivitesi incelendi. Kinetik parametreleri hesaplayabilmek için Lineweaver-Burk grafiği çizilerek Michaelis-Menten sabitleri olan Km ve Vmak hesaplandı.
4. ARAġTIRMA SONUÇLARI VE TARTIġMA
4.1. Halkalı ve Halkalı Yapıda Olmayan Anyonik Yüzey Aktif Maddelerin Enzim Aktivitesine Etkisi
Anyonik yüzey aktif madde olarak sodyum dodesil sülfonat (SDS), p-sulfo kaliks[4]aren ve p-sulfo kaliks[8]aren kullanıldı (ġema 4.1).
ġema 4.1.
4.1.1. Halkalı yapıda olmayan yüzey aktif madde (SDS)
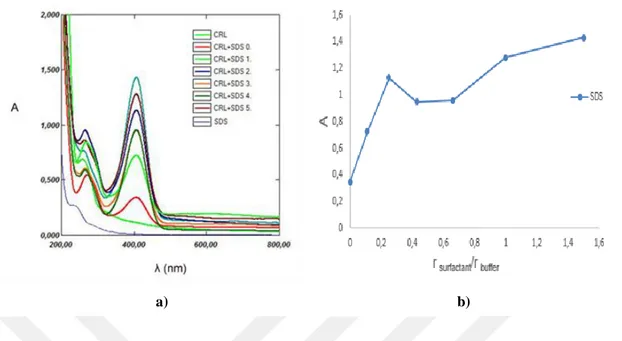
Bu çalıĢmada, farklı konsantrasyonlarda (0,625 mM, 1,25 mM, 2,5 mM, 5 mM)
SDS çözeltileri hazırlandı ve lipaz aktivitesinde kullanıldı. Farklı parametreler (pH, karıĢtırma süresi, konsantrasyon) incelendi. KarıĢtırma süresi olarak 5 dk, 15 dk ve 30 dk gibi farklı sürelerde etkileĢtirildi ve 15 dk’da maksimum enzim aktivitesi bulundu. Böylece tüm analizler 15 dk olarak alındı.
a) 0.625 mM b) 1,25 mM
c) 2,5 mM d) 5 mM
ġekil 4.2. Halkalı yapıda olmayan SDS’ nin farklı konsantrasyondaki enzim aktivite sonuçları (a-d, Yöntem 1’ göre, PBS kullanılarak yapılan)
Anyonik sodyum dodesil sülfonat (SDS), yüzey aktif maddesinin 0,625 mM ve 1.25 mM konsantrasyondaki sonuçlarına baktığımızda lipaz enzim aktivitesinin en yüksek değerleri bulundu (ġekil 4.2 a-b). 2,5 mM konsantrasyonda ise belirli bir hacimden sonra düĢüĢ gözlendi (4 mL). Daha sonraki eklemelerde azalarak sabitlendi (ġekil 4.2 c). Ancak 5 mM konsantrasyondaki sonuçlarına baktığımızda lipaz enzim aktivitesinin diğer konsantrasyonlara göre daha düĢük çıkmıĢtır (ġekil 4.2 d).
Alkil zincirinin uzunluğu ve anyonik ucun (sülfo grubu) küçük olması enzim aktivitesine daha iyi etkileĢim sağlamıĢtır. Ayrıca alkil zincirinin uzunluğu misel oluĢturmayı kolaylaĢtırır, enzim aktivitesini artırır (Gabriele ve ark., 2018). Örneğin, deterjan endüstrisinde SDS yüzey aktif maddesi kullanıldığında temizleme etkisine daha iyi etki edeceği söylenebilir (Rubing, 1996).
ġekil 4.3. Farklı konsantrasyonlarda SDS’ nin lipaz aktivitesine etkisi (Yöntem 1’e göre)
SDS’ nin farklı konsantrasyonlarını kıyasladığımızda en iyi sonucu 1,25 mM verdiğini söyleyebiliriz. SDS’ nin polar ucu enzimin protein yüzeyindeki spesifik yüklü bölgeleriyle güçlü iyonik etkileĢim yaparlar (Gabriele ve ark., 2018). Konsantrasyonu artırdığımızda aktivitenin azaldığı sonucuna ulaĢtık. Yüksek konsantrasyonlarda yüzey aktif maddelerin enzimleri denatüre ettiği iyi bilinmektedir ve yüzey aktif madde önemli ölçüde enzimin protein yapısını bozabileceğinden aktivitede (çoğunlukla geri dönüĢü olmayan) önemli kayıplar meydana gelir (Rubing, 1996).
a) b)
ġekil 4.4. Halkalı yapıda olmayan SDS’nin enzim aktivite sonuçları (a-b, Yöntem 2’ye göre, PBS kullanılmadan)
Candida rugosa lipaz (CRL), fosfat tamponunda hazırlamayıp, lineer SDS yüzey aktif maddesinde hazırladığımızda aktivitesinin daha da arttığını gözlemledik (ġekil 4.4 a-b). Lipaz enzimi birçok alanda kullanıldığından bu sonuçların bize çok fazla katkı sağlayacağı söylenebilir (Rubingh, 1996; Gabriele ve ark., 2018).
4.1.2. Halkalı yapıda olan yüzey aktif madde (p-sulfo kaliks[4]aren)
a) 0.625 mM b) 1,25 mM
c) 2,5 mM d) 5 mM
ġekil 4.5. Halkalı yapıda olan p-sulfo kaliks[4]aren’ nin farklı konsantrasyondaki enzim aktivite sonuçları (a-d, Yöntem 1’ göre, PBS kullanılarak yapılan) (1/5 oranında saf su ile seyreltme yapılmıĢtır.)
Halkalı yapıda, anyonik p-sulfo kaliks[4]aren yüzey aktif maddesinin 0,625 mM, 1.25 mM ve 2.5 mM konsantrasyondaki sonuçlarına baktığımızda lipaz enzim aktivitesinin yüksek değerleri bulundu (ġekil 4.5 a-c). Fakat 5 mM konsantrasyondaki sonuçlarına baktığımızda, lipaz enzim aktivitesine çok az etki ettiğini gördük (ġekil 4.5 d).
Lineer yapıdaki SDS yüzey aktif maddesine göre daha yüksek sonuçlar elde edildi. Bu bileĢiğin halkalı olması sadece misel oluĢturmanın yanı sıra enzimdeki katyonik yapıları ve serbest aminoasit grupları ile kompleksleĢtiği literatürden bilinmektedir (Gabriele ve ark., 2018). Dolayısıyla enzimin konformasyonu korunmaktadır. p-sulfo kaliks[4]aren’ nin sülfanat grupları ile ayrıca enzimin birçok grubu ile hidrojen bağı yapabilir. Yüzey aktif maddenin çok fazla olması enzimdeki aktif merkezleri ile etkileĢeceği için aktivitesini düĢürmektedir. Ancak lineer yapıdaki yüzey aktif maddeye göre daha iyi enzim aktivitesi gösterdi.
a) b)
ġekil 4.6. Halkalı yapıda olan p-sulfo kaliks[4]aren’ nin enzim aktivite sonuçları (a-b, Yöntem 2’ göre, PBS kullanılmadan)
Ayrıca bu bileĢik PBS kullanmadan yapılan çalıĢmada enzim aktivitenin daha etkili olduğu gözlendi (ġekil 4.6 a-b).
“Kapalı formu’’ “Açık form’’
ġema 4.2. Kapalı formdaki lipaz enziminin açık formuna dönüĢmesi
a) p-sulfo kaliks[4]aren (1 mM) b) p-sulfo kaliks[4]aren (5 mM)
ġekil 4.7. p-sulfo kaliks[4]aren yüzey aktif maddesinin farklı pH sonuçları (a-b, Yöntem 2’ göre, PBS kullanılmadan)
En yüksek lipaz aktivitesi pH 5’ de gözlendi. AĢırı asidik ortamda veya aĢırı bazik ortamda enzim denatürasyona uğrar (ġekil 4.7 a-b).
ġekil 4.8. Farklı konsantrasyonlarda p-sulfo kaliks[4]aren lipaz aktivitesine etkisi (Yöntem 1’e göre)
p-sulfo kaliks[4]aren’nin farklı konsantrasyonlarını kıyasladığımızda en iyi sonucu SDS deki gibi 1,25 mM verdiğini söyleyebiliriz (ġekil 4.8).
Daha yüksek yüzey aktif konsantrasyonlarında enzim aktivitesinde bir düĢüĢ gözlendi ve bu durum konsantrasyonun artması ile çözeltideki viskozitede artıĢ olduğunu göstermiĢ oldu (Gabriele ve ark., 2018).
DüĢük yüzey aktif madde seviyelerinde aktivasyon da oluĢabilir. Fakat yüksek konsantrasyonlarda yüzey aktif maddelerin enzimleri denatüre ettiği iyi bilinmektedir (Rubingh, 1996).
4.1.3. Halkalı yapıda olan yüzey aktif madde (p-sulfo kaliks[8]aren)
a) 0,625 mM b) 1,25 mM
c) 2,5 mM d) 5 mM
ġekil 4.9. Halkalı yapıda olan p-sulfo kaliks[8]aren’nin farklı konsantrasyondaki enzim aktivite sonuçları (a-d, Yöntem 1’ göre, PBS kullanılarak yapılan) (1/5 oranında saf su ile seyreltme yapılmıĢtır.)
Anyonik p-sulfo kaliks[8]aren yüzey aktif maddesi tüm konsantrasyonlarda yüksek enzim aktivite sonuçlarını vermiĢtir (1/5 oranında seyreltilmiĢ sonuçlar) (ġekil 4.9 a-d).
p-sulfo kaliks[4]arene göre daha büyük halka boĢluğuna sahip olduğundan enzim gibi makro yapılarla daha güçlü kompleks oluĢtururlar. Yapılan çalıĢmada görüldüğü gibi p-sulfo kaliks[8]aren, elde edilen enzim aktivite sonuçları p-sulfo kaliks[4]aren’ den daha yüksek olması bu bileĢiğin halka boĢluğunun büyük olmasına bağlayabiliriz. Enzimi daha sıkı paketleyerek konformasyonunu korur.
ġekil 4.10. Farklı konsantrasyonlarda p-sulfo kaliks[8]aren lipaz aktivitesine etkisi (Yöntem 1’e göre)
p-sulfo kaliks[8]aren’ in konsantrasyonlarının hepsinde genellikle artıĢ gözlenmiĢtir. Diğer anyonik yüzey aktif maddelere göre enzim aktivitesine daha yüksek etki etmiĢtir (ġekil 4.10).
a) b)
ġekil 4.11. Halkalı yapıda olan sulfo kaliks[8]aren’ nin enzim aktivite sonuçları (a-b, Yöntem 2 olan p-sulfo kaliks[8]aren’ göre, PBS kullanılmadan) (1/5 oranında saf su ile seyreltme yapılmıĢtır.)
p-sulfo kaliks[8]aren yüzey aktif maddesi PBS kullanmadan yapılan çalıĢmada enzim aktivitesi çok daha etkili olduğu gözlenmiĢtir. Grafik 4.11 b’ ye baktığımızda lipaz enziminle direk etkileĢen p-sulfo kaliks[8]aren’in daha etkili olduğu grafikten anlaĢılmaktadır.
a) p-sulfo kaliks[8]aren (1 mM) b) p-sulfo kaliks[8]aren (5 mM)
ġekil 4.12. p-sulfo kaliks[8]aren yüzey aktif maddesinin farklı pH sonuçları (a-b, Yöntem 2’ göre, PBS kullanılmadan)
pH 7’ de lipaz enziminin aktivitesi en yüksek çıkmıĢtır. Asidik ortamda veya bazik ortamda enzim denatürasyona uğrar (ġekil 4.12 a-b).
4.2. Katyonik Yüzey Aktif Maddenin Sonuçları
4.2.1. Tetra-bütil amonyum bromür (tBABr)
a) 0,625 mM b) 1,25 mM
c) 2,5 mM d) 5 mM
ġekil 4.13. tBABr’in farklı konsantrasyondaki enzim aktivite sonuçları (a-d, Yöntem 1’ göre, PBS kullanılarak yapılan)
Katyonik yapıda tBABr yüzey aktif maddesinin eklenmesiyle farklı konsantrasyonlarda enzim aktivitesi yapıldı. Konsantrasyon artıĢı ile enzim aktivitesinde artıĢ gözlendi. (ġekil 4.13 a-d).
SDS ile karĢılaĢtırdığımızda anyonik yüzey aktif madde enzimin aktivitesini daha iyi artırdığını gözlemledik. pH 7’ de enzimin anyonik yapılarının çok fazla olmaması elektrostatik etkileĢim yerine hidrojen bağları ile konformasyonunun korunması Ģeklinde yorumlanabilir. Literatüre göre (Gabriele ve ark, 2018), CRL’nin 31 asidik aminoasit ve 18 bazik aminoasit kalıntısı bulunmaktadır ve izoelektrik noktası pH 4,65 olmasından dolayı katyonik yapıların daha zayıf etkileĢtiği ve anyonik yapıların daha fazla etkileĢeceğini göstermektedir. Dolayısıyla anyonik yapılar elektrostatik etkileĢim sonucu konformasyonu korurken katyonik yapılar daha çok hidrojen bağı ile konformasyonu koruyacaktır.
a) b)
ġekil 4.14. Tetrabütil amonyum bromür’ ün (tBABr) enzim aktivite sonuçları (a-b, Yöntem 2’ göre, PBS kullanılmadan)
Tetrabütil amonyum bromür yüzey aktif maddesinde de diğerlerinde olduğu gibi PBS kullanmadan yapılan çalıĢmada enzim aktivitesinde artıĢ gözlenmiĢtir. Grafik 4.14a’ ya baktığımızda lipaz enziminle direk etkileĢen tBABr’ün daha etkili olduğu grafikten anlaĢılmaktadır. 4.14b’ye baktığımızda anyonik yüzey aktif maddelere göre daha az artıĢ olmuĢtur.
ġekil 4.15. Farklı konsantrasyonlarda tBABr’ ün lipaz aktivitesine etkisi (Yöntem 1’e göre)
Genel olarak baktığımızda tBABr’ün lipaz aktivitesine etkisini incelediğimizde tüm konsantrasyonlarda artıĢ gösterdiği sonucuna ulaĢtık. Ancak 2,5 mM konsantrasyondan sonra ani bir yükseliĢ gözlendi (ġekil 4.15).
4.3. Zwitter iyonik Yüzey Aktif Maddelerin Sonuçları
4.3.1. L-Prolin yüzey aktif maddesi
a) 1,25 mM b) 2,5 mM
c) 5 mM
ġekil 4.16. L-prolin’ in farklı konsantrasyondaki enzim aktivite sonuçları (a-c, Yöntem 1’ göre, PBS kullanılarak yapılan)
L-prolin’in izoelektrik noktası pI 6,3 olan olmasına rağmen kullandığımız diğer yüzey aktif maddelerle kıyaslamak için pH 7’ de ölçüldü ve aktiviteyi hemen hemen artırmadığı gözlemlendi. Ancak bu bileĢiğin kaliks[4]-L prolin türevinin etkisi oldukça
0 0,2 0,4 0,6 0,8 1 1,2 0 0,5 1 1,5 2 A r surfactant/r buffer L-prolin yüksek olduğu görüldü. 0,625 mM konsantrasyonda bile hem anyonik hem katyonik yüzey aktif maddelerden oldukça yüksek görülmesi bu bileĢiğinin zwitter iyonik olmasından açıklanabilir. Literatürde (Becker ve ark., 2008) bu bileĢiğin zwitter olduğu bilinmektedir. Zwitter iyonik yapıda bir bileĢik enzimin yapısında hem asidik hem bazik aminoasit grupları ile kolaylıkla elektrostatik etkileĢim ve hidrojen bağı yaparak enzimin aktif merkezi ve konformasyonunu korur (Gabriele ve ark, 2018). Diğer kullandığımız yüzey aktif maddelerde olduğu gibi yüksek konsantrasyonlarda enzim aktivitesinde düĢüĢ gözlendi (ġekil 4.16 a-c).
a) b)
ġekil 4.17. L-Prolin yüzey aktif maddesinin enzim aktivite sonuçları (a-b, Yöntem 2’ göre, PBS kullanılmadan)
L-prolinin yüzey aktif maddesi PBS kullanmadan yapılan çalıĢmada enzim aktivitesi daha etkili olduğu gözlendi. L-prolinin amfoterik özelliği olmasıyla enzimdeki asidik ve bazik aminoasit uçlarıyla direk etkileĢime girmesi aktiviteyi artırmıĢtır (ġekil 4.17 a-b).
4.3.2. Kaliks[4] L-Prolin türevinin etkisi
a) 1,25 mM b) 2,5 mM
c) 5 mM
ġekil 4.18. Kaliks[4] L-prolin’in farklı konsantrasyondaki enzim aktivite sonuçları (a-c, Yöntem 1’ göre, PBS kullanılarak yapılan)
ġekil 4.19. Farklı konsantrasyonlarda Kaliks[4] L-prolin’ in lipaz aktivitesine etkisi (Yöntem 1’e göre)
Kaliks[4] L-prolin’in tüm konsantrasyonlarında enzim aktivitesinde artıĢ gösterdiği sonucuna ulaĢtık (ġekil 4.19).
a) b)
ġekil 4.20. Kaliks[4] L-Prolin yüzey aktif maddesinin enzim aktivite sonuçları (a-b, Yöntem 2’ göre, PBS kullanılmadan)
Kaliks[4] L-prolin türevinin yüzey aktif maddesi, PBS kullanmadan yapılan çalıĢmada enzim aktivitesi çok daha etkili olduğu gözlendi. ġekil 4.20 a’ ya baktığımızda Kaliks[4] L-Prolin yüzey aktif maddesinin, ġekil 4.17a’ daki L-prolin yüzey aktif maddesine göre enzim aktivitesini daha fazla artırmıĢtır.


![ġekil 4.5. Halkalı yapıda olan p-sulfo kaliks[4]aren’ nin farklı konsantrasyondaki enzim aktivite sonuçları (a-d, Yöntem 1’ göre, PBS kullanılarak yapılan) (1/5 oranında saf su ile seyreltme yapılmıĢtır.)](https://thumb-eu.123doks.com/thumbv2/9libnet/4938769.99439/45.892.161.778.169.790/halkalı-konsantrasyondaki-aktivite-sonuçları-kullanılarak-oranında-seyreltme-yapılmıģtır.webp)
![ġekil 4.8. Farklı konsantrasyonlarda p-sulfo kaliks[4]aren lipaz aktivitesine etkisi (Yöntem 1’e göre)](https://thumb-eu.123doks.com/thumbv2/9libnet/4938769.99439/48.892.217.725.114.453/ġekil-farklı-konsantrasyonlarda-sulfo-kaliks-aktivitesine-etkisi-yöntem.webp)
![ġekil 4.9. Halkalı yapıda olan p-sulfo kaliks[8]aren’nin farklı konsantrasyondaki enzim aktivite sonuçları (a-d, Yöntem 1’ göre, PBS kullanılarak yapılan) (1/5 oranında saf su ile seyreltme yapılmıĢtır.)](https://thumb-eu.123doks.com/thumbv2/9libnet/4938769.99439/49.892.120.790.204.876/halkalı-konsantrasyondaki-aktivite-sonuçları-kullanılarak-oranında-seyreltme-yapılmıģtır.webp)
![ġekil 4.10. Farklı konsantrasyonlarda p-sulfo kaliks[8]aren lipaz aktivitesine etkisi (Yöntem 1’e göre)](https://thumb-eu.123doks.com/thumbv2/9libnet/4938769.99439/51.892.197.707.115.436/ġekil-farklı-konsantrasyonlarda-sulfo-kaliks-aktivitesine-etkisi-yöntem.webp)
![ġekil 4.11. Halkalı yapıda olan p-sulfo kaliks[8]aren’ nin enzim aktivite sonuçları (a-b, Yöntem 2 olan p- p-sulfo kaliks[8]aren’ göre, PBS kullanılmadan) (1/5 oranında saf su ile seyreltme yapılmıĢtır.)](https://thumb-eu.123doks.com/thumbv2/9libnet/4938769.99439/52.892.129.769.108.468/halkalı-aktivite-sonuçları-yöntem-kullanılmadan-oranında-seyreltme-yapılmıģtır.webp)